Sr. Editor:
Aunque la utilización de nuevos stents ha mejorado los resultados tras una angioplastia coronaria, el desarrollo de reestenosis del stent (RIS) continúa siendo uno de los principales problemas tras este tipo de intervenciones. Se define la RIS como aquella estenosis > 50% que se desarrolla en un segmento del stent o en sus bordes (hasta 5 mm), generalmente secundaria a una proliferación neointimal progresiva. Se ha descrito hasta casi en un 30% de los enfermos que han recibido un stent convencional y en un 10% de los portadores de uno farmacoactivo1-3.
Multitud de factores pueden favorecer su desarrollo, derivados del paciente (diabetes, insuficiencia renal, síndromes coronarios agudos), de la lesión (complejidad B2-C, longitud > 20 mm, diámetro < 3 mm, oclusiones crónicas, lesiones ostiales, bifurcaciones y puentes coronarios) y del procedimiento (malaposición, expansión insuficiente, áreas luminales < 3 mm, múltiples stents, fracturas del stent, disecciones de bordes y tipo de fármaco, polímero o estructura del stent)1,4,5.
El sistema más utilizado para describir las RIS es la clasificación angiográfica de Mehran, que aunque fue desarrollada para stents convencionales se aplica actualmente en todos los tipos de stents. Consta de 4 grados (I: focal; II: difusa; III: proliferativa; IV: oclusiva) y tiene valor pronóstico1. No obstante, aunque hay estudios sobre la RIS tras la implantación de múltiples diseños de stents, su mecanismo fisiopatológico después de una angioplastia en el infarto de miocardio con elevación del segmento ST (IAMCEST) no se comprende por completo, y además se considera que es una situación en la que podría ser frecuente la aparición de condiciones favorecedoras de la RIS (expansión insuficiente o malaposición, stents pequeños para un vaso que se encuentra constreñido por catecolaminas circulantes, trombofilia, etc.)2,3.
En nuestra unidad se ha realizado un estudio cuyo objetivo primario fue el tipo de RIS (focal frente a difusa) y analizar su relación con respecto a los perfiles paciente-procedimiento y tipo de stent, en pacientes que habían recibido cualquier tipo de stent en una angioplastia primaria.
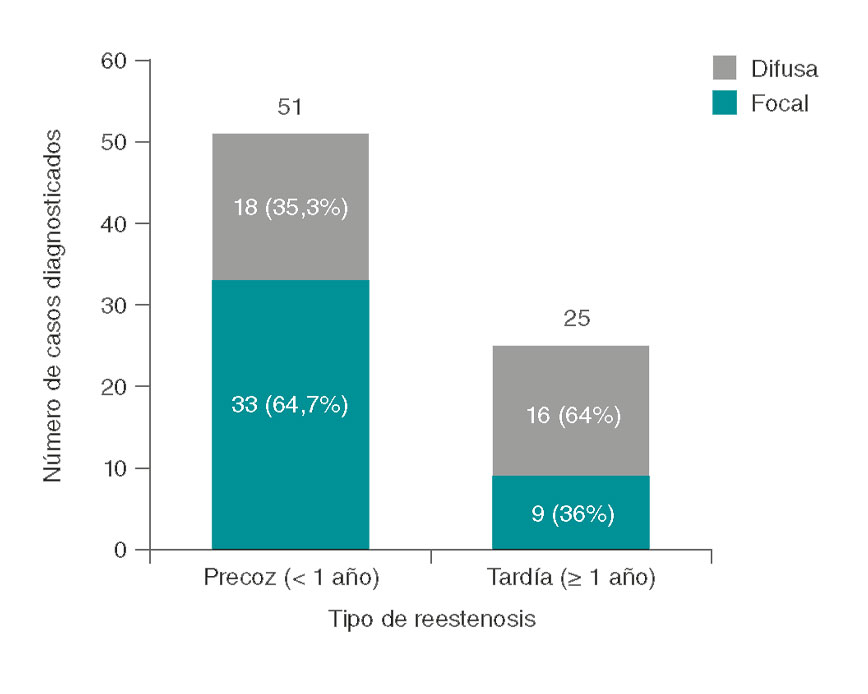
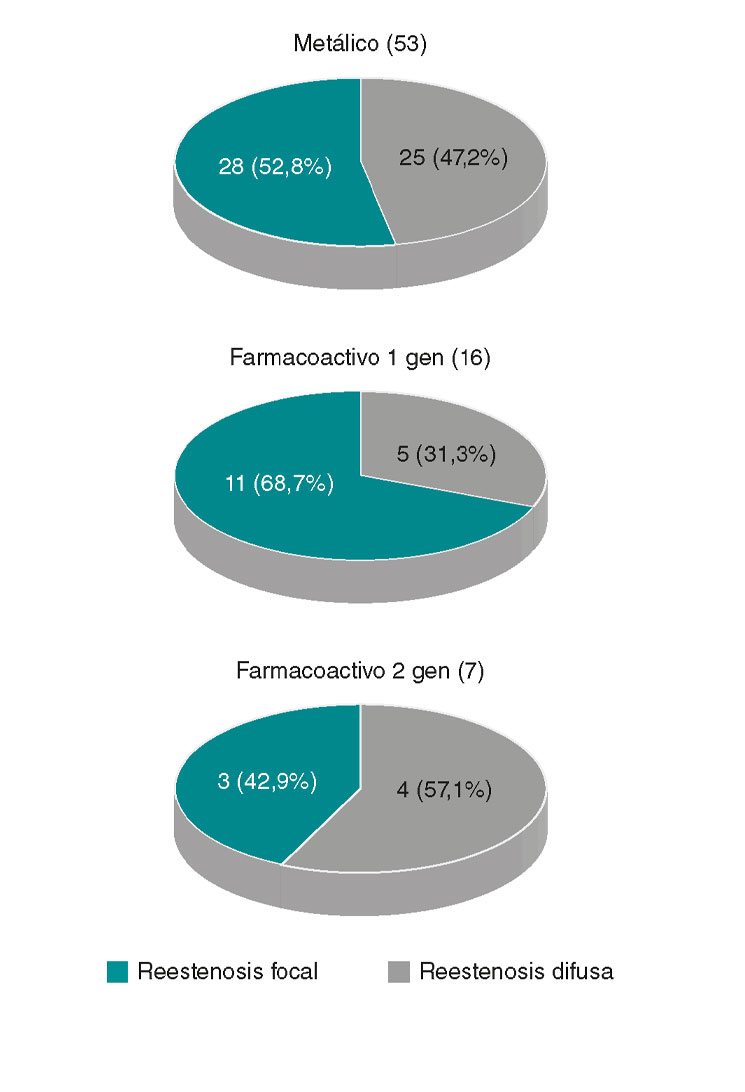
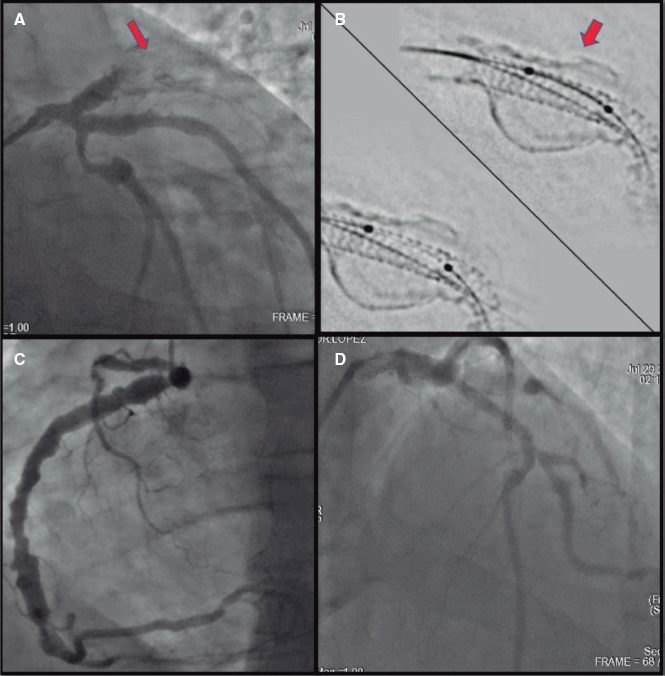
Para ello, se seleccionó retrospectivamente a todos los pacientes con diagnóstico de RIS relevante demostrada angiográficamente (> 50% visual de estenosis) en una lesión previamente tratada con angioplastia con stent durante un IAMCEST, entre los años 2004 y 2014. Se incluyeron 76 pacientes consecutivos. El tipo de RIS se dividió, siguiendo la clasificación de Mehran, en focal (tipo I, n = 42) o difusa (II = 5, III = 17 y IV = 12, que se analizaron conjuntamente; n = 34). En cuanto a su posición respecto al stent, las focales se encontraron en los bordes en 19 casos (45,2%). La mayoría de los pacientes eran varones (82%), con una edad promedio de 61,5 años. Los factores de riesgo cardiovascular fueron frecuentes; en la tabla 1 se muestran estratificados por tipo de reestenosis. La arteria coronaria derecha (53%) fue la más frecuentemente involucrada, seguida por la descendente anterior (32%). La mediana de seguimiento fue de 88 meses (rango intercuartílico: 37,2-111,0) y la mediana del tiempo hasta el diagnóstico de RIS fue de 8,7 meses (rango intercuartílico: 6,2-24,2). Comparando patrones difusos frente a focales, los perfiles clínicos y del procedimiento fueron similares (tabla 1). Las RIS focales se diagnosticaron antes que las difusas tras el IAMCEST (figura 1). Además, la RIS tardía fue más frecuente para el patrón difuso (47,1 frente a 21,4%, p = 0,018) y con grados más altos de estenosis angiográfica (media: 80,56 frente a 70,86%, p = 0,02). Aunque globalmente no hubo diferencias estadísticamente significativas en cuanto al tipo de reestenosis en función de la generación del stent (p = 0,41), el patrón focal estuvo presente en un mayor porcentaje de stents de metal desnudo y de stents liberadores de fármacos de primera generación, mientras que los farmacoactivos más modernos (segunda generación) mostraron una tendencia a un mayor porcentaje de reestenosis difusa (figura 2). Con cautela por el reducido tamaño muestral, se postula que esto podría estar relacionado con la menor dosis de fármaco antiproliferativo, una liberación más homogénea y los diferentes polímeros (algunos reabsorbibles).
Tabla 1. Datos epidemiológicos y del procedimiento de los pacientes analizados, en función del patrón de reestenosis
| Característica | Patrón difuso (II-IV Mehran) | Patrón focal (I Mehran) | p |
|---|---|---|---|
| Sexo (varón) | 26 (76,5%) | 36 (85,7%) | 0,30 |
| Edad (años) | 62,6 ± 13,2 | 60,6 ± 11,9 | 0,50 |
| Talla (cm) | 168,2 ± 6,3 | 167,5 ± 7,9 | 0,68 |
| Peso (kg) | 76,1 ± 10,5 | 78,8 ± 11,3 | 0,27 |
| Hipertensión arterial | 21 (61,8%) | 24 (57,1%) | 0,68 |
| Diabetes mellitus | 9 (26,5%) | 14 (33,3%) | 0,51 |
| Dislipemia | 13 (38,2%) | 19 (45,2%) | 0,54 |
| Hábito tabáquico | 20 (58,8%) | 31 (73,8%) | 0,16 |
| Hábito enólico | 1 (2,9%) | 1 (2,4%) | 0,87 |
| Antecedentes familiares de coronariopatía | 2 (5,9%) | 0 | 0,11 |
| Vasculopatía periférica | 1 (2,9%) | 2 (4,8%) | 0,68 |
| Nefropatía crónica | 0 | 1 (2,4%) | 0,36 |
| Angioplastia previa | 5 (14,7%) | 5 (11,9%) | 0,71 |
| Procedimiento índice (angioplastia primaria) | |||
| Tipo de stent: | 0,41 | ||
| Convencional | 25 (47,2%) | 28 (52,8%) | |
| Farmacoactivo 1.ª generación | 5 (31,3%) | 11 (68,7%) | |
| Farmacoactivo 2.ª generación | 4 (57,1%) | 3 (42,9%) | |
| Máxima presión inflado (atmósferas), mediana (rango intercuartílico) | 16 (14-18) | 14 (14-18) | 0,17 |
| Tamaño: | 0,17 | ||
| Grande (> 2,5 mm) | 27 (79,4%) | 38 (90,5%) | |
| Pequeño (≤ 2,5 mm) | 7 (20,6%) | 4 (9,5%) | |
| Número de stents | 1,0 ± 0,4 | 1,1 ± 0,4 | 0,73 |
| Tiempo a primaria, min mediana (rango intercuartílico) | 170 (120-375) | 180 (120-360) | 0,58 |
| Tromboaspirador | 13 (38,2%) | 12 (28,6%) | 0,37 |
| No-reflow | 2 (5,9%) | 2 (4,8%) | 0,92 |
| Vaso culpable: | 0,19 | ||
| Tronco | 1 (2,9%) | 0 | |
| Descendente anterior | 9 (26,5%) | 15 (35,7%) | |
| Circunfleja | 7 (20,6%) | 2 (4,8%) | |
| Coronaria derecha | 16 (47,1%) | 24 (57,1%) | |
| Puente safeno | 1 (2,9%) | 1 (2,4%) | |
| FEVI | 53,0 ± 16,1 | 56,0 ± 11,5 | 0,38 |
| Pico de creatina cinasa, mediana (rango intercuartílico) | 988 (484-2715) | 1446 (480-3808) | 0,62 |
| Diagnóstico de reestenosis | |||
| Diagnóstico para nuevo cateterismo: | 0,35 | ||
| Isquemia silente | 1 (2,9%) | 2 (4,8%) | |
| Asintomático* | 12 (35,3%) | 21 (50%) | |
| IAMCEST | 7 (20,6%) | 3 (7,1%) | |
| IAMSEST | 6 (17,6%) | 8 (19%) | |
| Ángor inestable | 2 (5,9%) | 4 (9,5%) | |
| Ángor estable | 3 (8,8%) | 0 | |
| Insuficiencia cardiaca | 2 (5,9%) | 3 (7,1%) | |
| Taquicardia ventricular | 1 (2,9%) | 1 (2,4%) | |
| Relación temporal: | 0,01 | ||
| RIS precoz (< 1año) | 18 (52,9%) | 33 (78,6%) | |
| RIS tardía (≥ 1año) | 16 (47,1%) | 9 (21,4%) | |
FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto de miocardio con elevación del segmento ST; IAMSEST: infarto de miocardio sin elevación del segmento ST; RIS: reestenosis del stent. * El cateterismo de control lo indica el médico responsable (propósitos académicos, estudios clínicos, preoperatorio u otras causas). | |||
Figura 1. Número de diagnósticos en función del tiempo desde la angioplastia primaria, estratificados por tipo de reestenosis del stent (media hasta el diagnóstico en RIS difusa, 29,5 meses; en RIS focal, 14,0 meses; p = 0,015). RIS: reestenosis del stent.
Figura 2. Tipo de reestenosis, según la clasificación de Mehran, en función del tipo de stent.
Los stents pequeños (≤ 2,5 mm) mostraron una tendencia no significativa a presentar enfermedad más difusa (64 vs 37%, p = 0,17). No se encontraron diferencias significativas en cuanto al tiempo hasta el diagnóstico de RIS estratificando por tipo de stent (convencional, farmacoactivo de primera o segunda generación).
Dadas las características del estudio, con un número pequeño de casos, entre otras limitaciones, no es posible calcular la incidencia precisa de RIS por no disponer de coronariografía de seguimiento en todos los IAMCEST atendidos en nuestro centro durante el periodo de estudio, y tampoco es posible ofrecer una cronología exacta del momento de desarrollo de las RIS, que muchas veces son oligosintomáticas. Sin embargo, las características clínicas de los enfermos y el comportamiento de los diferentes stents resultan congruentes con los datos publicados previamente sobre RIS en pacientes en otros contextos clínicos1.
En conclusión, en la RIS, el patrón y el tiempo podrían verse influidos por el tipo de stent implantado después de un IAMCEST.
BIBLIOGRAFÍA
1. Her AY, Shin ES. Current Management of In-Stent Restenosis.Korean Circ J. 2018;48:337-349.
2. Alfonso F, Byrne RA, Rivero F, Kastrati A. Current treatment of in-stent restenosis. J Am Coll Cardiol. 2014;63:2659-2673.
3. Alfonso F, Rivero F. Network meta-analyses on in-stent restenosis treatment: dealing with complexity to clarify efficacy and safety. J Thorac Dis. 2015;7:1678-1683.
4. Diego A, Pérez de Prado A, Cuellas C, et al. Instent restenosis related to vessel injury score degree. Are current experimental models valid for drug-eluting stents analysis? Rev Esp Cardiol. 2011;64:745-751.
5. Goel SS, Dilip Gajulapalli R, Athappan G, et al. Management of drug eluting stent in-stent restenosis: a systematic review and meta-analysis. Catheter Cardiovasc Interv. 2016;87:1080-1091.
Autor para correspondencia: Hospital Clínico San Carlos, Calle Profesor Martín Lagos s/n, 28040 Madrid, España.
Correo electrónico: ibnsky@yahoo.es (I.J. Núñez-Gil).