RESUMEN
Introducción y objetivos: La mayoría de los pacientes con embolia pulmonar (EP) aguda reciben únicamente anticoagulación. La reperfusión es necesaria en los pacientes con EP de alto riesgo y en una minoría de pacientes con EP de riesgo intermedio-alto. La trombólisis sistémica (TS) es el tratamiento de reperfusión de primera línea, pero debido a las contraindicaciones y a la preocupación por las hemorragias graves, las terapias dirigidas por catéter (TDC) están surgiendo como una alternativa adecuada. El objetivo del presente estudio fue detectar predictores del uso de TDC con respecto a otras terapias en pacientes con EP aguda.
Métodos: Este registro incluyó pacientes consecutivos con EP de riesgo intermedio y alto en dos centros terciarios, con un equipo de respuesta a la EP, desde 2014 hasta 2022. Los pacientes se agruparon según la terapia inicial: solo anticoagulación, TDC o TS; y se evaluaron los predictores de selección de terapia y variables de seguridad.
Resultados: Se incluyó a un total de 274 pacientes. De ellos, 112 recibieron solo anticoagulación, 96 recibieron TS como tratamiento primario y 66 fueron sometidos a TDC en un primer momento. Las comorbilidades fueron mayores en el grupo TDC que en los otros dos. Los pacientes sometidos a TS o TDC presentaban mayores parámetros de gravedad de la EP al ingreso hospitalario. Tras el análisis multivariable, el índice de comorbilidad de Charlson (OR = 1,29; IC95%, 1,05-1,59), la cirugía reciente (OR = 11,07; IC95%, 3,07-39,87) y la EP central bilateral (OR = 2,42; IC95%, 1,10-5,32) siguieron siendo predictores independientes del uso de TDC. En cuanto a los resultados precoces de seguridad, sólo se produjeron hemorragias intracraneales en el grupo TS (1,8% de los pacientes).
Conclusiones: Este registro contemporáneo utilizó TDC como terapia inicial en el 24% de los pacientes de riesgo intermedio y alto, principalmente en pacientes comórbidos y posquirúrgicos. La TDC fue una alternativa segura y eficaz al tratamiento médico en pacientes seleccionados.
Palabras clave: Terapia dirigida por catéter. Intervencionismo dirigido por catéter. Embolia pulmonar. Trombólisis sistémica. Anticoagulación. Trombólisis local
ABSTRACT
Introduction and objectives: Most patients with acute pulmonary embolism (PE) receive anticoagulation only. Reperfusion is required in high-risk and a minority of intermediate-risk PE patients. Systemic thrombolysis (ST) is the first-line reperfusion therapy, but due to contraindications and major bleeding concerns, the use of catheter-directed therapies (CDT) is increasing as a suitable alternative. The objective of the present study was to detect predictors of the use of CDT compared with other therapies in patients with acute PE.
Methods: This registry included consecutive intermediate- and high-risk PE patients in 2 tertiary centers with a 24/7 PE response team from 2014 to 2022. The patients were grouped according to the primary treatment: anticoagulation only, CDT, or ST. We evaluated predictors of treatment assignment and safety endpoints.
Results: A total of 274 patients were included. Of them, 112 received anticoagulation only, 96 received ST as the primary treatment, and 66 underwent CDT first. Comorbidities were higher in the CDT group than in the other 2 groups. Patients undergoing ST/CDT had higher PE severity parameters at hospital admission. On multivariable analysis, independent predictors for the use of CDT were Charlson Comorbidity Index (OR, 1.29; 95%CI, 1.05-1.59), recent surgery (OR, 11.07; 95%CI, 3.07-39.87), and bilateral central PE (OR, 2.42; 95%CI, 1.10-5.32). Analysis of early safety outcomes showed that intracranial bleeding occurred only in the ST group (1.8% of patients).
Conclusions: This contemporary registry used CDT as the primary treatment in 24% of intermediate- and high-risk patients, mainly in comorbid and postsurgical patients. CDT was a safe and effective alternative to medical therapy in selected patients.
Keywords: Catheter-directed therapies. Pulmonary embolism. Systemic thrombolysis. Anticoagulation. Local thrombolysis
Abreviaturas
AR: alto riesgo. EP: embolia pulmonar. RIA: riesgo intermedio-alto. SA: solo anticoagulación. TDC: terapias dirigidas por catéter. TS: trombolisis sistémica.
INTRODUCCIÓN
La embolia pulmonar (EP) es la tercera causa de muerte cardiovascular y la primera causa de muerte evitable en pacientes hospitalizados1. Según las guías de la European Society of Cardiology (ESC), el manejo de la EP se basa en valorar el riesgo del paciente2. La terapia de reperfusión mediante rombólisis sistémica (TS) está indicada como terapia de primera línea en pacientes con EP de alto riesgo (AR) y de riesgo intermedio-alto (RIA) que empeoran con el tratamiento anticoagulante2. No obstante, la TS está infrautilizada por las contraindicaciones descritas en casi el 30% de los pacientes, incluso en aquellos con EP-AR y ninguna contraindicación formal3-5. Además, esta terapia comporta un importante riesgo de sangrado mayor (≈10-15%), sobre todo, en pacientes de edad avanzada, cirugía reciente o cáncer activo3.
Las terapias dirigidas por catéter (TDC) han surgido como una alternativa a la TS para la reperfusión en pacientes con EP aguda6-10. Estas técnicas mejorar no solo los parámetros indirectos derechos de fracaso ventricular sino también los resultados clínicos con índices de sangrado más bajos. En un metanálisis de estudios observacionales que compararon la trombolisis dirigida por catéter frente a la TS, se observó que el riesgo de mortalidad intrahospitalaria y de hemorragias intracraneales se redujo en pacientes tratados con intervenciones percutáneas11. Las guías actuales de la ESC establecen que se debería tener en cuenta el uso de TDC en pacientes con EP-AR y un intento fallido de trombólisis o una contraindicación a este tratamiento y, como terapia de rescate, en pacientes con EP-RIA y deterioro clínico2. No obstante, el uso de terapias intervencionistas va en aumento, lo cual revela la discrepancia existente entre las recomendaciones de las guías y la práctica clínica.
En la actualidad, hay pocas evidencias en la literatura médicas sobre la elección contemporánea de terapias de reperfusión, los parámetros que llevan a los médicos a seleccionar una terapia de reperfusión en detrimento de las demás y la población diana que más podría beneficiarse de estas TDC. En este sentido, el objetivo principal del presente estudio fue identificar los factores clínicos asociados a la elección de TDC tales como el tratamiento de la EP en una cohorte contemporánea de pacientes con EP aguda.
MÉTODOS
Diseño del estudio
Este estudio se basó en un registro multicéntrico ambispectivo que incluyó a pacientes consecutivos con EP de RIA y AR valorados por los equipos de respuesta a la embolia pulmonar (PERT) locales, clasificados según las guías de la ESC2 y tratados con TDC12. Dos centros terciarios de referencia reclutaron también a pacientes valorados por los PERT y tratados médicamente, tal y como se informó previamente en una experiencia unicéntrica13. Este estudio analizó a todos aquellos pacientes consecutivos valorados por los PERT local en estos 2 hospitales desde 2014 hasta 2022.
Los criterios de inclusión fueron pacientes mayores de 18 años con un diagnóstico confirmado de EP aguda de riesgo alto o intermedio (según tomografía computarizada o ecocardiograma transtorácico más sospecha clínica en pacientes inestables no aptos para realizarles una tomografía computarizada). Se excluyó a todos aquellos pacientes con un diagnóstico incierto de EP, con síntomas de más de 7 días de evolución hasta el diagnóstico y con EP de bajo riesgo según las guías de la ESC2. El registro fue observacional, sin recomendaciones sobre el manejo de la EP. En este sentido, el tratamiento se estableció atendiendo a los criterios de los médicos tratantes y el uso de TDC se eligió atendiendo a la disponibilidad y decisión de los PERT. La presentación de este estudio se hizo de conformidad con la guía STROBE sobre la publicación de estudios observacionales en epidemiología para estudios de cohorte14.
Recogida de datos y definición de las variables
Una base de datos segura online almacenó datos anonimizados en ambos centros. Los datos fueron facilitados por los propios investigadores locales a partir de registros clínicos digitales e incluyeron signos vitales y valores de laboratorio. El ingreso inicial a la unidad de cuidados intensivos cardiológicos incluyó datos más granulares registrando los signos vitales clínicos cada hora, los parámetros de shock al ingreso y el empeoramiento durante el ingreso en la unidad de cuidados intensivos cardiológicos y hasta después de la reperfusión (en el caso de que el paciente fuese reperfundido). Tras el alta hospitalaria, se llevó a cabo un seguimiento estructurado con visitas trascurrido 1, 3-6 y 12 meses. No obstante, los resultados del seguimiento a los 30 días también se incluyen en este estudio. La relación ventrículo derecho/ventrículo izquierdo se determinó, principalmente, en la tomografía computarizada, salvo en pacientes sin tomografía computarizada inicial por razones de inestabilidad. Se llegó al diagnóstico de EP bilateral central cuando la tomografía computarizada o la angiografía detectaron un trombo en ambas arterias pulmonares principales. El riesgo de EP se estratificó según las guías de la ESC2. En todos los pacientes, se calculó el índice de shock, definido por la relación entre la frecuencia cardiaca y la presión arterial sistólica, la puntuación obtenida en la escala de gravedad de la embolia pulmonar15, en la escala Bova16 y el índice de comorbilidad de Charlson17. Los parámetros hemodinámicos (como la presión arterial pulmonar sistólica y media) se midieron de forma invasiva en la mayoría de los pacientes a tratamiento con una TDC con un catéter que se introdujo en la arteria pulmonar.
Tratamientos de la embolia pulmonar
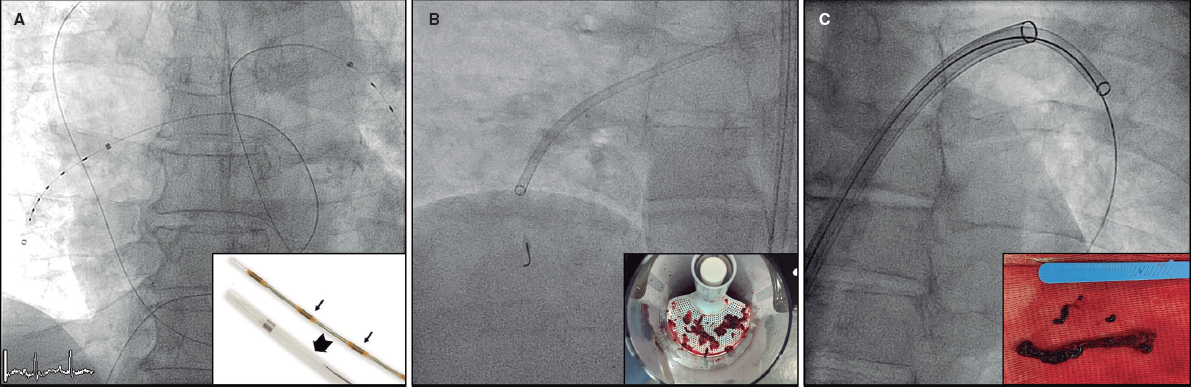
La anticoagulación parenteral se inició inmediatamente después del diagnóstico de EP. La TS se administró a través de una vena periférica según las dosis recomendadas en las guías de la ESC2. Las TDC incluyeron: a) trombolisis dirigida por catéter mediante el uso de 1 o varios catéteres multiperforados introducidos en la arteria pulmonar y dejados entre 6 y 24 horas para la infusión de trombolíticos a dosis bajas (habitualmente alteplasa 0,25 mg/kg o el equivalente de tenecteplasa); b) la fragmentación mecánica de los trombos; c) la aspiración de trombos con el uso de catéteres no dedicados (por lo general, catéteres guía de 8 Fr) o dedicados (Indigo 8 Fr [Penumbra, Estados Unidos], Nautilus 10 Fr [iVascular, España] o FlowTriever 24 Fr [Inari medical, Estados Unidos]) o d) una combinación de las anteriores. La dosis de terapia fibrinolítica (tanto para la TS como para la trombolisis dirigida por catéter) se dejó a criterio del médico tratante. Consultar la figura 1 para ver una ilustración de las diferentes opciones de TDC.
Figura 1. Terapias dirigidas por catéter utilizadas en el estudio. Imágenes representativas de terapias dirigidas por catéter. A: trombolisis ecoguiada, sistema EKOS (Boston Scientific, Estados Unidos). B: trombectomía percutánea con el sistema Indigo (Penumbra, Estados Unidos). C: aspiración de trombos de gran calibre, catéter FlowTriever (Inari, Estados Unidos).
Objetivos
El principal objetivo del presente estudio fue detectar los predictores del uso de TDC en pacientes con EP de RI o AR que requieren terapia de reperfusión. Otro objetivo fue comparar las características de los pacientes que recibieron diferentes terapias para la EP aguda: solo anticoagulación (SA), TS o TDC. Cuando se empleó más de una terapia de reperfusión, los pacientes fueron agrupados según la terapia administrada en primera instancia. El análisis se centró en identificar las variables asociadas a la elección de diferentes terapias por parte del médico tratante. La mortalidad por cualquier causa a 30 días se informó como un resultado de seguridad. También se analizaron los eventos adversos intrahospitalarios, tales como los eventos hemorrágicos según clasificación de la International Society of Thrombosis and Hemostasis18, así como la lesión renal aguda. En aquellos pacientes tratados de TDC, también se registraron los resultados de la intervención (como, por ejemplo, la mejoría hemodinámica).
Ética y financiación
El protocolo del registro fue aprobado por el comité de ética de investigación clínica del Hospital Clínico San Carlos como comité central del registro de conformidad con la legislación local en materia de investigación clínica (código 18/010-E). Todos los pacientes incluidos prospectivamente firmaron un formulario de consentimiento informado. El comité de investigación ética otorgó una exención de dicho consentimiento a aquellos pacientes que fueron reclutados retrospectivamente. La investigación fue un estudio académico, no financiado e iniciado por los investigadores.
Análisis estadístico
Las variables categóricas se expresaron como números y porcentajes y las continuas como media ± desviación estándar (DE) o mediana [rango intercuartílico (RIC)], según corresponda. Las comparativas de grupos (SA, TDC y TS) para las variables continuas se realizaron utilizando las pruebas de ANOVA y X2 para las variables categóricas. Las comparativas inter-grupo se realizaron con las pruebas t de Student o de Wilcoxon, según corresponda, para las variables continuas y la prueba de X2 para las categóricas. Los predictores de uso de las diferentes técnicas de reperfusión (es decir, TDC o TS) se determinaron empleando un análisis de regresión logística. El análisis univariado incluyó las variables basales y clínicas en el diagnóstico de EP. Las variables con valores de p < 0,10 en el análisis univariado se incluyeron, también, en el modelo multivariado. Se utilizaron pruebas t pareadas para analizar los cambios en los parámetros hemodinámicos tras la realización de las intervenciones percutáneas. Los valores faltantes de covariables, si los hubiera, no fueron imputados. Los análisis estadísticos se realizaron utilizando el software Stata 16 (StataCorp, College Station, Estados Unidos).
RESULTADOS
Características basales y estratificación del riesgo
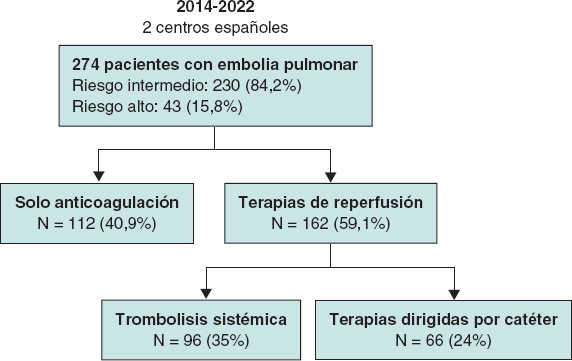
Entre 2014 y 2022, un total de 274 pacientes fueron incluidos en el registro (el 9,5% con EP de riesgo intermedio-bajo, el 74,7% con EP de RIA y el 15,8% con EP-AR) (figura 2). De todos estos pacientes, 112 (40,9%) recibieron SA: el 57% heparina de bajo peso molecular y el 43% heparina no fraccionada. Los demás 162 pacientes (59,1%) recibieron terapia de reperfusión: el 35% recibió TS como tratamiento principal y el 24% recibió tratamiento, en primera instancia, con TDC. Todos los pacientes del grupo a tratamiento con TS recibieron alteplasa como tratamiento fibrinolítico y 5, TDC de rescate tras una TS fallida. Se debe mencionar que el 58% de los pacientes con EP-RIA de nuestra cohorte recibieron terapias de reperfusión.
Figura 2. Pacientes del estudio y tratamiento seleccionado.
Las características basales de los pacientes según la estrategia de tratamiento se muestran en la tabla 1. El estudio estuvo bien equilibrado en cuanto al género (un 52% de hombres); no obstante, hubo más hombres en el grupo a tratamiento con SA que en el que recibió TS (58,0 frente al 42,7%, p = 0,027). Hubo muchos más pacientes en los grupos a tratamiento con SA y TDC que en el grupo a tratamiento con TS (65,9 ± 16,2 y 62,3 ± 14,7 frente a 57,4 ± 16,6 años, respectivamente, p < 0,001). En cuanto a las comorbilidades, los antecedentes oncológicos fueron más habituales entre pacientes del grupo TDC que entre aquellos del grupo TS. El Índice de Comorbilidad de Charlson fue más alto en el grupo a tratamiento con TDC que en los otros 2 grupos. Entre los factores desencadenantes de EP, la historia de cirugía reciente fue más habitual en los pacientes del grupo TDC que en los otros 2 grupos, mientras que una hospitalización reciente fue más habitual en los grupos a tratamiento con SA y TDC que en el grupo TS.
Tabla 1. Características basales
| Total | SA | TS | TDC | p | ||||
|---|---|---|---|---|---|---|---|---|
| N = 274 | N = 112 | N = 96 | N = 66 | Global | SA frente a TS | SA frente a TDC | TS frente a TDC | |
| Sexo varón | 142 (51,8%) | 65 (58,0%) | 41 (42,7%) | 36 (54,5%) | 0,077 | 0,027 | 0,650 | 0,138 |
| Edad, años | 62,1 (16,4) | 65,9 (16,2) | 57,4 (16,6) | 62,3 (14,7) | < 0,001 | < 0,001 | 0,136 | 0,056 |
| Índice de masa corporal (kg/m2) | 29,4 (6,7) | 29,4 (6,0) | 29,7 (8,8) | 29,2 (5,0) | 0,921 | 0,765 | 0,890 | 0,724 |
| Obesidad | 133 (48,5%) | 52 (46,4%) | 54 (56,3%) | 27 (40,9%) | 0,136 | 0,167 | 0,533 | 0,078 |
| Tromboembolismo venoso previo | 53 (19,4%) | 20 (17,9%) | 22 (23,2%) | 11 (16,7%) | 0,511 | 0,345 | 0,840 | 0,316 |
| Antecedentes oncológicos | 42 (15,3%) | 15 (13,4%) | 11 (11,5%) | 16 (24,2%) | 0,065 | 0,674 | 0,065 | 0,032 |
| Hipertensión | 135 (49,5%) | 55 (49,1%) | 46 (47,9%) | 34 (52,3%) | 0,857 | 0,864 | 0,681 | 0,585 |
| Diabetes mellitus | 51 (18,7%) | 18 (16,1%) | 19 (19,8%) | 14 (21,5%) | 0,628 | 0,484 | 0,362 | 0,788 |
| Insuficiencia cardiaca | 14 (5,1%) | 8 (7,1%) | 3 (3,1%) | 3 (4,5%) | 0,411 | 0,197 | 0,487 | 0,638 |
| Enfermedad renal crónica | 20 (7,3%) | 10 (8,9%) | 4 (4,2%) | 6 (9,1%) | 0,342 | 0,172 | 0,971 | 0,201 |
| Índice de Comorbilidad de Charlson | 1,0 (1,6) | 0,8 (1,4) | 0,9 (1,5) | 1,5 (1,8) | 0,026 | 0,676 | 0,010 | 0,043 |
| Cirugía reciente | 35 (12,8%) | 12 (10,8%) | 4 (4,2%) | 19 (28,8%) | < 0,001 | 0,074 | 0,002 | < 0,001 |
| Inmovilización reciente | 48 (17,5%) | 14 (12,5%) | 17 (17,7%) | 17 (25,8%) | 0,080 | 0,293 | 0,024 | 0,216 |
| Ingreso hospitalario reciente | 28 (10,3%) | 14 (12,6%) | 4 (4,2%) | 10 (15,2%) | 0,044 | 0,032 | 0,633 | 0,014 |
|
SA: solo anticoagulación; TDC: terapias dirigidas por catéter; TS: trombolisis sistémica. Los datos expresan media (DE) para las variables continuas y nº (%) para las categóricas. Los valores de p denotan la significación de las diferencias observadas entre los grupos para las variables continuas analizadas con la prueba ANOVA y de X2, la que corresponda. La prueba de X2 se usó para valorar la significación de las diferencias entre gru- pos para las variables categóricas. La obesidad se definió como un índice de masa corporal ≥ 30 kg/m2. Los valores con significación estadística se muestran en negrita. |
||||||||
Tanto los parámetros clínicos como de estratificación del riesgo al ingreso hospitalario se muestran en la tabla 2. Aquellos pacientes que recibieron terapias de reperfusión, con TDC o TS mostraron parámetros de gravedad más altos que los del grupo a tratamiento con SA (por ejemplo, índice de shock, compromiso del ventrículo derecho o niveles de lactato). La puntuación obtenida en la escala de gravedad de la embolia pulmonar, que incorpora comorbilidades y parámetros de gravedad de la EP, fue más alta en los pacientes a tratamiento con TDC que en los otros 2 grupos (p < 0,001).
Tabla 2. Parámetros de estratificación del riesgo en el ingreso hospitalario
| Total | SA | TS | TDC | p | ||||
|---|---|---|---|---|---|---|---|---|
| N = 274 | N = 112 | N = 96 | N = 66 | Global | SA frente a TS | SA frente a TDC | TS frente a TDC | |
| Presión arterial sistólica, mmHga | 118,7 (25,3) | 126,8 (23,1) | 114,5 (25,9) | 110,8 (24,6) | < 0,001 | < 0,001 | < 0,001 | 0,359 |
| Frecuencia cardiaca, lpm | 106,9 (18,8) | 99,5 (19,7) | 112,9 (16,3) | 110,9 (16,2) | < 0,001 | < 0,001 | < 0,001 | 0,459 |
| Índice de shock | 0,96 (0,36) | 0,82 (0,28) | 1,06 (0,39) | 1,07 (0,35) | < 0,001 | < 0,001 | < 0,001 | 0,953 |
| Insuficiencia respiratoria | 71 (28,9%) | 28 (26,4%) | 29 (34,9%) | 14 (24,6%) | 0,314 | 0,205 | 0,796 | 0,191 |
| Síncope | 57 (20,8%) | 23 (20,5%) | 18 (18,8%) | 16 (24,2%) | 0,696 | 0,747 | 0,564 | 0,399 |
| Trombosis venosa profunda | 74 (27,6%) | 34 (30,6%) | 23 (24,5%) | 17 (27,0%) | 0,612 | 0,326 | 0,612 | 0,723 |
| Compromiso del ventrículo derecho | 249 (94,0%) | 93 (87,7%) | 94 (98,9%) | 62 (96,9%) | 0,002 | 0,002 | 0,042 | 0,346 |
| Embolia pulmonar bilateral | 175 (63,9%) | 70 (62,5%) | 57 (59,4%) | 48 (72,7%) | 0,204 | 0,645 | 0,163 | 0,080 |
| Niveles de lactato, mmol/l | 2,9 (2,9) | 2,2 (2,0) | 3,7 (3,8) | 3,0 (2,6) | 0,006 | 0,002 | 0,039 | 0,315 |
| Niveles de troponina elevados | 209 (86,0%) | 85 (83,3%) | 73 (89,0%) | 51 (86,4%) | 0,539 | 0,271 | 0,600 | 0,642 |
| Niveles de NT-proBNP elevados | 167 (78,4%) | 74 (77,9%) | 57 (78,1%) | 36 (80,0%) | 0,958 | 0,977 | 0,777 | 0,804 |
| EP de alto riesgob | 43 (15,8%) | 8 (7,1%) | 18 (18,8%) | 17 (26,2%) | 0,002 | 0,012 | < 0,001 | 0,264 |
| Puntuación obtenida en la escala PESI | 105,1 (35,1) | 97,6 (29,3) | 104,9 (36,1) | 118,2 (39,4) | < 0,001 | 0,109 | < 0,001 | 0,028 |
| Puntuación obtenida en la escala Bova | 4,7 (1,5) | 4,2 (1,5) | 5,1 (1,4) | 5,0 (1,5) | < 0,001 | < 0,001 | 0,002 | 0,526 |
|
EP: embolia pulmonar; PESI: escala de gravedad de la embolia pulmonar; SA: solo anticoagulación; TDC: terapias dirigidas por catéter; TS: trombolisis sistémica. Los valores con significación estadística se muestran en negrita. Los datos expresan media ± desviación estándar para las variables continuas y nº (%) para las categóricas. Los valores de p denotan la significación de las diferencias entre los grupos para las variables continuas analizadas mediante la prueba ANOVA y la prueba t de Student, según corresponda. La prueba de X2 evaluó la significación de las diferencias entre grupos para las variables categóricas. aEsta variable refleja la presión arterial sistólica al ingreso hospitalario, si bien algunos de estos pacientes estaban a tratamiento con vasopresores mientras otros permanecieron estables al ingreso, aunque luego empeoraron hemodinámicamente. bSegún definición de las guías de la European Society of Cardiology. |
||||||||
Terapias de reperfusión
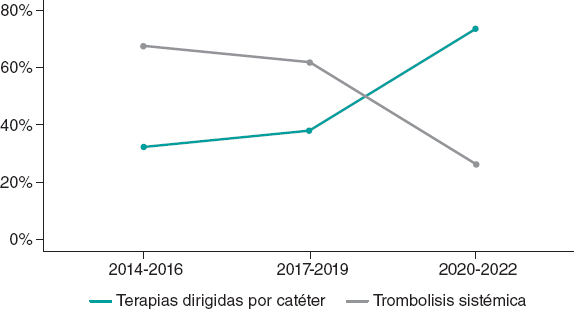
La figura 3 muestra la tendencia en la elección entre las 2 principales terapias de reperfusión a lo largo del tiempo. Se observó un aumento progresivo en el uso de TDC emparejado a un menor uso de la TS. Las variables que podrían haber llevado a los médicos tratantes a elegir entre estas dos terapias de reperfusión se muestran en la tabla 3. En el análisis univariado, las variables asociadas a la elección de las TDC en detrimento de la TS fueron aquellas que reflejaban comorbilidades tales como la edad avanzada, los antecedentes oncológicos y el Índice de Comorbilidad de Charlson. Tanto las cirugías como los ingresos hospitalarios recientes se asociaron a la elección de las TDC. Tras el análisis multivariado en esta cohorte de pacientes con EP aguda, los únicos predictores independientes de la elección de las TDC en detrimento de la TS fueron el Índice de Comorbilidad de Charlson y las cirugías recientes. Este análisis también reveló que la presencia de EP central bilateral se asoció a la elección del médico tratante de TDC en detrimento de la TS.
Figura 3. Elección de la terapia de reperfusión a lo largo de los años.
Tabla 3. Predictores uni y multivariables en la elección de TDC en detrimento da la TS o SCA como tratamiento de primera línea en el manejo de la embolia pumonar aguda
| Univariables | Multivariables | |||
|---|---|---|---|---|
| Variables | OR (IC95%) | p | OR (IC95%) | p |
| Sexo varón | 1,61 (0,86-3,03) | 0,139 | ||
| Edad (por año) | 1,02 (1,00-1,04) | 0,058* | ||
| Índice de masa corporal (por cada kg/m2) | 0,99 (0,94-1,04) | 0,722 | ||
| Tromboembolismo previo venoso | 0,66 (0,30-1,48) | 0,317 | ||
| Antecedentes oncológicos | 2,47 (1,06-5,75) | 0,035* | ||
| Hipertensión | 1,19 (0,63-2,24) | 0,585 | ||
| Diabetes mellitus | 1,11 (0,51-2,42) | 0,788 | ||
| Insuficiencia cardiaca | 1,48 (0,29-7,55) | 0,640 | ||
| Enfermedad renal crónica | 2,30 (0,62-8,49) | 0,211 | ||
| Cirugía reciente | 9,30 (2,99-28,90) | < 0,001 | 11,07 (3,07-39,87) | < 0,001 |
| Inmovilización reciente | 1,61 (0,75-3,45) | 0,219 | ||
| Ingreso hospitalario reciente | 4,11 (1,23-13,72) | 0,022 | 1,25 (0,29-5,43) | 0,767 |
| Presión arterial sistólica (per mmHg) | 0,99 (0,98-1,01) | 0,357 | ||
| Insuficiencia cardiaca (por lpm) | 0,99 (0,97-1,01) | 0,457 | ||
| Insuficiencia respiratoria | 0,61 (0,29-1,29) | 0,193 | ||
| Síncope | 1,39 (0,65-2,97) | 0,400 | ||
| Trombosis venosa profunda | 1,14 (0,55-2,36) | 0,723 | ||
| Compromiso del ventrículo derecho | 0,33 (0,03-3,72) | 0,369 | ||
| Embolia pulmonar central bilateral | 1,82 (0,93-3,59) | 0,082 | 2,42 (1,10-5,32) | 0,028 |
| Niveles de lactato (por mmol/l) | 0,94 (0,83-1,06) | 0,317 | ||
| Niveles de troponina elevados | 1,00 (1,00-1,00) | 0,312 | ||
| Niveles de NT-proBNP elevados | 1,12 (0,45-2,81) | 0,804 | ||
| Índice de Comorbilidad de Charlson | 1,21 (1,00-1,47) | 0,048 | 1,29 (1,05-1,59) | 0,018 |
|
IC95%: índice de confianza del 95%; OR: odds ratio. Se empleó la regresión logística para detectar los predictores que llevaron a los médicos a elegir terapias dirigidas por catéter en detrimento de la trombolisis sistémica como tratamiento de reperfusión. Las variables con valores de p < 0,10 en el análisis univariable fueron incluidas en el modelo multivariable. La obesidad se definió como un índice de masa corporal ≥ 30 kg/m2. Los valores estadísticamente significativos se muestran en negrita. *Ni la edad ni los antecedentes oncológicos se incluyeron en el modelo multivariable a pesar de ser significativos en el análisis univariado a fin de evitar problemas de colinealidad al estar ya incluidos en el Índice de Comorbilidad de Charlson. |
||||
Las características de la intervención del grupo a tratamiento con TDC se muestran en la tabla 4. La mediana del retraso del tratamiento desde el diagnóstico de EP aguda hasta el tratamiento percutáneo fue de 6,0 horas [rango intercuartílico [RIC], 3,5-19,0] y la duración media de la intervención de 89,0 ± 44,4 minutos. La trombolisis dirigida por catéter se empleó en 35 pacientes (53,0%) y el fármaco trombolítico más utilizado fue la alteplasa (71,4%) a una dosis media de 16,7 ± 7,2 mg. La dosis media del bolo en los pacientes a tratamiento con alteplasa fue de 4 mg [RIC: 2,9-6,3] y la mediana de tiempo de perfusión de la dosis restante,16,0 horas [RIC: 12,0-20,0]. El fármaco se administró en forma de bolo a todos los pacientes a tratamiento con tenecteplasa, Se realizó aspiración de trombos en 42 pacientes (63,6%). Los dispositivos de aspiración más utilizados fueron los catéteres coronarios (42,9%) seguidos del catéter FlowTriever (Inari Medical, Estados Unidos) (38,1%). Se realizó una técnica combinada de trombolisis más aspiración en 11 pacientes. La presión arterial pulmonar sistólica pasó de 57,9 ± 15,4 a 47,6 ± 12,6 mmHg (media: −10,3 ± 11,3 mmHg, p < 0,001) tras la intervención percutánea y la presión arterial pulmonar media de 35,0 ± 9,1 a 28,6 ± 8,8 mmHg (media: −6,4 ± 6,8 mmHg, p < 0,001). La presión arterial sistólica aumentó notablemente tras la intervención pasando de 127,8 ± 23,4 a 138,8 ± 22,0 mmHg (media: +11,0 ± 24,5 mmHg, p = 0,028).
Tabla 4. Características de la intervención en el grupo de pacientes a tratamiento con terapias dirigidas por catéter
| Pacientes tratados mediante intervenión percutánea (N = 66) | |
|---|---|
| Demora en el tratamiento, horas* | 6,0 [3,3-19,0] |
| Duración de la intervención, minutos | 89,0 (44,4) |
| Acceso vascular | |
| Femoral | 64 (97,0%) |
| Braquial | 2 (3,0%) |
| Diámetro máximo de la vaina introductora, French | 8,0 [6,0-20,0] |
| Trombolisis dirigida por catéter | 35 (53,0%) |
| Fármaco trombolítico | |
| Alteplasa | 25 (71,4%) |
| Tenecteplasa | 10 (28,6%) |
| Dosis farmacológica | |
| Alteplasa, mg | 16,7 (7,2) |
| Tenecteplasa, unidades | 3.737,5 (1.947,8) |
| Ecoguiada | 2 (5,7%) |
| Aspiración de trombos | 42 (63,6%) |
| Catéter | |
| Catéteres coronarios | 18 (42,9%) |
| FlowTriever | 16 (38,1%) |
| Indigo | 6 (14,3%) |
| Nautilus | 2 (4,8%) |
| Cambios en la PAPs, mmHg | −10,3 (11,3) |
| Cambios en la PAPm, mmHg | −6,4 (6,8) |
| Cambios en la PAS, mmHg | +11,0 (24,5) |
| Cambios en la PAm, mmHg | +5,3 (17,6) |
|
PAm: presión arterial media; PAPm: presión arterial pulmonar media; PAS: presión arterial sistólica; PAPs: presión arterial pulmonar sistólica. Los datos expresan media ± desviación estándar o mediana [rango intercuartílico] para las variables, según corresponda, y nº (%) para las categóricas. *La demora en el tratamiento se definió como el tiempo trascurrido entre el diagnóstico de embolia pulmonar y la realización de la intervención. |
|
Resultados de seguridad
Tanto los primeros resultados clínicos como los eventos intrahospitalarios asociados a la estrategia terapéutica en cuestión se muestran en la tabla 5. La estancia media hospitalaria fue de 8 días [RIC: 6,0-13,0]. Sobrevinieron sangrados mayores intrahospitalarios, según definición de la International Society of Thrombolisis and Hemostasis, en 7 pacientes (7,3%) del grupo TS y 9 pacientes (13,6%) del grupo a tratamiento con TDC. Sobrevinieron sangrados intracraneales en 5 pacientes, todos ellos en el grupo a tratamiento con TS, durante el ingreso hospitalario. Sobrevinieron, asimismo, complicaciones del acceso vascular, incluidos eventos menores y mayores, en 6 de los pacientes (10,6%) que recibieron TDC. Se debe mencionar que 5 de estos pacientes recibieron trombolisis dirigida por catéter (4 con alteplasa y 1 con tenecteplasa) y el paciente tratado con tenecteplasa se sometió a aspiración con un catéter no específico. Una de las complicaciones vasculares fue un hematoma relacionado con la implantación de oxigenación con membrana extracorpórea y que, por lo tanto, no tuvo una relación directa con el procedimiento de TDC. Los demás eventos fueron 1 episodio hemorrágico en el acceso femoral que provocó un shock hipovolémico que condujo a la muerte (un caso de TDC de trombólisis local), 2 hematomas que requirieron transfusión y otros 2 hematomas que no. El índice de mortalidad por cualquier causa a 30 días fue del 4,6% 10,4 y 15,9% para los grupos a tratamiento con SA, TS y TDC, respectivamente (p = 0,045). Fallecieron 22 pacientes de causas asociadas al deterioro hemodinámico o respiratorio secundario a la EP, 2 de encefalopatía anóxica (ambos en el grupo a tratamiento con TDC) y 1 de hemorragia intracraneal grave (grupo TS).
Tabla 5. Resultados de seguridad preliminares de pacientes con embolia pulmonar
| Total | SA | TS | TDC | p | ||||
|---|---|---|---|---|---|---|---|---|
| N = 274 | N = 112 | N = 96 | N = 66 | Global | SA frente a TS | SA frente a TDC | TS frente a TDC | |
| Duración del ingreso, días | 8,0 (6,0-13,0) | 7,0 (6,0-11,0) | 9,0 (6,0-12,5) | 10,0 (6,0-23,0) | 0,132 | 0,394 | 0,052 | 0,178 |
| Eventos intrahospitalarios | ||||||||
| Hemorragias mayores* | 18 (6,6%) | 2 (1,8%) | 7 (7,3%) | 9 (13,6%) | 0,008 | 0,052 | 0,002 | 0,184 |
| Hemorragias intracraneales | 5 (1,8%) | 0 (0,0%) | 5 (5,2%) | 0 (0,0%) | 0,009 | 0,014 | - | 0,060 |
| Daño renal agudo | 22 (8,0%) | 11 (9,8%) | 9 (9,4%) | 2 (3,0%) | 0,228 | 0,913 | 0,093 | 0,115 |
| Complicación en el acceso vascular | - | - | - | 6 (10,6%) | - | - | - | - |
| Mortalidad por cualquier causa a 30 días | 25 (9,3%) | 5 (4,6%) | 10 (10,4%) | 10 (15,9%) | 0,045 | 0,110 | 0,011 | 0,310 |
|
SA: solo anticoagulación TDC: terapias dirigidas por catéter; TS: trombolisis sistémica. Los datos expresan mediana [rango intercuartílico] para las variables continuas y nº (%) para las categóricas. *Según definición de la International Society of Thrombosis and Hemostasis. |
||||||||
DISCUSIÓN
El presente estudio explora las características clínicas, el perfil de riesgo y los resultados de pacientes de con EP de riesgo alto e intermedio de 2 centros terciarios de referencia a través de un equipo PERT de guardia las 24 horas del día, 7 días a la semana. Los principales hallazgos fueron los siguientes: a) en esta cohorte contemporánea de EP, los factores asociados a la elección de las TDC en detrimento de la TS en el análisis multivariado fueron un índice de comorbilidad de Charlson más alto, los antecedentes de cirugía reciente y la confirmación de EP proximal bilateral; b) cada vez se opta más por TDC como la terapia de reperfusión de referencia y c) las TDC mejoran ostensiblemente los parámetros hemodinámicos, lo cual sugiere que la efectividad del tratamiento se mantiene en esta población con comorbilidades; en cualquier caso, el riesgo de complicaciones no es desdeñable y debe ser tenido en cuenta en la toma de decisiones.
Hasta donde nosotros sabemos, se trata del primer estudio sobre parámetros asociados a la elección de los médicos tratantes entre las estrategias de tratamiento disponibles para pacientes con EP de riesgo alto e intermedio. Como era de esperar, los pacientes reperfundidos tenían un peor estado hemodinámico y solían presentar disfunción ventricular derecha o niveles más altos de lactato. La TS se utilizó más habitualmente en pacientes con menos comorbilidades (por ejemplo, edad más joven, cirugía o ingreso hospitalario recientes) lo cual va en consonancia con lo descrito en anteriores estudios3-5. Por el contrario, se optó por el uso de TDC en pacientes con más comorbilidades y, probablemente, un mayor riesgo de sangrado (cirugía reciente). No obstante, no se observó ninguna diferencia en lo referente a la edad, el sexo o las comorbilidades previas entre el grupo de pacientes tratados con SA y aquellos que recibieron una TDC, siendo la gravedad de la EP el único factor para reperfundir con TDC.
Las terapias dirigidas por catéter son la opción cada vez más elegida
Durante los últimos 10 años, las TDC se han ido convirtiendo en una alternativa prometedora a la TS, aunque todavía faltan estudios aleatorizados que las comparen con el tratamiento médico estándar. En la actualidad, el panorama de la EP presenta 2 escenarios en lados opuestos de la curva de innovación. Por un lado, los primeros en adoptarlas (Estados Unidos) están empleando las TDC con un umbral muy bajo como terapia electiva para el tratamiento de las EP submasivas (incluido todo el espectro de RI) a pesar de la falta de evidencias aleatorizadas o recomendaciones sólidas en las guías a este respecto. Por el contrario, el nivel de concienciación en torno a estas TDC y su disponibilidad podría ser relativamente bajo en países tardíos a la hora de adoptar esta tecnología en centros no académicos ni terciarios, provocando desigualdades en el acceso de los pacientes a terapias avanzadas contra la EP.
El ascenso de los tratamientos con TDC se debe al creciente mercado y a los resultados prometedores de los primeros estudios realizados que revelan mejoras casi inmediatas de la función del ventrículo derecho así como del estado hemodinámico frente al tratamiento conservador7,10,19,20 con un riesgo de sangrado muy bajo21,22. La variedad de técnicas disponibles (figura 1), no obstante podría añadir cierta heterogeneidad, si bien el debate en torno a las diferentes TDC que existen va más allá del ámbito de actuación del presente manuscrito.
Lo que nos dice el importante número de pacientes reperfundidos de nuestra cohorte (el 59% de los pacientes con EP-RIA y el 81% de los pacientes con EP-AR) es que, en la actualidad, los PERT solo se activan para un segmento de pacientes de más alto riesgo. También, que esto es reflejo de la óptima accesibilidad a la reperfusión cuando ambas terapias, TS y TDC, están disponibles.
Trombolisis sistémica frente a terapias dirigidas por catéter
La TS es el tratamiento preferido para pacientes con inestabilidad hemodinámica y cardiorrespiratoria asociada a la EP, aunque el beneficio sobre la mortalidad se basa principalmente en un pequeño ensayo clínico (n = 8) finalizado prematuramente23. Los factores de riesgo para la EP incluyen la edad, diferentes comorbilidades y, ante todo, los antecedentes oncológicos o la presencia de un cáncer activo24, que también confieren un riesgo hemorrágico mucho más alto25, sobre todo, cuando el tratamiento que se usa es la TS. Estudios publicados sostienen que los sangrados mayores sobrevienen en entre el 10 y el 15% de los pacientes con EP aguda tratados con TS y los episodios hemorrágicos intracraneales entre el 1,5 y 2% de esta población de pacientes3,4,26,27. Es por esto que, quizás, este tratamiento no suela administrarse a pacientes mayores con comorbilidades preexistentes, tal y como demuestran no solo el presente estudio sino otras muchas publicaciones3-5. En este sentido, el manejo de pacientes mayores oncológicos y con comorbilidades con EP aguda representa un importante desafío para los médicos y, en este contexto, las TDC podrían ser una alternativa segura y eficaz. De hecho, el análisis multivariable de nuestro estudio reveló que el aumento de las comorbilidades fue un factor independiente para optar por TDC en detrimento de la TS como terapia de reperfusión preferida. Estos hallazgos ofrecen una nueva opción para pacientes altamente vulnerables que, de otro modo, no serían reperfundidos y, por lo tanto, correrían un mayor riesgo de mortalidad asociado a un abordaje más conservador3. No obstante, estos resultados se deben interpretar con cautela por el bajo porcentaje de pacientes tratados con TS en el presente estudio (35,0%), así como el bajo porcentaje de pacientes con EP-AR incluidos (15,8%). Además, debido al largo período de tiempo cubierto por el estudio, se incluyó un porcentaje significativo de pacientes con EP-RIA que recibieron TS. Con la publicación del ensayo PEITHO28 y la llegada de catéteres específicos para el tratamiento de la EP, la TS en pacientes con EP-RIA ha caído en desuso incluso entre aquellos que tienen peor pronóstico dentro de este subgrupo. En este sentido, quizás nuestra población del estudio no sea un reflejo exacto de los pacientes de la práctica clínica actual.
Los pacientes posoperatorios son especialmente complejos porque la cirugía es un factor de riesgo para la EP además de una contraindicación formal para la TS. La trombectomía percutánea ha mostrado una baja incidencia de sangrados mayores en estudios de un único brazo y parece una buena opción para estos pacientes8,9,29. No obstante, para emplear estos dispositivos, el trombo ha de estar localizado en el segmento proximal de las arterias pulmonares principales. De hecho, la EP central bilateral resultó ser una variable independiente que nos impulsó a optar por estas TDC en nuestro estudio.
Anticoagulación frente a terapias dirigidas por catéter
La anticoagulación solo está recomendada para pacientes con EP-RI estable y de bajo riesgo2. En pacientes de EP-RI la TS ha logrado reducir el riesgo de descompensación hemodinámica, pero a un alto coste hemorrágico28 razón por la cual las terapias de reperfusión están destinadas a pacientes con deterioro hemodinámico2. No obstante, la irrupción de las terapias percutáneas, sobre todo de los dispositivos de aspiración de gran calibre, podría proporcionar las ventajas que ofrece la reperfusión pulmonar observadas en el estudio PEITHO28 sin los preocupantes efectos adversos (principalmente hemorrágicos). Aunque nuestro estudio confirma que el uso de las TDC ha ido a más durante los últimos años estas terapias se reservan, prudentemente, para el manejo de las EP de mayor riesgo. Grandes ensayos clínicos en curso, en la actualidad, como el PEERLESS (NCT: 05111613), el HI-PEITHO (NCT: 04790370) y el PE-TRACT (NCT: 05591118) aclararán de una vez por todas la indicación para TDC en pacientes con EP-RIA aguda.
Primeros resultados de seguridad en pacientes con embolias pulmonares agudas
Nuestro estudio reveló una incidencia de mortalidad por cualquier causa a los 30 días del 9,3%, más baja que la de otros estudios observacionales21,30. En cualquier caso, mientras los estudios mencionados solo incluyeron a pacientes reperfundidos (mediante TDC o TS), el presente estudio incluyó, también, a pacientes que recibieron tratamiento conservador, que se espera, estén menos graves y, en consecuencia, tengan un mejor pronóstico. A diferencia de los hallazgos hechos por otras publicaciones19,21,31, la incidencia de hemorragias mayores intrahospitalarias y muerte precoz por cualquier causa fue relativamente alta en el grupo a tratamiento con TDC en nuestra cohorte. Principalmente, son 2 las razones que explicarían estos resultados: en primer lugar, los pacientes del grupo a tratamiento con TDC de nuestra cohorte eran mayores y tenían más comorbilidades (de hecho, el 30% presentaba alguna contraindicación formal para la TS) y, en segundo lugar, el grupo TDC incluyó a casi un 50% de los pacientes que recibieron fármacos trombolíticos, que se asocian a un mayor riesgo hemorrágico que, solo, la aspiración de trombos. Además, se administró tenecteplasa al 28,6% de los pacientes del grupo tratados mediante trombólisis guiada por catéter, un fármaco que está asociado a una alta incidencia de hemorragias mayores en el estudio PEITHO28. Por último, el acceso vascular empleado en la gran mayoría de los pacientes del presente estudio fue el femoral (97,0%) y la incidencia de complicaciones vasculares estuvo en torno al 10,6% (todas sobrevinieron en pacientes tratados mediante trombólisis dirigida por catéter o aspiración con catéter no específico). Anteriores estudios han confirmado la baja incidencia de las hemorragias mayores cuando se realiza trombólisis dirigida por catéter mediante acceso braquial32. No obstante, en la actualidad, los dispositivos específicos, sobre todo los de aspiración de gran calibre, solo se pueden usar por vía femoral debido a su gran calibre. No se informaron episodios de hemorragias intracraneales en pacientes a tratamiento con TDC en nuestra cohorte.
Por otro lado, nuestro estudio vino a confirmar una notable mejora hemodinámica en aquellos pacientes a tratamiento con TDC, tal y como han descrito otros estudios7-10,33. Aunque este beneficio es importante, no debemos olvidar la futilidad de los tratamientos intervencionistas en pacientes muy ancianos y con comorbilidades a fin de equilibrar la relación coste-efectividad y el juicio clínico34. Se necesitan más datos para poder determinar cuál es el equilibrio riesgo-beneficio de las TDC frente a la anticoagulación y la TS en pacientes mayores o con una alta carga de comorbilidades.
Limitaciones
Se deben tener en cuenta varias limitaciones a la hora de interpretar los resultados de este estudio. Debido a su diseño observacional, la presencia de factores de confusión no medidos podría haber influido en las conclusiones del estudio. Como se desconoce el número total de pacientes ingresados con EP en el período de estudio en los 2 centros, se debe reconocer que existe un sesgo de supervivencia. El porcentaje de pacientes de riesgo intermedio-bajo incluidos fue relativamente bajo, lo cual sugiere que los PERT se activaron para atender a los pacientes más graves. En este sentido, también podríamos tener un cierto sesgo de selección en este estudio. Aunque al inicio de este estudio, no contamos con dispositivos específicos para el tratamiento percutáneo de la EP, estos se incorporaron a medida que fueron estando disponibles (los primeros dispositivos específicos en 2018). Como este fue un registro con datos facilitados por los propios pacientes sin seguimiento externo son los investigadores locales los responsables de la integridad de los datos.
CONCLUSIONES
Los resultados de este estudio vienen a confirmar que los factores asociados a la elección de las TDC en el análisis multivariable fueron un índice de comorbilidad de Charlson más alto, las cirugías recientes y las EP proximales bilaterales. La elección de las TDC en detrimento de la TS como terapia de reperfusión aumentó durante el período de estudio. Aunque las TDC fueron una opción efectiva para pacientes mayores y con comorbilidades con EP, el manejo de pacientes con EP agudas plantea muchos desafíos y ha de ser individualizado.
FINANCIACIÓN
Esta investigación no recibió ninguna subvención procedente de organismos de financiación del sector público, privado o sin ánimo de lucro.
CONSIDERACIONES ÉTICAS
El protocolo del registro fue aprobado por el comité de ética en investigación clínica del Hospital Clínico San Carlos como comité central del registro de conformidad con la legislación local en materia de investigación (código 18/010-E). Todos los pacientes incluidos prospectivamente firmaron un formulario de consentimiento informado. El comité de investigación ética concedió una exención de consentimiento informado para todos aquellos pacientes reclutados retrospectivamente. Los datos sobre el sexo de los pacientes (no el género) fueron incluidos en el diseño de la base de datos en 2018.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial en la preparación de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORES
C. Real diseñó el esquema del estudio, llevó a cabo el análisis estadístico y redactó el artículo. C. Ferrera diseñó el esquema del estudio y redactó el artículo. M.E. Vázquez-Álvarez participó en la recopilación de datos e interpretación de estos. M. Huanca, F.J. Noriega, E. Gutiérrez-Ibañes, A.M. Mañas-Hernández, N. Ramos-López, M. Juárez, P. Jiménez-Quevedo, J. Elízaga y A. Viana-Tejedor participaron en la recopilación de datos y llevaron a cabo una revisión crítica del manuscrito. P. Salinas diseñó el protocolo, la base de datos y el esquema del estudio, coordinó el análisis e interpretación de los datos y realizó una revisión crítica el manuscrito. Todos los autores aprobaron la versión final del manuscrito a efectos de publicación.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- Las terapias dirigidas por catéter (TDC) han surgido como terapias de reperfusión seguras y efectivas para pacientes con embolias pulmonares (EP) agudas. Según las guías de la ESC, estas terapias deben ser tenidas en cuenta en pacientes con EP-AR y trombolisis fallida o con contraindicaciones a esta terapia y como terapia de rescate para pacientes con EP-RIA y deterioro clínico. No obstante, durante los últimos años, son muchos los estudios publicados que han intentado establecer la indicación para estas terapias en un espectro más amplio de pacientes. Además, como preocupa el riesgo de sangrado, se sabe que la terapia de reperfusión con trombolisis sistémica (TS) está infrautilizada, razón por la cual las TDC podría ser una opción viable para estos pacientes que, de otro modo, quedarían sin tratamiento.
¿QUÉ APORTA DE NUEVO?
- En la práctica clínica, en dos centros terciarios de referencia, los factores asociados a la elección de las TDC en detrimento de la TS fueron las comorbilidades, los antecedentes de cirugía reciente y las EP proximales bilaterales. No obstante, el perfil de riesgo de los pacientes tratados con las dos terapias fue similar en cada estrato de riesgo. En consecuencia, se puede concluir que las TDC son una alternativa segura y efectiva en pacientes que necesitan terapia de reperfusión.
AGRADECIMIENTOS
Los autores desean agradecer a María Beneito-Durá su asesoramiento en materia estadística.
BIBLIOGRAFÍA
1. Götzinger F, Lauder L, Sharp ASP, et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 2023 Oct;20:670-684.
2. Konstantinides S V, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41:543-603.
3. Keller K, Hobohm L, Ebner M, et al. Trends in thrombolytic treatment and outcomes of acute pulmonary embolism in Germany. Eur Heart J. 2020;41:522-529.
4. Jiménez D, Bikdeli B, Barrios D, et al. Epidemiology, patterns of care and mortality for patients with hemodynamically unstable acute symptomatic pulmonary embolism. Int J Cardiol.2018;269:327-333.
5. Stein PD, Matta F. Thrombolytic Therapy in Unstable Patients with Acute Pulmonary Embolism:Saves Lives but Underused. Am J Med.2012;125:465-470.
6. Pruszczyk P, Klok FK, Kucher N, et al. Percutaneous treatment options for acute pulmonary embolism:a clinical consensus statement by the ESC Working Group on Pulmonary Circulation and Right Ventricular Function and the European Association of Percutaneous Cardiovascular Interventions. EuroIntervention. 2022;18:623-638.
7. Kucher N, Boekstegers P, Müller OJ, et al. Randomized, Controlled Trial of Ultrasound-Assisted Catheter-Directed Thrombolysis for Acute Intermediate-Risk Pulmonary Embolism. Circulation. 2014;129:479-486.
8. Tu T, Toma C, Tapson VF, et al. A Prospective, Single-Arm, Multicenter Trial of Catheter-Directed Mechanical Thrombectomy for Intermediate-Risk Acute Pulmonary Embolism. JACC Cardiovasc Interv. 2019;12:859-869.
9. Sista AK, Horowitz JM, Tapson VF, et al. Indigo Aspiration System for Treatment of Pulmonary Embolism. JACC Cardiovasc Interv. 2021;14:319-329.
10. Kroupa J, Buk M, Weichet J, et al. A pilot randomised trial of catheter-directed thrombolysis or standard anticoagulation for patients with intermediate-high risk acute pulmonary embolism. EuroIntervention. 2022;18:639-646.
11. Pasha AK, Siddiqui MU, Siddiqui MD, et al. Catheter directed compared to systemically delivered thrombolysis for pulmonary embolism:a systematic review and meta-analysis. J Thromb Thrombolysis.2022;53:454-466.
12. Salinas P, Vázquez-Álvarez M-E, Salvatella N, et al. Catheter-directed therapy for acute pulmonary embolism:results of a multicenter national registry. Rev Esp Cardiol. 2024;77:(2):138-147.
13. Ramos-López N, Ferrera C, Luque T, et al. Impact of a pulmonary embolism response team initiative on hospital mortality of patients with bilateral pulmonary embolism. Med Clin. 2023;160:469-475.
14. Elm E, Altman DG, Egger M, et al. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement:guidelines for reporting observational studies. J Clin Epidemiol. 2008;61:344-349.
15. Aujesky D, Obrosky DS, Stone RA, et al. Derivation and Validation of a Prognostic Model for Pulmonary Embolism. Am J Respir Crit Care Med. 2005;172:1041-1046.
16. Bova C, Sanchez O, Prandoni P, et al. Identification of intermediate-risk patients with acute symptomatic pulmonary embolism. Eur Respir J. 2014;44:694-703.
17. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies:Development and validation. J Chronic Dis. 1987;40:373-383.
18. Schulman S, Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non?surgical patients. J Thromb Haemost. 2005;3:692-694.
19. Ismayl M, Machanahalli Balakrishna A, et al. Meta-Analysis Comparing Catheter-Directed Thrombolysis Versus Systemic Anticoagulation Alone for Submassive Pulmonary Embolism. Am J Cardiol. 2022;178:154-162.
20. Kuo WT, Banerjee A, Kim PS, et al. Pulmonary Embolism Response to Fragmentation, Embolectomy, and Catheter Thrombolysis (PERFECT). Chest. 2015;148:667-673.
21. Beyer SE, Shanafelt C, Pinto DS, et al. Utilization and Outcomes of Thrombolytic Therapy for Acute Pulmonary Embolism. Chest. 2020;157:645-653.
22. Pei DT, Liu J, Yaqoob M, et al. Meta-Analysis of Catheter Directed Ultrasound-Assisted Thrombolysis in Pulmonary Embolism. Am J Cardiol.2019;124:1470-1477.
23. Jerjes-Sanchez C, Ramírez-Rivera A, de Lourdes García M, et al. Streptokinase and heparin versus heparin alone in massive pulmonary embolism:A randomized controlled trial. J Thromb Thrombolysis. 1995;2:227-229.
24. Blom JW. Malignancies, Prothrombotic Mutations, and the Risk of Venous Thrombosis. JAMA. 2005;293:715.
25. Winter MA, Dorresteijn JAN, Ageno W, et al. Estimating Bleeding Risk in Patients with Cancer-Associated Thrombosis:Evaluation of Existing Risk Scores and Development of a New Risk Score. Thromb Haemost. 2022;122:818-829.
26. Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism:a systematic review and meta-analysis. Eur Heart J. 2015;36:605-614.
27. Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for Pulmonary Embolism and Risk of All-Cause Mortality, Major Bleeding, and Intracranial Hemorrhage. JAMA. 2014;311:2414.
28. Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for Patients with Intermediate-Risk Pulmonary Embolism. N Engl J Med. 2014;370:1402-1411.
29. Toma C, Jaber WA, Weinberg MD, et al. Acute outcomes for the full US cohort of the FLASH mechanical thrombectomy registry in pulmonary embolism. EuroIntervention. 2023;18:1201-1212.
30. Hobohm L, Schmidt FP, Gori T, et al. In-hospital outcomes of catheter-directed thrombolysis in patients with pulmonary embolism. Eur Hear J Acute Cardiovasc Care. 2021;10:258-264.
31. Stein PD, Matta F, Hughes MJ. Catheter-Directed Thrombolysis in Submassive Pulmonary Embolism and Acute Cor Pulmonale. Am J Cardiol.2020;131:109-114.
32. Portero-Portaz JJ, Córdoba-Soriano JG, Gallardo-López A, Gutiérrez-Díez A, Melehi El-Assali D, Jiménez-Mazuecos JM. Resultados de la terapia dirigida por catéter en la tromboembolia pulmonar aguda. Rev Esp Cardiol. 2020;73:953-954.
33. Piazza G, Hohlfelder B, Jaff MR, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose TFibrinolysis for Acute Massive and Submassive Pulmonary Embolism. JACC Cardiovasc Interv. 2015;8:1382-1392.
34. Lindman BR, Alexander KP, O'Gara PT, Afilalo J. Futility, Benefit, and Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2014;7:707-716.