RESUMEN
La tomografía computarizada es una técnica no invasiva, de gran resolución espacial, con excelente definición del calcio y del espacio intravascular al emplear medios de contraste, que brinda la posibilidad de realizar tanto mediciones como simulaciones virtuales de intervencionismo coronario y estructural. Se ha establecido como la técnica de referencia en la selección de pacientes y la planificación de procedimientos de intervencionismo transcatéter coronario y estructural en diferentes escenarios (implante percutáneo de válvula aórtica, cierre percutáneo de orejuela izquierda, reemplazo de válvula mitral transcatéter y reemplazo de válvula tricúspide transcatéter). El presente trabajo revisa el papel de la tomografía computarizada en el intervencionismo cardiaco coronario y estructural.
Palabras clave: Tomografía computarizada. Intervencionismo estructural. TAVI. LAAO. TMVR.
ABSTRACT
Computed tomography is a noninvasive imaging technique with high spatial resolution, providing excellent definition of calcium and intravascular space through the use of contrast media. This imaging modality allows both highly accurate measurements and virtual simulations for preprocedural planning in coronary and structural heart disease interventions. Computed tomography is currently the gold standard technique for patient selection and preprocedural planning in numerous scenarios, such as transcatheter aortic valve implantation, left atrial appendage occlusion, transcatheter mitral valve repair, and transcatheter tricuspid valve repair. This article reviews the role of computed tomography in transcatheter coronary and structural heart disease interventions.
Keywords: Computed tomography. Structural heart disease interventions. TAVR. LAAO. TMVR.
Abreviaturas ECG: electrocardiograma. LAAO: cierre percutáneo de la orejuela izquierda. TAVI: implante percutáneo de válvula aórtica. TC: tomografía computarizada. TMVR: reemplazo valvular mitral transcatéter. TSVI: tracto de salida del ventrículo izquierdo.
INTRODUCCIÓN
El intervencionismo coronario y estructural cardiaco ha tenido como técnicas de imagen tradicionales la fluoroscopia y la ecocardiografía transesofágica, en especial para la monitorización durante los procedimientos. La selección de los pacientes por imagen generalmente se fundamentaba también en la ecocardiografía, pero el avance tecnológico y de conocimiento en los últimos años ha permitido introducir nuevas técnicas, en particular la tomografía computarizada (TC) y en menor medida la resonancia magnética, en el ámbito del intervencionismo.
En la actualidad, la TC es la técnica de elección previa al intervencionismo estructural cardiaco en una amplia variedad de procedimientos, así como la técnica de cribado de enfermedad coronaria e incluso para la planificación del intervencionismo coronario.
En la presente revisión se repasan los usos y las indicaciones de la TC cardiaca en el ámbito del intervencionismo cardiaco transcatéter coronario y estructural.
ASPECTOS GENERALES DE LA TOMOGRAFÍA COMPUTARIZADA CARDIACA
La TC es una herramienta idónea para la valoración de los pacientes antes de un procedimiento de cardiología intervencionista. Es una técnica de imagen no invasiva, con excelente definición del calcio y del espacio intravascular con el uso de medios de contraste, que presenta una resolución espacial submilimétrica isotrópica y una aceptable resolución temporal.
La TC, igual que la coronariografía invasiva, utiliza una fuente de rayos X para generar la imagen. Los equipos actuales van montados sobre un anillo (gantry) en el que se dispone el tubo de rayos X opuesto a una corona de detectores. El haz de radiación emitido se atenúa y absorbe de acuerdo con las densidades de los tejidos del paciente. La energía captada por los detectores es reconstruida para obtener una imagen médica.
Al realizar una imagen tomográfica de las estructuras cardiacas y de las arterias coronarias hay que tener en cuenta que se trata de estructuras de reducido calibre y en constante movimiento, de forma independiente entre sí, en los tres ejes del espacio. Por ello, se requiere que el equipo tenga una serie de capacidades técnicas que permitan obtener estudios concluyentes. La tabla 1 recoge la definición de algunos parámetros técnicos fundamentales en la imagen de TC.
Tabla 1. Principales conceptos básicos de tomografía computarizada
| Concepto | Definición |
|---|---|
| Resolución espacial | Capacidad de visualizar dos puntos independientes que se encuentran muy cerca. Depende del tamaño de los detectores; en los equipos modernos es < 1 mm |
| Isotropismo | Imagen compuesta por vóxeles con un tamaño similar en los tres planos del espacio. Permite reformatear la imagen minimizando la pérdida de resolución |
| Resolución temporal | El menor tiempo que precisa el equipo para adquirir la imagen. Depende de la velocidad de rotación del gantry y del método de adquisición |
La adquisición de una TC cardiaca debe realizarse siempre con sincronización electrocardiográfica (ECG-gatted). Esta sincronización ECG permite compensar los movimientos cardiacos, y la realización del estudio en apnea permite compensar los movimientos respiratorios. Se pueden realizar adquisiciones durante todo el ciclo cardiaco o durante una fase del ciclo seleccionada previamente. La adquisición de todo el ciclo cardiaco (llamada «retrospectiva» en los tomógrafos con una cobertura en Z menor de 16 cm) presenta la ventaja de poder reconstruir todas sus fases y hacer una valoración funcional (volúmenes, fracción de eyección, movimiento de los velos valvulares) y reconstrucciones en 4D; sin embargo, requiere una mayor dosis de radiación. Esto puede corregirse en parte con una adquisición retrospectiva con modulación de dosis, en la que se predefine una o varias fases para realizar la adquisición de máxima calidad y el resto del ciclo cardiaco se adquiere con menos calidad, y por lo tanto con una menor dosis de radiación1.
La mejora tecnológica y el aumento de la disponibilidad de escáneres de TC con software para adquisición cardiaca ha permitido incluir esta técnica como estándar en diversos procedimientos de intervencionismo estructural. Se considera que lo mínimo requerido es un equipo de TC de 64 cortes con capacidad para sincronizar con el ECG, pero los equipos más modernos permiten mejor calidad de imagen, menor radiación y uso de contraste. Los equipos de última generación siguen distintas líneas de desarrollo: a) equipos de amplia cobertura (aumenta la distancia explorada en cada latido incrementando el número de detectores, y existen equipos con más de 300 detectores y cobertura cardiaca en un solo latido); b) doble fuente con pitch alto (utilizan dos fuentes de radiación desalineadas 90° con una alta velocidad de la mesa para mejorar la resolución temporal de manera muy significativa); c) equipos espectrales (mediante detectores de distinta sensibilidad o diferentes niveles de energía del emisor se obtienen imágenes en diferentes espectros energéticos que permiten cierto grado de caracterización tisular); y d) conteo de fotones (se eliminan los detectores fotoluminiscentes intermedios, permitiendo aumentar la resolución espacial a 0,2 mm).
Además del equipo de TC son necesarios una bomba inyectora al menos bifásica que permita un alto flujo (4-7 ml/s), un medio de contraste con una concentración de yodo en torno a 350 mg/ml (idealmente isoosmolar) y un sistema digital de procesamiento y almacenamiento de imagen en formato DICOM (Digital Imaging and Communication in Medicine).
La preparación de los pacientes para realizar una TC cardiaca es de crucial importancia para obtener estudios diagnósticos de calidad. Tras descartar contraindicaciones para la realización de la prueba, se debe obtener su consentimiento informado. Se canalizará un acceso venoso periférico, generalmente antecubital derecho (18-20 G). El paciente suele colocarse en decúbito supino con los brazos por encima de la cabeza. Se aplican los electrodos del ECG asegurando una excelente calidad del trazado. Se debe explicar y ensayar con el paciente la apnea necesaria durante la exploración, así como comprobar la calidad del ECG durante la apnea.
En función de la indicación del estudio, si la frecuencia del paciente es alta o el ritmo es irregular puede ser necesario utilizar medicación previa a la exploración, siendo la más frecuente bloqueadores beta intravenosos. En aquellos estudios en los que sea preciso evaluar el lumen coronario, en general se administrará también nitroglicerina sublingual. En cuanto a la realización de una TC cardiaca previa a un intervencionismo estructural, hay que recordar que una estenosis aórtica o mitral grave sintomática es una contraindicación para el uso de nitroglicerina, y los bloqueadores beta deben administrarse con precaución, bajo supervisión de personal cualificado y garantizando la disponibilidad de medios para llevar a cabo una resucitación cardiopulmonar avanzada si fuera necesaria.
APLICACIÓN AL INTERVENCIONISMO CORONARIO
La angiografía coronaria por TC permite hacer una valoración anatómica detallada del árbol coronario, su origen y trayecto, detectar la presencia de lesiones ateroescleróticas, cuantificar los segmentos afectados y determinar la gravedad de la estenosis y la carga ateroesclerótica. Es la técnica estándar para la valoración del paciente sintomático y se puede plantear en algunos pacientes asintomáticos de alto riesgo seleccionados. Tiene una sensibilidad del 97% y una especificidad del 78% tomando como referencia la coronariografía invasiva en una población con una probabilidad pretest del 56%. En comparación con otras técnicas invasivas presenta la mayor sensibilidad, si bien tienen más especificidad técnicas funcionales tales como la resonancia magnética de estrés (80%), la ecocardiografía de estrés (82%) y la tomografía por emisión de positrones (85%)2. A pesar de tener una menor especificidad, la estrategia anatómica basada en la TC se ha comprobado que no es inferior en términos de pronóstico respecto a la estrategia funcional basada en test de isquemia (estudio PROMISE)3.
El alto valor predictivo negativo de la TC la ha posicionado, según las guías de práctica clínica, como técnica de primera línea en los pacientes sintomáticos de riesgo bajo-intermedio para descartar la presencia de enfermedad coronaria obstructiva4. La tabla 2 recoge las principales indicaciones de la TC coronaria en diferentes escenarios clínicos.
Tabla 2. Indicaciones actuales de la tomografía computarizada de arterias coronarias y de la medición del calcio arterial coronario según las guías de práctica clínica de la Sociedad Europea de Cardiología
| Síntomas agudos | Grado de recomendación | Nivel de evidencia | Año | Ref. |
|---|---|---|---|---|
| Pacientes con sospecha de síndrome coronario agudo, troponinas normales o en rango incierto, electrocardiograma normal y no recurrencia de dolor; puede ser considerado como parte de la evaluación diagnóstica inicial | IIA | A | 2023 | 5 |
| Uso sistemático en pacientes con sospecha de síndrome coronario agudo | III | B | 2023 | 5 |
| Síntomas estables | Grado de recomendación | Nivel de evidencia | Año | Ref. |
| Paciente sintomático con sospecha de enfermedad coronaria que no puede ser descartada clínicamente | I | B | 2019 | 4 |
| Estratificación del riesgo en pacientes con sospecha o nuevo diagnóstico de enfermedad coronaria | I | B | 2019 | 4 |
| Pacientes con sospecha de angina vasoespástica para estudiar enfermedad coronaria subyacente | I | C | 2019 | 4 |
| Despistaje de enfermedad coronaria en pacientes hemodinámicamente estables con vegetaciones aórticas que requieren cirugía cardiaca | I | B | 2023 | 6 |
| Pacientes con probabilidad baja-intermedia de enfermedad coronaria y un test previo de estrés no invasivo equívoco | IIA | C | 2021 | 7 |
| Alternativa a coronariografía invasiva previamente a cirugía cardiaca valvular en pacientes con probabilidad baja de enfermedad coronaria | IIA | C | 2021 | 8 |
| Pacientes con sospecha de cardiomiopatía para el despistaje de enfermedad arterial coronaria o anomalías coronarias que puedan causar la miocardiopatía | IIA | C | 2023 | 9 |
| Pacientes previamente a cirugía no cardiaca no urgente, de riesgo intermedio-alto: a) baja-intermedia probabilidad de enfermedad coronaria y sospecha de síndrome coronario crónico o síndrome coronario agudo sin movilización enzimática; b) paciente no elegible para pruebas funcionales no invasivas | IIA | C | 2022 | 10 |
| No se recomienda la tomografía computarizada coronaria para el seguimiento sistemático de pacientes con enfermedad coronaria establecida | III | C | 2019 | 4 |
| Asintomáticos | Grado de recomendación | Nivel de evidencia | Año | Ref. |
| Puntuación de calcio como modificador del riesgo en pacientes asintomáticos de moderado riesgo cardiovascular | IIB | B | 2019 | 4 |
| Individuos seleccionados sin historia de enfermedad coronaria, alto riesgo cardiovascular (SCORE > 10%, fuerte historia familiar, hipercolesterolemia familiar) y deseo de iniciar un programa de ejercicio intenso | IIB | B | 2021 | 11 |
| Alto riesgo cardiovascular (diabetes mellitus, historia familiar o test previo que sugieren enfermedad coronaria) | IIB | C | 2019 | 4 |
| Adultos (> 40 años) asintomáticos con diabetes mellitus | IIB | B | 2019 | 4 |
| Adultos asintomáticos no diabéticos de bajo riesgo | III | C | 2019 | 4 |
Los avances tecnológicos y la inclusión de nuevas técnicas, como la perfusión de estrés con TC y el análisis de la reserva fraccional de flujo con TC (FFRCT, fractional flow reserve computed tomography), han permitido aumentar la especificidad hasta el 85-87%12, con un mayor valor predictivo positivo de la técnica y permitiendo evaluar de manera precisa a pacientes de riesgo intermedio-alto.
Se han publicado importantes trabajos en relación con el pronóstico de los pacientes estudiados mediante TC. El estudio SCOT-HEART13 demostró una reducción de las muertes por causa cardiovascular y de los infartos de miocardio no fatales a los 5 años de seguimiento con una estrategia guiada por TC con ajuste de tratamiento según los resultados, frente a una estrategia de manejo convencional. Por otra parte, el estudio DISCHARGE14 demostró un similar riesgo de eventos cardiovasculares mayores en el seguimiento en pacientes con probabilidad intermedia y dolor torácico estable aleatorizados a TC frente a coronariografía invasiva, y una menor tasa de complicaciones en el grupo con la técnica no invasiva. Estos estudios avalan a la TC como herramienta de primera línea para descartar la presencia de enfermedad coronaria, establecer el tratamiento de prevención en los pacientes con enfermedad coronaria no obstructiva, estratificar a los pacientes con enfermedad coronaria obstructiva y ser una alternativa a la coronariografía invasiva en un amplia variedad de pacientes.
En los pacientes con antecedente de enfermedad coronaria, la TC coronaria se puede emplear para valorar los puentes de derivación aortocoronaria, para comprobar la permeabilidad de stents coronarios en determinados casos (segmentos proximales y stents > 3,0 mm) y para el estudio de oclusiones coronarias totales crónicas previo a la revascularización coronaria percutánea. En el estudio BYPASS-CTCA15, en el que se aleatorizó a los pacientes con revascularización coronaria quirúrgica previa para realizarles una valoración anatómica basada en TC y coronariografía invasiva, o una coronariografía invasiva aislada, se objetivó una reducción de la duración del procedimiento y de la nefropatía por contraste en los pacientes con valoración no invasiva de la derivación aortocoronaria.
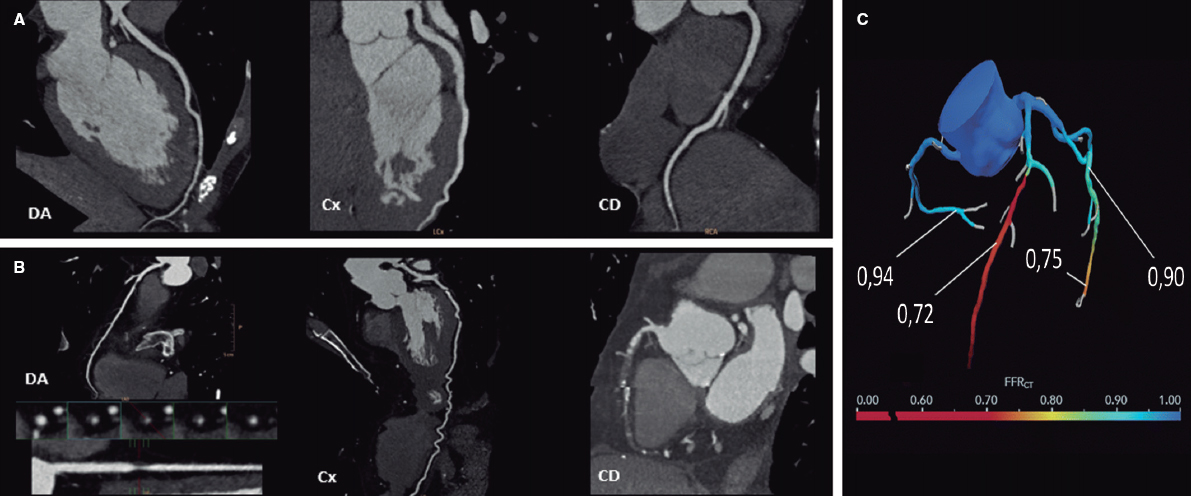
La TC coronaria debe ser procesada de acuerdo con las recomendaciones de la Society of Cardiovascular Computed Tomography16. Existen diferentes formatos de representación de imágenes (axial, reformateo multiplanar, proyección de máxima intensidad, reformateo multiplanar curvado o reconstrucción volumétrica), siendo su uso complementario. La lectura de un estudio de TC coronaria comienza por la valoración de su calidad, la identificación de potenciales artefactos y la visualización del origen, el trayecto y la dominancia coronaria. A continuación, los principios generales para la lectura son: a) revisión sistemática de cada segmento coronario desde múltiples planos y en sección transversal; b) estar alerta a posibles artefactos; c) evaluación de la morfología y la composición de las lesiones; y d) graduación de la gravedad de las lesiones utilizando una imagen de alta resolución en vistas longitudinales y transversales al lumen del vaso. Las arterias coronarias se segmentan, siguiendo la distribución modificada de la American Heart Association, en 18 segmentos coronarios. Las lesiones identificadas se enumerarán haciendo referencia al segmento, la naturaleza de la lesión (no calcificada, parcialmente calcificada o calcificada) y el grado de estenosis que genera (figura 1): normal (ausencia de lesión o estenosis), mínima (reducción del lumen < 25%), leve (25-49%), moderada (50-69%), grave (70-99%) u oclusión (> 99%).
Figura 1. La tomografía computarizada permite evaluar las arterias coronarias con el objetivo de excluir la presencia de enfermedad coronaria (A, arterias coronarias normales), o bien determinar la gravedad y la localización de la enfermedad coronaria obstructiva (B, lesión grave en la arteria descendente anterior [DA] proximal y oclusión crónica total en la arteria coronaria derecha [CD] media y distal). Mediante simulación computacional se puede evaluar la funcionalidad de las lesiones (C, reserva fraccional de flujo con TC [FFRCT], lesión grave en la DA media y en la arteria circunfleja [Cx] distal).
El análisis detallado de la TC permite establecer un plan de intervencionismo percutáneo, seleccionar el material a utilizar y potencialmente reducir el tiempo y la complejidad del procedimiento. Esto puede ser especialmente útil en la optimización del ángulo de fluoroscopia basado en el análisis de la TC en lesiones coronarias complejas o bifurcadas, así como en la realización de un sondaje coronario complejo en pacientes portadores de prótesis valvular aórtica percutánea17.
La complejidad global de la enfermedad coronaria se puede representar mediante índices como la puntuación de calcio o el número de segmentos con algún grado de enfermedad coronaria, pero también se dispone de varias escalas específicas. De estas, las más difundidas son CAD-RADSTM (Coronary Artery Disease Reporting and Data System)18 y su actualización CAD-RADSTM 2.019, en la que se añaden parámetros de perfusión y complejidad de placa. Existen otras más específicas, como la escala CT-SYNTAX20 con información anatómica de la TC y los datos clínicos de la escala SYNTAX, y las escalas Functional CT-SYNTAX21 y Functional FFRCT22, que añaden la información funcional del FFRCT. Estas escalas permiten refinar la decisión entre una estrategia de revascularización quirúrgica o percutánea, con buenos resultados iniciales23. Su validación pronóstica en diferentes escenarios, así como su implementación en la práctica asistencial, pueden suponer un cambio de paradigma en la realización de estudios diagnósticos invasivos en pacientes estables.
En los pacientes con oclusión coronaria total crónica, el análisis de la TC previo al procedimiento permite estimar la probabilidad de éxito de revascularización coronaria percutánea; para ello se han elaborado varias escalas pronósticas, como J-CTO24, CT-RECTOR25 y KCCT26 (tabla 3). Los parámetros analizados incluyen la extensión de la calcificación, la tortuosidad vascular, la morfología del «muñón» de la oclusión, la presencia de múltiples oclusiones y la longitud de las lesiones.
Tabla 3. Escalas de predicción para el éxito y la dificultad de revascularización de oclusiones totales crónicas por tomografía computarizada
| Puntuación | Variables (puntuación) | Clasificación |
|---|---|---|
| J-CTO | Extremidad cónica (0) frente a desafilada (1) | Fácil (0) Intermedio (1) Difícil (2) Muy difícil (≥ 3) |
| Ninguna calcificación (0) frente a alguna (1) | ||
| Angulación de la oclusión ≤ 45° (0) frente a > 45° (1) | ||
| Longitud de la oclusión < 20 mm (0) frente a ≥ 20 mm (1) | ||
| Sin intentos de revascularización previos fallidos (0) frente a con intentos previos (1) | ||
| CT-RECTOR | < 2 oclusiones (0) frente a ≥ 2 interrupciones completas (1) | Fácil (0) Intermedio (1) Difícil (2) Muy difícil (≥ 3) |
| Extremidad cónica (0) frente a desafilada (1) | ||
| < 50% de calcificación del perímetro del vaso en el eje corto (0) frente a ≥ 50% de calcificación en algún punto de la oclusión (1) | ||
| Angulación de la oclusión ≤ 45° (0) frente a > 45° (1) | ||
| Sin intentos de revascularización previos fallidos (0) frente a con intentos previos (1) | ||
| Tiempo de duración de la oclusión coronaria total crónica < 12 meses (0) frente a ≥ 12 meses (1) | ||
| KCCT | Extremidad cónica (0) frente a desafilada (1) | Fácil (0) Intermedio (1) Difícil (2) Muy difícil (3) Extremamente difícil (≥ 4) |
| Sin ramas colaterales adyacentes (0) frente a con ramas colaterales adyacentes (1) | ||
| Longitud de la oclusión < 15 mm (0) frente a ≥ 15 mm (1) | ||
| Angulación de la oclusión ≤ 45° (0) frente a > 45° (1) | ||
| Calcificación del vaso en el eje corto < 180° de perímetro o < 50% del área (0) frente a ≥ 180° de perímetro y ≥ 50% del área (1) frente a calcificación central completa de 360° de perímetro y 100% del área (2) | ||
| Sin intentos de revascularización previos fallidos (0) frente a con intentos previos (1) | ||
| Tiempo de duración de la oclusión coronaria total crónica < 12 meses (0) frente a ≥ 12 meses (1) |
APLICACIÓN AL INTERVENCIONISMO ESTRUCTURAL CARDIACO
Implante percutáneo de válvula aórtica
Una vez diagnosticada la estenosis aórtica grave por ecocardiografía, la TC constituye la prueba de elección para realizar una valoración integral del paciente candidato a implante percutáneo de válvula aórtica (TAVI)27. Con la TC se puede, en un único estudio, valorar los accesos vasculares, confirmar el grado de estenosis aórtica y la morfología valvular, medir el anillo aórtico, evaluar el riesgo de oclusión coronaria y determinar los ángulos óptimos de fluoroscopia, entre otros aspectos. Además, en un alto porcentaje de los casos permite realizar un cribado de enfermedad coronaria obstructiva proximal y una valoración de hallazgos extracardiacos28.
El estudio de planificación de un TAVI incluye: a) adquisición sin contraste para cuantificar el calcio valvular aórtico (opcional); b) adquisición con sincronización ECG en fase sistólica, al menos en la región del complejo valvular aórtico; y c) dependiendo de la velocidad y de la cobertura del equipo utilizado, una o varias adquisiciones para los accesos iliofemorales, sin ser imprescindible la sincronización ECG en esta región. El estudio requiere la inyección de medio de contraste (50-90 ml, con flujo a 3-5 ml/s, sujeto a variaciones según el equipo utilizado y la superficie corporal del paciente)28.
Los principales aspectos que deben detallarse en el informe de TC para realizar un TAVI se listan en la tabla 4.
Tabla 4. Principales aspectos a describir en el informe de la tomografía computarizada previa a un implante percutáneo de válvula aórtica o un cierre percutáneo de la orejuela auricular izquierda
| Implante percutáneo de válvula aórtica | |
|---|---|
| Anillo aórtico | Medición en fase sistólica |
| Área y perímetro | |
| Diámetros mayor y menor | |
| Proyección de fluoroscopia óptima | |
| Calcio y válvula | Presencia, morfología y extensión del calcio |
| Morfología valvular | |
| Aorta y accesos | Altura del origen de las arterias coronarias |
| Diámetro luminal mínimo de cada segmento vascular | |
| Descripción de calcificaciones y patología vascular | |
| Otros | Anatomía coronaria |
| Hallazgos extracardiacos | |
| Cierre percutáneo de orejuela auricular izquierda | |
| Trombo | Despistaje de defecto repleción arterial/venoso |
| Morfología y zona de despliegue | Describir la morfología y la presencia de lóbulos proximales |
| Medir la zona de despliegue, diámetro mayor | |
| Medir la profundidad y la longitud de la orejuela | |
| Proyección de fluoroscopia óptima | |
| Otros | Anatomía del septo interauricular |
| Anatomía de las venas pulmonares | |
| Describir si hay derrame pericárdico | |
En la actualidad existen dos diseños generales de prótesis valvulares aórticas transcatéter: expandibles con balón y autoexpandibles. Los TAVI expandibles con balón utilizan la fuerza radial acompañada del inflado del balón para acomodar su diseño circular a la forma oval del anillo aórtico. En cambio, los autoexpandibles se expanden por sí mismos, gracias a la memoria del nitinol, hasta acomodarse sobre el anillo. Además de diferencias técnicas y de diseño, hay que tener en cuenta que los algoritmos de selección del tamaño del dispositivo no son intercambiables entre ellos. Las prótesis expandibles con balón se basan en el área del anillo aórtico, y las autoexpandibles en el perímetro.
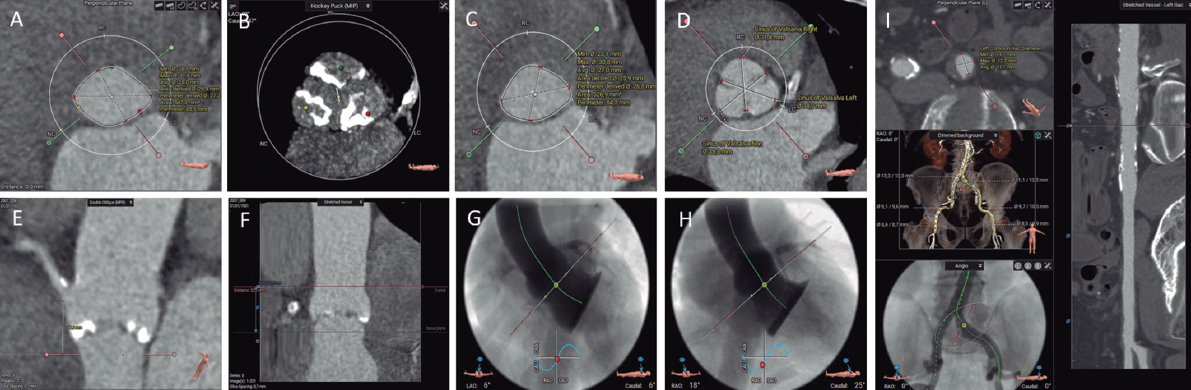
La figura 2 resume toda la evaluación necesaria antes de realizar un TAVI.
Figura 2. Evaluación previa al implante percutáneo de válvula aórtica con tomografía computarizada y software de análisis 3mensio CT: anillo aórtico (A), calcio valvular aórtico (B), tracto de salida del ventrículo izquierdo (C), diámetros de los senos de Valsalva (D), altura del origen de la coronaria derecha (E), altura de la unión sinotubular (F), proyección coplanar 3 cusp (G), proyección cusp-overlap (H) y accesos transfemorales (I).
Es preciso comprender y analizar la anatomía del complejo valvular aórtico, compuesto por el tracto de salida del ventrículo izquierdo (TSVI), los senos de Valsalva, los triángulos fibrosos entre los velos aórticos y los velos aórticos en sí mismos. Una medida fundamental es la valoración adecuada del plano del anillo aórtico, que se define como el plano virtual alineado con el punto de inserción más bajo de cada cúspide aórtica o nadires. Se determinan los diámetros mayor y menor, el área y el perímetro del anillo aórtico. De acuerdo con estas medidas, se seleccionará el tamaño del TAVI. El anillo aórtico modifica su tamaño y forma durante el ciclo cardiaco, siendo la mesosístole (30-35% R-R), en la mayoría de las ocasiones, el mejor momento para realizar la medición (mayor tamaño y menor elipticidad)29. Existen software específicamente diseñados para automatizar estas medidas y simular el implante, que facilitan el flujo de trabajo y reducen la variabilidad inter- e intraobservador.
La zona de despliegue de la prótesis (landing zone) comprende las cúspides aórticas, el anillo aórtico y el TSVI. La presencia de calcificación grave en el TSVI y en la válvula aórtica aumenta el riesgo de regurgitación periprotésica ulterior, mientras que la presencia de calcificaciones nodulares de gran tamaño puede conllevar un mayor riesgo de rotura del anillo aórtico, en especial con las prótesis expandibles con balón30. Se deben describir la localización y la extensión del calcio en la válvula aórtica y en los primeros 5-7 mm del TSVI, al ser esta la zona de sellado de la mayoría de los TAVI disponibles. La morfología y el grado de calcificación de la válvula aórtica deben ser sistemáticamente informados, prestando especial atención a la presencia de calcio con efecto masa (bulky) o que fusione parcialmente las comisuras aórticas28.
Hay que evaluar la altura perpendicular desde el plano del anillo aórtico hasta el origen de las arterias coronarias. Si bien no se han establecido unos valores de corte absolutos, una altura de origen de las arterias coronarias < 12 mm y unos senos de Valsalva < 30 mm conllevan un mayor riesgo de oclusión coronaria asociada al TAVI31.
En el informe deben constar también las proyecciones óptimas por TC para el despliegue de la prótesis. Su identificación reduce la dosis de radiación, el contraste y la duración del procedimiento29. Se reportarán la angulación para obtener una proyección coplanar (3 cusp), con alineamiento de las cúspides, y la angulación para obtener una proyección de solapamiento (cusp overlap), con las cúspides izquierda y derechas solapadas. Este plano despliega el TSVI y permite realizar un mejor control de la profundidad del implante durante la liberación de la prótesis, en especialmente con las autoexpandibles32.
En cuanto a los accesos vasculares, la TC permite su valoración en un único estudio, con excelente resolución y delimitación de la presencia y la extensión de las calcificaciones. Las complicaciones vasculares incrementan la morbimortalidad del procedimiento de TAVI. Los factores asociados con la aparición de complicaciones vasculares son la relación entre el diámetro mínimo vascular y el diámetro externo del introductor empleado, la presencia de calcificaciones moderadas o graves, y la tortuosidad vascular33. Se deben reflejar en el informe los diámetros luminales mínimos, la extensión, la distribución y la gravedad de la calcificación, y la presencia o no de patología vascular en todos los segmentos vasculares entre la válvula aórtica y las arterias femorales comunes izquierda y derecha a la altura de la cabeza del fémur28. En caso de que los accesos femorales no sean válidos, se valorarán accesos alternativos, siendo los más habituales el axilar/subclavio, el carotídeo, el transcava y el transapical.
Requiere especial atención la válvula aórtica bicúspide, dado que asocia una menor tasa de éxito del procedimiento y mayores tasas de regurgitación periprotésica, pero con similares resultados clínicos34. Se deben determinar el tipo de válvula bicúspide (fusión de senos, dos senos o forme fruste)35, la presencia de rafe, la distribución del calcio, el tamaño y la excentricidad del anillo, así como el origen y la altura del origen de las arterias coronarias. La medición del anillo aórtico puede resultar especialmente compleja en válvulas bicúspides de dos senos, precisando una metodología específica28. Se define el anillo aórtico como el plano virtual alineado con el punto de inserción más bajo de la cúspide más anterior/lateral. Se fija dicho punto como punto de partida con rotación antihoraria hasta el punto de inserción más bajo de la cúspide posterior/medial. La perpendicular a estos dos puntos centrada en el punto en que se alcanza la menor área transversal es el lugar indicado para trazar la medida (una angulación excesiva o insuficiente puede conducir a una sobre- o infraestimación del tamaño del anillo). Se determinan los diámetros mayor y menor, y el área y el perímetro del anillo aórtico. En relación con la selección del tamaño de la prótesis basándose en el tamaño del anillo aórtico, se han desarrollado algoritmos que también tienen en cuenta la longitud del rafe, el volumen de la calcificación y su distribución (CASPER, calcium algorithm sizing for bicuspid evaluation with raphe)36. Por otro lado, se ha propuesto un método (LIRA, level of implantation at the raphe) mediante la delineación del perímetro del orificio de apertura de la válvula bicúspide37, si bien no está claro que resulte superior a las mediciones convencionales38.
Una variante del TAVI es el implante valve-in-valve, en el cual se coloca una prótesis percutánea sobre una bioprótesis previa disfuncionante. La TC tiene un papel crucial para la selección del tamaño de la prótesis, en especial cuando se desconoce el modelo o el tamaño de la prótesis implantada, pero también para estratificar el riesgo de oclusión coronaria. Entre los parámetros principales para determinar el riesgo de obstrucción coronaria se encuentran el nivel que alcanzan los velos protésicos respecto del origen de las coronarias y de la unión sinotubular, el plano de riesgo sobre la unión sinotubular, la distancia del TAVI virtual a la unión sinotubular < 2 mm, la distancia del TAVI virtual al origen de las arterias coronarias < 4 mm, una prótesis previa supraanular o supracoronaria, una prótesis quirúrgica con velos implantados por fuera del anillo (tipo Mitroflow o Trifecta), un implante previo en posición alta y la presencia de una desviación comisural moderada o grave39,40.
Una vez realizado el TAVI, la TC permite valorar la posición y la geometría de la prótesis, así como el grosor y la movilidad de los velos protésicos. Tras el procedimiento de TAVI puede realizarse una TC en caso de disfunción o degeneración protésica identificada por ecocardiografía, sospecha de trombosis, endocarditis infecciosa o regurgitación periprotésica que requiera valoración anatómica. Se ha descrito el fenómeno de engrosamiento con hipoatenuación y reducción de la movilidad en los velos protésicos, que está asociado a trombosis subclínica y que se resuelve con un régimen de anticoagulación. Este hallazgo se ha asociado a una mayor tendencia (no significativa) a eventos embólicos, por lo que no existe un consenso ni indicación establecida de realizar TC de forma sistemática después del TAVI. Su aparición es más frecuente en valve-in-valve, prótesis expandibles con balón y prótesis de mayor tamaño o con expansión excéntrica por válvulas bicúspides, por ejemplo41.
Por último, comentar la posibilidad de utilizar la TC para resolver dudas diagnósticas en relación con la gravedad de la estenosis aórtica. Puede resultar particularmente útil la valoración del calcio valvular aórtico en pacientes con estenosis aórtica de bajo flujo y bajo gradiente con fracción de eyección preservada, siendo sugestivos de estenosis aórtica grave degenerativa unos valores ≥ 2.000 unidades Agatston en varones y ≥ 1.200 en mujeres, y por el contrario sugestivos de ausencia de estenosis grave degenerativa unos valores < 1.600 en varones y < 800 en mujeres8.
Cierre percutáneo de la orejuela izquierda
El cierre percutáneo de la orejuela izquierda (LAAO [left atrial appendage occlusion]) es una alternativa a la anticoagulación oral en pacientes en fibrilación auricular en quienes esta se encuentre contraindicada. La técnica tradicionalmente utilizada en la selección de pacientes es la ecocardiografía transesofágica (ETE), para descartar la presencia de trombo en la orejuela y poder realizar las mediciones para la selección del dispositivo. De forma consistente, se ha demostrado que las mediciones tridimensionales (ETE-3D, TC) tienen más precisión para seleccionar el tamaño del dispositivo que la ETE-2D. Por lo tanto, la TC es una técnica alternativa en la selección de pacientes, ya que permite ver si hay trombo y evaluar la anatomía y el tamaño de la orejuela, así como del septo interauricular42.
La TC para valoración del LAAO debe llevarse a cabo con sincronización ECG, idealmente en fase telesistólica (de mayor expansión de la orejuela izquierda), y se debe realizar una segunda adquisición en fase venosa, 60-90 segundos tras la administración del contraste, para evaluar la presencia o no de trombo en la orejuela izquierda43. Los principales aspectos que hay que detallar en un informe de TC para LAAO se listan en la tabla 4. Si la calidad lo permite, es recomendable realizar una valoración de la anatomía coronaria.
Tabla 5. Predictores de obstrucción del tracto de salida del ventrículo izquierdo en el implante percutáneo de válvula mitral
| Predictores de obstrucción | Límite de riesgo de obstrucción |
|---|---|
| Área del neo-TSVI | < 1,9 cm2 |
| Área de falda del neo-TSVI | < 1,5 cm2 |
| Dimensiones del velo mitral anterior | > 25 mm |
| Septo interventricular saliente | Grosor > 15 mm |
| Distancia del anillo mitral al septo interventricular | < 17,8 mm |
| Ángulo aortomitral agudo | < 110° |
| Ventrículo izquierdo pequeño | Diámetro telediastólico < 48 mm |
| Hipertrofia del ventrículo izquierdo | Masa miocárdica indexada > 105 g/m2 |
|
TSVI: tracto de salida del ventrículo izquierdo. |
|
La morfología de la orejuela izquierda es muy variable y compleja. Se han comercializado diferentes dispositivos para LAAO, de los cuales los más empleados son los dispositivos de lóbulo y de disco. La medición de la zona de despliegue se realiza mediante reformateo multiplanar partiendo de los planos de dos cámaras y coronal. En el caso de los dispositivos de lóbulo, la zona de despliegue se sitúa desde la arteria circunfleja a un punto situado a 10-20 mm por dentro del ligamento de Marshall. La profundidad viene determinada desde la zona de despliegue hasta el extremo más distal de la orejuela. Por su parte, con los dispositivos de disco, la zona de despliegue se sitúa a 10-12 mm por dentro del ostium de la orejuela, cubriendo en su extremo inferior el trayecto de la arteria circunfleja. La profundidad en este tipo de dispositivos se define desde el ostium hasta la pared opuesta de la orejuela43. Es importante valorar también la anatomía de las estructuras adyacentes, en especial del ligamento de Marshall para valorar la factibilidad de cubrirlo por completo con un dispositivo de disco y evitar la formación de trombos en el seguimiento44, así como las características anatómicas de la arteria pulmonar en relación con la orejuela izquierda45.
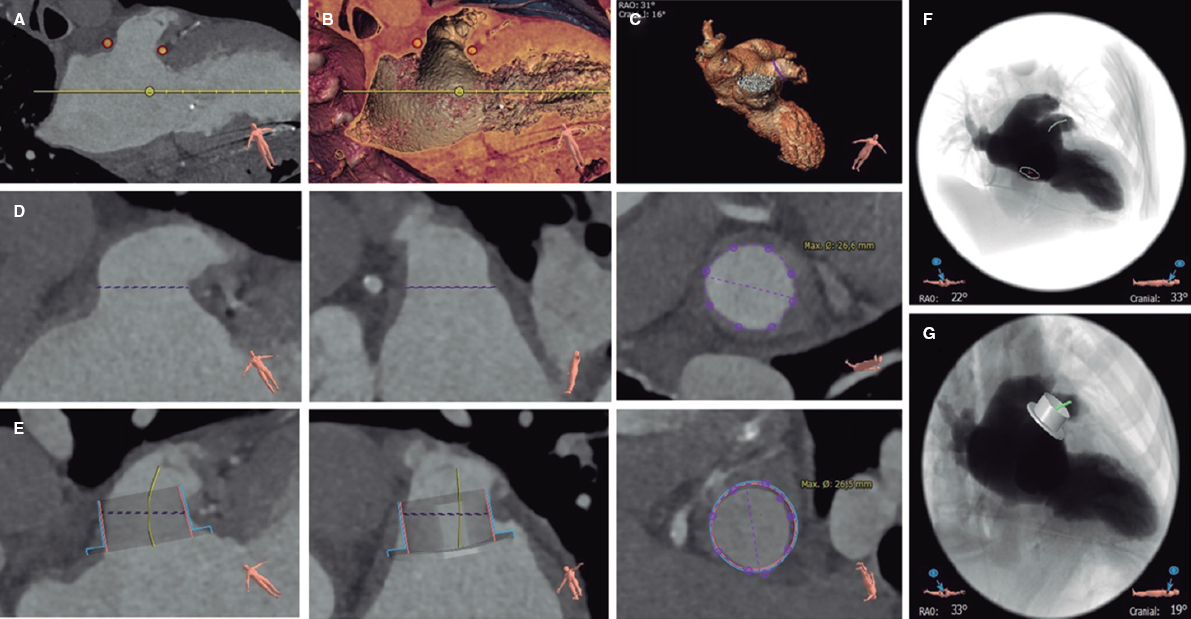
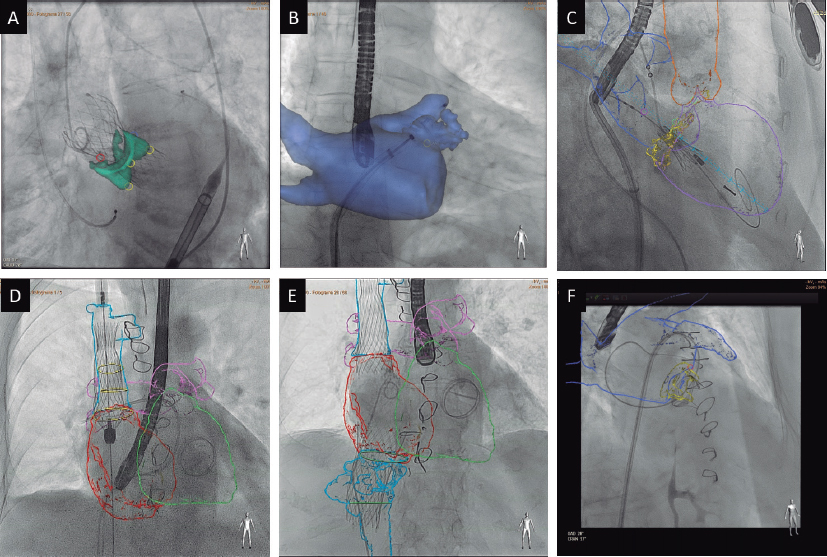
Existen software específicamente diseñados para automatizar estas medidas y simular el implante (figura 3). La utilización de un software de simulación del procedimiento mediante computación permite mejorar la selección de los dispositivos y el resultado del procedimiento46.
Figura 3. Planificación del cierre percutáneo de la orejuela izquierda con tomografía computarizada y software de análisis 3mensio CT: identificación del ostium de la orejuela izquierda (A y B), morfología de la orejuela izquierda (C), medida de la zona de despliegue (D, planos longitudinales y transversal), simulación del dispositivo oclusor (E, planos longitudinales y transversal), simulación de la proyección de fluoroscopia y posición de la punción transeptal (F), y simulación del dispositivo oclusor en la fluoroscopia (G).
Tras el LAAO se recomienda realizar una prueba de imagen a los 45-60 días del implante, para comprobar la estabilidad y el posicionamiento del dispositivo, en búsqueda de fugas residuales y para descartar la presencia de un trombo relacionado con el dispositivo. La ETE y la TC son las técnicas más habitualmente empleadas. La TC permite una mejor visualización de la posición y del despliegue del dispositivo, tiene igual capacidad de detección de trombos y presenta una mayor sensibilidad en la detección de paso residual de contraste. Este último puede ser debido a una malposición del dispositivo, a la presencia de una fuga peridispositivo o a la permeabilidad del tejido de recubrimiento47. La relevancia clínica de las fugas residuales, así como la importancia de su tamaño, no están del todo aclaradas48.
Reemplazo valvular mitral transcatéter
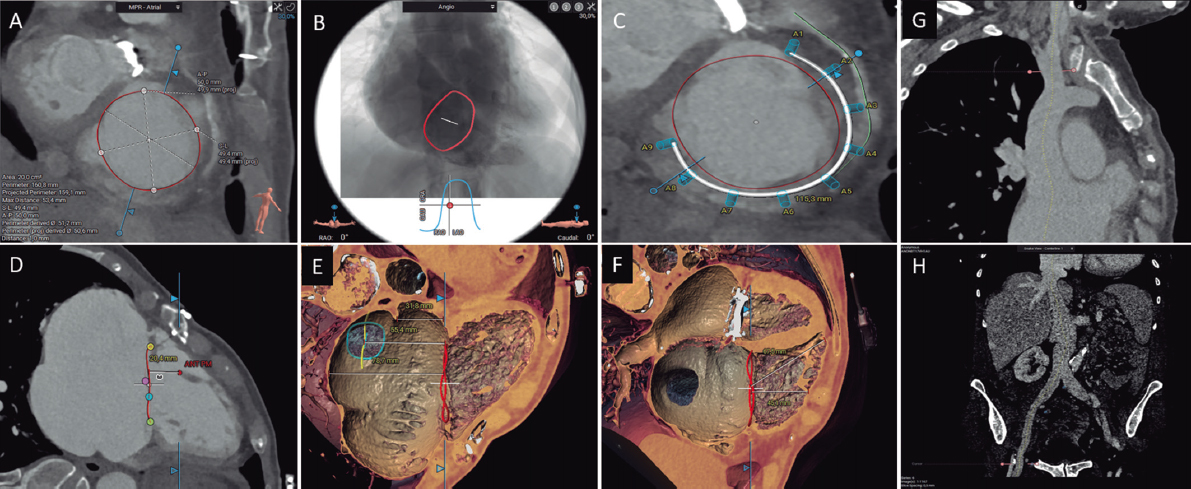
Dentro del intervencionismo valvular mitral transcatéter existen opciones de reparación y reemplazo. Las técnicas de reparación borde-a-borde están clínicamente consolidadas; en ellas, la selección de pacientes y la monitorización del procedimiento se realiza con ETE. En cambio, para las diferentes técnicas de reemplazo valvular la TC es una herramienta imprescindible. La TC debe adquirirse con sincronización ECG cubriendo y reconstruyendo todo el ciclo cardiaco tras la administración de medio de contraste con una adecuada opacificación de al menos las cavidades izquierdas, e idealmente también las derechas para mejorar la visualización de la anatomía y sus relaciones. Se han publicado recomendaciones detalladas para su adquisición y optimización49. La TC permite evaluar el tamaño y la forma del anillo mitral, seleccionar el tipo y el tamaño de la prótesis a implantar, simular virtualmente el implante y evaluar el neo-TSVI resultante del implante virtual, seleccionar los ángulos óptimos de fluoroscopia y planificar los accesos vasculares (transeptal o transapical)49 (figura 4). Las mediciones específicas para cada dispositivo están determinadas por el fabricante.
Figura 4. Diferentes pasos de la planificación del reemplazo valvular mitral transcatéter con tomografía computarizada y software de análisis 3mensio CT en dos pacientes con valve-in-MAC (A-C) y con válvula nativa (D-F): delimitación y medición del anillo mitral (A y D), evaluación de la distancia de la prótesis virtual al septo interventricular (D y E) y medición del neotracto de salida del ventrículo izquierdo (C y F).
Se ha descrito el reemplazo valvular mitral transcatéter (TMVR, transcatheter mitral valve replacement) sobre válvula nativa, sobre anuloplastia quirúrgica previa (valve-in-ring), sobre prótesis valvular biológica disfuncionante previa (valve-in-valve) y sobre anillo mitral nativo gravemente calcificado (valve-in-MAC)50. La TC resulta en especial útil para la selección del tamaño de la prótesis, así como para la valoración del riesgo embólico en procedimientos de valve-in-MAC mediante la valoración del espesor del calcio anular mitral, su extensión en el perímetro posterior o en los trígonos mitrales, y el daño de los velos mitrales51.
La principal complicación que debemos evitar durante la planificación del TMVR es la aparición de obstrucción del TSVI tras el TMVR. El neo-TSVI es la distancia/área existente entre el borde inferior del implante virtual y el septo interventricular. Los principales factores predictores de obstrucción en el neo-TSVI se detallan en la tabla 552. El área del neo-TSVI debe evaluarse en meso-telesístole (40-50% R-R; menor área del ciclo cardiaco), y el nivel de riesgo de obstrucción será mayor cuanto menor sea el área de neo-TSVI: < 170 mm2 muy alto riesgo, 170-190 mm2 alto riesgo, 190-220 mm2 riesgo aceptable y > 220 mm2 bajo riesgo. En casos seleccionados con alto riesgo de obstrucción se pueden aplicar técnicas de laceración del velo anterior mitral (LAMPOON) o ablación del septo interventricular (ablación septal con alcohol) para aumentar el área de neo-TSVI53.
Reemplazo valvular tricúspide transcatéter
Entre los procedimientos transcatéter sobre la válvula tricúspide se han descrito principalmente la reparación borde-a-borde, la anuloplastia y el reemplazo valvular ortotópico y heterotópico (prótesis valvulares en las venas cavas).
La adquisición es similar a la de la TC previa al TMVR (sincronización ECG cubriendo y reconstruyendo todo el ciclo cardiaco tras la administración de medio de contraste), pero optimizando el contraste de las cavidades cardiacas derechas, usando para ello protocolos de inyección trifásica (mezcla de contraste y solución salina a distintas concentraciones). Se han publicado recomendaciones detalladas para su adquisición y optimización49. El estudio mediante TC permite evaluar la geometría y el tamaño del anillo tricúspide a lo largo del ciclo cardiaco, la morfología y la movilidad de los velos tricuspídeos, la posición y la relación de la arteria coronaria derecha respecto al anillo tricúspide, el volumen y la fracción de eyección del ventrículo derecho, el ángulo óptimo de fluoroscopia y los accesos vasculares54 (figura 5).
Figura 5. Evaluación de la válvula tricúspide mediante tomografía computarizada y software de análisis 3mensio CT: medición del anillo tricúspide (A), simulación de la proyección de fluoroscopia (B), simulación de los anclajes de anuloplastia percutánea respecto a la arteria coronaria derecha (C), distancia del anillo tricúspide al músculo papilar anterior (D), distancia del anillo tricúspide al techo del seno coronario, la vena cava inferior y el techo de la aurícula derecha (E), distancia del anillo tricúspide a la pared libre y al ápex del ventrículo derecho (F), reconstrucción multiplanar curvada de la vena cava superior (G) y la vena cava inferior, y accesos femorales (H).
La TC también puede complementar la valoración de la posición y la relación de los electrodos de estimulación con los velos tricuspídeos en casos seleccionados de reparación borde-a-borde. Sin embargo, su utilidad principal radica en la selección de pacientes y la planificación de procedimientos de anuloplastia y reemplazo valvular, en los que es una técnica imprescindible. En relación con la anuloplastia, permite seleccionar el tamaño del dispositivo, descartar mediante simulación la interacción de los sistemas de anclaje y el trayecto de la arteria coronaria derecha, y evaluar el tenting de los velos tricuspídeos para valorar una posible regurgitación residual tras el procedimiento54. En el reemplazo heterotópico permite dimensionar las venas cavas superior e inferior a diferentes niveles, evaluar la anatomía y la localización de las venas suprahepáticas, y establecer el tamaño de la aurícula derecha; aspectos que determinarán el tipo y el tamaño del dispositivo a implantar55. Por último, en el reemplazo ortotópico los criterios de selección dependen en gran medida del dispositivo elegido; no obstante, en general, es necesario evaluar el tamaño del anillo, la distancia al músculo papilar anterior o a la pared libre del ventrículo derecho, la posición de confluencia de las venas cavas y los ángulos entre estas y el anillo tricúspide, así como la vía de acceso56.
Otros procedimientos
Cierre de fugas periprotésicas
La TC ha mostrado un buen rendimiento diagnóstico en la detección de fugas periprotésicas aórticas y mitrales, permitiendo definir el número, la localización, la forma y el tamaño de los defectos57. Es especialmente útil en la valoración de complicaciones de endocarditis infecciosa58, así como para la planificación y el soporte del cierre de fugas periprotésicas en posición aórtica59. Por otro lado, la simulación basada en la TC previa al procedimiento de reemplazo valvular aórtico o mitral permite predecir la aparición de fugas periprotésicas60.
Cardiopatías congénitas
La resonancia magnética es la técnica de elección en el diagnóstico, la evaluación y el seguimiento de las cardiopatías congénitas. Esto se debe a su capacidad para obtener cualquier geometría de exploración y realizar una valoración anatómica y funcional, una caracterización tisular y un análisis de flujos, así como a la ausencia de radiación en una población generalmente joven. La TC se reserva para pacientes y casos seleccionados.
La selección de los pacientes, del dispositivo y del tamaño de este previamente al intervencionismo en cardiopatías congénitas puede realizarse con TC o con resonancia magnética. La TC tiene mayor resolución espacial y permite delimitar con más precisión las áreas de calcificación y el adecuado dimensionado de la prótesis. Es imprescindible realizar una resonancia magnética o una TC antes de la intervención en el reemplazo valvular pulmonar transcatéter y en el tratamiento percutáneo de la coartación de aorta. Puede resultar también útil en casos de conducto arterial permeable y de fístulas complejas. Presenta un menor valor añadido en el cierre de defectos septales, tales como comunicación interauricular o interventricular61. Sin embargo, en la comunicación interventricular posinfarto de miocardio la TC puede resultar muy útil para dimensionar el defecto y valorar la morfología, la extensión y los bordes, ya que suelen ser defectos anfractuosos y complejos difíciles de evaluar correctamente por ecocardiografía62.
Fusión de imagen de TC y fluoroscopia durante el intervencionismo
La información anatómica y la planificación realizada antes del procedimiento pueden integrarse en la monitorización de este. Para ello, utilizando un software y una estación de trabajo específicas, se realiza una segmentación de las estructuras cardiacas de manera semiautomática y se corregistra con la anatomía del paciente en la mesa de intervención desde dos proyecciones de fluoroscopia. Tras el corregistro se puede integrar toda la información de la TC en el procedimiento, permitiendo, entre otras opciones, ampliar el rango de visión, mejorar la compresión de las relaciones anatómicas, posicionar marcadores o trayectorias, y planificar angulaciones de fluoroscopia óptimas63, si bien son imágenes estáticas que no tienen sincronización ECG ni respiratoria (figura 6).
Figura 6. Ejemplos de fusión de imágenes de tomografía computarizada y fluoroscopia en diferentes procedimientos empleando Heart Navigator (Philips): reemplazo valvular aórtico percutáneo (A), cierre de orejuela izquierda (B), reemplazo valvular mitral percutáneo valve-in-MAC (C), implante valvular en la vena cava superior (D) e inferior (E), y cierre de fuga periprotésica mitral (F).
La fusión de TC y fluoroscopia ha demostrado reducir la duración del procedimiento, el uso de contraste y la radiación en el TAVI y el LAAO, así como disminuir la necesidad de cambio de tamaño de dispositivo intraprocedimiento en el LAAO. Se han descrito su uso y utilidad en multitud de procedimientos, y ha mostrado ser más útil en las intervenciones más complejas (TMVR, reemplazo valvular tricúspide transcatéter, TAVI transcava, cierre de fugas periprotésicas, etc.)64.
CONCLUSIONES
La TC es una técnica no invasiva, de elevada resolución espacial, con excelente definición del calcio y del espacio intravascular con el empleo de medios de contraste, que brinda la posibilidad de realizar tanto mediciones como simulaciones virtuales de intervencionismo coronario y estructural. Se ha establecido como la técnica de referencia en la selección de pacientes y la planificación de procedimientos de intervencionismo transcatéter coronario y estructural en diferentes escenarios (TAVI, LAAO, TMVR y reemplazo valvular tricúspide transcatéter).
FINANCIACIÓN
El presente trabajo no ha recibido ninguna financiación.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado inteligencia artificial para la elaboración del presente trabajo.
CONTRIBUCIÓN DE LOS AUTORES
El borrador del manuscrito fue elaborado por M. Barreiro-Pérez e I. Cruz-González, y revisado en profundidad y aprobado por todos los autores. Las correcciones y la respuesta a los revisores, y los cambios editoriales, los realizaron Berenice Caneiro Queija y M. Barreiro-Pérez.
CONFLICTO DE INTERESES
M. Barreiro-Pérez ha recibido pagos por presentaciones o actividades educativas de Abbott Vascular, Edwards Lifesciences, Venus MedTech, Lifetech y Cardiovalve. I. Cruz-González ha recibido pagos por presentaciones o actividades educativas de Abbott Vascular y Boston Scientific. R. Estévez Loureiro ha recibido pagos por presentaciones o actividades educativas de Abbott Vascular, Boston Scientific, Edwards Lifesciences y Venus MedTech.
BIBLIOGRAFÍA
1. Abbara S, Blanke P, Maroules CD, et al. SCCT guidelines for the performance and acquisition of coronary computed tomographic angiography:A report of the society of Cardiovascular Computed Tomography Guidelines Committee:Endorsed by the North American Society for Cardiovascular Imaging (NASCI). J Cardiovasc Comput Tomogr. 2016;10:435-449.
2. Knuuti J, Ballo H, Juarez-Orozco LE, et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina:a meta-analysis focused on post-test disease probability. Eur Heart J. 2018;39:3322-3330.
3. Douglas PS, Hoffmann U, Patel MR, et al. Outcomes of anatomical versus functional testing for coronary artery disease. N Engl J Med. 2015;372:1291-1300.
4. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
5. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44:3720-3826.
6. Delgado V, Ajmone Marsan N, De Waha S, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023;44:3948-4042.
7. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42:3599-3726.
8. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
9. Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J. 2023;44:3503-3626.
10. Halvorsen S, Mehilli J, Cassese S, et al. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J. 2022;43:3826-3924.
11. Pelliccia A, Sharma S, Gati S, et al. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J. 2021;42:17-96.
12. Pontone G, Baggiano A, Andreini D, et al. Stress Computed Tomography Perfusion Versus Fractional Flow Reserve CT Derived in Suspected Coronary Artery Disease:The PERFECTION Study. JACC Cardiovasc Imaging. 2019;12(8 Pt 1):1487-1497.
13. Newby DE, Adamson PD, Berry C, et al. Coronary CT Angiography and 5-Year Risk of Myocardial Infarction. N Engl J Med. 2018;379:924-933.
14. Maurovich-Horvat P, Bosserdt M, Kofoed KF, et al. CT or Invasive Coronary Angiography in Stable Chest Pain. N Engl J Med. 2022;386:1591-1602.
15. Jones DA, Beirne AM, Kelham M, et al. Computed Tomography Cardiac Angiography Before Invasive Coronary Angiography in Patients With Previous Bypass Surgery:The BYPASS-CTCA Trial. Circulation. 2023;148:1371-1380.
16. Leipsic J, Abbara S, Achenbach S, et al. SCCT guidelines for the interpretation and reporting of coronary CT angiography:A report of the Society of Cardiovascular Computed Tomography Guidelines Committee. J Cardiovasc Comput Tomogr. 2014;8:342-358.
17. Andreini D, Collet C, Leipsic J, et al. Pre-procedural planning of coronary revascularization by cardiac computed tomography:An expert consensus document of the Society of Cardiovascular Computed Tomography. J Cardiovasc Comput Tomogr. 2022;16:558-572.
18. Cury RC, Abbara S, Achenbach S, et al. CAD-RADSTM Coronary Artery Disease –Reporting and Data System. An expert consensus document of the Society of Cardiovascular Computed Tomography (SCCT), the American College of Radiology (ACR) and the North American Society for Cardiovascular Imaging (NASCI). Endorsed by the American College of Cardiology. J Cardiovasc Comput Tomogr. 2016;10:269-281.
19. Cury RC, Leipsic J, Abbara S, et al. CAD-RADSTM 2.0 –2022 Coronary Artery Disease-Reporting and Data System:An Expert Consensus Document of the Society of Cardiovascular Computed Tomography (SCCT), the American College of Cardiology (ACC), the American College of Radiology (ACR), and the North America Society of Cardiovascular Imaging (NASCI). J Cardiovasc Comput Tomogr. 2022;16:536-557.
20. Papadopoulou SL, Girasis C, Dharampal A, et al. CT-SYNTAX score:a feasibility and reproducibility study. JACC Cardiovasc Imaging. 2013;6:413-415.
21. Collet C, Miyazaki Y, Ryan N, et al. Fractional Flow Reserve Derived From Computed Tomographic Angiography in Patients With Multivessel CAD. J Am Coll Cardiol. 2018;71:2756-2769.
22. Gabara L, Hinton J, Kira M, et al. Derivation and validation of a novel functional FFRCT score incorporating the burden of coronary stenosis severity and flow impairment to predict clinical events. J Cardiovasc Comput Tomogr. 2024;18:33-42.
23. Kageyama S, Serruys PW, Kotoku N, et al. Coronary computed tomography angiography-based SYNTAX score for comprehensive assessment of advanced coronary artery disease. J Cardiovasc Comput Tomogr. 2024;18:120-136.
24. Morino Y, Abe M, Morimoto T, et al. Predicting successful guidewire crossing through chronic total occlusion of native coronary lesions within 30 minutes:the J-CTO (Multicenter CTO Registry in Japan) score as a difficulty grading and time assessment tool. JACC Cardiovasc Interv. 2011;4:213-221.
25. Opolski MP, Achenbach S, Schuhbäck A, et al. Coronary computed tomographic prediction rule for time-efficient guidewire crossing through chronic total occlusion:insights from the CT-RECTOR multicenter registry (Computed Tomography Registry of Chronic Total Occlusion Revascularization). JACC Cardiovasc Interv. 2015;8:257-267.
26. Yu CW, Lee HJ, Suh J, et al. Coronary Computed Tomography Angiography Predicts Guidewire Crossing and Success of Percutaneous Intervention for Chronic Total Occlusion:Korean Multicenter CTO CT Registry Score as a Tool for Assessing Difficulty in Chronic Total Occlusion Percutaneous Coronary Intervention. Circ Cardiovasc Imaging. 2017;10:e005800.
27. Otto CM, Kumbhani DJ, Alexander KP, et al. 2017 ACC Expert Consensus Decision Pathway for Transcatheter Aortic Valve Replacement in the Management of Adults With Aortic Stenosis:A Report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2017;69:1313-1346.
28. Blanke P, Weir-McCall JR, Achenbach S, et al. Computed Tomography Imaging in the Context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR):An Expert Consensus Document of the Society of Cardiovascular Computed Tomography. JACC Cardiovasc Imaging. 2019;12:1-24.
29. Francone M, Budde RPJ, Bremerich J, et al. CT and MR imaging prior to transcatheter aortic valve implantation:standardisation of scanning protocols, measurements and reporting —a consensus document by the European Society of Cardiovascular Radiology (ESCR). Eur Radiol. 2020;30:2627-2650.
30. Hahn RT, Kodali S, Tuzcu EM, et al. Echocardiographic imaging of procedural complications during balloon-expandable transcatheter aortic valve replacement. JACC Cardiovasc Imaging. 2015;8:288-318.
31. Ribeiro HB, Webb JG, Makkar RR, et al. Predictive factors, management, and clinical outcomes of coronary obstruction following transcatheter aortic valve implantation:insights from a large multicenter registry. J Am Coll Cardiol. 2013;62:1552-1562.
32. Kim WK, Toggweiler S, Renker M, et al. Comparison of 3-Cusp Coplanar and 2-Cusp Overlap Views for the Implantation of a Self-Expanding Transcatheter Heart Valve. JACC Cardiovasc Interv. 2023;16:1422-1424.
33. Toggweiler S, Gurvitch R, Leipsic J, et al. Percutaneous aortic valve replacement:vascular outcomes with a fully percutaneous procedure. J Am Coll Cardiol. 2012;59:113-118.
34. Jilaihawi H, Chen M, Webb J, et al. A Bicuspid Aortic Valve Imaging Classification for the TAVR Era. JACC Cardiovasc Imaging. 2016;9:1145-1158.
35. Michelena HI, Della Corte A, Evangelista A, et al. International consensus statement on nomenclature and classification of the congenital bicuspid aortic valve and its aortopathy, for clinical, surgical, interventional and research purposes. Eur J Cardiothorac Surg. 2021;60:448-476.
36. Petronio AS, Angelillis M, De Backer O, et al. Bicuspid aortic valve sizing for transcatheter aortic valve implantation:Development and validation of an algorithm based on multi-slice computed tomography. J Cardiovasc Comput Tomogr. 2020;14:452-461.
37. Iannopollo G, Romano V, Buzzatti N, et al. Supra-annular sizing of transcatheter aortic valve prostheses in raphe-type bicuspid aortic valve disease:the LIRA method. Int J Cardiol. 2020;317:144-151.
38. Weir-McCall JR, Attinger-Toller A, Blanke P, et al. Annular versus supra-annular sizing for transcatheter aortic valve replacement in bicuspid aortic valve disease. J Cardiovasc Comput Tomogr. 2020;14:407-413.
39. Tang GHL, Komatsu I, Tzemach L, et al. Risk of coronary obstruction and the need to perform BASILICA:the VIVID classification. EuroIntervention. 2020;16:E757-E759.
40. Tarantini G, Sathananthan J, Fabris T, et al. Transcatheter Aortic Valve Replacement in Failed Transcatheter Bioprosthetic Valves. JACC Cardiovasc Interv. 2022;15:1777-1793.
41. Jilaihawi H, Asch FM, Manasse E, et al. Systematic CT Methodology for the Evaluation of Subclinical Leaflet Thrombosis. JACC Cardiovasc Imaging. 2017;10:461-470.
42. Eng MH, Wang DD, Greenbaum AB, et al. Prospective, randomized comparison of 3-dimensional computed tomography guidance versus TEE data for left atrial appendage occlusion (PRO3DLAAO). Catheter Cardiovasc Interv. 2018;92:401-407.
43. Korsholm K, Berti S, Iriart X, et al. Expert Recommendations on Cardiac Computed Tomography for Planning Transcatheter Left Atrial Appendage Occlusion. JACC Cardiovasc Interv. 2020;13:277-292.
44. Cepas-Guillén P, Flores-Umanzor E, Leduc N, et al. Impact of Device Implant Depth After Left Atrial Appendage Occlusion. JACC Cardiovasc Interv. 2023;16:2139-2149.
45. Halkin A, Cohen C, Rosso R, et al. Left atrial appendage and pulmonary artery anatomic relationship by cardiac-gated computed tomography:Implications for late pulmonary artery perforation by left atrial appendage closure devices. Heart Rhythm. 2016;13:2064-2069.
46. De Backer O, Iriart X, Kefer J, et al. Impact of Computational Modeling on Transcatheter Left Atrial Appendage Closure Efficiency and Outcomes. JACC Cardiovasc Interv. 2023;16:655-666.
47. Agudelo V, Millán X, Li CH, et al. Prevalence, mechanisms and impact of residual patency and device-related thrombosis following left atrial appendage occlusion:a computed tomography analysis. EuroIntervention. 2021;17:E944-E952.
48. Saw J, Fahmy P, DeJong P, et al. Cardiac CT angiography for device surveillance after endovascular left atrial appendage closure. Eur Heart J Cardiovasc Imaging. 2015;16:1198-1206.
49. Pulerwitz TC, Khalique OK, Leb J, et al. Optimizing Cardiac CT Protocols for Comprehensive Acquisition Prior to Percutaneous MV and TV Repair/Replacement. JACC Cardiovasc Imaging. 2020;13:836-850.
50. Babaliaros VC, Lederman RJ, Gleason PT, et al. The Art of SAPIEN 3 Transcatheter Mitral Valve Replacement in Valve-in-Ring and Valve-in-Mitral-Annular-Calcification Procedures. JACC Cardiovasc Interv. 2021;14:2195-2214.
51. Guerrero M, Wang DD, Pursnani A, et al. A Cardiac Computed Tomography-Based Score to Categorize Mitral Annular Calcification Severity and Predict Valve Embolization. JACC Cardiovasc Imaging. 2020;13:1945-1957.
52. Yoon SH, Bleiziffer S, Latib A, et al. Predictors of Left Ventricular Outflow Tract Obstruction After Transcatheter Mitral Valve Replacement. JACC Cardiovasc Interv. 2019;12:182-193.
53. Barreiro-Perez M, Caneiro-Queija B, Puga L, et al. Imaging in Transcatheter Mitral Valve Replacement:State-of-Art Review. J Clin Med. 2021;10:5973.
54. Hell MM, Emrich T, Kreidel F, et al. Computed tomography imaging needs for novel transcatheter tricuspid valve repair and replacement therapies. Eur Heart J Cardiovasc Imaging. 2021;22:601-610.
55. Lopes BBC, Hashimoto G, Bapat VN, Sorajja P, Scherer MD, Cavalcante JL. Cardiac Computed Tomography and Magnetic Resonance Imaging of the Tricuspid Valve:Preprocedural Planning and Postprocedural Follow-up. Interv Cardiol Clin. 2022;11:27-40.
56. Barreiro-Pérez M, González-Ferreiro R, Caneiro-Queija B, et al. Transcatheter Tricuspid Valve Replacement:Illustrative Case Reports and Review of State-of-Art. J Clin Med. 2023;12:1371.
57. Koo HJ, Lee JY, Kim GH, et al. Paravalvular leakage in patients with prosthetic heart valves:cardiac computed tomography findings and clinical features. Eur Heart J Cardiovasc Imaging. 2018;19:1419-1427.
58. Entrikin DW, Gupta P, Kon ND, Carr JJ. Imaging of infective endocarditis with cardiac CT angiography. J Cardiovasc Comput Tomogr. 2012;6:399-405.
59. Lesser JR, Han BK, Newell M, Schwartz RS, Pedersen W, Sorajja P. Use of cardiac CT angiography to assist in the diagnosis and treatment of aortic prosthetic paravalvular leak:a practical guide. J Cardiovasc Comput Tomogr. 2015;9:159-164.
60. Morris MF, Pena A, Kalya A, et al. Predicting paravalvular leak after transcatheter mitral valve replacement using commercially available software modeling. J Cardiovasc Comput Tomogr. 2020;14:495-499.
61. Siripornpitak S, Goo HW. CT and MRI for Repaired Complex Adult Congenital Heart Diseases. Korean J Radiol. 2021;22:308-323.
62. Arzamendi D, Li CH, Serra A. Cardiac Computed Tomography-guided Closure of Ventricular Septal Defect Secondary to Myocardial Infarction. Rev Esp Cardiol. 2015;68:626.
63. Hussain MA, Nabi F. Complex Structural Interventions:The Role of Computed Tomography, Fluoroscopy, and Fusion Imaging. Methodist Debakey Cardiovasc J. 2017;13:98-105.
64. Barreiro-Perez M, Cruz-Gonzalez I, Moreno-Samos JC, Barahona MF, Sanchez PL. Cardiovascular Structural Interventions —Echo/Computed Tomography-Fluoroscopy Fusion Imaging Atlas. Circ J. 2018;82:2206-2207.
* Autor para correspondencia.
Correo electrónico: (M. Barreiro-Pérez).
@manuelbarreirop; @icruzgonzalez; @RodrigoEstvez1; @CHPedroLi; @che_parada; @lvaroRodriperez; @b_caneiro