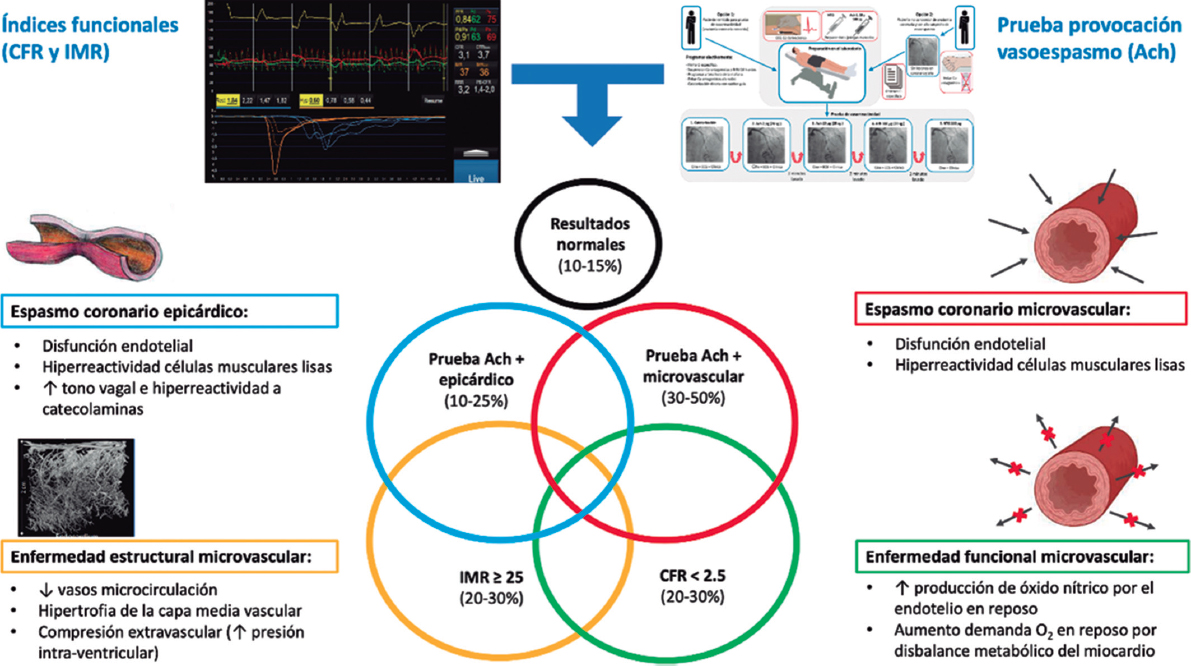
La llegada de los stents farmacoactivos (SFA) hace casi 2 décadas supuso una revolución para la cardiología intervencionista. El añadido de un fármaco antiproliferativo a la plataforma redujo de forma drástica la tasa de reestenosis, y ha aumentado el número de pacientes que desde entonces se han beneficiado de la revascularización percutánea1,2. Sin embargo, su talón de Aquiles fue el incremento de las trombosis tardías. El polímero permanente utilizado en los primeros SFA inducía reacciones inflamatorias y de hipersensibilidad, que retrasaban la endotelización. Esto provocó una alerta sanitaria3 que obligó a la comunidad médica a recomendar la prolongación del régimen de doble antiagregación, y se puso en duda la idoneidad de los SFA. Más allá del incremento de la tasa de trombosis, la primera generación de estos stents presentaba limitaciones adicionales: se trataba de plataformas de acero inoxidable con un grosor de strut de hasta 140 µm, con peor navegabilidad y menos capacidad de cruce. Además, su máxima expansión era limitada (3,5 mm en el stent Cypher, Cordis Corp.), lo que en ocasiones impedía tratar lesiones del tronco coronario izquierdo. Con el tiempo se ha ido refinando la tecnología del stent y se han optimizado sus 3 componentes principales: la plataforma, el polímero y el fármaco antiproliferativo.
Los cambios en la plataforma han ido orientados al desarrollo de aleaciones más biocompatibles, que han permitido reducir de forma marcada el grosor de los struts y por tanto mejorar su navegabilidad, conservando la fuerza radial necesaria para el tratamiento de la lesión (tabla 1). La mayoría de los stents más representativos han optado por aleaciones de cromo-cobalto o cromo-platino. El diseño de celda abierta se ha impuesto sobre el de celda cerrada, ya que disminuye el número de links inter-strut, reduce el grado de enjaulamiento de la rama lateral y mejora su navegabilidad y su conformabilidad. Además, la nueva generación de SFA tiene unos límites de expansión mayores (4,5-6 mm), lo que permite el abordaje de lesiones del tronco coronario, adaptando el stent a las dos referencias del vaso sin dañar la plataforma.
Tabla 1. Características de los stents farmacoactivos
| Stent | Plataforma | Polímero/cubrimiento | Fármaco | Grosor del strut (µm) | Expansión máxima (mm) | Estudios con DAP 1 mes |
|---|---|---|---|---|---|---|
| XIENCE | Cromo-cobalto | Permanente/circunferencial | Everolimus | 81 | 2-3,25 !92; 3,75 3,5-4 !92; 5,5 | Xience 28 USA (NCT03815175) |
| SYNERGY | Cromo-platino | Bioabsorbible/abluminal | Everolimus | 74 | 2,25 !92; 3,5 3-3,5 !92; 4,25 4-5 !92; 5,75 | SENIOR (NCT02099617) |
| Onyx | Cromo-níquel-platino | Permanente/circunferencial | Zotarolimus | 81 | 2,5-3 !92; 3,75 3,5-4 !92; 4,75 4,5-5 !92; 5,75 | Onyx ONE (NCT03344653) |
| Orsiro | Cromo-cobalto | Bioabsorbible/ circunferencial | Sirolimus | 60 | 2,5-3 !92; 3,5 3,5-4 !92; 4,5 | Bioflow-DAPT (NCT04137510) |
| Ultimaster Tansei | Cromo-cobalto | Bioabsorbible/abluminal | Sirolimus | 80 | 2,25-3 !92; 4,5 3,5-4 !92; 5,5 | Master DAPT (NCT03023020) |
| BioFreedom | Acero inoxidable | Sin polímero/abluminal | Umirolimus | 112 | 2.5-3 !92; 4,76 3,5-4 !92; 5,96 | LEADERS FREE (NCT01623180) |
| Angiolite | Cromo-cobalto | Permanente/circunferencial | Sirolimus | 75-85 | 2-2,5 !92; 4 2,75-3,5 !92; 5,25 4-4,5 !92; 6 | – |
DAP: doble antiagregación plaquetaria. | ||||||
En cuanto a los polímeros, actúan como reservorio desde el cual se libera el fármaco de manera controlada a la pared arterial. Los stents XIENCE (Abbott) y Resolute Onyx (Medtronic) han optado por mantener los polímeros permanentes, pero con una biocompatibilidad mejorada. El polímero del XIENCE es altamente fluorado, lo que reduce la adhesión y la activación plaquetarias, aumentando el perfil de seguridad. El stent Onyx usa el Biolinx, que consiste en una mezcla de polímeros con cualidades hidrófilas que le hacen biocompatible e hidrófobas que permiten una liberación prolongada y uniforme del fármaco. No obstante, a pesar de los buenos resultados de los nuevos polímeros permanentes, hay compañías que han apostado por polímeros bioabsorbibles (stents SYNERGY [Boston Scientific], Orsiro [Biotronik], Ultimaster Tansei [Terumo], etc.). El empleo de recubrimiento polimérico bioabsorbible permite que se degrade después de la liberación completa del fármaco, dejando solo un stent metálico a los 3-4 me- ses del implante, con lo que se evita que el polímero remanente participe en la respuesta inmunitaria asociada a la trombosis. El stent con polímero biodegradable SYNERGY reportó una tasa de trombosis del 0% a los 6 meses de seguimiento, con una tasa de revascularización de la lesión diana similar a la mostrada por el stent con polímero permanente Promus Element (Boston Scientific)4, mientras que con el stent Orsiro con polímero biodegradable se ha observado una reducción significativa de la tasa de fracaso de la lesión diana en comparación con el stent XIENCE con polímero permanente5. Sin embargo, el grupo con stent XIENCE presentaba una mayor longitud y un mayor número de stents, factores ambos asociados a eventos adversos en el seguimiento.
Como alternativa al polímero biodegradable están los stents sin polímero, de los cuales el más representativo es el BioFreedom (Biosensors). Se trata de una plataforma de acero inoxidable con microporos en los que se almacena el biolimus, liberando el fármaco en 1 mes. Al prescindir del polímero es posible acortar los tiempos de doble antiagregación, que se equiparan a los necesarios con los stents convencionales. En el estudio LEADERS FREE6, el BioFreedom se comparó frente a un stent convencional en pacientes con alto riesgo de hemorragia y un régimen de doble antiagregación de 1 mes. Los resultados mostraron que fue superior en cuanto a los criterios de valoración primarios de seguridad y eficacia. Posteriormente, casi todas las compañías han realizado o puesto en marcha estudios de seguridad y eficacia con 1 mes de doble antiagregación (tabla 1).
Muchos son, por tanto, los avances logrados con la nueva generación de stents. El impacto clínico que pueda tener la reducción del strut, o la selección de un stent con polímero bioabsorbible frente a uno permanente o sin polímero, está por dilucidar, pero lo cierto es que estas mejoras han tenido repercusión en la navegabilidad, la capacidad de expansión y el tiempo de doble antiagregación. Sin embargo, estas cualidades del stent que demandamos los cardiólogos intervencionistas deben estar sustentadas sobre una base robusta de estudios que confirmen su eficacia y seguridad. Y en esta fase se encuentra el stent Angiolite (iVascular), que se ha incorporado recientemente al arsenal de SFA. Se trata de una plataforma de cromo-cobalto con strut ultrafino (75-85 µm), fluoropolímero bioestable y sirolimus como fármaco antiproliferativo. En el estudio ANCHOR mostró un excelente grado de endotelización en la evaluación por tomografía de coherencia óptica7, con una cobertura endotelial del 83% de los struts a los 3 meses. Posteriormente, en el estudio ANGIOLITE se comparó con el referente de los SFA y se observó una pérdida luminal tardía de 0,04 mm, frente a los 0,08 mm del stent XIENCE, así como una baja tasa de eventos a los 2 años de seguimiento en ambos grupos8 (fallo de la lesión diana: 7,1% con Angiolite y 7,6% con XIENCE). En un artículo publicado en REC Interventional Cardiology, Pérez de Prado et al.9 han presentado un registro multicéntrico del stent Angiolite en la vida real, lo que viene a ser «la prueba del algodón» de este stent. Cabe recordar que el stent Absorb (Abbott) tuvo unos excelentes resultados inmediatos y a 5 años10 en los estudios iniciales, y sin embargo se demostró una alta tasa de trombosis cuando se utilizó en pacientes de la vida real. En el registro ANCHOR se incluyen 646 pacientes con un seguimiento clínico de 2 años. El 30% de los pacientes eran diabéticos, la presentación clínica en casi un 25% de ellos fue un infarto de miocardio con elevación del ST y cerca del 50% tenían enfermedad multivaso. A los 2 años, la tasa de fracaso del vaso diana fue del 3,4% y la tasa de trombosis total fue del 0,9%. En este sentido, el stent ofrece resultados equiparables a los obtenidos con stents de última generación, como muestra la tabla del material adicional del mencionado artículo9. No obstante, es necesario que estos prometedores resultados se confirmen a los 5 años de seguimiento. Además, será preciso evaluar el comportamiento del stent en lesiones complejas, como bifurcaciones u oclusiones crónicas que se asocian a peores resultados clínicos y que tienen una representación residual en el registro.
FINANCIACIÓN
Los autores no han recibido financiación alguna para la preparación del presente artículo.
CONFLICTO DE INTERESES
J. Suárez de Lezo ha recibido honorarios de Terumo por labores de consultoría, y de Abbott y AstraZeneca por presentaciones en cursos de formación. P. Martín ha recibido honorarios de Cathmedical por labores de consultoría, y de Abbott y Boston Scientific por presentaciones en cursos de formación.
BIBLIOGRAFÍA
1. Moses JW, Leon MB, Popma JJ, et al.; SIRIUS Investigators. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med. 2003;349:1315-1323.
2. Stone GW, Ellis SG, Cox DA, et al.; TAXUS-IV Investigators. A polymer-based, paclitaxel-eluting stent in patients with coronary artery disease. N Engl J Med. 2004;350:221-231.
3. Camenzind E, Steg PG, Wijns W. Stent thrombosis late after implantation of first-generation drug-eluting stents: a cause for concern. Circulation. 2007;115:1440-1455.
4. Meredith IT, Verheye S, Dubois CL, et al. Primary endpoint results of the EVOLVE trial: a randomized evaluation of a novel bioabsorbable polymer-coated, everolimus-eluting coronary stent. J Am Coll Cardiol. 2012:59:1362-1370.
5. Kandzari DE, Mauri L, Koolen JJ, et al. Ultrathin, bioresorbable polymer sirolimus-eluting stents versus thin, durable polymer everolimus-eluting stents in patients undergoing coronary revascularisation (BIOFLOW V): a randomised trial. Lancet. 2017;390:1843-1852.
6. Urban P, Meredith IT, Abizaid A, et al. Polymer-free drug-coated coronary stents in patients at high bleeding risk. N Engl J Med. 2015;373:2038-2047.
7. Puri R, Otaegui I, Sabate M, et al. Three- and 6-month optical coherence tomographic surveillance following percutaneous coronary intervention with the Angiolite(R) drug-eluting stent: The ANCHOR study. Catheter Cardiovasc Interv. 2018;91:435-443.
8. Moreu J, Moreno-Gomez R, Perez de Prado A, et al. First-in-man randomised comparison of the Angiolite durable fluoroacrylate polymer-based sirolimus-eluting stent versus a durable fluoropolymer-based everolimus-eluting stent in patients with coronary artery disease: the ANGIOLITE trial. EuroIntervention. 2019;15:e1081-e1089.
9. Pérez de Prado A, Ocaranza-Sánchez R, Lozano Ruiz-Poveda F, et al. Real-world registry of the durable Angiolite fluoroacrylate polymer-based sirolimus-eluting stent: the EPIC02–RANGO study. REC Interv Cardiol. 2021. https://doi.org/10.24875/RECICE.M21000223.
10. Onuma Y, Dudek D, Thuesen L, et al. Five-Year Clinical and Functional Multislice Computed Tomography Angiographic Results After Coronary Implantation of the Fully Resorbable Polymeric Everolimus-Eluting Scaffold in Patients With De Novo Coronary Artery Disease: The ABSORB Cohort A Trial. JACC Cardiovasc Interv. 2013;6:999-1009.
* Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Reina Sofía, Menéndez Pidal s/n, 14004 Córdoba, España.
Correo electrónico: jslht@yahoo.es (J. Suárez de Lezo).