RESUMEN
Un número importante de aquellos pacientes en quienes se realiza coronariografía por angina o isquemia presentan en pruebas no invasivas arterias coronarias sin lesiones o con estenosis no significativas. Muchos de estos pacientes tienen isquemia miocárdica de causa no obstructiva (INOCA/ANOCA), una condición con importancia pronóstica que afecta de manera considerable la calidad de vida. La ausencia de un diagnóstico que haga posible un tratamiento médico efectivo acarrea la repetición de pruebas diagnósticas y un mayor uso de recursos sociosanitarios. Es necesaria una estrategia diagnóstica adecuada para poder realizar un tratamiento personalizado, que mejore los síntomas y la calidad de vida. En este documento de la SEC-Asociación de Cardiología Clínica, SEC-Asociación de Cardiología Intervencionista, SEC-Asociación de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares, y SEC-Asociación de Imagen Cardiaca, se establecen unos algoritmos sencillos y prácticos con el objetivo de facilitar el diagnóstico precoz y el tratamiento más adecuado de los pacientes con ANOCA.
Palabras clave: ANOCA. INOCA. Disfunción microvascular. Angina vasoespástica.
ABSTRACT
A substantial number of patients undergoing coronary angiography for angina or ischemia in noninvasive tests have coronary arteries without lesions or with nonsignificant stenosis. Many of these patients have nonobstructive myocardial ischemia (INOCA/ANOCA), which is an entity with prognostic importance that significantly affects patients’ quality of life. The absence of a proper diagnosis leads to inappropriate medical treatment, repeat diagnostic tests, and greater use of social and health resources. An adequate diagnostic strategy is required for individualized treatment that improves symptoms and quality of life. In this document from the SEC-Clinical Cardiology Association, SEC-Interventional Cardiology Association, SEC-Ischemic Heart Disease and Acute Cardiac Care Association, and SEC-Cardiovascular Imaging Association of the Spanish Society of Cardiology, we provide simple and practical algorithms, with the aim of facilitating the early diagnosis and most appropriate treatment for patients with ANOCA.
Keywords: ANOCA. INOCA. Microvascular dysfunction. Vasospastic angina.
Abreviaturas ANOCA: angina con arterias coronarias sin lesiones obstructivas (angina with no obstructive coronary arteries). IMR: índice de resistencias de la microcirculación. INOCA: isquemia con arterias coronarias sin lesiones obstructivas (ischemia with no obstructive coronary artery disease). PET: tomografía por emisión de positrones (positron emission tomography). RFC: reserva de flujo coronario. SEC: Sociedad Española de Cardiología.
INTRODUCCIÓN
La angina de pecho afecta a más de 100 millones de personas en todo el mundo1-5. Se estima que en España, de acuerdo con el estudio OFRECE, la prevalencia de angina es del 2,6%, lo que implica que hay más de 270.000 personas con esta afección4. De los pacientes estables remitidos a coronariografía, ya sea por angina o por test positivo de detección de isquemia, un número significativo no tienen enfermedad obstructiva de las arterias coronarias1. Muchos de estos pacientes presentan angina (ANOCA, angina with no obstructive coronary arteries) o isquemia (INOCA, ischemia with non-obstructive coronary artery disease) de causa no obstructiva. Estas representan dos aspectos de la misma enfermedad, por lo que las recomendaciones del documento son extensibles a ambas.
Es más frecuente en las mujeres (50-70%) que en los varones (30-50%), si bien la prevalencia real se desconoce1-5. En estos pacientes, la angina o la isquemia se produce por una disfunción vascular coronaria, causada por trastornos vasomotores del vaso epicárdico o de las arteriolas, o por disfunción coronaria microvascular6-8.
Cabe destacar que, en la actualidad, se encuentra masivamente infradiagnosticada y, por ende, con miles de pacientes que sufren sus consecuencias sin un tratamiento que podría ser efectivo. Las causas de esta falta de diagnóstico y de tratamiento son varias. En primer lugar está la inercia asociada al paradigma que ha dominado durante décadas la aproximación diagnóstica de los pacientes con angina, centrado en identificar estenosis coronarias y no trastornos vasomotores o microcirculatorios coronarios. Además, de manera bastante generalizada, se ha considerado al paciente con angina sin estenosis coronarias como un paciente de bajo riesgo y con una escasa respuesta al tratamiento antianginoso convencional9. En segundo lugar, y en parte relacionado con lo anterior, está el hecho de que muchas técnicas no invasivas se basan en la identificación de isquemia regional característica de las estenosis coronarias (déficits de contractilidad o captación de un isótopo durante el esfuerzo o estrés), por lo que presentan unas bajas sensibilidad y especificidad para detectar la isquemia de origen no obstructivo. En tercer lugar, la mayor parte de los cardiólogos no han tenido acceso a técnicas invasivas que proporcionan evidencia objetiva de disfunción vascular en sus pacientes. Dichas técnicas intracoronarias se han considerado una parcela del cardiólogo intervencionista que, en la mayoría de los casos, no desempeña un papel clave en el tratamiento y el seguimiento del paciente con INOCA. Estas barreras impiden que la valiosa información proporcionada por las técnicas invasivas no sea utilizada en el abordaje clínico de estos pacientes. Finalmente, los pacientes con ANOCA/INOCA a menudo presentan patologías y afecciones extracardiológicas que requieren un enfoque multidisciplinario y dificultan el seguimiento por cardiólogos especialistas.
En el año 2019, las guías de la Sociedad Europea de Cardiología para el diagnóstico y el tratamiento del paciente con síndrome coronario crónico supusieron un importante avance en el reconocimiento de la angina de origen microvascular y del valor de las técnicas diagnósticas específicas. Así, en la aproximación diagnóstica de los pacientes con sospecha de angina coronaria microvascular, las guías señalan que se debe considerar la medición de la reserva de flujo coronario (RFC) y de la resistencia microcirculatoria mediante una guía de presión en pacientes con síntomas persistentes, pero con coronarias angiográficamente normales o con estenosis moderadas y reserva fraccional de flujo normal (recomendación IIaB). Incluso el resto de las recomendaciones, como la administración intracoronaria de acetilcolina durante la coronariografía o el empleo de Doppler transtorácico de la descendente anterior, la resonancia magnética cardiaca (cardio-RM) o la tomografía por emisión de positrones (PET) para la evaluación no invasiva de la RFC, tienen un nivel de recomendación menor (IIbB). En los pacientes con sospecha de angina vasoespástica, las guías señalan que se debe considerar la realización de pruebas de provocación intracoronarias para la identificación del espasmo coronario (recomendación IIaB)10.
Sin embargo, en los últimos años se han realizado numerosos estudios dirigidos al paciente con ANOCA que evalúan la eficacia de nuevas pruebas diagnósticas invasivas para su diagnóstico específico, y también ensayos aleatorizados que valoran la mejora sintomática cuando se realiza un tratamiento personalizado. Estos estudios apuntan de forma consistente a que el abordaje personalizado y multidisciplinario de estos pacientes ayuda a la mejora de los síntomas, reduce las visitas médicas, disminuye el número de tratamientos administrados y reduce el coste económico generado por este síndrome11-13.
OBJETIVOS DEL DOCUMENTO
Promovido por la Asociación de Cardiología Clínica, la Asociación de Cardiología Intervencionista, la Asociación de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares y la Asociación de Imagen Cardiaca de la Sociedad Española de Cardiología (SEC), pretende:
- Revisar las distintas causas del síndrome ANOCA y los métodos actuales para realizar su diagnóstico y su tratamiento personalizado.
- Proponer un algoritmo de diagnóstico y de tratamiento para el abordaje de estos pacientes acorde con las guías de práctica clínica para el síndrome coronario crónico de la Sociedad Europea de Cardiología y con las evidencias más recientes.
- Estimular a los distintos agentes gestores de salud a crear circuitos multidisciplinarios para el diagnóstico, el tratamiento y el seguimiento dirigido de estos pacientes.
La elaboración de este documento se ha basado en la interpretación de las últimas evidencias científicas, pero con un enfoque eminentemente práctico, para que las recomendaciones puedan aplicarse de una manera efectiva en nuestro medio. Cada asociación de la SEC aportó las evidencias científicas y su visión del área correspondiente, para luego, mediante consenso, elaborar un único documento con recomendaciones prácticas. La elección de los miembros para elaborar el documento la realizaron los presidentes de las asociaciones implicadas, escogiéndolos en función de su experiencia clínica y sus conocimientos sobre la materia.
IMPORTANCIA DE LA ANOCA EN LA PRÁCTICA CLÍNICA
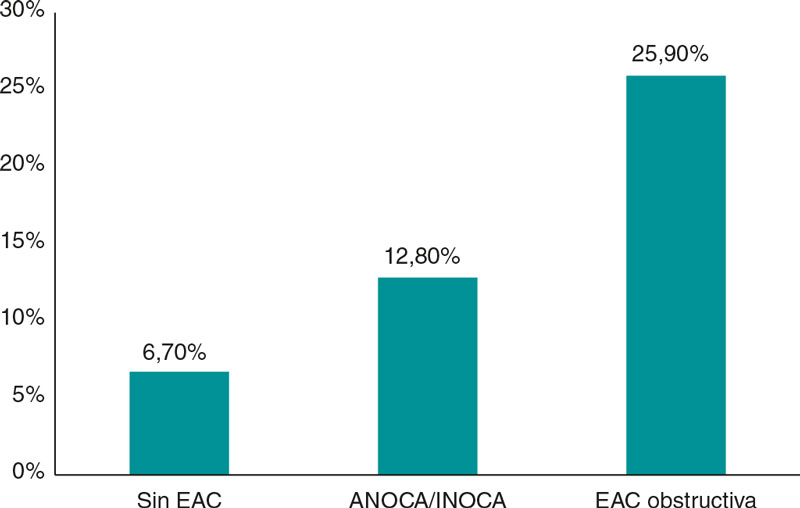
Si bien desde hace décadas se admite que los pacientes con angina sin lesiones coronarias podrían corresponder a una condición nosológica propia (inicialmente denominada síndrome X), en la práctica clínica se les ha prestado poca atención debido sobre todo a la extendida noción de que tienen un buen pronóstico14. No obstante, numerosos estudios en los que el diagnóstico se realizó, a diferencia del síndrome X, basándose en evidencia objetiva de disfunción vascular coronaria, mostraron de forma consistente que la isquemia de origen no obstructivo tiene una importante repercusión pronóstica. El riesgo de eventos coronarios adversos en estos pacientes viene determinado en gran medida por factores como la carga de placa, la demostración de isquemia miocárdica, la disfunción microvascular y la presencia de vasoespasmo o de disfunción endotelial coronaria. Así, en un estudio realizado en 917 mujeres con signos o síntomas de isquemia miocárdica, la variable combinada de infarto de miocardio o muerte de causa cardiovascular ocurrió en el 6,5% de las mujeres sin enfermedad arterial coronaria, en el 12,8% de las que tenían ateromatosis no obstructiva y en el 25,9% de aquellas con enfermedad arterial coronaria obstructiva, tras 10 años de seguimiento (figura 1)15. En un metanálisis de 54 estudios, con 35.039 pacientes, se confirmó el aumento del riesgo de infarto de miocardio no mortal y de muerte, con una incidencia, tras 5 años de seguimiento, de 0,98/100 personas-año en los pacientes con ANOCA, siendo mayor el riesgo en los sujetos con isquemia probada (frente a aquellos sin isquemia), así como en los pacientes con enfermedad arterial coronaria no obstructiva (frente a aquellos con coronarias normales)16.
Figura 1. Riesgo de infarto de miocardio o de muerte de causa cardiovascular tras 10 años de seguimiento en una cohorte de mujeres15. EAC: enfermedad arterial coronaria; ANOCA/INOCA: angina/isquemia con arterias coronarias no obstructivas.
En la misma línea, aun en presencia de unas arterias coronarias angiográficamente normales, la disfunción microvascular determinada por una RFC disminuida ha demostrado ser un potente determinante del riesgo de muerte y de infarto en estos pacientes17. Asimismo, en estos sujetos también se han descrito un aumento de otras complicaciones cardiovasculares, incluyendo ictus e insuficiencia cardiaca18, y una mayor prevalencia de enfermedad cerebral de pequeño vaso19. En conclusión, los pacientes con disfunción microvascular coronaria, identificada por una RFC alterada, tienen un mayor riesgo de eventos cardiovasculares mayores20.
La prueba de acetilcolina coronaria también permite estratificar el riesgo coronario. La respuesta anormal a la acetilcolina intracoronaria es indicativa de trastornos vasomotores causados por disfunción endotelial o por hiperreactividad de las células musculares lisas. Además de causar angina vasoespástica, los trastornos vasomotores coronarios condicionan un mayor riesgo de eventos cardiovasculares a largo plazo en los pacientes con angina, en especial cuando se asocian a aumentos de la microcirculación coronaria13,21. Incluso respuestas vasoconstrictoras moderadas a la acetilcolina pueden predecir un peor pronóstico en este contexto20.
Además, los pacientes con ANOCA suelen tener síntomas persistentes, en parte debido a que no se alcanza un diagnóstico precoz adecuado y, por lo tanto, se retrasa el tratamiento, lo que se asocia con un aumento innecesario de pruebas diagnósticas dirigidas a descartar una enfermedad arterial coronaria obstructiva, visitas a urgencias, ingresos hospitalarios, ansiedad, empeoramiento de la calidad de vida, bajas laborales y costes sanitarios directos e indirectos16,22,23.
Realizar un diagnóstico de INOCA es importante para formular tratamientos efectivos para el control de la sintomatología anginosa. El estudio CorMicA (Coronary Microvascular Angina) incluyó 151 pacientes con ANOCA en los que se realizaron cateterismo y estudio funcional invasivo (determinación del RFC, del índice de resistencia microcirculatoria y de la reserva fraccional de flujo) seguido de test de vasorreactividad con acetilcolina11. Los pacientes se aleatorizaron para revelar el endotipo concreto y guiar el tratamiento en concordancia con los resultados (grupo intervención) frente al tratamiento estándar que se aplicaría sin conocer los resultados de la prueba (grupo control). El tratamiento dirigido se adaptó de acuerdo con los endotipos documentados en el estudio invasivo (angina vasoespástica: cese del tabaco, antagonistas de los canales de calcio, nitratos de larga duración y cambios en el estilo de vida; angina microvascular: bloqueadores beta, cambios en el estilo de vida, considerar inhibidores de la enzima convertidora de angiotensina y estatinas; dolor torácico no cardiaco: suspender el tratamiento antianginoso) y se asoció de manera significativa con una mejoría de la angina a los 6 meses (medida con el Seattle Angina Questionnaire), de la calidad de vida, de la percepción de enfermedad y de la satisfacción con el tratamiento, si bien no hubo diferencias en el riesgo de eventos adversos cardiacos mayores. En el grupo de intervención se prescribieron más fármacos antianginosos (87,8 frente a 48,7%; p < 0,001). Aunque los resultados son muy interesantes, no hay que olvidar que se trata de un único estudio y con un número limitado de pacientes.
ENDOTIPOS DEL PACIENTE CON ANOCA
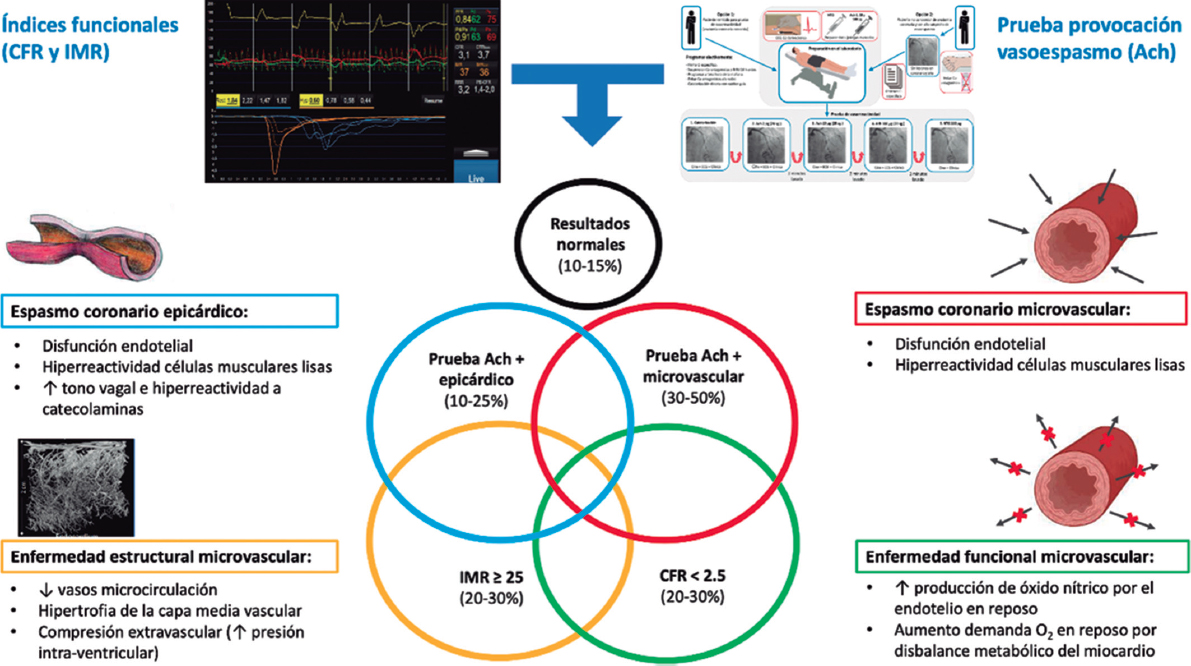
Las causas específicas de ANOCA aún no están por completo descritas y probablemente sean multifactoriales en la inmensa mayoría de los pacientes. En la figura 2 se resumen las causas específicas descubiertas hasta el momento y los mecanismos fisiopatológicos involucrados en su génesis. Cabe destacar que las técnicas de diagnóstico específico muchas veces no permiten diferenciar entre los distintos mecanismos fisiopatológicos, y además en muchos pacientes estos mecanismos se superponen. Actualmente se describen 4 mecanismos fisiopatológicos causantes de ANOCA:
Figura 2. Posibles resultados del estudio funcional invasivo en un paciente con ANOCA. Causas específicas descubiertas hasta el momento con los mecanismos fisiopatológicos involucrados en su génesis. Ach: acetilcolina; ANOCA: angina con arterias coronarias sin lesiones obstructivas; IMR: índice de resistencias de la microcirculación; RFC: reserva de flujo coronario. (Figura de elaboración propia basada en Meeder et al.1, Jansen et al.3, Kunadian et al.7, Kunadian et al.34 y Hokimoto et al.35.)
- Disfunción microvascular por una alteración estructural de la microcirculación. En pacientes con miocardiopatía hipertensiva se ha encontrado una escasa densidad de microvasos en comparación con pacientes sin miocardiopatía24. También se ha descrito un remodelado de la microcirculación coronaria consistente en hipertrofia e induración de la capa media arteriolar en pacientes con hipertensión y la suma de otros factores de riesgo cardiovascular, infiltración vascular por amiloide en la amiloidosis cardiaca y reducción del calibre luminal por compresión extrínseca en casos de hipertrofia del ventrículo o de aumento de la presión intraventricular izquierda3,7,25. Estos cambios provocan una disminución en la conductancia microcirculatoria que se manifiesta con un aumento de las resistencias microvasculares (índice de resistencias de la microcirculación [IMR, index of microcirculatory resistance] ≥ 25). Los valores elevados de IMR se relacionan con mayor edad y con hipertrofia del ventrículo izquierdo, sin una clara diferencia entre sexos26,27.
- Enfermedad funcional microvascular. Especialmente aquellas mujeres con escasos factores de riesgo y sin cardiopatía estructural objetivable presentan un flujo coronario en reposo aumentado que se traduce en una RFC baja28. A pesar de que el flujo coronario está habitualmente preservado en hiperemia máxima, muchos de estos pacientes presentan una baja capacidad de esfuerzo. En estos casos se plantea un desbalance en la disponibilidad de oxígeno (por un aumento de la demanda) con participación del endotelio como mecanismo principal de su génesis (por un incremento de la síntesis de óxido nítrico)29. Además, en estos pacientes se ha asociado un mayor número de alteraciones isquémicas en otros órganos, como el riñón, la retina y el sistema nervioso central, por lo que es probable que se trate de una afectación sistémica30.
- Disfunción microvascular por espasmo de la microcirculación. La disfunción microvascular por vasoespasmo es más frecuente en las mujeres que presentan factores de riesgo cardiovascular, y posiblemente la disfunción endotelial desempeñe un papel fundamental. Esta ocurre con más frecuencia en las arteriolas grandes y medianas, y se traduce en una vasoconstricción paradójica en respuesta al aumento de la demanda de oxígeno por el miocardio, lo cual se pone de manifiesto tras la administración intracoronaria de acetilcolina3,7,19,31.
- Espasmo epicárdico. Habitualmente el espasmo epicárdico no se relaciona con los factores de riesgo tradicionales, a excepción del tabaquismo. Se cree que existen 2 grandes mecanismos causantes de espasmo epicárdico: la disfunción endotelial y la hiperreactividad de las células musculares lisas. Estos mecanismos responden a los estímulos del sistema nervioso autónomo de forma contraria si son estímulos procedentes del sistema simpático (como ejercicio o una prueba de estimulación por frío) y de forma aumentada si son estímulos parasimpáticos (por ejemplo, con espasmos nocturnos)19,32.
CARACTERÍSTICAS CLÍNICAS DEL PACIENTE CON ANOCA
El primer paso para identificar al paciente con ANOCA es la sospecha diagnóstica. Los pacientes con angina microvascular suelen referir dolor torácico de tipo anginoso, en general con el esfuerzo, aunque a veces puede ser en reposo, más frecuente en las mujeres, y con respuesta limitada a los nitratos de acción corta. En ocasiones, en lugar de angina los sujetos pueden presentar un equivalente anginoso en forma de disnea de esfuerzo o sintomatología más atípica con predominio de náuseas, vómitos, mareo o fatiga. En el espasmo microvascular, que es más frecuente en el sexo femenino, se puede presentar angina inestable, con respuesta variable a los nitratos1,3.
En relación a la angina causada por trastornos coronarios vasomotores, es importante señalar que el espectro y las manifestaciones de estos son mucho más variados que el patrón de angina de Prinzmetal, que constituye un caso muy concreto de trastorno vasomotor causado por el espasmo oclusivo de un vaso epicárdico, pero que no es representativo de sustratos mucho más frecuentes, como el espasmo difuso no oclusivo y el espasmo arteriolar o microvascular. Por ejemplo, en los trastornos vasomotores causados por disregulación endotelial, la sintomatología dominante es la angina de esfuerzo, mientras que en cuadros vasomotores desencadenados por hiperreactividad de las células musculares lisas de los vasos coronarios (como es el caso de la angina de Prinzmetal) la angina suele presentarse como angina de reposo o inestable, sobre todo nocturna, aunque también puede asociarse a dolor torácico de esfuerzo, y puede iniciarse en respuesta a un estímulo concreto como el estrés, el frío o el aumento de factores humorales vasoconstrictores. También se puede asociar a otras patologías, como migraña o fenómeno de Raynaud. Es conocida la relación de algunos fármacos anticancerosos, como el 5-fluorouracilo y la capecitabina, entre otros, con la angina vasoespástica33. Asimismo, la primera manifestación clínica del vasoespasmo epicárdico puede ser un infarto de miocardio sin presencia de obstrucciones coronarias (MINOCA, Myocardial Infarction with No Obstructive Coronary Arteries)19. El hábito tabáquico se asocia con frecuencia a esta afección, a diferencia de otros factores de riesgo clásicos, como la hipertensión arterial, la diabetes mellitus y la dislipemia19,32.
ABORDAJE DIAGNÓSTICO NO INVASIVO DEL PACIENTE CON ANOCA
El abordaje diagnóstico del paciente con ANOCA se enmarca dentro del proceso diagnóstico del síndrome coronario crónico recomendado por las guías de práctica clínica, y en primer lugar es no invasivo10. No obstante, es importante destacar que se han analizado las evidencias científicas disponibles, que en ciertos aspectos son escasas, por lo que algunas de las afirmaciones se basan no solo en estudios clínicos sino también en el consenso de los autores del documento.
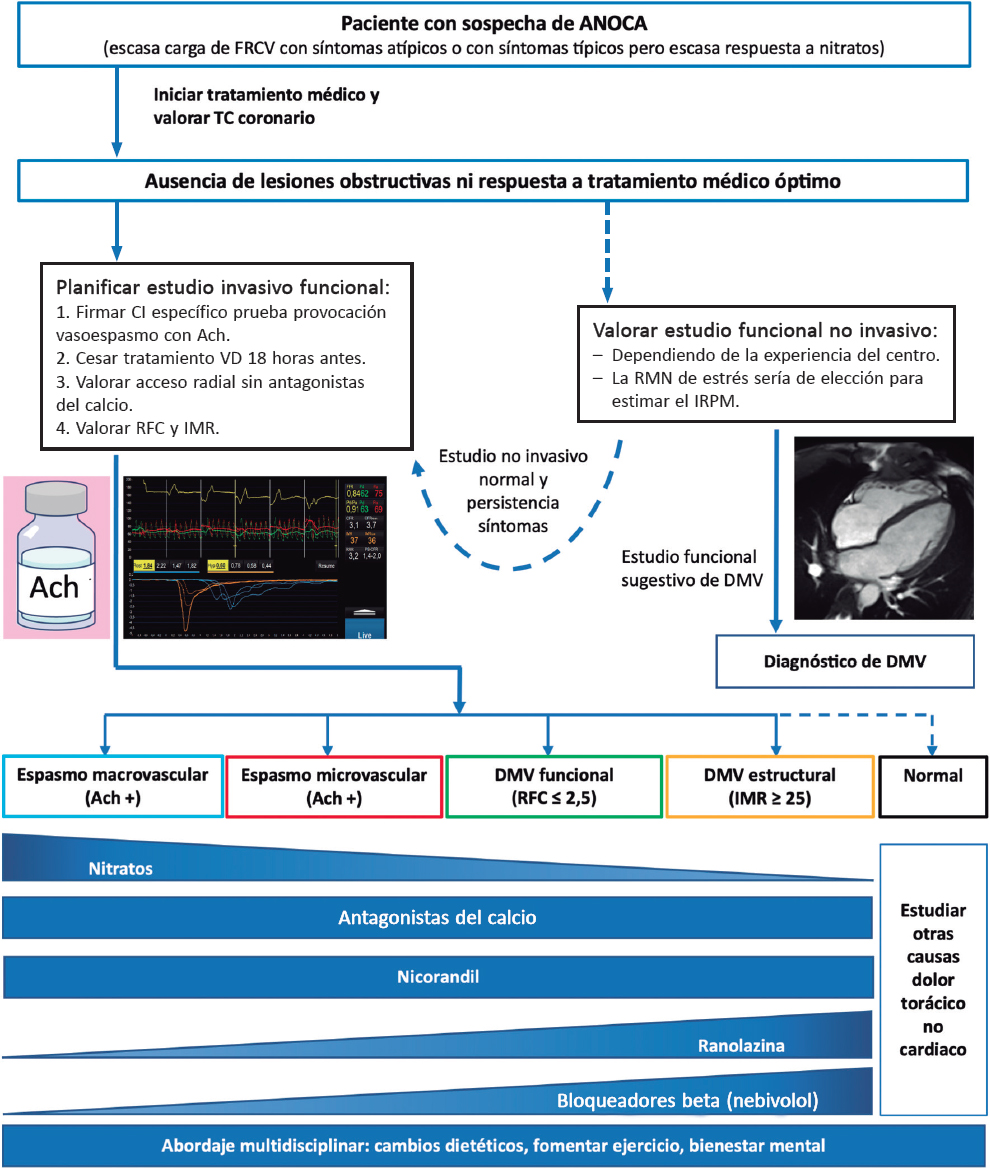
Tras la sospecha diagnóstica de angina, el paciente debe ser enviado a cardiología para realizar una evaluación básica de los síntomas, electrocardiograma, ecocardiograma, analítica general y respuesta clínica a un primer tratamiento antianginoso. Se recomienda una estrategia no invasiva en la mayoría de los pacientes con síntomas no limitantes y que presentan un valor pretest de riesgo de enfermedad obstructiva coronaria bajo o intermedio. Esta estrategia consiste en la realización de pruebas de imagen no invasivas, incluyendo estudios funcionales, que se basan en subrogados del flujo miocárdico y de la reserva de flujo coronaria o estudios anatómicos, principalmente tomografía computarizada coronaria3. La elección de las diferentes pruebas diagnósticas dependerá de la capacidad de realización de ejercicio por parte del paciente, la disponibilidad y la experiencia de cada centro, entre otros factores (figura 3)1,3,7,34,35.
Figura 3. Abordaje diagnóstico del paciente con sospecha de ANOCA o INOCA. Ach: acetilcolina; ANOCA: angina con arterias coronarias sin lesiones obstructivas; CI: consentimiento informado; DMV: disfunción microvascular; FRCV: factores de riesgo cardiovascular; IMR: índice de resistencias de la microcirculación; INOCA: isquemia con arterias coronarias sin lesiones obstructivas; IRPM: índice de reserva de perfusión miocárdica; RFC: reserva de flujo coronario; RM: resonancia magnética; TC: tomografía computarizada; VD: vasodilatador. (Figura de elaboración propia basada en Meeder et al.1, Perera et al.2, Jansen et al.3, Kunadian et al.7, Ang y Berry31, Kunadian et al.34 y Hokimoto et al.35.)
Cabe destacar que, en gran parte de los pacientes con ANOCA, las pruebas de imagen no invasivas para detección de isquemia tienen una baja sensibilidad para diagnosticar la mayoría de endotipos, en especial los asociados a trastornos coronarios vasomotores. En un registro de pacientes estudiados con pruebas de detección de isquemia no invasivas y con pruebas invasivas funcionales (consideradas como el método de referencia para su diagnóstico), solo un 50% de aquellos con una RFC baja presentaban alteración en las pruebas de imagen no invasivas36. De hecho, ningún estudio no invasivo de estrés puede detectar con fiabilidad el espasmo de la microvasculatura y la disfunción endotelial coronaria, y un test de estrés negativo no excluye disfunción coronaria vasomotora, en especial en pacientes sintomáticos7. Las causas de la baja sensibilidad de estas técnicas son diversas, pero cabe destacar que se basan en objetivar diferencias regionales entre segmentos miocárdicos (captación no uniforme de trazadores en la tomografía por emisión de fotón único, diferencias en la movilidad de un segmento miocárdico en la ecocardiografía de estrés). Dadas las características de la angina microvascular, en la que la isquemia puede ser generalizada, es difícil encontrar defectos regionales en las pruebas no invasivas. Además, los pacientes con vasoespasmo suelen presentar negatividad en las pruebas de esfuerzo basadas en la comparación entre reposo e hiperemia. Por lo tanto, es importante destacar que la sospecha de ANOCA debe estar presente siempre en pacientes con dolor torácico sugestivo y con tomografía computarizada coronaria normal o sin enfermedad coronaria obstructiva (< 50% de reducción del diámetro), y en pacientes con resultado negativo en pruebas de imagen no invasivas para la detección de isquemia. En la actualidad, ninguna técnica permite la visualización anatómica directa de la microcirculación coronaria in vivo en humanos, por lo que su evaluación recae en la medición de parámetros que reflejan el estado funcional, como el flujo de sangre miocárdico y la reserva del flujo miocárdico7.
Sin embargo, ciertos endotipos de ANOCA que presentan una RFC baja y una alta sospecha de angina microvascular pueden diagnosticarse de forma no invasiva, mediante varias técnicas de imagen, como PET, ecocardiograma transtorácico Doppler, ecocardiograma transtorácico con contraste y cardio-RM. La RFC se define como el incremento de flujo entre el estado de reposo y el de hiperemia máxima. Valores inferiores a una RFC entre 2 y 2,5 se consideran patológicos1.
La PET permite determinar el flujo sanguíneo miocárdico tanto en reposo como en hiperemia en términos absolutos, lo que permite calcular la RFC. Aunque esta es la técnica no invasiva considerada de referencia, y se correlaciona bien con el estudio invasivo (una RFC < 2 se asocia con un peor pronóstico independientemente de la gravedad de la enfermedad coronaria)37, su disponibilidad se encuentra muy limitada en nuestro medio3,38 debido a su alto coste y a la necesidad de utilizar radiotrazadores específicos que necesitan un ciclotrón cerca y que emiten radiación, como por ejemplo el agua marcada con oxígeno-15, el amoníaco marcado con nitrógeno-13 o el rubidio-82 análogo del potasio.
El ecocardiograma transtorácico Doppler permite determinar la velocidad de flujo sanguíneo basal y en hiperemia (tras la adminis- tración de adenosina) mediante la onda del Doppler pulsado. Una RFC < 2,5 se considera diagnóstica de disfunción microvascular. Sin embargo, requiere personal altamente entrenado y solo puede medirse en la arteria descendente anterior3,39. Por otra parte, el estudio mediante ecocardiograma transtorácico con contraste con uso de microburbujas permite estimar el flujo de perfusión miocárdica en función del grado de opacificación de este, y se ha demostrado una buena correlación con la PET, si bien puede existir una gran variabilidad interobservador y requiere mayor validación en estudios40.
Finalmente, con la cardio-RM se puede determinar la perfusión miocárdica mediante la utilización de agentes estresores y de contraste (gadolinio), con el fin de calcular el índice de reserva de perfusión miocárdica, que es un parámetro subrogado de la RFC. La disponibilidad de esta técnica es mayor que la de la PET y existe menor variabilidad interobservador que en los estudios con ecocardiograma, lo que la convierte en la prueba más adecuada para valorar la disfunción microvascular en nuestro medio; sin embargo, necesita ser validada en el resto de los endotipos de la ANOCA3,41. El estado de hiperemia o vasodilatación coronaria se puede conseguir mediante la perfusión con bomba de adenosina o la administración de un bolo único de regadenosón, y se compara de forma cuantitativa la perfusión en estrés frente al reposo. La capacidad diagnóstica de la cardio-RM de estrés en la disfunción microvascular se demostró hace ya dos décadas42; un índice de reserva de per- fusión miocárdica < 1,84 ha demostrado una sensibilidad del 73% y una especificidad del 74% para predecir alteraciones en el estudio invasivo de fisiología coronaria, con un área bajo la curva ROC (receiver operating characteristic) de 0,7841. Una valoración cuantitativa de los estudios de perfusión de estrés demostró una correlación aún mayor con el estudio invasivo en una serie de 65 pacientes (50 con angina estable, el 46% de ellos sin lesiones coronarias, y 15 voluntarios sanos) para discriminar entre enfermedad multivaso y disfunción microvascular, con un área bajo la curva de 0,94 (p < 0,001) para el valor de flujo miocárdico global en estrés < 1,82 ml/g/min43. En este estudio, el flujo miocárdico en estrés se correlacionó mejor con las medidas invasivas que la reserva de flujo miocárdico. Por otra parte, también se ha demostrado su capacidad pronóstica: en una serie de 218 pacientes con angina y coronarias sin lesiones epicárdicas44, un índice de reserva de perfusión miocárdica ≤ 1,47 se asoció con 3 veces más riesgo de eventos cardiovasculares mayores respecto a aquellos pacientes con un valor > 1,47 (hazard ratio = 3,14; intervalo de confianza del 95%, 1,58-6,25; p = 0,001). En otra serie de 395 pacientes, la reserva de perfusión miocárdica aumentó el valor pronóstico frente al modelo basal (edad, sexo y realce tardío) del objetivo primario, definido como muerte de causa cardiovascular, infarto no fatal, parada recuperada y revascularización tardía, tras 460 días de seguimiento. En este estudio, además, se confirmó que la valoración de la isquemia mediante perfusión cuantitativa (definida como más de un 10% de miocardio isquémico) fue mejor que la valoración cualitativa (definida como un defecto de perfusión en 2 o más segmentos)45. Rahman et al.46 también demostraron que las técnicas de cardio-RM de alta resolución que utilizan perfusión por completo cuantitativa tenían una buena precisión y eran mejores que la evaluación visual para detectar la disfunción microvascular.
Desafortunadamente, algunas de las pruebas que ayudarían en el diagnóstico funcional no invasivo de los pacientes con ANOCA/INOCA no están disponibles para uso clínico habitual en muchos centros de nuestro país, lo que limita la aproximación diagnóstica de estos pacientes.
La tabla 1 muestra los criterios diagnósticos de ANOCA, y en la figura 3 el algoritmo diagnóstico completo propuesto para los pacientes con ANOCA, especificando la estrategia inicial y cuándo planificar el estudio invasivo, así como las posibles terapias en función del endotipo específico.
Tabla 1. Criterios diagnósticos de ANOCA
| Endotipo | Fisiopatología | Criterios | Comentarios |
|---|---|---|---|
| Angina microvascular | Disfunción microvascular coronaria | Síntomas de isquemia miocárdica | • Angina de esfuerzo o reposo • Equivalente anginoso (disnea de esfuerzo) |
| Evidencia de isquemia miocárdica | • Prueba de detección de isquemia positiva | ||
| Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50% • Observado mediante TC de coronarias o coronariografía |
||
| Función microvascular coronaria alterada | • Test de adenosina: RFC ≤ 2,0 (2,5 según el método), IRM ≥ 25, RHM ≥ 1,9 • Espasmo microvascular (espontáneo o test de acetilcolina): angina, alteraciones ECG, sin espasmo epicárdico (reducción de la luz < 90%) |
||
| Angina vasoespástica | Espasmo epicárdico | Síntomas | • Angina, más en reposo, sobre todo nocturna • Tolerancia al esfuerzo disminuida, sobre todo por la mañana • Respuesta a nitratos y antagonistas del calcio |
| Cambios ECG | • Cambios (elevación/descenso) del segmento ST ≥ 1 mV • Nuevas ondas U negativas |
||
| Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50% • Observado mediante TC de coronarias o coronariografía |
||
| Espasmo coronario | • Vasoconstricción > 90% con angina y cambios ECG espontáneos o tras test de provocación (acetilcolina) | ||
| Función microvascular coronaria conservada | • Test de adenosina: RFC > 2,0 (2,5 según el método), IRM < 25, RHM < 1,9 | ||
| Mixto | Angina microvascular y espasmo epicárdico | Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50% • Observado mediante TC de coronarias o coronariografía |
| Angina microvascular | • Disfunción microvascular • Test de adenosina: RFC ≤ 2,0 (2,5 según el método), IRM ≥ 25, RHM ≥ 1,9 |
||
| Espasmo coronario | • Angina + cambios ECG + vasoconstricción epicárdica (> 90%) | ||
| Dolor torácico no cardiaco | Ninguna | Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50%, • Observado mediante TC de coronarias o coronariografía |
| Test funcionales normales | • Test de adenosina: RFC > 2,0 (2,5 según el método), IRM < 25, RHM < 1,9 • Test de acetilcolina negativo |
||
|
ANOCA: angina con arterias coronarias sin lesiones obstructivas; ECG: electrocardiograma; IRM: índice de resistencia microvascular; RFC: reserva de flujo coronario; RFF: reserva fraccional de flujo; RHM: resistencia a la velocidad hiperémica miocárdica; TC: tomografía computarizada. Tabla basada en los datos de Meeder et al.1, Perera et al.2, Jansen et al.3, Kunadian et al.7, Mejia-Renteria et al.19, Ong et al.25, Ang y Berry31, Kunadian et al.34 y Hokimoto et al.35. |
|||
ABORDAJE DIAGNÓSTICO INVASIVO DEL PACIENTE CON ANOCA
Con respecto a la valoración invasiva del paciente con sospecha de ANOCA, si bien se trata de procedimientos muy seguros, no están exentos de riesgo, por lo que es preciso que el personal posea una formación específica en la realización y la interpretación de las distintas pruebas, así como establecer los circuitos adecuados. Actualmente se recomienda un estudio funcional doble con una prueba de provocación de vasoespasmo con infusión intracoronaria de acetilcolina y una prueba de función microvascular median- te guía de presión-termistor en reposo y en hiperemia máxima farmacológica7,11,34,35.
Se recomienda realizar la prueba de provocación de vasoespasmo con acetilcolina intracoronaria. Debido a que la ficha técnica de la acetilcolina no contempla su uso intracoronario, antes de realizar la prueba es preciso contactar con el servicio de farmacia del centro para autorizarlo. En la mayoría de los casos, el paciente deberá consentir por escrito el uso del fármaco fuera de ficha técnica47. Esta prueba ha demostrado tener unas altas sensibilidad y especificidad (en torno al 90 y el 100%, respectivamente, dependiendo de las características de los pacientes) para el diagnóstico de angina vasoespástica (tanto micro- como macrovascular), con un número muy reducido de complicaciones47,48. Para su realización es importante evitar el uso de fármacos vasodilatadores de larga duración antes de la prueba. Se recomienda un mínimo de 18 horas sin agentes vasodilatadores orales o tópicos para evitar falsos negativos. A pesar de que el uso de bloqueadores beta puede incrementar la vasoconstricción tras la infusión de acetilcolina, no se recomienda interrumpirlos antes de la prueba si se considera necesario. Hay que valorar que en los procedimientos realizados por vía radial deberá evitarse el uso de antagonistas del calcio47. Básicamente, la prueba consiste en la infusión de dosis crecientes de acetilcolina y valorar de manera simultánea la reproducción de los síntomas que aqueja el paciente, los cambios en el electrocardiograma (en 12 derivaciones) y la presencia de un espasmo de las arterias epicárdicas > 90% del diámetro basal. En el año 2021, la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología publicó un documento técnico para su realización e interpretación47.
La valoración de la función microvascular puede realizarse con guía intracoronaria Doppler o con guía de presión-termistor. No obstante, a día de hoy, las únicas guías disponibles son las de presión-termistor (Pressurewire X, Abbott, Estados Unidos) que utilizan el método de termodilución. La termodilución coronaria permite obtener valores de flujo coronario en reposo y en hiperemia máxima tras la infusión de cualquier agente vasodilatador de la microcirculación (habitualmente adenosina o un derivado). Estos valores se obtienen con la infusión de 3 ml de solución salina fisiológica por el catéter guía y calculando el tiempo de tránsito de esta entre el segmento proximal de la arteria y el segmento distal, donde se emplaza el termistor distal de la guía tanto en reposo como en hiperemia máxima. Obteniendo los datos de flujo en reposo y en hiperemia máxima se calcula la RFC, que en condiciones normales debe ser > 2,5. Unos valores de RFC ≤ 2,5 se consideran diagnósticos de disfunción microvascular. Debido a que durante la realización de la prueba en hiperemia máxima se obtiene de manera simultánea la presión de perfusión de la microcirculación (presión que se mide en el segmento distal de la arteria donde se emplaza la guía), se puede calcular la resistencia mínima de la microcirculación (el IMR). En los estudios con pacientes sanos se ha establecido un punto de corte de 25. Los valores de IMR ≥ 25 también son considerados como disfunción microvascular7,34,35.
Cabe destacar también otro método prometedor en el campo del diagnóstico invasivo del paciente con ANOCA. Utilizando la misma guía de presión y un microcatéter dedicado (RayFlow, Hexacath, Francia), se pueden obtener el valor de flujo absoluto coronario (en ml/min) y las resistencias absolutas de la microcirculación (en unidades Wood)49. Al tratarse de valores absolutos, estos dependen en parte del territorio de perfusión de la arteria y del segmento estudiado. Actualmente se encuentra en investigación una aproximación indexada utilizando este método50.
ABORDAJE TERAPÉUTICO DEL PACIENTE CON ANOCA
Enfoque general
En el paciente con ANOCA el tratamiento debería enfocarse en el alivio de los síntomas y en mejorar el perfil de riesgo, la calidad de vida y el pronóstico. En este sentido, el diagnóstico precoz, la identificación de los mecanismos fisiopatológicos implicados y el inicio temprano del tratamiento ajustado al endotipo de INOCA son clave para lograr el éxito terapéutico1,3,7,25,31,34,35,51-54. Sin embargo, los estudios realizados con tratamiento médico específico para esta patología son de pequeño tamaño, con metodología heterogénea y resultados variables, por lo que es difícil establecer unas recomendaciones robustas en el abordaje terapéutico de estos pacientes.
Cambios en el estilo de vida y control de los factores de riesgo cardiovascular
En primer lugar, dado el impacto que tienen los factores de riesgo cardiovascular en el desarrollo de la disfunción microvascular coronaria y el espasmo epicárdico, es fundamental un control adecuado de ellos, tanto con cambios en el estilo de vida (reducción de peso, ejercicio físico, cese del hábito tabáquico, reducción del estrés) como con tratamientos farmacológicos adecuados10. Para disminuir el riesgo de vasoespasmo coronario es importante evitar factores desencadenantes, como el hábito tabáquico y el consumo de ciertas drogas (cocaína y anfetaminas)10.
Las estatinas no solo son beneficiosas por su efecto sobre el perfil lipídico, sino que también se ha observado que tienen un efecto positivo sobre la función endotelial y en la prevención del desarrollo de espasmos coronarios55,56. Los inhibidores del sistema renina-angiotensina son beneficiosos al disminuir la presión arterial y mejorar la función endotelial. De hecho, se han descrito efectos positivos con estos fármacos tanto en la disfunción microvascular coronaria como en el vasoespasmo epicárdico55-57. El papel del ácido acetilsalicílico en los pacientes sin enfermedad cardiovascular conocida es controvertido55,56. De hecho, en el documento de las sociedades japonesas no se recomienda en ausencia de estenosis angiográficas en los pacientes con vasoespasmo (indicación IIIB)35.
Tratamiento antianginoso
Es fundamental para disminuir los síntomas de los pacientes. En los que tienen un endotipo estructural de INOCA (disfunción microvascular) se recomienda preferentemente el empleo de fármacos que disminuyan el consumo de oxígeno miocárdico, como los bloqueadores beta o los antagonistas de los canales del calcio (también se podría plantear la ivabradina en ciertos casos), valorando asimismo el empleo de otros como la ranolazina, la trimetazidina y el nicorandil. En los pacientes con un endotipo vasomotor de INOCA (tanto si se trata de espasmo epicárdico como microvascular) se recomienda el uso de antagonistas de los canales del calcio, nitratos o nicorandil, o ambos (tabla 2)1,3,7,25,31,34,35,51-54.
Tabla 2. Abordaje terapéutico del paciente con ANOCA o INOCA
| Tratamiento general | |||
|---|---|---|---|
| Cambios en el estilo de vida | • Dieta mediterránea • Ejercicio físico • Control del peso • Reducción del estrés |
||
| Control de los factores de riesgo cardiovascular | • Hipertensión arterial • Dislipemia • Diabetes • Cese del hábito tabáquico |
||
| Ácido acetilsalicílico | • Si antecedentes de ECV • Si no antecedentes de ECV, su uso es controvertido |
||
| IECA o ARA II | • Reducción de la presión arterial • Mejoría de la función endotelial: posible beneficio en la disfunción microvascular coronaria y el vasoespasmo coronario |
||
| Estatinas | • Reducción del colesterol total y LDL • Mejoría de la función endotelial • Posible beneficio en la angina vasoespástica |
||
| Fármacos antianginosos | Angina microvascular | Bloqueadores beta | • Disminución del consumo de oxígeno miocárdico* |
| Antagonistas del calcio | • Disminución del consumo de oxígeno miocárdico • Relajación del músculo liso vascular |
||
| Ranolazina | • Mejoría de la reserva de perfusión microvascular | ||
| Trimetazidina | • Aumento de la tolerancia celular a la isquemia | ||
| Angina vasoespástica | Antagonistas del calcio | • Disminución del consumo de oxígeno miocárdico • Disminución del espasmo coronario, vía relajación del músculo liso vascular |
|
| Nitratos | • Disminución del consumo de oxígeno miocárdico • Disminución del espasmo coronario, vía relajación del músculo liso vascular |
||
| Nicorandil | • Efecto vasodilatador coronario | ||
| Angina microvascular + angina vasoespástica | Antagonistas del calcio, nitratos, ranolazina, trimetazidina, nicorandil | ||
|
* Valorar el uso de nebivolol por sus propiedades antioxidantes a través del óxido nítrico. ANOCA: angina con arterias coronarias sin lesiones obstructivas; ARA II: antagonistas de los receptores de la angiotensina II; ECV: enfermedad cardiovascular; IECA: inhibidores de la enzima convertidora de la angiotensina; INOCA: angina con arterias coronarias sin lesiones obstructivas; LDL: lipoproteínas de baja densidad. Tabla basada en los datos de Meeder et al.1, Jansen et al.3, Kunadian et al.7, Kobayashi et al.26, Ang y Berry31, Kunadian et al.34, Hokimoto et al.35, Beltrame et al.51, Mehta et al.52, Seitz et al.53 y Abouelnour et al.54. |
|||
Existen algunas evidencias con el nebivolol respecto a otros bloqueadores beta, debido a su potencial efecto vasodilatador por su acción sobre la producción de óxido nítrico58. También se ha sugerido un efecto beneficioso del carvedilol al mejorar la dilatación dependiente del endotelio59. Un estudio aleatorizado con 81 pacientes demostró un beneficio del tratamiento con ranolazina en el control de los síntomas en aquellos pacientes con una RFC < 2,560. El tratamiento con diltiazem no mostró beneficio en la reducción de los síntomas, la calidad de vida ni la función microvascular coronaria en el estudio aleatorizado EDIT-CMD con 73 pacientes con ANOCA tras 6 semanas de tratamiento, si bien sí se documentó una reducción en la inducción de vasoespasmo epicárdico12. Finalmente, existen prometedores posibles beneficios con fármacos que actúan sobre nuevas dianas terapéuticas, como el cilostazol, un inhibidor de la fosfodiesterasa 3 que actúa sobre el vasoespasmo coronario61, o el zibotentán, un antagonista selectivo de la endotelina A con beneficios sobre la microcirculación y la disfunción endotelial62, o el fasudilo, un inhibidor de la enzima rho-cinasa que ha demostrado disminuir el IMR en pacientes con test de provocación de vasoespasmo positivo e IMR elevado13.
Tratamiento para la angina resistente
En aquellos pacientes que continúan con angina se ha planteado el uso de fármacos como los antidepresivos tricíclicos a dosis bajas (modulan la captación de noradrenalina y los efectos anticolinérgicos, lo cual puede inducir la analgesia) o los neuroestimuladores que bloquean la transmisión del dolor a nivel de la médula espinal, e incluso la realización de intervencionismo coronario en caso de angina vasoespástica refractaria al tratamiento médico51.
Seguimiento de los pacientes
El seguimiento de estos pacientes se debería realizar de manera coordinada entre atención primaria y cardiología, y una vez controlados los síntomas se debería hacer de manera preferente en atención primaria, remitiendo a cardiología en caso de descompensación. Por otra parte, dadas las particularidades de la ANOCA, es fundamental explicar al paciente en qué consiste su enfermedad y las implicaciones que tiene, y es necesario un abordaje multidisciplinario puesto que en ocasiones se requiere la implicación de otros profesionales sanitarios, como psicólogos, internistas, clínica del dolor, etc.
Líneas futuras de investigación
Finalmente, existen ensayos clínicos en marcha que están explorando si el tratamiento intensivo de la aterosclerosis coronaria con estatinas de alta intensidad, inhibidores del sistema renina-angiotensina-aldosterona y dosis bajas de ácido acetilsalicílico mejora la angina y la isquemia. El ensayo WARRIOR (NCT03417388) está evaluando si dicho tratamiento se traduce en mejores resultados, mientras que el MINOCA-BAT (NCT03686696) investiga si una intervención con bloqueadores beta e inhibidores del sistema renina-angiotensina-aldosterona reduce los eventos clínicos cardiovasculares mayores.
CONCLUSIONES
Los pacientes con sospecha de ANOCA muestran una amplia diversidad, pero hoy en día pueden tener un diagnóstico y un tratamiento personalizado eficaz. Es importante que los cardiólogos clínicos conozcan las distintas patologías que puede presentar un paciente con ANOCA y las herramientas diagnósticas y terapéuticas disponibles. La realización de pruebas de diagnóstico invasivo es una nueva opción que requiere entrenamiento específico para su correcta realización e interpretación, al igual que la cardio-RM con adenosina o regadenosón para el cálculo de la perfusión miocárdica. En resumen, hay que realizar acciones concretas en todos los centros asistenciales para crear circuitos diagnósticos y terapéuticos específicos para el abordaje de estos pacientes.
FINANCIACIÓN
El presente trabajo no contó con financiación.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido en la concepción, la búsqueda bibliográfica, el desarrollo, la redacción, la lectura y la aprobación final del manuscrito. C. Escobar fue el coordinador del consenso.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado la inteligencia artificial para la realización del presente documento.
CONFLICTO DE INTERESES
J. Escaned, receptor del Proyecto para Intensificación de la Actividad Investigadora INT22/00088 del Instituto de Salud Carlos III, declara haber recibido honorarios como ponente en actividades educativas para Abbott y Philips. C. Escobar, J.M. Gámez y V. Barrios han recibido honorarios por ponencias de Menarini. El resto de los autores no tienen conflictos de intereses.
BIBLIOGRAFÍA
1. Meeder JG, Hartzema-Meijer MJ, Jansen TPJ, Konst RE, Damman P, Elias-Smale SE. Outpatient Management of Patients With Angina With No Obstructive Coronary Arteries:How to Come to a Proper Diagnosis and Therapy. Front Cardiovasc Med. 2021;8:716319.
2. Perera D, Berry C, Hoole SP, et al. Invasive coronary physiology in patients with angina and non-obstructive coronary artery disease:a consensus document from the coronary microvascular dysfunction workstream of the British Heart Foundation/National Institute for Health Research Partnership. Heart. 2022;109:88-95.
3. Jansen TPJ, Konst RE, Elias-Smale SE, et al. Assessing Microvascular Dysfunction in Angina With Unobstructed Coronary Arteries:JACC Review Topic of the Week. J Am Coll Cardiol. 2021;78:1471-1479.
4. Alonso JJ, Muñiz J, Gómez-Doblas JC, et al. Prevalencia de angina estable en España. Resultados del estudio OFRECE. Rev Esp Cardiol. 2015;68:691-699.
5. Douglas PS, Hoffmann U, Patel MR, et al. Outcomes of anatomical versus functional testing for coronary artery disease. N Engl J Med. 2015;372:1291-1300.
6. Rahman H, Ryan M, Lumley M, et al. Coronary microvascular dysfunction is associated with myocardial ischemia and abnormal coronary perfusion during exercise. Circulation. 2019;140:1805-1816.
7. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI expert consensus document on ischaemia with non-obstructive coronary arteries in collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology and Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. Eur Heart J. 2020;41:3504-3520.
8. Taqueti VR. Coronary microvascular dysfunction in vasospastic angina:provocative role for the microcirculation in macrovessel disease prognosis. J Am Coll Cardiol. 2019;74:2361-2364.
9. Luu JM, Wei J, Shufelt CL, et al. Clinical Practice Variations in the Management of Ischemia With No Obstructive Coronary Artery Disease. J Am Heart Assoc. 2022;11:e022573.
10. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
11. Ford TJ, Stanley B, Good R, et al. Stratified medical therapy using invasive coronary function testing in angina:the CorMicA trial. J Am Coll Cardiol. 2018;72(23 Pt A):2841-2855.
12. Jansen TPJ, Konst RE, de Vos A, et al. Efficacy of Diltiazem to Improve Coronary Vasomotor Dysfunction in ANOCA:The EDIT-CMD Randomized Clinical Trial. JACC Cardiovasc Imaging. 2022;15:1473-1484.
13. Suda A, Takahashi J, Hao K, et al. Coronary Functional Abnormalities in Patients With Angina and Nonobstructive Coronary Artery Disease. J Am Coll Cardiol. 2019;74:2350-2360.
14. Kaski JC, Collins P, Nihoyannopoulos P, Maseri A, Poole-Wilson PA, Rosano GM. Cardiac syndrome X:clinical characteristics and left ven-tricular function:long-term follow-up study. J Am Coll Cardiol. 1995;25:807-814.
15. Sharaf B, Wood T, Shaw L, et al. Adverse outcomes among women presenting with signs and symptoms of ischemia and no obstructive coronary artery disease:findings from the national heart, lung, and blood institute-sponsored women's ischemia syndrome evaluation (WISE) angiographic core laboratory. Am Heart J. 2013;166:134-141.
16. Radico F, Zimarino M, Fulgenzi F, et al. Determinants of long-term clinical outcomes in patients with angina but without obstructive coronary artery disease:a systematic review and meta-analysis. Eur Heart J. 2018;39:2135-2146.
17. Pepine CJ, Anderson RD, Sharaf BL, et al. Coronary microvascular reactivity to adenosine predicts adverse outcome in women evaluated for suspected ischemia:results from the National Heart, Lung and Blood Institute WISE (Women's Ischemia Syndrome Evaluation) study. J Am Coll Cardiol. 2010;55:2825-2832.
18. Patel S, Fung M, Liang Z, Butalia S, Anderson TJ. Temporal Trends of the Prevalence of Angina With No Obstructive Coronary Artery Disease (ANOCA). Can J Cardiol. 2023;39:63-70.
19. Mejia-Renteria H, Travieso A, Matías-Guiu JA, et al. Coronary microvascular dysfunction is associated with impaired cognitive function:the Cerebral-Coronary Connection study (C3 study). Eur Heart J. 2023;44:113-125.
20. Boerhout CKM, de Waard GA, Lee JM, et al. Prognostic value of structural and functional coronary microvascular dysfunction in patients with non-obstructive coronary artery disease;from the multicentre international ILIAS registry. EuroIntervention. 2022;18:719-728.
21. Grigorian-Shamagian L, Oteo JF, Gutiérrez-Barrios A, et al. Endothelial dysfunction in patients with angina and non-obstructed coronary arteries is associated with an increased risk of mayor cardiovascular events. Results of the Spanish ENDOCOR registry. Int J Cardiol. 2023;370:18-25.
22. Jespersen L, Abildstrøm SZ, Hvelplund A, Prescott E. Persistent angina:highly prevalent and associated with long-term anxiety, depression, low physical functioning, and quality of life in stable angina pectoris. Clin Res Cardiol. 2013;102:571-581.
23. Schumann CL, Mathew RC, Dean JL, et al. Functional and Economic Impact of INOCA and Influence of Coronary Microvascular Dysfunction. JACC Cardiovasc Imaging. 2021;14:1369-1379.
24. Nadruz W. Myocardial remodeling in hypertension. J Hum Hypertens. 2015;29:1-6.
25. Ong P, Camici PG, Beltrame JF, et al.;Coronary Vasomotion Disorders International Study Group (COVADIS). International standardization of diagnostic criteria for microvascular angina. Int J Cardiol. 2018;250:16-20.
26. Kobayashi Y, Fearon WF, Honda Y, et al. Effect of Sex Differences on Invasive Measures of Coronary Microvascular Dysfunction in Patients With Angina in the Absence of Obstructive Coronary Artery Disease. JACC Cardiovasc Interv. 2015;8:1433-1441.
27. Chung JH, Lee KE, Lee JM, et al. Effect of Sex Difference of Coronary Microvascular Dysfunction on Long-Term Outcomes in Deferred Lesions. JACC Cardiovasc Interv. 2020;13:1669-1679.
28. Nardone M, McCarthy M, Ardern CI, et al. Concurrently Low Coronary Flow Reserve and Low Index of Microvascular Resistance Are Associated With Elevated Resting Coronary Flow in Patients With Chest Pain and Nonobstructive Coronary Arteries. Circ Cardiovasc Interv. 2022;15:e011323.
29. Rahman H, Demir OM, Khan F, et al. Physiological Stratification of Patients With Angina Due to Coronary Microvascular Dysfunction. J Am Coll Cardiol. 2020;75:2538-2549.
30. Beltrame JF, Crea F, Kaski JC, et al. International standardization of diagnostic criteria for vasospastic angina. Eur Heart J. 2017;38:2565-2568.
31. Ang DTY, Berry C. What an Interventionalist Needs to Know About INOCA. Interv Cardiol. 2021;16:e32.
32. Lanza GA, Careri G, Crea F. Mechanisms of coronary artery spasm. Circulation. 2011;124:1774-1782.
33. Matsumoto T, Saito Y, Saito K, et al. Relation Between Cancer and Vasospastic Angina. Adv Ther. 2021;38:4344-4353.
34. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology &Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. EuroIntervention. 2021;16:1049-1069.
35. Hokimoto S, Kaikita K, Yasuda S, et al. JCS/CVIT/JCC 2023 Guideline Focused Update on Diagnosis and Treatment of Vasospastic Angina (Coronary Spastic Angina) and Coronary Microvascular Dysfunction. Circ J. 2023;87:879-936.
36. Lee SH, Shin D, Lee JM, et al. Clinical Relevance of Ischemia with Nonobstructive Coronary Arteries According to Coronary Microvascular Dysfunction. J Am Heart Assoc. 2022;11:e025171.
37. Ziadi MC, Dekemp RA, Williams KA, et al. Impaired myocardial flow reserve on rubidium-82 positron emission tomography imaging predicts adverse outcomes in patients assessed for myocardial ischemia. J Am Coll Cardiol. 2011;58;740-748.
38. Driessen RS, Raijmakers PG, Stuijfzand WJ, Knaapen P. Myocardial perfusion imaging with PET. Int J Cardiovasc Imaging. 2017;33:1021-1031.
39. Michelsen MM, Mygind ND, Pena A, et al. Transthoracic Doppler echocardiography compared with positron emission tomography for assessment of coronary microvascular dysfunction:the iPOWER study. Int J Cardiol. 2017;228:435-443.
40. Vogel R, Indermühle A, Reinhardt J, et al. The quantification of absolute myocardial perfusion in humans by contrast echocardiography:algorithm and validation. J Am Coll Cardiol. 2005;45:754-762.
41. Thomson LE, Wei J, Agarwal M, et al. Cardiac magnetic resonance myocardial perfusion reserve index is reduced in women with coronary microvascular dysfunction. A National Heart, Lung, and Blood Institute–sponsored study from the Women's Ischemia Syndrome Evaluation. Circ Cardiovasc Imaging. 2015;8:e002481.
42. Panting JR, Gatehouse PD, Yang GZ, et al. Abnormal subendocardial perfusion in cardiac syndrome X detected by cardiovascular magnetic resonance imaging. N Engl J Med. 2002;346:1948-1953.
43. Kotecha T, Martinez-Naharro A, Boldrini M, et al. Automated Pixel-Wise Quantitative Myocardial Perfusion Mapping by CMR to Detect Obstructive Coronary Artery Disease and Coronary Microvascular Dysfunction:Validation Against Invasive Coronary Physiology. JACC Cardiovasc Imaging. 2019;12:1958-1969.
44. Zhou W, Lee JCY, Leung ST, et al. Long-Term Prognosis of Patients With Coronary Microvascular Disease Using Stress Perfusion Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2021;14:602-611.
45. Sammut EC, Villa ADM, Di Giovine G, et al. Prognostic Value of Quantitative Stress Perfusion Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2018;11:686-694.
46. Rahman H, Scannell CM, Demir OM, et al. High-Resolution Cardiac Magnetic Resonance Imaging Techniques for the Identification of Coronary Microvascular Dysfunction. JACC Cardiovasc Imaging. 2021;14:978-986.
47. Gutiérrez E, Gómez-Lara J, Escaned J, et al. Assessment of the endothelial function and spasm provocation test performed by intracoronary infusion of acetylcholine. Technical report from the ACI-SEC. REC Interv Cardiol. 2021;3:286-296.
48. Montone RA, Rinaldi R, Del Buono MG, et al. Safety and prognostic relevance of acetylcholine testing in patients with stable myocardial ischaemia or myocardial infarction and non-obstructive coronary arteries. EuroIntervention. 2022;18:e666-e676.
49. Rivero F, Gutiérrez-Barrios A, Gomez-Lara J, et al. Coronary microvascular dysfunction assessed by continuous intracoronary thermodilution:A comparative study with index of microvascular resistance. Int J Cardiol. 2021;333:1-7.
50. de Vos A, Jansen TPJ, van't Veer M, et al. Microvascular Resistance Reserve to Assess Microvascular Dysfunction in ANOCA Patients. JACC Cardiovasc Interv. 2023;16:470-481.
51. Beltrame JF, Tavella R, Jones D, Zeitz C. Management of ischaemia with non-obstructive coronary arteries (INOCA). BMJ. 2021;375:e060602.
52. Mehta PK, Huang J, Levit RD, Malas W, Waheed N, Bairey Merz CN. Ischemia and no obstructive coronary arteries (INOCA):A narrative review. Atherosclerosis. 2022;363:8-21.
53. Seitz A, Martínez Pereyra V, Sechtem U, Ong P. Update on coronary artery spasm 2022 –A narrative review. Int J Cardiol. 2022;359:1-6.
54. Abouelnour A, Gori T. Vasomotor Dysfunction in Patients with Ischemia and Non-Obstructive Coronary Artery Disease:Current Diagnostic and Therapeutic Strategies. Biomedicines. 2021;9:1774.
55. Ong P, Athanasiadis A, Sechtem U. Treatment of Angina Pectoris Associated with Coronary Microvascular Dysfunction. Cardiovasc Drugs Ther. 2016;30:351-356.
56. Picard F, Sayah N, Spagnoli V, Adjedj J, Varenne O. Vasospastic angina:A literature review of current evidence. Arch Cardiovasc Dis. 2019;112:44-55.
57. Choi BG, Jeon SY, Rha SW, et al. Impact of Renin-Angiotensin System Inhibitors on Long-Term Clinical Outcomes of Patients With Coronary Artery Spasm. J Am Heart Assoc. 2016;5:e003217.
58. Erdamar H, Sen N, Tavil Y, et al. The effect of nebivolol treatment on oxidative stress and antioxidant status in patients with cardiac syndrome-X. Coron Artery Dis. 2009;20:238-244.
59. Matsuda Y, Akita H, Terashima M, et al. Carvedilol improves endothelium-dependent dilatation in patients with coronary artery disease. Am Heart J. 2000;140:753-759.
60. Rambarat CA, Elgendy IY, Handberg EM, et al. Late sodium channel blockade improves angina and myocardial perfusion in patients with severe coronary microvascular dysfunction:Women's Ischemia Syndrome Evaluation-Coronary Vascular Dysfunction ancillary study. Int J Cardiol. 2019;276:8-13.
61. Shin ES, Lee JH, Yoo SY, et al. A randomised, multicentre, double blind, placebo controlled trial to evaluate the efficacy and safety of cilostazol in patients with vasospastic angina. Heart. 2014;100:1531-1536.
62. Morrow AJ, Ford TJ, Mangion K, et al. Rationale and design of the Medical Research Council's Precision Medicine with Zibotentan in Microvascular Angina (PRIZE) trial. Am Heart J. 2020;229:70-80.
* Autor para correspondencia.
Correo electrónico: (C. Escobar).
@JEscaned; @AntoniCarolRuiz; @S_Raposeiras; @jmgamez3; @rfreixap; @Ana_Viana_T; @clinica_sec; @AgudosSEC