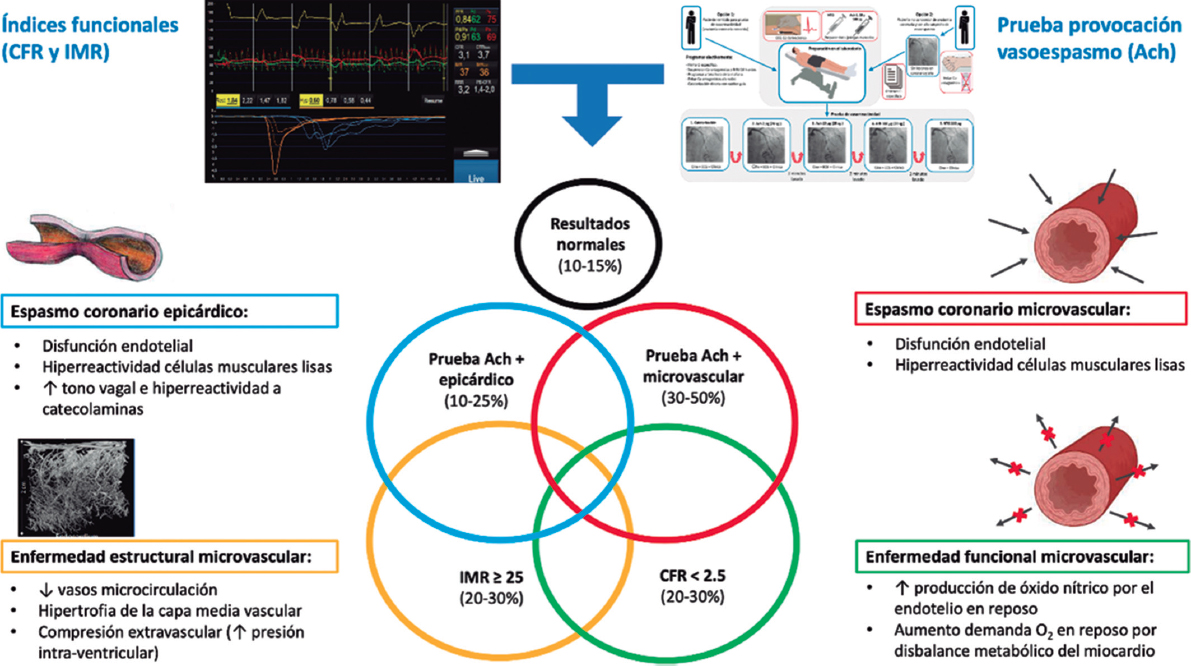
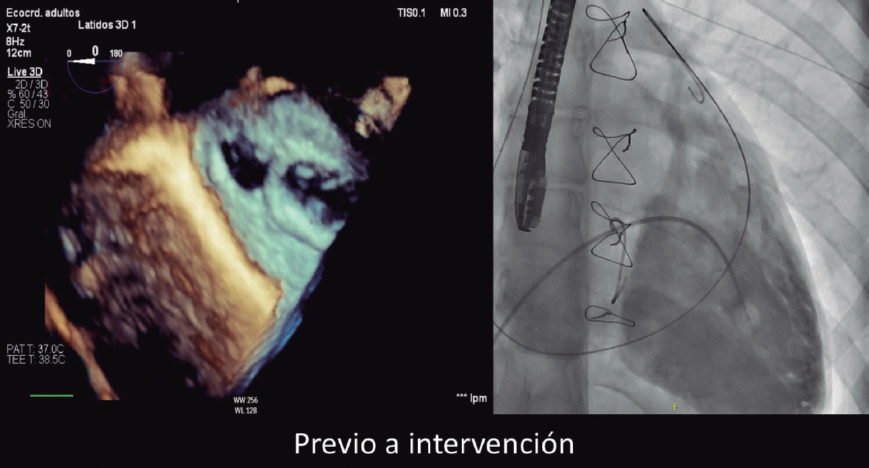
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI) es una intervención consolidada para el tratamiento de la estenosis aórtica sintomática grave. En un principio, esta intervención solo se empleaba en pacientes inoperables y de alto riesgo quirúrgico, pero ahora se usa de forma habitual inclusive en poblaciones de riesgo intermedio y bajo. Paralelamente y a nivel global, se tiene cada vez más experiencia en diferentes escenarios considerados off-label tales como válvulas bicúspides, valve-in-valve, así como en la insuficiencia aórtica no calcificada (IANC)1.
INSUFICIENCIA AÓRTICA
Las anomalías en los velos de la válvula aórtica, en sus estructuras de soporte (raíz y anillo aórticos), o en ambas, son las responsables de que la insuficiencia aórtica (IA) cause un reflujo diastólico de sangre desde la aorta hacia el ventrículo izquierdo (VI) que lo hipertrofia y dilata, lo cual a su vez, resulta en un mayor volumen sistólico. No obstante, con el paso del tiempo, esto provoca un deterioro de la función sistólica, ocasionando síntomas, lo que confiere un mal pronóstico2. Las actuales guías europeas y americanas recomiendan la intervención quirúrgica en presencia de IA significativa y sintomática, una fracción de eyección del VI reducida o dilatación grave del VI3-4. Aunque la IA moderada o grave afecta a alrededor del 2,2% de la población de 70 o más años, hasta el 30% de estos individuos se consideran inoperables debido a la edad avanzada o a la presencia de comorbilidades, razón por la cual las opciones percutáneas, incluidos los dispositivos dedicados y no dedicados, han ganado interés ante la falta de opciones quirúrgicas seguras5.
DESAFÍOS DEL TAVI EN LA IANC
En concreto, los desafíos a los que nos enfrentamos con los dispositivos percutáneos se deben a las características de los pacientes con IANC tales como una dimensión anular aórtica más grande, la dilatación de la raíz aórtica, una calcificación anular insuficiente para el anclaje y un mayor volumen sistólico con reflujo hacia el VI provocando un “efecto de succión”. Todos estos factores complican la selección, el posicionamiento y el implante adecuado del dispositivo, lo cual aumenta el riesgo de embolización o mala aposición de la prótesis valvular, haciendo necesario el implante de un segundo dispositivo. En última instancia, todos estos desafíos se asocian a una mayor la mortalidad siendo el más preocupante la embolización de la válvula. Para minimizar el riesgo de esta complicación en la medida de lo posible, suele sobredimensionarse la prótesis; sin embargo, el grado exacto de sobredimensionamiento de cada dispositivo todavía no se ha estandarizado. Además, el sobredimensionamiento se asocia a una alta tasa de trastornos del sistema de conducción y a un mayor riesgo de rotura anular.
DISPOSITIVOS Y EVIDENCIA
Existen 2 dispositivos dedicados para tratar la IANC: el sistema Trilogy (Jena-Valve Technology Inc, California, Estados Unidos) y el J-Valve (JC Medical Inc, California, Estados Unidos). La experiencia más reciente con estos dispositivos dedicados es la de Adam et al.6. y García et al.7. El sistema Trilogy se asoció con una tasa de mortalidad a los 30 días del 1,7% (frente al 3,7% del J-Valve) y ambos arrojaron una tasa de IA residual ≥ moderada del 0%. No obstante, el 7,4% precisó conversión a cirugía con el sistema J-Valve, lo cual obligó a hacer algunos cambios técnicos en la tecnología. Se debe mencionar que la tasa de implante de marcapasos con los 2 sistemas estuvo por encima del 10% (19,6 y 13%, respectivamente). Sin embargo, estas prometedoras tecnologías dedicadas se acompañan de ciertas limitaciones, siendo la principal, la falta de tamaños capaces de cubrir anillos grandes; de hecho, para un sobredimensionamiento del 10%, la proporción de pacientes con IA cuyas estructuras aórticas estaban por encima de las indicaciones recomendadas fue de hasta ~50%8.
El primer uso compasivo en humanos de la válvula SAPIEN (Edwards Lifesciences, California, Estados Unidos) se reportó en 20129, seguido de múltiples series de casos y registros que reportaron la viabilidad del TAVI en el tratamiento de la IANC con dispositivos no dedicados de nueva generación. El resumen más reciente de la experiencia se informó en un metanálisis realizado por Takagi et al.10 y un análisis conjunto realizado a los 30 días que arrojaron índices de éxito del dispositivo, mortalidad por cualquier causa, IA residual ≥ moderada e implante de marcapasos del 80,4, 9,5, 7,4 y 11,6%, respectivamente. Aunque estos hallazgos resultaron prometedores y mucho mejores que los obtenidos con dispositivos de primera generación en todos los aspectos, seguía habiendo un abismo importante para lograr resultados similares a los del TAVI en el tratamiento de la estenosis aórtica. De hecho, la tasa de embolización de la válvula fue alta (> 9% con todas las tecnologías, incluso con las dedicadas)10.
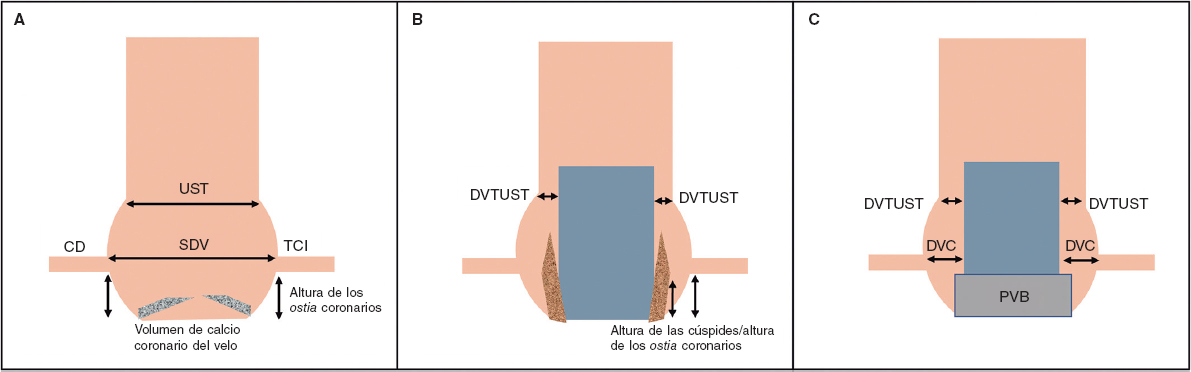
Más recientemente, la nueva válvula balón expandible Myval (Meril Lifesciences Ltd, Vapi, India) ha obtenido mejores resultados que los informados por Takagi et al., probablemente por la disponibilidad de tamaños extragrandes (30,5 y 32 mm), lo cual permite un mayor grado de sobredimensionamiento y la cobertura de anillos de hasta 100,5 mm de perímetro y 840 mm2 de área en su volumen nominal, aumentando, así, la proporción de pacientes inoperables que podrían recibir tratamiento percutáneo. Debido a la alta tasa de éxito de la intervención (94,7%) y la ausencia de complicaciones anatómicas graves (tales como rotura anular, disección aórtica u obstrucción coronaria), la válvula balón expandible Myval surge como un nueva y prometedora alternativa en el tratamiento de esta enfermedad hasta que contemos con dispositivos dedicados para estos tamaños anulares. No obstante, la embolización de la prótesis valvular se ha descrito en el 3,5% de los pacientes, lo cual sugiere que hay margen de mejora; según esta investigación, la interacción entre el anillo aórtico y el tracto de salida del ventrículo izquierdo (TSVI) podría ayudar a predecir el riesgo de embolización de la válvula, sugiriendo que en tamaños anulares límite, cuando no se puede lograr un sobredimensionamiento del 20% y se detecta una morfología adversa (con forma de cono), se debe evitar la intervención o realizarse bajo soporte circulatorio mecánico (figura 1)11.
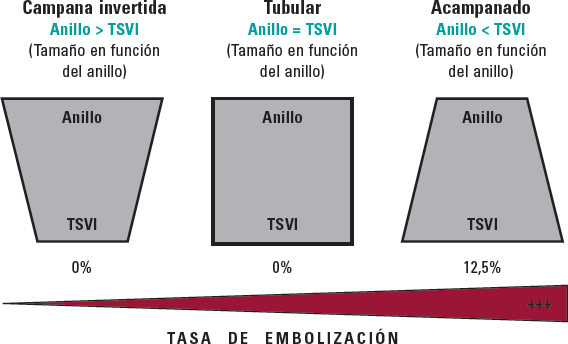
Figura 1. Predictor anatómico de embolización de la válvula durante implante percutáneo de válvula aórtica en el manejo de la insuficiencia aórtica no calcificada. TSVI: tracto de salida del ventrículo izquierdo.
Poletti et al.12 compararon recientemente dispositivos no dedicados de última generación y sugirieron que el dispositivo Myval es el que mejor resultado da frente a otros dispositivos. De hecho, el subanálisis aún no publicado que comparó las 2 plataformas balón expandibles sugiere que, a pesar de emplearse en pacientes con anillos aórticos muchos más pequeños, la SAPIEN-3 tenía una tasa de éxito más baja (72% frente a 90%) y una tasa más alta de migración/embolización de la prótesis (SAPIEN 17% frente a MyVal 5%)12. Se muestra un resumen del estudio PURE-AR11 con la válvula Myval en la figura 2. La evidencia actual sobre los diferentes dispositivos disponibles se resume en la tabla 1.
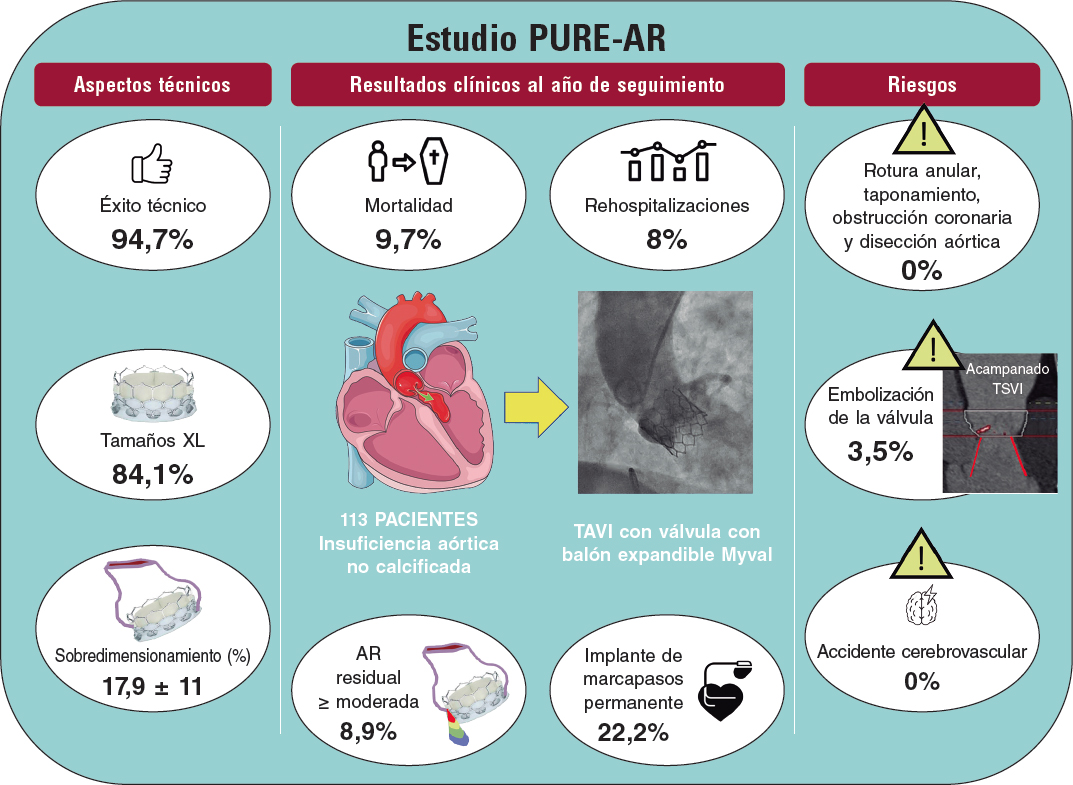
Figura 2. Principales resultados informados en el registro Myval para el tratamiento de insuficiencia aórtica no calcificada con anillos grandes. IA: insuficiencia aórtica; TAVI, implante percutáneo de válvula aórtica; TSVI: tracto de salida del ventrículo izquierdo.
Tabla 1. Comparativa de resultados entre los distintos registros internacionales
| Registro | Nº. de pacientes | Tipo de dispositivo | Éxito del dispositivo | Mortalidad por cualquier causa | Insuficiencia aórtica residual ≥ moderada | Tasa de implante de marcapasos permanente |
|---|---|---|---|---|---|---|
| Yoon et al.13 (2017) | 331 pacientes con IANC y VCQF | Dispositivos no dedicados | Total: 74,3% | Total: 10,9% | Total: 9,6% | Total: 18,2% |
| Dispositivos de primera generación (CoreValve, SAPIEN XT) | Dispositivos de primera generación: 61,3% | Dispositivos de primera generación: 13,4% | Dispositivos de primera generación: 18,8% | Dispositivos de primera generación: 17,5% | ||
| Dispositivos de nueva generación (Evolut R, JenaValve, Engager, Portico, ACURATE, Lotus, Direct Flow, SAPIEN 3) | Dispositivos de nueva generación: 81,1% | Dispositivos de nueva generación: 9,4% | Dispositivos de nueva generación: 4,2% | Dispositivos de nueva generación: 18,6% | ||
| De Backer et al.14 (2018) | 254 pacientes con IANC | Dispositivos no dedicados Dispositivos de primera generación (CoreValve, SAPIEN XT) | Dispositivos de primera generación: 47% | Dispositivos de primera generación: 17% | THV de primera generación: 36% | No informado |
| Dispositivos de nueva generación (Evolut R, JenaValve, Engager, Portico, ACURATE, Lotus, Direct Flow, SAPIEN 3) | Dispositivos de nueva generación: 82% | Dispositivos de nueva generación: 8% | THV de nueva generación: 5% | |||
| Sawaya et al.15 (2018) | 146 pacientes con IANC y VCQF | Dispositivos de primera generación (CoreValve SAPIEN XT) | IANC: 72% | IANC: 13% | IANC: 13% | IANC: 18% |
| Dispositivos de nueva generación (Evolut R, JenaValve, Lotus, Direct Flow, SAPIEN 3) | VCQF: 71% | VCQF: 6% | VCQF: 6% | VCQF: 5% | ||
| Dispositivos de primera generación: 54% | Dispositivos de primera generación: 22% | Dispositivos de primera generación: 27% | ||||
| Dispositivos de nueva generación: 85% | Dispositivos de nueva generación: 8% | Dispositivos de nueva generación: 3% | ||||
| Sánchez-Luna et al.11 2023 | 113 pacientes con IANC | Dispositivo no dedicado de nueva generación: Myval | 94,7% | 9,7% | 8,9% | 22,2% |
| Poletti et al.12 2023 | 201 pacientes con IANC | Dispositivos de nueva generación: VAE (Evolut R/Pro, ACURATE Neo/Neo2, Jena Valve, Navitor/Portico) | Total: 76,1% | Total: 5% | Total: 9,5% | Total: 22,3% |
| VAE (SAPIEN, Myval) | VAE: 75,8% | VAE: 5,3% | VAE: 9,2% | VAE: 22,6% | ||
| VBE (SAPIEN, Myval) | VBE: 76,8% | VBE: 4,4% | VBE: 10,1% | VBE: 21,8% | ||
| Adam et al.6 (2023) | 58 pacientes con IANC | Dispositivo dedicado: sistema Trilogy (JenaValve) | 98% | 1,7% | 0% | 19,6% |
| Garcia S et al.7 (2023) | 27 pacientes con IANC | Dispositivo dedicado: J-Valve | 81% | 3,7% | 0% | 13% |
IANC: insuficiencia aórtica no calcificada; THV: prótesis valvular cardiaca percutánea; VAE, válvula autoexpandible; VBE, válvula con balón expandible; VCQF, válvula cardiaca quirúrgica fallida. Medtronic (Estados Unidos): CoreValve, Engager y Evolut R. Edwards Lifesciences (Estados Unidos): SAPIEN XT, SAPIEN 3. Abbott Vascular (Estados Unidos): Navitor/Portico. Meril Life (India): Myval. Boston Scientific (Estados Unidos): ACURATE Neo/Neo2, Lotus. Trilogy (Alemania): JenaValve. Direct Flow Medical (Estados Unidos): Direct Flow. JC Medical (Estados Unidos): J-Valve. | ||||||
En conclusión, aunque el abordaje quirúrgico sigue siendo el tratamiento estándar de pacientes con IANC, los resultados de los dispositivos TAVI de nueva generación, tanto dedicados como no dedicados, han mejorado notablemente y de forma creciente. Las principales limitaciones son la falta de dispositivos dedicados de gran tamaño y el riesgo de embolización de la válvula con dispositivos no dedicados, aunque este riesgo se puede minimizar con tamaños extra-grandes y análisis morfológico del TSVI. La tasa de trastornos de la conducción es más alta que en el TAVI en el tratamiento de la estenosis aórtica. Disminuir esta tasa requie- re tecnologías y estrategias específicas dada su repercusión potencialmente negativa en el remodelado del VI. Se necesitan urgentemente ensayos clínicos que comparen cirugía y TAVI en este contexto con pacientes de alto riesgo quirúrgico.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
I.J. Amat-Santos y J.P. Sánchez-Luna contribuyeron, por igual, al diseño, recogida de datos, análisis y aprobación final del manuscrito.
CONFLICTO DE INTERESES
I.J. Amat-Santos es proctor para Boston Scientific, Medtronic y Meril Life. No existe ningún otro posible conflicto de intereses relacionado con este trabajo.
BIBLIOGRAFÍA
1. Santos-Martínez S, Amat-Santos IJ. New Challenging Scenarios in Transcatheter Aortic Valve Implantation:Valve-in-valve, Bicuspid and Native Aortic Regurgitation. Eur Cardiol. 2021;16:e29.
2. Maurer G. Aortic regurgitation. Heart. 2006;92:994-1000.
3. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. EuroIntervention. 2022;17:e1126-e1196.
4. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease:Executive Summary:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e35-e71.
5. Singh JP, Evans JC, Levy D, et al. Prevalence and clinical determinants of mitral, tricuspid, and aortic regurgitation (the Framingham Heart Study). Am J Cardiol. 1999;83:897-902.
6. Adam M, Tamm AR, Wienemann H, et al. Transcatheter Aortic Valve Replacement for Isolated Aortic Regurgitation Using a New Self-Expanding TAVR System. JACC Cardiovasc Interv. 2023;16:1965-1973.
7. Garcia S, Ye J, Webb J, et al. Transcatheter treatment of native aortic valve regurgitation:The North American Experience with a Novel Device. JACC Cardiovasc Interv. 2023;16:1953-1960.
8. Chen Y, Zhao J, Liu Q, et al. Computed tomography anatomical characteristics based on transcatheter aortic valve replacement in aortic regurgitation. Int J Cardiovasc Imaging. 2023;39:2063–2071.
9. D'Ancona G, Pasic M, Buz, S, et al. TAVI for pure aortic valve insufficiency in a patient with a left ventricular assist device. Ann Thorac Surg. 2012;93:e89-e91.
10. Takagi H, Hari Y, Kawai N, et al. Meta-analysis and meta-regression of transcatheter aortic valve implantation for pure native aortic regurgitation. Heart Lung Circ. 2020;29:729-741.
11. Sánchez-Luna JP, Martin P, Dager AE, et al. Clinical outcomes of TAVI with the Myval balloon-expandable valve for non-calcified aortic regurgitation. EuroIntervention. 2023;19:580-588.
12. Poletti E, De Backer O, Scotti A, et al. Transcatheter Aortic Valve Replacement for Pure Native Aortic Valve Regurgitation:The PANTHEON International Project. JACC Cardiovasc Interv. 2023;16:1974-1985
13. Yoon SH, Schmidt T, Bleiziffer S, et al. Transcatheter Aortic Valve Replacement in Pure Native Aortic Valve Regurgitation. J Am Coll Cardiol. 2017;70:2752-2763.
14. De Backer O, Pilgrim T, Simonato M, et al. Usefulness of Transcatheter Aortic Valve Implantation for Treatment of Pure Native Aortic Valve Regurgitation. Am J Cardiol. 2018;122:1028-1035.
15. Sawaya FJ, Deutsch MA, Seiffert M, et al. Safety and Efficacy of Transcatheter Aortic Valve Replacement in the Treatment of Pure Aortic Regurgitation in Native Valves and Failing Surgical Bioprostheses:Results From an International Registry Study. JACC Cardiovasc Interv. 2017;10:1048-1056.