El artículo de García-Guimarães et al.1 recientemente publicado en REC: Interventional Cardiology representa un ejemplo evidente de cómo una modificación técnica de un dispositivo percutáneo que ya se usa con buenos resultados clínicos puede tener impacto relevante no solo desde un punto de vista de los parámetros de resultado técnico, sino también y sobre todo desde un punto de vista clínico. En el desarrollo de las prótesis para implante percutáneo de válvula aórtica (TAVI) de los últimos 20 años hemos asistido a una evolución tecnológica progresiva en la que dos conceptos diferentes, la prótesis autoexpandible y la prótesis expandible con balón, han logrado inicialmente resultados clínicos esperanzadores en pacientes de alto riesgo o inoperables1,2, y progresivamente hasta resultados superiores al recambio valvular quirúrgico a corto plazo en pacientes de bajo riesgo3,4. Este camino de éxito se debe en gran parte al interés por desarrollar y mejorar los dispositivos de TAVI iniciales, así como los sucesivos. Ya en los estudios de pacientes de alto riesgo se detectó una mayor incidencia de fuga paravalvular tras el TAVI en comparación con la reparación quirúrgica. Además, esta era más frecuente y lastraba, junto con una mayor necesidad de marcapasos tras el implante, a las primeras válvulas autoexpandibles2.
Conceptualmente era esperable, dado que no hay resección de la válvula nativa ni eliminación alguna del calcio yacente en los velos o en el anillo. La necesidad de marcapasos definitivo aumenta debido al mecanismo implícito de fijación mecánica por presión al anillo valvular y a sus estructuras adyacentes. Además, es interesante constatar que ambos fenómenos pueden estar inversamente relacionados, es decir, a mayor sobreexpansión anular más probabilidad de bloqueo auriculoventricular, y al revés con la fuga paravalvular. Si se acepta que el impacto clínico de la fuga residual, aunque con evidencias dispares5,6, puede suceder incluso con los grados etiquetados de ligeros, todos los cambios en el diseño, así como en la técnica de implante, han procurado reducir su tasa y su gravedad.
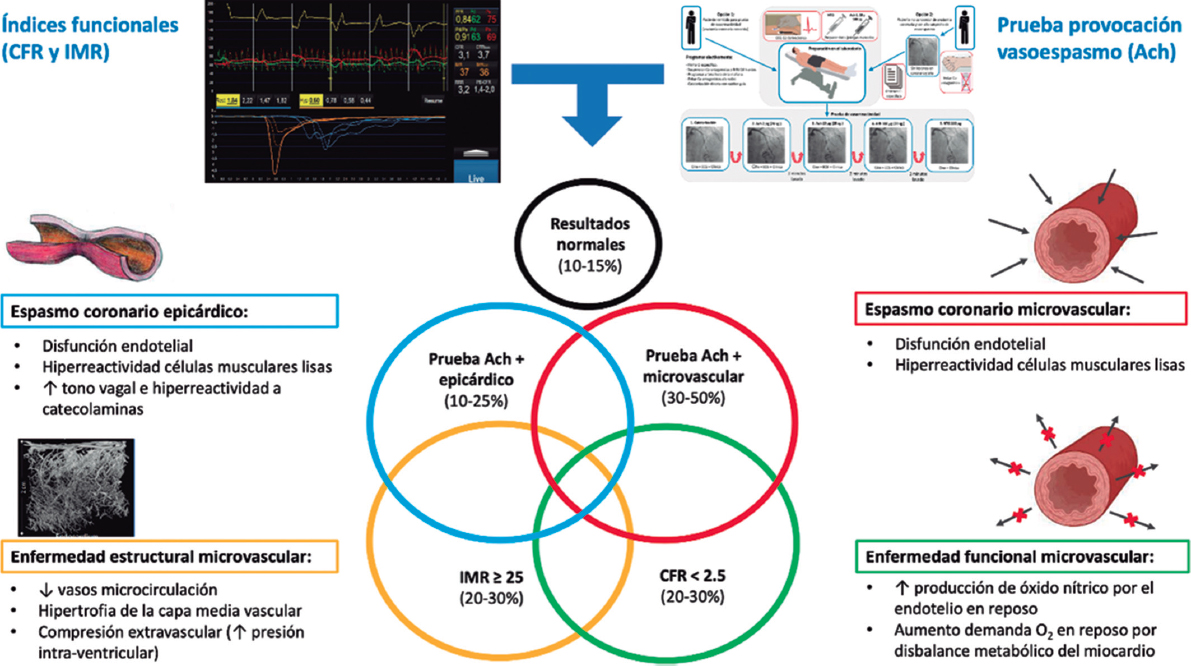
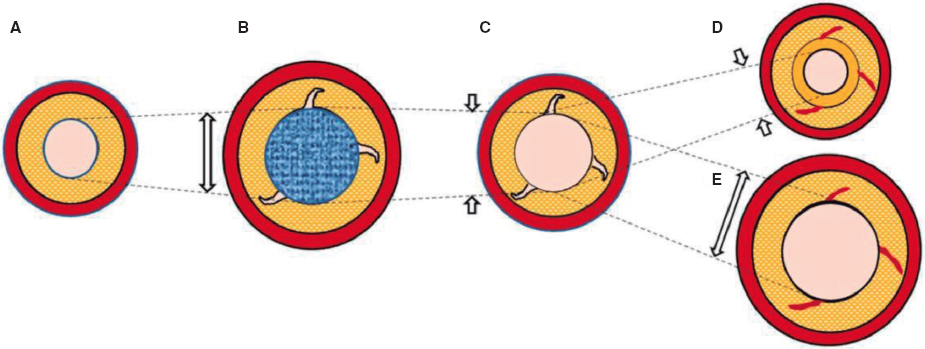
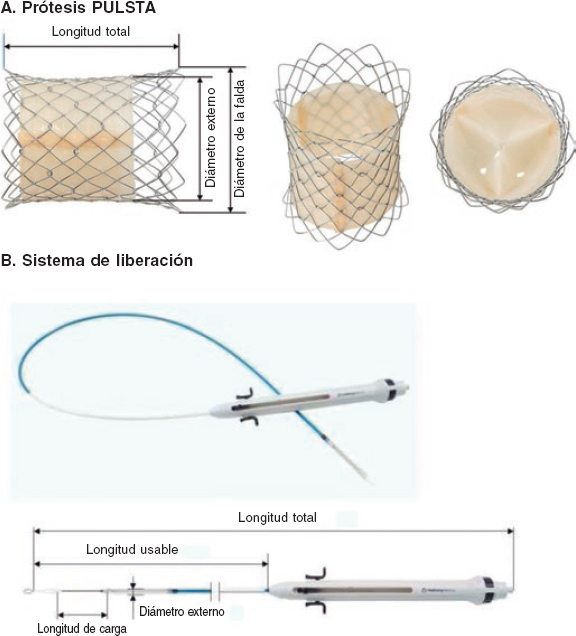
La naturaleza y los mecanismos de la regurgitación paravalvular son obviamente distintos de los de la válvula nativa, por lo que varios autores proponen una atomización mayor de su gradación y una modificación en la técnica de análisis de la ecocardiografía transtorácica tras el implante. Esto va dirigido a detectar de manera adecuada grados de regurgitación paravalvular con potencial efecto pronóstico adverso7. El caso es que el desarrollo de los dispositivos de TAVI se ha dirigido en gran parte a reducir el grado de fuga paravalvular sin comprometer la tasa de nuevo marcapasos tras el implante, es decir, sin modificar el grado de presión sobre el anillo nativo. En este sentido, las «faldas» que rodean la estructura metálica de las prótesis en su zona de contacto con el anillo no solo han llegado para quedarse, sino que han adoptado longitudes mayores y variaciones morfológicas. La historia de ACURATE neo (Boston Scientific Corporation, Estados Unidos) es en realidad un buen ejemplo de cómo una falda un 60% más larga y su modificación pueden tener un beneficio que, aunque podría parecer espurio, en realidad constituye un avance con un potencial beneficio clínico, como muestran García-Guimarães et al.1.
A pesar de que el estudio tiene algunas limitaciones inherentes a su propia naturaleza, como son comparar 2 cohortes históricas no homogéneas, logra demostrar algo que los operadores que hemos utilizado uno y otro modelo ya hemos constatado en la experiencia diaria: el embalaje de la porción en contacto con el anillo ha reducido las tasas de fuga en el TAVI. Y lo que es más destacable, cuando se trata del desarrollo de un dispositivo, no hay que pagar peaje: la válvula ACURATE neo 2 reduce la fuga paravalvular sin comprometer la tasa de marcapasos, como describe también otro estudio similar que compara 2 cohortes consecutivas con los 2 modelos consecutivos de ACURATE neo8.
Bien es cierto que en el proceso de desarrollo de las nuevas prótesis para TAVI hemos aprendido a evaluar mejor con tomografía computarizada (TC) el tamaño de los anillos aórticos, y con ello a realizar un preciso ajuste del tamaño de la prótesis a implantar. También han aparecido más opciones técnicas en cuanto al tamaño de la válvula, su medida, la altura de implante e incluso la necesidad de pre- o posdilatación. La influencia de cada uno de estos factores se podría intentar despejar estadísticamente, aunque esto dista de ser sencillo entre 2 cohortes históricas diferentes.
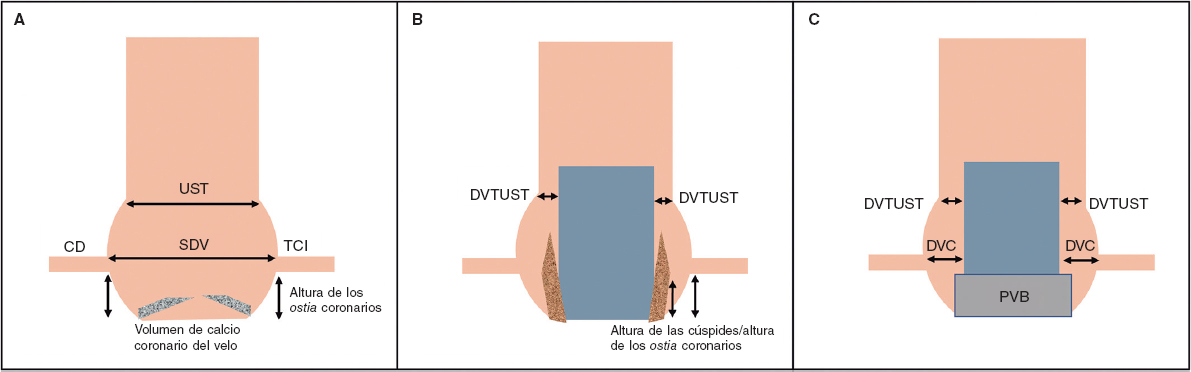
Si analizamos en profundidad lo que supone evaluar las válvulas aórticas por TC, y sobre todo la capacidad de predecir la incidencia de fuga paravalvular tras el TAVI, encontramos algunas contradicciones. Aunque el grado de calcificación o la extensión de esta puedan parecer lógicamente los causantes de la regurgitación paravalvular, no todo es tan claro ni lineal. Esta confusión puede atribuirse a la variabilidad del impacto del calcio valvular en el sellado de la prótesis según el tipo (expandible con balón o autoexpandible), el diseño específico (con o sin falda, entre otros) y el tamaño elegido, así como a cuestiones técnicas de la intervención (altura del implante). En los estudios dirigidos a relacionar la calcificación por TC existe variabilidad en la técnica usada para la cuantificación del calcio (TC sin contraste o angiografía por TC [angio-TC]) y en los métodos de análisis (umbral de detección del calcio, valoración de unidades Agatston o volumen de calcio, inclusión del tracto de salida, entre otros).
El método estándar para la cuantificación del calcio utiliza un estudio basal, típicamente realizado antes de la inyección del material de contraste yodado necesario para la angio-TC cardiaca y aórtica. Ante la falta de dicha determinación basal, la cuantificación del calcio usada en el artículo de García-Guimarães et al.1 considera un umbral de detección dicotómico basado en la opacificación obtenida en el tracto de salida en las imágenes de la angio-TC9; método sencillo y con una correlación aceptable que fue aplicado de manera homogénea a ambas cohortes.
El tamaño escogido de la válvula, la altura del implante y la distribución de ese calcio tanto en el anillo como en el tracto de salida del ventrículo izquierdo pueden haber compartido protagonismo en este estudio y en este aspecto.
La limitación del sellado con el TAVI en comparación con la cirugía de recambio es probable que persista a pesar de los desarrollos ulteriores del primero, pero la posición supravalvular de la coaptación y el inferior perfil del stent metálico frente al de una prótesis quirúrgica pueden ser bazas favorables para el TAVI al evaluar la durabilidad en el largo plazo.
Finalmente, aunque de momento no puede asegurarse que haya una relación de causa-efecto, es llamativo que el grupo con mayor grado de fuga residual, tanto en el estudio que comentamos1 como en otros10, presenta también mayor sangrado en el seguimiento. Está claro que, al ser cohortes históricas, podría deberse a otros factores implicados en la propia curva de aprendizaje y desarrollo de la técnica, como pueden ser el tratamiento del acceso vascular o el uso de medicaciones que afecten el sangrado, pero también podría ser porque la propia fuga tenga efectos reológicos deletéreos, como sugieren algunos estudios11.
Es interesante que, aunque los nuevos embalajes suelen llegar con algún que otro peaje, este parece que no.
FINANCIACIóN
Esta editorial no ha contado con financiación alguna.
CONFLICTO DE INTERESES
B. García del Blanco es proctor de Edwards y ha recibido financiación por tareas de asesoría a Medtronic y Boston Scientific. H. Cuéllar Calabria no comunica ningún conflicto de intereses.
BIBLIOGRAFíA
1. García-Guimarães M, Van Ginkel D-J, Rensing BJ, et al. Paravalvular leak with ACURATE neo and neo2: a comparative study with calcium quantification. REC Interv Cardiol. 2023;5:170-177.
2. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
3. Mack MJ, Leon MB, Thourani VH, et al. PARTNER 3 Investigators. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
4. Reardon MJ, Adams DH, Kleiman NS, et al. 2-Year Outcomes in Patients Undergoing Surgical or Self-Expanding Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2015;66:113-121.
5. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
6. Athappan G, Patvardhan E, Tuzcu EM, et al. Incidence, predictors, and outcomes of aortic regurgitation after transcatheter aortic valve replacement: meta-analysis and systematic review of literature. J Am Coll Cardiol. 2013;61:1585-1595.
7. Ando T, Briasoulis A, Telila T, Afonso L, Grines CL, Takagi H. Does mild paravalvular regurgitation post transcatheter aortic valve implantation affect survival? A meta-analysis. Catheter Cardiovasc Interv. 2018;91:135-147.
8. Jones BM, Tuzcu EM, Krishnaswamy A, et al. Prognostic significance of mild aortic regurgitation in predicting mortality after transcatheter aortic valve replacement. J Thorac Cardiovasc Surg. 2016;152:783-790.
9. Angelillis M, Costa G, De Backer O, et al. Threshold for calcium volume evaluation in patients with aortic valve stenosis: correlation with Agatston score. J Cardiovasc Med (Hagerstown). 2021;22:496-502.
10. Kim WK, Eckel C, Renker M, et al. Comparison of the Acurate Neo Vs Neo2 Transcatheter Heart Valves. J Invasive Cardiol. 2022;34:E804-E810.
11. Mehran R, Sorrentino S, Claessen BE. Paravalvular Leak: An Interesting Interplay of Acquired vWF-Disease and Late Bleeding After TAVR. J Am Coll Cardiol. 2018;72:2149-2151.
* Autor para correspondencia.
Correo electrónico: brunogb51@gmail.com (B. García del Blanco).