RESUMEN
Introducción y objetivos: La embolización distal y el fenómeno de no-reflow son complicaciones frecuentes de la angioplastia primaria. La información disponible sobre la influencia de la velocidad de desinflado del sistema de liberación del stent es escasa. Nuestro objetivo es analizar la influencia de este factor en los resultados de la angioplastia primaria.
Métodos: Entre diciembre de 2016 y febrero de 2019, todos los pacientes consecutivos con infarto de miocardio con elevación del segmento ST sometidos a coronariografía urgente en nuestro centro y que eran susceptibles de trombectomía, inhibidores de IIB-IIIA e implante directo de stent fueron aleatorizados 1:1 a un desinflado rápido del sistema de liberación (grupo 1, n = 103) o a un desinflado lento a 1 atm/s (grupo 2, n = 107). Por protocolo, no se permitió la predilatación previa ni posterior. Los objetivos primarios fueron el grado de blush miocárdico ≥ 2 y la resolución del segmento ST ≥ 70%. Los objetivos secundarios fueron el tamaño del infarto, la fracción de eyección al alta y a los 12 meses, y las mortalidades total y cardiovascular a los 12 meses.
Resultados: El estudio se detuvo prematuramente con el 50% del tamaño muestral calculado por futilidad. Se encontró blush ≥ 2 en 77 (74,7%) frente a 79 (75,2%) pacientes (p = 0,93) y resolución del segmento ST ≥ 70% en 54 (53,9%) frente a 59 (55,5%) pacientes (p = 0,75) en los grupos 1 y 2, respectivamente, sin diferencias en ninguno de los objetivos secundarios.
Conclusiones: En nuestra serie, la velocidad de desinflado del sistema de liberación del stent en la angioplastia primaria no modificó el blush miocárdico ni la resolución del segmento ST, y tampoco demostró tener influencia en los resultados clínicos, el tamaño del infarto según los biomarcadores ni la fracción de eyección.
Palabras clave: Angioplastia primaria. Infarto con elevación del segmento ST. No-reflow. Resolución del segmento ST. Blush miocárdico.
ABSTRACT
Introduction and objectives: Distal embolization and no-reflow are common complications in primary angioplasty and the information available on the role played by the deflation speed of the stent delivery system is scarce. Our aim is to analyze how the deflation speed of the stent delivery system impacts the results of primary angioplasty.
Methods: From December 2016 through February 2019, all consecutive patients with ST-segment elevation myocardial infarction undergoing urgent coronary angiography at our institution and who were eligible for thrombectomy, IIB-IIIA inhibitors, and direct stenting were randomized in a 1:1 ratio to rapid (group 1, n = 103) or slow deflation of the stent delivery system, at 1 atm/second, (group 2, n = 107). Pre- and postdilatation was not allowed per protocol. The primary outcomes were myocardial blush ≥ 2 and ST-segment resolution ≥ 70% while the size of myocardial damage, the ejection fraction both at discharge and at the 12-month follow-up, and the overall and 12-month cardiovascular mortality rates were the secondary outcomes.
Results: The study was stopped prematurely with 50% of the estimated sample size due to futility. Myocardial blush ≥ 2 occurred in 77 (74.7%) vs 79 (75.2%) of the patients, P = .93, and ST-segment resolution ≥ 70% occurred in 54 (53.9%) vs 59 (55.5%) of the patients, P = .75 in groups 1 and 2, respectively without any differences being reported in any of the secondary endpoints.
Conclusions: In our series, the deflation speed of the stent delivery system in primary angioplasty did not modify the myocardial blush ≥ 2, the ST-segment resolution ≥ 70% or impacted the clinical outcomes, the size of myocardial infarction according to the biomarkers or the ejection fraction.
Keywords: Primary angioplasty. ST-segment-elevation myocardial infarction. No-reflow. ST-segment resolution. Myocardial blush.
Abreviaturas BM: blush miocárdico. ICPp: angioplastia primaria. RST: resolución del segmento ST. IAMCEST: infarto agudo de miocardio con elevación del segmento ST. TIMI: Thrombolysis in Myocardial Infarction.
INTRODUCCIÓN
Tanto la embolización distal como el flujo coronario lento suelen limitar el éxito de la angioplastia primaria (ICPp). Entre el 25 y el 50% de los casos presentan una mala reperfusión microvascular que, además, tiene mal pronóstico a pesar de haber conseguido restaurar el flujo satisfactoriamente1. Este es un campo en el que el debate sigue abierto porque estrategias que, al principio, daban resultados positivos, se ponen ahora en duda como la implantación directa de stents2, la trombectomía3,4 y la administración de bloqueadores beta5 e inhibidores de los receptores IIB-IIIA6.
Se ha demostrado que una dilatación agresiva del balón con una relación balón/arteria alta puede provocar la aparición del fenómeno de no-reflow. Se ha especulado, también, con la posibilidad de que la velocidad de desinflado del sistema de liberación del stent pudiese influir en los resultados, aunque hay poca información a este respecto.
Esta falta de restauración del flujo miocárdico puede deberse a diferentes factores fisiopatológicos tales como embolización distal, lesión isquemia-reperfusión, así como a la susceptibilidad de la microcirculación coronaria a la lesión7,8. Un desinflado rápido del balón puede desencadenar el llamado efecto sifón y cambios rápidos en la hemodinámica coronaria que pueden estar asociados a la embolización distal y a la disfunción microcirculatoria9. Como parte de un trabajo previo, los investigadores diseñaron un estudio experimental in vitro que combinaron con un modelo informático. Descubrieron que la tensión de cizallamiento de la pared vascular provocada por diferentes estrategias de desinflado del balón desencadenaba, también, diferencias en la velocidad final del flujo.
Nuestro objetivo es analizar el impacto de la velocidad de desinflado del sistema de liberación del stent tanto sobre el blush miocárdico (BM) como sobre la resolución del segmento ST (RST) en la fase aguda, así como el pronóstico y fracción de eyección tras 12 meses de seguimiento.
MÉTODOS
Pacientes
Se realizó un estudio paralelo, aleatorizado y de un único centro con un programa de 24 horas de ICPp con área de referencia de 440.000 pacientes. La inscripción se llevó a cabo mediante muestreo por conveniencia y los pacientes elegibles eran todos los sujetos consecutivos con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) derivados para someterse a ICPp y con una lesión culpable susceptible de tratamiento mediante implante directo de stent. Los pacientes debían presentar elevación del segmento ST ≥ 0,1 mV en 2 derivaciones contiguas o un bloqueo de rama izquierda de nueva aparición.
Los criterios de exclusión fueron contraindicación al ácido acetilsalicílico, clopidogrel o inhibidores de los receptores IIB-IIIA, imposibilidad de completar el seguimiento, una esperanza de vida < 12 meses, lesión no apta para ser tratada mediante implante directo de stent, lesiones culpables localizadas en injertos o trombosis del stent y anticoagulación oral previa.
Tras realizar la coronariografía, los pacientes que cumplían los criterios de inclusión y no presentaban criterios de exclusión dieron su consentimiento oral inicial y fueron asignados mediante aleatorización simple a través de una lista generada por ordenador que creó códigos individuales. Estos códigos se introdujeron en sobres idénticos, preparados por personal ajeno al estudio, lo bastante gruesos como para que no se pudieran ver dichos códigos. Se pidió a todos los pacientes que confirmaran su participación dando su consentimiento informado por escrito en un plazo de 24 horas. El protocolo del estudio se diseñó de conformidad con las guías éticas de la Declaración de Helsinki de 1975 tal y fue aprobado por el comité de ética regional
Se crearon grupos paralelos mediante a) implante directo de stent con desinflado rápido del sistema de liberación del stent tras 20 segundos de inflado del balón (grupo 1) o b) implante directo de stent con desinflado lento a 1 atmósfera por segundo tras el mismo periodo de inflado (grupo 2).
Intervención
Tanto los pacientes como los revisores de los resultados se mantuvieron completamente cegados a la intervención. Para minimizar la variabilidad y cualquier posible factor de confusión, el protocolo fue estricto e incluyó la administración de 250 mg de ácido acetilsalicílico seguido de 600 mg de clopidogrel en el primer contacto médico (según el protocolo de infarto de miocardio de nuestra comunidad autónoma), 70 mg/kg de heparina IV y abciximab IV o tirofibán al inicio de la intervención y durante las siguientes 12 horas. Se llevó a cabo trombectomía manual en todos los casos y el protocolo no permitía el implante de un segundo stent ni la dilatación con balón previa o posterior al implante. Se hicieron análisis por intención de tratar y por protocolo. El primero dictó el análisis principal. El volumen de contraste en cada inyección fue de 6 ml administrados durante 3 segundos en tronco común izquierdo y de 4 ml administrados durante 2 segundos en coronaria derecha a través del dispositivo ACIST (ACIST Medical Systems Inc., Estados Unidos). Se administró nitroglicerina intracoronaria (entre 100 y 200 µg) previa a la inyección final para valorar el BM. El blush miocárdico se estudió en proyección oblicua anterior derecha de 20º con angulación caudal de 20º y en oblicua anterior izquierda de 45º con angulación craneal de 20º para la coronaria izquierda y en proyección anteroposterior con angulación craneal de 20º de la coronaria derecha. Las grabaciones se obtuvieron con 30 imágenes por segundo sin ampliación de imágenes y con una duración prolongada hasta completar la fase venosa de la circulación miocárdica.
Durante los primeros 30 minutos tras la llegada a la unidad de cuidados coronarios, a los pacientes se les realizó un electrocardiograma de 12 derivaciones y se tomaron muestras de sangre para estudiar los niveles de troponina I entre 6 y 24 horas después de la intervención, así como mediciones adicionales hasta confirmar un descenso de estos niveles.
Se recomendó, siguiendo las guías de práctica clínica, tratamiento médico óptimo con estatinas, bloqueadores beta o bloqueadores del sistema renina-angiotensina. También se indicó tratamiento antiplaquetario doble durante 12 meses. Asimismo, se recomendó cambiar el clopidogrel por ticagrelor durante el ingreso en ausencia de un riesgo hemorrágico significativo.
Resultados
Los 2 objetivos primarios fueron la influencia de la velocidad de desinflado del sistema de liberación del stent en el BM y en la RST. El BM final se estudió mediante análisis ciego en un laboratorio central externo de otra región. La variable analizada fue el porcentaje de grado de BM ≥ 2 frente a < 2 entre ambos grupos mediante estimación visual. La evaluación se llevó a cabo por 2 cardiólogos intervencionistas con más de 10 años de experiencia en evaluación del BM10 solicitándose la opinión de un tercer cardiólogo en caso de discrepancia. La RST fue analizada por revisores que se mantuvieron ciegos tanto al estudio como a la intervención. El punto J se identificó manualmente con respecto a los 0,5 mm más cercanos en todas las derivaciones salvo en la aVR. Empleando el segmento TP como intervalo basal isoeléctrico, se midió el grado de elevación del segmento ST con respecto a los 0,05 mV más cercanos 80 ms después del punto J. La RST se calculó a partir del descenso observado en las elevaciones del segmento ST en todas las derivaciones salvo en la aVR, tanto en el ECG basal como en el realizado a la llegada a la unidad de cuidados coronarios. La variable fue binaria, la resolución > 70% de la suma de los milímetros de elevación del segmento ST entre ambos registros.
Los objetivos secundarios fueron: a) el grado de daño miocárdico comparando los niveles máximos de troponina I; b) la fracción de eyección al alta hospitalaria; c) la fracción de eyección a los 12 meses; d) la tasa de mortalidad por cualquier causa a los 12 meses y d) la tasade mortalidad cardiovascular a los 12 meses
Definiciones
La carga trombótica descrita en los hallazgos angiográficos se definió atendiendo a la clasificación de Sianos11 y la circulación colateral según la clasificación de Rentrop12.
Angiografía coronaria cuantitativa
Se empleó el sistema Medis Suite XA (Medis Medical Imaging, Israel) para el análisis según la recomendación deexpertos13. La longitud de la lesión se midió después de haber restaurado el flujo del vaso mediante trombectomía. Los parámetros del diá- metro se tomaron al final de la intervención después de implantar el stent por la dificultad de medición del vaso antes de la intervención en arterias ocluidas. Se emplearon los siguientes datos: diámetro del vaso de referencia (el diámetro luminal medio en los segmentos adyacentes sin enfermedad ateroesclerótica), el diámetro luminal mínimo, la estenosis posoperatoria y el ratio stent/arteria.
Cálculos del tamaño muestral
Basado en un porcentaje de casos del 50 % de RST en el grupo de control14,15 y 62,5% en el grupo de la intervención según el criterio de diferencia mínima clínicamente significativa entre tratamientos del 25%16 y con un índice de abandono del 10%, se calculó una muestra de 420 pacientes (210 por grupo).
Análisis intermedio
Ante la incertidumbre de los resultados y la falta de datos disponibles en la literatura, se propuso realizar un análisis intermedio de futilidad tras inscribir el 50% del tamaño muestral.
Análisis estadístico
Las variables cuantitativas con distribución normal se expresaron como media y desviación estándar y aquellas sin distribución normal como mediana y rango intercuartílico. Las variables categóricas se expresaron con valor absoluto y porcentaje. La comparativa entre medias se realizó con la prueba t de Student en las variables con distribución normal o la prueba U de Mann-Whitney cuando no se cumplía esta premisa. Para comparar proporciones se usó la prueba de la χ2 o la prueba exacta de Fisher Se emplearon pruebas bilaterales para analizar todos los estudios y se consideró un valor de p ≤ 0,05 como estadísticamente significativo. Se llevó a cabo un análisis de regresión logística para realizar un ajuste y poder analizarla influencia de la velocidad de desinflado del sistema de liberación del stent en cada uno de los 2 objetivos primarios. Las variables que cumplían los 2 criterios de relación razonable con los objetivos primarios y con valor de p < 0,20 en el análisis univariante se incluyeron en el análisis multivariante. Los cálculos se realizaron empleando el software de análisis estadístico SPSS 27.0.0.0 (IBM Corp, Estados Unidos).
RESULTADOS
Características basales
Entre diciembre de 2016 y febrero de 2019 un total de 447 pacientes fueron derivados a nuestra sala de hemodinámica con un diagnóstico de IAMCEST (figura 1, diagrama de flujo). Un total de 237 (53%) no cumplían criterios de inclusión y los 210 restantes (47%) fueron aleatorizados a un grupo de desinflado rápido (103, 49%) y a otro de desinflado lento del balón (107, 51%). Aunque el tamaño muestral calculado inicialmente fue de 420 pacientes, tras un análisis intermedio con el 50% de la muestra reclutada, el estudio fue interrumpido prematuramente por futilidad. Se observó 1 violación del protocolo en el primer grupo y 4 en el segundo. El análisis por intención de tratar se puede consultar en esta sección y el análisis por protocolo en las tablas 3 a 5 del material suplementario. Las características basales y de la intervención se muestran en la tabla 1 y tabla 2. Aunque no hubo ninguna diferencia a nivel estadístico entre los 2 grupos, sí se observó una tendencia no significativa hacia un mayor diámetro del vaso en el grupo con desinflado lento del balón. En todos los casos se emplearon catéteres guía de 6 Fr.
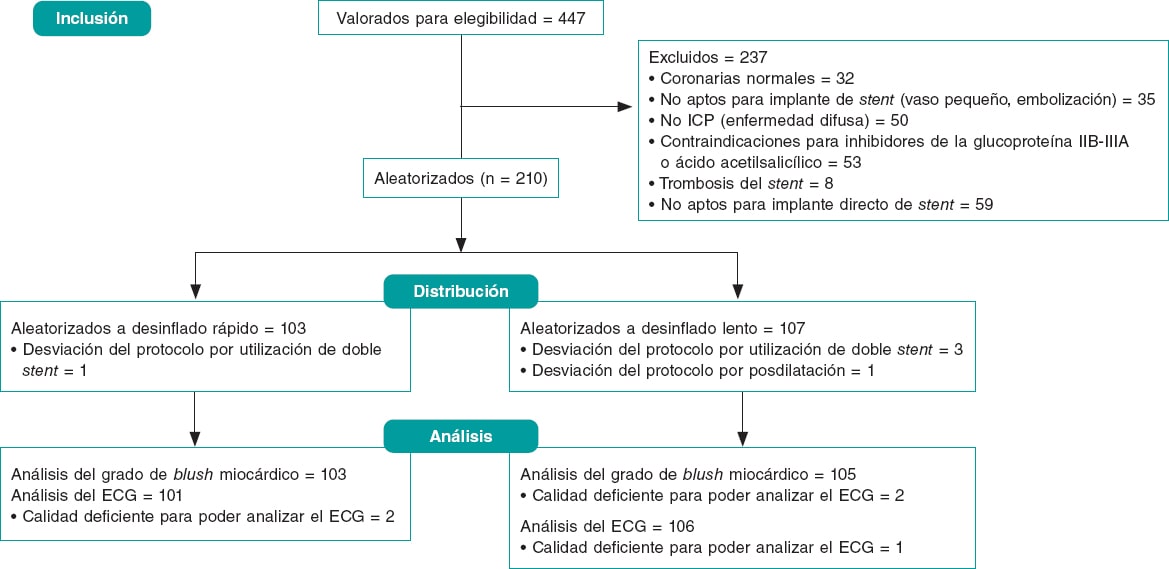
Figura 1. Diagrama de flujo del estudio. ECG: electrocardiograma: ICP: intervención coronaria percutánea.
Tabla 1. Características clínicas basales
| Desinflado rápido n = 103 | Desinflado lento n = 107 | p | |
|---|---|---|---|
| Edad | 59,73 (10,56) | 59,33 (10,71) | 0,78 |
| Sexo (mujer) | 26 (25,2) | 20 (18,7) | 0,25 |
| Diabetes | 14 (13,6) | 21 (19,6) | 0,24 |
| Hipertensión | 40 (38,9) | 48 (44,8) | 0,37 |
| Hipercolesterolemia | 37 (35,9) | 45 (42,1) | 0,36 |
| Tabaquismo | 65 (63,1) | 71 (66,3) | 0,62 |
| Infarto de miocardio previo | 4 (3,9) | 6 (5,6) | 0,75 |
| Intervención coronaria percutánea previa | 3 (2,9) | 4 (3,7) | 1,00 |
| Cirugía de revascularización coronaria previa | 0 (0) | 1 (0,1) | 1,00 |
| Accidente cerebrovascular previo | 1 (0,1) | 0 (0,0) | 0,49 |
| Aclaramiento de creatinina < 60 ml/min | 14 (13,6) | 22 (20,5) | 0,18 |
| Presión arterial al alta al ingreso | 123,4 (30,8) | 129,6 (28) | 0,13 |
| Shock | 4 (3,9) | 1 (0,09) | 0,21 |
| Abordaje radial | 103 (100) | 105 (98,1) | 0,50 |
| Número de vasos enfermos | 1,38 (0,61) | 1,45(0,66) | 0,42 |
| Tiempo total de isquemia | 192 (125-295) | 169 (120-260) | 0,21 |
| Tiempo primer contacto médico/balón | 87 (66-130) | 80 (65-114) | 0,22 |
| Elevación del segment ST antes de la intervención (mm) | 11,40 (6,74) | 12,63 (8,06) | 0,24 |
Las variables cuantitativas con distribución normal se expresan como medias y desviaciones estándar (DE) y aquellas sin una distribución normal como medianas y rangos intercuartílicos. Las variables categóricas se expresan como valores absolutos y porcentajes. | |||
Tabla 2. Características de la intervención
| Desinflado rápido n = 103 | Desinflado lento n = 107 | p | |
|---|---|---|---|
| Vaso | 0,60 | ||
| Descendente anterior | 44 (42,7) | 40 (37,4) | |
| Circunfleja izquierda | 13 (12,6) | 18 (16,8) | |
| Coronaria derecha | 46 (44,7) | 49 (45,8) | |
| Grado de flujo TIMI ≥ 2 preintervencióna | 10 (9,7) | 17 (15,9) | 0,21 |
| Rentrop ≥ 2 | 15 (14,6) | 19 (17,8) | 0,53 |
| Grado del trombo ≥ 4 | 46 (44,6) | 50 (46,7) | 0,76 |
| Stent farmacoactivo | 100 (97,1) | 101 (94,4) | 0,50 |
| Porcentaje de estenosis | 99,28 (3,43) | 98,89 (6,48) | 0,58 |
| DVRb | 2,74 (0,42) | 2,86 (0,47) | 0,07 |
| Longitud de la lesión | 14,07 (5,94) | 13,44 (4,71) | 0,39 |
| Diámetro del stent | 3,23 (0,47) | 3,32 (0,57) | 0,17 |
| Presión máxima de inflado | 14,68 (1,48) | 14,77 (1,69) | 0,67 |
| DLMc | 2,89 (0,38) | 3,00 (0,49) | 0,06 |
| Diámetro luminal mínimo | 2,63 (0,39) | 2,67 (0,48) | 0,48 |
| Estenosis posintervención | 8,92 (4,75) | 11,20 (6,25) | 0,01 |
| Proporción stent/arteria | 1,05 (0,07) | 1,05 (0,08) | 0,95 |
Las variables cuantitativas con distribución normal se expresan como medias y desviaciones estándar (DE) y aquellas sin una distribución normal como medianas y rangos intercuartílicos. Las variables categóricas se expresan como valores absolutos y porcentajes. a TIMI, escala de riesgo Thrombolysis in Myocardial Infarction. b DVR, diámetro del vaso de referencia tras la intervención. c DLM, diámetro luminal máximo tras la intervención. | |||
Tabla 3. Resultados
| Desinflado rápido n = 103 | Desinflado lento n = 107 | p | |
|---|---|---|---|
| Blush miocárdico ≥ 2 | 77 (74,7) | 79 (75,2) | 0,93 |
| Elevación del segmento ST posintervención (mm) | 4,26 (5,19) | 4,03 (4,69) | 0,73 |
| Resolución de la elevación del segmento ST (mm) | 7,03 (6,99) | 8,56 (8,11) | 0,15 |
| Porcentaje de resolución (%) | 64,97 (33,35) | 65,40 (34,69) | 0,92 |
| Resolución ≥ 70 % | 54 (53,4) | 59 (55,6) | 0,75 |
| Grado de flujo TIMI posintervención | 0,38 | ||
| 0 | 1 | 0 | |
| 1 | 0 | 1 | |
| 2 | 5 | 9 | |
| 3 | 97 | 97 | |
| Niveles máximos de troponina I | 47,84 (14-129) | 72 (29,7-144,75) | 0,14 |
| Fracción de eyección al alta | 53,9 (8,58) | 54,62 (8,71) | 0,55 |
| Fracción de eyección a los 12 meses | 57,43 (8,20) | 57,75 (6,48) | 0,76 |
| Tasa de mortalidad intrahospitalaria | 1 (0,9) | 2 (1,8) | 1,00 |
| Tasa de mortalidad global a los 12 meses | 3 (2,9) | 3 (2,8) | 1,00 |
| Tasa de mortalidad cardiovascular a los 12 meses | 2 (1,9) | 3 (2,8) | 1,00 |
| Infarto de miocardio | 1 (0,9) | 1 (0,9) | 1,00 |
| Revascularización del vaso diana | 0 | 1 (0,9) | 1,00 |
Las variables cuantitativas con distribución normal se expresan como medias y desviaciones estándar (DE) y aquellas sin una distribución normal como medianas y rangos intercuartílicos. Las variables categóricas se expresan como valores absolutos y porcentajes. TIMI, escala de riesgo Thrombolysis in Myocardial Infarction. | |||
Objetivos
El objetivo primario de BM ≥ 2 frente a < 2 se observó en 77 (74,7%) frente a 79 pacientes (75,2%), p = 0,93 y la RST ≥ 70% en 54 (53,9%) frente a 59 pacientes (55,5%), p = 0,75 en los grupos de desinflado rápido y lento, respectivamente. No se observaron diferencias en ninguno de los objetivos secundarios (grado de daño miocárdico, fracción de eyección al alta hospitalaria, fracción de eyección a los 12 meses, tasa de mortalidad global a los 12 meses o tasade mortalidad cardiovascular a los 12 meses) (tabla 3).
Predictores de blush miocárdico
El análisis univariante se llevó a cabo con las variables dela tabla 1 del material suplementario. Las variables edad, aclaramiento de creatinina < 60 ml/min, diámetro luminal máximo posintervención, historia previa de hipertensión, presión arterial sistólica al ingreso, grado de circulación colateral Rentrop ≥ 2 y tiempo primer contacto médico/balón se incluyeron en el análisis de regresión logística. Tanto la presión arterial sistólica al ingreso, como el aclaramiento de creatinina < 60 ml/min y el diámetro luminal máximo posintervención fueron predictores de blush miocárdico ≥ 2 si bien en el modelo final la hipertensión alcanzó valor de p = 0,074 (tabla 4). El poder predictivo fue moderado con un área bajo la curva (AUC) receiver operating characteristic (ROC) de 0,71 (0,63-0,80) (figura 2).
Tabla 4. Predictores de blush miocárdico ≥ 2 y de resolucón del segmento ST
| OR | IC95% | p | |
|---|---|---|---|
| Predictores de blush miocárdico ≥ 2 | |||
| Presión arterial sistólica al ingreso | 1,02 | 1,02-1,03 | 0,011 |
| Aclaramiento de creatinina < 60 ml/min | 0,29 | 0,13-0,66 | 0,003 |
| Diámetro luminal máximo posintervención | 3,08 | 1,24-7,63 | 0,015 |
| Hipertensión | 0,52 | 0,26-1,06 | 0,074 |
| Predictores de resolución del segmento ST | |||
| Diabetes | 0,16 | 0,06-0,43 | < 0,001 |
| Infarto de miocardio previo | 13,54 | 1,47-124,91 | 0,022 |
| Descendente anterior | 0,46 | 0,24-0,91 | 0,025 |
| Grado de flujo TIMI ≥ 2 preintervención | 3,95 | 1,36-11,46 | 0,011 |
| Grado de flujo TIMI 3 posintervención | 7,10 | 1,76-28,68 | 0,006 |
| Grado de circulación colateral Rentrop ≥ 2 | 0,31 | 0,13-0,75 | 0,010 |
Las variables cuantitativas con distribución normal se expresan como medias y desviaciones estándar (DE) y aquellas sin una distribución normal como medianas y rangos intercuartílicos. Las variables categóricas se expresan como valores absolutos y porcentajes. IC95%: intervalo de confianza del 95%; OR, odds ratio; TIMI, escala de riesgo Thrombolysis in Myocardial Infarction. | |||
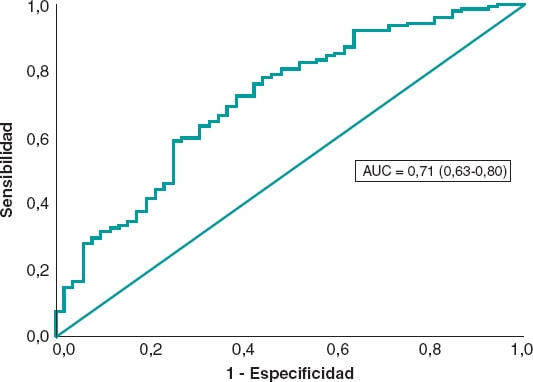
Figura 2. Curva ROC del modelo de regresión logística para la predicción de blush miocárdico.
Predictores de resolución del segmento ST ≥ 70%
El análisis univariante se realizó con las variables que se muestran en la tabla 2 del material suplementario. Las variables estudiadas en el análisis multivariante fueron: sexo, diabetes, hipercolesterolemia, tabaquismo, shock, descendente anterior, infarto de miocardio previo, grado de flujo TIMI ≥ 2 preintervención, grado de flujo TIMI 3 posintervención, grado de circulación colateral Rentrop ≥ 2, número de milímetros de elevación del segmento ST antes de la intervención y aclaramiento de creatinina < 60 ml/min. El modelo de regresión logística incluyó diabetes, infarto de miocardio previo, descendente anterior, grado de flujo TIMI ≥ 2 preintervención, grado de flujo TIMI 3 posintervención y grado de circulación colateral Rentrop ≥ 2 como predictores de una resolución del segmento ST ≥ 70% (tabla 4). El área bajo la curva (AUC) receiver operating characteristic (ROC) fue 0.75 (0.68-0.82) (figura 3).
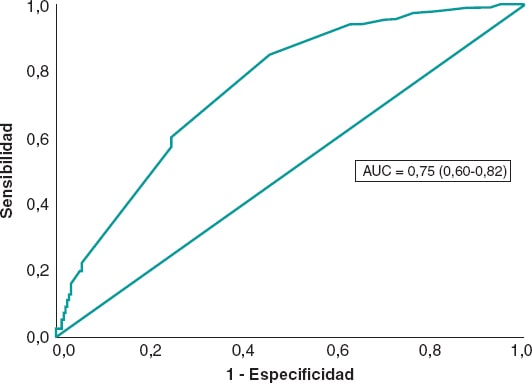
Figura 3. Curva ROC del modelo de regresión logística para la resolución del segmento ST.
Análisis por protocolo
Se registró violación del protocolo en 5 pacientes por uso de 2 stents en 1 paciente del grupo con desinflado rápido y en 3 pacientes del grupo con desinflado lento, además de 1 caso de posdilatación en este último grupo (figura 1). Las tablas 3, 4 y 5 del material suplementario muestran el análisis por protocolo sin haberse encontrado ninguna diferencia significativa comparado con el análisis por intención de tratar.
Valores perdidos
La calidad del angiograma no nos permitió realizar un análisis adecuado del BMen 2 pacientes del grupo con desinflado lento. De la misma forma, la calidad del electrocardiograma fue subóptima en 2 pacientes del grupo de desinflado rápido y en 1 del grupo de desinflado lento. Estos datos son completely missing at random, por lo que se considera que no alteraron la aleatorización.
DISCUSIÓN
En este estudio se estudió la influencia de la velocidad de desinflado del sistema de liberación del stent en el blush miocárdico ≥ 2 y en la resolución del segmento ST ≥ 70%. Los hallazgos más importantes fueron los siguientes: a) hubo que interrumpir el estudio con el 50% del tamaño muestral predefinido por cuestiones de futilidad y ni el BM ni la RST se vieron alterados por la intervención; b) no se observaron diferencias en el tamaño del infarto por marcadores ni en la fracción de eyección a los 12 meses y al alta, así como tampoco en la tasa de mortalidad por cualquier causa o de mortalidad cardiovascular a los 12 meses; c) la presión arterial sistólica al ingreso, el aclaramiento de creatinina < 60 ml/min y el diámetro luminal máximo posintervención fueron predictores del BM; por otro lado, la historia previa de hipertensión probablemente habría estado en el modelo final si el tamaño muestral hubiese sido mayor; y d) los predictores de la RST fueron la diabetes, infarto previo, arteria descendente anterior, el flujo TIMI ≥ 2 preintervención y el flujo TIMI 3 posintervención, así como por el grado de circulación colateral Rentrop ≥ 2
Los datos disponibles en la literatura sobre este tema de investigación son escasos y, hasta donde nosotros sabemos, solo 1 grupo ha aportado información al respecto. Gu et al.17 también estudiaron la relación existente entre el desinflado del balón durante la liberación del stent con el flujo coronario y los resultados clínicos de la ICPp en una serie de 211 pacientes. En su estudio, el desinflado lento favorecía el flujo coronario y disminuía el tamaño del infarto frente a un desinflado rápido convencional. Estos resultados contradictorios podrían estar justificados por las notables diferencias observadas entre ambas cohortes de pacientes. Estudios publicados con anterioridad ya se han referido al papel que tiene el inflado del balón18, la trombectomía19,20 y los inhibidores de los receptoresIIB-IIIA21 en el BM. En nuestra serie, se diseñó un protocolo estricto para controlar estos posibles factores de confusión, razón por la cual la predilatación y posdilatación no estaban permitidas, y tanto la aspiración de trombos como los inhibidores de los receptores IIB-IIIA eran obligatorios. En el estudio de Gu et al. se permitió pre y posdilatación y el uso de la trombectomía y de los inhibidores IIB-IIIA se dejó a criterio del operador. De hecho, se predilató a > 80% de los pacientes de los 2 grupos, se posdilató a casi el 40%, se llevó a cabo tromboaspiración solo en el 20% y se administraron inhibidores IIB-IIIA al 70% de los pacientes. En nuestra opinión, el protocolo de Gu et al. favoreció la validez externa, pero esos 4 factores podrían haber influido en los resultados de forma muy notable, especialmente al no haberse hecho ningún ajuste con análisis multivariante. Por último, el TIMI frame count utilizado en su estudio y el BM no son el mismo concepto y la resolución del segmento ST no se analizó en la serie de Gu et al. En su estudio tampoco se observó ninguna diferencia en los resultados entre ambas estrategias
Como se ha mencionado, no pudimos demostrar que la velocidad de desinflado del sistema de liberación del stent influyera en el BM. En el análisis multivariante los niveles de presión arterial al ingreso, el aclaramiento de creatinina y el diámetro luminal máximo fueron predictores de BM; por otro lado, la historia previa de hipertensión probablemente habría alcanzado significación estadística con una muestra de mayor tamaño. Anteriores estudios han demostrado la influencia de la presión arterial en el BM22. Además, los pacientes hipertensos al tener mayor resistencia microvascular tienen menor MBr22. En un trabajo previo se indica que el aumento delos eventos cardiovasculares causados por la insuficiencia renal podría estar mediado por una mayor resistencia microvascular23. La demora en la realización de la angioplastia primaria también influyó en el BM en estudio previos24. En nuestra cohorte se observaron diferencias significativas en el análisis univariante pero esta variable fue excluida en el último paso del análisis multivariante; sin embargo, probablemente habría estado presente en el modelo final con una muestra de mayor tamaño. En cualquier caso, comparando nuestra serie con el estudio descrito anteriormente, se analizó el tamaño del vaso como predictor del BM, variable que no se analizó en el estudio de Luca y que sí tuvo un papel importante en trabajosprevios25.
De la misma forma, la velocidad de desinflado del sistema de liberación del stent no demostró influencia en la RST. Se encontraron hasta 6 factores predictores, la mayoría de ellos ya descritos en anteriores estudios. La circulación colateral, al limitar la isquemia en el infarto de miocardio, también reduce el impacto de la ICPp sobre la RST26. Por otra parte, infartos anteriores con lesión en la descendente anterior también mostraron tener influencia en la resolución del segmento ST en cohortes previas27-29. Otros factores como el flujo TIMI ≥ 2 preintervención, grado de flujo TIMI < 3 posintervención14,27,28,30 y la presencia de diabetes también demostraron su influencia en estudios previos14,28. Finalmente, en nuestra serie, el infarto de miocardio previo fue un predictor de la RST, aunque no encontramos ninguna explicación para este hallazgo.
Limitaciones
El estudio se interrumpió por el análisis intermedio debido a futilidad. No obstante, no esperamos que los resultados en objetivos primarios fuesen diferentes de haberse completado la muestra. Es posible que hubiésemos hallado más predictores y un mayor poder predictivo en los modelos BM y RST, pero este no fue el objetivo de nuestro estudio. El perfil de riesgo de los pacientes fue bajo porque los criterios de inclusión de implante directo del stent, uso de inhibidores IIB-IIIA y trombectomía centraron el estudio en lesiones más comúnmente asociadas a pacientes más jóvenes con menos riesgo hemorrágico y menos calcificación, características que se asocian a mejores resultados. Este hecho limita la validez externa del estudio porque, tal y como muestra la figura 1, apenas el 50% de los pacientes no fueron aptos para participar y podría haber contribuido a la falta de diferencias descrita entre los grupos del estudio. No obstante, como ya se ha explicado, el propósito del protocolo tan estricto fue evitar cualquier posible factor de confusión. El clopidogrel fue el inhibidor del receptor plaquetario P2Y12 durante el primer contacto médico según el protocolo de la red de infarto de miocardio regional de nuestra zona, circunstancia que podría limitar, también, la validez externa de los resultados. Aunque el blush miocárdico fue valorado visualmente por 2 operadores experimentados, no puede descartarse cierto grado de subjetividad. El potencial predictivo del BM y de la RST fue bajo, aunque esto es algo que también se ha visto en series previas28 describiéndose la concordancia entre ambos factores como moderada31. Por último, no hallamos ninguna explicación para el papel que juega el infarto de miocardio previo a la hora de predecir la RST pues es un factor que no estuvo presente en anteriores series.
CONCLUSIONES
En nuestra serie, la velocidad de desinflado del sistema de liberación del stent en la angioplastia primaria no influyó en el blush miocárdico, la resolución del segmento ST ni en los resultados clínicos, el tamaño del infarto de miocardio por biomarcadores ni en la fracción de eyección al alta y a los 12 meses.
FINANCIACIÓN
Este estudio ha sido financiado por una beca de investigación de Abbott Laboratories.
CONTRIBUCIÓN DE LOS AUTORES
B. Vega, J. M. Vegas, J. Rondan, E. Segovia y Í. Lozano: diseño, recopilación de datos, redacción y revisión del manuscrito. A. Pérez de Prado, C. Cuellas-Ramon, M. López-Benito, T. Benito-González y F. Hernández-Vázquez: mediciones del blush miocárdico y revisión del manuscrito.
CONFLICTO DE INTERESES
Los autores no han declarado ningún conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- Tanto la embolización distal como un flujo coronario lento suelen reducir el éxito de la angioplastia primaria.
- Se han estudiado ya varias intervenciones, pero este sigue siendo un campo objeto de debate porque las estrategias que dieron resultados positivos al principio como el implante directo de stent, la aspiración de trombos y el uso de bloqueadores beta e inhibidores de la glucoproteína IIB-IIIA ahora se ponen en duda.
- Ha quedado demostrado que la dilatación agresiva del balón con una relación balón/arteria alta favorece el fenómeno de no-reflow. También se ha especulado con la posibilidad de que la velocidad de desinflado del sistema de liberación del stent podría influir en los resultados, aunque todavía hay poca información al respecto.
¿QUÉ APORTA DE NUEVO?
- Nuestro objetivo es analizar la velocidad de desinflado del sistema de liberación del stent para comprobar si influye en el blush miocárdico, en la resolución del segmento ST en fase aguda, en el pronóstico y en la fracción de eyección a los 12 meses.
- El estudio se interrumpió prematuramente por cuestiones de futilidad porque la velocidad de desinflado del sistema de liberación del stent no alteró los objetivos primarios ni influyó, en modo alguno, en el tamaño del infarto ni en el pronóstico, así como tampoco en la fracción de eyección a los 12 meses.
BIBLIOGRAFÍA
1. Ito H, Tomooka T, Sakai N, et al. Lack of myocardial perfusion immediately after successful thrombolysis. A predictor of poor recovery of left ventricular function in anterior myocardial infarction. Circulation. 1992;85:1699-1705.
2. Mahmoud KD, Jolly SS, James S, et al. Clinical impact of direct stenting and interaction with thrombus aspiration in patients with ST-segment elevation myocardial infarction undergoing percutaneous coronary intervention:Thrombectomy Trialists Collaboration. Eur Heart J. 2018;39:2472-2479.
3. Frobert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med. 2013;369:1587-1597.
4. Jolly SS, Cairns JA, Yusuf S, et al. Outcomes after thrombus aspiration for ST elevation myocardial infarction:1-year follow-up of the prospective randomised TOTAL trial. Lancet. 2016;387:127-135.
5. Roolvink V, Ibanez B, Ottervanger JP, et al. Early Intravenous Beta-Blockers in Patients With ST-Segment Elevation Myocardial Infarction Before Primary Percutaneous Coronary Intervention. J Am Coll Cardiol. 2016;67:2705-2715.
6. Ellis SG, Tendera M, de Belder MA, et al. Facilitated PCI in patients with ST-elevation myocardial infarction. N Engl J Med. 2008;358:2205-2217.
7. Konijnenberg LSF, Damman P, Duncker DJ, et al. Pathophysiology and diagnosis of coronary microvascular dysfunction in ST-elevation myocardial infarction. Cardiovasc Res. 2020;116:787-805.
8. Dong M, Mu N, Guo F, et al. The beneficial effects of postconditioning on no-reflow phenomenon after percutaneous coronary intervention in patients with ST-elevation acute myocardial infarction. J Thromb Thrombolysis. 2014;38:208-214.
9. Li R, Zijlstra JG, Kamps JA, van Meurs M, Molema G. Abrupt reflow enhances cytokine-induced proinflammatory activation of endothelial cells during simulated shock and resuscitation. Shock. 2014;42:356-364.
10. Perez de Prado A, Fernandez-Vazquez F, Cuellas-Ramon JC, Iglesias-Garriz I. Coronary clearance frame count:a new index of microvascular perfusion. J Thromb Thrombolysis. 2005;19:97-100.
11. Sianos G, Papafaklis MI, Daemen J, et al. Angiographic stent thrombosis after routine use of drug-eluting stents in ST-segment elevation myocardial infarction:the importance of thrombus burden. J Am Coll Cardiol. 2007;50:573-583.
12. Rentrop KP, Cohen M, Blanke H, Phillips RA. Changes in collateral channel filling immediately after controlled coronary artery occlusion by an angioplasty balloon in human subjects. J Am Coll Cardiol. 1985;5:587-592.
13. Suzuki N, Asano T, Nakazawa G, et al. Clinical expert consensus document on quantitative coronary angiography from the Japanese Association of Cardiovascular Intervention and Therapeutics. Cardiovasc Interv Ther. 2020;35:105-116.
14. Farkouh ME, Reiffel J, Dressler O, et al. Relationship between ST-segment recovery and clinical outcomes after primary percutaneous coronary intervention:the HORIZONS-AMI ECG substudy report. Circ Cardiovasc Interv. 2013;6:216-223.
15. Fabris E, van 't Hof A, Hamm CW, et al. Clinical impact and predictors of complete ST segment resolution after primary percutaneous coronary intervention:A subanalysis of the ATLANTIC Trial. Eur Heart J Acute Cardiovasc Care. 2019;8:208-217.
16. Fregni F. Sample Size Calculation. Clinical Thinking in Clinical Research:Applied Theory and Practice Using Case Studies. New York:Oxford University Press. 2018:225-242.
17. Gu J, Zhuo Y, Liu TJ, et al. Balloon Deflation Strategy during Primary Percutaneous Coronary Intervention in Acute ST-Segment Elevation Myocardial Infarction:A Randomized Controlled Clinical Trial and Numerical Simulation-Based Analysis. Cardiol Res Pract. 2020;2020:4826073.
18. Loubeyre C, Morice MC, Lefevre T, Piechaud JF, Louvard Y, Dumas P. A randomized comparison of direct stenting with conventional stent implantation in selected patients with acute myocardial infarction. J Am Coll Cardiol. 2002;39:15-21.
19. Lemesle G, Sudre A, Bouallal R, et al. Impact of thrombus aspiration use and direct stenting on final myocardial blush score in patients presenting with ST-elevation myocardial infarction. Cardiovasc Revasc Med. 2010;11:149-154.
20. Sardella G, Mancone M, Nguyen BL, et al. The effect of thrombectomy on myocardial blush in primary angioplasty:the Randomized Evaluation of Thrombus Aspiration by two thrombectomy devices in acute Myocardial Infarction (RETAMI) trial. Catheter Cardiovasc Interv. 2008;71:84-91.
21. G DEL, Bellandi F, Huber K, et al. Early glycoprotein IIb-IIIa inhibitors in primary angioplasty-abciximab long-term results (EGYPT-ALT) cooperation:individual patient's data meta-analysis. J Thromb Haemost. 2011;9:2361-2370.
22. Marra MP, Corbetti F, Cacciavillani L, et al. Relationship between myocardial blush grades, staining, and severe microvascular damage after primary percutaneous coronary intervention a study performed with contrast-enhanced magnetic resonance in a large consecutive series of patients. Am Heart J. 2010;159:1124-1132.
23. Bajaj NS, Singh A, Zhou W, et al. Coronary Microvascular Dysfunction, Left Ventricular Remodeling, and Clinical Outcomes in Patients With Chronic Kidney Impairment. Circulation. 2020;141:21-33.
24. De Luca G, van 't Hof AW, de Boer MJ, et al. Time-to-treatment significantly affects the extent of ST-segment resolution and myocardial blush in patients with acute myocardial infarction treated by primary angioplasty. Eur Heart J. 2004;25:1009-1013.
25. Ng VG, Lansky AJ, Toro S, et al. Prognostic utility of myocardial blush grade after PCI in patients with NSTE-ACS:Analysis from the ACUITY trial. Catheter Cardiovasc Interv. 2016;88:215-224.
26. Bottner RK, Morea CJ, Green CR, Renzi RH, Kent KM, Krucoff MW. Quantitation of ischemia during total coronary occlusion with computer-assisted high resolution ST-segment monitoring:effect of collateral flow. J Electrocardiol. 1987;20 Suppl:104-106.
27. Brodie BR, Stuckey TD, Hansen C, et al. Relation between electrocardiographic ST-segment resolution and early and late outcomes after primary percutaneous coronary intervention for acute myocardial infarction. Am J Cardiol. 2005;95:343-348.
28. Verouden NJ, Haeck JD, Kuijt WJ, et al. Clinical and angiographic predictors of ST-segment recovery after primary percutaneous coronary intervention. Am J Cardiol. 2010;105:1692-1697.
29. Lefevre T, Garcia E, Reimers B, et al. X-sizer for thrombectomy in acute myocardial infarction improves ST-segment resolution:results of the X-sizer in AMI for negligible embolization and optimal ST resolution (X AMINE ST) trial. J Am Coll Cardiol. 2005;46:246-252.
30. De Luca G, Ernst N, van 't Hof AW, et al. Preprocedural Thrombolysis in Myocardial Infarction (TIMI) flow significantly affects the extent of ST-segment resolution and myocardial blush in patients with acute anterior myocardial infarction treated by primary angioplasty. Am Heart J. 2005;150:827-831.
31. Brener SJ, Dizon JM, Mehran R, et al. Complementary prognostic utility of myocardial blush grade and ST-segment resolution after primary percutaneous coronary intervention:analysis from the HORIZONS-AMI trial. Am Heart J. 2013;166:676-683.
* Autor para correspondencia: Servicio de Cardiología, Hospital de Cabueñes, Avenida Los Prados 395, 33203 Gijón, España.
Correo electrónico: inigo.lozano@gmail.com (Í. Lozano).