Resumen
Introducción y objetivos: La evidencia del beneficio en el pronóstico a largo plazo de los stents farmacoactivos (SFA) de nueva generación es limitada, en especial en los pacientes con angioplastia primaria. El objetivo de este trabajo fue comparar el impacto en el pronóstico a largo plazo de la implantación de SFA frente a stents metálicos (SM) en pacientes del mundo real tratados con angioplastia primaria.
Métodos: Estudio de cohortes en el que incluyeron 1.499 pacientes ingresados de forma consecutiva con diagnóstico de infarto agudo de miocardio con elevación del segmento ST y sometidos a angioplastia primaria entre enero de 2008 y diciembre de 2015. El 24,9% recibió un SFA. Mediante un análisis de emparejamiento por puntuación de propensión se obtuvieron 2 grupos de 262 pacientes emparejados según la implantación de SFA o SM.
Resultados: Durante el seguimiento (mediana de 1.015 días), los pacientes que recibieron SFA tuvieron tasas más bajas de mortalidad por todas las causas (6,5 frente a 12,2%; p = 0,049), así como en el objetivo combinado de eventos adversos mayores (16,4 frente a 25,2%; p = 0,049) y un objetivo combinado orientado al paciente que incluía muerte por cualquier causa, infarto de miocardio y revascularización en el seguimiento (12,6 frente a 22,5%; p = 0,017). No se observaron diferencias en cuanto a trombosis definitiva del stent.
Conclusiones: En nuestro registro, en una población del mundo real de pacientes consecutivos tratados con ICP primaria, la utilización de SFA frente a SM se asoció a una mayor supervivencia y una reducción de los eventos clínicos en el seguimiento a largo plazo, sin observar diferencias en la trombosis del stent.
Palabras clave: Stent farmacoactivo. Stent metálico. Angioplastia primaria. Infarto agudo de miocardio con elevación del segmento ST.
Abstract
Introduction and objectives: Evidence of the long-term prognostic benefit of new generation drug-eluting stents (DES) is limited, especially in the context of primary percutaneous coronary interventions. The goal of this study was to compare the long-term prognostic impact of the implantation of DESs versus bare-metal stents (BMSs) in real-world patients undergoing primary percutaneous coronary interventions.
Methods: A cohort study was conducted with 1499 consecutive patients diagnosed with ST-segment elevation myocardial infarction who underwent percutaneous coronary interventions between January 2008 and December 2015. A total of 24.9% of the patients received a DES. A matched propensity score analysis yielded 2 groups of 262 matched patients depending on whether they were treated with a DES or a BMS.
Results: During follow-up (median 1015 days), the patients who received DES had a lower all-cause mortality rate (6.5% vs 12.2%; P = .049) a lower composite endpoint of major adverse cardiac events (16.4% vs 25.2%; P = .049) and a lower patient-oriented composite endpoint of death from any cause, myocardial infarction and revascularization at follow-up (12.6% vs 22.5%; P = .017). No differences were seen in the definite stent thrombosis rate.
Conclusions: In our registry, in a real-world population of consecutive patients undergoing primary percutaneous coronary interventions, the use of DES versus BMS associated more survival and less clinically significant major adverse cardiac events and patient-oriented composite endpoints in a long-term follow-up, without any differences in stent thrombosis.
Keywords: Drug-eluting stent. Bare-metal stent. Primary PCI. ST-segment elevation myocardial infarction.
Abreviaturas: SM: stent metálico. SFA: stent farmacoactivo. MACE: episodios adversos cardiovasculares graves. ICP: intervención coronaria percutánea. IAMCEST: infarto agudo de miocardio con elevación del segmento ST.
Introducción
La intervención coronaria percutánea (ICP) es el tratamiento estándar para el abordaje del infarto agudo de miocardio con elevación del segmento ST (IAMCEST). Los stents farmacoactivos (SFA) de primera generación lograron reducir la reestenosis y la necesidad de nuevas intervenciones comparados con los stents metálicos (SM)1,2. No obstante, las tasas más altas de trombosis tardía3, mortalidad e infarto4 encienden la polémica en lo que respecta a la sobreimplantación de estos dispositivos en pacientes que sufren un IAMCEST, una población con un mayor riesgo identificado de trombosis del stent5.
Los SFA de segunda generación con struts más finos, polímeros biocompatibles y propiedades tromborresistentes resultaron ser seguros y más efectivos que los SFA de primera generación y que los SM tradicionales, sobre todo, con descensos más marcados de la reestenosis angiográfica y las revascularizaciones no programadas de la lesión diana o la arteria no causante6. Las actuales guías de práctica clínica para el tratamiento del IAMCEST recomiendan el uso de SF de nueva generación7.
En un análisis conjunto de los ensayos clinicos EXAMINATION y COMFORTABLE-AMI que llevaron a cabo una comparativa entre SFA de nueva generación y SM, el uso de un SFA se asoció a mayor seguridad y eficacia al cabo de un año8. En el seguimiento a 2 años que se hizo de pacientes incluidos en el COMFORTABLE-AMI, el uso de SFA se asoció a un descenso del objetivo compuesto de mortalidad por cualquier causa, infarto de miocardio durante el seguimiento y nuevas revascularizaciones9. Los resultados del seguimiento a 5 años del estudio EXAMINATION10, que llevó a cabo una comparativa entre stents liberadores de everolimus y SM, reveló que los SFA de nueva generación se asociaron a una mayor supervivencia y a menos infartos de miocardio durante el seguimiento6.
Nuestro objetivo fue analizar el impacto pronóstico a largo plazo de SFA de nueva generación en una población de pacientes con IAMCEST del mundo real.
Métodos
Población del estudio
Este es un estudio retrospectivo y observacional que incluyó (n = 1.499) a todos los pacientes consecutivos ingresado tras sufrir un IAMCEST y sometidos a una intervención coronaria percutánea (ICP) en nuestro hospital entre enero de 2008 y diciembre de 2015. Aquellos pacientes a quienes no se les implantó un stent durante la intervención coronaria percutánea (n = 131) y aquellos con un armazón bioabsorbible (n = 11) fueron excluidos. En el 24,9% de los pacientes (n = 374), la ICP se realizó con implantación de un SFA en la arteria responsable del infarto.
La ICP se realizó siguiendo las guías de la Sociedad Europea de Cardiología7,11 y la decisión de implantar un SFA o un SM quedó a discreción de los criterios clínicos del cardiólogo intervencionista responsable. El tratamiento antiplaquetario consisitió en ácido acetilsalicílico y un inhibidor del P2Y12 (clopidogrel durante los primeros años y, más recientemente, ticagrelor y prasugrel).
Un cardiólogo recogió todos los datos demográficos, clínicos, ecocardiográficos, de las angiografías coronarias y de laboratorio en una base de datos informatizada. Tanto el material utilizado durante la ICP como las características de la intervención fueron incluidos en el momento en que se realizó la ICP por el especialista en hemodinámica y el operador asistente. El seguimiento estructurado se llevó a cabo con el sistema de historia clínica electrónica IANUS (el único disponible y obligatorio en Galicia, España). Los episodios se adjudicaron de manera independiente, por dos cardiólogos intervencionista y, en situaciones de desacuerdo, por un tercer cardiólogo.
Definiciones
Los diagnósticos de IAMCEST e infarto de miocardio se establecieron según las actuales guías7,12. El tiempo de isquemia se definió como el tiempo transcurrido entre la aparición de síntomas y la reperfusión (el paso de la guía a través de la arteria culpable durante la realización de la ICP). La revascularización tanto del vaso como de la lesión diana se definieron atendiendo a los criterios establecidos por el Consorcio de Investigación Académica (ARC)13.
Los episodios cardiovasculares adversos graves (MACE) incluyeron mortalidad por cualquier causa, infarto agudo de miocardio, insuficiencia cardiaca que requirió hospitalización y la realización de nuevas revascularizaciones no programadas. Siguiendo las recomendaciones del ARC para el estudio del pronóstico del stent, se incluyó un objetivo combinado orientado al paciente (POCE) de muerte por cualquier causa, infarto de miocardio o nuevas revascularizaciones no programadas13. El objetivo combinado orientado al dispositivo (DOCE) incluyó muerte cardiaca, infarto de miocardio en el vaso diana y revascularización de la lesión diana inducida por isquemia. Se consideró trombosis definitiva del stent a la demostrada angiográficamente.
Objetivos del estudio
El principal objetivo de este estudio fue comparar el pronóstico a largo plazo de la revascularización con SFA frente a SM en pacientes consecutivos ingresados por un cuadro de IAMCEST y sometidos a una ICP. Los resultados clínicos se evaluaron basándose en la mortalidad por cualquier causa y en un objetivo compuesto e individual de MACE, POCE y DOCE. El seguimiento medio fue de 1.015 días y el rango intercuartílico se situó entre los 400 y 1.800 días.
Análisis estadístico
Las diferencias en el análisis descriptivo se evaluaron usando, para ello, la prueba para calcular la diferencia entre las medianas (prueba de la t de Student) y la prueba de X2 de comparación de proporciones, dependiendo de si la variable era continua o categórica. Para minimizar el sesgo implícito al estudiar el efecto pronóstico de los SFA frente a los SM, desde un punto de vista observacional, se llevó a cabo un análisis de emparejamiento por puntuación de propensión. Las variables incluidas en el modelo fueron la edad, el sexo, el índice de masa corporal, la hipertensión arterial, la diabetes, la dislipemia, el tabaquismo, la cardiopatía isquémica, el tiempo de isquemia, la localización del infarto, la arteria culpable del infarto, el uso de inhibidores de la glucoproteína IIb/IIIa, el número de vasos enfermos, la tasa de filtrado glomerular, los niveles de creatinina en el momento del ingreso hospitalario, los valores máximos de troponina I, la hemoglobina, la glucosa, la frecuencia cardiaca, la presión arterial sistólica, la clase Killip, la fracción de eyección del ventrículo izquierdo, las escalas GRACE y CRUSADE y el año de inclusión en el análisis. Un análisis del factor de inflación de la varianza no reveló ningún problema de multicolinealidad en las variables utilizadas (factor de inflación de la varianza 1,56 y ninguna variable > 4). El calibrador utilizado fue de 0,25 y la relación sensibilidad-especificidad obtenida fue alta (área bajo la curva del 75%). Ninguna variable presentó un sesgo importante, siendo el sesgo medio del 3,3%. Tras el análisis de emparejamiento por puntuación de propensión, no se observó ninguna diferencia estadísticamente relevante en ninguna de las variables analizadas.
Los gráficos de la figura 1 y figura 2 muestran el estimador de Nelson-Aalen de la hazard ratio acumulada, y las diferencias se evaluaron usando la prueba de log-rank. Se calculó usando al análisis de regresión univariado de Cox.
El análisis estadístico se llevó a cabo usando los paquetes estadísticos STATA 14 y SPSS 22.0.
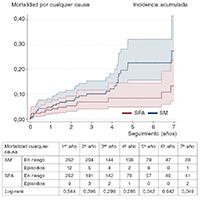
Figura 1. Curvas de incidencia acumulada para la supervivencia. SFA: stent farmacoactivo; SM: stent metálico.
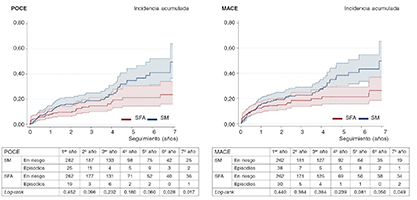
Figura 2. Curvas de incidencia acumulada para supervivencia libre de POCE y MACE. MACE: episodios cardiovasculares adversos graves; POCE: objetivo combinado orientado al paciente; SFA: stent farmacoactivo; SM: stent metálico.
Resultados
Características basales
La cohorte del estudio incluyó a 1.357 pacientes; 983 recibieron SM y 374 SFA. Los pacientes del grupo que recibió SFA eran más jóvenes, había más varones, su índice de masa corporal era más alto y las puntuaciones de la escala CRUSADE arrojaban un mayor riesgo hemorrágico. Los pacientes revascularizados con SM solían presentar infartos de la pared anterior, niveles más bajos de hemoglobina y una peor función renal. La longitud total de los stents implantados era mayor en el grupo de pacientes que recibió SFA y el diámetro de los stents era mayor en el grupo de pacientes implantados con SM. No se observaron diferencias significativas en ningún otro factor de riesgo cardiovascular, tiempo de isquemia, valores máximos de troponina, estado hemodinámico, clase Killip en el momento del ingreso hospitalario, fracción de eyección del ventrículo izquierdo, puntuación en la escala GRACE, número de lesiones tratadas, número de stents utilizados ni en el tratamiento farmacológico en el momento del alta hospitalaria, a excepción del tratamiento antiagregante plaquetario (tabla 1).
El estudio de cohorte con análisis de emparejamiento por puntuación de propensión incluyó a 262 pacientes de cada pareja, que no presentaban diferencias significativas en ninguna de las variables mencionadas (tabla 1).
Tabla 1. Características basales de la cohorte global y la cohorte analizada mediante emparejamiento por puntuación de propensión
| Cohorte global | Cohorte analizada mediante emparejamiento por puntuación de propensión | |||||
| SM | SFA | p | SM | SFA | p | |
| (n = 983) | (n = 374) | (n = 262) | (n = 262) | |||
| Demografía | ||||||
| Edad (años) | 65 (14) | 62 (12) | <0,001 | 62 (14) | 63 (12) | 0,847 |
| Sexo (varón) | 76,5% | 81,6% | 0,037 | 80,9% | 81,3% | 0,911 |
| IMC (kg/m2) | 28 (4) | 29 (4) | 0,039 | 28 (4) | 29 (4) | 0,981 |
| Historia personal | ||||||
| Hipertensión | 48,3% | 49,5% | 0,707 | 50,8% | 49,6% | 0,794 |
| Diabetes mellitus | 19,9% | 28,6% | 0,001 | 26,0% | 24,8% | 0,764 |
| Dislipemia | 46,6% | 54,3% | 0,012 | 51,1% | 51,9% | 0,862 |
| Tabaquismo | 49,5% | 48,1% | 0,642 | 49,6% | 49,6% | 1 |
| Cardiopatía isquémica | 9,6% | 11,5% | 11,5% | 11,8% | 11,5% | 0,892 |
| Datos ICP | ||||||
| Tiempo de isquemia (min) | 271 (202) | 289 (232) | 0,227 | 291 (215) | 279 (222) | 0,549 |
| Localización en pared anterior | 41,6% | 25,9% | <0,001 | 32,4% | 31,3% | 0,779 |
| Arteria culpable del infarto | 0,033 | 0,130 | ||||
| ADAI | 40,5% | 42,8% | 40,8% | 38,2% | ||
| Cx/td> | 15,4% | 18,5% | 17,2% | 20,2% | ||
| ACD | 43,2% | 36,4% | 42,0% | 39,3% | ||
| TCI | 0,7% | 1,6% | - | 1,2% | ||
| Número vasos enfermos | 0,626 | 0,696 | ||||
| Dos vasos | 28,1% | 27,0% | 28,2% | 25,2% | ||
| Tres vasos | 14,8% | 16,8% | 13,4% | 14,9% | ||
| Número de lesiones tratadas | 0,387 | 0,537 | ||||
| 1 | 93,9% | 92,8% | 95,0% | 93,5% | ||
| 2 | 5,3% | 6,2% | 5,0% | 5,7% | ||
| 3 | 0,8% | 0,8% | - | 0,4% | ||
| Flujo de grado TIMI pre-ICP | 0,380 | 0,982 | ||||
| 0 | 80,9% | 80,8% | 83,6% | 83,2% | ||
| 1 | 4,7% | 2,9% | 3,1% | 2,7% | ||
| 2 | 7,5% | 9,4% | 7,2% | 8,0% | ||
| 3 | 6,9% | 7,0% | 6,1% | 6,1% | ||
| Flujo de grado TIMI post-ICP | 0,262 | 0,917 | ||||
| 0 | 0,9% | 0,8% | 1,2% | 1,2% | ||
| 1 | 0,9% | 0,5% | 0,8% | 0,8% | ||
| 2 | 2,8% | 1,1% | 1,9% | 1,2% | ||
| 3 | 98,4% | 97,6% | 96,2% | 97,5% | ||
| Uso de inhibidores de la glucoproteína IIb/III | ||||||
| Trombectomía | 68,8% | 69,0% | 0,939 | 73,3% | 72,5% | 0,845 |
| Número de stents | 0,619 | 0,192 | ||||
| 1 | 71,4% | 67,9% | 70,6% | 69,1% | ||
| 2 | 22,6% | 24,3% | 21,8% | 24,4% | ||
| 3 | 4,6% | 6,4% | 5,0% | 5,7% | ||
| 4 | 1,0% | 0,8% | 2,7% | 0,4% | ||
| 5 | 0,3% | 0,5% | – | 0,4% | ||
| 6 | 0,1% | – | – | – | ||
| Parámetros de laboratorio | ||||||
| TFG (ml/min) | 83 (37) | 97 (38) | < 0,001 | 96 (44) | 93 (35) | 0,378 |
| Valores de creatinina (mg/dl) | 1,1 (0,6) | 0,9 (0,6) | 0,001 | 1,0 (0,6) | 1,0 (0,6) | 0,752 |
| Valores máximos de troponina I (ng/ml) | 107 (133) | 105 (113) | 0,747 | 111 (127) | 108 (113) | 0,769 |
| Hemoglobina (g/dl) | 14,3 (1,8) | 14,6 (2,9) | 0,018 | 12,4 (1,6) | 14,4 (1,7) | 0,860 |
| Glucosa (mg/dl) | 170 (87) | 174 (115) | 0,552 | 169 (79) | 166 (81) | 0,662 |
| Datos clínicos | ||||||
| Frecuencia cardiaca (lpm) | 77 (21) | 76 (19) | 0,339 | 74 (19) | 75 (19) | 0,639 |
| PAS (mmHg) | 128 (29) | 130 (29) | 0,209 | 132 (25) | 129 (29) | 0,320 |
| Clase Killip | 0,379 | 0,731 | ||||
| Clase I | 82,7% | 84,0% | 87,4% | 88,6% | ||
| Clase II | 6,3% | 7,2% | 4,6% | 5,7% | ||
| Clase III | 2,9% | 1,3% | 2,7% | 1,5% | ||
| Clase IV | 8,1% | 7,5% | 5,3% | 6,1% | ||
| FEVI (%) | 51 (12) | 52 (11) | 0,200 | 52 (11) | 52 (10) | 0,699 |
| Escala GRACE | 162 (46) | 158 (78) | 0,432 | 152 (40) | 153 (41) | 0,785 |
| Escala CRUSADE | 27 (18) | 22 (14) | < 0,001 | 21 (14) | 22 (13) | 0,581 |
| Tratamiento tras el alta hospitalaria | ||||||
| Ácido acetilsalicílico | 99,0% | 99,5% | 0,401 | 99,6% | 99,2% | 0,563 |
| Inhibidor del P2Y12 | < 0,001 | 0,126 | ||||
| Clopidogrel | 88,2% | 59,6% | 69,1% | 73,3% | ||
| Prasugrel | 5,19% | 15,1% | 11,5% | 13,7% | ||
| Ticagrelor | 5,74% | 24,7% | 19,5% | 12,6% | ||
| Bloqueadores beta | 87,8% | 89,5% | 0,754 | 84,4% | 88,8% | 0,132 |
| Inhibidor de la ECA | 81,0% | 84,3% | 0,247 | 80,9% | 83,8% | 0,381 |
| Estatinas | 97,4% | 97,8% | 0,282 | 98,1% | 96,9% | 0,514 |
ACD: arteria coronaria derecha; ACI: arteria coronaria izquierda; ADAI: arteria descendente anterior izquierda; Cx: arteria circunfleja; ECA: enzima de conversión de la angiotensina; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; SFA: stent farmacoactivo; SM: stent metálico; TCI: tronco coronario izquierdo; TGF: tasa de filtrado glomerular; TIMI: Thrombolysis in Myocardial Infarction. | ||||||
Episodios durante el seguimiento
Los episodios que sobrevinieron durante el seguimiento se muestran en la tabla 2. La tasa de mortalidad global fue del 16,9% (n = 205). En toda la cohorte del estudio, el implante de un SFA se asoció a un menor riesgo de mortalidad por cualquier causa (6,9 frente al 12,2%; prueba de log-rank, p < 0,001); El objetivo compuesto de MACE y POCE también fue menos frecuente en pacientes implantados con SFA. No se observó ninguna diferencia en el DOCE, la mortalidad cardiovascular, el infarto de miocardio, el infarto de miocardio en el vaso diana, la revascularización del vaso diana, la revascularización de la lesión diana ni en la revascularización de cualquier otro vaso. Tampoco se observó diferencia en la trombosis definitiva del stent durante el seguimiento.
Tabla 2. Episodios adversos durante el seguimiento
| Cohorte global | Cohorte analizada mediante emparejamiento por puntuación de propensión | |||||
| SM | SFA | Prueba de log rank valor p | SM | SFA | Prueba de log rank p | |
| (n = 983) | (n = 374) | (n = 262) | (n = 262) | |||
| Muerte por cualquier causa | 18,3% (180) | 6,7% (25) | 0,001 | 12,2% (32) | 6,5% (17) | 0,049 |
| MACE | 33,2% (326) | 16,0% (60) | 0,001 | 25,2% (66) | 16,4% (43) | 0,049 |
| POCE | 28,0% (275) | 13,1% (49) | 0,004 | 22,5% (59) | 12,6% (33) | 0,017 |
| DOCE | 10,0% (98) | 5,9% (22) | 0,706 | 10,6% (28) | 7,3% (19) | 0,764 |
| Mortalidad cardiovascular | 3,76% (37) | 1,87% (7) | 0,860 | 2,7% (7) | 3,8% (10) | 0,409 |
| IM durante el seguimiento | 5,3% (52) | 2,1% (8) | 0,437 | 5,0% (13) | 2,7% (7) | 0,243 |
| IM diana durante el seguimiento | 2,0% (20) | 0,8% (3) | 0,765 | 2,3% (6) | 1,1% (3) | 0,713 |
| Insuficiencia cardiaca | 4,0% (39) | 3,5% (13) | 0,97 | 3,1% (8) | 3,4% (9) | 0,759 |
| RVD | 6,7% (66) | 4,0% (15) | 0,435 | 8,4% (22) | 4,6% (12) | 0,114 |
| RLD | 6,2% (61) | 4,0% (15) | 0,664 | 7,6% (20) | 4,6% (12) | 0,199 |
| Trombosis definitiva | 3,7% (36) | 2,7% (10) | 0,973 | 2,7% (7) | 1,9% (5) | 0,686 |
DOCE: objetivo combinado orientado al dispositivo; IM: infarto de miocardio; MACE: episodios cardiovasculares adversos graves; POCE: objetivo combinado orientado al paciente; RLD: revascularización de la lesión diana; RVD: revascularización del vaso diana; SFA: stent farmacoactivo; SM: stent metálico. | ||||||
En el estudio de cohorte de análisis de emparejamiento por puntuación de propensión, los pacientes que recibieron un SFA tuvieron una tasa mucho menor de mortalidad por cualquier (6,7 frente a 18,3%; prueba de log-rank, p < 0,001) y tasas más bajas de incidencia de MACE y POCE durante el seguimiento (16,8% frente a 25,6%, prueba de log-rank, p < 0,049; 12,6% frente a 22,5%, prueba de log-rank, p < 0,017, respectivamente). La revascularización del vaso diana (4,6 frente a 8,4%) y la revascularización de la lesión diana (4,6 frente a 7,6%) mostraron una tendencia a caer, sin relevancia estadística. El DOCE fue numéricamente más bajo en el grupo que recibió SFA. No se observaron diferencias en la mortalidad cardiovascular, infarto de miocardio, infarto de miocardio en el vaso diana ni revascularización de cualquier otro vaso. Las curvas de supervivencia revelaron que ambos grupos fueron separándose, con el paso del tiempo, con respecto al principio del seguimiento, estas diferencias eran significativas tras cinco años de seguimiento (figura 1). Las curvas de incidencia acumulada para MACE y POCE (figura 2) revelan un patrón similar, aunque estas diferencias eran estadísticamente significativas tras seis años de seguimiento en MACE y POCE. Por último, no se observó ninguna diferencia significativa en la tasa de trombosis definitiva del stent, ambos grupos tasas bajas del 2,7% en el grupo SM y 1,9% en el grupo SFA (prueba de log-rank, p < 0,686).
Discusión
Los resultados de este estudio vienen a confirmar que en una población del mundo real de pacientes consecutivos con IAMCEST sometidos a ICP, el uso de SFA de nueva generación se asoció a tasas más bajas tanto de mortalidad global como de MACE y POCE a largo plazo, sin que se observara ninguna en la tasa de incidencia de trombosis definitiva del stent. El efecto protector de los SFA se mantuvo en los análisis de cohorte guiados por análisis de emparejamiento por puntuación de propensión, donde ambos subgrupos tuvieron distribuciones similares de covariadas.
Nuestros resultados indican que el uso de SFA de nueva generación en la ICP de pacientes con IAMCEST se asoció con un beneficio pronóstico sobre los SM indicativo de que los SFA de primera generación podrían llegar a ser el abordaje de primera opción en estos pacientes, lo cual coincide con las actuales recomendaciones de las guías de práctica clínica11.
En nuestro estudio, vimos un descenso de la mortalidad por todas las causas en el grupo de pacientes revascularizados con SFA, sin observar diferencia en la mortalidad cardiovascular. En lo que respecta a la reducción de la tasa de mortalidad global el efecto protector de los SFA no puede establecerse directamente; no obstante, estos hallazgos coinciden con los resultados a largo plazo de anteriores estudios publicados10. Es sabido que la pérdida luminal de los SM es mayor que la de los SFA14. Una explicación de la diferencia observada en la tasa de mortalidad global podría tener relación con una mayor tasa de reestenosis subclínica en pacientes con SM que, a su vez provocaría isquemia silente, una fracción de eyección reducida o bien una menor reserva de flujo coronario, lo cual, en el caso de episodios intercurrentes como infecciones, hemorragias o cáncer, entre otros, podría acarrear un peor pronóstico. El estudio NORSTENT15, un extenso estudio multicéntrico de 9.013 pacientes aleatorizados a recibir SFA o SM de nueva generación, no reveló ninguna diferencia en el objetivo primario compuesto de mortalidad por cualquier causa o nuevo infarto de miocardio no mortal tras seis años de seguimiento. En este estudio, tampoco se observó diferencia en la tasa de mortalidad global. La población tenía un perfil de riesgo menor que el de nuestro registro: menos de la tercera parte de los pacientes ingresaron con un cuadro de IAMCEST, y se excluyó a aquellos pacientes ya sometidos a anteriores revascularizaciones percutáneas, con una esperanza de vida inferior a cinco años, a tratamiento anticoagulante y con lesiones en bifurcación. A pesar de que no se hallaron diferencias en el objetivo primario, los SFA demostraron su efectividad, lo cual se asoció a una menor necesidad de realizar nuevas revascularizaciones (16,5 frente a 19,8%; p < 0,001) y revascularizaciones de la lesión diana (5,6 frente a 10,2%; p < 0,001). Probablemente debido al pequeño tamaño de la muestra de nuestro estudio, solo se observó una tendencia estadísticamente no significativa hacia una reducción en la necesidad de nuevas revascularizaciones tanto de la lesión como del vaso diana en los pacientes que recibieron SFA.
El descenso del POCE de nuestro registro mostró un patrón parecido al observado en el seguimiento a cinco años del estudio EXAMINATION10, donde las diferencias favorables a los SFA fueron cada vez mayores durante el seguimiento, alcanzando la relevancia estadística a partir del tercer año en adelante. En dicho estudio, los SFA también redujeron el DOCE durante el seguimiento, siendo las diferencias relevantes a nivel estadístico tras 3 años de seguimiento10. En nuestro registro, la tasa de DOCE fue similar a la del estudio EXAMINATION a los 2 años (≈ 9%); en cualquier caso, solo observamos un descenso numérico del DOCE, probablemente debido a la falta de potencial estadístico.
La evidencia a largo plazo disponible de SFA frente a SM es muy limitada; la mayoría de estudios clínicos que han llevado a cabo comparativas entre SM y SFA de primera generación realizaron seguimientos de < 2 años16-22 y aún así han confirmado la mayor eficacia de los SFA a costa de menos revascularizaciones de la lesión diana, sin diferencias en otros eventos clínicos ni en la supervivencia. Solo dos ensayos clínicos, el EXAMINATION18 y el COMFORTABLE-AMI han comparado SFA de segunda generación y SM en pacientes con IAMCEST y, en ambos casos, se llevó a cabo un seguimiento de un año de duración: en el estudio COMFORTABLE-AMI el uso de stents liberadores de biolimus (BioMatrix; Biosensors Europe SA, Morges, Suiza) se asoció a menos nuevos infartos en la arteria causante y menos revascularizaciones del vaso diana inducidas por isquemia23. Asimismo, en el estudio EXAMINATION, el uso de un stent liberador de everolimus (Xience V; Abbott Vascular, Santa Clara,CA, Estados Unidos) se asoció con menos revascularizaciones del vaso diana y a tasas más bajas de revascularización de la lesión diana18. En un análisis conjunto de ambos estudios, el uso de SFA redujo los eventos POCE lo cual, acarreó menos revascularizaciones de la lesión diana, así como un menor riesgo de nuevos infartos en la arteria responsable del infarto8. El fenómeno de catch-up tardío (trombosis o reestenosis un año después de la implantación) está descrito en SFA de primera generación, lo cual no deja de ser preocupante para la eficacia y seguridad a largo plazo de los SFA24,25. Comparados con los SM, que desarrollan hiperplasia intimal máxima a los 6 meses26, los SFA de primera generación presentan una pérdida luminal progresiva después de 2 años en un seguimiento angiográfico27. Algunos estudios sugieren que este efecto también está presente en los SFA de nueva generación28. Nuestros resultados y los del estudio a largo plazo EXAMINATION avalan la hipótesis de que la efectividad clínica de los SFA de nueva generación, en lo que a una mayor supervivencia y menos MACE y POCE se refiere, lo cual se observa durante el seguimiento a largo plazo.
Por último, el perfil de seguridad de los SFA de nueva generación respecto a su baja tasa de trombosis definitiva del stent, sin ninguna diferencia descrita con respecto a los SM, coincide con lo que algunos ensayos clínicos han publicado sobre nuevos SFA en pacientes con IAMCEST8,10,15. En cuanto al momento de la trombosis del stent, es notable la ausencia de trombosis del stent muy tardía entre aquellos pacientes que recibieron SFA.
Limitaciones
Al ser este un estudio retrospectivo, observacional y aleatorizado con inclusión consecutiva de pacientes realizado en un único centro, las limitaciones son las inherentes a un estudio de estas características.
A fin de evitar sesgos y controlar los efectos de los posibles factores de confusión, se ajustó por puntuación de propensión. No obstante, no se puede excluir los efectos de los factores de confusión que no fueron analizados. Debido a la falta de datos sobre modificaciones del tratamiento durante el seguimiento, no se puede descartar la posibilidad de que las diferencias observadas pudiesen haberse visto influidas, al menos en parte, por el tratamiento. Por último, tampoco podemos descartar la existencia del efecto de heterogeneidad entre los distintos tipos de SFA.
Conclusiones
Según nuestro registro, en una población de pacientes del mundo real, la implantación de SFA de nueva generación frente a SM se asoció a una mayor supervivencia de supervivencia en el seguimiento a largo plazo, a descensos en las tasas de de MACE y POCE, sin observarse ninguna diferencia en la trombosis definitiva del stent.
Financiación
Este estudio ha sido financiado por la Fundación MAPFRE.
Conflicto de intereses
No se declara ninguno.
¿Qué se sabe del tema?
- A pesar de las recomendaciones de las actuales guías la evidencia de los resultados a largo plazo de los nuevos stents farmacoactivos para el tratamiento de los cuadros de IAMCEST es limitada y se basa en gran medida en datos obtenidos de ensayos clínicos.
¿Qué aporta de nuevo?
- La población de este estudio refleja el abordaje y tratamiento de una cohorte de pacientes con IAMCEST del mundo real.
- Nuestros resultados confirman la eficacia y seguridad a largo plazo de la nueva generación de stents farmacoactivos en un registro de pacientes no seleccionados.
Bibliografía
1. Stettler C, Wandel S, Allemann S, et al. Outcomes associated with drugeluting and bare-metal stents: a collaborative network meta-analysis. Lancet. 2007;370:937-948.
2. Kastrati A, Mehilli J, Pache J, et al. Analysis of 14 trials comparing sirolimus-eluting stents with bare-metal stents. N Engl J Med. 2007;356:1030-1039.
3. Raber L, Wohlwend L, Wigger M, et al. Five-year clinical and angiographic outcomes of a randomized comparison of sirolimus-eluting and paclitaxel-eluting stents: results of the Sirolimus-Eluting Versus Paclitaxel-Eluting Stents for Coronary Revascularization LATE trial. Circulation. 2011;123: 2819-2828, 6 p following 2828.
4. Camenzind E, Steg PG, and Wijns W. Stent thrombosis late after implantation of first-generation drug-eluting stents: a cause for concern. Circulation. 2007;115:1440-1455; discussion 1455.
5. Kukreja N, Onuma Y, Garcia-Garcia HM, et al. The risk of stent thrombosis in patients with acute coronary syndromes treated with bare-metal and drug-eluting stents. JACC Cardiovasc Interv. 2009;2:534-541.
6. Bangalore S, Kumar S, Fusaro M, et al. Short- and long-term outcomes with drug-eluting and bare-metal coronary stents: a mixed-treatment comparison analysis of 117 762 patient-years of follow-up from randomized trials. Circulation. 2012;125:2873-2891.
7. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018;39:119-177.
8. Sabate M, Raber L, Heg D, et al. Comparison of newer-generation drugeluting with bare-metal stents in patients with acute ST-segment elevation myocardial infarction: a pooled analysis of the EXAMINATION (Clinical Evaluation of the Xience-V stent in Acute Myocardial Infarction) and COMFORTABLE-AMI (Comparison of Biolimus Eluted From an Erodible Stent Coating With Bare Metal Stents in Acute ST-Elevation Myocardial Infarction) trials. JACC Cardiovasc Interv. 2014;7:55-63.
9. Raber L, Kelbaek H, Taniwaki M, et al. Biolimus-eluting stents with biodegradable polymer versus bare-metal stents in acute myocardial infarction: two-year clinical results of the COMFORTABLE AMI trial. Circ Cardiovasc Interv. 2014;7:355-364.
10. Sabate M, Brugaletta S, Cequier A, et al. Clinical outcomes in patients with ST-segment elevation myocardial infarction treated with everolimus-eluting stents versus bare-metal stents (EXAMINATION): 5-year results of a randomised trial. Lancet. 2016;387:357-366.
11. Kolh P, Windecker S, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur J Cardiothorac Surg. 2014;46:517-592.
12. Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. Circulation. 2012;126:2020-2035.
13. Cutlip DE, Windecker S, Mehran R, et al. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation. 2007;115:2344-2351.
14. Tsai ML, Chen CC, Chen DY, et al. Review: The outcomes of different vessel diameter in patients receiving coronary artery stenting. Int J Cardiol. 2016;224:317-322.
15. Bonaa KH, Mannsverk J, Wiseth R, et al. Drug-eluting or bare-metal stents for coronary artery disease. N Engl J Med. 2016;375:1242-1252.
16. Di Lorenzo E, De Luca G, Sauro R, et al. The PASEO (Paclitaxel or Sirolimus-Eluting Stent Versus Bare Metal Stent in Primary Angioplasty) Randomized Trial. JACC Cardiovasc Interv. 2009;2:515-523.
17. Menichelli M, Parma A, Pucci E, et al. Randomized trial of Sirolimus-Eluting Stent Versus Bare-Metal Stent in Acute Myocardial Infarction (SESAMI). J Am Coll Cardiol. 2007;49:1924-1930.
18. Sabate M, Cequier A, Iñiguez A, et al. Everolimus-eluting stent versus bare-metal stent in ST-segment elevation myocardial infarction (EXAMINATION): 1 year results of a randomised controlled trial. Lancet. 2012;380:1482-1490.
19. Spaulding C, Henry P, Teiger E, et al. Sirolimus-eluting versus uncoated stents in acute myocardial infarction. N Engl J Med. 2006;355:1093-1104.
20. Stone GW, Lansky AJ, Pocock SJ, et al. Paclitaxel-eluting stents versus bare-metal stents in acute myocardial infarction. N Engl J Med. 2009;360: 1946-1959.
21. Valgimigli M, Campo G, Arcozzi C, et al. Two-year clinical follow-up after sirolimus-eluting versus bare-metal stent implantation assisted by systematic glycoprotein IIb/IIIa inhibitor infusion in patients with myocardial infarction: results from the STRATEGY study. J Am Coll Cardiol. 2007;50: 138-145.
22. van der Hoeven BL, Liem SS, Jukema JW, et al. Sirolimus-eluting stents versus bare-metal stents in patients with ST-segment elevation myocardial infarction: 9-month angiographic and intravascular ultrasound results and 12-month clinical outcome results from the MISSION! Intervention Study. J Am Coll Cardiol. 2008;51:618-626.
23. Raber L, Kelbaek H, Ostojic M, et al. Effect of biolimus-eluting stents with biodegradable polymer vs bare-metal stents on cardiovascular events among patients with acute myocardial infarction: the COMFORTABLE AMI randomized trial. JAMA. 2012;308:777-787.
24. Lagerqvist B, James SK, Stenestrand U, et al. Long-term outcomes with drug-eluting stents versus bare-metal stents in Sweden. N Engl J Med. 2007; 356:1009-1019.
25. Nakagawa Y, Kimura T, Morimoto T, et al. Incidence and risk factors of late target lesion revascularization after sirolimus-eluting stent implantation (3-year follow-up of the j-Cypher registry). Am J Cardiol. 2010;106:329-336.
26. Kimura T, Yokoi H, Nakagawa Y, et al. Three-year follow-up after implantation of metallic coronary-artery stents. N Engl J Med. 1996;334:561-566.
27. Byrne RA, Iijima R, Mehilli J, et al. Durability of antirestenotic efficacy in drug-eluting stents with and without permanent polymer. JACC Cardiovasc Interv. 2009;2:291-299.
28. Iijima R, Araki T, Nagashima Y, et al. Incidence and predictors of the late catch-up phenomenon after drug-eluting stent implantation. Int J Cardiol. 2013;168:2588-2592.
Correo electrónico: alfredoredondo@gmail.com (A. Redondo Diéguez).