RESUMEN
Introducción y objetivos: Tras los resultados de varios estudios aleatorizados, la tromboaspiración (TA) sistemática ha sido relegada a un segundo plano por no mejorar el pronóstico de los pacientes con infarto agudo de miocardio con elevación del segmento ST e incluso aumentar sus complicaciones. El objetivo de este trabajo fue evaluar el impacto de la TA selectiva durante la angioplastia primaria (ICPp), su seguridad y sus beneficios clínicos tras 1 año de seguimiento.
Métodos: El registro TAPER (eficacia y seguridad de la tromboaspiración selectiva en la práctica clínica real) incluyó retrospectivamente pacientes con infarto de miocardio con elevación del segmento ST tratados con ICPp. Se evaluaron las características clínicas y de los procedimientos, así como la presentación del evento combinado de muerte cardiovascular, infarto de miocardio no fatal, trombosis de stent, necesidad de revascularización de la lesión tratada o ictus tras 1 año de seguimiento.
Resultados: Se analizaron 687 pacientes (76,9% varones, 64 ± 12 años). La TA se realizó en el 40,3% de los casos (89,9% como estrategia inicial y 10,1% como rescate) y fue exitosa en el 93,8%. El predictor más importante de uso de TA fue un alto grado de trombo inicial según la escala TIMI (Thrombolysis in Myocardial Infarction) (odds ratio = 3,2; intervalo de confianza del 95%, 2,5-3,9; p < 0,0001). La TA consiguió una mejora significativa del flujo de 2,4 puntos en la escala TIMI de flujo y una reducción significativa del grado de trombo de 2,6 puntos en la escala TIMI de trombo. En 1 año de seguimiento no se observó ningún ictus en el grupo de TA y la tasa del evento combinado fue similar en ambos grupos (grupo de TA 8% y grupo de no-TA 5,7%; p = 0,24).
Conclusiones: La TA selectiva se usa con frecuencia en la práctica clínica actual, con una alta tasa de éxito y pocas complicaciones asociadas. La TA selectiva reduce significativamente la carga de trombo y mejora el flujo coronario. Tras 1 año de seguimiento, se observó una tasa similar de eventos adversos en los pacientes a quienes se realizó ICPp con independencia del uso de TA.
Palabras clave: Tromboaspiración. Angioplastia primaria. IAMCEST.
ABSTRACT
Introduction and objectives: After the results of several randomized trials, routine thrombus aspiration (TA) has remained out of the spotlight after not improving the prognosis of patients with ST-segment elevation myocardial infarction and even increasing their complications. The goal here was to assess the impact of selective TA during primary percutaneous coronary intervention (pPCI), its safety and clinical benefits at 1-year follow-up.
Methods: The TAPER registry (efficacy and safety of selective Thrombus Aspiration in Real clinical Practice) retrospectively included patients with ST-segment elevation myocardial infarction treated with pPCI. The clinical and procedural characteristics and the composite endpoint of cardiovascular mortality, non-fatal myocardial infarction, stent thrombosis, target lesion revascularization or stroke were evaluated after at 1-year follow-up.
Results: 687 patients (76.9% males, 64 ± 12 years) were analyzed. The TA was performed in 40.3% of cases (in 89.9% as the initial strategy and in 10.1% as the bailout strategy) and it was successful in 93.8% of them. The most important predictor of TA use was a higher initial Thrombolysis in Myocardial Infarction (TIMI) thrombus grade (OR, 3.2; 95%CI, 2.5-3.9; P < .0001). TA achieved a significant improvement of TIMI-flow (2.4 points) and a significant reduction of the TIMI thrombus grade (2.6 points). At 1-year follow-up, no stroke was observed in the TA-group and the rate of the composite endpoint (cardiovascular mortality, non-fatal myocardial infarction, stent thrombosis, target lesion revascularization or stroke) was similar in both groups (TA-group 8% vs non-TA-group 5.7%; P = .24).
Conclusions: Selective TA is frequently used in the current clinical practice with a high success rate and a low rate of associated complications. It significantly reduces thrombotic burden and improves coronary flow. At 1-year follow-up, a similar rate of adverse events was observed regardless of the use of TA.
Keywords: Thrombus aspiration. Primary PCI. STEMI.
Abreviaturas: ICPp: angioplastia primaria. TA: tromboaspiración.
INTRODUCCIÓN
La angioplastia primaria (ICPp) es el tratamiento preferido para el manejo del infarto agudo de miocardio con elevación del segmento ST1. No obstante, una de sus limitaciones es la posibilidad de embolización trombótica distal y el fallo en la restauración del flujo a nivel microvascular, lo cual acarrea un incremento significativo de mortalidad2. La tromboaspiración (TA) se ideó como un método sencillo de disminuir la carga trombótica antes del implante de stents, reducir la embolización distal y mejorar los resultados de la ICPp3.
Después de los prometedores resultados del estudio TAPAS4,5, la TA se incluyó como práctica habitual, y se hizo probablemente un uso excesivo de la misma6. Sin embargo, los resultados de los estudios clínicos TASTE8 y TOTAL9 crearon incertidumbre sobre los beneficios clínicos de la TA. Además, se ha sugerido que esta técnica puede asociarse a un mayor riesgo de sufrir accidentes cerebrovasculares9. Por esta razón las guías clínicas han rebajado la indicación para el uso rutinario de la TA de IIa10-12 a III13,14 lo que ha resultado en un descenso paulatino del uso de la TA (figura 1)4,7,9,15.
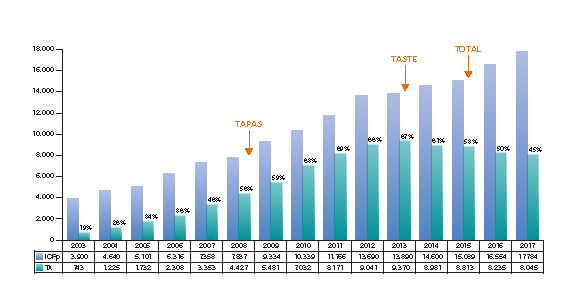
Figura 1. Evolución de la ICPp y la TA durante los últimos 15 años: evolución de la angioplastia primaria y TA en España durante los últimos 15 años15 en relación a la publicación de los principales estudios sobre TA4,7,9. ICPp: angioplastia primaria; TA: tromboaspiración.
Además de que estos estudios clínicos podrían no reflejar la práctica clínica actual6, se debe mencionar que estas recomendaciones se refieren a la TA rutinaria, no a la TA selectiva, en la que el intervencionista la aplica a los casos en los que se espera obtener mayor beneficio. Aunque la TA selectiva quizá sea un reflejo más fiel de la práctica habitual, no disponemos de datos sobre su aplicación. Por este motivo, se diseñó el registro TAPER (eficacia y seguridad de la tromboaspiración selectiva en la práctica clínica real) con el objetivo de analizar las ventajas de la TA selectiva durante la ICPp, su seguridad y beneficio clínico a un año de seguimiento.
MÉTODOS
Pacientes y diseño del estudio
El registro TAPER incluyó retrospectivamente a pacientes con infarto agudo de miocardio con elevación del segmento ST tratados con ICPp en centros de alto volumen de diferentes países (A, B, C, D) en un programa 24/7. Estos centros atienden comunidades de 615.000, 400.000, 450.000 y 350.000 habitantes, respectivamente.
Entre enero de 2015 y diciembre de 2016 se incluyó a pacientes con infarto agudo de miocardio con elevación del segmento ST derivados para recibir ICPp en las primeras 12 horas desde el inicio de los síntomas. Los que habían recibido tratamiento fibrinolítico no fueron incluidos.
Se excluyó a los pacientes sin lesiones coronarias culpables evidentes, aquellos que presentaron parada cardiaca y las pérdidas durante el seguimiento. También se excluyó a aquellos con contraindicaciones para recibir tratamiento antiagregante plaquetario (figura 2).
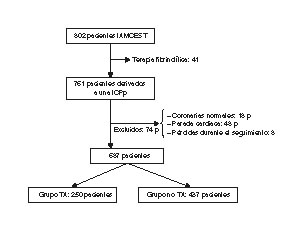
Figura 2. Diagrama de flujo del estudio. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICPp: angioplastia primaria; P: pacientes; TA: tromboaspiración.
Se incluyó en el grupo TA a los pacientes en quienes se realizó TA como estrategia inicial y el grupo no-TA a los pacientes en quienes no se realizó TA o se realizó como estrategia de rescate tras dilatación con balón o implante de stent.
Se analizaron las características clínicas y de la intervención y el objetivo primario fue un compuesto de mortalidad cardiovascular, infarto de miocardio no fatal asociado a la lesión tratada, trombosis del stent, revascularización de la lesión diana o accidente cerebrovascular al año de seguimiento.
Procedimientos del estudio
Los pacientes recibieron tratamiento antiagregante y anticoagulante según las guías de práctica clínica16. La incorporación de inhibidores de la glucoproteína IIb/IIIa fue a criterio del intervencionista. El uso de la TA y otros detalles técnicos de la ICPp se dejaron, también, a criterio del cardiólogo intervencionista. La TA se realizó utilizando la técnica estándar9.
Valoración angiográfica
El análisis angiográfico se llevó a cabo por 4 intervencionistas experimentados. Después de definir la lesión culpable en la angiografía inicial, el flujo distal del vaso culpable se valoró usando la escala TIMI (Thrombolysis In Myocardial Infarction)17. Después de cruzar la lesión culpable con una guía coronaria, la carga trombótica se definió según la escala TIMI de trombo18. Tras la TA se volvieron a valorar las escalas TIMI de flujo y trombo. La presentación del fenómeno de ausencia de reperfusión (fenómeno de no-reflow) y la embolización trombótica distal también se evaluaron.
Seguimiento y definiciones de los objetivos clínicos
El seguimiento de los pacientes se llevó a cabo por teléfono o a través de los registros en la historia clínica electrónica de las visitas en el servicio de cardiología.
El objetivo primario fue la aparición de eventos adversos cardiovasculares mayores (MACE) [mortalidad cardiovascular, infarto de miocardio asociado a la lesión tratada, trombosis del stent, necesidad de revascularización de la lesión tratada o accidente cerebrovascular] al año de seguimiento. Como objetivos secundarios se analizaron de forma independiente los eventos adversos que formaban parte del objetivo compuesto primario.
Todas las muertes se consideraron cardiovasculares salvo que se documentara otra causa específica. El infarto de miocardio se definió siguiendo las recomendaciones actuales19 y solo se tuvieron en cuenta los relacionados con la lesión tratada, ya fueran periprocedimiento o durante el seguimiento. La revascularización de la lesión diana o la trombosis del stent se definieron según los criterios del Academic Research Consortium20.
El éxito angiográfico se definió como un flujo distal final TIMI 3 con una estenosis residual < 20% en el vaso tratado y sin complicaciones mecánicas inmediatas. La TA se consideró exitosa cuando se consiguió una mejoría del grado de flujo TIMI ≥ 1 o una reducción en la escala TIMI de trombo ≥ 1, sin complicaciones inmediatas asociadas a la técnica.
Análisis estadístico
Las variables cuantitativas con distribución normal se expresaron como media ± desviación estándar. Aquellas sin esta distribución se expresaron por la mediana [rango]. Las variables cualitativas se expresaron como frecuencias absolutas y relativas de sus categorías.
Los niveles de p < 0,05 se consideraron estadísticamente significativos y se calculó el intervalo de confianza del 95% (IC95%) de las variables analizadas. En el análisis bivariado, se emplearon la pruebas t de Student o la no paramétrica U de Mann-Whitney para la comparación de medias y las pruebas X2 y exacta de Fisher para comparar las variables cualitativas.
Se utilizó la regresión logística para el análisis multivariado. Las variables se consideraron predictores potenciales del riesgo en el modelo multivariado cuando mostraron una relación estadísticamente significativa en el análisis univariado. Los cálculos se hicieron con el paquete de software estadístico SPSS versión 20 (Armonk, NY: IBM Corp).
RESULTADOS
De los 761 pacientes inicialmente seleccionados, se excluyó a 74 (18 no presentaban lesiones coronarias culpables evidentes, 48 presentaron una parada cardiaca y 8 se perdieron durante el seguimiento). Finalmente se analizó a los restantes 687 pacientes (64,1 ± 12,2 años; el 76,9% varones). Sus características basales se muestran en la tabla 1.
Tabla 1. Características basales
| Grupo TA n = 250 | Grupo no-TA n = 437 | p | |
|---|---|---|---|
| Edad (años) | 63,6 ± 12,6 | 64,4 ± 12,1 | 0,46 |
| Varón | 208 (83,2%) | 320 (73,2%) | 0,003 |
| IMC | 27,2 ± 6,4 | 26,6 ± 5,8 | 0,23 |
| Fumador | 105 (42%) | 140 (32%) | 0,012 |
| Diabetes mellitus | 44 (17,6%) | 80 (18,3%) | 0,86 |
| Dislipemia | 74 (29,6%) | 103 (23,6%) | 0,07 |
| Hipertensión | 114 (45,6%) | 195 (44,6%) | 0,68 |
| FEVI | 48,7 ± 10,7 | 49,7 ± 10,4 | 0,27 |
| ICP previa | 27 (10,8%) | 37 (8,5%) | 0,29 |
| CABG previa | 3 (1,2%) | 5 (1,1%) | 0,93 |
| Insuficiencia renal crónica | 13 (5,2%) | 13 (2,9%) | 0,14 |
CABG: cirugía de revascularización coronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; TA: tromboaspiración. Los datos expresan n (%) o media ± desviación estándar. | |||
Características de la intervención
En la cohorte general, la lesión culpable se localizó habitualmente en la arteria descendente anterior (45,6%) seguida de la coronaria derecha (36,9%). El 48,1% de los pacientes presentaba enfermedad multivaso. El grado inicial de flujo TIMI fue 0-1 en el 72,7% de los casos y el grado de trombo TIMI ≥ 3 en el 61,6% de los casos.
La TA se realizó en el 40,3% de los casos. La TA fue la estrategia inicial en el 89,9% de los casos después de cruzar la lesión culpable con la guía coronaria, mientras que en el 10,1% se realizó como estrategia de rescate (figura 3). Las características de los procedimientos se muestran en la tabla 2.
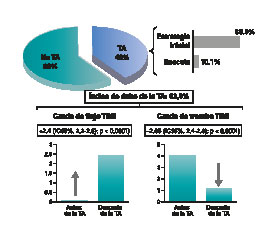
Figura 3. Rendimiento de la TA selectiva y efectos beneficiosos durante una angioplastia primaria. Porcentaje de casos en los que se utilizó la TA (como estrategia inicial o de rescate) y tasa de éxito de la TA (al mejorar el flujo o el grado de trombo TIMI). TA: tromboaspiración; TIMI: Thrombolysis in Myocardial Infarction.
Tabla 2. Características angiográficas y de la intervención
| Grupo TA n = 250 | Grupo no-TA n = 437 | p | |
|---|---|---|---|
| Arteria culpable | 0,01 | ||
| TCI | 5 (2%) | 2 (0,5%) | |
| DA | 98 (39,2%) | 209 (47,8%) | |
| CX | 30 (12%) | 71 (16,2%) | |
| CD | 114 (45,6%) | 148 (33,8%) | |
| Otra | 3 (1,2%) | 1 (0,2%) | |
| Enfermedad multivaso | 107 (42,8%) | 221 (50,6%) | 0,08 |
| Inhibidor del receptor plaquetario P2Y12 | < 0,0001 | ||
| Clopidogrel | 185 (74%) | 272 (62,2%) | |
| Prasugrel | 15 (6%) | 29 (6,6%) | |
| Ticagrelor | 37 (14,8%) | 119 (27,2%) | |
| Anticoagulación | 0,69 | ||
| HNF | 245 (96%) | 433 (99%) | |
| Bivalirudina | 2 (0,8%) | 2 (0,45%) | |
| Enoxaparina | 0 (0%) | 1 (0,22%) | |
| Inhibidor de la glucoproteína IIb/IIIa | 0,13 | ||
| Abciximab | 91 (36,4%) | 120 (27,5%) | |
| Eptifibatide | 15 (6%) | 18 (4,1%) | |
| Dispositivo de asistencia ventricular | 11 (4,4%) | 12 (2,7%) | 0,24 |
| Flujo TIMI inicial | 0,3 ± 0,8 | 1,1 ± 1,3 | < 0,0001 |
| Grado inicial de flujo TIMI 0-1 | 228 (91,2%) | 271 (62%) | < 0,0001 |
| Grado inicial de trombo TIMI | 4,8 ± 0,9 | 2,5 ± 1,4 | < 0,0001 |
| Grado inicial de trombo TIMI ≥ 3 | 233 (93,2%) | 191 (43,7%) | < 0,0001 |
| Trombosis inicial del stent (como lesión culpable) | 14 (5,6%) | 7 (1,6%) | 0,004 |
| Bifurcación (en la lesión culpable) | 62 (24,8%) | 108 (24,7%) | 0,8 |
| TPB (minutos) | 101 ± 55 | 102 ± 83 | 0,8 |
| Dispositivo TA | |||
| Medtronic Export | 134 (53,6%) | NA | |
| Terumo Eliminate | 96 (38,4%) | NA | |
| Hexacath Recover | 20 (8%) | NA | |
| Implante de stent directo | 178 (71,2%) | 144 (32,9%) | < 0,0001 |
| Tipo de stent | 0,04 | ||
| Stent sin fármaco | 80 (32%) | 108 (24,7%) | |
| Farmacoactivo | 170 (68%) | 329 (75,3%) | |
| Longitud del stent (mm) | 29 ± 13,8 | 27,8 ± 14,8 | 0,29 |
| Diámetro del stent (mm) | 3,3 ± 0,7 | 3,4 ± 2,2 | 0,8 |
| Posdilatación | 43 (17,2%) | 82 (18,8%) | 0,47 |
| No reflow | 24 (9,6%) | 31 (7,1%) | 0,24 |
| Embolización distal | 4 (1,6%) | 7 (1,6%) | 0,97 |
| Éxito angiográfico | 238 (95,2%) | 404 (92,4%) | 0,16 |
CD: coronaria derecha; CX: circunfleja; DA: descendente anterior; TA: tromboaspiración; TCI: tronco común de la coronaria izquierda; TIMI: Thrombolysis in Myocardial Infarction; TPB: tiempo puerta-balón. Los datos expresan n (%) o media ± desviación estándar. | |||
Predictores del uso de tromboaspiración
Se observaron diferencias significativas en la frecuencia de uso de TA entre los distintos centros (A = 63,7%; B = 32,9%; C = 16,9%; D = 15,7%; p < 0,0001). La TA fue la estrategia inicial más usada en varones (40,9 frente al 26,4%; p = 0,003), fumadores (47,7 frente al 36,1%; p = 0,012) y cuando la lesión culpable era la trombosis de un stent previo (66,7 frente al 36%; p = 0,004). La frecuencia de uso de TA también fue distinta en función de la arteria culpable (descendente anterior, 31,9%; circunfleja, 29,7%; coronaria derecha, 43,5%; p = 0,01). Además, los pacientes del grupo no-TA fueron tratados más a menudo con ticagrelor o prasugrel que con clopidogrel (p < 0,0001) y con stents farmacoactivos (68% en el grupo TA frente al 75,3% del grupo no-TA; p = 0,04). En los pacientes del grupo TA, el grado inicial de flujo TIMI fue significativamente más bajo (0,3 ± 0,8 frente a 1,1 ± 1,3; p < 0,0001) y el grado inicial de trombo TIMI más alto (4,3 ± 0,9 frente a 2,5 ± 1,4; p < 0,0001).
En el análisis multivariado se incluyeron las variables que mostraron una asociación estadísticamente significativa con la TA en el análisis univariado: sexo, tabaquismo, lesión culpable, inhibidor del receptor plaquetario P2Y12, flujo inicial TIMI, grado inicial de trombo TIMI, trombosis inicial del stent (como lesión culpable), centro y tipo de stent. El predictor independiente más importante del uso de TA como estrategia inicial fue un grado inicial de trombo TIMI más alto (odds ratio [OR] = 3,2; IC95%, 2,5-3,9; p < 0,0001). La realización de la ICPp en el centro A (OR = 20,7; IC95%, 10-42,5; p < 0,0001) o B (OR = 3,3; IC95%, 1,4-7,5; p = 0,005) también fue un predictor independiente del uso de TA (comparado con el centro D; el que menos utilizó la TA). La localización de la lesión culpable en la coronaria derecha (OR = 2; IC95%, 1,008-3,9; p = 0,047) también se identificó como predictor del uso de TA como estrategia inicial.
Resultados angiográficos después de la tromboaspiración
Cuando la TA se realizó como estrategia inicial, el flujo TIMI mejoró significativamente (2,4; IC95%, 2,2-2,5; p < 0,0001) y el grado de trombo TIMI se redujo significativamente (2,6; IC95%, 2,4-2,8; p < 0,0001) (figura 3). El implante de stent directo fue el doble en el grupo de TA. No se observaron diferencias entre los 2 grupos en la aparición del fenómeno de no reflow ni en la embolización distal. Asimismo, el éxito de la intervención fue alto y similar en ambos grupos (95,2% en el grupo TA y 92,4% en el grupo no TA; p = 0,16) (tabla 2).
Eventos adversos durante el seguimiento
Al año de seguimiento, no se observaron diferencias significativas en la frecuencia de presentación de MACE entre ambos grupos (8 en el grupo TA frente al 5,7% en el grupo no-TA; p = 0,24). Tampoco se observaron diferencias significativas en ninguno de los eventos adversos individuales: mortalidad cardiovascular (5,2 en el grupo TA frente al 3,9% en el grupo no-TA; p = 0,38), infarto de miocardio (2,4 en el grupo TA frente al 3,4% en el grupo no-TA; p = 0,47), trombosis del stent (2,4 en el grupo TA frente al 2,3% en el grupo no-TA; p = 0,9) o revascularización de la lesión diana (4,4 en el grupo TA frente al 4,8% en el grupo no-TA; p = 0,85). La frecuencia de eventos isquémicos cerebrales fue similar en los 2 grupos (del 0,4 en el grupo TA frente al 0,46% en el grupo no-TA; p = 0,92). Solo se diagnosticó un accidente isquémico transitorio en 1 paciente del grupo TA, que sobrevino > 30 días después de la ICPp. Ningún otro paciente de este grupo sufrió accidentes cerebrovasculares durante el seguimiento. Dos pacientes del grupo no-TA sufrieron sendos accidentes cerebrovasculares (uno isquémico 24 horas después de la ICPp y otro hemorrágico que sobrevino 3 meses después de la intervención en un paciente a tratamiento antitrombótico triple por fibrilación auricular). No se observaron diferencias en la frecuencia de presentación de MACE durante las primeras 24 horas que siguieron la ICPp (1,2 en el grupo TA frente a 1,4% en el grupo no-TA; p = 0,88) ni después de 1 mes de seguimiento (3,6 en el grupo TA frente al 3,9% en el grupo no-TA; p = 0,9) (figura 4).
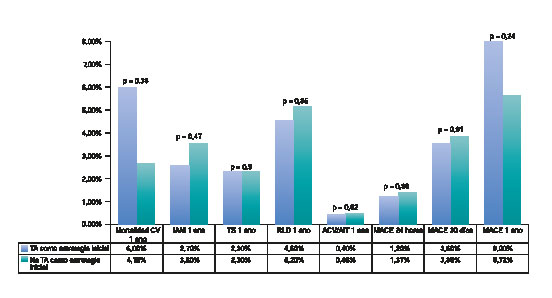
Figura 4. MACE durante el seguimiento. AIT: accidente isquémico transitorio; CV: cardiovascular; IAM: infarto agudo de miocardio; MACE: eventos adversos cardiovasculares mayores; TA: tromboaspiración; RLD: revascularización de la lesión diana; TS: trombosis del stent.
DISCUSIÓN
Los principales hallazgos de este estudio son: a) la TA se emplea con frecuencia durante la ICPp (40,3%), principalmente como estrategia inicial con diferencias significativas entre los distintos centros; b) un grado inicial de trombo TIMI más alto es el predictor más importante del uso de TA; c) la TA tiene un alto índice de éxito técnico que reduce significativamente la carga trombótica, mejora el flujo TIMI y facilita la ICPp posibilitando con mayor frecuencia el implante de stent directo; d) la TA no se asoció a una mayor frecuencia de accidentes cerebrovasculares; y e) la TA tampoco se asoció a diferencias en la aparición de MACE durante la fase aguda o al año de seguimiento.
Este estudio analiza la eficacia y seguridad de la TA selectiva en la práctica clínica real, lo cual es importante por 2 razones: los estudios más importantes sobre TA4,7,9 valoraron el uso rutinario de esta técnica. La realización de una TA rutinaria durante una ICPp no es lo habitual en la práctica clínica, donde la TA se realiza, de manera selectiva, en escenarios en los que se espera que esta técnica sea más efectiva. Además, algunos de estos estudios podrían tener sesgos de selección de la muestra nada desdeñables6,7,9que no reflejaran la verdadera práctica clínica. En nuestro estudio, la frecuencia media de uso de TA fue del 40,3%. Esta frecuencia fue similar a la observada en otros registros nacionales15. El predictor más importante del uso de TA fue una alta carga trombótica inicial.
Un hallazgo clave de este registro es que la TA es efectiva a la hora de facilitar la ICPp. A diferencia de otros estudios, nosotros describimos específicamente una reducción significativa de la carga trombótica y una mejora del flujo coronario tras la TA lo que, en nuestra opinión, son los efectos más representativos de la utilidad de esta técnica. La TA tuvo éxito en el 93,8% de los casos. Como el nuestro no fue un estudio aleatorizado, no es fácil analizar la reducción del fenómeno de no reflow o de la embolización distal con la TA. Esto es así porque intentando reflejar la práctica clínica real, la TA se usó de forma selectiva a criterio del intervencionista, por lo que el grupo TA tuvo un grado inicial de trombo TIMI más alto (aproximadamente el doble) que el grupo no-TA (tabla 2). Es precisamente en pacientes con una carga trombótica más alta en quienes cabe esperar frecuencias más altas de no reflow y embolización distal. No obstante, probablemente debido a esta TA inicial que posibilitó una reducción significativa del grado de trombo, no hubo diferencias en la presentación de no reflow o embolización distal comparando con el grupo no-TA que presentaba un grado inicial de trombo más bajo.
Además, los pacientes con TA como estrategia inicial presentaron una frecuencia de implante de stent directo de más del doble que los tratados convencionalmente. Más allá del posible beneficio económico, el implante directo del stent podría tener beneficios clínicos21.
Como sugiere nuestro estudio es posible que el mayor beneficio de la TA se obtenga cuando se realiza, de manera selectiva, en pacientes con carga trombótica más alta. Esta idea también se ha sugerido en un metanálisis que incluye los principales estudios sobre TA3. Los resultados de estos trabajos y metanálisis deben interpretarse con cautela ya que un porcentaje significativo de pacientes que recibieron una TA rutinaria no tenían cargas trombóticas significativas. En el estudio TAPAS, no se observaron trombos angiográficos en el 51,4% de los casos4, algo que también sucedió en el 35% de los pacientes del estudio TASTE7. El estudio TOTAL reveló que hasta en el 90% de los pacientes, la escala de trombo fue ≥ 39. No obstante, la carga trombótica se valoró antes de cruzar la lesión culpable con la guía coronaria lo que, probablemente, llevó a sobrevalorar la escala TIMI de trombo18 pues el 65% de los pacientes tenían un grado de flujo TIMI 0. En nuestra opinión esto limita las conclusiones extraídas de este estudio y subsiguientes análisis22.
Más allá de la efectividad de la TA, nuestros resultados avalan el perfil de seguridad de esta técnica. El estudio TOTAL9 describió un leve aumento de la frecuencia de accidentes cerebrovasculares asociados a la TA. Este resultado, discordante con lo descrito en anteriores estudios ha originado un debate que todavía no se ha cerrado. En nuestro estudio no hubo diferencias significativas en la tasa de accidentes cerebrovasculares entre los 2 grupos. Estos resultados son similares a los de los estudios TASTE7,8 o INFUSE-AMI23. En este sentido, los ictus asociados a la TA serían, en principio, de origen isquémico, se producirían durante la la intervención y serían evidentes en las primeras 24 horas. Parece poco probable que los ictus hemorrágicos o isquémicos que sobrevienen > 24 horas después de la intervención guarden relación con esta técnica24. En el estudio TOTAL9, la tasa de ictus isquémicos que sobrevinieron durante las primeras 48 horas tras la ICPp fue bajo y no varió significativamente entre los 2 grupos. Además, en los análisis por intención de tratamiento o por protocolo, la tasa de ictus por cualquier causa a los 30 días tampoco varió significativamente entre los 2 grupos.
De forma similar a los estudios sobre TA publicados recientemente7,9 nosotros tampoco hallamos beneficio pronóstico significativo de la técnica durante la fase aguda ni tras un seguimiento de 1 año. A pesar de haber quedado demostrado en distintos trabajos que la TA mejora los parámetros de reperfusión4,9, que ésta no se asocie a un beneficio pronóstico tiene sentido. En primer lugar, porque no parece probable que una herramienta técnica, diseñada para facilitar la ICPp, pueda reducir la mortalidad. En segundo lugar, porque la baja tasa de eventos descritos (tanto en nuestra cohorte como en anteriores estudios) dificulta el hecho de que un único tratamiento logre un descenso significativo de la tasa de mortalidad. En último lugar, porque la mortalidad depende de muchos factores que ni estos estudios ni el nuestro analizaron25.
Limitaciones
Este es un estudio observacional y retrospectivo con las limitaciones propias de un estudio de estas características. La exclusión de pacientes con parada cardiaca o que recibieron ICP de rescate podría implicar sesgos de selección.
La cuantificación de la carga trombótica según la anterior escala TIMI de trombo validada podría no ser precisa por el diseño de esta herramienta. Se ha mantenido esta clasificación por ser la más empleada en este escenario. No obstante, el grado de trombo previo a la TA se valoró después de cruzar la lesión diana con la guía de angioplastia para minimizar el número de casos con flujo inicial de grado TIMI 0 en los que resulta imposible valorar el grado inicial de trombo TIMI.
Se definió una TA como exitosa si lograba mejorar el flujo TIMI ≥ 1 grado o reducir ≥ 1 el grado de trombo en la escala TIMI sin complicaciones inmediatas asociadas a esta técnica. Sin embargo, no se midieron otros parámetros de reperfusión microvascular tales como la resolución de la elevación del segmento ST o el grado de blush miocárdico.
No se analizaron los datos del flujo coronario tras la realización de la estrategia alternativa a la TA inicial en el grupo no-TA. Esto podría ser una limitación ya que los resultados inmediatos no se pudieron comparar con los del grupo TA. Además, el análisis angiográfico no lo realizó un laboratorio central independiente que habría añadido validez a los resultados.
La alta heterogeneidad de los intervencionistas implicados podría haber influido en los resultados observados por sus preferencias individuales en cuanto a la TA. En cualquier caso, creemos que esto podría favorecer la validez externa de nuestros hallazgos.
CONCLUSIONES
A pesar de haber sido recientemente desacreditada, la TA suele emplearse en la práctica clínica actual durante la realización de una ICPp, principalmente como estrategia inicial. Un grado inicial de trombo más alto es el predictor más importante de la utilización de TA selectiva, que facilita la realización de la ICPp al reducir la carga trombótica y mejorar el flujo coronario. La TA selectiva no se asoció significativamente a una reducción de la tasa de eventos adversos ni durante la fase aguda ni durante el seguimiento al año. Tampoco se observó asociación entre la TA y una mayor tasa de accidentes cerebrovasculares.
CONFLICTO DE INTERESES
Los autores no han declarado conflictos de intereses.
¿QUÉ SE SABE DEL TEMA?
- Después de los hallazgos descritos por varios estudios aleatorizados, la TA rutinaria ha sido desacreditada al no mejorar el pronóstico de pacientes con infarto agudo de miocardio con elevación del segmento ST e incluso implicar más complicaciones.
- Aunque la TA selectiva podría reflejar mejor la práctica habitual, no disponemos de datos suficientes sobre su aplicación.
¿QUÉ APORTA DE NUEVO?
- La TA selectiva sigue empleándose en la práctica clínica actual durante la realización de ICPp, sobre todo como estrategia inicial.
- Un grado inicial de trombo más alto es el predictor más importante del uso de la TA.
- La TA selectiva facilita la ICPp reduciendo la carga trombótica y mejorando el flujo coronario.
- La TA selectiva no se asocia a un descenso de los eventos adversos al cabo de 1 año. Tampoco se observa una relación entre la TA y una mayor tasa de accidentes cerebrovasculares.
BIBLIOGRAFÍA
1. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction:a quantitative review of 23 randomised trials. Lancet. 2003;361:13-20.
2. Henriques JP, Zijlstra F, Ottervanger JP, et al. Incidence and clinical significance of distal embolization during primary angioplasty for acute myocardial infarction. Eur Heart J. 2002;23:1112-1117.
3. Jolly SS, James S, Dzavik V, et al. Thrombus Aspiration in ST-Segment-Elevation Myocardial Infarction:An Individual Patient Meta-Analysis:Thrombectomy Trialists Collaboration. Circulation. 2017;135:143-152.
4. Svilaas T, Vlaar PJ, van der Horst IC, et al. Thrombus aspiration during primary percutaneous coronary intervention. N Engl J Med. 2008;358: 557-567.
5. Vlaar PJ, Svilaas T, van der Horst IC, et al. Cardiac death and reinfarction after 1 year in the Thrombus Aspiration during Percutaneous coronary intervention in Acute myocardial infarction Study (TAPAS):a 1-year follow-up study. Lancet. 2008;371:1915-1920.
6. Jurado-Roman A, Sanchez-Perez I, Lozano-Ruiz-Poveda F. Letter by Jurado-Roman et al Regarding Article, “Thrombus Aspiration in ST-Segment-Elevation Myocardial Infarction:An Individual Patient Meta-Analysis:Thrombectomy Trialists Collaboration“. Circulation. 2017;135:e1099-e1100.
7. Frobert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med. 2013;369: 1587-1597.
8. Lagerqvist B, Frobert O, Olivecrona GK, et al. Outcomes 1 year after thrombus aspiration for myocardial infarction. N Engl J Med. 2014;371: 1111-1120.
9. Jolly SS, Cairns JA, Yusuf S, et al.;for the TOTAL Investigators. Randomized trial of primary PCI with or without routine manual thrombectomy. N Engl J Med. 2015;372:1389-1398.
10. Wijns W, Kolh P, Danchin N, et al.;Task Force on Myocardial Revascularization of the European Society (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS), European Association for Percutaneous Cardiovascular Interventions (EAPCI). Guidelines on myocardial revascularization. Eur Heart J. 2010;31:2501-2555.
11. O'Gara PT, Kushner FG, Ascheim DD, et al.;American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;127:e362-425.
12. Levine GN, Bates ER, Blankenship JC, et al.;American College of Cardiology Foundation;American Heart Association Task Force on Practice Guidelines;Society for Cardiovascular Angiography and Interventions. 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. J Am Coll Cardiol. 2011;58:e44-122.
13. Neumann FJ, Sousa-Uva M, Ahlsson A, et al.;Group ESCSD. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
14. Levine GN, Bates ER, Blankenship JC, et al. 2015 ACC/AHA/SCAI Focused Update on Primary Percutaneous Coronary Intervention for Patients With ST-Elevation Myocardial Infarction:An Update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention and the 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. J Am Coll Cardiol. 2016;67:1235-1250.
15. Cid Álvarez AB, Rodríguez Leor O, Moreno R, Pérez de Prado A. Spanish Cardiac Catheterization and Coronary Intervention Registry. 27th Official Report of the Spanish Society of Cardiology Working Group on Cardiac Catheterization and Interventional Cardiology (1990-2017). Rev Esp Cardiol. 2018;71:1036-1046.
16. Windecker S, Kolh P, Alfonso F, et al.;Authors/Task Force members. 2014 ESC/EACTS Guidelines on myocardial revascularization:The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35: 2541-2619.
17. Chesebro JH, Knatterud G, Roberts R, et al. Thrombolysis in Myocardial Infarction (TIMI) Trial, Phase I:A comparison between intravenous tissue plasminogen activator and intravenous streptokinase. Clinical findings through hospital discharge. Circulation. 1987;76:142-154.
18. Sianos G, Papafaklis MI, Serruys PW. Angiographic thrombus burden classification in patients with ST-segment elevation myocardial infarction treated with percutaneous coronary intervention. J Invasive Cardiol. 2010; 22:6B-14B.
19. Thygesen K, Alpert JS, Jaffe AS, et al.;ESC Committee for Practice Guidelines (CPG). Third universal definition of myocardial infarction. Eur Heart J. 2012;33:2551-2567.
20. Cutlip DE, Windecker S, Mehran R, et al. Academic Research Consortium. Clinical end points in coronary stent trials:a case for standardized definitions. Circulation. 2007;115:2344-2351.
21. Mahmoud KD, Jolly SS, James S, et al. Clinical impact of direct stenting and interaction with thrombus aspiration in patients with ST-segment elevation myocardial infarction undergoing percutaneous coronary intervention:Thrombectomy Trialists Collaboration. Eur Heart J. 2018;39: 2472-2479.
22. Jolly SS, Cairns JA, Lavi S, et al.;TOTAL Investigators. Thrombus Aspiration in Patients With High Thrombus Burden in the TOTAL Trial. J Am Coll Cardiol. 2018;72:1589-1596.
23. Stone GW, Maehara A, Witzenbichler B, et al.;INFUSE-AMI Investigators. Intracoronary abciximab and aspiration thrombectomy in patients with large anterior myocardial infarction:the INFUSE-AMI randomized trial. JAMA. 2012;307:1817-1826.
24. Sabate M, Brugaletta S. Thrombectomy and Stroke:Guilty or Innocent Bystander?J Am Coll Cardiol. 2018;72:1597-1599.
25. Spitzer E, Heg D, Stefanini GG, et al. Aspiration Thrombectomy for Treatment of ST-segment Elevation Myocardial Infarction:a Meta-analysis of 26 Randomized Trials in 11,943 Patients. Rev Esp Cardiol. 2015;68: 746-752.
Corresponding author: Unidad de Cardiología Intervencionista, Hospital General Universitario de Ciudad Real, Avda. del Obispo Rafael Torija s/n, 13005 Ciudad Real, España.
Correo electrónico: alfonsojuradoroman@gmail.com (A. Jurado-Román).