RESUMEN
Introducción y objetivos: El implante percutáneo de válvula pulmonar es, actualmente, un procedimiento habitual en pacientes con cardiopatías congénitas con un tracto de salida del ventrículo derecho disfuncionante. Hasta abril de 2022, en Europa solo estaban disponibles las válvulas expandibles con balón, que no cubrían las necesidades de las distintas anatomías del tracto de salida derecho. Desde ese año está disponible la válvula autoexpandible Venus P (MedTech, China). Presentamos la experiencia inicial en nuestro centro con esta nueva válvula pulmonar para implante percutáneo.
Métodos: Descripción de los implantes valvulares con la nueva válvula autoexpandible realizados entre septiembre y noviembre de 2022.
Resultados: Se han realizado 8 implantes valvulares, todos con éxito y sin complicaciones graves durante el procedimiento. Todos los pacientes presentaban insuficiencia pulmonar grave con repercusión sobre el ventrículo derecho y dilatación del tronco pulmonar, y no eran buenos candidatos para las válvulas expandibles con balón. Cinco pacientes tenían una tetralogía de Fallot de base. En 7 pacientes el implante se llevó a cabo por vía femoral y en 1 por vía yugular. Como medida de seguridad, en todos los pacientes el implante se hizo a través de una vaina DrySeal (Gore, W.L. Gore & Associates, Inc., Estados Unidos). La media de tiempo de ingreso fue de 3 días.
Conclusiones: El implante de la nueva válvula autoexpandible Venus P fue, en nuestra experiencia preliminar, un procedimiento seguro y factible, que permite valvular tractos de salida derechos muy dilatados con contraindicación para las actuales válvulas expandibles con balón.
Palabras clave: Implante percutáneo valvular. Válvula pulmonar Venus P. Tetralogía de Fallot. Insuficiencia pulmonar. Válvula pulmonar. Cardiopatías congénitas.
ABSTRACT
Introduction and objectives: Percutaneous pulmonary valve implantation is currently a common procedure in patients with congenital heart disease with a dysfunctional right ventricular outflow tract. Until April 2022, there were only balloon-expandable valves available in Europe, which did not cover the needs of the different anatomies of the right ventricular outflow tract. Since this year we have available the self-expandible Venus P-valve (MedTech, China). We present the initial experience with this new percutaneous pulmonary valve in our center.
Methods: Description of the valve implants with the new self-expandible valve performed between September and November 2022.
Results: Eight valve implants have been performed, all successful and without severe complications during the procedure. All patients had severe pulmonary regurgitation with a dilated right ventricle and severe dilatation of the pulmonary trunk and were not good candidates for percutaneous balloon-expandable valves. Five patients had a tetralogy of Fallot. In 7 patients, the implant was performed through the femoral vein and in one through jugular access. As a safety measure, all valves were implanted through a DrySeal sheath (Gore, W.L. Gore & Associates, Inc., USA). The mean hospital stay was 3-day.
Conclusions: Valve implantation with the new self-expandible Venus P-valve was, in our preliminary experience, a safe and feasible procedure, allowing us to treat very dilated right outflow tracts, not suitable for the current balloon-expandable valves.
Keywords: Percutaneous valve implantation. Venus P-valve. Tetralogy of Fallot. Pulmonary regurgitation. Pulmonary valve. Congenital heart disease.
Abreviaturas
RM: resonancia magnética. TC: tomografía computarizada. TP: tronco pulmonar. TSVD: tracto de salida del ventrículo derecho. VD: ventrículo derecho.
INTRODUCCIÓN
El implante percutáneo de válvula pulmonar es, actualmente, un procedimiento habitual en pacientes con cardiopatías congénitas con un tracto de salida del ventrículo derecho (TSVD) disfuncionante1. Las válvulas pulmonares percutáneas expandibles con balón (Melody, Medtronic Inc., Estados Unidos, y Sapien, Edwards Lifescience, Estados Unidos, ambas con marcado de la Comunidad Europea [CE]) tienen indicación para ser implantadas en conductos, tractos nativos y prótesis valvulares1-3. Sin embargo, un alto porcentaje de los pacientes que requieren un implante de válvula pulmonar son pacientes intervenidos mediante reparación transanular, en su mayoría con tetralogía de Fallot, o con insuficiencia pulmonar poscomisurotomía o valvuloplastia de estenosis pulmonar, con tractos de salida muy pulsátiles y con dimensiones mayores que el tamaño de la actuales válvulas expandibles con balón (22 mm para Melody y 29 mm para Edwards4); incluso la válvula Myval (Meril Life Sciences Pvt. Ltd., India), de 32 mm, sin indicación para implante pulmonar, no sería adecuada para los TSVD más grandes.
En abril de 2022, la válvula autoexpandible Venus P (MedTech, China) consiguió el marcado CE y representa una alternativa para los tractos nativos de mayor tamaño.
Presentamos la experiencia inicial con esta nueva válvula pulmonar en nuestro centro y en nuestro país.
MÉTODOS
Descripción de la válvula
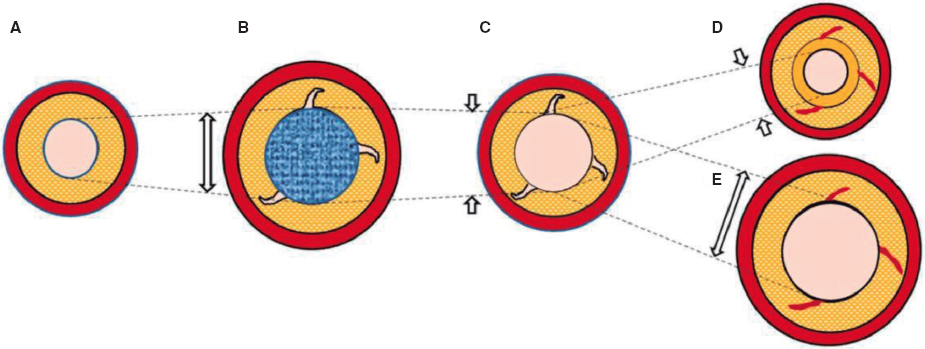
La estructura de la válvula Venus P está formada por un stent de nitinol; las valvas y el recubrimiento del stent son de pericardio porcino. El nitinol otorga al stent una memoria de forma que le permite adaptarse adecuadamente al tronco pulmonar (TP) sin comprimir las estructuras vecinas. Esta válvula está disponible en tamaños desde 28 hasta 36 mm de diámetro, con incrementos de 2 mm (figura 1), y es adecuada para los tractos nativos de mayor calibre5. El stent de la válvula Venus P tiene forma de diábolo y mide 10 mm más en los extremos que en la zona central (figura 1). Al ser más ancha en los extremos, la válvula está diseñada para ser implantada idealmente en TP tubulares, sin estenosis distales ni de las arterias pulmonares. La zona central y el extremo proximal están recubiertos de pericardio porcino para evitar fugas paravalvulares, y el extremo distal está sin recubrir, evitando así la oclusión de las arterias pulmonares (figura 2)6. El stent presenta unas marcas radioopacas en el extremo distal de la parte tubular y en su extremo proximal, que indican el nivel de inserción de la válvula porcina. El crimpado de la válvula sobre su sistema de liberación se realiza bajo agua helada. En estas condiciones, el nitinol se ablanda y puede crimparse sobre el sistema de liberación (figura 3). La válvula se fija al sistema de liberación por 2 pequeños ganchos u orejas (ears) (figura 2). Una vez enganchada y reducido el tamaño, se cubre la válvula con la cápsula de la vaina del sistema de liberación, de tal manera que la válvula entra en el paciente recubierta (figura 3 y figura 4). Esta vaina es de 22 Fr en las válvulas de 28 y 30 mm, y de 24 Fr en las más grandes (> 30 mm). Una vez situada en el árbol pulmonar en la localización elegida, al retraer la cápsula del sistema de liberación la válvula recuperará su forma de diábolo al entrar en contacto con el torrente sanguíneo, a una temperatura de 36-37 °C.
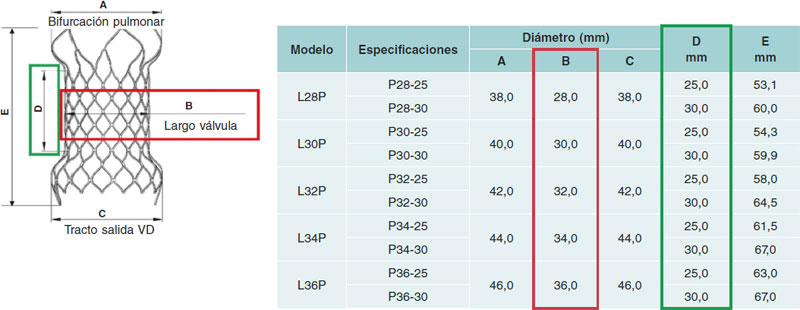
Figura 1. Tabla de selección de tamaños valvulares, mostrando las dimensiones de las distintas partes de la válvula. VD: ventrículo derecho.
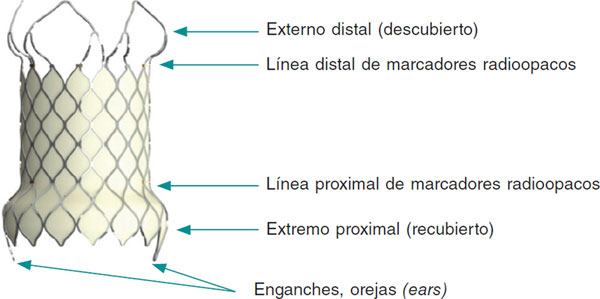
Figura 2. Imagen de la válvula Venus P en la que se observan su forma de diábolo, el recubrimiento de toda la válvula dejando el extremo distal sin recubrir y los marcadores radioopacos.
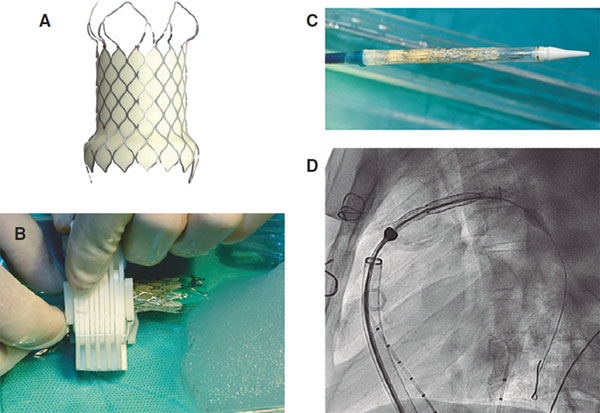
Figura 3. A: válvula Venus P antes del crimpado. B: crimpado de la válvula sobre el sistema de liberación, realizado en solución salina fisiológica helada y con un crimpador específico. C: válvula crimpada dentro del sistema de liberación y recubierta por una cápsula. D: radioscopia en la que se la válvula en el sistema de liberación, dentro de la cápsula, ya introducida en la arteria pulmonar del paciente.
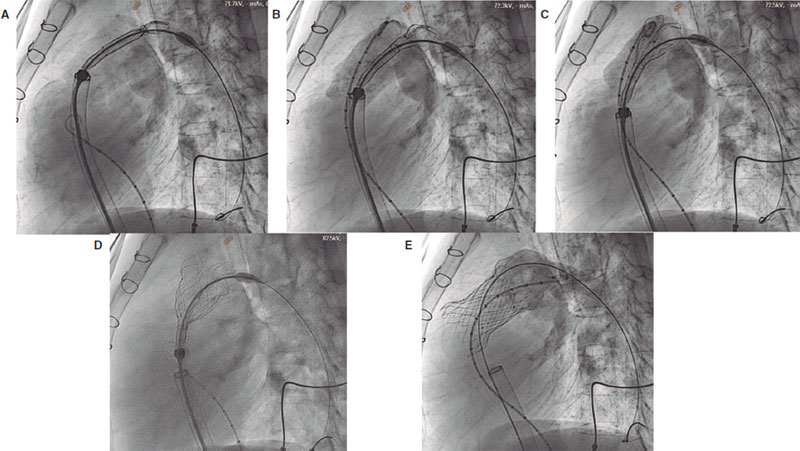
Figura 4. Proceso de implante valvular. A-D: retirada lenta de la cápsula para dejar que la válvula se vaya conformando y adaptándose al tracto de salida del ventrículo derecho (TSVD). Realizamos controles de angiografía con el pigtail colocado en el TSVD. E: resultado final tras el implante valvular.
Descripción del procedimiento
El cateterismo se realizó bajo anestesia general con el paciente intubado y con heparinización a 100 U/kg. Se canalizaron 2 venas femorales, una para el cateterismo diagnóstico, el tallado y el avance del sistema de liberación de la válvula, y la otra para realizar angiografías de control con un catéter pigtail en el TSVD durante el implante valvular (figura 4). En todos los pacientes se realizó una interrogación de las arterias coronarias mediante aortograma o coronariografía selectiva, con el balón de tallado de 34 mm (Sizing Balloon, AGA Medical Corp., Estados Unidos) inflado en el TSVD, para descartar el riesgo de compresión coronaria durante el procedimiento (figura 5B). Asimismo, se realizó también un tallado del TSVD con el mismo balón de 34 mm para comprobar la idoneidad de la anatomía y elegir el diámetro y la longitud de la válvula. El tallado se consideró oclusivo cuando descendió la presión aórtica durante el inflado del balón y se comprobó angiográficamente la ausencia de paso de flujo del ventrículo derecho (VD) a las arterias pulmonares mediante una inyección de contraste en el VD durante el máximo inflado del balón (figura 5A).
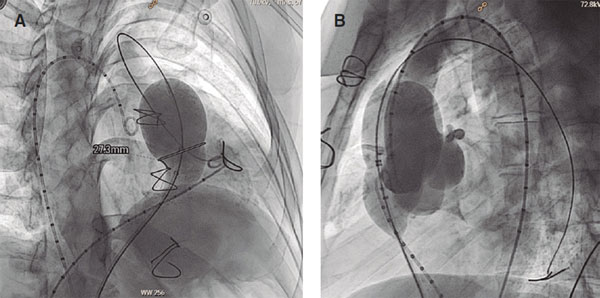
Figura 5. Tallado del tracto de salida del ventrículo derecho con balón de tallado de 34 mm. A: angiografía simultánea en el ventrículo derecho en la que no se observa que la oclusión sea completa. El balón presenta una muesca a nivel de la estenosis de 27 mm. B: interrogación de las arterias coronarias durante el inflado del balón de tallado, sin observar compromiso coronario.
Aunque las pruebas de imagen realizadas en la planificación (tomografía computarizada [TC] con o sin resonancia magnética [RM]) orientan sobre qué tamaño de válvula va a ser necesario en cada paciente, elegimos el tamaño basándonos en las medidas de las angiografías (lateral y oblicua derecha craneada 30°-30°) y en el diámetro y la localización de la muesca observada en el balón durante el tallado oclusivo. El tallado con balón permite valorar la distensibilidad del TP, algo que solo podemos intuir con las imágenes de RM, y por tanto este paso es determinante en la elección del tamaño valvular. Elegimos una válvula unos 2-4 mm mayor que la cintura del balón de tallado y con una longitud que permitiera dejar la parte distal a nivel de la bifurcación pulmonar y el extremo proximal del diábolo en el VD.
La válvula Venus P se implanta sin necesidad de implantar previamente un stent para crear una zona de aterrizaje (landing zone). Se coloca una guía Lunderquist (Cook Medical, Dinamarca) de alto soporte preferiblemente en la arteria pulmonar izquierda. En caso de estenosis, hipoplasia o ángulo desfavorable, la guía se coloca en la arteria pulmonar derecha. El sistema de liberación se avanza a través de una vaina Dryseal (Gore, W.L. Gore & Associates, Inc., Estados Unidos) de 65 cm y 26 Fr para las válvulas > 30 mm de diámetro o de 24 Fr para las menores. Una vez posicionada la vaina Dryseal en la arteria pulmonar elegida, se avanza el sistema de liberación de la válvula Venus P. Seguidamente se retrae la vaina Dryseal y se comprueba la correcta posición de la cápsula en la arteria pulmonar. Entonces se procede a descubrir lentamente la válvula, retirando la cápsula (girando la rueda del sistema de liberación en sentido horario). Al entrar en contacto con la sangre del paciente, la válvula va recuperando su estructura habitual en forma de diábolo. Cuando ya se ha conformado parcialmente el extremo más distal en la rama pulmonar, se retira suavemente todo el sistema al TP y se continúa descubriendo lentamente la válvula, comprobando mediante inyecciones con un pigtail en el TSVD que la posición de la válvula es correcta (figura 4). La válvula tiene 2 líneas de marcadores radioopacos que guían durante el implante. Las marcas distales que indican el extremo distal de la parte tubular del stent quedarán a nivel de la bifurcación. Las marcas proximales deberán quedar a nivel de la zona más estrecha del TP o del anillo nativo (donde observamos la muesca durante el tallado con balón), lo que reduce el riesgo de embolización. La parte proximal de la válvula, 10 mm mayor que la zona central, quedará alojada, en la mayoría de los casos, en el infundíbulo del VD.
El procedimiento se lleva a cabo con una vaina Dryseal para facilitar la navegación del sistema de liberación de la válvula y para asegurar una adecuada recaptura de la válvula en caso de necesitar reposicionarla. La válvula se puede recapturar hasta que se ha descubierto la mitad de su estructura.
Al finalizar el procedimiento, en todos los pacientes se hizo un aortograma (preferentemente en caudal 30° más oblicua anterior izquierda 20°) para comprobar la ausencia de compresión de las arterias coronarias (figura 6).
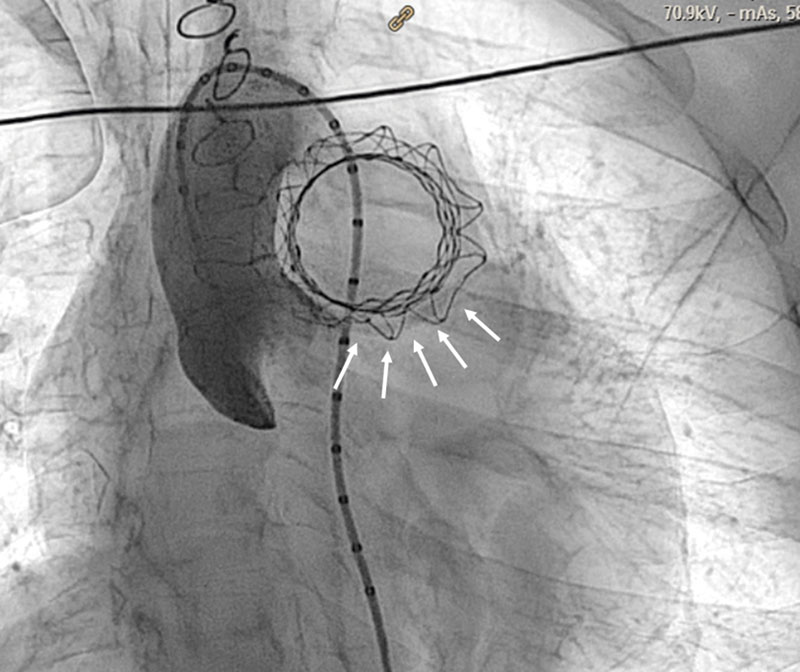
Figura 6. Aortograma final para valorar las arterias coronarias. Las flechas indican el recorrido de la arteria descendente anterior.
Selección de los pacientes
En los pacientes potencialmente candidatos y con criterios de valvulación según las guías de la Sociedad Europea de Cardiología7,8 se hizo un estudio previo mediante cateterismo diagnóstico o RM con o sin TC para valorar si la anatomía era adecuada para implantar una válvula Venus P (figura 7). Las imágenes de TC o de RM fueron analizadas por los técnicos de imagen de MedTech y se discutieron con el equipo de hemodinamistas de nuestro hospital mediante videoconferencia. Tras el análisis de las imágenes, se determinaron la idoneidad para el implante valvular y los tamaños de válvula más adecuados a las dimensiones del TSVD del paciente, aunque el tamaño final no se decidió hasta haber realizado el tallado con balón durante el cateterismo.
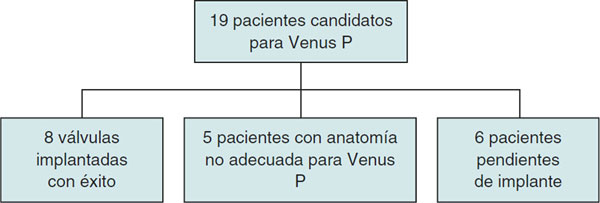
Figura 7. Diagrama de flujo de la inclusión de pacientes.
Este primer estudio de imagen permitió descartar 5 pacientes que no presentaban una anatomía adecuada para esta válvula: 2 pacientes con stents y estenosis en las arterias pulmonares, 2 pacientes con un TSVD de dimensiones mayores que las adecuadas para esta válvula y 1 paciente con un tracto de salida piramidal.
Descripción del estudio
Realizamos un estudio prospectivo de los primeros pacientes a quienes se ha implantado una válvula Venus P en nuestro centro, entre el 20 de septiembre y el 4 de noviembre de 2022. Se trata de los primeros implantes con esta válvula realizados en España.
Criterios de inclusión
Se incluyeron pacientes con disfunción del TSVD nativo e indicación de valvulación pulmonar en los que el cateterismo diagnóstico y el test de tallado permitieron proceder con el implante valvular.
Variables
Se recogieron datos demográficos, antropométricos, de pruebas de imagen y del procedimiento para realizar un análisis descriptivo de nuestra experiencia.
Definiciones
Las complicaciones se categorizan como menores o mayores. Las complicaciones mayores fueron muerte, efectos adversos potencialmente letales y eventos que requirieran cirugía (embolización, perforación miocárdica, rotura vascular, IP residual, hemólisis, lesión valvular). Se consideraron complicaciones menores aquellas que revierten espontáneamente o con tratamiento médico sin tener potencialmente un desenlace fatal (problemas de accesos vasculares, fiebre, neuroapraxias, etc.). El implante se consideró con éxito si en las 24 horas posteriores el paciente no presentaba complicaciones mayores.
RESULTADOS
Entre el 20 de septiembre y el 4 de noviembre de 2022 implantamos 8 válvulas Venus P en 8 pacientes en nuestro centro. La patología de base fue tetralogía de Fallot en 5 pacientes, atresia pulmonar con comunicación interventricular en 1 paciente, canal auriculoventricular con estenosis pulmonar en 1 paciente, y comunicación interventricular y cerclaje de la arteria pulmonar (banding) en 1 paciente que requirió una ampliación del TSVD en su evolución. En todos los casos, los pacientes tenían un parche transanular. Además, todos los pacientes presentaban insuficiencia pulmonar grave con repercusión sobre el VD y dilatación del TP, y no eran buenos candidatos para las válvulas percutáneas expandibles con balón por el tamaño de su TSVD. En la tabla 1 se encuentra una descripción general de los pacientes.
Tabla 1. Descripción general de la muestra
| Paciente | Sexo | Edad (años) | Peso (kg) | VD (ml/m2) | TP (mm) RM | TP (mm) TC | TP (mm) angiografía | Tallado con balón (mm) | Tamaño válvula |
|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 41 | 56 | 122 | 28 | ND | 26 | 26 | 30-25 |
| 2 | M | 34 | 62 | 164 | 28 | 27 | 28 | 28 | 32-25 |
| 3 | F | 25 | 66 | ND | ND | ND | 28 | 28 | 32-25 |
| 4 | M | 33 | 90 | ND | ND | 33 | 31 | 32 | 36-25 |
| 5 | M | 34 | 68 | 134 | 31 | ND | 26 | 27 | 34-25 |
| 6 | M | 17 | 63 | 173 | 29 | 31 | 31 | 31 | 34-25 |
| 7 | M | 45 | 68 | ND | ND | 34 | 26 | 32 | 34-30 |
| 8 | F | 43 | 42 | 130 | 25 | ND | 24 | 24 | 28-25 |
F: femenino; M: masculino; ND: no disponible; RM: resonancia magnética; TC: tomografía computarizada; TP: tronco pulmonar; VD: ventrículo derecho. | |||||||||
Todos los pacientes tenían un TP dilatado valorado por TC o RM (por lo que eran candidatos subóptimos para las válvulas expandibles con balón) y un TP tubular sin estenosis en al menos una de las arterias pulmonares.
En todos los pacientes la válvula se implantó con éxito, sin complicaciones y con una competencia valvular óptima inmediatamente tras el implante. Se llevaron a cabo 7 implantes con acceso femoral y 1 por la vena yugular derecha, debido a trombosis venosa femoral bilateral. En 6 casos se colocó la guía de alto soporte en la arteria pulmonar izquierda y en 2 casos en la arteria pulmonar derecha, uno por una estenosis moderada de la arteria pulmonar izquierda y otro por ser acceso yugular. En 7 casos se usó una vaina Dryseal de 26 Fr y en 1 la de 24 Fr, a través de la que se llevó a cabo el implante valvular. La longitud de las válvulas implantadas fue de 25 mm (n = 7) y de 30 mm (n = 1).
La mediana de tiempo de escopia fue de 34 minutos (rango intercuartílico: 32-37) y la dosis media de radiación fue de 307 mGy/m2(desviación estándar: 64,4). Observamos una adecuada correlación entre las medidas del TP realizadas por TC y RM y las medidas de angiografía y tallado con balón.
No hubo complicaciones graves en ningún caso. En 1 paciente, durante la liberación de la válvula, uno de los anclajes proximales se quedó enganchado en el sistema de liberación debido a una retirada incompleta de la cápsula que recubre la válvula, y se resolvió sin eventos adversos (figura 8). Tres pacientes presentaron dolor torácico de carácter leve en las 24 horas siguientes al implante, sin elevación de las troponinas ni alteraciones electrocardiográficas, y 1 paciente asoció dolor escapular derecho. Uno de los pacientes presentó extrasistolia ventricular frecuente que se inició justo tras el implante valvular y que disminuyó espontáneamente en las 48 horas siguientes, sin precisar tratamiento al alta. Un paciente tuvo febrícula en las 48 horas siguientes al implante, sin elevación de los reactantes de fase aguda.
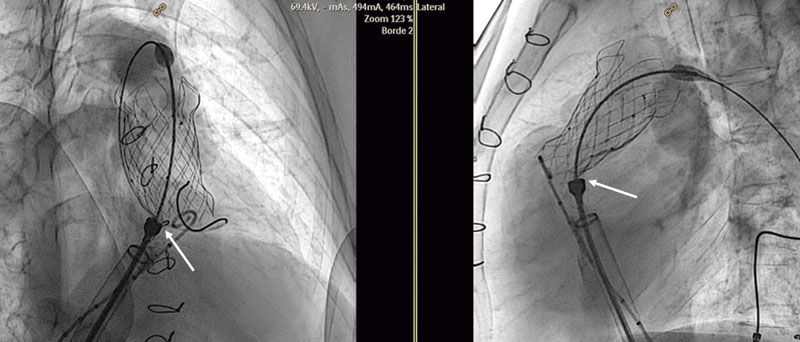
Figura 8. Las flechas señalan, en 2 proyecciones, cómo una de las orejas de anclaje de la válvula sigue enganchada al sistema de liberación, impidiendo el despliegue completo de la válvula.
La media de días de ingreso fue de 3 (rango: 2-4). Se dio de alta a todos los pacientes con tratamiento con ácido acetilsalicílico.
DISCUSIÓN
El implante percutáneo valvular pulmonar es, actualmente, un procedimiento habitual en las salas de hemodinámica de las unidades de cardiopatías congénitas. Hasta ahora, las válvulas disponibles, con tamaños de hasta 29 mm, dejaban sin opción terapéutica percutánea a un porcentaje importante de pacientes. En algunos casos se recurría a técnicas fuera de guía (implante de varios stents en el TP para reducir su calibre, anclaje del stent en la arteria pulmonar izquierda, etc.) o a implante de válvulas expandibles con balón de mayor tamaño con indicación para la aorta (Myval de 32 mm) y no aprobadas para TSVD9.
Entre las principales ventajas de la válvula Venus P se encuentra la posibilidad de realizar el cateterismo diagnóstico y el implante valvular en un único procedimiento, al no requerir el implante de un stent previo para crear una zona de aterrizaje (como ocurría con la válvula Melody y la Edwards en muchos tractos nativos). En los troncos pulmonares más dilatados (> 24-26 mm) es práctica frecuente implantar un stent en un primer tiempo, esperar al menos 6 semanas para su endotelización y así minimizar el riesgo de embolización durante las manipulaciones del implante valvular, lo que requiere un segundo cateterismo para implantar la válvula. Otra ventaja de la válvula Venus P es su fácil manejo, que resulta en un procedimiento corto y con tiempos de escopia de 34 minutos en nuestros casos, inferiores a los de nuestra serie con TSVD nativos y otras válvulas, que oscilan entre 40 y 50 minutos.
La flexibilidad de la válvula permite que se adapte adecuadamente al TP sin ejercer fuerza radial sobre las estructuras adyacentes, lo que supone una ventaja para los casos de anatomías coronarias relacionadas con el TSVD.
En 7 pacientes usamos la válvula corta, de 25 mm, ya que la anatomía del TP era adecuada para esta longitud. A mayor longitud, la válvula pierde flexibilidad y podría presentar mayor riesgo de fracturas a largo plazo. Hasta la fecha se ha descrito un porcentaje de fracturas del 11 al 27%, sin que se hayan observado complicaciones ni pérdida de la competencia valvular relacionada con las fracturas5,10.
Hay que poner especial atención a la retirada completa de la cápsula durante el final de la liberación valvular, ya que si no es completa, como en nuestro caso (figura 8), las orejas no se desenganchan y la válvula no se libera, y puede embolizar el VD11. Para estar seguro del desenganche conviene revisar que se ven las orejas en al menos 2 proyecciones6.
La forma de diábolo hace que esta válvula no sea adecuada para todas las anatomías de TSVD. No es recomendable en casos de estenosis distales a nivel del TP o del origen de las arterias pulmonares, ya que estas estenosis limitarían la apertura del extremo distal de la válvula. En relación con esta forma, más ancha en sus extremos, se ha descrito la aparición de extrasistolia ventricular transitoria por el contacto del extremo proximal con el infundíbulo, sin que hasta la fecha se hayan producido arritmias que precisaran ablación o cardioversión. En nuestra experiencia, solo 1 paciente presentó extrasistolia frecuente sin documentar arritmias ventriculares sostenidas.
En el ensayo clínico (NCT 02846753) realizado para la obtención del marcado CE se observó una endocarditis aislada (incidencia del 1,2%). Cuando se disponga de un seguimiento a largo plazo podrá evaluarse la incidencia de endocarditis, fracturas y disfunción valvular.
Limitaciones
El corto seguimiento de los pacientes supone la principal limitación de este estudio. Estamos realizando un seguimiento estrecho de los pacientes, incluyendo Holter y pruebas de imagen (ecocardiografía, TC y RM), para poder evaluar adecuadamente la evolución a medio y largo plazo tras el implante valvular. Otra limitación es la ausencia de grupo quirúrgico de control, por lo que la comparación solo es posible con una cohorte histórica.
CONCLUSIONES
El implante de la nueva válvula autoexpandible Venus P es, en nuestra experiencia preliminar, un procedimiento seguro y factible, que permite valvular TSVD muy dilatados con contraindicación para las actuales válvulas expandibles con balón con marcado CE.
FINANCIACIÓN
Este estudio no ha recibido financiación.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido en el tratamiento y el seguimiento de los pacientes, y en la recogida de datos, y han aprobado la versión final del texto. M. Álvarez-Fuente y M.J. del Cerro realizaron el diseño del estudio y el análisis de los datos, así como la redacción del manuscrito. I. Hernández e I. García Ormazábal también han colaborado en la redacción del manuscrito.
CONFLICTO DE INTERESES
Ningún autor presenta conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- El implante percutáneo de válvula pulmonar es un procedimiento frecuente en los pacientes con cardiopatías congénitas, pero las válvulas actuales no son adecuadas para todas las variantes anatómicas ni para todos los tamaños de tronco pulmonar.
- Se están desarrollando nuevas válvulas autoexpandibles con mayores diámetros para dar solución a este problema.
¿QUÉ APORTA DE NUEVO?
- La experiencia con la nueva válvula pulmonar autoexpandible Venus P ha resultado ser satisfactoria en los 8 prime-ros implantes en nuestro centro.
- Nos ha permitido valvular percutáneamente a pacientes que por su anatomía hubieran requerido una cirugía.
- Esta nueva válvula permite el implante en un único tiempo y tiene un manejo sencillo.
BIBLIOGRAFÍA
1. McElhinney DB, Hellenbrand WE, Zahm EM, et al. Short- and medium-term outcomes after transcatheter pulmonary valve placement in the expanded multicenter US melody valve trial. Circulation. 2010;122:507-516.
2. Bonhoeffer P, Boudjemline Y, Saliba Z, et al. Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction. Lancet. 2000;356:1403-1405.
3. Boone RH, Webb JG, Horlick E, et al. Transcatheter pulmonary valve implantation using the Edwards SAPIEN transcatheter heart valve. Catheter Cardiovasc Interv. 2010;75:286-294.
4. Schievano S, Coats L, Migliavacca F, et al. Variations in right ventricular outflow tract morphology following repair of congenital heart disease: implications for percutaneous pulmonary valve implantation. J Cardiovasc Magn Reson. 2007;9:687-695.
5. Sivakumar K, Sagar P, Qureshi S, et al. Outcomes of Venus P-valve for dysfunctional right ventricular outflow tracts from Indian Venus P-valve database. Ann Pediatr Cardiol. 2021;14:281-292.
6. Garay F, Pan X, Zhang YJ, Wang C, Springmuller D. Early experience with the Venus p-valve for percutaneous pulmonary valve implantation in native outflow tract. Neth Heart J. 2017;25:76-81.
7. Alvarez-Fuente M, Garrido-Lestache E, Fernandez-Pineda L, et al. Timing of Pulmonary Valve Replacement: How Much Can the Right Ventricle Dilate Before it Looses Its Remodeling Potential? Pediatr Cardiol. 2016;37:601-605.
8. Baumgartner H, De Backer J, Babu-Narayan SV, et al.; ESC Scientific Document Group. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J. 2021;42:563-645.
9. Rodríguez Ogando A, Ballesteros F, Martínez JLZ. Pulmonary percutaneous valve implantation in large native right ventricular outflow tract with 32 mm Myval transcatheter heart valve. Catheter Cardiovasc Interv. 2022;99:E38-E42.
10. Morgan G, Prachasilchai P, Promphan W, et al. Medium-term results of percutaneous pulmonary valve implantation using the Venus P-valve: international experience. EuroIntervention. 2019;14:1363-1370.
11. Promphan W, Prachasilchai P, Siripornpitak S, Qureshi SA, Layangool T. Percutaneous pulmonary valve implantation with the Venus P-valve: clinical experience and early results. Cardiol Young. 2016;26:698-710.
* Autores para correspondencia.
Correos electrónicos: maria.alvarezfuente@gmail.com (M. Álvarez-Fuente); majecerro@yahoo.es (M.J. del Cerro).