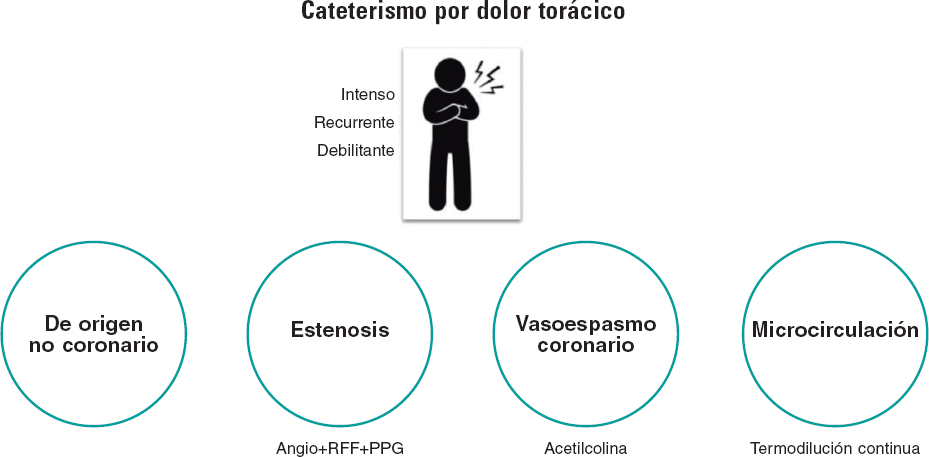
En pocas palabras, el objetivo de la coronariografía diagnóstica es diferenciar el origen del dolor torácico de un paciente entre 1 de 4 endotipos: a) estenosis epicárdica; b) espasmo coronario; c) enfermedad microvascular coronaria (EMC); y d) igualmente importante, dolor torácico no coronario. Resulta imperativo señalar que este último es un diagnóstico por descarte y, por lo tanto, no puede confirmarse sin realizar una valoración formal de los demás mecanismos implicados (figura 1). A pesar de esta verdad palmaria, la interpretación de la mayoría de las coronariografías se limita a la mera «observación» de un «sombragrama». Un abordaje con un bajo rendimiento diagnóstico, ya que el 40% de los pacientes no presentan estenosis epicárdicas significativas, una entidad conocida como angina sin enfermedad coronaria obstructiva (ANOCA)1. A pesar de la presencia de angina típica o de la evidencia de isquemia durante las pruebas no invasivas, estos pacientes suelen quedar descartados sin más sin un diagnóstico formal.
Figura 1. Se debe realizar un cateterismo con coronariografía a los pacientes que presentan dolor torácico intenso, recurrente y debilitante y, cuando sea necesario, pruebas de la función coronaria para averiguar el mecanismo desencadenante del dolor. El dolor torácico de origen no coronario es un diagnóstico de exclusión y, por lo tanto, solo puede confirmarse tras valorar otros 3 mecanismos. RFF: reserva fraccional de flujo; PPG: gradiente de presión en retirada.
Este grupo tan grande de pacientes es heterogéneo y establecer la causa subyacente de la ANOCA requiere de un protocolo exhaustivo de pruebas de la función coronaria (PFC) incluida una angiografía diagnóstica, pruebas de provocación de microespasmo o vasoespasmo epicárdico y valoración de la EMC2. No obstante, en muchos centros, la angiografía diagnóstica no suele complementarse con una PFC. En aquellos centros que sí, las pruebas suelen ser incompletas y los pacientes suelen no ser diagnosticados de la causa de base de su ANOCA ni beneficiarse de tratamientos específicos para su endotipo concreto. Posibles explicaciones de este comportamiento son la falta de familiaridad con las causas que dan origen a la ANOCA, una falta de conocimiento sobre los tipos de pruebas disponibles, preocupaciones en torno a la precisión de las pruebas y la creencia de que las enfermedades de base no se pueden tratar.
En un reciente artículo publicado en REC: Interventional Cardiology, Rinaldi et al.3 describen su experiencia de un único centro con la implementación de un protocolo específico para el diagnóstico y tratamiento de la ANOCA en el Hospital Clínic de Barcelona (España). En este programa, todos los pacientes con ANOCA recibieron PFC sistemáticas con termodilución en bolo para calcular la reserva de flujo coronario y el índice de resistencia microvascular y pruebas de provocación intracoronaria para valorar el espasmo epicárdico o microvascular. Atendiendo a los resultados de estas pruebas, se clasificó a los pacientes en 1 de 4 endotipos: a) angina microvascular (AMV) (EMC o espasmo microvascular); b) angina vasoespástica (espasmo epicárdico); c) AMV y angina vasoespástica y d) dolor torácico no coronario.
Los autores demostraron que, tras identificar los endotipos específicos de la ANOCA, las prescripciones médicas dirigidas (bloqueadores beta, bloqueadores de los canales de calcio no dihidropiridínicos y nitratos de acción prolongada) aumentaron significativamente. No obstante, aunque esto no se tradujo en una mejoría estadísticamente significativa de la calidad de vida entre los valores basales y a los 3 meses, la angina mejoró significativamente en términos de limitación física, estabilidad de la angina y percepción de la enfermedad. Se debe mencionar que el protocolo resultó seguro, comunicándose, solo, 3 eventos adversos menores, todos durante la administración de acetilcolina (bradicardia transitoria, fibrilación auricular paroxística con cardioversión espontánea).
Este trabajo tiene fortalezas importantes que se deben mencionar. El ensayo CorMicA ofrece la primera evidencia científica de un ensayo controlado aleatorizado de los beneficios de la PFC sistemática con terapia médica dirigida4. No obstante, hasta la fecha, hay poca información del mundo real sobre la implementación de tales protocolos en la práctica clínica habitual. Como tal, este pequeño estudio observacional del mundo real es muy bienvenido. Más allá de los resultados clínicos obtenidos en un número relativamente pequeño de pacientes, el trabajo de Rinaldi et al.3 es sumamente valioso por diferentes aspectos metodológicos, 3 de los cuales se discuten a continuación.
(i) ¿Qué pacientes deben entrar en este programa y cómo? Los pacientes fueron cribados en una clínica ambulatoria específica y su inclusión se basó en criterios bien estandarizados. Lo ideal es que, solo aquellos pacientes con síntomas convincentes, recurrentes e incapacitantes reciban una PFC. La utilidad de dicho programa se reduce significativamente si se derivan pacientes con síntomas poco convincentes o una alta probabilidad de enfermedad epicárdica antes de realizar la prueba. Se debe mencionar que el creciente papel que juega la angiotomografía computarizada en el cribado de enfermedades epicárdicas en pacientes anginosos permite, en la actualidad, diagnosticar la ANOCA sin tener que realizar una angiografía diagnóstica invasiva, razón por la cual los pacientes pueden ser derivados directamente para recibir una PFC.
(ii) ¿Cómo se debe realizar la PFC? Tal y como describen los autores, tanto la función microvascular como la vasomoción coronaria deben estudiarse de forma estrictamente estandarizada y, a poder ser, en la descendente anterior. No obstante, el orden de estas pruebas sigue siendo objeto de debate. En nuestra opinión, no tiene sentido estudiar la función endotelial ni la vasomoción coronaria con una guía en la coronaria ni cuando el paciente ya ha recibido fármacos vasoactivos tales como nitratos y bloqueadores de los canales de calcio. En este sentido, pensamos que las pruebas con acetilcolina sen deben realizar primero, induciendo vasodilatación epicárdica con nitratos al final de las pruebas con acetilcolina. Este último es, asimismo, un paso importante (y una buena práctica clínica) antes de proceder a medir la función microcirculatoria con guías coronarias. En cuanto a la elección del tipo de prueba, la termodilución en bolo se debería reemplazar por la termodilución continua, ya que permite calcular la reserva de flujo coronario, la resistencia microvascular absoluta (Rμ) y la reserva de resistencia microvascular a partir del flujo volumétrico absoluto y no de sustitutos del flujo5. Se espera que futuros estudios aclaren los valores de corte clínicamente relevantes para los índices derivados de la termodilución continua. Estos valores deberían dar lugar a una definición más sólida de la EMC, algo que, en la actualidad, sigue siendo una necesidad no satisfecha.
(iii) ¿Qué seguimiento se ha de hacer a estos pacientes? El seguimiento de estos pacientes deben hacerlo los mismos médicos en una clínica ambulatoria dedicada y se debe preguntar a los pacientes sobre sus síntomas de manera estructurada y sistemática. En este sentido, se debe animar a los autores a usar cuestionarios estructurados para evaluar la angina y la calidad de vida. El clásico sistema de calificación de la Canadian Cardiovascular Society para la angina no vale en pacientes con ANOCA, ya que sus síntomas difieren de los descritos por pacientes con enfermedad epicárdica. Además, a menudo faltan signos objetivos de isquemia. En el futuro, quizás a los pacientes se les dé una aplicación en su smartphone para vigilar de cerca sus síntomas6.
En líneas generales, como con cualquier programa nuevo, es importante reconocer que hay una fase de aprendizaje. No obstante, con un programa bien estructurado y estandarizado, como el propuesto por Rinaldi et al.3, esta fase de aprendizaje probablemente sea corta. Ahora es necesario realizar trabajos futuros que aborden las implicaciones de dicho protocolo en términos de tiempo y costes en la práctica clínica habitual. Por ejemplo, en el contexto de una ocupada sala de hemodinámica del mundo real, ¿cuánto tiempo, de media, añade dicho protocolo a la duración de la intervención? Además, ¿cuáles son las implicaciones económicas y están lo bastante compensadas por una mayor calidad de vida y control sintomático?
En conclusión, ahora existen sólidos fundamentos clínicos para la implementación sistemática de la PFC en pacientes con ANOCA. Además, tal y como demuestran Rinaldi et al., un programa de pruebas estandarizado y sólido se puede implementar eficazmente en la práctica del mundo real3. Ahora hay que validar criterios diagnósticos claros para la EMC a fin de que los resultados de la PFC se puedan interpretar e implementar fácilmente. Los pacientes y sus médicos derivadores no merecen menos.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
T. Mahendiran recibió una beca de la Fundación Nacional Suiza de Ciencia (SNSF). B. De Bruyne es consultor de Boston Scientific, Abbott Vascular, CathWorks, Siemens y Coroventis Research, recibe subvenciones de investigación de Abbott Vascular, Coroventis Research, Cathworks y Boston Scientific y es accionista minoritario en Philips-Volcano, Siemens, GE Healthcare, Edwards Life Sciences, HeartFlow, Opsens, Sanofi y Celyad.
BIBLIOGRAFÍA
1. Patel MR, Peterson ED, Dai D, et al. Low Diagnostic Yield of Elective Coronary Angiography. N Engl J Med. 2010;362:886-895.
2. Jansen TPJ, Konst RE, Elias-Smale SE, et al. Assessing Microvascular Dysfunction in Angina With Unobstructed Coronary Arteries. J Am Coll Cardiol. 2021;78:1471-1479.
3. Rinaldi R, Spione F, Verardi FM, et al. Angina or ischemia with no obstructed coronary arteries:a specific diagnostic and therapeutic protocol. REC Interv Cardiol. 2023. https://doi.org/10.24875/RECICE.M23000418.
4. Ford TJ, Stanley B, Good R, et al. Stratified Medical Therapy Using Invasive Coronary Function Testing in Angina:The CorMicA Trial. J Am Coll Cardiol. 2018;72:2841-2855.
5. De Bruyne B, Pijls NHJ, Gallinoro E, et al. Microvascular Resistance Reserve for Assessment of Coronary Microvascular Function:JACC Technology Corner. J Am Coll Cardiol. 2021;78:1541-1549.
6. Nowbar AN, Howard JP, Shun-Shin MJ, et al. Daily angina documentation versus subsequent recall:development of a symptom smartphone app. Eur Heart J Digit Health. 2022;3:276-283.
* Autor para correspondencia.
Correo electrónico: Bernard.de.bruyne@olvz-aalst.be (B. De Bruyne).