RESUMEN
Introducción y objetivos: La angiografía por tomografía computarizada (angio-TC) es el estándar para medir el anillo aórtico en pacientes tratados mediante implante percutáneo de válvula aórtica (TAVI), aunque en algunos casos podría no ser factible. Debería evaluarse la precisión de las medición del anillo aórtico angiográfica (AAA) durante el TAVI como alternativa para elegir el tamaño correcto de la válvula cardiaca percutánea. Por ello, investigamos la correlación entre las mediciones angiográficas y por angio-TC para elegir el tamaño adecuado de la válvula en pacientes que reciben un TAVI.
Métodos: Se incluyeron pacientes de TAVI con prótesis de balón expandible y angio-TC de alta calidad. Las mediciones del AAA se obtuvieron de la angiografía de la raíz aórtica en proyección de 3 cúspides. Se comparó la distancia angiográfica entre la cúspide izquierda y no coronariana con las mediciones de angio-TC. Se evaluaron la prueba diagnóstica y la correlación entre las medidas angiográficas y de angio-TC, así como la eficacia (éxito técnico, posición correcta y desempeño intencionado) y la seguridad (múltiples válvulas, embolización, implante de marcapasos e insuficiencia valvular moderada o mayor) definida por VARC-3.
Resultados: Para válvulas con balón expandible de 23 mm, la distancia en la aortografía tuvo una correlación de 0,528 (p < 0,01) comparada con las mediciones de angio-TC; para las de 26 mm, la correlación fue de 0,451 (< 0,01), y para las de 29 mm fue de 0,579 (< 0,01). No hubo diferencia en cuanto a eficacia (94,2 frente a 96,0%; p = 0,60) y seguridad (90,9 frente a 91,9%; p = 0,84) entre casos con medidas concordantes y discordantes.
Conclusiones: Las mediciones del AAA mostraron un moderado valor de prueba diagnóstica y de correlación Spearman en comparación con la angio-TC para elegir el tamaño de la válvula cardiaca percutánea. Esta estrategia podría permitir un TAVI en situaciones en que la angio-TC no esté disponible.
Palabras clave: Cúspide no coronariana. Cúspide coronaria izquierda. Aortografía. Mediciones angiográficas del anillo aórtico. Implante percutáneo de válvula aórtica.
ABSTRACT
Introduction and objectives: Coronary computed tomography angiography (CCTA) has become the gold standard to measure the size of the aortic annulus and better select the size of transcatheter heart valves (THV) in patients undergoing transcatheter aortic valve implantation (TAVI). However, in selected cases, CCTA may not be feasible. Angiographic aortic annulus (AAA) measurements during TAVI may be an alternative and should be evaluated for precision regarding the proper selection of THV sizes. We sought to investigate the correlation between AAA and CCTA measurements for the proper selection of balloon-expandable valve (BEV) sizes in patients undergoing TAVI.
Methods: Patients undergoing TAVI with BEV and high-quality CCTA were included. AAA measurements were obtained in the standard 3-cusp view after aortic root aortography. Angiographic distance between non- and left coronary cusps were compared to CCTA annulus measurements. Endpoints were diagnostic tests and correlations between angiographic and CCTA measurements, and the composite endpoint of the VARC-3-defined efficacy (technical success, correct position, and intended performance), and safety profile (multiple valves, valve embolization, pacemaker implantation, and more than moderate valvular regurgitation).
Results: Regarding the Sapien family of THV, aortography-based distance measurements showed a correlation of 0.528 (P < .01), 0.451 (P < .01), and 0.579 (P < .01) for 23 mm, 26 mm, and 29 mm valves with CCTA-based distance measurements. No difference was seen regarding the VARC-3-defined efficacy (94.2% vs 96.0%; P = .60) and safety profile (90.9% vs 91.9%; P = .84) among cases showing discordant and concordant pairs of measurements.
Conclusions: AAA measurement showed a moderate diagnostic test and Spearman’s correlation coefficient compared to CCTA-based annulus assessment for perioperative THV size selection. This strategy could potentially enable TAVI in patients in whom access to preoperative CCTA is not available.
Keywords: Non-coronary cusp. Left coronary cusp. Aortography. Angiographic aortic annulus measurements. Transcatheter aortic valve implantation.
Abreviaturas
Angio-TC: angiotomografía computarizada. CCI: cúspide coronaria izquierda. CNC: cúspide no coronaria. TAVI: implante percutáneo de válvula aórtica. VBE: válvula de balón expandible. VCP: válvula cardiaca percutánea.
INTRODUCCIÓN
Durante el implante percutáneo de válvula aórtica (TAVI), la angiotomografía computarizada (angio-TC) sigue siendo el factor clave para determinar las características de la válvula aórtica y predefinir las dimensiones del anillo a fin de seleccionar la válvula cardiaca percutánea (VCP) adecuada1,2. Se han descrito diversos protocolos angio-TC para obtener mediciones fidedignas y reproducibles del anillo aórtico3,4. Las mediciones obtenidas mediante ecocardiografía transtorácica y transesofágica también han mostrado una buena correlación, a la hora de determinar las dimensiones del anillo aórtico, con el patrón oro de mediciones directamente quirúrgicas y obtenidas mediante angio-TC5,6. En cualquier caso, la angio-TC proporcionó imágenes de mejor calidad y una valoración detallada del anillo aórtico, así como de otras anatomías que son útiles para acometer TAVI transfemorales (vasos aorto-ilíaco-femorales)7, lo cual convierte a la angio-TC en la estrategia por defecto a efectos de planificación preoperatoria.
La adecuada selección del tamaño de la VCP es un factor que tener en cuenta para evitar desajustes paciente-prótesis, reducir el riesgo de sobre o infradimensionamiento y, por ende, el mayor riesgo de mortalidad por cualquier causa y reintervenciones no programadas6,8,9. Aunque la angio-TC se ha establecido como el patrón oro para dimensionar el anillo previo al TAVI4, también se ha descrito la relación que existe entre la exposición a la radiación y el cáncer y entre el agente de contraste empleado y la nefropatía10,11. Además, en casos seleccionados, la angio-TC puede no ser viable previa al TAVI por una indicación clínica emergente o por el propio estado de inestabilidad del paciente.
La medición del anillo solo mediante aortografía se ha descrito como una técnica eficiente para determinar las dimensiones del anillo aórtico y seleccionar el tamaño de la VCP12,13. Partiendo de la proyección de las 3 cúspides, la determinación angiográfica de las dimensiones anatómicas con el agente de contraste (o dimensionamiento del balón) ayuda a identificar las dimensiones correctas del anillo cuando este dimensionamiento no se puede llevar a cabo mediante angio-TC14-17. Las mediciones obtenidas mediante aortografía guardan relación con las mediciones anatómicas perioperatorias directas del anillo aórtico13.
Con este trasfondo, nos propusimos investigar si las mediciones angiográficas del anillo aórtico entre la cúspide no coronaria (CNC) y la cúspide coronaria izquierda (CCI) guardan algún tipo de relación con las mediciones obtenidas por angio-TC a la hora de seleccionar el tamaño apropiado de VCP en una cohorte retrospectiva de pacientes no seleccionados de un único centro tratados con TAVI.
MÉTODOS
Población del estudio
Este análisis retrospectivo y observacional evaluó a todos los pacientes consecutivos tratados con TAVI transfemoral tras valoración del equipo multidisciplinar de la unidad de enfermedades cardiovasculares del German Heart Centre con sede en Múnich (Alemania). El TAVI transfemoral se llevó a cabo con un abordaje minimalista18 en todos los casos. Por su parte, la selección del tamaño de la VCP corrió a cargo de los operadores según una tabla de tamaños, las mediciones obtenidas mediante angio-TC y factores anatómicos tales como la distribución y gravedad del calcio coronario, las dimensiones del anillo aórtico, la altura y enfermedad coronarias.
Se incluyó en este estudio a todos los pacientes con valvulopatía tricuspídea calcificada nativa y una angio-TC de alta calidad aptos para el TAVI. La información de la intervención se obtuvo de una base de datos individualizada y cribada para todos los pacientes tratados con TAVI entre enero de 2014 y diciembre de 2021 en el German Heart Centre de Múnich (Alemania). Durante este periodo, se realizaron 2.500 TAVI por abordaje transfemoral con VCP autoexpandibles (365) y de balón expandible (1.865). Solo se incluyó en este análisis a los pacientes que recibieron válvulas de balón expandible (VBE) SAPIEN 3 o SAPIEN 3 Ultra (Edwards Lifesciences, Estados Unidos).
El estudio se llevó a cab de conformidad con los principios establecidos en la Declaración de Helsinki y todos los pacientes dieron su consentimiento informado previo a la intervención. La aprobación ética se obtuvo del comité de ética de la Technical University Munich con nº de registro OBSERVTAVI (#525/17). Las mediciones angio-TC se obtuvieron antes de implantar la VCP. Las mediciones angiográficas del anillo aórtico entre la CNC y la CCI se obtuvieron offline y quedaron documentadas en la base de datos. Las características clínicas basales, de la intervención (incluido el tamaño de la VCP implantada y la insuficiencia aórtica angiográfica tras el implante) y los resultados de las pruebas de laboratorio se obtuvieron de los datos del registro o de las propias historias clínicas de los pacientes, lo que fuese más apropiado. Se monitorizó y registró el seguimiento intrahospitalario y al alta atendiendo a los resultados de seguridad y eficacia definidos por los criterios estándar del Valve Academic Research Consortium 3 (VARC-3). También se estableció un periodo de seguimiento de 30 días por vía telefónica, visitas hospitalarias o cartas de seguimiento.
Mediciones obtenidas mediante angiotomografía computarizada
La angio-TC la analizaba 1 operador experimentado (HA) y la muestra de 40 casos para determinar la variabilidad interobservador la analizaba un segundo cardiólogo experimentado (JM). En la reconstrucción de la tomografía computarizada multicorte se obtuvieron medidas cuantitativas de las dimensiones del anillo aórtico (diámetro, perímetro y área mínimos, máximos y medios) según protocolos predefinidos2 con el software 3-Mensio (Pie Medical Imaging, Países Bajos). En resumen, se detectaron y seleccionaron los 3 puntos bisagra de las cúspides aórticas. Tras la identificación de los 3 puntos bisagra, la reconstrucción multiplanar automática mostró el anillo aórtico. Las mediciones de este se obtuvieron 0,5 mm por debajo de los puntos bisagra y se trazó el contorno anular para calcular área y diámetro derivados del perímetro (figura 1A). Para definir la medición uniplanar directa entre la CNC y la CCI (N-CCI) en la angio-TC se trazó 1 línea recta entre los puntos bisagra rojo (CCI) y amarillo (CNC) para determinar la longitud (figura 1B-C). El tamaño más apropiado de VCP se eligió siguiendo las recomendaciones de la tabla de tamaños y las consideraciones anatómicas (figura 1D). Las mediciones y cálculos obtenidos en la angio-TC se usaron para saber qué tamaño debía tener la VCP según las tablas de tamaño del fabricante. El área y diámetro medios del anillo aórtico se emplearon para seleccionar el tamaño de la VCP (23, 26 y 29 mm) y se codificaron como variable binaria paca cada categoría de tamaño. Solo cuando hubo 1 medida dentro del rango propuesto para un tamaño determinado de VCP según la tabla de tamaños del fabricante (dentro de la zona gris), se usó el área para decidir cuál debía ser el tamaño de la VCP.
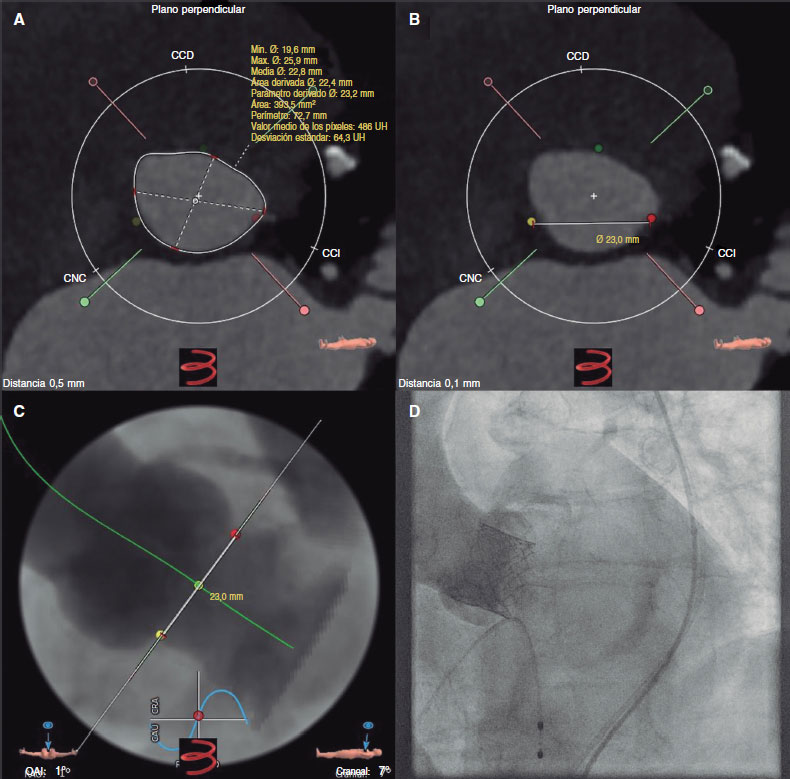
Figura 1. Figura central. A: mediciones del anillo aórtico por angio-TC del diámetro mínimo (19,6 mm), máximo (25,9 mm) y medio (22,8 mm), perímetro (73 mm) y área (394 mm2). B: medición por angio-TC desde el punto más bajo entre la cúspide coronaria izquierda (punto rojo) y la no coronaria (punto amarillo) con una distancia de 23,0 mm. C: predicción de la angulación angiográfica por angio-TC para obtener la proyección estándar de las 3 cúspides (proyección oblicua anterior izquierda de los nervios craneales primero y séptimo) con la cúspide coronaria izquierda a 1 lado (punto rojo) y la no coronaria al otro (punto amarillo) y la distancia entre ambos (23,0 mm). D: resultado angiográfico tras implante de válvula de balón expandible según las mediciones tomográficas de la figura 1 A (SAPIEN 3 Ultra 23 mm).
Mediciones aortográficas
Todas las intervenciones las llevaron a cabo operadores experimentados en TAVI empleando un sistema monoplano de radiografía digital (Allura Xper FD 10 C, Royal Philips, Países Bajos) en una sala de hemodinámica híbrida dedicada. Todas las imágenes fluoroscópicas de la proyección de las 3 cúspides se analizaron después de la intervención y se guardaron con las medidas de la distancia obtenidas. Las mediciones angiográficas se obtuvieron offline de la inyección angiográfica de la raíz aórtica (anillo nativo sin la VCP implantada) con un catéter pigtail de 5 Fr colocado en la cúspide coronaria derecha en la proyección de las 3 cúspides14,15. La distancia entre los puntos bisagra de la CNC y la CCI la calcularon cardiólogos experimentados (HA y JM) con un software dedicado de Phillips (figura 2A-H). Las mediciones angiográficas se obtuvieron tras calibración automática (basada en el factor de calibración determinado por el software) y manual (empleando el catéter de 5 Fr como factor de calibración de referencia) para determinar la distancia en milímetros.
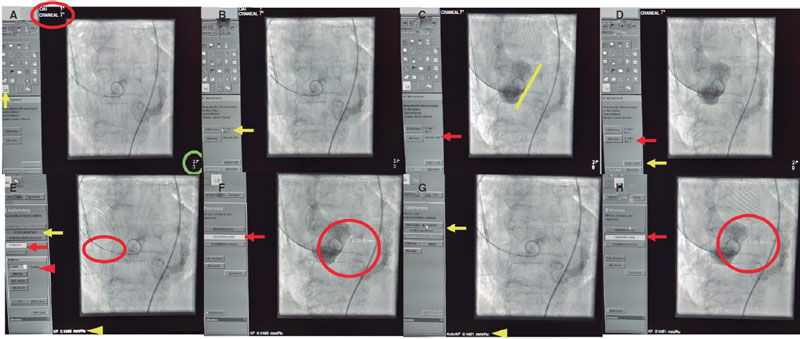
Figura 2. A: proyección oblicua anterior derecha estándar, en sentido craneal, de las 3 cúspides de los pares craneales primero y séptimo (círculo rojo) para determinar la medición longitudinal (flecha amarilla) en la mejor imagen contrastada (círculo verde). B: opción de calibración según la mejor imagen disponible (flecha amarilla). C: opción de medición (flecha roja) para determinar la distancia sobre el anillo aórtico (flecha amarilla) en las imágenes guardadas (círculo verde). D: imagen guardada (flecha roja) para «iniciar el análisis» (flecha amarilla). E: calibración manual mediante catéter 5 Fr (flecha y punta de flecha rojas) dibujando 2 líneas sobre el catéter (círculo rojo) comparando el factor de calibración dado por el software (0,1451 mm/ píxeles, flecha amarilla) con el obtenido mediante calibración manual (0,1486 mm/píxeles, punta de flecha amarilla). F: para hacer 1 «medición longitudinal» (flecha roja) dibujar una línea en el punto bisagra de las cúspides coronaria izquierda y no coronaria (círculo rojo). G: para calibración automática, seleccionar «aceptar calibración automática» (flecha amarilla); el factor de calibración dado por el software (0,1451 mm/píxeles) se empleará a efectos de medición (punta de flecha amarilla, factor de calibración de 0,1451 mm/píxeles). H: medición del anillo aórtico mediante calibración automática seleccionando la «medición longitudinal» (flecha roja) y dibujando 1 línea entre los puntos bisagra de las cúspides coronaria izquierda y no coronaria (círculo rojo).
Objetivos
Los objetivos fueron la correlación entre las mediciones angiográficas y obtenidas mediante angio-TC de la distancia entre la CNC y la CCI. También se analizaron los índices de eficacia definida según los criterios estándar del VARC-3 (éxito técnico, posición correcta y rendimiento pretendido según las definiciones del VARC-319) y el perfil de seguridad (múltiples válvulas, embolización de las mismas, implante de marcapasos e insuficiencia valvular más que moderada según las definiciones del VARC-3) en pacientes con mediciones concordantes y discordantes entre las mediciones angiográficas y las obtenidas mediante angio-TC.
También se comunicaron los índices de complicaciones intrahospitalarias definidos como conversión a cirugía, mortalidad perioperatoria, hemorragias amenazantes para la vida, hemorragias mayores y menores, complicaciones vasculares mayores y menores y mortalidad intrahospitalaria en pacientes con mediciones concordantes y discordantes. La mortalidad a 30 días, la insuficiencia cardia-
ca crónica, los accidentes cerebrovasculares, la disfunción valvular, el gradiente aórtico medio y la insuficiencia aórtica también se recogieron.
Análisis estadístico
Las variables categóricas se expresaron como frecuencias y proporciones y se compararon con la prueba de la χ2 y la prueba exacta de Fisher, la que fuese más conveniente. La normalidad de los datos continuos se comprobó empleando la prueba de Shapiro-Wilk y estos se expresaron como media (± desviación estándar) o mediana (rango intercuartil [RIQ]), lo que fuese más conveniente y se compararon, respectivamente, empleando la prueba t no emparejada o la prueba U de Whitney-Wilcoxon.
La población del estudio se clasificó en cohorte de derivación (n = 1.256) y de validación (n = 40 cases). El grupo de interés del estudio se obtuvo de la cohorte de derivación (n = 393). En dicha cohorte, la selección de los tamaños específicos de las VCP (23, 26 y 29 mm) según valoración de la angio-TC (patrón oro) se clasificó como 1 variable binaria y a continuación se comparó a la selección del tamaño de la VCP según la aortografía. Después, se hizo un análisis de regresión logística con la variable binaria derivada de la selección de la VCP según la angio-TC como variable dependiente y las mediciones de la distancia aortográfica se consideraron como 1 variable independiente. Luego se hizo un análisis de las curvas ROC (receiver operating characteristic) para identificar los criterios de corte óptimos (distancia en mm, índice de Youden) y determinar los rangos de cada diámetro según las medidas angiográficas de la distancia para cada tamaño de VCP. El valor más bajo de la VCP más pequeña y el más alto de la más grande se determinaron usando el RIQ (diferencia entre el percentil 75 y el 25) obtenido de la distribución de la población de derivación. El tamaño de las VCP se propuso según la aortografía con calibración manual o automática. Se emplearon la sensibilidad, especificidad, valores predictivos positivo y negativo y probabilidad positiva y negativa para determinar el índice de precisión diagnóstica. Se emplearon gráficos de Bland-Altman para comprobar la correlación entre las CNC-CCI según angio-TC, CNC-CCI según aortografía con calibración manual y CNC-CCI según aortografía con calibración automática.
Dos cardiólogos independientes llevaron a cabo un análisis inter e intraobservador que empleó los coeficientes de correlación interclase (con acuerdo absoluto) y de Pearson para datos dicotomizados en una muestra de 40 casos.
A efectos de validación interna, se aplicaron valores de corte establecidos previamente para determinar el tamaño de la VCP mediante aortografía en una cohorte independiente de 40 pacientes (cohorte de validación) que se compararon con el patrón oro (determinación del tamaño mediante angio-TC).
Las parejas de tamaños resultantes según la angiografía y la angio-TC se generaron como un grupo de interés del estudio y se clasificaron como concordantes o discordantes tras 1 comparativa que empleó la prueba de la χ2 o la prueba exacta de Fisher, la prueba t no pareada o la prueba U de Whitney-Wilcoxon, la que fuese más conveniente. El análisis estadístico se hizo con el paquete de software estadístico IBM SPSS (versión 27, IBM Corporation, Estados Unidos). Todas las pruebas fueron bilaterales. Los valores p = 0,05 se consideraron significativos a nivel estadístico.
RESULTADOS
Tras la fase de exclusión, se valoró a 1.256/2.500 pacientes tratados con VBE (50,2%) en la cohorte de validación (figura 3). Las mediciones del diámetro según la aortografía fueron viables en 393 de estos pacientes (15,7%) (grupo de interés del estudio).
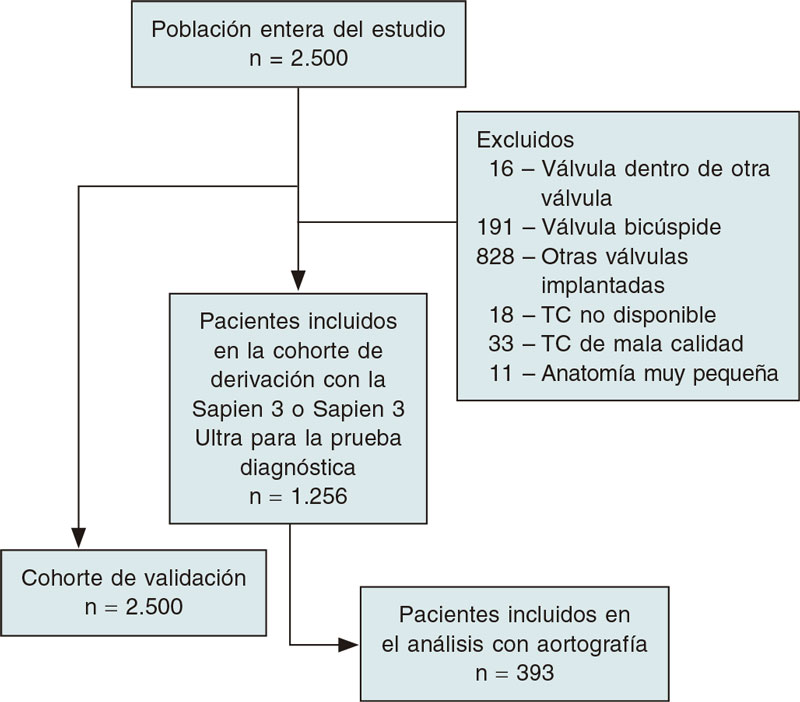
Figura 3. Diagrama de flujo de la fase de inclusión del estudio.
Tanto las características basales como las de la angio-TTC se detallan en la tabla 1. La mediana de edad de toda la población fue 81 años (77-85) (34,3% mujeres) con una función de eyección del ventrículo izquierdo del 60% [47-60] y una puntuación media en la escala EuroScore II de 3,74 (2,14-6,24).
Tabla 1. Características basales
| Válvula de balón expandible (n = 393) | |
|---|---|
| Edad, años | 81 [77 - 85] |
| Varones | 257 (65,7) |
| IMC, kg/m2 | 26,2 [23,8-29,5] |
| ASC, m2 | ASC, m2 |
| Clase funcional III-IV según la NYHA | 238 (60,9) |
| Clase III-IV según la CCS | 32 (8,2) |
| Hipertensión arterial | 353 (90,3) |
| Diabetes mellitus | 131 (33,5) |
| Dislipemia | 265 (67,8) |
| EPOC | 19 (4,9) |
| Antecedentes tabáquicos | 123 (31,5) |
| EAP | 77 (19,7) |
| ICP previa | 162 (41,4) |
| EC | 341 (87,2) |
| 1 vaso | 204 (52,2) |
| 2 vasos | 57 (14,6) |
| 3 vasos | 80 (20,5) |
| Implante de marcapasos | 36 (9,2) |
| IM previo | 43 (11) |
| CABG previa | 37 (9,5) |
| Accidente cerebrovascular/AIT previos | 60 (15,3) |
| Fibrilación auricular | 149 (38,1) |
| Niveles de creatinina, mg/dl | 1,11 [0,89-1,37] |
| TFGe, ml/min | 60 [46-76] |
| Diálisis | 3 (0,8) |
| Insuficiencia aórtica grado 2+ | 39 (10) |
| AVA, mm2 | 0,70 [0,60-0,84] |
| FEVI, % | 60 [47-60] |
| Gradiente Ao medio, mmHg | 42 [36-49] |
| Gradiente Ao máximo, mmHg | 68 [59-80] |
| PAPs, mmHg | 42 [33-45] |
| EuroScore I, % | 11,84 [7,82-19,46] |
| EuroScore II, % | 3,74 [2,14 - 6,24] |
| Mediciones obtenidas mediante angio-TC | |
| Diámetro mínimo, mm | 21,6 [20,1-23,2] |
| Diámetro máximo, mm | 27,9 [26,2-29,6] |
| Diámetro medio, mm | 24,8 [23,2-26,3] |
| Área, mm2 | 474 [414-533] |
| Perímetro, mm | 79 [74-84] |
| Estimación visual de la gravedad de la calcificación valvular | |
| Leve | 80 (20,5) |
| Moderada | 185 (47,3) |
| Grave | 126 (32,2) |
| Estimación visual de la gravedad de la calcificación anular | |
| Ninguna | 55 (14,1) |
| Leve | 268 (68,5) |
| Moderada | 67 (17,1) |
| Grave | 1 (0,3) |
| Estimación visual de la gravedad de la calcificación del TSVI | |
| Ninguna | 223 (57) |
| Leve | 145 (37,1) |
| Moderada | 23 (5,9) |
Los datos expresan n (%) o media ± desviación estándar o mediana [rango intercuartil]. %: porcentaje; AIT: accidente isquémico transitorio; angio-TC: angiotomografía computarizada; Ao: aórtico; ASC: área de superficie corporal; AVA, área valvular aórtica; CABG: cirugía de revascularización coronaria; CCS: clasificación de la gravedad de la angina según la Canadian Cardiovascular Society; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; mg/dl: miligramos por decilitro; ml/min: mililitros por minuto; mm2: milímetros cuadrados; mmHg: milímetros de mercurio; NYHA: clasificación funcional de la New York Heart Association; PAPs: presión arterial pulmonar sistólica; TFGe: tasa de filtrado glomerular estimada; TSVI: tracto de salida del ventrículo izquierdo. | |
Las características de la intervención se muestran en la tabla 2. El tiempo de la intervención, la dosis fluoroscópica y el tiempo de fluoroscopia fueron 48 minutos [38-59], 919 cGys/cm2 [444-1.712] y 10,9 [8,2-14,7] minutos, respectivamente. La tasa de éxito técnico se alcanzó en el 95,4% de los casos. En cuanto a las complicaciones intrahospitalarias (tabla 3), los índices de eventos hemorrágicos mayores, complicaciones vasculares mayores y mortalidad intrahospitalaria fueron del 16,1%, 14,6% y 1,5%, respectivamente.
Tabla 2. Comparativa entre el grupo transyugular y el transfemoral (casos exitosos)
| Válvula de balón expandible (n = 393) | |
|---|---|
| Electiva | 389 (99,5) |
| Necesidad de intubación | |
| Profiláctica | 5 (1,3) |
| Urgente | 8 (2) |
| Uso de ECMO | |
| Profiláctico | 0 (0) |
| Urgente | 1 (0,3) |
| Uso de dispositivo de protección cerebral | 16 (4,1) |
| Tamaño de la válvula implantada | |
| 23 mm | 118 (30,2) |
| 26 mm | 207 (52,9) |
| 29 mm | 66 (16,9) |
| VCP implantada | |
| SAPIEN 3 | 95 (24,3) |
| SAPIEN 3 Ultra | 296 (75,7) |
| Predilatación | 166 (42,5) |
| Posdilatación | 54 (13,8) |
| Medio de contraste, ml | 139 [110-172] |
| Tiempo de fluoroscopia, min | 10,9 [8,2-14,7] |
| Dosis de fluoroscopia, cGys/cm2 | 919 [444-1712] |
| Tiempo de la intervención, min | 48 [38 - 59] |
| Éxito técnico | 373 (95,4) |
| Éxito de la intervención | 384 (98,2) |
| Rendimiento pretendido | 380 (97,2) |
| Posición correcta | 389 (99,5) |
| Múltiples válvulas | 1 (0,3) |
| Complicaciones en el punto de acceso | 18 (4,6) |
| Embolización de la VCP | 1 (0,3) |
| Taponamiento cardiaco | 5 (1,3) |
| Rotura anular | 3 (0,8) |
| Deterioro coronario | 0 (0) |
| RCP operatoria | 2 (0,5) |
| Conversión a cirugía | 4 (1) |
| Mortalidad operatoria | 3 (0,8) |
| IA angiográfica ≥ moderada | 5 (1,3) |
| Gradiente medio posoperatorio, mmHg | 9 [5-10] |
| Días en la UCI | 1 [1-1] |
Los datos expresan n (%) o media ± desviación estándar o mediana [rango intercuartil]. cGys/cm2: centiGrays por centímetro cuadrado; ECMO: oxigenador extracorpóreo de membrana; IA: insuficiencia aórtica; min: minutes; ml: mililitros; mm: milímetros; RCP: reanimación cardiopulmonar; UCI: unidad de cuidados intensivos; VCP: válvula cardiaca percutánea. | |
Tabla 3. Complicaciones intrahospitalarias
| Válvula de balón expandible (n = 393) | |
|---|---|
| Hemorragias amenazantes para la vida | 11 (2,8) |
| Hemorragias mayores | 63 (16,1) |
| Hemorragias menores | 65 (16,6) |
| Complicaciones vasculares mayores | 57 (14,6) |
| Complicaciones vasculares menores | 80 (20,5) |
| AIT | 0 (0) |
| Accidente cerebrovascular mayor | 4 (1) |
| Accidente cerebrovascular menor | 5 (1,3) |
| Infarto de miocardio | 3 (0,8) |
| Nuevo implante de marcapasos | 26 (6,6) |
| Mortalidad intrahospitalaria | 6 (1,5) |
Los datos expresan n (%). | |
No se observó ninguna diferencia en las tasas de eficacia (94,2 frente al 96%; p = 0,60) ni en el perfil seguridad (90,9 frente al 91,9%;
p = 0,84) entre las parejas discordantes y las concordantes en lo que respecta a las mediciones tomográficas y angiográficas, respectivamente, empleando la aortografía con calibración manual (tabla 4).
Tabla 4. Complicaciones operatorias en tamaños valvulares concordantes y discordantes empleando la calibración manual y automática en aortografía frente a angio-TC (n = 393)
| Todas (n = 393) | Discordantes (n = 121) | Concordantes (n = 272) | p | |
|---|---|---|---|---|
| Eficacia | 375 (95,4) | 114 (94,2) | 261 (96,0) | 0,60a |
| Éxito técnico | 386 (98,2) | 118 (97,5) | 268 (98,5) | 0,44b |
| Posición correcta | 391 (99,5) | 120 (99,2) | 271 (99,6) | 0,52b |
| Rendimiento pretendido | 382 (97,2) | 117 (96,7) | 265 (97,4) | 0,74b |
| Seguridad | 360 (91,6) | 110 (90,9) | 250 (91,9) | 0,84a |
| Múltiples válvulas | 1 (0,3) | 0 (0) | 1 (0,4) | > 0,99b |
| Embolización de la VCP | 1 (0,3) | 0 (0) | 1 (0,4) | > 0,99b |
| Nuevo implante de marcapasos | 27 (6,9) | 9 (7,4) | 18 (6,6) | 0,83a |
| IA > moderada tras implante de la válvula | 5 (1,3) | 2 (1,7) | 3 (1,1) | 0,64b |
| Conversión a cirugía | 4 (1,0) | 1 (0,8) | 3 (1,1) | > 0,99b |
| Mortalidad operatoria | 3 (0,8) | 1 (0,8) | 2 (0,7) | > 0,99b |
| Hemorragias amenazantes para la vida | 11 (2,8) | 5 (4,1) | 6 (2,2) | 0,32b |
| Hemorragias mayores | 64 (16,3) | 20 (16,5) | 44 (16,2) | > 0,99a |
| Hemorragias menores | 66 (16,8) | 16 (13,2) | 50 (18,4) | 0,24a |
| Complicaciones vasculares mayores | 58 (14,8) | 17 (14) | 41 (15,1) | 0,87a |
| Complicaciones vasculares menores | 81 (20,6) | 22 (18,2) | 59 (21,7) | 0,50a |
| Mortalidad intrahospitalaria | 6 (1,5) | 2 (1,7) | 4 (1,5) | > 0,99b |
Los datos expresan n (%). | ||||
Se observó una tímida correlación entre el tamaño de las VCP según la angio-TC y la aortografía: tamaños de 23, 26 y 29 mm se asociaron a coeficiente de correlación de Spearman de 0,528 (p < 0,01), 0,451 (p < 0,01) y 0,579 (p < 0,01). Para más información, consultar las tablas 1-3 del material adicional.
Los valores de corte angiográficos sugeridos para cada tamaño de VCP se muestran en la tabla 5. En resumen, los mejores rangos de diámetro para optar por VBE de 23, 26 y 29 mm fueron de 18,46 a 22,55 mm, 21,55 a 24,55 mm y ≥ 24,25 a < 28,50 mm, respectivamente. Los coeficientes de correlación interclase intra e interobservador fueron 0,931 (IC95%, 0,869-0,963; p < 0,01) y 0,902 (IC95%, 0,814-0,948; p < 0,01), respectivamente (ver tabla 4 del material adicional). La distancia CNC-CCI según la angio-TC y CNC-CCI tuvo un coeficiente de correlación interclase de 0,885 (IC95%, 0,834-0,920; p < 0,01) (figura 4).
Tabla 5. Tabla con tamaños angiográficos sugeridos para la válvula de balón expandible SAPIEN
| 23 mm | 26 mm | 29 mm | |
|---|---|---|---|
| Distancia CNC-CCI | 18,46–22,55 | 21,55–24,55 | 24,25–28,50 |
CNC-CCI: cúspide no coronaria a coronaria izquierda; mm: milímetros; mm2: milímetros cuadrados. | |||
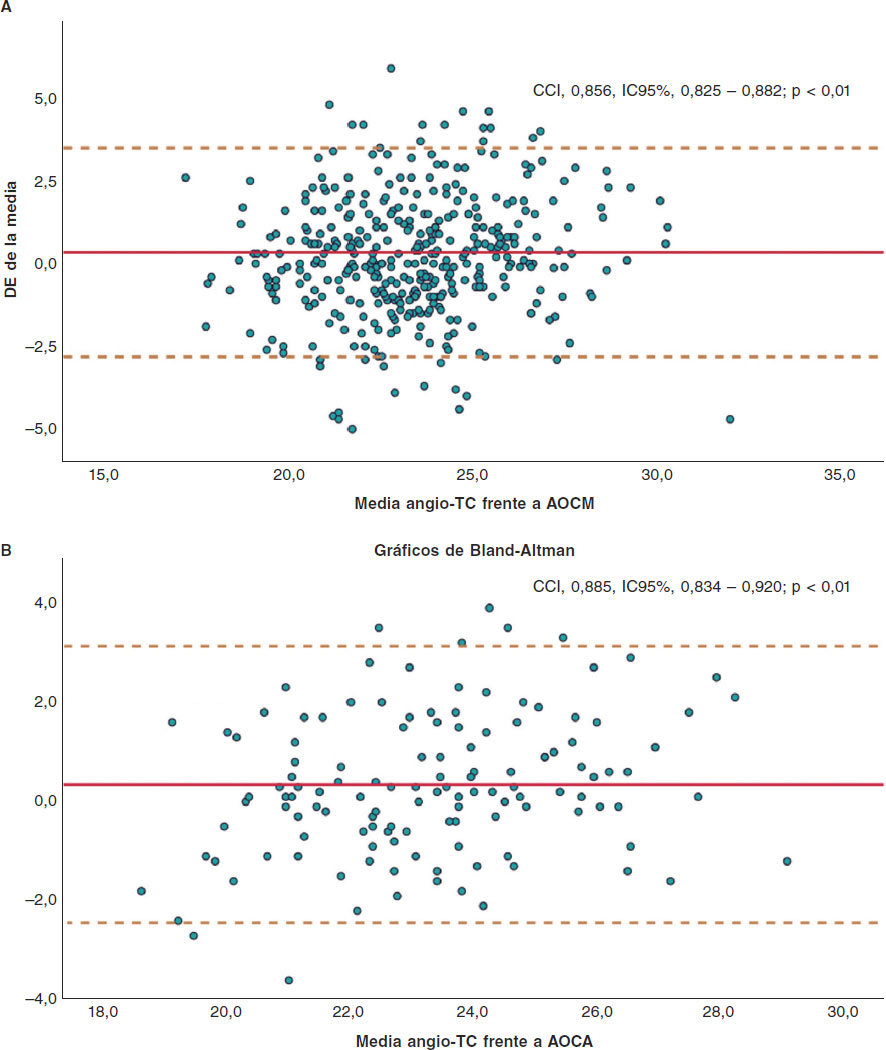
Figura 4. Gráficos de Bland-Altman: A: angio-TC frente a AOCM; B: angio-TC frente a AOCA. Angio-TC: angiotomografía computarizada; AOCA: aortografía con calibración automática; AOCM: aortografía con calibración manual; CCI: coeficiente de correlación interclase; DE: desviación estándar; IC: intervalo de confianza.
Los valores obtenidos se comprobaron con los de la cohorte de validación (n = 40) y dieron como resultado un análisis diagnóstico de moderado a bueno, un buen coeficiente de correlación de Spearman [0,711 (IC95%, 0,506-0,840; p < 0,01)] y una moderada precisión diagnóstica (tabla 5 del material adicional). La cohorte de validación de 40 pacientes se muestra en las tablas 6-10 del material adicional.
El seguimiento a 30 día se muestra en la tabla 6. No se observó ninguna diferencia en la mortalidad a 30 días entre las mediciones tomográficas y angiográficas discordantes y concordantes (1,7 frente al 2,6%; p = 0,73). Tampoco se observó ninguna diferencia a los 30 días en el gradiente medio (11 [10-16] frente a 12 [10-15] mmHg; p = 0,76) y una insuficiencia aórtica más que moderada (3,2 frente al 1,1%; p = 0,34) según la aortografía con calibración manual entre las mediciones tomográficas y angiográficas discordantes y concordantes, respectivamente.
DISCUSIÓN
Este estudio observacional, retrospectivo y de un único centro investigó la correlación y precisión diagnóstica existentes entre las mediciones angiográficas y tomográficas a la hora de determinar el tamaño de las VCP según 1 única medición angiográfica obtenida entre la CNC y la CCI en pacientes que recibieron VBE.
En relación a este objetivo, los hallazgos más significativos son: a) la determinación de las dimensiones del anillo aórtico a partir de las mediciones de la distancia entre las CNC y CCI es reproducible; b) la precisión diagnóstica entre la determinación de las dimensiones del anillo aórtico según la angio-TC y la angiografía es moderadamente sólida (tabla 5 del material adicional) y c) la validación interna de rangos de diámetro previamente establecidos para la determinación de las dimensiones del anillo aórtico según la angiografía tuvo una precisión diagnóstica moderada.
Se observó una precisión diagnóstica global moderada, así como una correlación entre las mediciones angiográficas y las obtenidas mediante angio-TC en la determinación de las dimensiones del anillo aórtico para la selección de VCP. El uso de, solo, mediciones angiográficas podría ampliar el abordaje minimalista del TAVI a escenarios en los que la angio-TC no es una opción viable.
El método patrón oro para dimensionar el anillo aórtico es la medición quirúrgica directa que resulta imposible en el contexto del TAVI. En este estudio se han empleado diferentes métodos reproducibles no invasivos para determinar las dimensiones del anillo aórtico3,5-7,20. No obstante, la angio-TC se ha convertido en la herramienta diagnóstica por excelencia para determinar las dimensiones4 del anillo aórtico gracias a su extraordinaria reproducibilidad. Antes de que la angio-TC se convirtiera en el método patrón oro, se empleaban mediciones angiográficas que tenían una buena correlación con las mediciones perioperatorias directas obtenidas en pacientes tratados de reemplazo quirúrgico de válvula aórtica (r = 0,93)13. La comparativa entre ecocardiografía transesofágica y angio-TC y mediciones directas perioperatorias descrita por Wang et al.20 reveló una correlación moderada. Nuestro estudio confirmó una precisión diagnóstica y correlación moderadas entre las mediciones angiográficas y tomográficas obtenidas para determinar el tamaño de la VCP. Se obtuvieron resultados parecidos en una pequeña muestra de 50 pacientes en la que se dimensionaron adecuadamente el 60% de las válvulas con una coincidencia en las mediciones entre buena y moderada en las selecciones de la angiografía y la angio-TC12. Esto viene a demostrar que las mediciones angiográficas podrían emplearse, también, en escenarios en los que la angio-TC no está disponible o comporta más riesgos.
Exposición a la radiación durante valoración por angio-TC
Ha quedado demostrado que, potencialmente, los estudios de imágenes asociados al TAVI pueden aumentar la exposición a la radiación de 15,4 a 79 milisieverts (mSv). Solo el TAVI está asociado a una dosis efectiva de 26.9 ± 8 mSv y a un producto dosis-área de 2006,3 ± 1152,2 centiGrays/cm2 (cGys/cm2). Esta exposición a la radiación se asocia a un mayor riesgo de muerte por cáncer de pulmón en mujeres y varones del 70 y 50%, respectivamente y a un mayor riesgo de leucemia entre el 12 y el 21% y el 23 y el 33% en mujeres y varones, respectivamente10. Se debe mencionar que la población de nuestro estudio estuvo menos expuesta a la radiación de la intervención (919 [444-1712] cGys/cm2) durante el TAVI incluido el dimensionamiento del anillo aórtico lo cual, a su vez, reduciría el riesgo asociado de cáncer. En pacientes tratados con TAVI, el uso intraoperatorio de protocolos con dosis bajas de radiación consigue eficacias similares a las que se obtienen con los protocolos estándar sin comprometer la seguridad en modo alguno21, lo cual reduce la exposición a la radiación y sus riesgos asociados. Además, el dimensionamiento del balón sumado a nuestras mediciones angiográficas propuestas aumentaría la precisión a la hora de determinar el tamaño más apropiado de la VCP. Sobre todo, cuando la medición aortográfica del anillo se acerca al valor de corte entre 2 tamaños distintos de VCP, se puede emplear el dimensionamiento de balón para confirmar el uso del dispositivo más grande o más pequeño15. Aunque el empleo adicional del dimensionamiento del balón puede aumentar la exposición a la radiación por la adquisición extra de imágenes, el uso de un protocolo con dosis bajas de radiación reduce este riesgo sin afectación sobre el resultado final21.
Nefropatía inducida por contraste
Al margen de los beneficios que supone minimizar los riesgos asociados a la radiación, preocupa enormemente la nefropatía inducida por contraste en pacientes tratados con TAVI. La insuficiencia renal crónica se da en el 38% de los pacientes con estenosis valvular aórtica, el 55, 30 y 15% de los cuales presentan insuficiencia renal crónica leve, moderada y grave, respectivamente22. La administración de agentes de contraste puede exacerbar la insuficiencia renal crónica en pacientes con la enfermedad en grado entre moderado y grave (del 2 al 17%)11 y aumentar la tasa de mortalidad estimada a los 5 años22.
La literatura médica ya ha confirmado el perfil de seguridad y eficacia del TAVI frente al reemplazo quirúrgico de válvula aórtica en todos los rangos de riesgo quirúrgico23-28. Contra este trasfondo, nuestros datos sugieren que el uso de la aortografía para dimensionar correctamente VCP en indicaciones seleccionadas es seguro. En los casos en los que el dimensionamiento de la VCP mediante aortografía coincidía con el tamaño de la VCP según la angio-TC, los favorables resultados de seguridad y eficacia se parecían a los de estudios ya publicados en categorías similares de pacientes de riesgo.
Limitaciones del estudio
Este estudio está limitado por su propia naturaleza observacional y de un único centro. Haría falta un estudio aleatorizado o prospectivo que confirmara nuestros resultados. Además, haber utilizado 1 único modelo equipo de fluoroscopia podría limitar la aplicabilidad de los hallazgos a otros equipos de otros fabricantes. Además, por problemas de espacio, no siempre pudimos contar con un equipo de angiografía para determinar las dimensiones del anillo mediante calibración manual o automática. Tanto los valores más altos como los más bajos de la tabla de tamaños sugerida se determinaron según el rango intercuartil de los percentiles 75 y 25, respectivamente, por la falta de valores fuera de rango más altos o bajos que nos permitiría determinar estos valores.
CONCLUSIONES
Las mediciones angiográficas del anillo aórtico son reproducibles y revelan una correlación y precisión diagnóstica moderadas frente a mediciones obtenidas mediante angio-TC a la hora de seleccionar el tamaño adecuado de la VCP de balón expandible. Una técnica que podría ser útil en situaciones en las que no se puede hacer una angio-TC, para evitar exposiciones a radiaciones altas, en pacientes en estado crítico y para minimizar el riesgo de nefropatía inducida por contraste. Esta estrategia podría contribuir al abordaje minimalista del TAVI en pacientes seleccionados.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
H. A. Alvarez-Covarrubias: diseño, metodología, análisis formal, investigación, recursos y redacción del artículo original. M. Kasel: diseño, redacción y edición del artículo original. J.M. Michel: redacción del artículo original y análisis formal. S. Cassese: visualización e investigación: S. Kufner: supervisión y recogida de datos. C. Duesmann, C. Pellegrini, T. Rheude y N. P. Mayr: recursos y recogida de datos. H. Schunkert: supervisión, redacción del artículo y edición de la visualización. A. Kastrati: supervisión, visualización, redacción, revisión y edición del artículo. E. Xhepa: redacción y supervisión del artículo y análisis formal. G. Borrayo-Sánchez y M. Joner: diseño, redacción y revisión del artículo y gestión del proyecto.
CONFLICTO DE INTERESES
M. Kasel declaró ser proctor y consultor de Edwards Lifesciences, aunque sin relación alguna con este artículo; J. M. Michel declaró ser proctor para Boston Scientific, aunque sin relación alguna con este artículo; S. Cassese declaró haber recibido subvenciones de Abbott Vascular, Boston Scientific y SIS Medical AG, honorarios como asesor de SIS Medical AG y como conferenciante de Abiomed, Astra Zeneca, SIS Medical AG y Teleflex, aunque sin relación alguna con este artículo; S. Kufner declaró haber recibido honorarios como conferenciante y consultor de AstraZeneca, Bristol Myers Squibb, Bentley y Translumina, aunque sin relación alguna con este artículo; C. Pellegrini declaró haber recibido una subvención de Else-Kröner Fresenius Memorial Stipendium, aunque sin relación alguna con este artículo; T. Rheude declaró haber recibido honorarios como conferenciante de SIS Medical AG y Astra Zeneca, aunque sin relación alguna con este artículo; H. Schunkert declaró haber recibido honorarios como consultor y conferenciante de AMGEN, Daiichi-Sankyo, MSD SHARP&DOHME, Astra Zeneca, Bayer Vital, Boehring-Ingelheim, Novartis, Servier y Synlab, aunque sin relación alguna con este artículo; A. Kastrati declaró tener una patente con número de registro PCT/EP2021/053116 y haber participado en la Junta de Monitorización de Datos y Seguridad del ensayo DSMB-TARGET, aunque sin relación alguna con este artículo; E. Xhepa declaró haber recibido honorarios como conferenciante de Astra Zeneca, Boston Scientific y SIS Medical AG y asistente de congresos organizados por Abbott Vascular, aunque sin relación alguna con este artículo; G. Borrayo declaró haber sido presidente de la Asociación Nacional de Cardiólogos de México entre 2020 y 2022; M. Joner declaró haber recibido subvenciones de Boston Scientific, Cardiac Dimensions, Edwards Lifesciences, Infraredx, honorarios como asesor de Biotronik, TriCares, Veryan y Shockwave y como conferenciante de Abbott Vascular, Biotronik, Boston Scientific, Edwards Lifesciences, Cardiac Dimensions, Astra Zeneca, Recor Medical y Shockwave, aunque sin relación alguna con este artículo. Los demás autores no han declarado ningún conflicto de intereses. Este artículo es parte de un programa de máster y doctorado en ciencias médicas de la Universidad Nacional Autónoma de México (UNAM).
¿QUÉ SE SABE DEL TEMA?
- Se ha investigado poco la implementación de la aortografía como herramienta diagnóstica para determinar las dimensiones del anillo aórtico .
- Estudios publicados emplean la aortografía para determinar las dimensiones del balón en el tratamiento de la valvuloplastia en la era pre-TAVI.
- La aortografía lleva tiempo empleándose en la era TAVI como método para determinar el plano anular y desplegar la válvula.
¿QUÉ APORTA DE NUEVO?
- La aortografía como técnica de imágenes complementaria a la angiotomografía computarizada (angio-TC) puede ayudar a determinar qué tamaño debe tener la válvula.
- Las mediciones obtenidas mediante aortografía no son reproducibles y ofrecen una precisión moderada a la hora de decidir el mejor tamaño de la válvula en casos en los que la angio-TC no está disponible y los pacientes pre-
cisan tratamiento inmediato.
BIBLIOGRAFÍA
1. Clavel M-A, Messika-Zeitoun D, Pibarot P, et al. The complex nature of discordant severe calcified aortic valve disease grading: new insights from combined Doppler echocardiographic and computed tomographic study. J Am Col Cardiol. 2013;62:2329-2338.
2. Kasel AM, Cassese S, Bleiziffer S, et al. Standardized Imaging for Aortic Annular Sizing: Implications for Transcatheter Valve Selection. JACC: Cardiovasc Imaging. 2013;6(2):249-62.
3. Francone M, Budde RPJ, Bremerich J, et al. CT and MR imaging prior to transcatheter aortic valve implantation: standardisation of scanning protocols, measurements and reporting-a consensus document by the European Society of Cardiovascular Radiology (ESCR). Eur Radiol. 2020;30:2627-2650.
4. Blanke P, Weir-McCall JR, Achenbach S, et al. Computed Tomography Imaging in the Context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR): An Expert Consensus Document of the Society of Cardiovascular Computed Tomography. JACC: Cardiovasc Imaging. 2019;12:1-24.
5. Fox H, Hemmann K, Lehmann R. Comparison of transthoracic and transesophageal echocardiography for transcatheter aortic valve replacement sizing in high-risk patients. J Echocardiogr. 2020;18:47-56.
6. Vo AT, Nakajima T, Nguyen TTT, et al. Aortic prosthetic size predictor in aortic valve replacement. J Cardiothorac Surg. 2021;16:221.
7. Cerillo AG, Mariani M, Berti S, Glauber M. Sizing the aortic annulus. Ann Cardiothorac Surg. 2012;1:245-256.
8. Okuno T, Heg D, Lanz J, et al. Heart valve sizing and clinical outcomes in patients undergoing transcatheter aortic valve implantation. Catheter Cardiovasc Interv. 2021;98:E768-e79.
9. Medalion B, Blackstone EH, Lytle BW, White J, Arnold JH, Cosgrove DM. Aortic valve replacement: is valve size important? J Thorac Cardiovasc Surg. 2000;119:963-974.
10. Karambatsakidou A, Omar A, Chehrazi B, Rück A, Scherp Nilsson J, Fransson A. Skin dose, effective dose and related risk in transcatheter aortic valve implantation (TAVI) procedures: is the cancer risk acceptable for younger patients? Radiat Prot Dosimetry. 2016;169:225-231.
11. Davenport MS, Perazella MA, Yee J, et al. Use of Intravenous Iodinated Contrast Media in Patients with Kidney Disease: Consensus Statements from the American College of Radiology and the National Kidney Foundation. Radiology. 2020;294:660-668.
12. Gansera L, Ulm B, Bramlage P, et al. Utility of conventional aortic root shot angiography for SAPIEN 3 prosthesis sizing in TAVI: feasibility and inter-reader variability. Open Heart. 2019;6:e001201.
13. Mukharji J, Sloan TJ, Estrera AS, Lipscomb KM. Measurement of aortic root size by biplane angiography before cardiac valve replacement. Am J Cardiol. 1984;53:1084-1086.
14. Kasel AM, Cassese S, Leber AW, von Scheidt W, Kastrati A. Fluoroscopy-guided aortic root imaging for TAVR: “follow the right cusp” rule. JACC Cardiovasc Imaging. 2013;6:274-275.
15. Shivaraju A, Thilo C, Ott I, et al. Tools and Techniques - Clinical: Fluoroscopic balloon sizing of the aortic annulus before transcatheter aortic valve replacement (TAVR) - follow the “right cusp rule”. EuroIntervention. 2015;
11:840-842.
16. Shivaraju A, Ott I, Cassese S, et al. Fluoroscopic calcification-guided optimal deployment projection during transcatheter aortic valve replacement - “The eye of the pigtail.” (Follow the right cusp rule- Part II). Catheter Cardiovasc Interv. 2016;87:996-998.
17. Kasel AM, Shivaraju A, Scheidt Wv, Kastrati A, Thilo C. Anatomic Guided Crossing of a Stenotic Aortic Valve Under Fluoroscopy: “Right Cusp Rule, Part III”. JACC: Cardiovasc Interv. 2015 Jan;8(1 Pt A):119-120.
18. Frangieh AH, Ott I, Michel J, et al. Standardized Minimalistic Transfemoral Transcatheter Aortic Valve Replacement (TAVR) Using the SAPIEN 3 Device: Stepwise Description, Feasibility, and Safety from a Large Consecutive Single-Center Single-Operator Cohort. Struct Heart. 2017;1:169-178.
19. Généreux P, Piazza N, Alu MC, et al. Valve Academic Research Consortium 3: updated endpoint definitions for aortic valve clinical research. Eur Heart J. 2021;42:1825-1857.
20. Wang H, Hanna JM, Ganapathi A, et al. Comparison of aortic annulus size by transesophageal echocardiography and computed tomography angiography with direct surgical measurement. Am J Cardiol. 2015;115:1568-1573.
21. Michel JM, Hashorva D, Kretschmer A, et al. Evaluation of a Low-Dose Radiation Protocol During Transcatheter Aortic Valve Implantation. Am J Cardiol. 2021;139:71-78.
22. Bohbot Y, Candellier A, Diouf M, et al. Severe Aortic Stenosis and Chronic Kidney Disease: Outcomes and Impact of Aortic Valve Replacement. J Am Heart Assoc. 2020;9:e017190.
23. Leon MB, Smith CR, Mack M, et al. Transcatheter Aortic-Valve Implantation for Aortic Stenosis in Patients Who Cannot Undergo Surgery. N Engl J Med. 2010;363:1597-1607.
24. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus Surgical Aortic-Valve Replacement in High-Risk Patients. N Engl J Med. 2011;364:2187-2198.
25. Thyregod HGH, Steinbrüchel DA, Ihlemann N, et al. Transcatheter Versus Surgical Aortic Valve Replacement in Patients With Severe Aortic Valve Stenosis. J Am Coll Cardiol. 2015;65:2184-2194.
26. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
27. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
28. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
* Autor para correspondencia.
Correo electrónico: gabyborsan@gmail.com (G. Borrayo-Sánchez).