Artículos de revisión
REC Interv Cardiol. 2019;1:41-50
Tratamiento antitrombótico tras revascularización percutánea en pacientes con indicación crónica de anticoagulación oral
Antithrombotic therapy after percutaneous revascularization in patients on chronic oral anticoagulation treatment
aServicio de Cardiología, Hospital General Universitario de Alicante, Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL), Alicante, España bÁrea de Enfermedades del Corazón, Hospital Universitario de Bellvitge – IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona, España
RESUMEN
El calcio coronario aumenta la complejidad del intervencionismo coronario percutáneo. La calcificación grave dificulta la preparación de la lesión, impide la adecuada expansión y la aposición del stent, y aumenta el riesgo de trombosis y de reestenosis. Las técnicas de modificación de placa se pueden dividir en 2 tipos según el tipo de dispositivo: sin balón y con balón. La aterectomía rotacional ha sido la técnica por excelencia para el tratamiento de lesiones gravemente calcificadas. Actualmente existen nuevos dispositivos que facilitan la preparación de la lesión, como el novedoso balón de litoplastia, que utiliza pulsos de alta energía mecánica para fragmentar el calcio coronario. La litoplastia coronaria es una técnica sencilla, con una curva de aprendizaje corta, que parece tener efecto sobre el calcio profundo y aumentar la distensibilidad luminal, lo que podría suponer un gran cambio en el enfoque del tratamiento de las lesiones calcificadas. Cabe destacar la relevancia de la imagen intravascular al seleccionar el dispositivo de modificación de placa más adecuado, así como para evaluar el resultado final del stent. Esta revisión proporciona una visión general sobre las técnicas disponibles y la evidencia de los dispositivos aprobados para el tratamiento de las lesiones calcificadas.
Palabras clave: Aterectomía rotacional. Aterectomía orbital. Láser de excímeros. Litoplastia coronaria.
ABSTRACT
Severe coronary calcium increases the complexity of percutaneous coronary interventions. It may affect the adequate preparation of the lesion, proper stent expansion and apposition and increase the risk of stent thrombosis and restenosis. The techniques available for the management of severe calcified lesions can be divided into 2 groups: non-balloon and balloon-based technologies. Rotational atherectomy has been the predominant technique to treat severe calcified lesions. As a matter of fact, there are new devices available that facilitate the modification of the plaque such as the new lithoplasty balloon that involves the use of highenergy mechanical pulses to crack coronary calcium. Coronary lithoplasty is an easy technique with a short learning curve that seems to be more effective on deep calcium by increasing luminal compliance. This may revolutionize the standard approach for the management of severe calcified coronary lesions. Also, the role of intravascular imaging is essential to select the most appropriate plaque-modification device and assess the optimal stent result. This review provides an overview of the techniques available and evidence on the currently approved devices to treat calcified lesions.
Keywords: Rotational atherectomy. Orbital atherectomy. Excimer laser. Coronary lithoplasty.
Abreviatruras ACLE: aterectomía coronaria con láser de excímeros. AO: aterectomía orbital. AR: aterectomía rotacional. ICP: intervención coronaria percutánea. IVUS: ecografía intravascular. LC: litoplastia coronaria. LCGC: lesión coronaria gravemente calcificada. OCT: tomografía de coherencia óptica.
INTRODUCCIÓN
Las lesiones coronarias gravemente calcificadas (LCGC) suponen un gran desafío para el éxito de las intervenciones coronarias percutáneas (ICP)1. La edad avanzada, la diabetes mellitus, la enfermedad renal crónica y el tabaquismo se asocian con un incremento de la calcificación coronaria2. El calcio coronario se puede infraestimar mediante fluoroscopia y coronariografía, y es necesario utilizar técnicas de imagen intravascular, como la ecografía intravascular (IVUS) y la tomografía de coherencia óptica (OCT), que permiten la evaluación de la gravedad y la caracterización de la placa con precisión3.
La calcificación coronaria grave aumenta la complejidad de la ICP4. Puede perjudicar el cruce de la lesión, impedir la adecuada expansión y aposición del stent, dañar el polímero liberador del fármaco, aumentar el riesgo de trombosis y de reestenosis del stent, y afectar de forma negativa a los resultados a corto y largo plazo5. El enfoque óptimo para el tratamiento de las LCGC requiere el conocimiento de varios factores: las características de la lesión, la distribución del calcio, las técnicas de imagen intravascular y el mecanismo de acción de cada dispositivo de modificación de placa6.
Actualmente, las técnicas de modificación de placa se pueden dividir en 2 grupos según el tipo de dispositivos: sin balón y con balón6,7. Entre las intervenciones con dispositivos basados en tecnología sin balón cabe señalar la aterectomía rotacional ([AR], Rotablator y ROTAPro; Boston Scientific, Natick, MA, Estados Unidos), la aterectomía orbital ([AO], Diamondback 360; Cardiovascular Systems, Inc., St Paul, MN, Estados Unidos) y la AR con láser de excímeros (CVX-300 Excimer Laser System, Philips, Andover, MA, Estados Unidos)8,9. Entre las intervenciones con dispositivos basados en tecnología con balón se encuentran cutting balloon (WOLVERINE, Boston Scientific, Marlborough, MA, Estados Unidos) y scoring balloon, de los que destacan AngioSculpt (Biotronik, Berlín, Alemania), Scoreflex (OrbusNeich, Hong Kong, China) y NSE Alpha (B. Braun, Melsungen, Alemania); el balón no distensible (NC, por sus siglas en inglés) de muy alta presión OPN (SIS Medical AG, Winterthur, Suiza); y el dispositivo de litoplastia coronaria ([LC], Shockwave Medical, Inc., Fremont, CA, Estados Unidos)8,9.
El uso generalizado de estas técnicas y dispositivos se ve limitado por el riesgo de complicaciones, el grado de dificultad técnica, la experiencia del operador y el consumo de recursos sanitarios que conlleva. La presente revisión se centra en las técnicas disponibles y en la evidencia de los dispositivos aprobados para el tratamiento de las LCGC.
ATERECTOMÍA ROTACIONAL
Definición
La AR es un procedimiento endovascular destinado a la modificación de la placa aterosclerótica mediante el avance de una oliva metálica giratoria recubierta de diamante10,11.
Principios operativos
El dispositivo de AR (Boston Scientific, Marlborough, Massachusetts, Estados Unidos) consiste en una oliva de forma elíptica recubierta de cristales de diamante en su tercio distal, que rota a alta velocidad y realiza un corte diferencial al avanzar hacia delante (figura 1 del material adicional). La AR pulveriza los componentes fibrocalcificados de la placa a la vez que preserva el tejido elástico adyacente, liberando las micropartículas a la circulación coronaria distal7,10.
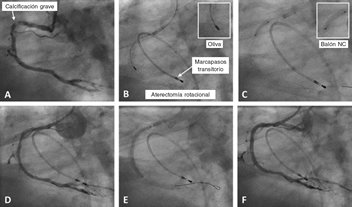
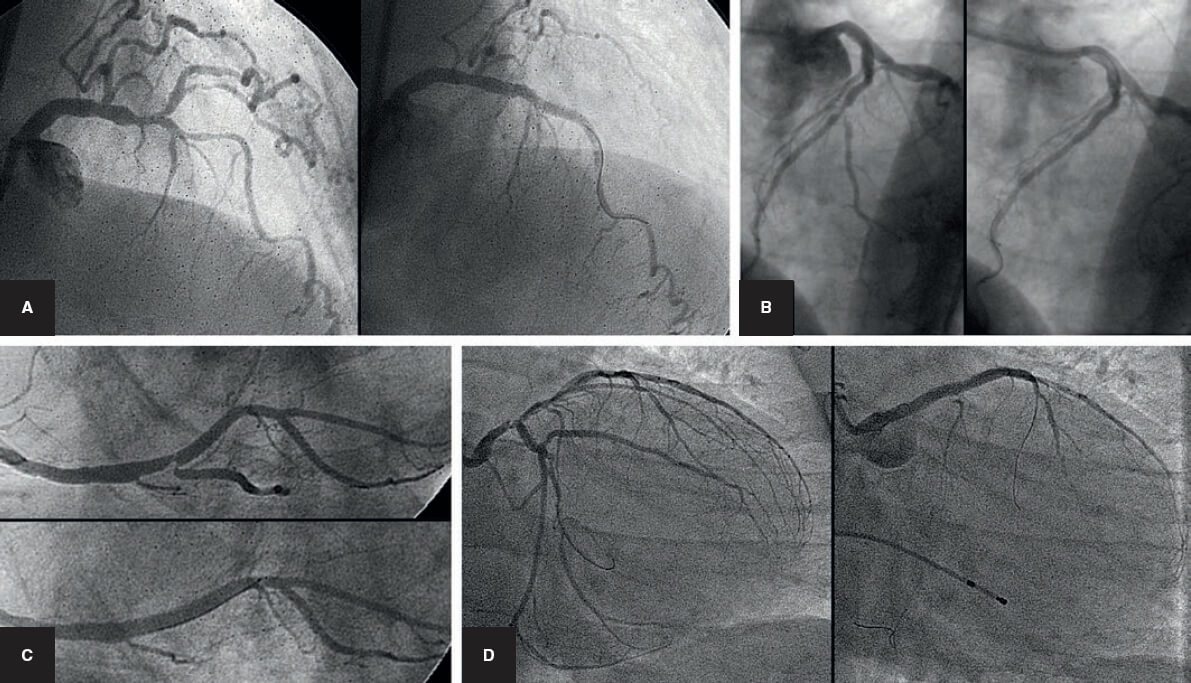
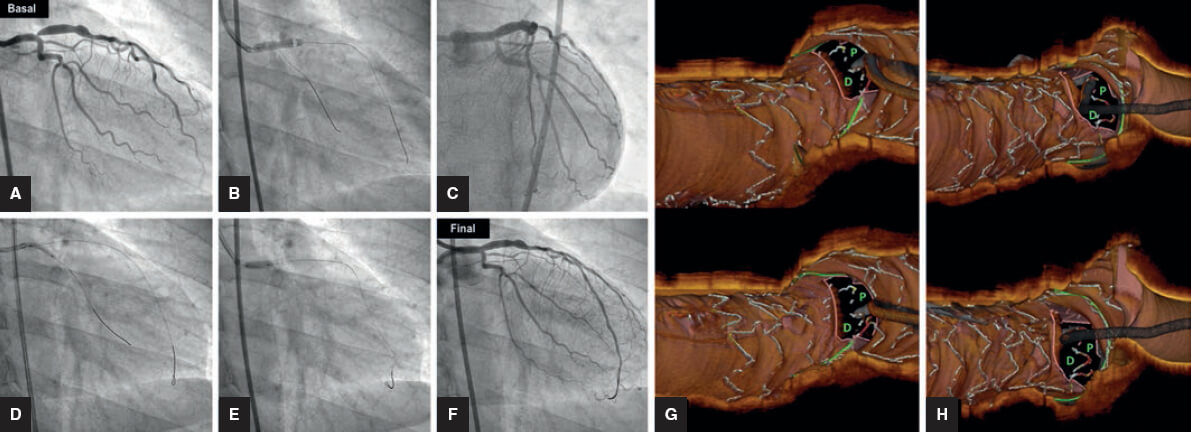
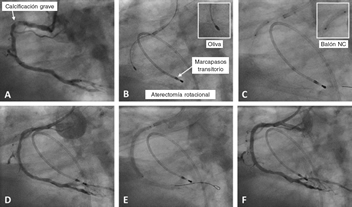
Figura 1. Caso de aterectomía rotacional sobre lesión calcificada en coronaria derecha. A: angiografía basal. B: rotablación de la lesión calcificada con oliva de 1,5 mm. C: predilatación con balón no distensible de 3 × 12 mm. D: resultado angiográfico tras la rotablación. E: implantación de stent farmacoactivo de 3 × 38 mm. F: resultado angiográfico final tras la posdilatación. NC: non-compliant balloon (balón no distensible).
La oliva se encuentra disponible en diferentes tamaños (de 1,25 a 2,5 mm) y está montada sobre un eje de transmisión que se encuentra conectado a una consola que aporta la energía rotacional. Posee 3 conexiones (actualmente van en un solo cable con 3 salidas que se conectan a la consola): un cable tacómetro, una conexión de corriente y una conexión de aire/nitrógeno comprimido. Desde la consola, el aire/nitrógeno comprimido proporciona una presión que permite que el motor gire a las revoluciones seleccionadas. Asimismo, hay una conexión de solución salina fisiológica a la que se suelen añadir heparina y vasodilatadores, permitiendo lubricar la vaina y refrigerar el motor (figura 1 del material adicional). Se recomienda una relación entre el tamaño de la oliva y el vaso de 0,5:0,6. La oliva se avanza sobre una guía específica de 0,009 pulgadas (RotaWire, Boston Scientific, Natrick, MA, Estados Unidos)10,11. Es relevante destacar que la guía RotaWire tiene a lo largo de su longitud diferentes diámetros: el cable es de 0,009 pulgadas y la parte radioopaca es de 0,014 pulgadas. La oliva es compatible con la parte proximal de la guía de 0,009 pulgadas. Se encuentran disponibles 2 versiones de RotaWire (RotaWire Extra Support y RotaWire Floppy), que se utilizarán dependiendo de las características de la placa y del soporte necesario10,11 (figura 1 del material adicional).
Se recomienda una velocidad de rotación entre 135.000 y 180.000 rpm, evitar la desaceleración > 5.000 rpm, realizar un avance gradual de la oliva con movimientos suaves adelante-atrás y tiempos de rotablación no superiores a 20 segundos con pausas entre cada ciclo. Una vez realizada la rotablación, la oliva se retira activando el modo dynaglide. Habitualmente, la desaceleración, salvo que haya un problema técnico, indica una resistencia importante al avance de la oliva debido a la gravedad y la calcificación de la lesión, produciendo un ruido específico. Se recomienda escuchar con atención durante la AR, ya que la desaceleración puede indicar riesgo de atrapamiento de la oliva7,10,11 (tabla 1).
Tabla 1. Características generales de los dispositivos de modificación de placa basados en tecnología sin balón
| Aterectomía rotacional | Aterectomía orbital | Aterectomía coronaria de láser de excímeros | |
|---|---|---|---|
| Principios operativos | |||
| Tipo de dispositivo | Oliva rotadora de alta velocidad | Corona con rotación elíptica de alta velocidad | Catéter láser de luz de alta energía |
| Mecanismo de acción | Corte diferencial anterógrado | Lijado diferencial anterógrado y retrógrado | Fotoablación |
| Curva de aprendizaje | Larga | Larga | Larga |
| Tamaño del dispositivo | Oliva de 1,25-2,5 mm | Corona de 1,25 mm | Catéter de 0,9-2 mm |
| Catéter compatible | 6-8 Fr | 6 Fr | 5-8 Fr |
| Tipo de guía | RotaWire de 0,009/0,0014 in | ViperWire de 0,012/0,014 in | Guía de 0,014 in |
| Equipo de consola | Pequeña sin pedal (ROTAPro) | Pequeña sin pedal | Muy grande con pedal |
| Indicaciones | |||
| Indicación principal | Modificación de placa | Modificación de placa | Lesiones difíciles de cruzar, como oclusión total crónica |
| Localización óptima del calcio | Luminal | Luminal | Luminal |
| Reestenosis del stent | Sí | Sí | Sí |
| Complicaciones | |||
| Disección | Riesgo moderado | Riesgo moderado | Riesgo moderado |
| Perforación | Riesgo moderado | Riesgo moderado | Riesgo moderado |
| Slow-flow/no-reflow | Riesgo moderado | Riesgo moderado | Riesgo moderado |
| Atrapamiento de oliva/corona | Riesgo moderado | Riesgo bajo | N/A |
| Consejos prácticos | |||
| Velocidad | 135.000-180.000 | 80.000-120.000 | N/A |
| Relación entre dispositivo y vaso | 0,5:0,6 | N/A | 0,5:0,6 |
| Recomendaciones | Movimientos de picoteo Ciclos cortos Pausas entre ciclos Evitar con tortuosidad significativa | Desplazamiento continuo y lento de avance y retroceso Ciclos cortos Pausas entre ciclos | Requiere infusión continua de líquido |
|
N/A: no aplica. |
|||
Está disponible una actualización del dispositivo, el ROTAPro, que facilita la manipulación por un solo operador y ofrece una interfaz de usuario mejorada con los controles integrados en el dispositivo de avance. El pedal ha sido reemplazado por un botón ubicado en la parte superior del controlador de avance de la oliva. Hay otro botón en la parte trasera del dispositivo que permite cambiar al modo dynaglide. La consola es más pequeña, tiene una pantalla digital y requiere menos tiempo de configuración (figura 2 del material adicional).
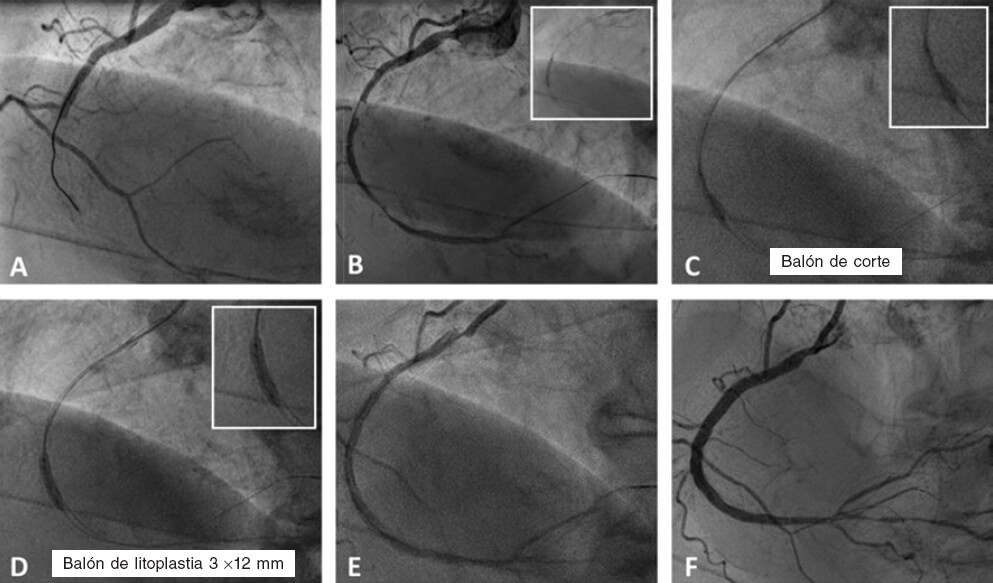
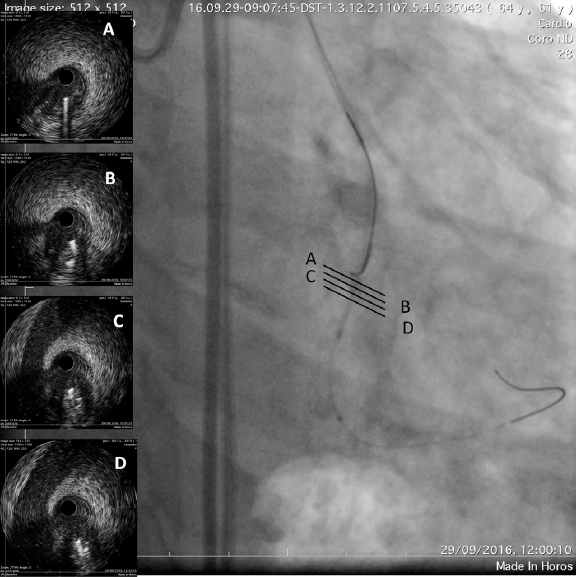
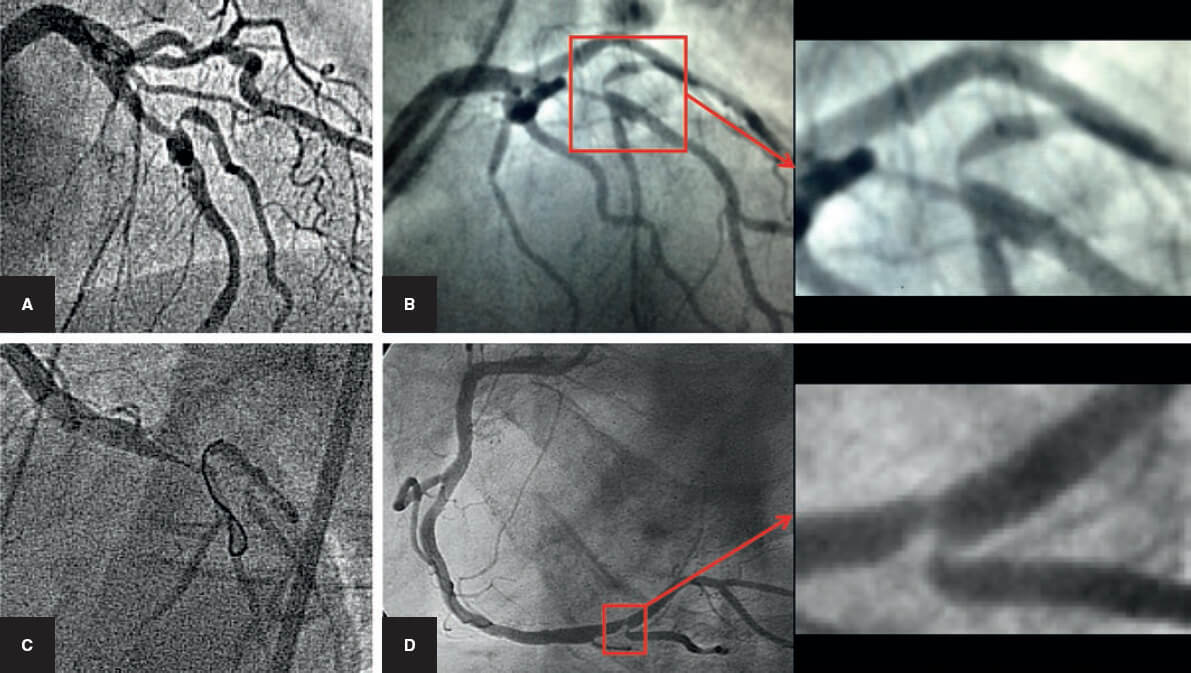
Figura 2. Caso de litoplastia coronaria en paciente con síndrome coronario agudo con elevación del segmento ST inferior. A: angiografía basal. B: resultado tras la predilatación con balón semidistensible de 2 × 15 mm. C: predilatación con balón no distensible de 2,5 × 8 mm y balón de corte de 2,5 × 6 mm sin éxito. D: litotricia coronaria con balón de litoplastia de 3 × 12 mm. E: resultado angiográfico tras la litoplastia coronaria. F: resultado final tras la implantación de dos stents farmacoactivos solapados (2,75 × 33 mm y 3 × 38 mm) y posdilatación con balón no distensible de 3 × 12 mm.
Indicaciones
La principal indicación de la AR es el tratamiento de LCGC no dilatables por métodos convencionales, mediante la modificación de placa, lo que facilita la adecuada expansión y la buena aposición del stent 10,11 (figura 1).
Los siguientes factores influyen de manera significativa en el resultado de la AR: la excentricidad del calcio, el área luminal y el tamaño de la oliva. El escenario óptimo para conseguir una ganancia luminal adecuada es una lesión concéntrica, con una distribución circunferencial del calcio y con un área luminal mínima menor que el tamaño de la oliva7. Otra indicación más controvertida es el tratamiento de la reestenosis del stent por una infraexpansión de este. Las lesiones excéntricas y con tortuosidad significativa son menos favorables para el tratamiento con AR, ya que conllevan un incremento del riesgo de complicaciones9.
La AR se puede plantear como estrategia primaria para la modificación de lesiones calcificadas o como estrategia de rescate tras el intento fallido de una predilatación de la lesión con balón9. Es una técnica segura en ambos casos, aunque la estrategia primaria se asocia con una disminución de los tiempos de procedimiento y fluoroscopia, del volumen de contraste y del número de balones de predilatación utilizados10 (tabla 1).
Datos clínicos
En la actualidad existe controversia en cuanto al uso sistemático de la AR, ya que no se ha demostrado claramente su beneficio clínico12-15. El ensayo ROTAXUS16 incluyó 240 pacientes con calcificación moderada-grave, que se aleatorizaron a AR y stent farmacoactivo o predilatación con balón y stent farmacoactivo. La AR mostró una mayor tasa de éxito del procedimiento y una mayor ganancia luminal inicial (1,56 ± 0,43 frente a 1,44 ± 0,49 mm; p = 0,01), y se observó una mayor pérdida luminal tardía del stent a los 9 meses de seguimiento (0,44 ± 0,58 frente a 0,31 ± 0,52 mm; p = 0,04). No se encontraron diferencias significativas en cuanto a la tasa de reestenosis ni de trombosis del stent, la necesidad de nueva revascularización de la lesión diana ni la tasa de eventos cardiovasculares adversos mayores (MACE, por sus siglas en inglés) a los 9 meses de seguimiento16.
En el estudio PREPARE-CALC17 se incluyeron 200 pacientes con LCGC que fueron aleatorizados 1:1 a tratamiento con cutting/scoring balloon o AR. No se hallaron diferencias significativas en cuanto a las complicaciones entre ambos grupos. No obstante, se observó una mayor tasa de éxito del procedimiento con la AR, con un menor porcentaje de estenosis residual (98 frente a 81%; p = 0,0001). No hubo diferencias significativas entre ambos grupos respecto a la pérdida luminal en el stent ni a los resultados clínicos a los 9 meses de seguimiento17.
En el registro multicéntrico ROTATE18 se incluyeron 1.176 pacientes con LCGC tratadas mediante AR y stent farmacoactivo, y se observó una tasa de MACE del 16% al año de seguimiento. El registro multicéntrico europeo de AR incluyó datos de 963 pacientes, en los que se logró el éxito clínico en el 92%, con una tasa de mortalidad del 12,5% y una tasa de MACE del 17% al año de seguimiento (resultados presentados en el congreso EuroPCR 2019)19.
Complicaciones
Las complicaciones más temidas de la AR son el atrapamiento de la oliva, la perforación y la disección coronaria (tabla 2)10,20.
Tabla 2. Complicaciones de la aterectomía rotacional, estrategia de prevención y tratamiento
| Estrategia de prevención | Tratamiento | |
|---|---|---|
| Slow-flow/no-reflow | Uso de olivas de menor tamaño Evitar velocidades de rotación elevadas Realizar ciclos cortos con pausas entre ellos |
Administración intracoronaria de nitratos, nitroprusiato, adenosina Mantener una perfusión adecuada si hay hipotensión |
| Disección | En relación con lesiones localizadas en segmentos con tortuosidad significativa | Si se observa una disección significativa se recomienda no continuar con la aterectomía Se recomienda el manejo estándar de la disección |
| Perforación | Relacionado con la elección de olivas grandes, la tortuosidad significativa del vaso y la selección de una velocidad de rotación no adecuada | Se recomienda el tratamiento estándar (incluido el uso de stents recubiertos y la pericardiocentesis de urgencia) |
| Atrapamiento de la oliva | Complicación rara; habitualmente se puede evitar con la selección adecuada de los casos y con la realización de una buena técnica | Realizar movimientos controlados de avance y retroceso Posicionar una segunda guía para avanzar un balón con la intención de liberar la oliva Aumentar el soporte mediante la intubación activa o con el uso de un extensor de catéter para aumentar la tracción El tratamiento mediante cirugía cardiaca puede ser necesario |
En cuanto al atrapamiento de la oliva, se diferencian 2 tipos: a) atrapamiento en la lesión (no permite el avance ni el retroceso de la oliva) y b) atrapamiento distal (la oliva no se puede retirar, pero sí avanzar). Diversos factores, como lesiones importantes y olivas muy pequeñas, predisponen a esta complicación. En caso de atrapamiento de la oliva no se recomienda activar la rotablación ni el modo dynaglide 10,11. Para solventarlo, se puede intentar realizar las siguientes maniobras: a) empuje y tracción controlados con una intubación activa del catéter; b) cortar el catéter del dispositivo y avanzar lo máximo posible un extensor de catéter guía con el objetivo de traccionar con mayor fuerza; o c) posicionar un segundo catéter guía a través del cual se avanzan una segunda guía y un balón con la intención de liberar la oliva11. Esta complicación es muy grave y en ocasiones requiere cirugía cardiaca emergente21.
La tortuosidad significativa, así como la falta de coaxialidad adecuada del catéter guía en el tratamiento de lesiones ostiales, pueden facilitar la disección coronaria y aumentar el riesgo de perforación10,11.
El fenómeno de slow-flow/no-reflow (flujo lento o ausencia de flujo) es la complicación relativamente más frecuente, aunque su incidencia ha disminuido hasta un 2,6% con la mejora de la técnica y la mayor experiencia de los operadores7,21. Existe más riesgo de que se produzca este fenómeno en lesiones largas y significativas en las que se realizan múltiples ablaciones, y cuando existe mal vaso distal. Se produce por embolización de residuos a la microvasculatura11. Se puede prevenir realizando ciclos cortos de rotablación, utilizando en primer lugar olivas de pequeño tamaño, haciendo pausas entre los ciclos y controlando angiográficamente el flujo. Una vez establecido el diagnóstico se trata administrando fluidoterapia, vasodilatadores locales a nivel distal y aminas vasoactivas si hay hipotensión, así como atropina en caso de bradicardia10,11.
ATERECTOMÍA ORBITAL
Definición
La AO es un procedimiento endovascular destinado a modificar la placa calcificada mediante una corona recubierta de diamante, cuyo mecanismo de acción consiste en la modificación de la placa tanto anterógrada como retrógrada7.
Principios operativos
El dispositivo estándar de AO es el Diamondback 360 (Cardiovascular Systems, Inc., St. Paul, MN, Estados Unidos), que consta de una corona de tamaño único (1,25 mm) recubierta de diamante que se encuentra conectada a un eje de transmisión y a un controlador alimentado por una consola neumática (figura 3 del material adicional). La corona se avanza sobre una guía específica de 0,012/0,014 pulgadas (ViperWire; Cardiovascular Systems, Inc., St. Paul, MN, Estados Unidos). La fuerza centrífuga generada durante la rotación comprime la corona contra la placa, produciendo su modificación y aumentando la distensibilidad22,23.
El mecanismo de acción de la AO consiste en una rotación elíptica de la corona, que consigue un aumento progresivo del diámetro orbital a medida que se aumenta la velocidad de rotación de 80.000 a 120.000 rpm22. Al incrementar la órbita con la mayor velocidad de rotación permite el lijado diferencial de lesiones calcificadas en vasos de hasta 3,5 mm utilizando la corona de 1,25 mm7. Para conseguir un resultado óptimo, la corona debe desplazarse de manera lenta y gradual a través de la lesión, en general a una velocidad de 1-3 mm/s, lo que permite una mayor ganancia luminal y una disminución de la tasa de complicaciones en comparación con velocidades de desplazamiento más altas7,22.
El efecto de la AO es dependiente del tiempo; se recomiendan ciclos de 30 segundos con pausas de 30 segundos entre ellos22. Es necesaria la infusión continua de una solución lubricante (ViperSlide) para ayudar a minimizar las lesiones térmicas durante la AO; además, se administran aproximadamente 18 ml/min de líquido para ayudar a refrigerar el dispositivo y a eliminar los residuos, disminuyendo así la isquemia y la embolización distal22,24.
Se encuentra disponible el sistema Micro Crown (Cardiovascular Systems, Inc., St. Paul, MN, Estados Unidos), que representa un avance tecnológico destinado a mejorar la eficiencia de la AO. Consta de un eje de transmisión con un nuevo diseño que posibilita un avance más fácil de la corona hasta la lesión. Permite la modificación de la placa con velocidades menores (50.000-70.000 rpm)9,22 (tabla 1).
Indicaciones
La principal indicación de la AO es el tratamiento de las lesiones calcificadas no dilatables por métodos convencionales, con el objetivo de modificar la placa y aumentar la distensibilidad del vaso para permitir una adecuada expansión del stent 22,23. Con el nuevo sistema de AO Micro Crown se pueden tratar lesiones ostiales y suboclusivas9 (tabla 1).
Datos clínicos
El estudio ORBIT I25, que incluyó 50 pacientes, demostró la seguridad y la eficacia de la AO para el tratamiento de las lesiones calcificadas. El éxito del procedimiento se logró en el 94% de los pacientes, y se observó una tasa de MACE del 8% a los 6 meses.
En el estudio ORBIT II26 se incluyeron 443 pacientes. Se logró el éxito del dispositivo en el 98,6%, la tasa de disecciones significativas fue del 2,3% y la tasa de MACE a 30 días fue del 10,4%. Los resultados a los 3 años de seguimiento señalaron una tasa de MACE del 23,5%27.
El estudio COAST28, en el que se utilizó el nuevo sistema Micro Crown, incluyó 100 pacientes y se observó el éxito del procedimiento en el 85%, con una tasa de MACE del 22,2% al año de seguimiento. Se está llevando a cabo el estudio ECLIPSE (NCT03108456), que incluirá 2.000 pacientes con LCGC aleatorizados a AO y stent farmacoactivo o a predilatación con balón y stent farmacoactivo.
Complicaciones
Las complicaciones son similares a las descritas para la AR. No obstante, comparada con la AR, la AO, al realizar un lijado anterógrado y retrógrado, disminuye la probabilidad de atrapamiento de la corona en la lesión. Los residuos que se producen son de menor tamaño y además no impide el flujo coronario durante su aplicación, reduciendo el riesgo de fenómeno de slow-flow/no-reflow, así como la lesión térmica del endotelio coronario7,24. La perforación coronaria es una de las complicaciones más graves de la AO, con una incidencia del 0,7-2%26-28. No se recomienda realizar AO cuando la anatomía coronaria presenta tortuosidad significativa (angulaciones > 90°).
ATERECTOMÍA CORONARIA CON LÁSER DE EXCÍMEROS
Definición
La aterectomía coronaria con láser de excímeros (ACLE) es un procedimiento endovascular destinado al tratamiento de lesiones significativas y calcificadas no dilatables con las técnicas habituales, mediante un mecanismo de acción fotoquímico, fototérmico y fotomecánico que se deriva de la aplicación de luz de alta energía29,30.
Principios operativos
El sistema de ACLE Philips CVX-300 utiliza cloruro de xenón y emite pulsos de luz ultravioleta a longitudes de onda de 308 nm. Los pulsos ultravioleta generados solo penetran 50 µm en profundidad y, por lo tanto, producen la desintegración de la placa calcificada mediante un mecanismo de ablación sin dañar la capa media ni la adventicia (figura 4 del material adicional)31. Hay disponibles 4 tamaños de catéter monorraíl ACLE (0,9, 0,14, 1,7 y 2,0 mm), que se puede avanzar sobre una guía de 0,014 pulgadas. La selección del tamaño adecuado se basa en una relación entre el catéter y el vaso de 0,5:0,67.
El efecto fotomecánico tiene lugar cuando el láser actúa en un medio líquido (solución salina, contraste o sangre), con la consiguiente liberación de burbujas expansivas que actúan sobre la placa aterosclerótica32. Un avance lento del dispositivo favorece el incremento de la ganancia luminal a nivel de la lesión. El número de pulsos, su longitud y el tiempo total de tratamiento con ACLE deben individualizarse según las características de la lesión. Las partículas generadas tienen un diámetro inferior a 10 µm, por lo que son reabsorbidas por el sistema reticuloendotelial y se evita la obstrucción microvascular31 (tabla 1).
Indicaciones
El uso clínico del ACLE es limitado. Su principal indicación es el tratamiento de las lesiones no dilatables por métodos convencionales. Rara vez se utiliza como estrategia de primera línea para el tratamiento de las LCGC, pero es la única opción cuando la lesión no puede cruzarse con un microcatéter o directamente con las guías RotaWire/ViperWire, como ocurre en las oclusiones crónicas33,34.
Otras indicaciones más controvertidas son el tratamiento de la reestenosis del stent no dilatable por métodos habituales cuando se debe a una infraexpansión de este35, las lesiones ostiales, las oclusiones de injertos de vena safena36 y las lesiones con contenido trombótico37-39. Se recomienda evitar realizar esta técnica en lesiones de tronco común no protegido, ante la presencia de tortuosidad significativa y cuando la lesión es bifurcada (tabla 1).
Datos clínicos
Los datos disponibles en la literatura procedentes de estudios aleatorizados (predilatación con balón frente a ACLE) son antiguos y no mostraron diferencias significativas en cuanto a sus resultados29,30,40.
En el infarto agudo de miocardio, los resultados del estudio multicéntrico CARMEL39, que incluyó 151 pacientes con lesiones trombóticas, mostraron el éxito del dispositivo en el 95% de los casos. El registro multicéntrico CORAL36 incluyó 98 pacientes con estenosis significativa del injerto de vena safena y observó una tasa de MACE del 18,4% a los 30 días.
Un estudio en el que se incluyeron 81 lesiones con reestenosis del stent por infraexpansión ha señalado la superioridad de la ACLE sobre la predilatación con balón de alta presión, observando mediante OCT la fractura del calcio por detrás de los struts producido por la ACLE35.
Complicaciones
Las potenciales complicaciones de la ACLE son similares a las descritas para la AR y la AO. Las principales son la disección coronaria, con una incidencia del 7%, y la perforación coronaria, con una incidencia del 0,5-8%29,30,33. No obstante, las mejoras en el diseño, el uso de una técnica con infusión continua de solución salina y el empleo de catéteres de menor calibre han permitido reducir la tasa de complicaciones33,34.
LITOPLASTIA CORONARIA
Definición
La LC es una técnica innovadora que emplea pulsos de alta energía mecánica, administrados por un balón semicompatible, que modifican la placa mediante fragmentación del calcio coronario41,42.
Principios operativos
El dispositivo disponible es el Coronary Rx Lithoplasty System (Shockwave Medical, Inc., Fremont, CA, Estados Unidos). El balón de litoplastia (BL) es un balón de angioplastia de un solo uso, con una longitud de 12 mm y diámetros disponibles de 2,5 a 4 mm, que se avanza sobre una guía de 0,014 pulgadas42,43. Emite pulsos de presión acústica circunferencial, lo que permite el tratamiento de lesiones calcificadas concéntricas (figura 5 del material adicional).
El BL se infla a nivel de la lesión calcificada a una presión de 4 atm y se administran ondas de choque a una frecuencia de 1 Hz43,44. La energía mecánica se transmite a la lesión cuando el BL entra en contacto con la capa íntima arterial, lo que permite la fractura del calcio en las capas tanto superficiales como profundas de la pared del vaso7, y con ello se facilitan la adecuada expansión y una buena aposición del stent 7,42,43.
Una vez situado el BL en la lesión, se conecta a una unidad externa que genera ondas mecánicas pulsátiles (figura 5 del material adicional). Se recomienda que la relación entre el tamaño del BL y el vaso sea 1:141,42. El BL se infla inicialmente a una presión de 4 atm y se administran 10 pulsos (requieren unos 10 segundos). A continuación, el BL se infla a una presión de 6 atm y después se desinfla para restaurar el flujo. Se continúan así nuevos ciclos; se puede llegar hasta un total de 8 terapias (80 pulsos) por balón y por lesión42,43. Debido al tamaño del BL, si la longitud de la lesión supera los 12 mm, el BL puede ser reposicionado para tratar la lesión en su totalidad. El uso del BL es sencillo, con una curva de aprendizaje corta, y simplifica la ICP7,42 (tabla 3).
Indicaciones
La principal indicación de la LC son las lesiones calcificadas concéntricas con una distribución circunferencial del calcio41,42. Parece tener más efecto sobre el calcio más profundo que otras técnicas de modificación de la placa45-47. La LC es efectiva en vasos de gran calibre, pues existen balones de litoplastia de hasta 4 mm de diámetro. Este dispositivo se puede utilizar en lesiones bifurcadas, ya que permite situar 2 guías durante el procedimiento para proteger la rama lateral. Asimismo, el BL parece seguro y efectivo ante la presencia de tortuosidad significativa, reestenosis del stent debida a infraexpansión48,49 y lesión calcificada en el tronco común con disfunción ventricular izquierda grave50,51 (tabla 3). Otra indicación más discutible puede ser el tratamiento de LCGC en el contexto de un infarto agudo de miocardio con elevación del ST52 (figura 2).
Tabla 3. Características generales de los dispositivos de modificación de placa basados en tecnología con balón
| Litoplastia coronaria | Cutting/scoring balloon | Balón de muy alta presión | |
|---|---|---|---|
| Principios operativos | |||
| Tecnología | Balón semidistensible que emite pulsos de alta energía mecánica | Balón NC con microcuchillas/balón semidistensible con filamentos en espiral | Balón NC de doble capa |
| Mecanismo de acción | Litotricia/fragmentación de calcio | Corte de la superficie luminal de la placa | Permite el inflado a 35-40 atm |
| Curva de aprendizaje | Corta | Corta | Corta |
| Tamaño del dispositivo | 2,5-4 mm | 2,75-3,5 mm/2,0-3,5 mm | 1,5-4,5 mm |
| Catéter compatible | 6 Fr | 6 Fr | 6 Fr |
| Indicaciones | |||
| Indicación principal | Preparación de lesiones calcificadas | Reestenosis del stent | Optimización del stent |
| Localización óptima del calcio | Luminal con distribución circunferencial | Luminal | Luminal |
| Reestenosis del stent | Sí | Sí | Sí |
| Complicaciones | |||
| Dificultad de cruce | Sí, mejorado con el BL de nueva generación | Sí/no | Sí |
| Disección | Riesgo bajo | Riesgo moderado | Riesgo moderado |
| Perforación | Riesgo bajo | Riesgo bajo | Riesgo bajo |
| Slow-flow/no-reflow | Riesgo bajo | Riesgo bajo | Riesgo bajo |
| Consejos prácticos | |||
| Pulsos administrados | Hasta 80 pulsos (8 ciclos) | N/A | N/A |
| Relación entre dispositivo y vaso | 1:1 | 0,8:1 | 1:1 |
| Recomendaciones | Inflado a 4 atm, 10 pulsos; después se sube a 6 atm y se desinfla Útil con tortuosidad Útil en bifurcaciones | Inflado lento y gradual | Inflado lento y gradual Permite posdilatar el stent a altas atm |
|
BL: balón de litoplastia; N/A: no aplica. NC: non-compliant balloon (balón no distensible). |
|||
Datos clínicos
El ensayo DISRUPT CAD I fue un estudio previo a la comercialización, que demostró la seguridad y la efectividad de la LC en LCGC previamente a la implantación del stent; la tasa de MACE fue del 8% a los 6 meses45. El estudio DISRUPT CAD II, con 120 pacientes, demostró la seguridad de la LC antes de la implantación del stent, con una tasa de MACE a los 30 días del 7,6%46. No obstante, se precisan estudios más grandes y con periodos de seguimiento más largos para confirmar estos resultados. El DISRUPT CAD III (NCT03595176) es un estudio multicéntrico, con una inclusión estimada de 392 pacientes, que evaluará la seguridad y la efectividad del BL con el fin de obtener la aprobación de la Food and Drug Administration para el uso del dispositivo en los Estados Unidos (tabla 4).
Tabla 4. Características y resultados de los principales estudios sobre diferentes técnicas de modificación de placa
| Estudio y año | N.º pacientes y grupos de tratamiento | Características de la lesión | Resultados del estudio | |
|---|---|---|---|---|
| Aterectomía rotacional | ||||
| ROTAXUS16 (2014) | 240 pacientes AR + stent frente a ICP estándar |
Lesión con calcificación moderada-grave | Pérdida luminal en el stent a los 9 meses Tasa de MACE a los 9 meses |
0,44 frente a 0,31 mm; p = 0,04 24,2 frente a 28,3%, p = 0,46 |
| PREPARE-CALC17 (2018) | 200 pacientes Cutting/scoring balloon frente a AR |
Lesión gravemente calcificada | Pérdida luminal a los 9 meses Revascularización de la lesión diana |
0,16 ± 0,39 frente a 0,22 ± 0,40 mm; p = 0,21 7% frente a 2%; p = 0,17 |
| ROTATE18 (2016) | 1.176 pacientes AR + stent farmacoactivo |
Lesión gravemente calcificada | Tasa de MACE a 1 año Tasa de MACE a 2 años |
16% 24,9% |
| Registro Europeo de AR19 (2019) | 963 pacientes | Lesión gravemente calcificada | Éxito clínico Tasa de MACE a 1 año |
92% 17% |
| Aterectomía orbital | ||||
| ORBIT I25 (2013) | 50 pacientes | Lesión calcificada | Éxito del procedimiento Tasa de MACE a 6 meses |
94% 8% |
| ORBIT II26,27 (2014) | 443 pacientes | Lesión gravemente calcificada | Éxito del procedimiento ZTasa de MACE a 1 y 3 años |
98,6% 16,4 y 23,5% |
| COAST28 (2017) | 100 pacientes Micro Crown AO |
Lesión gravemente calcificada | Éxito del procedimiento Tasa de MACE a 1 año |
85% 22,2% |
| Aterectomía coronaria con láser de excímeros | ||||
| AMRO29 (1996) | 308 pacientes (157/151) ICP estándar/láser |
Lesión gravemente calcificada/reestenosis del stent | Ganancia luminal a 6 meses Tasa de MACE a 6 meses |
0,48 frente a 0,44 mm, p = 0,34 29,9 frente a 33,1%, p = 0,55 |
| LAVA30 (1997) | 215 pacientes (98/117) ICP estándar/láser |
Lesión gravemente calcificada/reestenosis del stent | Éxito del procedimiento Al año de seguimiento |
96,9 frente a 96,6%, p = 0,88 Sin diferencias significativas |
| ERBAC40 (1997) | 222/232/231 pacientes ICP estándar frente a ACLE frente a AR |
Lesión con calcificación moderada-grave | Éxito del procedimiento Revascularización de la lesión diana |
80 frente a 77 frente a 89%; p = 0,0019 32 frente a 46 frente a 42,4%; p = 0,013 |
| Litoplastia coronaria | ||||
| DISRUPT CAD I44 (2019) | 60 pacientes | Lesión gravemente calcificada | Éxito angiográfico Tasa de MACE a 6 meses |
100% 8,3% |
| DISRUPT CAD II45 (2019) | 120 pacientes | Lesión gravemente calcificada | Éxito angiográfico Tasa de MACE a 30 días |
100% 7,6% |
|
ACLE: aterectomía coronaria con láser de excímeros; AMRO: Amsterdam-Rotterdam trial; AO: aterectomía orbital; AR: aterectomía rotacional; COAST: Coronary Orbital Atherectomy System Study; ERBAC: Excimer Laser, Rotational Atherectomy, and Balloon Angioplasty Comparison; ICP: intervención coronaria percutánea; LAVA: Laser Angioplasty Versus Angioplasty; MACE: eventos cardiovasculares adversos mayores; ROTAXUS: Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease. |
||||
Complicaciones
Cabe destacar que las complicaciones durante el procedimiento son inciertas (disección y perforación). A pesar del éxito del dispositivo a corto plazo, existen pocos datos del mundo real publicados sobre el uso del BL. Parece ser que la fragmentación del calcio producida por el BL permanece in situ sin producir embolización distal, lo que disminuye la incidencia del fenómeno de slow-flow/no-reflow 7,42,43.
OTRAS TÉCNICAS Y OTROS DISPOSITIVOS
Balón no distensible
El balón NC presenta mínimos cambios de dimensión incluso a altas presiones, lo que permite concentrar la fuerza en un punto en concreto para permitir la dilatación de la lesión calcificada sin producir una dilatación excesiva en otros segmentos del vaso. Se suele utilizar para posdilatar el stent y garantizar una adecuada expansión y una buena aposición53. Hay que tener precaución, ya que el empleo de un balón NC en LCGC puede provocar la perforación coronaria o la disección de los bordes del stent cuando se utiliza para posdilatar53.
Balón de muy alta presión
El balón de muy alta presión consiste en un sistema de doble capa que permite una expansión uniforme del balón, reduciendo el riesgo de rotura y de perforación coronaria54. El dispositivo OPN (SIS Medical AG, Winterthur, Suiza) proporciona una presión de hasta 35-40 atm sin que se produzca la rotura del balón (tabla 3). Estas características permiten el tratamiento de la infraexpansión del stent cuando otras opciones han fallado. La principal limitación de este tipo de balón es su perfil de cruce, debido a su mayor rigidez y a la tecnología de doble capa7,54.
Cutting balloon y scoring balloon
El balón de corte (cutting balloon) WOLVERINE (Boston Scientific, Marlborough, MA, Estados Unidos) consiste en un balón NC con 3 microcuchillas dispuestas longitudinalmente sobre su superficie con el objetivo de crear incisiones dentro de la lesión calcificada durante el inflado del balón; se recomienda realizar un inflado secuencial hasta 6 atm55. Las principales limitaciones son su perfil de cruce y el riesgo de disección y perforación coronaria (tabla 3). El perfil de cruce y la navegabilidad del balón han mejorado con una nueva generación del dispositivo, el scoring ballon (tabla 3): AngioSculpt, Scoreflex y NSE Alpha. Consiste en un balón semidistensible de bajo perfil rodeado por 3 filamentos de nitinol dispuestos en espiral que permiten un mayor anclaje a la placa, con menos probabilidad de deslizamiento del balón y menor riesgo de disección y perforación56.
COMBINACIÓN DE TÉCNICAS
La combinación de AR y balón de corte en las LCGC facilita la fractura del calcio y permite una mejor expansión y aposición del stent57.
La técnica RASER consiste en la combinación de ACLE y AR o AO58. Esta combinación se puede utilizar en lesiones que no permiten el avance de un microcatéter. El láser puede proporcionar una modificación suficiente de la placa para avanzar el microcatéter y realizar el intercambio por una RotaWire/ViperWire que permita llevar a cabo AR o AO para lograr una adecuada expansión del stent58.
La combinación de AR y LC (técnica RotaTripsy) ha sido descrita recientemente59. Puede ser útil en lesiones muy graves y calcificadas con distribución circunferencial del calcio. En este tipo de lesiones, en las que es difícil posicionar directamente el BL en la lesión diana, la AR puede conseguir la modificación de placa inicial para permitir avanzar el BL y, de este modo, aumentar la distensibilidad luminal con el fin de lograr una adecuada expansión del stent59.
IMAGEN INTRAVASCULAR EN LAS LESIONES CALCIFICADAS
Las técnicas de imagen intravascular (IVUS y OCT) mejoran la identificación de las LCGC y permiten una evaluación meticulosa de la carga, la distribución y la excentricidad del calcio7,42.
Debido a la mayor penetración de los ultrasonidos, la IVUS es capaz de detectar depósitos calcificados en las capas más profundas de la pared del vaso. Sin embargo, debido a la sombra acústica, solo permite la definición del arco cálcico, sin poder ofrecer información sobre su espesor60,61. La OCT tiene mayor resolución espacial y ofrece una definición más precisa. El calcio se visualiza como un área de atenuación con un borde luminal bien delimitado. Parece ser una técnica más precisa que la IVUS para definir la carga de calcio, ya que proporciona información sobre los grados del arco cálcico, el área, el espesor, la longitud y el volumen de distribución del calcio42,61-63.
La imagen intravascular es esencial para seleccionar el dispositivo de modificación de la placa y para evaluar el resultado final del stent. La OCT presenta mayor sensibilidad para detectar la infraexpansión y la malaposición del stent, así como para evaluar el resultado tras la posdilatación7,61.
CONCLUSIONES
La calcificación coronaria se encuentra asociada a lesiones complejas y pacientes con importante comorbilidad, lo cual es un predictor de mal pronóstico a corto y medio plazo. En la actualidad se tratan pacientes cada vez más complejos y con lesiones más calcificadas, por lo que la preparación de la placa es clave en estos casos para favorecer la adecuada expansión y la buena aposición del stent, y de este modo evitar la reestenosis y la trombosis del stent.
El dispositivo de modificación de la placa ideal sería aquel que resultara fácil de implementar, de uso sencillo, eficaz y seguro durante el procedimiento, y con buenos resultados a medio y largo plazo. Con la aparición de la LC y la actualización del Rotablator y del balón de corte, parece que este campo presenta un resurgir positivo. En la actualidad se dispone de muchos dispositivos, que se pueden clasificar en técnicas de modificación de placa con balón y sin balón.
Todavía falta mucha evidencia procedente de estudios aleatorizados y de registros del mundo real para conocer con exactitud el papel de cada una de las técnicas, así como el beneficio de sus combinaciones, ya que, lejos de ser técnicas excluyentes, podrían ser complementarias. Con independencia de la técnica de modificación de la placa utilizada, se recomienda realizar imagen intravascular para asegurar la adecuada expansión y aposición del stent.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Bourantas CV, Zhang YJ, Garg S, et al. Prognostic implications of coronary calcification in patients with obstructive coronary artery disease treated by percutaneous coronary intervention:a patient-level pooled analysis of 7 contemporary stent trials. Heart. 2014;100:1158-1164.
2. Otsuka F, Sakakura K, Yahagi K, et al. Has our understanding of calcification in human coronary atherosclerosis progressed?Arterioscler Thromb Vasc Biol. 2014;34:724-736.
3. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
4. Généreux P, Madhavan MV, Mintz GS, et al. Ischemic outcomes after coronary intervention of calcified vessels in acute coronary syndromes. Pooled analysis from the HORIZONS-AMI (Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction) and ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) TRIALS. J Am Coll Cardiol. 2014;63:1845-1854.
5. Maehara A, Mintz GS, Witzenbichler B, et al. Relationship between intravascular ultrasound guidance and clinical outcomes after drug-eluting stents:the assessment of dual antiplatelet therapy with drug-eluting stents (ADAPT-DES) study. Circulation. 2014;129:463-470.
6. Barbato E, Shlofmitz E, Milkas A, Shlofmitz R, Azzalini L, Colombo A. State of the art:evolving concepts in the treatment of heavily calcified and undilatable coronary stenoses —from debulking to plaque modification, a 40-year-long journey. EuroIntervention. 2017;13:696-705.
7. De Maria GL, Scarsini R, Banning AP. Management of Calcific Coronary Artery Lesions:Is it Time to Change Our Interventional Therapeutic Approach?JACC Cardiovasc Interv. 2019;12:1465-1478.
8. Kassimis G, Raina T, Kontogiannis N. How should we treat heavily calcified coronary artery disease in contemporary practice?From atherectomy to intravascular lithotripsy. Cardiovasc Revasc Med. 2019. https://doi.org/10.1016/j.carrev.2019.01.010.
9. Shavadia JS, Vo MN, Bainey KR. Challenges With Severe Coronary Artery Calcification in Percutaneous Coronary Intervention:A Narrative Review of Therapeutic Options. Can J Cardiol. 2018;34:1564-1572.
10. Sharma SK, Tomey MI, Teirstein PS, et al. North American Expert Review of Rotational Atherectomy. Circ Cardiovasc Interv. 2019;12:e007448.
11. Barbato E, CarriéD, Dardas P, et al. European expert consensus on rotational atherectomy. EuroIntervention. 2015;11:30-36.
12. Bittl JA, Chew DP, Topol EJ, et al. Meta-analysis of randomized trials of percutaneous transluminal coronary angioplasty versus atherectomy, cutting balloon atherotomy, or laser angioplasty. J Am Coll Cardiol. 2004;43:936-942.
13. Whitlow PL, Bass TA, Kipperman RM, et al. Results of the study to determine Rotablator and transluminal angioplasty strategy (STRATAS). Am J Cardiol. 2001;87:699-705.
14. Safian RD, Feldman T, Muller DW, et al. Coronary angioplasty and Rotablator atherectomy trial (CARAT):immediate and late results of a prospective multicenter randomized trial. Catheter Cardiovasc Interv. 2001;53:213-220.
15. Sakakura K, Inohara T, Kohsaka S, et al. Incidence and Determinants of Complications in Rotational Atherectomy:Insights From the National Clinical Data (J-PCI Registry). Circ Cardiovasc Interv. 2016;9:e004278.
16. Abdel-Wahab M, Richardt G, Joachim Buttner H, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions:the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6:10-19.
17. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. The Randomized PREPARE-CALC. Circ Cardiovasc Interv. 2018;11:e007415.
18. Kawamoto H, Latib A, Ruparelia N., et al. In-hospital and midterm clinical outcomes of rotational atherectomy followed by stent implantation:The ROTATE multicentre registry. EuroIntervention. 2016;12:1448-1456.
19. Carrié D, Reczuch K, Dobrzycki K, et al.;on behalf of the EURO4C Registry investigators. Results of the prospective European Registry on Rotational Atherectomy. EuroPCR Congress 2019. Disponible en:https://media.pcronline.com/diapos/EuroPCR2019/3355-20190523_1630_Theatre_Bordeaux_Carrie_Didier_1111_(12324)/Carrie_Didier_20190523_1630_Theatre_Bordeaux.pdf. Consultado 12 Nov 2019.
20. Sulimov DS, Abdel-Wahab M, Toelg R. Stuck Rotablator:the nightmare of rotational atherectomy. EuroIntervention. 2013;9:251-258.
21. Tomey MI, Kini AS, Sharma SK. Current status of rotational atherectomy. JACC Cardiovasc Interv. 2014;7:345-353.
22. Shlofmitz E, Shlofmitz R, Lee MS. Orbital Atherectomy:A Comprehensive Review. Interv Cardiol Clin. 2019;8:161-171.
23. Sotomi Y, Cavalcante R, Shlofmitz RA, et al. Quantification by optical coherence tomography imaging of the ablation volume obtained with the orbital atherectomy system in calcified coronary lesions. EuroIntervention. 2016;12:1126-1134.
24. Yamamoto MH, Maehara A, Karimi Galougahi K, et al. Mechanisms of orbital versus rotational atherectomy plaque modification in severely calcified lesions assessed by optical coherence tomography. JACC Cardiovasc Interv. 2017;10:2584-2586.
25. Parikh K, Chandra P, Choksi N, et al. Safety and feasibility of orbital atherectomy for the treatment of calcified coronary lesions:the ORBIT I trial. Catheter Cardiovasc Interv. 2013;81:1134-1139.
26. Chambers JW, Feldman RL, Himmelstein SI, et al. Pivotal trial to evaluate the safety and efficacy of the orbital atherectomy system in treating de novo, severely calcified coronary lesions (ORBIT II). JACC Cardiovasc Interv. 2014;7:510-518.
27. Lee M, Genereux P, Shlofmitz R, et al. Orbital atherectomy for treating de novo, severely calcified coronary lesions:3-year results of the pivotal ORBIT II trial. Cardiovasc Revasc Med. 2017;18:261-264.
28. Sharma S, Saito S, Shlofmitz R, et al. LBT-3 treatment of severely calcified coronary lesions with the coronary orbital atherectomy system Micro Crown:1-year results from the COAST trial. JACC Cardiovasc Interv. 2017;3:S1-2.
29. Appelman YE, Piek JJ, Strikwerda S, et al. Randomized trial of excimer laser angioplasty versus balloon angioplasty for treatment of obstructive coronary artery disease. Lancet. 1996;347:79-84.
30. Stone GW, de Marchena E, Dageforde D, et al. Prospective, randomized, multicenter comparison of laser-facilitated balloon angioplasty versus stand-alone balloon angioplasty in patients with obstructive coronary artery disease. The Laser Angioplasty Versus Angioplasty (LAVA) Trial Investigators. J Am Coll Cardiol. 1997;30:1714-1721.
31. Ambrosini V, Sorropago G, Laurenzano E, et al. Early outcome of high energy laser (Excimer) facilitated coronary angioplasty on hard and complex calcified and balloon-resistant coronary lesions:LEONARDO Study. Cardiovasc Revasc Med. 2015;16:141-146.
32. Deckelbaum LI, Natarajan MK, Bittl JA, et al. Effect of intracoronary saline infusion on dissection during excimer laser coronary angioplasty:a randomized trial. The Percutaneous Excimer Laser Coronary Angioplasty (PELCA) Investigators. J Am Coll Cardiol. 1995;26:1264-1269.
33. Fernandez JP, Hobson AR, McKenzie D, et al. Beyond the balloon:excimer coronary laser atherectomy used alone or in combination with rotational atherectomy in the treatment of chronic total occlusions, non-crossable and nonexpansible coronary lesions. EuroIntervention. 2013;9:243-250.
34. Mohandes M, Rojas S, Moreno C, Fernández F, Fuertes M, Guarinos J. Excimer laser in percutaneous coronary intervention of device uncrossable chronic total and functional occlusions. Cardiovasc Revasc Med. 2019. < a href="https://doi.org/10.1016/j.carrev.2019.08.022" target="_blank">https://doi.org/10.1016/j.carrev.2019.08.022.
35. Lee T, Shlofmitz RA, Song L, et al. The effectiveness of excimer laser angioplasty to treat coronary in-stent restenosis with peri-stent calcium as assessed by optical coherence tomography. EuroIntervention 2019;15:e279-288.
36. Giugliano GR, Falcone MW, Mego D, et al. A prospective multicenter registry of laser therapy for degenerated saphenous vein graft stenosis:the COronary graft Results following Atherectomy with Laser (CORAL) trial. Cardiovasc Revasc Med. 2012;13:84-89.
37. Nishino M, Mori N, Takiuchi S, et al. Indications and outcomes of excimer laser coronary atherectomy:Efficacy and safety for thrombotic lesions —The ULTRAMAN registry. J Cardiol. 2017;69:314-319.
38. Dorr M, Vogelgesang D, Hummel A, et al. Excimer laser thrombus elimination for prevention of distal embolization and no-reflow in patients with acute ST elevation myocardial infarction:results from the randomized LaserAMI study. Int J Cardiol. 2007;116:20-26.
39. Topaz O, Ebersole D, Das T, et al. Excimer laser angioplasty in acute myocardial infarction (the CARMEL multicenter trial). Am J Cardiol. 2004;93:694-701.
40. Reifart N, Vandormael M, Krajcar M, et al. Randomized comparison of angioplasty of complex coronary lesions at a single center. Excimer Laser, Rotational Atherectomy, and Balloon Angioplasty Comparison (ERBAC) Study. Circulation. 1997;96:91-98.
41. De Silva K, Roy J, Webb I, et al. A Calcific, Undilatable Stenosis:Lithoplasty, a New Tool in the Box?JACC Cardiovasc Interv. 2017;10:304-306.
42. Ali ZA, Brinton TJ, Hill JM, et al. Optical Coherence Tomography Characterization of Coronary Lithoplasty for Treatment of Calcified Lesions:First Description. JACC Cardiovasc Imaging. 2017;10:897-906.
43. Serruys PW, Katagiri Y, Onuma Y. Shaking and Breaking Calcified Plaque:Lithoplasty, a Breakthrough in Interventional Armamentarium?JACC Cardiovasc Imaging. 2017;10:907-911.
44. Rodriguez Costoya I, Tizón Marcos H, Vaquerizo Montilla B, et al. Coronary Lithoplasty:Initial Experience in Coronary Calcified Lesions. Rev Esp Cardiol. 2019;72:788-790.
45. Brinton TJ, Ali ZA, Hill JM, et al. Feasibility of Shockwave Coronary Intravascular Lithotripsy for the Treatment of Calcified Coronary Stenoses. Circulation. 2019;139:834-836.
46. Ali ZA, Nef H, Escaned J, et al. Safety and Effectiveness of Coronary Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Stenoses:The Disrupt CAD II Study. Circ Cardiovasc Interv. 2019;12:e008434.
47. Wong B, El-Jack S, Newcombe R, Glenie T, Armstrong G, Khan A. Shockwave Intravascular Lithotripsy for Calcified Coronary Lesions:First Real-World Experience. J Invasive Cardiol. 2019;31:46-48.
48. Tovar Forero MN, Wilschut J, Van Mieghem NM, Daemen J. Coronary lithoplasty:a novel treatment for stent underexpansion. Eur Heart J. 2019;40:221.
49. Watkins S, Good R, Hill J, Brinton TJ, Oldroyd KG. Intravascular lithotripsy to treat a severely underexpanded coronary stent. EuroIntervention. 2019;15:124-125.
50. Wong B, E-Jack S, Khan A, et al. Treatment of Heavily Calcified Unprotected Left Main Disease With Lithotripsy:The First Case Series. J Invasive Cardiol. 2019;31:E143-E147.
51. Ristalli F, Maiani S, Mattesini A, et al. Intravascular lithotripsy and Impella support to assist complex LM angioplasty. Cardiovasc Revasc Med. 2019. https://doi.org/10.1016/j.carrev.2019.06.014.
52. Wong B, El-Jack S, Newcombe R, et al. Shockwave Intravascular Lithotripsy of Calcified Coronary Lesions in ST-Elevation Myocardial Infarction:First-in-Man Experience. J Invasive Cardiol. 2019;31:E73-E75.
53. Romagnoli E, Sangiorgi GM, Cosgrave J, et al. Drug-eluting stenting:the case for post-dilation. JACC Cardiovasc Interv. 2008;1:22-31.
54. Secco GG, Ghione M, Mattesini A, et. al. Very high-pressure dilatation for undilatable coronary lesions:indications and results with a new dedicated balloon. EuroIntervention. 2016;12:359-365.
55. Mauri L, Bonan R, Weiner BH, et al. Cutting balloon angioplasty for the prevention of restenosis:results of the Cutting Balloon Global Randomized Trial. Am J Cardiol. 2002;90:1079-1083.
56. de Ribamar Costa JJr, Mintz GS, Carlier SG, et al. Nonrandomized comparison of coronary stenting under intravascular ultrasound guidance of direct stenting without predilation versus conventional predilation with a semi-compliant balloon versus predilation with a new scoring balloon. Am J Cardiol. 2007;100:812-817.
57. Amemiya K, Yamamoto MH, Maehara A, et al. Effect of cutting balloon after rotational atherectomy in severely calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019. https://doi.org/10.1002/ccd.28278.
58. Fernandez JP, Hobson AR, McKenzie D, et al. Beyond the balloon:excimer coronary laser atherectomy used alone or in combination with rotational atherectomy in the treatment of chronic total occlusions, non-crossable and nonexpansible coronary lesions. EuroIntervention. 2013;9:243-250.
59. Jurado-Román A, Gonzálvez A, Galeote G, Jiménez-Valero S, Moreno R. RotaTripsy:Combination of Rotational Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified Lesions. JACC Cardiovasc Interv. 2019;12:e127-e129.
60. Hoffmann R, Mintz GS, Popma JJ, et al. Treatment of calcified coronary lesions with Palmaz-Schatz stents. An intravascular ultrasound study. Eur Heart J. 1998;19:1224-1231.
61. Sharma SK, Vengrenyuk Y, Kini AS. IVUS, OCT, and coronary artery calcification:is there a bone of contention?JACC Cardiovasc Imaging. 2017;10:880-882.
62. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
63. Zhang M, Matsumura M, Usui E, et al. TCT 51:IVUS Predictors of Stent Expansion in Severely Calcified Lesions. J Am Coll Cardiol. 2019;74(13 Supplement) B51. http://www.onlinejacc.org/content/74/13_Supplement/B51.
- Archivo PDF del volumen (ES): Descargar revista completa
RESUMEN
El tratamiento de la oclusión total coronaria (OTC) sigue siendo uno de los grandes retos de la cardiología. La complejidad del procedimiento de angioplastia de una OTC, unida a cierta controversia en cuanto al beneficio clínico, han generado resistencias en la comunidad de cardiólogos para desarrollar programas de intervención coronaria en los laboratorios de hemodinámica. Sin embargo, la evidencia proveniente de estudios observacionales indica que el intervencionismo con éxito puede aumentar de manera significativa la calidad de vida del paciente, mejorar la función ventricular izquierda, reducir la necesidad de una posterior cirugía y, posiblemente, prolongar la supervivencia. Deben tenerse en cuenta varios factores en la selección de los pacientes para el intervencionismo, como la extensión de la isquemia que rodea a la oclusión, la viabilidad miocárdica, la ubicación coronaria de la OTC y la probabilidad de éxito del procedimiento. Esta revisión proporciona una descripción general de la anatomía y de la histopatología de las OTC, la evidencia sobre el beneficio clínico del intervencionismo, el uso de sistemas de puntuación que pueden ser útiles para evaluar de forma más objetiva la probabilidad de éxito, y un resumen de las técnicas actuales para la realización del procedimiento.
Palabras clave: Enfermedad arterial coronaria. Oclusión total crónica. Intervención coronaria percutánea. Cardiopatía isquémica estable.
ABSTRACT
The management of chronic total coronary occlusions (CTO) is still today one of the greatest challenges of cardiology. The complexity of the angioplasty procedure of a CTO added to its controversial clinical benefits has generated certain skepticism in the community of cardiologists when developing CTO intervention programs at the catheterization laboratory. However, the evidence from observational studies indicates that if the intervention is successful it can significantly increase the patient’s quality of life, improve the left ventricular function, reduce the need for a subsequent coronary artery bypass graft, and possibly improve survival. Several factors must be taken into consideration in the selection of patients elective for an intervention, including the extent of ischemia surrounding the occlusion, the myocardial viability, the coronary location of the CTO, and the chances of being successful with the procedure. This review provides a general description of the anatomy and histopathology of the CTOs, the evidence surrounding the clinical benefit of these procedures, the use of useful scoring systems to assess more objectively the probability of success, and a summary of the latest techniques available today to perform this procedure.
Keywords: Coronary artery disease. Chronic total coronary occlusion. Percutaneous coronary intervention. Stable ischemic heart disease.
Abreviaturas: EAC: enfermedad arterial coronaria. ICP: intervencionismo coronario percutáneo. IVUS: ecografía intravascular. MACE: evento adverso cardiovascular mayor. MDL: microcatéter de doble luz. OTC: oclusión total coronaria.
INTRODUCCIÓN
El tratamiento de los pacientes con una oclusión total coronaria (OTC) es uno de los mayores retos en la enfermedad isquémica coronaria. En la actualidad existe cierta controversia en cuanto a las indicaciones del intervencionismo coronario percutáneo (ICP) en los pacientes con OTC y al impacto de la revascularización en el pronóstico final. No es de extrañar, por tanto, que un buen número de cardiólogos intervencionistas traten de evitar estos procedimientos potencialmente largos, costosos y con importante exposición a la radiación. La complejidad y la falta de familiaridad con los nuevos dispositivos y técnicas a menudo resultan en intentos fallidos y en abandonos prematuros del intervencionismo. Sin embargo, en la actualidad se dispone de técnicas que facilitan la obtención de unas altas tasas de éxito.
Por este motivo, en la presente revisión se insta a la comunidad de cardiólogos intervencionistas a promover la excelencia clínica a través de la capacitación en la desoclusión coronaria mediante la realización de curvas de aprendizaje, así como a fomentar la investigación y el desarrollo tecnológico en este campo1.
DEFINICIÓN, EPIDEMIOLOGÍA Y CLÍNICA
Definición
El consenso actual establece la definición de una OTC verdadera como la presencia de flujo TIMI (Thrombolysis In Myocardial Infarction) 0 en el segmento ocluido con una duración estimada de más de 3 meses. El tiempo durante el cual ha estado presente una oclusión es difícil de determinar con total certeza y, por ello, a menudo se determina después de una evaluación cuidadosa de la historia clínica y de los síntomas cardiacos en los 3 meses previos.
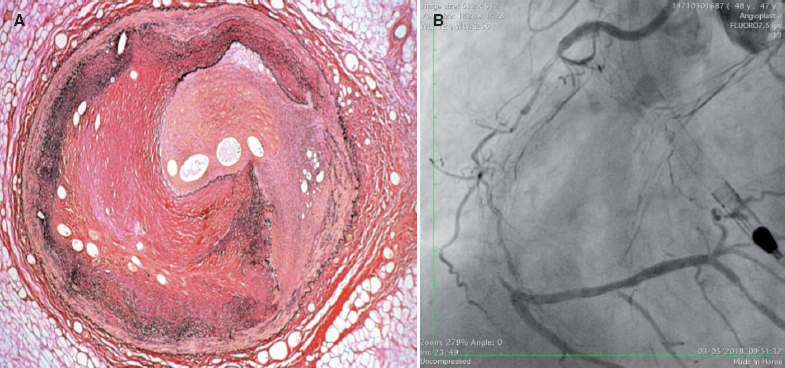
Una cuestión importante es el proceso de neovascularización que ocurre a lo largo de toda la lesión oclusiva y en la pared del vaso. La neoangiogénesis aumenta con el tiempo de oclusión. En las OTC de menos de 1 año de evolución, la formación neocapilar es predominantemente adventicial. En las OTC de más de 1 año suele existir una rica red de neovasos que con frecuencia atraviesa la pared adventicial del vaso hasta la íntima y forma las denominadas colaterales puente (bridging collaterals). El proceso de neoformación vascular puede dar lugar a la formación de capilares relativamente largos, que se denominan microcanales y que pueden llegar a atravesar el cuerpo de la oclusión, recanalizando parcialmente la luz distal (figura 1A). Su presencia tiene importancia, ya que una guía de angioplastia con recubrimiento hidrófilo puede atravesarlos y alcanzar la luz distal. Los microcanales también pueden conectarse con los vasa vasorum de la adventicia y crear un acceso colateral extraluminal hacia la luz distal, con el típico aspecto de caput medusae (figura 1B). Esto último suele verse en OTC complejas y de larga evolución. En general, la dureza y la concentración del material fibrocalcificado, y la complejidad de la OTC, se correlacionan con el tiempo de oclusión2.
Figura 1. A: se puede apreciar la existencia de microcanales en el interior de la luz del vaso; alrededor existe gran fibrosis. B: imagen característica de neovascularización extraluminal caput medusae.
Otro componente anatómico fundamental de las OTC es la circulación colateral que proporciona flujo sanguíneo al territorio ocluido. Puede ser epicárdica o intramiocárdica, y provenir del territorio coronario homolateral o contralateral. Cuando está presente antes de que se desarrolle la OTC, aporta flujo sanguíneo suficiente para mantener la viabilidad del miocardio irrigado por la arteria ocluida, pero casi siempre es insuficiente para evitar la presencia de angina de esfuerzo o isquemia. La circulación colateral no precisa un miocardio viable para desarrollarse, y por ello es importante matizar que la desoclusión de una OTC no debe basarse en la presencia o no de circulación colateral ni en su cantidad o calidad3,4.
Epidemiología
Según los datos obtenidos del NHLBI Dynamic Registry5 entre los años 1997 y 1999, las OTC son más prevalentes en la arteria coronaria derecha y menos en la circunfleja. El porcentaje de pacientes sometidos a intervencionismo por una OTC de esta serie fue del 15,6%. Según los datos del EuroCTO Club: en 28.283 pacientes, el 12% de los ICP se realizaron sobre OTC. La prevalencia informada de OTC varía mucho, del 16 al 50% en los pacientes con enfermedad arterial coronaria (EAC) clínicamente significativa, pero en general está en torno al 18-20%6,7.
Clínica
Los pacientes con OTC tienen un perfil de riesgo cardiovascular más desfavorable que con aquellos sin OTC6. La presentación clínica de una OTC puede ser muy variable: angina estable, isquemia silente, insuficiencia cardiaca de origen isquémico, angina de reciente comienzo o como hallazgo incidental en pacientes sometidos a ICP primario debido a una oclusión aguda en un vaso culpable diferente.
En la cardiopatía isquémica estable, el objetivo de la revasculari- zación en una OTC es mejorar los síntomas y el pronóstico valorando la presencia de síntomas, viabilidad o isquemia. Por ello, en los pacientes asintomáticos con OTC, la carga isquémica debe evaluarse antes de considerar el intervencionismo8. En los pacientes con evidencia de infarto de miocardio previo y alteraciones de la contractilidad segmentaria se recomienda realizar un estudio no invasivo antes del tratamiento, para establecer la presencia de isquemia o viabilidad en el territorio de la arteria ocluida.
BENEFICIO DEL INTERVENCIONISMO CORONARIO EN LA OCLUSIÓN TOTAL CRÓNICA
Varios estudios han documentado que el tratamiento exitoso de la OTC produce una mejoría clínica del ángor9, una normalización de las pruebas funcionales y una mejoría de la función ventricular izquierda, y que disminuye la cirugía de revascularización coronaria10,11. También se ha documentado que la recanalización de una OTC contribuye a la estabilización eléctrica del segmento miocárdico y mejora la tolerancia clínica ante futuros eventos coronarios en el territorio no ocluido12.
A pesar de todo ello, un buen número de pacientes con enfermedad de un vaso crónicamente ocluido son tratados de forma exclusivamente farmacológica, con independencia de la gravedad de los síntomas y del grado de isquemia. La presencia de una OTC en pacientes con enfermedad multivaso es una indicación clásica de cirugía. En el estudio aleatorizado SYNTAX13 (cirugía frente a ICP en enfermedad multivaso), un 27% de los pacientes en cada grupo tenían al menos una OTC, y en general eran pacientes más complejos con una puntuación SYNTAX más alta. De los pacientes aleatorizados a cirugía, solo en el 68,1% se revascularizaron los vasos ocluidos, y el éxito de la revascularización percutánea en los sometidos a ICP fue del 49,4%. Esto supuso una revascularización completa en el 49,6% de los casos de cirugía y en el 35,8% de los casos de ICP, lo que quiere decir que el motivo de más peso para tener una puntuación SYNTAX > 32, que es la presencia de una OTC, no indica necesariamente que esta vaya a ser revascularizada quirúrgicamente, como de hecho asi ocurrió en un 31,9% de los casos. Los enfermos con revascularización incompleta sufrieron en el seguimiento un mayor número de eventos combinados (muerte, infarto o accidente cerebrovascular), de forma significativa.
La evidencia clínica de los ensayos aleatorizados y de los estudios observacionales difiere en cuanto al beneficio del intervencionismo. Los ensayos aleatorizados han presentado en conjunto limitaciones, como una tasa de inclusión lenta que ha dado lugar a muestras insuficientes e inadecuadamente potenciadas, con una alta tasa de cruce entre los grupos de estudio. Así mismo, existen sesgos de selección de los pacientes, ya que resulta inaceptable aleatorizar a pacientes con una gran carga isquémica que podrían beneficiarse del intervencionismo. Por este motivo, los estudios observacionales, de donde provienen los datos más favorables del intervencionismo, han cobrado una relevancia notable en la valoración global del beneficio de la revascularización.
Ensayos aleatorizados
El estudio EuroCTO mostró que el intervencionismo de una OTC mejora el estado de salud, la frecuencia de angina, el grado de limitación física y la calidad de vida de los pacientes con angina estable14.
Sin embargo, en el ensayo EXPLORE15 no se hallaron diferencias en la función del ventrículo izquierdo en los pacientes con infarto con elevación del ST sometidos a intervencionismo precoz de una OTC en comparación con el tratamiento médico óptimo, y en el estudio DECISION-CTO16 se obtuvieron tasas similares de muerte, infarto, accidente cerebrovascular o revascularización de la lesión diana a los 3 años en los grupos de intervencionismo y de tratamiento farmacológico, en pacientes con síndrome coronario agudo o angina estable15,16.
En el ensayo más reciente REVASC17 tampoco se observó mejoría en la función miocárdica regional a los 6 meses, valorada por resonancia magnética, en pacientes consecutivamente sometidos a ICP de una OTC en comparación con el tratamiento médico óptimo, si bien la tasa de eventos adversos cardiovasculares mayores (MACE) anual fue menor, de manera significativa, en el grupo de ICP17.
En la tabla 1 se muestran los resultados de los estudios aleatorizados sobre OTC más relevantes.
Tabla 1. Resultados de los estudios aleatorizados sobre oclusión total crónica más relevantes
| DECISION-CTO16 | EuroCTO14 | EXPLORE15 | REVASC17 | |
|---|---|---|---|---|
| Pacientes | 834 | 407 | 304 | 205 |
| Periodo del estudio | 2010-2016 | 2012-2015 | 2007-2015 | 2007-2015 |
| Comparación | ICP OTC frente a TMO | ICP OTC frente a TMO | ICP OTC frente a TMO en IAMCEST | ICP OTC frente a TMO |
| Objetivo primario | Muerte, infarto, ictus, RVD | Estado clínico y calidad de vida | FEVI, VTDVI | Engrosamiento segmentario territorio OTC por resonancia. MACE: NS |
| Tasa de cruce (%) | 18,1 | 7,3 | ||
| Puntuación J-CTO | 2,2 ± 1,2 | 1,82 ± 1,07 | 2 ± 1 | 2 ± 1 |
| Tasa de éxito (%) | 91,1 | 86,3 | 73 | 99 |
| Seguimiento | 3 años | 12 meses | 4 meses | 12 meses |
| MACE (%) | 19,0 (TMO) frente a 21,4 (ICP); p = NS | 6,7 (TMO) frente a 5,2 (ICP); p = NS | 5,4 (TMO) frente a 2,6 (ICP); p = NS | 16,3 (TMO) frente a 5,9 (ICP); p = 0,02 |
| Conclusión | No mejora el objetivo primario | Mejoría de la clínica y la calidad de vida | No mejoran la FEVI ni el VTDVI | No mejora el engrosamiento segmentario |
|
FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervencionismo coronario percutáneo; MACE: evento adverso cardiovascular mayor; NS: no significativo; OTC: oclusión total crónica; RVD: revascularización del vaso diana; TMO: terapia médica óptima; VTDVI: volumen telediastólico del ventrículo izquierdo. |
||||
Estudios observacionales
Varios estudios observacionales han comparado los resultados del ICP con los de la terapia médica. Tomasello et al.18 examinaron los resultados a largo plazo de 1.777 pacientes con OTC del registro de OTC italiano, según la estrategia de tratamiento: ICP (43,7%), terapia médica (46,5%) o cirugía (9,8%). Al año de seguimiento, la terapia médica se asoció con una tasa más alta de MACE (7,6 frente a 1,7%; p < 0,001), muerte cardiaca (4,4 frente a 1,5%; p = 0,002), infarto agudo de miocardio (2,9 frente a 1,1%) y rehospitalización (4,4 frente a 2,3%; p = 0,04). Jang et al.19 compararon los resultados a largo plazo de diferentes estrategias de tratamiento en 738 pacientes con al menos una lesión oclusiva y colaterales bien desarrolladas. Durante una mediana de seguimiento de 42 meses, los pacientes sometidos a revascularización coronaria tuvieron una menor incidencia de muerte cardiaca (hazard ratio [HR] = 0,27; intervalo de confianza del 95% [IC95%], 0,09-0,80; p = 0,029) y de MACE (HR = 0,44; IC95%, 0,23-0,82; p = 0,01).
Varios pequeños estudios observacionales han explorado el posible efecto del ICP de la OTC sobre varios objetivos secundarios, como la depresión, la capacidad de ejercicio y el riesgo de arritmias ventriculares, con resultados favorables para el ICP12,20,21.
Asimismo, se dispone de estudios que han comparado las OTC recanalizadas con éxito frente a las fallidas. En un metanálisis de 25 estudios se compararon los procedimientos exitosos (71%) y fallidos (29%) realizados entre los años 1990 y 2014 en 28.486 pacientes. Durante una media seguimiento de 3,11 años, el éxito se asoció con menor mortalidad (odds ratio [OR] = 0,52; IC95%, 0,43-0,63), menos angina residual (OR = 0,38; IC95%, 0,24-0,60), menor riesgo de ictus (OR = 0,72; IC95%, 0,60-0,88) y menos necesidad de posterior cirugía de revascularización coronaria (OR = 0,18; IC95%, 0,14-0,22)22. Tsai et al.23 examinaron los intentos de intervencionismo sobre OTC de 2.394 pacientes de 79 centros entre los años 2007 y 2013. El éxito del ICP se asoció con un menor riesgo ajustado de mortalidad y de derivación a cirugía de revascularización coronaria a los 2 años.
El registro OPEN CTO24 utilizó el cuestionario de angina de Seattle en 1.000 pacientes consecutivos sometidos a estrategia híbrida. Al mes de seguimiento, la calidad de vida según el cuestionario mejoró (de 49,4 ± 0,9 a 75,0 ± 0,7; p < 0,01), con una disminución simultánea de los síntomas.
Hay que tener en consideración que la localización de la OTC en el árbol coronario puede ser importante para la supervivencia del paciente. En un estudio de 2.608 pacientes, el ICP de la OTC mostró beneficio en cuanto a supervivencia solo en los pacientes con oclusión de la arteria descendente anterior (88,9 frente a 80,2%; p < 0,001)25.
Por último, en un metanálisis se estudiaron los 4 ensayos aleatorizados descritos previamente y 3 estudios observacionales, y no se encontraron diferencias en el objetivo compuesto primario analizado (muerte cardiovascular, infarto de miocardio y reintervención coronaria). El análisis independiente de cada uno de los componentes observó que el intervencionismo tuvo un mejor resultado en cuanto a muerte cardiovascular (OR = 0,52; IC95%, 0,33-0,81; p < 0,01), fundamentalmente a expensas de los resultados favorables en los estudios observacionales26.
FACTORES QUE INFLUYEN EN EL ÉXITO
Además de los factores clínicos, como son la extensión de la isquemia que rodea a la oclusión, la viabilidad miocárdica y la localización de la OTC, también hay que tener en cuenta la probabilidad de éxito del procedimiento al abordar la recanalización de una oclusión.
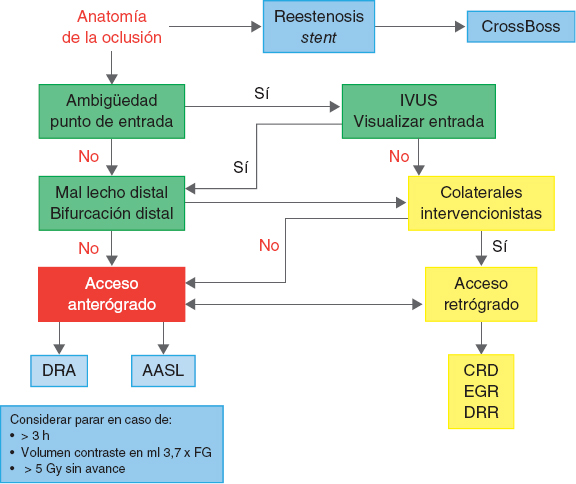
Requisitos para realizar intervencionismo en las OTC
Para optimizar la probabilidad de éxito y superar las diferencias en las tasas de éxito existentes entre los diversos registros (54-80%) y las alcanzadas en centros con experiencia (85-90%), probablemente se requiera el desarrollo de nuevos equipos y técnicas, así como programas de entrenamiento y educación continuada, y demostraciones con casos en vivo27. Lo ideal sería que todo centro involucrado en la formación de hemodinamistas tuviera implementado de manera regular un programa para desoclusión de OTC, con el fin de proporcionar suficiente conocimiento teórico para una selección apropiada de los pacientes y de las OTC, así como experiencia práctica para incrementar las probabilidades de éxito y evitar los errores más comunes28.
Predictores de éxito y fracaso
Se han descrito numerosos predictores de éxito y fracaso en la reca- nalización de una OTC, aunque en general existe una gran uniformidad entre los estudios.
En un metanálisis se revisaron los predictores angiográficos y demográficos de éxito clínico y técnico29. Entre las variables demográficas se encuentra que el antecedente de infarto, el intervencionismo percutáneo previo, la cirugía de revascularización coronaria, el ictus y la enfermedad vascular periférica previa se asocia con una reducción de al menos un 20% en la probabilidad de éxito. Las variables angiográficas asociadas con un menor éxito fueron la presencia de colaterales puente, la calcificación moderada-grave, la angulación del vaso > 45°, la tortuosidad, la presencia de un muñón romo, las lesiones oclusivas ostiales y las OTC en un vaso diferente de la arteria descendente anterior29.
Escalas de puntuación en el intervencionismo de la OTC
A lo largo de los últimos años se han desarrollado numerosas escalas de puntuación que tratan de predecir, en su mayoría, la probabilidad de éxito técnico del procedimiento de desoclusión.
Las escalas de puntuación se consideran de gran utilidad por varios motivos: a) cuantifican la probabilidad de éxito y de complicaciones; b) permiten optimizar la selección de casos; c) ayudan a revisar y planificar la forma de abordaje de la OTC; y d) contribuyen a estandarizar la complejidad de las lesiones y poder comparar resultados30.
La puntuación J-CTO31 asigna un punto a cada predictor independiente de cruzar la lesión oclusiva dentro de los 30 minutos posteriores al inicio del procedimiento. El valor total se usó para desarrollar un modelo que estratificara todas las lesiones en 4 grupos, según la dificultad del procedimiento: fácil (puntuación = 0), intermedio (puntuación = 1), difícil (puntuación = 2) o muy difícil (puntuación = 3-5). En nuestra opinión, una puntuación J-CTO alta no significa que no deba realizarse un intento de intervencionismo, pero sí podría indicar que el paciente debe ser remitido a un centro con experiencia o para una cirugía de revascularización31.
La puntuación ORA se considera más apropiada para operadores experimentados que acostumbran a utilizar procedimientos híbridos y retrógrados32. La puntuación CL33 se ajusta mejor a aquellos operadores que usan exclusivamente la vía anterógrada, y la PROGRESS CTO34 es apropiada para los procedimientos híbridos de desoclusión.
En la tabla 2 se resumen algunas de las escalas más utilizadas en la actualidad.
Tabla 2. Escalas de puntuación más usadas en la actualidad
| Variable | J-CTO31 | ORA32 | CL33 | PROGRESS34 |
|---|---|---|---|---|
| N.º de casos | 494 | 1.073 | 1.657 | 781 |
| Objetivo primario | Cruce de guía < 30 min | Éxito técnico | Éxito técnico | Éxito técnico |
| Edad, años | – | + (≥ 75) | – | – |
| Cirugía de revascularización coronaria previa | – | – | + | – |
| Fracaso previo | + | _ | _ | _ |
| Cápsula proximal | + (roma) | + (ostial) | + (roma) | + (ambigua) |
| Tortuosidad | + (> 45° intralesional) | – | – | + (moderada/proximal) |
| Calcificación | + | – | + (grave) | – |
| Longitud de la lesión | + (≥ 20 mm) | – | + (≥ 20 mm) | – |
| Vaso diana | – | – | + (si vaso diana diferente de arteria descendente anterior) | + (si vaso diana es arteria circunfleja) |
| Colaterales | – | + (Rentrop < 2) | – | + (no accesibles) |
| Otros | – | – | Infarto previo | – |
Estudio diagnóstico de una OTC
La tasa de éxito está relacionada con un buen estudio diagnóstico que ayude a determinar la arquitectura del vaso en la zona de oclusión. Es importante realizar una buena contrastación para ver el punto proximal de oclusión y diferencia si hay microcanales o colaterales de proximidad, pero no es necesario pasar de 15 imágenes por segundo; sin embargo, en ocasiones hay que incrementar el volumen y la presión a la que se inyecta el contraste. Los catéteres deben estar bien colocados en los ostium coronarios para no perder contraste por la aorta. También es crucial la inyección contralateral (a veces la circulación colateral es homolateral) para visualizar el punto final de la oclusión, la anatomía del lecho distal, y hacer una correcta valoración de las colaterales que determinará la posibilidad de intervencionismo retrógrado.
Las proyecciones básicas para la correcta valoración de los segmentos ocluidos (valores aproximados) se detallan en la tabla 3.
Tabla 3. Mejores proyecciones para visualizar los distintos segmentos ocluidos de las arterias coronarias
| Arteria | Descendente anterior | Descendente anterior | Circunfleja | Coronaria derecha | Coronaria derecha |
|---|---|---|---|---|---|
| Segmento | Medio | Ostium | Proximal-medial | Proximal-medial | Distal |
| Proyección | AP 0°, craneal 30-40° | OAI 30°, caudada 30º | AP 0°, caudada 30-40º | OAI 90° | AP 0°, craneada 30-40°, OAI 30°, craneada 30° |
|
AP: anteroposterior; OAI: oblicua anterior izquierda. |
|||||
Existe una situación especial en la que la descendente anterior recibe circulación colateral por el anillo de Viuessens35, donde la arteria conal derecha se anastomosa con la arteria conal izquierda que sale del segmento proximal o medial de la descendente anterior. En ocasiones, esta arteria conal sale de un ostium independiente de la arteria coronaria derecha, y debe ser canulada con un catéter con curva de arteria mamaria o hockey stick. Es recomendable realizar una tomografía computarizada coronaria para evaluar la arquitectura de la oclusión en los pacientes con cirugía de revascularización aortocoronaria, puntuación J-CTO elevada u oclusiones aorto-ostiales.
TÉCNICA Y MÉTODO DEL INTERVENCIONISMO
Aspectos generales
Aunque existe una tendencia a realizar intervencionismo minimalista, si los valores en las escalas de puntuación son elevados se recomiendan las siguientes pautas:
-
– Acceso anterógrado. Es aconsejable utilizar catéteres guía de 8 Fr, preferiblemente con máximo lumen interno. En la coronaria izquierda se usarán curvas Extra back up. En caso de oclusión de la arteria coronaria derecha, se recomienda el uso de Amplatz Left 1 8 Fr SH (agujeros laterales). Es conveniente manejar estos catéteres con las 2 manos y la guía teflonada de 0,035-8 pulgadas en su interior, para evitar movimientos bruscos que puedan producir disecciones ostiales. En ocasiones, dependiendo de la anatomía de la coronaria izquierda, se usará un Judkins Left de 3,5, y si se trata de la coronaria derecha, un Judkins Right 3,5-4, multipropósito (salidas verticales) o Amplatz Left 2 (aortas elongadas).
-
– Acceso retrógrado. Si solo se pretende la inyección de contraste puede accederse por vía radial con un catéter guía de 5 o 6 Fr. Es recomendable usar un catéter guía para poder poner una guía de angioplastia en la arteria coronaria y estabilizar el catéter; mejora la calidad de las inyecciones de contraste y previene problemas por posibles disecciones ostiales. Si las colaterales son intervencionistas, se recomienda 7 Fr, en ocasiones 8 Fr y catéter guía Extra back up para la coronaria izquierda y Amplatz Left 1 para la derecha. Los catéteres guía contralaterales no deben tener agujeros laterales para evitar una pérdida de contraste hacia la aorta.
Algoritmo híbrido y algoritmo Asia-Pacífico
Hasta la aparición del algoritmo híbrido36 no había ninguna pauta definida sobre cómo debía abordarse una OTC. En este algoritmo se promueve la inyección coronaria dual para realizar una revisión cuidadosa de la anatomía y determinar la mejor estrategia para tratar una OTC, moviéndose entre el acceso anterógrado, el acceso retrógrado y la disección y reentrada. Cuando el grado de dificultad de las OTC es bajo, la tasa de éxito es alta por vía anterógrada, y a medida que la dificultad anatómica aumenta, las técnicas convencionales tienen una tasa de éxito más baja y es necesario el acceso retrógrado o técnicas específicas de disección y reentrada. En este algoritmo se valoran la presencia de un muñón ambiguo, la longitud > 20 mm y la calidad del lecho distal para tomar decisiones en cuanto al acceso. La aplicación de este algoritmo tiene una tasa de éxito del 87%, siendo el abordaje anterógrado en el 52%, retrógrado en el 27% y disección y reentrada en el 21%.
Otro algoritmo, el Asia-Pacífico37, integra todas las técnicas de intervencionismo coronario en la OTC y determina la estrategia en función de los hallazgos anatómicos. También valora la necesidad de terminar un procedimiento (figura 2).
Figura 2. Algoritmo modificado (Asia-Pacífico) para el abordaje de oclusiones. AASL: acceso anterógrado subintimal limitado; CRD: cruce retrógrado directo; DRA: disección y reentrada anterógrada; DRR: disección y reentrada retrógrada; EGR: escalado de guía retrógrado; FG: filtrado glomerular; IVUS: ecografía intravascular.
En el algoritmo Asia-Pacífico se tiene en cuenta la arquitectura del vaso en la zona de la oclusión; para ello, hay que realizar una buena inyección bilateral que permita visualizar las arterias coronarias, e incluso debería hacerse una tomografía computarizada coronaria en algunos casos si fuese necesario. Se determinan 3 parámetros fundamentales de la anatomía coronaria (la longitud > 20 mm no determina la actitud):
-
– La ambigüedad del punto de entrada.
-
– Las características del lecho distal al punto de la oclusión, valorando la calidad del lecho distal y si la OTC acaba en una bifurcación de cierta envergadura.
-
– La existencia de colaterales factibles para el abordaje retró- grado.
Este algoritmo también considera otros factores, como la tortuosidad del vaso en la zona de oclusión, la calcificación, los intentos fallidos previos, los posibles microcanales y zonas de referencia (stents, calcio, contrastación), para tomar la decisión de qué estrategia seguir.
Acceso anterógrado
Ecografía intravascular
Si el punto de entrada es ambiguo y no existen referencias para posicionar la guía, la utilización de la ecografía intravascular (IVUS) puede ser de gran ayuda. Para ello, es necesario que haya una rama lateral donde colocar una guía e IVUS. En estos casos resulta muy útil la técnica Slipstream38, que consiste en colocar detrás de la IVUS un microcatéter de doble luz (MDL) sobre la guía de la rama. Con ello se incrementa mucho la fuerza ejercida con la guía que sale por el puerto lateral del MDL y se controla mejor el torque de esta (figura 3). La IVUS permite ver dónde está el vaso ocluido y así puede dirigirse la guía (de alto gramaje, con alto grado de directividad y respuesta de torque) hacia ese punto (figura 4).
Figura 3. Se aprecia cómo el vaso ocluido se sitúa a las 6 aproximadamente (A) y cómo la guía progresa hacia la oclusión (B, C y D).
Figura 4. El catéter de la ecografía intravascular, en el espacio subintimal, se sitúa entre las 9 y las 12, y se aprecia la luz verdadera entre las 3 y las 9.
Escalado de guías
Es imprescindible usar un microcatéter con una buena capacidad de navegación. Deberá ser suficientemente flexible y no condicionar la dirección de la guía dentro de la arquitectura del vaso.
La elección de la guía, elemento fundamental, depende del operador. Es conveniente comprobar la parte proximal de la oclusión, ya que el grado de dureza de la placa es desconocido y puede ser variable. Empezar con guías de muy alto gramaje, alto poder de penetración o poliméricas hace perder la percepción de las características de la OTC. El problema principal se produce cuando la guía sale al espacio subintimal y se limitan las posibilidades de recanalizar con éxito; esto se produce porque la placa es más dura que la guía, lo que condiciona la elección de una guía de más gramaje.
Microcatéteres de doble luz
La forma actual de reentrar desde el espacio subintimal a la luz verdadera distal es mediante un MDL. Si una guía sale al espacio subintimal es muy importante no moverla ni inyectar contraste para evitar la formación de un hematoma que limitaría la reentrada distal. El fundamento de su uso es poder introducir otra guía de más alto gramaje por el puerto lateral que pueda penetrar en la oclusión, incrementando de forma importante la fuerza de la guía para poder alcanzar el lecho distal.
Esta técnica exige un control tridimensional de la guía en la arquitectura del vaso, como describen Tanaka et al.39, que se realiza mediante giros concretos, dependiendo del segmento arterial donde se encuentre. Los giros de 90-180° de rotación se muestran en la tabla 4.
Tabla 4. Movimiento y dirección de las guías de angioplastia
| Arteria | Giro horario | Giro antihorario |
|---|---|---|
| Tronco común izquierdo | Hacia circunfleja | Hacia descendente anterior |
| Descendente anterior | Hacia diagonales | Hacia septales |
| Circunfleja | Hacia circunfleja principal | Hacia ramas marginales |
| Coronaria derecha | Hacia coronaria derecha propiamente dicha y posterolateral | Hacia arteria margen agudo y descendente posterior |
Disección y reentrada con dispositivos específicos
Dentro del algoritmo híbrido36, cuando las OTC tienen un muñón ambiguo, una longitud > 20 mm e imposibilidad de acceso retrógrado, puede realizarse un abordaje mediante la técnica de disección y reentrada. Se realiza con un dispositivo específico para conseguir una reentrada del espacio subintimal a la luz verdadera de forma eficaz y segura. Para ello, se usa el balón Stingray LP junto con su guía específica (Boston Scientific, Nattick, Massachusetts, Estados Unidos).
Hasta hace unos años, esta técnica de disección y reentrada se hacía de forma convencional con CrossBoss y Stingray directamente. En la actualidad, en muchas ocasiones no es necesario usar CrossBoss y puede utilizarse un microcatéter de tipo Corsair (ASAHI Intec, Nagoya, Japón) o Turnpike (Teleflex Inc, Wayne, PA, Estados Unidos) de 135 cm, de tal manera que se avanza una guía con el microcatéter hasta un punto determinado donde ya no puede avanzarse más, y una vez que se ha llegado a este lugar, en posición subintimal, se intercambia por el balón Stingray LP, que se infla a 4 atmósferas en el espacio subintimal, y a través de los dos puertos laterales, situados a 180° el uno del otro, se intenta reentrar en la luz verdadera distal con una guía rígida (Stingray wire, Hornet 14, Confianza Pro 12) mediante técnicas de stick and swap o fenestración múltiple, y posteriormente canalizar distalmente con una guía polimérica Pilot 200 (Abbott Santa Clara, CA, Estados Unidos) o Gladius Mongo (ASAHI Intecc, Nagoya, Japón).
Acceso retrógrado
El acceso retrógrado se basa en las características histológicas de la zona distal, ya que el grado de dureza es menor que en la zona proximal40 al no estar expuesta a la presión arterial directa del sistema arterial.
Vías de acceso retrógrado
El acceso se realiza por canales colaterales nativos o por injertos aortocoronarios. Las ramas colaterales están localizadas en la zona septal, epicárdica o intramiocárdica. La limitación más importante para poder cruzarlas es la tortuosidad. Una colateral es abordable si puede cruzarse con seguridad de no producir una perforación. La clasificación de Werner41 es la más usada: CC0, sin conexión continua entre donante y receptor; CC1, continua, conexión tipo hilo (diámetro aproximado de 0,3 mm); y CC2, continua, parecida a una rama a lo largo de todo el recorrido (diámetro aproximado de 0,4 mm).
Existen riesgos añadidos al cruzar una colateral: rotura, disección y oclusión. Sin embargo, las ramas septales (generalmente más numerosas) son las que menos riesgos tienen y se usan en el 68% de los casos42; su rotura no suele tener mayores consecuencias al ser contenida o fistulizar a la cavidad ventricular. Existen ramas invisibles, que son fácilmente cruzables. La mejor proyección para estudiarlas es la oblicua anterior derecha a 0 o 30° de angulación craneal. Generalmente, las ramas septales van de la arteria descendente anterior a la descendente posterior. Es más sencillo cruzar de la arteria descendente anterior a la descendente posterior por la angulación de salida de la septal desde la arteria descendente anterior. Las ramas septales muy proximales en ocasiones conectan con la arteria posterolateral, y las más distales a veces conectan con ramas que van por la pared libre del ventrículo derecho.
Las ramas epicárdicas más frecuentes son las que conectan la arteria descendente anterior con la descendente posterior a nivel apical, de la arteria posterolateral a la rama obtusa marginal o de la obtusa marginal a las diagonales. Cruzarlas tiene un riesgo añadido de rotura con taponamiento pericárdico, al igual que las colaterales en la zona auriculoventricular.
Las colaterales intramiocárdicas más frecuentes se sitúan entre la obtusa marginal y la arteria posterolateral, así como entre la obtusa marginal y la arteria descendente posterior.
En general se prefiere un microcatéter de tipo Corsair, Turnpike, Mamba Flex (Boston Scientific Natick, Massachusetts, Estados Unidos) o Teleport (OrbusNeich, Hong Kong), fabricado con varias mallas internas que facilitan su rotación sin fracturas. La guía de elección para cruzar una colateral es la SION o SION black (ASAHI). En caso de gran tortuosidad de las colaterales, la guía de elección es la SUOH03 (ASAHI).
Escalado de guías
Cuando se accede retrógradamente se intenta avanzar hasta la OTC con la misma guía que se pasó la colateral, excepto si fue con una SUOH03. Una vez que se ha llegado a la zona de OTC es posible estudiar la dureza de la placa y definir el escalado de guías que debe realizarse41. En un 40% de los casos se consigue una recanalización directa con escalado de guías: unas veces más rígida para realizar una penetración controlada o una rotación rápida, y otras veces una guía polimérica para facilitar el deslizamiento por la placa.
Disección y reentrada: knuckle, R-CART
En el 60% de los casos en que no se consigue una recanalización directa deben realizarse técnicas de intervencionismo para conectar la parte proximal a la distal.
Cuando no se conozca la arquitectura del vaso se precisarán guías poliméricas con un knuckle para acortar la oclusión avanzando subintimal. A veces hay que hacerlo por vía anterógrada también, cuando no se conocen la zona de entrada proximal ni la arquitectura del vaso. De la misma manera, si hay calcificación muy grave, estas guías poliméricas con o sin knuckle van avanzando en el segmento ocluido por el espacio subintimal, excluyendo el calcio y avanzando hacia la zona proximal. Si una de las guías está en disección y no se consigue reconducir la guía, puede usarse un MDL (Sasuke, ASAHI) por vía retrógrada para intentar canalizar otra zona del segmento ocluido.
Cuando no se logra conectar las guías, se dispone del R-CART (reverse controlled antegrade and retrograde subintimal tracking)42. Esta técnica es preferible realizarla con IVUS por vía anterógrada previamente para visualizar la posición de la guía anterógrada y el tamaño del balón con el que realizar la dilatación anterógrada. Se dilata el segmento anterógrado con un balón y se intenta orientar la guía retrógrada hacia el balón; una vez próxima, se desinfla el balón y se intenta entrar en el espacio dilatado por el balón para conectar ambos lúmenes. Es de gran ayuda una extensión de catéter guía con balón como el Trapliner (Teleflex). Conectados ambos espacios, por vía intraplaca o subintimal se externaliza una guía de al menos 300 cm para poder completar el procedimiento. Una vez realizada la intervención es preciso comprobar posibles daños en el vaso principal donante (disección) y en las colaterales (rotura).
COMPLICACIONES
La tasa de complicaciones es algo más alta que en el intervencionismo general42: infarto de onda Q, 2,5% frente a 0,02%; cirugía de revascularización urgente, 0,1% frente a 0,03%; ictus, 0,01% frente a 0,04%; muerte, 0,2-0,9% frente a 0,14%; y perforación 2-4,8% frente a 0,38%.
Las complicaciones extracardiacas más frecuentes son las vasculares (2%) y la nefropatía inducida por contraste (3,8%). La lesión por radiación, que aparece semanas e incluso meses después del cateterismo, se encuentra en general infradiagnosticada e infracomunicada en los estudios43.
Las complicaciones cardiacas coronarias son la perforación del vaso principal, del vaso distal o del vaso colateral, que puede condicionar taponamiento cardiaco, oclusión aguda del vaso donante por trombosis, disección, embolización aérea y atrapamiento de dispo- sitivos.
STENTS Y DOBLE ANTIAGREGACIÓN
Las OTC se caracterizan por ser lesiones con más riesgo de reestenosis y trombosis: son más largas, más calcificadas, más tortuosas y precisan stents más largos, en muchas ocasiones solapados. Desde que se comenzó a usar stents farmacoactivos, la reducción de la reestenosis, las revascularizaciones y la trombosis es significativa con respecto a los stents metálicos44.
En el estudio CIBELES45 se demostró que la pérdida tardía de los stents de everolimus a los 9 meses era de 0,13 ± 0,69 mm, lo cual favo- rece unos mejores resultados en este tipo de enfermos. Lee et al.46 estudiaron una serie consecutiva de 539 OTC en las que incluyeron stents de everolimus (n = 313) y stents de zotarolimus (n = 226), y obtuvieron una tasa de eventos combinados (muerte, infarto o revascularización del vaso diana) del 12,2% con un seguimiento medio de 3,3 años.
El tratamiento antiagregante no debe diferir de la pauta establecida por la enfermedad coronaria de base. Si el riesgo de sangrado es bajo, la recomendación es doble antiagregación con ácido acetilsalicílico y clopidogrel durante 1 año.
CONTROVERSIAS PENDIENTES
Existe una gran variabilidad entre los enfermos sometidos a intervencionismo de OTC: con angina, asintomáticos, con disfunción ventricular o con test de detección de isquemia patológico. Es una tarea pendiente definir de forma objetiva en un ensayo clínico definitivo qué pacientes se beneficiarán en términos de supervivencia libre de eventos. Objetivar la sintomatología, definir claramente la isquemia, la viabilidad y hacerlo siempre igual en todos los enfermos, junto con la estandarización de una técnica de intervencionismo (de elevado éxito) fácilmente reproducible e inde- pendiente del operador, son retos para el futuro. Otro aspecto importante es determinar cómo influye el resultado de la angioplastia en la preservación de la microcirculación.
TÉCNICAS INNOVADORAS
La innovación en este campo está basada en dos estrategias: los dispositivos y las técnicas de reconstrucción anatómica en 3 dimensiones. La guía de angioplastia coronaria es uno de los elementos clave. La tecnología aplicada con múltiples espirales de filamentos (coils) y recubrimientos hidrófilos que facilitan la sensación táctil, junto con la directividad orientada, permitirán tener más éxito cada vez. Hay nuevos dispositivos que aplican energía con radiofrecuencia en las guías de angioplastia, con resultados muy prometedores.
Parece lógico imaginar que, de la misma manera que conducimos un vehículo por una carretera, girando el volante a derecha e izquierda según las curvas que nos van apareciendo, podríamos abrir una coronaria con dispositivos específicos, moviéndonos con precisión en 3 dimensiones dentro de la arquitectura del vaso para entrar y salir de forma rápida y segura en la luz distal. Esto puede conseguirse con herramientas de software asociadas a la angiografía y a la tomografía computarizada coronaria.
CONCLUSIONES
Existen evidencias a favor del intervencionismo en la OTC, ya que mejora clínicamente la angina de forma objetiva, mejora la función ventricular si hay viabilidad y aumenta la supervivencia libre de eventos. La tasa de éxito de los operadores especializados es próxima al 90%, con pocas complicaciones, y esto tiene unos beneficios, por extensión, para el resto de los enfermos. Poder hacer determinadas intervenciones con éxito en las arterias coronarias hace del cardiólogo intervencionista un mejor operador para las intervenciones del día a día y beneficia al conjunto de los pacientes sometidos a ICP.
CONFLICTO DE INTERESES
Los autores no tienen conflictos de intereses que declarar.
BIBLIOGRAFÍA
1. Abbott JD, Kip KE, Vlachos HA, et al. Recent trends in the percutaneous treatment of chronic total coronary occlusions. Am J Cardiol. 2006;97:1691-1696.
2. Dimitri GS, Vasilis AT, Lambros KM. Chronic Total Coronary occlusions:a review of their special features and the existing techiniques of percutaneous treatment. Hellenic J Cardiol. 2003;44:136-142.
3. Werner GS, Figulla HR. Direct assessment of coronary steal and associated changes of collateral hemodynamics in chronic total coronary occlusions. Circulation. 2002;106:435-440.
4. Werner GS, Surber R, Ferrari M, Fritzenwanger M, Figulla HR. The functional reserve of collaterals supplying long-term chronic total coronary occlusions in patients without prior myocardial infarction. Eur Heart J. 2006;27:2406-2412.
5. Cohen HA, Williams DO, Holmes DR, et al. Impact of age on procedural and 1-year outcome in percutaneous transluminal coronary angioplasty:the NHLBI Dynamic Registry. Am Heart J. 2003;146:513-519.
6. Fefer P, Knudtson ML, Cheema AN, et al. Current perspectives on coronary chronic total occlusions:the Canadian Multicenter Chronic Total Occlusions Registry. J Am Coll Cardiol. 2012;59:991-997.
7. Di Mario C, Werner GS, Sianos G, et al. European perspective in the recanalization of Chronic Total Occlusions:consensus document from the EuroCTO Club. EuroIntervention. 2007;3:30-43.
8. Shaw LJ, Berman DS, Maron DJ, et al. Optimal medical therapy with or without percutaneous coronary intervention to reduce ischemic burden:results from the Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation (COURAGE) trial nuclear substudy. Circulation. 2008;117:1283-1291.
9. Grantham JA, Jones PG, Cannon L, Spertus JA. Quantifying the early health status benefits of successful chronic total occlusion recanalization:Results from the FlowCardia's Approach to Chronic Total Occlusion Recanalization (FACTOR) Trial. Circ Cardiovasc Qual Outcomes. 2010;3:284-290.
10. Khan MF, Wendel CS, Thai HM, Movahed MR. Effects of percutaneous revascularization of chronic total occlusions on clinical outcomes:a meta-analysis comparing successful versus failed percutaneous intervention for chronic total occlusion. Catheter Cardiovasc Interv. 2013;82:95-107.
11. Werner GS, Betge S, Kuthe F, Figulla HR, Betge S, Kuthe F. Delayed recovery of left ventricular function after recanalization of a chronic coronary occlusion. Catheter Cardiovasc Interv. 2003;60:491-495.
12. Nombela-Franco L, Mitroi CD, Fernández Lozano I, et al. Ventricular arrhythmias among implantable cardioverter-defibrillator recipients for primary prevention:impact of chronic total coronary occlusion (VACTO Primary Study). Circ Arrhythm Electrophysiol.2012;5:147-154.
13. Serruys PW, Morice MC, Kappetein AP, et al.;for the SYNTAX Investigators. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease. N Engl J Med. 2009;360:961-972.
14. Werner GS, Martin-Yuste V, Hildick-Smith D, et al. A randomized multicenter trial to compare revascularization with optimal medical therapy for the treatment of chronic total coronary occlusions. Eur Heart J. 2018;39:2484-2493.
15. Henriques JP, Hoebers LP, Ramunddal T, et al.;EXPLORE Trial Investigators. Percutaneous intervention for concurrent chronic total occlusions in patients with STEMI:the EXPLORE trial. J Am Coll Cardiol. 2016;68:1622-1632.
16. Park S. Drug-eluting stent implantation versus optimal medical treatment in patients with chronic total occlusion (DECISION-CTO). En:American College of Cardiology's 66th Annual Scientific Session &Expo;2017 Mar 18;Washington, DC. Disponible en:http://www.acc.org/latest-in-cardiology/clinical-trials/2017/03/17/08/40/decision-cto. Consultado 31 May 2019.
17. Mashayekhi K, Nührenberg TG, Toma A, et al. A randomized trial to assess regional left ventricular function after stent implantation in chronic total occlusion:The REVASC trial. JACC Cardiovasc Interv. 2018;11:1982-1991.
18. Tomasello SD, Boukhris M, Giubilato S, et al. Management strategies in patients affected by chronic total occlusions:results from the Italian Registry of Chronic Total Occlusions. Eur Heart J. 2015;36:3189-3198.
19. Jang WJ, Yang JH, Choi SH, et al. Long-term survival benefit of revascularization compared with medical therapy in patients with coronary chronic total occlusion and well-developed collateral circulation. JACC Cardiovasc Interv. 2015;8:271-279.
20. Bruckel JT, Jaffer FA, O'Brien C, Stone L, Pomerantsev E, Yeh RW. Angina severity, depression, and response to percutaneous revascularization in patients with chronic total occlusion of coronary arteries. J Invasive Cardiol. 2016;28:44-51
21. Abdullah SM, Hastings JL, Amsavelu S, et al. Percutaneous coronary intervention of coronary chronic total occlusions improves peak oxygen uptake during cardiopulmonary exercise testing. J Invasive Cardiol. 2017;29:83-91.
22. Christakopoulos GE, Christopoulos G, Carlino M, et al. Meta-analysis of clinical outcomes of patients who underwent percutaneous coronary interventions for chronic total occlusions. Am J Cardiol. 2015;115:1367-1375.
23. Tsai TT, Stanislawski MA, Shunk KA, et al. Contemporary incidence, management, and long-term outcomes of percutaneous coronary interventions for chronic coronary artery total occlusions:insights from the VA CART program. JACC Cardiovasc Interv. 2017;10:866-875.
24. Sapontis J, Salisbury AC, Yeh RW, et al. Early Procedural and Health Status Outcomes After Chronic Total Occlusion Angioplasty. A Report From the OPEN-CTO Registry (Outcomes, Patient Health Status, and Efficiency in Chronic Total Occlusion Hybrid Procedures). JACC Cardiovasc Interv. 2017;10:1523-1534.
25. Safley DM, House JA, Marso SP, Grantham JA, Rutherford BD. Improvement in survival following successful percutaneous coronary intervention of coronary chronic total occlusions:variability by target vessel. JACC Cardiovasc Interv. 2008;3:295-302.
26. Iannaccone M, D'ascenzo F, Piazza F, et al. Optimal medical therapy vs. coronary revascularization for patients presenting with chronic total occlusion:A meta-analysis of randomized controlled trials and propensity score adjusted studies. Catheter Cardiovasc Interv. 2019;93:E320-E325.
27. Brilakis ES, Vo MN. How to develop a successful chronic total occlusion percutaneous coronary intervention program. Cardiovasc Revasc Med. 2016;17:3-4.
28. Sharma V, Jadhav ST, Harcombe AA, et al. Impact of proctoring on success rates for percutaneous revascularization of coronary chronic total occlusions. Open Heart. 2015;2:e000228.
29. Wang N, Fulcher J, Abeysuriya N, Adams L, Lal S. Predictors of successful chronic total occlusion percutaneous coronary interventions:a systematic review and meta-analysis. Heart. 2018;104:517-524.
30. Karatasakis A, Danek BA, Brilakis ES. Scoring systems for chronic total occlusion percutaneous coronary intervention:if you fail to prepare you are preparing to fail. J Thorac Dis. 2016;8:E1096-E1099.
31. Morino Y, Abe M, Morimoto T, et al. Predicting successful guidewire crossing through chronic total occlusion of native coronary lesions within 30 minutes:the J-CTO (Multicenter CTO Registry in Japan) score as a difficulty grading and time assessment tool. JACC Cardiovasc Interv. 2011;4:213-221.
32. Galassi AR, Boukhris M, Azzarelli S, et al. Percutaneous Coronary Revascularization for Chronic Total Occlusions:A Novel Predictive Score of Technical Failure Using Advanced Technologies. JACC Cardiovasc Interv. 2016;9:911-922.
33. Alessandrino G, Chevalier B, Lefèvre T, et al. A Clinical and Angiographic Scoring System to Predict the Probability of Successful First-Attempt Percutaneous Coronary Intervention in Patients With Total Chronic Coronary Occlusion. JACC Cardiovasc Interv. 2015;8:1540-1548.
34. Christopoulos G, Kandzari DE, Yeh RW, et al. Development and Validation of a Novel Scoring System for Predicting Technical Success of Chronic Total Occlusion Percutaneous Coronary Interventions:The PROGRESS CTO (Prospective Global Registry for the Study of Chronic Total Occlusion Intervention) Score. JACC Cardiovasc Interv. 2016;9:1-9.
35. de Agustín JA, Marcos-Alberca P, Hernández-Antolín R, et al. Collateral circulation from the conus coronary artery to the anterior descending coronary artery:assessment using multislice coronary computed tomography. Rev Esp Cardiol. 2010;63:347-351.
36. Tajti P, Karmpaliotis D, Alaswad K, et al. The Hybrid Approach to Chronic Total Occlusion Percutaneous Coronary Intervention Update From the PROGRESS CTO Registry. J Am Coll Cardiol Interv. 2018;11:1325-1335.
37. Harding SA, Wu EB, Lo S, et al. A New Algorithm for Crossing Chronic Total Occlusions From the Asia Pacific Chronic Total Occlusion Club. JACC Cardiovasc Interv. 2017;10:2135-2143.
38. Kinoshita Y, Fujiwara H, Suzuki T. “Slipstream technique“—New concept of intravascular ultrasound guided wiring technique with double lumen catheter in the treatment of coronary total occlusions. J Cardiol Cases. 2017;16:52-55.
39. Tanaka T, Okamura A, Iwakura K, et al. Efficacy and Feasibility of the 3-Dimensional Wiring Technique for Chronic Total Occlusion Percutaneous Coronary Intervention First Report of Outcomes of the 3-Dimensional Wiring Technique. JACC Cardiovasc Interv. 2019;12:545-555.
40. Danek BA, Karatasakis A, Karmpaliotis D, et al. Use of antegrade dissection re-entry in coronary chronic total occlusion percutaneous coronary intervention in a contemporary multicenter registry. Int J Cardiol. 2016;214:428-437.
41. Werner GS, Ferrari M, Heinke S, et al. Angiographic assessment of collateral connections in comparison with invasively determined collateral function in chronic coronary occlusions. Circulation. 2003;107:1972-1977.
42. Brilakis ES, Grantham JA, Thompson CA, et al. The retrograde approach to coronary artery chronic total occlusions:a practical approach. Catheter Cardiovasc Interv. 2012;79:3-19.
43. Patel VG, Brayton KM, Tamayo A. Angiographic success and procedural complications in patients undergoing percutaneous coronary chronic total occlusion interventions:a weighted meta-analysis of 18,061 patients from 65 studies. JACC Cardiovasc Interv. 2013;6:128-136.
44. Colmenarez HJ, Escaned J, Fernández C, et al. Efficacy and safety of drug-eluting stents in chronic total coronary occlusion recanalization:a systematic review and meta-analysis. J Am Coll Cardiol. 2010;55:1854-1866.
45. Moreno R, Garcia E, Teles R, et al. Randomized comparison of sirolimus-eluting and everolimus-eluting coronary stents in the treatment of total coronary occlusions:results from the chronic coronary occlusion treated by everolimus-eluting stent randomized trial. Circ cardiovasc Interv. 2013;6:21-28.
46. Lee PH, Cho MS, Lee SW, et al. Everolimus- versus zotarolimus-eluting stent following percutaneous coronary chronic total occlusion intervention. In J Cardiol. 2017;241:128-132.

RESUMEN
En este artículo se revisan los cambios acaecidos durante los últimos 20 años en el tratamiento percutáneo de las lesiones en bifurcación bajo la perspectiva de nuestra experiencia. También se analizan los estudios más relevantes en este campo, así como las estrategias y las recomendaciones actuales. Los aspectos técnicos son fundamentales en el tratamiento de las lesiones en bifurcación, por lo que parte de la revisión se dedica a ellos. Las mejoras técnicas aparecidas en los últimos años han sido determinantes en el aumento de la tasa de éxito del tratamiento de este tipo de lesiones complejas. Al mismo tiempo, la estrategia terapéutica ha sido reglada y estandarizada, de modo que actualmente podemos abordar con seguridad todo tipo de lesiones en bifurcación, incluida la enfermedad del tronco común de la arteria coronaria izquierda.
Palabras clave: Enfermedad coronaria. Lesiones coronarias en bifurcación. Stents. Tratamiento percutáneo.
ABSTRACT
In this article, we analyse the changes occurred over the last 20 years in the percutaneous treatment of bifurcation lesions based on our own experience. We also analyse the more relevant papers recently published, as well as the strategies and guidelines recommended for the percutaneous management of bifurcation lesions. Technical aspects are relevant in this field and, for this reason, a significant section of this manuscript is dedicated to the technique used together with some tips and tricks also provided here. The technical advances made over the last years have significantly increased the success rate in the management of these complex lesions. At the same time, the technique of treatment has been standardized allowing the management of all type of bifurcations including distal left main disease.
Keywords: Coronary heart disease. Coronary bifurcation lesions. Stents. Percutaneous treatment.
INTRODUCCIÓN
Las lesiones en bifurcación constituyen un grupo frecuente de lesiones (20-30%) a las que nos enfrentamos diariamente en el laboratorio de hemodinámica1. Aunque se encuadran dentro de las lesiones complejas, su tratamiento ha evolucionado favorablemente en los últimos años, de forma que hoy se dispone de una nueva generación de stents y de técnicas coadyuvantes a la angiografía que resultan de gran eficacia en su abordaje. Al mismo tiempo, la estrategia terapéutica se ha reglado y estandarizado2, con un grado de éxito superior al de los años anteriores. Así, actualmente es posible abordar con seguridad todo tipo de bifurcaciones, incluida la enfermedad del tronco común de la coronaria izquierda3. Sin embargo, hasta llegar a los estándares actuales de tratamiento, se ha recorrido un largo camino en los últimos 20 años.
PERSPECTIVA HISTÓRICA
El tratamiento percutáneo de las bifurcaciones comienza en la era de la angioplastia con balón, previamente a la disponibilidad del stent coronario. Por aquel entonces ya se describían técnicas específicas, como el uso de 2 catéteres guía de 8 Fr por los que se introducían guías y balones de forma independiente en el vaso principal (VP) y en la rama lateral (RL) para realizar un inflado simultáneo (figura 1). Sin embargo, el punto de inflexión del tratamiento percutáneo de las bifurcaciones lo marcó la llegada del stent de Palmaz-Schatz. La primera técnica que se describió fue una dilatación simple con balón de la RL a través de las celdillas del stent4. A partir de entonces se describió un sinfín de técnicas para tratar ambos vasos con 1 o 2 stents. Con la llegada de los stents farmacoactivos se mejoraron los resultados de todos los procedimientos coronarios. En el campo de las bifurcaciones, se adoptó la experiencia adquirida en la época de los stents metálicos y se desarrollaron también algunas nuevas técnicas complejas: el crush y sus variantes, el TAP (T y protrusión) y el simultaneous kissing stents (SKS).
Figura 1. Bifurcación en la arteria descendente anterior/rama diagonal. Tratamiento percutáneo en la era anterior a los stents. A: angiografía basal. B: dilatación con balón de la descendente anterior y diagonal. Dos catéteres guía femorales de 8 Fr con guías y balones independientes para realizar una dilatación simultánea de los balones (kissing balloon). C: resultado final.
DEFINICIÓN DE LESIÓN EN BIFURCACIÓN
Se considera una lesión coronaria en bifurcación cuando esta se localiza adyacente a una división de una arteria pericárdica mayor. La definición de RL «significativa» es arbitraria y sujeta a los criterios subjetivos del operador5. Aunque de la definición ya se deduce la falta de acuerdo sobre lo que es o no significativo, en la gran mayoría de los estudios se han incluido bifurcaciones con RL > 2,2 mm. La característica diferencial de estas lesiones respecto a las lesiones convencionales es que cuando se actúa sobre el VP puede producirse un compromiso de la RL por desplazamiento de la carina o de la placa de ateroma. Así, son necesarias estrategias específicas para resolver esta situación.
CLASIFICACIÓN DE LAS LESIONES EN BIFURCACIÓN
Se han propuesto varias clasificaciones para definir las características basales de las bifurcaciones, algunas durante de la era de los stents metálicos. Sin embargo, la más aceptada actualmente es la clasificación de Medina6 (figura 2). Su éxito se debe a su sencillez y a lo fácil que resulta memorizarla. Esta clasificación fue aceptada en septiembre de 2005 en la primera reunión del European Bifurcation Club, en Burdeos (figura 2), donde los autores de la clasificación de Massy renunciaron a su propia clasificación para adoptar la nueva6 como la única propuesta por este grupo. Tras captar la importancia de tal hecho, la clasificación se publicó en Revista Española de Cardiología y alcanzó un récord de citaciones (el artículo más citado de toda su historia).
Figura 2. A la izquierda: reunión de Burdeos en septiembre de 2005, en la que se propuso la clasificación de Medina como la única aceptada por el European Bifurcation Club. A la derecha: clasificación de Medina, reproducida con permiso de Medina et al.6. DMB: distal main branch (vaso principal distal); PMB: proximal main branch (vaso principal proximal); SB: side branch (rama lateral).
TRATAMIENTO PERCUTÁNEO DE LAS LESIONES EN BIFURCACIÓN
Durante estos años se han publicado una gran variedad de técnicas para abordar las lesiones coronarias en bifurcación con stents. Para intentar sistematizarlas, el European Bifurcation Club ha propuesto la clasificación MADS (Main, Across, Double, Side)7. De acuerdo con esta clasificación, las diferentes modalidades de tratamiento son muy numerosas. Sin embargo, para simplificarlas, se ha utilizado con frecuencia una clasificación más sencilla en técnicas simples (1 stent en VP) y complejas (2 stents en VP y RL). Estas 2 estrategias de tratamiento se han comparado hasta la saciedad, tanto en la época de los stents metálicos como en la actual de los stents farmacoactivos.
Descripción de las técnicas simples. El stent provisional como una filosofía de tratamiento
La técnica del stent provisional básicamente consiste en implantar 1 stent en el VP y a continuación evaluar el resultado en la RL2. Este puede quedar simplemente cubierto, dilatado con balón o «stentado» en función del flujo y de la estenosis residual. Para ello, se procede a introducir 2 guías, una en el VP y otra en la RL. El tamaño del stent del VP se selecciona de acuerdo con la longitud enferma y con el diámetro de referencia del vaso distal. Tras la implantación debe realizarse la técnica POT (proximal optimization technique), que consiste en una dilatación de la parte proximal del stent con un balón corto y de diámetro superior al de la suelta, de acuerdo con el segmento proximal. De esta forma se consigue adaptar el stent proximal a un vaso con un diámetro mayor que el componente distal de la bifurcación y, en caso de necesidad, facilita el recruce a la RL. En este punto debe valorarse el estado del origen de la rama colateral. Si no hay estenosis significativa o si el vaso es pequeño con un flujo TIMI (Thrombolysis In Myocardial Infarction) 3, el procedimiento ha finalizado. En caso de compromiso del origen en una rama significativa debe pasarse una segunda guía a la rama con objeto de tratarla, al mismo tiempo que se extrae la guía encarcelada. El inflado del balón puede hacerse simultáneamente con otro balón inflado en el VP (kissing balloon) o de forma aislada8. Se recomienda una segunda POT sobre todo si no se realiza inflado simultáneo. En la mayoría de las bifurcaciones se obtiene un buen resultado con todas estas maniobras. No obstante, en un porcentaje variable de los casos el origen de la rama colateral persiste con un resultado subóptimo y es necesaria la implantación de un segundo stent, seguido de un kissing balloon final2.
Técnica de la guía encarcelada
La estrategia del stent provisional se ha llamado «técnica simple», aunque en ocasiones puede no ser tan simple porque la RL puede ocluirse tras el implante del stent en el VP (figura 3). Esta situación, si no se resuelve, conduce a un infarto de miocardio. La técnica de la guía encarcelada se describió para ayudar a resolver esta situación. Consiste en dejar una guía en la RL mientras se implanta el stent del VP. De esta forma queda atrapada entre la pared del vaso y la estructura metálica del stent.
Figura 3. Cuatro ejemplos de oclusión abrupta de la rama lateral tras el implante del stent en el vaso principal. A y B: descendente anterior/diagonal. C: coronaria derecha/descendente posterior. D: tronco común de la coronaria izquierda con cierre de la arteria circunfleja.
Las ventajas que proporciona son:
-
La guía encarcelada ayuda a mantener abierta la RL, y en caso de oclusión de esta, la guía es el único marcador de su posición, lo que posibilita el rescate del vaso ocluido.
-
Facilita el acceso a la RL al modificar favorablemente el ángulo de la bifurcación.
-
Produce un mecanismo de anclaje de la guía, y así facilita la intubación del catéter guía al suministrar un apoyo más firme para cruzar el origen de la RL con el balón.
-
Por último, en situaciones extremas, puede utilizarse para introducir un balón de bajo perfil, dilatar la RL y terminar con la técnica de inverted crush o redilatando el stent aplastado en el VP una vez que se ha resuelto la oclusión de la rama9.
Riesgos de la técnica de la guía encarcelada. Dado que el stent del VP queda impactado a presión contra la pared arterial, la guía atrapada entre estas 2 estructuras puede sufrir daño e incluso fracturarse en el momento de su retirada10. A pesar de que es un hecho infrecuente, se han descrito casos de rotura de la guía al realizar su extracción; una grave complicación del procedimiento que en ocasiones requiere una extracción quirúrgica de urgencia11-13. Existen algunas recomendaciones para prevenir la fractura de la guía14: a) no ubicar la porción distal de la guía en vasos secundarios de escaso calibre; b) evitar las altas presiones en la suelta del stent; c) evitar cubrir una gran porción de la guía encarcelada con varios stents; y d) usar el tipo de guía más resistente a la tracción. Este último punto ha generado mucha controversia en los últimos años. Así, inicialmente se recomendó el uso de guías no poliméricas basándose en opiniones de expertos15,16, pero cuando se realizó un estudio aleatorizado para evaluar el daño de la guía tras su encarcelamiento por microscopía estereoscópica resultaron más resistentes y con menos daño las guías poliméricas10. No obstante, las nuevas generaciones de guías también deberían probarse para esta indicación.
Predilatación o no de la rama lateral previa a la implantación del stent en el vaso principal
La predilatación de la RL ha sido motivo de controversia en los últimos años. Esta maniobra tiene una serie de ventajas y desventajas que se analizan seguidamente:
-
Posibles ventajas: la dilatación de la RL aumentaría la luz del vaso y podría facilitar su re-wiring (recruce); podría ayudar a mantener el flujo en la RL y evitar su cierre tras el implante del stent en el VP; y tras el implante del stent del VP podría ser un procedimiento definitivo sin necesidad de posdilatación. De esta forma se simplifica el procedimiento y se evita la producción de deformidades en el stent del VP.
-
Desventajas: la presencia de una disección en el origen de la RL podría dificultar el acceso con una guía que tendría que cruzar el stent del VP y el segmento disecado de la RL. El aumento de la luz en el origen de la RL incrementa la posibilidad de acceder a este vaso a través de la celdilla proximal del stent del VP, lo que conlleva una mayor deformidad en el stent del VP y una falta de andamiaje en el origen de la RL, aumentando así la probabilidad de un segundo stent en la RL17,18.
Para aclarar el papel de la predilatación de la RL en la estrategia del stent provisional, nuestro grupo realizó un estudio aleatorizado en el que se compararon pacientes con bifurcaciones verdaderas tratados con esta estrategia y con predilatación o no de la RL19. El objetivo primario de valoración (la presencia de un flujo TIMI 0-1 en la RL justo después de implantar el stent del VP) fue significativamente menor (1 frente a 10%; p < 0,001) en el grupo con predilatación. Además, un 32% de los pacientes con predilatación no precisó tratamiento adicional sobre la rama, con lo que se simplificó el procedimiento. En los restantes pacientes que sí precisaron posdilatación, la predilatación no supuso un inconveniente para el recruce con la guía. Tras este estudio han aparecido registros con resultados en contra20 y a favor de esta maniobra21,22. En general, la predilatación de la RL se deja a criterio del operador y se recomienda cuando la RL presenta en su origen una lesión de difícil acceso, muy grave, calcificada o con un flujo coronario comprometido basalmente o tras la predilatación del VP2.
Acceso difícil a la rama lateral
Esta circunstancia sigue constituyendo un problema en el tratamiento de las bifurcaciones. Angulaciones excesivas, calcificaciones y lesiones difusas pueden impedir la introducción de la guía en la RL (figura 4). La situación se agrava una vez implantado el stent del VP, por la interposición de una capa de metal y por el aumento de la estenosis o incluso su cierre en el origen de la RL. Para resolverlo se han diseñado dispositivos específicos y técnicas ingeniosas de wiring de la RL. Entre los nuevos dispositivos se encuentran los microcatéteres con punta deflectable o muy angulada23 que se orientan hacia el origen de la RL. Los catéteres de doble luz permiten el uso de una guía muy angulada por la salida lateral, pudiendo avanzar y retroceder con todo el sistema hasta «enganchar» el origen de la RL24. Esto en ocasiones es muy difícil y constituye en la actualidad un problema no resuelto en un pequeño porcentaje de los casos.
Figura 4. Acceso difícil a la rama lateral. A, B y C: arteria descendente anterior/diagonal. D: coronaria derecha/descendente posterior. A la derecha: detalle ampliado del ángulo de la bifurcación.
Descripción de técnicas complejas con 2 stents
El minicrush, el culotte, el TAP y el T stenting empezando por la rama hija también son técnicas ampliamente utilizadas cuando se planifica una estrategia con 2 stents. Todas ellas se han descrito con detalle en una revisión clásica de Louvard et al.15. Sin embargo, más recientemente, el double kissing crush (DK crush) ha alcanzado una gran popularidad por los resultados de los estudios aleatorizados25. Para su realización se introduce una guía en el VP y la RL, y se predilatan ambos vasos. Manteniendo la guía en el VP, se introduce un stent en la RL con una protrusión de 2-4 mm en el VP. Se avanza un balón en el VP y se realiza el implante del stent en la RL. Se extrae el balón de la RL y se infla el balón del VP, con lo que se aplasta toda la parte proximal del stent de la RL. Se realiza un nuevo re-wiring de la RL y se reintroducen 2 balones para hacer un inflado simultaneo (primer kissing). Se retiran los balones y la guía de la RL, y se introduce el stent de la VP, que se implanta cubriendo la RL. Se retira el balón y se realiza un nuevo re-wiring de la RL. Se introducen 2 balones y se realiza el segundo inflado simultáneo (segundo kissing).
Comparación de las técnicas simples y complejas
Como ya se ha comentado, este tipo de comparación se ha realizado muchas veces en la literatura. Primero, durante la época de los stents no farmacoactivos26, y aunque en esos tiempos no se realizaron estudios aleatorizados, las comparaciones observacionales apuntaban a un mejor resultado de las técnicas sencillas26. En la era de los stents farmacoactivos se repitieron los estudios, pero estos sí fueron aleatorizados27-32 y confirmaron los hallazgos previos sobre la no superioridad de las técnicas complejas sobre las sencillas. Estos resultados también se reflejaron en una abundancia de metanálisis que recogieron los mismos estudios comparativos y llegaron a las mismas conclusiones33-37. Así, el European Bifurcation Club y las guías europeas recomiendan el uso de la técnica del stent provisional para la mayoría de las lesiones en bifurcación38. Sin embargo, durante el congreso Transcatheter Cardiovascular Therapeutics de 2017 se produjo un verdadero tsunami con la presentación del estudio DKCRUSH-V25, que mostró un mejor resultado del DK crush frente a la técnica del stent provisional en la bifurcación del tronco común de la coronaria izquierda. Estos hallazgos estaban en contradicción con todos los estudios comparativos previamente comunicados. Además, el mismo grupo ya había comunicado estos mismos resultados en bifurcaciones fuera del tronco común de la coronaria izquierda39. Si tenemos en consideración estos hallazgos, habría que cambiar totalmente nuestra estrategia en el tratamiento de las bifurcaciones. ¿Cuáles han sido las reacciones de la comunidad científica internacional?
Mientras que algunos lo han aceptado sin reparos, otros han criticado el artículo de Chen et al.25. Nosotros pensamos que tiene limitaciones importantes. Así, en la rama del stent provisional no se realizó POT tras el implante del stent en el tronco previo al re-wiring de la arteria circunfleja. El porcentaje de pacientes aleatorizados a stent provisional que pasaron a 2 stents fue muy elevado (47%), así como la tasa de trombosis del stent (3,3%); ambas cifras muy superiores a las comunicadas en otros estudios recientes. Finalmente, gran parte de las reintervenciones de la lesión diana en el seguimiento tuvieron lugar al año, durante las reevaluaciones angiográficas sistemáticas. Así, las ultimas guías de revascularización38 otorgaron una recomendación IA a la técnica del stent provisional (recomendación más potente que en las guías anteriores), mientras que el DK crush solo recibió una recomendación IIb.
Cuándo planificar una técnica con 2 stents desde el principio
Aunque después de todos los estudios mencionados hay un consenso general sobre el uso del stent provisional en la mayoría de las lesiones en bifurcación, hay situaciones especiales en las que las técnicas con 2 stents parecen ofrecer ventajas sobre las estrategias simples:
-
La primera situación que no ofrece dudas es cuando se obtiene un resultado subóptimo en la RL durante un tratamiento con stent provisional. Aunque esta situación parece clara, existe mucha controversia sobre lo que debe considerarse un resultado subóptimo. Así, se ha venido considerando un mal resultado sobre la RL si el flujo coronario en este vaso es menor de TIMI 3, la lesión es del 75% o hay una disección más grave del tipo A. Sin embargo, el porcentaje de paso a 2 stents es muy variable de una serie a otra (del 2 a > 50%)27-32,40, lo que explica la falta de consenso sobre lo que realmente es un mal resultado en la RL.
-
Otra situación que también se considera una indicación de técnicas de 2 stents desde el principio es la presencia de una lesión larga o difusa en una importante RL. En estos casos se asume que la angioplastia con balón no va a tener un buen resultado (figura 5).
-
Un difícil acceso a la RL también parece una buena indicación de implante de stent en ella, una vez que se ha conseguido introducir la guía. La implantación del stent en el VP supondría aumentar todavía más esa dificultad, por lo que podría ser aconsejable una técnica de 2 stents empezando por la RL.
-
Cuando una lesión en bifurcación se asocia a una oclusión coronaria pueden producirse disecciones importantes que afecten al origen de la RL, inducidas por el proceso de recanalización41,42. De nuevo, en estos casos, el implante electivo de un stent en la RL previo al implante de otro stent en el VP podría ser una buena estrategia.
-
Por último, la restenosis de la RL tras un procedimiento simple también merece el tratamiento con un segundo stent en la RL (figura 6)43.
Figura 5. Bifurcación en la descendente anterior con lesión difusa en la rama lateral. Técnica de 2 stents desde el comienzo (cullotte). A: angiografía basal. B: resultado final. C: imagen en vacío de los 2 stents.
Figura 6. A: reestenosis difusa del origen de la arteria circunfleja después del tratamiento con stent provisional del tronco de la coronaria izquierda. Tratamiento con un segundo stent (T y protrusión en 2 tiempos). B, C y D: stent boost del tronco común durante los diferentes pasos de la técnica.
ALTERNATIVAS A LA ANGIOGRAFÍA EN LA VALORACIÓN DE LAS LESIONES EN BIFURCACIÓN: TÉCNICAS DE IMAGEN Y FISIOLOGÍA CORONARIA
Ecografía intravascular
La ecografía intravascular (IVUS) resulta útil en la evaluación antes del tratamiento de la lesión y en la valoración del resultado tras la implantación del stent. Proporciona información sobre la anatomía basal de la lesión y la distribución de la placa. Esta información permite una selección precisa del diámetro y de la longitud del stent, y es de capital importancia en la bifurcación del tronco común de la coronaria izquierda44. Adicionalmente, la retirada longitudinal de la IVUS permite evaluar la forma de la carina45,46. Una carina puntiaguda (signo de la ceja, descrito por Medina) predice un alto riesgo de compromiso de la RL tras la implantación del stent del VP45,46.
Una vez implantado el stent, la IVUS resulta útil en la identificación de deformaciones, no expansiones, no aposiciones y disecciones de los bordes47,48. Todas estas anomalías pueden ser corregidas y con ello obtener un mejor resultado inmediato, que influirá favorablemente en el seguimiento de estos pacientes.
Tomografía de coherencia óptica
La tomografía de coherencia óptica es otra técnica de imagen incorporada más recientemente que la IVUS. Tiene la ventaja, frente a la anterior, de poseer mayor resolución, pero al mismo tiempo menor penetración. Otro inconveniente es que para visualizar la arteria hay que limpiar de sangre la luz con contraste o con dextrano.
En la valoración pretratamiento, la tomografía de coherencia óptica proporciona una información similar a la de la IVUS, con las ventajas y los inconvenientes mencionados. Donde verdaderamente ha supuesto una revolución ha sido en la visualización de los struts del stent. La resolución con que los identifica, junto con la utilización de nuevo software, permiten una reconstrucción del stent muy similar a la que se obtiene en los estudios in vitro. Resulta una técnica muy sensible para identificar deformaciones, no aposiciones y no expansiones. Al mismo tiempo, proporciona información precisa sobre las relaciones del vaso con el stent, en especial entre las celdillas y el origen de la RL. Para establecer esta relación, es la única técnica disponible. Así, permite el diagnóstico del acceso a la RL a través de la celdilla proximal o distal. La recomendación, a partir de los estudios in vitro, es acceder a través de la celdilla distal, con lo que se consigue un mejor andamiaje de la rama y una menor deformidad del stent del VP. La monitorización con tomografía de coherencia óptica del procedimiento permite identificar un acceso proximal y corregirlo por uno más distal (figura 7). La utilidad de esta técnica en el tratamiento de las bifurcaciones ha sido resumida en un documento de consenso del European Bifurcation Club49.
Figura 7. Tratamiento de una lesión ostial de la descendente anterior con la técnica del stent provisional. A: angiografía basal. B: stent en tronco/descendente anterior. C: compromiso del origen de la arteria circunfleja. D: dilatación de la circunfleja. E: redilatación proximal (Re-POT). F: resultado angiográfico. G: tomografía de coherencia óptica, wiring incorrecto de la circunfleja a través de la celdilla proximal (P). H: tomografía de coherencia óptica en la que tras un segundo intento la guía aparece a través de la celdilla distal (D), donde finalmente se efectúa la dilatación.
Estudio de la fisiología coronaria en las lesiones en bifurcación
Los índices de fisiología coronaria han demostrado una gran utilidad en la valoración de las lesiones angiográficamente intermedias. Específicamente, en las lesiones bifurcadas se han empleado para la valoración del resultado de la RL cuando se utiliza una técnica del stent provisional. En esta situación, la angiografía tiene muchas limitaciones para evaluar el resultado en un segmento que presenta una disección tras la dilatación con balón. Prueba de ello es la gran variabilidad de cruce a un segundo stent en las diferentes series de la literatura antes comentadas. La reserva de flujo fraccional se ha utilizado como fuente de información de interés frente a la angiografía. Así, aparentes malos resultados angiográficos presentan una reserva de flujo fraccional por encima del punto de corte para tratarlo50. La llegada de los nuevos índices de valoración fisiológica de las lesiones coronarias abre un nuevo campo en el estudio de las lesiones en bifurcación. El cociente diastólico instantáneo sin ondas (iFR), un índice fácil de obtener que no precisa inyección de adenosina, se muestra prometedor en la valoración del resultado de la RL durante la estrategia del stent provisional51 (figura 8).
Figura 8. Monitorización del resultado sobre la rama lateral (descendente posterior) con el cociente diastólico instantáneo sin onda (iFR). A: angiografía basal. B: tras el implante del stent en el vaso principal (coronaria derecha). Compromiso angiográfico del origen de la descendente posterior con un iFR > 0,90, por lo que no se precisa dilatación ulterior.
CONCLUSIONES
El tratamiento percutáneo de las lesiones en bifurcación ha cambiado radicalmente en los últimos 20 años, como en el resto de las lesiones no bifurcadas. En este tipo de lesiones se han conseguido importantes mejoras y se ha sistematizado la estrategia de tratamiento para la mayoría de ellas. Sin embargo, todavía quedan algunos aspectos por resolver, que esperamos que se solucionen en los próximos años.
CONFLICTO DE INTERESES
M. Pan ha recibido pagos menores por presentaciones o consultoría de Abbott, Terumo y Philips. S. Ojeda ha recibido pagos menores por presentaciones de Terumo y Philips. A. Lostalo no tiene conflictos de intereses.
BIBLIOGRAFÍA
1. Thomas M, Hildick-Smith D, Louvard Y, et al. Percutaneous coronary intervention for bifurcation disease. A consensus view from the first meeting of the European Bifurcation Club. EuroIntervention. 2006;2:149-153.
2. Lassen JF, Burzotta F, Banning AP, et al. Percutaneous coronary intervention for the left main stem and other bifurcation lesions:12th consensus document from the European Bifurcation Club. EuroIntervention. 2018;13:1540-1553.
3. Burzotta F, Lassen JF, Banning AP, et al. Percutaneous coronary intervention in left main coronary artery disease:the 13th consensus document from the European Bifurcation Club. EuroIntervention. 2018;14:112-120.
4. Caputo RP, Chafizadeh ER, Stoler RC, et al. Stent jail:a minimum-security prison. Am J Cardiol. 1996;77:1226-1229.
5. Louvard Y, Medina A. Definitions and classifications of bifurcation lesions and treatment. EuroIntervention. 2015;11:V23-V26.
6. Medina A, Suárez de Lezo J, Pan M. A new classification of coronary bifurcation lesions. Rev Esp Cardiol. 2006;59:183.
7. Louvard Y, Thomas M, Dzavik V, et al. Classification of coronary artery bifurcation lesions and treatments:time for a consensus!Catheter Cardiovasc Interv. 2008;71:175-183.
8. Pan M, Medina A, Suárez de Lezo J, et al. Coronary bifurcation lesions treated with simple approach (from the Cordoba &Las Palmas [CORPAL] Kiss Trial). Am J Cardiol. 2011;107:1460-1465.
9. Pan M, Romero M, Ojeda S, et al. Inverted crush technique for uncrossable side branch occlusion during provisional side branch stenting:a new role for the jailed wire. Rev Esp Cardiol. 2011;64:718-722.
10. Pan M, Ojeda S, Villanueva E, et al. Structural Damage of Jailed Guidewire During the Treatment of Coronary Bifurcation Lesions:A Microscopic Randomized Trial. JACC Cardiovasc Interv. 2016;9:1917-1924.
11. Owens CG, Spence MS. How should I treat a patient to remove a fractured jailed side branch wire?EuroIntervention. 2011;7:520-527.
12. Sezgin AT, Gullu H, Ermis N. Guidewire entrapment during jailed wire technique. J Invasive Cardiol. 2006;18:391-392.
13. Döring V, Hamm C. Delayed surgical removal of a guide-wire fragment following coronary angioplasty. Thorac Cardiovasc Surg. 1990;38:36-37.
14. Burns AT, Gutman J, Whitbourn R. Side-branch wire entrapment during bifurcation PCI:avoidance and management. Catheter Cardiovasc Interv. 2010;75:351-353.
15. Louvard Y, Lefevre T, Morice M-C. Percutaneous coronary intervention for bifurcation coronary disease. Heart. 2004;90:713-722.
16. Latib A, Colombo A. Bifurcation disease. What do we know, what should we do?JACC Cardiovasc Interv. 2008;1:218-226.
17. Stankovic G, Darremont O, Ferenc M, et al. Percutaneous coronary intervention for bifurcation lesions:2008 consensus document from the fourth meeting of the European Bifurcation Club. EuroIntervention. 2009;5:39-49.
18. Lefèvre T, Darremont O, Albiero R. Provisional side branch stenting for the treatment of bifurcation lesions. EuroIntervention. 2010;6:J65-J71.
19. Pan M, Medina A, Romero M, et al. Assessment of side branch predilation before a provisional T-stent strategy for bifurcation lesions. A randomized trial. Am Heart J. 2014;168:374-380.
20. Song PS, Song YB, Yang JH, et al. The impact of side branch predilatation on procedural and long-term clinical outcomes in coronary bifurcation lesions treated by the provisional approach. Rev Esp Cardiol. 2014;67:804-812.
21. Lee SH, Song YB, Lee JM, et al. Effect of Side Branch Predilation in Coronary Bifurcation Stenting With the Provisional Approach - Results From the COBIS (Coronary Bifurcation Stenting) II Registry. Circ J. 2018;82:1293-1301.
22. Burzotta F, Shoeib O, Aurigemma C, et al. Procedural Impact of a Kissing-Balloon Predilation (Pre-Kissing) Technique in Patients With Complex Bifurcations Undergoing Drug-Eluting Stenting. J Invasive Cardiol. 2019;31:80-88.
23. Ojeda S, Pan M, Mazuelos F, et al. Use of the venture wire-control catheter for accessing side branches during provisional stenting:an option for bifurcations with an unfavorable anatomy. Rev Esp Cardiol. 2010;63:1487-1491.
24. Burzotta F, De Vita M, Sgueglia G, Todaro D, Trani C. How to solve difficult side branch access?EuroIntervention. 2010;6:J72-J80.
25. Chen SL, Zhang JJ, Han Y, et al. Double Kissing Crush Versus Provisional Stenting for Left Main Distal Bifurcation Lesions:DKCRUSH-V Randomized Trial. J Am Coll Cardiol. 2017;70:2605-2617.
26. Pan M, Suárez de Lezo J, Medina A, et al. Simple and complex stent strategies for bifurcated coronary arterial stenosis involving the side branch origin. Am J Cardiol. 1999;83:1320-1325.
27. Pan M, de Lezo JS, Medina A, et al. Rapamycin-eluting stents for the treatment of bifurcated coronary lesions:a randomized comparison of a simple versus complex strategy. Am Heart J. 2004;148:857-864.
28. Colombo A, Moses JW, Morice MC, et al. Randomized study to evaluate sirolimus-eluting stents implanted at coronary bifurcation lesions. Circulation. 2004;109:1244-1249.
29. Steigen TK, Maeng M, Wiseth R, et al. Randomized study on simple versus complex stenting of coronary artery bifurcation lesions:the Nordic bifurcation study. Circulation. 2006;114:1955-1961.
30. Ferenc M, Gick M, Kienzle RP, et al. Randomized trial on routine vs. provisional T-stenting in the treatment of de novo coronary bifurcation lesions. Eur Heart J. 2008;29:2859-2867.
31. Colombo A, Bramucci E, SaccàS, et al. Randomized study of the crush technique versus provisional side-branch stenting in true coronary bifurcations:the CACTUS (Coronary Bifurcations:Application of the Crushing Technique Using Sirolimus-Eluting Stents) Study. Circulation. 2009;119:71-78.
32. Hildick-Smith D, de Belder AJ, Cooter N, et al. Randomized trial of simple versus complex drug-eluting stenting for bifurcation lesions:the British Bifurcation Coronary Study:old, new, and evolving strategies. Circulation. 2010;121:1235-1243.
33. Zhang F, Dong L, Ge J. Simple versus complex stenting strategy for coronary artery bifurcation lesions in the drug-eluting stent era:a meta-analysis of randomised trials. Heart. 2009;95:1676-1681.
34. Hakeem A, Khan FM, Bhatti S, et al. Provisional vs complex stenting strategy for coronary bifurcation lesions:Meta-analysis of randomized trials. J Invasive Cardiol. 2009;21:589-595.
35. Katritsis DG, Siontis GC, Ioannidis JP. Double versus single stenting for coronary bifurcation lesions. A meta-analysis. Cir Cardiovasc Intervent. 2009;2:409-415.
36. Brar SS, Gray WA, Dangas G, et al. Bifurcation stenting with drug-eluting stents:a systematic review and meta-analysis of randomised trials. EuroIntervention. 2009;5:475-484.
37. Heras M, Avanzas P, Bayes-Genis A, Pan M, Pérez de Isla L, Sanchis J. Unplanned redundant publications:a consequence of too many cardiovascular journals?EuroIntervention. 2010;6:179-181.
38. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
39. Chen SL, Santoso T, Zhang JJ, et al. A randomized clinical study comparing double kissing crush with provisional stenting for treatment of coronary bifurcation lesions:results from the DKCRUSH-II (Double Kissing Crush versus Provisional Stenting Technique for Treatment of Coronary Bifurcation Lesions) trial. J Am Coll Cardiol. 2011;57:914-920.
40. Pan M, Suárez de Lezo J, Medina A, et al. Drug-eluting stents for the treatment of bifurcation lesions:a randomized comparison between paclitaxel and sirolimus stents. Am Heart J. 2007;153:15.e1-7.
41. Ojeda S, Pan M, Gutiérrez A, et al. Bifurcation lesions involved in the recanalization process of coronary chronic total occlusions:Incidence, treatment and clinical implications. Int J Cardiol. 2017;230:432-438.
42. Ojeda S, Azzalini L, Chavarria J, et al. One Versus 2-stent Strategy for the Treatment of Bifurcation Lesions in the Context of a Coronary Chronic Total Occlusion. A Multicenter Registry. Rev Esp Cardiol. 2018;71:432-439.
43. Ojeda S, Pan M, Martín P, et al. Immediate results and long-term clinical outcome of patients with unprotected distal left main restenosis:the CORPAL registry (Córdoba and Las Palmas). JACC Cardiovasc Interv. 2014;7:212-221.
44. Mintz GS, Lefèvre T, Lassen JF, et al. Intravascular ultrasound in the evaluation and treatment of left main coronary artery disease:a consensus statement from the European Bifurcation Club. EuroIntervention. 2018;14:e467-e474.
45. Medina A, Martín P, Suárez de Lezo J, et al. Vulnerable carina anatomy and ostial lesions in the left anterior descending coronary artery after floating-stent treatment. Rev Esp Cardiol. 2009;62:1240-1249.
46. Suárez de Lezo J, Medina A, Martín P, et al. Predictors of ostial side branch damage during provisional stenting of coronary bifurcation lesions not involving the side branch origin:an ultrasonographic study. EuroIntervention. 2012;7:1147-1154.
47. Pan M, Suárez de Lezo J, Medina A, et al. Resultados del tratamiento de las lesiones en bifurcación con stents farmacoactivos. Papel de la ecografía intracoronaria. Rev Esp Cardiol Supl. 2007;7(E):49-56.
48. de Lezo JS, Medina A, Martín P, et al. Ultrasound findings during percutaneous treatment of bifurcated coronary lesions. Rev Esp Cardiol. 2008;61:930-935.
49. Onuma Y, Katagiri Y, Burzotta F, et al. Joint consensus on the use of OCT in coronary bifurcation lesions by the European and Japanese bifurcation clubs. EuroIntervention. 2019;14:e1568-e1577.
50. Koo BK, Waseda K, Kang HJ, et al. Anatomic and functional evaluation of bifurcation lesions undergoing percutaneous coronary intervention. Circ Cardiovasc Interv. 2010;3:113-119.
51. Hidalgo F, Pan M, Ojeda S, et al. Feasibility and Efficacy of the Jailed Pressure Wire Technique for Coronary Bifurcation Lesions. JACC Cardiovasc Interv. 2019;12:109-111.
Resumen
El tratamiento antitrombótico tras una revascularización percutánea en los pacientes con indicación de anticoagulación oral crónica ha sido siempre un tema de máximo interés y de gran complejidad, debido sobre todo al alto riesgo isquémico y tromboembólico intrínseco de esta población, y al elevado riesgo hemorrágico que comporta la combinación de fármacos antiagregantes y anticoagulantes. El manejo invasivo actual de la cardiopatía isquémica hace que esta población esté en crecimiento, aspecto que incrementa el interés por definir cuáles son los mejores fármacos y estrategias terapéuticas. A pesar de la escasa evidencia científica, a lo largo de los últimos años se han estudiado diferentes regímenes antitrombóticos, buscando fundamentalmente una reducción de los eventos hemorrágicos, sin que esto repercutiera en la eficacia de las nuevas combinaciones. Las estrategias estudiadas se han basado en el acortamiento de la duración del tratamiento triple e incluso en el uso del tratamiento doble (anticoagulación más un único antiagregante) priorizando el clopidogrel. Sin embargo, ha sido la llegada de los anticoagulantes de acción directa, con la realización de importantes ensayos clínicos en esta población, lo que está aportando información relevante y trascendente que, sin lugar a dudas, contribuirá a modificar la práctica clínica.
Palabras clave: Anticoagulación oral. Fibrilación auricular. Intervencionismo coronario percutáneo. Stent.
Abstract
The antithrombotic treatment after percutaneous revascularization in patients with chronic indication for oral anticoagulation has always been a matter of great interest and complexity, basically because of the high ischemic and thromboembolic risk of this population and high hemorrhagic risk associated with combination therapy with antiplatelet and anticoagulant drugs. The actual invasive management of ischemic cardiomyopathy has made this population of patients grow and raised concerns on which the optimal drugs and therapeutic strategies really are. Yet despite the scarce scientific evidence available, different antithrombotic regimens have been studied over the last few years in an attempt to reduce hemorrhagic events without affecting the efficacy of the new combination therapies. The strategies studied have been based on shortening the duration of triple anticoagulation therapy, and even on the use of double anticoagulation therapy (anticoagulation plus one single antiplatelet drug) prioritizing clopidogrel. But it has been the arrival of direct-acting anticoagulants, with important clinical trials conducted on this population, that has provided us with relevant and fundamental information that will undoubtedly contribute to change the actual clinical practice.
Keywords: Atrial fibrillation. Percutaneous coronary intervention. Stent. Oral anticoagulation.
Abreviaturas: AAS: ácido acetilsalicílico. ACO: anticoagulación oral. ACOD: anticoagulantes orales de acción directa. AVK: antagonistas de la vitamina K. FA: fibrilación auricular. ICP: intervencionismo coronario percutáneo. IP2Y12: inhibidores del receptor P2Y12 SCA: síndrome coronario agudo. TAD: tratamiento antitrombótico doble. TAPD: tratamiento antiagregante plaquetario doble. TAT: tratamiento antitrombótico triple.
Introducción
El manejo antitrombótico del paciente con fibrilación auricular (FA) sometido a intervencionismo coronario percutáneo (ICP) ha sido, es y seguirá siendo motivo de estudio, discusión e investigación. La complejidad de esta población con alta comorbilidad hace que presente un mal pronóstico en el medio y largo plazo, con un alto índice de eventos isquémicos. Por otro lado, el uso de tratamientos antitrombóticos combinados (anticoagulación y antiagregación doble o simple) dirigidos a mejorar el pronóstico isquémico de estos pacientes genera un número de complicaciones hemorrágicas no despreciable que ha llevado a la búsqueda de regímenes antitrombóticos más seguros (en intensidad y tiempo), sin repercutir en la eficacia.
La complejidad de estos pacientes y la dificultad para incluirlos en ensayos clínicos realmente representativos de la vida real han hecho que la mayor parte de la información sobre el régimen antitrombótico óptimo proceda de registros, metanálisis y recomendaciones de expertos y grupos de trabajo.
Precisamente, ha sido la llegada de los anticoagulantes orales de acción directa (ACOD), fármacos más seguros y al menos igual de eficaces que los antagonistas de la vitamina K (AVK) para el tratamiento de la FA, la que está aportando y aportará más evidencia. La existencia de un importante número de pacientes con FA tratados con stent ha llevado a la realización de 4 grandes ensayos clínicos que comparan la seguridad y la eficacia de los ACOD frente a los AVK, con el uso de diferentes regímenes antitrombóticos.
A lo largo de este artículo se revisa la evidencia existente sobre esta población tan trascendental, importante por su elevada prevalencia, por su mal pronóstico y por las grandes novedades que ha habido en estos últimos años y que se presentarán en los próximos.
Magnitud del problema y pronóstico
La prevalencia de los pacientes con FA tratados con ICP varía entre el 6% y el 10% dependiendo de los diferentes registros, las poblaciones incluidas y los síndromes tratados. Parece haber una mayor prevalencia de FA en los pacientes revascularizados por angina estable que en aquellos que lo son por síndrome coronario agudo (SCA). Así, Rohla et al.1 describen una prevalencia de un 10,2% en los pacientes estables frente a un 6,5% en los revascularizados por SCA. Esta prevalencia se incrementa en los registros españoles de SCA hasta el 8-9%2,3. Se trata, por tanto, de unos pacientes nada excepcionales en el día a día de los servicios de cardiología y las salas de hemodinámica.
Sin embargo, lo realmente importante es conocer cómo la presencia de FA en los pacientes revascularizados percutáneamente es uno de los predictores de peor pronóstico. De forma general, y sin valorar la influencia del tratamiento, en el medio plazo (seguimiento de 20 meses) 1 de cada 3 pacientes (32,3%) presentará un evento adverso mayor y casi 1 de cada 4 (22,6%) fallecerá4. Al comparar esta población con los pacientes sin FA se observa cómo la mortalidad en el largo plazo (56 meses) se triplica por el hecho de tener FA (41% frente a 13%), y la presencia de arritmia es uno de los grandes predictores de mortalidad1.
Otro aspecto que debe considerarse es la aparición de FA de novo en los pacientes que ingresan por SCA. La información del registro ARIAM (Análisis del Retraso en el Infarto Agudo de Miocardio)2 describe cómo los pacientes con FA de novo pueden suponer hasta un 55% del total de los pacientes con FA ingresados por un SCA. Lo importante no solo es el alto porcentaje de esta presentación, sino el mal pronóstico hospitalario con el que se relaciona, que es un predictor independiente de mortalidad hospitalaria además de estar relacionado con una mayor presencia de reinfarto, arritmias malignas e insuficiencia cardiaca.
El peor pronóstico de estos pacientes viene determinado por su edad más avanzada, mayor comorbilidad y, en muchas ocasiones, por su infratratamiento tanto con estrategias (menor realización de cateterismos y de revascularizaciones percutáneas) como con fármacos recomendados2,5.
El otro aspecto fundamental que confiere un pronóstico tórpido es el uso, precisamente, de los tratamientos antitrombóticos recomendados. El alto riesgo isquémico de estos pacientes demanda regímenes basados en la combinación de anticoagulación y antiagregación doble o simple. La búsqueda de la reducción de estos eventos isquémicos genera un aumento de las hemorragias graves provocadas por fármacos correctamente indicados, y estas complicaciones hemorrágicas terminan siendo muchas veces determinantes en el pronóstico del paciente.
Por tanto, es crucial identificar a esta población y su riesgo, para así intentar aportar las estrategias de tratamiento y las medidas óptimas durante el ingreso hospitalario, al alta y en el seguimiento, con el objetivo final de mejorar un pronóstico de por sí grave.
Tratamiento antitrombótico con antagonistas de la vitamina K: Tratamiento doble o triple
La anticoagulación oral (ACO) crónica es superior al tratamiento antiagregante (en monoterapia o doble) en cuanto a la prevención de las complicaciones tromboembólicas (ictus y embolia sistémica) de la FA6,7, mientras que el tratamiento antiagregante plaquetario doble con ácido acetilsalicílico (AAS) y un inhibidor del receptor P2Y12 (IP2Y12) es el tratamiento antitrombótico de elección para prevenir eventos isquémicos aterotrombóticos (infarto de miocardio y trombosis de stent) en los pacientes en quienes se realiza un ICP (en el contexto o no de un SCA)8,9. Al asociarse ambas situaciones es cuando la elección del tratamiento antitrombótico se convierte en un problema clínico, porque la que sería la elección más simple, es decir, el uso de tratamiento antitrombótico triple (TAT, combinación de ACO y antiagregación doble), es sabido que incrementa el riesgo de sangrado mayor al menos 2 a 3 veces respecto a cualquier otro régimen antitrombótico, ya sea antiagregación doble o tratamiento antitrombótico doble (TAD, combinación de ACO y un antiagregante)10-12. Surge por tanto la controversia entre el temor a emplear TAT por el comentado aumento de las complicaciones hemorrágicas y el posible aumento de los eventos isquémicos en caso de emplear estrategias menos «agresivas» como el TAD.
El aumento del riesgo hemorrágico asociado al uso de TAT se ha evidenciado de manera consistente en numerosos estudios observacionales (incluyendo registros a gran escala), mientras que los hallazgos referentes a la prevención de eventos aterotrombóticos han sido más dispares, aunque en general no se han encontrado diferencias entre el TAT y el TAD en lo que respecta a la reducción de eventos isquémicos12-14. Es importante señalar que el aumento del riesgo hemorrágico con TAT se mantiene durante toda la duración de este12, por lo que, si se decide iniciarlo, la evidencia disponible señala que debería mantenerse el mínimo tiempo que se considere estrictamente necesario para obtener un beneficio en cuanto a reducción de eventos aterotrombóticos. Por otra parte, merece la pena echar la vista atrás y retrotraerse a los estudios de finales de los años 1990 que sentaron la indicación de usar doble antiagregación plaquetaria en el contexto del ICP con implante de stent coronario15-18. En estos estudios, la antiagregación plaquetaria doble (AAS y tienopiridina) tuvo un beneficio franco en cuanto a reducción de eventos isquémicos, en especial en el primer mes tras el ICP, comparada con una estrategia de TAD (AAS y AVK) (tabla 1). Además, es relevante señalar que los eventos isquémicos (infarto de miocardio o trombosis de stent) en el primer mes tras el ICP tienen un pronóstico peor en términos de mortalidad que los que se presentan de forma más tardía19,20.
Tabla 1. Ensayos clínicos aleatorizados que comparan el tratamiento antiagregante doble (AAS y AVK) con el tratamiento antitrombótico doble tras el implante de un stent coronario
| Ensayo clínico | Grupos de tratamiento | Eventos adversos cardiacos mayores | Eventos hemorrágicos | ||
| Definició | Resultados | Definició | Resultados | ||
| ISAR15 n = 517) |
TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK) | Muerte de causa cardiaca, IM, cirugía de revascularización o reintervención a los 30 días | 1,6% frente a 6,2%; p = 0,01 |
Cualquier sangrado a los 30 días | 0% frente a 6,5%; p < 0,01 |
| STARS16 (n = 1.653) |
AAS frente a TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK)* | Muerte, IM, TS o revascularización de la lesión diana a los 30 días | 0,5% frente a 2,7%; p = 0,01 |
Cualquier sangrado a los 30 días | 5,5% frente a 6,2%; p = 0,99 |
| MATTIS17 (n = 350) |
TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK) | Muerte CV, IM o repetición de revascularización a los 30 días | 5,6% frente a 11,0%; p = 0,07 |
Hemorragia mayor o complicación vascular mayor a los 30 días | 1,7% frente a 6,9%; p = 0,02 |
| FANTASTIC18 (n = 485) |
TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK) | Muerte, IM u oclusión del stent a las 6 semanas | 5,7% frente a 8,3%; p = 0,37 |
Cualquier sangrado a las 6 semanas | 13,5% frente a 21,0%; p = 0,03 |
|
AAS: ácido acetilsalicílico; AVK: antagonistas de la vitamina K; CV: cardiovascular; IM: infarto de miocardio; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble; TS: trombosis del stent. * Se comunican solo los resultados de la comparación entre antiagregación plaquetaria doble y tratamiento antitrombótico doble. |
|||||
Sin embargo, hay que ser muy prudente al extraer argumentos o conclusiones a favor o en contra del TAT basándose en estudios observacionales, pues al fin y al cabo tienen la limitación de la falta de aleatorización que puede condicionar sesgos relevantes (como podría ser, en el caso que nos ocupa, el sesgo de confusión por indicación de los diferentes regímenes antitrombóticos según las características de los pacientes). Por todo ello, conviene enfatizar los resultados de los ensayos clínicos aleatorizados, aunque como veremos a continuación tampoco están exentos de limitaciones, en especial en lo que respecta a la valoración de la eficacia (prevención de eventos isquémicos).
Antes de entrar en lo que podemos llamar la era de los ACOD, se realizaron 2 ensayos clínicos aleatorizados que evaluaron la seguridad de diferentes estrategias antitrombóticas con AVK: el WOEST y el ISAR-TRIPLE21,22. El ensayo WOEST incluyó 573 pacientes con necesidad de ACO (por diversas indicaciones, el 69% con FA o aleteo auricular) que fueron aleatorizados para recibir TAT con AVK frente a TAD consistente en clopidogrel y AVK, y se apreció una reducción importante del riesgo de sangrado (evento hemorrágico de cualquier tipo) al año de seguimiento en los pacientes que recibieron TAD (19,4% frente a 44,4%; hazard ratio [HR], 0,36; intervalo de confianza del 95% [IC95%], 0,26-0,50; p < 0,001)21, aunque este beneficio se debió principalmente a una reducción de los sangrados menores, y no se evidenció ningún incremento de los eventos aterotrombóticos en el grupo con TAD (figura 1). El estudio ha recibido críticas por contar con numerosas limitaciones, entre las que destacan la falta de poder estadístico para evaluar las variables de eficacia, la inclusión de pacientes de relativo bajo riesgo de eventos isquémicos (poco más del 25% con SCA) y la presencia de otros aspectos que pueden favorecer un aumento en la incidencia de hemorragias, como una duración excesiva del TAT en el grupo control (1 año, que es más de lo recomendado), el acceso femoral en la mayoría de los casos y la baja utilización de inhibidores de la bomba de protones23. A pesar de todo, la relevancia del estudio WOEST es manifiesta, pues fue el primero en cuestionar la necesidad de TAT y en poner sobre la mesa la posibilidad de usar TAD inmediatamente tras el ICP en este escenario.
Figura 1. Resultados de ensayos clínicos aleatorizados de tratamiento triple frente a tratamiento doble antitrombótico en pacientes con indicación de anticoagulación oral crónica en los que se realiza intervencionismo coronario percutáneo. Seguridad: eventos hemorrágicos (A). Eficacia: eventos adversos cardiacos mayores (B). Las definiciones de la variable principal de seguridad varían según el estudio: WOEST, cualquier evento hemorrágico a los 12 meses; PIONEER AF-PCI, hemorragia clínicamente significativa (TIMI) a los 12 meses; RE-DUAL PCI, hemorragia mayor o clínicamente relevante (ISTH) en el seguimiento (14 meses de media). Las definiciones de los eventos adversos cardiacos mayores varían según el estudio: WOEST, muerte, infarto de miocardio, ictus, revascularización de vaso diana o trombosis de stent a los 12 meses; PIONEER AF-PCI, muerte de causa cardiovascular, infarto de miocardio o ictus a los 12 meses; RE-DUAL PCI, muerte, evento tromboembólico (infarto de miocardio, ictus o embolia sistémica) o revascularización no planeada en el seguimiento. AVK: antagonista de la vitamina K; Dab 110: dabigatrán 110 mg/12 h; Dab 150: dabigatrán 150 mg/12 h; TAD: tratamiento antitrombótico doble; Riv 2,5: rivaroxabán 2,5 mg/12 h; Riv 15: rivaroxabán 15 mg/24 h; TAT: tratamiento antitrombótico triple.
El ensayo ISAR-TRIPLE aleatorizó 614 pacientes con indicación de ACO (83,9% con FA) en los que se realizaba ICP con implante de stent liberador de fármaco y 2 diferentes duraciones de TAT, una larga de 6 meses frente a una corta de 6 semanas (ambas consistentes en AAS, clopidogrel y AVK seguidos de AAS y AVK)22. No se hallaron diferencias entre las 2 duraciones de TAT en cuanto a la variable principal (un combinado de muerte, infarto de miocardio, trombosis de stent definitiva, ictus y sangrado mayor según la escala Thrombolysis in Myocardial Infarction [TIMI]) a los 9 meses (9,8% frente a 8,8%; HR, 1,14; IC95%, 0,68-1,91; p = 0,63), y tampoco se encontraron diferencias significativas en los eventos isquémicos y los eventos hemorrágicos por separado. No obstante, en un análisis de los eventos sucedidos a partir de las 6 semanas (una vez abandonado el clopidogrel en el brazo de TAT corto) sí se apreció un ligero aumento de las hemorragias de cualquier tipo según la clasificación del Bleeding Academic Research Consortium (no con la clasificación TIMI) en el grupo de TAT largo. Pese a las limitaciones de ambos estudios, siendo la principal la ausencia de poder estadístico para evaluar convenientemente la eficacia de las distintas estrategias analizadas en cuanto a prevención de eventos aterotrombóticos, sus resultados sugieren que la duración del TAT no debe prolongarse de manera injustificada para no incrementar el riesgo hemorrágico más de lo estrictamente necesario.
Posicionamiento de los anticoagulantes orales de acción directa
Entre las estrategias para reducir las complicaciones hemorrágicas derivadas del uso de fármacos antritrombóticos, además de la reducción de la duración del tiempo del TAT o de la suspensión del AAS en determinados grupos de alto riesgo, se encuentra el uso de ACOD.
El mejor perfil de seguridad de estos nuevos anticoagulantes, junto al interés lógico por posicionarse en una población grande en número y con posibilidades de mejoría, ha llevado a la reali-zación de un ensayo clínico para cada uno de los 4 ACOD aprobados.
Con la información disponible actualmente, las últimas guías europeas de práctica clínica se han decantado de manera clara a favor del uso de los ACOD en esta población, en detrimento de los AVK8,24.
Si bien los 4 ensayos clínicos comparan en pacientes con FA revascularizados con ICP la seguridad de los nuevos anticoagulantes frente al TAT (AVK, AAS y clopidogrel), y presentan criterios de inclusión y exclusión bastante similares, existen diferencias importantes en los regímenes antitrombóticos utilizados y en las dosis de los fármacos, que pueden tener alguna influencia en las conclusiones de los estudios y en su repercusión práctica. A continuación se resumen por orden cronológico los 4 grandes ensayos clínicos que ya están publicados o se encuentran en fase de seguimiento, y se presentan los aspectos más relevantes y los más cuestionados. En la tabla 225 se detallan el diseño, los objetivos y los principales hallazgos de cada uno de ellos.
Tabla 2. Características diferenciales y hallazgos fundamentales de los 4 ensayos clínicos que comparan anticoagulantes orales de acción directa frente a anticoagulantes antivitamina K en pacientes con fibrilación auricular revascularizados percutáneamente
| Estudio | Población | Pacientes | Grupos de estudio | Grupos de control | Objetivo primario de seguridad | Principales hallazgos | Eficacia | |||
| PIONEER AF-PCI26 |
Pacientes con FA sometidos a ICP | 2.124 | Ribaroxabán 15 mg/24 h + IP2Y12 |
Ribaroxabán 2,5 mg/12 h + IP2Y12 + AAS |
Warfarina + IP2Y12 + AAS |
Sangrado clínicamente significativo (clasificación TIMI) | Sangrados TIMI mayor (12%), menor (7%) o que requieren atención médica (85%) | El porcentaje de sangrados fue menor en los dos grupos de rivaroxabán (16,8% y 18%) que en el grupo control (26,7%); p < 0,0001 | No inferior. Estudio sin poder estadístico para detectar diferencias de eficacia |
|
| RE-DUAL PCI29 |
Pacientes con FA sometidos a ICP | 2.725 | Dabigatrán 150 mg/12 h + IP2Y12 |
Dabigatrán 110 mg/12h + IP2Y12 |
Warfarina + IP2Y12 + AAS |
Sangrado mayor o sangrado clínicamente relevante no mayor (clasificación ISTH) | Sangrado mayor ISTH (32%) o clínicamente relevante no mayor (68%) | El porcentaje de sangrados fue menor en los dos grupos de dabigatrán (20,2% y 15,4%) que en el grupo control (25,7% y 26,9% respectivamente); p < 0,0001 | No inferior. Estudio sin poder estadístico para detectar diferencias de eficacia |
|
| AUGUSTUS31 | Pacientes con SCA o ICP | 4.614 | Apixabán 5 o 2,5 mg/12 h + IP2Y12 + AAS |
Apixabán 5 o 2,5 mg/12 h + IP2Y12 |
Warfarina + IP2Y12 + AAS |
Warfarina + IP2Y12 |
Sangrado mayor o sangrado clínicamente relevante no mayor (clasificación ISTH) | El porcentaje de sangrados fue menor con apixabán que con AVK (10,5 y 14,7%; p < 0,001) y con placebo frente a AAS (9 y 16,1%; p < 0,001) | Menos ingresos hospitalarios en apixabán y similar incidencia de eventos isquémicos | |
| ENTRUST-AF PCI32 |
1.500 | Edoxabán 60 mg/24 h + IP2Y12 |
Warfarina + IP2Y12 + AAS |
Sangrado mayor o sangrado clínicamente relevante no mayor (clasificación ISTH) | En fase de seguimiento | En fase de seguimiento | ||||
|
AAS: ácido acetilsalicílico; FA: fibrilación auricular; ICP: intervencionismo coronario percutáneo; IP2Y12: inhibidor del receptor P2Y12; ISTH: International Society on Thrombosis and Haemostasis; SCA: síndrome coronario agudo; TIMI: Thrombolysis in Myocardial Infarction. |
||||||||||
Estudio PIONEER AF-PCI
El estudio PIONEER AF-PCI fue el primero en publicarse. Es un ensayo clínico multicéntrico e internacional que aleatorizó a 2.124 pacientes con FA revascularizados con stent a 3 estrategias de tratamiento: rivaroxabán 15 mg/día e IP2Y12; rivaroxabán 2,5 mg/12 h y AAS más IP2Y12; o TAT (AVK, AAS y clopidogrel)26. El objetivo primario fue la ocurrencia de hemorragias clínicamente significativas (sangrados mayores o menores de la clasificación TIMI) o de hemorragias que requiriesen atención médica.
El objetivo del estudio se alcanzó para los 2 grupos de rivaroxabán (16,8% y 18% frente a 26,7%; p < 0,001). En términos de eficacia, los eventos isquémicos (muerte de causa cardiovascular, infarto o ictus) y la mortalidad global fueron similares en los 3 grupos, si bien el estudio no tenía potencia estadística para evaluar diferencias en cuanto a eficacia. Los autores concluyen que el tratamiento con rivaroxabán 15 mg/día más clopidogrel o con rivaroxabán 2,5 mg/12 h más clopidogrel y AAS es más seguro que el TAT con AVK, clopidogrel y AAS.
Este fue el primer estudio que posicionó a los ACOD en esta población, pero son varios los aspectos que deben comentarse al respecto. Se desconoce si estas 2 dosis de rivaroxabán son suficientes para la prevención del ictus en los pacientes con FA, comparadas con los AVK o con el rivaroxabán a dosis de 20 mg/día en pacientes con función renal normal27,28. La dosis de rivaroxabán de 15 mg/24 h no está estudiada de forma generalizada en los pacientes con FA en la prevención tromboembólica, y puede generar dudas sobre su recomendación a todo tipo de pacientes. Y lo mismo ocurre con la dosis de 2,5 mg/12 h, que ha sido estudiada en la cardiopatía isquémica pero no en la FA y que se presume como claramente insuficiente.
El uso de estas dosis no aprobadas para el tratamiento de la FA, si bien ha posicionado al rivaroxabán como el primer ACOD estudiado en esta población y con un perfil de seguridad positivo, ha generado una indicación con evidencia tan solo IIbB en la guía europea de antiagregación doble (rivaroxabán 15 mg/día)8, curiosamente inferior a la otorgada al uso de rivaroxabán a dosis de 20 o 15 mg/día (según la función renal), basado en su estudio general y en subestudios (IIaC)8,27.
Estudio RE-DUAL PCI
El ensayo clínico RE-DUAL PCI aleatorizó a 2.725 pacientes en 3 grupos (TAT con AVK, tratamiento doble con dabigatrán 150 mg/12 h y tratamiento doble con dabigatrán 110 mg/12 h), partiendo de la hipótesis de que un tratamiento doble con dabigatrán y un IP2Y12 puede ser más seguro que el tratamiento estándar basado en TAT en pacientes con FA sometidos a ICP29. La incidencia del evento primario (sangrado mayor o clínicamente relevante de la International Society on Thrombosis and Haemostasis [ISTH]) fue del 15,4% para el dabigatrán a dosis de 110 mg y del 26,9% para el TAT (HR, 0,52; p < 0,0001 para no inferioridad y superioridad), y del 20,7% para el dabigatrán a dosis de 150 mg frente al 25,7% para el TAT (HR, 0,72; p < 0,0001 para no inferioridad). La incidencia del evento combinado para eficacia fue similar en los 3 grupos. El estudio concluye que en los pacientes con FA sometidos a ICP el riesgo de sangrado fue menor en ambos grupos de dabigatrán comparados con el TAT, sin hallar diferencias en eficacia.
El aspecto más relevante, sin duda, es el perfil de seguridad que aporta el dabigatrán con reducciones del 48% en los sangrados en los pacientes tratados con dabigatrán a dosis de 110 mg y del 24% en los tratados con dabigatrán a dosis de 150 mg. En favor de este estudio hay que mencionar que las dosis utilizadas fueron las mismas que en el estudio RELY30, en el que se demostraron su eficacia y seguridad para el tratamiento de la FA no valvular, que fueron confirmadas posteriormente en amplios registros de la vida real.
La principal duda tras este estudio vino determinada por el hallazgo de una incidencia de trombosis del stent del 1,5% en el grupo de dabigatrán 110 mg frente al 0,8% en el grupo con TAT (p = 0,15), así como un aumento del infarto (4,5% frente a 3,0%; p = 0,09). Hay que mencionar que estas tasas de trombosis y de infarto no se observaron con la dosis más alta de 150 mg/12 h. Si bien las diferencias no fueron estadísticamente significativas, estos datos deben llevar a plantear si no se estará pasando de regímenes antitrombóticos muy potentes a otros demasiado livianos en aras de priorizar la seguridad sobre la eficacia. Y la segunda cuestión no solucionada es conocer si el mejor perfil de seguridad del dabigatrán lo es por la mayor seguridad del fármaco o por la no exposición al AAS. Al fin y al cabo, estos 2 ensayos clínicos no comparan estrategias similares (tratamiento triple frente a doble) y por tanto no podrán resolver cuestiones que son absolutamente clave.
A pesar de todo, el REDUAL-PCI debe considerarse como un estudio de gran importancia que permite valorar con mucha fuerza esta nueva opción terapéutica en los pacientes con FA tratados con stent, y quizás de forma más concreta en aquellos que muestren un alto riesgo hemorrágico.
Estudio AUGUSTUS
El estudio AUGUSTUS31 es sin duda el mejor planteado o al menos el que va a poder dar respuesta a un mayor número de preguntas.
El ensayo presenta un diseño factorial 2 × 2 diseñado para comparar apixabán con AVK y AAS frente a placebo en pacientes con FA que presentan un SCA o se les realiza ICP y están recibiendo un IP2Y12. Es el estudio con mayor número de pacientes, pues incluye 4.614.
El objetivo primario es el combinado de sangrados mayores y no mayores clínicamente relevantes siguiendo la clasificación de la ISTH. Los objetivos secundarios del estudio son la mortalidad por cualquier causa, la hospitalización por cualquier causa y los eventos isquémicos.
La incidencia del evento primario se produjo en el 10,5% del grupo apixabán frente al 14,7% en el grupo AVK (HR = 0,69; p < 0,001 para inferioridad y superioridad) y en el 16,1% de los pacientes que recibieron AAS frente al 9% de los que recibieron placebo (HR = 1,89; p < 0,001). Los pacientes del grupo del apixabán tuvieron una menor incidencia de hospitalización que los del grupo de AVK con similar número de eventos isquémicos.
No cabe duda de que este estudio confirma la superioridad de los ACOD en esta población por su claro mejor perfil de seguridad. Pero probablemente no genera evidencia suficiente para una discontinuación de la AAS de forma rutinaria en estos pacientes. Debemos señalar la presencia de más eventos trombóticos en el grupo placebo frente al grupo AAS con el doble de trombosis del stent, diferencias que si bien no alcanzaron significación estadística pueden generar dudas por la falta de poder estadístico para detectar eventos isquémicos. Y no debemos olvidar que los pacientes fueron aleatorizados días o semanas después del evento isquémico, habiendo todos tomado AAS hasta la aleatorización.
Estudio ENTRUST-AF PCI
El ensayo clínico ENTRUST-AF PCI32 se encuentra en fase de seguimiento y ha aleatorizado a 1.500 pacientes con FA, bajo tratamiento anticoagulante y revascularizados con ICP, a 2 estrategias terapéuticas: edoxabán 60 mg/24 h (o 30 mg si se reúnen los criterios para esta dosis) más un IP2Y12 frente a TAT con AVK. El objetivo primario de seguridad vuelve a ser la incidencia de sangrados mayores y no mayores clínicamente relevantes siguiendo la clasificación de la ISTH, y el objetivo primario de eficacia es el combinado de muerte de causa cardiovascular, ictus, embolia, infarto o trombosis definitiva de stent.
El pequeño tamaño del estudio solo permitirá dar respuesta a la pregunta de si un régimen de tratamiento doble con edoxabán es más seguro que un TAT con AVK. Es fácil hipotetizar que así será, pues al fin y al cabo no se comparan en idénticas condiciones al eliminar el AAS del grupo de edoxabán, igual que se hizo en el estudio REDUAL-PCI. Además, la falta de potencia estadística no permitirá mostrar diferencias entre la eficacia de ambas estrategias.
Consideraciones de las guías de práctica clínica
En los últimos años se han elaborado diversas guías de práctica clínica por parte de las sociedades científicas y documentos de consenso específicos por grupos de expertos que han aportado una serie de recomendaciones sobre el manejo del tratamiento antitrombótico en los pacientes con necesidad de ACO crónica en los que se realiza ICP7,8,24,25,33,34. El hecho de que las recomendaciones de estos documentos no siempre coincidan, y que presenten mayoritariamente un nivel de evidencia bajo, pone de manifiesto la complejidad de este escenario.
En lo que respecta al tratamiento antitrombótico tras el ICP, las recomendaciones más recientes (incorporando los resultados de los estudios con ACOD) de las sociedades científicas europeas pueden resumirse de manera sucinta en los siguientes puntos8,24,25:
- TAT con AAS, clopidogrel y ACO durante 1 mes es la estrategia por defecto en los pacientes en los que se implanta un stent, con independencia del tipo de dispositivo implantado.
- TAT al menos 1 mes en pacientes con alto riesgo isquémico por SCA o con otras características anatómicas o del procedimiento, que supera al riesgo hemorrágico.
- TAD inicial con ACO y clopidogrel (de preferencia) o AAS en pacientes con riesgo hemorrágico elevado y superior al riesgo isquémico.
- En pacientes con FA no valvular debe recomendarse los ACOD de manera rutinaria.
- Los ACOD deben usarse a la mínima dosis efectiva para la prevención del ictus que haya sido evaluada en los ensayos de FA.
- Puede considerarse el uso de la dosis de 15 mg de rivaroxabán (en lugar de 20 mg), aunque su eficacia en la prevención del ictus no ha sido suficientemente evaluada.
- Cuando se usa en TAD, la dosis de dabigatrán preferida es la de 150 mg/12 h.
- En caso de usar AVK, el International Normalized Ratio objetivo debe estar en el rango bajo y el tiempo en rango terapéutico debe ser > 65%.
- El uso de ticagrelor o de prasugrel como parte del TAT no está recomendado.
- Debería considerarse la interrupción del tratamiento antiagregante y dejar solo ACO al cabo de 12 meses tras el procedimiento, aunque puede continuarse añadiendo un antiagregante en casos seleccionados según el riesgo isquémico.
En este apartado merece la pena comentar un documento de consenso de expertos norteamericanos que ha generado cierta polémica por recomendar, entre otros aspectos, el TAD como estrategia por defecto en la mayoría de los pacientes y dejar el TAT hasta 1 mes como máximo únicamente para pacientes de alto riesgo isquémico y bajo riesgo hemorrágico34. En definitiva, estas divergencias vienen a subrayar la dificultad del manejo de estos pacientes, la disparidad en las interpretaciones de los estudios disponibles y la imperiosa necesidad de tener más evidencia científica al respecto.
Optimizar el equilibrio entre eficacia y seguridad. Consideraciones prácticas
Una vez repasada la evidencia generada por los estudios y las guías de práctica clínica, lo que queda meridianamente claro es la necesidad de realizar una valoración minuciosa y pormenorizada del riesgo individual de cada paciente de sufrir eventos isquémicos, tromboembólicos y hemorrágicos (figura 2). Esta valoración individualizada debe incorporar la evaluación de factores relacionados con el paciente y con el procedimiento realizado.
Figura 2. Variables que deben considerarse al decidir el tratamiento antitrombótico óptimo en los pacientes con fibrilación auricular sometidos a intervencionismo coronario percutáneo. FA: fibrilación auricular; ICP: intervencionismo coronario percutáneo; SCA: síndrome coronario agudo.
Así pues, existen características clínicas (presentación en forma de SCA, antecedentes de infarto de miocardio o de trombosis de stent, presencia de comorbilidad como diabetes mellitus, insuficiencia renal o enfermedad arterial periférica, etc.), de la anatomía coronaria (enfermedad difusa multivaso) y del ICP (procedimientos complejos con tratamiento de varias lesiones, implante de varios stents o de una gran longitud total, técnicas de 2 stents en bifurcaciones, oclusiones crónicas, etc.) que sugieren un mayor riesgo isquémico y que deben considerarse al optar por regímenes más potentes y más prolongados8,35. La otra cara de la moneda serían aquellos factores que podrían condicionar un mayor riesgo hemorrágico (antecedente de sangrado mayor o ictus hemorrágico, esperanza de vida corta, presencia de anemia, edad avanzada, neoplasia activa, insuficiencia renal grave, fragilidad, etc.) y que, por tanto, deben tenerse en cuenta al optar por estrategias antitrombóticas menos potentes y más cortas. En cuanto al tipo de stent implantado, en la actualidad está demostrada la mayor seguridad de los stents liberadores de fármaco de última generación en los pacientes de alto riesgo hemorrágico24,36, y su uso debe ser generalizado. En cualquier caso, desde el punto de vista práctico, el primer paso en todos los pacientes es considerar y aplicar dentro de lo posible una serie de medidas que contribuyen a minimizar el riesgo de sangrado y que pueden realizarse antes, durante y después del ICP (figura 3).
Figura 3. Medidas que deben tenerse en cuenta para reducir el riesgo hemorrágico en los pacientes con indicación de anticoagulación oral crónica en los que se realiza intervencionismo coronario percutáneo. AAS: ácido acetilsalicílico; ACO: anticoagulación oral; ACOD: anticoagulantes orales de acción directa; AVK: antagonista de la vitamina K; FANV: fibrilación auricular no valvular; GP: glucoproteína; HNF: heparina no fraccionada; HTA: hipertensión arterial; IBP: inhibidor de la bomba de protones; ICP: intervencionismo coronario percutáneo; IP2Y12: inhibidor del receptor P2Y12; TAD: tratamiento antitrombótico doble; TAT: tratamiento antitrombótico triple; TRT: tiempo en rango terapéutico.
Tanto los ensayos clínicos comentados, que han comparado TAT con AVK frente a estrategias de TAD con AVK o ACOD21,26,29, como algunos metanálisis que han agrupado los datos de dichos ensayos37,38, han evidenciado un aumento del riesgo hemorrágico con el uso de TAT sin encontrar un beneficio claro de este régimen en cuanto a reducción de los eventos isquémicos. Sin embargo, existen varias razones por las que no parece justificado, con la evidencia actual, descartar totalmente el TAT en este escenario: 1) ninguno de los ensayos clínicos tenía una potencia estadística suficiente para evaluar de manera adecuada las variables de eficacia (eventos isquémicos y tromboembólicos); 2) otra limitación de estos ensayos fue la inclusión de pacientes con un riesgo relativamente bajo de eventos aterotrombóticos, por lo que puede argüirse que no existen datos suficientes que aseguren la eficacia de los regímenes de TAD en sujetos con un alto riesgo de eventos isquémicos o ictus; y 3) los eventos isquémicos (infarto de miocardio y trombosis del stent) que se producen de manera temprana tras el ICP tienen un peor pronóstico, lo que también iría a favor de no prescindir del TAT al menos en el periodo inicial tras el procedimiento. Por todo ello, la opinión de los autores (en consonancia con las guías europeas) es que, con la evidencia actual, parece aconsejable, siempre tras una evaluación personalizada y muy cuidadosa del riesgo isquémico y del riesgo hemorrágico, una estrategia inicial de TAT durante el mínimo tiempo posible (en el que cada paciente tenga una mayor probabilidad de padecer un evento adverso isquémico) para no aumentar de manera innecesaria el riesgo de sangrado, dejando el TAD como alternativa en aquellos sujetos con un riesgo hemorrágico elevado y superior al isquémico, en los que se considere, por tanto, que no existe una contrapartida clara del uso de TAT para la prevención de eventos aterotrombóticos. Como recomendación práctica, aunque empírica, 1 mes de TAT parece suficiente en la mayoría de los pacientes con ICP en el contexto de una cardiopatía isquémica estable, mientras que en los pacientes con un SCA cabría moverse en un intervalo de entre 1 y 6 meses de TAT, siempre individualizando según el balance ya comentado de riesgos, aunque la duración de 6 meses parece recomendable únicamente para los pacientes con un riesgo de eventos isquémicos francamente elevado.
En lo que respecta a la elección del fármaco anticoagulante, los ACOD, por su mejor perfil de seguridad, parecen los idóneos en un escenario clínico en el que el riesgo de sangrado es muy elevado por la necesaria combinación de fármacos antiagregantes24. En lo que respecta a la dosis de ACOD, en el TAT debe utilizarse la dosis mínima que ha demostrado eficacia para la prevención de ictus en los ensayos de referencia de FA8,24. Este punto es relevante porque cada vez aparecen más evidencias que muestran que utilizar innecesariamente dosis «reducidas» de ACOD (sin cumplir los criterios de ajuste de dosis especificados en la ficha técnica) se asocia con un incremento de los eventos tromboembólicos en el seguimiento39. En el supuesto de escoger dabigatrán, se recomienda usar la dosis de 110 mg durante el TAT y la de 150 mg si el paciente recibe TAD.
En cuanto a los fármacos antiagregantes, el IP2Y12 recomendado para el TAT es claramente el clopidogrel. Pese a que los datos provenientes de los ensayos clínicos sobre la combinación de ACO con un IP2Y12 potente son tremendamente escasos (< 6% en el PIONEER AF-PCI y aproximadamente un 12% de ticagrelor en el RE-DUAL PCI), en algunos estudios observacionales se han apreciado unas tasas de sangrado muy altas con el uso de prasugrel o ticagrelor como parte del TAT40,41. La elección de AAS o de clopidogrel como parte del TAD puede resultar algo más controvertida; si bien las guías muestran su preferencia por clopidogrel como el antiagregante de elección en este contexto, la combinación de AAS y ACO también es válida y puede contemplarse, en especial si se tiene en cuenta que un porcentaje no despreciable de pacientes (aproximadamente el 15-30% en nuestro medio) presentan una respuesta insuficiente al clopidogrel42.
Conclusiones
El paciente con tratamiento anticoagulante que es revascularizado percutáneamente presenta en general un mal pronóstico en el medio y largo plazo, con una alta incidencia de eventos isquémicos, tromboembólicos y hemorrágicos.
A modo de resumen pueden hacerse las siguientes recomendaciones, siempre de forma global, teniendo en cuenta que la complejidad de estos pacientes exigirá siempre una individualización del tratamiento:
- La intensidad y la duración del tratamiento antitrombótico tienen que estar determinadas por el cuadro clínico que establece la revascularización y por los riesgos isquémico, tromboembólico y hemorrágico del paciente. El tipo de stent ha dejado de ser una variable que influya en la decisión del tratamiento antitrombótico de esta población, y la mayoría de los pacientes deberán ser tratados con stents farmacoactivos, por su mayor eficacia respecto a los convencionales y por su mayor seguridad.
- Cuando se opte por el TAT, su duración debe reducirse lo máximo posible y se centrará en el periodo de mayor riesgo isquémico y de trombosis del stent, con el fin de poder minimizar el riesgo hemorrágico. Con la información disponible, parece justificado el uso de TAT en aquellos pacientes en los que se priorice el riesgo isquémico y en los que sea asumible el riesgo hemorrágico.
- En los pacientes en los que se priorice el riesgo hemorrágico sobre el isquémico podrá indicarse TAD (anticoagulación más un único antiagregante, siendo clopidogrel el preferido por las guías de práctica clínica) desde la revascularización.
- El uso de nuevos antiagregantes (prasugrel o ticagrelor) está claramente desaconsejado en esta población. Deben estar contraindicados como parte del TAT (salvo en contadas excepciones) y no hay apenas evidencia sobre su uso en regímenes de TAD.
- El empleo de ACOD en este escenario parece particularmente beneficioso y está recomendado por las guías de práctica clínica más recientes de forma preferente sobre los AVK. Si bien no se dispone de estudios con suficiente potencia estadística como para determinar diferencias en cuanto a eficacia, toda la evidencia orienta a la superioridad de los ACOD como fármacos más seguros y con similar eficacia. Es importante destacar que hay que indicar las dosis de ACOD que hayan demostrado eficacia para la prevención de eventos tromboembólicos en los estudios generales en pacientes con FA.
- Independientemente de las recomendaciones antitrombóticas, deben aplicarse siempre medidas generales relacionadas con el procedimiento con el fin de reducir los eventos hemorrágicos (acceso radial, evitar tratamientos puente cuando sea posible o contraindicar el uso de inhibidores de la glucoproteína IIb/IIIa salvo en situaciones de «rescate»).
Conflicto de intereses
J.M. Ruiz-Nodar declara haber recibido honorarios por ponencias de AstraZeneca, Biosensor, Boston Scientific, Medtronic y Terumo. J.L. Ferreiro declara haber recibido honorarios por ponencias de Eli Lilly Co., Daiichi Sankyo, Inc., AstraZeneca, Roche Diagnostics, Pfizer y Boehringer Ingelheim; por consultoría, de AstraZeneca, Eli Lilly Co. y Ferrer; y becas de investigación de AstraZeneca.
Bibliografía
1. Rohla M, Vennekate CK, Tentzeris I, et al. Long-term mortality of patients with atrial fibrillation undergoing percutaneous coronary intervention with stent implantation for acute and stable coronary artery disease. Int J Cardiol.2015;184;108-114.
2. Almendro-Delia M, Valle-Caballero MJ, Garcia-Rubira JC, et al. Prognostic impact of atrial fibrillation in acute coronary syndromes: results from the ARIAM registry. Eur Heart J Acute Cardiovasc Care. 2014;3:141-148.
3. Ruiz-Nodar JM, Cequier A, Lozano T, et al. Impacto del tipo de hospital en el tratamiento y evolución de los pacientes con síndrome coronario agudo sin elevación del ST. Rev Esp Cardiol. 2010;63:390-399.
4. Ruiz-Nodar JM, Marín F, Hurtado JA, et al. Anticoagulant and antiplatelet therapy use in 426 patients with atrial fibrillation undergoing percutaneous coronary intervention and stent implantation: implications for bleeding risk and prognosis. J Am Coll Cardiol. 2008;51:818-825.
5. Lopes RD, Li L, Granger CB, et al. Atrial fibrillation and acute myocardial infarction: antithrombotic therapy and outcomes. Am J Med. 2012:125:897-905.
6. Connolly S, Pogue J, Hart R, et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet. 2006;367:1903-1912.
7. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37:2893-2962.
8. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39:213-260.
9. Lugo LM, Ferreiro JL. Dual antiplatelet therapy after coronary stent implantation: individualizing the optimal duration. J Cardiol. 2018;72:94-104.
10. Rubboli A, Agewall S, Huber K, Lip GY. New-onset atrial fibrillation after recent coronary stenting: warfarin or non-vitamin K-antagonist oral anticoagulants to be added to aspirin and clopidogrel? A viewpoint. Int J Cardiol. 2015;196:133-138.
11. Sørensen R, Hansen ML, Abildstrom SZ, et al. Risk of bleeding in patients with acute myocardial infarction treated with different combinations of aspirin, clopidogrel, and vitamin K antagonists in Denmark: a retrospective analysis of nationwide registry data. Lancet. 2009;374:1967-1974.
12. Lamberts M, Olesen JB, Ruwald MH, et al. Bleeding after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation. 2012;126:1185-1193.
13. Wustrow I, Sarafoff N, Haller B, et al. Real clinical experiences of dual versus triple antithrombotic therapy after percutaneous coronary intervention. Catheter Cardiovasc Interv. 2018;92:1239-1246.
14. Kawai H, Watanabe E, Yamamoto M, et al. Major bleeding complications related to combined antithrombotic therapy in atrial fibrillation patients 12 months after coronary artery stenting. J Cardiol. 2015;65:197-202.
15. Schömig A, Neumann FJ, Kastrati A, et al. A randomized comparison of antiplatelet and anticoagulant therapy after the placement of coronary-artery stents. N Engl J Med. 1996;334:1084-1089.
16. Leon MB, Baim DS, Popma JJ, et al. A clinical trial comparing three antithrombotic-drug regimens after coronary-artery stenting. Stent Anticoagulation Restenosis Study Investigators. N Engl J Med. 1998;339:1665-1671.
17. Urban P, Macaya C, Rupprecht HJ, et al. Randomized evaluation of anticoagulation versus antiplatelet therapy after coronary stent implantation in high-risk patients: the multicenter aspirin and ticlopidine trial after intra-coronary stenting (MATTIS). Circulation. 1998;98:2126-2132.
18. Bertrand ME, Legrand V, Boland J, et al. Randomized multicenter comparison of conventional anticoagulation versus antiplatelet therapy in unplanned and elective coronary stenting. The full anticoagulation versus aspirin and ticlopidine (fantastic) study. Circulation. 1998;98:1597-1603.
19. Brener SJ, Kirtane AJ, Stuckey TD, et al. The Impact of Timing of Ischemic and Hemorrhagic Events on Mortality After Percutaneous Coronary Intervention: The ADAPT-DES Study. JACC Cardiovasc Interv. 2016;9:1450-1457.
20. Secemsky EA, Matteau A, Yeh RW, et al. Comparison of Short- and Long-Term Cardiac Mortality in Early Versus Late Stent Thrombosis (from Pooled PROTECT Trials). Am J Cardiol. 2015;115:1678-1684.
21. Dewilde WJ, Oirbans T, Verheugt FW, et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet. 2013;381:1107-1115.
22. Fiedler KA, Maeng M, Mehilli J, et al. Duration of Triple Therapy in Patients Requiring Oral Anticoagulation After Drug-Eluting Stent Implantation: The ISAR-TRIPLE Trial. J Am Coll Cardiol. 2015;65:1619-1629.
23. Capodanno D, Lip GY. Triple therapy for atrial fibrillation and ACS with or without PCI: don’t drop aspirin just yet. J Am Coll Cardiol. 2015;65:515-516.
24. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
25. Lip GYH, Collet JP, Haude M, et al. 2018 Joint European consensus document on the management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous cardiovascular interventions: a joint consensus document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). Europace. 2018. https://doi.org/10.1093/europace/euy174
26. Gibson CM, Mehran R, Bode C, et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med. 2016;375:2423-2434.
27. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365:883-891.
28. Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J. 2018:39:1330-1393.
29. Cannon CP, Bhatt DL, Oldgren J, et al. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med. 2017;377:1513-1524.
30. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139-1151.
31. Lopes RD, Heizer G, Aronson R, et al. Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. N Engl J Med. 2019. https://doi.org/10.1056/NEJMoa1817083
32. Vranckx P, Lewalter T, Valgimigli M, et al. Evaluation of the safety and efficacy of an edoxaban-based antithrombotic regimen in patients with atrial fibrillation following successful percutaneous coronary intervention (PCI) with stent placement: rationale and design of the ENTRUST-AF PCI trial. Am Heart J. 2018;196:105-112.
33. Levine GN, Bates ER, Bittl JA, et al. 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines. Am Coll Cardiol. 2016;68:1082-1115.
34. Angiolillo DJ, Goodman SG, Bhatt DL, et al. Antithrombotic Therapy in Patients With Atrial Fibrillation Treated With Oral Anticoagulation Undergoing Percutaneous Coronary Intervention. A North American Perspective – 2018 Update. Circulation. 2018;138:527-536.
35. Giustino G, Chieffo A, Palmerini T, et al. Efficacy and Safety of Dual Anti-platelet Therapy After Complex PCI. J Am Coll Cardiol. 2016;68:1851-1864.
36. Urban P, Meredith IT, Abizaid A, et al. Polymer-free drug-coated coronary stents in patients at high bleeding risk. N Engl J Med. 2015;373:2038-2047.
37. Cavallari I, Patti G. Meta-Analysis Comparing the Safety and Efficacy of Dual Versus Triple Antithrombotic Therapy in Patients With Atrial Fibrillation Undergoing Percutaneous Coronary Intervention. Am J Cardiol. 2018;121:718-724.
38. Golwala HB, Cannon CP, Steg PG, et al. Safety and efficacy of dual vs. triple antithrombotic therapy in patients with atrial fibrillation following percutaneous coronary intervention: a systematic review and meta-analysis of randomized clinical trials. Eur Heart J. 2018;39:1726-1735a.
39. Yao X, Shah ND, Sangaralingham LR, Gersh BJ, Noseworthy PA. Non-Vi-tamin K Antagonist Oral Anticoagulant Dosing in Patients With Atrial Fibrillation and Renal Dysfunction. J Am Coll Cardiol. 2017;69:2779-2790.
40. Sarafoff N, Martischnig A, Wealer J, et al. Triple therapy with aspirin, prasugrel, and vitamin K antagonists in patients with drug-eluting stent implantation and an indication for oral anticoagulation. J Am Coll Cardiol. 2013;61:2060-2066.
41. Verlinden NJ, Coons JC, Iasella CJ, Kane-Gill SL. Triple Antithrombotic Therapy With Aspirin, IP2Y12 Inhibitor, and Warfarin After Percutaneous Coronary Intervention: An Evaluation of Prasugrel or Ticagrelor Versus Clopidogrel. J Cardiovasc Pharmacol Ther. 2017;22:546-551.
42. Angiolillo DJ, Ferreiro JL. Platelet adenosine diphosphate P2Y12 receptor antagonism: benefits and limitations of current treatment strategies and future directions. Rev Esp Cardiol. 2010;63:60-76.