Artículos de revisión
REC Interv Cardiol. 2019;1:41-50
Tratamiento antitrombótico tras revascularización percutánea en pacientes con indicación crónica de anticoagulación oral
Antithrombotic therapy after percutaneous revascularization in patients on chronic oral anticoagulation treatment
aServicio de Cardiología, Hospital General Universitario de Alicante, Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL), Alicante, España bÁrea de Enfermedades del Corazón, Hospital Universitario de Bellvitge – IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona, España
RESUMEN
Las intervenciones coronarias percutáneas en enfermedad arterial coronaria calcificada representan un desafío para el cardiólogo intervencionista. Además, los pacientes con enfermedad arterial coronaria calcificada tienden a tener peores resultados en el seguimiento a corto y largo plazo. La infraexpansión del stent es el resultado más temido cuando se realiza una intervención coronaria percutánea en estos pacientes y es un gran predictor de falla del stent. Por lo tanto, la modificación del calcio guiada por imágenes intracoronarias, es un paso importante en el tratamiento de esta enfermedad. La siguiente revisión describe el uso «paso a paso» de imágenes intracoronarias en la evaluación de la calcificación coronaria y en la selección de una técnica de modificación de calcio adecuada. Además, se describen las técnicas actuales de modificación de calcio disponibles, la evidencia para su uso, su mecanismo de acción y los resultados típicos que se observan en las imágenes intracoronarias.
Palabras clave: Calcificación coronaria. Modificación de placa calcificada. Aterectomía. Litoplastia. Tomografía coherencia óptica. Ecografía intravascular.
ABSTRACT
Calcified coronary artery disease poses a number of challenges to the interventional cardiologist when performing percutaneous coronary interventions, and patients with calcified coronary artery disease continue to have poorer outcomes at both the short and the long-term follow up. Stent underexpansion is the most feared outcome when performing percutaneous coronary interventions in these patients and is a strong predictor of stent failure. Therefore, intracoronary imaging to guide calcium modification is an important step in the treatment of this disease. The following review outlines a stepwise approach using intracoronary imaging in the assessment of coronary calcification, and in the selection of the appropriate calcium modification tool. Additionally, we describe current calcium modification techniques available, the evidence behind their use, their mechanism of action, and the typical results seen on intracoronary imaging.
Keywords: Coronary calcium. Calcium modification. Atherectomy. Lithotripsy. Optical coherence tomography. Intravascular ultrasound.
Abreviaturas
AR: aterectomía rotacional. AO: aterectomía orbital. EC: enfermedad coronaria. ICP: intervención coronaria percutánea. IIV: imagen intravascular. IVUS: ecocardiografía intravascular. LIV: litotripsia intravascular. OCT: tomografía de coherencia óptica.
INTRODUCCIÓN
La estenosis coronaria calcificada es un hallazgo relativamente frecuente en el 30% de las lesiones programadas para intervención coronaria percutánea (ICP)1. La ateroesclerosis calcificada plantea una serie de dificultades durante la ICP, sobre todo la infraexpansión del stent, un potente predictor del fracaso del stent (trombosis y reestenosis)2-4. No sorprenden, pues, los resultados clínicos que se obtienen tras una ICP para tratar la enfermedad calcificada entre moderada y grave comparada con placas ateroescleróticas sin calcio1. En la actualidad, se dispone en una serie de técnicas para modificar la placa de calcio, aunque pocas comparativas directas entre ellas, lo cual complica la elección del dispositivo que se debe emplear. Entender la morfología del calcio puede contribuir a la adecuada selección del dispositivo o la técnica que mejor funcionan bajo guiado mediante imágenes intravasculares (IIV). En esta revisión, se ofrece una descripción de la valoración del calcio coronario empleando IIV, se propone el algoritmo de modificación del calcio simplificado que usamos en nuestro centro y se analiza el mecanismo de acción y la evidencia científica que avala el uso de cada una de estas técnicas.
Fisiopatología e implicaciones pronósticas del calcio coronario
La fisiopatología de la ateroesclerosis está bien documentada y empieza con lesiones vasculares y acumulación de lipoproteínas de baja densidad que atraviesan cambios oxidativos que resultan en la liberación de citocinas proinflamatorias. Estas atraen monocitos que migran hacia la íntima, se convierten en macrófagos y, por último, en células espumosas5. El subsiguiente reclutamiento de células musculares lisas de la media produce una matriz extracelular que provoca engrosamiento intimal y avance de la placa. Con el paso del tiempo y en presencia de factores de riesgo como la edad, el sexo masculino, la raza caucásica, la hipertensión, la hiperlipemia, la diabetes y la insuficiencia renal crónica, puede sobrevenir la calcificación de las placas ateroescleróticas cuya patogénesis tiene mucho en común con la osteogénesis1,5-8. Se piensa que la transformación de las células musculares lisas en un fenotipo osteoblástico es el factor de inicio motivado por exposición a la proteína morfogenética ósea 2 (BMP 2) que producen las células endoteliales cuando se ven expuestas a estresores tales como hipoxia, presión alta, flujo turbulento e inflamación9. El resultado es la pérdida de expresión de los marcadores específicos del músculo liso vascular y la expresión de genes que suelen encontrarse en los osteoblastos10. Otras vías también tienen un papel, por ejemplo, la apoptosis de células musculares lisas vasculares y la formación de vesículas de matriz calcificadas por los macrófagos6. Los primeros resultados son la deposición de microcalcificaciones que terminan por fusionarse en depósitos de calcio más grandes que adoptan una apariencia de «calcificaciones irregulares» en las IIV. El avance de estas calcificaciones resulta en placas o láminas de calcio que pueden llegar a extenderse por múltiples cuadrantes del vaso, endureciéndolo y alterando su distensibilidad11. La calcificación nodular es un importante subtipo morfológico que penetra en la luz del vaso y se forma cuando se rompen las placas de calcio6. En el pronóstico, la presencia de ateroesclerosis calcificada se vincula a peores resultados cardiovasculares12,13. Una calcificación irregular inicial representa un periodo inestable en la evolución de la enfermedad coronaria (EC) calcificada y estas lesiones suelen asociarse a rotura de la placa y al síndrome coronario agudo6,14. En cambio, las lesiones con mayor porcentaje de volumen de placa calcificada según la angiotomografía computarizada son más estables y suelen presentar menos eventos cardiovasculares agudos, pero más síndromes coronarios agudos y enfermedad multivaso6,15.
Intervención coronaria percutánea para el tratamiento de la ateroesclerosis calcificada
Las estenosis calcificadas se dan en hasta el 30% de los pacientes aptos para ICP1. La subsiguiente reducción de la distensibilidad coronaria plantea una serie de dificultades en la intervención. Una inadecuada dilatación de la lesión puede resultar en la infraexpansión del stent16, uno de los predictores más importantes de su fracaso2-4. Otras dificultades son el mayor riesgo de disección y perforación, dificultad a la hora de pasar el equipo distalmente, la afectación del polímero del stent, una cinética de liberación del fármaco alterada y, potencialmente, la deformación o pérdida del stent1,17,18. Además, los pacientes con calcificación coronaria son menos propensos a recibir revascularizaciones completas y suelen presentar resultados adversos tras una ICP. En un análisis conjunto de los estudios HORIZONS-AMI y ACUITY, la presencia de calcificación moderada o grave (valorada angiográficamente) se asoció a peores resultados al año para todos los objetivos incluida la muerte, la mortalidad cardiovascular, el infarto de miocardio y el índice total de eventos cardiovasculares adversos mayores1. Al cabo de 1 año, el riesgo de trombosis del stent aumentó en un 62% y el de revascularización de la lesión diana (RLD) en un 44% en lesiones calcificadas frente a no calcificadas. Estos hallazgos se han podido replicar en otros estudios en seguimientos a corto y largo plazo1,7,19-21. En un reciente análisis del estudio SYNTAXES, las lesiones extensamente calcificadas se asociaron a un índice de mortalidad por cualquier causa más alto al cabo de 10 años con independencia del tipo de revascularización empleada (hazard ratio, 1,79; intervalo de confianza del 95%, 1,49-2,16; p < 0,001)21. Optimizar los resultados de la ICP tiene una importancia capital y preparar la placa modificando el calcio es un paso importante en este proceso.
Técnicas de imagen para la detección del calcio
Detectar la presencia de calcio coronario previo a la ICP es importante para poder planificar la intervención pudiéndose emplear una serie de técnicas imágenes como las que se muestran en la tabla 1.14,15,22-28
Tabla 1. Resumen de las técnicas de imagen disponibles para la detección del calcio coronario
| Técnica de imágenes | Cuantificación | Sensibilidad | Especificidad | Ventajas | Desventajas |
|---|---|---|---|---|---|
Tomografía computarizada14,15,22,23 |
|
++++ | ++++ |
|
|
Coronariografía23,24,25 |
|
++ +++ en presencia de calcificación grave |
+++ |
|
|
OCT25,26,27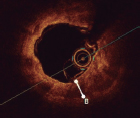 |
|
++++ | ++++ |
|
|
IVUS25,27,28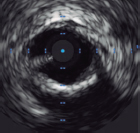 |
|
++++ | ++++ |
|
|
|
IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica. |
|||||
Técnicas de imagen no invasivas para el tratamiento de la calcificación coronaria
La angiotomografía computarizada es altamente sensible y específica para detectar placas de calcio, además de tratarse de una técnica no invasiva. También es capaz de determinar la morfología de la placa y el volumen porcentual de placa calcificada con significación pronóstica15. Su utilidad durante la planificación de la intervención adquiere mayor importancia durante la planificación de oclusiones coronarias totales crónicas, no tanto para guiar la estrategia interoperatoria.
Técnicas de imagen invasivas para el tratamiento de la calcificación coronaria
Hace tiempo que se sabe que la coronariografía invasiva tiene una sensibilidad baja pero una especificidad alta para la detección del calcio coronario. Comparada con la ecocardiografía intravascular (IVUS), su sensibilidad general es del ~ 48%, aunque puede subir hasta > 85% en presencia de calcificación grave (4 cuadrantes)24,25. En cualquier caso, el arco ha de superar los 100° en las IIV para poder detectar la placa de calcio en la angiografía, lo cual pone de manifiesto el potencial que tiene el calcio de pasar desapercibido cuando la ICP está guiada solo por angiografía25. Esta normalmente clasifica la calcificación como nula/leve, moderada o grave (tabla 1). Aunque la angiografía proporciona información valiosa para guiar la intervención sobre la tortuosidad del vaso, la angulación de las bifurcaciones, etc., sus limitaciones también están bien documentadas y los estudios han demostrado consistentemente peores resultados cuando la ICP está guiada por angiografía en lugar de por IIV29-31.
Las IIV satisfacen muchas de las carencias que presentan otras técnicas de imagen. Tanto la tomografía de coherencia óptica (OCT) como la IVUS son más sensibles a la detección del calcio que la coronariografía25. Además, ambas técnicas ofrecen información adicional para guiar y optimizar la intervención (tabla 1)27. El corregistro con la angiografía está disponible para ambas técnicas y puede reducir la curva de aprendizaje significativamente32. Aunque las ventajas que tiene la IIV sobre la angiografía han sido objeto de varios estudios, todavía no se ha publicado ningún estudio no aleatorizado que analice específicamente sus posibles beneficios en el tratamiento de la EC calcificada. No obstante, ante la complejidad de estas lesiones, parece razonable llevar a cabo la ICP guiada por IIV.
Ecocardiografía intravascular
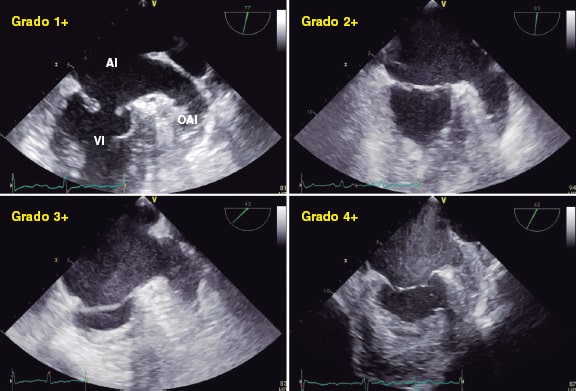
La IVUS tiene una sensibilidad y especificidad altas (del 86,7 y 93,3%, respectivamente frente a las muestras histológicas) para la detección de calcificaciones densas, aunque es menos sensible para detectar microcalcificaciones33 y en presencia de placas fibróticas superpuestas34. El calcio refleja el ultrasonido como una señal hiperecoica brillante con una sombra posterior significativa que suele impedir que se pueda valorar el grosor de la placa de calcio (figura 1)35. Se pueden emplear marcadores indirectos del grosor de calcio tales como la presencia de reverberaciones posteriores (asociadas a placas más finas de calcio < 0,5 mm), si bien la presencia de una sombra significativa sugiere una calcificación más gruesa (> 1 mm)25. Recientemente, un sistema de puntuación específico mediante IVUS ha resultado útil para predecir la infraexpansión del stent empleando para ello 4 criterios: un arco de calcio > 270° para una longitud de ≥ 5 mm, la presencia de un arco de calcio de 360°, la presencia de nódulos calcificados y un diámetro del vaso adyacente < 3,5 mm. Una puntuación ≥ 2 sugiere que debe acometerse la modificación del calcio, razón por la cual los operadores deberían intentar medir cada uno de estos parámetros mediante pullbacks de IVUS36.
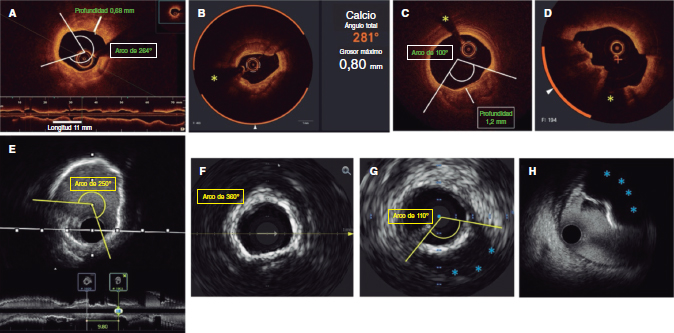
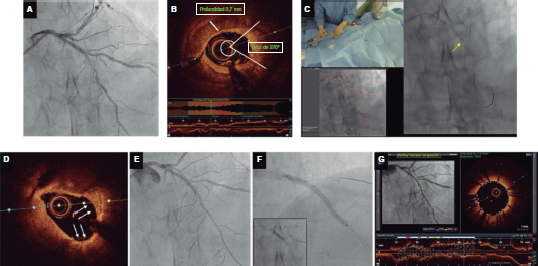
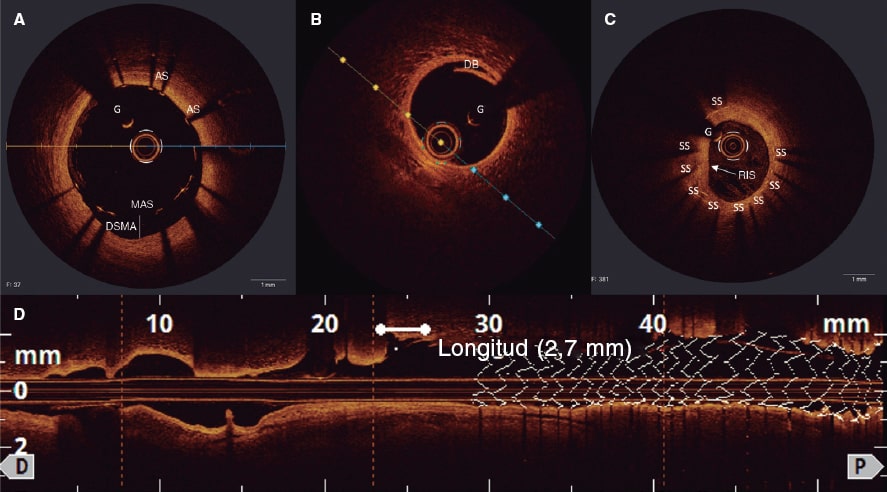
Figure 1. Morfología del calcio y mediciones mediante el empleo de imágenes intracoronarias. A: calcificación concéntrica en una tomografía de coherencia óptica (OCT); arco de calcio de 264°, profundidad de 0,68 mm y longitud de 11 mm – características de riesgo alto en la OCT para la infraexpansión del stent; se aconseja preparación de la placa. B: calcificación concéntrica; arco de calcio de 281° y profundidad de 0,8 mm. Detección automática del calcio empleando el software Ultreon; grados de calcio detectados definidos por el arco naranja que rodea la imagen de la OCT. C: calcio excéntrico en la OCT; arco de calcio < 180°. Obsérvese que los bordes bien definidos del calcio permiten poder valorar la profundidad de este (1,2 mm). D: nódulo calcificado en la OCT. Significativa sombra posterior provocada por el nódulo que evita la valoración de su borde posterior. E: calcificación concéntrica en la IVUS con un arco de calcio de 250° y una longitud de 9,8 mm. Tanto la sombra posterior como la falta de reverberaciones sugieren una placa gruesa de calcio (~1 mm). Estas características representan un riesgo alto de infraexpansión del stent. F: calcificación concéntrica en la ecocardiografía intravascular (IVUS) con un arco de calcio de 360°. G: calcificación excéntrica en la IVUS con un arco de calcio < 180°. Sombra acústica posterior significativa (asterisco azul). H: nódulo calcificado en la IVUS protruyendo hacia el interior de la luz y proyectando una significativa sombra acústica posterior (asterisco azul). El asterisco amarillo (en todas las imágenes OCT) denota el artefacto de la guía.
Tomografía de coherencia óptica
Aunque mucho más sensible que la angiografía, la OCT es menos sensible que la IVUS en la detección del calcio coronario. Wang et al. descubrieron que el ~ 6% de las lesiones con calcio detectable mediante IVUS no se veían en la OCT, lo cual se atribuía a la presencia de una placa fibrótica superpuesta25. En la OCT, el calcio se muestra como una región de baja intensidad de señal con bordes bien definidos que permiten valorar la profundidad del calcio26. Fujino et al. demostraron que un arco de calcio > 180°, una profundidad de > 0,5 mm y una longitud de > 5 mm en la OCT se asociaban a mayor riesgo de infraexpansión del stent, razón por la que -al igual que con la IVUS- los operadores deberían analizar cada uno de estos parámetros37. Recientemente ha aparecido un software de inteligencia artificial (Ultreon OCT system, Abbott, Estados Unidos) que identifica automáticamente el arco y profundidad del calcio y la lámina elástica externa para el dimensionamiento del vaso, lo cual ayuda a simplificar el análisis (figura 1).
En términos prácticos, podría resultar útil valorar el grado de calcificación coronaria en las IIV teniendo en cuenta el arco, profundidad y longitud del calcio, así como si es superficial o profundo, tal y como se muestra en la figura 1. Teniendo en cuenta el arco circunferencial, el calcio coronario se puede dividir en 3 subtipos morfológicos (figura 1): excéntrico, que se extiende por 2 o menos cuadrantes con un arco < 180°; concéntrico, con un arco > 180°, y calcificación nodular, que se presenta como una protrusión eruptiva en el interior de la luz. El calcio también se puede subdividir en superficial (localizado a < 50% de profundidad de la placa más el grosor de la media) o profundo (localizado a > 50% de profundidad de la placa más el grosor de la media)28. La longitud del calcio se debe medir en proyecciones longitudinales tanto en la IVUS como en la OCT.
Modificación de la placa calcificada
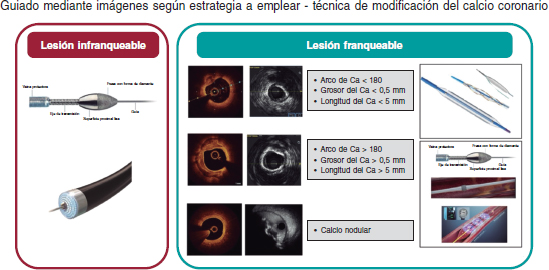
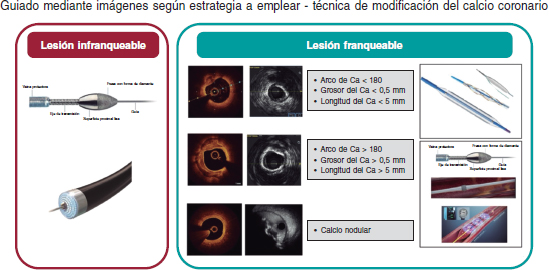
Aunque no hay ensayos clínicos que comparen las diferentes técnicas de modificación de la placa empleadas en las diferentes morfologías de calcio, el consenso sugiere que los tratamientos basados en balones son efectivos en el tratamiento de la calcificación excéntrica, que tiene una longitud corta. Aunque los tratamientos ablativos y basados en la litotripsia son más útiles para tratar la calcificación concéntrica o las lesiones calcificadas largas, la litotripsia es especialmente útil para tratar depósitos de calcio más profundos. La calcificación nodular plantea el mayor desafío de todos; no obstante, son muchos los que abogan por el uso de técnicas ablativas y datos publicados recientemente sugieren que la litotripsia podría tener un papel importante38. Las lesiones infranqueables y no dilatables pueden tratarse con la aterectomía rotacional (AR) o mediante angioplastia coronaria con láser excímer (ELCA). Aunque reconocemos la escasez de datos y la falta de ensayos comparativos directos entre las diferentes técnicas disponibles, hemos intentado resumir a título orientativo tanto esta práctica clínica como la de nuestro propio centro en un algoritmo simplificado de modificación del calcio (figura 2). La tabla 2 resume el mecanismo de acción y las especificaciones de estas técnicas. Los resultados esperados tras la modificación del calcio se muestran en la figura 3.
Figure 2. Algoritmo de modificación del calcio. Se aconseja la obtención de imágenes intravasculares (IIV) para valorar la lesión antes de modificar la placa. Las lesiones infranqueables, con frecuencia, requieren el uso de la aterectomía rotacional o de la angioplastia coronaria con láser excímer (ELCA). Las lesiones franqueables con calcificación excéntrica sin características de alto riesgo para la infraexpansión del stent se pueden tratar con balones no distensibles, de tallado o scoring balloons. La calcificación concéntrica o el calcio con características de alto riesgo para la infraexpansión del stent se pueden tratar mediante técnicas de aterectomía o litotripsia intravascular (LIV). Aunque el calcio nodular puede modificarse empleando técnicas de aterectomía, cada vez se tienen más evidencias de que la LIV también puede ser efectiva. La posmodificación de la placa en las IIV es clave para valorar la modificación de la placa adecuadamente. Ca: calcio.
Tabla 2. Herramientas de modificación del calcio: descripción, mecanismo de acción y especificaciones
| Balones de tallados | Scoring balloons | Balones no distensibles (NC) de alta presión | Aterectomía rotacional | Aterectomía orbital | LÁSER excímer | Litotripsia | |
|---|---|---|---|---|---|---|---|
| Descripción de la tecnología | Plataforma de balón con una serie de microcuchillas | Varias guías de nitinol envueltas en un balón semidistensible o no distensible | Balón no distensible de doble capa | Fresa recubierta de diamante capaz de realizar una aterectomía en un movimiento hacia delante | Corona recubierta de diamante montada excéntricamente capaz de realizar una aterectomía en un movimiento hacia delante y hacia atrás | Sistema concéntrico o excéntrico de fibras láser Emplea una mezcla de gases raro y halógeno que generan pulsos cortos de alta intensidad y luz UV de longitud de onda corta | Serie de emisores encerrados dentro de un sistema de liberación con balón |
| Mecanismo de acción | Incisiones controladas del calcio | Incisiones controladas del calcio | Dilatación con balón de muy alta presión con una presión máxima de inflado de 35 atm (a menudo dilatado a ~50 atm) | La rotación de la fresa a alta velocidad (140-160.000 rpm) resulta en una aterectomía diferencial del tejido fibrocalcificado Efecto adicional derivado de la vibración de la fresa (+) | La fuerza centrífuga hace que la corona orbite a altas velocidades (80 o 120.000 rpm) lo cual permite el lijado del calcio Efecto adicional derivado de la vibración de la corona (+++) | Rompe la placa empleando 3 mecanismos Fotoquímico: rompe las uniones de carbón entre moléculas Fototérmico: produce energía térmica y burbujas de vapor Fotomecánico: rompe la placa por la expansión de las burbujas de vapor La energía lumínica (fluencia) empleada oscila entre los 30 y 80 ml/mm2 La tasa de repetición de los pulsos se sitúa entre los 25 y 80 Hz | Los emisores producen chispas eléctricas que a su vez crean una burbuja de vapor que expande y propaga una onda acústica por la pared vascular Genera fuerzas compresivas y descompresivas ante la presencia de la placa de calcio provocando la rotura del mismo |
| Tamaños disponibles | Una serie de marcas disponibles en tamaños que van de 2,0 a 4,0 mm | Una serie de marcas disponibles en tamaños que van de 1,47 a 4,0 mm | Balones de 1,5 a 4,5 mm | Fresa de 1,25, 1,5, 1,75, 2,0, 2,15, 2,25, 2,38 y 2,5 mm | Corona de 1,25 mm | 0,9, 1,4, 1,7 y 2,0 mm | Diámetros de 2,5, 3,0, 3,5 y 4,0 mm Todos los tamaños son de 12 mm de largo |
| Compatibilidad con el catéter guía | 6 Fr | Los tamaños de algunos balones son compatibles con sistemas de 5 y 6 Fr | 6 Fr | 6 Fr; 1,25 y 1,5 mm 7 Fr; 1,75 mm 8 Fr; 2,0 y 2,15 mm 9 Fr; 2,25 y 2,38 mm 10 Fr; 2,50 mm |
6 Fr | 6 Fr: 0,9 y 1,4 mm 7 Fr: 1,7 mm 8 Fr: 2,0 mm |
6 Fr |
| Compatibilidad de la guía | Guías convencionales de 0,014 pulgadas | Guías convencionales de 0,014 pulgadas | Guías convencionales de 0,014 pulgadas | Se requiere una guía especializada de 0,009 o 0,014 pulgadas | Se requiere una guía especializada Viper de 0,012 o 0,014 pulgadas | Guías convencionales de 0,014 pulgadas | Guías convencionales de 0,014 pulgadas |
| Otras advertencias | Balón 1:1: dimensionamiento del vaso Rotar el balón seguido de inflados repetidos puede aumentar el número de incisiones |
Balón 1:1: dimensionamiento del vaso | Balón 1:1: dimensionamiento del vaso | Ratio fresa-arteria de 0,5 a 0,6 Lubricante disponible pero no obligatorio y contraindicado en pacientes alérgicos al huevo y la soja |
Se requiere un lubricante específico que está contraindicado en pacientes alérgicos al huevo y la soja | Ratio catéter-arteria de 0,5 a 0,6 Requiere de la infusión continua de una solución salina a través del catéter guía La infusión de contraste aumenta la efectividad, pero también el riesgo de daños térmicos |
Balón 1:1: dimensionamiento del vaso Preparado riguroso del balón para retirar todo el air Podría hacer falta volver a retirar el aire mientras se esté usando |
| Ventajas | Fácil de usar Compatible con guías convencionales |
Fácil de usar Compatible con guías convencionales |
Fácil de usar Compatible con guías convencionales |
Útil en lesiones no dilatables Podría ser más útil que otras tecnologías para el tratamiento del calcio nodular |
Útil en lesiones no dilatables Podría ser más útil que otras tecnologías para el tratamiento del calcio nodular Permite la ablación tanto hacia delante como hacia atrás Genera partículas más pequeñas que la aterectomía rotacional |
Fácil de usar Compatible con guías convencionales |
Fácil de usar Compatible con guías convencionales Modifica la calcificación profunda y superficial No genera material particulado razón por la cual el riesgo de flujo lento o ausencia de flujo es menor |
| Desventajas | Podría no bastar como monoterapia Aparatoso |
Podría no bastar como monoterapia Aparatoso |
Aparatoso | Se requiere una guía especializada El sesgo de la guía puede resultar en una aterectomía diferencial Ablación solo en un movimiento hacia delante No permite mantener la guía en la rama lateral durante la aterectomía Genera partículas más grandes que la aterectomía rotacional La embolización distal puede resultar en un flujo lento o en la ausencia de flujo |
Se requiere una guía especializada Requiere de la infusión de lubricación especializada No permite mantener la guía en la rama lateral durante la aterectomía, La embolización distal puede resultar en un flujo lento o en la ausencia de flujo |
Tiempo de preparación Se necesita protección adicional UV |
Aparatoso para franquear lesiones 80 pulsos por catéter podrían requerir el uso de > 1 catéter para el tratamiento de lesiones largas |
| Potenciales complicaciones | Perforación Disección Flujo lento/ausencia de flujo |
Perforación Disección Flujo lento/ausencia de flujo |
Perforación Disección Flujo lento/ausencia de flujo |
Perforación Disección Atrapamiento de la fresa Fractura de la guía Flujo lento/ausencia de flujo Bloqueo aurículoventricular transitorio |
Perforación Disección Atrapamiento de la corona Flujo lento/ausencia de flujo |
Perforación Disección Lesión térmica |
Perforación Disección |
|
Fr: french; Hz: hercios; NC: no distensible; rpm: revoluciones por minuto; UV: ultravioleta. |
|||||||
Abordaje terapéutico para la calcificación excéntrica
Tecnologías especializadas basadas en balones
Las tecnologías especializadas basadas en balones se suelen emplear en calcificaciones excéntricas, aunque también resultan útiles en calcificaciones concéntricas si se emplean con otras técnicas. El balón de tallados incorpora una serie de microcuchillas montadas sobre un balón. Los scoring balloons, por su parte, incorporan un balón semidistensible alrededor del cual se envuelven varias guías de nitinol. Ambos realizan incisiones en el calcio que facilitan la dilatación vascular. La ventaja de estas tecnologías es que se anclan al calcio, no resbalan tanto (el fenómeno llamado «pepita de sandía») y por tanto evitan disecciones en áreas adyacentes. Aunque en ocasiones se emplean indistintamente, un estudio de Matsukawa et al. que empleó IIV confirmó mejor modificación del calcio y mayor ganancia luminal con balones de tallados que con scoring balloons39. Sin embargo, en lo que respecta a la calcificación grave, los balones de tallados tienen índices más bajos de éxito operatorio que la AR40. Combinar balones de tallados con otras tecnologías podría resultar útil. Estudios observacionales demuestran una mayor ganancia luminal con balones de tallados tras una AR que solo con balones convencionales o solo AR41,42.
Los balones de muy alta presión son efectivos para romper el calcio tanto de calcificaciones excéntricas como concéntricas. No suelen ser la primera opción de tratamiento y suelen emplea rse en lesiones no dilatables. Se trata de balones no distensibles de doble capa con una presión máxima de inflado de ~ 35 atm. No obstante, en la práctica suelen dilatarse a ~ 50 atm. En una serie retrospectiva de 326 lesiones consecutivas no dilatables, Secco et al. confirmaron el éxito angiográfico en > 90% de las lesiones en las que se usaron balones de alta presión OPN (OPN NC; SIS Medical AG, Suiza)43. Las lesiones calcificadas con arcos de calcio > 270° solían necesitar presiones > 40 atm. Más recientemente, el estudio ISAR-CALC aleatorizó lesiones con estenosis residuales > 30% tras el uso de balones estándar a recibir scoring balloons o balones de muy alta presión44. No se hallaron diferencias en la OCT que definieran el índice de expansión del stent entre grupos (0,72 frente a 0,68; p = 0,22) ni en el éxito angiográfico, de la intervención o de la estrategia. No obstante, los pacientes del grupo con balones de muy alta presión necesitaron menos dilataciones nuevas con balones no distensibles previas al implante de stent. También tenían diámetros luminales mínimos más grandes según valoración angiográfica y menos estenosis residual que los pacientes de la cohorte con scoring balloons. En consecuencia, los balones de muy alta presión tienen un papel importante en el tratamiento de lesiones no dilatables pero sí franqueables.
Calcificación concéntrica y nodular
Litotripsia
La litotripsia intravascular (LIV) (SHOCKWAVE Medical inc, Estados Unidos) es una técnica que se ha presentado recientemente basada en el uso de energía acústica. Incorpora un sistema de liberación con balón con una serie de emisores que generan chispas eléctricas cortas que generan a su vez una burbuja de vapor en el medio líquido del interior del balón que se dilata a 4 atm. Dicha burbuja se expande, creando una onda de presión acústica que se propaga por la pared vascular y provocan fuerzas compresivas y descompresivas ante la presencia de calcio, el cual rompen45. Cada pulso corto libera el equivalente a ~ 50 atm de presión. En la actualidad, estudios no aleatorizados han confirmado la fisurización del calcio superficial y profundo en las IIV (figura 3). Un análisis conjunto de series de estudios DISRUPT CAD ha confirmado que la intervención es un éxito (estenosis residual angiográfica ≤ 30%) en > 90% de las lesiones46. Aunque hasta la fecha, la LIV se ha empleado sobre todo para tratar el calcio concéntrico, el análisis de calcificaciones definidas angiográficamente como excéntricas o concéntricas sugiere un éxito similar en estas 2 morfologías del calcio47. Además, datos publicados recientemente no sugieren que haya diferencias en el área mínima del stent en la OCT cuando la LIV se emplea para tratar calcificaciones excéntricas, concéntricas y el calcio nodular38. Aunque todavía es una indicación fuera de ficha técnica, ya se han descrito varios casos sobre el uso de la LIV para tratar la infraexpansión del stent por calcificación grave y neoateroesclerosis calcificada48-51. El uso de la LIV en un stent recién desplegado, aunque infraexpandido, todavía no se ha descrito de forma extensa y preocupa teóricamente la posibilidad de daños al polímero del stent. Hasta la fecha, nuestra práctica ha sido emplear la LIV predominantemente en calcificaciones concéntricas, si bien estamos a la espera de nuevos datos. La figura 4 muestra un caso de modificación de la placa mediante una LIV guiada por OCT.
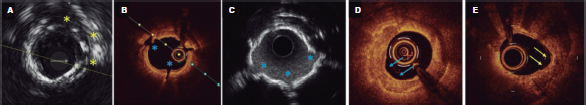
Figure 3. Morfologías de calcio y resultados de las diferentes técnicas de modificación en las imágenes intravasculares. A: discretas incisiones en la placa de calcio y rotura tras el uso de un balón de tallado (asterisco amarillo). B, C: roturas de calcio tras litotripsia intravascular en tomografía de coherencia óptica y ecocardiografía intravascular (IVUS) (asterisco azul). Adviértase cómo se ven las reverberaciones en los puntos de rotura (asterisco azul) en la IVUS ahora que las ondas acústicas pueden atravesar los puntos de rotura. D: resultados de modificación del calcio con aterectomía rotacional en 1 lesión infranqueable. Puede observarse una apariencia “hueca” con ensanchamiento luminal y forma de medialuna en algunas zonas (flecha azul). E: resultados of modificación del calcio tras aterectomía orbital. La forma de medialuna de la corona de la aterectomía orbital se aprecia en las flechas amarillas.
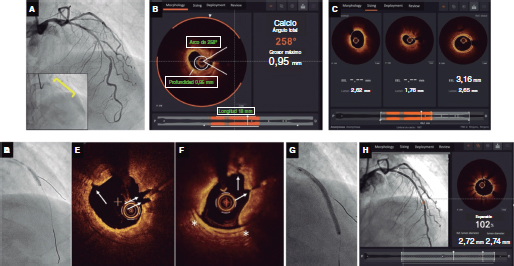
Figure 4. Ejemplo de caso que confirma la modificación del calcio tras guiado por litotripsia intravascular (LIV) con imágenes corregistradas por tomografía de coherencia óptica (OCT) empleando el software Ultreon. A: estenosis fuertemente calcificada en descendente anterior con calcio visible en la fluoroscopia (recuadro).B: la OCT confirma la presencia de calcificación concéntrica; el software Ultreon identifica automáticamente un arco de calcio de 285º, una profundidad de 0,95 mm y una longitud de 18 mm. Estos parámetros sugieren un riesgo alto de infraexpansión del stent. C: zonas de anclaje proximal y distal y longitud del stent requerido. La distancia que existe entre la lámina elástica externa de la zona de anclaje distal y la lámina elástica externa (líneas blancas punteadas detectadas automáticamente por el software Ultreon) mide 3,16 mm mientras que, proximalmente, no se puede ver la lámina elástica externa y el diámetro luminal es 2,62 mm. La longitud predicha del stent necesario es de 45 mm. D: balón de LIV de 3,0 x 12 mm (dimensionamiento 1:1). Liberación de 60 pulsos a lo largo y ancho de la lesión calcificada. E, F: rotura extensa del calcio en la OCT tras LIV (flechas blancas). También se observa 1 disección (asterisco blanco). G: implante de 1 stent farmacoactivo de 3,0 x 48 mm según dimensionamiento mediante OCT. Optimizado con un balón no distensible de 3,0 x 12 mm. F: OCT final; óptima expansión del stent (> 90%) sin mala aposición ni complicaciones (por ejemplo, disecciones) en las zonas de anclaje proximal y distal.
Aterectomía rotacional
La AR (Rotablator, Boston Scientific, Estados Unidos) incorpora una fresa con punta de diamante que rota a 140-180.000 rpm que realiza la ablación diferencial del tejido calcificado sin alterar los tejidos elásticos sanos. La ablación se realiza en un movimiento hacia delante. Se requiere una guía especializada (RotaWire Floppy o RotaWire Extra Support, Boston Scientific, Estados Unidos) y una fresa que no supere más de 0,5-0,6 veces el tamaño del vaso. Antes, se abogaba por la infusión de nitroglicerina, verapamilo o heparina para mitigar los efectos de la embolización del material trombótico y por insertar una guía para la estimulación temporal, o por la infusión de aminofilina para combatir la bradicardia sobre todo durante la AR de la coronaria derecha. No obstante, los cambios en las técnicas de AR han contribuido a reducir las complicaciones. La reducción agresiva del volumen de placa que permite la AR se ha sustituido por ciclos más cortos (de 10 y 15 segundos), movimientos de picoteo con la fresa, tamaños de fresa más pequeños y periodos de descanso para eliminar las partículas embolizadas. En ocasiones, en las IIV, el raspado y alisado del calcio adoptan forma de medialuna desde el lugar desde donde se realizó la ablación con la fresa (figura 3).
El estudio ROTAXUS aleatorizó a 240 pacientes con EC calcificada para recibir AR o tratamiento convencional previo al implante de un stent farmacoactivo52. Tanto el éxito de la intervención como la ganancia luminal (1,56 frente a 1,44 mm, p < 0,01) fueron mayores en el grupo AR durante la intervención índice. Sin embargo, se observó una mayor pérdida luminal tardía en el grupo AR a los 9 meses (0,44 frente a 0,31 mm, p = 0,04). Además, tras 2 años de seguimiento no se observaron diferencias entre los distintos grupos respecto a los eventos cardiovascular adversos graves, el infarto de miocardio, la revascularización de la lesión diana o la revascularización del vaso diana (p > 0,05 para todas las comparativas)53. El estudio PREPARE-CALC analizó la AR y la comparó con los balones modificados (de tallado o scoring balloons) en el tratamiento de la enfermedad calcificada grave. Similar a lo descrito en el estudio ROTAXUS, la estrategia tuvo más éxito en el grupo AR que en el de balones modificados (98 frente al 81%, p = 0,0001) sobre todo por la mayor capacidad de cruce del grupo con balones modificados (el 10% del grupo con balones modificados)40. No obstante, este mayor éxito en la estrategia del grupo AR no se tradujo en diferencias en los resultados clínicos ni angiográficos a los 9 meses40, lo cual se explicaría en parte porque la expansión final del stent según la OCT no varió entre los grupos (73,5 frente al 73,1% para balones modificados y AR, respectivamente; p = 0,85)54.
Cada vez se usan más combinaciones de técnicas adicionales para modificar el calcio coronario. Un estudio de 92 pacientes realizado por Tang et al. confirmó un mayor descenso del porcentaje de estenosis (del 54,5 al 36,1% frente al 55,7 al 46,9%, p < 0,001) acompañado de una mayor expansión del stent (71,7 frente al 54,5%) con la AR más un balón de tallado que con solo la AR41. Asimismo, Amemiya et al. observaron una mayor rotura de la placa de calcio y expansión del stent (78,9 frente al 66,7%, p < 0,01) en la OCT con el balón de tallado que con una angioplastia con balón tras la AR42. Además, se han descrito numerosos casos clínicos sobre el uso de LIV tras AR con un bueno efecto55,56. Serán necesarios estudios aleatorizados y observacionales más grandes que ayuden a determinar si estas (y otras) combinaciones dan mejores resultados a largo plazo. En términos prácticos y en nuestra propia práctica clínica, la AR va bien para tratar lesiones infranqueables no dilatables y calcificaciones concéntricas graves (figura 2) a menudo acompañada de otras técnicas.
Aterectomía orbital
La AO (DIAMONDBACK 360 orbital atherectomy system, Cardiovascular systems Inc., Estados Unidos) incorpora una corona recubierta de diamante que emplea la fuerza centrífuga para orbitar y provocar un lijado preferencial del calcio coronario, alejándose de zonas colindantes con tejido elástico sano. Precisa de una guía dedicada (ViperWire advance) y de la infusión de lubricante (ViperSlide both Cardiovascular systems Inc., Estados Unidos) durante la ablación. La corona de 1,25 mm orbita a 1 de las siguientes 2 configuraciones de velocidad (80 o 120.000 rpm), lo cual resulta en el ensanchamiento o estrechamiento del arco orbital. A diferencia de la AR, la AO puede realizar ablaciones moviéndose hacia delante y hacia atrás. Precisa también movimientos lentos (~ 1 mm/segundo). Los ciclos de la aterectomía deberían ser de ≤ 30 segundos con periodos de descanso para poder retirar el material trombótico. Las IIV realizadas tras una AO confirman el raspado y alisado del calcio, a menudo con un arco visible o forma de medialuna en el punto donde se realizó el lijado (figura 3). Los estudios no aleatorizados ORBIT I y II analizaron el perfil de seguridad y efectividad de la AO y confirmaron que redujo el porcentaje de estenosis por diámetro al ≤ 50% en el > 98% de las lesiones57,58. Hubo disecciones significativas en el 2,3% de los casos. No obstante, el índice de complicaciones tales como perforaciones, flujo lento y ausencia de flujo, fue < 1%58. Los 3 años de seguimiento del estudio ORBIT II revelaron una incidencia acumulada de eventos cardiovascular adversos graves y revascularización de la lesión diana del 23,5 y 7,8%, respectivamente59. El estudio prospectivo de un único grupo COAST analizó un sistema de AO modificado con una microcorona distal para mejorar la capacidad de penetración. Este sistema redujo el porcentaje de estenosis por diámetro al ≤ 50% en el > 99% de las lesiones60. En la actualidad, no se ha publicado ningún ensayo aleatorizado comparando la AO a ninguna otra forma de modificación del calcio. No obstante, un pequeño estudio de OCT sugirió que la modificación del calcio era más profunda con la AO que con la AR61 y un metanálisis de estudios observacionales no halló diferencias entre la AO y la AR en lo referente a complicaciones asociadas la intervención, ni tampoco en los eventos a los 30 días incluida la muerte, el infarto de miocardio y la revascularización del vaso diana62. No obstante, aunque hacen falta más datos, nuestra práctica clínica avala el uso de la AO en detrimento de la AR en vasos más grandes con calcificaciones concéntricas o nodulares. La figura 5 muestra un ejemplo de modificación de la placa mediante AO y la tabla 3 resume los datos de que disponemos en la actualidad para AO y AR.
Figure 5. Modificación del calcio por aterectomía orbital guiada por imágenes corregistradas mediante tomografía de coherencia óptica (OCT). A: estenosis fuertemente calificada en segmento medio de descendente anterior. B: OCT con hallazgos de calcificación circunferencial grave; arco de calcio ~270°, profundidad de 0,7 mm y longitud > 5 mm; valores sugestivos de alto riesgo de infraexpansión del stent según criterios OCT. Diámetros luminales de referencia distales y proximales de 2,5 y 3,25 mm, respectivamente con una longitud del stent predicha de 33 mm. C: aterectomía orbital (flecha amarilla) con el sistema de aterectomía orbital DIAMONDBACK 360 y 1 corona de 1,25 mm avanzada a 1 mm/s. El lijado/la aterectomía se llevaron a cabo en movimientos hacia delante y hacia atrás. Utilización del dynamic road mapping para guiar la intervención (abajo a la izquierda). D: apariencia lisa tras aterectomía orbital. La imagen confirma que el ‘casquete’ de calcio se ha reducido enormemente gracias al efecto de lijado logrado por la aterectomía orbital (AO). Se aprecia una forma de la medialuna como efecto de la rotación de la corona (flechas blancas). E: la angiografía realizada tras la AO confirma el descenso significativo del porcentaje de estenosis por diámetro. F: implante de 1 stent farmacoactivo de 2,5 x 36 mm con optimización proximal mediante la utilización de 1 balón no distensible de 3,5 x 10 mm (recuadro). G: las imágenes OCT corregistradas finales obtenidas tras la AO y el implante de stent confirman la correcta expansión y aposición del stent sin complicaciones.
Tabla 3. Resumen de los principales estudios prospectivos que analizaron los resultados obtenidos con las técnicas de AR y AO
| Técnica | Nombre del estudio | Diseño | Número de participantes | Resultados de la intervención | Resultados a corto y medio plazo | Resultados a largo plazo |
|---|---|---|---|---|---|---|
| Aterectomía rotacional | Estudio ROTAXUS52,53 | Ensayo controlado aleatorizado | 240
|
Éxito de la estrategia
|
Resultados a los 9 meses PLT intrastent
|
Resultados a los 2 años MACE
|
| PREPARE-CALC40 | Ensayo controlado aleatorizado | 200
|
Éxito de la estrategia
|
Resultados a los 9 meses PLT intrastent
|
||
| Aterectomía orbital | ORBIT I57 | Ensayo prospectivo, no aleatorizado | 50 |
|
MACE
|
|
| ORBIT II58,59 | Estudio prospectivo, multicéntrico y no aleatorizado | 443 |
|
MACE
|
Resultados a los 3 años
|
|
| COAST60 | Estudio prospectivo, multicéntrico y de un único grupo | 100 |
|
MACE
|
Resultados al año
|
|
|
AO: aterectomía orbital; AR: aterectomía rotacional; BM: balones modificados; IM: infarto de miocardio; ER: estenosis residual; MACE: eventos cardiovasculares adversos mayores; RLD: revascularización de la lesión diana; RVD: revascularización del vaso diana; TE: tratamiento estándar; TIMI: Thrombolysis in Myocardial Infarction. Definiciones
ROTAXUS
ORBIT I
ORBIT II
COAST
|
||||||
Angioplastia coronaria con láser excímer
La angioplastia coronaria con láser excímer (ELCA) emplea una mezcla de gases raro y halógeno que genera pulsos breves de luz ultravioleta de alta intensidad y así romper la placa aterosclerótica a través de 3 mecanismos de acción: fotoquímico, rompiendo las uniones de carbón entre moléculas, fototérmico, mediante la producción de calor y burbujas de vapor que rompen las células y fotomecánico, a través de la expansión de burbujas de vapor que también rompen la placa de calcio. Tanto la fluencia (energía medida en mJ/mm2) como la frecuencia de pulso se pueden cambiar para aumentar su efectividad. Se recomienda la infusión constante de una solución salina para evitar la aparición de lesiones térmicas. Además, la longitud de onda corta (~308 nm) de luz ultravioleta reduce la profundidad de penetración para no dañar tejidos sanos. La evidencia de que disponemos del uso de la ELCA en el tratamiento de la EC calcificada es limitada. Un estudio multicéntico y prospectivo de 100 lesiones infranqueables/ no dilatables confirmó el éxito técnico del 92% de las lesiones63 si bien un estudio multicéntrico, también prospectivo, publicado recientemente confirmó el éxito en 126 lesiones infranqueables en el ~ 82% de los casos64. No obstante, la calcificación grave se asoció significativamente el fracaso de la ELCA. En cualquier caso, en un contexto de reestenosis intrastent, se observó más rotura de calcio en la OCT en el grupo tratado con ELCA que con tratamiento convencional65. Dada la falta de estudios a gran escala y teniendo en cuenta los datos disponibles hasta la fecha, a la ELCA se le asigna un papel relativamente nicho para el tratamiento de lesiones infranqueables, prefiriéndose el uso de la AR como terapia ablativa de primera línea ante esta circunstancia.
CONCLUSIONES
La EC calcificada sigue siendo un obstáculo para poder realizar, con éxito, una ICP. Además, la población envejecida sugiere que la proporción de pacientes con EC calcificada que necesitarán una ICP probablemente vaya en aumento. Su presencia se asocia no solo a peores resultados agudos sino también a más eventos adversos durante el seguimiento a largo plazo. La infraexpansión del stent es uno de los predictores más potentes del fracaso del stent y suele ocurrir en presencia de calcificación coronaria significativa. Identificar la presencia de calcio coronario es básico para poder planificar una ICP, y la IIV es una forma de lograrlo con mayor precisión. En la actualidad son muchas las tecnologías con diferentes mecanismos de acción disponibles para modificar el calcio coronario, aunque todavía nos faltan comparativas directas entre todas estas técnicas. En cualquier caso, proponemos el algoritmo simplificado para la modificación del calcio coronario basado en hallazgos en las IIV que usamos actualmente en nuestro centro. Futuros estudios deberán comparar estas técnicas para determinar cuáles son las mejores combinaciones para garantizar los mejores resultados en estos pacientes complejos.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
A. McInerney: idea, diseño y elaboración del manuscrito. J. Escaned: aportó las imágenes clínicas y participó en la fase revisión del manuscrito. N. Gonzalo: idea, diseño, elaboración y revisión crítica del manuscrito; también aportó imágenes clínicas.
CONFLICTO DE INTERESES
N. Gonzalo declara haber recibido honorarios como asesora y conferenciante de Abbott y Boston Scientific. Los demás autores no declaran ningún conflicto de intereses en relación a esta publicación.
BIBLIOGRAFÍA
1. Genereux P, Madhavan MV, Mintz GS, et al. Ischemic outcomes after coronary intervention of calcified vessels in acute coronary syndromes. Pooled analysis from the HORIZONS-AMI (Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction) and ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) TRIALS. J Am Coll Cardiol. 2014;63:1845-1854.
2. Fujii K, Carlier SG, Mintz GS, et al. Stent underexpansion and residual reference segment stenosis are related to stent thrombosis after sirolimus-eluting stent implantation: an intravascular ultrasound study. J Am Coll Cardiol. 2005;45:995-998.
3. Hong MK, Mintz GS, Lee CW, et al. Intravascular ultrasound predictors of angiographic restenosis after sirolimus-eluting stent implantation. Eur Heart J. 2006;27:1305-1310.
4. Stefanini GG, Alfonso F, Barbato E, et al. Management of myocardial revascularisation failure: an expert consensus document of the EAPCI. EuroIntervention. 2020;16:e875-e890.
5. Libby P, Buring JE, Badimon L, et al. Atherosclerosis. Nat Rev Dis Primers. 2019;5:56.
6. Mori H, Torii S, Kutyna M, et al. Coronary Artery Calcification and its Progression: What Does it Really Mean? JACC Cardiovasc Imaging. 2018;11:127-142.
7. Bourantas CV, Zhang YJ, Garg S, et al. Prognostic implications of coronary calcification in patients with obstructive coronary artery disease treated by percutaneous coronary intervention: a patient-level pooled analysis of 7 contemporary stent trials. Heart. 2014;100:1158-1164.
8. Madhavan MV, Tarigopula M, Mintz GS, et al. Coronary artery calcification: pathogenesis and prognostic implications. J Am Coll Cardiol. 2014;63:1703-1714.
9. Johnson RC, Leopold JA, Loscalzo J. Vascular calcification: pathobiological mechanisms and clinical implications. Circ Res. 2006;99:1044-1059.
10. Kapustin AN, Shanahan CM. Calcium regulation of vascular smooth muscle cell-derived matrix vesicles. Trends Cardiovasc Med. 2012;22:133-137.
11. Alfonso F, Macaya C, Goicolea J, et al. Determinants of coronary compliance in patients with coronary artery disease: an intravascular ultrasound study. J Am Coll Cardiol. 1994;23:879-884.
12. Detrano R, Guerci AD, Carr JJ, et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups. N Engl J Med. 2008;358:1336-1345.
13. Vliegenthart R, Oudkerk M, Hofman A, et al. Coronary calcification improves cardiovascular risk prediction in the elderly. Circulation. 2005;112:572-577.
14. Motoyama S, Kondo T, Sarai M, et al. Multislice computed tomographic characteristics of coronary lesions in acute coronary syndromes. J Am Coll Cardiol. 2007;50:319-326.
15. Jin HY, Weir-McCall JR, Leipsic JA, et al. The Relationship Between Coronary Calcification and the Natural History of Coronary Artery Disease. JACC Cardiovasc Imaging. 2021;14:233-242.
16. Kobayashi Y, Okura H, Kume T, et al. Impact of target lesion coronary calcification on stent expansion. Circ J. 2014;78:2209-2214.
17. Genereux P, Madhavan MV, Mintz GS, et al. Relation between coronary calcium and major bleeding after percutaneous coronary intervention in acute coronary syndromes (from the Acute Catheterization and Urgent Intervention Triage Strategy and Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction Trials). Am J Cardiol. 2014;113:930-935.
18. Hendry C, Fraser D, Eichhofer J, et al. Coronary Perforación in the drug-eluting stent era: incidence, risk factors, management and outcome: the UK experience. EuroIntervention. 2012;8:79-86.
19. Konigstein M, Madhavan MV, Ben-Yehuda O, et al. Incidence and predictors of target lesion failure in patients undergoing contemporary DES implantation-Individual patient data pooled analysis from 6 randomized controlled trials. Am Heart J. 2019;213:105-111.
20. Guedeney P, Claessen BE, Mehran R, et al. Coronary Calcification and Long-Term Outcomes According to Drug-Eluting Stent Generation. JACC Cardiovasc Interv. 2020;13:1417-1428.
21. Kawashima H, Serruys PW, Hara H, et al. 10-Year All-Cause Mortality Following Percutaneous or Surgical Revascularization in Patients With Heavy Calcification. JACC Cardiovasc Interv. 2022;15:193-204.
22. Knez A, Becker A, Leber A, et al. Relation of coronary calcium scores by electron beam tomography to obstructive disease in 2,115 symptomatic patients. Am J Cardiol. 2004;93:1150-1152.
23. Budoff MJ, Diamond GA, Raggi P, et al. Continuous probabilistic prediction of angiographically significant coronary artery disease using electron beam tomography. Circulation. 2002;105:1791-1796.
24. Mintz GS, Popma JJ, Pichard AD, et al. Patterns of calcification in coronary artery disease. A statistical analysis of intravascular ultrasound and coronary angiography in 1155 lesions. Circulation. 1995;91:1959-1965.
25. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
26. Tearney GJ, Regar E, Akasaka T, et al. Consensus standards for acquisition, measurement, and reporting of intravascular optical coherence tomography studies: a report from the International Working Group for Intravascular Optical Coherence Tomography Standardization and Validation. J Am Coll Cardiol. 2012;59:1058-1072.
27. Raber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39:3281-3300.
28. Mintz GS, Nissen SE, Anderson WD, et al. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement and Reporting of Intravascular Ultrasound Studies (IVUS). A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37:1478-1492.
29. Gao XF, Ge Z, Kong XQ, et al. 3-Year Outcomes of the ULTIMATE Trial Comparing Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation. JACC Cardiovasc Interv. 2021;14:247-257.
30. Hong SJ, Mintz GS, Ahn CM, et al. Effect of Intravascular Ultrasound-Guided Drug-Eluting Stent Implantation: 5-Year Follow-Up of the IVUS-XPL Randomized Trial. JACC Cardiovasc Interv. 2020;13:62-71.
31. Kinnaird T, Johnson T, Anderson R, et al. Intravascular Imaging and 12-Month Mortality After Unprotected Left Main Stem PCI: An Analysis From the British Cardiovascular Intervention Society Database. JACC Cardiovasc Interv. 2020;13:346-357.
32. Mc Inerney A, Escaned J, Gonzalo N. Online Co-Registration Of IVUS and OCT. Minerva Cardiol Angiol. 2021;69:641-654.
33. Pu J, Mintz GS, Biro S, et al. Insights into echo-attenuated plaques, echolucent plaques, and plaques with spotty calcification: novel findings from comparisons among intravascular ultrasound, near-infrared spectroscopy, and pathological histology in 2,294 human coronary artery segments. J Am Coll Cardiol. 2014;63:2220-2233.
34. Kim SW, Mintz GS, Lee WS, et al. DICOM-based intravascular ultrasound signal intensity analysis: an Echoplaque Medical Imaging Bench study. Coron Artery Dis. 2014;25:236-241.
35. Mintz GS. Intravascular imaging of coronary calcification and its clinical implications. JACC Cardiovasc Imaging. 2015;8:461-471.
36. Zhang M, Matsumura M, Usui E, et al. Intravascular Ultrasound-Derived Calcium Score to Predict Stent Expansion in Severely Calcified Lesions. Circ Cardiovasc Interv. 2021;14:e010296.
37. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
38. Ali Z, Price M, Maehara A, Lansky A. New Insights on the Consistency of Coronary IVL Data. Proceedings of Transcatheter Cardiovascular Therapeutics; 2021 05/11/2021. Disponible en: https://tct2021.crfconnect.com/ondemand/world-connect/86455. Consultado 12 Dic 2021.
39. Matsukawa R, Kozai T, Tokutome M, et al. Plaque modification using a cutting balloon is more effective for stenting of heavily calcified lesion than other scoring balloons. Cardiovasc Interv Ther. 2019;34:325-334.
40. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. Circ Cardiovasc Interv. 2018;11:e007415.
41. Tang Z, Bai J, Su SP, et al. Aggressive plaque modification with rotational atherectomy and cutting balloon for optimal stent expansion in calcified lesions. J Geriatr Cardiol. 2016;13:984-991.
42. Amemiya K, Yamamoto MH, Maehara A, et al. Effect of cutting balloon after rotational atherectomy in severely calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019;94:936-944.
43. Secco GG, Buettner A, Parisi R, et al. Clinical Experience with Very High-Pressure Dilatation for Resistant Coronary Lesions. Cardiovasc Revasc Med. 2019;20:1083-1087.
44. Rheude T, Rai H, Richardt G, et al. Super high-pressure balloon versus scoring balloon to prepare severely calcified coronary lesions: the ISAR-CALC randomised trial. EuroIntervention. 2021;17:481-488.
45. Kereiakes DJ, Virmani R, Hokama JY, et al. Principles of Intravascular Lithotripsy for Calcific Plaque Modification. JACC Cardiovasc Interv. 2021;14:1275-1292.
46. Kereiakes DJ, Di Mario C, Riley RF, et al. Intravascular Lithotripsy for Treatment of Calcified Coronary Lesions: Patient-Level Pooled Analysis of the Disrupt CAD Studies. JACC Cardiovasc Interv. 2021;14:1337-1348.
47. Blachutzik F, Honton B, Escaned J, et al. Safety and effectiveness of coronary intravascular lithotripsy in eccentric calcified coronary lesions: a patient-level pooled analysis from the Disrupt CAD I and CAD II Studies. Clin Res Cardiol. 2021;110:228-236.
48. Salazar C, Escaned J, Tirado G, Gonzalo N. Intravascular lithotripsy for recurrent restenosis caused by severe calcific neoatherosclerosis. EuroIntervention. 2020;16:e351-e352.
49. Salazar C, Escaned J, Tirado G, Gonzalo N. Undilatable Calcific Coronary Stenosis Causing Stent Underexpansion and Late Stent Thrombosis: A Complex Scenario Successfully Managed With Intravascular Lithotripsy. JACC Cardiovasc Interv. 2019;12:1510-1512.
50. Yeoh J, Cottens D, Cosgrove C, et al. Management of stent underexpansion using intravascular lithotripsy-Defining the utility of a novel device. Catheter Cardiovasc Interv. 2021;97:22-29.
51. Ali ZA, McEntegart M, Hill JM, Spratt JC. Intravascular lithotripsy for treatment of stent underexpansion secondary to severe coronary calcification. Eur Heart J. 2020;41:485-486.
52. Abdel-Wahab M, Richardt G, Joachim Buttner H, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6:10-19.
53. de Waha S, Allali A, Buttner HJ, et al. Rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: Two-year clinical outcome of the randomized ROTAXUS trial. Catheter Cardiovasc Interv. 2016;87:691-700.
54. Hemetsberger R, Gori T, Toelg R, et al. Optical Coherence Tomography Assessment in Patients Treated With Rotational Atherectomy Versus Modified Balloons: PREPARE-CALC OCT. Circ Cardiovasc Interv. 2021;14:e009819.
55. Kaur N, Pruthvi CR, Sharma Y, Gupta H. Rotatripsy: synergistic effects of complementary technologies: a case report. Eur Heart J Case Rep. 2021;5:ytab083.
56. Gonzálvez-García A, Jiménez-Valero S, Galeote G, et al. “RotaTripsy: Combination of rotational atherectomy and intravascular lithotripsy in heavily calcified coronary lesions: A case series”. Cardiovasc Revasc Med. 2022;35:179-184.
57. Parikh K, Chandra P, Choksi N, Khanna P, Chambers J. Safety and feasibility of orbital atherectomy for the treatment of calcified coronary lesions: the ORBIT I trial. Catheter Cardiovasc Interv. 2013;81:1134-1139.
58. Chambers JW, Feldman RL, Himmelstein SI, et al. Pivotal trial to evaluate the safety and efficacy of the orbital atherectomy system in treating de novo, severely calcified coronary lesions (ORBIT II). JACC Cardiovasc Interv. 2014;7:510-518.
59. Lee M, Genereux P, Shlofmitz R, et al. Orbital atherectomy for treating de novo, severely calcified coronary lesions: 3-year results of the pivotal ORBIT II trial. Cardiovasc Revasc Med. 2017;18:261-264.
60. Redfors B, Sharma SK, Saito S, et al. Novel Micro Crown Orbital Atherectomy for Severe Lesion Calcification: Coronary Orbital Atherectomy System Study (COAST). Circ Cardiovasc Interv. 2020;13:e008993.
61. Kini AS, Vengrenyuk Y, Pena J, et al. Optical coherence tomography assessment of the mechanistic effects of rotational and orbital atherectomy in severely calcified coronary lesions. Catheter Cardiovasc Interv. 2015;86:1024-1032.
62. Goel S, Pasam RT, Chava S, et al. Orbital atherectomy versus rotational atherectomy: A systematic review and meta-analysis. Int J Cardiol. 2020;303:16-21.
63. Bilodeau L, Fretz EB, Taeymans Y, et al. Novel use of a high-energy excimer laser catheter for calcified and complex coronary artery lesions. Catheter Cardiovasc Interv. 2004;62:155-161.
64. Ojeda S, Azzalini L, Suarez de Lezo J, et al. Excimer laser coronary atherectomy for uncrossable coronary lesions. A multicenter registry. Catheter Cardiovasc Interv. 2021;98:1241-1249.
65. Lee T, Shlofmitz RA, Song L, et al. The effectiveness of excimer laser angioplasty to treat coronary in-stent restenosis with peri-stent calcium as assessed by optical coherence tomography. EuroIntervention. 2019;15:e279-e288.

RESUMEN
La coronariografía es el método de elección para el estudio de la anatomía coronaria en la práctica clínica diaria. Las diferentes modalidades de imagen intracoronaria permiten valorar en tiempo real la anatomía de la pared arterial coronaria. Sobre esta base, la tomografía de coherencia óptica y la ecografía intravascular tienen un impacto positivo en el diagnóstico y en el intervencionismo percutáneo. La presente revisión proporciona un resumen de las técnicas de imagen intracoronaria basadas en la evidencia actual disponible.
Palabras clave: Ecografía intravascular. Tomografía de coherencia óptica. Coronariografía.
ABSTRACT
Invasive coronary angiography is the standard approach in the routine clinical practice. Intracoronary imaging modalities provide real-time images of intracoronary anatomy. On this basis, optical coherence tomography and intravascular ultrasound have a positive impact on diagnosis and percutaneous coronary intervention. This summary pro e imaging modalities for the interventional and clinical cardiologist with the currently available evidence.
Keywords: Intravascular ultrasound. Optical coherence tomography. Invasive coronary angiography.
Abreviaturas
ETCI: enfermedad de tronco común izquierdo. ICP: intervención coronaria percutánea. IIC: imágenes intracoronarias. IVUS: ecocardiografía intravascular. MACE: eventos adversos cardiovasculares mayores. OCT: tomografía de coherencia óptica. OTC: oclusión coronaria total crónica.
INTRODUCCIÓN
La enfermedad coronaria sigue siendo la principal causa de muerte en todo el mundo y tiene un amplio abanico de presentación dada su naturaleza dinámica1. La coronariografía es el patrón oro que se emplea para evaluar la presencia y gravedad de la enfermedad coronaria. Se ve, no obstante, limitada por la valoración cualitativa, si bien se han hecho avances en este sentido como, por ejemplo, la coronariografía cuantitativa2. Durante las últimas décadas se han desarrollado nuevas técnicas de imágenes de evaluación coronaria para mejorar los resultados clínicos de los pacientes3.
Las imágenes intracoronarias (IIC) no solo proporcionan información detallada sobre aquellos aspectos que contribuyen a la patogénesis de la enfermedad coronaria, sino que también ayudan a guiar el proceso de toma de decisiones. Tanto la ecocardiografía intravascular (IVUS) como la tomografía de coherencia óptica (OCT) generan imágenes transversales de las coronarias a tiempo real. Datos de estudios clínicos sugieren mejores resultados cuando las intervenciones coronarias percutáneas (ICP) complejas se realizan guiadas por IIC4,5. Las guías de práctica clínica europeas y norteamericanas sobre la revascularización miocárdica le asignan una recomendación clase II (American College of Cardiology/American Heart Association: clase IIa6 y Sociedad Europea de Cardiología: clase IIa) a la ICP guiada por IVUS7, siendo la ICP guiada por OCT una alternativa salvo en casos de enfermedad de tronco común izquierdo ostial6,7. Su uso, no obstante, no se ha extendido por igual en todo el mundo.
La presente revisión pretende resumir la evidencia actualmente disponible mediante una descripción de todas las posibles ventajas y desventajas de ambas técnicas de imágenes basadas en catéter en la práctica clínica habitual.
TÉCNICAS DE IMÁGENES
IVUS
Los catéteres IVUS son de intercambio rápido y constan de un cristal piezoeléctrico que genera ondas de sonido a través de transductores cuando se excita eléctricamente. Las ondas de sonido se propagan por los diferentes tejidos y se reflejan en las superficies en función de las propiedades acústicas del tejido en cuestión. Las ondas de choche que retornan se formatean en imágenes a escala de grises con resolución mediante contraste dinámico. Esta técnica de imágenes permite al cardiólogo intervencionista evaluar la integridad de la pared vascular, caracterizar la composición de los tejidos y abordar cualquier problema que pudiera presentarse durante la ICP (como por ejemplo la mala aposición e infraexpansión del stent)8.
La calidad de las imágenes depende de la onda de sonido y del transductor, así como de las propiedades de los tejidos. La resolución de las imágenes resultantes es mayor a distancias más cortas (campo cercano), aunque no es tan clara en campos profundos (campo lejano) por la dispersión de los rayos. Las propiedades del flujo también hacen que sea más difícil distinguir la luz de los tejidos. Tanto los catéteres mecánicos como los rotacionales tra-bajan a frecuencias de entre 40 y 60 MHz, a diferencia de los electrónicos, que trabajan a 20 MHz y tienen más resolución axial y lateral. En líneas generales, las mejores imágenes se obtienen cuando el catéter es coaxial al vaso, el rayo es perpendicular a la lesión y las luces son más nítidas8,9.
La adquisición de imágenes IVUS se debe llevar a cabo de forma rutinaria con anticoagulación IV y nitratos intracoronarios para evitar complicaciones asociadas al dispositivo5. La interrogación de los vasos se puede realizar mediante pullbacks manuales o automáticos empezando, como mínimo, a 10 mm en sentido distal a la lesión diana hasta que pueda verse la aorta o el catéter guía. En el caso de lesiones aortoostiales, el catéter guía se debe retirar para desenmascarar lesiones ostiales. Los pullbacks automáticos tienen la ventaja de proporcionar mediciones de la longitud de la lesiones, que se calcula a partir del tiempo medio y de la velocidad del pullback. Se consideran lesiones múltiples aquellas en las que la distancia es > 5 mm dentro del mismo segmento coronario. No obstante, la orientación espacial es una limitación muy importante8,9. Las características principales se muestran en la tabla 1 y tabla 2.
Tabla 1. Características generales de las técnicas de imágenes intracoronarias
| Técnica de imágenes intracoronarias | Fuente de las imágenes | Frecuencia (Mhz) | Longitud de onda (µm) | Catéter guía mínimo (Fr) | Resolución axial (µm) | Resolución lateral (µm) | Penetración en los tejidos (mm) | Longitud del pullback (mm) | Velocidad del pullback (mm/seg) |
|---|---|---|---|---|---|---|---|---|---|
| IVUSa | Ecografía | 20-60 | 40-50 | 5 | 20-170 | 50-260 | 3-8 | 100 | 0,5-10 |
| OCTb | Luz infrarroja | NA | 1,3 | 5 | 15-20 | 20-40 | 1-3 | 75 | 10-40 |
| Híbrido (OCT/IVUS)c | Ecografía y luz infrarroja | 40 | 1,3 | 5 | 200/15 | 200/30 | 3-8 | 100-150 | 0,5-40 |
|
IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica; NA: no aplicable. a Incluye OptiCross (Boston Scientific, Estados Unidos), Volcano (Philips, Estados Unidos), Infraredx (Burlington, Estados Unidos), ACIST Cvi (ACIST, Estados Unidos) y Fastview (Terumo, Japón). b Incluye OPTIS (Abbott Vascular, Estados Unidos) y Lunawave (Terumo, Japón). c Incluye Novasight Hybrid (Conavi Medical, Canadá) y Dual Sensor (Terumo, Japón). |
|||||||||
Tabla 2. Principales ventajas y desventajas de las técnicas de imágenes intracoronarias
| Ecocardiografía intravascular | Ecocardiografía intravascular |
|---|---|
| • Más capacidad de penetración y de valoración del volumen de placa y placas más profundas • Más apta para ser usada en CTO, unión aortoostial, ETCI y dimensionamiento del stent • No require contraste | • Mayor resolución, menos artefactos y facilita la identificación de detalles sutiles • Uso más sencillo • Capaz de valorar el grosor del calcio • Más apta para la valoración de struts y trombos |
| • Menor resolución • Require anticoagulación y tiempo adicional • La interpretación de las imágenes require experiencia y conocimientos • No es capaz de penetrar el calcio ni de valorar los trombos adecuadamente • Cara | • Menor capacidad de penetración; no apta para la evaluación de lesiones ostiales • Requiere anticoagulación y tiempo extra • La adquisición de imágenes precisa aclaramiento sanguíneo mediante contraste u otro medios • La interpretación de las imágenes requiere experiencia y conocimientos • Cara |
|
OTC: oclusiones coronarias totales crónicas; ETCI: enfermedad de tronco común izquierdo. |
|
Durante los últimos años, se han descrito los esfuerzos que se han ido haciendo por explorar los posibles beneficios de IVUS sobre coronariografía con resultados prometedores. En un reciente metanálisis de 27.610 pacientes que comparó ICP guiadas por IVUS o por coronariografía, la IVUS se asoció a menos mortalidad cardiovascular (cociente de tasas de incidencia [RR], 0,63; intervalo de confianza del 95% [IC95%], 0,54–0,73) y complicaciones asociadas a la ICP. El riesgo de infarto de miocardio (RR = 0,71; IC95%, 0,58–0,86), revascularización de la lesión diana (RR = 0,81; IC95%, 0,70–0,94) y trombosis intratent (RR = 0,57; IC95%, 0,41–0,79), también fue menor en las ICP guiadas por IVUS10.
Tomografía de coherencia óptica
La OCT genera imágenes mediante luz infrarroja (longitud de onda, 1,3 μm). Comparada con la IVUS, esta técnica de imágenes ofrece mayor resolución axial (10-20 frente a 50-150 μm) pero con una penetración limitada en los tejidos blandos (1-2 frente a 5-6 mm salvo para la evaluación del calcio)3,4,11.
Los dispositivos actuales son compatibles con 5 Fr a través de un sistema de intercambio rápido que, también, permite pullbacks automáticos con corregistro de imágenes de angiografía y mediciones automáticas de la luz y detección del calcio. La calidad de las imágenes depende de la interacción de la luz con los tejidos circundantes (demora en el tiempo de eco). Como tal, la reflexión, refracción y atenuación de la luz (absorción) determinan la resolución final de las imágenes. Tanto los dispositivos metálicos como las placas fibróticas se consideran potentes reflectores en contraposición al calcio y a los núcleos necróticos que se consideran malos reflectores (ricos en lípidos). Los glóbulos rojos provocan la dispersión de la luz que requiere el lavado del contraste, lo cual provoca la aparición de una imagen de «seudotrombo» con mal aclaramiento sanguíneo.
Las imágenes de OCT también se suelen obtener mediante la administración de anticoagulación IV y nitratos intracoronarios para evitar complicaciones. El estudio de los vasos se inicia a 10 mm en sentido distal a la lesión diana, se purga el catéter con contraste y, después se hace un pullback automático con corregistro (si está disponible). La velocidad media del pullback de 10-40 mm/s normalmente permite administrar 1 único bolo de contraste para conseguir un entorno libre de sangre12. Las características generales de la OCT se muestran en la tabla 1 y tabla 2.
Comparada con la ICP guiada por coronariografía, estudios observacionales han sugerido un posible beneficio de la ICP guiada por OCT, con incidencias más bajas de eventos cardiovasculares adversos mayores (MACE) y complicaciones asociadas al stent13. Además, la OCT proporciona imágenes más fiables y reproducibles, con menor variabilidad interobservador que la IVUS. En este sentido, la OCT sería superior a la hora de valorar el stent y los diámetros de la luz14,15.
ESCENARIOS ESPECÍFICOS
Síndromes coronarios agudos
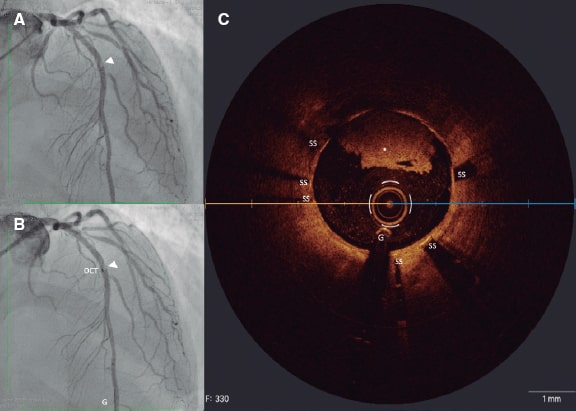
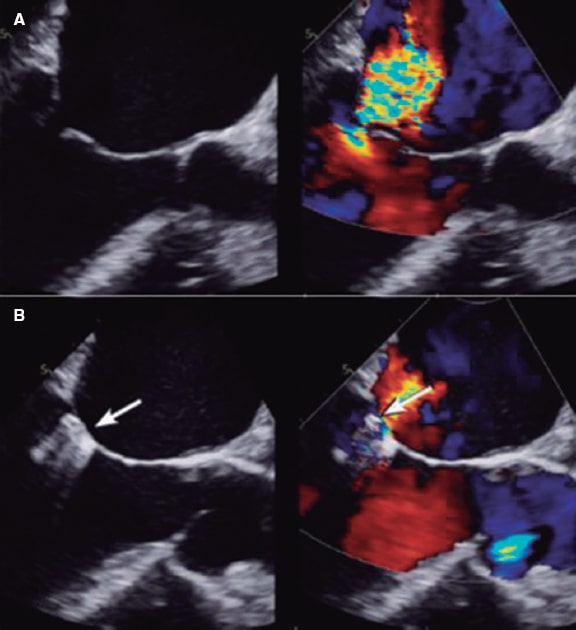
Los síndromes coronarios agudos se suelen deber a trombosis coronarias provocadas por la rotura o erosión de la placa o la presencia de un nódulo calcificado eruptivo16. Hacer un diagnóstico preciso puede llegar a tener implicaciones pronósticas. La rotura de la placa se asocia a una incidencia más alta de ausencia de flujo miocárdico y embolización distal. La erosión de la placa se puede tratar de modo conservador ante la presencia de estenosis no críticas. Los nódulos calcificados se asocian a una incidencia más alta de reestenosis y trombosis intrastent17 (figura 1).
Figura 1. Trombosis intrastent. A: defecto de llenado (cabeza de flecha) en el segmento medio de la descendente anterior en el plano oblícuo anterior derecho. B: co-registro de tomografía de coherencia óptica y angiografía. C: imagen transversal mediante OCT de una trombosis intrastent no oclusiva (asterisco blanco). G: guía; OCT: tomografía de coherencia óptica; SS: struts del stent.
La OCT se suele usar para la identificación perioperatoria de le-siones culpables tras una meticulosa evaluación de las características morfológicas del casquete fibroso18. El algoritmo de clasificación de placas mediante OCT las clasifica según el estado de los casquetes fibrosos: intacto en presencia de erosión de la placa y alterado en presencia de placas rotas o nódulos calcificados. La OCT también se usa para determinar la carga trombótica sin tener que establecer cuál es la lesión culpable. No obstante, una reciente publicación que comparó la espectroscopia de infarrojo cercano con IVUS y OCT en 276 pacientes confirmó que la primera es capaz de caracterizar de forma precisa las lesiones culpables tras haber hecho lo propio con el calcio, la cavidad de la placa y el índice máximo de carga del núcleo lipídico, con una sensibilidad y especificidad del 93 y 100%, respectivamente19.
Además, los datos avalan la preferencia de la ICP guiada por IIC para mejorar los resultados en el tratamiento del síndrome coronario agudo. Un metanálisis de 26.610 pacientes comunicó un beneficio neto derivado del uso de IVUS con independencia de la presencia de síndrome coronario agudo y una incidencia más baja de MACE (RR = 0,57; IC95%, 0,41-0,79) frente a la ICP guiada por coronariografía10. Asimismo, un registro observacional coreano de 11.731 pacientes en tratamiento con ICP primaria comunicó una menor incidencia de mortalidad cardiovascular, reinfarto del vaso diana y revascularización de la lesión diana con la intervención guiada tanto por IVUS como por OCT20.
Lesiones coronarias en bifurcación
Las lesiones coronarias en bifurcación se dan entre el 15 y el 20% de todos los pacientes tratados con ICP21. El principal reto en el tratamiento de lesiones coronarias en bifurcación es seleccionar la estrategia ICP adecuada para evitar el fracaso de la lesión diana o la oclusión de ramas laterales. La importancia de realizar una evaluación exhaustiva resulta evidente con la enfermedad de tronco común izquierdo (ETCI) distal. El European Bifurcation Club recomienda el uso de imágenes intracoronarias para tratar lesiones bifurcadas22.
El riesgo de compromiso de las ramas laterales puede minimizarse tanto con la IVUS como con la OCT con solo seleccionar el stent adecuado (tipo y tamaño), la zona de anclaje y evaluar los resultados post-ICP (expansión y aposición del stent; disección distal). Las imágenes intracoronarias pueden identificar carinas «puntiagudas» en casos de ETCI distal, lo cual se asocia a reestenosis secundarias al desplazamiento de la carina. También se han descrito otros predictores del compromiso de ramas laterales con IVUS (área luminal mínima de las ramas laterales y carga de placa)19 y OCT (ángulos < 50º y longitudes punto en rama hasta punta de carina < 1,70 mm)23.
Además, las 2 técnicas de imágenes se pueden emplear para estimar el tamaño del stent en lesiones bifurcadas; no obstante, se recomienda evitar que las zonas de anclaje sean áreas con alta carga de placa o placas lipídicas en las que ambas técnicas son útiles. En líneas generales, las IIC también resultan útiles para tratar bifurcaciones con ICP porque ayudan a comprobar la entrada de la guía en ramas laterales, la calcificación, la longitud de la lesión y las complicaciones posimplante de stent que podrían interferir en los resultados clínicos22. En la actualidad, hay 2 estudios en curso que están analizando el papel de la OCT en pacientes con lesiones en bifurcación (NCT03171311; NCT03507777).
Calcificación coronaria
La calcificación coronaria aumenta la complejidad de la ICP dificultando el despliegue, expansión y aposición del stent, lo cual a su vez aumenta el riesgo de trombosis y reestenosis del stent.24 La coronariografía es capaz de detectar, con una sensibilidad entre baja y moderada, la presencia de calcificación coronaria siendo visibles los casos graves sin movimiento cardiaco ni inyección de contraste25.
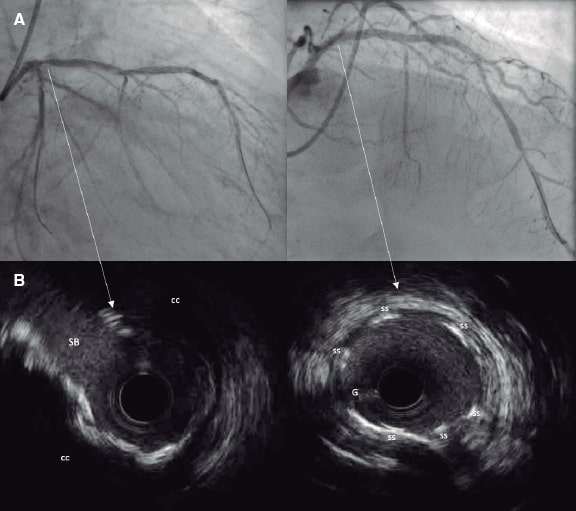
Las placas calcificadas se muestran como estructuras hiperecoicas con una sombra acústica característica en la IVUS (figura 2)8. Con la IVUS se puede hacer una evaluación cuantitativa (ángulo y longitud), semicuantitativa (ausente o distribuida en cuadrantes) y cualitativa (profundidad de la sombra acústica según el grosor de la placa y la íntima media) de la calcificación coronaria25. Un estudio que comparó IVUS y coronariografía en 67 lesiones de oclusiones coronarias totales crónicas (OTC) descubrió que la IVUS fue superior en la identificación de los depósitos de calcio (96 frente al 61%)26. Aunque la IVUS no puede evaluar las microcalcificaciones (> 5 μm) sí puede calcular la profundidad o el grosor de los depósitos de calcio25.
Figura 2. Imágenes mediante coronariografía (A) y ecocardiografía intravascular (B) de descendente anterior ostial con presencia de calcificación coronaria concéntrica grave. Los paneles C y D muestran los resultados inmediatos tras el implante definitivo del stent. CC: calcificación concéntrica; G: guía; SS: struts del stent.
En la OCT, la calcificación aparece como una estructura heterogénea con bordes bien definidos, algo que podría usarse para compensar alguna de las limitaciones de la IVUS. Aunque la OCT penetra menos en los tejidos25, la evaluación que hace del grosor, área y volumen del calcio es más precisa y fiable27.
El análisis de las IIC de las características del calcio resulta ilustrativo para poder hacer una planificación eficiente y evitar la infraexpansión o mala aposición del stent28,29. Por tanto, circunferencias de calcio > 180º, grosores > 0,5 mm o longitudes > 5 mm en las IIC deben recibir tratamientos adyuvantes de modificación de la placa30. El análisis OCT de 31 pacientes del estudio Disrupt CAD reveló que las características del calcio fueron el principal mecanismo de acción de la litotripsia coronaria observándose una tendencia hacia una expansión más adecuada del stent31. Se observaron resultados parecidos con la aterectomía rotacional en un estudio que analizó 88 lesiones calcificadas con ambas técnicas de IIC y que confirmó que la aterectomía rotacional guiada por OCT tuvo menores expansiones del stent (83 frente a 72%; p = 0,0004) con índices similares de supervivencia al año de seguimiento32. No obstante, la IVUS podría ser de ayuda durante una ICP en el tratamiento de la enfermedad del tronco común izquierdo33, donde una primera valoración ayuda a identificar cuál debería ser la técnica óptima de modificación de la placa que debería emplearse34.
Lesiones de oclusión coronaria total crónica
La prevalencia de las OTC es del 20% en pacientes con enfermedad coronaria. Realizar una ICP en una OTC puede mejorar los síntomas, la capacidad de hacer ejercicio y la calidad de vida de los pacientes35. El índice de éxito de intervenciones realizadas en OTC está entre el 70 y 90%. No obstante, cuanto mejor sea la planificación, mejores resultados podrán alcanzarse36,37.
La IVUS proporciona una forma adecuada y más eficaz de evaluar las características de la OTC (ambigüedad del casquete, longitud de la lesión y calcificación) lo cual permite reentradas óptimas a la luz verdadera mediante abordaje anterógrado y retrógrado38. Los estudios que han comparado IVUS frente a coronariografía en ICP realizadas en OTC ofrecen resultados contradictorios en lo que a la incidencia de MACE se refiere (tabla 3)39-41. Además, la IVUS ha demostrado ser capaz de predecir la reestenosis en ICP realizadas en OTC en las que diámetros luminales mínimos tras la intervención de ≤ 2,4 mm e índices de expansión del stent del ≤ 70% fueron predictores independientes de reestenosis post-ICP en el seguimiento a medio plazo, sobre todo, en OTC complejas42. Una de las principales limitaciones de las ICP guiadas por IVUS y realizadas en OTC son los artefactos que provoca la renderización del calcio que complican la interpretación de las imágenes38.
Tabla 3. Coronariografía invasiva frente a imágenes intracoronarias para realizar intervenciones coronarias percutáneas en oclusiones coronarias totales crónicas
| Referencia | Tipo de estudio | IVUS frente a C (n) | Objetivo primario | Objetivos secundarios |
|---|---|---|---|---|
| Tian et al.39 | ECA prospectivo | 130 frente a 130 | Pérdida luminal tardía intrastent | • Incidencia de la reestenosis intrastent (3,9 frente al 13,7%; p = 0,021) • Incidencia de eventos adversos a los 2 años (21,7 frente al 25,2%; p = 0,641) |
| Hong et al.40 | Retrospectivo | 206 frente a 328 | Trombosis intrastent | • Incidencia similar de MACE en la cohorte emparejada • Menos trombosis intrastent en ICP guiadas por IVUS (0 frente al 3%; p = 0,015) |
| Kim et al.41 | ECA | 201 frente a 201 | Mortalidad cardiovascular | • Menos MACE (HR = 0,35; IC95%, 0,13–0,97) y trombosis intrastent (0 frente al 1,5%; p = 0,11) en ICP guiadas por IVUS |
|
C: coronariografía; ECA: ensayo controlado aleatorizado; ICP: intervención coronaria percutánea; IVUS: ecocardiografía intravascular; MACE: eventos cardiovasculares adversos mayores. |
||||
El principal obstáculo de las OCT empleadas para guiar la ICP que se realizan en OTC es la necesidad de lavado de contraste y la propagación de las disecciones debido a la necesidad de aclaramiento sanguíneo, razón por la cual se ha considerado una técnica de imágenes poco apropiada. No obstante, esta técnica de imágenes sí podría emplearse en la optimización de la ICP de OTC y monitorizaciones durante el seguimiento. Un estudio retrospectivo confirmó un índice más alto de mala aposición del stent y struts no cubiertos a los 6 meses tras estudios OCT realizados en pacientes con ICP exitosas realizadas en OTC43. El registro ALSTER-OCT-OTC obtuvo resultados similares tras analizar 111 lesiones mediante OCT confirmando un mayor índice de struts del stent mal apuestos y sin cubrir en OTC que aquellas sin OTC tras 12 meses de seguimiento44.
Aneurismas coronarios
Los aneurismas coronarios suelen ser silentes, a nivel clínico, y se suelen identificar en el 5% de todos los pacientes sometidos a coronariografía. Las causas más frecuentes son la aterosclerosis en adultos y la enfermedad de Kawasaki en niños. El aneurisma coronario se define como una dilatación focal de, al menos, > 1,5 veces la coronaria normal adyacente. Por otro lado, la dilatación difusa se considera ectasia coronaria. A nivel morfológico, si se analizan desde su diámetro máximo, pueden observarse aneurismas saculares y fusiformes teniendo los primeros un diámetro más transversal que longitudinal45.
Decir cuál es la técnica de IIC óptima sigue siendo un asunto controvertido. No obstante, tradicionalmente, la IVUS es el abordaje preferido para el análisis y seguimiento del aneurisma coronario en la enfermedad de Kawasaki. La mayor capacidad de penetración de la IVUS permite evaluar el diámetro del vaso. También distingue, de forma precisa, los falsos de los verdaderos aneurismas al identificar el abombamiento de 1 sola capa. Se recomienda llevar a cabo una planificación preoperatoria guiada por IVUS puesto que la coronariografía suele infradimensionar los aneurismas45.
Dionne et al. realizaron un análisis de aneurismas coronarios empleando la OCT en una población pediátrica con historia clínica de enfermedad de Kawasaki. La OCT demostró ser segura, ofreciendo hallazgos similares (hiperplasia intimal, fibrosis y disrupción de la lámina media) en lesiones aneurismáticas comparada con anteriores estudios histopatológicos. No obstante, estos hallazgos también se observaron en segmentos coronarios no aneurismáticos, lo cual explicaría el mayor riesgo de isquemia de pacientes con historia clínica de enfermedad de Kawasaki46.
Enfermedad de tronco común izquierdo
La prevalencia de la ETCI es del 4%. Tradicionalmente, la cirugía de revascularización coronaria ha sido el tratamiento estándar, pero cada vez hay más evidencias que avalan a la ICP47. Elegir la técnica de imágenes adecuada es importante para saber, de forma precisa, qué grado de importancia clínica tiene la ETCI. La coronariografía sigue siendo la técnica de evaluación por excelencia, si bien está sujeta a una variabilidad inter e intraobservador alta en lo que a la detección de lesiones intermedias se refiere (entre el 30 y el 70%)48. En consecuencia, las imágenes intracoronarias mejoran tanto la valoración de la ETCI como los resultados a largo plazo.
La importancia que tiene la IVUS en la evaluación de la anatomía de la ETCI es evidente por su mayor capacidad de penetración en los tejidos, lo cual permite evaluar mejor la placa. Estudios publicados (tabla 4) confirmaron la presencia de ETCI significativa con áreas luminales mínimas entre 6 y 9 mm2 calculadas mediante IVUS33,49 con valores < 6 mm2 mostrando una buena correlación con valores de la reserva fraccional de flujo < 0,7550. No obstante, se han descrito áreas más pequeñas en la población asiática51. Un estudio prospectivo y multicéntrico que evaluó la ETCI mediante IVUS confirmó una incidencia similar de eventos cardiovasculares a los 2 años en pacientes revascularizados con áreas luminales mínimas (ALM) < 6 mm2 (5,5%) y con ALM ≥ 6 mm2 (2,3%) con diferimiento de la revascularización33. Así pues, ETCI angiográficamente ambiguas con ALM > 6 mm2 según la IVUS pueden considerarse no isquémicas y aquellas con ALM ≤ 4,5 mm2, generadoras de isquemia. No obstante, en aquellas ETCI con ALM entre 4,5 y 6 mm2, se necesitan herramientas de evaluación invasivas o no invasivas para descartar la presencia de isquemia en curso52.
Tabla 4. Resumen de los estudios que evaluaron imágenes coronarias invasivas para valorar la enfermedad del tronco común izquierdo
| Referencia | Tipo de estudio | Uso de IIC | Tiempo de seguimiento | Resultados |
|---|---|---|---|---|
| De la Torre Hernandez et al.33 | Multicéntrico y prospectivo | IVUS | 2 años | Diferir ICP con ALM > 6 mm2 es seguro |
| Fassa et al.49 | Prospectivo | IVUS | 3 años | Diferir ICP con ALM ≥ 7,5 mm2 es seguro |
| Jasti et al.50 | Prospectivo | IVUS | 3 años | ALM < 5,9 mm2 está bien correlacionado con valores de FFR < 0,75 |
| Park et al.51 | Prospectivo | IVUS | NA | Valores de FFR < 0,8 mantuvieron una buena correlación con ALM ≤ 4,5 mm2 entre los asiáticos |
|
ALM: área luminal mínima; ICP: intervención coronaria percutánea; IIC: imágenes intracoronarias; IVUS: ecocardiografía intravascular. |
||||
Estudios publicados han demostrado que cargas de placa > 60% fuera del contexto de la ETCI son un predictor de MACE reconocible durante la valoración del riesgo de eventos futuros tras ICP4. Mediante análisis IVUS, se pudo observar que a mayor carga de placa en la ETCI, mayor carga de placa a nivel general en el árbol coronario53. No obstante, según el estudio PROSPECT, una mayor carga de placa no se asoció a una mayor incidencia de MACE a diferencia de la carga de placa generalizada (HR = 1,06; IC95%, 1,01–1,11; p = 0,02)54. Así pues, la evaluación de la carga de placa de la ETCI mediante IVUS es capaz de identificar a pacientes de alto riesgo con enfermedad aterosclerótica sin ETCI asociada.
El papel que juega la IVUS en la ETCI no se limita únicamente al diagnóstico (tabla 5)55-59. Un metanálisis que comparó ICP guiadas por IVUS o por coronariografía en la ETCI confirmó que las primeras se asociaron a menos mortalidad cardiovascular (RR = 0,47; IC95%, 0,33–0,66; p < 0,001), nueva revascularización de la lesión diana (RR = 0,43; IC95%, 0,25–0,73; p = 0,002) y trombosis del stent (RR = 0,28; IC95%, 0,12–0,67; p = 0,004)60. De la Torre Hernández et al. también se dieron cuenta de que las ICP guiadas por IVUS fueron especialmente útiles en lesiones distales con una menor incidencia de eventos que las ICP no guiadas por IVUS (HR = 0,54; IC95%, 0,34–0,90)56. Otros estudios han propuesto un papel para la IVUS en la optimización de la ETCI tras el despliegue del stent donde las áreas luminales mínimas se asociaron a la infraexpansión del stent, lo cual podría ser predictivo de reestenosis del stent con diferentes umbrales según el segmento evaluado (8 mm2 para el tronco común izquierdo proximal, 6 mm2 para el ostium coronario de la descendente anterior y 5 mm2 para el ostium coronario de la circunfleja izquierda)61.
Tabla 5. Resumen de los estudios que compararon intervenciones coronarias percutáneas guiadas por IVUS o coronariografía en el tratamiento de la enfermedad del tronco común izquierdo
| Referencia | Objetivos | Resultados |
|---|---|---|
| Park et al.55 | • El objetivo primario fue la mortalidad por cualquier causa • Los objetivos secundarios fueron IM, RVD y el objetivo compuesto primario | • La ICP guiada por IVUS se asoció a una menor incidencia de mortalidad global (HR = 0,31; IC95%, 0,19–0,51) e IM (HR = 0,470; IC95%, 0,33-0,67). • El riesgo de RVD (HR = 0,47; IC95%, 0,33-0,67) no se redujo con el guiado mediante IVUS |
| De la Torre Hernandez et al.56 | • El objetivo primario fue MACE (muerte cardiovascular, IM, RLD) • Los objetivos secundarios fueron la mortalidad por cualquier causa, la mortalidad cardiovascular, la supervivencia libre de infarto, la supervivencia libre de RLD y la incidencia de TS | • Menor incidencia de mortalidad por cualquier causa a los 3 años con la ICP guiada por IVUS (4,7 frente al 16%; p = 0,048) • La incidencia de TS con la ICP guiada por IVUS también fue menor (0,6 frente al 2,2%; p = 0,04) • La ICP guiada por IVUS para el tratamiento de la ETCI se asoció a eventos adversos menores en lesiones distales (HR = 0,34; IC95%, 0,34-0,90) y en la población general (HR = 0,70; IC95%, 0,52-0,99) |
| Gao et al.57 | • El objetivo primario fue la incidencia de MACE al cabo de 1 año (mortalidad cardiovascular, IM, RVD) • El resultado de seguridad fue la TS | • Menor incidencia a 1 año de MACE del grupo guiado por IVUS (14,8 frente al 27,7%) • La ICP guiada por coronariografía se asoció a una menor incidencia de TS (2,7 frente al 0,6%; p = 0,026) |
| Tan et al.58 | • Incidencia de MACE a los 2 años (muerte, IM o RLD) | • Se observó una incidencia similar de eventos asociados a la RS (3,28% frente a 8,15%; P = 0,11) y a la TS (1,6 frente al 3,2%; p = 0,568) • La ICP guiada por IVUS se asoció a una menor incidencia de MACE (OR = 0,414; IC95%, 0,129-0,867) y RLD (8,2 frente a 19%; p = 0,045) |
| Andell et al.59 | • El objetivo primario fue un compuesto de mortalidad por cualquier causa, RS y TS) • Los objetivos secundarios fueron mortalidad por cualquier causa, RS, TS y mortalidad inexplicada a los 30 días | • El grupo IVUS se asoció a menos objetivos compuesto (HR = 0,65; IC95%, 0,50–0,84) y a una menor incidencia de la mortalidad por cualquier causa (HR = 0,62; IC95%, 0,47–0,82) • No se observaron diferencias en la incidencia de TS y RS |
|
95%IC: intervalo de confianza del 95%; ETCI: enfermedad de tronco común izquierdo; HR: hazard ratio; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecocardiografía intravascular; MACE: eventos cardiovasculares adversos mayores; OR: odds ratio; RLD: revascularización de la lesión diana; RS: reestenosis del stent; RVD: revascularización del vaso diana; TS: trombosis del stent. |
||
Por el contrario, la utilidad de la OCT valorando la ETCI es limitada dado su diámetro medio (de 3 a 5 mm) e incapacidad para evaluar lesiones aortoostiales en las que los campos libres de sangre son difíciles de alcanzar48. Recientemente, un estudio retrospectivo y multicéntrico (ROCK cohort II) ha confirmado una incidencia de fracaso de la lesión diana en ICP distales guiadas por imágenes intravasculares o angiográficas para tratar el TC (12,7 frente al 21,2%; p = 0,039) con resultados parecidos entre la OCT y la IVUS (p = 0,26)62. No obstante, se esperan futuros datos prospectivos que avalen las ICP guiadas por OCT y que definan mejor cuál ha de ser el tratamiento clínico óptimo de pacientes con ETCI (NCT04248777, NCT04391413, NCT03474432, NCT03820492 y NCT04531007).
Disecciones coronarias espontáneas
La disección coronaria espontánea es una patología amenazante para la vida infradiagnosticada que se puede dar en sujetos, en principio, sanos. El flujo coronario se ve comprometido tras el despliegue de una luz falsa mediante un mecanismo «de dentro a fuera» o «de fuera a dentro». La clasificación de Yip-Saw ha puesto de manifiesto las limitaciones de la coronariografía. El diagnóstico resulta especialmente complicado con disecciones coronarias espontáneas tipos 2 (estenosis lisa y difusa) y 3 (que imita a una estenosis ateroesclerótica)63,64.
Los beneficios de implementar IIC (tabla 6) en el diagnóstico o para guiar las intervenciones coronarias en el tratamiento de disecciones coronarias espontáneas son que ofrecen una mayor resolución65,66. La IVUS tiene mayor capacidad de penetración para visualizar la pared vascular y los hematomas intramurales y se recomienda para disecciones proximales8. También distingue entre luces verdaderas y falsas si se fusiona con interpolación cromática. Sin embargo, la OCT es más sensible a la hora de identificar señales sutiles tales como roturas intimales (roturas en la puerta de entrada a la luz falsa). De hecho, Ribero et al. la emplearon para establecer el mecanismo subyacente de la disección coronaria67.
Tabla 6. Beneficios de las técnicas de imágenes intravasculares para el abordaje de las disecciones coronarias espontáneas
| IVUS | OCT |
|---|---|
| Hematoma intramural (visualización completa de la pared vascular) | Caracterización detallada del flap intimal (disrupción de la íntima y de la media) |
| Luz verdadera y falsa (con IVUS y ChromaFlo*) | Conexión entre luz verdadera-falsa (rotura en puerta de entrada) |
| Trombosis de la luz falsa | Compromiso de ramas laterales y/o trombo |
| Posición de la guía | Posición de la guía |
|
IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica. * Chromaflo Volcano (Phillips, Estados Unidos). |
|
Si durante el tratamiento de una disección coronaria espontánea se considera necesario realizar IIC, es importante reconocer que existe un riesgo de complicaciones operatorias (tales como disecciones con inyección de contraste durante la OCT, sobre todo en disecciones espontáneas tipo I o que acarrean oclusiones vasculares). Un estudio de 28 pacientes con disecciones coronarias espontáneas descubrió que realizar valoraciones mediante imágenes intracoronarias se asoció a disecciones iatrogénicas por la guía (3,5%) y del catéter guía (3,5%), así como a propagación por reposicionamiento de las guías (10,7%) o por el avance del catéter OCT (3,5%)68. Por lo tanto, el beneficio podría ser mayor en casos de incertidumbre diagnóstica o con disecciones complejas que precisan ICP.
Vasculopatía del injerto cardiaco
La presentación clínica de la vasculopatía del injerto cardiaco (VIC) suele ser silente. Aún así, se caracteriza por una displasia fibromuscular difusa concéntrica y agresiva. La International Society for Heart and Lung Transplantation clasifica la vasculopatía del injerto en 4 categorías según la función del injerto y los hallazgos angiográficos teniendo la VIC2 y VIC3 el peor pronóstico de todos69. La VIC Se considera la técnica patrón oro para un despistaje rutinario y diagnóstico definitivo.
Los pacientes trasplantados de corazón pueden presentar engrosamiento intimal identificable, solo, a través de una IVUS. Estudios publicados han informado que un engrosamiento intimal > 0,5 mm con respecto a los valores basales se asoció a una mayor incidencia de eventos adversos durante el primer año tras el trasplante car-
diaco70,71. De acuerdo con estos hallazgos, estudios volumétricos con IVUS han revelado que la combinación de engrosamiento intimal más el remodelado negativo de la descendente anterior proximal se asociaron a rechazos agudos y eventos adversos mayores al cabo de 1 año72. No obstante, con la OCT se pueden identificar las primeras fases del engrosamiento intimal en forma de hiperplasia intimal (grosor > 100 μm) y mejorar los resultados clínicos73.
Hallazgos tras el implante de stent
Ambas técnicas de imágenes se han empleado para identificar la infraexpansión, aposición incompleta y disección de los bordes del stent como posibles mecanismos causales del fracaso del stent.
A este respecto, el área mínima del stent (AMS) se asocia a la reestenosis y a la trombosis del stent. Estudios IVUS confirmaron AMS entre 5,3 y 5,7 mm2 con áreas más pequeñas identificadas en pacientes con reestenosis definitiva del stent a corto plazo tras el implante74,75. Asimismo, 2 estudios revelaron que AMS < 5 mm2 según la OCT se asociaron a una mayor incidencia de revascularización de la lesión diana y trombosis del stent con stents farmacoactivos76,77. Por el contrario, la permeabilidad del stent evaluada mediante OCT sugirió que valores > 4,5 mm2 se asociaban a una menor incidencia de MACE76 si bien la evaluación mediante IVUS sugirió valores de corte más altos para la ETCI proximal (> 8 mm2) y distal (> 7 mm2). De ahí que las guías de práctica clínica recomienden un AMS/luz media de referencia post-ICP > 80%.
Una serie de registros OCT observaron que el mecanismo principal habitual responsable de la formación de trombos precoz (de 1 a 30 días), tardía (de 1 a < 12 meses) y muy tardía (> 1 año) es la mala aposición (distancia axial > 0,4 mm con una extensión longitudinal > 1 mm) de los segmentos implantados de stent78-80. En consonancia con esto, la disección de los bordes del stent también se asoció a eventos adversos tal y como confirmó el estudio CLI-OICP II en el que las disecciones de los bordes distales del stent > 200 µm se asociaron a una mayor incidencia de MACE76.
SEGURIDAD
El desarrollo de técnicas de IIC ha traído consigo importantes mejoras a nivel clínico que, sin embargo, no están exentas de complicaciones operatorias (figura 3).
Figura 3. Hallazgos tras el implante de stent mediante tomografía de coherencia óptica: A: mala aposición del stent desde la posición de las 16 a las 19 en punto; B y D: disección de los bordes con flap (asterisco blanco) a nivel distal al stent farmacoactivo implantado; C: reestenosis intrastent (flecha blanca) secundaria a proliferación neointimal concéntrica; los struts del stent son visibles bajo una capa homogénea y brillante. AS: aposición de los struts; DB: disección de los bordes; DSMA: distancia del stent mal apuesto; G: guía; MAS: mala aposición de los struts; RIS: reestenosis intrastent; SS: struts del stent.
Los estudios de seguridad sobre IVUS hablan de una tasa estimada de complicaciones entre 1-3%, en su mayoría asociados al tamaño del catéter. El inconveniente de la coronariografía es que emplea materiales de contraste para mejorar la calidad de las imágenes con el consiguiente riesgo de nefropatía inducida por contraste81. A este respecto, un pequeño estudio retrospectivo de 37 pacientes con enfermedad renal avanzada que evaluó el perfil de seguridad de una ICP guiada por IVUS sin contraste no halló una mayor incidencia de terapia de reemplazo renal o MACE82. Se han hecho hallazgos similares en un estudio prospectivo y multicéntrico83, así como en un ensayo clínico aleatorizado controlado84. También se ha valorado el perfil de seguridad y la viabilidad de la OCT sin hallarse una mayor incidencia de MACE85, complicaciones operatorias ni daño renal agudo86. Además, los datos de 2 estudios prospectivos sugieren que la OCT con menos contraste sería una técnica de imagen viable87,88.
En estudios publicados que compararon diferentes técnicas de IIC (tabla 7), se han descrito incidencias similares de complicaciones89-91. Van der Sijde et al. llevaron a cabo un estudio prospectivo para comparar las complicaciones operatorias de ambas IIC y no hallaron una mayor incidencia de eventos durante la adquisición de imágenes. Tampoco identificaron ningún factor de riesgo potencial en lo referente a los eventos adversos mayores, lo cual sugiere que la seguridad y viabilidad de las IIC son mayores de lo esperado y no guardan relación con la experiencia del operador92.
Tabla 7. Resumen de los estudios que compararon IVUS con OCT y coronariografía para el guiado de ICP
| Referencia | Tipo de estudio | Técnica de IIC | Resultados |
|---|---|---|---|
| Ali et al.89 | ECA multicéntrico | OCT frente a IVUS frente a C | No se observaron diferencias en los MACEa operatorios descritos entre OCT (3%) e IVUS (1%; p = 0,37) y C (1%; p = 0,37) Incidencia similar de complicaciones operatorias |
| Habara et al.90 | ECA prospectivo | OCT frente a IVUS | Índice similar de tiempo operatorio (40 ± 16,4 min frente a 47 ± 17,6 min; p = 0,09) y de fluoroscopia (20,4 ± 8,4 min frente a 24,8 ± 10,4 min; p = 0,05) Incidencia similar de complicaciones operatorias, sin muertes (p > 0,99) |
| Kubo et al.91 | ECA multicéntrico y prospectivo | OCT frente a IVUS | Incidencia similar de mortalidad cardiovascular (0 frente al 0,2%; p = 0,99) y MACEb (2,9 frente al 3,5%; p = 0,81) No se observó nefropatía inducida por contraste, pero sí una incidencia parecida de complicaciones entre los grupos |
| Van der Sijde et al.92 | Prospectivo de un único centro | OCT frente a IVUS | Incidencia similar de eventos cardiovasculares operatorios (< 1%) No se identificaron predictores de eventos adversos |
|
C: coronariografía; ECA: ensayo controlado aleatorizado; IIC: imágenes intracoronarias; IVUS: ecocardiografía intravascular; MACE: eventos cardiovasculares adversos mayores; OCT: tomografía de coherencia óptica. a Definidos como complicaciones operatorias (disección angiográfica, perforación, trombo o cierre agudo) e intervenciones activas (inflados del balón, implante de stent adicionales o pericardiocentesis). b Definidos como un compuesto de muerte, infarto de miocardio o revascularización de la lesión diana motivada por la isquemia. |
|||
CONCLUSIONES
Más allá de las limitaciones de la coronariografía, las evaluaciones coronarias siguen siendo difíciles de realizar por los diferentes signos de presentación. Por lo tanto, la técnica de imágenes ideal debería ser fácil de usar e interpretar además de segura. El guiado mediante imágenes intracoronarias está ya ampliamente reconocido a título diagnóstico, aunque también para planificar la ICP y guiar el tratamiento post-ICP. No obstante, sigue habiendo margen de mejora y los estudios que se realicen en el futuro contribuirán a que estas técnicas de imágenes se adopten más ampliamente en todas las salas de hemodinámica.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Á. Aparisi ha elaborado el manuscrito original. Á. Aparisi, H. Cubero-Gallego y H. Tizón-Marcos llevaron a cabo el proceso de revisión crítica del manuscrito en lo referente a su contenido intelectual más importante para, finalmente, redactar su versión definitiva. Todos los autores leyeron y dieron su consentimiento a la publicación de la presente versión del manuscrito.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Malakar AK, Choudhury D, Halder B, Paul P, Uddin A, Chakraborty S. A review on coronary artery disease, its risk factors, and therapeutics. J Cell Physiol. 2019;234:16812-16823.
2. Collet C, Grundeken MJ, Asano T, Onuma Y, Wijns W, Serruys PW. State of the art:coronary angiography. EuroIntervention. 2017;13:634-643.
3. Mintz GS, Guagliumi G. Intravascular imaging in coronary artery disease [published correction in Lancet. 2017;390:1026]. Lancet. 2017;390:793-809.
4. Räber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1:guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions [published correction in Eur Heart J. 2019;40:308]. Eur Heart J. 2018;39:3281-3300.
5. Garcia-Garcia HM, Fernández-Peregrina E, and KOK, Diletti R. Ongoing large randomized clinical trials on complex percutaneous coronary interventions:intravascular imaging-guided trials. REC Interv Cardiol. 2021;3:297-303.
6. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021;79:e21-e129.
7. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization [published correction in Eur Heart J. 2019;40:3096]. Eur Heart J. 2019;40:87-165.
8. Mintz GS, Nissen SE, Anderson WD, et al. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement and Reporting of Intravascular Ultrasound Studies (IVUS). A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37:1478-1492.
9. Xu J, Lo S. Fundamentals and role of intravascular ultrasound in percutaneous coronary intervention. Cardiovasc Diagn Ther. 2020;10:1358-1370.
10. Darmoch F, Alraies MC, Al-Khadra Y, Moussa Pacha H, Pinto DS, Osborn EA. Intravascular Ultrasound Imaging-Guided Vs Coronary Angiography-Guided Percutaneous Coronary Intervention:A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2020;9:e013678.
11. Ali ZA, Karimi Galougahi K, Maehara A, et al. Intracoronary Optical Coherence Tomography 2018:Current Status and Future Directions. JACC Cardiovasc Interv. 2017;10:2473-2487.
12. Tearney GJ, Regar E, Akasaka T, et al. Consensus standards for acquisition, measurement, and reporting of intravascular optical coherence tomography studies:a report from the International Working Group for Intravascular Optical Coherence Tomography Standardization and Validation. J Am Coll Cardiol. 2012;59:1058-1072.
13. Prati F, Di Vito L, Biondi-Zoccai G, et al. Angiography alone vs angiography plus optical coherence tomography to guide decision-making during percutaneous coronary intervention:the Centro per la Lotta contro l'Infarto-Optimisation of Percutaneous Coronary Intervention (CLI-OPCI) study. EuroIntervention. 2012;8:823-829.
14. Magnus PC, Jayne JE, Garcia-Garcia HM, et al. Optical coherence tomography vs intravascular ultrasound in the evaluation of observer variability and reliability in the assessment of stent deployment:the OCTIVUS study. Catheter Cardiovasc Interv. 2015;86:229-235.
15. Abnousi F, Waseda K, Kume T, et al. Variability in quantitative and qualitative analysis of intravascular ultrasound and frequency domain optical coherence tomography. Catheter Cardiovasc Interv. 2013;82:E192-E199.
16. Collet C, Conte E, Mushtaq S, et al. Reviewing imaging modalities for the assessment of plaque erosion. Atherosclerosis. 2021;318:52-59.
17. Khalifa AKM, Kubo T, Ino Y, et al. Optical Coherence Tomography Comparison of Percutaneous Coronary Intervention Among Plaque Rupture, Erosion, and Calcified Nodule in Acute Myocardial Infarction. Circ J. 2020;84:911-916.
18. Jia H, Abtahian F, Aguirre AD, et al. In vivo diagnosis of plaque erosion and calcified nodule in patients with acute coronary syndrome by intravascular optical coherence tomography. J Am Coll Cardiol. 2013;62:1748-1758.
19. Terada K, Kubo T, Kameyama T, et al. NIRS-IVUS for Differentiating Coronary Plaque Rupture, Erosion, and Calcified Nodule in Acute Myocardial Infarction. JACC Cardiovasc Imaging. 2021;14:1440-1450.
20. Kim N, Lee JH, Jang SY, et al. Intravascular modality-guided vs angiography-guided percutaneous coronary intervention in acute myocardial infarction. Catheter Cardiovasc Interv. 2020;95:696-703.
21. Sawaya FJ, Lefèvre T, Chevalier B, et al. Contemporary Approach to Coronary Bifurcation Lesion Treatment. JACC Cardiovasc Interv. 2016;9:1861-1878.
22. Burzotta F, Lassen JF, Lefèvre T, et al. Percutaneous coronary intervention for bifurcation coronary lesions:the 15th consensus document from the European Bifurcation Club. EuroIntervention. 2021;16:1307-1317.
23. Watanabe M, Uemura S, Sugawara Y, et al. Side branch complication after a single-stent crossover technique:prediction with frequency domain optical coherence tomography. Coron Artery Dis. 2014;25:321-329.
24. Mori H, Torii S, Kutyna M, Sakamoto A, Finn AV, Virmani R. Coronary Artery Calcification and its Progression:What Does it Really Mean?. JACC Cardiovasc Imaging. 2018;11:127-142.
25. Mintz GS. Intravascular imaging of coronary calcification and its clinical implications. JACC Cardiovasc Imaging. 2015;8:461-471.
26. Fujii K, Ochiai M, Mintz GS, et al. Procedural implications of intravascular ultrasound morphologic features of chronic total coronary occlusions. Am J Cardiol. 2006;97:1455-1462.
27. Mehanna E, Bezerra HG, Prabhu D, et al. Volumetric characterization of human coronary calcification by frequency-domain optical coherence tomography. Circ J. 2013;77:2334-2340.
28. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
29. Kobayashi Y, Okura H, Kume T, et al. Impact of target lesion coronary calcification on stent expansion. Circ J. 2014;78:2209-2214.
30. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
31. Ali ZA, Brinton TJ, Hill JM, et al. Optical Coherence Tomography Characterization of Coronary Lithoplasty for Treatment of Calcified Lesions:First Description. JACC Cardiovasc Imaging. 2017;10:897-906.
32. Teng W, Li Q, Ma Y, et al. Comparison of optical coherence tomography-guided and intravascular ultrasound-guided rotational atherectomy for calcified coronary lesions. BMC Cardiovasc Disord. 2021;21:290.
33. de la Torre Hernandez JM, Hernández Hernandez F, Alfonso F, et al. Prospective application of pre-defined intravascular ultrasound criteria for assessment of intermediate left main coronary artery lesions results from the multicenter LITRO study. J Am Coll Cardiol. 2011;58:351-358.
34. Sakakura K, Yamamoto K, Taniguchi Y, Tsurumaki Y, Momomura SI, Fujita H. Intravascular ultrasound enhances the safety of rotational atherectomy. Cardiovasc Revasc Med. 2018;19(3 Pt A):286-291.
35. Khan AA, Khalid MF, Ayub MT, et al. Outcomes of Percutaneous Coronary Intervention Vs Optimal Medical Treatment for Chronic Total Occlusion:A Comprehensive Meta-analysis. Curr Probl Cardiol. 2021;46:100695.
36. Wang N, Fulcher J, Abeysuriya N, Adams M, Lal S. Predictors of successful chronic total occlusion percutaneous coronary interventions:a systematic review and meta-analysis. Heart. 2018;104:517-524.
37. Ellis SG, Burke MN, Murad MB, et al. Predictors of Successful Hybrid-Approach Chronic Total Coronary Artery Occlusion Stenting:An Improved Model With Novel Correlates. JACC Cardiovasc Interv. 2017;10:1089-1098.
38. Galassi AR, Sumitsuji S, Boukhris M, et al. Utility of Intravascular Ultrasound in Percutaneous Revascularization of Chronic Total Occlusions:An Overview. JACC Cardiovasc Interv. 2016;9:1979-1991.
39. Tian NL, Gami SK, Ye F, et al. Angiographic and clinical comparisons of intravascular ultrasound- vs angiography-guided drug-eluting stent implantation for patients with chronic total occlusion lesions:two-year results from a randomised AIR-CTO study. EuroIntervention. 2015;10:1409-1417.
40. Hong SJ, Kim BK, Shin DH, et al. Usefulness of intravascular ultrasound guidance in percutaneous coronary intervention with second-generation drug-eluting stents for chronic total occlusions (from the Multicenter Korean-Chronic Total Occlusion Registry) [published correction in Am J Cardiol. 2014;114:1937]. Am J Cardiol. 2014;114:534-540.
41. Kim BK, Shin DH, Hong MK, et al. Clinical Impact of Intravascular Ultrasound-Guided Chronic Total Occlusion Intervention With Zotarolimus-Eluting Vs Biolimus-Eluting Stent Implantation:Randomized Study. Circ Cardiovasc Interv. 2015;8:e002592.
42. Kang J, Cho YS, Kim SW, et al. Intravascular Ultrasound and Angiographic Predictors of In-Stent Restenosis of Chronic Total Occlusion Lesions. PLoS One. 2015;10:e0140421.
43. Jia H, Hu S, Liu H, et al. Chronic total occlusion is associated with a higher incidence of malapposition and uncovered stent struts:OCT findings at 6 months following DES implantation. Catheter Cardiovasc Interv. 2017;89:582-591.
44. Heeger CH, Busjahn A, Hildebrand L, et al. Delayed coverage of drug-eluting stents after interventional revascularisation of chronic total occlusions assessed by optical coherence tomography:the ALSTER-OCT-CTO registry. EuroIntervention. 2016;11:1004-1012.
45. Kawsara A, Núñez Gil IJ, Alqahtani F, Moreland J, Rihal CS, Alkhouli M. Management of Coronary Artery Aneurysms. JACC Cardiovasc Interv. 2018;11:1211-1223.
46. Dionne A, Ibrahim R, Gebhard C, et al. Coronary Wall Structural Changes in Patients With Kawasaki Disease:New Insights From Optical Coherence Tomography (OCT). J Am Heart Assoc. 2015;4:e001939.
47. Sabatine MS, Bergmark BA, Murphy SA, et al. Percutaneous coronary intervention with drug-eluting stents vs coronary artery bypass grafting in left main coronary artery disease:an individual patient data meta-analysis. Lancet. 2021;398:2247-2257.
48. Collet C, Capodanno D, Onuma Y, et al. Left main coronary artery disease:pathophysiology, diagnosis, and treatment. Nat Rev Cardiol. 2018;15:321-331.
49. Park SJ, Ahn JM, Kang SJ, Yoon SH, Koo BK, Lee JY, Kim WJ, Park DW, Lee SW, Kim YH, Lee CW, Park SW. Intravascular ultrasound-derived minimal lumen area criteria for functionally significant left main coronary artery stenosis. JACC Cardiovasc Interv. 2014;7:868-874.
50. Jasti V, Ivan E, Yalamanchili V, Wongpraparut N, Leesar MA. Correlations between fractional flow reserve and intravascular ultrasound in patients with an ambiguous left main coronary artery stenosis. Circulation. 2004;110:2831-2836.
51. Park SJ, Ahn JM, Kang SJ, Yoon SH, Koo BK, Lee JY, Kim WJ, Park DW, Lee SW, Kim YH, Lee CW, Park SW. Intravascular ultrasound-derived minimal lumen area criteria for functionally significant left main coronary artery stenosis. JACC Cardiovasc Interv. 2014;7:868-874.
52. Johnson TW, Räber L, di Mario C, et al. Clinical use of intracoronary imaging. Part 2:acute coronary syndromes, ambiguous coronary angiography findings, and guiding interventional decision-making:an expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2019;40:2566-2584.
53. Uchida Y, Ichimiya S, Ishii H, et al. Impact of plaque burden in the left main coronary artery determined by intravascular ultrasound on cardiovascular events in a Japanese population undergoing percutaneous coronary intervention. Am J Cardiol. 2012;109:352-358.
54. Shimizu T, Mintz GS, De Bruyne B, et al. Relationship between left main coronary artery plaque burden and nonleft main coronary atherosclerosis:results from the PROSPECT study. Coron Artery Dis. 2018;29:397-402.
55. Park SJ, Kim YH, Park DW, et al. Impact of intravascular ultrasound guidance on long-term mortality in stenting for unprotected left main coronary artery stenosis. Circ Cardiovasc Interv. 2009;2:167-177.
56. de la Torre Hernandez JM, Baz Alonso JA, Gómez Hospital JA, et al. Clinical impact of intravascular ultrasound guidance in drug-eluting stent implantation for unprotected left main coronary disease:pooled analysis at the patient-level of 4 registries. JACC Cardiovasc Interv. 2014;7:244-254.
57. Gao XF, Kan J, Zhang YJ, et al. Comparison of one-year clinical outcomes between intravascular ultrasound-guided vs angiography-guided implantation of drug-eluting stents for left main lesions:a single-center analysis of a 1,016-patient cohort. Patient Prefer Adherence. 2014;8:1299-1309.
58. Tan Q, Wang Q, Liu D, Zhang S, Zhang Y, Li Y. Intravascular ultrasound-guided unprotected left main coronary artery stenting in the elderly. Saudi Med J. 2015;36:549-553.
59. Andell P, Karlsson S, Mohammad MA, et al. Intravascular Ultrasound Guidance Is Associated With Better Outcome in Patients Undergoing Unprotected Left Main Coronary Artery Stenting Compared With Angiography Guidance Alone. Circ Cardiovasc Interv. 2017;10:e004813.
60. Ye Y, Yang M, Zhang S, Zeng Y. Percutaneous coronary intervention in left main coronary artery disease with or without intravascular ultrasound:A meta-analysis. PLoS One. 2017;12:e0179756.
61. Kang SJ, Ahn JM, Song H, et al. Comprehensive intravascular ultrasound assessment of stent area and its impact on restenosis and adverse cardiac events in 403 patients with unprotected left main disease. Circ Cardiovasc Interv. 2011;4:562-569.
62. Cortese B, de la Torre Hernandez JM, Lanocha M, et al. Optical coherence tomography, intravascular ultrasound or angiography guidance for distal left main coronary stenting. The ROCK cohort II study. Catheter Cardiovasc Interv. 2021;99:664– 673.
63. Adlam D, Alfonso F, Maas A, Vrints C;Writing Committee. European Society of Cardiology, acute cardiovascular care association, SCAD study group:a position paper on spontaneous coronary artery dissection. Eur Heart J. 2018;39:3353-3368.
64. Hayes SN, Tweet MS, Adlam D, et al. Spontaneous Coronary Artery Dissection:JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;76:961-984.
65. Cerrato E, Giacobbe F, Rolfo C, et al. Role of Invasive and Non-invasive Imaging Tools in the Diagnosis and Optimal Treatment of Patients with Spontaneous Coronary Artery Dissection. Curr Cardiol Rep. 2019;21:122.
66. Alfonso F, Bastante T, Cuesta J, Rodríguez D, Benedicto A, Rivero F. Spontaneous coronary artery dissection:novel insights on diagnosis and management. Cardiovasc Diagn Ther. 2015;5:133-140.
67. Alfonso F, Paulo M, Gonzalo N, et al. Diagnosis of spontaneous coronary artery dissection by optical coherence tomography. J Am Coll Cardiol. 2012;59:1073-1079.
68. Macaya F, Salazar CH, Pérez-Vizcayno MJ, et al. Feasibility and Safety of Intracoronary Imaging for Diagnosing Spontaneous Coronary Artery Dissection. JACC Cardiovasc Imaging. 2019;12:763-764.
69. Lee MS, Tadwalkar RV, Fearon WF, et al. Cardiac allograft vasculopathy:A review. Catheter Cardiovasc Interv. 2018;92:E527-E536.
70. Olymbios M, Kwiecinski J, Berman DS, Kobashigawa JA. Imaging in Heart Transplant Patients. JACC Cardiovasc Imaging. 2018;11:1514-1530.
71. Javaheri A, Saha N, Lilly SM. How to Approach the Assessment of Cardiac Allograft Vasculopathy in the Modern Era:Review of Invasive Imaging Modalities. Curr Heart Fail Rep. 2016;13:86-91.
72. Okada K, Kitahara H, Yang HM, et al. Paradoxical Vessel Remodeling of the Proximal Segment of the Left Anterior Descending Artery Predicts Long-Term Mortality After Heart Transplantation. JACC Heart Fail. 2015;3:942-952.
73. Ichibori Y, Ohtani T, Nakatani D, et al. Optical coherence tomography and intravascular ultrasound evaluation of cardiac allograft vasculopathy with and without intimal neovascularization. Eur Heart J Cardiovasc Imaging. 2016;17:51-58.
74. Hong MK, Mintz GS, Lee CW, et al. Intravascular ultrasound predictors of angiographic restenosis after sirolimus-eluting stent implantation. Eur Heart J. 2006;27:1305-1310.
75. Doi H, Maehara A, Mintz GS, et al. Impact of Post-Intervention Minimal Stent Area on 9-Month Follow-Up Patency of Paclitaxel-Eluting Stents An Integrated Intravascular Ultrasound Analysis From the TAXUS IV, V, and VI and TAXUS ATLAS Workhorse, Long Lesion, and Direct Stent Trials. JACC Cardiovasc Interventions. 2009;2:1269-1275.
76. Prati F, Romagnoli E, Burzotta F, et al. Clinical Impact of OCT Findings During PCI The CLI-OPCI II Study. JACC Cardiovasc Imaging. 2015;8:1297-1305.
77. Meneveau N, Souteyrand G, Motreff P, et al. Optical Coherence Tomography to Optimize Results of Percutaneous Coronary Intervention in Patients with Non–ST-Elevation Acute Coronary Syndrome. Circulation. 2016;134:906-917
78. Adriaenssens T, Joner M, Godschalk TC, et al. Optical Coherence Tomography Findings in Patients With Coronary Stent Thrombosis. Circulation. 2017;136:1007-1021.
79. Souteyrand G, Amabile N, Mangin L, et al. Mechanisms of stent thrombosis analysed by optical coherence tomography:insights from the national PESTO French registry. Eur Heart J. 2016;37:1208-1216.
80. Taniwaki M, Radu MD, Zaugg S, et al. Mechanisms of Very Late Drug-Eluting Stent Thrombosis Assessed by Optical Coherence Tomography. Circulation. 2016;133:650-660.
81. Batkoff BW, Linker DT. Safety of intracoronary ultrasound:Data from a multicenter European registry. Catheter Cardio Diag. 1996;38:238-241.
82. Ali ZA, Galougahi KK, Nazif T, et al. Imaging- and physiology-guided percutaneous coronary intervention without contrast administration in advanced renal failure:a feasibility, safety, and outcome study. Eur Heart J. 2016;37:3090-3095.
83. Sakai K, Ikari Y, Nanasato M, et al. Impact of intravascular ultrasound-guided minimum-contrast coronary intervention on 1-year clinical outcomes in patients with stage 4 or 5 advanced chronic kidney disease. Cardiovasc Intervention Ther. 2019;34:234-241.
84. Mariani J, Guedes C, Soares P, et al. Intravascular Ultrasound Guidance to Minimize the Use of Iodine Contrast in Percutaneous Coronary Intervention The MOZART (Minimizing cOntrast utiliZation With IVUS Guidance in coRonary angioplasTy) Randomized Controlled Trial. JACC Cardiovasc Interventions. 2014;7:1287-1293.
85. Lehtinen T, Nammas W, Airaksinen JKE, Karjalainen PP. Feasibility and safety of frequency-domain optical coherence tomography for coronary artery evaluation:a single-center study. Int J Cardiovasc Imaging. 2013;29:997-1005.
86. Khurwolah MR, Meng H-Y, Wang Y-S, Wang L-S, Kong X-Q. Safety and efficacy of frequency-domain optical coherence tomography in evaluating and treating intermediate coronary lesions. World J Cardiol. 2018;10:222-233.
87. Gupta A, Chhikara S, Vijayvergiya R, et al. Saline as an alternative to radio-contrast for optical coherence tomography guided percutaneous coronary intervention:A prospective comparison. Cardiovasc Revasc Med. 2022;34:86-91.
88. Gore AK, Shlofmitz E, Galougahi KK, et al. Prospective Comparison Between Saline and Radiocontrast for Intracoronary Imaging With Optical Coherence Tomography. JACC Cardiovasc Imaging. 2020;13:2060-2062.
89. Ali ZA, Maehara A, Généreux P, et al. Optical coherence tomography compared with intravascular ultrasound and with angiography to guide coronary stent implantation (ILUMIEN III:OPTIMIZE PCI):a randomised controlled trial. Lancet. 2016;388:2618-2628.
90. Habara M, Nasu K, Terashima M, et al. Impact of Frequency-Domain Optical Coherence Tomography Guidance for Optimal Coronary Stent Implantation in Comparison With Intravascular Ultrasound Guidance. Circ Cardiovasc Interv. 2012;5:193-201.
91. Kubo T, Shinke T, Okamura T, et al. Optical frequency domain imaging vs intravascular ultrasound in percutaneous coronary intervention (OPINION trial):one-year angiographic and clinical results. Eur Heart J. 2017;38:3139-3147.
92. Sijde JN van der, Karanasos A, Ditzhuijzen NS van, et al. Safety of optical coherence tomography in daily practice:a comparison with intravascular ultrasound. Eur Heart J Cardiovasc Imaging. 2017;18:467-474.
RESUMEN
La insuficiencia cardiaca (IC) es la principal causa de hospitalización en los países desarrollados. A pesar de las mejoras en el diagnóstico y las terapias, una proporción importante de pacientes con IC aún persisten muy sintomáticos o con pobre calidad de vida. La mayoría de estos pacientes, además, no son candidatos a trasplante cardiaco ni a asistencia ventricular de destino. Así pues, existe una necesidad clínica no cubierta de tratar a este creciente subgrupo de pacientes. Los nuevos dispositivos percutáneos para IC son una opción de tratamiento para mejorar los síntomas y la calidad de vida de estos pacientes. Los primeros estudios en humanos con estos dispositivos han mostrado unos resultados prometedores en términos de factibilidad, seguridad e integridad de los dispositivos. No obstante, todavía hay pocos datos sobre su eficacia. En esta revisión nos centramos en describir las características, las ventajas y los inconvenientes, así como las evidencias, de los 3 tipos principales de dispositivos percutáneos para la IC, con especial énfasis en la base fisiopatológica subyacente que justifica su diseño: los dispositivos de derivación interauriculares, que pretenden descomprimir la presión de la aurícula izquierda y así evitar el edema pulmonar; los dispositivos de ventriculoplastia, que restauran físicamente el ventrículo izquierdo en situaciones de mal remodelado ventricular; y los dispositivos de modulación del flujo cardiorrenal, diseñados para mejorar la diuresis en situación de IC aguda descompensada con síndrome cardiorrenal asociado.
Palabras clave: Insuficiencia cardiaca. Nuevas terapias. Cardiología intervencionista.
ABSTRACT
Heart failure (HF) is the leading cause of hospitalization in the Western world. Despite improvements in diagnostic tools and therapies, a substantial number of patients with HF still remain highly symptomatic, with a poor quality of life. Most of these patients are ineligible for heart transplantation or left ventricular assist device placement, which underscores an unmet clinical need in this population. Novel device-based HF therapies represent therapeutic options for these patients to improve their symptoms and quality of life. First-in-man studies showed promising results in terms of feasibility, and device performances. However, there is still scarce data regarding efficacy. In this review, we focus on the pathophysiological rationale, emerging data, concerns, and future perspective behind the 3 most studied type of device-based HF therapy: interatrial shunt devices, designed to decompress the left atrium and prevent pulmonary edema; ventriculoplasty devices, designed to physically restore the left ventricle in patients with maladaptive left ventricular remodeling; and cardiorenal flow modulator devices, designed to improve diuresis and renal function in acute decompensated heart failure with cardiorenal syndrome.
Keywords: Heart failure. Novel devices. Interventional cardiology.
Abreviaturas
DDIA: dispositivo de derivación interauricular; IC: insuficiencia cardiaca; ICAD: insuficiencia cardiaca aguda descompensada; ICFEr: insuficiencia cardiaca con fracción de eyección reducida; TMOG: tratamiento médico optimizado según guías. VD: ventrículo derecho; VI: ventrículo izquierdo.
INTRODUCCIÓN
La insuficiencia cardiaca (IC) es la principal causa de hospitalización en Occidente además de un grave problema de salud pública. En los países desarrollados, la prevalencia estimada de la IC está en torno al 1-2% en la población adulta llegando al 10% en pacientes > 70 años1. A pesar de las mejoras en las herramientas diagnósticas y los tratamientos médicos, como, por ejemplo, la monitorización continua de la presión arterial pulmonar o fármacos como el sacubitrilo o los inhibidores del cotransportador sodio-glucosa tipo 2, una proporción significativa de pacientes con IC siguen sintomáticos y con mala calidad de vida2-4. Según los últimos datos europeos, los índices anuales de mortalidad y rehospitalización en pacientes con IC se sitúan en torno al 7-17% y al 34-44%, respectivamente4. En su mayoría estos pacientes no son aptos para recibir un trasplante cardiaco ni un dispositivo de asistencia ventricular izquierda, lo cual revela una necesidad clínica no cubierta en este subgrupo poblacional que está en continuo crecimiento. Esto ha dado a lugar al desarrollo de nuevos tratamientos mínimamente invasivos que se basan en el uso de nuevos dispositivos diseñados específicamente para trata la IC en distintos contextos. Estas nuevas terapias pueden ser una opción real para mejorar la calidad de vida y reducir las rehospitalizaciones por IC o incluso la mortalidad de estos pacientes, qué, a pesar de estar bajo tratamiento médico optimizado según guías (TMOG) aún persisten severamente sintomáticos y con pobre calidad de vida. Todo ello está contribuyendo a la creación de una nueva subespecialidad dentro de la cardiología intervencionista: la terapia intervencionista en IC.
En este artículo se revisa la base fisiopatológica que justifica el diseño de algunos de estos dispositivos, así como los datos a favor y en contra que conocemos hasta la fecha.
DISPOSITIVOS DE DERIVACIÓN INTERAURICULAR
El primer signo de afectación del ventrículo izquierdo (VI) (independientemente de la fracción de eyección) es la elevación de la presión telediastólica del ventrículo izquierdo, que se transmite de forma retrógrada a la aurícula izquierda y de esta al capilar pulmonar provocando la aparición de síntomas como la disnea y, en última instancia y si no se trata, el edema pulmonar5. Los dispositivos de derivación interauricular (DDIA) crean una comunicación interauricular permanente mediante un abordaje transeptal percutáneo convencional. El objetivo es descomprimir la presión de la aurícula izquierda para atenuar o incluso revertir el mecanismo subyacente del edema pulmonar6. No obstante, el shunt interauricular izquierda-derecha puede aumentar la precarga ventricular derecha (VD) y, en última instancia, causar una dilatación de las cavidades derechas. Estudios publicados sugieren que el tamaño del shunt juega un papel clave. El tamaño ideal del shunt debería permitir rebajar la presión de la aurícula izquierda sin causar un perjuicio de la función cardiaca derecha: DDIA demasiado grandes pueden provocar un aumento de la relación Qp/Qs que puede afectar al VD; por otro lado, DDIA demasiado pequeños pueden tener efectos de descompresión clínica y hemodinámicamente insignificantes. Los primeros estudios realizados en humanos sugieren que un shunt de < 10 mm probablemente no sea hemodinámicamente significativo (por ejemplo, una relación Qp/Qs > 1,5) como para comprometer el tamaño o la función del VD7. Los 2 dispositivos de shunt más estudiados hasta la fecha tienen aperturas con diámetros de 5mm (dispositivo V-Wave, V-Wave Ltd., Israel) y 8 mm (Dispositivo de Derivación Interauricular, Corvia Medical, Estados Unidos) (figura 1A, figura 1B y tabla 1)8. Los pacientes con aurículas (o VD) rígidas o fibróticas también son motivo de preocupación. En este escenario, ni la aurícula derecha ni el VD pueden asumir una mayor precarga. Por todas estas razones, los pacientes con miocardiopatía restrictiva, hipertensión pulmonar (resistencia vascular pulmonar > 4 unidades Wood) o disfunción VD son excluidos de estudios que evalúan shunts interatriales. Por último, también son motivo de preocupación la potencial aparición de eventuales accidentes cerebrovasculares paradójicos secundarios a una eventual inversión transitoria del flujo (de derecha a izquierda) asociados al uso de esta tecnología.
Figura 1. Dispositivos empleados en terapéutica intervencionista en insuficiencia cardiaca A: V-Wave (V-Wave Ltd., Israel) es un dispositivo de derivación interauricular con un marco de nitinol autoexpandible en forma de reloj de arena y una falda de PTFE expandida con un agujero central de 5 mm. B: Dispositivo de Derivación Interauricular (Corvia Medical, Estados Unidos) con un agujero central de 8 mm. C: Sistema de remodelado ventricular AccuCinch (Ancora Heart, Estados Unidos): dispositivo de ventriculoplastia izquierda completamente percutáneo. D: Sistema TC Revivent (BioVentrix Inc., Estados Unidos): dispositivo de ventriculoplastia izquierda que emplea microanclas para excluir cicatrices mediante un abordaje híbrido (yugular más minitoracotomía lateral). E: Catéter Doraya (Revamp Medical, Israel): reduce tanto la hipertensión renal venosa como la precarga para mejorar la diuresis en el tratamiento de la insuficiencia cardiaca aguda descompensada (ICAD) con síndrome cardiorrenal (SCR). F: Dispositivo Aortix (Procyrion Inc., Estados Unidos): bomba que mejora la presión de perfusión de las arterias renales y reduce la post-carga del ventrículo izquierdo. Se espera que Aortix sirva, también, para mejorar la diuresis en el tratamiento de la ICAD con SCR.
Tabla 1. Mecanismo de los dispositivos, características y evidencia de los dispositivos empleados en terapéutica intervencionista en insuficiencia cardiaca
| Dispositivo | Mecanismo y características del dispositivo | Estudio | Diseño del estudio | Principales criterios de inclusión | N | Principales resultados |
|---|---|---|---|---|---|---|
| V-Wave | – Shunt interauricular (abordaje transeptal) – Completamente percutáneo (vía vena femoral mediante un sistema de liberación de 12 Fr) – Dispositivo en forma de reloj de arena montado sobre un marco de nitinol autoexpandible con una falda de PTFE expandida – Diámetro luminal: 5 mm – La segunda generación no dispone de válvula unidireccional que garantice el shunt izquierda-derecha |
VW-SP-1 + cohorte canadiense8 | Multicéntrico, abierto, de un único grupo, fase I y con un seguimiento de 12 meses de duración | – Clase III-IV según NYHA; ≥ 1 Hospitalización por IC durante el último año con valores PNC ↑ |
38 (30 con ICFEr) | – Incidencia de MACE al año: 2,6% (1 taponamiento) – Mejoras significativas de la clase NYHA, CdV, KCCQ – Aumento significativo de la relación Qp/Qs |
| RELIEVE-HF NCT03499236 |
ECA multicéntrico, controlado simulado, ciego, con una ratio de asignación 1:1 y un seguimiento de entre 1 y 2 años de duración | – Clase II-IV según NYHA; ≥ 1 Hospitalización por IC durante el último año con valores PNC ↑ PEP > PAD; RVP < 4 UW; apto para abordaje transeptal |
500 (en curso) | En fase de inclusión (se completará en 2022) – Objetivos: EADM, MACE, NYHA, KCCQ y PM6M |
||
| Dispositivo de Derivación Interauricular | – Shunt interauricular (abordaje transeptal) – Completamente percutáneo (vía vena femoral) – Marco metálico de nitinol autoexpandible con un diseño en doble disco y una abertura en el centro – Agujero central de 8 mm |
REDUCE LAP-HF NCT01913613 |
Multicéntrico, abierto, de un único grupo y con un seguimiento de 6 meses de duración | – Clase II-IV según NYHA; FEVI > 40%; PEP ≥ 15 mmHg (o 25 mmHg en ejercicio) | 64 | – No MACE, el 52% experimentó un descenso de la PEP en reposo, el 54% un descenso de la PEP en ejercicio acompañado de una mejoría de la clase NYHA, CdV y PM6M |
| REDUCE LAP-HF I NCT02600234 |
ECA multicéntrico, controlado simulado, doble ciego, con una ratio de asignación 1:1 y un seguimiento de 1 año de duración | – Clase III-IV según NYHA; FEVI > 40%; PEP en ejercicio ≥ 25 mmHg; PEP-PAD ≥ 5 mmHg; hospitalización por IC previa o valores PNC ↑ | 44 | – Descenso de la PEP en ejercicio, incidencia similar de MACCE y ausencia de accidentes cerebrovasculares en ninguno de los 2 grupos – Tendencias hacia menos hospitalizaciones por IC, mejor CdV y tamaño del VD en el grupo tratado con el dispositivo |
||
| Sistema TC Revivent | – Ventriculoplastia – Híbrido (vena yugular + minitoracotomía lateral) – Anclas y cierre externo en la superficie epicárdica del VI |
REVIVE-HF NCT03845127 |
ECA multicéntrico y prospectivo con un seguimiento de 6 meses de duración (ratio de asignación 2:1; dispositivo frente a tratamiento médico optimizado según guías) | – Síntomas de IC con infarto de miocardio previo, mayor volumen sistólico VI y cicatriz contigua localizada en la pared anterior/apical del VI | 180 (en curso) | En fase de inclusión (se completará en 2022) – Objetivos: distancia PM6M a los 6 meses, CdV a los 6 meses, cambio en la clase NYHA a los 6 meses, VTDVIi a los 6 meses y FEVI a los 6 meses |
| Sistema de remodelado ventricular AccuCinch | – Ventriculoplastia – Completamente percutáneo; vía arteria femoral, abordaje aórtico retrógrado; diseñado inicialmente para la insuficiencia mitral – Se aseguran las anclas al aparato subvalvular mitral |
CORCINCH-HF NCT04331769 |
ECA multicéntrico, abierto y con un seguimiento de 5 años de duración | – Clase II-IV según NYHA; FEVI entre el 20 y el 40%; y DTVI > 55 mm; distancia PM6M entre 100 y 450 m | 400 (en curso) | En fase de inclusión (se completará en 2025) – Objetivos: EAM a los 6 meses y 1 año, cambios en la puntuación obtenida en el KCCQ, cambios en la PM6M, compuesto de mortalidad por cualquier causa, implante de DAVI o trasplante cardiaco, hospitalizaciones por IC y cambios en la puntuación obtenida en el KCCQ |
| Cerclaje de los músculos papilares | – Ventriculoplastia – Vía arteria femoral, abordaje aórtico retrógrado – Injerto de PTFE de 4 mm que se implanta alrededor de la base de los músculos papilares y, luego, se tensa |
NCT04475315 | ECA abierto de un único centro (ratio de asignación 1:1; CABG frente a CABG + cerclaje) con un seguimiento de 5 años de duración | – Clase II-IV según NYHA; DTVI ≥ 55; FEVI entre el 20 y el 40%; IMF ≤ 2+; distancia de separación interpapilar telediastólica ≥ 20 mm; miocardiopatía isquémica o no isquémica | 40 (en curso) | En fase de inclusión (se completará en 2026) – Objetivos: cambios en FEVI, volumen del VI, mortalidad, MACE, gravedad de la insuficiencia mitral funcional, CdV, PM6M, rehospitalización por cualquier causa, rehospitalización por IC, así como en el área de tenting de la valvas de la válvula mitral |
| Catéter Doraya | – Modulador del flujo renal venoso vía vena femoral (mediante un sistema de liberación de 12 Fr) – Descenso de la hipertensión renal y precarga VD |
NCT03234647 | Primer estudio multicéntrico y de un único centro realizado en humanos sobre viabilidad y seguridad | – ICAD con mala respuesta diurética | 9 | La fase de inclusión finalizó en mayo de 2021 – Adversos eventos graves asociados al dispositivo o a la intervención al cabo de 60 días |
| Aortix | – Modulador del flujo de las arterias renales vía vena femoral (mediante un sistema de liberación de 18 Fr) – Una bomba aumenta el flujo aórtico (hasta 5 l/min) y la presión de perfusión renal y reduce la poscarga del VI |
NCT04145635 | Estudio no controlado ni aleatorizado multicéntrico y prospectivo de viabilidad y seguridad | – ICAD con ICFEr o ICFEc – Empeoramiento de la función real tras 48 horas a tratamiento diurético IV (incremento de 0,3 mg/dl) – Congestión persistente (PEP ≥ 20 o presión venosa central ≥ 12 mmHg) |
60 (en curso) | En fase de inclusión (se completará en 2022) – Objetivos: eventos adversos graves a los 30 días, eventos adversos graves asociados a la intervención, rendimiento del dispositivo, descenso de la presión venosa central a los 7 días o PEP > 20%, cambios en la producción de orina y niveles de PNC más bajos en un 20% |
|
CABG: cirugía de revascularización coronaria; CdV: calidad de vida; DAVI: dispositivo de asistencia ventricular izquierda; DTVI: diámetro telediastólico del ventrículo izquierdo; EADM, eventos adversos asociados a dispositivos médicos; EAM: eventos adversos mayores; ECA: ensayo clínico aleatorizado; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; ICAD: insuficiencia cardiaca aguda descompensada; ICFEc: insuficiencia cardiaca con fracción de eyección conservada; ICFEr: insuficiencia cardiaca con fracción de eyección reducida; IV: intravenoso; KCCQ: Kansas City Cardiomyopathy Questionnaire; MACCE: eventos cardiovasculares y cerebrovasculares adversos mayores; MACE: eventos cardiovasculares adversos mayores; NYHA: New York Heart Association; PAD: presión auricular derecha; PEP: presión de enclavamiento pulmonar; PM6M: prueba de marcha de 6 minutos; PNC: péptido natriurético cerebral; RVP: resistencia vascular pulmonar; VD: ventrículo derecho; VI: ventrículo izquierdo; VTDVIi: volume telediastólico del ventrículo izquierdo indexado. |
||||||
La primera experiencia en humanos con los dispositivos V-wave y Corvia Medical confirmó mejoras importantes de la calidad de vida de los pacientes, así como alivio sintomático de la IC y mejoras en la capacidad de ejercicio6,8-9. En la actualidad, se están llevando a cabo varios estudios y ensayos clínicos aleatorizados con dispositivos DDIA en pacientes con IC sintomática a pesar del TMOG, tanto en pacientes con función sistólica del VI reducida como conservada, (tabla 1, estudios REDUCE LAP-ICFER [NCT03093961], REDUCE LAP-IC II [NCT03088033] y REDUCE LAP-IC IV [NCT04632160]).
VENTRICULOPLASTIA (REMODELADO DEL VENTRÍULO IZQUIERDO)
El VI tiene una arquitectura única con 3 orientaciones diferentes de las miofibrillas y una forma elipsoide elongada que son esenciales para su óptima función. Diferentes estados patológicos pueden provocar cambios tanto a nivel molecular como celular que alteren la oblicuidad de estas miofibrillas, que pasan a tener una disposición más horizontal lo cual provoca, a nivel macroscópico, la dilatación de las cámaras cardiacas y una mayor esfericidad. Esta respuesta adaptativa precoz es, en última instancia, perjudicial y tiende a la autoperpetuacion entrando en un círculo vicioso que resulta en una pérdida de función ventricular (remodelado maladaptativo). El remodelado maladaptativo del VI está claramente asociado a un mal pronóstico10.
La ventriculoplastia es una intervención que modifica anatómicamente la geometría del VI. Se basa en la ley de Laplace, en virtud de la cual la presión y la tensión sobre la pared del VI disminuye cuanto menor es el radio de la cavidad. Así pues, al reducir físicamente el radio del VI se revierte o atenua el remodelado maladaptativo del VI al disminuir la tensión sobre la pared de este. De esta forma, la ventirculoplastia pretende sacar del circulo vicioso en la que se encuentra un VI con remodelado maladaptativo. No obstante, la experiencia previa con la ventriculoplastia quirúrgica no mostró los resultados esperados, probablemente debido a desviaciones del protocolo de estudio y por problemas en la selección de los pacientes. Todo ello contribuyó a que la reducción del volumen del VI fuera menor a la esperada. Sin embargo, debemos mencionar que un análisis post hoc del citado estudio sí mostró buenos resultados en términos de descensos significativos de mortalidad a los 6 años en el subgrupo de pacientes con un volumen telesistólico del VI indexado < 70 ml/m2. Además, también se observó una clara tendencia a mayor supervivencia en los pacientes con reducción del 30% del volumen indexado telesistólico del VI11. A pesar de los controvertidos resultados de la ventriculoplastia quirúrgica del VI, la ventriculoplastia percutánea aún suscita un enorme interés, sobre todo, en pacientes con IC con fracción de eyección reducida (ICFEr). Hasta la fecha, se han desarrollado varios métodos para realizar la ventriculoplastia izquierda percutánea. En esta revisión nos centrarnos en los 3 métodos que han mostrado mejores resultados en los estudios iniciales: el sistema Revivent TC (BioVentrix Inc., Estados Unidos), el AccuCinch (Ancora Heart, Estados Unidos) y el cerclaje de los músculos papilares.
El sistema Revivent TC de BioVentrix se implanta mediante una intervención híbrida, transcatéte por abordaje yugular más minitoracotomía lateral quirúrgica. El sistema está diseñado para excluir cualquier aneurisma o cicatriz localizados en la pared anterior o apical del VI. Se coloca un ancla articulada en el lado derecho del septo interventricular distal (mediante abordaje yugular) y otra ancla externa de cierre sobre la superficie epicárdica del VI (vía minitoracotomía). Después, se utiliza un cable de amarre para juntar las 2 anclas hasta que las 2 paredes opuestas se toquen. Esta acción se repite por todo el eje largo del VI resultando en la exclusión del tejido cicatricial disfuncional (figura 1C). Los datos procedentes de un estudio de 86 pacientes mostraron la factibilidad y seguridad del sistema, así como evidencias en la mejora tanto en la fracción de eyección como en los volúmenes del VI, la calidad de vida y el estado funcional12. En la actualidad, hay 2 estudios en marcha analizando este tratamiento (el REVIVE-IC [NCT03845127] y el ALIVE [NCT02931240]) (tabla 1).
El sistema de remodelado ventricular AccuCinch incorpora un catéter con un trayecto prediseñado que se coloca mediante abordaje aórtico retrógrado para rodear el septo basal del VI y anclar una banda al segmento basal del miocardio del VI. Luego, se aplica tensión a un cable que reduce los diámetros de la pared basal y los volúmenes del VI13 (figura 1D). Aunque este dispositivo se diseñó originalmente para el tratamiento de la insuficiencia mitral funcional, hoy se emplea en pacientes con ICFEr. En la actualidad, se está llevando a cabo un importante ensayo clínico aleatorizado para analizar el uso de este dispositivo en pacientes con ICFEr frente a TMOG (tabla 1, CORCINCH-IC [NCT04331769]).
El sistema percutáneo de cerclaje de los músculos papilares está basado en una intervención quirúrgica ya existente que pretende reducir la distancia de separación de los músculos interpapilares laterales. Se emplea un cerclaje mediante abordaje aórtico retrógrado. En la actualidad, hay un estudio clínico que está analizado esta técnica en una cohorte quirúrgica (tabla 1, NCT04475315).
MODULACIÓN DEL FLUJO CARDIORRENAL
La IC aguda descompensada (ICAD) en pacientes con afectación de la función renal previas y/o síndrome cardiorrenal plantea un escenario extremadamente complejo para el manejo médico de estos pacientes. La fisiopatología del síndrome cardiorrenal es compleja, dinámica y multifactorial e incluye alteraciones tanto a nivel hemodinámico como del eje neurohumoral14. Datos de estudios previos sugieren que el gradiente de presión arteriovenosa a nivel del glomérulo renal debe ser lo bastante grande como para permitir un flujo sanguíneo renal y una filtración glomerular adecuados. Mantener este mecanismo hemodinámico parece esencial en pacientes con una afectación de la función renal preexistentes. En pacientes con ICAD y síndrome cardiorrenal se observa un descenso de la perfusión pre-renal junto con una hipertensión venosa renal. Esta última aumenta la resistencia renal que, a su vez, altera el flujo sanguíneo intrarrenal. El descenso de la perfusión renal se agrava por la vasoconstricción pre-glomerular que provoca la activación neurohumoral del eje renina-angiotensina-aldosterona, que resulta en una mayor reabsorción de sodio y agua en el túbulo proximal para mantener un volumen plasmático efectivo. Esto provoca oliguria, un empeoramiento de los síntomas congestivos y resistencia diurética. La relación que existe entre la resistencia diurética y mal pronóstico clínico en este contexto está bien establecida14.
Básicamente existen 2 tipos de dispositivos diseñados para interrumpir el círculo vicioso del síndrome cardiorrenal en la ICAD: los que reducen la hipertensión venosa renal como el catéter Doraya (Revamp Medical, Israel), y los que aumentan la presión de perfusión de las arterias renales como los dispositivos Aortix (Procyrion Inc., Estados Unidos) y Second Heart Assist (Second Heart LLC, Estados Unidos).
El catéter Doraya consta de un marco flexible de nitinol autoexpandible que está recubierto en su segmento distal para limitar el flujo sanguíneo. Se coloca en la vena cava inferior por debajo de la vena renal vía vena femoral empleando un sistema de liberación de 12 Fr. Actúa como un regulador temporal del flujo durante 24 horas. El Doraya provoca una caída temporal de la presión venosa central a nivel de las venas renales, lo cual además de aumentar el gradiente de presión a nivel glomerular mejorando la diuresis, reduce la precarga cardiaca y contribuye a la descarga del VI15 (figura 1E). El primer estudio clínico realizado en humanos para evaluar la seguridad, viabilidad y efectos hemodinámicos de este dispositivo en pacientes con ICAD, congestión y una respuesta inadecuada a los diuréticos finalizó la fase de inclusión en mayo de 2021 (tabla 1, NCT03234647).
Aortix es una bomba axial percutánea que se coloca en la aorta descendente a nivel suprarrenal vía abordaje transfemoral mediante un sistema de liberación de 18 Fr. Este dispositivo aumenta el flujo aórtico, reduce la post-carga y es capaz de bombear hasta 5 l/min (figura 1F). Un estudio realizado en pacientes sometidos a intervenciones coronarias percutáneas mostró un aumento de 10 veces en la producción de orina16. En la actualidad está en marcha un estudio para evaluar el perfil de viabilidad, seguridad y eficacia de Aortix en pacientes con ICAD (IC con fracción de eyección conservada e ICFEr) y síndrome cardiorrenal (tabla 1, NCT04145635).
En resumen, a pesar de las importantes mejoras en el manejo de la IC de los últimos años, aún persiste una proporción significativa de pacientes que persisten severamente sintomáticos y con mala calidad de vida. La terapia intervencionista en insuficiencia cardiaca es un campo nuevo y prometedor dentro de la cardiología intervencionista que puede ofrecer a estos pacientes una solución basada en la implantación de dispositivos percutáneos. Los shunts interauriculares, las ventriculoplastias percutáneas y los moduladores del flujo cardiorrenal son algunos de los dispositivos más importantes en este emergente campo de la cardiología.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Los autores han contribuido por igual en todas las fases de diseño y redacción de este manuscrito.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Ponikowski P, Voors AA, Anker SD, et al.;ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2016;37:2129-2200.
2. Bayes-Genis A, Codina P, Abdul-Jawad Altisent O, et al. Advanced remote care for heart failure in times of COVID-19 using an implantable pulmonary artery pressure sensor:the new normal. Eur Heart J Suppl. 2020;22:P29-P32.
3. Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375:323-334.
4. Maggioni AP, Dahlström U, Filippatos G, et al. EURObservationalResearch Programme:regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail. 2013;15:808-817.
5. Ritzema J, Troughton R, Melton I, et al. Physician-Directed Patient Self-Management of Left Atrial Pressure in Advanced Chronic Heart Failure. Circulation. 2010;121:1086-1095.
6. Del Trigo M, Bergeron S, Bernier M, et al. Unidirectional left-to-right interatrial shunting for treatment of patients with heart failure with reduced ejection fraction:a safety and proof-of-principle cohort study. Lancet. 2016;387:1290-1297.
7. Kaye DM, HasenfußG, Neuzil P, et al. One-Year Outcomes After Transcatheter Insertion of an Interatrial Shunt Device for the Management of Heart Failure With Preserved Ejection Fraction. Circ Heart Fail. 2016;9:e003662.
8. Rodés-Cabau J, Bernier M, Amat-Santos IJ, et al. Interatrial Shunting for Heart Failure:Early and Late Results From the First-in-Human Experience With the V-Wave System. JACC Cardiovasc Interv. 2018;11:2300-2310.
9. Feldman T, Mauri L, Kahwash R, et al. Transcatheter Interatrial Shunt Device for the Treatment of Heart Failure With Preserved Ejection Fraction (REDUCE LAP-HF I [Reduce Elevated Left Atrial Pressure in Patients With Heart Failure]). Circulation. 2018;137:364-375.
10. Adhyapak SM, Parachuri VR. Architecture of the left ventricle:insights for optimal surgical ventricular restoration. Heart Fail Rev. 2009;15:73-83.
11. Michler RE, Rouleau JL, Al-Khalidi HR, et al. Insights from the STICH trial:change in left ventricular size after coronary artery bypass grafting with and without surgical ventricular reconstruction. J Thorac Cardiovasc Surg. 2013;146:1139-1145.e6.
12. Klein P, Anker SD, Wechsler A, et al. Less invasive ventricular reconstruction for ischaemic heart failure. Eur J Heart Fail. 2019;21:1638-1650.
13. Gooley RP, Meredith IT. The Accucinch transcatheter direct mitral valve annuloplasty system. EuroIntervention. 2015;11(Suppl W):W60-1.
14. Rangaswami J, Bhalla V, Blair JEA, et al. Cardiorenal Syndrome:Classification, Pathophysiology, Diagnosis, and Treatment Strategies:A Scientific Statement From the American Heart Association. Circulation. 2019;139:e840-e878.
15. Dierckx R, Vanderheyden M, Heggermont W, Goethals M, Verstreken S, Bartunek J. Treatment of Diuretic Resistance with a Novel Percutaneous Blood Flow Regulator:Concept and Initial Experience. J Card Fail. 2019;25:932-934.
16. Vora AN, Schuyler Jones W, DeVore AD, Ebner A, Clifton W, Patel MR. First-in-human experience with Aortix intraaortic pump. Catheter Cardiovasc Interv. 2019;93:428-433.
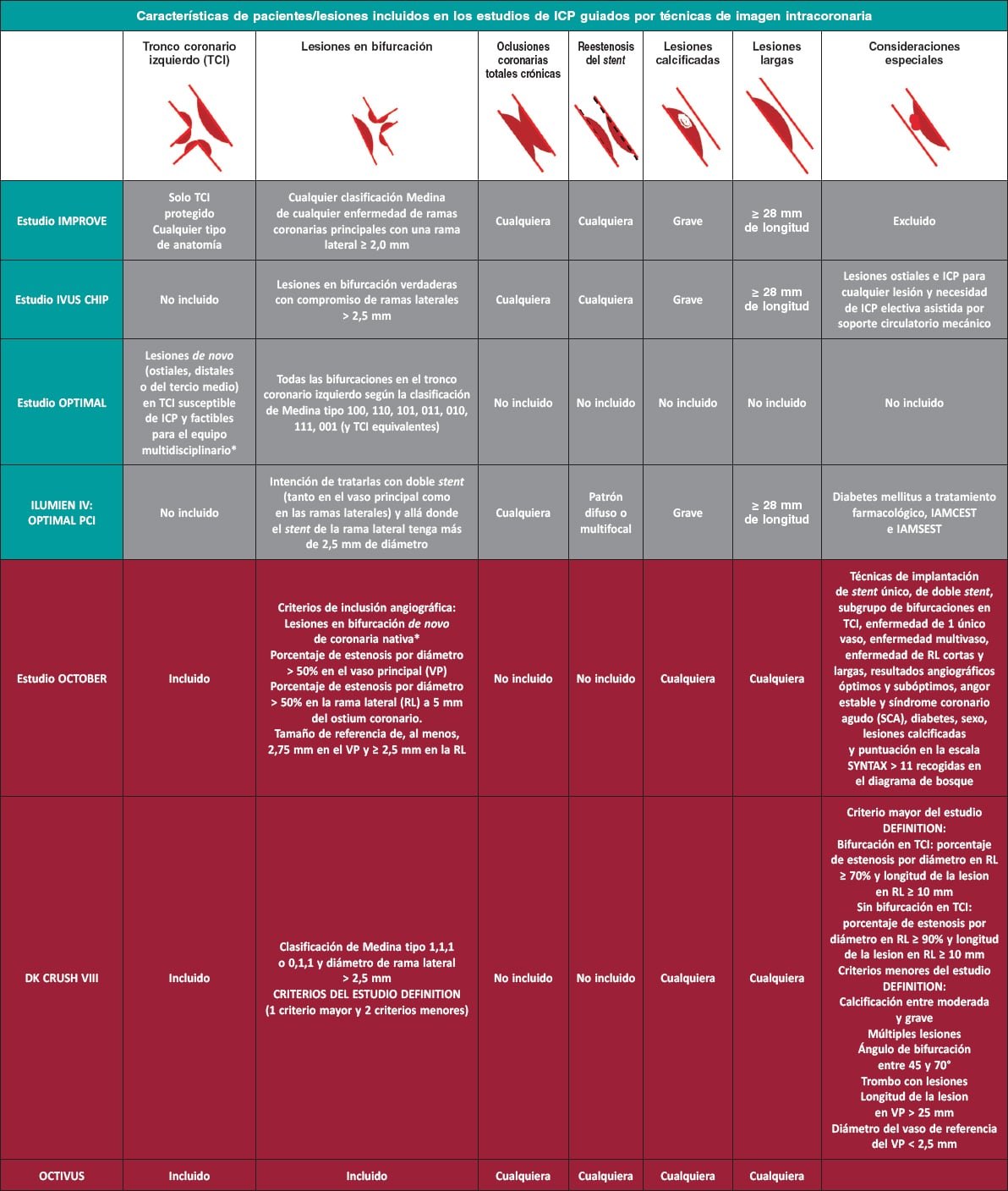
- Archivo PDF del volumen (ES): Descargar revista completa
RESUMEN
El intervencionismo coronario complejo es aún un escenario desafiante que todavía se asocia con resultados subóptimos. A lo largo de los años han surgido diferentes estrategias y tecnologías con el objetivo de mejorar dichos resultados. En concreto, el desarrollo y la evolución de herramientas de imagen intravascular para guiar el procedimiento han permitido perfeccionar la evaluación de la lesión y su preparación, y asegurar su optimización. No obstante, los posibles beneficios de su uso en este escenario particular son aún objeto de estudio. En este artículo, el objetivo es resumir brevemente los principales estudios realizados previamente con estas técnicas, así como los ensayos que en la actualidad están en marcha en intervencionismo coronario complejo guiado por imagen.
Palabras clave: Intervencionismo coronario complejo. Tomografía de coherencia óptica. Ecografía intravascular.
ABSTRACT
Percutaneous coronary intervention of complex coronary artery disease remains challenging and is still associated with suboptimal cardiovascular outcomes. Over the years, different strategies and technologies have been developed to improve these results. Particularly, the development and evolution of intravascular imaging modalities to guide the procedure have improved lesion assessment and preparation, and stent optimization. However, whether these advantages are beneficial in this particular setting is still under discussion. In this article we intend to briefly summarize previous imaging-guided trials and give an outline on the ongoing large trials that are being conducted on imaging-guided interventions in complex coronary disease.
Keywords: Complex percutaneous coronary intervention. Optical coherence tomography. Intravascular ultrasound.
Abreviaturas
ICP: intervención coronaria percutánea. IVUS: ecografía intravascular. OCT: tomografía de coherencia óptica.
INTRODUCCIÓN
En el abordaje de la enfermedad coronaria compleja, -que incluye lesiones coronarias extensamente calcificadas, bifurcaciones (incluidas las bifurcaciones del tronco coronario izquierdo), reestenosis del stent, oclusiones crónicas y lesiones largas-, la intervención coronaria percutánea (ICP) sigue asociándose a resultados cardiovasculares subóptimos a largo plazo. La posibilidad de reducir ese riesgo gracias a los avances en la tecnología de los stents y las técnicas de imagen intracoronaria sigue siendo objeto de debate. A continuación, se ofrece un breve recorrido histórico a través de los distintos estudios guiados por imagen intracoronaria realizados, así como un breve resumen de los ensayos clínicos aleatorizados actualmente en fase de desarrollo.
Tras 4 décadas de ser la angiografía el pilar de la angioplastia con balón y de las intervenciones con implante de stent, la evolución de la ecografía intravascular (IVUS) y de la tomografía de coherencia óptima (OCT) de forma paralela al desarrollo y mejora de los stents farmacoactivos y armazones bioabsorbibles de última generación ha promovido la adopción paulatina de ambas técnicas de imagen intravascular para guiar la ICP. A lo largo de los años, se han llevado a cabo diferentes ensayos clínicos y revisiones sistemáticas para comparar los resultados a largo plazo de la ICP guiada por angiografía con la ICP guiada por imagen intracoronaria, con importantes hallazgos1-12. Las últimas guías de práctica clínica publicadas recomiendan ambas técnicas de imagen para guiar el intervencionismo coronario solo en un subgrupo seleccionado de pacientes (el guiado por IVUS tiene una recomendación clase IIa y el guiado por OCT, una recomendación clase IIb)13,14. Esto abre nuevas oportunidades para realizar ensayos clínicos en las poblaciones de alto riesgo, que son las que más podrían beneficiarse de estas intervenciones.
Aunque las publicaciones, incluidos los ensayos multicéntricos y las revisiones sistemáticas, ya han confirmado los beneficios de la ICP guiada por técnicas de imagen intravascular frente a la ICP guiada por angiografía, se han comunicado diferentes hallazgos, posiblemente por diferencias en a) los pacientes y tipos de lesión incluidos en los estudios; b) la definición de criterios de optimización específicos basado en la imagen intravascular y las diferencias descritas en dichos criterios en los distintos estudios; c) la duración del seguimiento y d) los objetivos de los distintos estudios. Invariablemente, la omisión o falta de representación de ciertos grupos de lesiones angiográficamente complejas en estudios anteriores ha obligado a hacer estudios focalizados en esta cuestión2,3,7,9,15-20.
La tabla 1 ofrece algunos detalles de estudios previamente publicados en revascularización guiada por imagen, así como de los hallazgos descritos.
Tabla 1. Principales estudios publicados sobre ICP guiada por imagen intravascular
| Estudio (n), NCT | Año | Criterios de guiado | Técnica de imagen | Objetivos | Principales hallazgos |
|---|---|---|---|---|---|
| MUSIC (n = 161) NCT ND | 1998 | Aposición completa de todo el stent sobre la pared vascular; ALM: ALM del stent ≥ 90% del área luminal media de referencia o ≥ 100% del segmento de referencia con la menor área luminal de todas; ALM del stent de la entrada proximal del stent ≥ 90% del área luminal proximal de referencia. Si el ALM del stent > 9,0 mm2, el ALM del stent ≥ 80% del área luminal media de referencia o ≥ 90% del segmento de referencia con la menor área luminal de todas; ALM del stent de la entrada proximal del stent ≥ 90% del área luminal proximal de referencia; expansión simétrica del stent definida por el diámetro luminal mínimo dividido por un diámetro luminal máximo ≥ 0,7 | IVUS | Muerte, IM, cirugía de revascularización coronaria y RLD y oclusión trombótica (sub) aguda del stent clínica y/o documentada angiográficamente 30 días después del implante | Resultado angiográfico a los 6 meses en el grupo implantado guiado por IVUS: incidencia de RLD del 5,7% y de reestenosis del stent del 9,7% con el mayor DLM: 2,12 ± 0,67 mm |
| AVID (n = 800) NCT ND | 2000 | El AMS debería ser ≥ 90% del área transversal luminal del vaso distal de referencia; stent completamente apuesto; disecciones cubiertas por el stent | IVUS | Objetivo primario: incidencia de RLD a los 12 meses detectada en el seguimiento clínico sin necesidad de tener que repetir la angiografía | Los resultados a 12 meses revelaron una incidencia de la RLD del 10,1% en el grupo angiográfico frente a una incidencia del 4,3% en el grupo IVUS (p = 0,01; IC95%: −10,6% a −1,2%) |
| SIPS (n = 269) NCT ND | 2000 | Aposición completa de todo el stent a la pared vascular; ALM ≥ 90% del área luminal media de referencia o ≥ 100% del área luminal del segmento de referencia con un ALM > 9,0 mm2; ALM ≥ 80% del área luminal media de referencia o ≥ 90% del área luminal del segmento de referencia con la menor área luminal. Expansión simétrica del stent | IVUS | El objetivo primario del estudio fue el DLM angiográfico a los 6 meses. Los objetivos secundarios fueron el DLM agudo, el coste agudo y crónico, la calidad de vida, la incidencia del objetivo compuesto de eventos clínicos y la RLD por motivos clínicos | El seguimiento clínico (602 ± 307 días) reveló un importante descenso de la RLD por motivos clínicos en el grupo IVUS frente al grupo sometido a guiado estándar (17 frente a 29%, respectivamente; p = 0,02) |
| MAIN-COMPARE (n = 975) NCT ND | 2009 | Criterios específicos para guiado por IVUS no facilitados | IVUS | El objetivo primario del estudio fue la mortalidad. Los objetivos secundarios fueron el IM, la revascularización del vaso diana (RVD) o un objetivo compuesto de eventos | Comparado con el guiado angiográfico convencional, el guiado por IVUS, sobre todo durante el implante de stents farmacoactivos, reduce la tasa de mortalidad a largo plazo en el tratamiento de la estenosis de tronco coronario izquierdo no protegido |
| HOME DES (n = 210) NCT ND | 2010 | Buena aposición; aposición de todos los struts del stent a la pared vascular; expansión óptima del stent (con un AMS = 5 mm2) o un área transversal > 90% del área transversal luminal distal de referencia para vasos pequeños/y sin disección de los bordes (márgenes de 5 mm en proximales y distales al stent) | IVUS | MACE (muerte, IM y nueva intervención) | No se observaron diferencias importantes entre los 2 grupos tras 18 meses de seguimiento en lo que a la incidencia de MACE se refiere (11 frente a 12%; p = NS) |
| CLI-OICP (n = 670) NCT ND | 2012 | La infraexpansión del stent se definió en base a criterios IVUS establecidos de expansión óptima del stent (por ejemplo, área luminal mínima del stent ≥ 90% del área luminal media de referencia o ≥ 100% del área luminal del segmento de referencia con la menor área luminal de todas) | OCT | El objetivo primario fue la incidencia de muerte cardiovascular o IM al cabo de 1 año | El grupo OCT tuvo una incidencia mucho más baja, al cabo de 1 año, de muerte cardiovascular (1,2 frente a 4,5%; p = 0,010), muerte por causas cardiacas o IM (6,6 frente a 13,0%; p = 0,006), así como del objetivo compuesto de muerte por causas cardiaca, IM o nueva revascularización (9,6 frente a 14,8%, p = 0,044) |
| AVIO (n = 284) NCT ND | 2013 | AMS final de, al menos, el 70% de la hipotética área transversal del balón completamente inflado a efectos de posdilatación. El tamaño óptimo del balón a efectos de posdilatación es el promedio de los diámetros de la media-a-media de los segmentos distal y proximal del stent y de los lugares de mayor estrechamiento del stent. El valor se redondea a los valores más bajos de 0,00 o 0,50 mm. Para valores ≥ 3,5 mm el operador puede reducir el diámetro del balón según juicio clínico | IVUS | El objetivo primario del estudio fue el diámetro luminal mínimo de la lesión posoperatoria. Los objetivos secundarios fueron un compuesto de MACE, RLD, revascularización del vaso diana, IM y trombosis del stent al cabo de 1, 6, 9, 12 y 24 meses | IVUS optimizó el implante del SFA tal y como confirmó el diámetro luminal mínimo posoperatorio de las lesiones complejas. No se observaron diferencias significativas en la incidencia de MACE tras 24 meses de seguimiento |
| RESET (n = 1.574) NCT ND | 2013 | Criterios específicos para guiado IVUS no facilitados | IVUS | MACE, incluida la muerte cardiovascular, el IM o la revascularización del vaso diana al año de seguimiento tras implante de SFA en lesiones de poca longitud | No se observaron diferencias significativas en lo referente a la incidencia de MACE entre el grupo guiado por IVUS y el guiado por angiografía |
| AIR CTO (n = 230) NCT ND | 2015 | Buena aposición, AMS > 80% del área del vaso de referencia, índice de simetría > 70% y ausencia de disección > tipo B | IVUS | El objetivo primario fue la pérdida luminal tardía intra stent tras 1 año de seguimiento | La pérdida luminal tardía intra stent del grupo guiado por IVUS fue mucho menor que la del grupo guiado por angiografía al año de seguimiento (0,28 ± 0,48 mm frente a 0,46 ± 0,68 mm; p = 0,025) observándose una diferencia notable de la reestenosis del stent entre los 2 grupos (3,9 frente a 13,7%; p = 0,021) |
| CTO IVUS (n = 402) NCT01563952 | 2015 | a) AMS ≥ área luminal distal de referencia; b) área del stent en el segmento de la OTC ≥ 5 mm2 si lo permite el área del vaso; y c) aposición completa del stent | IVUS | El objetivo primario fue la ocurrencia de muerte cardiovascular. El objetivo secundario fue la incidencia de MACE definidos como un compuesto de muerte cardiovascular, IM o revascularización del vaso diana tras 12 meses de seguimiento | La estrategia guiada por IVUS no redujo la mortalidad cardiovascular significativamente. La ocurrencia de MACE fue mucho menor en el grupo guiado por IVUS que en el guiado por angiografía (2,6 frente a 7,1%) |
| IVUS-XPL (n = 1.400) NCT01308281 | 2016 | AMS mayor que el área transversal luminal en los segmentos distales de referencia post-ICP | IVUS | El objetivo primario fue un compuesto de MACE, incluida la muerte cardiovascular, el IM del vaso diana o la RLD motivada por la isquemia tras 1 año de seguimiento analizado por intención de tratar | El implante del stent guiado por IVUS se asoció a un significativo descenso absoluto del 2,9% y relativo del 48% del riesgo de MACE al cabo de 1 año comparado con el implante del stent guiado por angiografía |
| ILUMIEN III (n = 450) NCT02471586 | 2016 | AMS: expansión aceptable del stent (un área mínima del stent de, al menos, el 90% en ambas mitades proximal y distal del stent en relación al segmento de referencia más cercano) Expansión aceptable del stent: un AMS del segmento proximal ≥ 90% y < 95% del área luminal proximal de referencia y un MSA del segmento distal ≥ 90% y < 95% del área luminal distal de referencia | IVUS, OCT | El objetivo primario de eficacia fue el área mínima del stent post-ICP según la OCT realizada en un laboratorio central independiente y ciego tras completar el reclutamiento en todos los participantes aleatorizados de los que se tenían datos sobre los resultados primarios. El objetivo primario de seguridad fue la incidencia de MACE durante la intervención | El guiado por OCT no fue inferior al guiado por IVUS (intervalo de confianza unilateral del 97,5%: −0,70 mm²; p = 0,001), pero tampoco superior al guiado por IVUS (p = 0,42) ni al guiado angiográfico (p = 0,12). No se observaron diferencias significativas en los resultados MACE |
| OPINION (n = 800) NCT01873222 | 2016 | AML del stent ≥ 90% del área luminal media de referencia; aposición completa de todo el stent sobre la pared vascular; expansión simétrica del stent definida por el diámetro luminal mínimo dividido por el diámetro luminal máximo ≥ 0,7 sin protrusión de la placa, trombo ni disección de los bordes con posibilidad de provocar perturbaciones del flujo | IVUS, OCT | El objetivo primario fue el FVD definido como un compuesto de muerte cardiovascular, IM del vaso diana y revascularización del vaso diana motivada por la isquemia 12 meses después de la ICP | El FVD sobrevino en 21 (5,2%) de los 401 pacientes tratados de ICP guiada por OFDI y en 19 (4,9%) de los 390 pacientes tratados de ICP guiada por IVUS, lo cual vino a demostrar la no inferioridad de la ICP guiada por OFDI con respecto a la ICP guiada por IVUS (hazard ratio, 1,07; límite superior del intervalo de confianza unilateral del 95%: 1,80; valores p para no inferioridad = 0,042) |
| ULTIMATE (n = 1.448) NCT02215915 | 2021 | a) AML del stent > 5,0 mm o el 90% del AML en los segmentos distales de referencia; b) carga de placa a 5 mm de los bordes proximal o distal del stent < 50%; y c) ninguna disección de los bordes compromete la túnica media y una longitud > 3 mm. | IVUS | El objetivo primario fue el riesgo de FVD a los 3 años de seguimiento | El implante de SFA guiado por IVUS se asoció a una incidencia mucho menor de FVD y trombosis del stent a los 3 años en pacientes no seleccionados |
|
ALM: área luminal mínima; AMS: área mínima del stent; DLM: diámetro luminal mínimo; FVD: fracaso del vaso diana; IC95%, intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecografía intravascular; MACE: eventos adversos cardiovasculares mayores; ND: no disponible; NS: no significativo; OCT, tomografía de coherencia óptica; OFDI: imágenes de dominio de frecuencia óptica; OTC, oclusión coronaria total crónica; RLD: revascularización de la lesión diana; SFA: stent farmacoactivo. |
|||||
Actualmente existen nuevos estudios que buscan determinar el efecto en el resultado clínico a más largo plazo del intervencionismo guiado por imagen y el valor de estas modalidades en el tratamiento de subgrupos específicos de lesiones tales como la reestenosis del stent, las lesiones calcificadas y las lesiones largas. La tabla 2 recoge los estudios en marcha de ICP guiada por imagen intravascular.
Tabla 2. Estudios en curso sobre ICP guiadas por imagen intravascular
| Estudio, NCT | Técnica de imagen | Diseño del estudio | Objetivo del estudio | Criterios de las técnicas de imagen | Objetivos clínicos |
|---|---|---|---|---|---|
| IMPROVE, NCT04221815 | IVUS frente a angiografía | Estudio prospectivo, multicéntrico, internacional, investigación clínica de simple ciego. Nº aproximado de sujetos: entre 2.500 y 3.100 sujetos aleatorizados Periodo de seguimiento: 2 años | Demostrar la superioridad de una estrategia de implante del stent guiada por IVUS frente a una estrategia guiada por angiografía para lograr mayores dimensiones luminales post-ICP y mejorar los resultados cardiovasculares clínicos de pacientes con lesiones angiográficas complejas | Se considera que se ha logrado implantar el stent de forma óptima cuando se cumplen los siguientes 3 criterios en la IVUS final: AMS > 90% del área luminal distal de referencia. Ninguna disección de los bordes comprometiendo la capa media con un arco > 60º y una longitud > 3mm. Ausencia de pérdida geográfica definida como una carga de placa > 50% a 5 mm de los bordes proximal o distal del stent o ambos | Fracaso del vaso diana a los 12 meses definido como un compuesto de muerte cardiovascular, IM del vaso diana o revascularización del vaso diana por motivos clínicos |
| IVUS-CHIP, NCT04854070 | IVUS frente a angiografía | Estudio aleatorizado, controlado, multicéntrico, internacional, poscomercialización y basado en eventos. Alrededor de 2.020 pacientes serán aleatorizados en proporción 1:1 al grupo de ICP guiada por IVUS y al de ICP guiada por angiografía | Demostrar la superioridad del guiado por IVUS frente al guiado por angiografía respecto al fracaso del vaso diana | AMS final > 5 mm2 o AMS < 90% de la luz distal de referencia. Carga de placa > 50% a 5 mm de los bordes proximal o distal del stent. Ninguna disección de los bordes comprometiendo la capa media y una longitud > 3 mm | Fracaso del vaso diana definido como un compuesto de muerte cardiovascular, IM del vaso diana o revascularización del vaso diana por motivos clínicos |
| OPTIMAL, NCT04111770 | IVUS frente a angiografía | Estudio internacional, multicéntrico, controlado y aleatorizado | Demostrar la superioridad del implante de stent guiado por IVUS frente al guiado angiográfico en pacientes con enfermedad del TCI y, también, en la mejora de los resultados clínicos | AMS > 5 (CXI), > 6 (DA), > 7 (punto de bifurcación), > 8 (TCI). Mala aposición < 0,4 mm. Ausencia de disección de los bordes definida como ≥ 60° y una longitud ≥ 2 mm. Carga de placa en los bordes del stent < 50% | Objetivo combinado orientado al paciente (POCE): un compuesto de mortalidad por cualquier causa, cualquier accidente cerebrovascular, cualquier IM y cualquier revascularización por motivos clínicos tras 2 años de seguimiento |
| ILUMIEN IV, NCT03507777 | OCT frente a angiografía | Estudio clínico prospectivo, multicéntrico, aleatorizado y controlado. Nº de sujetos: entre 2.490 y 3.656 Periodo de seguimiento: 2 años. Duración estimada del estudio: aproximadamente 2 años | Demostrar la superioridad del implante de stent guiado por OCT frente al guiado angiográfico estándar en los resultados clínicos de los pacientes | Una expansión aceptable del stent (una AMS de, al menos, el 90% en los segmentos proximal y distal del stent con relación al segmento de referencia más próximo). Ambos segmentos de referencia, proximal y distal, tienen un área luminal mínima ≥ 4,5 mm2. Ausencia de una disección mayor de los bordes definida como ≥ 60° de la circunferencia del vaso en el punto de disección y una longitud ≥ 3 mm | Fracaso del vaso diana, un compuesto de muerte cardiovascular, IM del vaso diana o revascularización del vaso diana motivada por la isquemia |
| DKCRUSH VIII NCT0377065 | Ivus frente a angiografía | Estudio randomizado, controlado, multicéntrico. Muestra: 556 pacientes Aleatorización 1:1 | Evaluar la superioridad de la estrategia de DKCrush en bifurcaciones complejas guiado por IVUS frente a guiado por angiografía | Para TCI: AMS de al menos 10 mm2 (TCI), 7 mm2 (DA), 6 mm2 (Cx) Expansión del stent al menos 90% respecto al área luminal de referencia distal en Cx Índice de simetría > 0,8 Para no-TCI AMS de al menos 6 mm2 en el vaso principal y 5 mm2 en ostium de rama secundaria Expansión del stent al menos 90% del área luminal de la referencia distal Índice de simetría > 0,8 | El objetivo primario es el fracaso de vaso diana a 12 meses: muerte cardiaca, infarto de miocardio atribuído a vaso diana, revascularización de vaso diana guiado por clínica |
| OCTOBER, NCT03171311 | OCT frente a angiografía | Estudio aleatorizado, multicéntrico e iniciado por investigadores. El tamaño calculado de la muestra es de 1.200 pacientes aleatorizados en proporción 1:1 | Demostrar la superioridad del implante de stent guiado por OCT frente al guiado angiográfico estándar en lesiones en bifurcación | Expansión adecuada de stent y vaso (> 90%). Aposición completa del stent. Cobertura óptima de la lesión | El objetivo primario es un compuesto de muerte cardiovascular, infarto de miocardio de la lesión diana y revascularización de la lesión diana motivada por isquemia a los 2 años |
| OCTIVUS NCT03394079 | OCT frente a IVUS | Estudio multicéntrico, aleatorizado y controlado. Todos los pacientes que vayan a ser sometidos a ICP son elegibles Tamaño de la muestra: 2.000 pacientes Aleatorización 1:1 | Comparar la seguridad y eficacia clínia de la estrategia guiada por OCT frente a la guiada por IVUS | Criterios de optimización por IVUS u OCT: Expansión del stent > 80% de la media del área luminal de referencia Ausencia de disecciones mayores (> 60º, > 2 mm de longitud, flap que se extiende a media o adventicia) Ausencia de malaposición Bordes del stent en segmentos con carga de placa < 50% y sin placa rica en lípidos Tamaño del stent basado en referencia luminal distal (0,25 mm redondeado al alza) o basado en referencia membrana elástica externa a membrana elástica externa (0,25 mm redondeado a la baja) | El objetivo primario es el fracaso de vaso diana: muerte cardiaca, infarto de miocardio atribuído a vaso diana o revascularización guiada por isquemia del vaso diana a 1 año |
|
AMS: área mínima del stent; CXI, circunfleja izquierda; DA: descendente anterior; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecografía intravascular; OCT, tomografía de coherencia óptica; TCI: tronco coronario izquierdo. |
|||||
ENSAYOS CLÍNICOS EN CURSO SOBRE INTERVENCIONISMO GUIADO POR ECOGRAFÍA INTRAVASCULAR
El IMPROVE (Impact on revascularization outcomes of IVUS-guided treatment of complex lesions and economic impact, NCT04221815)17 es un estudio multicéntrico, prospectivo y simple ciego que incluirá a 3.100 pacientes. Su objetivo es demostrar la superioridad del implante de stent guiado por IVUS sobre el guiado por angiografía en lesiones complejas (incluidas oclusiones crónicas, lesiones calcificadas, lesiones largas, bifurcaciones y reestenosis del stent) basándose en el área mínima intrastent post-ICP y fracaso del vaso diana definido como un objetivo compuesto de muerte cardiovascular, infarto de miocardio del vaso diana y revascularización del vaso diana motivada por la isquemia a los 12 meses de seguimiento. (tabla 2 y figura 1).
Figura 1. Principales características de pacientes y lesiones incluidos en estudios actualmente en curso sobre intervencionismo guiado por imagen intracoronaria. * Criterios de inclusión funcional: significación funcional de la lesión del vaso principal o isquemia documentada del territorio del vaso principal u otra documentación objetiva de la significación de la lesión. Se requiere evidencia objetiva de isquemia para todas las lesiones diana excepto para aquellas con un porcentaje de estenosis por diámetro > 80% que se consideraría significativo. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; RL: rama lateral.
El IVUS-CHIP (Intravascular ultrasound guidance for complex high-risk indicated procedures, NCT04854070) es un estudio internacional, aleatorizado, controlado, multicéntrico, de poscomercialización y basado en eventos. Aleatoriza, en proporción 1:1, a 2.020 participantes con lesiones coronarias complejas (calcificaciones angiográficas graves, lesiones ostiales, lesiones coronarias con bifurcaciones verdaderas, lesiones en tronco coronario izquierdo, oclusiones crónicas, reestenosis del stent, lesiones largas) o que precisen una ICP electiva asistida por soporte circulatorio mecánico a recibir una ICP guiada por IVUS o por angiografía. El objetivo del estudio es demostrar la superioridad de la estrategia de ICP guiada por IVUS en lo que al objetivo primario se refiere, que es el fracaso del vaso diana definido como un compuesto de muerte cardiovascular, infarto de miocardio por afectación del vaso diana o revascularización del vaso diana por motivos clínicos (tabla 2 y figura 1).
El OPTIMAL (Optimization of left main PCI with intravascular ultrasound, NCT04111770) es un estudio internacional, aleatorizado, controlado y multicéntrico. Aleatorizará, en proporción 1:1, a 800 pacientes para recibir una ICP guiada por IVUS o por angiografía. Este estudio incluirá a pacientes con lesiones de novo (ostiales, distales o del tercio medio) del tronco coronario izquierdo aptos para recibir una ICP según el equipo multidisciplinar, así como lesiones de todas las bifurcaciones en el tronco coronario izquierdo según la clasificación de Medina tipo 100, 110, 101, 011, 010, 111, 001 (y TCI equivalentes). Por último, incluirá a pacientes con cirugías de revascularización coronaria previas que no tengan puentes coronarios permeables hacia la coronaria izquierda. El objetivo primario del estudio es un objetivo compuesto orientado al paciente: un compuesto de mortalidad por cualquier causa, cualquier accidente cerebrovascular, cualquier infarto de miocardio y cualquier revascularización por motivos clínicos tras 2 años de seguimiento (tabla 2 y figura 1).
El DK CRUSH VIII (NCT03770650) es un ensaya clínico controlado, multicéntrico y aleatorizado cuyo objetivo es valorar la superioridad de la revascularización mediante técnica de DK crush guiada por IVUS respecto a la guiada por angiografía. Incluirá a 556 pacientes con lesiones en bifurcaciones complejas basadas en los criterios DEFINITION. El objetivo primario incluye la muerte cardiaca, el fallo del vaso diana, el infarto de miocardio atribuido a vaso diana o la revascularización del vaso diana a 12 meses (tabla 2 y figura 1).
ENSAYOS CLÍNICOS EN CURSO SOBRE INTERVENCIONISMO GUIADO POR TOMOGRAFÍA DE COHERENCIA ÓPTICA
En el pasado, el ILUMIEN III (NCT02471586), que estudió la no inferioridad de la OCT frente a la IVUS (área mínima del stent; intervalo de confianza unilateral del 97,5% más bajo: –0,70 mm²; p = 0,001), demostró la superioridad de la estrategia de implante de stent guiado por OCT sobre el guiado angiográfico, ya que lograba mayores dimensiones luminales post-ICP y mejoraba los resultados cardiovasculares de pacientes con características clínicas de riesgo alto o lesiones angiográficas de alto riesgo. El estudio ILUMIEN IV (NCT03507777), que ha completado ya la fase de reclutamiento de pacientes (unos 3.600 programados inicialmente), pretende demostrar la superioridad de una estrategia de implante de stent guiado por OCT sobre el guiado angiográfico logrando mayores dimensiones luminales post-ICP y mejorando los resultados cardiovasculares clínicos de pacientes con características clínicas de alto riesgo como diabetes o lesiones angiográficas de alto riesgo. Se espera que los resultados de ambos estudios y sus similares objetivos arrojen luz sobre el papel de la OCT en el guiado de la ICP sobre lesiones coronarias complejas (tabla 2 y figura 1).
Otro estudio en el que se valora el papel de la OCT es el ensayo europeo multicéntrico, aleatorizado e iniciado por investigadores OCTOBER (European trial on optical coherence tomography optimized bifurcation event reduction; NCY3171311), cuyo objetivo es demostrar la superioridad del implante de stent guiado por OCT frente al guiado por angiografía estándar en lesiones en bifurcación. La aleatorización se encuentra estratificada como: a) enfermedad de tronco coronario izquierdo o no y b) técnica inicial de implantación de stent único seguido de inflado final con la técnica de kissing balloon o de doble stent18.
Se ha programado una comparativa directa entre OCT e IVUS en el OCTIVUS (NCT03394079), un estudio multicéntrico y controlado de una población de pacientes no seleccionados que serán aleatorizados a recibir una ICP guiada por OCT o por IVUS20. El objetivo primario es un compuesto de muerte, infarto de miocardio del vaso diana y revascularización del vaso diana motivada por la isquemia al cabo de 1 año (tabla 2 y figura 1).
CONCLUSIONES
No cabe duda de que la imagen intravascular tiene un papel esencial a la hora de optimizar el implante de stent. No obstante, todavía se desconoce la magnitud de este beneficio en poblaciones com- plejas. Según la evidencia arrojada por estudios ya publicados favorables a la ICP guiada por imagen intravascular, se espera que los ensayos clínicos aleatorizados y todavía en curso que presentamos confirmen un descenso de los eventos cardiovasculares adversos mayores y, en última instancia, avalen el uso de la imagen intracoronaria en esta población. Incluso se podría predecir un aumento importante en el uso de IVUS/OCT basándose en los resultados positivos obtenidos y al acceso a mayores reembolsos con la esperanza de que se produzcan cambios en las recomendaciones de las guías clínicas de las distintas sociedades científicas.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
H. M. Garcia-Garcia es el responsable del diseño del estudio y de la redacción del manuscrito. E. Fernández-Peregrina, K.O. Kuku y R. Diletti también redactaron el manuscrito y realizaron la revisión crítica del mismo.
CONFLICTO DE INTERESES
H. M. Garcia-Garcia y K. O. Kuku declaran que sus respectivos centros recibieron becas de investigación de Biotronik, Boston Scientific, Medtronic, Abbott Vascular, Neovasc, Shockwave, Phillips y Corflow. R. Diletti declara haber recibido becas de investigación para su centro de Biotronik y Boston Scientific. E. Fernández-Peregrina declara haber recibido una beca de investigación de la Sociedad Española de Cardiología.
BIBLIOGRAFÍA
1. de Jaegere P, Mudra H, Figulla H, et al. Intravascular ultrasound-guided optimized stent deployment. Immediate and 6 months clinical and angiographic results from the Multicenter Ultrasound Stenting in Coronaries Study (MUSIC Study). Eur Heart J. 1998;19:1214-1223.
2. Chieffo A, Latib A, Caussin C, et al. A prospective, randomized trial of intravascular-ultrasound guided compared to angiography guided stent implantation in complex coronary lesions:the AVIO trial. Am Heart J. 2013;165):65-72.
3. Tian N-L, Gami S-K, Ye F, et al. Angiographic and clinical comparisons of intravascular ultrasound- versus angiography-guided drug-eluting stent implantation for patients with chronic total occlusion lesions:two-year results from a randomised AIR-CTO study. EuroIntervention. 2015;10:1409-1417.
4. Kim B-K, Shin D-H, Hong M-K, et al. Clinical Impact of Intravascular Ultrasound-Guided Chronic Total Occlusion Intervention With Zotarolimus-Eluting Versus Biolimus-Eluting Stent Implantation:Randomized Study. Circ Cardiovasc Interv. 2015;8:e002592.
5. Hong S-J, Kim B-K, Shin D-H, et al. Effect of Intravascular Ultrasound-Guided vs Angiography-Guided Everolimus-Eluting Stent Implantation:The IVUS-XPL Randomized Clinical Trial. JAMA. 2015;314:2155-2163.
6. Park S-J, Kim Y-H, Park D-W, et al. Impact of Intravascular Ultrasound Guidance on Long-Term Mortality in Stenting for Unprotected Left Main Coronary Artery Stenosis. Circ Cardiovasc Interv. 2009;2:167-177.
7. Jakabcin J, Spacek R, Bystron M, et al. Long-term health outcome and mortality evaluation after invasive coronary treatment using drug eluting stents with or without the IVUS guidance. Randomized control trial. HOME DES IVUS. Catheter Cardiovasc Interv. 2010;75:578-583.
8. Kim J-S, Kang T-S, Mintz GS, et al. Randomized comparison of clinical outcomes between intravascular ultrasound and angiography-guided drug-eluting stent implantation for long coronary artery stenoses. JACC Cardiovasc Interv. 2013;6:369-376.
9. Sheth TN, Kajander OA, Lavi S, et al. Optical Coherence Tomography-Guided Percutaneous Coronary Intervention in ST-Segment-Elevation Myocardial Infarction:A Prospective Propensity-Matched Cohort of the Thrombectomy Versus Percutaneous Coronary Intervention Alone Trial. Circ Cardiovasc Interv. 2016;9:e003414.
10. Kim I-C, Yoon H-J, Shin E-S, et al. Usefulness of Frequency Domain Optical Coherence Tomography Compared with Intravascular Ultrasound as a Guidance for Percutaneous Coronary Intervention. J Interv Cardiol. 2016;29:216-224.
11. Steinvil A, Zhang Y-J, Lee SY, et al. Intravascular ultrasound-guided drug-eluting stent implantation:An updated meta-analysis of randomized control trials and observational studies. Int J Cardiol. 2016;216:133-139.
12. Shin D-H, Hong S-J, Mintz GS, et al. Effects of Intravascular Ultrasound-Guided Versus Angiography-Guided New-Generation Drug-Eluting Stent Implantation:Meta-Analysis With Individual Patient-Level Data From 2,345 Randomized Patients. JACC Cardiovasc Interv. 2016;9:2232-2239.
13. Levine GN, Bates ER, Blankenship JC, et al. 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. J Am Coll Cardiol. 2011;58:e44-122.
14. Kolh P, Windecker S, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization:the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur J Cardiothorac Surg. 2014;46:517-592.
15. Bavishi C, Sardar P, Chatterjee S, et al. Intravascular ultrasound-guided vs angiography-guided drug-eluting stent implantation in complex coronary lesions:Meta-analysis of randomized trials. Am Heart J. 2017;185:26-34.
16. Ali Z, Landmesser U, Karimi Galougahi K, et al. Optical coherence tomography-guided coronary stent implantation compared to angiography:a multicentre randomised trial in PCI - design and rationale of ILUMIEN IV:OPTIMAL PCI. EuroIntervention. 2021;16:1092-1099.
17. Shlofmitz E, Torguson R, Mintz GS, et al. The IMPact on Revascularization Outcomes of intraVascular ultrasound-guided treatment of complex lesions and Economic impact (IMPROVE) trial:Study design and rationale. Am Heart J. 2020;228:65-71.
18. Holm NR, Andreasen LN, Walsh S, et al. Rational and design of the European randomized Optical Coherence Tomography Optimized Bifurcation Event Reduction Trial (OCTOBER). Am Heart J. 2018;205:97-109.
19. Ge Z, Kan J, Gao XF et al. Comparison of intravascular ultrasound-guided with angiography-guided double kissing crush stenting for patients with complex coronary bifurcation lesions:Rationale and design of a prospective, randomized, and multicenter DK CRUSH VIII Trial. Am Heart J. 2021;234:101-110.
20. Kang DY, Ahn JM, Park H et al. Comparison of optical coherence tomography-guided percutaneous coronary intervention:Rationale and design of a randomized, controlled OCTIVUS trial. Am Heart J. 2020;228:72-80.
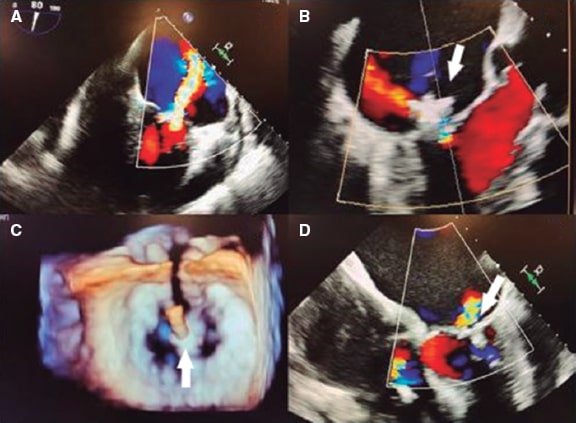
RESUMEN
Inicialmente el clip mitral surge como alternativa a la cirugía en pacientes con insuficiencia mitral (IM) grave y alto riesgo quirúrgico. Sin embargo, recientemente se ha posicionado también como tratamiento de primera línea en pacientes con fracción de eyección del ventrículo izquierdo del 20-50%, con diámetro telesistólico ventricular izquierdo < 70 mm y presión sistólica pulmonar < 70 mmHg. Su éxito depende de la disminución de la gravedad de la IM. Los parámetros usados para cuantificar la IM nativa no se han validado de manera adecuada en presencia de clip, por lo que resulta controvertido establecer cuál es el método de elección para valorar la IM residual en la ecocardiografía transesofágica intraprocedimiento. La escasa evidencia disponible carece de estudios de validación. Pese a sus limitaciones, parece que el Doppler color, el área de superficie de isovelocidad proximal y su área derivada, la señal del Doppler continuo, el flujo transmitral y el volumen regurgitante no son fiables debido a los artefactos producidos por el clip. La combinación de la anchura de la vena contracta, el área de la vena contracta medida por ecografía tridimensional y el patrón del flujo en las venas pulmonares parece arrojar resultados satisfactorios. La evaluación integral con varios parámetros es lo más completo.
Palabras clave: Clip mitral. Insuficiencia mitral. Ecocardiografia transesofagica intraprocedimiento. Cuantificacion de la insuficiencia mitral.
ABSTRACT
Initially, percutaneous mitral clip emerges as an alternative to surgery in patients with severe mitral regurgitation (MR) and high surgical risk. Nonetheless, it is now also considered a first-line treatment in patients with left ventricular ejection fractions somewhere between 20% and 50%, end-systolic diameters < 70 mm, and pulmonary systolic pressures < 70 mmHg. Successful results depend on reducing the severity of MR. The common parameters used to evaluate native MR have not been properly validated in this context. Therefore, the parameters that should be used to quantify residual MR during intraprocedural transesophageal echocardiography are still under discussion. There is scarce evidence and no validation studies. Although these have limitations, color Doppler echocardiography, proximal isovelocity surface area (PISA) and its derived area, continuous-wave Doppler signal, transmitral flow, and regurgitant flow are not accurate parameters to quantify residual MR due to clip artifacts. On the other hand, the width of the vena contracta, the 3D-vena contracta area, and pulmonary venous flow are associated with a satisfactory approach. Using a comprehensive method is the most practical thing to do.
Keywords: Mitral clip. Mitral regurgitation. Intraoperative transesophageal echocardiography. Mitral regurgitation assessment.
Abreviaturas
IM: insuficiencia mitral. PISA: area de isovelocidad proximal. ETE: ecocardiografia transesofagica.
INTRODUCCIÓN
La reparación mitral percutánea con clip se desarrolló inicialmente como una alternativa terapéutica a la cirugía mitral en caso de riesgo quirúrgico inaceptable e insuficiencia mitral (IM) grave sintomática1,2. De acuerdo con la última evidencia científica, la Sociedad Europea de Cardiología y la American Heart Association han considerado el clip como tratamiento de primera línea en pacientes con IM grave sintomática pese a recibir un tratamiento médico óptimo, con fracción de eyección del ventrículo izquierdo del 20-50%, diámetro telesistólico ventricular izquierdo < 70 mm y presión sistólica pulmonar < 70 mmHg3,4. El procedimiento consiste en una aproximación central de los bordes libres de los velos, creando un doble orificio a ambos lados del dispositivo5.
La cuantificación de la IM sobre la válvula nativa supone un reto en la práctica clínica debido a la forma de la válvula (ovalada, 2 comisuras en distintos planos, dividida en 3 festones anteriores y 3 posteriores), la limitación de la ecocardiografía transtorácica y transesofágica en 2 y 3 dimensiones (2D y 3D) con respecto a la orientación del transductor y los cortes de los planos, y la dependencia del operador. Si se modifica la morfología de la válvula mediante un clip, la valoración aún puede ser más complicada.
Cuando el clip aproxima los bordes libres de los festones centrales anterior y posterior (A2-P2) se producen una serie de modificacio- nes en el plano de coaptación que afectan a su valoración (figura 1)6: a) se crean 2 o más orificios de regurgitación (según el número de clips implantados) en la línea de coaptación, adyacentes al dispositivo; b) los nuevos orificios adoptan una geometría irregular en la que no deben aplicarse asunciones geométricas circulares o elípticas; y c) el dispositivo genera una sombra acústica sobre la válvula, que interfiere en la imagen del Doppler color (figura 2)7.
Figura 1. Imagen de ecocardiografía transesofágica tridimensional. A: área valvular mitral (AVM) antes de la reparación percutánea (antes RPVM), señalada dentro del círculo. B: comisura anterolateral (AL) y posteromedial (PM) antes de colocar el clip. La flecha indica el área valvular mitral. C: área valvular mitral del orificio) medial (AVM medial) tras colocar el clip (señalado con la flecha), delimitado por la comisura PM. D: doble orificio residual tras colocar el clip (después RPVM); el PM y el AL se señalan con círculos. E: área valvular mitral del orificio lateral (AVM lateral) residual tras colocar el clip (señalado con la flecha), delimitado por la comisura AL. Ambos orificios residuales se encuentran en distintos planos. Ao: aorta. Reproducida con permiso de Ikenaga et al.5.
Figura 2. Imagen de ecocardiografía transesofágica bidimensional. A: insuficiencia mitral previa a la colocación del clip. B: se aprecia el clip como una sombra acústica. En la imagen en color se ve la dificultad de valorar el radio del área de isovelocidad proximal y la vena contracta por interferencia del dispositivo (señalado con la flecha). Reproducida con permiso de Mayo Clinic7.
Debido a esto, actualmente los parámetros de valoración de la IM clásicos no se deben aplicar a la IM residual tras el implante de un clip. No obstante, es importante una valoración adecuada, ya que determina el éxito del procedimiento y tiene valor pronóstico8. La IM residual > 2/4 supone un mayor riesgo de eventos cardiacos mayores, muerte cardiaca y cirugía de válvula mitral o re-do de reparación percutánea con clip, así como un mayor riesgo de progresión en el tiempo, más sintomatología y peor supervivencia a los 12 meses8-11. Por otro lado, el implante de excesivos clips puede aumentar el gradiente transmitral y producir estenosis mitral, lo cual también aumenta la mortalidad a los 12 meses12,13. Pese a esta importancia pronóstica, no hay un parámetro bien establecido ni guías con recomendaciones detalladas que basen los resultados en estudios observacionales y tomen como referencia la evaluación por operadores expertos.
Los estudios iniciales (EVEREST I14, COAPT15 y MITRA-FR16) realizaron las medidas en laboratorios centrales. En el caso del estudio EVEREST I14, la valoración de la gravedad de la IM residual se hizo mediante el área de color del chorro, el patrón del flujo en las venas pulmonares, el volumen regurgitante y la fracción regurgitante. Se describe específicamente que no se usan el área de isovelocidad proximal (PISA) ni la anchura de la vena contracta por las limitaciones visuales que el dispositivo genera al interferir en la imagen (figura 2)7. En el COAPT-Trial se especifica que no se obtuvo el PISA por la misma razón, y para la anchura de la vena contracta se escogía la del chorro predominante en caso de múltiples chorros, o bien se sumaba la de todos ellos17. Sin embargo, el estudio MITRA-FR reporta únicamente el área del orificio efectivo 2D y el volumen regurgitante16. Como puede apreciarse, hay disparidades entre los parámetros utilizados, lo que refleja la falta de consenso.
La evidencia científica tiene resultados controvertidos. Únicamente se dispone de una guía de la American Society of Echocardiography de 20192 y de un consenso de expertos de la Sociedad Europea de Ecocardiografía y la American Society of Echocardiography18. Basándose en esto, las recomendaciones hacen referencia a la valoración de la insuficiencia mediante ecocardiografía transesofágica (ETE) intraprocedimiento e inmediatamente posterior, teniendo en cuenta el efecto de la sedación o de la anestesia general2. Estas guías intentan orientar la valoración de la gravedad de la IM residual, pero sin directrices específicas, lo que genera variabilidad en los resultados de cada centro y deja la valoración sujeta a la experiencia del operador.
MÉTODOS
Se hizo una búsqueda bibliográfica en las principales bases de da- tos internacionales (PubMed, Embase y Cochrane), usando los si- guientes términos MeSH: “mitral regurgitation AND MitraClip AND echocardiographic assessment “, “severity of residual mitral regurgitation after MitraClip”, “3D vena contracta area after MitraClip”, “TEE vena contracta after MitraClip”, “vena contracta area and MitraClip”, “vena contracta area after MitraClip”, “pulmonary venous flow after MitraClip”, “MitraClip and pulmonary flow”,” pulmonary venous flow and prediction of MitraClip”, “continuous doppler mitral regurgitation after MitraClip”, “mitral regurgitation doppler signal after MitraClip”, “doppler wave after MitraClip”, “transmitral doppler after MitraClip”, “E-wave after MitraClip”, “spontaneous contrast in LA after MitraClip”, “ratio VTI mitral and VTI LVOT after MitraClip”, “stroke volume after MitraClip”, “PISA after MitraClip” y “EROA and PISA and MitraClip”. Se usaron los filtros de idioma en español e inglés, y no se especificó ningún límite de antigüedad.
RESULTADOS
La evidencia se basa en estudios de pequeño o mediano tamaño muestral, observacionales, que usan como referencia la valoración por un operador experto o los parámetros de los estudios originales que no están validados. Según las recomendaciones del consenso más reciente2, a continuación se resume la evidencia específica para cada parámetro.
Doppler color
Es una valoración visual del tamaño del chorro, del número de chorros y de su origen y dirección. Tiende a sobreestimar la gravedad en caso de chorros múltiples y a infraestimarla en caso de chorros excéntricos19, si bien sirve para hacer un barrido inicial de los chorros residuales. Lin et al.20 y Altiok et al.6 señalan que aunque el volumen regurgitante de una IM sea el mismo por un chorro que por varios, el área en color es mayor cuando son múltiples chorros y se sobreestima la gravedad (figura 3)20. Por estos motivos, se desestima en los estudios como parámetro aislado.
Figura 3. Influencia de la dinámica de fluidos en el área del chorro en color. El volumen de regurgitación desde el ventrículo hacia la aurícula genera una interfase de velocidad entre este y la sangre de la aurícula, creando una superficie de cizallamiento donde se producen vórtices de sangre que encarrilan más sangre de su alrededor. El área en color del chorro aparece magnificada con respecto al volumen de regurgitación inicial. En A y B se ve que cuando el mismo volumen pasa a través de 2 orificios, cercanos o distantes entre sí, ambos chorros se funden debido a la formación de vórtices y da la impresión de una mayor gravedad. En C y D se aprecia que, para un mismo volumen (10 ml), se duplica el número de píxeles generados en función del número de orificios. Reproducida con permiso de Lin et al.20.
Convergencia del flujo (radio del PISA)
Para el cálculo del radio del PISA y del área del orificio regurgitante derivada deben crearse hemiesferas de isovelocidad del flujo convergente. Cuando se interpone un clip, no pueden crearse estas hemiesferas y la medición es técnicamente errónea2. Así, en caso de múltiples chorros, de chorros excéntricos o de gran sombra acústica se tiende a infraestimar o sobrestimar la gravedad. No está definida la gravedad de la regurgitación según la suma de múltiples PISA, por lo que no puede aplicarse. Debido a estas limitaciones, en los estudios originales de la reparación percutánea con clip14-16 no se estudió el PISA (figura 2 y figura 4)7,21.
Figura 4. Imagen de ecocardiografía transesofágica bidimensional. Pue- de verse la sombra acústica producida por el clip (flecha). Reproducida con permiso de Lesevic et al.21.
Anchura de la vena contracta
Si el orificio regurgitante no se aprecia bien (chorro pequeño o excéntrico, interferencia del clip), la medida puede presentar un artefacto (figura 5)22. Se debe usar con precaución, pues no está validada y tampoco se han establecido valores de gravedad en caso de múltiples chorros14. No hay estudios que evalúen este parámetro específicamente. Las guías americanas2 solo establecen que un valor ≥ 7 mm es específico de gravedad, y dado que el estudio COAPT lo utilizó en su valoración de IM residual17, podría considerarse en la práctica, sobre todo en caso de un chorro predominante no excéntrico. En los chorros excéntricos, la medida es menos fiable (similar a la IM nativa) y se recomienda promediar varios latidos2, pero se desestima como parámetro aislado.
Figura 5. Imágenes de ecocardiografía transesofágica bidimensional y tridimensional. A: insuficiencia mitral grave inicial. B: insuficiencia mitral residual tras la colocación del clip; se aprecia la interferencia del dispositivo (flecha) en la visualización de la vena contracta. C: imagen tridimensional del clip (flecha) y los 2 orificios residuales. D: Doppler color que muestra la insuficiencia mitral residual sin que pueda visualizarse la vena contracta por interferencia del clip (flecha). Reproducida con permiso de Elbey et al.22.
Área de la vena contracta tridimensional
Permite una mejor delineación del orificio regurgitante, pero con riesgo de efecto blooming (magnificación del área por una alta ganancia del Doppler color). Según el consenso citado2, se debe hacer de cada chorro por separado y luego sumar las áreas.
El área de la vena contracta por planimetría 3D es uno de los parámetros más estudiados para evaluar la IM tras la implantación de un clip, por su precisión y reproducibilidad, con escasa variabilidad interobservador21,23. Si bien no fue un parámetro usado en los primeros estudios14, ha ido ganando protagonismo. Esto se debe a la mejor delineación del orificio, sin asunciones geométricas, y a que no presenta los inconvenientes de los artefactos creados en otras medidas (figura 6)24. Su uso se apoya en que el parámetro más sólido para cuantificar la IM nativa es el área del orificio regurgitante19. Para su cálculo, varios estudios han demostrado que la planimetría 3D directa por ETE es el método más reproducible y preciso6,13,23.
Figura 6. Imagen de ecocardiografía transesofágica bidimensional. En A y B se calcula el área efectiva del orificio regurgitante según el área de isovelocidad proximal, con un resultado de 0,32 cm2. Cálculo del área de isovelocidad proximal 2D: área efectiva del orificio regurgitante = 2π × r2 × velocidad de aliasing / velocidad máxima de la insuficiencia mitral = [6,28 × (0,79) 2 × 38,2] / 472 = 150 / 472 = 0,32 cm2. C: cuando se realiza la medida por planimetría directa 3D, el resultado es de 0,41 cm2. La determinación directa por planimetría 3D permite una medida más fiable del orificio al eliminar los artefactos derivados de la medida indirecta. Reproducida con permiso de Katz et al.24.
Hyodo et al.25 valoraron si era adecuada la medida 3D de múltiples áreas de la vena contracta para cuantificar la gravedad de la IM en válvulas nativas. Hasta entonces se conocía su utilidad en chorros únicos, pero este fue el primer estudio en aportar resultados con múltiples chorros. Aunque se trata de un estudio de pequeño tamaño muestral (n = 60), en él se demostró una alta correlación entre el área 3D y el área del orificio regurgitante medida por termodilución como método de referencia. La correlación era más evidente en chorros moderados o graves, mientras que se sobrestimaba en caso de chorros ligeros. Tras su implementación en la IM sobre válvula nativa, se valoró su utilidad en los pacientes con clip mitral. En esta línea, Avenatti et al.13 llevaron a cabo un estudio retrospectivo con 155 pacientes. Se aplicó la suma de las áreas de múltiples chorros y se compararon los resultados entre el laboratorio de ecocardiografía local y ecocardiografistas expertos de 2 centros de alto volumen. En las curvas ROC (receiver operating characteristic) determinaron un umbral de 0,27 cm2 para identificar IM moderada o más grave, con un área bajo la curva de 0,81 y un valor predictivo negativo del 92%. Aunque presenta limitaciones, sus resultados son congruentes con los de otros registros y estudios observacionales rea- lizados en centros expertos14,26, que abogan por el uso de esta nueva medida, pero con la necesidad de estudios de validación. Sin embargo, hay que ser precavido respecto a la suma de las áreas de varios chorros, pues solo se cuenta con los 2 estudios mencionados, que en total suman 215 pacientes.
Por último, Altiok et al.6 aportaron más luz sobre la utilidad del área de la vena contracta medida por ecocardiografía 3D en la IM residual. En 39 pacientes, compararon las medidas del área del orificio regurgitante de la IM residual obtenidas por ecocardiografía transtorácica 2D (a través del PISA) con ETE 3D (área por planimetría de la vena contracta). En sus resultados, la variabilidad interobservador era mayor con la 2D que con la 3D, lo que pone de manifiesto la precisión que otorga la visualización directa del orificio regurgitante comparada con la medida indirecta a través del PISA, que infraestima la gravedad. De esta manera, aunque tampoco es un estudio de validación del área por ETE 3D de la vena contracta, puede concluirse que la medida directa del área por ETE 3D es reproducible y factible en esta población (figura 7 y figura 8)13.
Figura 7. Imágenes de ecocardiografía transesofágica bidimensional y tridimensional. A: se aprecia un primer chorro de insuficiencia mitral (chorro RM 1) tras la colocación del clip (flechas, MC). B: se aprecia un segundo chorro (chorro RM 2) tras la colocación del clip (flechas, MC). C: cálculo del área 3D con la vena contracta (VCA1) del primer chorro, con resultado de 0,07 cm2. D: cálculo del área 3D con la vena contracta (VCA2) del segundo chorro, con resultado de 0,11 cm2. La suma de las áreas 3D por vena contracta (total VCA1+2) es de 0,18 cm2. AVC: área de la vena contracta; MC: MitraClip; RM: regurgitación mitral. Reproducida con permiso de Avenatti et al.13.
Figura 8. Imágenes de ecocardiografía transesofágica tridimensional para valorar el área de la vena contracta. A: Doppler color 3D de insuficiencia mitral residual tras la colocación del clip. B: alineación de los ejes para obtener el área 3D de la vena contracta. C: trazado de la planimetría 3D. Reproducida con permiso de Avenatti et al.13.
En conclusión, el área de la vena contracta por ETE 3D es un parámetro prometedor, y el único que permitiría la suma de varios chorros12, aunque su uso está en fase precoz y es necesaria más evidencia. Es un método laborioso, pues requiere análisis con software y está sujeto al efecto blooming, que puede sobrestimar el área. Además, en caso de hacer la medida del área del orificio regurgitante con color, esta se ve afectada por la resolución temporal y la configuración de la velocidad de aliasing (saturación de la señal), que no está estandarizada en los distintos software12. Debido a estas limitaciones, en la práctica es difícil de aplicar y no es el principal parámetro utilizado. Posiblemente su utilidad sea mayor en caso de chorros excéntricos27, dado que en estos tiende a haber una asimetría inicial entre los velos, por lo que el chorro residual puede ser excéntrico aunque se implante adecuadamente un clip. La planimetría directa por 3D será más precisa, como muestra el estudio de Utsonomiya et al.27, si bien no hay más literatura al respecto.
Patrón del flujo en las venas pulmonares
Este parámetro cobra relevancia dadas las limitaciones de la valoración de la IM en la propia válvula. En caso de insuficiencia grave (3/4 o 4/4), el flujo sistólico pulmonar se invierte por completo o parcialmente en una o más venas pulmonares19,28 respecto al aumento de la presión de la aurícula izquierda (figura 9)29.
Figura 9. Esquema de las ondas de presión auriculares y el flujo pulmonar. Arriba: presión de la aurícula izquierda con las ondas correspondientes. Centro: flujo normal de las venas pulmonares, con una onda sistólica > diastólica. Abajo: flujo en las venas pulmonares con onda sistólica reversa en presencia de insuficiencia mitral grave. FSR: flujo sistólico reverso; ORA: onda reversa atrial; VMA: válvula mitral abierta; VMC: válvula mitral cerrada. Reproducida con permiso de Klein et al.29.
Asimismo, se ha estudiado su potencial como variable pronóstica. Ikenaga et al.28 valoraron la ratio integral velocidad/tiempo (IVT) sistólica/IVT diastólica medida en la vena pulmonar superior izquierda (salvo que las derechas fueran visibles y tuvieran mayor afectación). Con las curvas ROC, establecieron que el punto de corte de 0,72 tuvo la mejor área bajo la curva (0,67), con una sensibilidad del 61% y una especificidad del 73%. Así, una ratio < 0,72 se relacionó con más eventos cardiacos mayores (hazard ratio [HR] ajustada de 1,26; intervalo de confianza del 95% [IC95%], 1,01-1,54; p = 0,047). Dado que la curva del flujo pulmonar puede ser difícil de obtener, se hicieron los mismos cálculos con la relación pico de velocidad sistólico/pico de velocidad diastólico, y el punto de corte con mejor área bajo la curva (0,62) fue 0,83. Este parámetro también se asoció de manera significativa con eventos cardiacos mayores a los 12 meses (HR ajustada = 3,05; IC95%, 1,53-6,30; p = 0,002). Puesto que el flujo en las venas pulmonares se correlaciona con la presión auricular izquierda30, cuando se reduce la IM disminuye la presión en la aurícula izquierda y aumenta el componente sistólico venoso pulmonar. Al hacer de nuevo una curva ROC, la ratio velocidad pico sistólico/velocidad pico diastólico > 1,09 predijo una presión auricular izquierda ≤ 12 mmHg (normal) con una sensibilidad del 71% y una especificidad del 62%. La ratio pico sistólico de velocidad/pico diastólico de velocidad < 0,98 predijo una presión en la aurícula izquierda ≥ 20 mmHg con una sensibilidad del 77% y una especificidad del 71% (figura 10 y figura 11)28. Sin embargo, no está exento de limitaciones5,28, pues en caso de fibrilación auricular el flujo sistólico se reduce por la pérdida de contracción y relajación auricular, y en pacientes de edad avanzada aumenta la rigidez de la aurícula y disminuye la ratio flujo sistólico/flujo diastólico. No hay valores de corte estandarizados y en ocasiones no es posible hacer la medida por la dirección del chorro; si los chorros son excéntricos, estos afectan diferencialmente a cada par de venas pulmonares y pueden producir artefactos que interfieran en la valoración de la IM. En los estudios que valoran el flujo en las venas pulmonares28 se afronta esto comparando siempre la misma vena pulmonar basalmente y tras la colocación del clip. Todavía hay pocos estudios, pero en combinación con otros parámetros puede formar parte de una valoración integral, sobre todo haciendo una comparación entre antes y después de poner el clip (figura 12 y figura 13)24,31.
Figura 10. Imagen de ecocardiografía transesofágica bidimensional. A: Doppler color de la insuficiencia mitral residual tras la colocación del clip (flecha). B: se expone el flujo en la vena pulmonar superior izquierda correspondiente, con atenuación de la onda sistólica (S) con respecto a la diastólica (D). La integral velocidad/tiempo sistólica es de 7,5 cm y la diastólica es de 14 cm. La ratio entre ambas es de 0,54, que indicaría un riesgo más alto de eventos cardiovasculares mayores. En este caso, la colocación del clip es subóptima. AI: aurícula izquierda; VI: ventrículo izquierdo. Reproducida con permiso de Ikenaga et al.28.
Figura 11. Imagen de ecocardiografía transesofágica bidimensional. A: Doppler color de la insuficiencia mitral residual tras colocar el clip (flecha). B: flujo en la vena pulmonar superior izquierda con onda sistólica (S) mayor que onda diastólica (D). La integral velocidad/tiempo sistólica fue de 23 cm y la diastólica de 10 cm, con una ratio de 2,3, compatible con un resultado óptimo en el seguimiento. AI: aurícula izquierda; VI: ventrículo izquierdo. Reproducida con permiso de Ikenaga et al.28.
Figura 12. Imágenes de ecocardiografía transesofágica bidimensional. A: Doppler color de insuficiencia mitral grave (previa al clip mitral) con el patrón de flujo de las venas pulmonares. La onda sistólica (S) está invertida. B: se observa la insuficiencia mitral tras colocar el clip, con un patrón de flujo en las venas pulmonares corregido (onda sistólica [S] > onda diastólica [D]). Reproducida con permiso de Ikenaga et al.31.
Figura 13. Imágenes del flujo en las venas pulmonares. A: flujo pulmonar en la vena pulmonar superior izquierda (LUPV) previo al clip, con onda sistólica (S) invertida con respecto a la onda diastólica (D). B: flujo en la vena pulmonar superior derecha (RUPV) previo al clip, con onda S invertida con respecto a la onda D. C: flujo en la LUPV posterior al clip, con onda S mayor que onda D. D: flujo en la RUPV posterior al clip, con onda S mayor que onda D. Reproducida con permiso de Katz et al.24.
Doppler continuo del chorro
En la IM valvular nativa, el Doppler continuo del chorro puede orientar, pero no es lo bastante sensible como para usarlo de manera aislada o guiar un tratamiento19. Igualmente, en caso de implante de clip, cuanto mayor sea la densidad de la señal del Doppler color mayor es la probabilidad de gravedad, pero en caso de múltiples chorros no puede valorarse de manera adecuada2 (figura 14)30. Tampoco se han llevado a cabo estudios sobre su utilidad.
Figura 14. Imagen de ecocardiografía transesofágica. Se observa el Doppler de un único chorro de insuficiencia mitral grave. La forma es triangular y la densidad es alta, sugestivo de gravedad. Reproducida con permiso de López-Opitz y Moreno-Urrutia30.
Doppler del flujo transmitral
El descenso en la velocidad de la onda E sugiere una menor gravedad de la IM nativa, sin cuantificarla2. No es útil para la evaluación de la IM residual tras la colocación de un clip, dado que al aproximar los bordes de los velos mitrales se genera un aumento del gradiente transmitral30. Por tanto, una velocidad aumentada no es indicativa de IM residual significativa.
Presión en la aurícula izquierda con aparición de contraste espontáneo
Al disminuir el volumen de IM aparece estasis en la aurícula (figura 15)32. Puede indicar menor gravedad si aparece contraste espontáneo2, pero no hay estudios que lo valoren.
Figura 15. Imágenes de ecocardiografía transesofágica bidimensional. Se observan 4 grados de contraste espontáneo en la aurícula y la orejuela izquierda, de menor a mayor intensidad (1+ a 4+). AI: aurícula izquierda; OAI: orejuela aurícula izquierda; VI: ventrículo izquierdo. Reproducida con permiso de Ito y Suwa32.
Aumento del volumen latido en el tracto de salida del ventrículo izquierdo
Igual que el anterior, el aumento del volumen latido puede sugerir una reducción de la insuficiencia. Sin embargo, no se ha estudiado la relación entre el volumen latido del ventrículo izquierdo y la gravedad de la IM, aunque se sabe que, si mejora, la IM será menor2.
Cálculo del volumen de regurgitación
No se ha validado en este contexto2 ni tampoco en caso de múltiples chorros.
DISCUSIÓN
La IM residual tras la colocación de un clip condiciona el pronóstico del paciente. Cuando es moderada o grave, la mortalidad a los 12 meses puede llegar a ser el doble que la de aquellos pacientes con IM ligera13. La IM residual más que moderada supone la persistencia de la clínica inicial y un aumento de volumen del ventrículo iz- quierdo y del remodelado cardiaco. Asimismo, si no se hace una adecuada valoración de la gravedad de la IM intraprocedimiento, no es posible precisar el número de clips necesarios. Si estos son excesivos, aumenta el riesgo de estenosis mitral residual, que también empeora el pronóstico.
La principal limitación de los estudios es que el método de referencia utilizado es la evaluación por un operador experto. No hay una herramienta única capaz de evaluar la IM de forma simple, reproducible e independiente del operador, por lo que no se pueden llevar a cabo estudios de validación. Otra de las limitaciones es que las medidas se toman bajo anestesia general, que produce vasodilatación, disminución de la poscarga ventricular y reducción de la IM. No obstante, hay estudios13,23 en que los resultados son reproducibles hasta 4 semanas posprocedimiento, fundamentalmente con el área 3D de la vena contracta. No se ha demostrado que la valoración intraprocedimiento bajo anestesia general infraestime la gravedad de la insuficiencia residual con respecto al seguimiento.
Cada vez más, los estudios se centran en el área 3D de la vena contracta o en el flujo en las venas pulmonares. Si bien tienen limitaciones, los resultados son reproducibles y consistentes. El área 3D de la vena contracta parece ser el parámetro más preciso, dado que la valoración por planimetría 3D es directa, pero está condicionado por su laboriosidad y aplicabilidad a la práctica clínica. Con perspectiva de que esto cambie, los grupos de trabajo se centran en ella por la escasa variabilidad interobservador y la buena correlación con la gravedad de la IM medida por operadores expertos.
El flujo en las venas pulmonares tiene un interés creciente porque traduce la presión auricular izquierda, que está determinada por la gravedad de la IM (aunque la edad y el ritmo auricular influyen). Aun así, cuando se compara el flujo antes y después de la intervención, la diferencia se atribuye al efecto del clip. No obstante, en la IM de válvula nativa es un parámetro muy específico, pero poco sensible. Esto podría extrapolarse a la insuficiencia residual tras el procedimiento.
CONCLUSIONES
La correcta valoración de la IM residual tras el implante de clip mitral tiene implicaciones pronósticas. Sin embargo, no pueden extrapolarse los parámetros utilizados en la IM nativa, dado que el clip genera una serie de artefactos y cambios morfológicos en la válvula. Así como algunos de estos no han demostrado utilidad (Doppler color, flujo transmitral, volumen de regurgitación, etc.), otros parecen prometedores. El área 3D de la vena contracta y el patrón de flujo de las venas pulmonares son los parámetros más prometedores, sobre todo por su correlación con el pronóstico en el seguimiento, si bien no se dispone de estudios de validación. La estandarización de los softwares en todos los centros y la disponibilidad de la ETE 3D son fundamentales para seguir avanzando en el estudio de esta valvulopatía.
La IM residual tras la colocación de un clip tiene unas peculiaridades que no la hacen subsidiaria de ser valorada por los mismos parámetros y valores que la IM nativa. En la práctica se recomienda una aproximación integral y eficiente, usando la anchura de la vena contracta y la variación del flujo en las venas pulmonares, y si es posible, el área 3D de la vena contracta.
Debido al rápido avance de esta técnica, es necesario contar con documentos actualizados que sinteticen la información y permitan acceder a la literatura. Además, deben enfatizar la importancia pronóstica de la IM residual e incentivar estudios de calidad científica, para así en un futuro contar con estudios de validación de parámetros y estandarizar la evaluación de la IM residual tras la colocación de un clip mitral.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
S.P. Cabrera Huerta realizó la búsqueda bibliográfica, seleccionó los artículos de interés y redactó el manuscrito. J.A. De Agustín orientó el trabajo y su contenido, verificó las fuentes bibliográficas referidas y revisó la búsqueda.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
2. Zoghbi W, Asch FM, Bruce C, et al. Guidelines for the evaluation of valvular regurgitation after percutaneous valve repair or replacement. A report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr. 2019;32:431-475.
3. Coats AJS, Anker SD, Baumbach A, et al. The management of secondary mitral regurgitation in patients with heart failure:a joint position statement from the Heart Failure Association (HFA), European Association of Cardiovascular Imaging (EACVI), European Heart Rhythm Association (EHRA), and European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC. Eur Heart J. 2021;42,1254-1269.
4. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease. A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e72-e227.
5. Ikenaga H, Makar M, Rader F, et al. Mechanisms of mitral regurgitation after percutaneous mitral valve repair with the MitraClip. Eur Heart J. 2020;10:1131-1143.
6. Altiok E, Hamada S, Brehmer K, et al. Analysis of procedural effects of percutaneous edge-to-edge mitral valve repair by 2D and 3D echocardiography. Circ Cardiovasc Imaging. 2012;6:748-755.
7. Mayo Clinic. MitraClip treatment of mitral regurgitation after cardiac transplant:Case report. 2020. Disponible en:https://www.mayoclinic.org/medical-professionals/cardiovascular-diseases/news/mitraclip-treatment-of-mitral-regurgitation-after-cardiac-transplant-case-report/mcc-20502193.Consultado 23 Mar 2021.
8. Buzzatti N, De Bonis M, Denti P, et al. What is a “good“result after transcatheter mitral repair?Impact of 2+residual mitral regurgitation. J Thorac Cardiovasc Surg. 2016;1:88-96.
9. Reichart D, Kalbacher D, Rübsamen N, et al. The impact of residual mitral regurgitation after MitraClip therapy in functional mitral regurgitation. Eur J Heart Fail. 2020;22:1840-1848.
10. Paranskaya L, D'Ancona G, Bozdag-Turan I, et al. Residual Mitral Valve Regurgitation After Percutaneous Mitral Valve Repair with the MitraClip System is a Risk Factor for Adverse One-Year Outcome. Catheter Cardiovasc Interv. 2013;81:609-617.
11. Feldman T, Foster E, Glower DD, et al. Percutaneous Repair or Surgery for Mitral Regurgitation. N Engl J Med. 2011;364:1395-1406.
12. Grayburn PA. The Challenge of Assessing Residual Mitral Regurgitation During MitraClip Procedures. Is 3D Vena Contracta Area the Answer? JACC Cardiovasc Interv. 2019:12;592-594.
13. Avenatti E, Mackensen B, El-Tallawi KC, et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC Cardiovasc Interv. 2019;12:582-591.
14. Foster E, Wasserman HS, Gray W, et al. Quantitative Assessment of Severity of Mitral Regurgitation by Serial Echocardiography in a Multicenter Clinical Trial of Percutaneous Mitral Valve Repair. Am J Cardiol. 2007;100:1577-1583.
15. Stone GW, Lindenfeld JA, Abraham WT, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med. 2018;379:2307-2318.
16. Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous Repair or Medial Treatment for Secondary Mitral Regurgitation. N Engl J Med. 2018;379:2297-2306.
17. Asch FM, Grayburn PA, Siegel RJ, et al. Echocardiographic Outcomes After Transcatheter Leaflet Approximation in Patients With Secondary Mitral Regurgitation. The COAPT Trial. J Am Coll Cardiol. 2019;74:2969-2979.
18. Zamorano JL, Badano LP, Bruce C, et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter intervention for valvular heart disease. Eur Heart J. 2011;32:2189-2214.
19. Lancellotti P, Tribouilloy C, Hagendorff A, et al. Recommendations for the echocardiographic assessment of native valvular regurgitation:an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2013;7:611-644.
20. Lin BA, Forouhar AS, Pahlevan NM, et al. Color Doppler jet area overestimates regurgitant volume when multiple jets are present. J Am Soc Echocardiogr. 2010;9:993-1000.
21. Lesevic H, Sonne C, Kasel AM, et al. Implantation of a MitraClip between two previously implanted MitraClips to treat recurrent severe mitral regurgitation. J Cardiol Cases. 2017;15:50-52.
22. Elbey MA, Palma Dallan LA, Ferragut G. Value of MitraClip in Reducing Funtional Mitral Regurgitation. US Cardiol Rev. 2019;13:30-34.
23. Dietl A, Prieschenk C, Eckert F, et al. 3D vena contracta area after MitraClip procedure:precise quantification of residual mitral regurgitation and identification of prognostic information. Cardiovasc Ultrasound. 2018;16:1-10.
24. Katz WE, Conrad Smith AJ, Wrock FW, et al. Echocardiographic evaluation and guidance for Mitraclip procedure. Cardiovasc Diagn The. 2017;7:616-632.
25. Hyodo E, Iwata S, Tugcu A, et al. Direct measurement of multiple vena contracta areas for assessing the severity of mitral regurgitation using 3D TEE. JACC Cardiovasc Imaging. 2012;5:669-676.
26. Glower DD, Kar S, Trento A, et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients:results of the EVEREST II study. J Am Coll Cardiol. 2014;64:172-181.
27. Utsonomiya H, Itabashi Y, Kobayashi S, et al. Comparison of mitral valve geometrical effect of percutaneous edge-to-edge repair between central and eccentric functional mitral regurgitation:clinical implications. Eur Heart J. 2019;4:455-466.
28. Ikenaga H, Yoshida J, Hayashi A, et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes After Percutaneous Mitral Valve Repair With the MitraClip. JACC Cardiovasc Interv. 2019;12:140-150.
29. Klein A, Stewart WJ, Bartlett J, et al. Effects of Mitral Regurgitation on Pulmonary Venous Flow and Left Atrial Pressure:An Intraoperative Transesophageal Echocardiography Study. J Am Coll Cardiol. 1992;20:1345-1352.
30. López-Opitz JA, Moreno-Urrutia O. Insuficiencia mitral grave por perforación del velo mitral posterior. RETIC. 2016;2:13-16.
31. Ikenaga H, Hayashi A, Nagaura T, et al. Relation Between Pulmonary Venous Flow and Left Atrial Pressure During Percutaneous Mitral Valve Repair With the MitraClip. Am J Cardiol. 2018;122:1379-1386.
32. Ito T, Suwa M. Left atrial spontaneous echo contrast:relationship with clinical and echocardiographic parameters. Echo Res Pract. 2019;6:65-73.
- Intervencionismo en el infarto de miocardio con elevación del segmento ST: estado actual y perspectivas de futuro
- Tratamiento percutáneo de la válvula pulmonar y las arterias pulmonares en cardiopatías congénitas
- Revascularización percutánea del tronco coronario izquierdo: alea jacta est
- Asistencias ventriculares percutáneas en los pacientes agudos y en el intervencionismo coronario de alto riesgo