Revisión temática
REC Interv Cardiol. 2019;1:41-50
Tratamiento antitrombótico tras revascularización percutánea en pacientes con indicación crónica de anticoagulación oral
Antithrombotic therapy after percutaneous revascularization in patients on chronic oral anticoagulation treatment
aServicio de Cardiología, Hospital General Universitario de Alicante, Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL), Alicante, España bÁrea de Enfermedades del Corazón, Hospital Universitario de Bellvitge – IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona, España

RESUMEN
Todo cardiólogo debe realizar un viaje atrás en la historia para entender el estado actual de su especialidad. El stent coronario es uno de los logros más importantes de la investigación y de la ingeniería biomédica del último siglo. Su tecnología ha ido evolucionando e incorporando mejoras sustanciales que hoy en día hacen de este dispositivo un estándar de gran calidad para el tratamiento de la enfermedad coronaria. En este artículo se resume la historia del stent coronario desde su génesis hasta el presente. Se repasan los hitos históricos y científicos más remarcables que contribuyeron a hacer de la angioplastia percutánea un procedimiento seguro y altamente efectivo gracias al stent coronario. La evolución del stent ha ido de la mano del crecimiento y la maduración de la cardiología intervencionista.
Palabras clave: Stent. Stent liberador de fármaco. Angioplastia coronaria transluminal percutánea.
ABSTRACT
All cardiologists should delve into history to understand the current state of the art of their specialty. In the last century, the coronary stent was a pivotal achievement of research and biotechnological engineering. Since then, technology has advanced, and substantial improvements have been incorporated into this device, which has become the gold standard for treating coronary artery disease. This article summarizes the history of the coronary stent from its inception to the present day. The document reviews key historical and scientific milestones that have contributed to making percutaneous angioplasty a safe and highly effective procedure due to coronary stents. The evolution of the stent has been closely linked to the growth and maturation of interventional cardiology to date.
Keywords: Stent. Drug-eluting stent. Percutaneous transluminal coronary angioplasty.
CONCEPCIÓN Y DESARROLLO DE LA ANGIOPLASTIA CORONARIA (DÉCADAS DE 1970 Y 1980)
La cardiología intervencionista ha experimentado una espectacular evolución en las últimas décadas, que ha ido siempre al compás de la biotecnología. El desarrollo de los stents coronarios ha desempeñado un papel fundamental al haber permitido el asentamiento y la expansión de la angioplastia percutánea con fiabilidad. Los stents surgieron para resolver los problemas de la angioplastia coronaria percutánea con balón, que se evidenciaron durante los primeros pasos de esta. Por ello, conviene recordar cómo comenzó todo (tabla 1)1.
Tabla 1. Hitos en el desarrollo de la cardiología intervencionista
| Año | Hito |
|---|---|
| 1929 | Werner Forssmann realiza el primer cateterismo cardiaco transluminal |
| 1953 | Sven Seldinger emplea el acceso percutáneo |
| 1958 | Mason Sones realiza la primera angiografía coronaria (acceso braquial quirúrgico) |
| 1963 | Charles Dotter realiza la primera angioplastia arterial periférica |
| 1968 | Eberhard Zeitler expande la angioplastia periférica en Europa |
| 1968 | Melvin Judkins desarrolla la técnica de la coronariografía percutánea |
| 1977 | Andreas Grüntzig realiza la primera angioplastia coronaria percutánea con balón |
| 1979 | Geoffrey Hartzler realiza la primera angioplastia coronaria en infarto agudo de miocardio |
| 1986 | Jacques Puel implanta el primer stent coronario (Wallstent) |
| 1991 | Cannon y Roubin reportan el primer implante de stent en infarto agudo de miocardio |
| 1994 | Aprobación regulatoria del primer stent con base científica (Palmaz-Schatz) |
En los inicios de los años 1970, el tratamiento de la enfermedad coronaria se limitaba al uso de nitroglicerina y propranolol, escasas pruebas diagnósticas y muy pobre evidencia científica. Hasta entonces, eso sí, se habían producido algunos hitos importantes que sirvieron de precedente para dar el gran paso del tratamiento percutáneo1. Las coronariografías eran raramente indicadas, tan solo a pacientes con muchos síntomas y en vistas a un posible tratamiento con cirugía de puentes coronarios, que era la única modalidad de revascularización. Andreas Roland Grüntzig, radiólogo y cardiólogo alemán que desarrolló su carrera en Zúrich y luego en Atlanta, fue un personaje con una genialidad y un tesón particulares que le llevaron a desarrollar la técnica de la angioplastia con balón, superando el escepticismo y la oposición reinantes en su entorno. Habiendo recibido el legado de la angioplastia periférica de Charles Dotter a través de Eberhard Zeitler, se embarcó en el desarrollo del balón de angioplastia, aplicándolo primero a la enfermedad periférica en 1974 y luego dando el osado salto al árbol coronario en los humanos el 16 de septiembre de 19772.
Tras el éxito clínico inicial, se comenzaron a evidenciar las limitaciones de la técnica, en especial a medida que esta se expandió a diferentes escenarios clínicos y anatómicos. Preocupaban la oclusión aguda por la retracción elástica, la disección y la trombosis. Esto se traducía en infartos periprocedimiento, o en necesidad de cirugía cardiaca o de nueva angioplastia durante el seguimiento3. La restenosis era un fenómeno más tardío, pero su gran incidencia (20-40%) hacía que también supusiera un problema importante4. Para prevenir la retracción elástica y las disecciones oclusivas, se precisaba el mantenimiento de la fuerza radial ejercida por el balón de angioplastia, lo cual podría hacerlo una estructura protésica intraluminal.
LLEGADA Y APROBACIÓN DEL STENT CORONARIO (1980-1994)
El término stent es un anglicismo reconocido por la Real Academia Española5. Tiene un origen incierto, pero lo más aceptado es que se trata del epónimo del dentista británico Charles Thomas Stent (1807-1885), quien en 1856 patentó un material termoplástico para realizar impresiones dentarias, que denominó «pasta de Stent»6. Más adelante, cuando la patentada pasta de Stent dejó de emplearse, el término continuó aplicándose para el material protésico que podía suplir tejido biológico. Su uso se fue extendiendo para denominar también a las prótesis tubulares empleadas en cirugía hepatobiliar y en urología6. Charles Dotter, pionero también en esto, reporta en 1969 su experiencia al insertar unas espirales metálicas en arterias de perros con la finalidad de demostrar que sería posible implantar un dispositivo de contención intraluminal7. No obstante, no fue hasta los años 1980, tras evidenciar las limitaciones de la angioplastia con balón, cuando se expandió la denominación de stent y se desarrolló con énfasis la tecnología de los dispositivos que conocemos hoy en día.
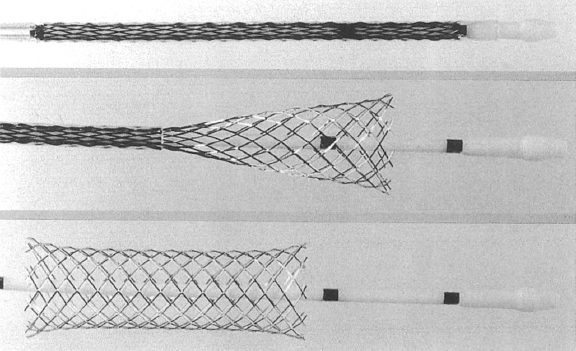
En 1980, el encuentro en Suiza entre dos suecos expatriados, Ake Senning, cirujano cardiotorácico que había sido valedor de Andreas Grüntzig, y el ingeniero Hans Wallsten, marcó el inicio de un proyecto exitoso que, con la colaboración del ingeniero francés Christian Imbert, acabaría dando a luz al primer stent para uso en arterias coronarias: el Wallstent. El término no era un epónimo del ingeniero, sino que derivaba de aplicar una próstesis (stent) sobre la pared de un vaso (wall)1. Se trataba de un mallado de filamentos de acero inoxidable con capacidad autoexpandible al ser liberado por un sistema (figura 1). Fundaron la compañía MedInvent (luego adquirida por Schneider, Suiza), buscaron investigadores para las pruebas del dispositivo y contactaron con Ulrich Sigwart (Lausanne) y Jacques Puel (Toulouse)1.
Figura 1. Stent autoexpandible Wallstent. Se muestra, de arriba abajo, el proceso de despliegue del dispositivo con el importante acortamiento longitudinal que se producía.
El protocolo de experimentación para el Wallstent comprendía primeramente su uso en animales, a continuación en arterias periféricas en humanos y finalmente en arterias coronarias de pacientes. El centro de Toulouse encontró menos dificultades para iniciar la experimentación animal y llegó antes a la prueba en humanos. Así, en diciembre de 1985, Hervé Rousseau y Francis Joffre, radiólogos del departamento de Jacques Puel en Toulouse, implantaron la primera endoprótesis periférica. Por su parte, Jacques Puel, en marzo de 1986, implantó la primera endoprótesis coronaria en un paciente que había presentado restenosis tras una angioplastia con balón en la descendente anterior1. En junio de ese mismo año, Ulrich Sigwart implantó la primera endoprótesis coronaria para el tratamiento de una disección aguda oclusiva en una descendente anterior proximal tras una angioplastia con balón; fue la primera vez que un paciente evitó la cirugía urgente por esta complicación1,8.
Más adelante, Sigwart se erigió como portavoz en la escena pública y en las publicaciones, quizás ayudado por su mejor dominio de la lengua inglesa1. En marzo de 1987 se publicó la primera descripción de la experiencia conjunta en The New England Journal of Medicine9. El trabajo reportó el implante de 24 stents coronarios en 19 pacientes para tratamiento de restenosis (n = 17), oclusión aguda tras angioplastia con balón (n = 4) o deterioro de bypass coronario (n = 3). Sigwart contó años después que la revista le solicitó no emplear el verbo stenting, pero sí el sustantivo stent para denominar al nuevo dispositivo10. Las experiencias multicéntricas iniciales con el Wallstent fueron lideradas por los centros de Toulouse, Laussane y Rotterdam. En 1991, Serruys et al.11 describieron el seguimiento de los primeros 105 pacientes tratados: la mortalidad fue del 7,6%, la incidencia de oclusión fue del 24% (mayoritariamente en las primeras 2 semanas) y la restenosis fue del 14-32% (según la definición considerada).
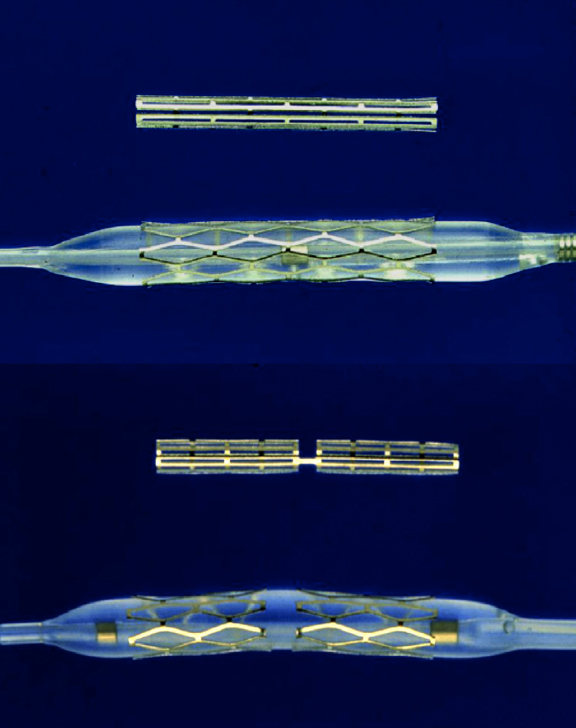
Paralelamente, al otro lado del océano, Julio Palmaz, un radiólogo intervencionista argentino afincado en los Estados Unidos, en 1977 asistía a las sesiones en vivo de Grüntzig y, al presenciar las complicaciones de la angioplastia, vio la oportunidad de desarrollar un dispositivo para prevenirlas. Diseñó su primer prototipo en la cocina de su casa con una pistola soldadora y alambre de cobre. Luego empleó acero inoxidable e inventó el primer stent expandible con balón, que implantó en aortas de perros1,12. Más adelante se trasladó a San Antonio (Tejas, Estados Unidos), donde pudo mejorar el dispositivo empleando máquinas de corte sobre tubos de acero13. Conoció a Richard Schatz, cardiólogo militar que le ayudó a adaptar el modelo para uso en arterias coronarias uniendo dos stents pequeños por un puente, mejorando así su flexibilidad y navegabilidad (figura 2). Tras reunir la inversión necesaria, iniciaron la compañía Expandable Grafts Partnership (después adquirida por Johnson & Johnson, Estados Unidos) para producir los prototipos y financiar la investigación12.
Figura 2. Stent expandible con balón Palmaz-Schatz (arriba) y PS 153 series (abajo), que consistía en 2 stents más cortos unidos por un puente con la finalidad de mejorar su flexibilidad y navegación.
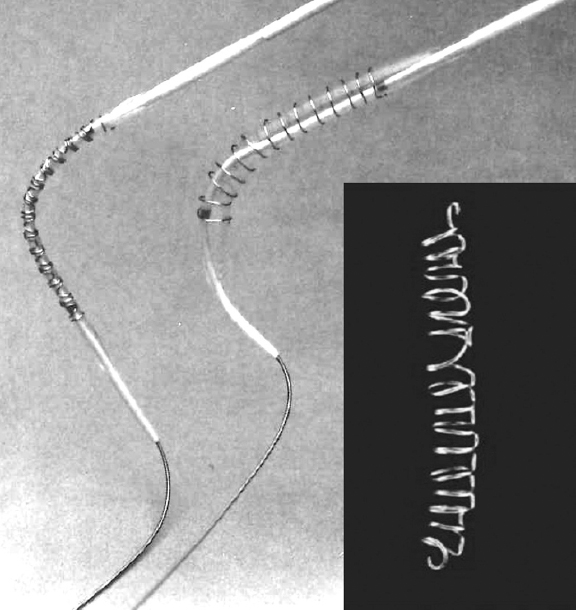
Debido a las restricciones en el progreso de las investigaciones en los Estados Unidos, las primeras pruebas en humanos se realizaron en el extranjero1,12. En octubre de 1987, Julio Palmaz y Goetz Richter implantaron el primer stent Palmaz-Schatz en arterias periféricas en Freiburg, Alemania. A finales de ese mismo año, Palmaz, Schatz y Eduardo Sousa implantaron el primer stent Palmaz-Schatz en arterias coronarias en Sao Paulo, Brasil (21 meses después del primer Wallstent coronario). Lamentablemente para Julio Palmaz, el hito del primer implante de stent expandible con balón lo habían logrado 3 meses antes Gary Roubin y Spencer King III en Emory, Atlanta. Se trataba de una estructura de filamento metálico enrollado sobre un balón (figura 3), inventada por el radiólogo italiano Cesare Gianturco, que previamente había trabajado con Grüntzig. La Food and Drug Administration de los Estados Unidos aprobó el stent Gianturco-Roubin (Cook Medical Inc., Estados Unidos) en 1993, pero no el Palmaz-Schatz, al cual se le exigió la realización de dos ensayos clínicos aleatorizados, que se completaron y publicaron en 1994, y entonces logró la aprobación de la agencia1,12,14,15. Aquí repasamos estos dos importantes estudios que validaron científicamente el uso del stent en cardiología.
Figura 3. Stent expansible con balón Gianturco-Roubin, con formación espiroidea.
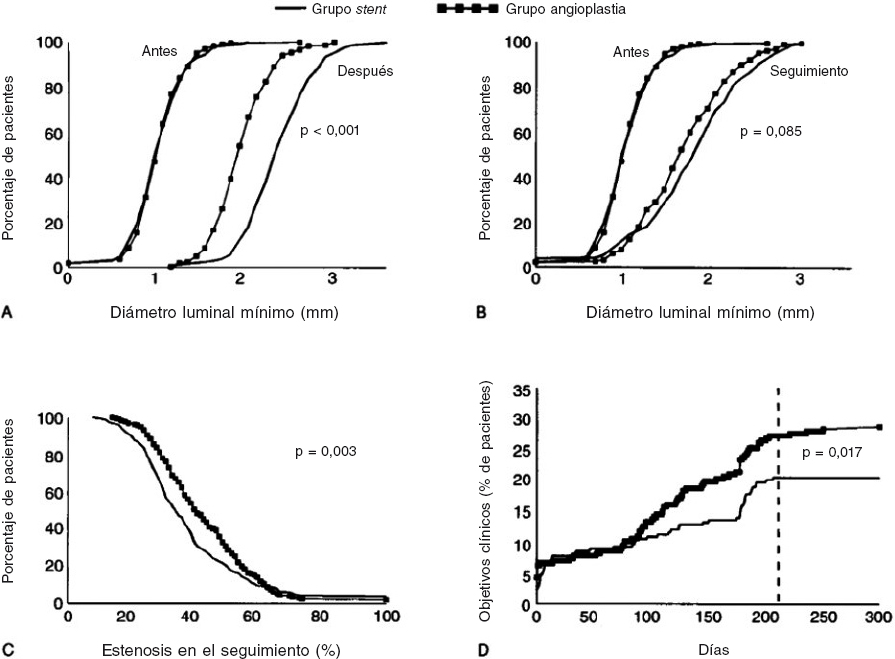
En el ensayo BENESTENT (Belgian Netherlands Stent), presentado por Serruys et al.15 en 1994, se aleatorizó a 520 pacientes con angina estable y enfermedad coronaria de 1 vaso para recibir tratamiento con angioplastia simple con balón o implante de un stent Palmaz-Schatz. Participaron 28 centros, en su gran mayoría europeos. Todos los pacientes recibieron ácido acetilsalicílico durante 6 meses, y si se les colocaba stent se añadía warfarina durante 3 meses. A los 7 meses, el tratamiento con stent redujo un 32% el combinado de eventos adversos, fundamentalmente a expensas de una menor incidencia de revascularización repetida. La restenosis binaria (≥ 50%) fue del 22% en el grupo de stent y del 32% en el grupo de balón (figura 4). La trombosis del stent sucedió en un 3,5% de los pacientes. Las complicaciones vasculares o hemorrágicas y la duración de la estancia hospitalaria fueron mayores en los pacientes tratados con stent. En el seguimiento a 1 año se mantuvo la reducción relativa del evento combinado en un 26% a favor del stent, con una incidencia de angioplastia repetida del 10 frente al 21% en el grupo de balón16.
Figura 4. Gráficas del estudio BENESTENT que muestran ganancia luminal aguda (A) y en el seguimiento (B). Se muestran también la distribución de frecuencias de restenosis (C) y la acumulación de eventos clínicos (D). (Reproducida con permiso de Serruys et al.15).
En el estudio STRESS (Stent Restenosis Study), reportado por Fischman et al.14 el mismo año, se aleatorizó a 410 pacientes procedentes de 20 centros, en su mayoría norteamericanos. El régimen antitrombótico incluía ácido acetilsalicílico indefinido para todos los pacientes y anticoagulación con warfarina durante 1 mes para aquellos que recibían el stent Palmaz-Schatz. A los 6 meses, la incidencia del combinado de eventos adversos fue similar (19,5% en el grupo de stent frente a 23,8% en el grupo de balón; p = 0,16), pero se observó una tendencia hacia una menor necesidad de revascularización repetida en el grupo de stent (10,2 frente a 15,4%; p = 0,06). La restenosis binaria también fue menor en los pacientes tratados con stent (32 frente a 42%; p < 0,05). La trombosis del stent ocurrió en el 3,4% (7/205) de los casos tratados por protocolo y en el 21,4% (3/14) de aquellos en los que el stent se empleó como rescate de la angioplastia (crossover). Nuevamente, las complicaciones vasculares o hemorrágicas, así como la duración de la estancia hospitalaria, fueron mayores en los pacientes tratados con stent. En el seguimiento cercano a 1 año se mantuvieron las diferencias numéricas a favor del stent, aunque sin significación estadística (revascularización no planeada: 12 frente a 17%; p = 0,09)17.
Finalmente, pese a los impedimentos y retrasos, el stent Palmaz-Schatz se acabó imponiendo como estándar de referencia durante un tiempo gracias a la evidencia que lo respaldaba, a su mayor seguridad y a su facilidad de uso. Los otros stents, a pesar de su importante expansión inicial, carecían del respaldo de estudios y preocupaba la incidencia de trombosis y restenosis. El stent Gianturco- Roubin se mostró inferior en estos aspectos frente al stent Palmaz-Schatz18, y el Wallstent tenía el problema del acortamiento longitudinal, la imprecisión en el implante y el compromiso de ramas laterales por su pequeño tamaño de celda. Todo esto influyó en que estos stents fueran siendo desplazados y gradualmente desaparecieran del mercado.
A partir de 1994, gracias a los estudios BENESTENT y STRESS, el uso del stent se expandió, pero aún existían dudas sobre si los costes generados por esta nueva intervención se traducirían en un beneficio significativo. Los estudios subsiguientes convencieron de la superioridad del stent frente a la angioplastia simple con balón en distintos escenarios. Hubo dos estudios importantes que mostraron el claro beneficio en términos de restenosis: en oclusiones crónicas (32 frente a 74%; p > 0,001) en 199619 y en enfermedad aislada de arteria descendente anterior proximal (19 frente a 40% a 12 meses; p = 0,02) en 199720. Por otro lado, se comparó la estrategia de angioplastia con stent frente a angioplastia con balón con posibilidad de rescate con stent, resultando favorecida la estrategia de empleo de stent en primera línea por beneficio clínico y balance de costes21. En el infarto agudo, el estudio Stent-PAMI sentó la indicación del uso de stent frente a la angioplastia con balón22.
PROGRESOS Y MODERNIZACIÓN DE LAS PLATAFORMAS (DÉCADA DE 1990)
Durante la década de 1990 se produjeron algunos avances importantes que repercutieron en la efectividad y la seguridad del stent (tabla 2)1, desde el uso de ultrasonido intravascular para optimizar el implante hasta los progresos en hemostasia y la expansión del acceso radial, que junto con el abandono de la anticoagulación en favor de la doble antiagregación disminuyeron las complicaciones hemorrágicas, tan evidentes en los ensayos BENESTENT y STRESS14,15. Por último, y no menos importante, las mejoras tecnológicas en la plataforma del stent fueron clave para generalizar este tratamiento.
Tabla 2. Avances de la angioplastia en la década de 1990
| Años | Avances | Resultados |
|---|---|---|
| 1989-1993 | Acceso radial para coronariografía y angioplastia coronaria | Inicios de la nueva era en acceso arterial mínimamente invasivo |
| 1993-1994 | Reducción del calibre de acceso a 6 Fr Cierres hemostáticos femorales | Reducción de la hospitalización y de las complicaciones hemorrágicas |
| 1994 | Publicación de los estudios BENESTENT15 y STRESS14 | El stent demuestra su efectividad en la angioplastia |
| El stent Palmaz-Schatz se consolida como referencia | ||
| Empleo de ecografía intravascular para la optimización del implante del stent | La expansión adecuada, gracias a una presión de implante elevada, conducía a mínima trombosis y menor restenosis | |
| 1995-1998 | Estudios con terapia antiplaquetaria doble | Minimización de la trombosis |
| Abandono de la anticoagulación oral | ||
| Reducción de las hemorragias | ||
| 1994-2000 | Mejoras del Palmaz-Schatz (Cordis) y aparición de nuevas plataformas modernas: Micro Stent (Arterial Vascular Engineering), Multi-Link (Advanced Cardiovascular Systems), etc. | Expansión de la indicación de la angioplastia con stent |
| Se impone el stent tubular o modular frente a los autoexpandibles y helicoidales |
Los stents iniciales tenían carencias técnicas evidentes que requerían ser resueltas para poder ampliar este tratamiento a distintos escenarios anatómicos (tortuosidades, bifurcaciones y lesiones calcificadas). Por iniciativa de los propios intervencionistas, se propuso la posibilidad de cortar el stent de Palmaz-Schatz por el puente articulado con el fin de disponer de un stent corto («Palmaz desarticulado» o «hemi-Palmaz») para lesiones cortas y que tuvieran un acceso anatómico más difícil23. Sin embargo, fue la incorporación de la tecnología de corte láser lo que trajo la innovación en el diseño de los stents. Cordis, compañía de Johnson & Johnson (Estados Unidos), mejoró la plataforma del Palmaz-Schatz creando el Spiral y luego el Crown24 (figura 5). Posteriormente evolucionaría hacia el Bx Velocity, un stent también de diseño tubular (tubo cortado a láser), pero con anillos en zigzag y conectores ondulados que permitían una mayor flexibilidad, aunque seguía manteniendo el diseño de celda cerrada (conectores en todos los ángulos de infle- xión de los anillos) que limitaba su navegación en curvas (figura 5). A partir de la plataforma del Bx Velocity, Cordis lanzó el primer stent farmacoactivo de la historia: el Cypher12.
Figura 5. Stents de Cordis: evolución de la plataforma del Palmaz-Schatz, desde el articulado PS 153 series (arriba), pasando por el Crown (centro), hasta la plataforma Bx Velocity (abajo).
En 1990, Medtronic Inc. (Estados Unidos) creó el Wiktor, un stent de filamento en espiral expandible con balón similar al Gianturco-Roubin, pero hecho de tántalo, más radiopaco (figura 6). Sin embargo, su fragilidad y su débil fuerza radial hicieron que fuera superado por las nuevas plataformas y finalmente fue retirado24. En torno a 1994, la compañía Arterial Vascular Engineering (AVE; Estados Unidos) lanzó el Micro Stent, un stent con un diseño modular consistente en un filamento redondo de acero que se curvaba con ángulos suavizados conformando anillos que luego se unían con soldaduras en vértices alternos formando celdas abiertas; todo ello mejoraba su flexibilidad y navegación, sin perder fuerza radial24. AVE fue adquirida por Medtronic en 1998. En las sucesivas iteraciones del Micro Stent (GFX, GFX2, S670, S7) se fue disminuyendo el grosor del strut (filamento que compone la malla del stent) y en 2002 se cambió el acero inoxidable por una aleación de cobalto y níquel en el stent Driver (figura 6). Ya bien entrado el siglo XXI, Medtronic empleó la plataforma del Driver para crear el stent farmacoactivo Endeavor. En 2010, la transición a la plataforma Integrity supuso usar un filamento continuo con forma sinusoidal, esta vez soldado con láser en múltiples puntos para proteger su integridad.
Figura 6. Stents de Medtronic y AVE: stent helicoidal Wiktor (A) y micro-stent modular AVE (B), con sus versiones GFX2 (C) y Driver (D). El diagrama muestra el cambio del strut con las sucesivas plataformas. Se muestra la plataforma Integrity (E) con la tecnología de filamento continuo soldado con láser.
Por otro lado, Advanced Cardiovascular Systems (Estados Unidos), una compañía adquirida previamente por la división de dispositivos de Eli Lilly (Estados Unidos), luego Guidant, creó el stent Multi-Link, aprobado para su uso en Europa en 1995 y en los Estados Unidos en 1997. Se trataba de un stent de acero de diseño tubular con celda abierta. En este caso el strut era plano y con ángulos romos en los anillos24. Este diseño más moderno lo hizo muy competitivo y fue dominando el mercado junto al stent de AVE12. Guidant continuó mejorando la plataforma Multi-Link al adelgazar el strut, emplear conectores curvos y pasar a usar la aleación de cromo-cobalto en el modelo Vision (figura 7). El Multi-Link Rx (strut de 50 μm) demostró superioridad frente al stent Bx Velocity (strut de 140 μm) en términos de restenosis a 12 meses en el estudio ISAR-STEREO-2 (18 frente a 31%; p < 0,001)25, lo cual demostró la importancia del grosor del strut en el daño de la pared del vaso y la aparición de restenosis. La plataforma Multi-Link de cromo-cobalto sirvió posteriormente de base para los stents farmacoactivos Xience V (Abbott Vascular, Estados Unidos) y Promus (Boston Scientific, Estados Unidos).
Figura 7. Stents de ACS-Guidant. Plataforma Multi-link en sus sucesivas versiones con modificaciones en la celda y en los conectores.
El stent NIR, de Medinol (Israel), distribuido por Boston Scientific, era un stent de acero inoxidable de celda cerrada con un diseño que permitía flexibilidad en la navegación, pero que una vez expandido su geometría de celda le confería gran rigidez y, por lo tanto, fuerza radial24 (figura 8). Esta plataforma sirvió para el primer stent farmacoactivo de paclitaxel, el Taxus, lanzado por Boston Scientific en 2003. A finales de los años 1990, Boston Scientific, que había distribuido el Wallstent y el NIR, desarrolló y comercializó sus propios stents, el Express y el Veriflex/Liberté, que también servirían para las siguientes versiones del Taxus (figura 8).
Figura 8. Plataformas empleadas por Boston para desarrollar el Taxus. Arriba se muestra el stent NIR de Medinol; abajo a la izquierda, la plataforma Express; y abajo a la derecha, la plataforma Veriflex que sirvió para el Taxus Liberté.
Muchos stents lanzados durante los años 1990 fueron comparados de acuerdo con sus características técnicas y mediante estudios de comparación directa, que en general ofrecieron datos equivalentes26. Tras esta revolución tecnológica vivida a finales de siglo, se podía concluir que los stents expandibles con balón de diseño tubular (Palmaz-Schatz y Multi-Link) y modular (Micro Stent) se habían impuesto frente a los autoexpandibles y a los helicoidales. Los avances de la angioplastia en esos años (tabla 2) posicionaron al stent como estándar de tratamiento percutáneo de la enfermedad coronaria. No obstante, la restenosis seguía siendo un inconveniente para el stent y para la angioplastia en general. La incidencia de restenosis había disminuido de un 30-40% con la angioplastia con balón a un 20-30% en los primeros estudios del stent Palmaz-Schatz14,15. Tras las sucesivas mejoras en las plataformas y las técnicas de implante, la restenosis se redujo, pero seguía cercana al 20% al año del implante27. Además, la ampliación del uso del stent a escenarios más complejos (injertos de safena, vaso pequeño, lesiones largas, etc.) hacía prever una incidencia de restenosis aún mayor. Afrontar este problema era el objetivo prioritario, lo que dio lugar a la siguiente revolución de la cardiología intervencionista con la llegada del siglo XXI.
DESAFIANDO LA RESTENOSIS EN EL SIGLO XXI: LA ERA DEL STENT FARMACOACTIVO
Una vez que el stent se generalizó, la restenosis y la trombosis fueron las complicaciones que había que comprender y tratar. Inicialmente se idearon los recubrimientos heparínicos para los stents en aras de evitar ambos procesos; mientras que parecían tener un efecto protector sobre la trombosis, su efecto sobre la restenosis era dudoso. El stent coronario supuso un avance claro para la angioplastia, pero la reacción vascular que producía llevaba a procesos inflamatorios sostenidos con crecimiento de tejido y pérdida luminal tardía28. Tras comprender que la restenosis ocurría principalmente por un mecanismo proliferativo de las células del músculo liso vascular29, los esfuerzos se centraron entonces en frenar ese proceso. La braquiterapia (administración transcatéter de radiación ionizante sobre la lesión) surgió precisamente para frenar esta respuesta proliferativa. Sin embargo, la dificultad de aplicación de esta terapia, junto con la aparición de trombosis muy tardía, en probable relación con la inhibición de la endotelización y la restenosis en los bordes del segmento radiado, frenaron su éxito30. Con todo esto, la atención se fue centrando en el desarrollo de fármacos antiproliferativos.
El sirolimus (rapamicina) es un agente antimicótico que se aisló por primera vez en 1965 en una bacteria hallada en Isla de Pascua (Chile)31. Es un inhibidor de la proteína mTOR (mammalian Target Of Rapamycin) con efecto antiproliferativo e inmunosupresor que había sido empleado en terapia oncológica y como tratamiento después del trasplante de órganos. Esta molécula fue seleccionada por el equipo investigador de Cordis para crear el primer stent farmacoactivo, el Cypher. El sirolimus se introdujo en un transportador (polímero) que recubría la superficie metálica del stent y permitía su liberación modulada al endotelio. Por otro lado, el paclitaxel, un antimitótico proveniente de la corteza del tejo, fue aislado por primera vez en 196732. Tiene un efecto citotóxico bloqueando el desensamblaje de los microtúbulos, interfiriendo en el ciclo celular y la mitosis. La compañía Boston Scientific lo seleccionó para crear la primera generación del stent Taxus, también con el fármaco embebido en un polímero transportador. Paralelamente, el paclitaxel se estaba empleando en el desarrollo de un balón liberador de fármaco por el grupo de Bruno Scheller y Ulrich Speck en Alemania, también con el objetivo de solucionar el problema de la restenosis33.
El primer implante de un stent farmacoactivo fue de un Cypher y tuvo lugar en diciembre de 1999 en Sao Paulo, Brasil. En el equipo se encontraban Eduardo Sousa y Patrick Serruys. La experiencia con los primeros 30 pacientes y su seguimiento al año, sin ningún caso de restenosis, marcó el inicio de una nueva era34. A esto le siguió el ensayo clínico RAVEL, en el que se aleatorizaron 238 pacientes para recibir Bx Velocity o Cypher. A los 6 meses, la pérdida luminal fue de 0,80 ± 0,53 mm con Bx Velocity y de –0,01 ± 0,33 mm con Cypher (p < 0,001), mientras que la restenosis binaria fue del 26,6% y del 0%, respectivamente (p < 0,001)35. Por otro lado, el estudio TAXUS II aleatorizó a 536 pacientes para recibir NIR o Taxus en dos formas distintas de liberación del paclitaxel (lenta o intermedia). A los 6 meses, la pérdida luminal por ultrasonografía intravascular fue > 20% con NIR y < 8% con Taxus. La restenosis se redujo del 19% al 2,3% con el Taxus de liberación lenta y al 4,7% con el de liberación intermedia (p < 0,001), y al cabo de 1 año los eventos se redujeron a la mitad, similar a lo observado en el estudio RAVEL36.
Pasados unos años de expansión del uso de los stents farmacoactivos, surgieron algunos datos que moderaron la euforia inicial. Comenzaron a reportarse fenómenos de trombosis tardías (más allá del primer mes) y ello hizo saltar las alarmas37. Los fármacos antiproliferativos producían una endotelización retardada y se reportaron algunos casos de reacción inflamatoria local, presumiblemente por el polímero38. Se asumía que esto podía explicar los casos de trombosis tardía observados. Más adelante, los estudios de patología demostraron el desarrollo de neoateroesclerosis de manera más frecuente y temprana con los stents farmacoactivos en comparación con los convencionales sin fármaco39. Los metanálisis comprobaron que el aumento del riesgo de trombosis era globalmente muy leve y sin diferencias en mortalidad, mientras que se confirmaba la sorprendente efectividad de los nuevos stents40.
Tras el éxito de la primera generación de Cypher y Taxus, fueron apareciendo nuevos stents mejorados en cuanto al fármaco empleado, el polímero y la plataforma metálica41 (tabla 3). Además, las mejoras en los sistemas de liberación permitieron alcanzar lesiones más complejas. La plataforma de acero inoxidable fue dando paso a aleaciones de cromo-cobalto y cromo-platino, que permitieron adelgazar el strut, minimizando el daño vascular y mejorando la navegación sin perder fuerza radial. La geometría de celda abierta con menos conectores se generalizó, con pequeñas variaciones entre marcas. Las compañías apostaron por análogos del sirolimus y emplearon nuevos polímeros más biocompatibles y de menor espesor en la superficie del strut. Se llevaron a cabo numerosos ensayos clínicos aleatorizados de comparación directa entre los stents farmacoactivos de segunda generación, los de primera generación y los metálicos convencionales42. Mientras que la superioridad de los stents farmacoactivos sobre los convencionales era poco discutible en la mayoría de los escenarios, las supuestas ventajas de las nuevas generaciones eran más difíciles de demostrar. A partir de 2008 se realizaron numerosos estudios de evaluación de la respuesta vascular a los distintos stents mediante tomografía de coherencia óptica. Esto también fue reproducido en estudios de anatomía patológica, que además mostraron mayor respuesta inflamatoria y acúmulo de fibrina con los stents de primera generación43. Hubo una renovación generacional: mientras Cypher y Taxus se fueron retirando, Xience (Abbott Vascular, Estados Unidos), por sus resultados más favorables, pasó a ser el stent de referencia (best-in-class) para las comparaciones posteriores.
Tabla 3. Stents farmacoactivos de primera y segunda generación (polímero y struts finos)
| Nombre | Compañía | Plataforma | Metal | Grosor del strut | Fármaco | Grosor del polímero |
|---|---|---|---|---|---|---|
| Cypher | Cordis (J&J) | Bx Velocity | Acero inoxidable | 140 μm | Sirolimus | 12,6 μm |
| Taxus Express | Boston Scientific | Express | Acero inoxidable | 132 μm | Paclitaxel | 16 μm |
| Taxus Liberté | Boston Scientific | Veriflex | Acero inoxidable | 97 μm | Paclitaxel | 16 μm |
| Endeavor | Medtronic | Driver | Cromo-cobalto | 91 μm | Zotarolimus | 4,1 μm |
| Resolute Onyx | Medtronic | Integrity | Níquel-cromo + platino-iridio | 81-91 μm | Zotarolimus | 4,1 μm |
| Xience V/Promus | Abbott/Boston Scientific | Multi-link | Cromo-cobalto | 81 μm | Everolimus | 7,6 μm |
| Promus Element | Boston Scientific | Omega | Cromo-platino | 81 μm | Everolimus | 6,0 μm |
ÚLTIMOS AVANCES Y STENT BIOABSORBIBLE
El stent farmacoactivo (1999) fue una de las grandes revoluciones en la cardiología intervencionista tras la del balón de angioplastia (1977) y la del stent convencional (1986). A partir de la segunda generación, el stent farmacoactivo se consolida como estándar por su seguridad y efectividad. Las siguientes generaciones de stents incorporan polímeros biodegradables, prescinden del polímero o cuentan con recubrimientos especiales para favorecer la endotelización y la biocompatibilidad (tabla 4). Además, se logró adelgazar aún más el strut. Los avances en el tipo de recubrimiento del stent no han logrado demostrar un beneficio de forma consistente44. Sin embargo, algunos datos indican que la evolución hacia el strut ultrafino sí puede suponer una ventaja en términos de menor incidencia de revascularizaciones repetidas en la lesión diana a largo plazo44,45. Hoy en día, los stents farmacoactivos disponibles en el mercado navegan muy satisfactoriamente y son muy efectivos. Las diferencias entre los distintos modelos son sutiles y las supuestas ventajas resultan difíciles de demostrar. La generalización de los estudios de comparación directa con diseño de no inferioridad reflejan esta especie de estancamiento en el progreso46. Pese a ello, el desarrollo tecnológico continúa en busca de mejoras41.
Tabla 4. Stents farmacoactivos con polímero biodegradable o sin polímero
| Nombre | Compañía | Metal | Grosor del strut | Polímero | Fármaco |
|---|---|---|---|---|---|
| Biomatrix Flex | Biosensors | Acero inoxidable | 112 μm | Sí | Biolimus A9 |
| Biomatrix Alfa | Biosensors | Cromo-cobalto | 84-88 μm | Sí | Biolimus A9 |
| Nobori | Terumo | Acero inoxidable | 112 μm | Sí | Biolimus A9 |
| Ultimaster | Terumo | Cromo-cobalto | 80 μm | Sí | Sirolimus |
| Synergy | Boston Scientific | Cromo-platino | 74-81 μm | Sí | Everolimus |
| Orsiro | Biotronik | Cromo-cobalto | 60-80 μm | Sí | Sirolimus |
| Biomime | Meril | Cromo-cobalto | 65 μm | Sí | Sirolimus |
| Supraflex Cruz | SMT | Cromo-cobalto | 60 μm | Sí | Sirolimus |
| Coroflex ISAR Neo | Braun | Cromo-cobalto | 55-65 μm | No | Sirolimus + probucol |
| Biofreedom | Biosensors | Acero inoxidable | 112 μm | No | Biolimus A9 |
| Biofreedom Ultra | Biosensors | Cromo-cobalto | 84-88 μm | No | Biolimus A9 |
| Cre8 | Alvimedica | Cromo-cobalto | 70-80 μm | No | Sirolimus + ácido graso |
Mención aparte merece la idea del stent reabsorbible, que podría evitar los inconvenientes de dejar una malla metálica permanente en una arteria coronaria. En los años 1990, el ingeniero japonés Keiji Igaki y el intervencionista Hideo Tamai idearon una plataforma compuesta de polímero de ácido poliláctico con strut de 170 μm y sin fármaco, que debía calentarse para expandirse en el implante (se hacía con contraste calentado a 80 °C). Teóricamente, el polímero comenzaría a degradarse al cabo de 6 meses y duraría hasta 2 años, perdiendo su fuerza radial de manera progresiva. El primer stent reabsorbible de la historia (stent Igaki-Tamai, Kyoto Medical) lo implantó Hideo Tamai en 1998, en Japón. Se publicaron los resultados de los primeros 15 pacientes tratados, con un seguimiento de 6 meses, que mostraron una incidencia de restenosis del 10,5% por lesión tratada47. Sin embargo, el seguimiento de 50 pacientes a 10 años reveló una incidencia de revascularización por vaso del 28% y de trombosis del 2,4%48.
En 2006, John Ormiston implantó el primer stent bioabsorbible farmacoactivo, el Absorb Bioresorbable Vascular Scaffold (Abbott Vascular, Estados Unidos), con everolimus embebido en una matriz polimérica de ácido poliláctico con strut de 150 μm1. Tras datos favorables en los estudios piloto se inició el estudio ABSORB II, que aleatorizó a 501 pacientes para recibir Absorb BVS o Xience, con el objetivo de superioridad en cuanto a respuesta vasomotora del segmento tratado (teórica ventaja de una plataforma reabsorbible) y de no inferioridad en términos de pérdida luminal tardía. Lamentablemente, el análisis a 3 años, presentado en 2016, mostró la no consecución de ambos objetivos, con el añadido de un aumento de los casos de trombosis subaguda (2,8 frente a 0%; p = 0,03) y de infarto del vaso diana (7,1 frente a 1,2%; p = 0,006)49. A esto siguieron los resultados desfavorables a largo plazo de otros ensayos clínicos aleatorizados y metanálisis50, que llevaron a Abbott a retirar su dispositivo del mercado.
El primer stent farmacoactivo bioabsorbible había fallado en las comparaciones con el estándar de referencia Xience, que demostró su gran fiabilidad. No obstante, se habían aprendido algunas lecciones importantes para el futuro progreso51. Absorb era un dispositivo de strut grueso (150 μm frente a 81 μm de Xience) que condicionaba una navegabilidad más limitada, mayor compromiso de ramas laterales, peor endotelización y mayor trombogenicidad; se debía mejorar este aspecto para resultar más competitivo. Por otro lado, la fuerza radial de Absorb era limitada frente a la de los stents metálicos, lo cual hacía fundamental una técnica de implante óptima mediante la correcta preparación de la placa, la medición fina del vaso empleando imagen intracoronaria y la posdilatación a alta presión52. La realización de estudios poscomercialización pragmáticos hizo evidentes estas carencias. Este proyecto encalló debido en parte a la temprana (tal vez prematura) expansión de un dispositivo de primera generación hacia escenarios de mayor complejidad anatómica, como lesiones largas, vaso pequeño, bifurcaciones e incluso oclusiones crónicas53, lo que sin duda contribuyó a mostrar sus desventajas frente al stent estándar de comparación del momento.
Otras compañías desarrollaron plataformas poliméricas reabsorbibles51, pero al no poder mejorar los aspectos limitantes del Absorb se frenó la carrera de experimentación clínica en espera de mejoras en la tecnología. Además, las guías de práctica clínica desaconsejaron su uso fuera de protocolos de investigación54. Por otra parte, el stent bioabsorbible de magnesio liberador de sirolimus DREAMS (Biotronik AG, Suiza) parece tener una mejor perspectiva, con una nueva generación en la que se ha logrado disminuir el grosor radial del strut e incrementar su fuerza radial modificando la composición. Los datos del primer estudio en humanos, en el ensayo BIOMAG-I, son también prometedores55, pero habrá que esperar pacientemente a disponer de más datos de seguridad antes de poder emplearlo fuera de protocolo. La combinación del desarrollo tecnológico y la puesta en práctica de las lecciones aprendidas con Absorb traerán con seguridad nuevas oportunidades para poder contar con esta tecnología en nuestros laboratorios de intervencionismo51.
CONCLUSIONES Y PERSPECTIVAS FUTURAS
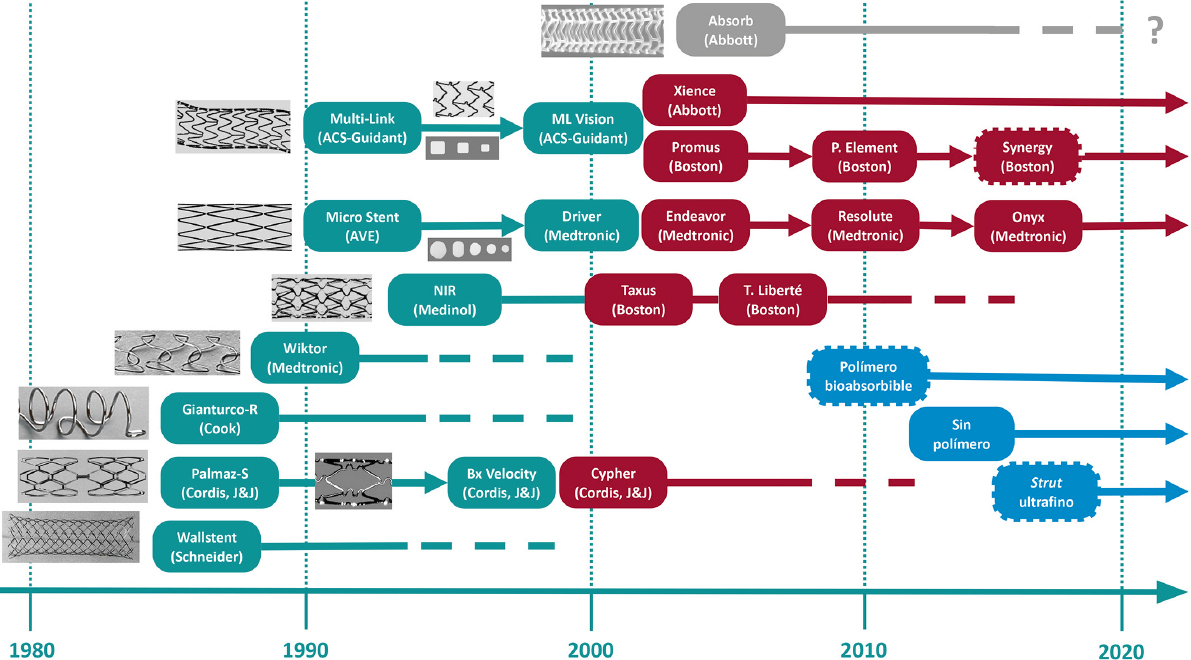
La invención del stent ha supuesto uno de los mayores avances en la historia de la cardiología y de la medicina en general. Este artículo relata el éxito de la colaboración entre genios innovadores e industria biomédica que invirtió lo necesario para el desarrollo de una terapia requerida por la población (figura 9). Esta hazaña trajo además importantes aprendizajes para la investigación en cardiología intervencionista. La necesidad de evaluar la seguridad y la efectividad de los sucesivos avances hizo madurar rápidamente la metodología de investigación y se crearon grandes redes de colaboración. La coordinación de los protocolos, la recogida y la auditoría de datos, y su análisis posterior, pudieron llevarse a cabo gracias al duro trabajo de investigadores dedicados y a la importante financiación por parte de las compañías y de las instituciones académicas. Como resultado, la cardiología intervencionista dispone hoy de una valiosa sistemática de trabajo y de la infraestructura necesaria para seguir innovando.
Figura 9. Stents coronarios que han marcado los hitos más importantes en la historia y su evolución en la línea del tiempo. En verde se señalan los stents metálicos convencionales; en rojo, los farmacoactivos; en gris, el polimérico bioabsorbible; y en azul, los nuevos stents farmacoactivos. El borde discontinuo indica polímero reabsorbible. ACS: Advanced Cardiovascular Systems; AVE: Arterial Vascular Engineering; J&J: Johnson & Johnson.
La práctica de la angioplastia es muy segura y efectiva, en gran parte gracias a los modernos stents que cuentan con todas las mejoras incorporadas durante su historia. En la actualidad, la incidencia de trombosis del stent es menor del 1% en las fases aguda, tardía y muy tardía56. Incluso, gracias a la seguridad de los dispositivos y las mejoras en la técnica, se está logrando acortar el tratamiento antitrombótico potente al mínimo41. La incidencia de restenosis del stent con necesidad de revascularización se presenta con una frecuencia anual del 1-2% tras el implante57. Aunque estas cifras son muy bajas, dado que se implantan millones de stents anualmente en el mundo, puede considerarse un problema de salud relevante desde el punto de vista epidemiológico. Sigue habiendo problemas que requieren la atención de la investigación: los pacientes con propensión a la restenosis recurrente, las lesiones calcificadas que impiden resultados óptimos, y el efecto deletéreo de los fármacos antiproliferativos sobre la función endotelial con el consecuente desarrollo de neoateroesclerosis41. Todo ello ofrece oportunidades para la innovación en la industria del stent. Además, la perspectiva de poder realizar angioplastias efectivas sin dejar un dispositivo permanente sigue abierta con la línea del stent bioabsorbible, aunque también con la posible expansión del uso del balón recubierto de fármaco a distintos escenarios clínico-anatómicos en los que el stent permanente pudiera presentar inconvenientes58.
FINANCIACIÓN
Los autores declaran la ausencia de fuentes de financiación para la elaboración de este artículo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado inteligencia artificial en este trabajo.
CONTRIBUCIÓN DE LOS AUTORES
F. Macaya-Ten: concepción y diseño, y redacción de la primera versión del manuscrito. N. Gonzalo: revisión crítica del manuscrito. J. Escaned: revisión crítica del manuscrito. C. Macaya: concepción y diseño, y revisión crítica del manuscrito.
CONFLICTO DE INTERESES
Se declara la ausencia de conflictos de intereses en relación con este trabajo.
AGRADECIMIENTOS
Los autores agradecen el apoyo con material visual y documentación bibliográfica proporcionado por diversas compañías citadas en este artículo.
BIBLIOGRAFÍA
1. Gaspard P, Whitin H. The History of Coronary Angioplasty. Toulouse:Europa Digital &Publishing/Europa Group;2017.
2. Gruentzig A, Myler R, Hanna E, Turina M. Coronary transluminal angioplasty (abstract). Circulation. 1977;56:84.
3. Gruentzig A. Results from coronary angioplasty and implications for the future. Am Heart J. 1982;103:779-783.
4. Gruentzig AR, King SB, Schlumpf M, Siegenthaler W. Long-term follow-up after percutaneous transluminal coronary angioplasty. The early Zurich experience. N Engl J Med.1987;316:1127-1132.
5. Navarro FA. Stent. Rev Esp Cardiol. 2018;71:694.
6. Roguin A. Stent:The Man and Word Behind the Coronary Metal Prosthesis. Circ Cardiovasc Interv.2011;4:206-209.
7. Dotter CT. Transluminally-placed coilspring endarterial tube grafts. Long-term patency in canine popliteal artery. Invest Radiol. 1969;4:329-332.
8. Sigwart U, Urban P, Golf S, et al. Emergency stenting for acute occlusion after coronary balloon angioplasty. Circulation. 1988;78:1121-1127.
9. Sigwart U, Puel J, Mirkovitch V, Joffre F, Kappenberger L. Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty. N Engl J Med. 1987;316:701-706.
10. Sigwart U. What is a stent and where can you get one?Am J Cardiol. 1997;80:1122.
11. Serruys PW, Strauss BH, Beatt KJ, et al. Angiographic follow-up after placement of a self-expanding coronary-artery stent. N Engl J Med.1991;324:13-17.
12. Tan C, Schatz RA. The History of Coronary Stenting. Interv Cardiol Clin. 2016;5:271-280.
13. Palmaz JC, Sibbitt RR, Reuter SR, Tio FO, Rice WJ. Expandable intraluminal graft:a preliminary study. Work in progress. Radiology. 1985;156:73-77.
14. Fischman DL, Leon MB, Baim DS, et al. A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N Engl J Med. 1994;331:496-501.
15. Serruys PW, de Jaegere P, Kiemeneij F, et al. A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. Benestent Study Group. N Engl J Med. 1994;331:489-495.
16. Macaya C, Serruys PW, Ruygrok P, et al. Continued benefit of coronary stenting versus balloon angioplasty:one-year clinical follow-up of Benestent trial. Benestent Study Group. J Am Coll Cardiol. 1996;27:255-261.
17. George CJ, Baim DS, Brinker JA, et al. One-year follow-up of the Stent Restenosis (STRESS I) Study. Am J Cardiol. 1998;81:860-865.
18. Lansky AJ, Roubin GS, O'Shaughnessy CD, et al. Randomized comparison of GR-II stent and Palmaz-Schatz stent for elective treatment of coronary stenoses. Circulation. 2000;102:1364-1368.
19. Sirnes PA, Golf S, Myreng Y, et al. Stenting in Chronic Coronary Occlusion (SICCO):a randomized, controlled trial of adding stent implantation after successful angioplasty. J Am Coll Cardiol. 1996;28:1444-1451.
20. Versaci F, Gaspardone A, Tomai F, Crea F, Chiariello L, GioffrèPA. A comparison of coronary-artery stenting with angioplasty for isolated stenosis of the proximal left anterior descending coronary artery. N Engl J Med.1997;336:817-822.
21. Serruys PW, de Bruyne B, Carlier S, et al. Randomized comparison of primary stenting and provisional balloon angioplasty guided by flow velocity measurement. Doppler Endpoints Balloon Angioplasty Trial Europe (DEBATE) II Study Group. Circulation. 2000;102:2930-2937.
22. Grines CL, Cox DA, Stone GW, et al. Coronary angioplasty with or without stent implantation for acute myocardial infarction. Stent Primary Angioplasty in Myocardial Infarction Study Group. N Engl J Med. 1999;341:1949-1956.
23. Colombo A, Hall P, Thomas J, Almagor Y, Finci L. Initial experience with the disarticulated (one-half) Palmaz-Schatz stent:a technical report. Cathet Cardiovasc Diagn. 1992;25:304-308.
24. Serruys PW, Rensing BJ. Handbook of Coronary Stents, Fourth Edition. Kentucky, USA:Taylor &Francis;2002.
25. Pache J, Kastrati A, Mehilli J, et al. Intracoronary stenting and angiographic results:strut thickness effect on restenosis outcome (ISAR-STEREO-2) trial. J Am Coll Cardiol. 2003;41:1283-1288.
26. Colombo A, Stankovic G, Moses JW. Selection of coronary stents. J Am Coll Cardiol. 2002;40:1021-1033.
27. Serruys PW, Unger F, Sousa JE, et al. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med.2001;344:1117-1124.
28. Gaspardone A, Versaci F. Coronary stenting and inflammation. Am J Cardiol. 2005;96:65L-70L.
29. Kearney M, Pieczek A, Haley L, et al. Histopathology of in-stent restenosis in patients with peripheral artery disease. Circulation. 1997;95:1998-2002.
30. SabatéM, Pimentel G, Prieto C, et al. Intracoronary brachytherapy after stenting de novo lesions in diabetic patients:results of a randomized intravascular ultrasound study. J Am Coll Cardiol. 2004;44:520-527.
31. Hobby G, Clark R, Woywodt A. A treasure from a barren island:the discovery of rapamycin. Clin Kidney J. 2022;15:1971-1972.
32. Weaver BA. How Taxol/paclitaxel kills cancer cells. Mol Biol Cell. 2014;25:2677-2681.
33. Scheller B, Speck U, Abramjuk C, Bernhardt U, Böhm M, Nickenig G. Paclitaxel balloon coating, a novel method for prevention and therapy of restenosis. Circulation. 2004;11:810-814.
34. Sousa JE, Costa MA, Abizaid AC, et al. Sustained suppression of neointimal proliferation by sirolimus-eluting stents:one-year angiographic and intravascular ultrasound follow-up. Circulation. 2001;104:2007-2011.
35. Morice MC, Serruys PW, Sousa JE, et al. A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N Engl J Med. 2002;346:1773-1780.
36. Colombo A, Drzewiecki J, Banning A, et al. Randomized study to assess the effectiveness of slow- and moderate-release polymer-based paclitaxel-eluting stents for coronary artery lesions. Circulation. 2003;108:788-794.
37. Pfisterer M, Brunner-La Rocca HP, Buser PT, et al. Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents:an observational study of drug-eluting versus bare-metal stents. J Am Coll Cardiol. 2006;48:2584-2591.
38. Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans:delayed healing and late thrombotic risk. J Am Coll Cardiol.2006;48:193-202.
39. Otsuka F, Byrne RA, Yahagi K, et al. Neoatherosclerosis:overview of histopathologic findings and implications for intravascular imaging assessment. Eur Heart J. 2015;36:2147-2159.
40. Stone GW, Moses JW, Ellis SG, et al. Safety and efficacy of sirolimus- and paclitaxel-eluting coronary stents. N Engl J Med. 2007;356:998-1008.
41. Torii S, Jinnouchi H, Sakamoto A, et al. Drug-eluting coronary stents:insights from preclinical and pathology studies. Nat Rev Cardiol. 2020;17:37-51.
42. Garg S, Serruys PW. Coronary Stents:Current Status. J Am Coll Cardiol. 2010;56:S1-S42.
43. Otsuka F, Vorpahl M, Nakano M, et al. Pathology of second-generation everolimus-eluting stents versus first-generation sirolimus- and paclitaxel-eluting stents in humans. Circulation.2014;129:211-223.
44. Taglieri N, Bruno AG, Ghetti G, et al. Target Lesion Failure With Current Drug-Eluting Stents:Evidence From a Comprehensive Network Meta-Analysis. JACC Cardiovasc Interv. 2020;13:2868-2878.
45. Madhavan MV, Howard JP, Naqvi A, et al. Long-term follow-up after ultrathin vs. 2nd-generation drug-eluting stents:a systematic review and meta-analysis of randomized controlled trials. Eur Heart J. 2021;42:2643-2654.
46. Macaya F, Ryan N, Salinas P, Pocock SJ. Challenges in the Design and Interpretation of Noninferiority Trials. J Am Coll Cardiol. 2017;70:894-903.
47. Tamai H, Igaki K, Kyo E, et al. Initial and 6-month results of biodegradable poly-l-lactic acid coronary stents in humans. Circulation. 2000;102:399-404.
48. Nishio S, Kosuga K, Igaki K, et al. Long-term (>10 years) clinical outcomes of first-in-human biodegradable poly-l-lactic acid coronary stents:Igaki-Tamai stents. Circulation. 2012;125:2343-2353.
49. Serruys PW, Chevalier B, Sotomi Y, et al. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent for the treatment of coronary artery stenosis (ABSORB II):a 3 year, randomised, controlled, single-blind, multicentre clinical trial. Lancet. 2016;388:2479-2491.
50. Ali ZA, Serruys PW, Kimura T, et al. 2-year outcomes with the Absorb bioresorbable scaffold for treatment of coronary artery disease:a systematic review and meta-analysis of seven randomised trials with an individual patient data substudy. Lancet. 2017;390:760-772.
51. Katagiri Y, Serruys PW, Asano T, et al. How does the failure of Absorb apply to the other bioresorbable scaffolds?An expert review of first-in-man and pivotal trials. EuroIntervention J. 2019;15:116-123.
52. Stone GW, Abizaid A, Onuma Y, et al. Effect of Technique on Outcomes Following Bioresorbable Vascular Scaffold Implantation:Analysis From the ABSORB Trials. J Am Coll Cardiol. 2017;70:2863-2874.
53. Smits PC, Chang CC, Chevalier B, et al. Bioresorbable vascular scaffold versus metallic drug-eluting stent in patients at high risk of restenosis:the COMPARE-ABSORB randomised clinical trial. EuroIntervention. 2020;16:645-653.
54. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
55. Haude M, Wlodarczak A, van der Schaaf RJ, et al. Safety and performance of the third-generation drug-eluting resorbable coronary magnesium scaffold system in the treatment of subjects with de novo coronary artery lesions:6-month results of the prospective, multicenter BIOMAG-I first-in-human study. EClinicalMedicine. 2023;59:101940.
56. Gori T, Polimeni A, Indolfi C, Räber L, Adriaenssens T, Münzel T. Predictors of stent thrombosis and their implications for clinical practice. Nat Rev Cardiol. 2019;16:243-256.
57. Giustino G, Colombo A, Camaj A, et al. Coronary In-Stent Restenosis:JACC State-of-the-Art Review. J Am Coll Cardiol. 2022;80:348-372.
58. Jeger RV, Eccleshall S, Wan AWA, et al. Drug-Coated Balloons for Coronary Artery Disease. JACC Cardiovasc Interv. 2020;13:1391-1402.
RESUMEN
La insuficiencia mitral funcional auricular (IMFA) ha sido recientemente el foco de atención de muchos artículos y revisiones originales. El envejecimiento de la población, el aumento de la prevalencia de insuficiencia cardiaca con fracción de eyección preservada y fibrilación auricular así como el desarrollo de las técnicas transcatéter para la reparación de la válvula mitral han resaltado la IMFA, un fenotipo de insuficiencia mitral que presenta desafíos diagnósticos específicos y para el cual actualmente las guías no tienen recomendaciones sólidas para su tratamiento. Existe una importante acumulación de datos que sugieren que el pronóstico de los pacientes con IMFA grave es malo si no se tratan. Sin embargo, las nuevas terapias para la insuficiencia cardiaca y las técnicas mínimamente invasivas pueden tener un impacto positivo en el prognóstico de esos pacientes.
Palabras clave: Insuficiencia mitral funcional atrial. Diagnóstico. Ecocardiografía. Reparación de borde a borde. Reparación mitral transcatéter.
ABSTRACT
Atrial functional mitral regurgitation (AFMR) has recently been the focus of numerous original articles and reviews. This entity has been highlighted by population aging, the increasing prevalence of heart failure with preserved ejection fraction and atrial fibrillation, and the advent of the transcatheter techniques for mitral valve repair. AFMR is phenotype of mitral regurgitation that presents specific diagnostic challenges and current guidelines do not provide strong recommendations for its management. Cumulative data show that the outcomes of patients with severe AFMR are poor if left untreated. However, new heart failure therapies and minimally invasive techniques may have a positive impact on the outcomes of these patients.
Keywords: Atrial functional mitral regurgitation. Diagnosis. Echocardiography. Edge-to-edge repair. Transcatheter mitral valve repair.
Abreviaturas IMFA: insuficiencia mitral funcional auricular.
La tríada propuesta por el Prof. Carpentier se suele emplear para caracterizar el mecanismo de la insuficiencia mitral: etiología, lesión y disfunción1. La deficiencia fibroelástica, la enfermedad mixomatosa, la cardiopatía reumática y la endocarditis son etiologías que provocan, directamente, lesiones en la válvula mitral tales como la rotura de las cuerdas tendinosas, tejido excesivo en las valvas, engrosamiento y calcificación de éstas y del aparato subvalvular y perforación de las valvas. Como consecuencia, la insuficiencia mitral resultante se conoce como orgánica o primaria. La cardiopatía isquémica, la miocardiopatía dilatada y la fibrilación auricular son etiologías que dan lugar a la dilatación del anillo mitral y a una restricción del movimiento de las valvas. Estas lesiones se consideran secundarias al proceso de remodelado tanto del ventrículo izquierdo como de la aurícula. En este sentido, la insuficiencia mitral resultante se considera secundaria o funcional. El abordaje para la reparación quirúrgica varía dependiendo de si se trata de insuficiencia mitral primaria o secundaria. En la primaria, las técnicas de reparación implican la resección del festón redundante de la valva mitral, el implante de neocuerdas, el uso de un parche pericárdico (en la perforación de las valvas) y una anuloplastia mitral para restablecer una coaptación normal. En la secundaria, la técnica que suele usarse es la anuloplastia mitral restrictiva.
La llegada de técnicas de reparación percutánea de la válvula mitral pone de manifiesto lo importante que es valorar la etiología de la insuficiencia mitral y caracterizar el aparato valvular mitral con especial atención al área valvular mitral, a la longitud y movimiento de las valvas, a la profundidad y longitud de coaptación y a la localización de la mayor vena contracta del chorro regurgitante2. Estos factores son clave a la hora de seleccionar a aquellos pacientes con insuficiencia mitral en quienes la reparación mitral percutánea de borde a borde tendrá éxito. Las guías actuales describen las características de la válvula mitral que definen las anatomías óptimas, complejas y no adecuadas de la válvula mitral a la hora de realizar una reparación mitral percutánea de borde a borde con garantías de éxito3. En pacientes de alto riesgo quirúrgico o considerados inoperables con insuficiencia mitral primaria y un aparato valvular mitral anatómicamente adecuado, se puede considerar la reparación mitral por catéter de borde a borde (clase IIb). En aquellos de alto riesgo quirúrgico o considerados inoperables y que no precisan revascularización coronaria y con insuficiencia mitral secundaria y un aparato valvular mitral anatómicamente adecuado, la reparación mitral percutánea de borde a borde tiene una recomendación clase IIa. En la actualidad, en este último escenario clínico, hay muchos pacientes con insuficiencia mitral secundaria debido a la dilatación auricular y del anillo mitral; se trata de pacientes distintos de aquellos en quienes la insuficiencia mitral está provocada por una dilatación y disfunción del ventrículo izquierdo. El riesgo quirúrgico de pacientes con insuficiencia mitral funcional auricular (IMFA) suele ser menor que el de aquellos con insuficiencia mitral funcional ventricular, si bien la evidencia que avale el uso de la reparación quirúrgica frente a percutánea de la valvular mitral sigue siendo escasa.
La IMFA aparece en un contexto de fibrilación auricular permanente o insuficiencia cardiaca con fracción de eyección mantenida4-6 y se caracteriza por la dilatación y disfunción del anillo y por una pérdida de sincronía auricular7. En pacientes con insuficiencia cardiaca y fracción de eyección mantenida, el remodelado del ventrículo izquierdo, caracterizado por una hipertrofia concéntrica y una mayor rigidez, resulta en presiones altas de llenado del ventrículo izquierdo que se transmiten a la aurícula izquierda. En respuesta a estas subidas de presión, la aurícula izquierda se dilata como mecanismo compensatorio para equilibrar esta subida de presión y que no pase a la circulación pulmonar. No obstante, el remodelado crónico de la aurícula izquierda conduce a la disfunción auricular y a la dilatación del anillo mitral y contribuye a una coaptación fallida de las valvas7.
La incidencia de la IMFA entre pacientes con fibrilación auricular se calcula en un 7%, aunque esta cifra puede aumentar hasta el 53% en pacientes con insuficiencia cardiaca y fracción de eyección mantenida8. Además, los datos de la Base de Datos Nacional de Eco de Australia (NEDA) informaron incidencias significativas de la IMFA llegando al 8% en pacientes con fibrilación auricular y sin cardiopatía estructural subyacente, al 28% en pacientes con fibrilación auricular de larga data y al 20% en aquellos con insuficiencia cardiaca y fracción de eyección conservada9.
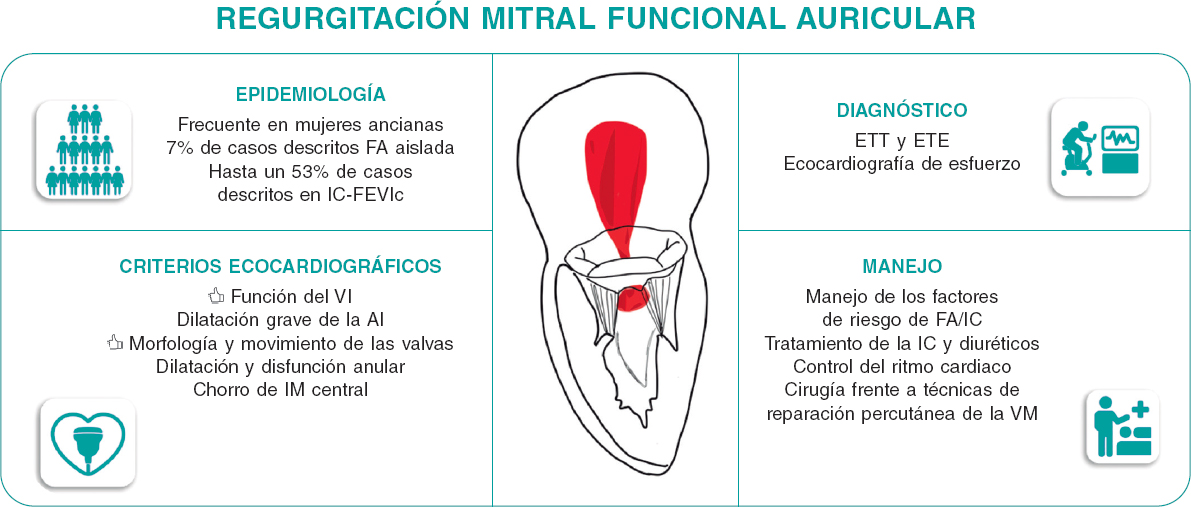
Según diferentes series, se sabe que la IMFA suele afectar a mujeres ancianas con antecedentes de fibrilación auricular e hipertensión arterial10. Se debe mencionar que tanto la fibrilación auricular como la insuficiencia cardiaca con fracción de eyección conservada suelen coexistir, lo cual provoca un mayor remodelado cardiaco, más sintomatología y peores resultados clínicos11. Se suele llegar al diagnóstico de IMFA, principalmente, mediante ecocardiografía transtorácica y transesofágica8. Las principales características ecocardiográficas de la IMFA incluyen una morfología y movimiento normales de las valvas mitrales con una coaptación alterada secundaria a la dilatación del anillo mitral, a menudo con diferentes grados de calcificación. Cuantificar el grado de IMFA puede ser todo un desafío al tratarse de una disfunción que depende de las condiciones de carga de los pacientes. Además, la presencia de fibrilación auricular añade complejidad a la cuantificación de la IMFA por la variabilidad latido a latido. Es importante tener en cuenta el papel que juega la ecocardiografía de esfuerzo, capaz de revelar la presencia de síntomas y detectar la IMFA grave durante la realización de ejercicio máximo. La inducción de insuficiencia tricuspídea significativa e hipertensión pulmonar también son habituales en el esfuerzo. La ecocardiografía de esfuerzo puede ser un segundo paso previo a otras técnicas de imagen, como la resonancia magnética cardiaca, para identificar a aquellos pacientes con IMFA grave.
Las implicaciones clínicas de la IMFA se han descrito recientemente8. El pronóstico de la IMFA grave bajo tratamiento médico es similar al de la insuficiencia mitral funcional del ventrículo izquierdo. En una comparativa con pacientes con insuficiencia mitral primaria, la IMFA se asoció a una peor supervivencia y a más hospitalizaciones por insuficiencia cardiaca. Es importante destacar que se suelen derivar menos a pacientes con IMFA para reparación o reemplazo quirúrgico de la válvula mitral que a pacientes con insuficiencia mitral funcional del ventrículo izquierdo o insuficiencia mitral primaria12. Esto probablemente se deba a la fisiopatología de la IMFA: las guías recomiendan, primero, prescribir el tratamiento médico óptimo (en este caso para la insuficiencia cardiaca con fracción de eyección conservada) y lograr controlar el ritmo cardiaco (en presencia de fibrilación auricular) antes de la intervención3. La evidencia que existe sobre el beneficio de supervivencia de la reparación quirúrgica de la válvula mitral aislada en el manejo de la IMFA es escasa. La reparación quirúrgica de la válvula mitral mediante anuloplastia con anillo rígido completo ha reportado índices bajos tanto de reintervenciones como de recurrencia de la insuficiencia mitral tras 5 años de seguimiento13.
Basándose en un gran registro, la inteligencia artificial ha sido capaz de identificar 4 grupos de pacientes con insuficiencia mitral tratados mediante reparación percutánea de la válvula mitral de borde a borde con resultados clínicos dispares14. Los pacientes del grupo 1 (insuficiencia mitral aislada), caracterizados por la presencia de dilatación auricular izquierda, fracción de eyección del ventrículo izquierdo conservada y una fibrilación auricular del 60% son los que tuvieron la supervivencia más alta. Por otro lado, los pacientes del grupo 4 (dilatación biauricular), caracterizados por la presen- cia de aurículas izquierda y derecha sumamente dilatadas, una fracción de eyección del ventrículo izquierdo en el límite inferior de la normalidad y todos con fibrilación auricular, fueron los que tuvieron peores resultados14. Estos resultados fueron confirmados en una cohorte externa. No obstante, no se especificó en el estudio qué lesión de la válvula mitral es la que provocaba insuficiencia mitral. En este sentido, podría haber pacientes con insuficiencia mitral primaria. En la actualidad, ningún ensayo clínico aleatorizado ha comparado los resultados de la reparación quirúrgica frente a la reparación percutánea de borde a borde de la válvula mitral en pacientes con IMFA.
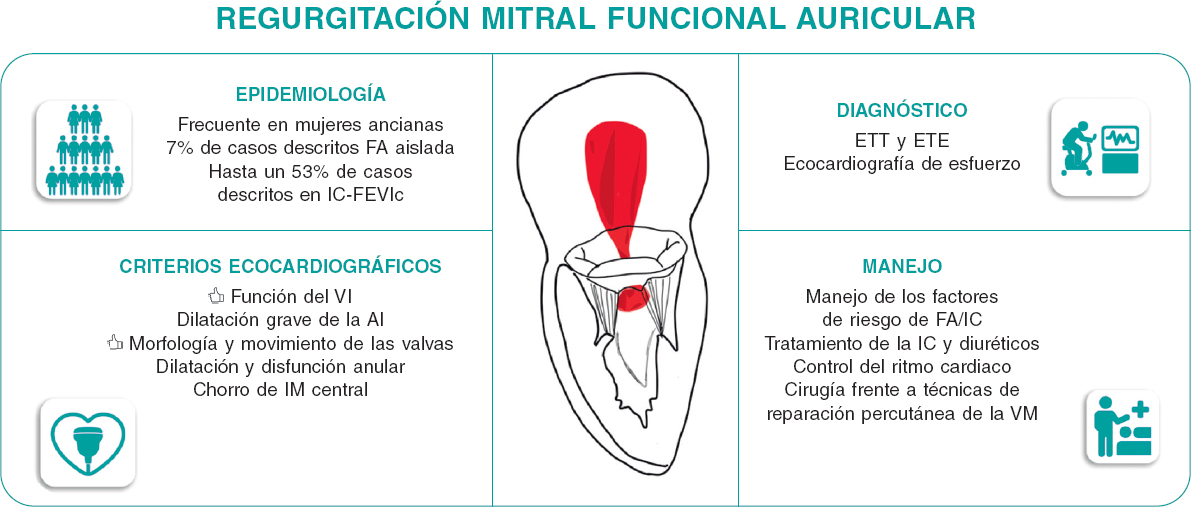
El campo de la IMFA va a atraer mucha atención porque la prevalencia de la insuficiencia cardiaca con fracción de eyección conservada y fibrilación auricular, las principales etiologías fisiopatológicas subyacentes de la IMFA, irán en aumento de forma simultánea al envejecimiento poblacional. Nuevos y eficaces tratamientos tales como los inhibidores del cotransportador de sodio-glucosa tipo 215, los agonistas del péptido similar al glucagón-116 y las técnicas tempranas de ablación de la fibrilación auricular17, pueden influir en la prevalencia de la IMFA. No obstante, necesitaremos nuevos ensayos centrados en la IMFA, aunque, quizás, antes debamos mejorar el abordaje de esta entidad que lleva demasiado tiempo descuidándose y considerándose un mero espectador de otras patologías. Se necesita un diagnóstico y caracterización precisos de la IMFA (figura 1). También se necesitan grandes registros que informen sobre los resultados de la IMFA a tratamiento médico y con técnicas quirúrgicas y de reparación percutánea de la válvula mitral para acotar y diseñar nuevos ensayos clínicos aleatorizados que perfeccionen las recomendaciones establecidas en las guías clínicas En este sentido, establecer la IMFA como una nueva entidad fue una necesidad clínica no satisfecha para dar un tratamiento óptimo y personalizado a cada paciente con insuficiencia mitral.
Figura 1. Caracterización y manejo de la insuficiencia mitral funcional auricular. AI: aurícula izquierda; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; IC-FEVIm: insuficiencia cardíaca con fracción de eyección del ventrículo izquierdo mantenida; IC: insuficiencia cardiaca; IM: insuficiencia mitral; VM: válvula mitral.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se han utilizado herramientas basadas en inteligencia artificial para redactar este manuscrito ni generar la figura.
CONTRIBUCIÓN DE LOS AUTORES
Los autores confirman las siguientes aportaciones a este artículo. Idea y diseño del artículo: V. Delgado, S. Danojevic, M. De Raffele y L. Niro. Metodología: V. Delgado, S. Danojevic. Validación, M. De Raffele y L. Niro. Búsqueda bibliográfica: S. Danojevic, M. De Raffele y L. Niro. Preparación y redacción del borrador original: S. Danojevic. Redacción, revisión y edición: V. Delgado, M. De Raffele y L. Niro. Supervisión: V. Delgado. Todos los autores han leído y aceptado la versión publicada del manuscrito.
CONFLICTO DE INTERESES
V. Delgado declaró haber recibido honorarios como conferenciante de Edwards Lifesciences, GE Healthcare, Novartis y Philips y como consultor de Novo Nordisk, MSD y Edwards Lifesciences. Los demás autores no declararon ningún conflicto de intereses.
BIBLIOGRAFÍA
1. Carpentier A. Cardiac valve surgery--The “French correction”. J Thorac Cardiovasc Surg. 1983;86:323-37.
2. Mauri L, Garg P, Massaro JM, et al. The EVEREST II Trial:Design and rationale for a randomized study of the evalve mitraclip system compared with mitral valve surgery for mitral regurgitation. Am Heart J. 2010;160:23-29.
3. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
4. Zoghbi WA, Levine RA, Flachskampf F, et al. Atrial Functional Mitral Regurgitation:A JACC:Cardiovascular Imaging Expert Panel Viewpoint. JACC Cardiovasc Imaging. 2022;15:1870-1882.
5. Levine RA, Schwammenthal E. Ischemic mitral regurgitation on the threshold of a solution:From paradoxes to unifying concepts. Circulation. 2005;112:745-758.
6. Ennezat PV, Maréchaux S, Pibarot P, Le Jemtel TH. Secondary mitral regurgitation in heart failure with reduced or preserved left ventricular ejection fraction. Cardiology. 2013;125:110-117.
7. Gertz ZM, Raina A, Saghy L, et al. Evidence of atrial functional mitral regurgitation due to atrial fibrillation:Reversal with arrhythmia control. J Am Coll Cardiol. 2011;58:1474-81.
8. Deferm S, Bertrand PB, Verbrugge FH, et al. Atrial Functional Mitral Regurgitation:JACC Review Topic of the Week. J Am Coll Cardiol. 2019;73:2465-2476.
9. Moonen A, Ng MKC, Playford D, Strange G, Scalia GM, Celermajer DS. Atrial functional mitral regurgitation:Prevalence, characteristics and outcomes from the National Echo Database of Australia. Open Heart. 2023;10:e002180.
10. Dziadzko V, Dziadzko M, Medina-Inojosa JR, et al. Causes and mechanisms of isolated mitral regurgitation in the community:Clinical context and outcome. Eur Heart J. 2019;40:2194-2202.
11. Lam CSP, Rienstra M, Tay WT, et al. Atrial Fibrillation in Heart Failure With Preserved Ejection Fraction:Association With Exercise Capacity, Left Ventricular Filling Pressures, Natriuretic Peptides, and Left Atrial Volume. JACC Heart Fail. 2017;5:92-98.
12. Mesi O, Gad MM, Crane AD, et al. Severe Atrial Functional Mitral Regurgitation:Clinical and Echocardiographic Characteristics, Management and Outcomes. JACC Cardiovasc Imaging. 2021;14:797-808.
13. Wagner CM, Brescia AA, Watt TMF, et al. Surgical strategy and outcomes for atrial functional mitral regurgitation:All functional mitral regurgitation is not the same!J Thorac Cardiovasc Surg. 2022;167(2):647-655.
14. Trenkwalder T, Lachmann M, Stolz L, et al. Machine learning identifies pathophysiologically and prognostically informative phenotypes among patients with mitral regurgitation undergoing transcatheter edge-to-edge repair. Eur Heart J Cardiovasc Imaging. 2023;24:574-587.
15. Gulsin GS, Graham-Brown MPM, Squire IB, Davies MJ, McCann GP. Benefits of sodium glucose cotransporter 2 inhibitors across the spectrum of cardiovascular diseases. Heart. 2022;108:16-21.
16. Kosiborod MN, Abildstrøm SZ, Borlaug BA, et al. Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 2023;389:1069-1084.
17. Yamauchi R, Morishima I, Okumura K, et al. Association Between Catheter Ablation for Nonparoxysmal Atrial Fibrillation and Functional Mitral Regurgitation in Patients With Heart Failure With Preserved Ejection Fraction. Am J Cardiol. 2023;207:192-201.
* Autor para correspondencia.
Correo electrónico: (V. Delgado).
@VDelgadoGarcia; @icorcat; @suzidanojevic; @Doc_Niro; @MartinaRaffele;
RESUMEN
La obstrucción de las arterias coronarias (OC) es una complicación rara, pero potencialmente fatal, del implante percutáneo de válvula aórtica (TAVI). El objetivo de esta revisión es resumir la evidencia sobre los factores de riesgo de OC y las estrategias preventivas. Se realizó una revisión integral de la literatura centrada en estos aspectos. El análisis consideró estudios que abordaran las características del paciente, los factores procedimentales y la efectividad de diferentes técnicas preventivas para reducir el riesgo de OC. Se describen los factores relacionados con el paciente y del procedimiento que condicionan un mayor riesgo de OC. A lo largo del texto se detallan las técnicas para disminuir el riesgo de OC, incluidos el stent en chimenea y la técnica BASILICA. Además, se aporta una descripción general de los dispositivos diseñados para abordar esta complicación. En conclusión, la identificación de los factores de riesgo de OC es crucial para optimizar los resultados del TAVI. La evaluación exhaustiva mediante imagen multimodal, junto a estrategias preventivas apropiadas, como la técnica BASILICA, pueden mitigar el riesgo de OC y mejorar los resultados. Aún se requiere más investigación para validar los dispositivos emergentes.
Palabras clave: Implante percutáneo de válvula aórtica. Obstrucción de arterias coronarias. Técnicas de protección coronaria.
ABSTRACT
Coronary obstruction (CO) is a rare but potentially fatal complication of transcatheter aortic valve implantation (TAVI). The present article aims to summarize the evidence on CO risk factors and provide an overview of preventive strategies. We performed a comprehensive literature review focused on these items. The analysis included studies addressing patient-specific characteristics, procedural aspects, and the effectiveness of various prevention techniques in mitigating CO risk. Specific risk factors for CO, which can be assessed by evaluating patient characteristics using computed tomography, are described. Procedural factors associated with an increased risk of CO are discussed. Preventive techniques, including the chimney stent and bioprosthetic aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction (BASILICA), are also described, highlighting the advantages and disadvantages of each method. The present review also provides an overview of emerging dedicated devices designed to address this complication. In conclusion, identifying patients at risk for CO is crucial for optimizing TAVI outcomes. Comprehensive imaging assessment and appropriate preventive strategies, such as the BASILICA technique, can mitigate the risk of CO and improve patient outcomes. Further research is needed to validate emerging dedicated devices.
Keywords: Transcatheter aortic valve replacement. Coronary artery obstruction. Coronary protection techniques.
Abreviaturas DVC: distancia válvula-coronaria. OC: obstrucción coronaria. PVB: prótesis valvular biológica. RQVA: reemplazo quirúrgico de válvula aórtica. SDV: seno de Valsalva. TAVI: implante percutáneo de válvula aórtica. THV: prótesis valvular cardiaca percutánea. UST: unión sinotubular.
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI) ha tenido una evolución rápida logrando un perfil de seguridad y eficacia notables1,2. No obstante, complicaciones tales como trastornos de la conducción, complicaciones relacionadas con el sitio de acceso y obstrucciones coronarias (OC) siguen preocupando por la morbimortalidad asociada a dichas complicaciones. La OC es una complicación rara (descrita entre el 0,5 y el 8% de los casos) pero potencialmente fatal durante el TAVI3-5. La tasa de mortalidad intrahospitalaria a los 30 días asociada a este evento está en torno al 30-50%6-8. Las OC pueden sobrevenir en un entorno agudo durante el implante de la válvula, antes de que el paciente haya salido de quirófano, o ser tardías y sobrevenir después de que el paciente haya abandonado el quirófano tras un TAVI exitoso. Las OC tardías se puede clasificar como OC tempranas (0-7 días) o tardías (> 7 días)9.
Existen 2 mecanismos principales en las OC. El primero es la obstrucción directa por desplazamiento de un velo nativo o protésico deteriorado por la prótesis valvular cardiaca percutánea (THV). Se ha descrito con mayor frecuencia en pacientes con orígenes coronarios bajos y senos de Valsalva (SDV) estrechos4. El segundo mecanismo es una obstrucción indirecta en la que también se desplaza el velo obstruyendo la unión sinotubular (UST) con el consiguiente secuestro de los senos de Valsalva. Se ha descrito con mayor frecuencia en UST bajas y estrechas. La mayoría de las OC sobrevienen en el ostium coronario (92%) y principalmente en la descendente anterior (78%)4. Otras causas de OC incluyen la embolización y obstrucción directa de los ostium coronarios por la prótesis TAVI3-5,7,10-12.
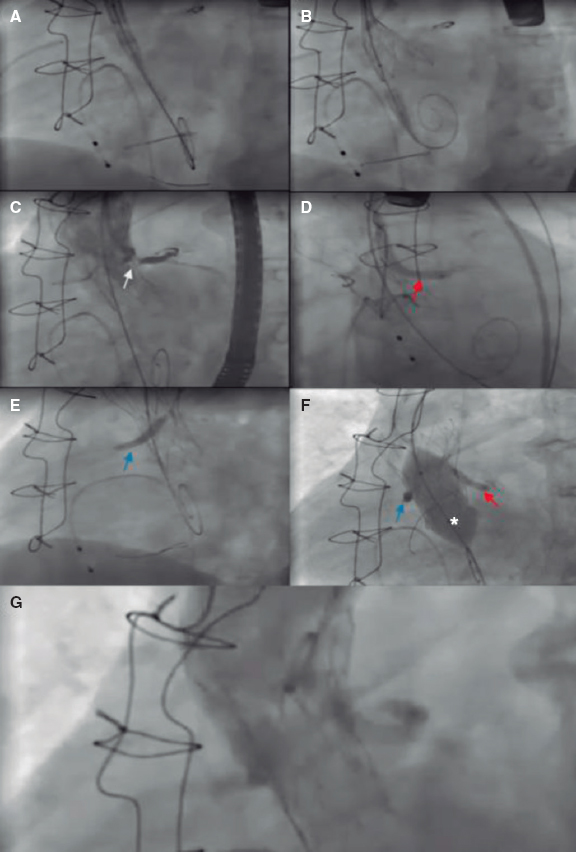
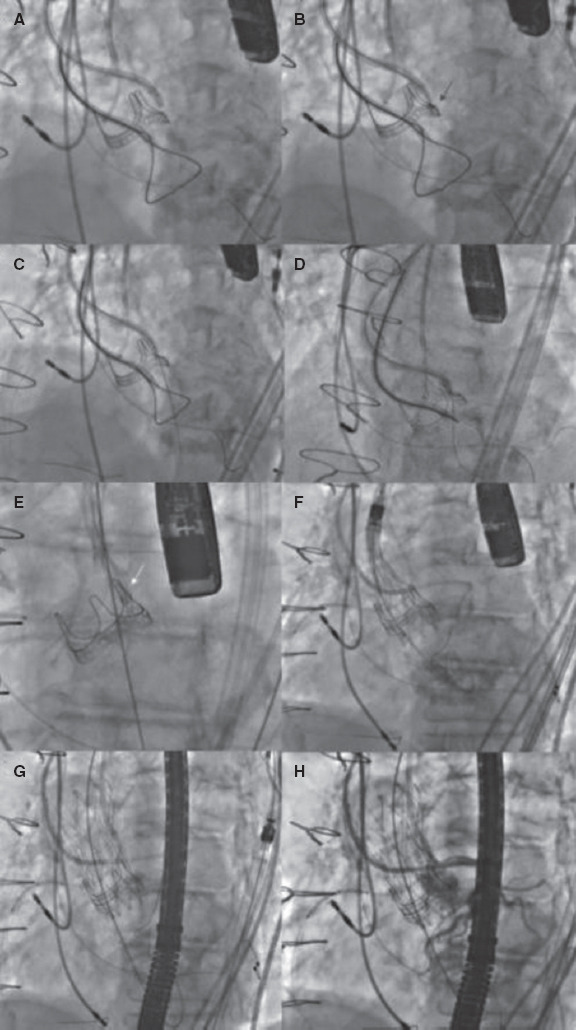
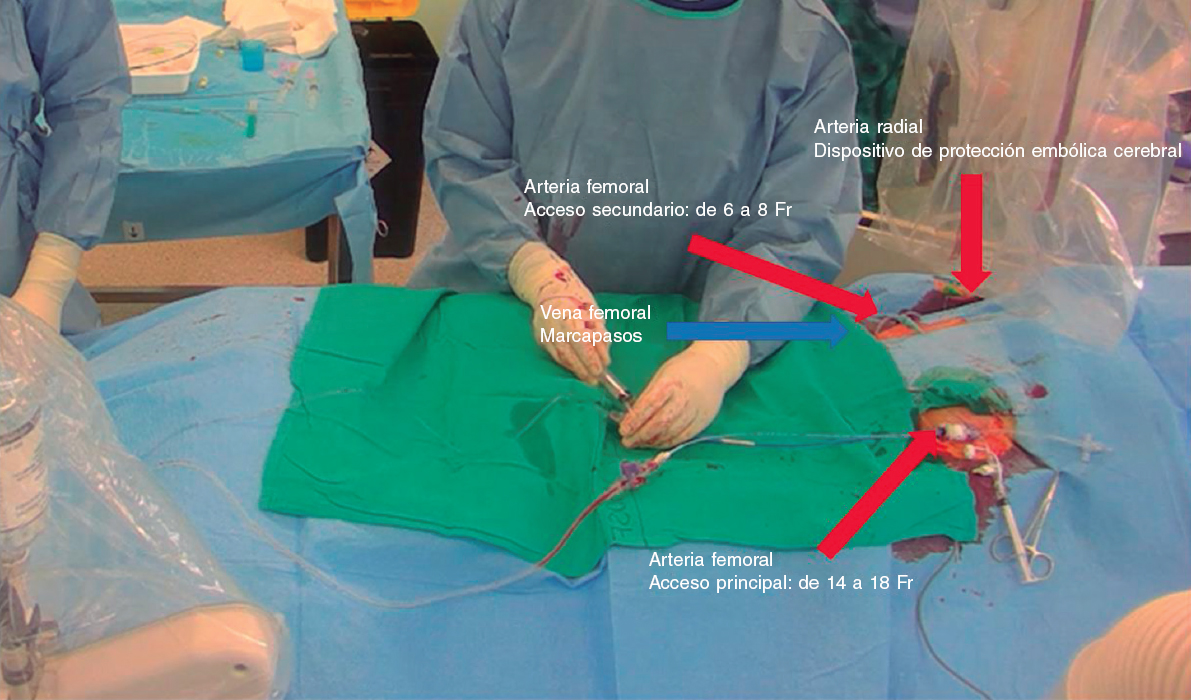
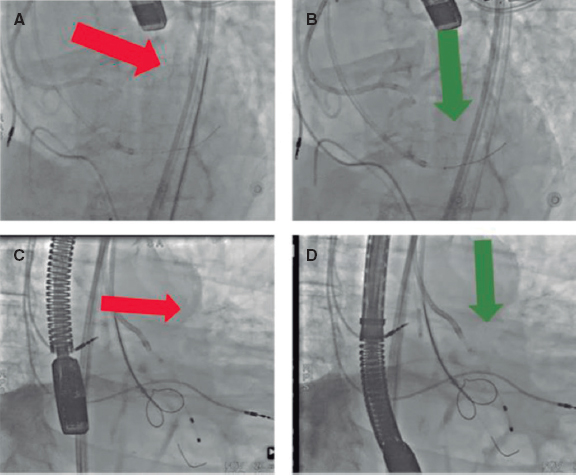
Tras realizar una evaluación exhaustiva, las características anatómicas de alto riesgo podrían llegar favorecer el reemplazo quirúrgico de válvula aórtica (RVAO). No obstante, si el riesgo quirúrgico es prohibitivo, es necesario proceder con el TAVI. En tales situaciones, usar técnicas de protección de las coronarias resulta clave a la hora de aumentar la seguridad y minimizar los riesgos13,14.
Esta revisión tiene como objetivo resumir y analizar los predictores de OC y las técnicas y estrategias que se emplean en la actualidad para prevenir esta complicación en el contexto del TAVI.
FACTORES ASOCIADOS A LA OBSTRUCCIÓN DE LAS CORONARIAS TRAS EL TAVI
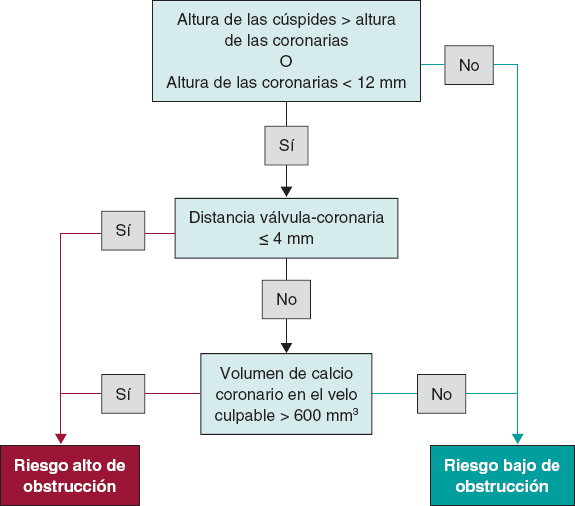
Una planificación meticulosa del TAVI sumado a una comprensión integral de los mecanismos subyacentes que predisponen a la ocurrencia de complicaciones son de una importancia capital para mejorar los resultados. La tomografía computarizada (TC) es esencial a la hora de valorar a los posibles candidatos a un TAVI, incluida una estimación de las posibles complicaciones que pueden darse15. Los principales predictores de OC asociados al TAVI se resumen en la tabla 1.
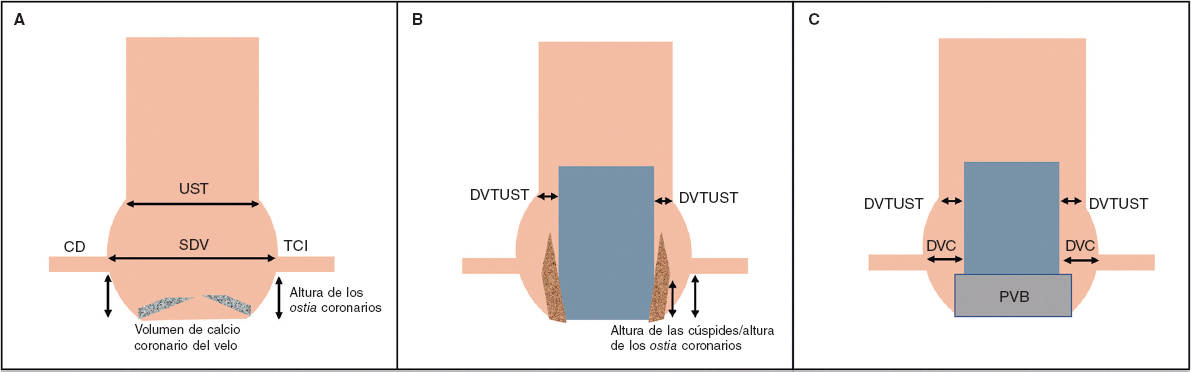
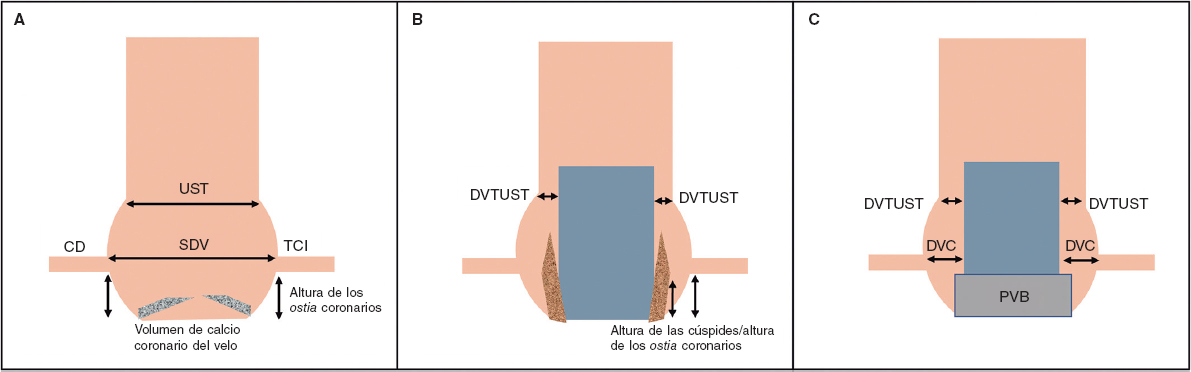
Tabla 1. Factores vinculados a oclusiones coronarias asociadas al TAVI
| Predictores | Comentario |
|---|---|
| Factores anatómicos | Altura de los ostium coronarios < 12 mm (< 10 mm: riesgo máximo)a |
| Diámetro del seno de Valsalva < 30 mma | |
| Altura de la cúspide > altura coronaria | |
| Baja altura y diámetro estrecho de la UST | |
| DVC ≤ 4 mm | |
| Calcificación del velo culpable > 600 mm3 | |
| TAVI ViV | DVC ≤ 4 mma,b |
| PVB sin stent o PVB con stent con velos montados externamenteb | |
| Sexo femenino | Probablemente asociado a la anatomía más pequeña de las mujeres |
| Factores de la THV y de la intervención | Las prótesis expandibles con balón se asocian a un mayor índice de OC agudas |
| Las prótesis expandibles con balón se asocian a la ocurrencia tardía de OC | |
| Faldón externo | |
| Implante alto | |
|
DVC: distancia válvula-coronaria; OC: obstrucción coronaria; PVB: prótesis valvular biológica; TAVI: implante percutáneo de válvula aórtica; THV: prótesis valvular cardiaca percutánea; UST: unión sinotubular. |
|
Factores anatómicos que contribuyen a la ocurrencia de OC en pacientes con válvulas aóticas nativas
El principal predictor es la altura baja de los ostium coronarios medida por TC desde el plano del anillo aórtico. Un consenso de expertos previo sugirió un valor de corte para la altura de los ostium coronarios inferior a 10 mm como indicativa de riesgo máximo16,17. No obstante, los datos de un registro multicéntrico confirmaron que la altura del ostium coronario del tronco común izquierdo (TCI) de casi el 80% de los pacientes con OC era inferior a 12 mm (altura media: 11 mm)3. Además, Ribeiro et al. informaron que en torno al 60% de los pacientes con OC presentaban ostium coronarios con alturas superiores a 10 mm, lo cual sugiere que el valor de corte debería subirse hasta los 12 mm18. El ostium de la coronaria derecha (CD) se vio afectado solo en solo el 11% de todos los casos de OC en un registro previo3 debido al origen más alto de esta arteria comparado con el TCI en la mayoría de los casos19, lo cual viene a subrayar lo importante que son estas mediciones.
Otro factor de riesgo es una raíz aórtica estrecha con un diámetro de los SDV < 30 mm7,11. La distancia válvula-coronaria (DVC) es la distancia que hay desde los ostium coronarios hasta la posición final anticipada de los velos bioprotésicos desplazadas tras del TAVI15. Para calcular la DVC mediante TC, se utiliza un cilindro virtual que representa la THV y se mide la distancia horizontal entre dicho cilindro y los ostium coronarios15. Si la DVC es superior a 6 mm, el riesgo de OC es bajo; entre 4 y 6 mm, el riesgo es límite y si es inferior a 4 mm, el riesgo es máximo7,15. No obstante, las mediciones de la DVC no son 100% específicas, lo cual podría deberse a las diferencias existentes entre las DVC estimada y observada descritas por Tzimas et al.20.
La relación entre la altura de la cúspide aórtica y la altura coronaria es un criterio relativamente nuevo. La altura de la cúspide es la distancia vertical desde el plano anular hasta la parte superior de la unión comisural de la cúspide. Esta medida es probablemente más reproducible que la longitud del velo.
El riesgo de OC indirecta por secuestro de seno es mayor cuando el diámetro anular es mayor que el de la UST y la altura de la cúspide es mayor que la de la UST21. Al igual que ocurre con la DVC, se debe calcular la distancia virtual desde la THV hasta la UST (DVTUST). La figura 1 muestra una representación esquemática de las mediciones asociadas a un valor predictivo para las OC.
Figura 1. Representación esquemática de la raíz aórtica y predictores de OC. A: válvula aórtica nativa. La altura de los ostium coronarios y la anchura de los SDV son predictores de la ocurrencia de OC. El volumen de calcio coronario de los velos también influye en los resultados en este contexto. B: velos de una válvula aórtica nativa desplazados por una THV representadas en esta figura. Una DVTUST más estrecha y una mayor altura de los velos con relación a la altura de los ostium coronarios se asocian al riesgo de OC. C: raíz aórtica con una PVB. El TAVI ViV es un factor de riesgo per se para la ocurrencia de OC; no obstante, este riesgo aumenta cuanto menor es la DVC. Por otro lado, se ha sugerido que una UST estrecha es otro factor contribuyente al riesgo de OC. CD: coronaria derecha; DVC: distancia válvula-coronaria; DVTUST: distancia virtual desde la THV hasta la UST; PVB: prótesis valvular biológica; SDV: seno de Valsalva; TCI: tronco común izquierdo; THV: prótesis valvular cardiaca percutánea; UST: unión sinotubular.
Khan et al. han desarrollado un algoritmo predictivo para valorar el riesgo de OC4. El algoritmo tiene en cuenta alturas de las cúspides mayores que las de las coronarias y cualquiera de las siguientes condiciones: DVC ≤ 4 mm o un volumen de calcio en el velo culpable > 600 mm3. El modelo tuvo un excelente rendimiento a la hora de predecir la obstrucción de los ostium coronarios izquierdo y derecho. La figura 2 muestra un diagrama de flujo para valorar el riesgo de OC en pacientes con válvulas aórticas nativas.
Figura 2. Valoración del riesgo de obstrucción coronaria en pacientes tratados de TAVI para válvulas aórticas nativas.
Características de los pacientes asociadas a la ocurrencia de OC
El sexo femenino está asociado a una mayor incidencia de OC. En torno al 80% de los pacientes de los registros de OC son mujeres18, una relación que probablemente se deba a las diferencias anatómicas entre ambos sexos. Las mujeres suelen tener raíces aórticas más pequeñas, SDV de menor tamaño y ostium coronarios más bajos19.
En cuanto a la historia del paciente, los antecedentes de cirugía de revascularización coronaria están asociados a una menor incidencia de OC sintomática por el «efecto protector» de proporcionar un flujo sanguíneo alternativo18. No obstante, la permeabilidad del injerto siempre debe valorarse antes del TAVI22.
Factores de la intervención que influyen en la ocurrencia de OC
El tipo de THV podría, también, influir en los resultados. Las prótesis expandibles con balón se asocian a un mayor riesgo de OC agudas que las prótesis autoexpandibles11,18. No obstante, esta diferencia podría explicarse, en parte, por las características de la armadura y el mecanismo de implantación18. No obstante, un registro posterior que evaluó la ocurrencia de OC tardías vino a confirmar que las prótesis autoexpandibles se asociaban a índices más altos de esta complicación que las prótesis expandibles con balón. Quizás esto se deba a que las válvulas autoexpandibles están hechas de nitinol y siguen expandiéndose tras el implante inicial9. Otros factores que podrían contribuir a la ocurrencia de OC en este contexto son la estancación del flujo y la micromigración de la prótesis. Jabbour et al. plantean que tanto la endotelización como la embolización de los trombos podrían guardan relación con la ocurrencia de OC tardías9.
Válvulas bioprotésicas quirúrgicas y TAVI «válvula dentro de otra válvula»
El TAVI se ha convertido en una nueva alternativa al RVAO en pacientes con una prótesis valvular biológica (PVB) fallida y riesgo perioperatorio alto o prohibitivo1,2. El TAVI «válvula dentro de otra válvula» (ViV) supone en torno al 5% de todos los TAVI que se realizan en Estados Unidos23. El índice de OC es entre 4 y 6 veces mayor en los TAVI ViV que en las válvulas nativas9. El riesgo más alto de sufrir OC probablemente se deba al diseño supraanular de la mayoría de las PVB que rebaja la altura de los ostium coronarios al tiempo que la sutura de la válvula aproxima las coronarias, reduciendo, así, la anchura del seno24.
Es conveniente contar con un informe preoperatorio integral23. Se deben investigar los detalles de la intervención previa, incluido el modelo y tamaño exactos de la PVB25. Esta diferenciación es esencial porque las válvulas sin stent (como la Freedom [Sorin Biomedica, Italia], la Toronto SPV [St Jude Medical, Estados Unidos], la Freestyle [Medtronic, Estados Unidos]) y las válvulas con stent con velos montados externamente (como la Mitroflow [Sorin Biomedica, Italia] y la Trifecta [St Jude Medical, Estados Unidos]) tienen asociado un mayor riesgo de OC25. Ribeiro et al. han informado de una incidencia mucho mayor de OC en pacientes con válvulas sin stent (3,7%) y válvulas con stent y velos montados externamente (6,4%) que en pacientes con válvulas con stent y velos montados internamente (0,7%). De hecho, el mismo registro demostró que la presencia de estos tipos de válvulas resultó ser un predictor independiente de OC7.
La DVC estimada por TC es uno de los predictores más precisos de OC tras un TAVI ViV7,26. También se ha de tener en cuenta la altura de los ostium coronarios y el diámetro medio de los SDV3,7,15. Otro posible factor de riesgo anatómico para la ocurrencia de OC en una intervención ViV es una UST estrecha, la posición supraanular y un perfil alto de los velos de la PVB27,28.
Redo-TAVI. Implicaciones en la obstrucción coronaria
La tendencia actual en el manejo de la enfermedad aórtica sugiere que dentro de poco, en pacientes con mayor esperanza de vida se empleará el TAVI y no el RVAO. En este sentido, el redo-TAVI quizá juegue un papel esencial en el tratamiento de pacientes con THV fallidas. No obstante, los datos con que contamos sobre predictores para evitar complicaciones en este contexto siguen siendo escasos.
En algunos de los primeros registros y revisiones sistemáticas que entraron a valorar el redo-TAVI o el TAVI en TAVI, los investigadores informaron tasas muy bajas de complicaciones perioperatorias de entre el 0 y el 0,9% de OC30-32. Esto probablemente se deba a un meticuloso análisis de la anatomía con conocimiento de los factores predictivos citados anteriormente, excluyendo a los pacientes de mayor riesgo y con un mayor sesgo de selección.
El redo-TAVI también se asocia a un cierto riesgo de OC y accesos coronarios comprometidos33. El implante de una segunda THV superpone las armaduras de los stents de ambas prótesis con el riesgo que de comprimir los velos de la primera THV, creando un cilindro cubierto hasta el borde de estos34. La superposición de las armaduras de los stents y la pérdida de flujo libre influyen en el flujo coronario y en la posibilidad de canulación.
En pacientes tratados de TAVI en TAVI, la UST juega un papel esencial a la hora de acceder a las coronarias a modo de cuello de botella anatómico. Una UST más alta y ancha ofrece más espacio entre la primera THV y la pared aórtica facilitando el acceso a los ostium coronarios y minimizando la probabilidad de obstrucción del flujo34. Además, la altura de los velos de la primera THV implantada también podría influir en el acceso y el flujo. Las THV previas con velos supraanulares y las THV implantadas en altura aumentan el riesgo de interacción con la UST y obstrucción del flujo en el supuesto de tener que implantar una segunda THV34,35. En este sentido, se sugiere calcular la DVTUST, sobre todo, en intervenciones TAVI en TAVI y TAVI «válvula dentro de otra válvula»36.
Tarantini et al. propusieron un algoritmo para predecir el riesgo de OC y la viabilidad de futuros accesos coronarios. Estos autores tuvieron en cuenta la valoración mediante TC de la altura de los ostium coronarios en relación con la primera THV, una distancia de 2 mm desde la THV hasta la pared aórtica y la confirmación de la posibilidad de canulación coronaria con la anterior válvula en su sitio. Si los ostium coronarios se encuentran por debajo del plano de riesgo de la anterior THV, la distancia hasta la pared aórtica es < 2 mm, lo cual hace inviable la canulación coronaria lo cual, a su vez, descarta la posibilidad de TAVI en TAVI33,37. La anchura de la raíz aórtica también es importante para valorar el riesgo de OC en este contexto.
Redondo et al. han destacado otro aspecto a considerar en la planificación y ejecución del TAVI en TAVI: el alineamiento de los postes comisurales de la anterior THV con respecto a la actual ubicación de los ostium coronarios. Si un paciente con una THV previa corre un riesgo alto de OC, se puede lacerar a propósito el festón aórtico bioprotésico o nativo mientras se emplea la técnica TAVI (BASILICA) para evitar la obstrucción iatrogénica de la coronaria y así mitigar dicho riesgo. Esta estrategia, consistente en lacerar el velo anterior para posibilitar un flujo coronario normal y que se detalla a continuación, podría no resultar con alineamientos inadecuados de los ostium coronarios en relación con los postes comisurales de la primera THV por una ubicación excéntrica de los ostium coronarios38.
ESTRATEGIAS PARA EVITAR OBSTRUCCIONES CORONARIAS TRAS EL TAVI
Tal y como venimos subrayando, el primer paso y el más importante para evitar la ocurrencia de complicaciones perioperatorias asociadas al TAVI es realizar valoraciones integrales con la ayuda de imágenes y una planificación adecuada. Ante el riesgo alto de OC, una nueva valoración del riesgo podría favorecer optar por el RQVA Un riesgo quirúrgico excesivo que requiera continuar con la estrategia percutánea requiere técnicas de protección coronaria22.
Protección coronaria con guía
Esta es la técnica de protección más simple en el contexto del TAVI con alto riesgo de OC y una de las primeras estrategias de protección informadas. La técnica consiste en la colocación de una guía de 0,014 pulgadas en 1 o ambas arterias a través de catéteres guía tras cruzar la válvula aórtica con la guía rígida. Dependiendo de las preferencias del operador, se avanza un balón de angioplastia con un diámetro de entre 2,5 y 3.5 mm a través de la guía para estar preparados ante una posible dilatación en caso de obstrucción súbita14,39,40. Si sobreviene una OC aguda, la guía se emplea para realizar una angioplastia ostial con un balón o implantar un stent para recuperar el flujo coronario.
El perfil de seguridad y la viabilidad de esta técnica han quedado demostrados en estudios ya publicados13,14. No obstante, se necesitan más evidencias de ensayos clínicos aleatorizados, lo cual quizá haga difícil extrapolar la efectividad de este abordaje. La ausencia de guías estandarizadas de cómo realizar la intervención quizá, contribuya, también a la variabilidad en su aplicación y resultados. A pesar de estos desafíos, lo que más preocupa sigue siendo el riesgo persistente de oclusión incluso después de haber retirado la guía, tal y como ha quedado demostrado en el registro de la Sociedad Española de Cardiología5.
Técnica del stent «en chimenea/snorkel»
La técnica del stent en chimenea es una estrategia basada en la colocación de una guía con un stent sin desplegar en una o ambas arterias coronarias. El stent se implanta si sobreviene una OC, de tal forma que sobresale por el exterior y parte superior del ostium coronario a modo de «chimenea» o snorkel. Chakravarty et al. fueron quienes dieron a conocer esta estrategia por primera vez para el tratamiento de una OC aguda anticipada del tronco común izquierdo (TCI) en un paciente con una PVB degenerada41. Son varios los informes de casos que han confirmado su perfil de seguridad y eficacia42,43.
El seguimiento clínico ha confirmado resultados aceptables a medio plazo (tiempo de seguimiento de 612 días, rango intercuartílico: entre 405 y 842 días) en un registro con un único caso de fracaso del stent y 1 posible caso de trombosis tardía del stent44. Se requieren resultados de seguimiento a más largo plazo que respondan a todas las cuestiones en torno a los resultados asociados al stent. Cabe esperar reaccesos coronarios difíciles a través del snorkel, lo cual plantea dudas sobre posibles complicaciones coronarias a futuro. Los posibles mecanismos del eventual fracaso del stent son un flujo turbulento persistente a través de la THV y el stent, la corrosión galvánica y los procesos inflamatorios locales10.
Detalles de la intervención
La técnica de la chimenea implica una serie de pasos críticos que pueden variar tímidamente de una sala de hemodinámica a otra y que se basan en la literatura médica y experiencia existentes en la actualidad. Al igual que ocurre con cualquier intervención compleja, se debe realizar por un equipo de intervencionistas experimentados. La figura 3 muestra un ejemplo de un caso real empleando la técnica del stent chimenea/snorkel para la protección de un paciente de alto riesgo de OC.
Figura 3. Pasos principales del TAVI «válvula dentro de otra válvula» (válvula Freedom [Sorin Biomedica, Italia]) empleando una técnica de chimenea bilateral para proteger ambas coronarias. A: previo al implante de la válvula, se colocaron stents farmacoactivos no desplegados tanto en la coronaria derecha (3,5 × 28 mm) como en el TCI (4 × 33 mm) en preparación para una posible intervención coronaria percutánea ante posibles obstrucciones coronarias agudas. B: luego se avanzó una válvula Portico (Abbott Vascular, Estados Unidos) y se inició el implante. C: durante la liberación de la válvula, se administraron inyecciones de contraste para valorar la permeabilidad de los ostium coronarios. Se observa el momento de la obstrucción del ostium del TCI (flecha blanca). D: ante el riesgo de obstrucción coronaria aguda, se implantó el stent del TCI (flecha roja). E: posteriormente, debido al alto riesgo, también se implantó el stent de la coronaria derecha (flecha azul). F: se optó por posdilatación con un balón de valvuloplastia (*) para mejorar la expansión de la prótesis valvular cardiaca percutánea. Para no comprimir los stents, los balones de los stents se inflaron al mismo tiempo que el balón aórtico. G: el seguimiento angiográfico final confirma la permeabilidad de los 2 ostium coronarios y la ausencia de insuficiencia aórtica. TCI: tronco común izquierdo.
Primer paso: valorar al paciente
-
– Una valoración preoperatoria integral resulta esencial. La intervención debe realizarse después de que el caso haya sido estudiado por un equipo multidisciplinario compuesto por cardiólogos intervencionistas y cirujanos cardiacos con suficiente experiencia.
Segundo paso: accesos vasculares
-
– Lograr acceso radial para abordajes secundarios (catéter pigtail). Cuando se protegen ambas coronarias, se pueden usar catéteres guía para administrar inyecciones de contraste y dirigir el implante de la THV y valorar la permeabilidad de los ostium coronarios.
-
– Acceder a la arteria femoral común para implantar la THV o un acceso alternativo si fuese necesario.
-
– Usar la arteria femoral contralateral para insertar un catéter guía para protección coronaria. Lo ideal es emplear un catéter de 7 Fr (Extra back-up [EBU] o Judkins izquierdo [JL] para el TCI y Judkins derecho [JR] para la CD).
-
– Lograr acceso venoso para el marcapasos si fuese necesario.
Tercer paso: preparar la protección coronaria y desplegar la THV
-
– Cruzar la válvula aórtica y colocar la guía TAVI en el ventrículo izquierdo (VI).
-
– Colocar la guía de 0,014 pulgadas en la arteria en riesgo.
-
– Avanzar los stents sobre las guías, asegurándonos de que sean lo bastante largos como para anclarse y sobresalir por encima de los velos de la THV. Puede emplearse un extensor de catéter guía para que el stent no interactúe con la THV.
-
– Realizar una valvuloplastia, caso de ser necesario, y evaluar el flujo coronario durante todo el proceso8,43.
-
– Avanzar la THV por la guía del VI y desplegarla, haciendo seguimiento del flujo coronario empleando inyecciones de contraste.
Cuarto paso: implantar el stent y realizar una evaluación posoperatoria
-
– Si el flujo coronario se hubiese visto afectado durante el implante de la THV, retirar los stents sin desplegar que sobresalen de la aorta y desplegarlos.
-
– Mantener un umbral bajo para el implante de los stents ante la dificultad de volver a cruzar la estructura de la THV.
-
– Posible dilatación del segmento proximal del stent con un balón para mejorar y anticiparse a un posible nuevo acceso a las coronarias.
-
– Posdilatar si es necesario empleando la técnica de kissing balloon para no comprimir el stent43.
-
– Realizar una valoración ecocardiográfica y angiográfica final para confirmar el éxito de los resultados antes de finalizar la intervención.
Tratamiento posoperatorio
El tratamiento antiagregante plaquetario óptima para estos pacientes no termina de estar claro. En líneas generales, se recomienda un curso de tratamiento antiagregante plaquetario doble (ácido acetilsalicílico más clopidogrel) de, como mínimo, 6 meses. No obstante, en personas mayores con comorbilidades, se debe tener en cuenta, además, el riesgo de sangrado. En pacientes a tratamiento anticoagulante, se puede usar un curso de terapia triple de 1 semana de duración, seguido de entre 3 y 6 meses de terapia doble (clopidogrel más anticoagulante) antes de continuar, solo, con el anticoagulante. Se necesitan, no obstante, más evidencias para determinar la mejor estrategia en estos casos.
La técnica BASILICA
La técnica BASILICA es otra estrategia sugerida para evitar la ocurrencia de OC. Esta estrategia se desarrolló como medida preventiva previa al implante de la THV, lacerando los velos para evitar su compresión contra los ostium coronarios, lo cual podría provocar oclusiones agudas24,45. La creación de un «triángulo de flujo» facilita el flujo sanguíneo hacia las coronarias46. BASILICA se diseñó como una alternativa a las técnicas basadas en stents con posibles limitaciones tales como una potencial compresión extrínseca, un riesgo de trombosis a largo plazo desconocido y accesos coronarios difíciles10.
Khan et al. informaron de los resultados a 30 días de 30 pacientes tratados con la técnica BASILICA, sin informar OC y con intervenciones exitosas en 28 pacientes. Los resultados de seguridad, incluidas las complicaciones cardiovasculares mayores, los accidentes cerebrovasculares, las lesiones renales y la muerte se informaron en el 70% de los pacientes, aunque no tuvieron nada que ver con la técnica BASILICA36. Recientemente, se demostró que esta intervención se puede realizar con un riesgo muy bajo de eventos cardiovasculares adversos mayores y una alta tasa de éxito en pacientes con válvulas aórticas nativas y protésicas47. La inestabilidad hemodinámica que sobreviene tras la laceración de la válvula fue rara y se resolvió tras implantar la THV. Las intervenciones fallidas se debieron, probablemente, a la calcificación grave de los velos, lo cual evitó su perforación antes de dividirse45. Los resultados a 1 año confirmaron la ausencia de más accidentes cerebrovasculares o infartos de miocardio y solo 2 muertes más48. Kitamura et al. informaron resultados aún mejores, sin complicaciones vasculares mayores, necesidad de soporte circulatorio mecánico, accidentes cerebrovasculares ni mortalidad a 30 días49. El empleo de la técnica BASILICA en THV fallidas es limitado por el diseño de algunos tipos de THV y el alineamiento comisural. Los modelos en estudio confirmaron que la división de los velos fue efectiva en las válvulas Sapien XT de generaciones anteriores, aunque menos en las válvulas Sapien 3 (Edwards Lifesciences, Estados Unidos) y EVOLUT (Medtronic, Estados Unidos) de última generación50. Además, aún en el caso de una laceración factible, las nuevas comisuras de la THV podrían alinearse de forma desfavorable y un posicionamiento demasiado alto del faldón de la nueva THV podría llegar a obstruir el velo lacerado.
Las contraindicaciones aún no se han definido claramente, pero la técnica podría resultar ineficaz ante SDV muy estrechos, ostium coronarios excéntricos o cúspides gravemente calcificadas. Además, se debería evitar en casos de endocarditis o trombosis valvular46. En lo que a la excentricidad se refiere, podría ser uno de los obstáculos más importantes que tener en cuenta para una protección efectiva de los ostium coronarios, sobre todo en pacientes tratados de TAVI en TAVI tal y como como sugirió Redondo et al. en una publicación anterior. En estos casos, si los ostium coronarios están en una posición excéntrica dentro de los SDV, la laceración probablemente no se alinee con los ostium, suprimiendo, así, su eficacia38.
Detalles de la intervención
La intervención se debe realizar bajo guiado ecocardiográfico transesofágico (ETE) para garantizar los mejores resultados posibles y facilitar el abordaje. La anestesia general es obligatoria. Algunos operadores prefieren emplear la ecocardiografía intracardiaca no haciéndose necesario, en estos casos, el uso de anestesia general. La figura 4 muestra un TAVI ViV con el uso de la técnica BASILICA para proteger el TCI por el alto riesgo de oclusión.
Figura 4. Pasos principales del TAVI «válvula dentro de otra válvula» con la técnica BASILICA. A: primero, se colocó un catéter guía JR (8 Fr) en el ventrículo izquierdo con un lazo y un pigtail en la aorta ascendente para una aortografía. Luego, se colocó un catéter diagnóstico JR de 5 Fr dentro de un catéter guía AL 3 de 8 Fr sobre el velo de la prótesis aórtica con un microcatéter Finecross 130 y una guía Astato XS 20 (Asahi Intecc, Estados Unidos) en su interior. B: tras identificar el punto óptimo de perforación del velo izquierdo mediante guiado eco y angiográfico, se colocó correctamente la guía, se electrificó y se perforó el velo (flecha roja). C: posteriormente, la guía quedó atrapada en el lazo colocado en el tracto de salida del ventrículo izquierdo y se tiró de ella hacia el interior del catéter guía JR (D, E) previo a externalizar la guía; se creó una «forma de V» en la zona central de la guía. Luego, se avanzó, y cuando la «forma de V» entró en contacto con el velo (E, flecha blanca), la guía volvió a electrificarse al tiempo que se tiró de ambos extremos lacerando el velo. F, G: se implantó una prótesis valvular cardiaca percutánea y autoexpandible confirmándose, finalmente, la permeabilidad coronaria (H). BASILICA, laceración intencionada del festón aórtico bioprotésico para evitar obstrucciones coronarias iatrogénicas; JR: Judkins derecho.
Primer paso: valoración del paciente
-
– Siempre se debe hacer una valoración de los pacientes tratados de TAVI. La planificación de la intervención deberá incluir una valoración con imágenes (las imágenes por TC aquí son clave).
Segundo paso: accesos vasculares
-
– Inicialmente, se necesitan, como mínimo, 3 accesos arteriales para esta técnica (figura 5)24.
-
– Se utiliza un introductor de 14 Fr (como mínimo) para el acceso principal. Se recomienda usar un introductor Dryseal (GORE, Estados Unidos) puesto que es capaz de acomodar 2 catéteres guía y mantener la hemostasia, a saber, 1 catéter guía (de entre 7 y 8 Fr) para perforar el velo y otro catéter pigtail para desplegarlo en el VI.
-
– Ante anatomías iliofemorales complejas, se recomienda utilizar un introductor femoral que se pueda desplegar para hacer avanzar la THV. De este modo, el cardiólogo intervencionista se asegura de que la THV avance sin problemas tras la laceración del velo.
-
– El segundo acceso se coloca en la arteria femoral común contralateral para insertar un catéter que se usa para colocar un lazo en el VI.
-
– El tercer acceso se inserta en la arteria radial para colocar un dispositivo de protección embólica cerebral (Sentinel [Boston Scientific, Estados Unidos]).
-
– En el caso de ser necesario, se debe obtener acceso venoso para implantar un marcapasos temporal.
Figura 5. Preparación del paciente con 3 accesos arteriales (radial derecho para el dispositivo de protección embólica cerebral y 2 femorales) y 1 acceso venoso para implantar el marcapasos temporal.
Tercer paso: perforación de los velos
-
– La válvula aórtica debe cruzarse y posteriormente, se debe colocar un catéter guía multipropósito de 6 Fr en el tracto de salida del ventrículo izquierdo (LVOT). Utilizando dicho catéter, se coloca un lazo en cuello de ganso del mismo tamaño que el LVOT (entre 20 y 30 mm) en el LVOT. Paralelo al lazo, empleando el mismo catéter multipropósito, se coloca una guía de 0,018 pulgadas en el VI hasta alcanzar al ápex; esta guía permite redirigir el lazo al VI si se tira de él. En lugar de un catéter multipropósito, se puede usar un catéter JR de 6 Fr dependiendo de lo angulada que sea la anatomía.
-
– Luego, se deben elegir diferentes catéteres, lo ideal es que sean de 7-8 Fr dependiendo de la cúspide a lacerar. Para el abordaje del velo izquierdo, la primera opción suele ser emplear un Amplatz izquierdo (AL) 3; no obstante, dependiendo de cómo sea la anatomía de la raíz aórtica, también se pueden usar catéteres AL1, AL2, AL4, EBU 3.5 y 4. Para el velo derecho, se suele usar un catéter multipropósito o un JR si la aorta es horizontal.
-
– Para perforar el velo izquierdo se hace necesario un catéter diagnóstico largo de 5 Fr en el interior de un catéter de 8 Fr (madre-hijo). La primera opción es un catéter mamario interno diagnóstico de 125 cm o un catéter JR 4.
-
– Con una serie de dispositivos telescopados, se coloca una guía de 300 cm (se sugiere la Astato XS 20 de 300 cm [Asahi Intecc, Estados Unidos]) y un microcatéter, ambos dentro de los catéteres mamario interno de 5 Fr y guía de 8 Fr.
-
– Los dispositivos telescopados se orientan, entonces, hacia la base de la cúspide diana, con la orientación correcta para evitar perforaciones no deseadas guiadas por fluoroscopia y ETE. El velo diana debe proyectarse en 2 ángulos fluoroscópicos, «vista frontal» y «lateral». Estas proyecciones, estimadas mediante evaluación por TC, ayudan a acceder a los velos con precisión. Las inyecciones de contraste también sirven para estimar la relación espacial de la válvula (figura 6).
-
– Una vez se logra la posición óptima del «telescopio» con un «ángulo de ataque» correcto, se intenta perforar el velo. Tras apuntalar el complejo catéteres-guía, se aproxima el microcatéter al velo y se electrifica la guía para realizar la perforación.
-
– Para electrificar la guía, se raspan entre 1 y 3 cm de su parte posterior con una hoja de bisturí hasta que la parte metálica queda expuesta; luego se conecta a un lápiz eléctrico con una pinza mosquito. El generador electroquirúrgico se ajusta al modo «corte puro» y la potencia se ajusta al velo; 30 vatios para velos porcinos, 50 para bovinos o nativos y 70 para velos gravemente calcificados. La electrificación ha de ser breve (< 1 segundo) y detenerse inmediatamente después de que la guía haya franqueado el velo46.
-
– Tras la perforación, la guía de 300 cm se coloca en el TSVI, intentando cruzarlo a través del lazo, que se debe situar en la parte alta del TSVI para no lesionar la válvula mitral. Tras capturarla, se tira de la guía de 300 cm hacia el interior de la guía con el lazo sin exteriorizarla.
-
– Se debe emplear guiado por ETE para que la guía no se enrede con el aparato mitral.
Figura 6. Orientación de los catéteres para la perforación del velo. A: vista lateral con dirección fuera de eje. B: vista lateral con dirección correcta. C: vista frontal con dirección fuera de eje. D: vista frontal con dirección correcta.
Cuarto paso: preparación de la THV
-
– Tras perforar el velo y antes de la laceración, se debe preparar la THV para que esté lista para un implante rápido una vez se haya modificado el velo ya perforar el velo puede llevar tiempo. La válvula no puede permanecer crimpada mucho tiempo porque puede aumentar el riesgo de dañar la THV.
-
– Tras perforar el velo, se debe volver a cruzar la válvula aórtica para colocar un catéter pigtail desde el acceso arterial principal e implantar rápidamente a la THV ante la presencia de inestabilidad hemodinámica tras la laceración del velo.
Quinto paso: laceración del velo
-
– Antes de externalizar la guía de 300 cm, se debe crear una «forma en V» en la región central de la misma acodando y recortando la guía con una hoja de bisturí de 10 mm, en la parte acodada (figura 7). Luego, se debe avanzar la guía hasta que la forma en V entre en contacto con el velo.
-
– La posición del microcatéter se fija con un dispositivo de torsión para identificar la «V voladora».
-
– Cuando la forma en V está en posición correcta, se tira de los 2 extremos de la guía, lo cual coincide con una nueva electrificación de esta con el lápiz conectado al mismo lugar empleando para la perforación. En este caso, la potencia a aplicar es mayor y depende del tipo de velo: 50 vatios para velos porcinos, 70 para bovinos o nativos y 100 para velos gravemente calcificados.
-
– La inyección de una solución de dextrosa en cada catéter guía se puede realizar simultáneamente con la laceración. No obstante, si no se usar dextrosa, los catéteres deben lavarse antes de la laceración para retirar todo el contenido sanguíneo.
-
– Para evitar la inestabilidad hemodinámica provocada por la laceración prolongada de un velo sin implante de una THV, ambos velos deben abordarse simultáneamente para proteger ambos 2 ostium coronarios, si fuese necesario. Esto requiere accesos vasculares adicionales tales como el uso de un introductor de 14 a 18 Fr en una arteria femoral para 1 velo y acceso doble con 2 vainas (de 6 a 8 Fr) en la otra arteria femoral o el uso de otro introductor grande (de 14 a 18 Fr) en la otra femoral, pero con un mayor riesgo de sangrado y vascular.
Figura 7. Astato XS 20 (Asahi Intecc, Estados Unidos) con forma de «V voladora» para laceración del velo.
Sexto paso: Implante de la THV y posdilatación
-
– La THV se debe implantar inmediatamente después de la laceración. Luego, se retiran los catéteres empleados en la laceración. El pigtail colocado en el VI se usa para avanzar la guía rígida e implantar la THV. La altura de implantación debe compensar el riesgo de gradientes altos con una posición baja y el riesgo de OC con un implante demasiado alto. Un implante demasiado alto puede hacer que el faldón cubra el «triángulo de flujo»46. Se deben seguir las recomendaciones para cada tipo de THV, intentando mantener el rango inferior de profundidad recomendado, por ejemplo, para un dispositivo EVOLUT Pro+ (Medtronic, Estados Unidos) este rango es de 3 mm de profundidad utilizando la proyección de solapamiento de cúspides. Esto es de una importancia capital en las THV supraanulares.
-
– Los operadores deben ser muy cautos a la hora de posdilatar y con la fractura del anillo de la PVB en las intervenciones realizadas con la técnica BASILICA porque se puede aumentar el riesgo de CO.
-
– Si el riesgo de OC es demasiado alto, los operadores pueden proteger las coronarias con guías y stents no desplegados a discreción24.
-
– Tras implantar la THV, se debe comprobar la permeabilidad de los ostium coronarios mediante una aortografía(preferible a una inyección selectiva). Además, una valoración mediante ETE ayudaría a comprobar los resultados hemodinámicos y la ausencia de otras posibles complicaciones.
-
– Al igual que ocurre durante la realización de otros TAVI, la intervención debe concluir con una hemostasia adecuada y con la comprobación de los accesos.
Dispositivos de corte
Aunque los resultados de la técnica BASILICA son prometedores, se trata de una intervención compleja que requiere un equipo altamente experimentado. El ShortCut (Pi-Cardia, Israel) se diseñó para simplificar la laceración y separar los velos51. Inicialmente pensados para las PVB, estos dispositivos constan de un mango, un sistema de liberación y una unidad distal y se introducen a través de un introductor de 16 Fr en la arteria femoral común. La ETE ayuda a guiar su posicionamiento actuando mecánicamente sobre el velo51.
Dvir et al. informaron de los hallazgos de la experiencia preclínica y primera en seres humanos con este dispositivo. Estos autores probaron el dispositivo en 8 pacientes con PVB fallidas. En todos los pacientes, el TAVI tuvo éxito y no sobrevino ninguna OC. Tampoco se informaron eventos neurológicos y los pacientes fueron dados de alta con un buen estado clínico51. Aunque los resultados iniciales son prometedores, sigue habiendo una brecha de evidencia. Los resultados de registros más grandes o incluso ensayos comparadores de este dispositivo con la técnica BASILICA podrían confirmar la utilidad de este dispositivo en el futuro.
Intervención UNICORN
La intervención UNICORN (minimización de la obstrucción coronaria iatrogénica con aguja de radiofrecuencia) es una nueva técnica para el manejo del riesgo de OC en pacientes tratados de TAVI en TAVI. La primera experiencia llevada a cabo en seres humanos con esta nueva estrategia fue reportada por Chan et al. Estos autores emplearon una guía dentro de un sistema telescópico compuesto por 1 catéter guía Amplatz izquierdo-1 de 7 Fr (Cordis, Estados Unidos) y 1 catéter de soporte Navicross de 135 cm (Terumo, Japón) para atravesar un velo protésico mediante un impulso de radiofrecuencia52. Tras perforar el velo, se realizaron sucesivas dilataciones de la fenestración con balones de mayor calibre. El último paso permitió avanzar una prótesis expandible con balón a través del velo perforado con posterior despliegue de la prótesis valvular cardiaca percutánea52.
El implante de la prótesis expandible con balón a través de la fenestración finaliza el proceso de laceración y captura del velo anterior, minimizando el riesgo de retroceso del velo y la posible obstrucción o embolización del ostium coronario52. La primera experiencia tuvo éxito y demostró la viabilidad de esta estrategia; no obstante, se necesitan más datos sobre los resultados a largo plazo.
CONCLUSIONES
Para optimizar los resultados en intervenciones TAVI, es esencial identificar a aquellos pacientes en riesgo de OC. La mejor forma de identificarlos es realizando una valoración estructurada que incluya mediciones específicas mediante TC de la altura de la cúspide y la coronaria, la DVC, el volumen de calcio coronario y otras características anatómicas y de riesgos asociados a la intervención. Sumada a intervenciones preventivas apropiadas tales como la técnica BASILICA, esta valoración integral del paciente ayuda a reducir el riesgo de OC. No obstante, se necesitan más estudios que nos ayuden a validar las diferentes estrategias y los dispositivos dedicados emergentes para prevenir esta complicación. A medida que las intervenciones TAVI se vayan popularizando, la identificación y manejo del riesgo de OC seguirán siendo esenciales para optimizar los resultados y mejorar la seguridad de los pacientes.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial.
CONFLICTO DE INTERESES
A. Regueiro es consultor de Abbott Vascular, Meril Life y OpSens. X. Freixa es consultor de Abbott Vascular fuera del trabajo presentado. M. Sabaté es consultor de Abbott Vascular e iVascular fuera del trabajo presentado. Los demás autores no declararon ningún conflicto de intereses.
AGRADECIMIENTOS
F. Spione ha recibido una beca de investigación dentro del programa de doctorado Cardiopath.
BIBLIOGRAFÍA
1. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease:Executive Summary:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e35-e71.
2. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
3. Ribeiro HB, Webb JG, Makkar RR, et al. Predictive factors, management, and clinical outcomes of coronary obstruction following transcatheter aortic valve implantation:insights from a large multicenter registry. J Am Coll Cardiol. 2013;62:1552-1562.
4. Khan JM, Kamioka N, Lisko JC, et al. Coronary Obstruction From TAVR in Native Aortic Stenosis:Development and Validation of Multivariate Prediction Model. JACC Cardiovasc Interv. 2023;16:415-425.
5. Ojeda S, González-Manzanares R, Jimenez-Quevedo P, et al. Coronary Obstruction after Transcatheter Aortic Valve Implantation. Insights from the Spanish TAVI Registry. JACC Cardiovasc Interv. 2023;16:1208-1217.
6. Holmes DR, Jr., Nishimura RA, Grover FL, et al. Annual Outcomes With Transcatheter Valve Therapy:From the STS/ACC TVT Registry. J Am Coll Cardiol. 2015;66:2813-2823.
7. Ribeiro HB, Rodés-Cabau J, Blanke P, et al. Incidence, predictors, and clinical outcomes of coronary obstruction following transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves:insights from the VIVID registry. Eur Heart J. 2018;39:687-695.
8. Akinseye OA, Jha SK, Ibebuogu UN. Clinical outcomes of coronary occlusion following transcatheter aortic valve replacement:A systematic review. Cardiovasc Revasc Med. 2018;19:229-236.
9. Jabbour RJ, Tanaka A, Finkelstein A, et al. Delayed Coronary Obstruction After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2018;71:1513-1524.
10. Lederman RJ, Babaliaros VC, Rogers T, et al. Preventing Coronary Obstruction During Transcatheter Aortic Valve Replacement:From Computed Tomography to BASILICA. JACC Cardiovasc Interv. 2019;12:1197-1216.
11. Arai T, Lefévre T, Hovasse T, et al. Incidence and predictors of coronary obstruction following transcatheter aortic valve implantation in the real world. Catheter Cardiovasc Interv. 2017;90:1192-1197.
12. Dvir D, Webb J, Brecker S, et al. Transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves:results from the global valve-in-valve registry. Circulation. 2012;126:2335-2344.
13. Abramowitz Y, Chakravarty T, Jilaihawi H, et al. Clinical impact of coronary protection during transcatheter aortic valve implantation:first reported series of patients. EuroIntervention. 2015;11:572-581.
14. Yamamoto M, Shimura T, Kano S, et al. Impact of preparatory coronary protection in patients at high anatomical risk of acute coronary obstruction during transcatheter aortic valve implantation. Int J Cardiol. 2016;217:58-63.
15. Blanke P, Soon J, Dvir D, et al. Computed tomography assessment for transcatheter aortic valve in valve implantation:The vancouver approach to predict anatomical risk for coronary obstruction and other considerations. J Cardiovasc Comput Tomogr. 2016;10:491-499.
16. Achenbach S, Delgado V, Hausleiter J, Schoenhagen P, Min JK, Leipsic JA. SCCT expert consensus document on computed tomography imaging before transcatheter aortic valve implantation (TAVI)/transcatheter aortic valve replacement (TAVR). J Cardiovasc Comput Tomogr. 2012;6:366-80.
17. Holmes DR, Jr., Mack MJ, Kaul S, et al. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement. J Am Coll Cardiol. 2012;59:1200-1254.
18. Ribeiro HB, Nombela-Franco L, Urena M, et al. Coronary obstruction following transcatheter aortic valve implantation:a systematic review. JACC Cardiovasc Interv. 2013;6:452-461.
19. Buellesfeld L, Stortecky S, Kalesan B, et al. Aortic root dimensions among patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2013;6:72-83.
20. Tzimas G, Akodad M, Meier D, et al. Predicted vs Observed Valve to Coronary Distance in Valve-in-Valve TAVR:A Computed Tomography Study. JACC Cardiovasc Interv. 2023;16:2021-2030.
21. Pilgrim T, Tomii D. Predicting Coronary Obstruction After TAVR:Better Safe Than Sorry. JACC Cardiovasc Interv. 2023;16:426-428.
22. Fetahovic T, Hayman S, Cox S, Cole C, Rafter T, Camuglia A. The Prophylactic Chimney Snorkel Technique for the Prevention of Acute Coronary Occlusion in High Risk for Coronary Obstruction Transcatheter Aortic Valve Replacement/Implantation Cases. Heart Lung Circ. 2019;28:e126-e130.
23. Vemulapalli S, Carroll JD, Mack MJ, et al. Procedural Volume and Outcomes for Transcatheter Aortic-Valve Replacement. N Engl J Med. 2019;380:2541-2550.
24. Khan JM, Dvir D, Greenbaum AB, et al. Transcatheter Laceration of Aortic Leaflets to Prevent Coronary Obstruction During Transcatheter Aortic Valve Replacement:Concept to First-in- Human. JACC Cardiovasc Interv. 2018;11:677-689.
25. Bapat V. Technical pitfalls and tips for the valve-in-valve procedure. Ann Cardiothorac Surg. 2017;6:541-552.
26. Barbanti M. Avoiding Coronary Occlusion and Root Rupture in TAVI - The Role of Pre- procedural Imaging and Prosthesis Selection. Interv Cardiol. 2015;10:94-97.
27. Dvir D, Leipsic J, Blanke P, et al. Coronary obstruction in transcatheter aortic valve-in- valve implantation:preprocedural evaluation, device selection, protection, and treatment. Circ Cardiovasc Interv. 2015;8:e002079.
28. Valvo R, Costa G, Barbanti M. How to Avoid Coronary Occlusion During TAVR Valve-in- Valve Procedures. Front Cardiovasc Med. 2019;6:168.
29. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
30. Landes U, Webb JG, De Backer O, et al. Repeat Transcatheter Aortic Valve Replacement for Transcatheter Prosthesis Dysfunction. J Am Coll Cardiol. 2020;75:1882-1893.
31. Gallo M, Fovino LN, Blitzer D, et al. Transcatheter aortic valve replacement for structural degeneration of previously implanted transcatheter valves (TAVR-in-TAVR):a systematic review. Eur J Cardiothorac Surg. 2022;61:967-976.
32. Barbanti M, Webb JG, Tamburino C, et al. Outcomes of Redo Transcatheter Aortic Valve Replacement for the Treatment of Postprocedural and Late Occurrence of Paravalvular Regurgitation and Transcatheter Valve Failure. Circ Cardiovasc Interv. 2016;9:e003930.
33. Tarantini G, Fabris T, Nai Fovino L. TAVR-in-TAVR and coronary access:importance of preprocedural planning. EuroIntervention. 2020;16:e129-e132.
34. Buzzatti N, Romano V, De Backer O, et al. Coronary Access After Repeated Transcatheter Aortic Valve Implantation:A Glimpse Into the Future. JACC Cardiovasc Imaging. 2020;13:508-515.
35. Percy ED, Harloff MT, Hirji S, et al. Nationally Representative Repeat Transcatheter Aortic Valve Replacement Outcomes:Report From the Centers for Medicare and Medicaid Services. JACC Cardiovasc Interv. 2021;14:1717-1726.
36. Komatsu I, Mackensen GB, Aldea GS, Reisman M, Dvir D. Bioprosthetic or native aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction. Part 1:how to evaluate patients for BASILICA. EuroIntervention. 2019;15:47-54.
37. Nai Fovino L, Scotti A, Massussi M, et al. Coronary Angiography After Transcatheter Aortic Valve Replacement (TAVR) to Evaluate the Risk of Coronary Access Impairment After TAVR-in-TAVR. J Am Heart Assoc. 2020;9:e016446.
38. Redondo A, Baladrón Zorita C, Tchétché D, et al. Commissural Versus Coronary Optimized Alignment During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2022;15:135-146.
39. Rodés-Cabau J, Webb JG, Cheung A, et al. Transcatheter aortic valve implantation for the treatment of severe symptomatic aortic stenosis in patients at very high or prohibitive surgical risk:acute and late outcomes of the multicenter Canadian experience. J Am Coll Cardiol. 2010;55:1080-1090.
40. Thomas M, Schymik G, Walther T, et al. Thirty-day results of the SAPIEN aortic Bioprosthesis European Outcome (SOURCE) Registry:A European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve. Circulation. 2010;122:62-69.
41. Chakravarty T, Jilaihawi H, Nakamura M, et al. Pre-emptive positioning of a coronary stent in the left anterior descending artery for left main protection:a prerequisite for transcatheter aortic valve-in-valve implantation for failing stentless bioprostheses?Catheter Cardiovasc Interv. 2013;82:E630-E636.
42. González LF, Mata RB, Roman KG-S, Villa JA. Emergent Chimney Stent to Treat Left Main Occlusion Following Valve-In-Valve Transfemoral Aortic Implantation Chimney Stent Following Valve-In-Valve TAVI. J Cardiovasc Thorac Surg.2018;3:1-2.
43. Spaziano M, Akodad M, Hovasse T, Lefévre T, Bouvier E, Chevalier B. Simultaneous TAVR and Left Main «Chimney»Stenting in a Patient With Low Left Main Height. JACC Cardiovasc Interv. Oct 23 2017;10:e185-e187.
44. Mercanti F, Rosseel L, Neylon A, et al. Chimney Stenting for Coronary Occlusion During TAVR:Insights From the Chimney Registry. JACC Cardiovasc Interv. 2020;13:751-761.
45. Khan JM, Greenbaum AB, Babaliaros VC, et al. The BASILICA Trial:Prospective Multicenter Investigation of Intentional Leaflet Laceration to Prevent TAVR Coronary Obstruction. JACC Cardiovasc Interv. 2019;12:1240-1252.
46. Komatsu I, Mackensen GB, Aldea GS, Reisman M, Dvir D. Bioprosthetic or native aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction. Part 2:how to perform BASILICA. EuroIntervention. 2019;15:55-66.
47. Cepas-Guillén P, Gabani R, Giménez-Milá M, Sanchis L, Freixa X, Regueiro A. Safety and efficacy of the BASILICA technique in patients at high risk of coronary obstruction undergoing TAVI. Rev Esp Cardiol. 2024;77:181-183.
48. Khan JM, Greenbaum AB, Babaliaros VC, et al. BASILICA Trial:One-Year Outcomes of Transcatheter Electrosurgical Leaflet Laceration to Prevent TAVR Coronary Obstruction. Circ Cardiovasc Interv. 2021;14:e010238.
49. Kitamura M, Majunke N, Holzhey D, et al. Systematic use of intentional leaflet laceration to prevent TAVI-induced coronary obstruction:feasibility and early clinical outcomes of the BASILICA technique. EuroIntervention. 2020;16:682-690.
50. Khan JM, Bruce CG, Babaliaros VC, Greenbaum AB, Rogers T, Lederman RJ. TAVR Roulette:Caution Regarding BASILICA Laceration for TAVR-in-TAVR. JACC Cardiovasc Interv. 2020;13:787-789.
51. Dvir D, Leon MB, Abdel-Wahab M, et al. First-in-Human Dedicated Leaflet Splitting Device for Prevention of Coronary Obstruction in Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2023;16:94-102.
52. Chan KE, Tai-Leung Chan D, Lam CS, et al. First-in-Human Undermining Iatrogenic Coronary Obstruction With Radiofrequency Needle (UNICORN) Procedure During Valve-in-Valve Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2022;15:928-931.
* Autor para correspondencia.
Correo electrónico: (A. Regueiro).
@anderregueiro; @victorArevalos; @freixa_xavier; @sbrugaletta; @lsanchisruiz; @fraspio; @hospitalclinic

RESUMEN
El estudio de la fisiología coronaria ha pasado de ser una técnica de investigación hace algunos años a convertirse en una herramienta necesaria para el abordaje óptimo de los pacientes con enfermedad coronaria epicárdica y para evaluar la microcirculación. La realización de estas técnicas requiere el uso de una guía de presión para la que hacen falta medios técnicos, tiempo y práctica en su ejecución, y es en parte por ello que su utilización es baja. Existe la necesidad de conocer la evidencia actualizada, las técnicas disponibles y la forma idónea de aplicarlas para ofrecer el mayor beneficio a los pacientes. Esta revisión ofrece un resumen práctico sobre el estado actual de los estudios de fisiología coronaria, con el fin de facilitar el mejor uso posible de esta herramienta diagnóstica esencial.
Palabras clave: Enfermedad coronaria. Fisiología coronaria. Angina microvascular.
ABSTRACT
The study of coronary physiology has evolved from a research topic to a necessary component for the optimal management of patients with coronary artery disease when assessing both epicardial and microvascular coronary segments. The performance of these techniques requires the use of pressure wires with additional supporting systems, time, and practice, which explains the overall low rate of usage. It is essential to know the updated evidence, the techniques available, and how to perform them properly to offer the greatest possible benefit to our patients. This review provides a practical overview on coronary physiology, and it is ultimately aimed at improving the quality of care.
Keywords: Coronary artery disease. Coronary physiology. Microvascular angina.
Abreviaturas CFR: reserva flujo coronario. iFR: índice instantáneo sin ondas. IMR: índice de resistencia microcirculatoria. Pd/Pa: cociente de presión coronaria distal/aórtica. QFR: cociente de flujo cuantitativo. RFF: reserva fraccional de flujo. RMh: resistencia microvascular hiperémica. SCA: síndrome coronario agudo.
INTRODUCCIÓN
Durante décadas, la angiografía ha sido el método de referencia para diagnosticar la enfermedad coronaria. Sin embargo, es una técnica que ignora la repercusión fisiológica de las estenosis coronarias epicárdicas. Por ello, desde finales del siglo xx se despertó un gran interés por caracterizar funcionalmente la circulación coronaria gracias al desarrollo de varias herramientas, tanto invasivas (guías intracoronarias específicas) como no invasivas (índices derivados de la angiografía). Tal es así que hemos asistido a un cambio de paradigma en el diagnóstico y el manejo de la enfermedad coronaria, que ha llevado a pasar de una estrategia basada en la angiografía a una estrategia basada en la isquemia1. Esto ha sido posible gracias a la abundante evidencia científica que avala el uso de índices fisiológicos y que ha hecho que la estrategia basada en la isquemia alcance el grado máximo de recomendación en las últimas guías europeas de revascularización miocárdica2. Sin embargo, la publicación reciente de algunos ensayos clínicos ha cuestionado el impacto de la fisiología coronaria en determinados escenarios, como la enfermedad multivaso y el síndrome coronario agudo (SCA) con elevación del segmento ST3,4. Por otro lado, estas técnicas requieren tiempo, instrumentación invasiva coronaria y, en ocasiones, la administración de fármacos vasodilatadores que no siempre son bien tolerados por los pacientes, además de cierta experiencia clínica. Por todo ello, la adopción de las técnicas de fisiología para guiar la revascularización continúa lejos de ser mayoritaria5.
En los siguientes párrafos se analizan, con un enfoque práctico, las valoraciones fisiológicas de las estenosis coronarias y de la microcirculación mediante índices invasivos e índices derivados de la angiografía. Los detalles de los conceptos fisiológicos subyacentes a cada índice serán obviados o se indicarán textos específicos para su consulta.
Valoración fisiológica de las estenosis coronarias
Índices invasivos
La reserva fraccional de flujo coronario (RFF) es el flujo sanguíneo miocárdico máximo en presencia de una estenosis respecto al flujo normal esperado en ausencia de estenosis; se expresa como una fracción de su valor normal esperado. Se obtiene midiendo la presión intracoronaria con guías específicamente desarrolladas para tal fin. Su determinación requiere la vasodilatación de la microcirculación mediante el uso de fármacos, principalmente adenosina —se ha descrito el uso de regadenosón intravenoso y nitroprusiato intracoronario con resultados equivalentes6, así como la medición del cociente de presión coronaria distal/aórtica (Pd/Pa) mínimo tras la inyección de contraste intracoronario (cRFF)7— y, por lo tanto, se trata de un índice fisiológico coronario hiperémico. Se basa en que en situación de hiperemia máxima se alcanza una relación lineal entre el flujo relativo y la presión intracoronaria relativa, ya que la resistencia coronaria es estable y mínima8. Su resultado es independiente de la microcirculación, la frecuencia cardiaca, la presión arterial y otras variables hemodinámicas. La guía europea para el abordaje del síndrome coronario crónico le otorga una indicación de tipo I y una evidencia de clase A para la estratificación del riesgo en pacientes sintomáticos que no responden de manera adecuada al tratamiento médico y en pacientes asintomáticos en quienes las pruebas no invasivas muestran alto riesgo de eventos, y de tipo IIa en aquellos en los que los resultados de las pruebas no invasivas son no concluyentes1.
En la tabla 1 se encuentra un resumen de los diferentes estudios FAME (Fractional Flow Reserve versus Angiography for Multivessel Evaluation)4,9-11. Los resultados refuerzan la necesidad de continuar investigando en el campo de la fisiología y de individualizar el tratamiento de los pacientes dentro de un equipo multidisciplinario.
Tabla 1. Resumen de los resultados de los estudios FAME
| Estudio | Año | n | Población | Comparación | Seguimiento | Objetivo primario | Muerte | Infarto de miocardio | Nueva revascularización | Otros resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| FAME9 | 2009 | SCC: 677 AI: 328 | Estenosis ≥ 50% en 2 o más vasos, consideradas para ICP | ICP con DES guiada por angiografía frente a guiada por RFF (≤ 0,80) | 1 año | Muerte, IAM, nueva revascularización: 13,2 frente a 18,3%; HR = 0,72; IC95%, 0,54-0,96 | 1,8 frente a 3,0%; HR = 0,58; IC95%, 0,26-1,32 | 5,7 frente a 8,7%; HR = 0,66; IC95%, 0,42-1,04 | 6,5 frente a 9,5%; HR = 0,68; IC95%, 0,45-1,05 | Sin diferencias en eventos por separado Sin diferencias en tasa de angina Menor uso de recursos con RFF |
| FAME II10 | 2012 | SCC: 888 | ≥ 1 estenosis en una arteria coronaria epicárdica con RFF ≤ 0,80 | ICP con stents de 2.a generación y TMO frente a TMO | 7 meses (media) | Muerte, IAM, revascularización urgente: 4,3 frente a 12,7%; HR = 0,32; IC95%, 0,19-0,53 | 0,2 frente a 0,7%; HR = 0,33; IC95%, 0,03-3,17 | 3,4 frente a 3,2%; HR = 1,05; IC95%, 0,51-2,19 | Urgente: 1,6 frente a 11,1%; HR = 0,13; IC95%, 0,06-0,30 No urgente: 1,6 frente a 8,6%; HR = 0,17; IC95%, 0,08-0,39 | Sin diferencias significativas en combinado de muerte y IAM, ni en muerte de origen cardiaco |
| FAME II - 5 años11 | 2018 | SCC: 888 | ≥ 1 estenosis en una arteria coronaria epicárdica con RFF ≤ 0,80 | ICP con stents de 2.ª generación y TMO frente a TMO | 5 años | Muerte, IAM, revascularización urgente: 13,9 frente a 27,0%; HR = 0,46; IC95%, 0,34-0,63 | 5,1 frente a 5,2%; HR = 0,98; IC95%, 0,55-1,75 | 8,1 frente a 12,0%; HR = 0,66; IC95%, 0,43-1,00 | Urgente: 6,3 frente a 21,1%; HR = 0,25; IC95%, 0,18-0,41 No urgente: 7,6 frente a 35,1%; HR = 0,18; IC95%, 0,12-0,26 | Sin diferencias significativas en muerte y IAM El porcentaje de pacientes con angina es menor durante los 3 primeros años; la diferencia no es significativa a los 5 años |
| FAME III4 | 2022 | SCC: 1500 | Enfermedad de 3 vasos | Diseño de no inferioridad: ICP guiada por RFF (≤ 0,80) frente a cirugía de revascularización coronaria | 1 año | Muerte, IAM, ictus, nueva revascularización: 10,6 frente a 6,9%; HR = 1,5; IC95%, 1,1-2,2; p = 0,35 para no inferioridad | 1,6 frente a 0,9%; HR = 1,7; IC95%, 0,7-4,3 | 5,2 frente a 3,5%; HR = 1,5; IC95%, 0,9-2,5 | 5,9 frente a 3,9%; HR = 1,5; IC95%, 0,9-2,3 | Sin diferencias significativas en combinado de muerte, infarto e ictus Menos sangrado mayor, daño renal, FA y rehospitalización a 30 días con ICP |
|
AI: angina inestable; DES: stent liberador de fármacos; FA: fibrilación auricular; FAME: Fractional Flow Reserve Versus Angiography for Multivessel Evaluation; RFF: reserva fraccional de flujo; HR: hazard ratio; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; SCC: síndrome coronario crónico; TMO: tratamiento médico óptimo. |
||||||||||
La hiperemia, especialmente la obtenida con adenosina intravenosa, necesaria para la obtención de la RFF, requiere tiempo, es costosa, altera la hemodinámica sistémica y puede provocar efectos secundarios desagradables (trastornos de la conducción, malestar torácico, náuseas, disnea, mareos, sofocos y cefalea). Por ello, desde su introducción, los índices de reposo, que no requieren fármacos hiperémicos, rápidamente ganaron popularidad. En general, estos índices son fásicos, a diferencia de la RFF (que se basa en presiones medias), y se miden en la parte media o tardía del periodo diastólico, cuando de manera natural hay mayor flujo transestenótico6. Aunque la primera descripción de un índice de reposo la realizaron Grüntzig et al.12 en su publicación inicial de la angioplastia coronaria, su uso clínico no se extendió hasta la aparición del índice instantáneo sin ondas (iFR, Philips, Países Bajos). Se llevaron a cabo varios estudios para comparar la concordancia diagnóstica del iFR y la RFF, así como para comparar el iFR, la RFF y otros parámetros de referencia de isquemia13,14. Dos ensayos clínicos multicéntricos aleatorizados, el DEFINE-FLAIR (Functional Lesion Assessment of Intermediate Stenosis to Guide Revascularization) y el iFR-SWEDEHEART (Evaluation of iFR vs RFF in Stable Angina or Acute Coronary Syndrome) aleatorizaron a 4.529 pacientes para ser tratados mediante revascularización percutánea guiada por RFF o por iFR, tanto con SCA como con síndrome coronario crónico15,16. Ambos estudios demostraron la no inferioridad del iFR respecto a la RFF, con bajas tasas de eventos, definidos como muerte por todas las causas, infarto agudo de miocardio o revascularización no planeada a 1 año: iFR 4,12% frente a RFF 4,05% (hazard ratio [HR] = 1,13; intervalo de confianza del 95% (IC95%), 0,72-1,79; p = 0,60). Además, en los grupos de iFR, el número de estenosis funcionalmente significativas y las tasas de revascularización fueron inferiores, la duración de la intervención fue menor y hubo un porcentaje más bajo de pacientes que sufrieron síntomas adversos asociados a la administración de adenosina15,16. En los últimos años se han desarrollado diferentes índices de reposo, fundamentados en el concepto descrito previamente: DFR (Diastolic Hyperaemia-Free Ratio, Boston Scientific, Estados Unidos)17 y cociente de presiones diastólicas en reposo (dPR) (ACIST, Estados Unidos)18,19. Con la excepción del ciclo cardiaco completo en reposo (RFR) (Abbott, Estados Unidos)18, que es un índice no hiperémico que valora la presión a lo largo de todo el ciclo cardiaco (tabla 2), todos los índices de reposo tienen una alta reproducibilidad y son idénticos al iFR, tanto numéricamente como en su concordancia con la RFF19. La capacidad pronóstica de la relación Pd/Pa es menos robusta que la RFF21, pues su correlación con la RFF en lesiones no culpables de pacientes que han tenido un SCA es del 80%22; con la aparición de los índices no hiperémicos, su interés clínico es escaso.
Tabla 2. Índices para el estudio de estenosis coronarias epicárdicas
| Vasodilatación | Periodo del ciclo | Punto de corte | Evidencia científica | |
|---|---|---|---|---|
| RFF | Hiperémico | – | ≤ 0,80 | ER: FAME, FAME II, FAME III, DEFER, DANAMI-3-PRIMULTI, COMPARE ACUTE, FLOWER-MI, FUTURE |
| iFR | No hiperémico | Diastólico | ≤ 0,89 | ER: DEFINE-FLAIR, iFR-SWEDEHEART Observacional: SYNTAX II |
| DFR | No hiperémico | Diastólico | ≤ 0,89 | Observacional: Johnson et al.14 |
| dPR | No hiperémico | Diastólico | ≤ 0,89 | Observacional: Lee et al.15, Van’t Veer et al.16 |
| RFR | No hiperémico | Todo el ciclo | ≤ 0,89 | Observacional: Lee et al.15 |
| Pd/Pa | No hiperémico | Todo el ciclo | 0,91-0,93 | Observacional: Kobayashi et al.20, Lee et al.15 |
|
DFR: diastolic hyperaemia-free ratio; dPR: cociente de presiones diastólicas en reposo; ER: estudios aleatorizados; RFF: reserva fraccional de flujo; iFR: índice instantáneo sin ondas; Pd/Pa: cociente de presión coronaria distal/aórtica; RFR: ciclo cardiaco completo en reposo. |
||||
En el material adicional se ofrece una descripción detallada del manejo práctico de los índices fisiológicos invasivos.
Procedimiento
En la figura 1 se muestran los pasos para medir los índices de reposo y de RFF, y en el material adicional hay una descripción detallada paso a paso. La figura 2 ilustra la utilidad de la guía de presión para el diagnóstico y la localización de estenosis significativas.
Figura 1. Pasos para la realización de guía de presión intracoronaria para medir los índices de reposo y la reserva fraccional de flujo. Ao: aorta; RFF: reserva fraccional de flujo; IC: intracoronaria; IV: intravenosa. * Catéter purgado con solución salina y sin introductor de guía.
Problemas, causas, soluciones y escenarios específicos
En la tabla 3 se exponen algunos de los principales problemas que pueden encontrarse al hacer un estudio con guía de presión, sus causas y sus soluciones. En el material adicional se encuentra una explicación detallada para hacer frente a tales problemas, así como una descripción del uso de la guía de presión en diferentes escenarios clínicos (enfermedad coronaria difusa, lesiones ostiales, estenosis aórtica, SCA, valoración tras angioplastia).
Tabla 3. Guía de presión: principales problemas, causas y soluciones
| Problema | Causas | Recomendaciones |
|---|---|---|
| Amortiguación de la presión aórtica | Desproporción catéter/vaso Lesión ostial | Utilizar catéter guía de menor diámetro Desenganchar el ostium para realizar mediciones |
| Presión aórtica falsamente disminuida | Conexiones al catéter guía sueltas No retirar introductor de guía Presencia de contraste en el catéter | Asegurar bien todas las conexiones antes de medir Siempre retirar introductor de guía Purgar catéter guía con solución salina |
| Pérdida de la ecualización (drift) | Necesidad de múltiples conexiones/desconexiones Procedimiento prolongado | Repetir ecualización y medición Ecualizar antes de realizar mediciones tras la ICP Utilizar guías con fibra óptica cuando se prevea un procedimiento prolongado |
| Espasmo, pseudoestenosis | Presencia y manipulación de guía intracoronaria Excesiva tortuosidad | Siempre administrar nitratos IC previo al procedimiento Dosis adicional de nitratos IC si se sospecha pseudoestenosis Considerar métodos alternativos en caso de excesiva tortuosidad |
| Escasa respuesta a adenosina | Consumo de cafeína, teobromina (chocolate), teofilina Inadecuada administración intracoronaria | Advertir a los pacientes de que no consuman café, chocolate ni teofilina 24 h antes del procedimiento Administrar adenosina IC o infusión IV a 210 μg/kg/min Asegurar adecuado sondaje para administrar adenosina IC No utilizar adenosina IC con catéter con agujeros laterales |
| Excesiva variabilidad de las mediciones | Movimientos del paciente Arritmias (FA) | Asegurar que el paciente esté confortable Repetir la medición en caso de tos o movimientos bruscos Seleccionar los puntos de medición manualmente en la consola |
|
FA: fibrilación auricular; IC: intracoronario/a; ICP: intervención coronaria percutánea; IV: intravenosa. |
||
Índices derivados de la angiografía
El estudio fisiológico de las estenosis epicárdicas se encuentra limitado en la práctica clínica habitual por la necesidad del uso de una guía de presión y, en algunos casos, de agentes hiperémicos, que conllevan un aumento del coste del procedimiento y la posibilidad de que aparezcan efectos secundarios23. Por ello, se han generado nuevos índices derivados de la angiografía, tales como el cociente de flujo cuantitativo (QFR), la RFFAngio, el CAAS-vRFF y el vRFF. Estos índices se basan en la reconstrucción tridimensional del árbol coronario a través de la angiografía, usando posteriormente una dinámica computacional de fluidos o simplificaciones matemáticas de esta como subrogado del flujo coronario.
El QFR (Qangio XA 3D, Medis Medical Imaging Systems, Países Bajos) emplea una reconstrucción 3D de la angiografía, y luego, asumiendo una presión y una velocidad de flujo constantes a lo largo de un vaso epicárdico normal, se computa un proxy del valor de RFF a través de distintos modelos: el modelo fijo (fQFR) usa información de una base de datos en la que previamente se han obtenido valores de RFF y velocidades de flujo; el modelo de QFR-contraste (cQFR) tiene en cuenta la velocidad a la que fluye el contraste administrado en la arteria epicárdica mediante recuento de frames; y el modelo QFR-adenosina (aQFR) lo valora tras la inducción de hiperemia mediante la administración de adenosina. Los tres modelos han sido evaluados frente a la RFF y se ha obtenido una mejor precisión diagnóstica con aQFR (87%) y cQFR (86%)24. Varios estudios posteriores han demostrado la utilidad y la alta precisión de este método para el diagnóstico funcional de una estenosis epicárdica25,26, así como la seguridad que confiere la decisión de revascularización o no basada en este27,28. El estudio FAVOR III China, que incluyó 3.825 pacientes, encontró una disminución de los eventos mayores (HR = 0,65; IC95%, 0,51-0,83; p = 0,0004) en los pacientes a quienes se difirió la revascularización basándose en un QFR ≤ 0,80, impulsado por menos infartos de miocardio y menos revascularizaciones guiadas por isquemia, en comparación con la revascularización guiada por angiografía28.
Otro índice es el CAAS-vRFF (Cardiovascular Angiographic Analysis System for vessel RFF, CAAS-vRFF, Pie Medical, Países Bajos), que se basa en el uso de una reconstrucción 3D de la angiografía adquirida y la posterior computación del gradiente de presión a través de una lesión. Su estudio de validación incluyó pacientes con enfermedad estable y SCA sin elevación del segmento ST, y mostró una precisión del 93% para el diagnóstico de lesiones con RFF ≤ 0,80, así como una correlación interobservador del 95%29.
También es de amplio uso el índice RFFAngio (Cathworks, Israel), que utiliza, a diferencia de los previos, al menos tres proyecciones angiográficas para realizar un mapeado funcional 3D. Fearon et al.30 lo evaluaron en una amplia población y encontraron una sensibilidad del 94%, una especificidad del 91% y una precisión diagnóstica del 92% para valores de RFF ≤ 0,80, con alta consistencia interobservador (96%).
Existen además otros índices, como el vRFF (virtual Fractional Flow Reserve, VirtuHeart Medical Physics Group, Reino Unido), que en su estudio de validación llegó a demostrar una alta precisión diagnóstica y unas elevadas sensibilidad y especificidad (97%, 86% y 100%, respectivamente)31, si bien aún se encuentra en fase de experimentación.
Recientemente, un metanálisis realizado por Collet et al.32 ha mostrado que las mediciones de RFF derivadas de la angiografía presentan una sensibilidad global del 89% y una especificidad del 90% respecto a la determinación invasiva de la RFF. No obstante, es posible que exista una zona gris relativamente amplia (0,75-0,86) en la que la determinación invasiva de la RFF podría estar indicada33. Asumiendo esta zona gris, la precisión diagnóstica de estos métodos podría llegar a ser > 95% —como se demostró en el estudio FAVOR II China25—, evitando la necesidad de un estudio invasivo en el 64% de las lesiones34.
A pesar de sus resultados prometedores, estos análisis presentan ciertas limitaciones. Una de las principales es obtener angiografías adecuadas para analizar sin desplazamientos (panning) ni superposición de estructuras35. Otra es la anatomía, ya que lesiones ostiales o en bifurcación presentan mayor dificultad para delinear su contorno y, por tanto, su estudio podría verse sesgado. En un análisis reciente sobre la población del estudio SYNTAX II, la evaluación por QFR frente a la estrategia híbrida iFR/RFF mostró una precisión diagnóstica del QFR cercana al 74%, con un 8,3% de falsos positivos y un 17,9% de falsos negativos, siendo el principal motivo de esta discordancia las lesiones en ramas marginales, vasos pequeños o zonas de bifurcación35. Además, de especial interés resulta el estado de la microcirculación, ya que estas técnicas asumen una máxima vasodilatación para computar la presión desde el flujo obtenido. No obstante, el grado de respuesta a la hiperemia —ya sea por contraste o por agentes hiperémicos farmacológicos— es variable en función del estado de la microcirculación de cada paciente, pudiendo incurrir en error. Mejía-Rentería et al.36 estudiaron la influencia que el estado de la microcirculación ejerce sobre este tipo de evaluaciones no invasivas de la reserva de flujo coronario (CFR), y observaron que la mayor fuente de discordancia venía dada por una alteración en la función microvascular, medida como un valor alterado del índice de resistencia microcirculatoria (IMR) o situación de infarto agudo de miocardio. Se podría pensar que el tiempo de procesado de la imagen y su análisis puede ser mayor que el de la realización de un estudio fisiológico con guía de presión. No obstante, con el debido entrenamiento, se ha demostrado que el estudio se puede hacer con mayor rapidez incluso que la determinación clásica de la RFF37,38. Por último, una limitación pendiente de resolver es la variabilidad (concordancia de 0,01 ± 0,08 para medidas repetidas), que depende del observador, la calidad de la angiografía y el grado de estenosis valorado por RFF39.
En el material adicional se ofrece una descripción detallada sobre el manejo práctico del QFR, la RFFAngio y el vRFF.
Valoración fisiológica de la microcirculación coronaria
Índices invasivos
Aunque la enfermedad coronaria comúnmente se relaciona con la afectación de las arterias epicárdicas, hasta un 25% de los pacientes que sufren angina típica no presentan estenosis epicárdicas significativas1. La disfunción microvascular es un factor contribuyente de la angina y el tratamiento individualizado ha demostrado mejorar la calidad de vida de los pacientes40, por lo que un adecuado diagnóstico intracoronario de la enfermedad microvascular en pacientes sintomáticos, sin estenosis o con estenosis coronarias moderadas, tiene una recomendación IIa en las guías europeas de síndrome coronario crónico1.
Las arteriolas, principal componente de la resistencia vascular coronaria, tienen un papel muy dinámico en el flujo sanguíneo coronario, reguladas por múltiples mecanismos metabólicos, miogénicos, endoteliales, neurales y hormonales41,42. Las alteraciones de la microcirculación pueden ocurrir por cualquiera de estas vías y ofrecer un pronóstico desfavorable, similar al de la enfermedad epicárdica obstructiva43. El tamaño de estos vasos hace imposible su valoración angiográfica, siendo indispensable el uso de otros métodos. La CFR mide la relación de flujo coronario en hiperemia respecto al flujo en reposo, con valores normales entre 3 y 4, que indican que el flujo coronario se incrementa de 3 a 4 veces con la hiperemia máxima. Los resultados de la CFR representan la capacidad de incrementar el flujo tanto de las arterias epicárdicas como de la microvasculatura. Una CFR reducida se asocia con un aumento significativo de la mortalidad (HR = 3,78; IC95%, 2,39-5,97) y de eventos cardiovasculares mayores (HR = 3,42; IC95%, 2,92-3,99) en diversas condiciones, incluyendo pacientes con SCA, disfunción microvascular, trasplante cardiaco y diabetes mellitus44.
La resistencia microcirculatoria se puede medir por termodilución o por Doppler intravascular, en condiciones basales o en hiperemia45. El IMR, índice de referencia para el estudio de la microcirculación, se basa en la medición de la presión distal y del flujo coronario por termodilución, valorado por la inversa del tiempo de llegada (tránsito) de solución salina a temperatura ambiente al segmento distal de la arteria durante la hiperemia máxima. Un IMR elevado, por encima de 25, se ha asociado a peor pronóstico cardiovascular; la combinación de un CFR bajo y un IMR alto tiene peor pronóstico46,47. Recientemente se ha descrito un nuevo método basado en termodilución y un flujo continuo de solución salina (catéter RayFlow, Hexacath, Francia), que permite calcular el flujo coronario absoluto en condiciones hiperémicas y la resistencia microcirculatoria absoluta48,49, con la ventaja de que no depende de los valores basales, lo que hace que la influencia de los cambios hemodinámicos sea menor, y además es independiente del operador. Su utilidad clínica todavía tiene que demostrarse, dada la limitación en la interpretación de valores absolutos.
Con la guía Doppler se puede calcular el CFR dividiendo la velocidad de flujo en hiperemia entre la velocidad de flujo basal, y se considera un punto de corte ≤ 2,5 como diagnóstico de disfunción microvascular en arterias epicárdicas sanas50. El valor pronóstico de la CFR medida de forma invasiva por Doppler en pacientes con angina es independiente de los hallazgos de pruebas no invasivas, con una HR de 2,97 (IC95%, 1,39-6,34) a 5 años para eventos cardiovasculares mayores51. También se calcula la resistencia microcirculatoria hiperémica (RMh) dividiendo la presión intracoronaria entre la velocidad de flujo hiperémica, considerando que una RMh > 1,9 mmHg·cm−1·s−1 es diagnóstica de disfunción microcirculatoria50, aunque existen reportes de que una RMh ≥ 2,5 mmHg·cm−1·s−1 tiene mejores sensibilidad y especificidad para el diagnóstico de disfunción microvascular52.
Abordaje práctico
Termodilución
En el material adicional se ofrece una descripción detallada del manejo práctico de la termodilución, tanto mediante bolos (figura 3) como en infusión continua (figura 4), y del estudio fisiológico mediante guía Doppler (figura 5).
Figura 2. A: angiografía de arteria coronaria derecha que muestra afectación difusa, con lesiones más graves a nivel distal (asteriscos). B: grabación del cociente de reposo de ciclo completo (RFR) en retirada que muestra 2 saltos focales correspondientes a los asteriscos marcados en A. C: resultado angiográfico final tras la implantación de 2 stents farmacoactivos. D: RFR final con resultado óptimo de 0,98.
Figura 3. Pasos para el estudio de la microcirculación por termodilución por bolos. Ao: aorta; CFR: reserva de flujo coronario; RFF: reserva fraccional de flujo; IC: intracoronaria; IV: intravenosa; IMR: índice de resistencia microcirculatoria. * Catéter purgado con solución salina y sin introductor de guía.
Figura 4. Pasos para el estudio de la microcirculación por termodilución continua. Ao: aorta; IC: intracoronaria; IV: intravenosa. a Catéter purgado con solución salina y sin introductor de guía. b No apagar el transmisor durante todo el procedimiento.
Figura 5. Pasos para el estudio de la microcirculación con guía Doppler. Ao: aorta; CFR: reserva de flujo coronario; RMh: resistencia microcirculatoria hiperémica; IC: intracoronaria; IV: intravenosa; Pd: presión coronaria distal. * Catéter purgado con solución salina y sin introductor de guía.
Índices derivados de la angiografía
Si bien la evaluación del estado de la microcirculación mediante el uso del IMR ha demostrado ampliamente su beneficio clínico50,53, su estudio en la práctica clínica habitual es limitado debido a la necesidad del uso de una guía de presión y de agentes hiperémicos. Por ello, recientemente se han desarrollado alternativas para la estimación del IMR a partir de la angiografía (IMRAngio) mediante la aplicación de dinámica computacional de fluidos, para lo que existen varias fórmulas.
La primera descripción la realizaron De Maria et al.54, quienes observaron una buena capacidad diagnóstica (92,4%) del IMRAngio frente al IMR invasivo usando otra fórmula derivada del aQFR en pacientes con infarto de miocardio, así como una alta correlación entre un valor alto de IMRAngio y la presencia de obstrucción microvascular detectada por resonancia magnética.
El IMRangio se ha estudiado tanto en pacientes estables como en aquellos que presentaban un SCA55, obteniendo una buena correlación entre IMR e IMRAngio y una alta precisión diagnóstica del último si se usaba adenosina, tanto en pacientes con SCA como en pacientes estables. No obstante, sí se observó que la relación entre IMR e IMRAngio derivado de cQFR (NH-IMRAngio) no se mantenía en arterias no culpables del evento agudo ni en casos de mayor estabilidad clínica, y tan solo mostraba una buena relación en las arterias culpables del infarto. Los autores consideraron como posible explicación para este fenómeno la mayor alteración en la capacidad vasodilatadora que presentan los pacientes con infarto agudo de miocardio con elevación del segmento ST, y propusieron un algoritmo híbrido, por el cual solo sería necesario el uso de adenosina en aquellos casos en que la determinación de NH-IMRAngio fuera > 30 U y < 90 U, lo que evitaría la necesidad de usar adenosina en el 38% de los casos. Además, en casos de infarto agudo de miocardio con elevación del segmento ST —en los que quizás el uso de hiperemia podría estar más restringido debido a la situación clínica—, este grupo mostró que un valor de NH-IMRAngio > 43 podría detectar con alta precisión un valor de IMR > 40 y ser predictor de eventos a largo plazo56 sin necesidad de utilizar adenosina.
Tebaldi et al.57 usan una fórmula a partir del valor de cQFR (NH-IMRAngio) para evaluar el estado de la microcirculación en pacientes con angina estable, y hallaron una alta correlación entre IMRAngio > 44,2 e IMR invasivo > 25.
Paralelamente, otro grupo también usó una fórmula que empleaba el valor de cQFR58 para evaluar la función microvascular en pacientes con síndrome coronario crónico y agudo, que confirmó una buena precisión diagnóstica global y apuntó, además, el valor añadido que podría tener su determinación para disminuir los valores falsamente positivos del QFR, ya que una función microvascular alterada podría influir en la precisión del análisis del QFR36. Un metanálisis de datos agrupados ha demostrado un buen rendimiento diagnóstico de la IMRAngio en comparación con el IMR invasivo, con una sensibilidad del 82%, una especificidad del 83%, una precisión del 83%, un valor predictivo positivo del 76% y un valor predictivo negativo del 85%59.
FlashAngio (Rainmed, China) es otro software para la derivación del IMR no invasivo60,61, que ofrece resultados diagnósticos similares. Además, más allá de su valor diagnóstico, Choi et al.61 demostraron el valor pronóstico de dicho índice, ya que un valor elevado de IMRAngio (< 40 U) se encontró asociado a muerte de causa cardiaca y rehospitalización por problemas cardiovasculares a largo plazo.
En el material adicional se encuentra una descripción detallada del manejo práctico del IMRAngio.
CONCLUSIONES
El estudio de la fisiología coronaria significa un gran avance en el tratamiento de los pacientes con enfermedad coronaria. Poder definir la gravedad funcional de las lesiones epicárdicas y la influencia de la microcirculación en la sintomatología de los pacientes permite personalizar el tratamiento, orientado a reducir los síntomas y, en muchos casos, con un mejor pronóstico. Se han hecho grandes avances en este campo, logrando conocer más a fondo la fisiología y obtener más precisión en el diagnóstico, con pruebas tanto invasivas como no invasivas. El conocimiento, aunque extenso, presenta brechas que se seguirán resolviendo con nuevos estudios. Todo este desarrollo requiere una formación específica y actualizada, que nos permita aprovechar el conocimiento y la tecnología en beneficio de nuestros pacientes.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
J.P. Vilchez-Tschischke, J. Sanz Sánchez y E. Fernández Peregrina contribuyeron a la idea, el diseño, la redacción y la revisión del artículo. J.L. Díez Gil, M. Echevarría Pinto y H.M. Garcia-Garcia contribuyeron tanto a la redacción del artículo como a la revisión crítica de su contenido intelectual.
CONFLICTO DE INTERESES
J. Sanz Sánchez declara haber recibido honorarios por su labor como conferenciante para Cordis y Terumo. H.M. Garcia-Garcia declara haber recibido honorarios por su labor como conferenciante para Biotronik, Abbot, Boston Scientific, Neovasc, Medtronic, Shockwave, Philips y Corflow. Los demás autores no presentan conflictos de intereses.
BIBLIOGRAFÍA
1. Neumann FJ, Sechtem U, Banning AP, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
2. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. EuroIntervention. 2019;14:1435-1534.
3. Puymirat E, Cayla G, Simon T, et al. Multivessel PCI Guided by FFR or Angiography for Myocardial Infarction. N Engl J Med. 2021;385:297-308.
4. Fearon WF, Zimmermann FM, de Bruyne B, et al. Fractional Flow Reserve-Guided PCI as Compared with Coronary Bypass Surgery. N Engl J Med. 2022;386:128-137.
5. Dattilo PB, Prasad A, Honeycutt E, Wang TY, Messenger JC. Contemporary patterns of fractional flow reserve and intravascular ultrasound use among patients undergoing percutaneous coronary intervention in the United States: insights from the National Cardiovascular Data Registry. J Am Coll Cardiol. 2012;60:2337-2339.
6. Lee JZ, Singh N, Nyotowidjojo I, et al. Comparison of regadenoson and nitroprusside to adenosine for measurement of fractional flow reserve: A systematic review and meta-analysis. Cardiovasc Revasc Med. 2018;19:168-174.
7. Leone AM, Campo G, Gallo F, et al. Adenosine-Free Indexes vs. Fractional Flow Reserve for Functional Assessment of Coronary Stenoses: Systematic Review and Meta-Analysis. Int J Cardiol. 2020;299:93-99.
8. Warisawa T, Cook CM, Akashi YJ, Davies JE. Past, Present and Future of Coronary Physiology. Rev Esp Cardiol. 2018;71:656-667.
9. Tonino PAL, de Bruyne B, Pijls NHJ, et al. Fractional Flow Reserve versus Angiography for Guiding Percutaneous Coronary Intervention. N Engl J Med. 2009;360:213-224.
10. de Bruyne B, Pijls NHJ, Kalesan B, et al. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease. N Engl J Med. 2012;367:991-1001.
11. Xaplanteris P, Fournier S, Pijls NHJ, et al. Five-Year Outcomes with PCI Guided by Fractional Flow Reserve. N Engl J Med. 2018;379:250-259.
12. Grüntzig AR, Senning Å, Siegenthaler WE. Nonoperative Dilatation of Coronary-Artery Stenosis. N Engl J Med. 1979;301:61-68.
13. Sen S, Asrress KN, Nijjer S, et al. Diagnostic classification of the instantaneous wave-free ratio is equivalent to fractional flow reserve and is not improved with adenosine administration. Results of CLARIFY (Classification Accuracy of Pressure-Only Ratios Against Indices Using Flow Study). J Am Coll Cardiol. 2013;61:1409-1420.
14. Petraco R, van de Hoef TP, Nijjer S, et al. Baseline instantaneous wave-free ratio as a pressure-only estimation of underlying coronary flow reserve: results of the JUSTIFY-CFR Study (Joined Coronary Pressure and Flow Analysis to Determine Diagnostic Characteristics of Basal and Hyperemic Indices of Functional Lesion Severity-Coronary Flow Reserve). Circ Cardiovasc Interv. 2014;7:492-502.
15. Davies JE, Sen S, Dehbi HM, et al. Use of the Instantaneous Wave-free Ratio or Fractional Flow Reserve in PCI. N Engl J Med. 2017;376:1824-1834.
16. Götberg M, Christiansen EH, Gudmundsdottir IJ, et al. Instantaneous Wave-free Ratio versus Fractional Flow Reserve to Guide PCI. N Engl J Med. 2017;376:1813-1823.
17. Johnson NP, Li W, Chen X, et al. Diastolic pressure ratio: new approach and validation vs. the instantaneous wave-free ratio. Eur Heart J. 2019;40:2585-2594.
18. Lee JM, Rhee TM, Choi KH, et al. Clinical Outcome of Lesions With Discordant Results Among Different Invasive Physiologic Indices - Resting Distal Coronary to Aortic Pressure Ratio, Resting Full-Cycle Ratio, Diastolic Pressure Ratio, Instantaneous Wave-Free Ratio, and Fractional Flow Reserve. Circ J. 2019;83:2210-2221.
19. Van’t Veer M, Pijls NHJ, Hennigan B, et al. Comparison of Different Diastolic Resting Indexes to iFR: Are They All Equal? J Am Coll Cardiol. 2017;70:3088-3096.
20. Kobayashi Y, Johnson NP, Berry C, et al. The Influence of Lesion Location on the Diagnostic Accuracy of Adenosine-Free Coronary Pressure Wire Measurements. JACC Cardiovasc Interv. 2016;9:2390-2399.
21. Ahn JM, Park DW, Kim SO, et al. Prognostic Value of Resting Distal-to-Aortic Coronary Pressure in Clinical Practice. Circ Cardiovasc Interv. 2020;13:e007868.
22. Piróth Z, Fülöp G, Boxma-de Klerk BM, et al. Correlation and Relative Prognostic Value of Fractional Flow Reserve and Pd/Pa of Nonculprit Lesions in ST-Segment-Elevation Myocardial Infarction. Circ Cardiovasc Interv. 2022;15:e010796.
23. Barauskas M, Ziubryte G, Barauskiene G, Unikaite R, Jodka N, Unikas R. Systemic analysis of diagnostic performance and agreement between fractional flow reserve and quantitative flow ratio. Cor Vasa. 2021;63:683-687.
24. Tu S, Westra J, Yang J, et al. Diagnostic Accuracy of Fast Computational Approaches to Derive Fractional Flow Reserve From Diagnostic Coronary Angiography The International Multicenter FAVOR Pilot Study. JACC Cardiovasc Interv. 2016;9:2024-2035.
25. Xu B, Tu S, Qiao S, et al. Diagnostic Accuracy of Angiography-Based Quantitative Flow Ratio Measurements for Online Assessment of Coronary Stenosis. J Am Coll Cardiol. 2017;70:3077-3087.
26. Westra J, Tu S, Campo G, et al. Diagnostic performance of quantitative flow ratio in prospectively enrolled patients: An individual patient-data meta-analysis. Catheter Cardiovasc Interv. 2019;94:693-701.
27. Spitaleri G, Tebaldi M, Biscaglia S, Westra J, Brugaletta S, Erriquez A. Quantitative Flow Ratio identifies nonculprit coronary lesions requiring revascularization in patients with ST segment elevation myocardial infarction and multivessel disease. Circ Cardiovasc Interv. 2018;11:e006023.
28. Xu B, Tu S, Song L, et al. Angiographic quantitative flow ratio-guided coronary intervention (FAVOR III China): a multicentre, randomised, sham-controlled trial. Lancet. 2021;398:2149-2159.
29. Masdjedi K, Tanaka N, Van Belle E, et al. Vessel fractional flow reserve (vFFR) for the assessment of stenosis severity: the FAST II study. EuroIntervention. 2022;17:1498-1505.
30. Fearon W, Achenbach S, Engstrom T, et al. Accuracy of fractional flow reserve derived from coronary angiography. Circulation. 2019;139:477-484.
31. Morris PD, Ryan D, Morton AC, et al. Virtual Fractional Flow Reserve From Coronary Angiography: Modeling the Significance of Coronary Lesions Results From the VIRTU-1 (VIRTUal Fractional Flow Reserve From Coronary Angiography) Study. JACC Cardiovasc Interv. 2013;6:149-157.
32. Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. Eur Heart J. 2018;39:3314-3321.
33. Yakazi K, Otsuka M, Kataoka S, Kahata, Kumagai A. Applicability of 3-Dimensional Quantitative Coronary Angiography-derived computed Fractional Flow Reserve for intermediate coronary stenosis. Circ J. 2017;81:988-992.
34. Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. Eur Heart J. 2018;39:3314-3321.
35. Asano T, Katagiri Y, Chang CC, et al. Angiography-Derived Fractional Flow Reserve in the SYNTAX II Trial: Feasibility, Diagnostic Performance of Quantitative Flow Ratio, and Clinical Prognostic Value of Functional SYNTAX Score Derived From Quantitative Flow Ratio in Patients With 3-Vessel Dis. JACC Cardiovasc Interv. 2019;12:259-270.
36. Mejía-Rentería H, Lee JM, Lauri F, et al. Influence of Microcirculatory Dysfunction on Angiography-Based Functional Assessment of Coronary Stenoses. JACC Cardiovasc Interv. 2018;11:741-753.
37. Westra J, Andersen BK, Campo G, et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow reserve: The FAVOR II Europe-Japan study. J Am Heart Assoc. 2018;7:e009603.
38. Haley H, Ghobrial M, Morris P, Gosling R, Williams G, Mills M. Virtual (Computed) Fractional Flow Reserve: Future Role in Acute Coronary Syndromes. Front Cardiovasc Med. 2021;8:735008.
39. Westra J, Sejr-Hansen M, Koltowski L, et al. Reproducibility of quantitative flow ratio: The QREP study. EuroIntervention. 2022;17:1252-1259.
40. Ford TJ, Stanley B, Sidik N, et al. 1-Year Outcomes of Angina Management Guided by Invasive Coronary Function Testing (CorMicA). JACC Cardiovasc Interv. 2020;13:33-45.
41. Chilian WM, Eastham CL, Marcus ML. Microvascular distribution of coronary vascular resistance in beating left ventricle. Am J Physiol. 1986;251(4 Pt 2):H779-H788.
42. Goodwill AG, Dick GM, Kiel AM, Tune JD. Regulation of Coronary Blood Flow. Compr Physiol. 2017;7:321.
43. Broyd CJ, Echavarria-Pinto M, Cerrato E, Escaned J. Evaluation of Microvascular Disease and Clinical Outcomes. Interv Cardiol Clin. 2015;4:443-457.
44. Kelshiker MA, Seligman H, Howard JP, et al. Coronary flow reserve and cardiovascular outcomes: a systematic review and meta-analysis. Eur Heart J. 2022;43:1582-1593.
45. Taqueti VR, di Carli MF. Coronary Microvascular Disease Pathogenic Mechanisms and Therapeutic Options: JACC State-of-the-Art Review. J Am Coll Cardiol. 2018;72:2625-2641.
46. Lee JM, Jung JH, Hwang D, et al. Coronary Flow Reserve and Microcirculatory Resistance in Patients With Intermediate Coronary Stenosis. J Am Coll Cardiol. 2016;67:1158-1169.
47. Padro T, Manfrini O, Bugiardini R, et al. ESC Working Group on Coronary Pathophysiology and Microcirculation position paper on “coronary microvascular dysfunction in cardiovascular disease”. Cardiovasc Res. 2020;116:741-755.
48. Van’t Veer M, Adjedj J, Wijnbergen I, et al. Novel monorail infusion catheter for volumetric coronary blood flow measurement in humans: in vitro validation. EuroIntervention. 2016;12:701-707.
49. Xaplanteris P, Fournier S, Keulards DCJ, et al. Catheter-Based Measurements of Absolute Coronary Blood Flow and Microvascular Resistance: Feasibility, Safety, and Reproducibility in Humans. Circ Cardiovasc Interv. 2018;11:e006194.
50. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International. Eur Heart J. 2020;41:3504-3520.
51. Lee SH, Shin D, Lee JM, et al. Clinical Relevance of Ischemia with Nonobstructive Coronary Arteries According to Coronary Microvascular Dysfunction. J Am Heart Assoc. 2022;11:e025171.
52. Williams RP, de Waard GA, de Silva K, et al. Doppler Versus Thermodilution-Derived Coronary Microvascular Resistance to Predict Coronary Microvascular Dysfunction in Patients With Acute Myocardial Infarction or Stable Angina Pectoris. Am J Cardiol. 2018;121:1-8.
53. Kobayashi Y, Fearon WF. Invasive coronary microcirculation assessment — Current status of index of microcirculatory resistance. Circ J. 2014;78:1021-1028.
54. De Maria GL, Scarsini R, Shanmuganathan M, et al. Angiography-derived index of microcirculatory resistance as a novel, pressure-wire-free tool to assess coronary microcirculation in ST elevation myocardial infarction. Int J Cardiovasc Imaging. 2020;36:1395-1406.
55. Scarsini R, Shanmuganathan M, Kotronias RA, et al. Angiography-derived index of microcirculatory resistance (IMRangio) as a novel pressure-wire-free tool to assess coronary microvascular dysfunction in acute coronary syndromes and stable coronary artery disease. Int J Cardiovasc Imaging. 2021;37:1801-1813.
56. Kotronias R, Terentes-Printzios D, Shanmuganathan M, et al. Long-Term Clinical Outcomes in Patients With an Acute ST-Segment-Elevation Myocardial Infarction Stratified by Angiography-Derived Index of Microcirculatory Resistance. Front Cardiovasc Med. 2021;1:717114.
57. Tebaldi M, Biscaglia S, Di Girolamo D, et al. Angio-based index of microcirculatory resistance for the assessment of the coronary resistance: A proof of concept study. J Interv Cardiol. 2020;2020:8887369.
58. Mejia-Renteria H, Lee JM, Choi KH, et al. Coronary microcirculation assessment using functional angiography: Development of a wire-free method applicable to conventional coronary angiograms. Catheter Cardiovasc Interv. 2021;98:1027-1037.
59. Fernández‐Peregrina E, Garcia‐Garcia HM, Sans‐Rosello J, et al. Angiography‐derived versus invasively‐determined index of microcirculatory resistance in the assessment of coronary microcirculation: A systematic review and meta‐analysis. Catheter Cardiovasc Interv. 2022;99:2018-2025.
60. Ai H, Feng Y, Gong Y, et al. Coronary Angiography-Derived Index of Microvascular Resistance. Front Physiol. 2020;11:605356.
61. Choi KH, Dai N, Li Y, et al. Functional Coronary Angiography–Derived Index of Microcirculatory Resistance in Patients With ST-Segment Elevation Myocardial Infarction. JACC Cardiovasc Interv. 2021;14:1670-1684.
* Autores para correspondencia.
Correos electrónicos: (M. Echevarria Pinto) y (H.M. Garcia-Garcia).
◊ Parte del contenido de este artículo se ha publicado previamente en la página web de la Sociedad Latinoamericana de Cardiología Intervencionista (SOLACI): https://proeducar.solaci.org/es/blog/post/fisiologia-coronaria.
RESUMEN
El acceso vascular es una parte esencial de cualquier procedimiento intervencionista coronario o estructural. En procedimientos coronarios, el acceso femoral tradicional prácticamente ha sido sustituido por el radial desde hace 15-20 años. No obstante, el acceso femoral, tanto arterial como venoso, sigue siendo la principal vía de abordaje para el intervencionismo estructural. El acceso femoral ha ido evolucionando con el paso del tiempo de una punción mediante referencias anatómicas a una punción mucho más precisa guiada por ecografía. La llegada de técnicas como el recambio valvular aórtico percutáneo ha condicionado el uso de introductores arteriales de gran tamaño y, por tanto, la necesidad de sistemas de control de la hemostasia, principalmente los sistemas percutáneos de cierre vascular. Este artículo revisa diversos conceptos anatómicos, técnicas de punción, evaluación diagnóstica y estrategias de cierre de las principales vías de acceso arterial y venoso utilizadas en el diagnóstico y el tratamiento de diferentes patologías estructurales.
Palabras clave: TAVI. Vascular. Accesos. Estructural.
ABSTRACT
Vascular access is an essential part of all interventional procedures whether coronary or structural. Over the last 15 to 20 years, in coronary interventions, traditional femoral access has been mostly replaced by the radial approach. Nonetheless, the femoral approach through both artery and vein is still the main approach for structural heart procedures. Over the last few years, femoral access has evolved from a puncture guided by anatomical references to more accurate ultrasound-guided approaches. The relatively recent introduction of interventions such as transcatheter aortic valve replacement has conditioned the use of large introducers and ultimately the need for specific hemostatic systems, above all, percutaneous closure devices. This manuscript reviews different anatomical concepts, puncture techniques, diagnostic assessments, and closure strategies of the main arterial and venous approaches for the diagnosis and treatment of different structural heart procedures.
Keywords: TAVI. Vascular. Accesses. Structural.
Abreviaturas AFC: arteria femoral común. DAP: ductus arterioso persistente. TAVI: implante percutáneo de válvula aórtica.
ACCESOS ARTERIALES
Técnica de punción arterial
El acceso vascular es una parte esencial de cualquier procedimiento intervencionista coronario o estructural. Para procedimientos coronarios, el acceso femoral tradicional prácticamente ha sido sustituido por el radial desde hace 15-20 años. No obstante, el acceso femoral sigue siendo el principal para intervencionismo estructural. También se utilizan en menor medida otros accesos, como el braquial, el cubital, el axilar y el carotídeo. El conocimiento de la anatomía y de la técnica de punción es fundamental. Esto es especialmente relevante en accesos distintos del radial/cubital, en los que la tasa de complicaciones es mayor, sobre todo si se emplean catéteres y dispositivos de gran tamaño.
Acceso femoral arterial
La arteria femoral común (AFC) es el lugar ideal de punción, por su mayor tamaño y por estar sobre la cabeza femoral, lo que favorece su palpación y un plano de compresión. La AFC está en la vaina femoral lateral, mientras que la vena femoral común está en la vaina medial y el nervio femoral por fuera de la vaina, lateral a la arteria. Distalmente, se divide en las arterias femorales superficial y profunda. Una punción alta, por encima del ligamento inguinal, dificulta la compresión arterial y favorece la posibilidad de sangrado retroperitoneal. Una punción baja, en la arteria femoral superficial o profunda, aumenta las posibilidades de seudoaneurisma, hematoma o isquemia, así como de fístula arteriovenosa, porque a ese nivel la vena con frecuencia está superpuesta a la arteria y se puede atravesar inadvertidamente.
Hay 3 forma básicas de canalizar la AFC:
1) Basada en referencias cutáneas
Era la forma más utilizada en el pasado. Típicamente se palpa en busca del latido arterial 2-3 cm por debajo del pliegue cutáneo inguinal. Se administra anestesia local y luego se utiliza una aguja con la técnica modificada de Seldinger, puncionando únicamente la pared anterior para evitar el sangrado en la zona posterior de la arteria. Una vez obtenido flujo pulsátil, se introduce una guía hasta la aorta abdominal bajo visualización fluoroscópica. De manera alternativa puede usarse un equipo de micropunción para practicar un orificio más pequeño, casi un 60% menor, con la potencial reducción de complicaciones. Se utilizan una guía de 0,018 pulgadas y un introductor de 4 Fr, mediante el cual se puede introducir ya la guía de 0,035 pulgadas. La punción basada en referencias cutáneas no es óptima si se busca una gran precisión.
2) Basada en referencias radiográficas
La cabeza femoral se visualiza por fluoroscopia y se coloca un marcador radiopaco en su borde inferior como referencia de altura. Si se punciona con la aguja inclinada 30-45°, este es el sitio donde introducir la aguja para intentar pinchar la arteria en la mitad de la cabeza femoral (figura 1). Si se punciona algo más vertical, se debe entrar en la piel un poco más cranealmente. El ligamento inguinal suele estar a unos 15 mm por encima de la mitad de la cabeza femoral y la bifurcación arterial femoral se encuentra en la mayoría de los pacientes distal a la parte inferior de la cabeza femoral, de ahí que la mitad de la cabeza femoral sea la zona objetivo. Cuando se necesitan introductores de gran calibre, como en el implante percutáneo de válvula aórtica (TAVI), se lleva a cabo una variación de esta técnica y se inyecta contraste mediante un catéter avanzado por otro acceso arterial hasta la AFC para localizarla con certeza.
Figura 1. Referencias radiológicas de la punción sobre la arteria femoral.
3) Guiada por ultrasonidos
La mayoría de los intervencionistas formados en los últimos 15 años han tenido una limitada experiencia con la vía femoral por el auge del acceso radial. Así, sería razonable que el aprendizaje de la vía femoral se basara en el uso de ultrasonidos. Se utiliza una sonda lineal vascular de 8-12 MHz introducida en una bolsa estéril. El eco bidimensional permite visualizar directamente la AFC, su bifurcación y la cabeza femoral. Se debe evaluar la AFC en el eje largo desde su bifurcación hasta que entra posteriormente en la pelvis, midiendo su calibre y valorando la presencia de placas de ateroma. Se debe evaluar también la arteria en el eje corto o transversal, que da una imagen típica de «cabeza de Mickey» en la bifurcación arterial con la vena medial y la femoral superficial sobre la profunda, y toda la sección de corte de la AFC para evaluar cuál es su sección más sana, desplazando el transductor cranealmente (vídeo 1 del material adicional). La vena se diferencia de la arteria porque es mucho más fácilmente compresible y por la dirección y la velocidad del flujo con Doppler color. La evaluación con ultrasonidos permite seleccionar la zona de la arteria con menos calcio en la pared anterior. La infiltración con un anestésico local en ese punto y la punción se realizan bajo control ecográfico, que muestra la entrada de la aguja en la parte central de la arteria para facilitar el buen funcionamiento de los sistemas de cierre. Tras introducir la guía de 0,035 pulgadas, se comprueba con ultrasonidos que el sitio de punción es el adecuado, ya que la guía es muy ecogénica y fácilmente visible. Este abordaje no requiere el uso de contraste ni de rayos X durante la punción. En el estudio FAUST1, un ensayo prospectivo y multicéntrico que asignó aleatoriamente a 1.004 pacientes para TAVI por acceso femoral guiado por fluoroscopia o por ecografía, la punción ecoguiada se asoció a una mayor tasa de éxito en el primer intento (83 frente a 46%; p < 0,01), una reducción del número de intentos (1,3 frente a 3,0; p < 0,01), una reducción del riesgo de venopunción (2,4 frente a 15,8; p < 0,01), una disminución del tiempo medio de acceso (136 frente a 148 segundos; p < 0,01) y una menor frecuencia de complicaciones derivadas del acceso (1,4 frente a 3,6%; p = 0,04).
Las complicaciones básicas de la punción arterial en procedimientos estructurales (TAVI) se resumen en la tabla 1. La edad avanzada, el sexo femenino, el bajo peso o la obesidad, la enfermedad vascular periférica, la insuficiencia renal, la diátesis hemorrágica, la anticoagulación basal y un mayor tamaño del introductor se asocian al desarrollo de complicaciones2. En el pasado, los porcentajes de complicaciones vasculares eran elevados, pero en los últimos años se han reducido de manera muy importante2.
Tabla 1. Principales complicaciones del acceso arterial femoral
| Incidencia (%) | |
|---|---|
| Hematoma | 2,2-12,5 |
| Hemorragia retroperitoneal | 1-2,2 |
| Rotura ileofemoral | 0,7-7,1 |
| Seudoaneurisma | 2-6 |
| Disección arterial | 2-7,4 |
| Infección local | 1,6-6,3 |
DISPOSITIVOS DE CIERRE ARTERIAL
Los dispositivos de cierre arterial se introdujeron a comienzos de la década de 1990. Para accesos arteriales con introductores > 8 Fr hay disponibles dispositivos de cierre basados en sutura o implantes bioabsorbibles. En la tabla 2 se describen los 3 dispositivos de cierre vascular de gran calibre de mayor uso en la actualidad.
Tabla 2. Principales dispositivos de cierre vascular percutáneo
| Compañía | Nombre | Tipo | Indicación FDA | Características |
|---|---|---|---|---|
| Abbot | Perclose Proglide | Sutura | Accesos AFC (5-21 Fr), vena (5-24 Fr) | Monofilamento de polipropileno con nudo premontado
Mínimo material intravascular residual Mantiene guía de acceso Sin restricción de reacceso Precierre con 2 dispositivos si > 8 Fr |
| Abbot | Prostar XL | Sutura | Accesos AFC (8,5-24 Fr) | Dos hilos de sutura de poliéster trenzado
Cuatro agujas de nitinol Mínimo material intravascular residual Mantiene la guía de acceso Precierre si > 10 Fr |
| Teleflex | Manta | Implante bioabsorbible | Acceso AFC dispositivos 10-20 Fr | No necesidad de precierre
Ancla intravascular residual |
|
AFC: arteria femoral común; FDA: Food and Drug Administration. |
||||
Proglide
Perclose/Proglide (Abbott Vascular, Estados Unidos) es el dispositivo de sutura más utilizado en la actualidad, por ser más sencillo que el Prostar XL. Se introduce sobre una guía de 0,035 pulgadas en la arteria hasta que se observa flujo pulsátil de sangre por el puerto lateral. Una palanca libera un pie dentro de la luz, que se tracciona sobre la pared anterior de la arteria mientras se liberan las agujas y se forma el nudo. El cierre de la arteria se logra al apretar el nudo. Para introductores > 8 Fr hace falta un precierre antes de poner el introductor, siguiendo los pasos comentados, pero sin apretar el nudo, maniobra que se realiza al finalizar el procedimiento. Para el uso del dispositivo de sutura se hace previamente una adecuada tunelización del tejido celular subcutáneo para garantizar la bajada del nudo corredizo de sutura. En general, para procedimientos de TAVI, el precierre se hace con 2 dispositivos liberados en diferentes orientaciones (habitualmente perpendiculares) que se aprietan al retirar al final el dispositivo utilizado, obteniendo una sutura en X sobre la superficie arterial.
Manta
El dispositivo Manta (Teleflex, Estados Unidos) está disponible en 2 tamaños, 14 y 18 Fr, para arteriotomías de 10-14 Fr y 15-20 Fr, respectivamente. Tras pinchar la arteria, se debe medir su profundidad con una vaina específica. A pesar de que su rendimiento es mayor en arterias no calcificadas, algunos operadores lo prefieren en arterias calcificadas porque es en estas donde los sistemas de cierre con sutura funcionan peor. Sobre un introductor específico se introduce el dispositivo de cierre por completo, hasta oír un clic. Después se retira el conjunto hasta la profundidad previamente medida y se libera el ancla intraarterial mediante una palanca. Se tracciona el dispositivo hasta observar un color verde-amarillo en un indicador de tensión y, manteniendo la tensión, se avanza un cilindro azul que baja un cierre radiopaco y fija el material de colágeno sobre la superficie arterial. Comprobada la hemostasia, se retira la guía (en general de 0,035 pulgadas de alto soporte) y se corta la sutura. El ancla es reabsorbible y el cierre metálico es útil para pinchar > 2,5 cm por encima o por debajo si es necesario volver a acceder a la arteria.
PARTICULARIDADES DEL ACCESO ARTERIAL EN EL TAVI
El TAVI ha revolucionado el tratamiento de la estenosis aórtica grave, convirtiéndose en el procedimiento de elección para una gran proporción de pacientes. En el TAVI, la elección de la vía de acceso marca los resultados, por lo cual es de vital importancia una adecuada planificación de esta.
Los diferentes estudios han mostrado resultados desfavorables para los accesos transtorácicos comparados con los transfemorales, por lo que siempre que sea posible se deben priorizar estos últimos3. Además, las sucesivas mejoras de la tecnología y el aumento de la experiencia de los operadores han logrado reducir las complicaciones vasculares mayores desde > 10% en las series iniciales hasta < 3% en los últimos años4.
Acceso transfemoral
Planificación
En la mayoría de los casos, el acceso transfemoral puede realizarse completamente percutáneo y con sedación superficial. Para garantizar su éxito, es obligatoria una planificación meticulosa mediante angiografía por tomografía computarizada (angio-TC) e, idealmente, reconstrucción volumétrica y análisis mediante software específicos. Mediante dicho análisis se debe valorar sobre todo el diámetro mínimo del vaso desde la bifurcación femoral hasta el origen de la ilíaca común. Se considera un mínimo de 5,5 mm para las prótesis de 14 Fr y de 6-6,5 mm para las de 18 Fr, aunque los operadores expertos pueden practicar accesos con diámetros menores si la arteria no presenta calcificación en los 360° de su pared. También se deben evaluar las tortuosidades, la presencia de placas calcificadas y la calidad de los lechos distales. Asimismo, se valorará toda la aorta descendente, considerando el acceso transfemoral como un todo desde la femoral hasta el anillo aórtico. En caso de duda concreta sobre el lugar de punción, la ecografía in situ suele ser de gran ayuda porque permite valorar con gran precisión el tamaño del vaso y la calidad de la pared arterial. Así pues, puede darse el caso de un vaso gravemente enfermo en el cual se identifique mediante ecografía la presencia de una zona preservada para la punción y el posterior cierre percutáneo.
Aspectos técnicos
La zona de punción se extiende desde 1 cm por encima de la bifurcación femoral hasta el origen de la arteria epigástrica. Distalmente, es deseable separarse de la bifurcación para evitar dañar el ostium de la arteria femoral profunda durante la punción o el cierre, así como para tener suficiente distancia en caso de que se requiera implantar un stent recubierto de rescate. Proximalmente, el límite de punción lo marca la arteria epigástrica que, al dirigirse hacia el músculo recto anterior, garantiza que nos encontramos fuera del abdomen.
La punción ecoguiada reduce el número de complicaciones1. Debe hacerse un barrido para elegir el segmento de arteria femoral común con menor grado de calcificación y menos placa, en especial en la pared anterior. La presencia de calcificación extensa anterior y la existencia de placas excéntricas inmediatamente proximales a la zona de punción pueden ser limitaciones importantes de los dispositivos de cierre con sutura; en estos casos, se puede considerar el abordaje quirúrgico (figura 2). Otras alternativas, como la micropunción o la colocación de un pigtail en la zona de punción mediante acceso femoral contralateral, son menos habituales. En algunos centros colocan una guía de seguridad anterógradamente desde la arteria radial o desde un acceso femoral contralateral para poder llevar a cabo una oclusión de emergencia mediante balón o implantar un stent cubierto si falla el cierre; en estos casos, deben sopesarse el potencial beneficio de la guía de seguridad y el riesgo de complicación vascular asociado a un acceso femoral secundario.
Figura 2. Bajada de parches de teflón a través de la sutura del dispositivo Proglide.
Si se obtiene un acceso femoral con éxito pero existe estenosis a un nivel más proximal (ilíaca externa o común), se puede considerar realizar dilataciones sucesivas mediante vainas de tamaños crecientes o dilataciones con balón. En algunos casos, la litotricia intravascular puede ser de utilidad. Si hay tortuosidades importantes, se puede utilizar un guía de muy alto soporte (Lunderquist, Cook Medical, Estados Unidos).
Las 3 modalidades de cierre más comunes son: a) 2 dispositivos de cierre mediante sutura (Proglide) girados (uno a las 11 y otro a la 1 horarias); b) 1 dispositivo de sutura y 1 dispositivo de colágeno (AngioSeal, Terumo, Japón); y c) 1 dispositivo de cierre con colágeno (Manta). El uso de dispositivos de cierre con sutura tiene mayor curva de aprendizaje, pero parece asociarse a un menor número de complicaciones graves y de cirugía abierta de rescate. En ocasiones se requieren más de 2 dispositivos para un cierre completo5. Si se produce un fallo del sistema de cierre, en caso de ser con sutura todavía, mantener la guía en la arteria permite la colocación de nuevos dispositivos (1 o varios Proglide con diferente rotación, o un nuevo dispositivo por colágeno). Si el dispositivo inicial fallido era de colágeno y no se ha dejado una guía en paralelo de rescate, no dispondremos de guía, por lo que las soluciones más rápidas serán implantar un stent-graft (stent recubierto de una membrana que evita el sangrado) o avisar a cirugía para un cierre quirúrgico de rescate. Por el contrario, en caso de cierre no fallido pero con sangrado residual, se puede añadir la mitad de la dosis de protamina y realizar una compresión prolongada. También es muy efectivo bajar pequeños parches de teflón a través de la sutura del Proglide (figura 2). La protamina a dosis completa puede llevar a la trombosis del sistema arterial, por lo que se recomienda usar la mitad de la dosis que se ha administrado de heparina sódica. Al finalizar el procedimiento, algunos operadores realizan una angiografía de control desde un acceso arterial secundario, aunque si no hay sangrado externo también se puede comprobar la ausencia de complicaciones y la presencia de flujo distal mediante ecografía. En cuanto al acceso secundario para angiografía durante el posicionamiento de la válvula, en algunos centros optan por el acceso femoral contralateral, aunque se debe priorizar el radial siempre que sea posible, ya que se asocia a menor riesgo de sangrado y de complicaciones vasculares6.
Acceso transaxilar
El acceso axilar/subclavio no debe utilizarse como acceso prioritario en pacientes con buen acceso transfemoral. Aunque algunos estudios han mostrado buenos resultados, el registro español encuentra una mayor tasa de complicaciones en comparación con el acceso transfemoral7. Por ello, se considera como acceso alternativo cuando el transfemoral no es de buena calidad.
En general, se prefiere el acceso izquierdo por no tener un origen común con la arteria carótida y presentar un acceso más parecido al femoral, debido a la curvatura mayor de la aorta y la perpendicularidad al plano anular. En cambio, el acceso derecho raramente se selecciona y se reserva para pacientes con injerto de mamaria izquierda permeable o estenosis graves de subclavia izquierda; se debe desaconsejar siempre que el plano anular se encuentre horizontalizado (> 30-45°), ya que entra en general por la curvatura menor de la aorta y desalineado con el plano valvular.
Como en el acceso transfemoral, la planificación mediante angio-TC es fundamental, valorando la presencia de calcificaciones, estenosis y calibre mínimo, en particular en el origen de la subclavia al ser la zona más proclive a presentar ateroesclerosis. Vale la pena señalar también la diferente histología de la arteria subclavia, que presenta una media con más fibras elásticas y una adventicia más fina, comparada con la femoral, que tiene una media con células musculares lisas y una adventicia más gruesa y fibrosa8. Estas características hacen de la subclavia una arteria más frágil y susceptible a roturas o disecciones. El acceso generalmente es mediante técnica quirúrgica, aunque se han descrito series con acceso percutáneo9. Es importante no avanzar demasiado el introductor, dejando al menos 5 cm hasta el plano valvular para el correcto despliegue de la prótesis. En algunos casos se puede suturar un tubo de dacrón a la arteria proximalmente y al introductor distalmente. Con la técnica percutánea se debe crear un asa radial-femoral con anterioridad al acceso, que permita posicionar un balón de oclusión en caso de sangrado o durante el intercambio de dispositivos.
Acceso transcarotídeo
En algunos centros con experiencia, el acceso transcarotídeo se considera como acceso alternativo de elección en pacientes sin acceso transfemoral. Mientras que el riesgo de ictus es similar al del acceso transfemoral, el principal riesgo es el daño de nervios periféricos, como el facial o el laríngeo recurrente (ramo del nervio vago), que se han descrito hasta en un 2,2% de los casos10,11.
La técnica generalmente es quirúrgica y se suele usar el lado izquierdo, practicando una pequeña incisión de 5 cm a lo largo del borde anterior del músculo esternocleidomastoideo, tras lo cual se debe retraer el músculo para exposición y punción directa de la arteria. Se puede comprobar mediante camplaje proximal la presencia de circulación colateral, y suele mantenerse la monitorización cerebral continua durante el procedimiento. Al igual que en el acceso subclavio, se debe procurar no avanzar demasiado el introductor para dejar espacio suficiente para el correcto despliegue de la válvula.
Acceso transcava
El abordaje transcava es el último desarrollado para el acceso vascular alternativo en el intervencionismo percutáneo. Su objetivo es evitar la morbilidad de los abordajes transtorácicos, a la vez que presenta las ventajas de un acceso transfemoral venoso (práctica ausencia de complicaciones a nivel femoral y posibilidad de sedación consciente). Sin embargo, el abordaje requiere la capacidad de realizar una punción desde la vena cava hacia la aorta abdominal a través del retroperitoneo y posteriormente avanzar el introductor y el sistema de liberación en el TAVI. Este paso precisa una planificación preoperatoria minuciosa con angio-TC. El acceso transcava es posible porque la presión hidrostática intersticial en el espacio retroperitoneal supera la presión venosa, por lo que la sangre que sale de la aorta abdominal durante el procedimiento vuelve a la circulación venosa en lugar de acumularse en el retroperitoneo. Por otro lado, la zona de entrada en la aorta abdominal deberá estar libre de calcificación, tanto para el correcto avance del material como para el cierre efectivo de esta comunicación cavo-aórtica al final del procedimiento mediante un dispositivo oclusor tipo Amplatzer (generalmente VSD Occluder, Abbott Vascular).
Los principales datos sobre el acceso transcava proceden de un registro prospectivo multicéntrico que incluyó 100 pacientes12. Este registro halló una tasa de éxito del procedimiento del 99%, pero una tasa de hemorragias potencialmente mortales del 7% y de complicaciones vasculares del 13%. Por ello, actualmente su uso suele ser marginal.
Acceso quirúrgico aórtico directo
El acceso quirúrgico aórtico directo requiere anestesia general y se desarrolló como alternativa al acceso transapical, intentando superar las complicaciones y el daño miocárdico derivados del acceso apical. Requiere una esternotomía superior parcial que se extiende hasta el segundo o el tercer espacio intercostal derecho. En la actualidad está en desuso.
Particularidades del acceso arterial en otros procedimientos estructurales
Fugas paravalvulares
El cierre de fugas (leaks) paravalvulares es probablemente uno de los procedimientos más complejos y con mayor heterogeneidad entre operadores. Las fugas paravalvulares se dividen principalmente en aórticas y mitrales.
Fugas paravalvulares aórticas
El acceso es principalmente retrógrado (aorta-ventrículo) y por tanto es imprescindible una punción arterial. En la mayoría de los casos se implanta un dispositivo Amplatzer Vascular Plug 3 (Abbott Vascular). Estos dispositivos requieren una vaina de liberación de entre 6 y 7 Fr. En las fugas más pequeñas se puede implantar un Amplatzer Vascular Plug 4, que puede avanzar por un catéter diagnóstico de 4 Fr. Estos procedimientos se pueden acometer por vía radial13, aunque la mayoría de los operadores prefieren la arteria femoral, evitando el riesgo de espasmo en caso de necesitar una manipulación de catéter importante. En general, el uso de una guía de alto soporte en el ventrículo izquierdo es suficiente para proporcionar soporte para avanzar los catéteres de liberación. En este sentido, se recomiendan guías de alto soporte, como las utilizadas en el TAVI, para evitar perforaciones del ventrículo izquierdo. En caso contrario, puede ser necesario realizar un asa arteriovenosa e incluso un asa arterioarterial (especialmente útil en fugas sobre TAVI autoexpandibles)14. En ambas situaciones será necesario un acceso adicional venoso o arterial específicamente. Por último, cabe destacar que, a pesar del tamaño limitado de los introductores, se recomienda el uso de sistemas de cierre vascular, al ser en su mayoría pacientes con válvulas mecánicas y que por tanto requieren un reinicio precoz de la anticoagulación.
Fugas paravalvulares mitrales
La mayoría de los operadores utilizan el acceso anterógrado (aurícula izquierda-ventrículo) a través de una vena femoral y acceso transeptal. Para esta técnica es imprescindible tener un buen soporte de imagen con ecocardiografía transesofágica tridimensional y usar un catéter con capacidad de flexión para orientarlo sobre el origen de la fuga. En la mayoría de los casos, la colocación de una guía de alto soporte en el ventrículo izquierdo evita la necesidad de un asa arteriovenosa (que requeriría un acceso arterial). Por tanto, muchas veces un acceso venoso único puede ser suficiente. Los dispositivos utilizados son generalmente los mismos que en las fugas aórticas y los catéteres necesarios tienen el mismo tamaño. Es importante destacar que, en ocasiones, las fugas mitrales requieren el implante de múltiples dispositivos. En caso de querer realizar un implante simultáneo de 2 o más dispositivos, puede ser necesario realizar tantos accesos venosos como dispositivos se vayan a implantar. Alternativamente, las fugas paravalvulares mitrales se pueden cruzar de manera retrógrada (ventrículo-aurícula izquierda). Esta técnica requiere la manipulación de catéteres dentro del ventrículo izquierdo y, por tanto, comporta un alto riesgo de arritmias. Puede ser una alternativa en caso de dificultades para el cruce anterógrado y en general es más fácil en fugas posteriores que en anteriores (ya que la guía siempre tiene tendencia a ir a través de la aorta). Esta técnica requiere, obviamente, una punción arterial y la realización de un asa arteriovenosa a nivel de la aurícula izquierda.
Coartación de aorta
El tratamiento percutáneo de elección para la coartación de aorta es el implante de stents. Para ello es necesario un acceso arterial de gran tamaño (10-14 Fr), que habitualmente es femoral. El calibre del introductor femoral depende de la elección de los balones y de los stents que se utilicen. Los stents pueden ser con o sin recubrimiento. Los stents recubiertos se usan sobre todo para las coartaciones complejas, como las que tienen obstrucción completa o estenosis crítica con riesgo de rotura, las que se asocian a aneurismas, seudoaneurismas, ductus o enfermedad de la pared (válvula bicúspide, Turner); en pacientes de edad avanzada se puede considerar el uso de stents recubiertos que puedan cubrir una disección o rotura. El inconveniente de usar stents recubiertos, aparte del riesgo de oclusión de las ramas próximas, es que necesitan una vaina 3 Fr mayor que lo necesario para el balón. En general, la vaina debe ser 2-3 Fr mayor que el mínimo requerido por el balón para dar espacio suficiente al stent y permitir su libre desplazamiento por el interior.
Para el acceso arterial femoral hay que tener en cuenta que los pacientes con coartación de aorta a menudo tienen una vasculatura arterial de diámetro menor del normal en los miembros inferiores. Además, un acceso adicional arterial radial es útil para la visualización y la angiografía durante el procedimiento, y para cruzar coartaciones críticas u oclusiones completas. En raros casos, el acceso carotídeo puede ser necesario para llegar a la aorta descendente (neonatos, estenosis críticas)15.
En cuanto al cierre, dado que la vaina suele ser de 12-14 Fr, se recomienda el cierre vascular con los dispositivos específicos antes mencionados o bien por compresión manual diferida una vez revertida la heparinización16.
Cierre de ductus arterioso
Para el cierre de ductus habitualmente se canalizan la arteria y la vena femorales. Es recomendable realizar un cateterismo izquierdo y derecho para registrar las presiones pulmonares y sistémicas, por lo que resulta razonable realizar el acceso venoso con un introductor de 7 Fr. Los dispositivos oclusores de ductus de mayor tamaño son también compatibles con 7 Fr y habitualmente se implantan por el lado venoso, por lo que puede plantearse un acceso arterial inicial de 5 Fr, que por comodidad suele hacerse por vía femoral (pensando en la posible necesidad de realizar un asa arteriovenosa), aunque puede hacerse por vía radial con una potencial reducción de las complicaciones vasculares. Cuando el acceso venoso femoral no es posible (oclusión bilateral femoral o de cava inferior) y se prefiere un acceso inferior a la aurícula derecha (como en el caso del cierre percutáneo del ductus o de defectos del tabique interauricular), se ha descrito el uso de otras rutas, como la transhepática17.
Respecto al calibre de los accesos vasculares, hay que tener en cuenta la técnica elegida y el tipo y el tamaño del dispositivo. Existen 2 posibilidades para el tratamiento percutáneo del ductus arterioso persistente: coils o dispositivos oclusores. Si el ductus es de pequeño tamaño (< 4 mm) se pueden usar 1 o varios coils de liberación controlada compatibles con catéteres de pequeño tamaño (4 Fr) e incluso con microcatéteres. Para ductus de mayor tamaño se suelen usar dispositivos oclusores. Todos ellos son de nitinol y autoexpandibles, que suelen ser compatibles con vainas de 5-7 Fr, dependiendo de su tamaño.
La canalización del ductus se hace por vía anterógrada (desde la arteria pulmonar) o retrógrada (desde la aorta), en cuyo caso requiere un asa arteriovenosa. En ambas vías se suele introducir la vaina del dispositivo por el lado venoso anterógrado desde donde se implanta. En cuanto al cierre, al ser accesos de no gran calibre, y habitualmente el mayor por acceso venoso, suele hacerse mediante compresión manual.
ACCESO VENOSO
Técnica de punción venosa ecoguiada
El acceso venoso transfemoral es el más utilizado para la realización de procedimientos de intervencionismo estructural percutáneo no TAVI. A través de la vena femoral se accede a las cámaras cardiacas derechas, y mediante una punción transeptal a las cámaras cardiacas izquierdas.
Tradicionalmente, la punción venosa se llevaba a cabo guiada por referencias anatómicas. Los operadores experimentados obtienen una razonable tasa de éxito con este método. Sin embargo, existe una posibilidad de complicaciones nada despreciable, como punción arterial inadvertida, fistula venoarterial, neumotórax (en el acceso venoso yugular interno), lesión nerviosa o múltiples intentos fallidos de canulación. El riesgo y las consecuencias de estas complicaciones dependen del tipo de pacientes tratados. Los factores de riesgo, como la obesidad, la caquexia, la radioterapia previa o las cicatrices quirúrgicas previas, entre otros, pueden influir en el éxito de la canulación y en la aparición de complicaciones18.
La técnica más segura para la canulación venosa es la ecoguiada. Para identificar la vena que se va a puncionar y establecer su relación con la arteria acompañante se puede hacer presión con la sonda de ultrasonidos, de manera que típicamente la vena se colapsará y no así la arteria (ver secciones anteriores).
Existen 2 técnicas para llevar a cabo la punción venosa ecoguiada: la transversal (fuera de plano) y la longitudinal (en plano)19. Ambas tienen ventajas y desventajas. La técnica transversal permite ver en el mismo plano las estructuras adyacentes que deben evitarse durante la punción. Sin embargo, con esta técnica es más difícil visualizar la punta de la aguja de punción; para ello se debe de ajustar el ángulo de la sonda con el fin de hacer coincidir el plano de la aguja y el plano de la sonda. La técnica longitudinal permite seguir la trayectoria de la aguja desde su entrada en la piel hasta el contacto con la vena diana. Como contrapartida, las estructuras adyacentes, y sobre todo la arteria acompañante, no se visualizan en el mismo plano. Se puede mejorar la visualización de la vena diana mediante una maniobra de Valsalva.
Dispositivos de cierre percutáneo de acceso venoso
Históricamente, la hemostasia de la punción venosa se ha realizado mediante compresión manual prolongada combinada con la aplicación de un vendaje compresivo. Con el uso de introductores de mayor tamaño para la realización de procedimientos de intervencionismo estructural, sobre todo en el acceso venoso femoral, se buscan métodos más efectivos y seguros para conseguir la hemostasia.
Punto de sutura subcutáneo «en 8»
Esta técnica consiste en pasar una sutura subcutánea proximal y transversal a la entrada del introductor venoso, y luego cruzar al lado contrario y hacer una sutura subcutánea distal a la entrada de la vaina. Esta sutura frunce la piel y el tejido celular subcutáneo, ejerciendo presión sobre la vena femoral. La técnica se complementa con un ligero vendaje compresivo. Se ha descrito una técnica modificada realizando la sutura subcutánea longitudinal al trayecto de la vena en vez de transversal, buscando minimizar la posibilidad de una punción inadvertida de la vena20.
Dispositivos de cierre vasculares
En el acceso venoso femoral con vainas de hasta 8 Fr se ha utilizado Angioseal con buenos resultados21. El uso del dispositivo de sutura percutánea Proglide ha demostrado ser efectivo y seguro en el acceso venoso femoral con vainas de hasta 24 Fr22. La técnica de implante es la misma que en la arteria (ver secciones anteriores). Dependiendo del resultado del cierre, se puede combinar con una sutura subcutánea «en 8» si la hemostasia inicial no es completa. Generalmente, se completa con un vendaje compresivo ligero.
Particularidades del intervencionismo mitral
La intervención percutánea sobre la válvula mitral más frecuente es la reparación «borde a borde» con los dispositivos MitraClip (Abbott Vascular, Estados Unidos) o Pascal (Edwards Lifesciences, Estados Unidos), si bien existen dispositivos de anuloplastia directa que intentan replicar una reparación similar a la efectuada quirúrgicamente. También se están desarrollando opciones de recambio valvular mitral transcatéter, algunas ya por completo percutáneas, con buenos resultados.
En el intervencionismo percutáneo sobre la válvula mitral, el acceso vascular más utilizado es la vena femoral, por su calibre, su accesibilidad y su facilidad de cierre al finalizar el procedimiento. La elección de la vena femoral izquierda o derecha depende de las circunstancias clínicas del enfermo (que tenga los 2 accesos disponibles, patología vascular intervenida previa en alguno de los 2 accesos, etc.) y de la preferencia del operador, por su comodidad al hacer el implante. Por esto, el acceso más usado es la vena femoral derecha, más cómoda para el operador y con algo menos de radiación.
Se ha descrito la posibilidad de efectuar el implante por vía yugular derecha, aunque solo se han publicado casos anecdóticos, por dificultades de acceso femoral, como la presencia de un filtro de vena cava inferior ocluido o de angulaciones muy marcadas del eje iliofemoral venoso23. El implante es técnicamente más dificultoso y requiere tener en cuenta múltiples consideraciones, si bien la punción es casi igual que la habitual.
La punción venosa ecoguiada limita sus posibles complicaciones y debería generalizarse. En la mayoría de los casos se implantan dispositivos de precierre antes de comenzar el procedimiento. Tras insertar una guía de alto soporte, que se lleva hasta la vena cava superior (o inferior, si el acceso es yugular), se efectúa una disección del acceso con fórceps, predilataciones del acceso con dilatadores de diferentes calibres y se avanza el catéter guía hasta la aurícula derecha. Su avance suele ser menos dificultoso que en el acceso arterial, con menos resistencia. El calibre del catéter guía del dispositivo MitraClip es de 24 Fr, con el dispositivo Pascal es de 22 Fr y para el implante de prótesis (mitrales o aórticas en posición mitral) difiere dependiendo del tipo de dispositivo que se vaya a implantar.
Particularidades del intervencionismo tricuspídeo
El intervencionismo sobre la válvula tricúspide ha evolucionado mucho en la última década, actuando bien sobre la coaptación de los velos, con anuloplastia con sutura o con anillo, y últimamente con recambio valvular percutáneo ortotópico o heterotópico24.
El acceso más utilizado es el venoso, a través de la vena femoral, de la yugular o de ambas. Dependiendo del tipo de procedimiento, es preciso canalizar otro acceso venoso más o un acceso arterial, preferiblemente radial, dado su menor índice de complicaciones vasculares.
El dispositivo que actualmente más se utiliza para el tratamiento de la insuficiencia tricuspídea es el TriClip (Abbott Vascular), desde que recibió la marca CE en el año 2020. Con el desarrollo del dispositivo TriClip, que tiene una rueda específica para alejarse del septo interauricular, el acceso venoso derecho o izquierdo no influye en el implante, y por ello la inmensa mayoría de los operadores utilizan la vena femoral derecha como vía de acceso25.
Respecto al implante de prótesis ortotópicas o heterotópicas, el acceso de elección es igualmente el femoral derecho, con calibres distintos dependiendo del dispositivo a utilizar (entre 14 y 30 Fr).
Particularidades del intervencionismo pulmonar
El intervencionismo sobre válvula o arteria pulmonar siempre requiere un acceso venoso muy variable en su diámetro, dependiendo de la técnica que se lleve a cabo. El acceso por la vena femoral es el más habitual y, por tanto, incrementar el tamaño de los introductores no supone un problema tan grave como en los accesos arteriales.
El implante percutáneo de válvulas pulmonares requiere el uso de introductores de 16-22 Fr, dependiendo del modelo. En muchos casos es necesario usar guías de alto soporte para rectificar las curvaturas en el trayecto en las cavidades derechas.
El tratamiento agudo de la enfermedad tromboembólica pulmonar requiere la introducción de sistemas de extracción de trombos. Dado que el principal condicionante del sistema utilizado es el tamaño del trombo, y que la arteria pulmonar puede albergar trombos de gran tamaño, algunos sistemas necesitan un acceso de gran calibre; por ejemplo, el Penumbra (Penumbra Inc, Estados Unidos) puede avanzar por un 8 Fr, el Nautilus (iVascular, España) por un 10 Fr y el Flowtriever (Inari Medical Inc, Estados Unidos) requiere 16-24 Fr.
En otros casos de trombectomía más distal o angioplastia pulmonar en enfermedad tromboembólica crónica se requieren introductores mucho más pequeños (6-7 Fr). Utilizar sistemas telescópicos (catéteres dentro de catéteres) puede ser muy útil en algunos casos de difícil acceso y puede requerir introductores más grandes.
Particularidades del cierre de la orejuela izquierda
Para el cierre percutáneo de la orejuela izquierda normalmente se practica un acceso venoso femoral. Algunos operadores realizan un acceso arterial adicional para monitorizar la presión arterial de manera invasiva. Este acceso arterial debe hacerse por vía radial para reducir las complicaciones hemorrágicas. En algunos casos, la guía es con ecografía intracardiaca, para la que se necesita un acceso femoral venoso complementario.
Un aspecto clave para la elección del calibre del introductor venoso por el que se va a implantar el dispositivo es el tipo y el tamaño del introductor. Los dispositivos más utilizados en nuestro medio son Amplatzer/Amulet (Abbott Vascular), Watchmann (Boston Scientific, Estados Unidos) y Lambre (Lifetech, China)26. El tamaño de los introductores varía desde 8-10 Fr (Lambre) hasta 12-14 Fr (Amulet y Watchman Flx).
En cuanto al cierre vascular, la mayoría de los operadores siguen usando compresión manual o sutura «en 8» para el acceso venoso, aunque también se pueden utilizar los sistemas de cierre vascular antes descritos.
Particularidades del acceso venoso en otros procedimientos estructurales
Hay otros procedimientos estructurales que requieren un acceso venoso, principalmente por la vena femoral. Entre los más prevalentes destacan el cierre del foramen oval permeable y el cierre de comunicaciones interauriculares. En algunos casos, estos procedimientos pueden ser guiados por ecografía intracardiaca, por lo que requieren un acceso femoral venoso adicional. Existen multitud de dispositivos de diferentes compañías que permiten el cierre de estas patologías, aunque los más habituales son los dispositivos Amplatzer PFO occluder, Amplatzer ASD occluder y Gore, sobre todo Gore Cardioform (WL Gore & Associates, Estados Unidos). En el caso de los dispositivos Amplatzer, para su implante se requieren introductores de entre 8 y 12 Fr. Por su parte, el sistema Gore requiere introductores de 11 Fr cortos, ya que vienen premontados sobre una vaina de liberación. En general, la incidencia de complicaciones vasculares es baja al tratarse principalmente de pacientes jóvenes y requerir un único acceso venoso femoral. En caso de oclusión de cava inferior, se han descrito implantes a través de la vena yugular27.
FINANCIACIÓN
Este artículo no ha recibido financiación.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido en la redacción y la revisión crítica del artículo.
CONFLICTO DE INTERESES
X. Freixa es proctor de Abbott Medical. R. Romaguera es editor asociado de REC: Interventional Cardiology, por lo que se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito; además, es proctor de Boston Scientific y ha recibido honorarios por charlas de Medtronic. R. Trillo es proctor de Medtronic y Boston Scientific. A. Jurado-Román ha recibido honorarios por charlas de Boston Scientific.
MATERIAL ADICIONAL
Vídeo 1. Freixa X. DOI: 10.24875/RECIC.M22000327
BIBLIOGRAFÍA
1. Seto AH, Abu-Fadel MS, Sparling JM, et al. Real-time ultrasound guidance facilitates femoral arterial access and reduces vascular complications: FAUST (Femoral Arterial Access With Ultrasound Trial). JACC Cardiovasc Interv. 2010;3:751-758.
2. Toggweiler S, Leipsic J, Binder RK, et al. Management of vascular access in transcatheter aortic valve replacement: part 2: Vascular complications. JACC Cardiovasc Interv. 2013;6:767-776.
3. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
4. Forrest JK, Deeb GM, Yakubov SJ, et al. 2-Year Outcomes After Transcatheter Versus Surgical Aortic Valve Replacement in Low-Risk Patients. J Am Coll Cardiol. 2022;79:882-896.
5. van Wiechen MP, Tchetche D, Ooms JF, et al. Suture- or Plug-Based Large-Bore Arteriotomy Closure: A Pilot Randomized Controlled Trial. JACC Cardiovasc Interv. 2021;14:149-157.
6. Junquera L, Urena M, Latib A, et al. Comparison of Transfemoral Versus Transradial Secondary Access in Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2020;13:e008609.
7. Jimenez-Quevedo P, Nombela-Franco L, Munoz-Garcia E, et al. Early clinical outcomes after transaxillary versus transfemoral TAVI. Data from the Spanish TAVI registry. Rev Esp Cardiol. 2021;75:479-487.
8. Schafer U, Ho Y, Frerker C, et al. Direct percutaneous access technique for transaxillary transcatheter aortic valve implantation: “the Hamburg Sankt Georg approach”. JACC Cardiovasc Interv. 2012;5:477-486.
9. Amat-Santos IJ, Santos-Martinez S, Conradi L, et al. Transaxillary transcatheter ACURATE neo aortic valve implantation - The TRANSAX multicenter study. Catheter Cardiovasc Interv. 2021;98:E291-E298.
10. Hameed I, Oakley CT, Hameed NUF, et al. Alternate accesses for transcatheter aortic valve replacement: A network meta-analysis. J Card Surg. 2021;36:4308-4319.
11. Panagides V, Kalavrouziotis D, Dumont E, et al. Cranial nerve injury during transcarotid transcatheter aortic valve replacement. Int J Cardiol. 2022;353:46-48.
12. Greenbaum AB, Babaliaros VC, Chen MY, et al. Transcaval Access and Closure for Transcatheter Aortic Valve Replacement: A Prospective Investigation. J Am Coll Cardiol. 2017;69:511-521.
13. Giacchi G, Freixa X, Hernández-Enríquez M, et al. Minimally Invasive Transradial Percutaneous Closure of Aortic Paravalvular Leaks: Following the Steps of Percutaneous Coronary Intervention. Can J Cardiol. 2016;32:1575.e17-e19.
14. Estévez-Loureiro R, Benito-González T, Gualis J, et al. Percutaneous paravalvular leak closure after CoreValve transcatheter aortic valve implantation using an arterio-arterial loop. J Thorac Dis. 2017;9:E103-E108.
15. Singh HS, Benson LN, Osten M, Horlick E. Cardiac Catheterization in Adult Congenital Heart Disease. En: Gatzoulis MA, Webb Piers GD, Daubeney EF, eds. Management of Adult Congenital Heart Disease. 3rd ed. Philadelphia: Elsevier; 2018.
16. Salinas P, Sánchez-Recalde A, Galeote G, et al. Intervencionismo percutáneo sobre coartación aórtica en el paciente adulto. En: Martín-Moreiras J, Cruz-González I, eds. Manual de Hemodinámica e Intervencionismo Cardiaco. Madrid: Marbán; 2014.
17. Ebeid MR. Transhepatic vascular access for diagnostic and interventional procedures: Techniques, outcome and complications. Catheter Cardiovasc Interv. 2007;69:594-606.
18. National Institute for Health and Care Excellence. Guidance on the use of ultrasound locating devices for placing central venous catheters. NICE; 2002. Disponible en: https://www.nice.org.uk/guidance/ta49/resources/guidance-on-the-use-of-ultrasound-locating-devices-for-placing-central-venous-catheters-pdf-2294585518021. Consultado 1 Jun 2022.
19. Privitera D, Mazzone A, Pierotti F, et al. Ultrasound-guided peripheral intravenous catheters insertion in patient with difficult vascular access: Short axis/out-of-plane versus long axis/in-plane, a randomized controlled trial. J Vasc Access. 2021;23(4):589-597.
20. Wyss CA, Anliker O, Gämperli O, et al. Closure of Large Percutaneous Femoral Venous Access Using a Modified “Figure-of-Eight” Suture. Innovations (Phila). 2018;13:147-151.
21. Coto HA. Closure of the femoral vein puncture site after transcatheter procedures using Angio-Seal. Catheter Cardiovasc Interv. 2002;55:16-19.
22. Geis NA, Pleger ST, Chorianopoulos E, et al. Feasibility and clinical benefit of a suture-mediated closure device for femoral vein access after percutaneous edge-to-edge mitral valve repair. EuroIntervention. 2015;10:1346-1353.
23. Yap J, Chen S, Smith TWR, et al. Transjugular mitral valve repair with the MitraClip: A step-by-step guide. Catheter Cardiovasc Interv. 2020;96:699-705.
24. Asmarats L, Puri R, Latib A, Navia JL, Rodés-Cabau J. Transcatheter Tricuspid Valve Interventions: Landscape, Challenges, and Future Directions. J Am Coll Cardiol. 2018;71:2935-2956.
25. Moñivas V, Li P, Sanchis R, et al. Tratamiento percutáneo de la insuficiencia tricuspídea. Procedimiento detallado guiado por imagen con MitraClip. REC Interv Cardiol. 2020;2:118-128.
26. Romaguera R, Ojeda S, Cruz-González I, Moreno R. Spanish Cardiac Catheterization and Coronary Intervention Registry. 30th Official Report of the Interventional Cardiology Association of the Spanish Society of Cardiology (1990-2020) in the year of the COVID-19 pandemic. Rev Esp Cardiol. 2021;74:1095-1105.
27. Qintar M, Villablanca P, Lee J, et al. Patent foramen ovale closure with vena cava thrombus: You need an arm and a neck! Clin Case Rep. 2021;9:e03884.
- Enfermedad coronaria calcificada: fisiopatología, evaluación por imagen intracoronaria y técnicas de modificación de placa
- Imagen intracoronaria: revisión y utilidad clínica
- Terapéutica intervencionista en insuficiencia cardiaca: un ámbito emergente en cardiología intervencionista
- Ensayos clínicos aleatorizados en desarrollo en intervencionismo coronario complejo: estudios guiados por imagen intravascular