Artículo
Artículos de revisión
REC Interv Cardiol. 2019;1:41-50
Tratamiento antitrombótico tras revascularización percutánea en pacientes con indicación crónica de anticoagulación oral
Antithrombotic therapy after percutaneous revascularization in patients on chronic oral anticoagulation treatment
aServicio de Cardiología, Hospital General Universitario de Alicante, Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL), Alicante, España bÁrea de Enfermedades del Corazón, Hospital Universitario de Bellvitge – IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona, España

RESUMEN
El 26 de mayo de 2021 entró en vigor el Reglamento Europeo de Productos Sanitarios (EU-MDR), que supuso un importante cambio en los requisitos de evaluación de los productos sanitarios en Europa. El EU-MDR Cardiovascular Collaboratory (EU-MCVC) se fundó con el fin de contribuir al desarrollo de vías más rápidas, eficientes y eficaces para la innovación de productos sanitarios cardiacos. Un registro es un sistema organizado que recoge datos uniformes y evalúa resultados específicos en una población definida por una enfermedad, afección o exposición. La mayoría de los registros se han desarrollado para mejorar la calidad de la atención y proporcionar información a médicos, hospitales y proveedores de servicios sanitarios. Los registros clínicos representan una construcción ideal para la colaboración científica, clínica y política. Describimos diversas experiencias de 5 países europeos y abordamos los componentes de calidad tradicionales en los ensayos clínicos. Se espera una colaboración continua entre académicos, especialistas en ensayos clínicos, representantes de pacientes, expertos en regulación, organizaciones de investigación, plataformas de registros, organismos reguladores y socios de la industria. La calidad de los datos es una preocupación primordial y los responsables de los registros deben optimizarla para cumplir con la normativa. Un enfoque colaborativo entre las partes interesadas en los dispositivos médicos puede mejorar la calidad de la atención, reducir los costes y proporcionar un acceso más rápido a tecnologías innovadoras, con el objetivo común de mejorar la atención y los resultados cardiovasculares.
Palabras clave: Ciencia reguladora. Registros clínicos. Ensayos clínicos.
ABSTRACT
On May 26, 2021, the European Medical Device Regulation (EU-MDR) entered into effect resulting in a major shift in the requirements for assessment of medical devices in Europe. The EU-MDR Cardiovascular Collaboratory (EU-MCVC) was founded to contribute to the development of faster, more efficient, and more effective pathways for innovation of cardiac medical devices. A registry is an organized system that collects uniform data and evaluates specified outcomes in a population defined by a disease, condition, or exposure. Most registries have been created to improve the quality of care and provide feedback to physicians, hospitals, and health providers. Clinical registries represent an ideal construct for scientific, clinical, and policy-making collaboration. We describe diverse experiences from 5 European countries and address the traditional quality components in clinical trials. Continued collaboration is expected among academics, clinical trialists, patient representatives, regulatory experts, research organizations, registry platforms, regulatory bodies, and industry partners. Data quality is a primary concern and registry leaders need to optimize data quality to become regulatory compliant. A collaborative approach among medical device stakeholders may improve quality of care, reduce costs, and provide faster access to innovative technologies, with the common objective of improving cardiovascular care and outcomes.
Keywords: Regulatory science. Clinical registries. Clinical trials.
Abbreviations EMA: European Medicines Agency. EU-MCVC: European Medical Device Regulation Cardiovascular Collaboratory. EU-MDR: European Medical Device Regulation. PMCF: Post-marketing clinical follow-up. RCT: Randomized controlled trial.
INTRODUCCIÓN
El 26 de mayo de 2021, se promulgó el Reglamento Europeo de Productos Sanitarios (EU-MDR) y la Unión Europea implementó un cambio importante en los requisitos en materia de investigación y desarrollo de dispositivos médicos1. No obstante, esta actualización legislativa coordinada permitió que cada país europeo adoptara este nuevo marco normativo aplicara su propio criterio, lo cual introdujo importantes curvas de aprendizaje. Los comités de ética, las autoridades competentes, los organismos notificados, las instituciones de salud académicas y no académicas, así como las organizaciones de investigación por contrato experimentaron retrasos, tiempos de espera más largos, una mayor carga de trabajo y, por ende, una pérdida de eficacia. Esto, a su vez, hizo que, en algunos casos, los fabricantes optaran por no priorizar a Europa como un lugar potencial para el desarrollo de nuevos tratamientos. Tres años después de la implementación del EU-MDR, se han superado las curvas de aprendizaje y Europa ha vuelto a ser una prioridad. No obstante, los nuevos requisitos y los mayores costes asociados abogan por la consecución de vías alternativas para generar datos en materia regulatoria.
Una actualización pertinente de este nuevo marco normativo es la necesidad de que los fabricantes lleven a cabo actividades de seguimiento clínico poscomercialización (PMCF) basadas en la recopilación de datos clínicos sobre el uso de dispositivos ya disponibles en el mercado. El propósito refleja el deseo de confirmar los requisitos de seguridad y rendimiento en condiciones normales de uso previsto del dispositivo, valorar los efectos adversos potencialmente raros y garantizar que la ratio riesgo-beneficio, específica de cada dispositivo, siga siendo favorable1. Aunque los estudios de poscomercialización eran algo habitual en el anterior marco regulador, el EU-MDR los ha convertido en obligatorios. Más allá de las consecuencias económicas, estos requisitos provocan, inevitablemente, una mayor carga de trabajo en aquellos hospitales en los que se emplean e implementan los dispositivos. Esta carga de trabajo adicional se podría aliviar estableciendo alianzas público-privadas para la recopilación y presentación de datos eficientes, efectivos y de alta calidad.
Un manejo exitoso de las enfermedades cardiacas requiere el uso o la implementación de dispositivos médicos; aquí el EU-MDR ha tenido un impacto esencial en el acceso a la investigación, la innovación y terapias mejoradas en la cardiología en Europa. En mayo de 2023, Cardialysis (Róterdam, Países Bajos) inició el EU-MDR Cardiovascular Collaboratory (EU-MCVC), una red internacional informal de expertos, a título voluntario y pro bono, que reúne a académicos europeos, ensayistas clínicos y expertos legisladores para colaborar con las partes interesadas en investigación clínica, tanto de ámbito local como internacional2. El propósito del EU-MCVC es crear una conversación dinámica y abierta para facilitar, en tiempo real, la implementación efectiva de la investigación clínica en Europa poniendo el énfasis en la navegación del EU-MDR. Los actores económicos en materia de investigación más importantes en esta colaboración son las organizaciones de investigación cardiovascular, las plataformas de registro, los organismos reguladores y los socios de la industria.
El abordaje prioritario de 2023 a 2024 es la definición, los requisitos y el establecimiento de registros clínicos cardiovasculares eficientes, efectivos y de alta calidad como una vía valiosa para la recopilación de datos PMCF. Este artículo aborda los siguientes 4 temas: a) la definición de registros y consideraciones relacionadas con el consentimiento informado; b) perspectivas de 5 líderes europeos sobre el establecimiento y desempeño de registros clínicos; c) la interacción entre los procesos de calidad de estudios clínicos tradicionales y los registros clínicos; d) los requisitos de datos de registro y su uso potencial y actual.
Este documento de perspectivas se redactó sobre la base de aportaciones voluntarias de todos los autores. El proceso de generación del manuscrito tuvo 2 componentes: a) un grupo de trabajo híbrido organizado por el EU-MCVC y Cardialysis, con miembros de la facultad que asistieron, sobre todo, en persona (11/13), el 8 de septiembre de 2023, en Róterdam (Países Bajos); y b) la compilación de presentaciones, debates y conclusiones, en un documento preliminar que fue revisado críticamente y ampliado por cada uno de los autores.
Definición de registros clínicos
La Agencia Europea de Medicamentos (EMA), U.S. Food and Drug Administration y el International Medical Device Regulators Forum son organismos que orientan en materia de definición de registros clínicos (tabla 1)3-6. Los elementos comunes de estas definiciones describen un registro como un sistema organizado que recopila datos uniformes y evalúa resultados específicos en una población definida por una enfermedad, patología o exposición. La definición que da el International Medical Device Regulators Forum se centra en la calidad asistencial dispensada al paciente, por lo que requiere un tamaño razonablemente extrapolable que sería más útil para informar a la hora de legislar. Sin embargo, la definición de la U.S. Food and Drug Administration adapta los objetivos a propósitos científicos, clínicos o políticos mientras que la definición de la EMA pone el acento en que la definición se haga a nivel del paciente, poniendo el foco del registro en la información sanitaria.
Tabla 1. Definición de registros clínicos
| Definición del International Medical Device Regulators Forum (IMDRF) |
| Un registro es un sistema organizado que, paralelamente a la práctica clínica diaria, recopila de manera continua y consistente datos relevantes, valora resultados significativos y da una cobertura integral a la población definida mediante la exposición a determinado/s dispositivo/s en una escala razonablemente extrapolable (como, por ejemplo, internacional, regional, sistema de salud), con el objetivo principal de mejorar la calidad asistencial del paciente |
| Definición de la U.S. Food and Drug Administration |
| Un registro es un sistema organizado que emplea métodos de estudio observacional para recopilar datos uniformes (clínicos y de otro tipo) para valorar los resultados específicos de una población definida por una enfermedad, patología o exposición determinada y que sirve uno o más propósitos científicos, clínicos o políticos predefinidos |
| Definición de de la Agencia Europea de Medicamentos (EMA) «Registro de pacientes» |
| Un sistema organizado que recopila datos uniformes (clínicos y de otro tipo) para identificar los resultados específicos de una población definida por una enfermedad, patología o exposición determinada. El término «paciente» resalta el enfoque del registro en la información de salud. Está ampliamente definido y puede incluir pacientes con una determinada enfermedad, mujeres embarazadas o lactantes o individuos con otras patologías, como defectos en el nacimiento o con características moleculares o genómicas |
| Elementos de una definición común de registro clínico del EU-MDR Cardiovascular Collaboratory |
| Sistema organizado |
| Recopila datos uniformes (de manera continua y consistente) (clínicos y de otro tipo) |
| Valora resultados especificados (significativos) |
| Población definida por una enfermedad, patología o exposición |
| Perspectivas del EU-MCVC sobre el tamaño de los registros clínicos |
| Registro clínico unicéntrico frente a multicéntrico |
| Registro clínico nacional integral (todos los centros) frente a no integral (centros seleccionados) |
| Registro clínico internacional integral (todos los centros) frente a no integral (centros seleccionados) |
| Redes de registros clínicos (varios registros fusionando bases de datos independientes a nivel del paciente o del registro) |
Cuando se habla de los requisitos del EU-MDR, una población se define por la exposición a un dispositivo específico, lo cual tiene importantes consecuencias para el establecimiento de plataformas de registro en Europa. La EMA define, al menos, 3 categorías de registros que, en circunstancias ideales, podrían estar interconectadas. En primer lugar, la EMA define los registros de enfermedades como aquellos registros de pacientes cuyos participantes están definidos por una enfermedad específica o características asociadas a la enfermedad, con independencia de su exposición a los tratamientos. Los registros de enfermedades son meramente observacionales. En segundo lugar, la EMA define los estudios basados en registros como la investigación de una cuestión en materia de investigación utilizando una población de pacientes dentro de un registro de pacientes. La interpretación del EU-MCVC es que esto alude a intervenciones de investigación o cuando la investigación clínica requiere intervenciones adicionales invasivas o complicadas o bien reglas de seguimiento. Lo ideal sería definir los análisis puramente observacionales o descriptivos bajo el paraguas de los registros de enfermedades. En tercer lugar, la EMA hace referencia a los registros de productos o dispositivos, que se suelen aplican a estudios PMCF. Los estudios PMCF deben cumplir la normativa que se aplica a los ensayos clínicos tradicionales (como, por ejemplo, a los estudios de un único grupo) en virtud del MDR, a menos que no se incorporen intervenciones adicionales invasivas o gravosas en el protocolo del registro.
El desarrollo de registros clínicos sostenibles podría mejorar la calidad asistencial dispensada, abaratar los costes y proporcionar un acceso más rápido a mejores tratamientos. La figura 1 ofrece un marco conceptual para la implementación de un registro clínico.
Figura 1. Marco conceptual para la implementación de un registro clínico. La fase 1 requiere fijar un marco legal y científico, así como también acordar y diseñar la distribución general de las tareas a realizar entre los colaboradores implicados. La fase 2 aborda el diseño e implementación del registro prestándose la mayor atención posible a los requisitos y calidad de los datos como común denominador. La fase 3 presenta actividades opcionales que pueden ser proporcionadas por partes independientes para aumentar la consistencia, calidad y confiabilidad a largo plazo. La fase 4 debe estar siempre lista y documentada cuando se esperan resultados. Todas las fases deberán ser debatidas e implementadas simultáneamente pues el producto final requiere la evaluación de estos 20 componentes. La documentación detallada, por escrito, de los acuerdos alcanzados debe obrar en poder del comité ejecutivo del registro. Todos los componentes de las fases 1, 2 y 4 son obligatorios y los de la fase 3, opcionales.
Antecedentes del utópico diseño de pacientes no seleccionados y de cómo los registros podrían ser la respuesta
Los ensayos controlados aleatorizados (ECA) son el patrón oro para valorar la seguridad y eficacia de las intervenciones médicas, ya que, por diseño, eliminan tantos factores de confusión como sea posible. Los ECA son el estándar para llevar a cabo una valoración previa precomercialización y suelen seleccionar a una población estrecha mediante criterios de elegibilidad cuidadosamente seleccionados, lo cual acarrea 4 consecuencias: a) se evitan la mayoría de los factores de confusión y se logran las estimaciones más puras posibles de los «efectos del tratamiento»; b) unos criterios de elegibilidad estrictos pueden dificultar la inscripción de pacientes, requiriendo más centros y más tiempo para completar la inscripción, si bien estos estudios suelen requerir tamaños de muestra más pequeños; c) como la población está altamente seleccionada, la validez externa limitada de la estimación del efecto de la intervención precisará estudios posteriores en poblaciones más grandes, normalmente en un contexto de poscomercialización; d) el diseño permite, solo, información limitada sobre posibles efectos adversos raros.
Como posible solución a los desafíos 2 y 3 mencionados arriba, se introdujo el «diseño de pacientes no seleccionados», que se caracteriza por tener criterios de elegibilidad simples. Este abordaje facilita la inscripción de una población de pacientes más representativa. No obstante, en un ensayo que evaluó stents coronarios7, quedaron sin inscribir tras el cribado, al menos, el 50% de los pacientes elegibles. Las principales razones fueron el proceso de consentimiento informado (el 33% no firmó el formulario de consentimiento informado, el 19% se negó a dar su consentimiento) y el 27% no cumplía los criterios de elegibilidad. Además, los pacientes que quedaron sin inscribir tuvieron peores resultados. Estas observaciones se han ido reproduciendo en muchas publicaciones posteriores. Otros posibles problemas a tener en cuenta en el abordaje de pacientes no seleccionados son: a) la incorporación de factores de confusión no controlados que podrían llevar a una “dilución” del efecto del tratamiento (inicialmente diseñado para una población específica y seleccionada) y a un efecto nulo en una comparativa aleatoria; b) los investigadores suelen excluir las presentaciones más graves como la insuficiencia cardiaca o el shock cardiogénico. En este sentido, el abordaje de pacientes no seleccionados sigue siendo selectivo. La llegada de investigaciones basadas en registros ofrece una oportunidad única de recopilar datos sobre todos los pacientes, sobre todo, en estudios meramente observacionales, y de comprender mejor los resultados en todas las subpoblaciones, especialmente aquellas tradicionalmente excluidas de los ensayos clínicos. La opinión del EU-MCVC es que las poblaciones no seleccionadas no deben tenerse en cuenta para realizar comparativas aleatorizadas tempranas a menos que se espere que un dispositivo beneficie a una población no seleccionada. En cambio, si se espera que el efecto de una intervención se dé, principalmente, en un subgrupo de pacientes, dichos subgrupos se deben investigar primero antes de emplear el abordaje de pacientes no seleccionados como abordaje inicial.
Consentimiento informado
Los pacientes ingresados o registrados en un centro sanitario no siempre son conscientes de que sus datos clínicos pueden ser utilizados de muchas formas. No obstante, por lo general, supondrán que la función más importante de los datos médicos, en lo que les atañe a ellos personalmente, es permitir que los profesionales sanitarios les den la mejor atención posible para mejorar su bienestar, calidad y esperanza de vida. No obstante, en función de cómo sea la legislación en materia de cuidados médicos, otros usuarios de sus datos pueden ser las compañías de seguros, las bases de datos nacionales, organizaciones asociadas (como, por ejemplo, las redes hospitalarias) y las bases de datos de calidad asistencial.
Cuando se invita a pacientes a participar en ensayos clínicos tradicionales, estos han de ser informados, en detalle, de los objetivos del estudio, los posibles riesgos y beneficios asociados, las cargas o compromisos adicionales, así como de cualquier otra información potencialmente relevante. De conformidad con el Reglamento general de protección de datos de la UE, los pacientes no solo ha de dar, voluntariamente, su consentimiento informado para inscribirse en una investigación clínica, sino que también deben dar, voluntariamente, su permiso para cada uso específico de sus datos; permiso que pueden retirar en cualquier momento1. A efectos de los ensayos clínicos y registros de pacientes, los datos de los participantes suelen estar codificados o seudonimizados, lo cual garantiza que sus identificadores personales no se compartirán fuera del centro médico que les trata. El uso de datos personales codificados se hace de conformidad con los requisitos de privacidad establecidos en el mencionado Reglamento general de protección de datos de la UE.
La cuestión de si se requiere consentimiento informado para ins- cribir participantes en un registro de pacientes depende de si la recopilación de datos del registro forma o no parte del estándar de cuidados (por ejemplo, el registro de calidad) y se define en los términos y condiciones del centro o en virtud de si el registro está fuera del alcance del estándar de cuidados. En el primer caso, el registro puede formar parte de los registros de las historias clínicas del paciente y las condiciones institucionales y regulatorias nacionales pueden, asimismo, no exigir el consentimiento específico para el registro. En el segundo caso, los pacientes deben dar su consentimiento antes de formar parte de un registro de pacientes. El EU-MCVC recomienda, siempre, coordinarse con el comité de ética local para definir la necesidad de consentimiento informado en el contexto de un registro clínico.
Lo que se espera de los registros de pacientes es que, solo, sean observacionales. En el caso de estudios de registros intervencionistas (es decir, con una intervención experimental) o estudios observacionales con complicadas intervenciones invasivas adicionales o reglas de seguimiento, se suele aceptar que los pacientes deben ser invitados a participar y que han de firmar un formulario de consentimiento informado. Los registros puramente observacionales también pueden precisar dicho proceso de consentimiento informado según sus objetivos y requisitos a nivel regional y nacional. Un formulario de consentimiento informado para registros observacionales debe indicar claramente que todos los datos codificados recopilados puedan emplearse para múltiples análisis de datos observacionales (de ámbito local o en la base de datos completa del registro) para evitar que el paciente tenga que volver a dar su consentimiento. Los pacientes siempre tienen el derecho a retirar su consentimiento informado.
Registros clínicos cardiovasculares: la experiencia española
España tiene una larga tradición de recopilación de datos basada en registros en cardiología intervencionista bajo el lema «la unión hace la fuerza» procedentes de una población de más de 47 millones de personas8. Al ser uno de los registros de calidad en cardiología intervencionista más antiguos que existen en la actualidad, la comunidad cardiológica ha podido proporcionar datos impactantes basados en registros. Desde 1990 lleva publicándose ininterrumpidamente un registro de ámbito nacional en cardiología intervencionista que ha ido recopilando datos a través de extensas encuestas realizadas cada año y que reflejan el volumen de actividad y no datos de pacientes9,10. En este sentido, en materia de investigación, el valor de este registro es muy limitado.
Los registros de pacientes empezaron como una colaboración académica entre colegas que voluntariamente y sin financiación externa desarrollaron bases de datos comunes para recopilar datos sobre intervencionismo cardiovascular y resultados clínicos durante el seguimiento. Todo empezó en 2004 y ha evolucionado desde los registros unicéntricos hasta una red académica interactiva multimodal. Estas aportaciones voluntarias fueron reflejo de innumerables horas de entrada de datos estructurados y planes de seguimiento. Un ejemplo destacado es el artículo seminal publicado en 2008 sobre trombosis del stent entre 23.500 pacientes de 20 centros españoles11. Otros registros realizados en años posteriores dieron lugar a más de 10 publicaciones. Esta red empezó con registros observacionales para luego incluir estudios aleatorizados y registros intervencionistas gracias a la cada vez mayor colaboración internacional.
Reconociendo una clara tendencia hacia la investigación colaborativa en un contexto de enfermedades complejas y abordajes terapéuticos complejos, la red multimodal española ha evolucionado hacia la Fundación Educación y Promoción de la Investigación en Enfermedades Cardiovasculares (EPIC). Fundada en 2016, en la actualidad EPIC está inmersa en tareas de investigación académica, investigación patrocinada por la industria y estudios observacionales y cuenta con un historial de 47 proyectos, incluidos 11 PMCF y vigilancia poscomercialización en virtud del MDR. En la actualidad, cada registro se configura como un estudio clínico, siguiendo las normas tradicionales ISO14155:2020 e incorpora el consentimiento informado de los pacientes. En la actualidad, EPIC está ampliando sus capacidades en investigación regulatoria en colaboración con socios locales e internacionales. Los registros se financian a través de subvenciones nacionales o de la propia industria. Como organización independiente que es bajo la supervisión de cardiólogos intervencionistas, EPIC es la única plataforma de este tipo en España, ya que no existe ningún otro foro de registros nacionales que esté financiado por las autoridades sanitarias.
Registros clínicos cardiovasculares: la experiencia belga
Bélgica tiene condiciones muy favorables para la investigación basada en registros al contar con una población de más de 11 millones de personas. Se debe mencionar que es uno de los raros ejemplos donde la recopilación de datos de registros es obligatoria y se financia atendiendo a requisitos nacionales en materia de estándar de cuidados. No obstante, también ejemplifica los desafíos de gobernanza que implica abordar las 3 áreas principales de interés según la definición que da la U.S. Food and Drug Administration: científica, clínica y legislativa. El registro de cardiología intervencionista belga comenzó como una iniciativa impulsada por facultativos para valorar la efectividad de los tratamientos, las disparidades regionales y la adherencia a las guías clínicas a fin de mejorar los resultados de los pacientes y avanzar en el terreno de la investigación científica.
En 1996, el grupo de trabajo belga de cardiología intervencionista comenzó a recopilar un conjunto limitado de datos clínicos y procedimentales (vía fax), sin ningún rigor científico, como es el caso de otros registros de calidad asistencia. Desde 2006, la entrada de datos pasó a una base de datos alojada por la Sociedad Europea de Cardiología (ESC), pero siguió siendo propiedad y gestionada por el grupo de trabajo belga de cardiología intervencionista. En 2012, la base de datos del Registro electrónico de calidad de actos médicos, implantes y dispositivos (Qermid), alojada por las autoridades sanitarias, entró en vigor12. Completar todos los datos es obligatorio para que intervenciones y dispositivos puedan ser reembolsados, lo cual permite recopilar ~100% de todas las intervenciones que se realizan, si bien añade una nueva carga administrativa.
Aunque Qermid recopila datos en materia de legislación y calidad asistencial, en la actualidad, el registro no está liderado ni gestionado por la comunidad científica, lo cual ha generado una paradoja, en virtud de la cual, aunque se da la situación ideal (recopilación completa de datos), no se aprovecha lo suficiente la ventaja científica que da contar con una infraestructura tan valiosa. Tampoco cuenta con recursos dedicados para la entrada de datos online (algo que, en la actualidad, realizan médicos o asistentes) y, por si esto fuera poco, los datos no están suficientemente supervisados. No obstante, gracias al grupo de trabajo belga de cardiología intervencionista y Qermid, Bélgica lleva más de 27 años publicando métricas fiables, proporcionando datos del mundo real a nivel nacional sobre intervenciones complejas13 y describiendo elegantemente los efectos que ha tenido la pandemia de la COVID-1914.
Registros clínicos cardiovasculares: La experiencia sueca
El Registro sueco de angiografía y angioplastia coronaria SCAAR forma parte del sistema web sueco para la mejora y desarrollo de cuidados basados en la evidencia en cardiopatías evaluados según los tratamientos recomendados (SWEDEHEART) y está considerado el modelo a seguir por otros registros coronarios15. Se trata de un registro que fue fundado, a título voluntario, por médicos para mejorar la calidad asistencial. La recopilación de datos se lleva a cabo a nivel nacional, se requiere la entrada de datos para todas las intervenciones y, en la actualidad, el sistema sanitario soporta la infraestructura. No es de extrañar que Suecia maravillara a la comunidad cardiovascular con los primeros ECA basados en registros iniciados por investigadores, publicados en revistas de primer nivel16,17. Con una población de más de 10 millones de personas, los registros de calidad del SWEDEHEART incorporan más de 80.000 intervenciones anuales. La recopilación de datos incluye datos iniciales, de la intervención y de los resultados obtenidos, para un total de más de 300 variables. El registro SWEDEHEART tiene una alta tasa de adherencia por encima del 95% de coincidencia de datos cuando se realizan actividades de seguimiento15.
El registro SWEDEHEART presenta ciertas características que crean condiciones propicias. En primer lugar, todos los pacientes que reciben tratamiento hospitalario están incluidos en el registro. Aunque no se precisa el consentimiento informado del paciente para ingresar a dicho registro, si este decide abandonarlo, se le da la oportunidad de hacerlo. En segundo lugar, se emplea un identificador de paciente común que permite fusionar múltiples bases de datos a nivel nacional, lo cual amplía considerablemente el rango de disponibilidad de datos comparado con un registro hospitalario (tabla 2). Esto permite un seguimiento indefinido a menos que un paciente abandone el país; la infraestructura de gobernanza tiene en cuenta los 3 elementos citados anteriormente (científico, clínico o legislativo); en concreto, el proceso permite enviar feedback al personal, a la dirección, a los pacientes y al público en general.
Tabla 2. Bases de datos conectadas que conforman el SWEDEHEART
| Bases de datos específicas de patologías (por ejemplo, SCAAR para ICP) |
| Registros en la National Board of Health and Welfare |
| El registro nacional de causas de muerte |
| El registro nacional de pacientes (todos los códigos CIE, todos los ingresos desde 1987) |
| El registro sueco de fármacos recetados (todos los fármacos dispensados desde 2005) |
| Central Bureau of Statistics (estado civil, país de nacimiento, ingresos, nivel educativo) |
| La Swedish Social Insurance Agency (gestión de bajas por enfermedad) |
| Otros registros nacionales de calidad (alrededor de 100 en la actualidad) |
|
CIE: Clasificación Internacional de Enfermedades; ICP: intervención coronaria percu- tánea; SCAAR: Registro sueco de angiografía y angioplastia coronaria. |
Desde 2018, los estudios SCAAR/SWEDEHEART se emplean por la industria de dispositivos médicos para avalar informes en materia reguladora en un marco de seguimiento clínico continuo y de completitud de datos. Desde entonces, los estudios SCAAR/SWEDEHEART han avalado a la mayoría de las principales compañías de dispositivos de ICP con informes del MDR. La experiencia actual permite la elaboración de informes predefinidos a nivel de pacientes, dispositivos, subgrupos de pacientes (por ejemplo, adultos mayores, diabéticos) o lesiones (vasos pequeños, lesiones largas). Esta plataforma es especialmente útil para dispositivos que no se utilizan habitualmente (como dispositivos del tronco común izquierdo, stents pequeños). En la actualidad, el modelo SWEDEHEART se implementa en Europa gracias al programa EuroHeart impulsado por la ESC. Algunos países ya contaban con registros similares en diferentes plataformas, por lo que uno de los primeros pasos más importantes fue establecer normas de datos compartidos18.
Registros clínicos cardiovasculares: la experiencia islandesa
La población de Islandia está en torno a las 400.000 personas y cuenta con un centro de cardiología intervencionista en el Landspitali University Hospital (Reikiavik). Este centro viene realizando aportaciones al SCAAR/SWEDEHEART desde 2008 mediante la recopilación prospectiva de datos. Como experiencia unicéntrica y fuera de Suecia, la Dra. Guðmundsdóttir confirma que la recopilación de datos en la base de datos de SCAAR es eficiente en el tiempo y se ve, ya, como parte integral de las historias clínicas de los pacientes. Tanto el médico tratante como las enfermeras de la sala de hemodinámica introducen los datos del paciente y de la intervención en el mismo momento en que se realiza esta, lo cual es preciso y eficiente en el tiempo, dado el abordaje simplificado en materia de recopilación de datos. El registro incluye a todos los pacientes tratados, permite valorar la calidad asistencial y es una vía abierta a la participación en ensayos clínicos multicéntricos basados en registros. El registro permite un acceso fácil a todos los datos islandeses para la investigación de ámbito local y el control de calidad. No obstante, todavía quedan desafíos a los que enfrentarse: a) las bases de datos islandesas no están integradas como en el caso sueco (tabla 2) y b) tanto la entrada de datos como el intercambio de estos tienen cierta complejidad. Como la entrada rutinaria de datos en el registro se considera parte de los cuidados del paciente, no se requiere el consentimiento informado. No obstante, en el caso de estudios basados en registros, sí se requiere la aprobación del comité de ética y la obtención del formulario de consentimiento informado firmado por cada participante. Aunque Islandia colabora en el programa EuroHeart proporcionando datos, en la actualidad, no utiliza la plataforma EuroHeart.
Registros clínicos cardiovasculares: la experiencia de Leiden con un banco de datos de imágenes no invasivas
Leiden University fue fundada en 1575 y es la universidad más antigua de Países Bajos. Su facultad de medicina está muy implicada en innovación y desarrollo y colabora con organizaciones tanto de ámbito local como internacional. Su departamento de cardiología no es una excepción y colabora con 18 países en materia de investigación, programas de doctorado y formación de posgrado. En este contexto, y gracias a una infraestructura y liderazgo muy acertados, en el año 2000 se estableció prospectivamente un potente banco de datos de imágenes no invasivas que ha ido recopilando datos retrospectivos desde 1990. Gracias al uso de protocolos de adquisición estandarizados basados en las trayectorias de asistencia médica (por ejemplo, en la enfermedad o patología del paciente) y esfuerzos de análisis dedicados (impulsados por el infatigable trabajo de becarios de investigación y profesores), Leiden ha logrado ofrecer a la comunidad científica mundial una mejor comprensión de la historia natural de la enfermedad, identificado poblaciones de mayor riesgo e informado sobre el diseño de ensayos clínicos.
La experiencia de Leiden nos deja 5 lecciones importantes: a) cada centro recopila una gran cantidad de datos que, si se utilizan adecuadamente, pueden cambiar nuestra comprensión de la enfermedad y su manejo; b) se requieren metodologías de adquisición y análisis consistentes para la realización de comparativas de datos a lo largo del tiempo. Así, al dedicar tiempo a una buena adquisición de datos, se facilitarán futuros esfuerzos; c) para analizar convenientemente estas enormes bases de datos, se necesitan innumerables horas, lo cual posibilitan programas de doctorado bien organizados; y d) la colaboración entre los registros de imágenes internacionales es especialmente valiosa en el caso de enfermedades menos prevalentes y más productiva cuando se seleccionan buenos centros con un alto volumen de casos, se establecen evaluaciones estandarizadas, las bases de datos están bien organizadas, hay profesionales comprometidos listos para crecer en sus respectivas carreras académicas y la integración de técnicas de imágenes multimodales crea mejores perspectivas para poder responder preguntas clínicamente relevantes. Algunos de estos ejemplos son la experiencia de Leiden con la estenosis aórtica moderada, la valvulopatía aórtica bicúspide y el infarto agudo de miocardio19-21.
Registros clínicos cardiovasculares: perspectiva del European Cardiovascular Research Institute-Cardialysis
El European Cardiovascular Research Institute es una fundación que reúne a una comunidad de destacados investigadores clínicos y socios del sector público/privado para realizar investigaciones clínicas que mejoren la asistencia cardiovascular. Desde 2012, este instituto viene realizando algunos de los ensayos en cardiología intervencionista más ambiciosos de Europa con la inscripción de casi 30.000 participantes y proporcionando datos de alta calidad que han tenido su eco en las guías clínicas de todo el mundo. Como organización de investigación académica que es, el European Cardiovascular Research Institute colabora con Cardialysis, un laboratorio central independiente de imágenes cardiacas orientado a la calidad y organización de investigación centrada en la cardiología. Cardialysis es la organización que más estudios en cardiología intervencionista ha realizado en Europa (más de 400 estudios completados en 40 años y un total de más de 200.000 pacientes inscritos)2. En este marco, desde 2021, Cardialysis viene experimentado una demanda creciente tanto de registros iniciados por la industria como por investigadores en los que es esencial desarrollar cierta concienciación y aceptación común de la calidad requerida para diversos fines tales como aprobación precomercialización, seguimiento poscomercialización, investigación científica, guías… Definir cómo avalar externamente las plataformas de registros con componentes de calidad específicos se ha convertido en una prioridad. El término «registros clínicos avalados externamente» se introdujo en el primer grupo de trabajo del EU-MCVC y alude a redes de registros que utilizan proveedores independientes para mejorar la calidad de los registros en función de los objetivos.
Una llamada a la calidad y participación de las partes interesadas
La cardiología se caracteriza por tener unos estándares muy altos en investigación clínica. La mayoría de las preguntas en materia de investigación en cardiología son comparativas binarias simples. No obstante, la riqueza de información necesaria para planificar una comparativa binaria adecuada acarrea una alta complejidad y requiere de la participación de expertos en varias disciplinas y con conocimientos distintos. Por esta razón, fijar los estándares a seguir se ha convertido en un catalizador efectivo para la innovación. Estos estándares comienzan con los requisitos de las agencias reguladoras3-6 y siguen con las definiciones y principios que dictan el diseño de los ensayos22 pasando por elementos de datos estándar, metodologías estándar y terminan con un proceso estándar de participación de los datos obtenidos. Los ensayos clínicos fallidos que cuentan con las herramientas estadísticas necesarias siguen siendo una característica habitual dentro del contexto de los ensayos clínicos ya que los dispositivos o las estrategias que parecían prometedoras en los ensayos iniciales con un número limitado de pacientes, a veces, tienen datos confirmatorios contradictorios en posteriores ensayos más extensos. Según el criterio del EU-MCVC, los ensayos confirmatorios deben realizarse empleando estándares de alta calidad. Los componentes metodológicos que aportan calidad a una investigación clínica se muestran en la tabla 3.
Tabla 3. Componentes metodológicos que añaden calidad a las investigaciones clínicas cardiovasculares
| Diseño del estudio y desarrollo del protocolo según los estándares internacionales (ISO 14155) |
| Uso de definiciones estándar (definiciones del ARC) |
| Comités de expertos independientes y sin conflicto de intereses (comités directivos, comités de eventos clínicos, juntas de vigilancia de datos y seguridad) |
| Laboratorios centrales de imágenes cardiacas independientes y sin conflictos |
| Selección adecuada de centros (infraestructura de investigación óptima) |
| Vigilancia de centros independiente y sin conflicto de intereses, incluida la verificación de datos (integridad, precisión) |
| Codificación consistente de las reacciones adversas (MedDRA) |
| Sistema electrónico de recopilación de datos conforme a la legislación vigente |
| Plan de análisis estadístico y estrategia de publicación predefinida |
| Informes estadísticos independientes o validación estadística independiente |
| Uso adecuado en tiempo y forma de bases de datos públicas (ClinicalTrials.gov) |
| Garantía consistente de calidad en cumplimiento de la legislación vigente y auditorías de los centros |
| Informes de estudios clínicos conforme a estándares internacionales (ISO 14155) |
|
ARC: Academic Research Consortium; ISO: Organización Internacional de Normalización; MedDRA: Diccionario Médico para Actividades Reguladoras. |
En una reciente revisión sistemática, Coordinating Research and Evidence for Medical Devices (CORE-MD), publicó los resultados de su estudio de los 11 registros europeos que existen en la actualidad, sobre stents coronarios y terapias valvulares percutáneas23. Concluyeron que existen una amplia heterogeneidad y una incompleta transparencia pública tanto en la estructura como en los métodos, así como una necesidad de crear un conjunto mínimo de criterios de calidad. Informaron que, de media, los criterios de calidad y completitud de los datos se cumplían en menos del 20% de los registros y que los datos de seguridad y rendimiento se abordaban como es debido en menos del 30%. Esta información viene a confirmar que la prioridad sigue siendo mejorar la calidad de la recopilación de datos y que se deben desarrollar métricas ampliamente aceptadas.
Algo que requiere más investigación es la necesidad y el valor relativo de las actividades de seguimiento y auditorías in situ en el contexto de los registros clínicos. Aunque los mecanismos automatizados y centralizados de seguimiento de datos pueden fomentar la eficiencia, todavía se desconoce cuál es el efecto que tienen las visitas de seguimiento in situ sobre la completitud y calidad de los datos. En líneas generales, el seguimiento in situ se viene empleando en registros de dispositivos impulsados por patrocinadores, no así en registros de pacientes impulsados por la comunidad académica.
Mejoras en la calidad de los registros clínicos tradicionales
Análisis independientes en laboratorios centrales
Establecer un laboratorio central independiente para un ensayo clínico aumenta la calidad abordando los siguientes requisitos de calidad: a) optimizando la calidad de las imágenes mediante el desarrollo de un protocolo uniforme de obtención de imágenes para todos los centros participantes. La adherencia al protocolo de obtención podría requerir confirmación de que se estudió (o recibió formación) el protocolo de obtención de imágenes y se proporcionó una prueba para confirmar el cumplimiento de este; b) garantizando que los datos se traten de manera consistente (por ejemplo, a través de seudonimización, estándares adecuados de privacidad y seguridad, un formato adecuado, software de análisis consistente); c) garantizando que los datos se analicen de consistentemente (por ejemplo, a través de metodología estándar, valoraciones reproducibles, personal debidamente capacitado); d) garantizando que la adjudicación de datos sea consistente (por ejemplo, la gravedad de la insuficiencia) y e) disponibilidad central de los conjuntos de datos originales para auditorías regulatorias24.
Tanto las mediciones como las valoraciones de las imágenes obtenidas a partir de datos del mundo real (por ejemplo, facilitadas in situ) no cumplirán los requisitos de calidad mencionados en el párrafo anterior al estar asociados a una mayor variabilidad en las valoraciones, así como a un mayor riesgo de sesgo por parte del investigador. A efectos de la investigación académica, pueden abordarse los requisitos 1 y 4 señalados en el párrafo anterior siendo aceptable la ausencia del resto siempre y cuando los datos de imágenes no salgan del centro tratante. No obstante, a efectos de los ensayos regulatorios, los 5 requisitos son necesarios, sobre todo, si las imágenes son parte del objetivo primario o del principal mecanismo de acción del dispositivo en investigación. En el contexto de los registros clínicos poscomercialización, dado el gran número potencial de pacientes, se deben diseñar soluciones intermedias. La tabla 4 ilustra las diferencias entre un laboratorio central sujeto que cumple con la legislación vigente y un laboratorio central académico de ámbito local.
Tabla 4. Requisitos para laboratorios de imágenes académicos frente a los que cumplen con la legislación vigente
| Laboratorio de imágenes que cumple con la legislación vigentea | Laboratorio de imágenes académico de ámbito local | |
|---|---|---|
| Obtención de imágenes | ||
| Manual/protocolo de imágenes específico del estudio | Sí | No/Sía |
| Capacitación/calificación específica del personal del estudio | Sí | No/Sía |
| Recursos destinados a la obtención de imágenes | Sí | No/Sía |
| Gestión de los datos proporcionados por las imágenes | ||
| Anonimización de Información de Salud Protegida | Sí | Noc |
| Sistema seguro de transferencia electrónica de imágenes | Sí | Noc |
| Manejo adecuado del material y archivo | Sí | Noc |
| Manejo del feedback en materia de calidad y consultas | Sí | Noc |
| Análisis de imágenes | ||
| Metodología de análisis estandarizada (de conformidad con las guías, definiciones aceptadas, garantizando la viabilidad) | Sí | No/Síb |
| Estación de trabajo de imágenes dedicada | Sí | No/Síb |
| Lector principal - ecografista/analista de imágenes | Sí | No/Síb |
| Lectura adicional - experto/supervisor de imágenes | Sí | No/Síb |
| Capacitación/formación específica del personal | Sí | No |
| Pruebas de reproducibilidad | Sí | No |
| Base de datos de imágenes | ||
| Formulario electrónico de casos específico del estudio validado | Sí | No |
| Altos requisitos de entrada de datos (carga automática de hojas de cálculo y consultas, cumplimiento de la Parte 11, registro de auditoría) | Sí | No |
| Verificación de fuente de datos y control de calidad | Sí | No |
| Procedimiento de liberación de datos tras el cierre de la base de datos | Sí | No |
|
a Pamela Douglas JASE. b No en registros, pero posible en estudios académicos. c No aplicable a un estudio de ámbito local. |
||
Adjudicación independiente de objetivos
Contar con un comité de eventos clínicos (CEC) independiente aumenta la calidad al abordar los siguientes requisitos de calidad: a) adherencia a definiciones estándar para determinar y clasificar eventos adversos que potencialmente cumplen con la definición de objetivo de un determinado estudio. Contar con un comité de expertos en un ensayo también otorga consistencia a la hora de clasificar eventos complejos tales como infarto de miocardio perioperatorios e insuficiencias cardiacas; b) garantizar que las valoraciones se realicen empleando una cantidad similar de información (por ejemplo, una lista de verificación consistente de documentos y materiales gráficos necesarios a efectos de adjudicación); c) disponibilidad central de documentos fuente originales para auditorías regulatorias; y d) como las indicaciones de los dispositivos se basan, en gran medida, en objetivos primarios clínicos, es importante que el CEC demuestre ser un órgano independiente del fabricante de un determinado dispositivo y no tener ningún conflicto de intereses que pueda lastrarle a la hora de cabo las tareas consignadas25.
En el contexto de la aprobación precomercialización, el EU-MCVC considera que la presencia de un CEC independiente es necesaria por las 4 razones expuestas en el párrafo anterior. No obstante, en el marco de un registro cardiovascular, parece que los datos informados in situ, sobre todo, cuando el informe es completo y emplea definiciones estándar, podrían bastar desde una perspectiva de calidad. Desde el punto de vista científico, aún está por demostrar si los datos de resultados clínicos de los registros son suficientes sin el concurso de un CEC. Además, en el actual contexto de estudios aleatorizados basados en registros en materia regulatoria, en opinión del EU-MCVC, es necesario contar con un CEC y su uso y validez deberían explorarse prospectivamente.
En cualquier caso, la mortalidad por cualquier causa no suele necesitar adjudicación de objetivos, sobre todo, si el registro o estudio específico tiene acceso a bases de datos nacionales sobre mortalidad. Se desconoce si las subclasificaciones de muerte podrían documentarse de manera confiable utilizando datos informados in situ o si un CEC aporta un valor adicional. Otros objetivos sobre los cuales se está trabajando para aclarar si la adjudicación es o no beneficiosa son el infarto de miocardio y la revascularización, cuando se codifican como binarios (sí/no). En opinión del EU-MCVC, casi todos los demás objetivos (insuficiencia cardíaca, sangrado, subtipos de infarto de miocardio, trombosis del stent, accidente cerebrovascular, angina inestable, revascularización no programada) muestran una ventaja cuando se someten a adjudicación, aunque todavía hay que demostrar esto prospectivamente.
Un ejemplo de adjudicación de eventos clínicos en un ECA basado en registros es el estudio VALIDATE SWEDEHEART (Bivalirudina frente a monoterapia con heparina en infarto de miocardio), que fue una prueba de concepto de esta metodología26. También se están diseñando y probando innovadores abordajes de adjudicación para mantener la calidad y reducir costes. Por ejemplo, en el estudio DAPA-MI, solo se adjudicaron la muerte y la hospitalización por insuficiencia cardiaca, mientras que el infarto de miocardio, la revascularización y el accidente cerebrovascular se informaron in situ27. Se presentan ejemplos adicionales en la tabla 5.
Tabla 5. Uso de la adjudicación de objetivos en ensayos clínicos aleatorizados basados en registros
| Estudio | Objetivo | Adjudicación | Objetivos del registro | Disparador del evento | Recopilación de datos | Otra información |
|---|---|---|---|---|---|---|
| TASTE | Muerte por cualquier causa | No | Sí | ND | No | - |
| VALIDATE | MACE y sangrado mayor | Sí | ND | Informado por el propio centro | Sí, FECC y notas del hospital | - |
| DETOX | Muerte por cualquier causa | No | Sí | ND | No | - |
| iFR | MACE y sangrado mayor | Sí | ND | Informado por el propio centro | Sí, FECC y notas del hospital | Laboratorio central |
| HELP | Episodios hemorrágicos | ND | Sí | ND | Sí | - |
| REDUCE | Muerte por cualquier causa e IM | ND | Sí | ND | No | - |
| Full REVASC | IM y revascularización no programada | Sí | ND | SCAAR/Riks-HIA | Sí, FECC y notas del hospital | - |
| SPIRRIT | Muerte por cualquier causa y hospitalización por IC | Sí | Códigos ICD | Códigos ICD y registro de mortalidad | Sí, FECC y notas del hospital | Proceso de adjudicación simplificado |
| DAPA-MI | Muerte por cualquier causa y hospitalización por IC | Sí | ND | Informado por el propio centro | Sí, FECC y notas del hospital | - |
| INFINITY | Objetivo combinado orientado al dispositivo | Sí | ND | Informado por el propio centro | Sí, FECC y notas del hospital | Laboratorio central |
|
FECC: formulario electrónico de registro de casos clínicos; IC: insuficiencia cardiaca; ICD: Clasificación Internacional de Enfermedades; IM: infarto de miocardio; MACE: eventos cardiovasculares adversos mayores; Riks-HIA: Registro sueco de información y conocimiento sobre ingresos en unidades de cuidados intensivos cardiacos de Suecia; SCAAR: Registro sueco de angiografía y angioplastia coronaria. |
||||||
Análisis o validación estadística independiente
El estudio de bases de datos de ensayos apropiadas va más allá de la base de datos de análisis estadístico bloqueada e incluye una valoración exhaustiva del diseño de un ensayo o registro. Desde la perspectiva de un experto en estadística, se debe tener en cuenta el diseño del estudio, la selección de pacientes, la elección del comparador, el cumplimiento normativo, la descripción de los méto- dos estadísticos y, por último, tanto la valoración de los resultados per se como la consistencia de los hallazgos. La brecha de calidad de los datos entre el paradigma de la medicina basada en la evidencia y el paradigma de los datos del mundo real es evidente en la actualidad y esto es conceptualmente correcto por diseño, dado que los datos del mundo real aluden a datos recopilados rutinariamente diseñados con una menor granularidad y precisión que los datos de los ensayos clínicos. Cuando los datos del mundo real se usan a efectos regulatorios y normativos, estos deben cumplir los siguientes requisitos: a) las fuentes de datos han de ser de buena calidad; b) se espera validez interna y externa; c) consistencia entre las fuentes de datos; y d) los datos deberán ser adecuados y precisos. Los documentos en materia regulatoria que emplean datos del mundo real también deben informar sobre el ajuste de posibles factores de confusión, identificar los posibles sesgos de selección e información, describir cuál debe ser el manejo de los datos faltantes y ofrecer un análisis de datos robusto.
Los registros clínicos adecuadamente diseñados y avalados son muy ventajosos desde un punto de vista clínico, pues ofrecen una mejor comprensión de la historia natural de las enfermedades, una mejor caracterización de las poblaciones diana y la identificación de nuevas dianas terapéuticas. Los registros también ofrecen la posibilidad de introducir nuevos abordajes estadísticos para agrupar y analizar datos. Cuando hay datos de pacientes disponibles en un único registro, se deben emplear abordajes estadísticos tradicionales, teniendo en cuenta las limitaciones de los datos. Cuando solo hay disponibles datos de registro, se pueden implementar métodos meta-analíticos que pueden usarse en materia legislativa o para la toma de decisiones de salud pública, pero no para valorar la seguridad, eficacia ni efectividad de un dispositivo, algo que requiere la mayor granularidad de todas y que no proporcionan los datos meta-analíticos del registro.
Papel que juegan los registros clínicos en los comités europeos en materia de guías clínicas
El proceso de generación de evidencia que conduce a las recomendaciones de las guías clínicas europeas está bien establecido y sigue los estándares más sólidos. En este proceso, los ensayos clínicos aleatorizados controlados y dotados de las herramientas estadísticas necesarias son la mejor fuente de información para la toma de decisiones. En el mejor de los casos, una recomendación clase IA debería contar con más de un ensayo clínico confirmatorio adecuadamente potenciado o, como mínimo, un metanálisis realizado correctamente. A falta de ECA, no obstante, se emplean otras fuentes de datos que, en última instancia, contribuyen al proceso de toma de decisiones de un comité.
Con el objetivo de optimizar tanto la asistencia clínica como los resultados cardiovasculares, la ESC ha propuesto un abordaje metódico para el desarrollo de indicadores de calidad y, en colaboración con los registros europeos unificados para la evaluación de los cuidados cardiacos y posteriores ensayos aleatorizados (EuroHeart), ha propuesto una serie de estándares de datos para el síndrome coronario agudo y la ICP, el implante percutáneo de válvula aórtica, la insuficiencia cardiaca y la fibrilación auricular/ablación con catéter del flúter18. Se han adoptado rápidamente con la incorporación de 40.000 casos provenientes de una serie de datos individuales de participantes recopilados en 2022 en 7 países participantes. Este nuevo ecosistema está evolucionando rápidamente y promete dejar huella tanto en materia legislativa como en las prioridades de salud pública.
Las fortalezas existentes de los registros clínicos convenientemente planificados y avalados incluyen ser efectivos en recursos, ofrecer una alta representatividad, integrarse en la rutina clínica y un reclutamiento consecutivo no seleccionado. Este contexto, sobre todo tal y como lo ha implementado el SWEDEHEART, ha abonado el camino para ECA basados en registros que reducen la carga de trabajo, minimizan el sesgo seleccionado, brindan un mejor acceso para poder acometer investigaciones impulsadas por los propios investigadores y, recientemente, han abierto la puerta a la posibilidad de realizar ensayos multinacionales. La investigación continuada puede informar mejor tanto a la comunidad científica como a los comités que elaboran guías clínicas sobre el uso de los resultados de ECA basados en registros para la toma de decisiones, siendo su papel final la medicina basada en la evidencia. La tabla 6 ofrece una comparativa entre registros tradicionales, ECA basados en registros y ECA.
Tabla 6. Tabla comparativa sobre el papel que juegan los registros clínicos en la medicina basada en la evidencia
| Registros | Ensayos controlados aleatorizados basados en registros | Ensayos controlados aleatorizados tradicionales |
|---|---|---|
| Meramente observacionales No son aptos para avalar una conclusión sobre eficacia en materia científica |
Pragmáticos Valoración abierta de opciones terapéuticas habitualmente utilizadas |
Máximo nivel de evidencia científica Patrón oro para estudios comparativos |
| De pacientes no seleccionados – representatividad Proporcionan datos para calcular la potencia estadística Resultados significativos a nivel clínico Eventos poco habituales |
De pacientes no seleccionados – representatividad Proporciona información sobre las características y el seguimiento de los pacientes |
Selección de pacientes elegibles Obtención del consentimiento informado Aleatorización del tratamiento Control de los factores de confusión Detección y adjudicación de objetivos clínicos |
| Generadores de hipótesis | Inferencia causal Para valoración de tratamientos, estrategias o agentes farmacológicos en fase aguda Valoración de agentes farmacológicos para nuevas indicaciones |
Inferencia causal |
| Eficientes en recursos | Bajo coste | Intensos en recursos |
Limitaciones
La información presentada y las organizaciones representadas en este manuscrito se limitan a la experiencia de los participantes del think tank que se reunió en Róterdam el pasado 8 de septiembre de 2023 y describe las perspectivas de los coautores. Este no es un documento de consenso ni una revisión sistemática. No se recopiló ni representó información sobre otras organizaciones o países implicados en el desarrollo ni en la elaboración de registros de cardiología intervencionista. El EU-MCVC da la bienvenida a la participación voluntaria de otras organizaciones de investigación cardiovascular establecidas o sociedades de cardiología. La vía de contacto con el EU-MCVC es el autor para correspondencia.
CONCLUSIONES
El EU-MDR ha ido incrementando los requisitos en lo referente a las actividades de seguimiento poscomercialización que deben cumplir todos los fabricantes de dispositivos que comercializan dispositivos médicos en Europa. Los registros clínicos adecuadamente planificados y avalados tienen el potencial de abordar requisitos adicionales a través de la creación de marcos de colaboración. La calidad de los datos es una preocupación esencial y tanto los registros actuales como las futuras plataformas de registro deben incluir estrategias para optimizar la calidad de los datos a fin de cumplir con los requisitos en materia regulatoria. Este abordaje colaborativo tiene el potencial de mejorar la calidad asistencial, reducir los costes y permitir un acceso más rápido a tecnologías innovadoras. Los registros, redes, estándares e intervenciones existentes deben ser adoptados y empleados consistentemente. Los múltiples usos potenciales de la recopilación de datos basada en registros hacen que sea un área que merece una mayor y continua atención por todas las partes interesadas de la industria en materia de dispositivos médicos, con el objetivo conjunto de mejorar tanto el manejo como los resultados cardiovasculares.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No utilizada.
CONTRIBUCIÓN DE LOS AUTORES
E. Spitzer y J.G.P. Tijssen contribuyeron al inicio, diseño y planificación del estudio. E. Spitzer, J.M. de la Torre Hernández, I.J. Guðmundsdóttir, E. McFadden, C. Held, C. Hanet, E. Boersma, C.B. Ren, V. Delgado, D. Erlinge, A. Pérez de Prado, J. Bax y J.G.P. Tijssen contribuyeron aportando datos/presentaciones. E. Spitzer compiló y redactó el manuscrito cuya revisión y corrección corrió a cargo de J.M. de la Torre Hernández, I.J. Guðmundsdóttir, E. McFadden, C. Held, C. Hanet, E. Boersma, C.B. Ren, V. Delgado, D. Erlinge, A. Pérez de Prado, J. Bax y J.G.P. Tijssen. Todos los autores aprobaron la versión final del manuscrito.
CONFLICTO DE INTERESES
E. Spitzer declaró haber suscrito contratos institucionales por los que no recibe compensación directa con Boston Scientific, Cardiawave, Edwards Lifesciences, Medtronic, Shanghai Microport Medical Co Ltd, NVT GmBH, Pie Medical Imaging y Siemens Healthcare GmBH. C.B. Ren declaró haber suscrito contratos institucionales para la realización de análisis en laboratorios de ecocardiografía con Boston Scientific, Cardiawave, Edwards Lifesciences, NVT GmBH/Biosensores, por los que no ha recibido ninguna compensación personal. Por otro lado, declaró haber recibido honorarios como conferenciante de Abbott. V. Delgado declaró haber recibido honorarios como conferenciante de Edwards Lifesciences, GE Healthcare, Novartis y Philips y consultor de Edwards Lifesciences, Novo Nordisk y MSD. A. Pérez de Prado es presidente de Fundación EPIC. J.G.P. Tijssen es miembro de la junta directiva del European Cardiovascular Research Institute. Los demás autores no declararon ningún otro conflicto de intereses.
A. Pérez de Prado es editor asociado de REC: Interventional Cardiology. Se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito.
J.M. de la Torre Hernández es editor jefe de REC: Interventional Cardiology. Se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito.
REFERENCES
1. European Parliament and the Council of the European Union. Regulation (EU) 2017/745 of 5 April 2017 on medical devices, amending Directive 2001/83/EC, Regulation (EC) No 178/2002 and Regulation (EC) No 1223/2009 and repealing Council Directives 90/385/EEC and 93/42/EEC. Disponible en: https://eur-lex.europa.eu/eli/reg/2017/745/oj. Consultado 9 Ene 2024.
2. Spitzer E. Forty years of Cardialysis:a leading European cardiovascular research organization. REC:Interv Cardiol. 2023;5:250-253.
3. US Food &Drud Administration (FDA). Use of Real-World Evidence to Support Regulatory Decision-Making for Medical Devices:Guidance for Industry and Food and Drug Administration Staff. 2017. Disponible en: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/use-real-world-evidence-support-regulatory-decision-making-medical-devices. Consultado 9 Ene 2024.
4. European Medicines Agency (EMA). Patient Registry Initiative - Strategy and Mandate of the Cross-Committee Task Force. 2017. Disponible en: https://www.ema.europa.eu/en/documents/other/patient-registry-initiative-strategy-mandate-cross-committee-task-force_en.pdf. Consultado 9 Ene 2024.
5. European Medicines Agency (EMA). Guideline on Registry-based Studies. 2021. Disponible en: https://www.ema.europa.eu/en/guideline-registry-based-studies-scientific-guideline. Consultado 9 Ene 2024.
6. International Medical Device Regulators Forum (IMDRF). Tools for Assessing the Usability of Registries in Support of Regulatory Decision-Making. 2018. Disponible en: https://www.imdrf.org/documents/tools-assessing-usability-registries-support-regulatory-decision-making. Consultado 9 Ene 2024.
7. de Boer SP, Lenzen MJ, Oemrawsingh RM, et al. Evaluating the 'all-comers'design:a comparison of participants in two 'all-comers'PCI trials with non-participants. Eur Heart J. 2011;32:2161-2167.
8. Jurado-Roman A, Freixa X, Cid B, et al. Spanish cardiac catheterization and coronary intervention registry. 32nd official report of the Interventional Cardiology Association of the Spanish Society of Cardiology (1990-2022). Rev Esp Cardiol. 2023;76:1021-1031.
9. Biswas S, Lefkovits J, Liew D, Gale CP, Reid CM, Stub D. Characteristics of national and major regional percutaneous coronary intervention registries:a structured literature review. EuroIntervention. 2018;14:1112-1120.
10. Freixa X, Jurado-Roman A, Cid B, Cruz-Gonzalez I. Spanish cardiac catheterization and coronary intervention registry. 31st official report of the Interventional Cardiology Association of the Spanish Society of Cardiology (1990-2021). Rev Esp Cardiol. 2022;75:1040-1049.
11. de la Torre-Hernández JM, Alfonso F, Hernandez F, et al. Drug-eluting stent thrombosis:results from the multicenter Spanish registry ESTROFA (Estudio ESpanol sobre TROmbosis de stents FArmacoactivos). J Am Coll Cardiol. 2008;51:986-90.
12. Hanet C, Claeys MJ, Carlier M, Desmet W. Quality assessment in percutaneous coronary interventions:the QERMID Belgian PCI registry. Acta Cardiol. 2018;73:388-391.
13. Kayaert P, Coeman M, Demolder A, et al. Mortality in STEMI Patients With Cardiogenic Shock:Results From a Nationwide PCI Registry and Focus on Left Main PCI. J Invasive Cardiol. 2022;34:E142-E148.
14. Claeys MJ, Argacha JF, Collart P, et al. Impact of COVID-19-related public containment measures on the ST elevation myocardial infarction epidemic in Belgium:a nationwide, serial, cross-sectional study. Acta Cardiol. 2021;76:863-869.
15. Jernberg T, Attebring MF, Hambraeus K, et al. The Swedish Web-system for enhancement and development of evidence-based care in heart disease evaluated according to recommended therapies (SWEDEHEART). Heart. 2010;96:1617-21.
16. Erlinge D, Omerovic E, Frobert O, et al. Bivalirudin versus Heparin Monotherapy in Myocardial Infarction. N Engl J Med. 2017;377:1132-1142.
17. Frobert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med. 2013;369:1587-1597.
18. Batra G, Aktaa S, Wallentin L, et al. Methodology for the development of international clinical data standards for common cardiovascular conditions:European Unified Registries for Heart Care Evaluation and Randomised Trials (EuroHeart). Eur Heart J Qual Care Clin Outcomes. 2023;9:161-168.
19. Butcher SC, Prevedello F, Fortuni F, et al. Prevalence and Prognostic Implications of Moderate or Severe Mitral Regurgitation in Patients with Bicuspid Aortic Valve. J Am Soc Echocardiogr. 2023;36:402-410.
20. Laenens D, Stassen J, Galloo X, et al. The impact of atrial fibrillation on prognosis in aortic stenosis. Eur Heart J Qual Care Clin Outcomes. 2023;9:778-784.
21. Nabeta T, Meucci MC, Westenberg JJM, et al. Prognostic implications of left ventricular inward displacement assessed by cardiac magnetic resonance imaging in patients with myocardial infarction. Int J Cardiovasc Imaging. 2023;39:1525-1533.
22. Spitzer E, McFadden E, Vranckx P, et al. Critical Appraisal of Contemporary Clinical Endpoint Definitions in Coronary Intervention Trials:A Guidance Document. JACC Cardiovasc Interv. 2019;12:805-819.
23. Hoogervorst LA, Geurkink TH, Lubbeke A, et al. Quality and Utility of European Cardiovascular and Orthopaedic Registries for the Regulatory Evaluation of Medical Device Safety and Performance Across the Implant Lifecycle:A Systematic Review. Int J Health Policy Manag. 2023;12:7648.
24. Douglas PS, DeCara JM, Devereux RB, et al. Echocardiographic imaging in clinical trials:American Society of Echocardiography Standards for echocardiography core laboratories:endorsed by the American College of Cardiology Foundation. J Am Soc Echocardiogr. 2009;22:755-765.
25. Spitzer E, Fanaroff AC, Gibson CM, et al. Independence of clinical events committees:A consensus statement from clinical research organizations. Am Heart J. 2022;248:120-129.
26. Erlinge D, Koul S, Eriksson P, et al. Bivalirudin versus heparin in non-ST and ST-segment elevation myocardial infarction-a registry-based randomized clinical trial in the SWEDEHEART registry (the VALIDATE-SWEDEHEART trial). Am Heart J. 2016;175:36-46.
27. James S, Erlinge D, Storey RF, et al. Rationale and design of the DAPA-MI trial:Dapagliflozin in patients without diabetes mellitus with acute myocardial infarction. Am Heart J. 2023;266:188-197.

RESUMEN
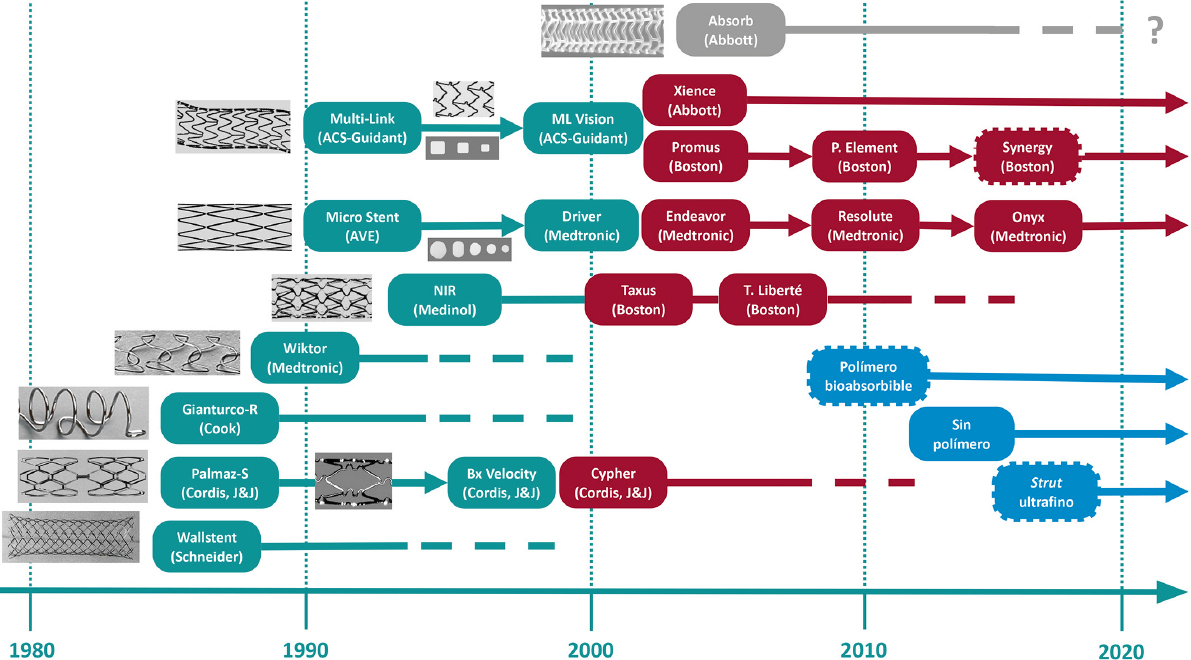
Todo cardiólogo debe realizar un viaje atrás en la historia para entender el estado actual de su especialidad. El stent coronario es uno de los logros más importantes de la investigación y de la ingeniería biomédica del último siglo. Su tecnología ha ido evolucionando e incorporando mejoras sustanciales que hoy en día hacen de este dispositivo un estándar de gran calidad para el tratamiento de la enfermedad coronaria. En este artículo se resume la historia del stent coronario desde su génesis hasta el presente. Se repasan los hitos históricos y científicos más remarcables que contribuyeron a hacer de la angioplastia percutánea un procedimiento seguro y altamente efectivo gracias al stent coronario. La evolución del stent ha ido de la mano del crecimiento y la maduración de la cardiología intervencionista.
Palabras clave: Stent. Stent liberador de fármaco. Angioplastia coronaria transluminal percutánea.
ABSTRACT
All cardiologists should delve into history to understand the current state of the art of their specialty. In the last century, the coronary stent was a pivotal achievement of research and biotechnological engineering. Since then, technology has advanced, and substantial improvements have been incorporated into this device, which has become the gold standard for treating coronary artery disease. This article summarizes the history of the coronary stent from its inception to the present day. The document reviews key historical and scientific milestones that have contributed to making percutaneous angioplasty a safe and highly effective procedure due to coronary stents. The evolution of the stent has been closely linked to the growth and maturation of interventional cardiology to date.
Keywords: Stent. Drug-eluting stent. Percutaneous transluminal coronary angioplasty.
CONCEPCIÓN Y DESARROLLO DE LA ANGIOPLASTIA CORONARIA (DÉCADAS DE 1970 Y 1980)
La cardiología intervencionista ha experimentado una espectacular evolución en las últimas décadas, que ha ido siempre al compás de la biotecnología. El desarrollo de los stents coronarios ha desempeñado un papel fundamental al haber permitido el asentamiento y la expansión de la angioplastia percutánea con fiabilidad. Los stents surgieron para resolver los problemas de la angioplastia coronaria percutánea con balón, que se evidenciaron durante los primeros pasos de esta. Por ello, conviene recordar cómo comenzó todo (tabla 1)1.
Tabla 1. Hitos en el desarrollo de la cardiología intervencionista
| Año | Hito |
|---|---|
| 1929 | Werner Forssmann realiza el primer cateterismo cardiaco transluminal |
| 1953 | Sven Seldinger emplea el acceso percutáneo |
| 1958 | Mason Sones realiza la primera angiografía coronaria (acceso braquial quirúrgico) |
| 1963 | Charles Dotter realiza la primera angioplastia arterial periférica |
| 1968 | Eberhard Zeitler expande la angioplastia periférica en Europa |
| 1968 | Melvin Judkins desarrolla la técnica de la coronariografía percutánea |
| 1977 | Andreas Grüntzig realiza la primera angioplastia coronaria percutánea con balón |
| 1979 | Geoffrey Hartzler realiza la primera angioplastia coronaria en infarto agudo de miocardio |
| 1986 | Jacques Puel implanta el primer stent coronario (Wallstent) |
| 1991 | Cannon y Roubin reportan el primer implante de stent en infarto agudo de miocardio |
| 1994 | Aprobación regulatoria del primer stent con base científica (Palmaz-Schatz) |
En los inicios de los años 1970, el tratamiento de la enfermedad coronaria se limitaba al uso de nitroglicerina y propranolol, escasas pruebas diagnósticas y muy pobre evidencia científica. Hasta entonces, eso sí, se habían producido algunos hitos importantes que sirvieron de precedente para dar el gran paso del tratamiento percutáneo1. Las coronariografías eran raramente indicadas, tan solo a pacientes con muchos síntomas y en vistas a un posible tratamiento con cirugía de puentes coronarios, que era la única modalidad de revascularización. Andreas Roland Grüntzig, radiólogo y cardiólogo alemán que desarrolló su carrera en Zúrich y luego en Atlanta, fue un personaje con una genialidad y un tesón particulares que le llevaron a desarrollar la técnica de la angioplastia con balón, superando el escepticismo y la oposición reinantes en su entorno. Habiendo recibido el legado de la angioplastia periférica de Charles Dotter a través de Eberhard Zeitler, se embarcó en el desarrollo del balón de angioplastia, aplicándolo primero a la enfermedad periférica en 1974 y luego dando el osado salto al árbol coronario en los humanos el 16 de septiembre de 19772.
Tras el éxito clínico inicial, se comenzaron a evidenciar las limitaciones de la técnica, en especial a medida que esta se expandió a diferentes escenarios clínicos y anatómicos. Preocupaban la oclusión aguda por la retracción elástica, la disección y la trombosis. Esto se traducía en infartos periprocedimiento, o en necesidad de cirugía cardiaca o de nueva angioplastia durante el seguimiento3. La restenosis era un fenómeno más tardío, pero su gran incidencia (20-40%) hacía que también supusiera un problema importante4. Para prevenir la retracción elástica y las disecciones oclusivas, se precisaba el mantenimiento de la fuerza radial ejercida por el balón de angioplastia, lo cual podría hacerlo una estructura protésica intraluminal.
LLEGADA Y APROBACIÓN DEL STENT CORONARIO (1980-1994)
El término stent es un anglicismo reconocido por la Real Academia Española5. Tiene un origen incierto, pero lo más aceptado es que se trata del epónimo del dentista británico Charles Thomas Stent (1807-1885), quien en 1856 patentó un material termoplástico para realizar impresiones dentarias, que denominó «pasta de Stent»6. Más adelante, cuando la patentada pasta de Stent dejó de emplearse, el término continuó aplicándose para el material protésico que podía suplir tejido biológico. Su uso se fue extendiendo para denominar también a las prótesis tubulares empleadas en cirugía hepatobiliar y en urología6. Charles Dotter, pionero también en esto, reporta en 1969 su experiencia al insertar unas espirales metálicas en arterias de perros con la finalidad de demostrar que sería posible implantar un dispositivo de contención intraluminal7. No obstante, no fue hasta los años 1980, tras evidenciar las limitaciones de la angioplastia con balón, cuando se expandió la denominación de stent y se desarrolló con énfasis la tecnología de los dispositivos que conocemos hoy en día.
En 1980, el encuentro en Suiza entre dos suecos expatriados, Ake Senning, cirujano cardiotorácico que había sido valedor de Andreas Grüntzig, y el ingeniero Hans Wallsten, marcó el inicio de un proyecto exitoso que, con la colaboración del ingeniero francés Christian Imbert, acabaría dando a luz al primer stent para uso en arterias coronarias: el Wallstent. El término no era un epónimo del ingeniero, sino que derivaba de aplicar una próstesis (stent) sobre la pared de un vaso (wall)1. Se trataba de un mallado de filamentos de acero inoxidable con capacidad autoexpandible al ser liberado por un sistema (figura 1). Fundaron la compañía MedInvent (luego adquirida por Schneider, Suiza), buscaron investigadores para las pruebas del dispositivo y contactaron con Ulrich Sigwart (Lausanne) y Jacques Puel (Toulouse)1.
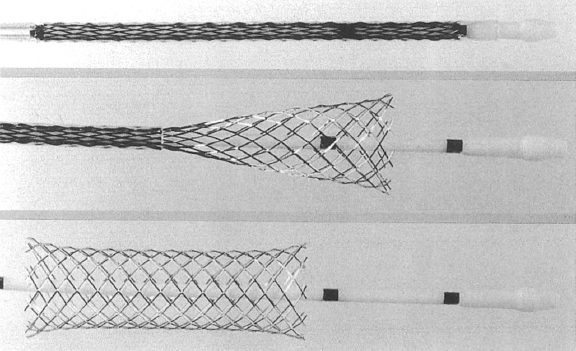
Figura 1. Stent autoexpandible Wallstent. Se muestra, de arriba abajo, el proceso de despliegue del dispositivo con el importante acortamiento longitudinal que se producía.
El protocolo de experimentación para el Wallstent comprendía primeramente su uso en animales, a continuación en arterias periféricas en humanos y finalmente en arterias coronarias de pacientes. El centro de Toulouse encontró menos dificultades para iniciar la experimentación animal y llegó antes a la prueba en humanos. Así, en diciembre de 1985, Hervé Rousseau y Francis Joffre, radiólogos del departamento de Jacques Puel en Toulouse, implantaron la primera endoprótesis periférica. Por su parte, Jacques Puel, en marzo de 1986, implantó la primera endoprótesis coronaria en un paciente que había presentado restenosis tras una angioplastia con balón en la descendente anterior1. En junio de ese mismo año, Ulrich Sigwart implantó la primera endoprótesis coronaria para el tratamiento de una disección aguda oclusiva en una descendente anterior proximal tras una angioplastia con balón; fue la primera vez que un paciente evitó la cirugía urgente por esta complicación1,8.
Más adelante, Sigwart se erigió como portavoz en la escena pública y en las publicaciones, quizás ayudado por su mejor dominio de la lengua inglesa1. En marzo de 1987 se publicó la primera descripción de la experiencia conjunta en The New England Journal of Medicine9. El trabajo reportó el implante de 24 stents coronarios en 19 pacientes para tratamiento de restenosis (n = 17), oclusión aguda tras angioplastia con balón (n = 4) o deterioro de bypass coronario (n = 3). Sigwart contó años después que la revista le solicitó no emplear el verbo stenting, pero sí el sustantivo stent para denominar al nuevo dispositivo10. Las experiencias multicéntricas iniciales con el Wallstent fueron lideradas por los centros de Toulouse, Laussane y Rotterdam. En 1991, Serruys et al.11 describieron el seguimiento de los primeros 105 pacientes tratados: la mortalidad fue del 7,6%, la incidencia de oclusión fue del 24% (mayoritariamente en las primeras 2 semanas) y la restenosis fue del 14-32% (según la definición considerada).
Paralelamente, al otro lado del océano, Julio Palmaz, un radiólogo intervencionista argentino afincado en los Estados Unidos, en 1977 asistía a las sesiones en vivo de Grüntzig y, al presenciar las complicaciones de la angioplastia, vio la oportunidad de desarrollar un dispositivo para prevenirlas. Diseñó su primer prototipo en la cocina de su casa con una pistola soldadora y alambre de cobre. Luego empleó acero inoxidable e inventó el primer stent expandible con balón, que implantó en aortas de perros1,12. Más adelante se trasladó a San Antonio (Tejas, Estados Unidos), donde pudo mejorar el dispositivo empleando máquinas de corte sobre tubos de acero13. Conoció a Richard Schatz, cardiólogo militar que le ayudó a adaptar el modelo para uso en arterias coronarias uniendo dos stents pequeños por un puente, mejorando así su flexibilidad y navegabilidad (figura 2). Tras reunir la inversión necesaria, iniciaron la compañía Expandable Grafts Partnership (después adquirida por Johnson & Johnson, Estados Unidos) para producir los prototipos y financiar la investigación12.
Figura 2. Stent expandible con balón Palmaz-Schatz (arriba) y PS 153 series (abajo), que consistía en 2 stents más cortos unidos por un puente con la finalidad de mejorar su flexibilidad y navegación.
Debido a las restricciones en el progreso de las investigaciones en los Estados Unidos, las primeras pruebas en humanos se realizaron en el extranjero1,12. En octubre de 1987, Julio Palmaz y Goetz Richter implantaron el primer stent Palmaz-Schatz en arterias periféricas en Freiburg, Alemania. A finales de ese mismo año, Palmaz, Schatz y Eduardo Sousa implantaron el primer stent Palmaz-Schatz en arterias coronarias en Sao Paulo, Brasil (21 meses después del primer Wallstent coronario). Lamentablemente para Julio Palmaz, el hito del primer implante de stent expandible con balón lo habían logrado 3 meses antes Gary Roubin y Spencer King III en Emory, Atlanta. Se trataba de una estructura de filamento metálico enrollado sobre un balón (figura 3), inventada por el radiólogo italiano Cesare Gianturco, que previamente había trabajado con Grüntzig. La Food and Drug Administration de los Estados Unidos aprobó el stent Gianturco-Roubin (Cook Medical Inc., Estados Unidos) en 1993, pero no el Palmaz-Schatz, al cual se le exigió la realización de dos ensayos clínicos aleatorizados, que se completaron y publicaron en 1994, y entonces logró la aprobación de la agencia1,12,14,15. Aquí repasamos estos dos importantes estudios que validaron científicamente el uso del stent en cardiología.
Figura 3. Stent expansible con balón Gianturco-Roubin, con formación espiroidea.
En el ensayo BENESTENT (Belgian Netherlands Stent), presentado por Serruys et al.15 en 1994, se aleatorizó a 520 pacientes con angina estable y enfermedad coronaria de 1 vaso para recibir tratamiento con angioplastia simple con balón o implante de un stent Palmaz-Schatz. Participaron 28 centros, en su gran mayoría europeos. Todos los pacientes recibieron ácido acetilsalicílico durante 6 meses, y si se les colocaba stent se añadía warfarina durante 3 meses. A los 7 meses, el tratamiento con stent redujo un 32% el combinado de eventos adversos, fundamentalmente a expensas de una menor incidencia de revascularización repetida. La restenosis binaria (≥ 50%) fue del 22% en el grupo de stent y del 32% en el grupo de balón (figura 4). La trombosis del stent sucedió en un 3,5% de los pacientes. Las complicaciones vasculares o hemorrágicas y la duración de la estancia hospitalaria fueron mayores en los pacientes tratados con stent. En el seguimiento a 1 año se mantuvo la reducción relativa del evento combinado en un 26% a favor del stent, con una incidencia de angioplastia repetida del 10 frente al 21% en el grupo de balón16.
Figura 4. Gráficas del estudio BENESTENT que muestran ganancia luminal aguda (A) y en el seguimiento (B). Se muestran también la distribución de frecuencias de restenosis (C) y la acumulación de eventos clínicos (D). (Reproducida con permiso de Serruys et al.15).
En el estudio STRESS (Stent Restenosis Study), reportado por Fischman et al.14 el mismo año, se aleatorizó a 410 pacientes procedentes de 20 centros, en su mayoría norteamericanos. El régimen antitrombótico incluía ácido acetilsalicílico indefinido para todos los pacientes y anticoagulación con warfarina durante 1 mes para aquellos que recibían el stent Palmaz-Schatz. A los 6 meses, la incidencia del combinado de eventos adversos fue similar (19,5% en el grupo de stent frente a 23,8% en el grupo de balón; p = 0,16), pero se observó una tendencia hacia una menor necesidad de revascularización repetida en el grupo de stent (10,2 frente a 15,4%; p = 0,06). La restenosis binaria también fue menor en los pacientes tratados con stent (32 frente a 42%; p < 0,05). La trombosis del stent ocurrió en el 3,4% (7/205) de los casos tratados por protocolo y en el 21,4% (3/14) de aquellos en los que el stent se empleó como rescate de la angioplastia (crossover). Nuevamente, las complicaciones vasculares o hemorrágicas, así como la duración de la estancia hospitalaria, fueron mayores en los pacientes tratados con stent. En el seguimiento cercano a 1 año se mantuvieron las diferencias numéricas a favor del stent, aunque sin significación estadística (revascularización no planeada: 12 frente a 17%; p = 0,09)17.
Finalmente, pese a los impedimentos y retrasos, el stent Palmaz-Schatz se acabó imponiendo como estándar de referencia durante un tiempo gracias a la evidencia que lo respaldaba, a su mayor seguridad y a su facilidad de uso. Los otros stents, a pesar de su importante expansión inicial, carecían del respaldo de estudios y preocupaba la incidencia de trombosis y restenosis. El stent Gianturco- Roubin se mostró inferior en estos aspectos frente al stent Palmaz-Schatz18, y el Wallstent tenía el problema del acortamiento longitudinal, la imprecisión en el implante y el compromiso de ramas laterales por su pequeño tamaño de celda. Todo esto influyó en que estos stents fueran siendo desplazados y gradualmente desaparecieran del mercado.
A partir de 1994, gracias a los estudios BENESTENT y STRESS, el uso del stent se expandió, pero aún existían dudas sobre si los costes generados por esta nueva intervención se traducirían en un beneficio significativo. Los estudios subsiguientes convencieron de la superioridad del stent frente a la angioplastia simple con balón en distintos escenarios. Hubo dos estudios importantes que mostraron el claro beneficio en términos de restenosis: en oclusiones crónicas (32 frente a 74%; p > 0,001) en 199619 y en enfermedad aislada de arteria descendente anterior proximal (19 frente a 40% a 12 meses; p = 0,02) en 199720. Por otro lado, se comparó la estrategia de angioplastia con stent frente a angioplastia con balón con posibilidad de rescate con stent, resultando favorecida la estrategia de empleo de stent en primera línea por beneficio clínico y balance de costes21. En el infarto agudo, el estudio Stent-PAMI sentó la indicación del uso de stent frente a la angioplastia con balón22.
PROGRESOS Y MODERNIZACIÓN DE LAS PLATAFORMAS (DÉCADA DE 1990)
Durante la década de 1990 se produjeron algunos avances importantes que repercutieron en la efectividad y la seguridad del stent (tabla 2)1, desde el uso de ultrasonido intravascular para optimizar el implante hasta los progresos en hemostasia y la expansión del acceso radial, que junto con el abandono de la anticoagulación en favor de la doble antiagregación disminuyeron las complicaciones hemorrágicas, tan evidentes en los ensayos BENESTENT y STRESS14,15. Por último, y no menos importante, las mejoras tecnológicas en la plataforma del stent fueron clave para generalizar este tratamiento.
Tabla 2. Avances de la angioplastia en la década de 1990
| Años | Avances | Resultados |
|---|---|---|
| 1989-1993 | Acceso radial para coronariografía y angioplastia coronaria | Inicios de la nueva era en acceso arterial mínimamente invasivo |
| 1993-1994 | Reducción del calibre de acceso a 6 Fr Cierres hemostáticos femorales | Reducción de la hospitalización y de las complicaciones hemorrágicas |
| 1994 | Publicación de los estudios BENESTENT15 y STRESS14 | El stent demuestra su efectividad en la angioplastia |
| El stent Palmaz-Schatz se consolida como referencia | ||
| Empleo de ecografía intravascular para la optimización del implante del stent | La expansión adecuada, gracias a una presión de implante elevada, conducía a mínima trombosis y menor restenosis | |
| 1995-1998 | Estudios con terapia antiplaquetaria doble | Minimización de la trombosis |
| Abandono de la anticoagulación oral | ||
| Reducción de las hemorragias | ||
| 1994-2000 | Mejoras del Palmaz-Schatz (Cordis) y aparición de nuevas plataformas modernas: Micro Stent (Arterial Vascular Engineering), Multi-Link (Advanced Cardiovascular Systems), etc. | Expansión de la indicación de la angioplastia con stent |
| Se impone el stent tubular o modular frente a los autoexpandibles y helicoidales |
Los stents iniciales tenían carencias técnicas evidentes que requerían ser resueltas para poder ampliar este tratamiento a distintos escenarios anatómicos (tortuosidades, bifurcaciones y lesiones calcificadas). Por iniciativa de los propios intervencionistas, se propuso la posibilidad de cortar el stent de Palmaz-Schatz por el puente articulado con el fin de disponer de un stent corto («Palmaz desarticulado» o «hemi-Palmaz») para lesiones cortas y que tuvieran un acceso anatómico más difícil23. Sin embargo, fue la incorporación de la tecnología de corte láser lo que trajo la innovación en el diseño de los stents. Cordis, compañía de Johnson & Johnson (Estados Unidos), mejoró la plataforma del Palmaz-Schatz creando el Spiral y luego el Crown24 (figura 5). Posteriormente evolucionaría hacia el Bx Velocity, un stent también de diseño tubular (tubo cortado a láser), pero con anillos en zigzag y conectores ondulados que permitían una mayor flexibilidad, aunque seguía manteniendo el diseño de celda cerrada (conectores en todos los ángulos de infle- xión de los anillos) que limitaba su navegación en curvas (figura 5). A partir de la plataforma del Bx Velocity, Cordis lanzó el primer stent farmacoactivo de la historia: el Cypher12.
Figura 5. Stents de Cordis: evolución de la plataforma del Palmaz-Schatz, desde el articulado PS 153 series (arriba), pasando por el Crown (centro), hasta la plataforma Bx Velocity (abajo).
En 1990, Medtronic Inc. (Estados Unidos) creó el Wiktor, un stent de filamento en espiral expandible con balón similar al Gianturco-Roubin, pero hecho de tántalo, más radiopaco (figura 6). Sin embargo, su fragilidad y su débil fuerza radial hicieron que fuera superado por las nuevas plataformas y finalmente fue retirado24. En torno a 1994, la compañía Arterial Vascular Engineering (AVE; Estados Unidos) lanzó el Micro Stent, un stent con un diseño modular consistente en un filamento redondo de acero que se curvaba con ángulos suavizados conformando anillos que luego se unían con soldaduras en vértices alternos formando celdas abiertas; todo ello mejoraba su flexibilidad y navegación, sin perder fuerza radial24. AVE fue adquirida por Medtronic en 1998. En las sucesivas iteraciones del Micro Stent (GFX, GFX2, S670, S7) se fue disminuyendo el grosor del strut (filamento que compone la malla del stent) y en 2002 se cambió el acero inoxidable por una aleación de cobalto y níquel en el stent Driver (figura 6). Ya bien entrado el siglo XXI, Medtronic empleó la plataforma del Driver para crear el stent farmacoactivo Endeavor. En 2010, la transición a la plataforma Integrity supuso usar un filamento continuo con forma sinusoidal, esta vez soldado con láser en múltiples puntos para proteger su integridad.
Figura 6. Stents de Medtronic y AVE: stent helicoidal Wiktor (A) y micro-stent modular AVE (B), con sus versiones GFX2 (C) y Driver (D). El diagrama muestra el cambio del strut con las sucesivas plataformas. Se muestra la plataforma Integrity (E) con la tecnología de filamento continuo soldado con láser.
Por otro lado, Advanced Cardiovascular Systems (Estados Unidos), una compañía adquirida previamente por la división de dispositivos de Eli Lilly (Estados Unidos), luego Guidant, creó el stent Multi-Link, aprobado para su uso en Europa en 1995 y en los Estados Unidos en 1997. Se trataba de un stent de acero de diseño tubular con celda abierta. En este caso el strut era plano y con ángulos romos en los anillos24. Este diseño más moderno lo hizo muy competitivo y fue dominando el mercado junto al stent de AVE12. Guidant continuó mejorando la plataforma Multi-Link al adelgazar el strut, emplear conectores curvos y pasar a usar la aleación de cromo-cobalto en el modelo Vision (figura 7). El Multi-Link Rx (strut de 50 μm) demostró superioridad frente al stent Bx Velocity (strut de 140 μm) en términos de restenosis a 12 meses en el estudio ISAR-STEREO-2 (18 frente a 31%; p < 0,001)25, lo cual demostró la importancia del grosor del strut en el daño de la pared del vaso y la aparición de restenosis. La plataforma Multi-Link de cromo-cobalto sirvió posteriormente de base para los stents farmacoactivos Xience V (Abbott Vascular, Estados Unidos) y Promus (Boston Scientific, Estados Unidos).
Figura 7. Stents de ACS-Guidant. Plataforma Multi-link en sus sucesivas versiones con modificaciones en la celda y en los conectores.
El stent NIR, de Medinol (Israel), distribuido por Boston Scientific, era un stent de acero inoxidable de celda cerrada con un diseño que permitía flexibilidad en la navegación, pero que una vez expandido su geometría de celda le confería gran rigidez y, por lo tanto, fuerza radial24 (figura 8). Esta plataforma sirvió para el primer stent farmacoactivo de paclitaxel, el Taxus, lanzado por Boston Scientific en 2003. A finales de los años 1990, Boston Scientific, que había distribuido el Wallstent y el NIR, desarrolló y comercializó sus propios stents, el Express y el Veriflex/Liberté, que también servirían para las siguientes versiones del Taxus (figura 8).
Figura 8. Plataformas empleadas por Boston para desarrollar el Taxus. Arriba se muestra el stent NIR de Medinol; abajo a la izquierda, la plataforma Express; y abajo a la derecha, la plataforma Veriflex que sirvió para el Taxus Liberté.
Muchos stents lanzados durante los años 1990 fueron comparados de acuerdo con sus características técnicas y mediante estudios de comparación directa, que en general ofrecieron datos equivalentes26. Tras esta revolución tecnológica vivida a finales de siglo, se podía concluir que los stents expandibles con balón de diseño tubular (Palmaz-Schatz y Multi-Link) y modular (Micro Stent) se habían impuesto frente a los autoexpandibles y a los helicoidales. Los avances de la angioplastia en esos años (tabla 2) posicionaron al stent como estándar de tratamiento percutáneo de la enfermedad coronaria. No obstante, la restenosis seguía siendo un inconveniente para el stent y para la angioplastia en general. La incidencia de restenosis había disminuido de un 30-40% con la angioplastia con balón a un 20-30% en los primeros estudios del stent Palmaz-Schatz14,15. Tras las sucesivas mejoras en las plataformas y las técnicas de implante, la restenosis se redujo, pero seguía cercana al 20% al año del implante27. Además, la ampliación del uso del stent a escenarios más complejos (injertos de safena, vaso pequeño, lesiones largas, etc.) hacía prever una incidencia de restenosis aún mayor. Afrontar este problema era el objetivo prioritario, lo que dio lugar a la siguiente revolución de la cardiología intervencionista con la llegada del siglo XXI.
DESAFIANDO LA RESTENOSIS EN EL SIGLO XXI: LA ERA DEL STENT FARMACOACTIVO
Una vez que el stent se generalizó, la restenosis y la trombosis fueron las complicaciones que había que comprender y tratar. Inicialmente se idearon los recubrimientos heparínicos para los stents en aras de evitar ambos procesos; mientras que parecían tener un efecto protector sobre la trombosis, su efecto sobre la restenosis era dudoso. El stent coronario supuso un avance claro para la angioplastia, pero la reacción vascular que producía llevaba a procesos inflamatorios sostenidos con crecimiento de tejido y pérdida luminal tardía28. Tras comprender que la restenosis ocurría principalmente por un mecanismo proliferativo de las células del músculo liso vascular29, los esfuerzos se centraron entonces en frenar ese proceso. La braquiterapia (administración transcatéter de radiación ionizante sobre la lesión) surgió precisamente para frenar esta respuesta proliferativa. Sin embargo, la dificultad de aplicación de esta terapia, junto con la aparición de trombosis muy tardía, en probable relación con la inhibición de la endotelización y la restenosis en los bordes del segmento radiado, frenaron su éxito30. Con todo esto, la atención se fue centrando en el desarrollo de fármacos antiproliferativos.
El sirolimus (rapamicina) es un agente antimicótico que se aisló por primera vez en 1965 en una bacteria hallada en Isla de Pascua (Chile)31. Es un inhibidor de la proteína mTOR (mammalian Target Of Rapamycin) con efecto antiproliferativo e inmunosupresor que había sido empleado en terapia oncológica y como tratamiento después del trasplante de órganos. Esta molécula fue seleccionada por el equipo investigador de Cordis para crear el primer stent farmacoactivo, el Cypher. El sirolimus se introdujo en un transportador (polímero) que recubría la superficie metálica del stent y permitía su liberación modulada al endotelio. Por otro lado, el paclitaxel, un antimitótico proveniente de la corteza del tejo, fue aislado por primera vez en 196732. Tiene un efecto citotóxico bloqueando el desensamblaje de los microtúbulos, interfiriendo en el ciclo celular y la mitosis. La compañía Boston Scientific lo seleccionó para crear la primera generación del stent Taxus, también con el fármaco embebido en un polímero transportador. Paralelamente, el paclitaxel se estaba empleando en el desarrollo de un balón liberador de fármaco por el grupo de Bruno Scheller y Ulrich Speck en Alemania, también con el objetivo de solucionar el problema de la restenosis33.
El primer implante de un stent farmacoactivo fue de un Cypher y tuvo lugar en diciembre de 1999 en Sao Paulo, Brasil. En el equipo se encontraban Eduardo Sousa y Patrick Serruys. La experiencia con los primeros 30 pacientes y su seguimiento al año, sin ningún caso de restenosis, marcó el inicio de una nueva era34. A esto le siguió el ensayo clínico RAVEL, en el que se aleatorizaron 238 pacientes para recibir Bx Velocity o Cypher. A los 6 meses, la pérdida luminal fue de 0,80 ± 0,53 mm con Bx Velocity y de –0,01 ± 0,33 mm con Cypher (p < 0,001), mientras que la restenosis binaria fue del 26,6% y del 0%, respectivamente (p < 0,001)35. Por otro lado, el estudio TAXUS II aleatorizó a 536 pacientes para recibir NIR o Taxus en dos formas distintas de liberación del paclitaxel (lenta o intermedia). A los 6 meses, la pérdida luminal por ultrasonografía intravascular fue > 20% con NIR y < 8% con Taxus. La restenosis se redujo del 19% al 2,3% con el Taxus de liberación lenta y al 4,7% con el de liberación intermedia (p < 0,001), y al cabo de 1 año los eventos se redujeron a la mitad, similar a lo observado en el estudio RAVEL36.
Pasados unos años de expansión del uso de los stents farmacoactivos, surgieron algunos datos que moderaron la euforia inicial. Comenzaron a reportarse fenómenos de trombosis tardías (más allá del primer mes) y ello hizo saltar las alarmas37. Los fármacos antiproliferativos producían una endotelización retardada y se reportaron algunos casos de reacción inflamatoria local, presumiblemente por el polímero38. Se asumía que esto podía explicar los casos de trombosis tardía observados. Más adelante, los estudios de patología demostraron el desarrollo de neoateroesclerosis de manera más frecuente y temprana con los stents farmacoactivos en comparación con los convencionales sin fármaco39. Los metanálisis comprobaron que el aumento del riesgo de trombosis era globalmente muy leve y sin diferencias en mortalidad, mientras que se confirmaba la sorprendente efectividad de los nuevos stents40.
Tras el éxito de la primera generación de Cypher y Taxus, fueron apareciendo nuevos stents mejorados en cuanto al fármaco empleado, el polímero y la plataforma metálica41 (tabla 3). Además, las mejoras en los sistemas de liberación permitieron alcanzar lesiones más complejas. La plataforma de acero inoxidable fue dando paso a aleaciones de cromo-cobalto y cromo-platino, que permitieron adelgazar el strut, minimizando el daño vascular y mejorando la navegación sin perder fuerza radial. La geometría de celda abierta con menos conectores se generalizó, con pequeñas variaciones entre marcas. Las compañías apostaron por análogos del sirolimus y emplearon nuevos polímeros más biocompatibles y de menor espesor en la superficie del strut. Se llevaron a cabo numerosos ensayos clínicos aleatorizados de comparación directa entre los stents farmacoactivos de segunda generación, los de primera generación y los metálicos convencionales42. Mientras que la superioridad de los stents farmacoactivos sobre los convencionales era poco discutible en la mayoría de los escenarios, las supuestas ventajas de las nuevas generaciones eran más difíciles de demostrar. A partir de 2008 se realizaron numerosos estudios de evaluación de la respuesta vascular a los distintos stents mediante tomografía de coherencia óptica. Esto también fue reproducido en estudios de anatomía patológica, que además mostraron mayor respuesta inflamatoria y acúmulo de fibrina con los stents de primera generación43. Hubo una renovación generacional: mientras Cypher y Taxus se fueron retirando, Xience (Abbott Vascular, Estados Unidos), por sus resultados más favorables, pasó a ser el stent de referencia (best-in-class) para las comparaciones posteriores.
Tabla 3. Stents farmacoactivos de primera y segunda generación (polímero y struts finos)
| Nombre | Compañía | Plataforma | Metal | Grosor del strut | Fármaco | Grosor del polímero |
|---|---|---|---|---|---|---|
| Cypher | Cordis (J&J) | Bx Velocity | Acero inoxidable | 140 μm | Sirolimus | 12,6 μm |
| Taxus Express | Boston Scientific | Express | Acero inoxidable | 132 μm | Paclitaxel | 16 μm |
| Taxus Liberté | Boston Scientific | Veriflex | Acero inoxidable | 97 μm | Paclitaxel | 16 μm |
| Endeavor | Medtronic | Driver | Cromo-cobalto | 91 μm | Zotarolimus | 4,1 μm |
| Resolute Onyx | Medtronic | Integrity | Níquel-cromo + platino-iridio | 81-91 μm | Zotarolimus | 4,1 μm |
| Xience V/Promus | Abbott/Boston Scientific | Multi-link | Cromo-cobalto | 81 μm | Everolimus | 7,6 μm |
| Promus Element | Boston Scientific | Omega | Cromo-platino | 81 μm | Everolimus | 6,0 μm |
ÚLTIMOS AVANCES Y STENT BIOABSORBIBLE
El stent farmacoactivo (1999) fue una de las grandes revoluciones en la cardiología intervencionista tras la del balón de angioplastia (1977) y la del stent convencional (1986). A partir de la segunda generación, el stent farmacoactivo se consolida como estándar por su seguridad y efectividad. Las siguientes generaciones de stents incorporan polímeros biodegradables, prescinden del polímero o cuentan con recubrimientos especiales para favorecer la endotelización y la biocompatibilidad (tabla 4). Además, se logró adelgazar aún más el strut. Los avances en el tipo de recubrimiento del stent no han logrado demostrar un beneficio de forma consistente44. Sin embargo, algunos datos indican que la evolución hacia el strut ultrafino sí puede suponer una ventaja en términos de menor incidencia de revascularizaciones repetidas en la lesión diana a largo plazo44,45. Hoy en día, los stents farmacoactivos disponibles en el mercado navegan muy satisfactoriamente y son muy efectivos. Las diferencias entre los distintos modelos son sutiles y las supuestas ventajas resultan difíciles de demostrar. La generalización de los estudios de comparación directa con diseño de no inferioridad reflejan esta especie de estancamiento en el progreso46. Pese a ello, el desarrollo tecnológico continúa en busca de mejoras41.
Tabla 4. Stents farmacoactivos con polímero biodegradable o sin polímero
| Nombre | Compañía | Metal | Grosor del strut | Polímero | Fármaco |
|---|---|---|---|---|---|
| Biomatrix Flex | Biosensors | Acero inoxidable | 112 μm | Sí | Biolimus A9 |
| Biomatrix Alfa | Biosensors | Cromo-cobalto | 84-88 μm | Sí | Biolimus A9 |
| Nobori | Terumo | Acero inoxidable | 112 μm | Sí | Biolimus A9 |
| Ultimaster | Terumo | Cromo-cobalto | 80 μm | Sí | Sirolimus |
| Synergy | Boston Scientific | Cromo-platino | 74-81 μm | Sí | Everolimus |
| Orsiro | Biotronik | Cromo-cobalto | 60-80 μm | Sí | Sirolimus |
| Biomime | Meril | Cromo-cobalto | 65 μm | Sí | Sirolimus |
| Supraflex Cruz | SMT | Cromo-cobalto | 60 μm | Sí | Sirolimus |
| Coroflex ISAR Neo | Braun | Cromo-cobalto | 55-65 μm | No | Sirolimus + probucol |
| Biofreedom | Biosensors | Acero inoxidable | 112 μm | No | Biolimus A9 |
| Biofreedom Ultra | Biosensors | Cromo-cobalto | 84-88 μm | No | Biolimus A9 |
| Cre8 | Alvimedica | Cromo-cobalto | 70-80 μm | No | Sirolimus + ácido graso |
Mención aparte merece la idea del stent reabsorbible, que podría evitar los inconvenientes de dejar una malla metálica permanente en una arteria coronaria. En los años 1990, el ingeniero japonés Keiji Igaki y el intervencionista Hideo Tamai idearon una plataforma compuesta de polímero de ácido poliláctico con strut de 170 μm y sin fármaco, que debía calentarse para expandirse en el implante (se hacía con contraste calentado a 80 °C). Teóricamente, el polímero comenzaría a degradarse al cabo de 6 meses y duraría hasta 2 años, perdiendo su fuerza radial de manera progresiva. El primer stent reabsorbible de la historia (stent Igaki-Tamai, Kyoto Medical) lo implantó Hideo Tamai en 1998, en Japón. Se publicaron los resultados de los primeros 15 pacientes tratados, con un seguimiento de 6 meses, que mostraron una incidencia de restenosis del 10,5% por lesión tratada47. Sin embargo, el seguimiento de 50 pacientes a 10 años reveló una incidencia de revascularización por vaso del 28% y de trombosis del 2,4%48.
En 2006, John Ormiston implantó el primer stent bioabsorbible farmacoactivo, el Absorb Bioresorbable Vascular Scaffold (Abbott Vascular, Estados Unidos), con everolimus embebido en una matriz polimérica de ácido poliláctico con strut de 150 μm1. Tras datos favorables en los estudios piloto se inició el estudio ABSORB II, que aleatorizó a 501 pacientes para recibir Absorb BVS o Xience, con el objetivo de superioridad en cuanto a respuesta vasomotora del segmento tratado (teórica ventaja de una plataforma reabsorbible) y de no inferioridad en términos de pérdida luminal tardía. Lamentablemente, el análisis a 3 años, presentado en 2016, mostró la no consecución de ambos objetivos, con el añadido de un aumento de los casos de trombosis subaguda (2,8 frente a 0%; p = 0,03) y de infarto del vaso diana (7,1 frente a 1,2%; p = 0,006)49. A esto siguieron los resultados desfavorables a largo plazo de otros ensayos clínicos aleatorizados y metanálisis50, que llevaron a Abbott a retirar su dispositivo del mercado.
El primer stent farmacoactivo bioabsorbible había fallado en las comparaciones con el estándar de referencia Xience, que demostró su gran fiabilidad. No obstante, se habían aprendido algunas lecciones importantes para el futuro progreso51. Absorb era un dispositivo de strut grueso (150 μm frente a 81 μm de Xience) que condicionaba una navegabilidad más limitada, mayor compromiso de ramas laterales, peor endotelización y mayor trombogenicidad; se debía mejorar este aspecto para resultar más competitivo. Por otro lado, la fuerza radial de Absorb era limitada frente a la de los stents metálicos, lo cual hacía fundamental una técnica de implante óptima mediante la correcta preparación de la placa, la medición fina del vaso empleando imagen intracoronaria y la posdilatación a alta presión52. La realización de estudios poscomercialización pragmáticos hizo evidentes estas carencias. Este proyecto encalló debido en parte a la temprana (tal vez prematura) expansión de un dispositivo de primera generación hacia escenarios de mayor complejidad anatómica, como lesiones largas, vaso pequeño, bifurcaciones e incluso oclusiones crónicas53, lo que sin duda contribuyó a mostrar sus desventajas frente al stent estándar de comparación del momento.
Otras compañías desarrollaron plataformas poliméricas reabsorbibles51, pero al no poder mejorar los aspectos limitantes del Absorb se frenó la carrera de experimentación clínica en espera de mejoras en la tecnología. Además, las guías de práctica clínica desaconsejaron su uso fuera de protocolos de investigación54. Por otra parte, el stent bioabsorbible de magnesio liberador de sirolimus DREAMS (Biotronik AG, Suiza) parece tener una mejor perspectiva, con una nueva generación en la que se ha logrado disminuir el grosor radial del strut e incrementar su fuerza radial modificando la composición. Los datos del primer estudio en humanos, en el ensayo BIOMAG-I, son también prometedores55, pero habrá que esperar pacientemente a disponer de más datos de seguridad antes de poder emplearlo fuera de protocolo. La combinación del desarrollo tecnológico y la puesta en práctica de las lecciones aprendidas con Absorb traerán con seguridad nuevas oportunidades para poder contar con esta tecnología en nuestros laboratorios de intervencionismo51.
CONCLUSIONES Y PERSPECTIVAS FUTURAS
La invención del stent ha supuesto uno de los mayores avances en la historia de la cardiología y de la medicina en general. Este artículo relata el éxito de la colaboración entre genios innovadores e industria biomédica que invirtió lo necesario para el desarrollo de una terapia requerida por la población (figura 9). Esta hazaña trajo además importantes aprendizajes para la investigación en cardiología intervencionista. La necesidad de evaluar la seguridad y la efectividad de los sucesivos avances hizo madurar rápidamente la metodología de investigación y se crearon grandes redes de colaboración. La coordinación de los protocolos, la recogida y la auditoría de datos, y su análisis posterior, pudieron llevarse a cabo gracias al duro trabajo de investigadores dedicados y a la importante financiación por parte de las compañías y de las instituciones académicas. Como resultado, la cardiología intervencionista dispone hoy de una valiosa sistemática de trabajo y de la infraestructura necesaria para seguir innovando.
Figura 9. Stents coronarios que han marcado los hitos más importantes en la historia y su evolución en la línea del tiempo. En verde se señalan los stents metálicos convencionales; en rojo, los farmacoactivos; en gris, el polimérico bioabsorbible; y en azul, los nuevos stents farmacoactivos. El borde discontinuo indica polímero reabsorbible. ACS: Advanced Cardiovascular Systems; AVE: Arterial Vascular Engineering; J&J: Johnson & Johnson.
La práctica de la angioplastia es muy segura y efectiva, en gran parte gracias a los modernos stents que cuentan con todas las mejoras incorporadas durante su historia. En la actualidad, la incidencia de trombosis del stent es menor del 1% en las fases aguda, tardía y muy tardía56. Incluso, gracias a la seguridad de los dispositivos y las mejoras en la técnica, se está logrando acortar el tratamiento antitrombótico potente al mínimo41. La incidencia de restenosis del stent con necesidad de revascularización se presenta con una frecuencia anual del 1-2% tras el implante57. Aunque estas cifras son muy bajas, dado que se implantan millones de stents anualmente en el mundo, puede considerarse un problema de salud relevante desde el punto de vista epidemiológico. Sigue habiendo problemas que requieren la atención de la investigación: los pacientes con propensión a la restenosis recurrente, las lesiones calcificadas que impiden resultados óptimos, y el efecto deletéreo de los fármacos antiproliferativos sobre la función endotelial con el consecuente desarrollo de neoateroesclerosis41. Todo ello ofrece oportunidades para la innovación en la industria del stent. Además, la perspectiva de poder realizar angioplastias efectivas sin dejar un dispositivo permanente sigue abierta con la línea del stent bioabsorbible, aunque también con la posible expansión del uso del balón recubierto de fármaco a distintos escenarios clínico-anatómicos en los que el stent permanente pudiera presentar inconvenientes58.
FINANCIACIÓN
Los autores declaran la ausencia de fuentes de financiación para la elaboración de este artículo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado inteligencia artificial en este trabajo.
CONTRIBUCIÓN DE LOS AUTORES
F. Macaya-Ten: concepción y diseño, y redacción de la primera versión del manuscrito. N. Gonzalo: revisión crítica del manuscrito. J. Escaned: revisión crítica del manuscrito. C. Macaya: concepción y diseño, y revisión crítica del manuscrito.
CONFLICTO DE INTERESES
Se declara la ausencia de conflictos de intereses en relación con este trabajo.
AGRADECIMIENTOS
Los autores agradecen el apoyo con material visual y documentación bibliográfica proporcionado por diversas compañías citadas en este artículo.
BIBLIOGRAFÍA
1. Gaspard P, Whitin H. The History of Coronary Angioplasty. Toulouse:Europa Digital &Publishing/Europa Group;2017.
2. Gruentzig A, Myler R, Hanna E, Turina M. Coronary transluminal angioplasty (abstract). Circulation. 1977;56:84.
3. Gruentzig A. Results from coronary angioplasty and implications for the future. Am Heart J. 1982;103:779-783.
4. Gruentzig AR, King SB, Schlumpf M, Siegenthaler W. Long-term follow-up after percutaneous transluminal coronary angioplasty. The early Zurich experience. N Engl J Med.1987;316:1127-1132.
5. Navarro FA. Stent. Rev Esp Cardiol. 2018;71:694.
6. Roguin A. Stent:The Man and Word Behind the Coronary Metal Prosthesis. Circ Cardiovasc Interv.2011;4:206-209.
7. Dotter CT. Transluminally-placed coilspring endarterial tube grafts. Long-term patency in canine popliteal artery. Invest Radiol. 1969;4:329-332.
8. Sigwart U, Urban P, Golf S, et al. Emergency stenting for acute occlusion after coronary balloon angioplasty. Circulation. 1988;78:1121-1127.
9. Sigwart U, Puel J, Mirkovitch V, Joffre F, Kappenberger L. Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty. N Engl J Med. 1987;316:701-706.
10. Sigwart U. What is a stent and where can you get one?Am J Cardiol. 1997;80:1122.
11. Serruys PW, Strauss BH, Beatt KJ, et al. Angiographic follow-up after placement of a self-expanding coronary-artery stent. N Engl J Med.1991;324:13-17.
12. Tan C, Schatz RA. The History of Coronary Stenting. Interv Cardiol Clin. 2016;5:271-280.
13. Palmaz JC, Sibbitt RR, Reuter SR, Tio FO, Rice WJ. Expandable intraluminal graft:a preliminary study. Work in progress. Radiology. 1985;156:73-77.
14. Fischman DL, Leon MB, Baim DS, et al. A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N Engl J Med. 1994;331:496-501.
15. Serruys PW, de Jaegere P, Kiemeneij F, et al. A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. Benestent Study Group. N Engl J Med. 1994;331:489-495.
16. Macaya C, Serruys PW, Ruygrok P, et al. Continued benefit of coronary stenting versus balloon angioplasty:one-year clinical follow-up of Benestent trial. Benestent Study Group. J Am Coll Cardiol. 1996;27:255-261.
17. George CJ, Baim DS, Brinker JA, et al. One-year follow-up of the Stent Restenosis (STRESS I) Study. Am J Cardiol. 1998;81:860-865.
18. Lansky AJ, Roubin GS, O'Shaughnessy CD, et al. Randomized comparison of GR-II stent and Palmaz-Schatz stent for elective treatment of coronary stenoses. Circulation. 2000;102:1364-1368.
19. Sirnes PA, Golf S, Myreng Y, et al. Stenting in Chronic Coronary Occlusion (SICCO):a randomized, controlled trial of adding stent implantation after successful angioplasty. J Am Coll Cardiol. 1996;28:1444-1451.
20. Versaci F, Gaspardone A, Tomai F, Crea F, Chiariello L, GioffrèPA. A comparison of coronary-artery stenting with angioplasty for isolated stenosis of the proximal left anterior descending coronary artery. N Engl J Med.1997;336:817-822.
21. Serruys PW, de Bruyne B, Carlier S, et al. Randomized comparison of primary stenting and provisional balloon angioplasty guided by flow velocity measurement. Doppler Endpoints Balloon Angioplasty Trial Europe (DEBATE) II Study Group. Circulation. 2000;102:2930-2937.
22. Grines CL, Cox DA, Stone GW, et al. Coronary angioplasty with or without stent implantation for acute myocardial infarction. Stent Primary Angioplasty in Myocardial Infarction Study Group. N Engl J Med. 1999;341:1949-1956.
23. Colombo A, Hall P, Thomas J, Almagor Y, Finci L. Initial experience with the disarticulated (one-half) Palmaz-Schatz stent:a technical report. Cathet Cardiovasc Diagn. 1992;25:304-308.
24. Serruys PW, Rensing BJ. Handbook of Coronary Stents, Fourth Edition. Kentucky, USA:Taylor &Francis;2002.
25. Pache J, Kastrati A, Mehilli J, et al. Intracoronary stenting and angiographic results:strut thickness effect on restenosis outcome (ISAR-STEREO-2) trial. J Am Coll Cardiol. 2003;41:1283-1288.
26. Colombo A, Stankovic G, Moses JW. Selection of coronary stents. J Am Coll Cardiol. 2002;40:1021-1033.
27. Serruys PW, Unger F, Sousa JE, et al. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med.2001;344:1117-1124.
28. Gaspardone A, Versaci F. Coronary stenting and inflammation. Am J Cardiol. 2005;96:65L-70L.
29. Kearney M, Pieczek A, Haley L, et al. Histopathology of in-stent restenosis in patients with peripheral artery disease. Circulation. 1997;95:1998-2002.
30. SabatéM, Pimentel G, Prieto C, et al. Intracoronary brachytherapy after stenting de novo lesions in diabetic patients:results of a randomized intravascular ultrasound study. J Am Coll Cardiol. 2004;44:520-527.
31. Hobby G, Clark R, Woywodt A. A treasure from a barren island:the discovery of rapamycin. Clin Kidney J. 2022;15:1971-1972.
32. Weaver BA. How Taxol/paclitaxel kills cancer cells. Mol Biol Cell. 2014;25:2677-2681.
33. Scheller B, Speck U, Abramjuk C, Bernhardt U, Böhm M, Nickenig G. Paclitaxel balloon coating, a novel method for prevention and therapy of restenosis. Circulation. 2004;11:810-814.
34. Sousa JE, Costa MA, Abizaid AC, et al. Sustained suppression of neointimal proliferation by sirolimus-eluting stents:one-year angiographic and intravascular ultrasound follow-up. Circulation. 2001;104:2007-2011.
35. Morice MC, Serruys PW, Sousa JE, et al. A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N Engl J Med. 2002;346:1773-1780.
36. Colombo A, Drzewiecki J, Banning A, et al. Randomized study to assess the effectiveness of slow- and moderate-release polymer-based paclitaxel-eluting stents for coronary artery lesions. Circulation. 2003;108:788-794.
37. Pfisterer M, Brunner-La Rocca HP, Buser PT, et al. Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents:an observational study of drug-eluting versus bare-metal stents. J Am Coll Cardiol. 2006;48:2584-2591.
38. Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans:delayed healing and late thrombotic risk. J Am Coll Cardiol.2006;48:193-202.
39. Otsuka F, Byrne RA, Yahagi K, et al. Neoatherosclerosis:overview of histopathologic findings and implications for intravascular imaging assessment. Eur Heart J. 2015;36:2147-2159.
40. Stone GW, Moses JW, Ellis SG, et al. Safety and efficacy of sirolimus- and paclitaxel-eluting coronary stents. N Engl J Med. 2007;356:998-1008.
41. Torii S, Jinnouchi H, Sakamoto A, et al. Drug-eluting coronary stents:insights from preclinical and pathology studies. Nat Rev Cardiol. 2020;17:37-51.
42. Garg S, Serruys PW. Coronary Stents:Current Status. J Am Coll Cardiol. 2010;56:S1-S42.
43. Otsuka F, Vorpahl M, Nakano M, et al. Pathology of second-generation everolimus-eluting stents versus first-generation sirolimus- and paclitaxel-eluting stents in humans. Circulation.2014;129:211-223.
44. Taglieri N, Bruno AG, Ghetti G, et al. Target Lesion Failure With Current Drug-Eluting Stents:Evidence From a Comprehensive Network Meta-Analysis. JACC Cardiovasc Interv. 2020;13:2868-2878.
45. Madhavan MV, Howard JP, Naqvi A, et al. Long-term follow-up after ultrathin vs. 2nd-generation drug-eluting stents:a systematic review and meta-analysis of randomized controlled trials. Eur Heart J. 2021;42:2643-2654.
46. Macaya F, Ryan N, Salinas P, Pocock SJ. Challenges in the Design and Interpretation of Noninferiority Trials. J Am Coll Cardiol. 2017;70:894-903.
47. Tamai H, Igaki K, Kyo E, et al. Initial and 6-month results of biodegradable poly-l-lactic acid coronary stents in humans. Circulation. 2000;102:399-404.
48. Nishio S, Kosuga K, Igaki K, et al. Long-term (>10 years) clinical outcomes of first-in-human biodegradable poly-l-lactic acid coronary stents:Igaki-Tamai stents. Circulation. 2012;125:2343-2353.
49. Serruys PW, Chevalier B, Sotomi Y, et al. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent for the treatment of coronary artery stenosis (ABSORB II):a 3 year, randomised, controlled, single-blind, multicentre clinical trial. Lancet. 2016;388:2479-2491.
50. Ali ZA, Serruys PW, Kimura T, et al. 2-year outcomes with the Absorb bioresorbable scaffold for treatment of coronary artery disease:a systematic review and meta-analysis of seven randomised trials with an individual patient data substudy. Lancet. 2017;390:760-772.
51. Katagiri Y, Serruys PW, Asano T, et al. How does the failure of Absorb apply to the other bioresorbable scaffolds?An expert review of first-in-man and pivotal trials. EuroIntervention J. 2019;15:116-123.
52. Stone GW, Abizaid A, Onuma Y, et al. Effect of Technique on Outcomes Following Bioresorbable Vascular Scaffold Implantation:Analysis From the ABSORB Trials. J Am Coll Cardiol. 2017;70:2863-2874.
53. Smits PC, Chang CC, Chevalier B, et al. Bioresorbable vascular scaffold versus metallic drug-eluting stent in patients at high risk of restenosis:the COMPARE-ABSORB randomised clinical trial. EuroIntervention. 2020;16:645-653.
54. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
55. Haude M, Wlodarczak A, van der Schaaf RJ, et al. Safety and performance of the third-generation drug-eluting resorbable coronary magnesium scaffold system in the treatment of subjects with de novo coronary artery lesions:6-month results of the prospective, multicenter BIOMAG-I first-in-human study. EClinicalMedicine. 2023;59:101940.
56. Gori T, Polimeni A, Indolfi C, Räber L, Adriaenssens T, Münzel T. Predictors of stent thrombosis and their implications for clinical practice. Nat Rev Cardiol. 2019;16:243-256.
57. Giustino G, Colombo A, Camaj A, et al. Coronary In-Stent Restenosis:JACC State-of-the-Art Review. J Am Coll Cardiol. 2022;80:348-372.
58. Jeger RV, Eccleshall S, Wan AWA, et al. Drug-Coated Balloons for Coronary Artery Disease. JACC Cardiovasc Interv. 2020;13:1391-1402.
RESUMEN
La insuficiencia mitral funcional auricular (IMFA) ha sido recientemente el foco de atención de muchos artículos y revisiones originales. El envejecimiento de la población, el aumento de la prevalencia de insuficiencia cardiaca con fracción de eyección preservada y fibrilación auricular así como el desarrollo de las técnicas transcatéter para la reparación de la válvula mitral han resaltado la IMFA, un fenotipo de insuficiencia mitral que presenta desafíos diagnósticos específicos y para el cual actualmente las guías no tienen recomendaciones sólidas para su tratamiento. Existe una importante acumulación de datos que sugieren que el pronóstico de los pacientes con IMFA grave es malo si no se tratan. Sin embargo, las nuevas terapias para la insuficiencia cardiaca y las técnicas mínimamente invasivas pueden tener un impacto positivo en el prognóstico de esos pacientes.
Palabras clave: Insuficiencia mitral funcional atrial. Diagnóstico. Ecocardiografía. Reparación de borde a borde. Reparación mitral transcatéter.
ABSTRACT
Atrial functional mitral regurgitation (AFMR) has recently been the focus of numerous original articles and reviews. This entity has been highlighted by population aging, the increasing prevalence of heart failure with preserved ejection fraction and atrial fibrillation, and the advent of the transcatheter techniques for mitral valve repair. AFMR is phenotype of mitral regurgitation that presents specific diagnostic challenges and current guidelines do not provide strong recommendations for its management. Cumulative data show that the outcomes of patients with severe AFMR are poor if left untreated. However, new heart failure therapies and minimally invasive techniques may have a positive impact on the outcomes of these patients.
Keywords: Atrial functional mitral regurgitation. Diagnosis. Echocardiography. Edge-to-edge repair. Transcatheter mitral valve repair.
Abreviaturas IMFA: insuficiencia mitral funcional auricular.
La tríada propuesta por el Prof. Carpentier se suele emplear para caracterizar el mecanismo de la insuficiencia mitral: etiología, lesión y disfunción1. La deficiencia fibroelástica, la enfermedad mixomatosa, la cardiopatía reumática y la endocarditis son etiologías que provocan, directamente, lesiones en la válvula mitral tales como la rotura de las cuerdas tendinosas, tejido excesivo en las valvas, engrosamiento y calcificación de éstas y del aparato subvalvular y perforación de las valvas. Como consecuencia, la insuficiencia mitral resultante se conoce como orgánica o primaria. La cardiopatía isquémica, la miocardiopatía dilatada y la fibrilación auricular son etiologías que dan lugar a la dilatación del anillo mitral y a una restricción del movimiento de las valvas. Estas lesiones se consideran secundarias al proceso de remodelado tanto del ventrículo izquierdo como de la aurícula. En este sentido, la insuficiencia mitral resultante se considera secundaria o funcional. El abordaje para la reparación quirúrgica varía dependiendo de si se trata de insuficiencia mitral primaria o secundaria. En la primaria, las técnicas de reparación implican la resección del festón redundante de la valva mitral, el implante de neocuerdas, el uso de un parche pericárdico (en la perforación de las valvas) y una anuloplastia mitral para restablecer una coaptación normal. En la secundaria, la técnica que suele usarse es la anuloplastia mitral restrictiva.
La llegada de técnicas de reparación percutánea de la válvula mitral pone de manifiesto lo importante que es valorar la etiología de la insuficiencia mitral y caracterizar el aparato valvular mitral con especial atención al área valvular mitral, a la longitud y movimiento de las valvas, a la profundidad y longitud de coaptación y a la localización de la mayor vena contracta del chorro regurgitante2. Estos factores son clave a la hora de seleccionar a aquellos pacientes con insuficiencia mitral en quienes la reparación mitral percutánea de borde a borde tendrá éxito. Las guías actuales describen las características de la válvula mitral que definen las anatomías óptimas, complejas y no adecuadas de la válvula mitral a la hora de realizar una reparación mitral percutánea de borde a borde con garantías de éxito3. En pacientes de alto riesgo quirúrgico o considerados inoperables con insuficiencia mitral primaria y un aparato valvular mitral anatómicamente adecuado, se puede considerar la reparación mitral por catéter de borde a borde (clase IIb). En aquellos de alto riesgo quirúrgico o considerados inoperables y que no precisan revascularización coronaria y con insuficiencia mitral secundaria y un aparato valvular mitral anatómicamente adecuado, la reparación mitral percutánea de borde a borde tiene una recomendación clase IIa. En la actualidad, en este último escenario clínico, hay muchos pacientes con insuficiencia mitral secundaria debido a la dilatación auricular y del anillo mitral; se trata de pacientes distintos de aquellos en quienes la insuficiencia mitral está provocada por una dilatación y disfunción del ventrículo izquierdo. El riesgo quirúrgico de pacientes con insuficiencia mitral funcional auricular (IMFA) suele ser menor que el de aquellos con insuficiencia mitral funcional ventricular, si bien la evidencia que avale el uso de la reparación quirúrgica frente a percutánea de la valvular mitral sigue siendo escasa.
La IMFA aparece en un contexto de fibrilación auricular permanente o insuficiencia cardiaca con fracción de eyección mantenida4-6 y se caracteriza por la dilatación y disfunción del anillo y por una pérdida de sincronía auricular7. En pacientes con insuficiencia cardiaca y fracción de eyección mantenida, el remodelado del ventrículo izquierdo, caracterizado por una hipertrofia concéntrica y una mayor rigidez, resulta en presiones altas de llenado del ventrículo izquierdo que se transmiten a la aurícula izquierda. En respuesta a estas subidas de presión, la aurícula izquierda se dilata como mecanismo compensatorio para equilibrar esta subida de presión y que no pase a la circulación pulmonar. No obstante, el remodelado crónico de la aurícula izquierda conduce a la disfunción auricular y a la dilatación del anillo mitral y contribuye a una coaptación fallida de las valvas7.
La incidencia de la IMFA entre pacientes con fibrilación auricular se calcula en un 7%, aunque esta cifra puede aumentar hasta el 53% en pacientes con insuficiencia cardiaca y fracción de eyección mantenida8. Además, los datos de la Base de Datos Nacional de Eco de Australia (NEDA) informaron incidencias significativas de la IMFA llegando al 8% en pacientes con fibrilación auricular y sin cardiopatía estructural subyacente, al 28% en pacientes con fibrilación auricular de larga data y al 20% en aquellos con insuficiencia cardiaca y fracción de eyección conservada9.
Según diferentes series, se sabe que la IMFA suele afectar a mujeres ancianas con antecedentes de fibrilación auricular e hipertensión arterial10. Se debe mencionar que tanto la fibrilación auricular como la insuficiencia cardiaca con fracción de eyección conservada suelen coexistir, lo cual provoca un mayor remodelado cardiaco, más sintomatología y peores resultados clínicos11. Se suele llegar al diagnóstico de IMFA, principalmente, mediante ecocardiografía transtorácica y transesofágica8. Las principales características ecocardiográficas de la IMFA incluyen una morfología y movimiento normales de las valvas mitrales con una coaptación alterada secundaria a la dilatación del anillo mitral, a menudo con diferentes grados de calcificación. Cuantificar el grado de IMFA puede ser todo un desafío al tratarse de una disfunción que depende de las condiciones de carga de los pacientes. Además, la presencia de fibrilación auricular añade complejidad a la cuantificación de la IMFA por la variabilidad latido a latido. Es importante tener en cuenta el papel que juega la ecocardiografía de esfuerzo, capaz de revelar la presencia de síntomas y detectar la IMFA grave durante la realización de ejercicio máximo. La inducción de insuficiencia tricuspídea significativa e hipertensión pulmonar también son habituales en el esfuerzo. La ecocardiografía de esfuerzo puede ser un segundo paso previo a otras técnicas de imagen, como la resonancia magnética cardiaca, para identificar a aquellos pacientes con IMFA grave.
Las implicaciones clínicas de la IMFA se han descrito recientemente8. El pronóstico de la IMFA grave bajo tratamiento médico es similar al de la insuficiencia mitral funcional del ventrículo izquierdo. En una comparativa con pacientes con insuficiencia mitral primaria, la IMFA se asoció a una peor supervivencia y a más hospitalizaciones por insuficiencia cardiaca. Es importante destacar que se suelen derivar menos a pacientes con IMFA para reparación o reemplazo quirúrgico de la válvula mitral que a pacientes con insuficiencia mitral funcional del ventrículo izquierdo o insuficiencia mitral primaria12. Esto probablemente se deba a la fisiopatología de la IMFA: las guías recomiendan, primero, prescribir el tratamiento médico óptimo (en este caso para la insuficiencia cardiaca con fracción de eyección conservada) y lograr controlar el ritmo cardiaco (en presencia de fibrilación auricular) antes de la intervención3. La evidencia que existe sobre el beneficio de supervivencia de la reparación quirúrgica de la válvula mitral aislada en el manejo de la IMFA es escasa. La reparación quirúrgica de la válvula mitral mediante anuloplastia con anillo rígido completo ha reportado índices bajos tanto de reintervenciones como de recurrencia de la insuficiencia mitral tras 5 años de seguimiento13.
Basándose en un gran registro, la inteligencia artificial ha sido capaz de identificar 4 grupos de pacientes con insuficiencia mitral tratados mediante reparación percutánea de la válvula mitral de borde a borde con resultados clínicos dispares14. Los pacientes del grupo 1 (insuficiencia mitral aislada), caracterizados por la presencia de dilatación auricular izquierda, fracción de eyección del ventrículo izquierdo conservada y una fibrilación auricular del 60% son los que tuvieron la supervivencia más alta. Por otro lado, los pacientes del grupo 4 (dilatación biauricular), caracterizados por la presen- cia de aurículas izquierda y derecha sumamente dilatadas, una fracción de eyección del ventrículo izquierdo en el límite inferior de la normalidad y todos con fibrilación auricular, fueron los que tuvieron peores resultados14. Estos resultados fueron confirmados en una cohorte externa. No obstante, no se especificó en el estudio qué lesión de la válvula mitral es la que provocaba insuficiencia mitral. En este sentido, podría haber pacientes con insuficiencia mitral primaria. En la actualidad, ningún ensayo clínico aleatorizado ha comparado los resultados de la reparación quirúrgica frente a la reparación percutánea de borde a borde de la válvula mitral en pacientes con IMFA.
El campo de la IMFA va a atraer mucha atención porque la prevalencia de la insuficiencia cardiaca con fracción de eyección conservada y fibrilación auricular, las principales etiologías fisiopatológicas subyacentes de la IMFA, irán en aumento de forma simultánea al envejecimiento poblacional. Nuevos y eficaces tratamientos tales como los inhibidores del cotransportador de sodio-glucosa tipo 215, los agonistas del péptido similar al glucagón-116 y las técnicas tempranas de ablación de la fibrilación auricular17, pueden influir en la prevalencia de la IMFA. No obstante, necesitaremos nuevos ensayos centrados en la IMFA, aunque, quizás, antes debamos mejorar el abordaje de esta entidad que lleva demasiado tiempo descuidándose y considerándose un mero espectador de otras patologías. Se necesita un diagnóstico y caracterización precisos de la IMFA (figura 1). También se necesitan grandes registros que informen sobre los resultados de la IMFA a tratamiento médico y con técnicas quirúrgicas y de reparación percutánea de la válvula mitral para acotar y diseñar nuevos ensayos clínicos aleatorizados que perfeccionen las recomendaciones establecidas en las guías clínicas En este sentido, establecer la IMFA como una nueva entidad fue una necesidad clínica no satisfecha para dar un tratamiento óptimo y personalizado a cada paciente con insuficiencia mitral.
Figura 1. Caracterización y manejo de la insuficiencia mitral funcional auricular. AI: aurícula izquierda; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; IC-FEVIm: insuficiencia cardíaca con fracción de eyección del ventrículo izquierdo mantenida; IC: insuficiencia cardiaca; IM: insuficiencia mitral; VM: válvula mitral.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se han utilizado herramientas basadas en inteligencia artificial para redactar este manuscrito ni generar la figura.
CONTRIBUCIÓN DE LOS AUTORES
Los autores confirman las siguientes aportaciones a este artículo. Idea y diseño del artículo: V. Delgado, S. Danojevic, M. De Raffele y L. Niro. Metodología: V. Delgado, S. Danojevic. Validación, M. De Raffele y L. Niro. Búsqueda bibliográfica: S. Danojevic, M. De Raffele y L. Niro. Preparación y redacción del borrador original: S. Danojevic. Redacción, revisión y edición: V. Delgado, M. De Raffele y L. Niro. Supervisión: V. Delgado. Todos los autores han leído y aceptado la versión publicada del manuscrito.
CONFLICTO DE INTERESES
V. Delgado declaró haber recibido honorarios como conferenciante de Edwards Lifesciences, GE Healthcare, Novartis y Philips y como consultor de Novo Nordisk, MSD y Edwards Lifesciences. Los demás autores no declararon ningún conflicto de intereses.
BIBLIOGRAFÍA
1. Carpentier A. Cardiac valve surgery--The “French correction”. J Thorac Cardiovasc Surg. 1983;86:323-37.
2. Mauri L, Garg P, Massaro JM, et al. The EVEREST II Trial:Design and rationale for a randomized study of the evalve mitraclip system compared with mitral valve surgery for mitral regurgitation. Am Heart J. 2010;160:23-29.
3. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
4. Zoghbi WA, Levine RA, Flachskampf F, et al. Atrial Functional Mitral Regurgitation:A JACC:Cardiovascular Imaging Expert Panel Viewpoint. JACC Cardiovasc Imaging. 2022;15:1870-1882.
5. Levine RA, Schwammenthal E. Ischemic mitral regurgitation on the threshold of a solution:From paradoxes to unifying concepts. Circulation. 2005;112:745-758.
6. Ennezat PV, Maréchaux S, Pibarot P, Le Jemtel TH. Secondary mitral regurgitation in heart failure with reduced or preserved left ventricular ejection fraction. Cardiology. 2013;125:110-117.
7. Gertz ZM, Raina A, Saghy L, et al. Evidence of atrial functional mitral regurgitation due to atrial fibrillation:Reversal with arrhythmia control. J Am Coll Cardiol. 2011;58:1474-81.
8. Deferm S, Bertrand PB, Verbrugge FH, et al. Atrial Functional Mitral Regurgitation:JACC Review Topic of the Week. J Am Coll Cardiol. 2019;73:2465-2476.
9. Moonen A, Ng MKC, Playford D, Strange G, Scalia GM, Celermajer DS. Atrial functional mitral regurgitation:Prevalence, characteristics and outcomes from the National Echo Database of Australia. Open Heart. 2023;10:e002180.
10. Dziadzko V, Dziadzko M, Medina-Inojosa JR, et al. Causes and mechanisms of isolated mitral regurgitation in the community:Clinical context and outcome. Eur Heart J. 2019;40:2194-2202.
11. Lam CSP, Rienstra M, Tay WT, et al. Atrial Fibrillation in Heart Failure With Preserved Ejection Fraction:Association With Exercise Capacity, Left Ventricular Filling Pressures, Natriuretic Peptides, and Left Atrial Volume. JACC Heart Fail. 2017;5:92-98.
12. Mesi O, Gad MM, Crane AD, et al. Severe Atrial Functional Mitral Regurgitation:Clinical and Echocardiographic Characteristics, Management and Outcomes. JACC Cardiovasc Imaging. 2021;14:797-808.
13. Wagner CM, Brescia AA, Watt TMF, et al. Surgical strategy and outcomes for atrial functional mitral regurgitation:All functional mitral regurgitation is not the same!J Thorac Cardiovasc Surg. 2022;167(2):647-655.
14. Trenkwalder T, Lachmann M, Stolz L, et al. Machine learning identifies pathophysiologically and prognostically informative phenotypes among patients with mitral regurgitation undergoing transcatheter edge-to-edge repair. Eur Heart J Cardiovasc Imaging. 2023;24:574-587.
15. Gulsin GS, Graham-Brown MPM, Squire IB, Davies MJ, McCann GP. Benefits of sodium glucose cotransporter 2 inhibitors across the spectrum of cardiovascular diseases. Heart. 2022;108:16-21.
16. Kosiborod MN, Abildstrøm SZ, Borlaug BA, et al. Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 2023;389:1069-1084.
17. Yamauchi R, Morishima I, Okumura K, et al. Association Between Catheter Ablation for Nonparoxysmal Atrial Fibrillation and Functional Mitral Regurgitation in Patients With Heart Failure With Preserved Ejection Fraction. Am J Cardiol. 2023;207:192-201.
* Autor para correspondencia.
Correo electrónico: (V. Delgado).
@VDelgadoGarcia; @icorcat; @suzidanojevic; @Doc_Niro; @MartinaRaffele;
RESUMEN
La obstrucción de las arterias coronarias (OC) es una complicación rara, pero potencialmente fatal, del implante percutáneo de válvula aórtica (TAVI). El objetivo de esta revisión es resumir la evidencia sobre los factores de riesgo de OC y las estrategias preventivas. Se realizó una revisión integral de la literatura centrada en estos aspectos. El análisis consideró estudios que abordaran las características del paciente, los factores procedimentales y la efectividad de diferentes técnicas preventivas para reducir el riesgo de OC. Se describen los factores relacionados con el paciente y del procedimiento que condicionan un mayor riesgo de OC. A lo largo del texto se detallan las técnicas para disminuir el riesgo de OC, incluidos el stent en chimenea y la técnica BASILICA. Además, se aporta una descripción general de los dispositivos diseñados para abordar esta complicación. En conclusión, la identificación de los factores de riesgo de OC es crucial para optimizar los resultados del TAVI. La evaluación exhaustiva mediante imagen multimodal, junto a estrategias preventivas apropiadas, como la técnica BASILICA, pueden mitigar el riesgo de OC y mejorar los resultados. Aún se requiere más investigación para validar los dispositivos emergentes.
Palabras clave: Implante percutáneo de válvula aórtica. Obstrucción de arterias coronarias. Técnicas de protección coronaria.
ABSTRACT
Coronary obstruction (CO) is a rare but potentially fatal complication of transcatheter aortic valve implantation (TAVI). The present article aims to summarize the evidence on CO risk factors and provide an overview of preventive strategies. We performed a comprehensive literature review focused on these items. The analysis included studies addressing patient-specific characteristics, procedural aspects, and the effectiveness of various prevention techniques in mitigating CO risk. Specific risk factors for CO, which can be assessed by evaluating patient characteristics using computed tomography, are described. Procedural factors associated with an increased risk of CO are discussed. Preventive techniques, including the chimney stent and bioprosthetic aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction (BASILICA), are also described, highlighting the advantages and disadvantages of each method. The present review also provides an overview of emerging dedicated devices designed to address this complication. In conclusion, identifying patients at risk for CO is crucial for optimizing TAVI outcomes. Comprehensive imaging assessment and appropriate preventive strategies, such as the BASILICA technique, can mitigate the risk of CO and improve patient outcomes. Further research is needed to validate emerging dedicated devices.
Keywords: Transcatheter aortic valve replacement. Coronary artery obstruction. Coronary protection techniques.
Abreviaturas DVC: distancia válvula-coronaria. OC: obstrucción coronaria. PVB: prótesis valvular biológica. RQVA: reemplazo quirúrgico de válvula aórtica. SDV: seno de Valsalva. TAVI: implante percutáneo de válvula aórtica. THV: prótesis valvular cardiaca percutánea. UST: unión sinotubular.
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI) ha tenido una evolución rápida logrando un perfil de seguridad y eficacia notables1,2. No obstante, complicaciones tales como trastornos de la conducción, complicaciones relacionadas con el sitio de acceso y obstrucciones coronarias (OC) siguen preocupando por la morbimortalidad asociada a dichas complicaciones. La OC es una complicación rara (descrita entre el 0,5 y el 8% de los casos) pero potencialmente fatal durante el TAVI3-5. La tasa de mortalidad intrahospitalaria a los 30 días asociada a este evento está en torno al 30-50%6-8. Las OC pueden sobrevenir en un entorno agudo durante el implante de la válvula, antes de que el paciente haya salido de quirófano, o ser tardías y sobrevenir después de que el paciente haya abandonado el quirófano tras un TAVI exitoso. Las OC tardías se puede clasificar como OC tempranas (0-7 días) o tardías (> 7 días)9.
Existen 2 mecanismos principales en las OC. El primero es la obstrucción directa por desplazamiento de un velo nativo o protésico deteriorado por la prótesis valvular cardiaca percutánea (THV). Se ha descrito con mayor frecuencia en pacientes con orígenes coronarios bajos y senos de Valsalva (SDV) estrechos4. El segundo mecanismo es una obstrucción indirecta en la que también se desplaza el velo obstruyendo la unión sinotubular (UST) con el consiguiente secuestro de los senos de Valsalva. Se ha descrito con mayor frecuencia en UST bajas y estrechas. La mayoría de las OC sobrevienen en el ostium coronario (92%) y principalmente en la descendente anterior (78%)4. Otras causas de OC incluyen la embolización y obstrucción directa de los ostium coronarios por la prótesis TAVI3-5,7,10-12.
Tras realizar una evaluación exhaustiva, las características anatómicas de alto riesgo podrían llegar favorecer el reemplazo quirúrgico de válvula aórtica (RVAO). No obstante, si el riesgo quirúrgico es prohibitivo, es necesario proceder con el TAVI. En tales situaciones, usar técnicas de protección de las coronarias resulta clave a la hora de aumentar la seguridad y minimizar los riesgos13,14.
Esta revisión tiene como objetivo resumir y analizar los predictores de OC y las técnicas y estrategias que se emplean en la actualidad para prevenir esta complicación en el contexto del TAVI.
FACTORES ASOCIADOS A LA OBSTRUCCIÓN DE LAS CORONARIAS TRAS EL TAVI
Una planificación meticulosa del TAVI sumado a una comprensión integral de los mecanismos subyacentes que predisponen a la ocurrencia de complicaciones son de una importancia capital para mejorar los resultados. La tomografía computarizada (TC) es esencial a la hora de valorar a los posibles candidatos a un TAVI, incluida una estimación de las posibles complicaciones que pueden darse15. Los principales predictores de OC asociados al TAVI se resumen en la tabla 1.
Tabla 1. Factores vinculados a oclusiones coronarias asociadas al TAVI
| Predictores | Comentario |
|---|---|
| Factores anatómicos | Altura de los ostium coronarios < 12 mm (< 10 mm: riesgo máximo)a |
| Diámetro del seno de Valsalva < 30 mma | |
| Altura de la cúspide > altura coronaria | |
| Baja altura y diámetro estrecho de la UST | |
| DVC ≤ 4 mm | |
| Calcificación del velo culpable > 600 mm3 | |
| TAVI ViV | DVC ≤ 4 mma,b |
| PVB sin stent o PVB con stent con velos montados externamenteb | |
| Sexo femenino | Probablemente asociado a la anatomía más pequeña de las mujeres |
| Factores de la THV y de la intervención | Las prótesis expandibles con balón se asocian a un mayor índice de OC agudas |
| Las prótesis expandibles con balón se asocian a la ocurrencia tardía de OC | |
| Faldón externo | |
| Implante alto | |
|
DVC: distancia válvula-coronaria; OC: obstrucción coronaria; PVB: prótesis valvular biológica; TAVI: implante percutáneo de válvula aórtica; THV: prótesis valvular cardiaca percutánea; UST: unión sinotubular. |
|
Factores anatómicos que contribuyen a la ocurrencia de OC en pacientes con válvulas aóticas nativas
El principal predictor es la altura baja de los ostium coronarios medida por TC desde el plano del anillo aórtico. Un consenso de expertos previo sugirió un valor de corte para la altura de los ostium coronarios inferior a 10 mm como indicativa de riesgo máximo16,17. No obstante, los datos de un registro multicéntrico confirmaron que la altura del ostium coronario del tronco común izquierdo (TCI) de casi el 80% de los pacientes con OC era inferior a 12 mm (altura media: 11 mm)3. Además, Ribeiro et al. informaron que en torno al 60% de los pacientes con OC presentaban ostium coronarios con alturas superiores a 10 mm, lo cual sugiere que el valor de corte debería subirse hasta los 12 mm18. El ostium de la coronaria derecha (CD) se vio afectado solo en solo el 11% de todos los casos de OC en un registro previo3 debido al origen más alto de esta arteria comparado con el TCI en la mayoría de los casos19, lo cual viene a subrayar lo importante que son estas mediciones.
Otro factor de riesgo es una raíz aórtica estrecha con un diámetro de los SDV < 30 mm7,11. La distancia válvula-coronaria (DVC) es la distancia que hay desde los ostium coronarios hasta la posición final anticipada de los velos bioprotésicos desplazadas tras del TAVI15. Para calcular la DVC mediante TC, se utiliza un cilindro virtual que representa la THV y se mide la distancia horizontal entre dicho cilindro y los ostium coronarios15. Si la DVC es superior a 6 mm, el riesgo de OC es bajo; entre 4 y 6 mm, el riesgo es límite y si es inferior a 4 mm, el riesgo es máximo7,15. No obstante, las mediciones de la DVC no son 100% específicas, lo cual podría deberse a las diferencias existentes entre las DVC estimada y observada descritas por Tzimas et al.20.
La relación entre la altura de la cúspide aórtica y la altura coronaria es un criterio relativamente nuevo. La altura de la cúspide es la distancia vertical desde el plano anular hasta la parte superior de la unión comisural de la cúspide. Esta medida es probablemente más reproducible que la longitud del velo.
El riesgo de OC indirecta por secuestro de seno es mayor cuando el diámetro anular es mayor que el de la UST y la altura de la cúspide es mayor que la de la UST21. Al igual que ocurre con la DVC, se debe calcular la distancia virtual desde la THV hasta la UST (DVTUST). La figura 1 muestra una representación esquemática de las mediciones asociadas a un valor predictivo para las OC.
Figura 1. Representación esquemática de la raíz aórtica y predictores de OC. A: válvula aórtica nativa. La altura de los ostium coronarios y la anchura de los SDV son predictores de la ocurrencia de OC. El volumen de calcio coronario de los velos también influye en los resultados en este contexto. B: velos de una válvula aórtica nativa desplazados por una THV representadas en esta figura. Una DVTUST más estrecha y una mayor altura de los velos con relación a la altura de los ostium coronarios se asocian al riesgo de OC. C: raíz aórtica con una PVB. El TAVI ViV es un factor de riesgo per se para la ocurrencia de OC; no obstante, este riesgo aumenta cuanto menor es la DVC. Por otro lado, se ha sugerido que una UST estrecha es otro factor contribuyente al riesgo de OC. CD: coronaria derecha; DVC: distancia válvula-coronaria; DVTUST: distancia virtual desde la THV hasta la UST; PVB: prótesis valvular biológica; SDV: seno de Valsalva; TCI: tronco común izquierdo; THV: prótesis valvular cardiaca percutánea; UST: unión sinotubular.
Khan et al. han desarrollado un algoritmo predictivo para valorar el riesgo de OC4. El algoritmo tiene en cuenta alturas de las cúspides mayores que las de las coronarias y cualquiera de las siguientes condiciones: DVC ≤ 4 mm o un volumen de calcio en el velo culpable > 600 mm3. El modelo tuvo un excelente rendimiento a la hora de predecir la obstrucción de los ostium coronarios izquierdo y derecho. La figura 2 muestra un diagrama de flujo para valorar el riesgo de OC en pacientes con válvulas aórticas nativas.
Figura 2. Valoración del riesgo de obstrucción coronaria en pacientes tratados de TAVI para válvulas aórticas nativas.
Características de los pacientes asociadas a la ocurrencia de OC
El sexo femenino está asociado a una mayor incidencia de OC. En torno al 80% de los pacientes de los registros de OC son mujeres18, una relación que probablemente se deba a las diferencias anatómicas entre ambos sexos. Las mujeres suelen tener raíces aórticas más pequeñas, SDV de menor tamaño y ostium coronarios más bajos19.
En cuanto a la historia del paciente, los antecedentes de cirugía de revascularización coronaria están asociados a una menor incidencia de OC sintomática por el «efecto protector» de proporcionar un flujo sanguíneo alternativo18. No obstante, la permeabilidad del injerto siempre debe valorarse antes del TAVI22.
Factores de la intervención que influyen en la ocurrencia de OC
El tipo de THV podría, también, influir en los resultados. Las prótesis expandibles con balón se asocian a un mayor riesgo de OC agudas que las prótesis autoexpandibles11,18. No obstante, esta diferencia podría explicarse, en parte, por las características de la armadura y el mecanismo de implantación18. No obstante, un registro posterior que evaluó la ocurrencia de OC tardías vino a confirmar que las prótesis autoexpandibles se asociaban a índices más altos de esta complicación que las prótesis expandibles con balón. Quizás esto se deba a que las válvulas autoexpandibles están hechas de nitinol y siguen expandiéndose tras el implante inicial9. Otros factores que podrían contribuir a la ocurrencia de OC en este contexto son la estancación del flujo y la micromigración de la prótesis. Jabbour et al. plantean que tanto la endotelización como la embolización de los trombos podrían guardan relación con la ocurrencia de OC tardías9.
Válvulas bioprotésicas quirúrgicas y TAVI «válvula dentro de otra válvula»
El TAVI se ha convertido en una nueva alternativa al RVAO en pacientes con una prótesis valvular biológica (PVB) fallida y riesgo perioperatorio alto o prohibitivo1,2. El TAVI «válvula dentro de otra válvula» (ViV) supone en torno al 5% de todos los TAVI que se realizan en Estados Unidos23. El índice de OC es entre 4 y 6 veces mayor en los TAVI ViV que en las válvulas nativas9. El riesgo más alto de sufrir OC probablemente se deba al diseño supraanular de la mayoría de las PVB que rebaja la altura de los ostium coronarios al tiempo que la sutura de la válvula aproxima las coronarias, reduciendo, así, la anchura del seno24.
Es conveniente contar con un informe preoperatorio integral23. Se deben investigar los detalles de la intervención previa, incluido el modelo y tamaño exactos de la PVB25. Esta diferenciación es esencial porque las válvulas sin stent (como la Freedom [Sorin Biomedica, Italia], la Toronto SPV [St Jude Medical, Estados Unidos], la Freestyle [Medtronic, Estados Unidos]) y las válvulas con stent con velos montados externamente (como la Mitroflow [Sorin Biomedica, Italia] y la Trifecta [St Jude Medical, Estados Unidos]) tienen asociado un mayor riesgo de OC25. Ribeiro et al. han informado de una incidencia mucho mayor de OC en pacientes con válvulas sin stent (3,7%) y válvulas con stent y velos montados externamente (6,4%) que en pacientes con válvulas con stent y velos montados internamente (0,7%). De hecho, el mismo registro demostró que la presencia de estos tipos de válvulas resultó ser un predictor independiente de OC7.
La DVC estimada por TC es uno de los predictores más precisos de OC tras un TAVI ViV7,26. También se ha de tener en cuenta la altura de los ostium coronarios y el diámetro medio de los SDV3,7,15. Otro posible factor de riesgo anatómico para la ocurrencia de OC en una intervención ViV es una UST estrecha, la posición supraanular y un perfil alto de los velos de la PVB27,28.
Redo-TAVI. Implicaciones en la obstrucción coronaria
La tendencia actual en el manejo de la enfermedad aórtica sugiere que dentro de poco, en pacientes con mayor esperanza de vida se empleará el TAVI y no el RVAO. En este sentido, el redo-TAVI quizá juegue un papel esencial en el tratamiento de pacientes con THV fallidas. No obstante, los datos con que contamos sobre predictores para evitar complicaciones en este contexto siguen siendo escasos.
En algunos de los primeros registros y revisiones sistemáticas que entraron a valorar el redo-TAVI o el TAVI en TAVI, los investigadores informaron tasas muy bajas de complicaciones perioperatorias de entre el 0 y el 0,9% de OC30-32. Esto probablemente se deba a un meticuloso análisis de la anatomía con conocimiento de los factores predictivos citados anteriormente, excluyendo a los pacientes de mayor riesgo y con un mayor sesgo de selección.
El redo-TAVI también se asocia a un cierto riesgo de OC y accesos coronarios comprometidos33. El implante de una segunda THV superpone las armaduras de los stents de ambas prótesis con el riesgo que de comprimir los velos de la primera THV, creando un cilindro cubierto hasta el borde de estos34. La superposición de las armaduras de los stents y la pérdida de flujo libre influyen en el flujo coronario y en la posibilidad de canulación.
En pacientes tratados de TAVI en TAVI, la UST juega un papel esencial a la hora de acceder a las coronarias a modo de cuello de botella anatómico. Una UST más alta y ancha ofrece más espacio entre la primera THV y la pared aórtica facilitando el acceso a los ostium coronarios y minimizando la probabilidad de obstrucción del flujo34. Además, la altura de los velos de la primera THV implantada también podría influir en el acceso y el flujo. Las THV previas con velos supraanulares y las THV implantadas en altura aumentan el riesgo de interacción con la UST y obstrucción del flujo en el supuesto de tener que implantar una segunda THV34,35. En este sentido, se sugiere calcular la DVTUST, sobre todo, en intervenciones TAVI en TAVI y TAVI «válvula dentro de otra válvula»36.
Tarantini et al. propusieron un algoritmo para predecir el riesgo de OC y la viabilidad de futuros accesos coronarios. Estos autores tuvieron en cuenta la valoración mediante TC de la altura de los ostium coronarios en relación con la primera THV, una distancia de 2 mm desde la THV hasta la pared aórtica y la confirmación de la posibilidad de canulación coronaria con la anterior válvula en su sitio. Si los ostium coronarios se encuentran por debajo del plano de riesgo de la anterior THV, la distancia hasta la pared aórtica es < 2 mm, lo cual hace inviable la canulación coronaria lo cual, a su vez, descarta la posibilidad de TAVI en TAVI33,37. La anchura de la raíz aórtica también es importante para valorar el riesgo de OC en este contexto.
Redondo et al. han destacado otro aspecto a considerar en la planificación y ejecución del TAVI en TAVI: el alineamiento de los postes comisurales de la anterior THV con respecto a la actual ubicación de los ostium coronarios. Si un paciente con una THV previa corre un riesgo alto de OC, se puede lacerar a propósito el festón aórtico bioprotésico o nativo mientras se emplea la técnica TAVI (BASILICA) para evitar la obstrucción iatrogénica de la coronaria y así mitigar dicho riesgo. Esta estrategia, consistente en lacerar el velo anterior para posibilitar un flujo coronario normal y que se detalla a continuación, podría no resultar con alineamientos inadecuados de los ostium coronarios en relación con los postes comisurales de la primera THV por una ubicación excéntrica de los ostium coronarios38.
ESTRATEGIAS PARA EVITAR OBSTRUCCIONES CORONARIAS TRAS EL TAVI
Tal y como venimos subrayando, el primer paso y el más importante para evitar la ocurrencia de complicaciones perioperatorias asociadas al TAVI es realizar valoraciones integrales con la ayuda de imágenes y una planificación adecuada. Ante el riesgo alto de OC, una nueva valoración del riesgo podría favorecer optar por el RQVA Un riesgo quirúrgico excesivo que requiera continuar con la estrategia percutánea requiere técnicas de protección coronaria22.
Protección coronaria con guía
Esta es la técnica de protección más simple en el contexto del TAVI con alto riesgo de OC y una de las primeras estrategias de protección informadas. La técnica consiste en la colocación de una guía de 0,014 pulgadas en 1 o ambas arterias a través de catéteres guía tras cruzar la válvula aórtica con la guía rígida. Dependiendo de las preferencias del operador, se avanza un balón de angioplastia con un diámetro de entre 2,5 y 3.5 mm a través de la guía para estar preparados ante una posible dilatación en caso de obstrucción súbita14,39,40. Si sobreviene una OC aguda, la guía se emplea para realizar una angioplastia ostial con un balón o implantar un stent para recuperar el flujo coronario.
El perfil de seguridad y la viabilidad de esta técnica han quedado demostrados en estudios ya publicados13,14. No obstante, se necesitan más evidencias de ensayos clínicos aleatorizados, lo cual quizá haga difícil extrapolar la efectividad de este abordaje. La ausencia de guías estandarizadas de cómo realizar la intervención quizá, contribuya, también a la variabilidad en su aplicación y resultados. A pesar de estos desafíos, lo que más preocupa sigue siendo el riesgo persistente de oclusión incluso después de haber retirado la guía, tal y como ha quedado demostrado en el registro de la Sociedad Española de Cardiología5.
Técnica del stent «en chimenea/snorkel»
La técnica del stent en chimenea es una estrategia basada en la colocación de una guía con un stent sin desplegar en una o ambas arterias coronarias. El stent se implanta si sobreviene una OC, de tal forma que sobresale por el exterior y parte superior del ostium coronario a modo de «chimenea» o snorkel. Chakravarty et al. fueron quienes dieron a conocer esta estrategia por primera vez para el tratamiento de una OC aguda anticipada del tronco común izquierdo (TCI) en un paciente con una PVB degenerada41. Son varios los informes de casos que han confirmado su perfil de seguridad y eficacia42,43.
El seguimiento clínico ha confirmado resultados aceptables a medio plazo (tiempo de seguimiento de 612 días, rango intercuartílico: entre 405 y 842 días) en un registro con un único caso de fracaso del stent y 1 posible caso de trombosis tardía del stent44. Se requieren resultados de seguimiento a más largo plazo que respondan a todas las cuestiones en torno a los resultados asociados al stent. Cabe esperar reaccesos coronarios difíciles a través del snorkel, lo cual plantea dudas sobre posibles complicaciones coronarias a futuro. Los posibles mecanismos del eventual fracaso del stent son un flujo turbulento persistente a través de la THV y el stent, la corrosión galvánica y los procesos inflamatorios locales10.
Detalles de la intervención
La técnica de la chimenea implica una serie de pasos críticos que pueden variar tímidamente de una sala de hemodinámica a otra y que se basan en la literatura médica y experiencia existentes en la actualidad. Al igual que ocurre con cualquier intervención compleja, se debe realizar por un equipo de intervencionistas experimentados. La figura 3 muestra un ejemplo de un caso real empleando la técnica del stent chimenea/snorkel para la protección de un paciente de alto riesgo de OC.
Figura 3. Pasos principales del TAVI «válvula dentro de otra válvula» (válvula Freedom [Sorin Biomedica, Italia]) empleando una técnica de chimenea bilateral para proteger ambas coronarias. A: previo al implante de la válvula, se colocaron stents farmacoactivos no desplegados tanto en la coronaria derecha (3,5 × 28 mm) como en el TCI (4 × 33 mm) en preparación para una posible intervención coronaria percutánea ante posibles obstrucciones coronarias agudas. B: luego se avanzó una válvula Portico (Abbott Vascular, Estados Unidos) y se inició el implante. C: durante la liberación de la válvula, se administraron inyecciones de contraste para valorar la permeabilidad de los ostium coronarios. Se observa el momento de la obstrucción del ostium del TCI (flecha blanca). D: ante el riesgo de obstrucción coronaria aguda, se implantó el stent del TCI (flecha roja). E: posteriormente, debido al alto riesgo, también se implantó el stent de la coronaria derecha (flecha azul). F: se optó por posdilatación con un balón de valvuloplastia (*) para mejorar la expansión de la prótesis valvular cardiaca percutánea. Para no comprimir los stents, los balones de los stents se inflaron al mismo tiempo que el balón aórtico. G: el seguimiento angiográfico final confirma la permeabilidad de los 2 ostium coronarios y la ausencia de insuficiencia aórtica. TCI: tronco común izquierdo.
Primer paso: valorar al paciente
-
– Una valoración preoperatoria integral resulta esencial. La intervención debe realizarse después de que el caso haya sido estudiado por un equipo multidisciplinario compuesto por cardiólogos intervencionistas y cirujanos cardiacos con suficiente experiencia.
Segundo paso: accesos vasculares
-
– Lograr acceso radial para abordajes secundarios (catéter pigtail). Cuando se protegen ambas coronarias, se pueden usar catéteres guía para administrar inyecciones de contraste y dirigir el implante de la THV y valorar la permeabilidad de los ostium coronarios.
-
– Acceder a la arteria femoral común para implantar la THV o un acceso alternativo si fuese necesario.
-
– Usar la arteria femoral contralateral para insertar un catéter guía para protección coronaria. Lo ideal es emplear un catéter de 7 Fr (Extra back-up [EBU] o Judkins izquierdo [JL] para el TCI y Judkins derecho [JR] para la CD).
-
– Lograr acceso venoso para el marcapasos si fuese necesario.
Tercer paso: preparar la protección coronaria y desplegar la THV
-
– Cruzar la válvula aórtica y colocar la guía TAVI en el ventrículo izquierdo (VI).
-
– Colocar la guía de 0,014 pulgadas en la arteria en riesgo.
-
– Avanzar los stents sobre las guías, asegurándonos de que sean lo bastante largos como para anclarse y sobresalir por encima de los velos de la THV. Puede emplearse un extensor de catéter guía para que el stent no interactúe con la THV.
-
– Realizar una valvuloplastia, caso de ser necesario, y evaluar el flujo coronario durante todo el proceso8,43.
-
– Avanzar la THV por la guía del VI y desplegarla, haciendo seguimiento del flujo coronario empleando inyecciones de contraste.
Cuarto paso: implantar el stent y realizar una evaluación posoperatoria
-
– Si el flujo coronario se hubiese visto afectado durante el implante de la THV, retirar los stents sin desplegar que sobresalen de la aorta y desplegarlos.
-
– Mantener un umbral bajo para el implante de los stents ante la dificultad de volver a cruzar la estructura de la THV.
-
– Posible dilatación del segmento proximal del stent con un balón para mejorar y anticiparse a un posible nuevo acceso a las coronarias.
-
– Posdilatar si es necesario empleando la técnica de kissing balloon para no comprimir el stent43.
-
– Realizar una valoración ecocardiográfica y angiográfica final para confirmar el éxito de los resultados antes de finalizar la intervención.
Tratamiento posoperatorio
El tratamiento antiagregante plaquetario óptima para estos pacientes no termina de estar claro. En líneas generales, se recomienda un curso de tratamiento antiagregante plaquetario doble (ácido acetilsalicílico más clopidogrel) de, como mínimo, 6 meses. No obstante, en personas mayores con comorbilidades, se debe tener en cuenta, además, el riesgo de sangrado. En pacientes a tratamiento anticoagulante, se puede usar un curso de terapia triple de 1 semana de duración, seguido de entre 3 y 6 meses de terapia doble (clopidogrel más anticoagulante) antes de continuar, solo, con el anticoagulante. Se necesitan, no obstante, más evidencias para determinar la mejor estrategia en estos casos.
La técnica BASILICA
La técnica BASILICA es otra estrategia sugerida para evitar la ocurrencia de OC. Esta estrategia se desarrolló como medida preventiva previa al implante de la THV, lacerando los velos para evitar su compresión contra los ostium coronarios, lo cual podría provocar oclusiones agudas24,45. La creación de un «triángulo de flujo» facilita el flujo sanguíneo hacia las coronarias46. BASILICA se diseñó como una alternativa a las técnicas basadas en stents con posibles limitaciones tales como una potencial compresión extrínseca, un riesgo de trombosis a largo plazo desconocido y accesos coronarios difíciles10.
Khan et al. informaron de los resultados a 30 días de 30 pacientes tratados con la técnica BASILICA, sin informar OC y con intervenciones exitosas en 28 pacientes. Los resultados de seguridad, incluidas las complicaciones cardiovasculares mayores, los accidentes cerebrovasculares, las lesiones renales y la muerte se informaron en el 70% de los pacientes, aunque no tuvieron nada que ver con la técnica BASILICA36. Recientemente, se demostró que esta intervención se puede realizar con un riesgo muy bajo de eventos cardiovasculares adversos mayores y una alta tasa de éxito en pacientes con válvulas aórticas nativas y protésicas47. La inestabilidad hemodinámica que sobreviene tras la laceración de la válvula fue rara y se resolvió tras implantar la THV. Las intervenciones fallidas se debieron, probablemente, a la calcificación grave de los velos, lo cual evitó su perforación antes de dividirse45. Los resultados a 1 año confirmaron la ausencia de más accidentes cerebrovasculares o infartos de miocardio y solo 2 muertes más48. Kitamura et al. informaron resultados aún mejores, sin complicaciones vasculares mayores, necesidad de soporte circulatorio mecánico, accidentes cerebrovasculares ni mortalidad a 30 días49. El empleo de la técnica BASILICA en THV fallidas es limitado por el diseño de algunos tipos de THV y el alineamiento comisural. Los modelos en estudio confirmaron que la división de los velos fue efectiva en las válvulas Sapien XT de generaciones anteriores, aunque menos en las válvulas Sapien 3 (Edwards Lifesciences, Estados Unidos) y EVOLUT (Medtronic, Estados Unidos) de última generación50. Además, aún en el caso de una laceración factible, las nuevas comisuras de la THV podrían alinearse de forma desfavorable y un posicionamiento demasiado alto del faldón de la nueva THV podría llegar a obstruir el velo lacerado.
Las contraindicaciones aún no se han definido claramente, pero la técnica podría resultar ineficaz ante SDV muy estrechos, ostium coronarios excéntricos o cúspides gravemente calcificadas. Además, se debería evitar en casos de endocarditis o trombosis valvular46. En lo que a la excentricidad se refiere, podría ser uno de los obstáculos más importantes que tener en cuenta para una protección efectiva de los ostium coronarios, sobre todo en pacientes tratados de TAVI en TAVI tal y como como sugirió Redondo et al. en una publicación anterior. En estos casos, si los ostium coronarios están en una posición excéntrica dentro de los SDV, la laceración probablemente no se alinee con los ostium, suprimiendo, así, su eficacia38.
Detalles de la intervención
La intervención se debe realizar bajo guiado ecocardiográfico transesofágico (ETE) para garantizar los mejores resultados posibles y facilitar el abordaje. La anestesia general es obligatoria. Algunos operadores prefieren emplear la ecocardiografía intracardiaca no haciéndose necesario, en estos casos, el uso de anestesia general. La figura 4 muestra un TAVI ViV con el uso de la técnica BASILICA para proteger el TCI por el alto riesgo de oclusión.
Figura 4. Pasos principales del TAVI «válvula dentro de otra válvula» con la técnica BASILICA. A: primero, se colocó un catéter guía JR (8 Fr) en el ventrículo izquierdo con un lazo y un pigtail en la aorta ascendente para una aortografía. Luego, se colocó un catéter diagnóstico JR de 5 Fr dentro de un catéter guía AL 3 de 8 Fr sobre el velo de la prótesis aórtica con un microcatéter Finecross 130 y una guía Astato XS 20 (Asahi Intecc, Estados Unidos) en su interior. B: tras identificar el punto óptimo de perforación del velo izquierdo mediante guiado eco y angiográfico, se colocó correctamente la guía, se electrificó y se perforó el velo (flecha roja). C: posteriormente, la guía quedó atrapada en el lazo colocado en el tracto de salida del ventrículo izquierdo y se tiró de ella hacia el interior del catéter guía JR (D, E) previo a externalizar la guía; se creó una «forma de V» en la zona central de la guía. Luego, se avanzó, y cuando la «forma de V» entró en contacto con el velo (E, flecha blanca), la guía volvió a electrificarse al tiempo que se tiró de ambos extremos lacerando el velo. F, G: se implantó una prótesis valvular cardiaca percutánea y autoexpandible confirmándose, finalmente, la permeabilidad coronaria (H). BASILICA, laceración intencionada del festón aórtico bioprotésico para evitar obstrucciones coronarias iatrogénicas; JR: Judkins derecho.
Primer paso: valoración del paciente
-
– Siempre se debe hacer una valoración de los pacientes tratados de TAVI. La planificación de la intervención deberá incluir una valoración con imágenes (las imágenes por TC aquí son clave).
Segundo paso: accesos vasculares
-
– Inicialmente, se necesitan, como mínimo, 3 accesos arteriales para esta técnica (figura 5)24.
-
– Se utiliza un introductor de 14 Fr (como mínimo) para el acceso principal. Se recomienda usar un introductor Dryseal (GORE, Estados Unidos) puesto que es capaz de acomodar 2 catéteres guía y mantener la hemostasia, a saber, 1 catéter guía (de entre 7 y 8 Fr) para perforar el velo y otro catéter pigtail para desplegarlo en el VI.
-
– Ante anatomías iliofemorales complejas, se recomienda utilizar un introductor femoral que se pueda desplegar para hacer avanzar la THV. De este modo, el cardiólogo intervencionista se asegura de que la THV avance sin problemas tras la laceración del velo.
-
– El segundo acceso se coloca en la arteria femoral común contralateral para insertar un catéter que se usa para colocar un lazo en el VI.
-
– El tercer acceso se inserta en la arteria radial para colocar un dispositivo de protección embólica cerebral (Sentinel [Boston Scientific, Estados Unidos]).
-
– En el caso de ser necesario, se debe obtener acceso venoso para implantar un marcapasos temporal.
Figura 5. Preparación del paciente con 3 accesos arteriales (radial derecho para el dispositivo de protección embólica cerebral y 2 femorales) y 1 acceso venoso para implantar el marcapasos temporal.
Tercer paso: perforación de los velos
-
– La válvula aórtica debe cruzarse y posteriormente, se debe colocar un catéter guía multipropósito de 6 Fr en el tracto de salida del ventrículo izquierdo (LVOT). Utilizando dicho catéter, se coloca un lazo en cuello de ganso del mismo tamaño que el LVOT (entre 20 y 30 mm) en el LVOT. Paralelo al lazo, empleando el mismo catéter multipropósito, se coloca una guía de 0,018 pulgadas en el VI hasta alcanzar al ápex; esta guía permite redirigir el lazo al VI si se tira de él. En lugar de un catéter multipropósito, se puede usar un catéter JR de 6 Fr dependiendo de lo angulada que sea la anatomía.
-
– Luego, se deben elegir diferentes catéteres, lo ideal es que sean de 7-8 Fr dependiendo de la cúspide a lacerar. Para el abordaje del velo izquierdo, la primera opción suele ser emplear un Amplatz izquierdo (AL) 3; no obstante, dependiendo de cómo sea la anatomía de la raíz aórtica, también se pueden usar catéteres AL1, AL2, AL4, EBU 3.5 y 4. Para el velo derecho, se suele usar un catéter multipropósito o un JR si la aorta es horizontal.
-
– Para perforar el velo izquierdo se hace necesario un catéter diagnóstico largo de 5 Fr en el interior de un catéter de 8 Fr (madre-hijo). La primera opción es un catéter mamario interno diagnóstico de 125 cm o un catéter JR 4.
-
– Con una serie de dispositivos telescopados, se coloca una guía de 300 cm (se sugiere la Astato XS 20 de 300 cm [Asahi Intecc, Estados Unidos]) y un microcatéter, ambos dentro de los catéteres mamario interno de 5 Fr y guía de 8 Fr.
-
– Los dispositivos telescopados se orientan, entonces, hacia la base de la cúspide diana, con la orientación correcta para evitar perforaciones no deseadas guiadas por fluoroscopia y ETE. El velo diana debe proyectarse en 2 ángulos fluoroscópicos, «vista frontal» y «lateral». Estas proyecciones, estimadas mediante evaluación por TC, ayudan a acceder a los velos con precisión. Las inyecciones de contraste también sirven para estimar la relación espacial de la válvula (figura 6).
-
– Una vez se logra la posición óptima del «telescopio» con un «ángulo de ataque» correcto, se intenta perforar el velo. Tras apuntalar el complejo catéteres-guía, se aproxima el microcatéter al velo y se electrifica la guía para realizar la perforación.
-
– Para electrificar la guía, se raspan entre 1 y 3 cm de su parte posterior con una hoja de bisturí hasta que la parte metálica queda expuesta; luego se conecta a un lápiz eléctrico con una pinza mosquito. El generador electroquirúrgico se ajusta al modo «corte puro» y la potencia se ajusta al velo; 30 vatios para velos porcinos, 50 para bovinos o nativos y 70 para velos gravemente calcificados. La electrificación ha de ser breve (< 1 segundo) y detenerse inmediatamente después de que la guía haya franqueado el velo46.
-
– Tras la perforación, la guía de 300 cm se coloca en el TSVI, intentando cruzarlo a través del lazo, que se debe situar en la parte alta del TSVI para no lesionar la válvula mitral. Tras capturarla, se tira de la guía de 300 cm hacia el interior de la guía con el lazo sin exteriorizarla.
-
– Se debe emplear guiado por ETE para que la guía no se enrede con el aparato mitral.
Figura 6. Orientación de los catéteres para la perforación del velo. A: vista lateral con dirección fuera de eje. B: vista lateral con dirección correcta. C: vista frontal con dirección fuera de eje. D: vista frontal con dirección correcta.
Cuarto paso: preparación de la THV
-
– Tras perforar el velo y antes de la laceración, se debe preparar la THV para que esté lista para un implante rápido una vez se haya modificado el velo ya perforar el velo puede llevar tiempo. La válvula no puede permanecer crimpada mucho tiempo porque puede aumentar el riesgo de dañar la THV.
-
– Tras perforar el velo, se debe volver a cruzar la válvula aórtica para colocar un catéter pigtail desde el acceso arterial principal e implantar rápidamente a la THV ante la presencia de inestabilidad hemodinámica tras la laceración del velo.
Quinto paso: laceración del velo
-
– Antes de externalizar la guía de 300 cm, se debe crear una «forma en V» en la región central de la misma acodando y recortando la guía con una hoja de bisturí de 10 mm, en la parte acodada (figura 7). Luego, se debe avanzar la guía hasta que la forma en V entre en contacto con el velo.
-
– La posición del microcatéter se fija con un dispositivo de torsión para identificar la «V voladora».
-
– Cuando la forma en V está en posición correcta, se tira de los 2 extremos de la guía, lo cual coincide con una nueva electrificación de esta con el lápiz conectado al mismo lugar empleando para la perforación. En este caso, la potencia a aplicar es mayor y depende del tipo de velo: 50 vatios para velos porcinos, 70 para bovinos o nativos y 100 para velos gravemente calcificados.
-
– La inyección de una solución de dextrosa en cada catéter guía se puede realizar simultáneamente con la laceración. No obstante, si no se usar dextrosa, los catéteres deben lavarse antes de la laceración para retirar todo el contenido sanguíneo.
-
– Para evitar la inestabilidad hemodinámica provocada por la laceración prolongada de un velo sin implante de una THV, ambos velos deben abordarse simultáneamente para proteger ambos 2 ostium coronarios, si fuese necesario. Esto requiere accesos vasculares adicionales tales como el uso de un introductor de 14 a 18 Fr en una arteria femoral para 1 velo y acceso doble con 2 vainas (de 6 a 8 Fr) en la otra arteria femoral o el uso de otro introductor grande (de 14 a 18 Fr) en la otra femoral, pero con un mayor riesgo de sangrado y vascular.
Figura 7. Astato XS 20 (Asahi Intecc, Estados Unidos) con forma de «V voladora» para laceración del velo.
Sexto paso: Implante de la THV y posdilatación
-
– La THV se debe implantar inmediatamente después de la laceración. Luego, se retiran los catéteres empleados en la laceración. El pigtail colocado en el VI se usa para avanzar la guía rígida e implantar la THV. La altura de implantación debe compensar el riesgo de gradientes altos con una posición baja y el riesgo de OC con un implante demasiado alto. Un implante demasiado alto puede hacer que el faldón cubra el «triángulo de flujo»46. Se deben seguir las recomendaciones para cada tipo de THV, intentando mantener el rango inferior de profundidad recomendado, por ejemplo, para un dispositivo EVOLUT Pro+ (Medtronic, Estados Unidos) este rango es de 3 mm de profundidad utilizando la proyección de solapamiento de cúspides. Esto es de una importancia capital en las THV supraanulares.
-
– Los operadores deben ser muy cautos a la hora de posdilatar y con la fractura del anillo de la PVB en las intervenciones realizadas con la técnica BASILICA porque se puede aumentar el riesgo de CO.
-
– Si el riesgo de OC es demasiado alto, los operadores pueden proteger las coronarias con guías y stents no desplegados a discreción24.
-
– Tras implantar la THV, se debe comprobar la permeabilidad de los ostium coronarios mediante una aortografía(preferible a una inyección selectiva). Además, una valoración mediante ETE ayudaría a comprobar los resultados hemodinámicos y la ausencia de otras posibles complicaciones.
-
– Al igual que ocurre durante la realización de otros TAVI, la intervención debe concluir con una hemostasia adecuada y con la comprobación de los accesos.
Dispositivos de corte
Aunque los resultados de la técnica BASILICA son prometedores, se trata de una intervención compleja que requiere un equipo altamente experimentado. El ShortCut (Pi-Cardia, Israel) se diseñó para simplificar la laceración y separar los velos51. Inicialmente pensados para las PVB, estos dispositivos constan de un mango, un sistema de liberación y una unidad distal y se introducen a través de un introductor de 16 Fr en la arteria femoral común. La ETE ayuda a guiar su posicionamiento actuando mecánicamente sobre el velo51.
Dvir et al. informaron de los hallazgos de la experiencia preclínica y primera en seres humanos con este dispositivo. Estos autores probaron el dispositivo en 8 pacientes con PVB fallidas. En todos los pacientes, el TAVI tuvo éxito y no sobrevino ninguna OC. Tampoco se informaron eventos neurológicos y los pacientes fueron dados de alta con un buen estado clínico51. Aunque los resultados iniciales son prometedores, sigue habiendo una brecha de evidencia. Los resultados de registros más grandes o incluso ensayos comparadores de este dispositivo con la técnica BASILICA podrían confirmar la utilidad de este dispositivo en el futuro.
Intervención UNICORN
La intervención UNICORN (minimización de la obstrucción coronaria iatrogénica con aguja de radiofrecuencia) es una nueva técnica para el manejo del riesgo de OC en pacientes tratados de TAVI en TAVI. La primera experiencia llevada a cabo en seres humanos con esta nueva estrategia fue reportada por Chan et al. Estos autores emplearon una guía dentro de un sistema telescópico compuesto por 1 catéter guía Amplatz izquierdo-1 de 7 Fr (Cordis, Estados Unidos) y 1 catéter de soporte Navicross de 135 cm (Terumo, Japón) para atravesar un velo protésico mediante un impulso de radiofrecuencia52. Tras perforar el velo, se realizaron sucesivas dilataciones de la fenestración con balones de mayor calibre. El último paso permitió avanzar una prótesis expandible con balón a través del velo perforado con posterior despliegue de la prótesis valvular cardiaca percutánea52.
El implante de la prótesis expandible con balón a través de la fenestración finaliza el proceso de laceración y captura del velo anterior, minimizando el riesgo de retroceso del velo y la posible obstrucción o embolización del ostium coronario52. La primera experiencia tuvo éxito y demostró la viabilidad de esta estrategia; no obstante, se necesitan más datos sobre los resultados a largo plazo.
CONCLUSIONES
Para optimizar los resultados en intervenciones TAVI, es esencial identificar a aquellos pacientes en riesgo de OC. La mejor forma de identificarlos es realizando una valoración estructurada que incluya mediciones específicas mediante TC de la altura de la cúspide y la coronaria, la DVC, el volumen de calcio coronario y otras características anatómicas y de riesgos asociados a la intervención. Sumada a intervenciones preventivas apropiadas tales como la técnica BASILICA, esta valoración integral del paciente ayuda a reducir el riesgo de OC. No obstante, se necesitan más estudios que nos ayuden a validar las diferentes estrategias y los dispositivos dedicados emergentes para prevenir esta complicación. A medida que las intervenciones TAVI se vayan popularizando, la identificación y manejo del riesgo de OC seguirán siendo esenciales para optimizar los resultados y mejorar la seguridad de los pacientes.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial.
CONFLICTO DE INTERESES
A. Regueiro es consultor de Abbott Vascular, Meril Life y OpSens. X. Freixa es consultor de Abbott Vascular fuera del trabajo presentado. M. Sabaté es consultor de Abbott Vascular e iVascular fuera del trabajo presentado. Los demás autores no declararon ningún conflicto de intereses.
AGRADECIMIENTOS
F. Spione ha recibido una beca de investigación dentro del programa de doctorado Cardiopath.
BIBLIOGRAFÍA
1. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease:Executive Summary:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e35-e71.
2. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
3. Ribeiro HB, Webb JG, Makkar RR, et al. Predictive factors, management, and clinical outcomes of coronary obstruction following transcatheter aortic valve implantation:insights from a large multicenter registry. J Am Coll Cardiol. 2013;62:1552-1562.
4. Khan JM, Kamioka N, Lisko JC, et al. Coronary Obstruction From TAVR in Native Aortic Stenosis:Development and Validation of Multivariate Prediction Model. JACC Cardiovasc Interv. 2023;16:415-425.
5. Ojeda S, González-Manzanares R, Jimenez-Quevedo P, et al. Coronary Obstruction after Transcatheter Aortic Valve Implantation. Insights from the Spanish TAVI Registry. JACC Cardiovasc Interv. 2023;16:1208-1217.
6. Holmes DR, Jr., Nishimura RA, Grover FL, et al. Annual Outcomes With Transcatheter Valve Therapy:From the STS/ACC TVT Registry. J Am Coll Cardiol. 2015;66:2813-2823.
7. Ribeiro HB, Rodés-Cabau J, Blanke P, et al. Incidence, predictors, and clinical outcomes of coronary obstruction following transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves:insights from the VIVID registry. Eur Heart J. 2018;39:687-695.
8. Akinseye OA, Jha SK, Ibebuogu UN. Clinical outcomes of coronary occlusion following transcatheter aortic valve replacement:A systematic review. Cardiovasc Revasc Med. 2018;19:229-236.
9. Jabbour RJ, Tanaka A, Finkelstein A, et al. Delayed Coronary Obstruction After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2018;71:1513-1524.
10. Lederman RJ, Babaliaros VC, Rogers T, et al. Preventing Coronary Obstruction During Transcatheter Aortic Valve Replacement:From Computed Tomography to BASILICA. JACC Cardiovasc Interv. 2019;12:1197-1216.
11. Arai T, Lefévre T, Hovasse T, et al. Incidence and predictors of coronary obstruction following transcatheter aortic valve implantation in the real world. Catheter Cardiovasc Interv. 2017;90:1192-1197.
12. Dvir D, Webb J, Brecker S, et al. Transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves:results from the global valve-in-valve registry. Circulation. 2012;126:2335-2344.
13. Abramowitz Y, Chakravarty T, Jilaihawi H, et al. Clinical impact of coronary protection during transcatheter aortic valve implantation:first reported series of patients. EuroIntervention. 2015;11:572-581.
14. Yamamoto M, Shimura T, Kano S, et al. Impact of preparatory coronary protection in patients at high anatomical risk of acute coronary obstruction during transcatheter aortic valve implantation. Int J Cardiol. 2016;217:58-63.
15. Blanke P, Soon J, Dvir D, et al. Computed tomography assessment for transcatheter aortic valve in valve implantation:The vancouver approach to predict anatomical risk for coronary obstruction and other considerations. J Cardiovasc Comput Tomogr. 2016;10:491-499.
16. Achenbach S, Delgado V, Hausleiter J, Schoenhagen P, Min JK, Leipsic JA. SCCT expert consensus document on computed tomography imaging before transcatheter aortic valve implantation (TAVI)/transcatheter aortic valve replacement (TAVR). J Cardiovasc Comput Tomogr. 2012;6:366-80.
17. Holmes DR, Jr., Mack MJ, Kaul S, et al. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement. J Am Coll Cardiol. 2012;59:1200-1254.
18. Ribeiro HB, Nombela-Franco L, Urena M, et al. Coronary obstruction following transcatheter aortic valve implantation:a systematic review. JACC Cardiovasc Interv. 2013;6:452-461.
19. Buellesfeld L, Stortecky S, Kalesan B, et al. Aortic root dimensions among patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2013;6:72-83.
20. Tzimas G, Akodad M, Meier D, et al. Predicted vs Observed Valve to Coronary Distance in Valve-in-Valve TAVR:A Computed Tomography Study. JACC Cardiovasc Interv. 2023;16:2021-2030.
21. Pilgrim T, Tomii D. Predicting Coronary Obstruction After TAVR:Better Safe Than Sorry. JACC Cardiovasc Interv. 2023;16:426-428.
22. Fetahovic T, Hayman S, Cox S, Cole C, Rafter T, Camuglia A. The Prophylactic Chimney Snorkel Technique for the Prevention of Acute Coronary Occlusion in High Risk for Coronary Obstruction Transcatheter Aortic Valve Replacement/Implantation Cases. Heart Lung Circ. 2019;28:e126-e130.
23. Vemulapalli S, Carroll JD, Mack MJ, et al. Procedural Volume and Outcomes for Transcatheter Aortic-Valve Replacement. N Engl J Med. 2019;380:2541-2550.
24. Khan JM, Dvir D, Greenbaum AB, et al. Transcatheter Laceration of Aortic Leaflets to Prevent Coronary Obstruction During Transcatheter Aortic Valve Replacement:Concept to First-in- Human. JACC Cardiovasc Interv. 2018;11:677-689.
25. Bapat V. Technical pitfalls and tips for the valve-in-valve procedure. Ann Cardiothorac Surg. 2017;6:541-552.
26. Barbanti M. Avoiding Coronary Occlusion and Root Rupture in TAVI - The Role of Pre- procedural Imaging and Prosthesis Selection. Interv Cardiol. 2015;10:94-97.
27. Dvir D, Leipsic J, Blanke P, et al. Coronary obstruction in transcatheter aortic valve-in- valve implantation:preprocedural evaluation, device selection, protection, and treatment. Circ Cardiovasc Interv. 2015;8:e002079.
28. Valvo R, Costa G, Barbanti M. How to Avoid Coronary Occlusion During TAVR Valve-in- Valve Procedures. Front Cardiovasc Med. 2019;6:168.
29. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
30. Landes U, Webb JG, De Backer O, et al. Repeat Transcatheter Aortic Valve Replacement for Transcatheter Prosthesis Dysfunction. J Am Coll Cardiol. 2020;75:1882-1893.
31. Gallo M, Fovino LN, Blitzer D, et al. Transcatheter aortic valve replacement for structural degeneration of previously implanted transcatheter valves (TAVR-in-TAVR):a systematic review. Eur J Cardiothorac Surg. 2022;61:967-976.
32. Barbanti M, Webb JG, Tamburino C, et al. Outcomes of Redo Transcatheter Aortic Valve Replacement for the Treatment of Postprocedural and Late Occurrence of Paravalvular Regurgitation and Transcatheter Valve Failure. Circ Cardiovasc Interv. 2016;9:e003930.
33. Tarantini G, Fabris T, Nai Fovino L. TAVR-in-TAVR and coronary access:importance of preprocedural planning. EuroIntervention. 2020;16:e129-e132.
34. Buzzatti N, Romano V, De Backer O, et al. Coronary Access After Repeated Transcatheter Aortic Valve Implantation:A Glimpse Into the Future. JACC Cardiovasc Imaging. 2020;13:508-515.
35. Percy ED, Harloff MT, Hirji S, et al. Nationally Representative Repeat Transcatheter Aortic Valve Replacement Outcomes:Report From the Centers for Medicare and Medicaid Services. JACC Cardiovasc Interv. 2021;14:1717-1726.
36. Komatsu I, Mackensen GB, Aldea GS, Reisman M, Dvir D. Bioprosthetic or native aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction. Part 1:how to evaluate patients for BASILICA. EuroIntervention. 2019;15:47-54.
37. Nai Fovino L, Scotti A, Massussi M, et al. Coronary Angiography After Transcatheter Aortic Valve Replacement (TAVR) to Evaluate the Risk of Coronary Access Impairment After TAVR-in-TAVR. J Am Heart Assoc. 2020;9:e016446.
38. Redondo A, Baladrón Zorita C, Tchétché D, et al. Commissural Versus Coronary Optimized Alignment During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2022;15:135-146.
39. Rodés-Cabau J, Webb JG, Cheung A, et al. Transcatheter aortic valve implantation for the treatment of severe symptomatic aortic stenosis in patients at very high or prohibitive surgical risk:acute and late outcomes of the multicenter Canadian experience. J Am Coll Cardiol. 2010;55:1080-1090.
40. Thomas M, Schymik G, Walther T, et al. Thirty-day results of the SAPIEN aortic Bioprosthesis European Outcome (SOURCE) Registry:A European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve. Circulation. 2010;122:62-69.
41. Chakravarty T, Jilaihawi H, Nakamura M, et al. Pre-emptive positioning of a coronary stent in the left anterior descending artery for left main protection:a prerequisite for transcatheter aortic valve-in-valve implantation for failing stentless bioprostheses?Catheter Cardiovasc Interv. 2013;82:E630-E636.
42. González LF, Mata RB, Roman KG-S, Villa JA. Emergent Chimney Stent to Treat Left Main Occlusion Following Valve-In-Valve Transfemoral Aortic Implantation Chimney Stent Following Valve-In-Valve TAVI. J Cardiovasc Thorac Surg.2018;3:1-2.
43. Spaziano M, Akodad M, Hovasse T, Lefévre T, Bouvier E, Chevalier B. Simultaneous TAVR and Left Main «Chimney»Stenting in a Patient With Low Left Main Height. JACC Cardiovasc Interv. Oct 23 2017;10:e185-e187.
44. Mercanti F, Rosseel L, Neylon A, et al. Chimney Stenting for Coronary Occlusion During TAVR:Insights From the Chimney Registry. JACC Cardiovasc Interv. 2020;13:751-761.
45. Khan JM, Greenbaum AB, Babaliaros VC, et al. The BASILICA Trial:Prospective Multicenter Investigation of Intentional Leaflet Laceration to Prevent TAVR Coronary Obstruction. JACC Cardiovasc Interv. 2019;12:1240-1252.
46. Komatsu I, Mackensen GB, Aldea GS, Reisman M, Dvir D. Bioprosthetic or native aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction. Part 2:how to perform BASILICA. EuroIntervention. 2019;15:55-66.
47. Cepas-Guillén P, Gabani R, Giménez-Milá M, Sanchis L, Freixa X, Regueiro A. Safety and efficacy of the BASILICA technique in patients at high risk of coronary obstruction undergoing TAVI. Rev Esp Cardiol. 2024;77:181-183.
48. Khan JM, Greenbaum AB, Babaliaros VC, et al. BASILICA Trial:One-Year Outcomes of Transcatheter Electrosurgical Leaflet Laceration to Prevent TAVR Coronary Obstruction. Circ Cardiovasc Interv. 2021;14:e010238.
49. Kitamura M, Majunke N, Holzhey D, et al. Systematic use of intentional leaflet laceration to prevent TAVI-induced coronary obstruction:feasibility and early clinical outcomes of the BASILICA technique. EuroIntervention. 2020;16:682-690.
50. Khan JM, Bruce CG, Babaliaros VC, Greenbaum AB, Rogers T, Lederman RJ. TAVR Roulette:Caution Regarding BASILICA Laceration for TAVR-in-TAVR. JACC Cardiovasc Interv. 2020;13:787-789.
51. Dvir D, Leon MB, Abdel-Wahab M, et al. First-in-Human Dedicated Leaflet Splitting Device for Prevention of Coronary Obstruction in Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2023;16:94-102.
52. Chan KE, Tai-Leung Chan D, Lam CS, et al. First-in-Human Undermining Iatrogenic Coronary Obstruction With Radiofrequency Needle (UNICORN) Procedure During Valve-in-Valve Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2022;15:928-931.
* Autor para correspondencia.
Correo electrónico: (A. Regueiro).
@anderregueiro; @victorArevalos; @freixa_xavier; @sbrugaletta; @lsanchisruiz; @fraspio; @hospitalclinic

RESUMEN
El estudio de la fisiología coronaria ha pasado de ser una técnica de investigación hace algunos años a convertirse en una herramienta necesaria para el abordaje óptimo de los pacientes con enfermedad coronaria epicárdica y para evaluar la microcirculación. La realización de estas técnicas requiere el uso de una guía de presión para la que hacen falta medios técnicos, tiempo y práctica en su ejecución, y es en parte por ello que su utilización es baja. Existe la necesidad de conocer la evidencia actualizada, las técnicas disponibles y la forma idónea de aplicarlas para ofrecer el mayor beneficio a los pacientes. Esta revisión ofrece un resumen práctico sobre el estado actual de los estudios de fisiología coronaria, con el fin de facilitar el mejor uso posible de esta herramienta diagnóstica esencial.
Palabras clave: Enfermedad coronaria. Fisiología coronaria. Angina microvascular.
ABSTRACT
The study of coronary physiology has evolved from a research topic to a necessary component for the optimal management of patients with coronary artery disease when assessing both epicardial and microvascular coronary segments. The performance of these techniques requires the use of pressure wires with additional supporting systems, time, and practice, which explains the overall low rate of usage. It is essential to know the updated evidence, the techniques available, and how to perform them properly to offer the greatest possible benefit to our patients. This review provides a practical overview on coronary physiology, and it is ultimately aimed at improving the quality of care.
Keywords: Coronary artery disease. Coronary physiology. Microvascular angina.
Abreviaturas CFR: reserva flujo coronario. iFR: índice instantáneo sin ondas. IMR: índice de resistencia microcirculatoria. Pd/Pa: cociente de presión coronaria distal/aórtica. QFR: cociente de flujo cuantitativo. RFF: reserva fraccional de flujo. RMh: resistencia microvascular hiperémica. SCA: síndrome coronario agudo.
INTRODUCCIÓN
Durante décadas, la angiografía ha sido el método de referencia para diagnosticar la enfermedad coronaria. Sin embargo, es una técnica que ignora la repercusión fisiológica de las estenosis coronarias epicárdicas. Por ello, desde finales del siglo xx se despertó un gran interés por caracterizar funcionalmente la circulación coronaria gracias al desarrollo de varias herramientas, tanto invasivas (guías intracoronarias específicas) como no invasivas (índices derivados de la angiografía). Tal es así que hemos asistido a un cambio de paradigma en el diagnóstico y el manejo de la enfermedad coronaria, que ha llevado a pasar de una estrategia basada en la angiografía a una estrategia basada en la isquemia1. Esto ha sido posible gracias a la abundante evidencia científica que avala el uso de índices fisiológicos y que ha hecho que la estrategia basada en la isquemia alcance el grado máximo de recomendación en las últimas guías europeas de revascularización miocárdica2. Sin embargo, la publicación reciente de algunos ensayos clínicos ha cuestionado el impacto de la fisiología coronaria en determinados escenarios, como la enfermedad multivaso y el síndrome coronario agudo (SCA) con elevación del segmento ST3,4. Por otro lado, estas técnicas requieren tiempo, instrumentación invasiva coronaria y, en ocasiones, la administración de fármacos vasodilatadores que no siempre son bien tolerados por los pacientes, además de cierta experiencia clínica. Por todo ello, la adopción de las técnicas de fisiología para guiar la revascularización continúa lejos de ser mayoritaria5.
En los siguientes párrafos se analizan, con un enfoque práctico, las valoraciones fisiológicas de las estenosis coronarias y de la microcirculación mediante índices invasivos e índices derivados de la angiografía. Los detalles de los conceptos fisiológicos subyacentes a cada índice serán obviados o se indicarán textos específicos para su consulta.
Valoración fisiológica de las estenosis coronarias
Índices invasivos
La reserva fraccional de flujo coronario (RFF) es el flujo sanguíneo miocárdico máximo en presencia de una estenosis respecto al flujo normal esperado en ausencia de estenosis; se expresa como una fracción de su valor normal esperado. Se obtiene midiendo la presión intracoronaria con guías específicamente desarrolladas para tal fin. Su determinación requiere la vasodilatación de la microcirculación mediante el uso de fármacos, principalmente adenosina —se ha descrito el uso de regadenosón intravenoso y nitroprusiato intracoronario con resultados equivalentes6, así como la medición del cociente de presión coronaria distal/aórtica (Pd/Pa) mínimo tras la inyección de contraste intracoronario (cRFF)7— y, por lo tanto, se trata de un índice fisiológico coronario hiperémico. Se basa en que en situación de hiperemia máxima se alcanza una relación lineal entre el flujo relativo y la presión intracoronaria relativa, ya que la resistencia coronaria es estable y mínima8. Su resultado es independiente de la microcirculación, la frecuencia cardiaca, la presión arterial y otras variables hemodinámicas. La guía europea para el abordaje del síndrome coronario crónico le otorga una indicación de tipo I y una evidencia de clase A para la estratificación del riesgo en pacientes sintomáticos que no responden de manera adecuada al tratamiento médico y en pacientes asintomáticos en quienes las pruebas no invasivas muestran alto riesgo de eventos, y de tipo IIa en aquellos en los que los resultados de las pruebas no invasivas son no concluyentes1.
En la tabla 1 se encuentra un resumen de los diferentes estudios FAME (Fractional Flow Reserve versus Angiography for Multivessel Evaluation)4,9-11. Los resultados refuerzan la necesidad de continuar investigando en el campo de la fisiología y de individualizar el tratamiento de los pacientes dentro de un equipo multidisciplinario.
Tabla 1. Resumen de los resultados de los estudios FAME
| Estudio | Año | n | Población | Comparación | Seguimiento | Objetivo primario | Muerte | Infarto de miocardio | Nueva revascularización | Otros resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| FAME9 | 2009 | SCC: 677 AI: 328 | Estenosis ≥ 50% en 2 o más vasos, consideradas para ICP | ICP con DES guiada por angiografía frente a guiada por RFF (≤ 0,80) | 1 año | Muerte, IAM, nueva revascularización: 13,2 frente a 18,3%; HR = 0,72; IC95%, 0,54-0,96 | 1,8 frente a 3,0%; HR = 0,58; IC95%, 0,26-1,32 | 5,7 frente a 8,7%; HR = 0,66; IC95%, 0,42-1,04 | 6,5 frente a 9,5%; HR = 0,68; IC95%, 0,45-1,05 | Sin diferencias en eventos por separado Sin diferencias en tasa de angina Menor uso de recursos con RFF |
| FAME II10 | 2012 | SCC: 888 | ≥ 1 estenosis en una arteria coronaria epicárdica con RFF ≤ 0,80 | ICP con stents de 2.a generación y TMO frente a TMO | 7 meses (media) | Muerte, IAM, revascularización urgente: 4,3 frente a 12,7%; HR = 0,32; IC95%, 0,19-0,53 | 0,2 frente a 0,7%; HR = 0,33; IC95%, 0,03-3,17 | 3,4 frente a 3,2%; HR = 1,05; IC95%, 0,51-2,19 | Urgente: 1,6 frente a 11,1%; HR = 0,13; IC95%, 0,06-0,30 No urgente: 1,6 frente a 8,6%; HR = 0,17; IC95%, 0,08-0,39 | Sin diferencias significativas en combinado de muerte y IAM, ni en muerte de origen cardiaco |
| FAME II - 5 años11 | 2018 | SCC: 888 | ≥ 1 estenosis en una arteria coronaria epicárdica con RFF ≤ 0,80 | ICP con stents de 2.ª generación y TMO frente a TMO | 5 años | Muerte, IAM, revascularización urgente: 13,9 frente a 27,0%; HR = 0,46; IC95%, 0,34-0,63 | 5,1 frente a 5,2%; HR = 0,98; IC95%, 0,55-1,75 | 8,1 frente a 12,0%; HR = 0,66; IC95%, 0,43-1,00 | Urgente: 6,3 frente a 21,1%; HR = 0,25; IC95%, 0,18-0,41 No urgente: 7,6 frente a 35,1%; HR = 0,18; IC95%, 0,12-0,26 | Sin diferencias significativas en muerte y IAM El porcentaje de pacientes con angina es menor durante los 3 primeros años; la diferencia no es significativa a los 5 años |
| FAME III4 | 2022 | SCC: 1500 | Enfermedad de 3 vasos | Diseño de no inferioridad: ICP guiada por RFF (≤ 0,80) frente a cirugía de revascularización coronaria | 1 año | Muerte, IAM, ictus, nueva revascularización: 10,6 frente a 6,9%; HR = 1,5; IC95%, 1,1-2,2; p = 0,35 para no inferioridad | 1,6 frente a 0,9%; HR = 1,7; IC95%, 0,7-4,3 | 5,2 frente a 3,5%; HR = 1,5; IC95%, 0,9-2,5 | 5,9 frente a 3,9%; HR = 1,5; IC95%, 0,9-2,3 | Sin diferencias significativas en combinado de muerte, infarto e ictus Menos sangrado mayor, daño renal, FA y rehospitalización a 30 días con ICP |
|
AI: angina inestable; DES: stent liberador de fármacos; FA: fibrilación auricular; FAME: Fractional Flow Reserve Versus Angiography for Multivessel Evaluation; RFF: reserva fraccional de flujo; HR: hazard ratio; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; SCC: síndrome coronario crónico; TMO: tratamiento médico óptimo. |
||||||||||
La hiperemia, especialmente la obtenida con adenosina intravenosa, necesaria para la obtención de la RFF, requiere tiempo, es costosa, altera la hemodinámica sistémica y puede provocar efectos secundarios desagradables (trastornos de la conducción, malestar torácico, náuseas, disnea, mareos, sofocos y cefalea). Por ello, desde su introducción, los índices de reposo, que no requieren fármacos hiperémicos, rápidamente ganaron popularidad. En general, estos índices son fásicos, a diferencia de la RFF (que se basa en presiones medias), y se miden en la parte media o tardía del periodo diastólico, cuando de manera natural hay mayor flujo transestenótico6. Aunque la primera descripción de un índice de reposo la realizaron Grüntzig et al.12 en su publicación inicial de la angioplastia coronaria, su uso clínico no se extendió hasta la aparición del índice instantáneo sin ondas (iFR, Philips, Países Bajos). Se llevaron a cabo varios estudios para comparar la concordancia diagnóstica del iFR y la RFF, así como para comparar el iFR, la RFF y otros parámetros de referencia de isquemia13,14. Dos ensayos clínicos multicéntricos aleatorizados, el DEFINE-FLAIR (Functional Lesion Assessment of Intermediate Stenosis to Guide Revascularization) y el iFR-SWEDEHEART (Evaluation of iFR vs RFF in Stable Angina or Acute Coronary Syndrome) aleatorizaron a 4.529 pacientes para ser tratados mediante revascularización percutánea guiada por RFF o por iFR, tanto con SCA como con síndrome coronario crónico15,16. Ambos estudios demostraron la no inferioridad del iFR respecto a la RFF, con bajas tasas de eventos, definidos como muerte por todas las causas, infarto agudo de miocardio o revascularización no planeada a 1 año: iFR 4,12% frente a RFF 4,05% (hazard ratio [HR] = 1,13; intervalo de confianza del 95% (IC95%), 0,72-1,79; p = 0,60). Además, en los grupos de iFR, el número de estenosis funcionalmente significativas y las tasas de revascularización fueron inferiores, la duración de la intervención fue menor y hubo un porcentaje más bajo de pacientes que sufrieron síntomas adversos asociados a la administración de adenosina15,16. En los últimos años se han desarrollado diferentes índices de reposo, fundamentados en el concepto descrito previamente: DFR (Diastolic Hyperaemia-Free Ratio, Boston Scientific, Estados Unidos)17 y cociente de presiones diastólicas en reposo (dPR) (ACIST, Estados Unidos)18,19. Con la excepción del ciclo cardiaco completo en reposo (RFR) (Abbott, Estados Unidos)18, que es un índice no hiperémico que valora la presión a lo largo de todo el ciclo cardiaco (tabla 2), todos los índices de reposo tienen una alta reproducibilidad y son idénticos al iFR, tanto numéricamente como en su concordancia con la RFF19. La capacidad pronóstica de la relación Pd/Pa es menos robusta que la RFF21, pues su correlación con la RFF en lesiones no culpables de pacientes que han tenido un SCA es del 80%22; con la aparición de los índices no hiperémicos, su interés clínico es escaso.
Tabla 2. Índices para el estudio de estenosis coronarias epicárdicas
| Vasodilatación | Periodo del ciclo | Punto de corte | Evidencia científica | |
|---|---|---|---|---|
| RFF | Hiperémico | – | ≤ 0,80 | ER: FAME, FAME II, FAME III, DEFER, DANAMI-3-PRIMULTI, COMPARE ACUTE, FLOWER-MI, FUTURE |
| iFR | No hiperémico | Diastólico | ≤ 0,89 | ER: DEFINE-FLAIR, iFR-SWEDEHEART Observacional: SYNTAX II |
| DFR | No hiperémico | Diastólico | ≤ 0,89 | Observacional: Johnson et al.14 |
| dPR | No hiperémico | Diastólico | ≤ 0,89 | Observacional: Lee et al.15, Van’t Veer et al.16 |
| RFR | No hiperémico | Todo el ciclo | ≤ 0,89 | Observacional: Lee et al.15 |
| Pd/Pa | No hiperémico | Todo el ciclo | 0,91-0,93 | Observacional: Kobayashi et al.20, Lee et al.15 |
|
DFR: diastolic hyperaemia-free ratio; dPR: cociente de presiones diastólicas en reposo; ER: estudios aleatorizados; RFF: reserva fraccional de flujo; iFR: índice instantáneo sin ondas; Pd/Pa: cociente de presión coronaria distal/aórtica; RFR: ciclo cardiaco completo en reposo. |
||||
En el material adicional se ofrece una descripción detallada del manejo práctico de los índices fisiológicos invasivos.
Procedimiento
En la figura 1 se muestran los pasos para medir los índices de reposo y de RFF, y en el material adicional hay una descripción detallada paso a paso. La figura 2 ilustra la utilidad de la guía de presión para el diagnóstico y la localización de estenosis significativas.
Figura 1. Pasos para la realización de guía de presión intracoronaria para medir los índices de reposo y la reserva fraccional de flujo. Ao: aorta; RFF: reserva fraccional de flujo; IC: intracoronaria; IV: intravenosa. * Catéter purgado con solución salina y sin introductor de guía.
Problemas, causas, soluciones y escenarios específicos
En la tabla 3 se exponen algunos de los principales problemas que pueden encontrarse al hacer un estudio con guía de presión, sus causas y sus soluciones. En el material adicional se encuentra una explicación detallada para hacer frente a tales problemas, así como una descripción del uso de la guía de presión en diferentes escenarios clínicos (enfermedad coronaria difusa, lesiones ostiales, estenosis aórtica, SCA, valoración tras angioplastia).
Tabla 3. Guía de presión: principales problemas, causas y soluciones
| Problema | Causas | Recomendaciones |
|---|---|---|
| Amortiguación de la presión aórtica | Desproporción catéter/vaso Lesión ostial | Utilizar catéter guía de menor diámetro Desenganchar el ostium para realizar mediciones |
| Presión aórtica falsamente disminuida | Conexiones al catéter guía sueltas No retirar introductor de guía Presencia de contraste en el catéter | Asegurar bien todas las conexiones antes de medir Siempre retirar introductor de guía Purgar catéter guía con solución salina |
| Pérdida de la ecualización (drift) | Necesidad de múltiples conexiones/desconexiones Procedimiento prolongado | Repetir ecualización y medición Ecualizar antes de realizar mediciones tras la ICP Utilizar guías con fibra óptica cuando se prevea un procedimiento prolongado |
| Espasmo, pseudoestenosis | Presencia y manipulación de guía intracoronaria Excesiva tortuosidad | Siempre administrar nitratos IC previo al procedimiento Dosis adicional de nitratos IC si se sospecha pseudoestenosis Considerar métodos alternativos en caso de excesiva tortuosidad |
| Escasa respuesta a adenosina | Consumo de cafeína, teobromina (chocolate), teofilina Inadecuada administración intracoronaria | Advertir a los pacientes de que no consuman café, chocolate ni teofilina 24 h antes del procedimiento Administrar adenosina IC o infusión IV a 210 μg/kg/min Asegurar adecuado sondaje para administrar adenosina IC No utilizar adenosina IC con catéter con agujeros laterales |
| Excesiva variabilidad de las mediciones | Movimientos del paciente Arritmias (FA) | Asegurar que el paciente esté confortable Repetir la medición en caso de tos o movimientos bruscos Seleccionar los puntos de medición manualmente en la consola |
|
FA: fibrilación auricular; IC: intracoronario/a; ICP: intervención coronaria percutánea; IV: intravenosa. |
||
Índices derivados de la angiografía
El estudio fisiológico de las estenosis epicárdicas se encuentra limitado en la práctica clínica habitual por la necesidad del uso de una guía de presión y, en algunos casos, de agentes hiperémicos, que conllevan un aumento del coste del procedimiento y la posibilidad de que aparezcan efectos secundarios23. Por ello, se han generado nuevos índices derivados de la angiografía, tales como el cociente de flujo cuantitativo (QFR), la RFFAngio, el CAAS-vRFF y el vRFF. Estos índices se basan en la reconstrucción tridimensional del árbol coronario a través de la angiografía, usando posteriormente una dinámica computacional de fluidos o simplificaciones matemáticas de esta como subrogado del flujo coronario.
El QFR (Qangio XA 3D, Medis Medical Imaging Systems, Países Bajos) emplea una reconstrucción 3D de la angiografía, y luego, asumiendo una presión y una velocidad de flujo constantes a lo largo de un vaso epicárdico normal, se computa un proxy del valor de RFF a través de distintos modelos: el modelo fijo (fQFR) usa información de una base de datos en la que previamente se han obtenido valores de RFF y velocidades de flujo; el modelo de QFR-contraste (cQFR) tiene en cuenta la velocidad a la que fluye el contraste administrado en la arteria epicárdica mediante recuento de frames; y el modelo QFR-adenosina (aQFR) lo valora tras la inducción de hiperemia mediante la administración de adenosina. Los tres modelos han sido evaluados frente a la RFF y se ha obtenido una mejor precisión diagnóstica con aQFR (87%) y cQFR (86%)24. Varios estudios posteriores han demostrado la utilidad y la alta precisión de este método para el diagnóstico funcional de una estenosis epicárdica25,26, así como la seguridad que confiere la decisión de revascularización o no basada en este27,28. El estudio FAVOR III China, que incluyó 3.825 pacientes, encontró una disminución de los eventos mayores (HR = 0,65; IC95%, 0,51-0,83; p = 0,0004) en los pacientes a quienes se difirió la revascularización basándose en un QFR ≤ 0,80, impulsado por menos infartos de miocardio y menos revascularizaciones guiadas por isquemia, en comparación con la revascularización guiada por angiografía28.
Otro índice es el CAAS-vRFF (Cardiovascular Angiographic Analysis System for vessel RFF, CAAS-vRFF, Pie Medical, Países Bajos), que se basa en el uso de una reconstrucción 3D de la angiografía adquirida y la posterior computación del gradiente de presión a través de una lesión. Su estudio de validación incluyó pacientes con enfermedad estable y SCA sin elevación del segmento ST, y mostró una precisión del 93% para el diagnóstico de lesiones con RFF ≤ 0,80, así como una correlación interobservador del 95%29.
También es de amplio uso el índice RFFAngio (Cathworks, Israel), que utiliza, a diferencia de los previos, al menos tres proyecciones angiográficas para realizar un mapeado funcional 3D. Fearon et al.30 lo evaluaron en una amplia población y encontraron una sensibilidad del 94%, una especificidad del 91% y una precisión diagnóstica del 92% para valores de RFF ≤ 0,80, con alta consistencia interobservador (96%).
Existen además otros índices, como el vRFF (virtual Fractional Flow Reserve, VirtuHeart Medical Physics Group, Reino Unido), que en su estudio de validación llegó a demostrar una alta precisión diagnóstica y unas elevadas sensibilidad y especificidad (97%, 86% y 100%, respectivamente)31, si bien aún se encuentra en fase de experimentación.
Recientemente, un metanálisis realizado por Collet et al.32 ha mostrado que las mediciones de RFF derivadas de la angiografía presentan una sensibilidad global del 89% y una especificidad del 90% respecto a la determinación invasiva de la RFF. No obstante, es posible que exista una zona gris relativamente amplia (0,75-0,86) en la que la determinación invasiva de la RFF podría estar indicada33. Asumiendo esta zona gris, la precisión diagnóstica de estos métodos podría llegar a ser > 95% —como se demostró en el estudio FAVOR II China25—, evitando la necesidad de un estudio invasivo en el 64% de las lesiones34.
A pesar de sus resultados prometedores, estos análisis presentan ciertas limitaciones. Una de las principales es obtener angiografías adecuadas para analizar sin desplazamientos (panning) ni superposición de estructuras35. Otra es la anatomía, ya que lesiones ostiales o en bifurcación presentan mayor dificultad para delinear su contorno y, por tanto, su estudio podría verse sesgado. En un análisis reciente sobre la población del estudio SYNTAX II, la evaluación por QFR frente a la estrategia híbrida iFR/RFF mostró una precisión diagnóstica del QFR cercana al 74%, con un 8,3% de falsos positivos y un 17,9% de falsos negativos, siendo el principal motivo de esta discordancia las lesiones en ramas marginales, vasos pequeños o zonas de bifurcación35. Además, de especial interés resulta el estado de la microcirculación, ya que estas técnicas asumen una máxima vasodilatación para computar la presión desde el flujo obtenido. No obstante, el grado de respuesta a la hiperemia —ya sea por contraste o por agentes hiperémicos farmacológicos— es variable en función del estado de la microcirculación de cada paciente, pudiendo incurrir en error. Mejía-Rentería et al.36 estudiaron la influencia que el estado de la microcirculación ejerce sobre este tipo de evaluaciones no invasivas de la reserva de flujo coronario (CFR), y observaron que la mayor fuente de discordancia venía dada por una alteración en la función microvascular, medida como un valor alterado del índice de resistencia microcirculatoria (IMR) o situación de infarto agudo de miocardio. Se podría pensar que el tiempo de procesado de la imagen y su análisis puede ser mayor que el de la realización de un estudio fisiológico con guía de presión. No obstante, con el debido entrenamiento, se ha demostrado que el estudio se puede hacer con mayor rapidez incluso que la determinación clásica de la RFF37,38. Por último, una limitación pendiente de resolver es la variabilidad (concordancia de 0,01 ± 0,08 para medidas repetidas), que depende del observador, la calidad de la angiografía y el grado de estenosis valorado por RFF39.
En el material adicional se ofrece una descripción detallada sobre el manejo práctico del QFR, la RFFAngio y el vRFF.
Valoración fisiológica de la microcirculación coronaria
Índices invasivos
Aunque la enfermedad coronaria comúnmente se relaciona con la afectación de las arterias epicárdicas, hasta un 25% de los pacientes que sufren angina típica no presentan estenosis epicárdicas significativas1. La disfunción microvascular es un factor contribuyente de la angina y el tratamiento individualizado ha demostrado mejorar la calidad de vida de los pacientes40, por lo que un adecuado diagnóstico intracoronario de la enfermedad microvascular en pacientes sintomáticos, sin estenosis o con estenosis coronarias moderadas, tiene una recomendación IIa en las guías europeas de síndrome coronario crónico1.
Las arteriolas, principal componente de la resistencia vascular coronaria, tienen un papel muy dinámico en el flujo sanguíneo coronario, reguladas por múltiples mecanismos metabólicos, miogénicos, endoteliales, neurales y hormonales41,42. Las alteraciones de la microcirculación pueden ocurrir por cualquiera de estas vías y ofrecer un pronóstico desfavorable, similar al de la enfermedad epicárdica obstructiva43. El tamaño de estos vasos hace imposible su valoración angiográfica, siendo indispensable el uso de otros métodos. La CFR mide la relación de flujo coronario en hiperemia respecto al flujo en reposo, con valores normales entre 3 y 4, que indican que el flujo coronario se incrementa de 3 a 4 veces con la hiperemia máxima. Los resultados de la CFR representan la capacidad de incrementar el flujo tanto de las arterias epicárdicas como de la microvasculatura. Una CFR reducida se asocia con un aumento significativo de la mortalidad (HR = 3,78; IC95%, 2,39-5,97) y de eventos cardiovasculares mayores (HR = 3,42; IC95%, 2,92-3,99) en diversas condiciones, incluyendo pacientes con SCA, disfunción microvascular, trasplante cardiaco y diabetes mellitus44.
La resistencia microcirculatoria se puede medir por termodilución o por Doppler intravascular, en condiciones basales o en hiperemia45. El IMR, índice de referencia para el estudio de la microcirculación, se basa en la medición de la presión distal y del flujo coronario por termodilución, valorado por la inversa del tiempo de llegada (tránsito) de solución salina a temperatura ambiente al segmento distal de la arteria durante la hiperemia máxima. Un IMR elevado, por encima de 25, se ha asociado a peor pronóstico cardiovascular; la combinación de un CFR bajo y un IMR alto tiene peor pronóstico46,47. Recientemente se ha descrito un nuevo método basado en termodilución y un flujo continuo de solución salina (catéter RayFlow, Hexacath, Francia), que permite calcular el flujo coronario absoluto en condiciones hiperémicas y la resistencia microcirculatoria absoluta48,49, con la ventaja de que no depende de los valores basales, lo que hace que la influencia de los cambios hemodinámicos sea menor, y además es independiente del operador. Su utilidad clínica todavía tiene que demostrarse, dada la limitación en la interpretación de valores absolutos.
Con la guía Doppler se puede calcular el CFR dividiendo la velocidad de flujo en hiperemia entre la velocidad de flujo basal, y se considera un punto de corte ≤ 2,5 como diagnóstico de disfunción microvascular en arterias epicárdicas sanas50. El valor pronóstico de la CFR medida de forma invasiva por Doppler en pacientes con angina es independiente de los hallazgos de pruebas no invasivas, con una HR de 2,97 (IC95%, 1,39-6,34) a 5 años para eventos cardiovasculares mayores51. También se calcula la resistencia microcirculatoria hiperémica (RMh) dividiendo la presión intracoronaria entre la velocidad de flujo hiperémica, considerando que una RMh > 1,9 mmHg·cm−1·s−1 es diagnóstica de disfunción microcirculatoria50, aunque existen reportes de que una RMh ≥ 2,5 mmHg·cm−1·s−1 tiene mejores sensibilidad y especificidad para el diagnóstico de disfunción microvascular52.
Abordaje práctico
Termodilución
En el material adicional se ofrece una descripción detallada del manejo práctico de la termodilución, tanto mediante bolos (figura 3) como en infusión continua (figura 4), y del estudio fisiológico mediante guía Doppler (figura 5).
Figura 2. A: angiografía de arteria coronaria derecha que muestra afectación difusa, con lesiones más graves a nivel distal (asteriscos). B: grabación del cociente de reposo de ciclo completo (RFR) en retirada que muestra 2 saltos focales correspondientes a los asteriscos marcados en A. C: resultado angiográfico final tras la implantación de 2 stents farmacoactivos. D: RFR final con resultado óptimo de 0,98.
Figura 3. Pasos para el estudio de la microcirculación por termodilución por bolos. Ao: aorta; CFR: reserva de flujo coronario; RFF: reserva fraccional de flujo; IC: intracoronaria; IV: intravenosa; IMR: índice de resistencia microcirculatoria. * Catéter purgado con solución salina y sin introductor de guía.
Figura 4. Pasos para el estudio de la microcirculación por termodilución continua. Ao: aorta; IC: intracoronaria; IV: intravenosa. a Catéter purgado con solución salina y sin introductor de guía. b No apagar el transmisor durante todo el procedimiento.
Figura 5. Pasos para el estudio de la microcirculación con guía Doppler. Ao: aorta; CFR: reserva de flujo coronario; RMh: resistencia microcirculatoria hiperémica; IC: intracoronaria; IV: intravenosa; Pd: presión coronaria distal. * Catéter purgado con solución salina y sin introductor de guía.
Índices derivados de la angiografía
Si bien la evaluación del estado de la microcirculación mediante el uso del IMR ha demostrado ampliamente su beneficio clínico50,53, su estudio en la práctica clínica habitual es limitado debido a la necesidad del uso de una guía de presión y de agentes hiperémicos. Por ello, recientemente se han desarrollado alternativas para la estimación del IMR a partir de la angiografía (IMRAngio) mediante la aplicación de dinámica computacional de fluidos, para lo que existen varias fórmulas.
La primera descripción la realizaron De Maria et al.54, quienes observaron una buena capacidad diagnóstica (92,4%) del IMRAngio frente al IMR invasivo usando otra fórmula derivada del aQFR en pacientes con infarto de miocardio, así como una alta correlación entre un valor alto de IMRAngio y la presencia de obstrucción microvascular detectada por resonancia magnética.
El IMRangio se ha estudiado tanto en pacientes estables como en aquellos que presentaban un SCA55, obteniendo una buena correlación entre IMR e IMRAngio y una alta precisión diagnóstica del último si se usaba adenosina, tanto en pacientes con SCA como en pacientes estables. No obstante, sí se observó que la relación entre IMR e IMRAngio derivado de cQFR (NH-IMRAngio) no se mantenía en arterias no culpables del evento agudo ni en casos de mayor estabilidad clínica, y tan solo mostraba una buena relación en las arterias culpables del infarto. Los autores consideraron como posible explicación para este fenómeno la mayor alteración en la capacidad vasodilatadora que presentan los pacientes con infarto agudo de miocardio con elevación del segmento ST, y propusieron un algoritmo híbrido, por el cual solo sería necesario el uso de adenosina en aquellos casos en que la determinación de NH-IMRAngio fuera > 30 U y < 90 U, lo que evitaría la necesidad de usar adenosina en el 38% de los casos. Además, en casos de infarto agudo de miocardio con elevación del segmento ST —en los que quizás el uso de hiperemia podría estar más restringido debido a la situación clínica—, este grupo mostró que un valor de NH-IMRAngio > 43 podría detectar con alta precisión un valor de IMR > 40 y ser predictor de eventos a largo plazo56 sin necesidad de utilizar adenosina.
Tebaldi et al.57 usan una fórmula a partir del valor de cQFR (NH-IMRAngio) para evaluar el estado de la microcirculación en pacientes con angina estable, y hallaron una alta correlación entre IMRAngio > 44,2 e IMR invasivo > 25.
Paralelamente, otro grupo también usó una fórmula que empleaba el valor de cQFR58 para evaluar la función microvascular en pacientes con síndrome coronario crónico y agudo, que confirmó una buena precisión diagnóstica global y apuntó, además, el valor añadido que podría tener su determinación para disminuir los valores falsamente positivos del QFR, ya que una función microvascular alterada podría influir en la precisión del análisis del QFR36. Un metanálisis de datos agrupados ha demostrado un buen rendimiento diagnóstico de la IMRAngio en comparación con el IMR invasivo, con una sensibilidad del 82%, una especificidad del 83%, una precisión del 83%, un valor predictivo positivo del 76% y un valor predictivo negativo del 85%59.
FlashAngio (Rainmed, China) es otro software para la derivación del IMR no invasivo60,61, que ofrece resultados diagnósticos similares. Además, más allá de su valor diagnóstico, Choi et al.61 demostraron el valor pronóstico de dicho índice, ya que un valor elevado de IMRAngio (< 40 U) se encontró asociado a muerte de causa cardiaca y rehospitalización por problemas cardiovasculares a largo plazo.
En el material adicional se encuentra una descripción detallada del manejo práctico del IMRAngio.
CONCLUSIONES
El estudio de la fisiología coronaria significa un gran avance en el tratamiento de los pacientes con enfermedad coronaria. Poder definir la gravedad funcional de las lesiones epicárdicas y la influencia de la microcirculación en la sintomatología de los pacientes permite personalizar el tratamiento, orientado a reducir los síntomas y, en muchos casos, con un mejor pronóstico. Se han hecho grandes avances en este campo, logrando conocer más a fondo la fisiología y obtener más precisión en el diagnóstico, con pruebas tanto invasivas como no invasivas. El conocimiento, aunque extenso, presenta brechas que se seguirán resolviendo con nuevos estudios. Todo este desarrollo requiere una formación específica y actualizada, que nos permita aprovechar el conocimiento y la tecnología en beneficio de nuestros pacientes.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
J.P. Vilchez-Tschischke, J. Sanz Sánchez y E. Fernández Peregrina contribuyeron a la idea, el diseño, la redacción y la revisión del artículo. J.L. Díez Gil, M. Echevarría Pinto y H.M. Garcia-Garcia contribuyeron tanto a la redacción del artículo como a la revisión crítica de su contenido intelectual.
CONFLICTO DE INTERESES
J. Sanz Sánchez declara haber recibido honorarios por su labor como conferenciante para Cordis y Terumo. H.M. Garcia-Garcia declara haber recibido honorarios por su labor como conferenciante para Biotronik, Abbot, Boston Scientific, Neovasc, Medtronic, Shockwave, Philips y Corflow. Los demás autores no presentan conflictos de intereses.
BIBLIOGRAFÍA
1. Neumann FJ, Sechtem U, Banning AP, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
2. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. EuroIntervention. 2019;14:1435-1534.
3. Puymirat E, Cayla G, Simon T, et al. Multivessel PCI Guided by FFR or Angiography for Myocardial Infarction. N Engl J Med. 2021;385:297-308.
4. Fearon WF, Zimmermann FM, de Bruyne B, et al. Fractional Flow Reserve-Guided PCI as Compared with Coronary Bypass Surgery. N Engl J Med. 2022;386:128-137.
5. Dattilo PB, Prasad A, Honeycutt E, Wang TY, Messenger JC. Contemporary patterns of fractional flow reserve and intravascular ultrasound use among patients undergoing percutaneous coronary intervention in the United States: insights from the National Cardiovascular Data Registry. J Am Coll Cardiol. 2012;60:2337-2339.
6. Lee JZ, Singh N, Nyotowidjojo I, et al. Comparison of regadenoson and nitroprusside to adenosine for measurement of fractional flow reserve: A systematic review and meta-analysis. Cardiovasc Revasc Med. 2018;19:168-174.
7. Leone AM, Campo G, Gallo F, et al. Adenosine-Free Indexes vs. Fractional Flow Reserve for Functional Assessment of Coronary Stenoses: Systematic Review and Meta-Analysis. Int J Cardiol. 2020;299:93-99.
8. Warisawa T, Cook CM, Akashi YJ, Davies JE. Past, Present and Future of Coronary Physiology. Rev Esp Cardiol. 2018;71:656-667.
9. Tonino PAL, de Bruyne B, Pijls NHJ, et al. Fractional Flow Reserve versus Angiography for Guiding Percutaneous Coronary Intervention. N Engl J Med. 2009;360:213-224.
10. de Bruyne B, Pijls NHJ, Kalesan B, et al. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease. N Engl J Med. 2012;367:991-1001.
11. Xaplanteris P, Fournier S, Pijls NHJ, et al. Five-Year Outcomes with PCI Guided by Fractional Flow Reserve. N Engl J Med. 2018;379:250-259.
12. Grüntzig AR, Senning Å, Siegenthaler WE. Nonoperative Dilatation of Coronary-Artery Stenosis. N Engl J Med. 1979;301:61-68.
13. Sen S, Asrress KN, Nijjer S, et al. Diagnostic classification of the instantaneous wave-free ratio is equivalent to fractional flow reserve and is not improved with adenosine administration. Results of CLARIFY (Classification Accuracy of Pressure-Only Ratios Against Indices Using Flow Study). J Am Coll Cardiol. 2013;61:1409-1420.
14. Petraco R, van de Hoef TP, Nijjer S, et al. Baseline instantaneous wave-free ratio as a pressure-only estimation of underlying coronary flow reserve: results of the JUSTIFY-CFR Study (Joined Coronary Pressure and Flow Analysis to Determine Diagnostic Characteristics of Basal and Hyperemic Indices of Functional Lesion Severity-Coronary Flow Reserve). Circ Cardiovasc Interv. 2014;7:492-502.
15. Davies JE, Sen S, Dehbi HM, et al. Use of the Instantaneous Wave-free Ratio or Fractional Flow Reserve in PCI. N Engl J Med. 2017;376:1824-1834.
16. Götberg M, Christiansen EH, Gudmundsdottir IJ, et al. Instantaneous Wave-free Ratio versus Fractional Flow Reserve to Guide PCI. N Engl J Med. 2017;376:1813-1823.
17. Johnson NP, Li W, Chen X, et al. Diastolic pressure ratio: new approach and validation vs. the instantaneous wave-free ratio. Eur Heart J. 2019;40:2585-2594.
18. Lee JM, Rhee TM, Choi KH, et al. Clinical Outcome of Lesions With Discordant Results Among Different Invasive Physiologic Indices - Resting Distal Coronary to Aortic Pressure Ratio, Resting Full-Cycle Ratio, Diastolic Pressure Ratio, Instantaneous Wave-Free Ratio, and Fractional Flow Reserve. Circ J. 2019;83:2210-2221.
19. Van’t Veer M, Pijls NHJ, Hennigan B, et al. Comparison of Different Diastolic Resting Indexes to iFR: Are They All Equal? J Am Coll Cardiol. 2017;70:3088-3096.
20. Kobayashi Y, Johnson NP, Berry C, et al. The Influence of Lesion Location on the Diagnostic Accuracy of Adenosine-Free Coronary Pressure Wire Measurements. JACC Cardiovasc Interv. 2016;9:2390-2399.
21. Ahn JM, Park DW, Kim SO, et al. Prognostic Value of Resting Distal-to-Aortic Coronary Pressure in Clinical Practice. Circ Cardiovasc Interv. 2020;13:e007868.
22. Piróth Z, Fülöp G, Boxma-de Klerk BM, et al. Correlation and Relative Prognostic Value of Fractional Flow Reserve and Pd/Pa of Nonculprit Lesions in ST-Segment-Elevation Myocardial Infarction. Circ Cardiovasc Interv. 2022;15:e010796.
23. Barauskas M, Ziubryte G, Barauskiene G, Unikaite R, Jodka N, Unikas R. Systemic analysis of diagnostic performance and agreement between fractional flow reserve and quantitative flow ratio. Cor Vasa. 2021;63:683-687.
24. Tu S, Westra J, Yang J, et al. Diagnostic Accuracy of Fast Computational Approaches to Derive Fractional Flow Reserve From Diagnostic Coronary Angiography The International Multicenter FAVOR Pilot Study. JACC Cardiovasc Interv. 2016;9:2024-2035.
25. Xu B, Tu S, Qiao S, et al. Diagnostic Accuracy of Angiography-Based Quantitative Flow Ratio Measurements for Online Assessment of Coronary Stenosis. J Am Coll Cardiol. 2017;70:3077-3087.
26. Westra J, Tu S, Campo G, et al. Diagnostic performance of quantitative flow ratio in prospectively enrolled patients: An individual patient-data meta-analysis. Catheter Cardiovasc Interv. 2019;94:693-701.
27. Spitaleri G, Tebaldi M, Biscaglia S, Westra J, Brugaletta S, Erriquez A. Quantitative Flow Ratio identifies nonculprit coronary lesions requiring revascularization in patients with ST segment elevation myocardial infarction and multivessel disease. Circ Cardiovasc Interv. 2018;11:e006023.
28. Xu B, Tu S, Song L, et al. Angiographic quantitative flow ratio-guided coronary intervention (FAVOR III China): a multicentre, randomised, sham-controlled trial. Lancet. 2021;398:2149-2159.
29. Masdjedi K, Tanaka N, Van Belle E, et al. Vessel fractional flow reserve (vFFR) for the assessment of stenosis severity: the FAST II study. EuroIntervention. 2022;17:1498-1505.
30. Fearon W, Achenbach S, Engstrom T, et al. Accuracy of fractional flow reserve derived from coronary angiography. Circulation. 2019;139:477-484.
31. Morris PD, Ryan D, Morton AC, et al. Virtual Fractional Flow Reserve From Coronary Angiography: Modeling the Significance of Coronary Lesions Results From the VIRTU-1 (VIRTUal Fractional Flow Reserve From Coronary Angiography) Study. JACC Cardiovasc Interv. 2013;6:149-157.
32. Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. Eur Heart J. 2018;39:3314-3321.
33. Yakazi K, Otsuka M, Kataoka S, Kahata, Kumagai A. Applicability of 3-Dimensional Quantitative Coronary Angiography-derived computed Fractional Flow Reserve for intermediate coronary stenosis. Circ J. 2017;81:988-992.
34. Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. Eur Heart J. 2018;39:3314-3321.
35. Asano T, Katagiri Y, Chang CC, et al. Angiography-Derived Fractional Flow Reserve in the SYNTAX II Trial: Feasibility, Diagnostic Performance of Quantitative Flow Ratio, and Clinical Prognostic Value of Functional SYNTAX Score Derived From Quantitative Flow Ratio in Patients With 3-Vessel Dis. JACC Cardiovasc Interv. 2019;12:259-270.
36. Mejía-Rentería H, Lee JM, Lauri F, et al. Influence of Microcirculatory Dysfunction on Angiography-Based Functional Assessment of Coronary Stenoses. JACC Cardiovasc Interv. 2018;11:741-753.
37. Westra J, Andersen BK, Campo G, et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow reserve: The FAVOR II Europe-Japan study. J Am Heart Assoc. 2018;7:e009603.
38. Haley H, Ghobrial M, Morris P, Gosling R, Williams G, Mills M. Virtual (Computed) Fractional Flow Reserve: Future Role in Acute Coronary Syndromes. Front Cardiovasc Med. 2021;8:735008.
39. Westra J, Sejr-Hansen M, Koltowski L, et al. Reproducibility of quantitative flow ratio: The QREP study. EuroIntervention. 2022;17:1252-1259.
40. Ford TJ, Stanley B, Sidik N, et al. 1-Year Outcomes of Angina Management Guided by Invasive Coronary Function Testing (CorMicA). JACC Cardiovasc Interv. 2020;13:33-45.
41. Chilian WM, Eastham CL, Marcus ML. Microvascular distribution of coronary vascular resistance in beating left ventricle. Am J Physiol. 1986;251(4 Pt 2):H779-H788.
42. Goodwill AG, Dick GM, Kiel AM, Tune JD. Regulation of Coronary Blood Flow. Compr Physiol. 2017;7:321.
43. Broyd CJ, Echavarria-Pinto M, Cerrato E, Escaned J. Evaluation of Microvascular Disease and Clinical Outcomes. Interv Cardiol Clin. 2015;4:443-457.
44. Kelshiker MA, Seligman H, Howard JP, et al. Coronary flow reserve and cardiovascular outcomes: a systematic review and meta-analysis. Eur Heart J. 2022;43:1582-1593.
45. Taqueti VR, di Carli MF. Coronary Microvascular Disease Pathogenic Mechanisms and Therapeutic Options: JACC State-of-the-Art Review. J Am Coll Cardiol. 2018;72:2625-2641.
46. Lee JM, Jung JH, Hwang D, et al. Coronary Flow Reserve and Microcirculatory Resistance in Patients With Intermediate Coronary Stenosis. J Am Coll Cardiol. 2016;67:1158-1169.
47. Padro T, Manfrini O, Bugiardini R, et al. ESC Working Group on Coronary Pathophysiology and Microcirculation position paper on “coronary microvascular dysfunction in cardiovascular disease”. Cardiovasc Res. 2020;116:741-755.
48. Van’t Veer M, Adjedj J, Wijnbergen I, et al. Novel monorail infusion catheter for volumetric coronary blood flow measurement in humans: in vitro validation. EuroIntervention. 2016;12:701-707.
49. Xaplanteris P, Fournier S, Keulards DCJ, et al. Catheter-Based Measurements of Absolute Coronary Blood Flow and Microvascular Resistance: Feasibility, Safety, and Reproducibility in Humans. Circ Cardiovasc Interv. 2018;11:e006194.
50. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International. Eur Heart J. 2020;41:3504-3520.
51. Lee SH, Shin D, Lee JM, et al. Clinical Relevance of Ischemia with Nonobstructive Coronary Arteries According to Coronary Microvascular Dysfunction. J Am Heart Assoc. 2022;11:e025171.
52. Williams RP, de Waard GA, de Silva K, et al. Doppler Versus Thermodilution-Derived Coronary Microvascular Resistance to Predict Coronary Microvascular Dysfunction in Patients With Acute Myocardial Infarction or Stable Angina Pectoris. Am J Cardiol. 2018;121:1-8.
53. Kobayashi Y, Fearon WF. Invasive coronary microcirculation assessment — Current status of index of microcirculatory resistance. Circ J. 2014;78:1021-1028.
54. De Maria GL, Scarsini R, Shanmuganathan M, et al. Angiography-derived index of microcirculatory resistance as a novel, pressure-wire-free tool to assess coronary microcirculation in ST elevation myocardial infarction. Int J Cardiovasc Imaging. 2020;36:1395-1406.
55. Scarsini R, Shanmuganathan M, Kotronias RA, et al. Angiography-derived index of microcirculatory resistance (IMRangio) as a novel pressure-wire-free tool to assess coronary microvascular dysfunction in acute coronary syndromes and stable coronary artery disease. Int J Cardiovasc Imaging. 2021;37:1801-1813.
56. Kotronias R, Terentes-Printzios D, Shanmuganathan M, et al. Long-Term Clinical Outcomes in Patients With an Acute ST-Segment-Elevation Myocardial Infarction Stratified by Angiography-Derived Index of Microcirculatory Resistance. Front Cardiovasc Med. 2021;1:717114.
57. Tebaldi M, Biscaglia S, Di Girolamo D, et al. Angio-based index of microcirculatory resistance for the assessment of the coronary resistance: A proof of concept study. J Interv Cardiol. 2020;2020:8887369.
58. Mejia-Renteria H, Lee JM, Choi KH, et al. Coronary microcirculation assessment using functional angiography: Development of a wire-free method applicable to conventional coronary angiograms. Catheter Cardiovasc Interv. 2021;98:1027-1037.
59. Fernández‐Peregrina E, Garcia‐Garcia HM, Sans‐Rosello J, et al. Angiography‐derived versus invasively‐determined index of microcirculatory resistance in the assessment of coronary microcirculation: A systematic review and meta‐analysis. Catheter Cardiovasc Interv. 2022;99:2018-2025.
60. Ai H, Feng Y, Gong Y, et al. Coronary Angiography-Derived Index of Microvascular Resistance. Front Physiol. 2020;11:605356.
61. Choi KH, Dai N, Li Y, et al. Functional Coronary Angiography–Derived Index of Microcirculatory Resistance in Patients With ST-Segment Elevation Myocardial Infarction. JACC Cardiovasc Interv. 2021;14:1670-1684.
* Autores para correspondencia.
Correos electrónicos: (M. Echevarria Pinto) y (H.M. Garcia-Garcia).
◊ Parte del contenido de este artículo se ha publicado previamente en la página web de la Sociedad Latinoamericana de Cardiología Intervencionista (SOLACI): https://proeducar.solaci.org/es/blog/post/fisiologia-coronaria.
- Abordaje de los accesos vasculares en intervencionismo en cardiopatía estructural
- Enfermedad coronaria calcificada: fisiopatología, evaluación por imagen intracoronaria y técnicas de modificación de placa
- Imagen intracoronaria: revisión y utilidad clínica
- Terapéutica intervencionista en insuficiencia cardiaca: un ámbito emergente en cardiología intervencionista