Artículos de revisión
REC Interv Cardiol. 2019;1:41-50
Tratamiento antitrombótico tras revascularización percutánea en pacientes con indicación crónica de anticoagulación oral
Antithrombotic therapy after percutaneous revascularization in patients on chronic oral anticoagulation treatment
aServicio de Cardiología, Hospital General Universitario de Alicante, Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL), Alicante, España bÁrea de Enfermedades del Corazón, Hospital Universitario de Bellvitge – IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona, España
RESUMEN
La coartación de aorta es una enfermedad congénita caracterizada por el estrechamiento de la aorta torácica, que provoca una obstrucción del flujo sanguíneo distal. Una coartación de aorta significativa se asocia con hipertensión arterial e hipoperfusión distal, así como con un mal pronóstico sin intervención. Inicialmente el tratamiento era quirúrgico, pero fueron surgiendo técnicas menos invasivas, como la angioplastia percutánea con balón, que mostró eficacia en ciertos pacientes. La incorporación del implante de stents mejoró de manera significativa los resultados, convirtiendo la reparación percutánea en la opción preferida, en especial en adolescentes y adultos. Sin embargo, siguen produciéndose complicaciones inmediatas y a largo plazo. Esto ha impulsado esfuerzos destinados a mejorar su seguridad y eficacia. Las estrategias modernas se enfocan en stents de diseño avanzado, con mejor perfil de entrega y un alto potencial de redilatación. Persisten vacíos por llenar, y nuevos datos provenientes de estudios con seguimientos más prolongados permitirán comprender mejor la evolución de estos pacientes. Esta revisión tiene como objetivo ofrecer una visión integral de estas intervenciones percutáneas, abordando los avances, los resultados y las perspectivas futuras.
Palabras clave: Coartación de aorta. Reparación percutánea. Complicaciones. Stents de diseño avanzado.
ABSTRACT
Aortic coarctation is a congenital disease that consists of the narrowing of the thoracic aorta, leading to distal blood flow obstruction. Significant aortic coarctation is associated with hypertension and distal hypoperfusion, with a poor prognosis without intervention. Initially, treatment was surgical; however, less invasive techniques such as percutaneous balloon angioplasty later emerged and proved effective in selected patients.
The introduction of stent implantation significantly improved the outcomes, making percutaneous repair the preferred option, especially in adolescents and adults.
However, immediate and long-term complications persist, which has driven research efforts aimed at improving the safety and efficacy profile. Modern strategies now focus on advanced stent designs, offering better delivery profiles and high redilatation potential. Gaps in knowledge remain, and data from studies with longer follow-up will be essential to further elucidate disease progression in these patients. This review aims to offer a comprehensive overview of these percutaneous procedures, discussing recent advancements, clinical outcomes, and future perspectives.
Keywords: Aortic coarctation. Percutaneous repair. Complications. Advanced stent designs.
INTRODUCCIÓN
La coartación de aorta (CoAo) es una cardiopatía congénita (CC) que se define como un estrechamiento de la aorta torácica1,2. Se trata de un defecto que suele localizarse en sentido distal a la arteria subclavia izquierda próximo al punto de inserción del remanente del conducto arterioso. La gravedad es variable y la CoAo puede presentarse en forma de estenosis discreta o segmento estenótico largo y tortuoso1,2. La CoAo es una de las CC más frecuentes y supone entre el 5 y 8% de este grupo de defectos3, con una incidencia de 3 a 4 casos por cada 10.000 nacidos vivos. Es más prevalente entre los varones, con una tasa de incidencia de 2:14. Esta enfermedad suele acompañarse de otros defectos cardiovasculares congénitos, con una incidencia de entre el 70 y el 87%1,5,6. El más común es la válvula aórtica bicúspide (VAB), descrita en hasta el 60% de los casos1,2.
La presentación clínica depende tanto de la gravedad de la obstrucción como de la presencia de otras CC asociadas. Los casos graves debutan durante la edad neonatal, a menudo con shock cardiogénico. En cambio, las obstrucciones menos graves pueden detectarse durante la infancia o la edad adulta con hipertensión en la parte superior del cuerpo, hipertrofia ventricular, dilatación de la aorta torácica y avance progresivo de circulación colateral7,8. Los signos y síntomas se muestran en la tabla 19.
Tabla 1. Signos y síntomas de la coartación aórtica en adultos con CoAo no reparada9
| Signos | Síntomas |
|---|---|
| Hipertensión en extremidades superiores | Intolerancia al esfuerzo/disnea |
| Pulsos femorales débiles o ausentes | Cefalea |
| Retraso braquio-femoral | Epistaxis |
| Gradiente de presión arterial entre extremidades superiores e inferiores | Mareo |
| Soplo sistólico o continuo interescapular | Claudicación de extremidades inferiores |
| Soplo de insuficiencia aórtica (en casos de raíz aórtica dilatada con o sin válvula bicúspide) | Angina abdominal |
| Impulso apical desplazado (en casos de ventrículo izquierdo dilatado) | Acúfenos |
| Pies fríos |
La historia natural de la CoAo no reparada tiene un pronóstico muy desfavorable. Campbell et al. describieron las principales causas de muerte por CoAo no tratada: insuficiencia cardiaca congestiva (25%), rotura aórtica (21%), endocarditis bacteriana (18%) y hemorragia intracraneal (11%)10. En este sentido, la reparación de la CoAo en pacientes con estenosis significativa es obligatoria para mejorar el pronóstico y la calidad de vida de los pacientes. En la actualidad, las guías de práctica clínica recomiendan intervenir cuando la CoAo se acompaña de hipertensión y un gradiente invasivo pico a pico > 20 mmHg11. La cirugía fue la primera técnica reparadora seguida del tratamiento percutáneo, que se estableció como opción terapéutica viable para pacientes seleccionados. El objetivo de esta revisión es resumir la evidencia disponible sobre las intervenciones percutáneas, analizar los avances hechos hasta la fecha, los resultados y las perspectivas futuras.
PERSPECTIVA HISTÓRICA
Crafoord realizó la primera cirugía de CoAo en 1944 consistente en una intervención de resección y anastomosis término-terminal12. Desde entonces, han aparecido otras técnicas quirúrgicas para prevenir la recoartación y formación de aneurismas, como la aortoplastia con parche, la aortoplastia con colgajo subclavio y la coartectomía con interposición de injerto2.
Aunque la cirugía ha sido el patrón oro durante años, la aparición de tratamientos percutáneos ha abierto un nuevo abanico de posibilidades. El primer tratamiento percutáneo de la CoAo fue publicado en 1982 por Singer et al. que realizaron con éxito una angioplastia con balón (ICP-balón) para tratar una CoAo en un recién nacido13. A pesar de la eficacia de esta técnica, la tasa de recoartación y formación de aneurismas fue alta14,15.
El primer caso documentado de implante de stent en un paciente con CoAo se publicó en 199116 y, posteriormente, en 1995, Suárez de Lezo et al. comunicaron la primera serie de pacientes tratados con este mismo abordaje, lo cual confirmó el perfil de seguridad y eficacia de este abordaje17. La principal ventaja del implante de stent es el soporte estructural que proporciona que, a su vez, reduce, las complicaciones18. En 1999, Gunn et al. y después, otros autores, describieron el uso de stents recubiertos con buenos resultados19-21.
En la actualidad, las guías europeas de práctica clínica recomiendan el implante de stent como primera opción en pacientes adultos con anatomías favorables11. No obstante, como la reparación quirúrgica sigue desempeñando un papel clave en determinados casos, el abordaje óptimo debe elegirse con suma cautela.
ANGIOPLASTIA CON BALÓN
Originariamente, la ICP-balón empezó empleándose en neonatos y lactantes con CoAo e insuficiencia cardiaca como estrategia de rescate o tratamiento definitivo en casos de alto riesgo quirúrgico13. No obstante, tiempo después, esta técnica empezó a probarse en niños mayores y adultos. La principal ventaja de la ICP-balón es su sencillez, con buenos resultados en coartaciones discretas. No obstante, la dilatación con balón dentro de la aorta puede provocar la rotura de la íntima, afectación de la capa media y posibles complicaciones posteriores22.
Entre sus desventajas están una menor eficacia en anatomías complejas, como la hipoplasia ístmica y la estenosis difusa23,24. Las complicaciones más frecuentes son la disección aórtica y el retroceso elástico a corto plazo y la recoartación y formación de aneurismas a largo plazo23,25,26. Un registro retrospectivo de niños tratados con ICP-balón informó de roturas/disecciones aórticas, recoartaciones y formación de aneurismas en el 2, 26 y 34% de los casos, respectivamente27. Un ensayo clínico aleatorizado que comparó la ICP-balón y el tratamiento quirúrgico en niños también informó de la formación de aneurismas y reestenosis en el 20 y 25% de los pacientes tratados con ICP-balón28. Por otro lado, en pacientes de mayor edad con coartación discreta, Walhout y Fawzy observaron una incidencia baja de recoartación (≈ 3%)29,30. La incidencia de aneurismas en adultos también parece ser menor que en niños (1,8-6%)31,32.
La ICP-balón tiene un buen perfil de eficacia en el 67-90% de los casos de coartaciones recurrentes (posoperatorias o pos-ICP-balón), especialmente en niños. Por eso, en la actualidad, la CoAo recurrente es una de las principales indicaciones para la ICP-balón25,33-35. También se emplea en el tratamiento de la coartación nativa en niños para retrasar el implante de stent hasta la edad adulta, cuando se puedan implantar stents de tamaño definitivo. A pesar de estas indicaciones principales, en casos seleccionados con obstrucción discreta y no crítica, la ICP-balón puede ser una intervención eficaz y evitar el implante de stent, tal y como ya se ha mencionado36.
IMPLANTE PERCUTÁNEO DE STENT
La introducción del implante de stent en el tratamiento de la CoAo tuvo como objetivo mejorar los resultados a corto y largo plazo tras la ICP-balón y minimizar las complicaciones asociadas a la elasticidad aórtica, el retroceso y la rotura de la pared35. La fuerza radial del stent se opone al retroceso aórtico y mejora la integridad del vaso tras el traumatismo inherente a la dilatación con balón35.
Zabal et al. observaron que el gradiente residual fue mucho menor en pacientes tratados con implante de stent que con ICP-balón. Una diferencia que fue más evidente en pacientes con coartación no discreta (coartación tubular o hipoplasia ístmica), en quienes se observó un gradiente residual > 20 mmHg en el 57% de los casos tras ICP-balón frente al 0% en el grupo que recibió un stent36. El implante de stent también reduce la incidencia de recoartación y formación de aneurismas37-39.
El implante de stent también ha demostrado ser seguro en el tratamiento de la recoartación, especialmente en pacientes ya intervenidos mediante reparación quirúrgica. Aunque se han descrito diversas complicaciones, el seguimiento a largo plazo ha mostrado una eficacia ciertamente prometedora40,41.
En la actualidad, se opta por el implante de stent en detrimento de la ICP-balón tanto en adultos como en adolescentes. Las guías europeas de práctica clínica también recomiendan el implante de stent a la reparación quirúrgica en casos con anatomías favorables42.
A pesar de sus ventajas, el implante de stent en niños menores de 8-10 años sigue estando limitado por el riesgo de complicaciones vasculares en el sitio de acceso (por el mayor tamaño de las vainas introductoras necesarias), por la limitación adicional de no poder implantar un stent de tamaño adulto en una aorta aún en crecimiento y por lo difícil que es implantar stents que se puedan posdilatar adecuadamente y adaptar al crecimiento aórtico futuro25,43.
Stents recubiertos frente a no recubiertos
En primer lugar, se debe mencionar que los stents expandibles con balón se prefieren a los autoexpandibles por la mayor fuerza radial de los primeros, lo cual mejora la dilatación de la CoAo y previene el retroceso aórtico. Entre los stents expandibles con balón, los recubiertos se prefieren a los metálicos no recubiertos en casi todos los escenarios clínicos. Los stents recubiertos crean un efecto de sellado en el lugar del implante y proporcionan una característica de seguridad adicional44.
En la actualidad, los stents recubiertos son el tratamiento percutáneo de primera línea de la CoAo nativa, la fractura del stent, la recoartación y la formación de aneurismas11. En el contexto de la CoAo nativa, se prefieren los stents recubiertos especialmente en anatomías complejas, pacientes de mayor edad y aquellos con enfermedades del tejido conectivo o síndrome de Turner (ST) para prevenir la rotura de la pared aórtica o la formación de aneurismas25,38. El «efecto de sellado» es toda una ventaja en pacientes pretratados que desarrollan aneurismas o rotura de la pared vascular45.
En niños, se opta por stents no recubiertos ante la posibilidad de redilatar el stent para adaptarlo al crecimiento aórtico. Los stents recubiertos solo pueden dilatarse hasta un diámetro específico sin dañar su material de recubrimiento, razón por la cual están indicados en pacientes adultos46.
ABORDAJES HÍBRIDOS
El abordaje híbrido que combina intervenciones quirúrgicas y tratamiento percutáneo es, en la actualidad, una opción en pacientes con CC. En el contexto de la CoAo, suele ser necesario un abordaje híbrido cuando el paciente presenta otro defecto cardiaco congénito que requiere reparación quirúrgica. Un escenario habitual es la coexistencia de dilatación de la aorta ascendente y VAB con insuficiencia o estenosis significativas47. El tratamiento de estos casos siempre es complejo ante la falta de guías y recomendaciones estandarizadas. El momento de efectuar las correcciones y la modalidad de intervención más adecuada siguen siendo objeto de debate.
Diversos autores han comunicado casos de pacientes con enfermedad de la VAB acompañada de dilatación de la aorta ascendente e insuficiencia aórtica tratados inicialmente con técnicas percutáneas para la CoAo y, después, mediante el procedimiento quirúrgico de Bentall47,48. La reparación de la CoAo previa al recambio valvular probablemente reduzca el riesgo de hipoperfusión de los órganos distales a la coartación. No obstante, y aunque la evidencia disponible todavía no es concluyente, la reparación quirúrgica de una valvulopatía en un primer acto quirúrgico ha resultado exitosa49.
Como nuevo abordaje, Russell et al. comunicaron su experiencia con un paciente con VAB, dilatación de la aorta ascendente y CoAo, tratado con un abordaje híbrido y en un único acto quirúrgico que incluyó la reparación endovascular de la raíz aórtica (CoAo) y el recambio quirúrgico de la válvula aórtica y aorta ascendente50.
IMÁGENES, SELECCIÓN DE PACIENTES Y CONSIDERACIONES PROPIAS DE LA INTERVENCIÓN
Imágenes
La evaluación mediante imágenes multimodales es obligatoria en pacientes con sospecha de CoAo para caracterizar adecuadamente la anatomía, descartar malformaciones asociadas y optar por la mejor opción terapéutica.
Ecocardiografía transtorácica
La ecocardiografía transtorácica suele ser la primera técnica de imágen que se realiza en pacientes con sospecha de CoAo. Con esta técnica, se puede ver la dilatación de la aorta ascendente y, en algunos casos, localizar la coartación en la proyección supraesternal a través de imágenes bidimensionales y Doppler color. Además, en la proyección supraesternal, el Doppler espectral permite visualizar el patrón típico en «dientes de sierra» con Doppler continuo, lo cual permite medir el gradiente en casos favorables51.
Angiotomografía computarizada
La angiografía computarizada (angio-TC) es la técnica de imágen de elección para el estudio de la aorta torácica en pacientes con alguna contraindicación para una resonancia magnética cardiaca (RMC) por ser portadores de marcapasos o desfibriladores. Además, es el patrón oro para diagnosticar la disección aórtica, una complicación conocida de la CoAo y la técnica de imágen preferida para valorar la permeabilidad luminal y descartar reestenosis o fracturas del stent en pacientes con CoAo reparada52.
Comparada con la RMC, la angio-TC proporciona una mayor resolución espacial de la aorta, precisa tiempos de adquisición más cortos y la toleran mejor los pacientes claustrofóbicos; no obstante, algunas de sus desventajas son que la radiación ionizante y el contraste IV que precisan pueden provocar afectación renal53.
Resonancia magnética cardiaca
En la actualidad, la RMC se considera la técnica de imágen de referencia para examinar pacientes adultos con sospecha de CoAo y otras CC. Esta técnica permite identificar, de forma precisa, la localización y relevancia de la coartación mediante análisis de flujo por contraste de fase. La RMC también permite medir la longitud del segmento coartado y las dimensiones aórticas para seleccionar el tamaño adecuado de stent, identifica el flujo colateral en las arterias intercostales, analiza la función cardiaca y la presencia de otras CC concomitantes. Todas estas ventajas sin necesidad de radiación ionizante54,55. La RMC también se emplea durante la vigilancia posoperatoria tras el implante de stent y la cirugía para detectar posibles complicaciones2.
Selección de pacientes e indicaciones
La reparación o recoartación de la CoAo nativa, por vía quirúrgica o percutánea, es obligatoria en pacientes hipertensos con un gradiente pico a pico confirmado > 20 mmHg (indicación clase I) y preferencia por el implante de stent siempre y cuando sea técnicamente viable según las últimas guías europeas y americanas11,56. Según las europeas, la reparación percutánea de la CoAo se debe tener en cuenta en pacientes hipertensos con estrechamientos del 50% sin gradiente pico a pico < 20 mmHg y normotensos sin gradientes significativos (indicación clase IIa)11.
La selección de la estrategia de reparación en pacientes con CoAo se debe basar en un análisis meticuloso que incorpore factores clave como la edad y el peso del paciente, las características anatómicas de la coartación y las intervenciones quirúrgicas realizadas. La reparación percutánea suele considerarse una alternativa menos arriesgada que la cirugía en pacientes bien seleccionados. La figura 1 ilustra una representación esquemática del proceso de toma de decisiones.
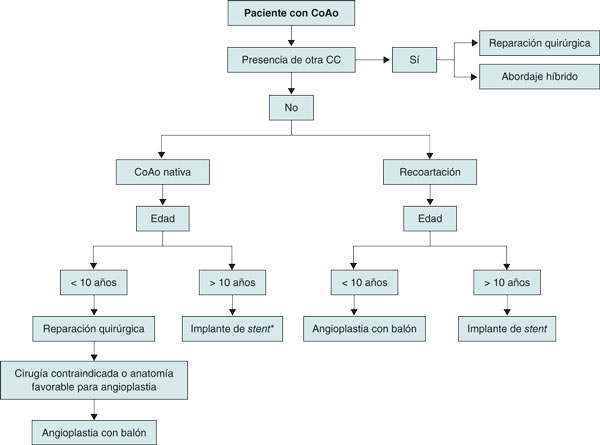
Figura 1. Algoritmo propuesto de tratamientos de primera línea según la edad de los pacientes con coartación aórtica, El abordaje sugerido en cada caso y grupo etario es general, por lo que la decisión sobre la estrategia seleccionada dependerá tanto de las características anatómicas como de la experiencia de los propios centros. CC: cardiopatía congénita; CoAo: coartación aórtica.
*Algunos autores sugieren un «umbral» de 25 kg, por debajo del cual el uso de stents estaría desaconsejado.
En lactantes y niños de 8-10 años con CoAo nativa, se prefiere la reparación quirúrgica a las técnicas percutáneas. Cuando se opta por la intervención endovascular, la ICP-balón debe ser el abordaje de elección25. Algunos autores también proponen un «umbral» de 25 kg por debajo del cual no se recomienda el implante de stent por el mayor tamaño de las vainas introductoras necesarias, lo cual supone un alto riesgo de complicaciones vasculares57.
En adolescentes y adultos, si la anatomía es favorable y en ausencia de una CC asociada que precise reparación quirúrgica, el implante de stent percutáneo se considera, en la actualidad, el tratamiento de primera línea25. Estas consideraciones dependerán de las características anatómicas de cada paciente. La experiencia de cada centro con estos casos también influye en la toma de decisiones clínicas.
Cuestiones en torno a la intervención
Una planificación adecuada resulta esencial para garantizar mejores resultados y minimizar el riesgo de complicaciones asociadas al implante de stent durante la coartación. Varios pasos pueden coincidir con los de la ICP-balón. A continuación, se describen los principales pasos y consideraciones técnicas. La figura 2 ilustra un caso de CoAo tratado con éxito mediante implante de stent.
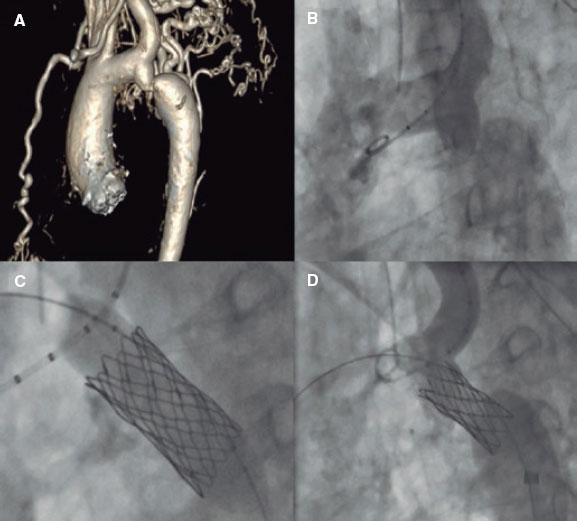
Figura 2. Tratamiento exitoso de una coartación aórtica en un adulto. A: tomografía computarizada con resultado de coartación aórtica. B: angiografía que confirma la presencia de coartación aórtica. C: angioplastia con balón e implante de stent. D: resultado fluoroscópico final tras implante de stent.
En primer lugar, antes de la intervención, resulta esencial controlar la hipertensión, ya que las crisis hipertensivas suelen ser habituales tras el implante del stent. Los bloqueadores beta ayudan a prevenir estas crisis. También se recomienda una vigilancia estricta durante el posoperatorio para detectar y tratar la hipertensión de forma eficaz y garantizar mejores resultados clínicos. Algunos autores recomiendan realizar cualquier tratamiento percutáneo bajo anestesia general. Como la dilatación de la CoAo suele ser dolorosa, este abordaje hace que la intervención sea más fácil de sobrellevar35. No obstante, en líneas generales, la sedación ligera o moderada suele bastar en pacientes adultos.
- – Vía de acceso: suele usarse la arteria femoral común (derecha o izquierda). Se debe emplear el precierre con Perclose ProGlide (Abbott Vascular, Estados Unidos). El tamaño de la vaina introductora debe ser parejo al diámetro del balón o del stent; se recomiendan vainas 2-3 Fr más grandes que el mínimo requerido para el balón. La heparina no fraccionada se administra para lograr tiempos de coagulación activados > 250 segundos. También se debe administrar una dosis profiláctica de cefazolina.
- – Cruce de la coartación: la CoAo se suele poder cruzar con una guía convencional de 0,035 pulgadas de politetrafluoroetileno y, a veces, con una guía hidrofílica. En anatomías especialmente complejas, puede hacerse necesario emplear el abordaje retrógrado desde la arteria radial con salida por la femoral. Se deben realizar nuevas mediciones del gradiente y angiografías para evaluar adecuadamente el defecto. La guía inicial se sustituirá por otra extra-rígida que se colocará en la aorta ascendente o en la subclavia izquierda (solo si la distancia desde el ostium subclavio al defecto supera los 10 mm).
- – Selección del tamaño del balón y de stent: el tamaño del stent (y del balón) debe ir parejo al diámetro del arco proximal, sin superar el diámetro de la aorta diafragmática.57 La longitud del stent debe ser lo bastante grande como para cubrir todo el segmento estenótico, teniendo en cuenta que una sobredilatación podría provocar un acortamiento de hasta el 30%. La tabla 2 muestra algunos de los stent disponibles en la actualidad para el tratamiento de la CoAo.
- – Dilatación e implante del stent: la predilatación está desaconsejada de forma sistemática, pues tanto el anclaje como el implante del stent suelen ser más eficaces cuando este se coloca directamente. No obstante, en casos de estenosis crítica, la predilatación resulta inevitable.
- Tras la dilatación, la relación entre el diámetro final del stent y la zona más estenótica de la CoAo debe ser < 3,557.
- – Eficacia: la intervención se considerará un éxito cuando el gradiente residual medido de forma invasiva no supere los 10 mmHg58.
Tabla 2. Stents empleados en la reparación de la CoAo
| Recubrimiento | Ensamblaje | Modelo de stent | Fabricante | Metal | Rango de expansión (mm) | Acortamiento | Tipo de celda* |
|---|---|---|---|---|---|---|---|
| No recubierto | Preensamblado | Formula | Cook Medical | Acero inoxidable | 8-20 | ~ 10-15% | Celda cerrada |
| No preensamblado | Andrastent XL y XXL | Andramed | Aleación cobalto-cromo | 12-32 | < 5% | Celda abierta | |
| CP stent | NuMED | Aleación platino-iridio | 12-30 | ≈ 15-20% | Celda cerrada | ||
| Optimus | AndraTec GmbH | Aleación cobalto-cromo | 10-28 | ~ 5% | Celda abierta | ||
| Recubierto | Preensamblado | Begraft aortic | Bentley Innomed GmbH | Aleación cobalto-cromo | 12-24 | < 5% | Celda cerrada |
| Atrium Advanta V12 | Maquet | Acero inoxidable | 12-16 | 0-15% | Celda cerrada | ||
| NuDEL | NuMED | Aleación platino-iridio | 12-24 | ~ 10% | Celda cerrada | ||
| No preensamblado | CP covered | NuMED | Aleación platino-iridio | 12-24 | ~ 15-20% | Celda cerrada | |
| Optimus covered | AndraTec GmbH | Aleación cobalto-cromo | 12-28 | < 5% | Celda abierta | ||
|
* Los stents de celda abierta tienen más espacios y menos struts de conexión, lo cual proporciona una mayor flexibilidad y mejor adaptación a vasos curvos. Aunque los de celda cerrada proporcionan más interconexiones, una mayor fuerza radial y una cobertura uniforme, ofrecen una menor flexibilidad y adaptabilidad a anatomías tortuosas. |
|||||||
RESULTADOS Y COMPLICACIONES
Resultados inmediatos y a corto plazo
El tratamiento percutáneo de la CoAo ha demostrado ser seguro y eficaz, con tasas de éxito que varían según el tipo de intervención y la población tratada. Las complicaciones inmediatas asociadas a la reparación percutánea incluyen la rotura de la pared aórtica, la mala aposición del stent y las complicaciones en el sitio de acceso vascular y su incidencia varía entre grupos y estudios. Steiner y Prsa observaron que la ICP-balón alcanzó tasas de éxito del 71 y 69% en el tratamiento de la CoAo nativa y recoartación, respectivamente. Por otro lado, el implante de stent tuvo una tasa de éxito del 100% en ambas situaciones59. Un metanálisis realizado por Nana et al. confirmó que la tasa de éxito técnico del implante de stent en adultos fue del 97%, con tasas de mortalidad intraoperatoria y a 30 días del 1%60. Otro metanálisis de Yang et al. informó una tasa global de éxito del 98% para el implante de stent en el tratamiento de la CoAo nativa61.
Resultados a largo plazo
El tratamiento percutáneo mediante stents, tanto metálicos como recubiertos, ha demostrado excelentes resultados a largo plazo. Schleiger et al. informaron una tasa de éxito de la intervención del 88,2% y tasas de supervivencia del 98,1, 95,6 y 95,6% a 5, 10 y 15 años, respectivamente. Las tasas de reintervención fueron del 27,8% y la mediana de seguimiento, 7,3 años, sin diferencias significativas entre stents metálicos y recubiertos62. Los estudios COAST y COAST II mostraron un buen perfil de eficacia en el seguimiento y una menor necesidad de antihipertensivos63.
Las complicaciones a largo plazo son la formación de aneurismas, la reestenosis y la fractura y migración del stent64. Se debe mencionar que los ensayos COAST y COAST II comunicaron una tasa acumulada de fracturas del stent del 24,4% en el seguimiento tardío. Las tasas de reintervención fueron del 21,3%, siendo factores predictivos una menor edad y diámetros más pequeños del stent63.
Pan et al. aportaron uno de los seguimientos más largos publicados (de 4 a 30 años). La incidencia acumulada de fractura del stent durante el seguimiento a largo plazo fue del 34% y la de formación de aneurismas, del 13%65.
En líneas generales, el implante de stent se asocia a altas tasas de éxito de la intervención, importantes beneficios de supervivencia a largo plazo y tasas más bajas hipertensión. No obstante, el seguimiento a largo plazo es esencial por el riesgo de fractura del stent, reintervenciones y complicaciones tardías como la formación de aneurismas42,56.
TRATAMIENTO DE LAS LIMITACIONES EN POBLACIONES ESPECÍFICAS
Síndrome de Turner y enfermedades del tejido conectivo
Las CC se dan en un tercio de los pacientes con ST, el 75% de los cuales son CoAo o VAB66,67. Aunque el tratamiento de primera línea de la CoAo en niños suele ser la reparación quirúrgica, los pacientes con ST tienen incidencias altas de disección aórtica (11%) y formación de aneurismas (30%) tras la cirugía68. Estos resultados se atribuyen a la debilidad intrínseca de la pared aórtica por la necrosis quística de la media propia del ST68. En este caso, en la actualidad, el tratamiento percutáneo con implante de stent recubierto es la opción preferida en pacientes con anatomías favorables. Los stents recubiertos cubren la zona lesionada de la pared y reducen el riesgo de formación de aneurismas en esta situación vascular tan especial69.
En lo referente a las enfermedades del tejido conectivo, como los síndromes de Marfan o Ehlers-Danlos, la evidencia no basta para seleccionar el tratamiento óptimo de la CoAo en estos casos. No obstante, pueden aplicarse consideraciones similares a las descritas para el ST en lo referente a la selección de stents recubiertos cuando el tratamiento percutáneo sea anatómicamente viable.
Adultos y pacientes de edad avanzada
Los pacientes de edad avanzada suelen presentar calcificación grave en el lugar de la coartación, lo que complica el implante y expansión del stent y puede conducir a resultados subóptimos y a un mayor riesgo de complicaciones. En este sentido, algunos autores recomiendan realizar varias dilataciones del stent implantado para ir restaurando poco a poco el diámetro aórtico fisiológico. Se aconseja el uso de stents recubiertos en el tratamiento de la CoAo en pacientes de edad avanzada con pared aórtica calcificada70.
En casos complejos seleccionados, como adultos con coartación grave de larga evolución conducente a oclusión aórtica completa o casi completa, el tratamiento percutáneo puede seguir siendo viable. Estos casos requieren una planificación meticulosa de la intervención, dilataciones escalonadas o stents recubiertos para restablecer de forma segura la permeabilidad aórtica. Se pueden emplear técnicas avanzadas como estrategias de escalado de guías, abordajes retrógrados o anterógrados y predilataciones meticulosas para minimizar el riesgo de lesión aórtica y optimizar el implante de stent. Casos clínicos y series pequeñas han demostrado que, con hemodinamistas experimentados y la planificación adecuada, la reparación percutánea logra resultados satisfactorios incluso en anatomías tan complicadas como estas65.
INNOVACIONES Y TÉCNICAS EMERGENTES
Avances en la tecnología de stents
Stents biodegradables
Polímeros bioabsorbibles como el PLLA (ácido poli-l-láctico) y el PLA (ácido poli-láctico)71 podrían ser una alternativa a los stents metálicos en niños y recién nacidos. Estos stents deben proporcionar soporte estructural a través de su geometría; no obstante, su menor resistencia frente los metales los hace inadecuados para vasos grandes y rígidos como la aorta72,73. En la actualidad, no hay ningún stent poliméricos bioabsorbible para el tratamiento de la CoAo en niños74. A pesar de esto, los stents bioabsorbibles podrían reducir los costes y riesgos asociados a los implantes permanentes. Los avances en la tecnología de stents pronto podrán dar soluciones biodegradables que permitan el tratamiento no quirúrgico y crecimiento normal de lactantes con CoA.
Stents expandibles
Una de las limitaciones del implante de stents en lactantes es el tamaño de la vaina introductora necesaria para implantar un stent que luego se pueda volver a dilatar a fin de adaptarse al crecimiento somático75. Los stents expandibles con balón son el patrón oro para el tratamiento de la CoAo76. No obstante, los stents autoexpandibles aún están en fase de investigación y podrían reducir el riesgo de fractura del stent, disección vascular y formación de aneurismas77.
Los intentos por abordar los desafíos asociados al crecimiento incluyen el desarrollo de stents autodisruptivos, como el Growth (QualiMed, Alemania), diseñado para el tratamiento de la CoAo. Este dispositivo consta de 2 mitades de acero inoxidable electropulido cortadas con láser y unidas mediante suturas bioabsorbibles que forman una estructura circular. Las suturas se reabsorben por completo en un plazo de 6 meses, periodo tras el cual ambas mitades se mantendrán en posición de forma segura sin limitar el crecimiento natural, lo cual permite implantar stents convencionales más grandes que podrán expandirse hasta dimensiones adultas. A pesar de las expectativas iniciales, estos stents fracasaron por las altas tasas de reintervención y por una adaptación insuficiente al crecimiento78.
En la actualidad, las últimas estrategias se centran en nuevos diseños de stents con perfiles de liberación bajos y alto potencial de redilatación, como el Palmaz Genesis XD, el Intrastent Mega y el Cheatham Platinum, siendo este último el primero aprobado para tratar la CoAo. Estos stents reducen notablemente el riesgo de reestenosis y la necesidad de implantes adicionales. El Cheatham Platinum (NuMED, Estados Unidos) está fabricado con alambres de platino e iridio dispuestos en una configuración en zigzag capaz de expandirse hasta un diámetro de 30 mm. Su importante capacidad de dilatación reduce, significativamente, la necesidad de implantar stents adicionales, lo cual se traduce en una menor tasa de reestenosis frente a otros dispositivos58,79.
Entre las tecnologías emergentes están el stent Minima (Renata Medical, Estados Unidos), diseñado para el tratamiento de la estenosis vascular congénita, permite un tamaño inicial < 4 mm para su implantación al nacimiento, puede expandirse > 22 mm manteniendo toda su integridad estructural y fuerza radial80 y el BeGrow (Bentley InnoMed, Alemania), desarrollado para el tratamiento de la estenosis de la arteria pulmonar, que permite dilataciones de hasta 11,5 mm y tiene puntos de rotura controlados para adaptarse al crecimiento y a futuras intervenciones81.
Tecnologías emergentes y de navegación
Los modelos impresos en tres dimensiones (3D) están demostrando ser muy valiosos para la planificación de intervenciones complejas en el tratamiento de CC82,83. Los modelos 3D han demostrado ser útiles durante la planificación quirúrgica y percutánea, incluida la hipoplasia del arco aórtico y el implante valvular percutáneo. Estos modelos se crean a partir de técnicas de imagen como la RMC, la angio-TC o la ecocardiografía, seguidas de segmentación e impresión. Los modelos rígidos son ideales para el posicionamiento de stents y los flexibles permiten examinar la dinámica de la pared vascular83. Desde el punto de vista clínico, la impresión 3D mejora la precisión de la intervención, acorta los tiempos de esta y reduce las complicaciones, lo cual resulta beneficioso para pacientes de alto riesgo o con anatomías complejas.
Líneas futuras
Las técnicas de imágen avanzada, las últimas tecnologías de stents74 y los abordajes híbridos son capaces de mejorar los resultados del tratamiento de la CoAo. También es fundamental contar con protocolos rigurosos de seguimiento a largo plazo para vigilar la durabilidad del tratamiento y valorar posibles complicaciones tardías en los pacientes.
Seguimos teniendo necesidades no cubiertas en el tratamiento percutáneo como falta de técnicas estandarizadas y abordajes óptimos para los distintos perfiles de los pacientes84,85. Se necesita perfeccionar los criterios de selección de los pacientes, mejorar el tratamiento de las complicaciones y recopilar datos clínicos más amplios a largo plazo que garanticen unos resultados óptimos y la seguridad del paciente.
Por último, las prioridades más importantes en materia de investigación en este campo incluyen realizar ensayos clínicos aleatorizados que comparen nuevos diseños de stents, optimizar las técnicas de implante, evaluar el papel que juega la posdilatación y el mejor momento para ello, mejorar las técnicas de imágen para guiar y valorar los resultados, determinar las indicaciones y el momento óptimo para realizar reintervenciones percutáneas y abordar el tratamiento de pacientes durante el paso de la atención pediátrica a adulta86.
No cabe duda de que la inteligencia artificial tendrá un papel relevante en el tratamiento percutáneo de las CC. En el caso de la CoAo, permitirá un análisis más preciso de las técnicas de imagen para caracterizar su gravedad. Asimismo, permitirá una mejor planificación terapéutica y posibilitará la selección del abordaje y dispositivo más adecuados y el diseño de stents individualizados adaptados al perfil de cada paciente, con vistas a optimizar los resultados a largo plazo.
CONCLUSIONES
El implante de stent percutáneo se ha convertido en el tratamiento estándar para pacientes elegibles con CoAo y viene avalado por un éxito operatorio consistente y resultados favorables a largo plazo, Los estudios que se realicen en el futuro deberían centrarse en optimizar el diseño de los dispositivos, la adaptabilidad pediátrica y los protocolos estandarizados de seguimiento.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial en la elaboración de esta revisión.
CONTRIBUCIÓN DE LOS AUTORES
Conceptualización: E. Flores-Umanzor, J. Galeano, O.A. Centurión y A. Ruberti, Metodología: R. Luna-López, I. Morr-Verenzuela, P. Cepas-Guillén, S. Montserrat y S. Prat-González; validación: D. Pereda, R. Sanz-Ruiz, J.M. Carretero Bellón, O. Abdul-Jawad Altisent, S. Brugaletta, M. Sabaté, X. Freixa; redacción, borrador original: V. Arévalos, A. Salazar-Rodríguez y G. Velázquez; redacción, revisión y edición: V. Arévalos, A. Salazar-Rodríguez, G. Velázquez, B. Vidal, L. Sanchis, I. Anduaga y A. Fernández-Cisneros; supervisión: M. Sabaté y E. Flores-Umanzor. Todos los autores leyeron y dieron su aprobación a la versión final del manuscrito.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Teo LL, Cannell T, Babu-Narayan SV, Hughes M, Mohiaddin RH. Prevalence of associated cardiovascular abnormalities in 500 patients with aortic coarctation referred for cardiovascular magnetic resonance imaging to a tertiary center. Pediatr Cardiol. 2011;32:1120-1127.
2. Kim YY, Andrade L, Cook SC. Aortic Coarctation. Cardiol Clin. Aug 2020;38:337-351.
3. Ruhela M, Randhawa H, Bagarhatta P, Bagarhatta R, Jain A. Coarctation of Aorta with Supravalvular Pulmonary Stenosis in an Adult Patient:A Rare Exception of the Fetal Flow Pattern Theory. Am J Med Case Rep. 2015;3:53-58.
4. Hoffman JI, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol. 2002;39:1890-1900.
5. Becker AE, Becker MJ, Edwards JE. Anomalies associated with coarctation of aorta:particular reference to infancy. Circulation. 1970;41:1067-1075.
6. Levy MJ, Levinsky L, Deviri E, Hauptman E, Blieden LC. Coarctation of the aorta in infancy. Tex Heart Inst J. 1983;10:57-62.
7. Mitchell ME. Aortic Coarctation Repair:How I Teach It. Ann Thorac Surg. 2017;104:377-381.
8. Chen B, Wei M. Aortic Coarctation. N Engl J Med. 2024;390:1420.
9. Baumgartner H, De Backer J, Babu-Narayan SV, et al. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J. 2021;42:563-645.
10. Campbell M. Natural history of coarctation of the aorta. Br Heart J. 1970;32:633-40.
11. Mazzolai L, Teixido-Tura G, Lanzi S, et al. 2024 ESC Guidelines for the management of peripheral arterial and aortic diseases. Eur Heart J. 2024;45:3538-3700.
12. Kvitting JP, Olin CL. Clarence Crafoord:a giant in cardiothoracic surgery, the first to repair aortic coarctation. Ann Thorac Surg. 2009;87:342-346.
13. Singer MI, Rowen M, Dorsey TJ. Transluminal aortic balloon angioplasty for coarctation of the aorta in the newborn. Am Heart J. 1982;103:131-132.
14. Harris KC, Du W, Cowley CG, Forbes TJ, Kim DW. A prospective observational multicenter study of balloon angioplasty for the treatment of native and recurrent coarctation of the aorta. Catheter Cardiovasc Interv. 2014;83:1116-1123.
15. Cowley CG, Orsmond GS, Feola P, McQuillan L, Shaddy RE. Long-term, randomized comparison of balloon angioplasty and surgery for native coarctation of the aorta in childhood. Circulation. 2005;111:3453-3456.
16. O'Laughlin MP, Perry SB, Lock JE, Mullins CE. Use of endovascular stents in congenital heart disease. Circulation. 1991;83:1923-1939.
17. Suárez de Lezo J, Pan M, Romero M, et al. Balloon-expandable stent repair of severe coarctation of aorta. Am Heart J. 1995;129:1002-1008.
18. Forbes TJ, Kim DW, Du W, et al. Comparison of surgical, stent, and balloon angioplasty treatment of native coarctation of the aorta:an observational study by the CCISC (Congenital Cardiovascular Interventional Study Consortium). J Am Coll Cardiol. 2011;58:2664-2674.
19. Gunn J, Cleveland T, Gaines P. Covered stent to treat co-existent coarctation and aneurysm of the aorta in a young man. Heart. 1999;82:351.
20. de Giovanni JV. Covered stents in the treatment of aortic coarctation. J Interv Cardiol. 2001;14:187-190.
21. Forbes T, Matisoff D, Dysart J, Aggarwal S. Treatment of coexistent coarctation and aneurysm of the aorta with covered stent in a pediatric patient. Pediatr Cardiol. 2003;24:289-291.
22. Lock JE, Castaneda-Zuniga WR, Bass JL, Foker JE, Amplatz K, Anderson RW. Balloon dilatation of excised aortic coarctations. Radiology. 1982;143:689-691.
23. Beekman RH, Rocchini AP, Dick M, 2nd, et al. Percutaneous balloon angioplasty for native coarctation of the aorta. J Am Coll Cardiol. 1987;10:1078-1084.
24. Rao PS. Balloon angioplasty of native coarctation of the aorta. J Invasive Cardiol. 2000;12:407-409.
25. Luijendijk P, Bouma BJ, Groenink M, et al. Surgical versus percutaneous treatment of aortic coarctation:new standards in an era of transcatheter repair. Expert Rev Cardiovasc Ther. 2012;10:1517-1531.
26. Hernández-González M, Solorio S, Conde-Carmona I, et al. Intraluminal aortoplasty vs. surgical aortic resection in congenital aortic coarctation. A clinical random study in pediatric patients. Arch Med Res. 2003;34:305-310.
27. Rodés-Cabau J, MiróJ, Dancea A, et al. Comparison of surgical and transcatheter treatment for native coarctation of the aorta in patients >or =1 year old. The Quebec Native Coarctation of the Aorta study. Am Heart J. 2007;154:186-192.
28. Shaddy RE, Boucek MM, Sturtevant JE, et al. Comparison of angioplasty and surgery for unoperated coarctation of the aorta. Circulation. 1993;87:793-799.
29. Walhout RJ, Lekkerkerker JC, Ernst SM, Hutter PA, Plokker TH, Meijboom EJ. Angioplasty for coarctation in different aged patients. Am Heart J. 2002;144:180-186.
30. Fawzy ME, Fathala A, Osman A, et al. Twenty-two years of follow-up results of balloon angioplasty for discreet native coarctation of the aorta in adolescents and adults. Am Heart J. 2008;156:910-917.
31. Fletcher SE, Cheatham JP, Froeming S. Aortic aneurysm following primary balloon angioplasty and secondary endovascular stent placement in the treatment of native coarctation of the aorta. Cathet Cardiovasc Diagn. 1998;44:40-44.
32. Carr JA. The results of catheter-based therapy compared with surgical repair of adult aortic coarctation. J Am Coll Cardiol. 2006;47:1101-1107.
33. Hellenbrand WE, Allen HD, Golinko RJ, Hagler DJ, Lutin W, Kan J. Balloon angioplasty for aortic recoarctation:results of Valvuloplasty and Angioplasty of Congenital Anomalies Registry. Am J Cardiol. 1990;65:793-797.
34. Rao PS, Thapar MK, Wilson AD, Levy JM, Chopra PS. Intermediate-term follow-up results of balloon aortic valvuloplasty in infants and children with special reference to causes of restenosis. Am J Cardiol. 1989;64:1356-1360.
35. Batlivala SP, Goldstein BH. Current Transcatheter Approaches for the Treatment of Aortic Coarctation in Children and Adults. Interv Cardiol Clin. 2019;8:47-58.
36. Reich O, Tax P, BartákováH, et al. Long-term (up to 20 years) results of percutaneous balloon angioplasty of recurrent aortic coarctation without use of stents. Eur Heart J. 2008;29:2042-2048.
37. Zabal C, Attie F, Rosas M, Buendía-Hernández A, García-Montes JA. The adult patient with native coarctation of the aorta:balloon angioplasty or primary stenting?Heart. 2003;89:77-83.
38. Tzifa A, Ewert P, Brzezinska-Rajszys G, et al. Covered Cheatham-platinum stents for aortic coarctation:early and intermediate-term results. J Am Coll Cardiol. 2006;47:1457-1463.
39. Qureshi AM, McElhinney DB, Lock JE, Landzberg MJ, Lang P, Marshall AC. Acute and intermediate outcomes, and evaluation of injury to the aortic wall, as based on 15 years experience of implanting stents to treat aortic coarctation. Cardiol Young. 2007;17:307-318.
40. Tanous D, Collins N, Dehghani P, Benson LN, Horlick EM. Covered stents in the management of coarctation of the aorta in the adult:initial results and 1-year angiographic and hemodynamic follow-up. Int J Cardiol. 2010;140:287-295.
41. Chessa M, Carrozza M, Butera G, et al. Results and mid-long-term follow-up of stent implantation for native and recurrent coarctation of the aorta. Eur Heart J. 2005;26:2728-2732.
42. Stout KK, Daniels CJ, Aboulhosn JA, et al. 2018 AHA/ACC Guideline for the Management of Adults With Congenital Heart Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;139:e698-e800.
43. Bulbul ZR, Bruckheimer E, Love JC, Fahey JT, Hellenbrand WE. Implantation of balloon-expandable stents for coarctation of the aorta:implantation data and short-term results. Cathet Cardiovasc Diagn. 1996;39:36-42.
44. Ewert P, Abdul-Khaliq H, Peters B, Nagdyman N, Schubert S, Lange PE. Transcatheter therapy of long extreme subatretic aortic coarctations with covered stents. Catheter Cardiovasc Interv. 2004;63:236-239.
45. Kenny D, Hijazi ZM. Coarctation of the aorta:from fetal life to adulthood. Cardiol J. 2011;18:487-495.
46. Krasemann T, Bano M, Rosenthal E, Qureshi SA. Results of stent implantation for native and recurrent coarctation of the aorta-follow-up of up to 13 years. Catheter Cardiovasc Interv. 2011;78:405-412.
47. Koletsis E, Ekonomidis S, Panagopoulos N, Tsaousis G, Crockett J, Panagiotou M. Two stage hybrid approach for complex aortic coarctation repair. J Cardiothorac Surg. 2009;4:10.
48. Teixeira AM, Reis-Santos K, Anjos R. Hybrid approach to severe coarctation and aortic regurgitation. Cardiol Young. 2005;15:525-528.
49. Novosel L, Perkov D, Dobrota S, C´oric´V, Štern Padovan R. Aortic coarctation associated with aortic valve stenosis and mitral regurgitation in an adult patient:a two-stage approach using a large-diameter stent graft. Ann Vasc Surg. 2014;28:494.e9-e14.
50. Russell TA, Quarto C, Nienaber CA. A single-stage hybrid approach for the management of severely stenotic bicuspid aortic valve, ascending aortic aneurysm, and coarctation of the aorta with a literature review. J Cardiol Cases. 2018;17:183-186.
51. Tacy TA, Baba K, Cape EG. Effect of aortic compliance on Doppler diastolic flow pattern in coarctation of the aorta. J Am Soc Echocardiogr. 1999;12:636-642.
52. Krieger EV, Stout KK, Grosse-Wortmann L. How to Image Congenital Left Heart Obstruction in Adults. Circ Cardiovasc Imaging. 2017;10:e004271.
53. Hedgire SS, Baliyan V, Ghoshhajra BB, Kalra MK. Recent advances in cardiac computed tomography dose reduction strategies:a review of scientific evidence and technical developments. J Med Imaging (Bellingham). 2017;4:031211.
54. Julsrud PR, Breen JF, Felmlee JP, Warnes CA, Connolly HM, Schaff HV. Coarctation of the aorta:collateral flow assessment with phase-contrast MR angiography. AJR Am J Roentgenol. 1997;169:1735-1742.
55. Hom JJ, Ordovas K, Reddy GP. Velocity-encoded cine MR imaging in aortic coarctation:functional assessment of hemodynamic events. Radiographics. 2008;28:407-416.
56. Isselbacher EM, Preventza O, Hamilton Black J, 3rd, et al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease:A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022;146:e334-e482.
57. Malek R, Puckett Y, Agasthi P. Catheter Management of Coarctation. StatPearls. StatPearls Publishing;2025. Disponible en:https://www.statpearls.com/physician/cme/activity/↻9/?specialty=specialty°=md.
58. Hatoum I, Haddad RN, Saliba Z, Abdel Massih T. Endovascular stent implantation for aortic coarctation:parameters affecting clinical outcomes. Am J Cardiovasc Dis. 2020;10:528-537.
59. Steiner I, Prsa M. Immediate results of percutaneous management of coarctation of the aorta:A 7-year single-centre experience. Int J Cardiol. 2021;322:103-106.
60. Nana P, Spanos K, Brodis A, et al. A Systematic Review and Meta-analysis on Stenting for Aortic Coarctation Management in Adults. J Endovasc Ther. 2023:15266028231179919.
61. Yang L, Chua X, Rajgor DD, Tai BC, Quek SC. A systematic review and meta-analysis of outcomes of transcatheter stent implantation for the primary treatment of native coarctation. Int J Cardiol. 2016;223:1025-1034.
62. Schleiger A, Al Darwish N, Meyer M, Kramer P, Berger F, Nordmeyer J. Long-term follow-up after endovascular treatment of aortic coarctation with bare and covered Cheatham platinum stents. Catheter Cardiovasc Interv. 2023;102:672-682.
63. Holzer RJ, Gauvreau K, McEnaney K, Watanabe H, Ringel R. Long-Term Outcomes of the Coarctation of the Aorta Stent Trials. Circ Cardiovasc Interv. 2021;14:e010308.
64. Feltes TF, Bacha E, Beekman RH, 3rd, et al. Indications for cardiac catheterization and intervention in pediatric cardiac disease:a scientific statement from the American Heart Association. Circulation. 2011;123:2607-2652.
65. Pan M, Pericet C, González-Manzanares R, et al. Very long-term follow-up after aortic stenting for coarctation of the aorta. Rev Esp Cardiol. 2024;77:332-341.
66. Morgan T. Turner syndrome:diagnosis and management. Am Fam Physician. 2007;76:405-410.
67. Donadille B, Christin-Maitre S. Heart and Turner syndrome. Ann Endocrinol (Paris). 2021;82:135-140.
68. Zanjani KS, Thanopoulos BD, Peirone A, Alday L, Giannakoulas G. Usefulness of stenting in aortic coarctation in patients with the Turner syndrome. Am J Cardiol. 2010;106:1327-1331.
69. Bons LR, Van Den Hoven AT, Malik M, et al. Abnormal Aortic Wall Properties in Women with Turner Syndrome. Aorta (Stamford). 2020;8:121-131.
70. Kische S, D'Ancona G, Stoeckicht Y, Ortak J, Elsässer A, Ince H. Percutaneous treatment of adult isthmic aortic coarctation:acute and long-term clinical and imaging outcome with a self-expandable uncovered nitinol stent. Circ Cardiovasc Interv. 2015;8:e001799.
71. Qiu TY, Song M, Zhao LG. A computational study of crimping and expansion of bioresorbable polymeric stents. Mech Time Depend Mater. 2018;22:273-290.
72. Borghi Jr TC, Costa Jr JR, Abizaid A, et al. Comparação da retração aguda do stent entre o suporte vascular bioabsorvível eluidor de everolimus e dois diferentes stents metálicos farmacológicos. Rev Bras Cardiol Invasiva. 2013;21.
73. Veeram Reddy SR, Welch TR, Wang J, et al. A novel design biodegradable stent for use in congenital heart disease:mid-term results in rabbit descending aorta. Catheter Cardiovasc Interv. 2015;85:629-639.
74. Veeram Reddy SR, Welch TR, Nugent A. Biodegradable Stent Use For Congenital Heart Disease. Progress in Pediatric Cardiology. 2021;61:101349.
75. Goldstein BH, Kreutzer J. Transcatheter Intervention for Congenital Defects Involving the Great Vessels:JACC Review Topic of the Week. J Am Coll Cardiol. 2021;77:80-96.
76. Zablah JE, Morgan GJ. Pulmonary Artery Stenting. Interv Cardiol Clin. 2019;8:33-46.
77. Sadeghipour P, Mohebbi B, Firouzi A, et al. Balloon-Expandable Cheatham-Platinum Stents Versus Self-Expandable Nitinol Stents in Coarctation of Aorta:A Randomized Controlled Trial. JACC Cardiovasc Interv. 2022;15:308-317.
78. Ewert P, Peters B, Nagdyman N, Miera O, Kühne T, Berger F. Early and mid-term results with the Growth Stent--a possible concept for transcatheter treatment of aortic coarctation from infancy to adulthood by stent implantation?Catheter Cardiovasc Interv. 2008;71:120-126.
79. Cheatham JP. Stenting of coarctation of the aorta. Catheter Cardiovasc Interv. 2001;54:112-125.
80. Zahn EM, Abbott E, Tailor N, Sathanandam S, Armer D. Preliminary testing and evaluation of the renata minima stent, an infant stent capable of achieving adult dimensions. Catheter Cardiovasc Interv. 2021;98:117-127.
81. Quandt D, Knirsch W, Michel-Behnke I, et al. First-in-man pulmonary artery stenting in children using the Bentley®BeGrow™stent system for newborns and infants. Int J Cardiol. 2019;276:107-109.
82. Pluchinotta FR, Giugno L, Carminati M. Stenting complex aortic coarctation:simulation in a 3D printed model. EuroIntervention. 2017;13:490.
83. Ghisiawan N, Herbert CE, Zussman M, Verigan A, Stapleton GE. The use of a three-dimensional print model of an aortic arch to plan a complex percutaneous intervention in a patient with coarctation of the aorta. Cardiol Young. 2016;26:1568-1572.
84. Khalaj R, Tabriz AG, Okereke MI, Douroumis D. 3D printing advances in the development of stents. Int J Pharm. 2021;609:121153.
85. Capelli C, Sauvage E, Giusti G, et al. Patient-specific simulations for planning treatment in congenital heart disease. Interface Focus. 2018;8:20170021.
86. Rigatelli G, Chiastra C, Pennati G, Dubini G, Migliavacca F, Zuin M. Applications of computational fluid dynamics to congenital heart diseases:a practical review for cardiovascular professionals. Expert Rev Cardiovasc Ther. 2021;19:907-916.
RESUMEN
El cierre percutáneo de la orejuela izquierda ha ido emergiendo como un procedimiento cada vez más prometedor para pacientes con fibrilación auricular no valvular y riesgo hemorrágico muy alto o prohibitivo. Se trata de una técnica segura, con un porcentaje de complicaciones bajo; sin embargo, algunas de ellas, como la embolización del dispositivo, pueden ser graves, y la toma de decisiones y la estrategia más adecuada pueden ser difíciles debido a la escasa evidencia disponible. La presente revisión proporciona un resumen de los aspectos más importantes sobre la embolización de dispositivos de cierre de la orejuela izquierda, tanto en su prevalencia como en su abordaje y las opciones de tratamiento.
Palabras clave: Cierre de orejuela. Embolización. Dispositivos.
ABSTRACT
Percutaneous left atrial appendage closure has emerged as a promising procedure for patients with non-valvular atrial fibrillation with a very high or prohibitive bleeding risk. It is a safe technique, with a low rate of complications; however, complications, such as device embolization can be potentially serious, and decision-making as well as selecting the most appropriate strategy may be challenging due to the limited evidence available in this context. This review provides an overview of the most critical aspects of left atrial appendage closure device embolization focusing on its prevalence, management strategies, and treatment options.
Keywords: Left atrial appendage closure. Embolization. Devices.
Abreviaturas
AI: aurícula izquierda. ETE: ecocardiograma transesofágico. VI: ventrículo izquierdo.
INTRODUCCIÓN
La fibrilación auricular se ha convertido en la arritmia más frecuente de nuestros tiempos. Se estima que su prevalencia en la población española es de un 4,4% en las personas mayores de 40 años, lo que en números absolutos se traduce en más de 1 millón de españoles con este trastorno del ritmo1. Desde hace años existe una sólida evidencia sobre su relación con el aumento de la incidencia de ictus y de la mortalidad de causa cardiovascular en ambos sexos2,3, por lo que la anticoagulación a dosis terapéuticas es un pilar fundamental del tratamiento de estos pacientes. Sin embargo, en aquellos con riesgo hemorrágico elevado o prohibitivo, el cierre percutáneo de la orejuela izquierda ha emergido como una alternativa razonable y no inferior al tratamiento anticoagulante en lo que respecta a eventos cardioembólicos, muerte de causa cardiovascular y sangrado clínicamente relevante4.
Aunque la tasa de complicaciones intraprocedimiento y posimplante se mantiene baja, al aumentar el número de procedimientos realizados en todo el mundo la tasa de embolización del dispositivo se sitúa actualmente en torno al 0-1.5% de todos los procedimientos realizados5.
La presente revisión resume la evidencia disponible acerca de la embolización de dispositivos de cierre percutáneo de la orejuela izquierda, mediante una descripción de los tipos de dispositivos disponibles, los potenciales predictores de embolización y el tratamiento recomendado para cada caso.
TIPOS DE DISPOSITIVOS
A continuación, se describen brevemente los 3 tipos de dispositivos que se encuentran disponibles en nuestro medio.
Familia WATCHMAN
Los WATCHMAN (Boston Scientific, Estados Unidos) son una familia de dispositivos de un único lóbulo de cierre que se implanta a unos 10 mm del ostium de la orejuela izquierda, por lo que este no queda cubierto.
En 2020, Boston Scientific sacó al mercado la nueva generación, WATCHMAN FLX, que en un metanálisis de 54.727 pacientes demostró ser superior en términos de mortalidad de causa cardiovascular, sangrados mayores, derrame pericárdico y embolización del dispositivo respecto a su predecesor, WATCHMAN 2.5. Esto se debe en parte a su menor superficie metálica, lo que reduce el riesgo de trombosis, y al mayor número de ganchos (18 frente a 10), lo que permite una mejor adaptación al ostium con menor incidencia de fugas6,7. Está disponible en 5 tamaños diferentes, que abarcan ostium desde 14 hasta 31,5 mm.
La Food and Drug Administration aprobó en 2024 el dispositivo WATCHMAN FLX pro, que incorpora como novedad una membrana de tejido recubierta de un fluoropolímero diseñada para aumentar la resistencia a los trombos y facilitar la endotelización, lo cual podría traducirse en regímenes antitrombóticos más cortos tras el procedimiento. Ha mostrado resultados prometedores en casos clínicos publicados8 y está en marcha un estudio unicéntrico, el WATCHMAN FLX PRO CT (NCT05567172), cuyo objetivo es determinar la morfología y la cobertura tisular de la superficie del dispositivo a los 90 días del implante. No dispone aún del marcado CE (Conformidad Europea) para su comercialización en Europa.
Familia Amplatzer
En 2013 obtuvo el marcado CE la segunda generación de esta familia: el Amplatzer Amulet (Abbott, Estados Unidos) (figura 1A). Consta de un lóbulo de cierre, que se suele implantar a 10-15 mm del ostium, y de un disco que permite cubrirlo por completo. Ambas partes están conectadas por una cintura central. Sus dimensiones se basan y miden en función de la zona de aterrizaje (landing zone) que presente la orejuela, que es el sitio donde descansa el lóbulo del dispositivo. Está disponible en varios tamaños, desde 16 hasta 34 mm, que cubren una superficie de zona de aterrizaje de la orejuela que abarca de 11 a 31 mm9.
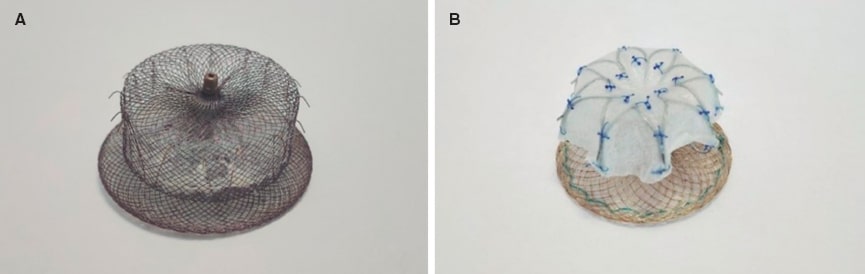
Figura 1. A: dispositivo Amplatzer. B: dispositivo LAmbre.
El estudio Amulet IDE10, que comparó el Amplatzer Amulet con el dispositivo WATCHMAN de primera generación, concluyó que la tasa de oclusión de la orejuela izquierda fue mayor con el dispositivo de doble sellado. Asimismo, se demostró la no inferioridad del primero con respecto a la seguridad y la efectividad en la reducción de ictus para pacientes con fibrilación auricular no valvular, pero se observó una incidencia más alta, casi el doble, de eventos adversos, como derrame pericárdico y embolización del dispositivo, si bien es cierto que la experiencia era mayor en aquel momento con los dispositivos WATCHMAN, lo cual pudo influir en que aparecieran más complicaciones con el dispositivo Amplatzer10. Los resultados de no inferioridad se mantuvieron en el análisis a 5 años, con un porcentaje significativamente mayor de pacientes sin anticoagulación prescrita en el grupo de Amplatzer (94 frente a 91%; p = 0,009) y una tasa muy baja de ictus al año en ambos grupos (1,6% por año), con una incidencia mayor de ictus mortal en el grupo de WATCHMAN (1,9 frente a 1,2%; p = 0,03)11.
En un estudio que comparó las 2 generaciones de dispositivos Abbott se concluyó que la segunda presentaba una menor incidencia de fugas residuales peridispositivo, pero no hubo diferencias significativas en cuanto a la tasa de complicaciones mayores ni la mortalidad, y la tasa de éxito en el implante fue similar12.
LAmbre
LAmbre es un dispositivo de doble mecanismo de sellado (lóbulo y disco) de la marca comercial Lifetech Scientific Corporation (China) (figura 1B). Abarca una gama de 15 tamaños diferentes (16-36 mm) y está fabricado con una malla de nitinol y una membrana de poliéster. Su diseño presenta 8 ganchos distales y 8 ganchos con forma de U, que confieren una mayor estabilización debido a un mejor anclaje en las trabéculas de la orejuela. Obtuvo el marcado CE en 2016.
En un estudio prospectivo multicéntrico realizado en China con 103 pacientes, el dispositivo LAmbre tuvo una tasa de éxito del implante del 98,05%. La incidencia de derrame pericárdico posprocedimiento en los primeros 7 días fue del 4,95%, y ninguno requirió tratamien- to activo. Un paciente presentó ictus a los 2 meses del procedimiento, en contexto de reducción de dosis de anticoagulante. No se observó trombosis del dispositivo en ningún paciente, si bien es cierto que el tiempo medio de seguimiento fue de solo 12,2 meses13.
Este dispositivo tiene la peculiaridad de que es posible fabricarlo a medida en caso de orejuelas anatómicamente complejas o con dimensiones fuera del rango normal.
INCIDENCIA DE EMBOLIZACIÓN
La embolización del dispositivo de cierre de la orejuela, ya sea a una cavidad cardiaca, a un vaso grande o a un vaso periférico, es una complicación infrecuente, pero potencialmente mortal, con incidencias de mortalidad que llegan hasta el 10,2% en los registros publicados. La experiencia de los cardiólogos intervencionistas o electrofisiólogos que realizan el implante de los dispositivos, así como el número de procedimientos por año en cada hospital, se han relacionado de manera significativa con diferencias en la incidencia de embolización (0,6 y 1,5% en centros de alto y bajo volumen, respectivamente)5.
En cuanto al tipo de dispositivo utilizado y la incidencia de embolización, la relación no está del todo clara. El dispositivo WATCHMAN FLX presenta una incidencia menor que su predecesor WATCHMAN 2.5, (odds ratio = 0,35; intervalo de confianza del 95%, 0,18-0,70; p < 0,02), como ya se demostró en un metanálisis con 54.727 pacientes publicado en 20236, y llega a ser del 0% en el estudio PINNACLE FLX7.
En cuanto al dispositivo Amulet, el estudio Amulet IDE, que comparó este implante con el WATCHMAN, mostró una incidencia de embolización del 0,6 y el 0,2%, respectivamente, pero los autores argumentan estos resultados en parte por la menor experiencia de los operadores en ese momento con el dispositivo Amulet10. En el estudio SWISS-APERO, de 2021, en el que se comparó con el dispositivo WATCHMAN FLX, ambos presentaron similar incidencia de embolización (0,9% en los dos grupos)14.
Por su parte, en una revisión sistemática de 403 pacientes publicada en 2020, con el dispositivo LAmbre no hubo ningún caso de embolización15, y en otro ensayo alemán de 2024 con 118 pacientes la incidencia fue del 1,7%, pero el procedimiento se realizaba sin contraste, lo cual supone un sesgo importante al interpretar este incremento en la incidencia de complicaciones16. En las diversas experiencias españolas, la tasa ha sido de prácticamente el 0%17,18, y en la experiencia inicial brasileña fue del 2%, si bien el tamaño muestral era pequeño (1 caso de 51 pacientes incluidos)19.
Por lo tanto, basándose en estos datos se puede afirmar que la incidencia de embolización de los distintos dispositivos se sitúa en torno al 1%, sin diferencias significativas entre ellos.
Es importante señalar que, entre los factores que influyen en la embolización, se encuentran no solo las características del dispositivo, sino también las características anatómicas y morfológicas de la orejuela. Se ha reportado que las orejuelas tipo cactus, que son aquellas con un lóbulo central dominante del que parten muchos y pequeños lóbulos secundarios, se asocian a mayor riesgo de embolización. Asimismo, las orejuelas poco profundas y con cuellos anchos también se han relacionado con mayor riesgo de embolización del dispositivo20,21.
Se ha descrito que el ritmo cardiaco del paciente podría influir en un mayor riesgo de embolización del dispositivo, aunque no está del todo claro su papel. Parece lógico, y así se ha postulado en algunos casos publicados22, que una orejuela contráctil, es decir, la que se encuentra en ritmo sinusal, tenga un mayor riesgo de migración o embolización del dispositivo por la mayor fuerza de contracción comparada con aquella en fibrilación auricular. A su vez, la conversión del ritmo, sea de sinusal a fibrilación auricular o viceversa, también se ha postulado como un posible mecanismo que favorece la embolización.
En un análisis retrospectivo de embolizaciones de dispositivos tipo WATCHMAN a partir de datos del registro NCDR LAAO23, se concluyó que los pacientes que se encuentran en ritmo sinusal en el momento del implante parecen tener mayor riesgo de embolización tardía del dispositivo (primeros 45 días tras el alta), posiblemente porque la contracción activa de la orejuela en ritmo sinusal puede llevar a una subestimación del tamaño del ostium. Ante una caída posterior en fibrilación auricular (estado en el cual la orejuela suele estar más dilatada), el dispositivo puede quedar infraajustado, lo que favorecería su migración23.
En cuanto al momento de aparición, en la revisión realizada por Eppinger et al.5 se evidenció que la embolización del dispositivo fue más frecuente en el periodo agudo (primeras 24 h desde el implante) excepto en las arterias periféricas, en las que fue más prevalente en el periodo tardío (> 45 días).
En la tabla 1, la figura 2 y la figura 3 se presenta un resumen de las características de los dispositivos y sus tasas de embolización.
Tabla 1. Características y tasa de embolización de los dispositivos con marcado CE
| Dispositivo | Año CE | Características específicas | Tasas de embolización |
|---|---|---|---|
| WATCHMAN FLX, Boston Scientific | 2019 | Diseño en forma de paraguas
Menor superficie metálica que su predecesor 18 ganchos de fijación |
PINNACLE FLX7, 2021: 0 %
SWISS-APERO14, 2021: 0,9% SEAL-FLX24, 2022: 0% Della Rocca et al.25, 2022: 0% SURPASS FLX26, 2024: 0,04% |
| Amplatzer Amulet, Abbott | 2013 | Disco proximal y lóbulo distal
Disco proximal independiente del lóbulo, sin tornillo 10 pares de ganchos en el disco distal Longitud de la cintura hasta 20 mm (mayor adaptabilidad) Diámetro del disco 40% más grande que el lóbulo |
Kleinecke et al.12, 2020: 0,9%
AMULET IDE10, 2021: 0,6% SWISS-APERO14, 2021: 0,9% SEAL-FLX24, 2022: 0,7% Della Rocca25, 2022: 0,1% |
| LAmbre, Lifetech | 2016 | Paraguas ajustable más cubierta de poliéster 8 pares de ganchos radiales en forma de U
Amplia variedad de tamaños (hasta 40 mm) |
Cruz-González et al.18, 2018: 0%
Li et al.27, 2018: 0% Park et al.28, 2018: 0% Huang et al.29, 2019: 0% Ali et al.15, 2020: 0% Llagostera-Martín et al.17, 2021: 0% Wang et al.30, 2021: 0% Chamié et al.19, 2022: 2% Chen et al.31, 2022: 0% Vij et al.16, 2024: 1,7% (sin contraste) |
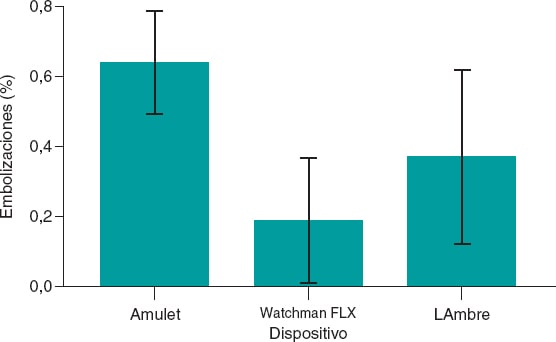
Figura 2. Gráfico de barras que muestra el porcentaje de embolizaciones de los dispositivos.
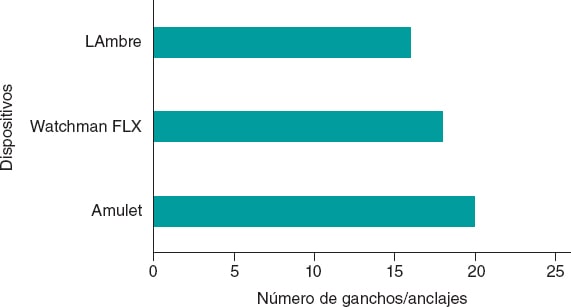
Figura 3. Dispositivos y número de ganchos y anclajes que presentan.
TÉCNICAS PARA REDUCIR EL RIESGO DE EMBOLIZACIÓN DEL DISPOSITIVO
Existen diversos factores relacionados con la anatomía de la aurícula y la orejuela izquierdas, el procedimiento per se y el dispositivo implantado que pueden favorecer un mayor riesgo de embolización. En mayo de 2023 se publicó un consenso de expertos de la Society for Cardiovascular Angiography & Interventions y la Heart Rhythm Society sobre el procedimiento de cierre de la orejuela izquierda y sus complicaciones32, en el que se abordan los aspectos más importantes (tabla 2). La elección correcta del tamaño del dispositivo es crucial, ya que tanto el sobre- como el infradimensionamiento favorecen la embolización. Además, los operadores deben estar entrenados y familiarizados con el procedimiento del implante (se recomienda haber realizado al menos 25 punciones transeptales y un mínimo de 10 cierres de orejuela como operador principal), así como con la recuperación del dispositivo embolizado (para lo cual se aconseja experiencia en el manejo de vainas de gran calibre y lazos de recuperación). En cuanto a las técnicas de imagen, pueden considerarse distintos momentos del procedimiento:
Tabla 2. Prevención de la embolización en las distintas fases del procedimiento
| Preprocedimiento | Intraprocedimiento | Posprocedimiento |
|---|---|---|
| Elección correcta del tamaño del dispositivo (evitar sobre- e infradimensionamiento) | Guía intraoperatoria mediante ETE 2D y 3D, y fluoroscopia | Verificación posoperatoria inmediata con ETT para detección temprana de embolizaciones |
| Entrenamiento adecuado del operador (mínimo 25 punciones transeptales y 10 cierres de orejuela) | Realización correcta del tug test (aunque su utilidad es debatida) | Evaluación prealta con ETT |
| Uso de técnicas de imagen preoperatorias: ETE 2D y 3D en múltiples ángulos o TC | Cumplimiento de criterios PASS (WATCHMAN) o CLOSE (Amplatzer) antes de liberar el dispositivo | Control de seguimiento a los 45-90 días con ETE o TC |
| La TC 3D es superior al ETE en la planificación del procedimiento | ||
| Evitar aurículas muy deplecionadas (< 12 mmHg) | ||
|
2D: bidimensional; 3D: tridimensional; ETE: ecocardiograma transesofágico; ETT: ecocardiograma transtorácico; TC: tomografía computarizada. |
||
- – En el preoperatorio se recomienda realizar un estudio dirigido mediante ecocardiograma transesofágico (ETE), obtener imá- genes bidimensionales en ángulos de 0°, 45°, 90° y 135°, y utilizar la técnica ETE tridimensional de manera sistemática, ya que proporciona una mejor precisión del tamaño. La tomografía computarizada cardiaca está cada vez más reconocida como una técnica superior al ETE para planificar el procedimiento, ya que ofrece mejor resolución espacial y permite identificar con más precisión el diámetro máximo de la zona de aterrizaje. Además, las reconstrucciones tridimensionales proporcionan una imagen volumétrica de la orejuela izquierda, mejoran la predicción del tamaño del dispositivo y, en algunos casos, mediante softwares especializados, permiten simular el implante y planificar rutas de acceso y punciones transeptales20.
- – En el intraoperatorio, el procedimiento debe guiarse por técnicas de imagen, utilizando la fluoroscopia y la ETE tanto bi- como tridimensional. Una nueva modalidad, la ecografía intracardiaca tridimensional, está evolucionando como una técnica de imagen complementaria para guiar el procedimiento, aunque actualmente presenta mayor coste y más complejidad que el ETE debido a la necesidad de colocar la sonda en la aurícula izquierda (AI). Un aspecto importante es la medición de la presión de la AI durante el procedimiento, ya que se ha demostrado que aurículas muy deplecionadas tienden a dar medidas erróneas. En general, para una correcta interpretación se recomienda que la presión auricular sea ≥ 12 mmHg. En caso de presión auricular baja, se pueden administrar líquidos intravenosos hasta alcanzar unos parámetros adecuados32.
- – En el posoperatorio inmediato es preciso comprobar la correcta colocación del dispositivo y descartar la presencia de derrame pericárdico u otras complicaciones.
- – Antes del alta resulta fundamental el ecocardiograma transtorácico, ya que la mayoría de las embolizaciones se producen en el posoperatorio inmediato, entendiendo como tal las primeras 24 horas posteriores al implante33,34.
- – Como control de seguimiento se recomienda realizar ETE o tomografía computarizada a los 45-90 días del implante.
Las casas comerciales de WATCHMAN y Amplatzer recomiendan una serie de pasos en el procedimiento intraoperatorio para asegurarse de que el dispositivo está implantado correctamente; deben cumplirse todos antes de liberar el dispositivo.
Para el WATCHMAN se utiliza el acrónimo PASS (posición, anclaje, tamaño [size] y sellado), y para el Amplatzer el acrónimo es CLOSE (circunfleja, lóbulo, orientación, separación y elíptico), tal como se detalla en la tabla 3.
Tabla 3. Criterios PASS y CLOSE para los dispositivos WATCHMAN y Amplatzer
| Criterios | PASS (WATCHMAN) | CLOSE (Amplatzer) |
|---|---|---|
| 1 | Posición: cobertura adecuada del ostium, inmediatamente distal o en el mismo ostium | Circunfleja: el lóbulo del dispositivo debe estar 1/3 a 2/3 distal de la arteria circunfleja |
| 2 | Anclaje: prueba de tracción suave sin cambio en la posición del dispositivo | Lóbulo: apariencia de neumático al comprimirlo |
| 3 | Tamaño (size): compresión del dispositivo del 8 al 20% de su tamaño original | Orientación: el lóbulo del dispositivo debe ser coaxial con la pared de la orejuela izquierda |
| 4 | Sellado: fuga residual < 5 mm; todos los lóbulos están cubiertos | Separación adecuada del lóbulo y el disco |
| 5 | Elíptico: el disco debe estar bajo tensión con una apariencia cóncava |
Un aspecto importante es la realización de la prueba del «tirón» (tug test) durante el procedimiento para evaluar la estabilidad del dispositivo implantado. Consiste en aplicar una fuerza de tracción controlada al dispositivo una vez que ha sido desplegado en la orejuela, con el objetivo de asegurar que esté firmemente anclado y no se desplace. Su uso está muy difundido en todo el mundo y hoy en día se realiza de manera habitual. Sin embargo, en 2020, un estudio indagó sobre su eficacia y determinó su utilidad mediante el implante de un dispositivo en la vaina principal de liberación que era capaz de medir la fuerza ejercida en Newtons35. El dispositivo elegido para el estudio fue el Amulet y se encontró que la fuerza ejercida por el operador en la liberación del dispositivo era mayor que en el propio tug test posterior, tanto para dispositivos mayores (2,96 ± 0,57 frente a 1,04 ± 0,24 N; p < 0,001) como menores de 25 mm (1,72 ± 0,43 frente a 1,01 ± 0,59 N; p = 0,049), por lo que se concluyó que el tug test era redundante. Cabe decir que en todos los implantes del estudio (un total de 23) se cumplieron los criterios CLOSE recomendados por la casa comercial.
CÓMO TRATAR LAS EMBOLIZACIONES
El abordaje y el tratamiento de las embolizaciones depende fundamentalmente de 3 factores: el tamaño del dispositivo embolizado, el sitio a donde ha migrado y el estado hemodinámico del paciente. En la revisión realizada por Eppinger et al.5, el sitio más frecuente de migración fue la aorta (37%), seguida del ventrículo izquierdo (VI) (33,3%), la AI (24,3%) y las arterias periféricas (4,6%). Además, los autores llegaron a la conclusión de que la embolización en el VI o en el aparato subvalvular mitral era la que presentaba mayor grado de complicaciones y más necesidad de cirugía (44,4%). En la revisión sistemática llevada a cabo por Aminian et al.34, el sitio predominante de embolización se repartió entre la aorta y el VI (30% cada uno), con una predilección del dispositivo WATCHMAN por la aorta (7 casos de 9) y del Amplatzer Cardiac Plug (Abbott, Estados Unidos; ya no comercializado en España) por el VI (6 casos de 9). En esta revisión, todos los dispositivos mayores de 25 mm se alojaron en la AI o en el VI. En el estudio LAAODE33, el sitio más frecuente de embolización siguió siendo la aorta (30%), seguido de la AI (24%) y del VI (20%).
Una vez producida la embolización, actualmente se dispone de 2 abordajes fundamentales:
– Abordaje percutáneo: puede ser por acceso transarterial o transeptal. Normalmente se suelen utilizar lazos únicos o múltiples, pero también se ha descrito el uso de pinzas de biopsia endomiocárdica36. La elección de uno u otro método depende fundamentalmente del tamaño, la localización y la anatomía del dispositivo. Alkhouli et al.36 publicaron una serie de recomendaciones: los lazos únicos son mejores para dispositivos grandes, la vaina debe ser 2-4 Fr más grande que el tamaño de la vaina requerido para implantar el dispositivo, y los dispositivos de nitinol (por ejemplo, Amplatzer) pueden doblarse y retraerse dentro de la vaina, mientras que los que no contienen nitinol (por ejemplo, WATCHMAN) suelen requerir una gran deformación para ser extraídos. En la tabla 4, la tabla 5 y la tabla 6 se muestra una lista de lazos, fórceps, biotomos y catéteres que pueden ser de utilidad para recapturar dispositivos de forma percutánea. Todo ello se ha extraído del catálogo European Device Guide37. La figura 4 muestra fotografías de dispositivos de lazo único y múltiple, a modo de ejemplo.
Tabla 4. Lazos que pueden ser de utilidad para recapturar un dispositivo embolizado
| Lazo | Fabricante | Introductor (Fr) | Longitud del lazo (cm) | Longitud del catéter (cm) | Diámetro útil del lazo (mm) | Características |
|---|---|---|---|---|---|---|
| GooseNeck MicroSnare | Medtronic | 2,3-3 | 175; 200 | 150 | 2; 4; 7 | Un solo lazo a 90° y coils de tungsteno dorado |
| GooseNeck Snare | Medtronic | 4; 6 | 120 | 102 | 5; 10; 15; 20; 25; 30; 35 | Similar a MicroSnare |
| EN Snare estándar | Merit Medical | 6; 7 | 120 | 100 | 6-10; 9-15; 12-20; 18-30; 27-45 | 3 lazos entrelazados |
| EN Snare Mini | Merit Medical | 3,2 | 175 | 150 | 2-4; 4-8 | Similar a EN Snare estándar |
| One Snare estándar | Merit Medical | 4; 6 | 120 | 100 | 5; 10; 15; 20; 25; 30; 35 | Lazo de captura con un solo ángulo de 90°, recubierto de tungsteno dorado |
| One Snare Micro | Merit Medical | 2,3-3 | 175; 200 | 150; 175 | 2; 4; 7 | Similar a One Snare estándar |
| Atrieve Snare | Argon Medical Devices, Inc. | 3,2; 6; 7 | 120; 175 | 100; 150 | 2-4; 4-8; 6-10; 9-15; 12-20; 18-30; 27-45 | 3 lazos superpuestos, no entrelazados |
| Bard Snare Kit | BD Interventional | 9; 11 | 120 | 63; 58 | 20 | Lazo de captura radiopaco de 90° |
| Sistema de recuperación vascular CloverSnare 4-Loop | Cook Medical | 6 | 90 | 85 | 32 | Lazo de nitinol de 4 asas con núcleo de tántalo |
| Multi-Snare | PFM Medical | 3; 4; 5; 6 | 125; 175 | 105; 150 | 2-3; 4-6; 5-8; 10-15; 15-20; 20-30; 30-40 | Sistema de recuperación de doble plano |
Tabla 5. Fórceps y biotomos que pueden ser de utilidad para recapturar dispositivos embolizados
| Fórceps/biotomo | Fabricante | Introductor (Fr) | Longitud (cm) | Características |
|---|---|---|---|---|
| Pinza de biopsia estándar | Cordis | 5,5; 7 | 50; 104 | Disponibles pinzas rectas y curvas |
| Pinza de biopsia endomiocárdica Procure | Abbott | 5,4-7 | 50; 105 | Disponibles pinzas rectas y curvas |
| Dispositivo de agarre Raptor* | US Endoscopy | 7 | 230 | Rotación de 360° |
| Sistema de recuperación Needle’s Eye | Cook Medical | 16 | 54; 94 | Alambre de acero inoxidable/nitinol, utilizado habitualmente para retirar electrodos cardiacos |
| Catéter Lasso ajustable | Biosense Webster | 7 | 115 | Catéter de mapeo usado en electrofisiología |
| Dispositivo de recuperación ŌNŌ | B. Braun Interventional Systems, Inc. | 7,5 | 100 | Cesta autoexpandible de nitinol de 35 mm |
| Pinza cardiológica de agarre con tres garras planas | H + H Maslanka | 5,4 | 120 | 3 garras retráctiles |
|
* El uso intravascular de este dispositivo se considera fuera de indicación. |
||||
Tabla 6. Catéteres y vainas de utilidad para recapturar dispositivos embolizados
| Catéter/vaina | Fabricante | Tamaño (Fr) | Longitud (cm) | Forma | Compatibilidad alambre guía (pulgadas) |
|---|---|---|---|---|---|
| Check-Flo extra grande | Cook Medical | 20-24 | 25; 40; 65 | Rígida | 0,038 |
| Vaina introductora Gore DrySeal Flex | Gore & Associates | 10; 12; 14; 15; 16; 18; 20; 22; 24; 26 | 33; 45; 65 | Flexible | 0,035 |
| Sistema de liberación Mitraclip | Abbott | 24 | 80 | Flexible | 0,035 |
| Keller-Timmermans | Cook Medical | 18-24 | 65; 85 | Disponible recta y curvada | 0,038 |
| Catéter guía bidireccional Destino con válvula hemostática | Oscor Inc. | 8,5; 10; 12 | 67; 71; 73; 75; 77 | Disponible recta y curvada | 0,038 |
– Abordaje quirúrgico: es un procedimiento más invasivo, alarga la estancia hospitalaria y tiene mayor mortalidad36. Habitualmente se lleva a cabo cuando existe una gran desestructuración del aparato valvular o es necesario reparar el ventrículo.

Figura 4. A: lazo tipo Amplatz de «cuello de ganso» como ejemplo de dispositivo de un único lazo. B: lazo tipo EN Snare en el que se observan sus 3 lazos entrelazados.
En el caso del tratamiento percutáneo, Fahmy et al.38, en su experiencia ex vivo, necesitaron vainas más grandes para recuperar dispositivos WATCHMAN que las usadas para recuperar dispositivos tipo Amplatzer Cardiac Plug, y es importante destacar que recomiendan un asa en «cuello de ganso» más grande (preferiblemente de 15-20 mm) para facilitar el enganche de las patas del WATCHMAN, así como una vaina más grande (idealmente de 18 Fr) para retraer el dispositivo con mayor facilidad. Otras opciones son enganchar el dispositivo por el centro o por los lados, pero se requiere una fuerza de tracción mucho mayor para recuperar el WATCHMAN dentro de la vaina. Es recomendable que 2 operadores participen en el intento de recuperación: uno para estabilizar la vaina mientras el otro tira con firmeza del dispositivo capturado hacia su interior38.
Como ya hemos visto, la embolización del dispositivo hacia el VI puede provocar inestabilidad hemodinámica y suele asociarse a una alta tasa de necesidad de recuperación quirúrgica. La recuperación percutánea en el VI es especialmente desafiante debido al riesgo no menospreciable de daño a las válvulas aórtica y mitral. Los alambres de estabilización, en especial si el dispositivo está desplegado, pueden engancharse en estructuras circundantes y causar lesiones tisulares. Abbadi et al.39 publicaron un caso de implante de dispositivo tipo Amulet que a las pocas horas embolizó al VI y quedó enredado en el aparato subvalvular mitral, lo que generó insuficiencia mitral grave. Para su recuperación, utilizaron un lazo tipo Amplatz de 35 mm montado sobre un catéter guía de 6 Fr e introducido a través de un sistema de catéter MitraClip (Abbott, Estados Unidos) de 24 Fr. El dispositivo se atrapó por la cintura central, se traccionó hasta la AI y posteriormente fue retirado dentro del catéter MitraClip. El paciente quedó estable y con insuficiencia mitral leve.
En la actualidad se investiga en materiales y sistemas específicos para facilitar la captura, la recolocación y la retirada de los dispositivos. Uno de ellos es O–NO– (B. Braun, Alemania), que consiste en una cesta autoexpandible de nitinol de 35 mm unida a un catéter de 12 Fr con una luz interna de 7,5 Fr. En una serie de 3 casos publicada en 2024 (2 con migración a la AI y 1 al tracto de salida del VI debajo de la válvula aórtica), el dispositivo O–NO– tuvo un éxito de recuperación del 100%, sin complicaciones40.
En la figura 5 y la figura 6 se muestran algunos ejemplos de embolización de dispositivos de cierre de la orejuela izquierda.
Figura 5. Ecocardiograma transesofágico (ETE) intraprocedimiento y fluoroscopia de cierre de la orejuela izquierda con un dispositivo Amulet de 25 mm. A: el dispositivo migró al ventrículo izquierdo (VI). B: se introdujo por un acceso femoral izquierdo un catéter guía JR4 de 8 Fr con un lazo de 20 mm que agarró el dispositivo por el tornillo del lóbulo distal y permitió traccionarlo a la aorta descendente. C: a continuación se canalizó la arteria femoral derecha con un introductor de 16 Fr, y con un catéter guía y un lazo de 30 mm se volvió a agarrar el dispositivo por el tornillo del lóbulo distal, que fue traccionado y finalmente extraído.
Figura 6. Ecocardiograma transtorácico (ETT) realizado 24 horas tras el implante de un dispositivo tipo LAmbre de 38 mm. A: se visualiza la migración al ventrículo izquierdo (VI), atrapado por el aparato subvalvular mitral. B: ampliación de la imagen.
ALGORITMOS DE TRATAMIENTO
Se han publicado diversos algoritmos cuyo objetivo es aportar algo de luz y guiar al operador en la toma de decisiones. En todos ellos se considera que, si el paciente se encuentra hemodinámicamente estable y no hay un daño vascular o valvular importante, la técnica percutánea es de elección como primer intento (76,4%, en contraposición al 21,7% de los pacientes que requirieron cirugía cardiaca abierta de entrada en la serie de Eppinger et al.5, de los cuales el 60% presentaban embolización al VI), siempre considerando que la embolización a una cámara cardiaca es de mayor riesgo que a un vaso grande o periférico36. Si el primer intento tiene éxito, es aceptable tanto intentar volver a recolocar el dispositivo en su sitio correcto como retirarlo del cuerpo del paciente y programar un nuevo implante.
En caso de que el primer intento percutáneo no tenga éxito, algo que suele ocurrir en aproximadamente una tercera parte de los pacientes, se puede volver a realizar otro intento percutáneo o directamente pasar a cirugía cardiaca abierta, teniendo en cuenta que el fallo de un primer intento ya incrementa la mortalidad de un 2,9% a un 21,4%5.
Si en el segundo intento tampoco se consigue capturar el dispositivo y el paciente no es candidato a cirugía, Alkhouli et al.36 plantean una serie de opciones, como pueden ser probar a desimpactar el dispositivo y recolocarlo en una zona anatómicamente menos comprometida, inflar un balón distal al mismo para traccionar y facilitar su movilización hacia una posición más segura, e incluso utilizar 2 lazos simultáneamente.
Por último, en los pacientes de riesgo quirúrgico prohibitivo, asintomáticos, y siempre y cuando el dispositivo se aloje en la aorta descendente, una opción es el tratamiento conservador con vigilancia periódica, aunque no está claro cada cuánto tiempo se debe hacer el seguimiento ni qué tratamiento antitrombótico o anticoagulante es el ideal.
En la figura 7 se propone un algoritmo de abordaje y tratamiento según la última evidencia disponible, en el que se sintetiza la información expuesta previamente.
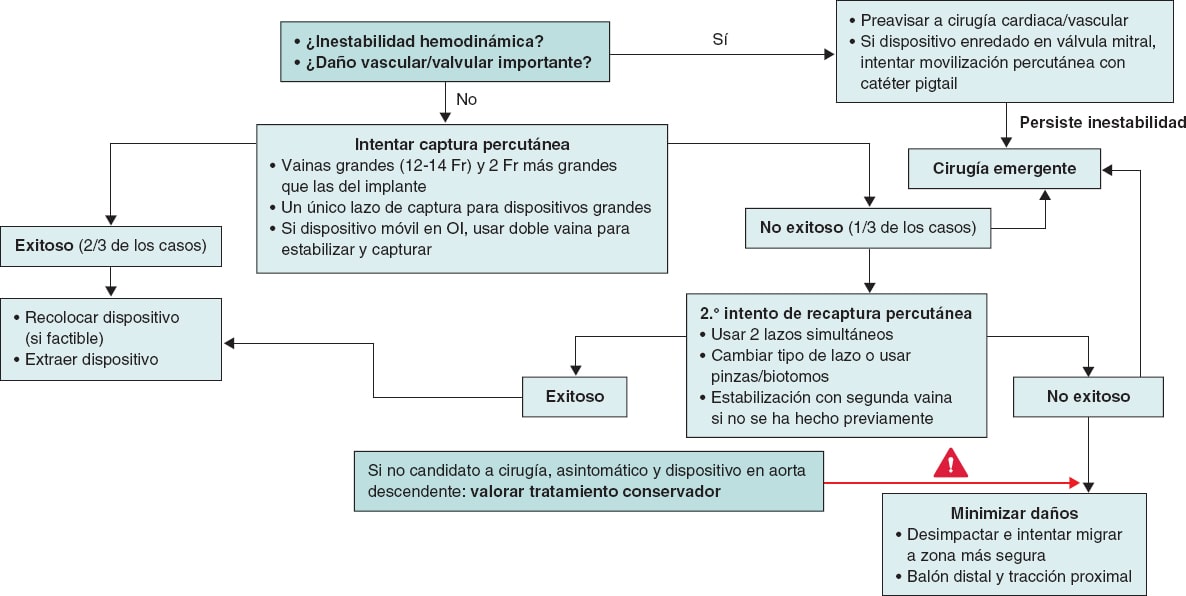
Figura 7. Propuesta de algoritmo de tratamiento para la embolización de un dispositivo de cierre de la orejuela izquierda (OI).
CONCLUSIONES
La embolización del dispositivo de cierre de la orejuela izquierda es una complicación infrecuente, pero potencialmente mortal, de un procedimiento que ha demostrado ser seguro y eficaz para la prevención de ictus en pacientes con fibrilación auricular no valvular y contraindicación para la anticoagulación. Aunque el diseño de los dispositivos ha evolucionado durante los últimos años, la correcta selección del paciente, la planificación preoperatoria detallada y una ejecución meticulosa del procedimiento siguen siendo pilares fundamentales para minimizar los riesgos. Esta revisión resalta la complejidad multifactorial y la gran cantidad de aspectos que intervienen en su aparición. Ante una embolización, la recuperación percutánea debe ser el enfoque inicial siempre que sea viable, y reservar la cirugía para casos seleccionados de desestructuración de la anatomía valvular, inestabilidad hemodinámica o tras un primer intento percutáneo fallido. El desarrollo de nuevas herramientas específicas para la recuperación y la estandarización de los algoritmos de tratamiento contribuirán a optimizar los resultados clínicos en estos escenarios. Futuras investigaciones deberán centrarse en identificar predictores anatómicos y técnicos más precisos, así como en validar estrategias preventivas que se puedan aplicar de manera universal.
FINANCIACIÓN
Este estudio no ha recibido ninguna subvención del sector público ni privado, así como tampoco de ninguna organización sin ánimo de lucro.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial en la preparación de esta revisión.
CONTRIBUCIÓN DE LOS AUTORES
M.Á. Martín-Arena y G. Galeote-García realizaron la búsqueda bibliográfica, recopilaron la información y redactaron las versiones inicial y final del artículo. A. Lara-García, A. Jurado-Román, S. Jiménez-Valero, A. Gonzálvez-García, D. Tébar-Márquez, B. Rivero-Santana, J. Zubiaur, M. Basile, S. Valbuena-López, L. Fernández-Gassó, R.D. González-Gallarza y R. Moreno aportaron imágenes, figuras y datos, realizaron una revisión crítica del texto y contribuyeron a su redacción final. Todos los autores aprobaron la versión final del artículo.
CONFLICTO DE INTERESES
R. Moreno es editor asociado de REC: Interventional Cardiology, y se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito; también ha recibido honorarios como conferenciante y consultor de Abbott, Medtronic y Boston Scientific. A. Gonzálvez ha recibido honorarios como conferenciante de Abbott. G. Galeote ha recibido honorarios como conferenciante de Abbott, Boston Scientific y M.A. Jurado es proctor de Abbott y Boston Scientific, y ha recibido honorarios como conferenciante de Abbott y Boston Scientific. M. Basile ha recibido ayudas para asistencia a congresos por parte de Abbott.
BIBLIOGRAFÍA
1. Gómez-Doblas JJ, Muñiz J, Martin JJA, et al. Prevalence of Atrial Fibrillation in Spain. OFRECE Study Results. Rev Esp Cardiol. 2014;67:259-269.
2. Wolf PA, Abbott RD, Kannel WB. Atrial Fibrillation: A Major Contributor to Stroke in the Elderly: The Framingham Study. Arch Intern Med. 1987; 147:1561-1564.
3. Kannel WB, Wolf PA, Benjamin EJ, Levy D. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates 1. Am J Cardiol. 1998;82(7, Suppl 1):2N-9N.
4. Osmancik P, Herman D, Neuzil P, et al. 4-Year Outcomes After Left Atrial Appendage Closure Versus Nonwarfarin Oral Anticoagulation for Atrial Fibrillation. J Am Coll Cardiol. 2022;79:1-14.
5. Eppinger S, Piayda K, Rodes-Cabau J, et al. Embolization of percutaneous left atrial appendage closure devices: timing, management and associated clinical outcomes. Eur Heart J. 2023;44(Suppl 2):ehad655.2276.
6. Najim M, Reda Mostafa M, Eid MM, et al. Efficacy and safety of the new generation WATCHMAN FLX device compared to the WATCHMAN 2.5: a systematic review and meta-analysis. Am J Cardiovasc Dis. 2023;13:291-299.
7. Kar S, Doshi SK, Sadhu A, et al. Primary Outcome Evaluation of a Next-Generation Left Atrial Appendage Closure Device. Circulation. 2021;143:1754-1762.
8. Nielsen-Kudsk JE, Kramer A, Andersen A, Kim WY, Korsholm K. First-in-human left atrial appendage closure using the WATCHMAN FLX Pro device: a case report. Eur Heart J Case Rep. 2024;8:ytae135.
9. Bavishi C. Transcatheter Left Atrial Appendage Closure: Devices Available, Pitfalls, Advantages, and Future Directions. US Cardiol Rev. 2023;17:e05.
10. Lakkireddy D, Thaler D, Ellis CR, et al. Amplatzer Amulet Left Atrial Appendage Occluder Versus WATCHMAN Device for Stroke Prophylaxis (Amulet IDE): A Randomized, Controlled Trial. Circulation. 2021;144:1543-1552.
11. Lakkireddy D, Ellis CR, Thaler D, et al. 5-Year Results From the AMPLATZER Amulet Left Atrial Appendage Occluder Randomized Controlled Trial. J Am Coll Cardiol. 2025;85:1141-1153.
12. Kleinecke C, Cheikh-Ibrahim M, Schnupp S, et al. Long-term clinical outcomes of Amplatzer cardiac plug versus Amulet occluders for left atrial appendage closure. Catheter Cardiovasc Interv. 2020;96:E324-E331.
13. Bangash AB, Li Y, Huang W, et al. Left atrial appendage occlusion using the LAmbre device in atrial fibrillation patients with a history of ischemic stroke: 1-Year outcomes from a multicenter study in China. Pacing Clin Electrophysiol. 2023;46:1478-1483.
14. Galea R, De Marco F, Meneveau N, et al. Amulet or WATCHMAN Device for Percutaneous Left Atrial Appendage Closure: Primary Results of the SWISS-APERO Randomized Clinical Trial. Circulation. 2022;145:724-738.
15. Ali M, Rigopoulos AG, Mammadov M, et al. Systematic review on left atrial appendage closure with the LAmbre device in patients with non-valvular atrial fibrillation. BMC Cardiovasc Disord. 2020;20:78.
16. Vij V, Ruf TF, Thambo JB, et al. Contrast-free left atrial appendage occlusion in patients using the LAMBRETM device. Int J Cardiol. 2024;405: 131939.
17. Llagostera-Martín M, Cubero-Gallego H, Mas-Stachurska A, et al. Left Atrial Appendage Closure with a New Occluder Device: Efficacy, Safety and Mid-Term Performance. J Clin Med. 2021;10:1421.
18. Cruz-González I, Freixa X, Fernández-Díaz JA, Moreno-Samos JC, Martín-Yuste V, Goicolea J. Left Atrial Appendage Occlusion With the LAmbre Device: Initial Experience. Rev Esp Cardiol. 2018;71:755-756.
19. Chamié F, Guerios E, Silva DP, Fuks V, Torres R. Oclusão do Apêndice Atrial Esquerdo com a Prótese Lambre: Experiência Multicêntrica Inicial no Brasil. Arq Bras Cardiol. 2022;119:48-56.
20. Holmes DR, Korsholm K, Rodés-Cabau J, Saw J, Berti S, Alkhouli MA. Left atrial appendage occlusion. EuroIntervention. 2023;18:e1038-e1065.
21. Garg J, Kabra R, Gopinathannair R, et al. State of the Art in Left Atrial Appendage Occlusion. JACC Clin Electrophysiol. 2025;11:602-641.
22. Bhagat A, Gier C, Kim P, Diggs P, Gursoy E. Delayed embolization of next-generation left atrial appendage closure device in an asymptomatic patient. Hear Case Rep. 2023;9:598-601.
23. Friedman DJ, Freeman JV, Zimmerman S, et al. WATCHMAN device migration and embolization: A report from the NCDR LAAO Registry. J Cardiovasc Electrophysiol. 2023;34:1192-1195.
24. Korsholm K, Kramer A, Andersen A, et al. Left atrial appendage sealing performance of the Amplatzer Amulet and WATCHMAN FLX device. J Interv Card Electrophysiol. 2023;66:391-401.
25. Rocca DGD, Magnocavallo M, Gianni C, et al. Procedural and short-term follow-up outcomes of Amplatzer Amulet occluder versus WATCHMAN FLX device: A meta-analysis. Heart Rhythm. 2022;19:1017-1018.
26. Kapadia SR, Yeh RW, Price MJ, et al. Outcomes With the WATCHMAN FLX in Everyday Clinical Practice From the NCDR Left Atrial Appendage Occlusion Registry. Circ Cardiovasc Interv. 2024;17:e013750.
27. Li S, Zhang J, Zhang J, et al. GW29-e1803 LAmbre Occluder in Patients with Atrial Fibrillation: a Prospective single-center registry. J Am Coll Cardiol. 2018;72(16, Suppl):C150.
28. Park JW, Sievert H, Kleinecke C, et al. Left atrial appendage occlusion with lambre in atrial fibrillation: Initial European experience. Int J Cardiol. 2018;265:97-102.
29. Huang H, Liu Y, Xu Y, et al. Percutaneous Left Atrial Appendage Closure With the LAmbre Device for Stroke Prevention in Atrial Fibrillation: A Prospective, Multicenter Clinical Study. JACC Cardiovasc Interv. 2017;10:2188-2194.
30. Wang B, Wang Z, He B, et al. Percutaneous Left Atrial Appendage Closure Confirmed by Intra-Procedural Transesophageal Echocardiography under Local Anesthesia: Safety and Clinical Efficacy. Acta Cardiol Sin. 2021;37: 146-154.
31. Chen YH, Wang LG, Zhou XD, et al. Outcome and safety of intracardiac echocardiography guided left atrial appendage closure within zero-fluoroscopy atrial fibrillation ablation procedures. J Cardiovasc Electrophysiol. 2022; 33:667-676.
32. Saw J, Holmes DR, Cavalcante JL, et al. SCAI/HRS expert consensus statement on transcatheter left atrial appendage closure. Heart Rhythm. 2023;20:e1-e16.
33. Murtaza G, Turagam MK, Dar T, et al. Left Atrial Appendage Occlusion Device Embolization (The LAAODE Study): Understanding the Timing and Clinical Consequences from a Worldwide Experience. J Atr Fibrillation. 2021;13:2516.
34. Aminian A, Lalmand J, Tzikas A, Budts W, Benit E, Kefer J. Embolization of left atrial appendage closure devices: A systematic review of cases reported with the WATCHMAN device and the amplatzer cardiac plug. Catheter Cardiovasc Interv. 2015;86:128-135.
35. Salmon MK, Hammer KE, Nygaard JV, Korsholm K, Johansen P, Nielsen-Kudsk JE. Left atrial appendage occlusion with the Amulet device: to tug or not to tug? J Interv Card Electrophysiol. 2021;61:199-206.
36. Alkhouli M, Sievert H, Rihal CS. Device Embolization in Structural Heart Interventions: Incidence, Outcomes, and Retrieval Techniques. JACC Cardiovasc Interv. 2019;12:113-126.
37. European Device Guide. Cardiac Interventions Today. Disponible en: https://citoday.com/device-guide/european. Consultado 2 Jul 2025.
38. Fahmy P, Eng L, Saw J. Retrieval of embolized left atrial appendage devices. Catheter Cardiovasc Interv. 2018;91:E75-E80.
39. Abbadi AB, Akodad M, Horvilleur J, Neylon A. Retrieval of a left appendage device from the left ventricle using a large bore steerable catheter. Catheter Cardiovasc Interv. 2024;104:365-367.
40. Hermann D, Khan Z, Khan Z, Abreu J, Loyalka P, Qureshi AM. First-in-Human Percutaneous Removal of Left Atrial Appendage Occlusion Devices With a Novel Retrieval System. JACC Clin Electrophysiol. 2024;10:1004-1009.
* Autor para correspondencia.
Correo electrónico: (M.Á. Martín-Arena).
@martinarenaMA;
@hemodin90;
@Azlaragarcia;
@JuradoRomanAl;
@Dr_DanielTebar;
@BorjaRiversa;
@JonZubiaur;
@MattiaBasile97;
@cayevalbuena;
@LuciaFGasso;
@reginadalmau;
@RaulmorenoMD
RESUMEN
Tras la actualización de la regulación europea sobre dispositivos médicos de 2017 y su posterior entrada en vigor en 2021, persisten multitud de dudas en cuanto a su implementación práctica en la investigación en productos sanitarios (PS) en España. Desarrollar PS implica la colaboración de multitud de actores, incluyendo investigadores, comités de ética, organismos notificados, Agencia Española de Medicamentos y Productos Sanitarios, industria de dispositivos y diversos colaboradores, que se han visto obligados a adaptarse a esta nueva regulación. Este hecho ha requerido un esfuerzo y un consumo de recursos significativo para comprender y aplicar las distintas directrices que persiguen unificar los protocolos en PS y asegurar la seguridad y la eficacia de estos productos. Desde su implementación, la colaboración entre las distintas partes ha permitido progresar y entender las nuevas dificultades que representa esta normativa. El objetivo de este documento es definir de manera práctica el contenido de dicha regulación y exponer las perspectivas de los diferentes actores implicados en el desarrollo de PS.
Palabras clave: Producto sanitario. Investigación sanitaria. Regulación en investigación.
ABSTRACT
Despite the 2017 update to European medical device regulation and its entry into force in 2021, many doubts persist about its real-world application in medical device (MD) research in Spain. The development of MDs requires collaboration among numerous stakeholders, including researchers, ethics committees, notified bodies, the Spanish Agency of Medicines and Medical Devices, manufacturers, and other involved parties—all of whom have had to adapt to the new regulatory framework. This has required a significant effort and consumption of resources to understand and apply the different clinical practice guidelines to unify protocols in MD research and ensure the safety and efficacy profile of these products. Although challenges remain, the adoption of this legislation has fostered collaboration among stakeholders, enabling progress and a better understanding of the new obstacles it presents. The aim of this review is to define, in a practical way, the content of this regulation and expose the perspectives of the different actors involved in the development of MD.
Keywords: Medical device. Health research. Research regulation.
Abreviaturas
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios. CE: Certificación Europea. CEIm: comité de ética de la investigación con medicamentos. EU-MDR: Reglamento Europeo de Productos Sanitarios. MDR: Reglamento de Productos Sanitarios. ON: organismo notificado. PS: producto sanitario.
INTRODUCCIÓN
Desde la actualización del Reglamento Europeo de Productos Sanitarios (PS) en 2017 con el Reglamento (EU) 2017/745 de Productos Sanitarios (EU-MDR)1 y el reglamento (EU) 2017/746 de productos in vitro (EU-IVDR)2, así como con la publicación en España del Real Decreto 192/2023 de 21 de marzo3, ha surgido la necesidad de adaptarse a las nuevas normativas impulsadas desde Europa. El objetivo que persiguen estas regulaciones es establecer un nuevo marco normativo sólido, transparente, previsible y sostenible para los PS, que garantice los más altos niveles de seguridad y de protección de la salud de pacientes y usuarios, y que asimismo impulse la innovación y los intereses de las pequeñas y medianas empresas (PYME) que desarrollan sus actividades en este sector, obteniendo de esta manera el marcado de Certificación Europea (CE). Este reglamento armoniza las normas aplicables a la introducción en el mercado y la puesta en servicio en la Unión Europea de PS y sus accesorios, permitiendo así que estos se acojan al principio de libre circulación de mercancías y garantizando, además, un nivel de protección elevado, de modo que los productos en circulación no presenten riesgos para la salud de los pacientes, usuarios o terceras personas, y alcancen las prestaciones asignadas por el fabricante, cuando se utilicen en las condiciones previstas3.
La complejidad de esta nueva normativa ha llevado a que desde el punto de vista académico se hayan publicado documentos previos, en los ámbitos tanto europeo como nacionales, para ayudar a comprender las nuevas regulaciones4,5. No obstante, estos cambios regulatorios generan, de manera invariable, tensiones entre los distintos actores implicados en el desarrollo de PS. Entre ellos se encuentran los organismos reguladores, como son la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), los comités éticos de la investigación con medicamentos (CEIm) y los organismos notificados (ON); la industria, compuesta por distintas grandes empresas, PYME y empresas emergentes (start-up); los colaboradores, como pueden ser empresas encargadas del registro y el análisis de datos sanitarios, o distintos tipos de asesorías; los investigadores y, finalmente, los propios pacientes y sus asociaciones. Dado que todos estos actores persiguen un mismo objetivo común, la colaboración entre cada una de las partes en la comprensión de esta regulación, aportando su perspectiva única y las dificultades que individualmente presentan, puede llevar a mejorar el desarrollo de PS y facilitar un proceso que cada vez es más complejo (figura 1).
Figura 1. Figura central. Partes interesadas en el desarrollo de productos sanitarios, y retos y amenazas a los que se enfrentan. Los iconos han sido realizados por Freepik, Smalllikeart, Rizal2109, e Iconpro en www.flaticon.com. Imagen obtenida de Servier Medical Art, bajo licencia CC BY 4.0 (https://smart.servier.com).
El objetivo de este documento es resumir el contenido de la EU-MDR para facilitar su comprensión y exponer la perspectiva de cada una de las partes implicadas en el proceso de desarrollo de PS. En enero de 2025, con el objetivo mencionado, se organizó una reunión presencial impulsada por la Fundación Epic en la que se expusieron estas perspectivas con distintas presentaciones. A continuación, se resume el contenido de las presentaciones, las cuestiones y los debates que tuvieron lugar en la reunión.
Definiciones y nomenclatura en productos sanitarios
A pesar de que en el ámbito médico la utilización de PS es ubicua, el personal sanitario raras veces está familiarizado con la nomenclatura y las definiciones que se aplican a estos. En la tabla 1 se resumen de manera breve los principales términos que se utilizarán en este documento. El EU-MDR define claramente la terminología a utilizar en su artículo 21, pero resulta conveniente extenderse en algunas definiciones para comprender totalmente los matices del desarrollo de PS. La clasificación de riesgo de los PS tiene en consideración el propósito de uso del dispositivo y sus riesgos inherentes (EU-MDR, anexo VIII1, y guía de la Comisión Europea6). Los dispositivos pueden clasificarse como de bajo riesgo (clase I), medio riesgo (clase IIa) y alto riesgo (clase IIb y clase III), y en el caso de los productos sanitarios para diagnóstico in vitro en las clases A, B, C y D, siendo la clase A la de menor riesgo y la clase D la de mayor riesgo. Los dispositivos de clase I que se consideran más simples pueden ser autocertificados por el fabricante, pero otros dispositivos de clase I (que sean estériles o que tengan función de medición) y los de las clases IIa, IIb y III deben superar una valoración de conformidad que implica la participación de un ON. Los dispositivos implantables y los que estén en contacto directo con el sistema circulatorio se definen todos como de alto riesgo (clase III); de estos, el 40% son de aplicación cardiovascular7. En la figura 2 se presentan algunos ejemplos de las distintas clases de dispositivos. Se definen como:
Tabla 1. Definiciones de los principales términos utilizados en el documento
| Término | Definición |
|---|---|
| Producto sanitario | Todo instrumento, dispositivo, equipo, programa informático, implante, reactivo, material u otro artículo destinado por el fabricante a ser utilizado en personas, por separado o en combinación, con alguna de las siguientes finalidades médicas específicas:
– Diagnóstico, prevención, seguimiento, predicción, pronóstico, tratamiento o alivio de una enfermedad. – Diagnóstico, seguimiento, tratamiento, alivio o compensación de una lesión o de una discapacidad. – Investigación, sustitución o modificación de la anatomía de un proceso o estado fisiológico o patológico. – Obtención de información mediante el examen in vitro de muestras procedentes del cuerpo humano, incluyendo donaciones de órganos, sangre y tejidos. |
| Además, no ejerce su acción principal prevista en el interior o en la superficie del cuerpo humano por mecanismos farmacológicos, inmunológicos ni metabólicos, pero a su función puedan contribuir tales mecanismos.
Los siguientes también se considerarán productos sanitarios: – Productos de control o apoyo de la concepción. – Productos destinados específicamente a la limpieza, desinfección o esterilización de los productos que se contemplan en el artículo 1, apartado 4, y en el párrafo primero del presente punto. (MDR, artículo 2.1) |
|
| Producto de diagnóstico in vitro | Cualquier producto sanitario que consista en un reactivo, producto reactivo, calibrador, material de control, kit, instrumento, aparato, pieza de equipo, programa informático o sistema, utilizado solo o en combinación, destinado por el fabricante a ser utilizado in vitro para el estudio de muestras procedentes del cuerpo humano, incluidas las donaciones de sangre y tejidos, única o principalmente con el fin de proporcionar información acerca de uno o varios de los elementos siguientes:
1. Relativa a un proceso o estado fisiológico o patológico. 2. Relativa a deficiencias físicas o mentales congénitas. 3. Relativa a la predisposición a una dolencia o enfermedad. 4. Para determinarla seguridad y compatibilidad con posibles receptores. 5. Para predecir la respuesta o reacción a un tratamiento. 6. Para establecer o supervisar medidas terapéuticas. Los recipientes para muestras se consideran también productos sanitarios para diagnóstico in vitro. |
| Producto sanitario legacy | Cualquier producto sanitario que cumplía con la normativa previa al EU-MDR, pero que aún no está certificado por la normativa actual. |
| Regulation (EU) 2017/745 en MDR | Reglamento europeo de productos sanitarios. |
| Regulation (EU) 2017/746 en IVDR | Reglamento europeo de productos in vitro. |
| Marcado CE | Marcado por el que un fabricante indica que un producto es conforme con los requisitos aplicables establecidos en el presente reglamento y en otra legislación de armonización de la Unión aplicable que prevea su colocación (MDR, artículo 2.43). |
|
CE: Certificación Europea; EU: Unión Europea; IVDR: regulación de dispositivos in vitro; MDR: reglamento de productos sanitarios. |
|

Figura 2. Clasificación de los distintos productos sanitarios y ejemplos de ellos. Los iconos han sido realizados por Kiranshastry, Vectorslab, Iconsmeet, Freepik y N.style en www.flaticon.com.
- – Clase I: productos de bajo riesgo para el paciente, generalmente no invasivos. Ejemplos: estetoscopio, electrodos de electrocardiograma, instrumental quirúrgico reutilizable y esfigmomanómetro no automatizado. Las clases específicas son Is (estéril), Im (función de medición) e Ir (reutilizable).
- – Clase IIa: productos de riesgo moderado que se utilizan de manera invasiva, pero temporalmente. Ejemplos: aguja hipodérmica, estetoscopio electrónico, equipos electrónicos de medición de la presión arterial, electrocardiógrafo, máquina de ultrasonido de diagnóstico (como ecocardiografía) y sistema de resonancia magnética.
- – Clase IIb: productos de mayor riesgo que pueden tener contacto prolongado con el cuerpo o que controlan funciones vitales. Ejemplos: bombas de infusión, dispositivos de monitorización y alarma en cuidados intensivos, ventiladores, desfibriladores externos y dispositivos de diagnóstico que emiten radiación ionizante.
- – Clase III: productos de alto riesgo, en general implantables y que tienen un impacto significativo en la salud del paciente. Ejemplos: catéteres y guías cardiovasculares, stents metálicos y liberadores de fármacos, válvulas cardiacas protésicas y dispositivos de reparación de válvulas, dispositivos implantables para otras intervenciones estructurales cardiovasculares, electrodos de electrofisiología y catéteres y equipos de ablación, dispositivos electrónicos implantables cardiovasculares incluidos marcapasos, desfibriladores automáticos implantables y terapia de resincronización cardiaca, sistemas de circulación extracorpórea, oxigenador extracorpóreo de membrana, bomba de balón intraaórtico y dispositivos de asistencia ventricular izquierda.
PERSPECTIVA DE LAS AGENCIAS REGULADORAS, LOS ORGANISMOS NOTIFICADOS Y LOS COMITÉS ÉTICOS
Para la obtención del marcado CE, un PS debe cumplir una serie de requisitos impuestos por los distintos organismos reguladores. Tales requisitos dependen de la finalidad para la que se presenta y la clasificación de riesgo de cada tipo de PS. Por otra parte, en cuanto a la realización de investigaciones clínicas con PS cubiertas por el reglamento 2017/745, en la tabla 2 se indican ciertos requisitos fundamentales. A continuación, se comentan las particularidades de todos los organismos implicados.
Tabla 2. Requisitos para la realización de investigaciones clínicas con productos sanitarios
| Investigaciones con productos sanitarios | CEIm | AEMPS | Conformidad de dirección | Seguro | Artículo |
|---|---|---|---|---|---|
| Sin CE | Sí | Autorización | Sí | Sí | Artículo 62 (objetivo: evaluar conformidad CE) |
| Con CE, distinta finalidad | Sí | Autorización | Sí | Sí | Artículo 74, Apartado 2 |
| Con CE, misma finalidad y siguiendo las instrucciones de uso | |||||
| Con procedimientos adicionales invasivos o gravosos | Sí | Notificar | Sí | No | Artículo 74, Apartado 1 |
| Artículo 73 (notificar NEOPS/EUDAMED) | |||||
| Sin procedimientos adicionales invasivos ni gravosos | Sí | No | Sí | No | |
|
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; CE: Certificación Europea; CEIm: comité de ética en investigación médica. |
|||||
Comité de ética de la investigación con medicamentos
Obtener la aprobación por el CEIm es el primer paso que toda investigación debe superar para su realización. Debe distinguirse entre el comité de ética de la investigación, que regula proyectos de investigación biomédica en la Ley 14/2007, y el CEIm8, que además está acreditado para emitir un dictamen en estudios clínicos con medicamentos y PS, regulado por el Real Decreto 1090/20159. No se han publicado aún los criterios que un CEIm debe cumplir para la evaluación de investigaciones clínicas con PS. Los estudios de funcionamiento de PS para diagnóstico in vitro no requerirán evaluación por un CEIm; en algunos casos, puede ser por un comité de ética de la investigación según el EU-IVDR10. La función de todo CEIm es salvaguardar los derechos, la seguridad y el bienestar de los sujetos participantes. Para este fin, en su composición debe contar con profesionales sanitarios, vocales ajenos a las profesiones sanitarias (incluyendo graduados en derecho), representantes de pacientes y un experto en el Reglamento General de Protección de Datos; adicionalmente, puede solicitar el asesoramiento de expertos cuando no reúna los conocimientos o la experiencia necesarios para evaluar un estudio (como puede ser en la investigación de procedimientos quirúrgicos, técnicas diagnósticas o terapias avanzadas). Consultar a expertos en materia de PS es muy frecuente, dadas su variedad y diferente finalidad y naturaleza que, en ocasiones, hacen difícil elucidar si un dispositivo se trata de un PS (por ejemplo, en el caso de aplicaciones informáticas). La evaluación del CEIm requerirá:
- Evidencia clínica previa de que el PS ejercerá su función y tendrá garantías de seguridad.
- Metodología adecuada para dar respuesta a los objetivos, definiendo claramente en el protocolo la justificación, la población a estudio, el tamaño muestral, las variables a incluir, el proceso de reclutamiento y aleatorización, etc.
- Desde el punto de vista ético, debe garantizar el cumplimiento de los principios éticos, especialmente en relación con la obtención del consentimiento informado, y cumplir los principios de la Declaración de Helsinki11 y la norma internacional ISO 14155:2021 («Investigación clínica de productos sanitarios para humanos. Buenas prácticas clínicas»)12.
Según el Real Decreto 192/2023, para la investigación en PS se exigirá la conformidad de la dirección del centro o de los centros donde vaya a realizarse, así como un dictamen favorable del CEIm local o, en caso de tratarse de un estudio multicéntrico, un dictamen emitido por un CEIm del territorio nacional único y vinculante3. En cualquier caso, debe considerarse que cada centro tiene que gestionar aspectos administrativos internos para permitir la realización del estudio. El plazo para que cada CEIm emita su dictamen no se especifica en el Real Decreto 192/2023, por lo que depende en gran medida de las características de cada comité.
Considerando la evidente complejidad de la nueva regulación, representantes de distintos CEIm en la Asociación Nacional de Comités de Ética de la Investigación (ANCEI), junto con la AEMPS, acordaron en 2023 formar un grupo de trabajo para armonizar la evaluación de las investigaciones en PS. Se espera que de esta colaboración surja en los próximos meses un memorando en conjunto de instrucciones para facilitar el proceso de certificación y armonizar la documentación requerida por ambas entidades; por ejemplo, el memorando definirá los plazos de los que se dispondrá para emitir un dictamen.
Agencia Española de Medicamentos y Productos Sanitarios
En España, la AEMPS es la autoridad competente encargada de la aplicación y la supervisión del reglamento EU 2017/745. La AEMPS ha elaborado una serie de documentos y manuales con el objetivo de aclarar el proceso, los requisitos y la documentación que es necesario presentar para su evaluación de estudios con PS13. En la tabla 2 se presenta un resumen de los requerimientos para la realización de investigaciones clínicas con PS.
La AEMPS sigue trabajando en revisar nuevos documentos. Quedan pendientes los relativos a PS para diagnóstico in vitro y el documento conjunto de los CEIm con la AEMPS ya mencionado. Además, desde el Medical Device Coordination Group, que es el grupo europeo implicado en la regulación de los PS, también se publican guías cuyo cumplimiento es de carácter voluntario, pero que reflejan la actualidad y el consenso en estos temas desde el punto de vista europeo14. Respecto a los estudios del funcionamiento de PS para diagnóstico in vitro, sus requerimientos, en muchos casos, no precisarán autorización ni notificación por la AEMPS, y además podrían ser evaluados por un comité de ética de la investigación. Sin embargo, aquellos estudios de funcionamiento de PS para diagnóstico in vitro que pudieran ser gravosos para la salud o presentar un riesgo para los pacientes se regulan por el artículo 58 de su propia regulación (EU-IVDR 2017/74610), y sus requerimientos son similares a los mostrados en la tabla 2. Entre los procedimientos de riesgo se incluyen la toma de muestra quirúrgicamente invasiva únicamente a efectos del estudio, los procedimientos invasivos adicionales y otros riesgos para los sujetos participantes (como procedimientos intervencionistas o pruebas diagnósticas que puedan influir en las decisiones clínicas).
Existen también estudios combinados que implican a la vez medicamentos y PS, a los que se aplicarán ambas regulaciones. Un caso que conviene clarificar es el de los productos integrados. Los estudios con estos productos no serían estudios combinados, ya que no implican medicamentos y PS. Un producto integrado es un PS o un medicamento, y se le aplicaría solo la legislación correspondiente. El criterio que debe seguirse es fundamentalmente su mecanismo de acción principal: si es el de un medicamento o el de un PS. Un ejemplo de producto integrado que es un PS sería un stent farmacoactivo, cuyo mecanismo de acción principal es el efecto mecánico para dilatar la arteria coronaria y en el que la pequeña cantidad de sustancia medicinal que incorpora tendría una acción antiproliferativa accesoria. Por otra parte, una jeringa precargada de insulina también se trataría de un producto integrado, pero en este caso el mecanismo de acción principal es el del medicamento (insulina). La «parte del producto» que sería PS por separado actuaría únicamente como sistema de administración del medicamento.
El procedimiento de autorización de investigaciones clínicas con PS por la AEMPS, así como otra información relativa a la regulación de PS, se encuentran recogidos en las instrucciones publicadas en su página web, que en la actualidad están siendo revisadas13. El procedimiento es, de forma muy resumida: 15 días de plazo para la validación de la documentación, 20 días para que el promotor responda a los posibles requerimientos de la AEMPS y 10 días para la evaluación de las respuestas por la AEMPS. Una vez admitida a trámite la solicitud, comienza el periodo de evaluación de la investigación clínica, que será de 45 días, aunque la AEMPS puede disponer de 20 días naturales más con el fin de consultar a expertos. La AEMPS podrá presentar objeciones al promotor, así como requerir información complementaria, quedando en este caso suspendidos los plazos y disponiendo el promotor de 10 días hábiles (ampliables a 5 más) para responder. Es importante mencionar que la AEMPS requerirá la aprobación del CEIm, por lo que se recomienda enviar la documentación con el dictamen del CEIm ya emitido o en proceso avanzado; de no ser así, la AEMPS denegará automáticamente la investigación cuando se cumpla el plazo. Una vez finalizada la investigación clínica, en 15 días naturales el promotor lo notificará a la AEMPS. Si se realiza una paralización temporal o una finalización anticipada, el promotor deberá notificarlo en 15 días naturales y proporcionará una justificación; si se debe a motivos de seguridad, deberá informar a la AEMPS en un plazo de 24 horas. Para el informe final de la investigación, el promotor dispondrá de 1 año desde la finalización de la investigación o de 3 meses si esta ha sido finalizada de manera anticipada. Se debe destacar que en el artículo 69 del EU-MDR se especifican las condiciones en las que las investigaciones deben disponer de un seguro o garantía financiera para los sujetos de investigación1. Como se indica en la tabla 2, las investigaciones con PS sin marcado CE, o con marcado CE, pero utilizadas con una finalidad distinta de la aprobada cuando obtuvieron la CE, deberán exigir un seguro para los sujetos.
Un pilar fundamental para el desarrollo de la EU-MDR es la base de datos EUDAMED (European Database on Medical Devices, cuyo objetivo es mejorar la transparencia pública, facilitar la trazabilidad de dispositivos, facilitar la supervisión del mercado y reforzar la coordinación entre los Estados miembros. Esta base de datos, que será accesible para las organizaciones estatales, aún no se encuentra disponible en el momento de la publicación de este documento. Por lo tanto, la AEMPS sigue utilizando su registro general para la tramitación de las autorizaciones de investigaciones clínicas con PS y de los estudios del funcionamiento con PS para diagnóstico in vitro. Para los casos que únicamente requieren notificación (tabla 2) se está utilizando la base de datos denominada NEOPS (notificación de investigaciones clínicas con productos sanitarios), hasta que EUDAMED se implemente de manera definitiva.
Organismo notificado
Un ON es una organización designada por un Estado miembro de la Unión Europea (u otros países en el marco de acuerdos específicos) para evaluar la conformidad de determinados productos antes de introducirlos en el mercado. El único ON creado en España es el Centro Nacional de Certificación de Productos Sanitarios, que dispone de competencia y capacidad para designar y realizar el seguimiento de PS. El ON exige documentación técnica normalizada y que cumpla con los requisitos necesarios de nivel de evidencia previo y conformidad con la regulación general de seguridad y funcionamiento. En su página web se encuentran los documentos necesarios para realizar cada uno de los trámites y guías orientativas (tabla 1 del material adicional).
Desde el comienzo de su actividad, el 15 de septiembre de 2022, el ON español ha sido requerido por 142 empresas solicitantes, con las cuales se han llegado a firmar 100 acuerdos. Estos acuerdos se definen como un contrato formal entre el ON y el fabricante que permite al ON realizar una evaluación del PS, definiendo el alcance de la evaluación, las obligaciones del fabricante y del ON, las condiciones para mantener, renovar o suspender la CE, y aspectos de confidencialidad y responsabilidad. Entre estos acuerdos, se han emitido 40 certificados que incluyen en torno a 300 productos (29 certificados de calidad y 11 de documentación técnica [PS de clase IIb implantables o de clase III]). El tiempo habitual entre el registro del PS y la firma del acuerdo es de 1 a 4 semanas. No obstante, en ocasiones este trámite puede alargarse más de 2 meses debido a una serie de dificultades que el ON presenta, como son:
- – Importante carga de trabajo: actualmente el ON tiene 275 productos por revisar, de los cuales el 25% son implantables, que requieren una evaluación más exhaustiva y exigente.
- – Estructura de la documentación técnica no adaptada: a pesar de los esfuerzos por generar una documentación estandarizada, habitualmente se requieren múltiples correcciones de la documentación, lo que retrasa el proceso de certificación.
- – Consulta a expertos: ciertos PS requieren una evaluación por un panel de expertos. De hecho, el artículo 56 declara que para los PS de clase IIb o III es obligatoria la consulta con un panel de expertos1. Encontrar expertos en determinados PS es en ocasiones una tarea difícil, teniendo en cuenta que algunos de los PS son para aplicaciones muy específicas, por lo que este hecho puede retrasar aún más la evaluación.
Es de especial importancia considerar que existe una fecha límite para la certificación de los PS con una certificación previa. Los PS que no hayan obtenido la CE bajo la nueva normativa para este plazo ya no podrán comercializarse, y podrían verse obligados a ser retirados del mercado. Este límite ya ha sido aplazado por el riesgo de escasez de productos en el mercado, la limitación de los ON y la influencia de la pandemia de COVID-19, siendo las fechas actuales el 31 de diciembre de 2027 para los PS de clase III y IIb implantables y el 31 de diciembre de 2028 para los de clase IIb no implantables, IIa, Is (estériles) e Ir (función de medición)15. Sin embargo, aunque estas fechas pueden parecer lejanas, el Centro Nacional de Certificación de Productos Sanitarios invita a los fabricantes a realizar el procedimiento de certificación sin demora.
Una limitación importante de los ON es la ausencia de un diálogo previo con los fabricantes. Este hecho puede dificultar el desarrollo de estudios clínicos adecuadamente diseñados que, en ocasiones, serían considerados inadecuados por el ON tras ser completados. Trabajar en conjunto en el diseño de los estudios clínicos podría ser beneficioso para ambas partes, reduciendo el tiempo necesario para la aprobación del PS y facilitando la realización del estudio y su revisión.
La documentación requerida es compleja y supone multitud de dudas y preguntas. Por ello, se han facilitado varios enlaces de interés a documentos y páginas web oficiales de los organismos correspondientes, donde estos aspectos complejos y concretos se explican con detenimiento (tabla 1 del material adicional).
PERSPECTIVA DE LA INDUSTRIA Y DE LOS FABRICANTES
Amenazas y retos
La industria tecnológica ha requerido una serie de profundas adaptaciones a la nueva normativa, implicando esta multitud de amenazas y dificultades. Según la asociación europea COCIR (European Trade Association representing the medical imaging, radiotherapy, health ICT and electromedical industries), la nueva regulación ha incrementado significativamente el tiempo hasta la certificación, aumentando un 157% el tiempo hasta la preparación de los documentos y un 263% hasta su aprobación final. También se ha elevado un 262% el coste y ha habido que incrementar un 5-9% el personal dedicado a la regulación, implicando una pérdida de profesionales y de presupuesto en el sector de investigación, desarrollo e innovación16. Una encuesta dirigida a diferentes empresas fabricantes en la industria de PS, realizada por MedTech Europe, encontró que los principales retos identificados son la insuficiente evidencia clínica generada mientras los dispositivos están en el mercado, la ausencia de una clara definición de lo que se considera información clínica suficiente y la dificultad para acordar con el ON un plan apropiado de seguimiento tras la comercialización17. Por otra parte, en una pregunta abierta con la que se evaluaron los principales obstáculos se mencionaron los costes asociados, los plazos, la divergencia de requerimientos en los distintos Estados y los importantes requisitos de las investigaciones clínicas. En este sentido, el Real World Data y el Real World Evidence son fuentes de información clínica relevantes. El Real World Data hace referencia a la información obtenida fuera de los ensayos clínicos tradicionales; puede extraerse de historias clínicas, registros de pacientes, bases de datos de seguros o estudios observacionales o de cohortes. El Real World Evidence implica el análisis o la interpretación del Real World Data, que se limita a datos crudos. De esta manera, el Real World Evidence permite generar evidencia sobre seguridad, efectividad, resultados de salud y uso de PS en la práctica diaria. No obstante, en la encuesta se observa que los ON aceptarían este tipo de evidencia mayormente como fuente adicional, que un 23% de los ON no la aceptarían en absoluto y que solo un 12% la aceptarían como única fuente de evidencia clínica. Entre el tipo de fuentes, los registros clínicos serían los más aceptados, quedando el resto de los formatos (encuestas, registros administrativos, etc.) muy por debajo en cuanto a aceptación.
Una amenaza particularmente sensible del desarrollo de PS afecta a aquellos destinados a pacientes vulnerables o con enfermedades huérfanas. Los PS cuyo ámbito de utilización sea en pacientes pediátricos o mujeres embarazadas corren el riesgo de no poder obtener la evidencia clínica suficiente para cumplir con los requerimientos necesarios para la obtención del marcado CE. De igual manera, si se exige una evidencia clínica sólida para un PS en enfermedades huérfanas, cuya prevalencia e incidencia son mínimas, existe el riesgo de que las empresas encargadas no sean capaces de cubrir los gastos de este desarrollo, ya de por sí complicado debido a la idiosincrasia de este tipo de enfermedades infrecuentes.
Competitividad con otros mercados
Muchas de estas limitaciones suponen una grave amenaza para PYME y start-up, que suelen presentar una estructura financiera menos sólida y consolidada que las grandes empresas. El incremento de los costes y la necesidad de personal adicional desincentiva el desarrollo de PS en Europa. Por lo tanto, algunas start-up, como Aortyx, han decidido enfocar el desarrollo de sus PS en sistemas más favorables, como el de Estados Unidos, cuyo principal atractivo desde el punto de vista burocrático está fundamentado en 2 puntos clave. El primero es la mayor rapidez de los trámites por parte de la Food and Drug Administration (FDA), que tiene un tiempo máximo de 90 días para dar una respuesta, mientras que los ON de Europa tardan una media de 50 días en simplemente aceptar el caso. En segundo lugar, resulta de especial interés la posibilidad de mantener un diálogo con la FDA para establecer qué tipo de estudio clínico sería el más adecuado para obtener su aprobación, en reuniones no vinculantes a través del programa Q-sub. En Europa, queda en manos del fabricante el diseño del estudio, sin posibilidad de recibir retroalimentación por parte del organismo regulador antes de finalizarlo, arriesgándose así a obtener una valoración desfavorable. En consecuencia, se vería obligado a repetir el estudio, con la sustancial inversión que esto implica. Aun así, en el artículo 57 de la EU-MDR se recomienda a los fabricantes consultar de manera voluntaria a un panel de expertos sobre la estrategia de desarrollo clínico y propuestas de investigación1. Además, en los Estados Unidos, algunos programas, como el Breakthrough Device Designation, pueden acelerar aún más el proceso priorizando aquellos PS novedosos considerados disruptivos y que traten enfermedades graves, que con frecuencia son enfermedades cardiovasculares18.
Aunque los anteriores motivos pueden considerarse suficientes para la priorización hacia Estados Unidos de ciertas empresas fabricantes de PS, la rentabilidad financiera también tiene una gran relevancia. El mercado americano ofrece, desde esta perspectiva, una serie de ventajas frente a la Unión Europea. La primera es la mayor morbilidad de la población estadounidense, y la segunda es el significativo mayor precio con que la mayoría de los PS se comercializan. En conjunto, todo esto hace que no solo desde el punto de vista burocrático, sino también desde el puramente financiero, el acceso al mercado sea más prometedor para la mayoría de pequeñas empresas tecnológicas sanitarias. De igual manera, y por razones similares, otros mercados como China y Japón resultan incrementalmente atractivos para las empresas y suponen una amenaza de reenfoque de los esfuerzos regulatorios y, en consecuencia, de desabastecimiento de PS innovadores en el mercado europeo.
Ejemplo de un estudio tras la comercialización
Con el objetivo de obtener el marcado CE MDR para un PS, la empresa iVascular realizó un plan de desarrollo clínico para un producto coronario de clase III legacy, un catéter-balón de angioplastia coronaria, tras su comercialización. Los PS legacy son aquellos certificados por la normativa previa y que disponen de un periodo para cumplir con la normativa actual. El seguimiento tras la comercialización debe confirmar la seguridad y el funcionamiento del producto a lo largo de su vida útil prevista, identificar y analizar riesgos emergentes, garantizar la aceptabilidad beneficio-riesgo e identificar posibles usos sistemáticos indebidos o no contemplados. Inicialmente se preparó el plan de desarrollo clínico en el que se establecieron 2 actividades. La primera fue una actividad formulario en la que se realizó una encuesta específica sobre el producto incluyendo variables de seguridad y funcionamiento clínico, y se envió a cardiólogos intervencionistas usuarios del dispositivo. La segunda actividad consistió en una investigación clínica, observacional, prospectiva y multicéntrica, con el objetivo de evaluar la seguridad y el funcionamiento clínico en población del mundo real y siguiendo las indicaciones de uso del fabricante. El estudio fue aprobado por los CEIm de cada centro. Tras completar el tamaño de la muestra y realizar el análisis estadístico, se elaboró un informe clínico que fue enviado al ON, donde se validó el resultado del PS y se otorgó el marcado CE.
A pesar del éxito de esta empresa, en su experiencia reconoce que la falta de retroalimentación por parte del ON, cuyo asesoramiento y aprobación podrían facilitar la elaboración del plan de desarrollo clínico, y la ausencia de una plantilla para el plan de desarrollo clínico y para la actividad formulario, supusieron limitaciones significativas en el procedimiento. Un proceso similar realizado en los Estados Unidos habría podido beneficiarse de un diálogo con la FDA para definir el tipo de estudio de manera consensuada e incluso aprovechar el programa Breakthrough Device Designation para acelerar el proceso. En China y Japón, aunque los plazos están más definidos, también se requiere un estudio clínico local para la aprobación del dispositivo. A pesar de estas ventajas, cabe señalar que disponer de un diálogo no garantiza una aprobación más acelerada, pues dependerá de las exigencias del estudio clínico requerido.
PERSPECTIVA DE LOS COLABORADORES
Los exigentes requerimientos para el desarrollo de un PS han llevado a que la mayoría de los investigadores y de los fabricantes necesiten el apoyo de empresas colaboradoras para el correcto cumplimiento de las distintas necesidades de los cada vez más complejos estudios clínicos. Existen una serie de aspectos en los que las empresas colaboradoras pueden ofrecer un servicio en el desarrollo de PS. De hecho, por las limitaciones existentes para los investigadores médicos y desarrolladores de PS existen las CRO (Contract Research Organization), empresas que ofrecen apoyo a la investigación clínica desde un enfoque global, gestionando el diseño del ensayo clínico, la recogida y el análisis de los datos, las cuestiones regulatorias, la monitorización del estudio clínicos y las auditorías y el control de calidad. A continuación, se mencionan las actividades para las que los investigadores y fabricantes demandan apoyo de colaboradores externos.
Elaboración y análisis de bases de datos
La creación de bases de datos adecuadas supone una parte crucial en el desarrollo de investigación clínica para garantizar el registro de todas las variables importantes que influyen en el estudio. Además, se debe garantizar que estas bases de datos sean accesibles a los investigadores y que se completen de manera adecuada. Para este fin, las empresas que dan soporte al diseño de bases de datos pueden ser un refuerzo esencial para los investigadores en la creación de estas y de los formularios adecuados, el seguimiento clínico, la curación y el análisis de los datos. Estas habilidades pueden requerir conocimientos específicos de informática de los que los investigadores no siempre disponen. Adicionalmente, la disponibilidad de bases de datos conjuntas en línea permite minimizar el riesgo de errores de transcripción y de errores en el seguimiento clínico mediante la adecuada coordinación de múltiples centros en estudios o ensayos clínicos multicéntricos. La externalización de este proceso puede aliviar la carga de trabajo de los investigadores y evitar errores en cada uno de los pasos.
Unificación de registros sanitarios
Una gran barrera en España para la realización de estudios de Real World Evidence es la limitación al acceso nacional de los datos. El hecho de que cada comunidad autónoma disponga de bases de datos independientes no accesibles a todos los investigadores nacionales dificulta la extracción y el análisis de datos a escala global. En este sentido, se han elaborado plataformas específicas con el objetivo de unificar bases de datos sanitarias en regiones con bases de datos heterogéneas, como ocurre en España. Una plataforma unificada podría aportar una serie de beneficios respecto al sistema actual. Para empezar, desde el punto de vista del paciente individual, que podría desplazarse por el territorio nacional y disponer de los resultados de pruebas previas realizadas en otras comunidades autónomas, facilitaría la asistencia sanitaria. Por otro lado, en cuanto a la investigación clínica, permitiría la extracción de datos unificados, aportando versatilidad en la exportación y comunicación con organizaciones y Estados, y la participación en proyectos de investigación conjuntos.
Consideraciones éticas y legales
Mientras que disponer de una gran cantidad de datos sanitarios puede ser una idea atractiva para los investigadores, este hecho conlleva cuestiones éticas sobre la protección de datos relativa a los pacientes. Existen asesorías especializadas en la seguridad de la información en el sector sanitario. Esta destaca por la compleja legislación existente en el ámbito de la seguridad del paciente y de la privacidad como derecho fundamental de los individuos. Es habitual que el investigador o el fabricante que debe centrar su capacidad de trabajo e intelectual en el desarrollo de una investigación o de un PS desconozca todos los matices de la compleja legislación en este ámbito concreto. Por ello, este tipo de empresas pueden ser un apoyo sustancial en el desarrollo de la investigación con PS, asegurando el cumplimiento de todos aquellos requerimientos legales necesarios y facilitando la realización de otras tareas a investigadores y fabricantes.
PERSPECTIVA DEL INVESTIGADOR
Desde el punto de vista del investigador, la aparición de nuevas regulaciones implica un esfuerzo adicional para su estudio y evaluación con el fin de llevar a cabo los proyectos de una manera eficiente y efectiva. La nueva normativa ha generado multitud de dudas en la comunidad investigadora y ha enlentecido, al menos temporalmente, el desarrollo de PS. En este sentido, la organización de reuniones de actualización con un enfoque transversal facilita la comprensión de estas complejas normativas, apoyan al investigador y permiten establecer valiosas redes profesionales que potencian la colaboración científica, reguladora e industrial.
El papel del investigador en tanto que experto en determinados PS, como se ha visto a lo largo del documento, es también fundamental. Tanto la AEMPS como los CEIm requerirán con frecuencia la valoración de determinados proyectos por paneles de expertos, y a su vez se recomienda a los fabricantes consultar con expertos los proyectos antes de presentarlos a los organismos oficiales. Por lo tanto, disponer de un grupo de expertos sólido y con experiencia supone una necesidad crucial para llevar a cabo investigaciones eficaces y para valorar con criterio las nuevas solicitudes de PS en colaboración con los organismos oficiales.
Por último, es habitual que muchos proyectos interesantes, iniciados por el investigador para responder a una pregunta académica o clínica, se vean enlentecidos o incluso detenidos debido a la imposibilidad de conseguir fondos suficientes. Este aspecto es en especial importante en el desarrollo de ensayos clínicos aleatorizados, que son el paradigma de la investigación clínica, pues requerirán un coste mayor para cubrir la necesidad de seguro sanitario para los participantes. La investigación en PS, por otra parte, puede suscitar un enfoque menos atractivo al investigador. No obstante, no se debe menospreciar la importancia de los estudios posautorización, ya que gracias a este tipo de estudios se han identificados PS y fármacos con efectos no identificados en los ensayos clínicos, en ocasiones perjudiciales para los pacientes, que han llevado a su retirada del mercado.
PERSPECTIVA DEL PACIENTE
En este complejo panorama es fácil olvidar que el objetivo final del desarrollo de PS es la mejora de la salud poblacional y de los pacientes, que son los receptores últimos de los PS. Por ello, su perspectiva es muy importante, y dar a conocer la complejidad del desarrollo de tecnología en salud y la multitud de requisitos necesarios para obtener PS seguros y eficaces resulta beneficioso tanto para los propios pacientes como para el resto de las partes. Limitar la participación de los pacientes a la firma del consentimiento informado minimiza su participación en el proceso y puede generar desconfianza hacia los investigadores, los fabricantes y los organismos reguladores. En cambio, explicar el proceso de desarrollo de PS de manera clara y sencilla puede acercar este complejo mundo a los pacientes. Desde los CEIm, de hecho, ya existe la exigencia de contar con representantes de pacientes dentro del comité. Otros ejemplos podrían ser la consulta directa a grupos de pacientes durante el diseño de los estudios, su participación en la definición de prioridades de investigación, el desarrollo de materiales informativos comprensibles para los participantes, y su colaboración en la interpretación y la difusión de los resultados. Estas formas de participación buscan fortalecer la transparencia, mejorar la relevancia de los estudios y fomentar la confianza en los procesos de investigación. Todos estos aspectos son un paso importante para fomentar la participación de pacientes en estudios clínicos y asegurar un seguimiento y un cumplimiento activo que, finalmente, repercutirán de manera positiva en la salud individual y poblacional.
CONCLUSIONES
La regulación europea EU-MDR ha traído cambios sustanciales al proceso de desarrollo de PS con el fin de unificar y asegurar un desarrollo eficaz y seguro de nuevos dispositivos médicos. Pese a que su implementación conlleva retos y amenazas para la investigación en PS en la Comunidad Europea, la colaboración de los múltiples actores implicados y compartir sus perspectivas ayudan a comprender el procedimiento en conjunto y facilitan un proceso más armónico y unificado.
FINANCIACIÓN
La Fundación Epic organizó la reunión y se hizo cargo de todos los gastos. El Instituto de Empresa (IE) cedió las instalaciones para la reunión Epic MDR25.
CONSIDERACIONES ÉTICAS
Este artículo es una revisión de la literatura previamente publicada y no involucra estudios originales con seres humanos ni animales por parte de los autores. Por lo tanto, no fue necesario obtener la aprobación de un comité de ética.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
Para la redacción de este documento no se utilizó ningún programa de inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORES
J. Zubiaur y A. Pérez de Prado redactaron la primera versión del texto. J.R. Rumoroso Cuevas, M.C. Rodríguez Mateos, G. Hernández, I. Alfonso Farnós, M. Aláez, S. Pich, J. Martorell, E. Paredes, A. Escario, P.P. Fernández Rivero, E. Jiménez-Carles y A. Pérez de Prado contribuyeron a la elaboración del contenido de donde se obtuvo la información para la redacción del documento. Todos los autores revisaron la versión final del artículo.
CONFLICTO DE INTERESES
A. Pérez de Prado es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. J.R. Rumoroso Cuevas es director general de la Fundación Epic. I. Alfonso Farnós es presidenta de la ANCEI. M. Aláez es trabajadora en la FENIN. S. Pich es trabajadora en iVascular. J. Martorell es fundador y trabajador de Aortyx. E. Paredes es fundador y trabajador de pInvestiga. A. Escario es trabajador en Madrija. P.P. Fernández Rivero es trabajador en Start Up SL. E. Jiménez-Carles es director general y trabajador de Soinde Neuro SL.
BIBLIOGRAFÍA
1. Regulation - 2017/745 - EN - Medical Device Regulation - EUR-Lex. Disponible en: https://eur-lex.europa.eu/eli/reg/2017/745/oj/eng. Consultado 18 Ene 2025.
2. Regulation (EU) 2017/746 of the European Parliament and of the Council of 5 April 2017 on in vitro diagnostic medical devices and repealing Directive 98/79/EC and Commission Decision 2010/227/EU (Text with EEA relevance). OJ L abr 5, 2017. Disponible en:http://data.europa.eu/eli/reg/2017/746/oj/eng. Consultado 25 Ene 2025.
3. Ministerio de Sanidad. Real Decreto 192/2023, de 21 de marzo, por el que se regulan los productos sanitarios. Sec. 1, Real Decreto 192/2023 mar 22, 2023 p. 42678-42706. Disponible en: https://www.boe.es/eli/es/rd/2023/03/21/192. Consultado 25 Ene 2025.
4. Fraser AG, Byrne RA, Kautzner J, et al. Implementing the new European Regulations on medical devices —clinical responsibilities for evidence-based practice:a report from the Regulatory Affairs Committee of the European Society of Cardiology. Eur Heart J. 2020;41:2589-2596.
5. Spitzer E, de la Torre-Hernández JM, Guðmundsdóttir Ingibjörg J, et al. Uso de registros cardiovasculares en procesos regulatorios:perspectivas del Colaboratorio Cardiovascular EU-MDR. REC Interv Cardiol. 2024;6:213-223.
6. DocsRoom - European Commission. Disponible en: https://ec.europa.eu/docsroom/documents/10337/attachments/1/translations. Consultado 21 Ene 2025.
7. Biomed Alliance. Biomed Alliance response to JRC consultation on medical devices clinical investigation summary reporting requirements. 10 sep 2018. Disponible en: https://www.biomedeurope.org/wp-content/uploads/2018/12/Biomed_Alliance_Response_to_JRC_Consultation_10_Sep_2018-2.pdf. Consultado 25 Ene 2025.
8. Jefatura del Estado. Ley 14/2007, de 3 de julio, de Investigación biomédica. Sec. 1, Ley 14/2007 jul 4, 2007 p. 28826-28848. Disponible en: https://www.boe.es/eli/es/l/2007/07/03/14. Consultado 25 Ene 2025.
9. Ministerio de Sanidad, Servicios Sociales e Igualdad. Real Decreto 1090/2015, de 4 de diciembre, por el que se regulan los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos. Sec. 1, Real Decreto 1090/2015 dic 24, 2015 p. 121923-121964. Disponible en: https://www.boe.es/eli/es/rd/2015/12/04/1090. Consultado 25 Ene 2025.
10. Regulation - 2017/746 - EN - Medical Device Regulation - EUR-Lex. Disponible en: https://eur-lex.europa.eu/eli/reg/2017/746/oj/eng. Consultado 17 Ene 2025.
11. WMA - The World Medical Association - Declaración de Helsinki de la AMM - Principios éticos para las investigaciones médicas con participantes humanos. Disponible en: https://www.wma.net/es/policies-post/declaracion-de-helsinki-de-la-amm-principios-eticos-para-las-investigaciones-medicas-en-seres-humanos/. Consultado 18 Ene 2025.
12. UNE-EN ISO 14155:2021 Investigación clínica de productos sanitarios. Disponible en: https://www.une.org/encuentra-tu-norma/busca-tu-norma/norma?c=N0066686. Consultado 18 Ene 2025.
13. Agencia Española de Medicamentos y Productos Sanitarios. 2023 Instrucciones de la AEMPS para la realización de investigaciones clínicas con productos sanitarios en España. Disponible en: https://www.aemps.gob.es/productos-sanitarios/investigacionclinica-productossanitarios/instrucciones-de-la-aemps-para-la-realizacion-de-investigaciones-clinicas-con-productos-sanitarios-en-espana/. Consultado 17 Ene 2025.
14. Guidance - MDCG endorsed documents and other guidance - European Commission. 2025. Disponible en: https://health.ec.europa.eu/medical-devices-sector/new-regulations/guidance-mdcg-endorsed-documents-and-other-guidance_en. Consultado 27 Ene 2025.
15. BOE.es - DOUE-L-2023-80401 Reglamento (UE) 2023/607 del Parlamento Europeo y del Consejo de 15 de marzo de 2023 por el que se modifican los Reglamentos (UE) 2017/745 y (UE) 2017/746 en lo que respecta a las disposiciones transitorias relativas a determinados productos sanitarios y a productos sanitarios para diagnóstico in vitro. Disponible en: https://www.boe.es/buscar/doc.php?id=DOUE-L-2023-80401. Consultado 23 Ene 2025.
16. COCIR. COCIR Position on the Future Governance Framework for the Medical Technologies Sector. Disponible en: https://www.cocir.org/position/cocir-position-on-the-future-governance-framework-for-the-medical-technologies-sector/. Consultado 18 Ene 2025.
17. MedTech Europe. MedTech Europe 2024 Regulatory Survey:key findings and insights. Disponible en: https://www.medtecheurope.org/resource-library/medtech-europe-2024-regulatory-survey-key-findings-and-insights/. Consultado 18 Ene 2025.
18. U.S. Food and Drug Administration. Breakthrough Devices Program. FDA. 11 de julio de 2024. Disponible en: https://www.fda.gov/medical-devices/how-study-and-market-your-device/breakthrough-devices-program. Consultado 18 Ene 2025.
RESUMEN
La estenosis aórtica grave es la valvulopatía más frecuente y su incidencia aumenta cada año. El implante percutáneo de válvula aórtica (TAVI) es la primera línea de tratamiento con cualquier riesgo quirúrgico. Una complicación frecuente del TAVI es una tasa más alta de implante de marcapasos permanente (IMPP) en comparación con la cirugía. La profundidad óptima de implante es fundamental para reducir la tasa de IMPP sin generar otras complicaciones, como la embolización de la válvula. La técnica clásica de implante, en la cual las 3 cúspides están alineadas en el mismo plano, se ha modificado a una proyección de superposición de cúspides, aislando la cúspide no coronaria y superponiendo la izquierda y la derecha. Esta modificación proporciona una visualización óptima durante el despliegue y facilita obtener la profundidad deseada para reducir la tasa de IMPP. Otra limitación del TAVI es el reacceso coronario debido a la obstrucción de la válvula a los ostium coronarios. La alineación comisural de la prótesis con la válvula nativa facilita la canulación selectiva de las coronarias después del procedimiento. En la presente revisión se comentan las técnicas y la evidencia sobre estas modificaciones de la técnica de liberación e implante, y cómo pueden mejorar el TAVI.
Palabras clave: Alineamiento comisural. Proyección de superposición de cúspides. Recambio valvular aórtico percutáneo.
ABSTRACT
Severe aortic stenosis is the most frequent valve condition requiring surgery, and its incidence is increasing yearly. Transcatheter aortic valve implantation (TAVI) is the first-line treatment for patients at all levels of surgical risk. Nevertheless, modifications to the procedure often appear to improve clinical outcomes. A major concern after TAVI is the higher rate of permanent pacemaker implantation (PPMI) compared with surgical valve replacement. Optimal implantation depth is crucial to reduce the burden of PPMI without causing serious complications such as valve embolization. The classic implantation technique, where the 3 cusps are aligned in the same plane, has been modified to a cusp overlap projection by isolating the noncoronary cusp and superimposing the left and right cusps. This simple modification provides optimal visualization during deployment and helps to achieve the desired implant depth to reduce conduction disturbances and PPMI. Another limitation after TAVI is coronary reaccess due to the frame of the transcatheter valve obstructing the coronary ostia. Commissural alignment of the prostheses with the native valve may facilitate selective cannulation of the coronary arteries after this procedure. This review will discuss the techniques and supporting evidence for these modifications to the deployment and implant projection methods, and how they can improve TAVI outcomes.
Keywords: Cusp overlap projection. Commissural alignment. Transcatheter aortic valve replacement.
Abreviaturas EC: enfermedad coronaria. IMPP: implante de marcapasos permanente. PI: profundidad de implante. TAVI: implante percutáneo de válvula aórtica. THV: prótesis valvular cardiaca percutánea. TSC: técnica de superposición de cúspides.
INTRODUCCIÓN
La estenosis aórtica grave sintomática (EAGS) es la valvulopatía más frecuente en Europa y América del Norte. Hablamos de una enfermedad que ha sido diagnosticada en más de 7 millones de pacientes y supone hasta el 40% de todas las intervenciones que se realizan en las válvulas nativas1. La cifra total de intervenciones realizadas en la válvula aórtica ha ido aumentando, de forma constante, cada año, principalmente por la gran cantidad de diagnósticos nuevos entre la población de edad avanzada. Algunas estimaciones calculan que el número de valvulopatías graves se duplicará en 20502.
El tratamiento de la EAGS solía precisar cirugía a corazón abierto. No obstante, desde que se practicara el primer implante en 2002 y se aprobase en Europa en 2007, el implante percutáneo de válvula aórtica (TAVI) ha trasformado el panorama actual ofreciendo un tratamiento menos invasivo de la EAGS3. Al principio, el TAVI se limitaba a pacientes inoperables, pero desde los estudios Partner 34 y SURTAVI5 realizados entre pacientes de riesgo bajo e intermedio, respectivamente, el TAVI se ha convertido en el tratamiento de primera línea para pacientes en todo el espectro de riesgo quirúrgico. Las últimas guías europeas fomentan el uso del TAVI transfemoral como la opción terapéutica recomendada en pacientes mayores de 75 años4. Por si esto fuera poco, algunos estudios confirman análisis coste-efectividad favorables al TAVI en detrimento del reemplazo quirúrgico de la válvula aórtica (RQVA)5; además, los protocolos de alta temprana y tratamiento ambulatorio también han demostrado ser seguros con resultados alentadores6. Entre 2019 y 2021, el número de TAVI realizados en España pasó de 90 a 120 por cada millón de personas7. A tenor de esta tendencia, se calcula que el número absoluto de TAVI, tanto en pacientes jóvenes como de edad avanzada, irá en aumento en los próximos años.
Teniendo en cuenta que la indicación del TAVI se ha ido ampliando, son varios los escenarios clave que precisan más investigación, en caso de estar presentes, podrían desaconsejar el uso de dicha intervención. En primer lugar, hasta el 50% de los pacientes TAVI presentan enfermedad coronaria (EC) significativa. Como los implantes se están realizando en pacientes más jóvenes y, por lo tanto, con una mayor esperanza de vida, se espera que muchos de ellos terminen desarrollando EC significativa y, por ende, precisando, una coronariografía y el tratamiento correspondiente8. La coronariografía en pacientes portadores de prótesis valvulares cardiacas percutáneas (THV) es complejo porque dicha prótesis obstaculiza el sondaje selectivo. En este sentido, las estrategias para facilitar la realización de intervenciones coronarias tras el TAVI son una pieza clave de todo este proceso.
En segundo lugar, comparado con el RQVA, el número de implantes de marcapasos permanentes (IMPP) es mayor con tasas de hasta el 17,4% para la válvulas autoexpandibles y el 6,5% para las prótesis balón-expandibles9,10. Registros publicados recientemente informan tasas de IMPP del 11,3% para todos los TAVI. Los pacientes que precisan el IMPP tras un TAVI tienen peores resultados clínicos, hospitalizaciones más largas y tasas más altas de mortalidad durante el seguimiento11.
Para mitigar estos riesgos, se están desarrollando válvulas de última generación y han surgido consideraciones especiales durante la planificación preoperatoria y el implante de THV, avances sobre los que versa esta revisión y que se presentan a continuación.
PROFUNDIDAD ÓPTIMA DE IMPLANTE
Mucho se ha debatido sobre la profundidad óptima de implante (PI), sobre todo en lo que se refiere a los efectos que tiene sobre el rendimiento de la válvula y la capacidad de alterar otros resultados clínicos. Un implante alto de la THV puede provocar temidas complicaciones tales como embolización de la válvula, obstrucción coronaria y fuga periprotésica (FPP). En cambio, un implante profundo aumenta el riesgo de IMPP, FPP y deteriora la función de la válvula mitral. En este sentido, garantizar una PI óptima es clave para obtener mejores resultados (figura 1)12.
Figura 1. A: lograr una profundidad óptima de implante es esencial para mejorar los resultados. Una válvula implantada profundamente podría afectar la función de la válvula mitral, provocar fugas periprotésicas llegando, incluso, a interactuar con el sistema de conducción aumentando las tasas de implante de marcapasos permanente. Por otro lado, un implante alto de la válvula podría provocar obstrucciones coronarias, embolizaciones de la válvula y fugas periprotésicas. B: se ha demostrado que la proyección de superposición de cúspides, donde las cúspides izquierda y derecha se superponen en el lado derecho de la pantalla, aislando la cúspide no coronaria, sirve para optimizar la profundidad de implante. CAU: caudal; CRA: craneal; MP: marcapasos permanente; OAD: oblicuo anterior derecho.
Una de las principales razones por las que la PI produce alteraciones de la conducción es que interactúa con el septo membranoso, una estructura fibrosa del septo interventricular que se ubica en la base del triángulo de Koch. El sistema de conducción viaja por el interior del septo membranoso y continúa, superficialmente, como rama izquierda hasta llegar al septo muscular. Por eso el bloqueo de rama izquierda (BRI) es el trastorno de la conducción más frecuente tras el TAVI, dependiendo de la longitud del septo membranoso y la profundidad de la THV. Se ha demostrado que una PI óptima minimiza dicha interacción con el septo membranoso, los trastornos de la conducción y las tasas de IMPP13.
CURVA DOBLE EN FORMA DE S
La técnica de implante clásica (TIC), que alinea las 3 cúspides en el mismo plano, suele provocar el acortamiento del sistema de liberación y eliminar el paralaje, lo cual, a su vez, desvía la prótesis del plano anular. Una curva doble en forma de S consistente en un punto de intersección en el que el anillo y el sistema de liberación están en posición óptima puede facilitar una liberación más controlada de la THV.
En un estudio realizado por Ben-Shoshan et al.14, 100 pacientes fueron tratados mediante TAVI con el modelo de curva doble S con la válvula autoexpandible de Medtronic. Más del 80% de los pacientes presentaban una curva doble S en el cuadrante oblicuo anterior derecho y caudal. Los autores informaron que la intervención tuvo éxito en el 98% de los pacientes y que las tasas de IMPP y otras complicaciones fueron parecidas a las descritas en otros estudios. También aclararon que no pretendían una PI más alta. En este sentido, las tasas de IMPP fueron similares a las de otros estudios con pacientes con el mismo riesgo. Esta técnica todavía no se ha adoptado ampliamente porque la curva S precisa análisis de imágenes intraoperatorias, algo con lo que no cuentan todos los centros14.
SUPERPOSICIÓN DE CÚSPIDES
En su día, Tang et al.15 propusieron la técnica de superposición de cúspides (TSC) para optimizar el implante de THV autoexpandibles empleando la TIC mediante la superposición de las cúspides coronarias izquierda y derecha y el aislamiento de la cúspide no coronaria (CNC). La tomografía computarizada multicorte (TCMC) ayuda a predecir la angulación necesaria durante el implante. Esta proyección resulta sumamente útil no solo porque alarga el tracto de salida sino porque superpone las cúspides coronarias derecha (CCD) e izquierda (CCI) a lo largo del plano basal del anillo aórtico, aísla la CNC y sitúa la comisura entre CNC/CCD en el centro del plano fluoroscópico, posibilitando la liberación de la THV de forma más controlada y con una mayor PI15. Comparada con la curva en forma de doble S, la TSC tuvo una alta concordancia en más del 80% de los pacientes, minimizando la necesidad de obtener imágenes intraoperatorias (figura 1)14.
Un resumen simplificado de la TSC podría ser el siguiente: a) la TCMC preoperatoria aísla la CNC y superpone las cúspides derecha e izquierda. En la mayoría de los pacientes, esto da como resultado la obtención de un plano oblicuo anterior derecho/caudal; b) una guía de alto soporte como la Safari (Boston Scientific, Estados Unidos) o la Lunderquist de doble curva (Cook Medical, Estados Unidos) mantiene la posición durante la liberación de la válvula; c) se inserta un catéter pigtail en la CNC y da comienzo la liberación de la THV colocando el marcador del anillo en la porción media del catéter (en el caso de la última versión de la válvula Evolut FX [Medtronic Inc., Estados Unidos], en la porción más baja de este) para lograr una PI de unos 3 mm; d) cuando la válvula ya se ha desplegado en un 80%, se elimina el paralaje en un plano oblicuo anterior izquierdo para comprobar la profundidad alcanzada. La THV se debe recapturar y reposicionar con una PI < 1 o > 5 mm; e) si la porción de entrada de la válvula es infra-anular, esta se despliega lentamente desde el catéter de liberación (figura 2)16.
Figura 2. Figura central. Pequeñas modificaciones durante el implante pueden conseguir el alineamiento comisural (lado izquierdo del panel), facilitar el acceso coronario en futuras intervenciones, reducir el riesgo de oclusiones coronarias en el redo-TAVI y mejorar la hemodinámica valvular. Una proyección de superposición de cúspides (lado derecho del panel) mejora la visión del implantador para ayudar a optimizar la profundidad de implante, reduce los trastornos de la conducción y las tasas de implante de marcapasos permanente y, en última instancia, mejora tanto los resultados como la duración de la hospitalización. ECG: electrocardiograma; IMPP: implante de marcapasos permanente; TAVI: implante percutáneo de válvula aórtica.
VÁLVULAS AUTOEXPANDIBLES
Evolut R, Evolut PRO, Evolut PRO+ y Evolut FX de Medtronic Inc. (Estados Unidos)
Buena parte de la literatura disponible sobre la TSC se centra en la válvula autoexpandible de Medtronic. En una experiencia unicéntrica, Pascual et al.17 valoraron la TSC con las válvulas Evolut R y PRO. Este centro modificó todos los implantes pasando de la TIC a la TSC y realizó una comparativa de 226 pacientes (113 en cada grupo). Los resultados revelaron que, en los pacientes del grupo TSC, la profundidad del implante fue 1 mm menor (4,8 ± 2,2 frente a 5,7 ± 3,1 mm; p = 0,011) y la tasa de IMPP se redujo del 23 al 12,4% (OR = 0,45; intervalo de confianza del 95% [IC95%], 0,21-0,97; p = 0,043)17. Aunque el tamaño muestral de este estudio unicéntrico fue relativamente pequeño, se obtuvieron resultados similares en un segundo análisis de 2 centros de alto volumen mediante emparejamiento por puntuación de propensión de 444 pacientes (175 en el grupo TSC). El análisis confirmó un descenso medio de la PI de 1 mm (4,2 frente a 5,3 mm; p < 0,001) y tasas más bajas de IMPP durante los primeros 30 días (11,8 frente al 21,7%; p = 0,03; RR = 0,54; IC95%, 0,32-0,91) con una incidencia similar de otras complicaciones18. Este último estudio incluyó a pacientes portadores de la Evolut PRO+ de última generación.
En una experiencia de 3 centros, Mendiz et al.19 analizaron las tasas de nuevo BRI e IMPP en 257 pacientes (101 del grupo TSC). Las tasas fueron más bajas para el grupo TSC con un 12,9 frente al 5,8% (p = 0,05) para nuevos BRI y un 17,8 frente al 6,4% (p = 0,004) para nuevos IMPP. Asimismo, Maier et al.20 reclutaron a un total de 759 pacientes de un único centro desde 2016 hasta 2021 empleando el emparejamiento por puntuación de propensión. Los resultados fueron iguales a los ya mencionados con una tasa de IMPP del 8,0% para el grupo TSC y del 16.8% para el grupo TIC (p = 0,028) y menos alteraciones de la conducción. Todavía resulta más interesante el hecho de que las tasas más bajas de de IMPP acarrearon hospitalizaciones más cortas en el grupo TSC (8,4 ± 4,0 frente a 10,3 ± 6,7 días; p = 0,007). Un estudio de Ochiai et al.21 incluyó a 258 pacientes desde 2017 hasta 2022. Utilizando la TSC, estos autores buscaron una mayor PI. Hubo muchos menos BRI de nueva aparición (4,2 frente al 11,3%) y las tasas de IMPP fueron mucho menores en aquellos pacientes en quienes se empleó la TSC (0,0 frente al 10,8%; p = 0,02).
La última generación de válvulas de Medtronic (Evolut FX) se diseñó para mejorar la capacidad de liberación, trazabilidad y precisión durante la colocación de la válvula. Merdler et al.22 incluyeron en su estudio a 200 pacientes consecutivos; los primeros 100 recibieron la Evolut PRO+ y los restantes, la Evolut FX. No se observaron diferencias significativas en las tasas de IMPP (12 frente al 9%; p = 0,21) y los resultados clínicos fueron similares. Otra serie mostró un descenso de las tasas de IMPP del 11,2 al 7% en los primeros 43 pacientes, aunque esta diferencia no fue estadísticamente significativa (p = 0,25). Ante estos resultados y las modificaciones hechas a la válvula, se espera que los beneficios de la TSC se mantengan, también, con las válvulas de última generación. En este sentido, la mejor práctica de que disponemos avala, también, el uso de la TSC para esta última generación de válvulas23.
En un metanálisis que incluyó 11 estudios con 1.464 pacientes en el grupo TSC y 1.743 en el grupo TIC, la odds ratio para el IMPP fue de 0,48 (IC95%, 0,33-0,70), logrando una mayor PI con una diferencia media de casi 1 mm (0,83; IC95%, de 1,2 a −0,45; p < 0,001). No se hallaron diferencias estadísticamente significativas en las tasas de BRI de nueva aparición, aunque sí tasas de complicaciones similares de FPP moderada/grave, dislocación de la válvula, necesidad de una segunda THV, mortalidad a 30 días, accidentes cerebrovasculares, conversión a cirugía, obstrucción coronaria y gradientes medios pos-TAVI (mmHg)24. No obstante, este metanálisis no incluyó el análisis más extenso hasta la fecha realizado por Wieneman et al.25. Estos autores reclutaron a un total de 2.209 pacientes entre 2016 y 2022, en 1.151 de los cuales se empleó la TSC. Las tasas de IMPP (17,0 frente al 12,3%; p = 0,002) y FPP (4,6 frente al 2,4%; p = 0,006) fueron mucho más bajas en la cohorte TSC.
El único análisis prospectivo en curso, en la actualidad, es el Optimize PRO (NCT04091048), un análisis no aleatorizado que está comparando el perfil de seguridad y eficacia del TSC con las válvulas Evolut PRO y Evolut PRO+. Los datos preliminares sobre este estudio han sido facilitados por Grubb et al.26. La tasa de IMPP fue del 9,8% en 400 implantes intentados; tasa que descendió hasta el 5,8% cuando se cumplían 4 pasos críticos del protocolo TSC26. Las tasas de complicaciones a 30 días también fueron bajas, con tasas de mortalidad por cualquier causa, accidente cerebrovascular incapacitante, rehospitalización y rehospitalización por motivos cardiovasculares del 0,8, 0,7, 10,1 y 6.1%, respectivamente por cero casos de insuficiencia aórtica moderada o grave al alta. Estos prometedores resultados todavía están pendientes de confirmación a la espera de los resultados finales.
Acurate Neo2
Kim et al.27 compararon 901 TAVI con la válvula autoexpandible Acurate Neo2 (Boston Scientific Corporation, Estados Unidos): 631 empleando la TIC y 270 la TSC. No hubo diferencias significativas en el objetivo compuesto de IMPP, BRI de nueva aparición, fallo técnico y FPP ≥ moderada (23,1 frente al 21,5%; p = 0,586). Las tasas de IMPP analizadas por separado fueron similares entre los 2 grupos (TIC: 7,3 frente a TSC: 6,3%; p = 0,592), no observándose ninguna diferencia en la PI. Los autores señalan que el anclaje inicial de la corona superior limita el reposicionamiento de la válvula y que la PI no se ve afectada por la TSC. En cualquier caso, la proyección demostró ser segura y viable para esta válvula y las tasas de complicaciones similares en ambas técnicas. Para documentar el alineamiento comisural durante la intervención, Meduri et al.28 emplearon la proyección de la TSC para confirmar que la ubicación de la THV era la correcta. En este sentido, parece una mejor proyección para este tipo de válvula porque, aunque equivalente en la mayoría de los aspectos, parece favorecer el alineamiento comisural (AC).
Válvulas Portico y Navitor
La válvula Portico (Abbott Cardiovascular, Estados Unidos) con el sistema de entrega FlexNav de segunda generación se probó en 3 centros terciarios de referencia. Se reclutó a un total de 85 pacientes tratados de TAVI transfemoral, 42 con proyección de la TSC. La profundidad diana fue de 3 a 5 mm desde la CNC hasta la entrada del armazón de la válvula cardiaca. Los objetivos primarios fueron la PI y un compuesto de BRI de nueva aparición e IMPP. La TSC se asoció a una mayor PI (4,9 frente a 7,4 mm; p = 0,005), así como a una tasa más baja del objetivo compuesto (31,0 frente al 58,1%; p = 0,012). No obstante, cuando se analizaron los objetivos por separado, solo se observó una tendencia hacia menos IMPP (14,3 frente al 30,2%; p = 0,078)29. A pesar de las similitudes entre las válvulas Portico y Evolut, parece que existe un diferente impacto sobre los trastornos de la conducción cuando se obtiene un implante más alto. Estas diferencias podrían explicarse tanto por la fuerza de apertura como por la distribución de la fuerza radial, con tasas globales de IMPP más bajas para el sistema Portico (13,5 frente al 19%)30.
Un estudio más amplio de Wang et al.31 incluyó la válvula Portico y su última versión, la válvula Navitor. Estos autores compararon a un total de 366 pacientes y la colocación de la válvula empleando la TSC frente a la proyección coplanar estándar de 3 cúspides. Analizaron 183 pares como parte de un emparejamiento por puntuación de propensión. La tasa de IMPP fue del 12,6% en el grupo TSC frente al 18% en la TIC, aunque esta diferencia no fue significativa a nivel estadístico (P = .15). No obstante, al igual que otras válvulas autoexpandibles, el alineamiento comisural se obtuvo en la proyección de la TSC con una tasa de complicaciones parecida en ambos grupos. Se debe mencionar que tras el emparejamiento la válvula Portico se empleó en 183 pacientes del grupo TIC y la válvula Navitor de última generación en 183 del grupo TSC.
PRÓTESIS BALÓN-EXPANDIBLES
Aunque la superposición de las cúspides se llevó a cabo, inicialmente, en las válvulas autoexpandibles por la naturaleza asimétrica del despliegue propio de estas prótesis, Sammour et al.32 aplicaron los mismos principios a la Sapien 3 (Edwards Lifesciences, Estados Unidos) empleando la curva con forma de doble S y la TSC. En la mayoría de los pacientes, una proyección oblicua anterior derecha/caudal aislará la CNC y superpondrá la CCI y CCD. Siguiendo este principio, desarrollaron una técnica de implante alto (TIA): la válvula se implanta en un plano oblicuo anterior derecho/caudal, eliminándose, así, el paralaje de la válvula crimpada. Después, se libera la válvula alineando la línea radiolúcida de la válvula crimpada en la base de la CNC como marcador para el aortograma de despliegue a fin de confirmar la cobertura del stent. Los autores reclutaron a 622 pacientes (60,5%) para el despliegue convencional empleándose la TIA en 406 pacientes (39,5%). La PI fue mucho menor con la TIA (1,5 frente a 3,2 mm; p < 0,001). Las tasas de IMPP (5,5% frente al 13,1%; p < 0,001), bloqueo cardiaco completo (3,5 frente al 11,2%; p < 0,001) y BRI (5,3 frente al 12,2%; p < 0,001) también fueron menores con la TIA. La regresión logística multivariable confirmó que la TIA fue un predictor independiente de IMPP a los 30 días (OR = 0,439; IC95%, 0,246–0,781; p = 0,005). Las tasas de complicaciones fueron parecidas con 1 embolización de la válvula por cero obstrucciones coronarias.
El estudio de Ochiai et al.21 citado anteriormente incluyó a un total de 258 pacientes con la THV Sapien 3, en 108 de los cuales se empleó la TIA y en 150 el despliegue convencional de la válvula. Los resultados fueron parecidos a los de Sammour et al., con menos alteraciones de la conducción. No obstante, las tasas de IMPP fueron bajas en los 2 grupos (solo en el 2% de los pacientes). La posición de los ostia coronarios en relación a la THV se valoró mediante TCMC pos-TAVI. No se observaron diferencias en la interferencia de la falda de la THV con los ostia coronarios. No obstante, la incidencia de interferencias de la armadura del stent con el acceso a los ostia coronarios sí fue mucho mayor en el grupo TIA (97,2 frente al 89,3%; p = 0,02).
El último análisis realizado por Stephan et al.33 reclutó a 280 pacientes tratados mediante TAVI transfemoral con la válvula Sapien 3. Los autores utilizaron la TSC en 143 pacientes, alcanzando PI más altas. No obstante, no se observaron diferencias significativas en los BRI de nueva aparición. Aunque las tasas de IMPP fueron numéricamente más bajas (7,3 frente al 4,9%), la diferencia no fue estadísticamente significativa (p = 0,464).
La evidencia sobre PI más altas en las prótesis balón-expandibles es contradictoria. Aunque algunos estudios sugieren tasas más bajas de IMPP y alteraciones de la conducción, análisis recientes confirman similitudes entre la TIA y la TIC. No obstante, en la mayoría de los casos, existe, como mínimo, una tendencia hacia menos IMPP, tasas de complicaciones bajas e índices altos de éxito con la TIA. Necesitamos estudios prospectivos más extensos que nos ayuden a determinar con precisión los resultados que se consiguen con la TIA en este tipo de prótesis.
DESVENTAJAS DE LA SUPERPOSICIÓN DE CÚSPIDES Y MENOR PROFUNDIDAD DE IMPLANTE
La TSC es una técnica segura y viable que requiere modificaciones mínimas a la intervención estándar para la mayoría de THV disponibles en el mercado. Esta proyección facilita el AC y proporciona una mejor orientación visual para obtener una PI óptima, reduciendo las alteraciones de la conducción y el IMPP. Aunque la mayoría de los estudios no han informado diferencias significativas en las tasas de complicaciones, debemos tener en cuenta varias cuestiones. La embolización de la válvula es una complicación potencialmente grave con un riesgo de < 1%. Los operadores deben ser hábiles e ingeniosos en el manejo de esta complicación y liberar la válvula de forma segura en la aorta mientras preparan una segunda THV para su colocación. En pacientes con una menor carga de calcio y sin alteraciones previas de la conducción, como es el caso de pacientes más jóvenes, el beneficio de una menor PI debe sopesarse ante el posible riesgo de embolización de la válvula. Otro riesgo asociado a una menor PI es que podría dificultar la correcta canalización de las coronarias en futuras intervenciones.
En segundo lugar, una menor PI podría complicar el acceso coronario y, de hecho, se ha identificado como un predictor de sondajes fallidos. Aunque este riesgo podría mitigarse con el AC, existe el riesgo de que un implante alto de la válvula obstruya los ostia coronarios, lugar en el que la falda pericárdica cubre la entrada de la armadura, lo cual acarrea el riesgo taponamiento de las arterias nativas. De hecho, en los pacientes más jóvenes que pudiesen necesitar un implante percutáneo de válvula en válvula en el futuro, un implante alto podría ser un obstáculo para segundas intervenciones porque los velos de la primera válvula podrían crear una nueva falda con el potencial riesgo de obstrucción de los ostia coronarios35.
Además, los pacientes con reemplazo previo de la válvula aórtica corren un menor riesgo de IMPP tras un nuevo TAVI, un riesgo mucho mayor de obstrucción coronaria, sobre todo, aquellos con senos de Valsalva estrechos y ostia coronarios más bajos. En estos pacientes, intentar una menor PI podría no dar mejores resul- tados.
EL ALINEAMIENTO COMISURAL
Una de las principales preocupaciones a la hora de hacer extensiva la indicación del TAVI a pacientes más jóvenes y de bajo riesgo es la viabilidad del acceso coronario pos-TAVI, principalmente porque quizás sea necesaria una intervención coronaria percutánea, lo cual pone de manifiesto la importancia práctica que tiene lograr el AC. Además, las cuestiones de durabilidad y la posibilidad de un nuevo TAVI resultan esenciales ante una posible ampliación de las indicaciones a pacientes más jóvenes35.
El concepto de AC ha ido ganando relevancia durante los últimos años, lo cual ha conllevado mejoras en el diseño de las últimas generaciones de válvulas para facilitar este logro35. Datos de TCMC de estudios sin una técnica intencionada de AC revelan que aproximadamente el 80% de los pacientes tratados mediante TAVI presentan mal alineamiento comisural (MAC)36. Alrededor del 13% de los pacientes de bajo riesgo tratados de TAVI con prótesis balón-expandibles tenía un poste comisural que obstruía el ostium coronario. Las tasas de MAC llegan al 16% en el TAVI autoexpandible37. En el reciente estudio RE-ACCESS, Barbanti et al.38 aseguraron que solo el 7,7% de los pacientes tuvieron sondaje de las arterias coronarias fallido tras el TAVI.
El consorcio ALIGN-TAVI definió el AC en base al ángulo descrito entre las comisuras de la válvula nativa y la nueva. La definición de AC se estableció en diferentes categorías: alineamiento comisural (desviación angular < 15°), MAC leve (15°-30°), MAC moderado (30°-45°) y MAC grave (> 45°) (figura 3)39.
Figura 3. Tutorial paso a paso para alineamientos comisurales en válvulas autoexpandibles. A: válvula Evolut FX. En primer lugar, se coloca el puerto de lavado en la posición de las 3 en punto. La banda de marcaje en forma de sombrero se debe colocar mirando a la curvatura externa mientras se avanza la válvula por la aorta descendente. Después, durante la fase de liberación de la válvula, la banda debe mirar a la CNC. Por último, 2 de los marcadores radiopacos de la válvula Evolut FX deben verse en el lado izquierdo de la pantalla y el tercero en el lado derecho. B: válvula Acurate Neo2. En primer lugar, insertar la válvula con el puerto de lavado en la posición de las 6 en punto. Después, girar el catéter de liberación en sentido contrario al de las ajugas del reloj. Por último, durante la fase de despliegue de la válvula, deben verse 2 postes radiopacos en la curva mayor de la aorta y el tercero en el otro lado. Empleando la técnica clásica de implante, 1 poste debe visualizarse en el centro del anillo aórtico y los otros 2 a cada lado. TIC: técnica de implante clásica; TSC: técnica de superposición de cúspides.
El alineamiento comisural en válvulas autoexpandibles
Válvulas Evolut R, Evolut PRO, Evolut PRO+, Evolut FX de Medtronic
La mejor técnica para el AC comienza con un análisis preoperatorio mediante TCMC para seleccionar una proyección fluoroscópica específica de cada paciente. La técnica más comúnmente empleada para la válvula autoexpandible de Medtronic comienza con el puerto de lavado dirigido hacia las 3. La banda de marcaje en forma de sombrero se debe colocar mirando a la curvatura externa mientras se avanza la válvula por la aorta descendente. Durante la liberación en TSC visualizaremos los marcajes de las comisuras izquierda y derecha de la THVsuperpuestos en el lado derecho de la pantalla y el marcaje en forma de sombrero mirando a la CNC (en algunos casos, puede situarse en el centro). La última versión de la válvula Evolut FX incorpora 3 marcajes en el segmento de entrada de la falda de la válvula, correspondientes a cada comisura que mejoran el plano fluoroscópico y acarrean menos casos de MAC (figura 3)39.
ACURATE neo2
La técnica para el AC de la plataforma ACURATE neo2 es distinta. La inserción debe realizarse con el puerto de lavado en la posición de las 6. La THV incorpora 3 postes radiopacos que marcan cada comisura. El AC correcto puede garantizarse mediante fluoroscopia girando el catéter de liberación en sentido contrario al de las agujas del reloj. En la TSC, se deben superponer 2 postes en la curvatura mayor de la aorta y el último en la curvatura menor. Empleando la TIC, 1 poste debe verse en la región central del anillo aórtico y los otros 2 a cada lado (figura 3)40-41.
El alineamiento comisural en prótesis balón-expandibles
Aunque hay muy pocas evidencias concluyentes sobre esta cuestión, sí existen métodos ampliamente empleados para lograr el AC con THV balón-expandibles. Un pequeño estudio de Santos-Martínez et al.42 evaluó la viabilidad del AC con la válvula Myval (Meril Life Sciences Pvt. Ltd, India). Se simuló el TAVI preoperatorio mediante TCMC en un modelo in silico para predecir la rotación óptima de la válvula para lograr el AC usando un script autodesarrollado. Después, se crimparon las válvulas Myval en la rotación predicha por el citado modelo in silico para evitar el MAC. Esta estrategia se probó en 10 pacientes, 4 de los cuales solo mostraron un MAC leve y ninguno MAC moderado o grave. El ángulo medio del MAC fue de 16,7°. Aunque los resultados son prometedores, el hecho de que se necesite un modelo in silico antes de la intervención limita el uso de esta técnica.
REACCESO CORONARIO
Estudios recientes sobre reaccesos coronarios tras el TAVI en pacientes sin AC revelan que la tasa de sondaje coronario selectivo fallido está en torno al 7,7%38. Tarantini et al.43 compararon las válvulas Sapien con las válvulas supra-anulares autoexpandibles alineadas y no alineadas Evolut R/PRO y ACURATE Neo. Estos autores observaron que solo el 5% de aquellos pacientes que recibieron las válvulas Sapien 3 tenían accesos coronarios no selectivos y ningún paciente accesos coronarios inviables. No obstante, en las THV auto- expandibles, el grupo tratado con la técnica comisural no alineada mostró tasas de abordaje no selectivo y abordaje inviable del 43 y 11%, respectivamente. En cambio, solo el 3% del grupo con AC tenía abordajes inviables y el 26% con abordajes no selectivos43.
Los predictores más habituales de un acceso coronario fallido son la propia anatomía del paciente (seno de Valsalva estrecho), el tipo de THV (prótesis autoexpandibles) y la técnica TAVI empleada (menor PI). Respecto a la anatomía del paciente, la simetría de la cúspide y la excentricidad de los ostia coronarios son claves para predecir la viabiliad del AC y un posible reacceso coronario38. A pesar de lograr el AC, algunos pacientes presentan excentricidad coronaria o asimetría de las cúspides en quienes el AC no evita la obstrucción del ostium coronario por el poste de la THV, un fenómeno que suele observarse en pacientes con válvulas bicúspides, de ahí que se acuñara el término alineamiento coronario (figura 4).
Figura 4. Principales predictores de un acceso coronario deteriorado. THV: prótesis valvular cardiaca percutánea.
En un estudio que analizó 1.851 tomografías computarizadas de pacientes tratados mediante TAVI, se colocaron válvulas virtuales simulando tanto el AC como el alineamiento coronario en la raíz aórtica para valorar el solapamiento coronario moderado y grave provocado por el poste de la THV. Los hallazgos revelaron que un mal alineamiento coronario grave es raro en presencia de AC y que el alineamiento coronario solo mejoró el solapamiento del ostium derecho (coronario: 0,52%, izquierdo; 0,52%, derecho; comisural: 0,30%, izquierdo; 3,27%, derecho). La incidencia de no solapamiento con el ostium coronario izquierdo fue menor en el grupo con AC que en aquel con alineamiento coronario por la mayor prevalencia de excentricidad del ostium coronario derecho; el alineamiento intencionado con el ostium coronario derecho podría aumentar el riesgo de solapamiento con el ostium coronario izquierdo. La prevalencia de asimetría y excentricidad coronaria fue baja44.
HEMODINÁMICA VALVULAR: RENDIMIENTO Y DURABILIDAD
Obtener mejores resultados hemodinámicos es importante ya que las indicaciones para TAVI se amplían para incluir a pacientes más jóvenes y de bajo riesgo. Fuch et al.43 compararon válvulas aórticas quirúrgicas con TAVI y realizaron una tomografía computarizada (TC) tras el TAVI. Estos autores dividieron a los participantes en grupos según el AC pero no observaron ninguna diferencia en los gradientes transvalvulares, el llenado coronario o la FPP. Confirmaron, no obstante, un aumento significativo de la insuficiencia aórtica central.
Un estudio retrospectivo incluyó a un total 324 pacientes implantados aleatoriamente con una THV balón-expandible. Se realizó una TCMC pos-TAVI para definir el MAC moderado como desviaciones > 30°. El MAC pudo confirmarse en el 52,8% de estos pacientes. A los 30 días, no se observó ninguna diferencia entre pacientes con y sin MAC en lo que se refiere a las tasas de insuficiencia aórtica, gradientes transvalvulares o gradientes residuales significativos. Por su parte, la incidencia de IMPP y los resultados clínicos a largo plazo, incluida la muerte y el accidente cerebrovascular, tampoco variaron entre ambos grupos46.
El MAC se ha asociado a cambios en los patrones de flujo, a un mayor estrés de las valvas y, por ende, a un mayor riesgo de trombosis de estas. En este sentido, la detección del engrosamiento hipoatenuado de las valvas (HALT) en TC ha llamado cada vez más la atención de estudios recientes al ser ya un marcador de la trombosis subclínica de las valvas y poder predecir la durabilidad de la válvula39. Un estudio de casos y controles que comparó el AC en pacientes con y sin HALT (85 pacientes por grupo) confirmó la presencia de MAC grave en el 32% de los pacientes con HALT por solo el 17,2% de aquellos sin HALT47.
REDO-TAVI
Aunque las indicaciones para el TAVI se han ido ampliado, sobre todo en pacientes más jóvenes y de bajo riesgo, son pocos los datos de que disponemos sobre implantes de TAVI sobre TAVI. Según el importante análisis del registro EXPLANTOR-REDO-TAVR, las tasas de mortalidad a 30 días y 1 año fueron menor en pacientes con redo-TAVI, no observándose ninguna diferencia en la tasa de mortalidad a 4 años. Se puede argumentar que el RQVA debería reservarse para situaciones específicas tales como FPP o anatomías desfavorables para realizar el redo-TAVI y que el TAVI sobre TAVI experimentará un crecimiento exponencial en los próximos años48.
El principal problema del redo-TAVI es el riesgo de oclusión coronaria asociado y la dificultad potencial de reacceso coronario tras la intervención. Los modelos predictivos basados en TC sugieren un mayor riesgo de oclusión coronaria en pacientes sin AC. Buzzati et al.49 informaron que entre el 10 y el 20% de los redo-TAVI acarrean un mayor riesgo de oclusión coronaria y más de un 50% se asocian a accesos coronarios deteriorados. Otro estudio que empleó datos de TC pos-TAVI con las válvulas Evolut y Sapien predijo que el 45,5 y 2%, respectivamente, de los pacientes implantados con las válvulas Evolut y Sapien corrían riesgo de obstrucción coronaria por el secuestro de los senos de Valsalva; riesgo que se predijo en base a la distancia entre las válvulas y unión sinotubular21.
La experiencia con implantes percutáneos válvula en válvula se basa en THV implantadas dentro de válvulas quirúrgicas pre-implantadas con AC. En cambio, la mayoría de las THV degeneradas se implantaron sin tener en cuenta el AC. Técnicas agresivas tales como la técnica BASILICA, que permiten modificar las valvas para minimizar el riesgo de oclusión coronaria, resultan menos efectivas que las empleadas con válvulas quirúrgicas22.
CONCLUSIONES
En resumen, el papel que juega la proyección del implante en la optimización del TAVI podría minimizar los inconvenientes más habituales asociados a esta intervención. Existen abundantes evidencias que avalan los posibles beneficios de la TSC a la hora de reducir los trastornos de la conducción y la necesidad de IMPP con solo hacer pequeñas modificaciones durante el implante sin mayores riesgos frente a la TIC.
El riesgo de trastornos de la conducción e IMPP es un obstáculo importante tras el TAVI. Se requiere un estudio meticuloso mediante TCMC y planificación preoperatoria para seleccionar la estrategia correcta para cada paciente. En última instancia, el riesgo-beneficio de una menor PI usando la TSC debe adaptarse a las características de cada paciente. La técnica debería fomentarse en pacientes de alto riesgo de IMPP y desaconsejarse en aquellos de alto riesgo de obstrucción coronaria y una mayor carga de enfermedad coronaria. No obstante, en la mayoría de los pacientes, sobre todo cuando se emplean prótesis autoexpandibles, debería clasificarse como la proyección estándar para la liberación de la válvula.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial en la preparación de esta revisión.
AUTHORS’ CONTRIBUTIONS
Redacción del borrador original: R. Álvarez Velasco and M. Almendárez. Adquisición y edición de imagen: R. del Valle and A. Alperi. Revisión crítica: P. Antuña and I. Pascual. Aprobación final: I. Pascual.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Ferrer-Sistach E, Teis A, Bayés-Genís A, Delgado V. Multimodality imaging in aortic stenosis:new diagnostic and therapeutic frontiers. Rev Esp Cardiol. 2023;76:40-46.
2. D'Arcy JL, Coffey S, Loudon MA, et al. Large-scale community echocardiographic screening reveals a major burden of undiagnosed valvular heart disease in older people:the OxVALVE Population Cohort Study. Eur Heart J. 2016;37:3515-3522.
3. Nguyen V, Willner N, Eltchaninoff H, et al. Trends in aortic valve replacement for aortic stenosis:a French nationwide study. Eur Heart J. 2022;43:666-679.
4. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
5. Pinar E, García de Lara J, Hurtado J, et al. Cost-effectiveness analysis of the SAPIEN 3 transcatheter aortic valve implant in patients with symptomatic severe aortic stenosis. Rev Esp Cardiol. 2022;75:325-333.
6. García-Carreño J, Zatarain E, Tamargo M, Elízaga J, Bermejo J, Fernández-Avilés F. Feasibility and safety of early discharge after transcatheter aortic valve implantation. Rev Esp Cardiol. 2023;76:660-663.
7. Freixa X, Jurado-Román A, Cid B, Cruz-González I. Spanish cardiac catheterization and coronary intervention registry. 31st official report of the Interventional Cardiology Association of the Spanish Society of Cardiology (1990-2021). Rev Esp Cardiol. 2022;75:1040-1049.
8. Aurigemma C, Giannico MB, Burzotta F, et al. Clinical impact of the extent of jeopardized myocardium in patients undergoing transcatheter aortic valve intervention. Rev Esp Cardiol. 2023;76:157-164.
9. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement in Low-Risk Patients at Five Years. N Engl J Med. 2023;389:1949-1960.
10. Van Mieghem NM, Deeb GM, Sondergaard L, et al. Self-expanding Transcatheter vs Surgical Aortic Valve Replacement in Intermediate-Risk Patients:5-Year Outcomes of the SURTAVI Randomized Clinical Trial. JAMA Cardiol. 2022;7:1000-1008.
11. Rodés-Cabau J, Ellenbogen KA, Krahn AD, et al. Management of Conduction Disturbances Associated With Transcatheter Aortic Valve Replacement:JACC Scientific Expert Panel. J Am Coll Cardiol. 2019;74:1086-1106.
12. Breitbart P, Minners J, Hein M, Schröfel H, Neumann FJ, Ruile P. Implantation depth and its influence on complications after TAVI with self-expanding valves. Int J Cardiovasc Imaging. 2021;37:3081-3092.
13. Jilaihawi H, Zhao Z, Du R, et al. Minimizing Permanent Pacemaker Following Repositionable Self-Expanding Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2019;12:1796-1807.
14. Ben-Shoshan J, Alosaimi H, Lauzier PT, et al. Double S-Curve Versus Cusp-Overlap Technique:Defining the Optimal Fluoroscopic Projection for TAVR With a Self-Expanding Device. JACC Cardiovasc Interv. 2021;14:185-194.
15. Tang GHL, Zaid S, Michev I, et al. “Cusp-Overlap“View Simplifies Fluoroscopy-Guided Implantation of Self-Expanding Valve in Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2018;11:1663-1665.
16. Gada H, Vora A, Siddique S, et al. TCT CONNECT-457 Reduction of Rates of Permanent Pacemaker Implantation With 34-MM Evolut R Using Cusp Overlap Technique. J Am Coll Cardiol. 2020;76(Suppl. S):B196.
17. Pascual I, Almendárez M, Avanzas P, et al. Cusp-overlapping TAVI technique with a self-expanding device optimizes implantation depth and reduces permanent pacemaker requirement. Rev Esp Cardiol. 2022;75:412-420.
18. Pascual I, Hernández-Vaquero D, Alperi A, et al. Permanent Pacemaker Reduction Using Cusp-Overlapping Projection in TAVR:A Propensity Score Analysis. JACC Cardiovasc Interv. 2022;15:150-161.
19. Mendiz OA, NocˇM, Fava CM, et al. Impact of Cusp-Overlap View for TAVR with Self-Expandable Valves on 30-Day Conduction Disturbances. J Circ Interv Cardiol. 2021;9991528.
20. Meier D, Tzimas G, Akodad M, et al. TAVR in TAVR:Where Are We in 2023 for Management of Failed TAVR Valves? Curr Cardiol Rep. 2023;25:1425-1431.
21. Ochiai T, Yamanaka F, Shishido K, et al. Impact of High Implantation of Transcatheter Aortic Valve on Subsequent Conduction Disturbances and Coronary Access. JACC Cardiovasc Interv. 2023;16:1192-1204.
22. Merdler I, Case B, Bhogal S, et al. Early experience with the Evolut FX self-expanding valve vs. Evolut PRO+for patients with aortic stenosis undergoing TAVR. Cardiovasc Revasc Med. 2023;56:1-6.
23. Khera S, Krishnamoorthy P, Sharma SK, et al. Improved Commissural Alignment in TAVR With the Newest Evolut FX Self-Expanding Supra-Annular Valve:First-in-Human Experience. JACC Cardiovasc Interv. 2023;16:498-500.
24. Michel Pompeu S, Van den Eynde J, Jacquemyn X, et al. Cusp-overlap versus coplanar view in transcatheter aortic valve implantation with self-expandable valves:A meta-analysis of comparative studies. Catheter Cardiovasc Interv. 2023;101:639-650.
25. Wienemann H, Maier O, Beyer M, et al. Cusp overlap versus standard three-cusp technique for self-expanding Evolut transcatheter aortic valves. EuroIntervention. 2023;19:E176-E187.
26. Grubb KJ, Gada H, Mittal S, et al. Clinical Impact of Standardized TAVR Technique and Care Pathway:Insights From the Optimize PRO Study. JACC Cardiovasc Interv. 2023;16:558-570.
27. Kim WK, Toggweiler S, Renker M, et al. Comparison of 3-Cusp Coplanar and 2-Cusp Overlap Views for the Implantation of a Self-Expanding Transcatheter Heart Valve. JACC Cardiovasc Interv. 2023;16:1422-1424.
28. Meduri CU, Rück A, Linder R, et al. Commissural Alignment With ACURATE neo2 Valve in an Unselected Population. JACC Cardiovasc Interv. 2023;16:670-677.
29. Asmarats L, Gutiérrez-Alonso L, Nombela-Franco L, et al. Cusp-overlap technique during TAVI using the self-expanding Portico FlexNav system. Rev Esp Cardiol. 2023;76:767-773.
30. Kim WK. The cusp overlap technique for the Portico valve:it works! Rev Esp Cardiol. 2023;76:755-756.
31. Wang X, Wong I, Bajoras V, et al. Impact of implantation technique on conduction disturbances for TAVR with the self-expanding portico/navitor valve. Catheter Cardiovasc Interv. 2023;101:431-441.
32. Sammour Y, Banerjee K, Kumar A, et al. Systematic Approach to High Implantation of SAPIEN-3 Valve Achieves a Lower Rate of Conduction Abnormalities Including Pacemaker Implantation. Circ Cardiovasc Interv. 2021;14:E009407.
33. Stephan T, Krohn-Grimberghe M, von Lindeiner Genannt von Wildau A, et al. Cusp-overlap view reduces conduction disturbances and permanent pacemaker implantation after transcatheter aortic valve replacement even with balloon-expandable and mechanically-expandable heart valves. Front Cardiovasc Med. 2023;10:1269833.
34. Siddique S, Khanal R, Vora AN, Gada H. Transcatheter Aortic Valve Replacement Optimization Strategies:Cusp Overlap, Commissural Alignment, Sizing, and Positioning. US Cardiology Review. 2022;16:e10.
35. Barbanti M, Valvo R, Costa G. Predicting neocommissural orientation during TAVI workup. Rev Esp Cardiol. 2022;75:194-195.
36. Tang GHL, Zaid S, Fuchs A, et al. Alignment of Transcatheter Aortic-Valve Neo-Commissures (ALIGN TAVR):Impact on Final Valve Orientation and Coronary Artery Overlap. JACC Cardiovasc Interv. 2020;13:1030-1042.
37. Lim Y, Tan KA, Kuntjoro I, Hon JKF, Yip J, Tay E. Coronary Artery Disease in Patients Undergoing Transvalvular Aortic Valve Implantation. Interventional Cardiology: Reviews, Research, Resources. Circ Interv Cardiol. 2022;17:e13.
38. Barbanti M, Costa G, Picci A, et al. Coronary Cannulation After Transcatheter Aortic Valve Replacement:The RE-ACCESS Study. JACC Cardiovasc Interv. 2020;13:2542-2555.
39. Tang GHL, Amat-Santos IJ, De Backer O, et al. Rationale, Definitions, Techniques, and Outcomes of Commissural Alignment in TAVR:From the ALIGN-TAVR Consortium. JACC Cardiovasc Interv. 2022;15:1497-1518.
40. Redondo A, Santos-Martínez S, Delgado-Arana R, Baladrón Zorita C, San Román JA, Amat-Santos IJ. Fluoroscopic-based algorithm for commissural alignment assessment after transcatheter aortic valve implantation. Rev Esp Cardiol. 2022;75:185-188.
41. Redondo A, Valencia-Serrano F, Santos-Martínez S, et al. Accurate commissural alignment during ACURATE neo TAVI procedure. Proof of concept. Rev Esp Cardiol. 2022;75:203-212.
42. Santos-Martínez S, Redondo A, González-Bartol E, et al. Feasibility of precise commissural and coronary alignment with balloon-expandable TAVI. Rev Esp Cardiol. 2023;76:19-24.
43. Tarantini G, Nai Fovino L, Scotti A, et al. Coronary Access After Transcatheter Aortic Valve Replacement With Commissural Alignment:The ALIGN-ACCESS Study. Circ Cardiovasc Interv. 2022;15:E011045.
44. Vinayak M, Tang GHL, Li K, et al. Commissural vs Coronary Alignment to Avoid Coronary Overlap With THV-Commissure in TAVR:A CT-Simulation Study. JACC Cardiovasc Interv. 2024;17:715-726.
45. Fuchs A, Kofoed KF, Yoon SH, et al. Commissural Alignment of Bioprosthetic Aortic Valve and Native Aortic Valve Following Surgical and Transcatheter Aortic Valve Replacement and its Impact on Valvular Function and Coronary Filling. JACC Cardiovasc Interv. 2018;11:1733-1743.
46. Raschpichler M, Flint N, Yoon SH, et al. Commissural Alignment After Balloon-Expandable Transcatheter Aortic Valve Replacement Is Associated With Improved Hemodynamic Outcomes. JACC Cardiovasc Interv. 2022;15:1126-1136.
47. Jung S, Ammon F, Smolka S, Moshage M, Marwan M, Achenbach S. Commissural misalignment independently predicts leaflet thrombosis after transcatheter aortic valve implantation. Clin Res Cardiol. 2024;113:29-37.
48. Tang GHL, Zaid S, Kleiman NS, et al. Explant vs Redo-TAVR After Transcatheter Valve Failure:Mid-Term Outcomes From the EXPLANTORREDO-TAVR International Registry. JACC Cardiovasc Interv. 2023;16:927-941.
49. Buzzatti N, Montorfano M, Romano V, et al. A computed tomography study of coronary access and coronary obstruction after redo transcatheter aortic valve implantation. EuroIntervention. 2020;16:E1005-E1013.
RESUMEN
La evaluación funcional de las estenosis coronarias para guiar los procedimientos de intervencionismo coronario percutáneo se realiza frecuentemente midiendo la reserva fraccional de flujo durante la hiperemia inducida por adenosina o trifosfato de adenosina. Las contraindicaciones de estos estímulos hiperémicos y la posibilidad de que se produzca daño vascular con la guía de presión pueden limitar la utilización de la reserva fraccional de flujo. Esta revisión discute los métodos alternativos de evaluación funcional: diferentes agentes hiperémicos, índices no hiperémicos e índices angiográficos.
Palabras clave: Angiografía. Reserva fraccional de flujo. Hiperemia. Intervención coronaria percutánea.
ABSTRACT
Assessment of the functional significance of coronary artery stenoses to guide percutaneous coronary intervention is widely performed using pressure wire fractional flow reserve during adenosine- or adenosine triphosphate-induced hyperemia. However, the use of fractional flow reserve may be limited by the contraindications and adverse effects of this hyperemic stimulus, as well as the potential risk of vessel damage from the pressure wire. This review will discuss alternative evaluation methods, including various hyperemic agents, nonhyperemic pressure ratios, and angiography-based indices.
Keywords: Angiography. Fractional flow reserve. Hyperemia. Percutaneous coronary intervention.
Abreviaturas GP: guía de presión. ICP: intervención coronaria percutánea. iFR: índice diastólico instantáneo sin ondas. NHPR: cociente de presión no hiperémico. CFC: cociente de flujo cuantitativo. RFF: reserva fraccional de flujo.
INTRODUCCIÓN
La importancia funcional de las estenosis coronarias se suele valorar utilizando la reserva fraccional de flujo (RFF) para medir la presión más allá de la estenosis mediante una guía de presión (GP) durante hiperemia inducida por adenosina o trifosfato de adenosina (ATP). El uso de la RFF puede verse limitado por las contraindicaciones y reacciones adversas de este estímulo hiperémico, así como por la posibilidad de dañar el vaso con la GP, a pesar de tener una recomendación de clase 1 para guiar la revascularización de los síndromes coronarios crónicos1. En este sentido, con el tiempo han ido apareciendo diferentes fármacos hiperémicos y métodos alternativos. Esta revisión se centra en: a) las características más importantes de los agentes hiperémicos y b) la precisión diagnóstica y los da- tos de resultados tanto del cociente de presión no hiperémico (NHPR) como de los índices angiográficos.
AGENTES HIPERÉMICOS
El flujo coronario es el determinante crítico de la isquemia y, en reposo, se controla para igualar la demanda de oxígeno del miocardio y contrarrestar las variaciones de la presión de perfusión coronaria mediante cambios paralelos en la resistencia microvascular, resultando en una meseta autorreguladora. En hiperemia máxima, la relación entre el flujo coronario y la presión es curvilínea: recta dentro del rango de presión fisiológica y curva hacia el eje de presión a presiones más bajas2.
Teniendo en cuenta este vínculo, se emplea el cociente entre la presión coronaria distal media y la presión aórtica media en situación de hiperemia máxima (RFF) para calcular la relación entre el flujo máximo en coronarias estenóticas y el flujo máximo en coronarias sanas.
En estudios con animales, la papaverina resultó ser el vasodilatador farmacológico más potente, un hallazgo que, también, se confirmó en humanos. No obstante, a la luz de sus reacciones adversas, se procedió a validar la adenosina3. Después, la adenosina o el ATP se han ido empleando ampliamente en estudios clínicos que valoraron la utilidad de la RFF (por ejemplo, los ensayos DEFER, FAME, FAME-2).
En consecuencia, se recomienda el uso de adenosina o ATP salvo que los pacientes tomen cafeína (un antagonista competitivo de todos los subtipos de receptores de adenosina) en un plazo de 24 horas o tengan contraindicaciones (como, por ejemplo, asma y disfunción del nódulo sinoauricular o auriculoventricular)4; en tales casos, otros fármacos o el NHPR son especialmente útiles. Las características más importantes de los agentes hiperémicos investigados para calcular la RFF se muestran en la tabla 1 y a continuación.
Tabla 1. Características de los agentes hiperémicos
| Tipo de agente | Mecanismo de acción | Necesidad de suspender la cafeína ≈ 24 h antes | Dosis estándar | Vía de administración | Eficacia vasodilatadora | Principales efectos adversos | Tiempo trascurrido hasta lograr la hiperemia máxima (seg)* | Fase de meseta de la hiperemia (seg)* | Agente de reversión |
|---|---|---|---|---|---|---|---|---|---|
| Papaverina | Bloqueo de AMPc y GMPc | No | [12 mg (DA), 8 mg (CD)]5 | ic | > | Taquiarritmia ventricular (fibrilación ventricular 1,7%)5 | Ligeramente por debajo de 50 seg [respecto a una dosis de 12 a 16 mg (DA), 8 a 12 mg (CD)]6 | 44 [respecto a una dosis de 12 a 16 mg (DA), 8 a 12 mg (CD)]6 | No |
| Adenosina | Estimulación no selectiva de los receptores P1 (A1, A2A, A2B y A3) | Sí | 160 a 200 µg (DA), 60 a 100 µg (CD)7 | ic | ≃ | Bloqueo AV transitorio (completo 11,6%)8 | 15 [respecto a una dosis de 20 o 40 µg]9 | 21 [respecto a una dosis de 200 ug (DA)]7 | No |
| 21 [respecto a una dosis de 200 ug (CD)]7 | |||||||||
| 140 µg/kg/min8 | iv | ≃ | Bloqueo AV transitorio (completo 4,4%)8 Dolor torácico Disnea Rubor Náuseas8 | [80 (VF), 112 (VP)]9 | Dependiendo de la duración de la infusión | ||||
| Trifosfato de adenosina | Estimulación de los receptores P2 | Sí | 150 µg/kg/min10 | iv | ≃ | Bloqueo AV transitorio Dolor torácico Disnea Rubor11 | [76 (VF), 104 (VP)] (respecto a una dosis de 140 µg/kg/min)9 | Dependiendo de la duración de la infusión | No |
| Nitroprusiato de sodio | Inducción de óxido nítrico | No | [50 o 100 ug o 0,6 µg/kg]12 | ic | ≃ | Hipotensión sintomática (4%)13 | Alrededor de 15 [respecto a una dosis de 0,6 µg/kg]14 | 51 [respecto a una dosis de 0,6 µg/kg]14 | No |
| Regadenosón | Estimulación selectiva del receptor P1 A2A | Sí | 400 µg15 | iv | ≃ | [Dolor torácico (20%) Rubor (16%) Cefalea (16%) Disnea (4%)]16 | 34-5915 | 10-60015 | Sí (150 mg de aminofilina bolus IV) |
| Nicorandil | Apertura de los canales de potasio sensibles al ATP | No | 2 mg4 | ic | ≃ | Dolor torácico/disnea (5%)10 | 17-1817,18 | 27-3217,18 | No |
| Introducción de óxido nítrico | |||||||||
| Nicardipino | Bloqueador de los canales de calcio | No | 200 µg19 | ic | ≃ | [Dolor torácico (10%) Rubor (4%)]19 | 1319 | 14319 | No |
|
AMPc: adenosinmonofosfato cíclico; ATP: trifosfato de adenosina; AV: aurículoventricular; CD: coronaria derecha; DA descendente anterior; GMPc: monofosfato de guanosina cíclico; ic: intracoronario; iv: intravenoso; P: purinérgico; VF: vena femoral; VP: vena periférica. * Si no se especifica, las características de la hiperemia se refieren a la dosis estándar del agente hiperémico. |
|||||||||
Papaverina
Eficacia
Aunque falta una comparativa de los agentes hiperémicos a nivel general, ha quedado demostrado que la papaverina (utilizada en dosis estándar o más altas) es un vasodilatador más potente que el ATP o el nicorandil; la diferencia media de la RFF fue de 0,01 (p = 0,01, n = 50)11 y 0,016 (p < 0,001, n = 40)4, respectivamente.
En un grupo de 115 pacientes, tras emplear las dosis estándar y más altas de papaverina, los valores de la RFF no mostraron ninguna diferencia significativa5.
Reacciones adversas
El principal efecto adverso de la papaverina, la taquiarritmia ventricular, se asocia a la prolongación del intervalo QTU. Los factores de riesgo para su desarrollo son el género (femenino), la hipopotasemia y la alcalosis5.
Características de la hiperemia
Las características de la hiperemia se evaluaron en 46 pacientes sin comparación con otros agentes: a la papaverina le costó 12 segundos alcanzar el 90% del inicio hiperémico y cerca de 50 el inicio máximo6.
Adenosina
En el músculo liso vascular, la adenosina se fija a los receptores purinérgicos tipo 1 (subtipo A2A), que se acoplan a las proteínas Gs, acoplamiento que provoca el correspondiente aumento de monofosfato de adenosina cíclico, la activación de la proteína quinasa y los canales de potasio rectificadores de entrada (Kir) provocando vasodilatación.
La adenosina está disponible comercialmente en viales de 6 y 30 mg. Comparado con la vía intracoronaria (ic), la vía intravenosa (iv) requiere dosis más altas lo cual eleva los costes8; además, se tarda más tiempo en su preparación.
Eficacia
Según un metanálisis de 11 estudios (n = 587), cuando se utilizaron dosis altas (120-600 μg) de adenosina ic, no se observó ninguna diferencia media significativa de la RFF comparado con la adenosina IV, que se infundió a una velocidad de entre 140 (la tasa de infusión más utilizada) y 200 μg/kg/min8.
Hay incertidumbre en torno a cuál es la dosis óptima necesaria para lograr una hiperemia máxima con adenosina ic: por ejemplo, Leone et al.13 y De Luca et al.20 confirmaron que existe una relación dosis-respuesta entre los valores de la RFF y adenosina ic de hasta 600 y 720 μg, respectivamente.
Adjedj et al.7 sugirieron un rango inferior de dosis ic, permitiendo hasta un 98% de hiperemia máxima, lo cual representaría el mejor compromiso entre precisión diagnóstica y seguridad (ver “dosis estándar” en la tabla 1).
Reacciones adversas
El bloqueo AV completo, aunque transitorio, es más habitual con dosis altas (> 100 μg) de adenosina ic que con la infusión IV8. Por otro lado, las reacciones adversas sistémicas son más habituales con la adenosina IV8.
Características de la hiperemia
Los tiempos para alcanzar el 100% de hiperemia con adenosina (ic e iv), papaverina y ATP fueron analizados en un estudio realizado por De Bruyne et al.9 (n = 21), que confirmaron que la adenosina iv tuvo el tiempo más largo, mientras que la fase de meseta de la hiperemia fue corta para la vía ic; es decir, esta vía no es la más adecuada para realizar maniobras de retirada de la guía de presión. Estas últimas son importantes para valorar la presencia de estenosis en tándem o aterosclerosis coronaria focal frente a difusa (esta última se asocia no solo a resultados subóptimos de la intervención coronaria percutánea [ICP] sino a más angina) y, en consecuencia, tomar decisiones en torno a la ICP21.
Trifosfato de adenosina
El ATP es un trifosfato de nucleósido que consta de adenosina (formada por la base nitrogenada adenina y un azúcar ribosa) y 3 grupos fosfato unidos en serie. El ATP se une a los receptores purinérgicos tipo 2 y determina las subidas de calcio intracelular en el endotelio vascular, lo cual, indirectamente, estimula los canales Kir del músculo liso. El ATP está disponible comercialmente en viales de 100 mg, lo cual facilita su administración y reduce costes comparado con la adenosina.
Eficacia
Como se muestra, ha quedado demostrado que el ATP IV es menos potente que la papaverina11. La eficacia del ATP IV fue similar a la de la adenosina iv9 y menor o similar a la del nicorandil10,17 (ver sección “Nicorandil”).
Efectos adversos, características de la hiperemia
Son similares a los de la adenosina IV9,11.
Nitroprusiato de sodio
Eficacia
En un metanálisis de 7 estudios (n = 342), el nitroprusiato de sodio (NPS) generó mediciones de RFF parecidas (diferencia media ponderada: 0,00) a las de la adenosina ic (dosis de 50 a 300 μg) o iv (dosis estándar); en los estudios incluidos, el NPS también se administró en diferentes dosis (ver “dosis estándar” en la tabla 1), lo cual podría haber influido en su eficacia12.
Reacciones adversas
En el metanálisis, se observó un descenso significativo de las reacciones adversas asociadas al NPS12.
Características de la hiperemia
En 40 pacientes, la duración media de la fase de meseta fue más larga para 0,6 μg/kg de NPS (51 segundos) que para 60 μg de adenosina (28 segundos)14.
Regadenosón
Eficacia
En un metanálisis de 5 estudios (248 pacientes tratados mediante angiografía electiva) que comparó regadenosón con adenosina iv (normalmente la dosis estándar), la diferencia media entre las mediciones de la RFF fue de 0,00115.
Reacciones adversas
Se observó una mayor incidencia de bloqueos transitorios de la conducción AV, dolor torácico, disnea, hipotensión, enrojecimiento y cefalea asociados a la adenosina15. Cuando se revirtió el regadenosón mediante aminofilina IV, no se observaron efectos adversos22.
Características de la hiperemia
Comparado con la adenosina IV, el regadenosón IV logró la hiperemia máxima unos 30 segundos antes. El menor tiempo hasta la RFF de los pacientes que recibieron regadenosón podría explicarse tanto por la dosis no ponderada de regadenosón IV como por su mayor vida media (de 2 a 4 minutos)15.
Por otro lado, la duración de la fase de meseta del regadenosón es variable, probablemente por el metabolismo del fármaco, lo cual es una limitación (que se suma a su elevado coste)15.
Nicorandil
Eficacia
En una cohorte combinada de 429 pacientes, la eficacia hiperémica de un bolo ic de nicorandil de 2 mg fue similar a la infusión IV de 140 μg/kg/min de adenosina o 150 μg/kg/min de ATP: la diferencia media de la RFF fue de 0,00217.
En un estudio unicéntrico (n = 207), el nicorandil de 2 mg fue incluso más efectivo a la hora de lograr la hiperemia máxima que el ATP 150 μg/kg/min; una posible explicación sería la administración de ATP a través de una vía IV periférica10.
Reacciones adversas
El nicorandil no provocó bloqueo AV y se asoció a menos dolor torácico que la adenosina o el ATP17,18.
Características de la hiperemia
El tiempo trascurrido hasta la RFF más baja fue menor que con la adenosina o el ATP IV17.
Nicardipina
Eficacia
Cuando se comparó la nicardipina con una dosis estándar de adenosina ic en 159 pacientes, la RFF fue algo mayor con nicardipina (diferencia mediana de 0,02, p = 0,246). Por su parte, el índice de vasos con una RFF < 0,80 fue del 28,5% con nicardipina y del 32,1% con adenosina (p = 0,016)19.
Reacciones adversas
La nicardipina provocó menos dolor torácico y enrojecimiento que la adenosina en ausencia de bloqueo AV19.
Características de la hiperemia
El tiempo trascurrido hasta la RFF más baja fue parecido en ambos fármacos y el tiempo de meseta de un bolo IC de nicardipina fue mucho mayor que con adenosina ic19.
Resumen
Comparada con la administración IV, la administración ic de vasodilatadores requiere dosis (y costes) más bajas y una preparación más corta hasta alcanzar la eficacia máxima; la única desventaja es que es más difícil mantener la hiperemia máxima, algo importante durante las maniobras de retirada.
A fin de poder valorar con precisión la importancia funcional, se sugiere emplear una adenosina, ATP o nicorandil (en caso de ingesta de cafeína dentro de una ventana de oportunidad de 24 horas o en presencia de contraindicaciones para la adenosina o el ATP) como fármacos de primera línea y dejar la papaverina para casos dudosos (RFF entre 0,81 y 0,85)4. En cualquier caso, el nicorandil tiene la limitación de su baja disponibilidad17.
Tanto el nicorandil como el NPS son alternativas de primera línea válidas a la adenosina o al ATP gracias a su perfil de seguridad y eficacia y características de hiperemia máxima inducida. El NPS tiene una fase de meseta de hiperemia más larga que el nicorandil (aunque todavía no se han realizado comparativas directas a este respecto). Además, la dosis adecuada de NPS todavía no se ha establecido.
Aunque la papaverina tiene una alta eficacia, su perfil de seguridad es poco favorable por lo que resulta útil, sobre todo, en casos dudosos (RFF entre 0,81 y 0,85) en ausencia de factores de riesgo de taquiarritmia ventricular.
El regadenosón (debido a la duración variable de la hiperemia máxima y los costes) y la nicardipina (debido a su eficacia ligeramente menor) parecen alternativas menos válidas.
INDICES DE PRESIÓN NO HIPERÉMICOS
Los NHPR se estudian con GP de 0,014 pulgadas o microcatéteres de presión (MP) y diferentes softwares en ausencia de agentes hiperémicos. Como son independientes de un estado de hiperemia estable, son útiles mientras se realizan maniobras de retirada.
Las definiciones de NHPR y algunas características de los dispositivos utilizados para calcularlos están disponibles en la tabla 2.
Tabla 2. Definiciones del NHPR y características de los dispositivos
| Tipo de NHPR | Definición | Periodo de cálculo | Dispositivo (última versión) | Fabricante | Localización del sensor (desde la punta)* | Tipo de sensor | Coregistro (angiografía e IVUS) |
|---|---|---|---|---|---|---|---|
| iFR | Cociente medio Pd/Pa23 | Subciclo diastólico (periodo libre de ondas) que comienza en el punto 25% de la diástole y termina 5 ms antes del final de la misma23 | GP: OmniWire | Philips (Países Bajos) | 3 cm | Piezoeléctrico (con bandas conductoras) | Sí (para IntraSight 7 Platform vía SyncVision) |
| Cociente Pd/Pa en reposo | Cociente Pd/Pa medio24 | Ciclo cardiaco completo24 | GP/MP | Tecnología no propietaria | NA | NA | NA |
| dPR | Cociente Pd/Pa medio25 | Diástole completa que comienza en el nadir de la muesca dicrótica y termina 50 ms antes de la aparición del siguiente latido25 | GP: OptoWire Deux | OpSens Medical (Canadá) | 3,5 cm | Óptico | No |
| RFR | Cociente Pd/Pa filtrado más bajo26 | Ciclo cardiaco completo26 | GP: PressureWire X | Abbott (Estados Unidos) | 3 cm | Piezoeléctrico | No |
| DFR | Cociente Pd/Pa medio (en 5 latidos)27 | Subciclo diastólico que comienza cuando la Pa es inferior a la Pd media y con una Pa en caída27 | GP: Comet II | Boston Scientific (Estados Unidos) | 3 cm | Óptico | No |
| dPRmicro | Cociente Pd/Pa medio (en 5 latidos)28 | Punto diastólico dentro de la diástole a medio camino entre el pico de una forma de onda y el de la siguiente forma de onda28 | MP: Navvus II | ACIST (Estados Unidos) | 5 mm | Óptico | No |
| cRR | Cociente Pd/Pa medio29 | Subciclo diastólico (periodo libre de ondas) identificado calculando la derivada temporal del cociente Pd/Pa y hallando el periodo más largo cuando es igual a cero29 | MP: TruePhysio Insight | Lifetech (China) | ~ 2,5 mm | Sistema mécánico microeléctrico piezorresistente | No |
|
cRR: cociente de resistencia constante; DFR: cociente libre de hiperemia diastólica; dPR: cociente de presión diastólica; GP: guía de presión; iFR: índice diastólico instantáneo sin ondas; IVUS: ecografía intravascular; MP: microcatéter de presión; NA: no aplicable; NHPR: cociente de presión no hiperémico; Pa: presión aórtica; Pd: presión coronaria distal; RFR: cociente del ciclo cardiaco completo en reposo. * Para GP, el sensor se encuentra en una posición proximal a la parte radiopaca. |
|||||||
El índice diastólico instantáneo sin ondas (iFR) es el más ampliamente investigado y valores de 0,89 fueron los que más se equipararon a una RFF ≤ 0,8030. Su precisión diagnóstica comparada con la RFF obtenida mediante GP será objeto de debate en la sección «Índice diastólico instantáneo sin ondas».
El cociente de presión coronaria distal a presión aórtica (Pd/Pa) en reposo tiene un punto de corte de 0,91 para predecir la importancia funcional, mientras que los demás NHPR tienen el mismo punto de corte que el iFR (0,89); en estudios de análisis post hoc, estos valores fueron los mejores predictores del iFR mediante GP, casi siempre, con una precisión diagnóstica muy alta (algo menor, no obstante, para el cociente de presión diastólica [dPR]micro), tal y como se muestra en las secciones “Pd/Pa en reposo” a “Cociente de resistencia constante”.
El índice diastólico instantáneo sin ondas
Comparado con la determinación de la RFF con adenosina, el iFR se asoció a muchos menos signos y síntomas adversos asociados a la intervención (30,8 frente al 3,1%), principalmente, dolor torácico o disnea31 así como a intervenciones más cortas (en torno a 2-4 minutos de diferencia)31,32.
El iFR es el único índice que permite el corregistro de ecografía intravascular (IVUS) con angiografía, lo cual ayuda en el estudio de las estenosis.
Precisión diagnóstica
Los resultados concordantes entre el iFR y la RFF fueron del 79,4 al 88,2% en 3 estudios (n total = 1.259)33,35.
Tanto las mediciones hiperémicas (RFF) como en reposo (NHPR) se pueden emplear para valorar la importancia de las estenosis, incluso cuando la RFF se estudia durante el flujo hiperémico, que disminuye a medida que se agrava la estenosis con la consiguiente subida del gradiente de presión transestenótica (GPT) y descenso de la RFF, mientras que los NHPR se estudian cuando el flujo coronario está en reposo, algo que se mantiene en aquellas estenosis que van empeorando progresivamente (más allá de un punto crítico de estenosis, también se espera que disminuya el flujo en reposo)36. No obstante, el mantenimiento del flujo en reposo se debe a un descenso compensatorio de la resistencia microvascular a expensas de la presión coronaria distal, que disminuye a medida que aumenta el GPT; en consecuencia, el GPT va aumentando a medida que se va agravando la estenosis tanto en las mediciones hiperémicas como en reposo36.
Ciertos factores pueden influir en el flujo hiperémico y/o en reposo y explican las discordancias observadas, al menos en parte. Se observó discordancia entre la RFF y el NHPR (una RFF alta y un iFR o cociente del ciclo cardiaco completo en reposo [RFR] bajo) en condiciones capaces de arrojar valores de la RFF más altos por una menor capacidad de vasodilatación secundaria a la disfunción microvascular coronaria (DMC): diabetes mellitus en tratamiento con insulina, tasa de filtrado glomerular estimada más baja, edad avanzada (por su relación con las comorbilidades antes mencionadas) y fibrilación auricular (por su asociación con la edad avanzada o una frecuencia cardiaca más alta)33. Se observó una discordancia similar (RFF alta y iFR bajo) pues el flujo coronario en reposo aumenta paralelamente a la frecuencia cardiaca, con la frecuencia cardiaca alta o en ausencia de uso de bloqueadores beta34, lo cual arroja valores más bajos del iFR. Otras causas de discrepancia entre una RFF alta y un iFR bajo podrían ser la estenosis aórtica grave y el infarto de miocardio (IM).
El otro tipo de discordancia (RFF baja e iFR alto) se ve potencialmente influido por una reserva de flujo coronario (RFC) alta: en la estenosis del tronco común izquierdo (TCI) y la descendente anterior proximal el género masculino puede provocar una mayor variación del flujo coronario entre las condiciones de reposo e hiperemia y, en consecuencia, una mayor discordancia34,35.
Ambas discordancias son más habituales en estenosis intermedias (41-70%) que en leves o graves34,35.
Evaluación en condiciones clínicas o angiográficas específicas
Estenosis aórtica: los pacientes con un defecto grave pueden tener respuestas atenuadas a la hiperemia secundarias a una hipertrofia miocárdica, a una presión alta de llenado diastólico del ventrículo izquierdo y a la DMC. En este contexto, el iFR parece más fiable, aunque podría verse reducido por una mayor demanda de oxígeno y el flujo coronario en reposo secundario a la hipertrofia33.
Diabetes mellitus: esta patología está asociada a la DMC y puede influir en la fiabilidad de los valores de la RFF, por lo que en estos pacientes se opta por emplear el NHPR33. Por otro lado, en el ensayo DEFINE-FLAIR, realizado entre pacientes diabéticos, la revascularización guiada por iFR y RFF se asoció a un riesgo similar de reacciones adversas.
Enfermedad del TCI: la discordancia fue aún mayor (25,0%) en un reciente estudio de pacientes con enfermedad aislada del TCI o con TCI y enfermedad secundaria concomitante (36,2%). Datos previos sugieren que tanto la RFF como el iFR pueden ayudar a guiar la decisión de revascularizar o diferir lesiones del TCI; ante la presencia de resultados discordantes, solo se puede considerar realizar una IVUS y diferir la lesión del TCI cuando el área luminal mínima es > 6 mm² 37.
IM: comparado con pacientes con angina estable, las arterias no relacionadas con el infarto (ANRI) de un infarto agudo de miocardio sin elevación del segmento ST subagudo/infarto agudo de miocardio con elevación del segmento ST (IAMSEST/IAMCEST) mostraron un mayor flujo en reposo, una menor RFC y un flujo hiperémico mantenido. Además, el índice de resistencia microcirculatoria (IRM) derivado de las guías de presión-temperatura no aumentó. En consecuencia, el flujo coronario en reposo más alto de pacientes con IM podría ser el resultado de mecanismos compensatorios neurohumorales desencadenados por el daño miocárdico agudo38.
Según el primer estudio, estos hallazgos avalan el uso de la RFF en el IM subagudo38, si bien otro estudio informó un descenso significativo de la RFF en ANRI en IAMCEST desde la fase aguda hasta trascurrido 1 mes seguimiento (diferencia media = 0,02; p = 0,001) y un mayor IRM agudo39. En este mismo contexto, el iFR fue aumentando con el paso del tiempo, aunque sin significación estadística (diferencia media = 0,01; p = 0,12)39.
Al final, ambos métodos pueden verse alterados en pacientes con IAMCEST puesto que tanto la RFF como el iFR pueden infravalorar y subestimar, respectivamente, la gravedad de la lesión. Las guías europeas de 2023 recomendaron que las ICP de ANRI de pacientes con IAMCEST deberían basarse en la gravedad angiográfica puesto que la estrategia de guiado mediante RFF no suele reducir el riesgo de reacciones adversas, mientras que en pacientes con SCASEST, la estrategia de guiado mediante RFF ofrece datos más favorables que en pacientes con IAMCEST, razón por la cual una valoración invasiva funcional de las ANRI podría tenerse en cuenta durante la intervención índice40.
Lesiones en tándem: estas lesiones también son motivo de discordancia entre el NHPR y la RFF, ya que los índices se pueden usar por igual para valorar dichas lesiones. Por su parte, la RFF calcula mejor el GPT en otro tipo de lesiones, mientras que el NHPR se ve menos influido por la interacción entre estenosis seriadas21. La retirada de la guía otorga un GPT a cada lesión constitutiva de lesiones en tándem. Además, tratar la lesión con el GPT más alto y luego volver a valorar la otra lesión es un abordaje razonable21.
Datos de resultados
Dos grandes ensayos aleatorizados (DEFINE-FLAIR, n = 2.492; iFR-SWEDEHEART, n = 2.037) confirmaron la no inferioridad de una estrategia de ICP guiada por iFR frente a una guiada mediante RFF durante un seguimiento a 1 y 5 años, si bien el iFR mostró tasas de revascularización más bajas con valores de p casi significativos31,32.
El índice de eventos cardiovasculares adversos mayores (MACE) fue del 18,6 (iFR) frente al 16,8% (RFF) (p = 0,63) a los 5 años en pacientes diferidos con angina estable (n = 611) o lesiones no culpables de SCA (angina inestable y IAMSEST, n = 297). No se han observado diferencias significativas en los índices de eventos a largo plazo entre la angina estable y el SCA41.
Las lesiones diferidas con discordancia iFR-RFF no mostraron un mayor riesgo de eventos adversos a los 5 años42.
Asimismo, las lesiones diferidas con resultados discordantes entre el NHPR (iFR, dPR, RFR) y la RFF tuvieron un mayor riesgo de eventos asociados el vaso a los 5 años que aquellas con resultados negativos concordantes, pero no un mayor riesgo que las lesiones revascularizadas43. En pacientes con resultados discordantes, se recomendó un seguimiento meticuloso con tratamiento médico intensivo43.
Post-ICP: un iFR ≥ 0,95 (n = 500) tras el despliegue exitoso del stent se asoció a un descenso significativo del objetivo compuesto de muerte cardiaca, IM espontáneo o revascularización del vaso diana por motivos clínicos a 1 año comparado con un iFR más bajo44.
Cociente Pd/Pa en reposo
Precisión diagnóstica
El cociente Pd/Pa en reposo se calcula durante todo el ciclo cardiaco, lo cual provoca una mayor resistencia microvascular y, en consecuencia, un menor gradiente de presión y, potencialmente, una menor sensibilidad que el periodo diastólico libre de ondas del iFR36. No obstante, su precisión diagnóstica fue alta (93,0%) comparada con la del iFR (n = 627)24.
Datos de resultados
Tanto el cociente Pd/Pa en reposo como el iFR mostraron asociaciones similares con el riesgo de MACE a 2 años (1,5% para cocientes Pd/Pa negativos y 1,6% para valores de iFR negativos; n = 375)45.
Post-ICP: un cociente Pd/Pa ≤ 0,96 tras el despliegue del stent resultó el mejor predictor de MACE a 30 meses (n = 574)46.
Cociente de presión diastólica (guía de presión)
Precisión diagnóstica
La precisión diagnóstica fue de, aproximadamente, el 97,0% en un estudio realizado por Van’t Veer et al. (n = 197)25.
Datos de resultados
El estudio realizado por Lee et al.43 con una muestra de 435 pacientes mostró un índice de eventos asociados al vaso similares a los 5 años para valores negativos del dPR (7,9%) y iFR (8,0%), así como de la RFF (7,7%).
Post-ICP: no disponible.
Cociente del ciclo cardiaco completo en reposo
Precisión diagnóstica
Tal y como se muestra en la tabla 2, el RFR se calcula durante todo el ciclo cardiaco. Como el RFR se detectó fuera de la diástole en el 12,2% de los casos, según los autores, podrían pasarse por alto lesiones de cierta importancia midiendo el NHPR solo durante la diástole26. No obstante, la precisión diagnóstica del RFR frente a la del iFR fue del 97,4% en el ensayo VALIDATE-RFR (n = 504)26, similar a la de otros NHPR diastólicos como el dPR y el cociente diastólico libre de hiperemia.
Datos de resultados
En el mismo estudio de Lee et al.43, un RFR negativo arrojó un porcentaje similar (8,1%) de eventos adversos.
Post-PCI: no hay datos disponibles; el ensayo en curso PICIO (NCT04417634) analizará el RFR en este contexto.
Cociente diastólico libre de hiperemia
Precisión diagnóstica
La precisión diagnóstica se situó en el 97,6% en el estudio de Johnson et al. (n = 833)27.
Datos de resultados
En 926 pacientes, el fracaso de la lesión diferida (muerte cardiaca, IM, nueva revascularización) a los 3 años fue similar para un cociente diastólico libre de hiperemia (6,8%), iFR (6,9%), dPR (6,9%), RFR (7,1%) y RFF (5,9%) negativos47.
Post-ICP: no disponible.
Cociente de presión diastólica calculado con microcatéter (dPRmicro)
Precisión diagnóstica
En un estudio realizado por Arashi et al.28 (n = 161), el dPRmicro arrojó un sesgo medio de -0,028 y una precisión diagnóstica del 82,2% frente al iFR medido con GP; comparado con los demás NHPR, este valor más bajo podría haberse visto influido por el área transversal en el sitio de la lesión del MP Navvus que es mayor que la GP, (y también comparado con el MP TruePhysio), lo cual habría sobrevalorado las estenosis.
Datos de resultados
Los datos solo están disponibles en un contexto post-ICP: un dPRmicro ≤ 0,89 se asoció a una mortalidad cardiaca mucho más alta a los 2 años en 735 pacientes (se debe mencionar que, debido al limitado número de eventos, el análisis de las características operativas del receptor no pudo identificar un valor de corte óptimo y, por lo tanto, los autores tomaron deliberadamente el umbral isquémico aceptado de 0,89)48.
Cociente de resistencia constante
Precisión diagnóstica
La precisión diagnóstica fue del 97% con un sesgo medio de -0,0001 frente al iFR calculado mediante GP en un resumen proporcionado por Li et al. (n = 86)29.
Datos de resultados
Todavía no hay datos de resultados disponibles. El ensayo en curso SUPREME II (NCT05417763) valorará las implicaciones del cociente de resistencia constante post-ICP.
Resumen
Entre los NHPR, el iFR es del que más evidencia tenemos. Además, se mostró no inferior a una estrategia de ICP guiada por RFF durante un seguimiento largo con menos síntomas adversos asociados a la intervención y tiempos de intervención más cortos. No obstante, el cociente Pd/Pa en reposo, dPR (GP), RFR, cociente diastólico libre de hiperemia y cociente de resistencia constante mostraron una precisión diagnóstica muy alta comparados con el iFR, por lo que podrían usarse para reemplazar el iFR.
En cambio, se han mostrado resultados discordantes entre los NHPR y la RFF en un porcentaje no desdeñable de casos. Los pacientes con resultados discordantes arrojaron peores resultados que aquellos con resultados negativos concordantes y aunque se recomienda un seguimiento meticuloso con tratamiento médico intensivo, la revascularización de lesiones discordantes no termina de estar clara.
ÍNDICES ANGIOGRÁFICOS
Los índices angiográficos no requieren el uso de GP ni MP ni hiperemia inducida por fármacos, lo cual evita los posibles riesgos de lesión coronaria y efectos adversos. Tampoco se ven limitados por el drift de la presión (la diferencia entre la igualación inicial de presión y la verificación final), que se asocia a cambios en el sensor de presión (por ejemplo, por variaciones de temperatura) y provoca nuevas mediciones con ambos sistemas de GP y MP.
Los índices angiográficos comparten el mismo valor de corte que la RFF (0,80); todos los sistemas proporcionan una traza virtual de retirada que muestra los valores del vaso o vasos interrogados.
En la actualidad, se han evaluado los siguientes índices: reserva fraccional de flujo vascular (RFFv), cociente de flujo cuantitativo (CFC), RFF calculada por angiografía (angio-RFF), RFF derivada de la dinámica de fluidos-presión computacional (caRFF), RFF basada en angiografía no invasiva (accuRFFangio) y CFC basado en la ley fractal de Murray (CFCμ).
Estos índices se calculan empleando diferentes softwares mediante la reconstrucción tridimensional (3D) de las coronarias basándose en 1 o más imágenes angiográficas y en el cálculo de la velocidad del flujo coronario según la presión aórtica y el análisis del recuento de fotogramas. Es necesario medir la presión aórtica para los índices RFFv, angio-RFF, accuRFFangio y caRFF; en este último caso, se requiere un transductor de presión especializado (FlashPressure, RainMed Medical, China) que se conecta al catéter guía. La tabla 3 muestra otros destalles al respecto. La precisión diagnóstica (comparado con la RFF calculada con GP) y los datos de resultados se muestran a continuación.
Tabla 3. Características de los índices angiográficos
| Tipo de índice* | Proveedor de software | Base de la reconstrucción 3D | Recuento de fotogramas requerido | Necesidad de un input de presión aórtica | Tipo de reconstrucción 3D | Análisis simultáneo de vaso principal y ramas laterales | Tiempo de cálculo (minutos) | Verificación de un índice para analizar la microcirculación* | Verificación de un índice para diferenciar enfermedad focal y difusa (método cuantitativo)* |
|---|---|---|---|---|---|---|---|---|---|
| RFFv | Pie Medical Imaging (Países Bajos) | 2 proyecciones con, al menos, 30° de separación a 15 fotogramas/s (finalmente, 7,5)49,50 | No | Sí | 1 único vaso | No | No informado | No | No |
| CFC | Medis Medical Imaging (Países Bajos) / Pulse Medical Technology (China) | 2 proyecciones con, al menos, 25° de separación a 15 fotogramas/s (finalmente, 7,5)49,51 | Sí (para CFC) | No | 1 único vaso | No | 552 | Sí: – Angio-IRM – IMRangio – A-IMR – Angio-IRM no hiperémico | Sí: – QVP – CFC-PPG |
| angio-RFF | CathWorks (Israel) | ≥ 2 proyecciones con, al menos, 30° de separación a 10 fotogramas/s53 | No | Sí | Multi-vaso | Sí | 9,654 | No | No |
| caRFF | RainMed Medical (China) | ≥ 2 proyecciones con, al menos, 30° de separación a 15 fotogramas/s55 | Sí | Sí (con transductor de presión especializado) | 1 único vaso | No | 4,555 | Sí: – caIRM | Sí: – angio-RFF basada en PPG |
| accuRFFangio | ArteryFlow Technology (China) | 2 proyecciones con, al menos, 25° de separación a 15 fotogramas/s56 | Sí | Sí | 1 único vaso | No | 4,356 | Sí: – accuIRM | No |
| μ CFC | Pulse Medical Imaging Technology (China) | 1 proyección a 15 fotogramas/s57 | Sí | No | 1 único vaso | Sí | 1,157 | Sí: – RMA | No |
|
accuRFFangio: RFF basada en angiografía no invasiva; angio-RFF: reserva fraccional de flujo calculada por angiografía; caRFF: reserva fraccional del flujo derivada de la dinámica de presión-flujo computacional; IRM: índice de resistencia microcirculatoria; PPG: gradiente de presión en retirada; CFC: cociente de flujo cuantitativo; PPG: gradiente de presión en retirada derivado del CFC; CFD: cociente de flujo cuantitativo; QVP: retirada virtual del CFC; RFFv: reserva fraccional de flujo vascular; RMA: resistencia microvascular angiográfica; CFCμ: CFC basado en la ley fractal de Murray. * Todos los índices de la lista no precisan guía. |
|||||||||
Tanto las lesiones aortostiales como la superposición significativa de vasos son criterios de exclusión para todos los índices porque dificultan el análisis con software.
Reserva fraccional de flujo vascular
Precisión diagnóstica
En el estudio multicéntrico FAST II (n = 334, 39 IAMSEST), la precisión diagnóstica alcanzó el 90% frente a una RFF ≤ 0,80 en un laboratorio central independiente y ciego58.
La precisión se mantuvo en subgrupos específicos como los de pacientes con diabetes, bifurcaciones, calcificaciones moderadas o graves y lesiones tortuosas (el subanálisis del IAMSEST no está disponible)58. La precisión diagnóstica de la RFFv ≤ 0,80 a la hora de identificar lesiones del TCI con un área luminal mínima en la IVUS < 6,0 mm² fue buena (sensibilidad y especificidad del 98% y 71,4%, respectivamente)59.
Datos de resultados
Los datos de resultados solo están disponibles tras la ICP: los valores más bajos (≤ 0,93) de la RFFv se asociaron a un riesgo mucho mayor de fracaso del vaso diana (FVD) a los 5 años de seguimiento (n = 748)60.
Cociente de flujo cuantitativo
En la actualidad, el CFC es el índice del que más evidencias se tienen. El CFC se calculó a partir de 3 modelos: CFCcon flujo fijo (CFCf), con flujo de adenosina (CFCa) y con flujo de contraste (CFCc), respectivamente; este último se calcula sin inducir hiperemia empleando la velocidad del flujo de contraste a través de la estenosis calculada mediante el análisis del recuento de fotogramas51 que es automático en la última versión del software.
Precisión diagnóstica
Tanto el CFCc como el CFCa mostraron una concordancia similar con la RFF y una precisión más alta que el CFC51. La precisión diagnóstica global fue del 87% en el metanálisis realizado por Westra et al.61 (n = 819)
En el registro multicéntrico de Choi et al.62 (n = 452), la precisión diagnóstica del CFCc no se vio reducida en los vasos no culpables en el SCA (n = 153) mientras que en el de Lee et al.63 (n = 915), fue menor en los vasos no culpables del grupo con IAM (n = 103) que en los del grupo con angina (92,4 frente al 96%), aunque sin significación estadística. Una posible explicación sería que su cálculo se basa en el análisis del recuento de fotogramas, lo cual podría verse afectado por la DMC transitoria de las arterias tanto relacionadas como no relacionadas con el infarto63.
En el metanálisis de Westra et al.61, la diabetes, capaz también de provocar DMC, mostró una capacidad estadísticamente significativa de predecir valores del CFC, como mínimo, 0,10 por debajo de la medición correspondiente de la RFF, si bien la precisión diagnóstica del CFCc no varió en el subgrupo de diabetes del registro de Choi et al.62.
Aunque la precisión se mantuvo en bifurcaciones y lesiones calcificadas y tortuosas63, se redujo o mantuvo en lesiones en tándem en 2 estudios diferentes63,52.
La concordancia fue aceptable (90,7%) en lesiones intermedias del TCI64.
La concordancia numérica entre CFC y RFF se vio afectada negativamente por una RFF baja61; asimismo, en el caso de valores RFF < 0,75 y CFC ≤ 0,85, la precisión se vio reducida (91,2%) en el registro de Lee et al.63 lo cual sería indicativo de dificultades a la hora de precisar lesiones más graves con el CFD61.
Datos de resultados
En un extenso ensayo aleatorizado multicéntrico (n = 3.825) (FAVOR III China) de pacientes tratados con ICP (el 63,5% con SCA), el objetivo compuesto de muerte por cualquier causa, IM o revascularización motivada por la isquemia a 1 año se redujo significativamente en el grupo guiado por CFC frente al guiado por angiografía (5,8 frente al 8,8%)65.
Post-ICP: los valores de corte del CFC post-ICP para predecir el objetivo compuesto orientado al vaso al cabo de 1 y 3 años variaron de 0,89 a 0,94 en una reciente revisión sistemática66.
RFF derivada de coronariografía
En la RFF derivada de coronariografía se analiza todo el árbol coronario, incluidas las ramas laterales (RL), lo cual permite obtener valores de la RFF a lo largo de cada vaso. No obstante, esto suele alargar los tiempos de cálculo comparado con índices con un abordaje por vaso (tabla 3).
Precisión diagnóstica
En un análisis conjunto de 5 estudios (n = 588, 59 IAMSEST), la precisión diagnóstica fue del 93% por parte de operadores ciegos y consistente en lesiones no culpables de IAMSEST, pacientes diabéticos, bifurcaciones, vasos moderada o gravemente calcificados o tortuosos y lesiones en tándem67.
Para lesiones con valores de RFF entre 0,75 y 0,85, la precisión fue algo menor (85,5%)67.
Datos de resultados
En una cohorte de 536 pacientes (aproximadamente el 50% con SCA), el tratamiento guiado por angio-RFF del grupo diferido mostró un índice de MACE al año del 2,5%, datos que coinciden con los previamente informados empleando la RFF68.
Post-ICP: no disponible.
RFF derivada de la dinámica de fluidos-presión computacional
Precisión diagnóstica
En el ensayo multicéntrico FLASH-FFR la precisión diagnóstica de pacientes con angina estable o inestable (n = 328) fue del 95,7% según un laboratorio central independiente y ciego55.
La precisión diagnóstica de la caRFF fue menor (89,9%) en 119 vasos con valores de RFF entre 0,75 y 0,8555.
Datos de resultados
En un pequeño estudio unicéntrico (n = 69), los resultados a 12 meses mostraron que diferir la ICP guiada por caRFF resulta seguro (en el 3,4% de los pacientes se revascularizó el vaso diana) y comparable a datos previos sobre diferimiento de la ICP guiada por RFF69.
Post-ICP: en un grupo de 136 pacientes, unos valores de caRFF post-ICP más bajos (< 0,90) se asociaron a una incidencia más alta del FVD a los 9 meses70.
RFF basada en angiografía
Precisión diagnóstica
En un estudio observacional unicéntrico de 300 pacientes con angor estable, la precisión de accuRFFangio fue del 93,7%56.
Datos de resultados
No disponibles (ensayos en curso).
Cociente de flujo cuantitativo basada en la ley de fractal de Murray
El CFCμ emplea la ley fractal de bifurcación de Murray para reconstruir el tamaño de referencia del vaso, así como una única imagen angiográfica (con el consiguiente ahorro de tiempo) para generar valores tanto a lo largo del vaso principal como de sus RL.
Precisión diagnóstica
La precisión diagnóstica a nivel de los vasos del CFCμ en la identificación de lesiones con valores de RFF ≤ 0,80 fue del 93,0% en 330 vasos principales en 306 pacientes (presentación principal: angina estable/inestable); la precisión diagnóstica no se valoró en las RL57.
Datos de resultados
Al cabo de 3 años, el índice de FVD en 288 pacientes con verdaderas bifurcaciones coronarias a tratamiento mediante abordaje provisional sin tratamiento de las RL fue del 29,2% en el grupo con valores de CFCμ < 0,8 en las RL frente al 10,8% del grupo con valores de CFCμ en las RL ≥ 0,8 (p < 0,05)71.
Post-ICP: en un grupo de 169 pacientes, los valores de CFCμ ≤ 0,89 tras el tratamiento de la reestenosis intrastent con un balón farmacoactivo fueron el mejor valor de corte para predecir el objetivo final compuesto orientado al vaso a 1 año y se asoció a un riesgo 6 veces mayor66.
Resumen
Los índices angiográficos son una alternativa válida a la RFF en lo que a concordancia clínica se refiere. No obstante, algunas características angiográficas no se han investigadas. Comparado con la RFF y aunque la precisión diagnóstica fue buena, se observó una tendencia hacia una menor precisión en la zona límite de la RFF. La falta de comparativas directas con el tratamiento guiado por la RFF en los resultados y la reproducibilidad fueron variables.
En cuanto a esto último, la reproducibilidad inter e intraobservador del CFC fue de alta a poca entre los operadores entrenados observándose una notable variabilidad en los valores de RFFv entre operadores inexpertos y expertos. En cambio, los valores de la RFF pudieron obtenerse una y otra vez en otros estudios ya publicados con una imprecisión casi nula72.
Los autores coincidieron en señalar la importancia de adherirse a los procedimientos operativos estándar y proporcionar feedback y formación continua para lograr unos cálculos precisos72.
PERSPECTIVAS DE FUTURO
En nuestra opinión, los problemas más importantes que todavía hay que abordar son la necesidad de realizar ICP en lesiones con valores discordantes de NHPR/RFF y la comparativa entre índices angiográficos frente a índices basados en la RFF a la hora de guiar el tratamiento. El valor de estos índices se establecerá más a fondo en los siguientes ensayos que se están llevando a cabo en la actualidad: FAST III (NCT04931771), LIPSIASTRATEGY (NCT03497637), FAVOR III Europe Japan trial (NCT03729739), FLASH-RFF II (NCT04575207), NCT05209503 y NCT05202041 y ALL-RISE (NCT05893498) que analizarán el riesgo de eventos adversos empleando RFFv, CFC, caRFF, accuRFFangio y angio-RFF frente a la revascularización guiada por RFF.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado ningún sistema de inteligencia artificial en la preparación de este trabajo.
CONTRIBUCIÓN DE LOS AUTORES
F. Vergni, G. Fiore, F. Pellone y M. Luzi contribuyeron al diseño de este estudio. F. Vergni colaboró en su redacción y edición. F. Vergni, G. Fiore, F. Pellone y M. Luzi revisaron el estudio y aprobaron su versión final a efectos de publicación.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
2. Van de Hoef TP, Siebes M, Spaan JA, Piek JJ. Fundamentals in clinical coronary physiology:why coronary flow is more important than coronary pressure. Eur Heart J. 2015;36;3312-3319.
3. Van der Voort PH, van Hagen E, Hendrix G, van Gelder B, Bech JW, Pijls NH. Comparison of intravenous adenosine to intracoronary papaverine for calculation of pressure-derived fractional flow reserve. Cathet Cardiovasc Diagn. 1996;39:120-125.
4. Matsumoto H, Mikuri M, Masaki R, et al. Feasibility of intracoronary nicorandil for inducing hyperemia on fractional flow reserve measurement:Comparison with intracoronary papaverine. Int J Cardiol. 2020;314:1-6.
5. Nakayama M, Tanaka N, Yamashita J, Iwasaki K. Confirmation of maximal hyperemia by the incremental dose of intracoronary papaverine. Cardiovasc Interv Ther. 2020;35:371-378.
6. Mizukami T, Sonck J, Gallinoro E, et al. Duration of Hyperemia With Intracoronary Administration of Papaverine. J Am Heart Assoc. 2021;10:018562.
7. Adjedj J, Toth GG, Johnson NP, et al. Intracoronary Adenosine:Dose-Response Relationship With Hyperemia. JACC Cardiovasc Interv. 2015;8:1422-1430.
8. Rigattieri S, Biondi Zoccai G, Sciahbasi A, et al. Meta-Analysis of Head-to-Head Comparison of Intracoronary Versus Intravenous Adenosine for the Assessment of Fractional Flow Reserve. Am J Cardiol. 2017;120:563-568.
9. De Bruyne B, Pijls NH, Barbato E, et al. Intracoronary and intravenous adenosine 5'-triphosphate, adenosine, papaverine, and contrast medium to assess fractional flow reserve in humans. Circulation. 2003;107:1877-1883.
10. Ishibuchi K, Fujii K, Otsuji S, et al. Utility and Validity of Intracoronary Administration of Nicorandil Alone for the Measurement of Fractional Flow Reserve in Patients With Intermediate Coronary Stenosis. Circ J. 2019;83:2010-2016.
11. Nishi T, Kitahara H, Iwata Y, et al. Efficacy of combined administration of intracoronary papaverine plus intravenous adenosine 5'-triphosphate in assessment of fractional flow reserve. J Cardiol. 2016;68:512-516.
12. SolernóR, Pedroni P, Mariani J, Sarmiento R. Comparison of sodium nitroprusside and adenosine for fractional flow reserve assessment:a systematic review and meta-analysis. Expert Rev Cardiovasc Ther. 2018;16:765-770.
13. Leone AM, Porto I, De Caterina AR, et al. Maximal hyperemia in the assessment of fractional flow reserve:intracoronary adenosine vs intracoronary sodium nitroprusside vs intravenous adenosine:the NASCI (Nitroprussiato vs Adenosina nelle Stenosi Coronariche Intermedie) study. JACC Cardiovasc Interv. 2012;5:402-408.
14. Wang X, Li S, Zhao X, Deng J, Han Y. Effects of intracoronary sodium nitroprusside compared with adenosine on fractional flow reserve measurement. J Invasive Cardiol. 2014;26:119-122.
15. Gill GS, Gadre A, Kanmanthareddy A. Comparative efficacy and safety of adenosine and regadenoson for assessment of fractional flow reserve:A systematic review and meta-analysis. World J Cardiol. 2022;14:319-328.
16. Nair PK, Marroquin OC, Mulukutla SR, et al. Clinical utility of regadenoson for assessing fractional flow reserve. JACC Cardiovasc Interv. 2011;4:1085-1092.
17. Lee JM, Kato D, Oi M, et al. Safety and efficacy of intracoronary nicorandil as hyperemic agent for invasive physiological assessment:a patient-level pooled analysis. EuroIntervention. 2016;12:208-215.
18. Jang HJ, Koo BK, Lee HS, et al. Safety and efficacy of a novel hyperemic agent, intracoronary nicorandil, for invasive physiological assessments in the cardiac catheterization laboratory. Eur Heart J. 2013;34:2055-2062.
19. Roongsangmanoon W, Wongsoasup A, Angkananard T, Rattanajaruskul N, Jirapattrathamrong S. Comparison of efficacy and safety of intracoronary nicardipine and adenosine for fractional flow reserve assessment of coronary stenosis. Int J Cardiol. 2022;356:1-5.
20. De Luca G, Venegoni L, Iorio S, Giuliani L, Marino P. Effects of increasing doses of intracoronary adenosine on the assessment of fractional flow reserve. JACC Cardiovasc Interv. 2011;4:1079-1084.
21. Ilic I, Timcic S, Odanovic N, Otasevic P, Collet C. Serial stenosis assessment-can we rely on invasive coronary physiology. Front Cardiovasc Med. 2023;10:1172906.
22. Edward JA, Lee JH, White CJ, Morin DP, Bober R. Intravenous regadenoson with aminophylline reversal is safe and equivalent to intravenous adenosine infusion for fractional flow reserve measurements. Clin Cardiol. 2018;41:1348-1352.
23. Sen S, Escaned J, Malik IS, et al. Development and validation of a new adenosine-independent index of stenosis severity from coronary wave-intensity analysis:results of the ADVISE (ADenosine Vasodilator Independent Stenosis Evaluation) study. J Am Coll Cardiol. 2012;59:1392-1402.
24. Kobayashi Y, Johnson NP, Zimmermann FM, et al. Agreement of the Resting Distal to Aortic Coronary Pressure With the Instantaneous Wave-Free Ratio. J Am Coll Cardiol. 2017;70:2105-2113.
25. Van't Veer M, Pijls NHJ, Hennigan B, et al. Comparison of Different Diastolic Resting Indexes to iFR:Are They All Equal?J Am Coll Cardiol. 2017;70:3088-3096.
26. Svanerud J, Ahn JM, Jeremias A, et al. Validation of a novel non-hyperemic index of coronary artery stenosis severity:the Resting Full-cycle Ratio (VALIDATE RFR) study. EuroIntervention. 2018;14:806-814.
27. Johnson NP, Li W, Chen X, et al. Diastolic pressure ratio:new approach and validation vs the instantaneous wave-free ratio. Eur Heart J. 2019;40:2585-2594.
28. Arashi H, Kobayashi Y, Price MJ, et al. ACIST-FFR Study Investigators. Diagnostic Accuracy of Nonhyperemic Pressure Ratios Using a Pressure Sensing Microcatheter:The ACIST-FFR Study. JACC Cardiovasc Interv. 2020;13:1272-1275.
29. Li C, Yang J, Dong S, et al. Constant resistance ratio:a new resting index validated by iFR using a pressure microcatheter [abstract]. In:PCR 2020;2020 June 25-27;1st e-Course.
30. Escaned J, Echavarría-Pinto M, Garcia-Garcia HM, et al. Prospective Assessment of the Diagnostic Accuracy of Instantaneous Wave-Free Ratio to Assess Coronary Stenosis Relevance:Results of ADVISE II International, Multicenter Study (ADenosine Vasodilator Independent Stenosis Evaluation II). JACC Cardiovasc Interv. 2015;8:824-833.
31. Davies JE, Sen S, Dehbi HM, et al. Use of the Instantaneous Wave-free Ratio or Fractional Flow Reserve in PCI. N Engl J Med. 2017;376:1824-1834.
32. Götberg M, Berntorp K, Rylance R, et al. 5-Year Outcomes of PCI Guided by Measurement of Instantaneous Wave-Free Ratio Versus Fractional Flow Reserve. J Am Coll Cardiol. 2022;79:965-974.
33. Zdzierak B, Zasada W, Krawczyk-Oz˙óg A, et al. Comparison of Fractional Flow Reserve with Resting Non-Hyperemic Indices in Patients with Coronary Artery Disease. J Cardiovasc Dev Dis. 2023;10:34.
34. Dérimay F, Johnson NP, Zimmermann FM, et al. Predictive factors of discordance between the instantaneous wave-free ratio and fractional flow reserve. Catheter Cardiovasc Interv. 2019;94:356-363.
35. Lee JM, Shin ES, Nam CW, et al. Discrepancy between fractional flow reserve and instantaneous wave-free ratio:Clinical and angiographic characteristics. Int J Cardiol. 2017;245:63-68.
36. Nijjer SS, de Waard GA, Sen S, et al. Coronary pressure and flow relationships in humans:phasic analysis of normal and pathological vessels and the implications for stenosis assessment:a report from the Iberian-Dutch-English (IDEAL) collaborators. Eur Heart J. 2016;37:2069-2080.
37. Kayaert P, Coeman M, Ghafari C, et al. FR/FFR/IVUS Discordance and Clinical Implications:Results From the Prospective Left Main Physiology Registry. J Invasive Cardiol. 2023;35:E234-E247.
38. Mejía-Rentería H, Lee JM, van der Hoeven NW, et al. Coronary Microcirculation Downstream Non-Infarct-Related Arteries in the Subacute Phase of Myocardial Infarction:Implications for Physiology-Guided Revascularization. J Am Heart Assoc. 2019;8:011534.
39. Van der Hoeven NW, Janssens GN, de Waard GA, et al. Temporal Changes in Coronary Hyperemic and Resting Hemodynamic Indices in Nonculprit Vessels of Patients With ST-Segment Elevation Myocardial Infarction. JAMA Cardiol. 2019;4:736-744.
40. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes:Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J. 2023;44:3720-3826.
41. Berntorp K, Rylance R, Yndigegn T, et al. Clinical Outcome of Revascularization Deferral With Instantaneous Wave-Free Ratio and Fractional Flow Reserve:A 5-Year Follow-Up Substudy From the iFR-SWEDEHEART Trial. J Am Heart Assoc. 2023;12:028423.
42. Lee SH, Choi KH, Lee JM, et al. Physiologic Characteristics and Clinical Outcomes of Patients With Discordance Between FFR and iFR. JACC Cardiovasc Interv. 2019;12:2018-2031.
43. Lee JM, Lee SH, Hwang D, et al. Long-Term Clinical Outcomes of Nonhyperemic Pressure Ratios:Resting Full-Cycle Ratio, Diastolic Pressure Ratio, and Instantaneous Wave-Free Ratio. J Am Heart Assoc. 2020;9:016818.
44. Patel MR, Jeremias A, Maehara A, et al. 1-Year Outcomes of Blinded Physiological Assessment of Residual Ischemia After Successful PCI:DEFINE PCI Trial. JACC Cardiovasc Interv. 2022;15:52-61.
45. Lee JM, Park J, Hwang D, et al. Similarity and Difference of Resting Distal to Aortic Coronary Pressure and Instantaneous Wave-Free Ratio. J Am Coll Cardiol. 2017;70:2114-2123.
46. Hakeem A, Ghosh B, Shah K, et al. Incremental Prognostic Value of Post-Intervention Pd/Pa in Patients Undergoing Ischemia-Driven Percutaneous Coronary Intervention. JACC Cardiovasc Interv. 2019;12:2002-2014.
47. Ahn JM, Ali ZA, Svanerud J, et al. IRIS FFR:prognostic performance of five resting pressure-derived indexes of coronary physiology [abstract]. In:TCT 2018;2018 September 21-25;San Diego, United States.
48. Masdjedi K, van Zandvoort LJC, Neleman T, et al. Prognostic value of post-percutaneous coronary intervention diastolic pressure ratio. Neth Heart J 2022;30:352-359.
49. Jin C, Ramasamy A, Safi H, et al. Diagnostic accuracy of quantitative flow ratio (QFR) and vessel fractional flow reserve (vFFR) estimated retrospectively by conventional radiation saving X-ray angiography. Int J Cardiovasc Imaging. 2021;37:1491-1501.
50. Masdjedi K, van Zandvoort LJC, Balbi MM, et al. Validation of a three-dimensional quantitative coronary angiography-based software to calculate fractional flow reserve:the FAST study. EuroIntervention. 2020;16:591-599.
51. Tu S, Westra J, Yang J, et al. Diagnostic Accuracy of Fast Computational Approaches to Derive Fractional Flow Reserve From Diagnostic Coronary Angiography:The International Multicenter FAVOR Pilot Study. JACC Cardiovasc Interv. 2016;9:2024-2035.
52. Westra J, Andersen BK, Campo G, et al. Diagnostic Performance of In-Procedure Angiography-Derived Quantitative Flow Reserve Compared to Pressure-Derived Fractional Flow Reserve:The FAVOR II Europe-Japan Study. J Am Heart Assoc. 2018;7:009603.
53. Fearon WF, Achenbach S, Engstrom T,et al. Accuracy of Fractional Flow Reserve Derived From Coronary Angiography. Circulation. 2019;139:477-484.
54. Omori H, Witberg G, Kawase Y, et al. Angiogram based fractional flow reserve in patients with dual/triple vessel coronary artery disease. Int J Cardiol. 2019;283:17-22.
55. Li J, Gong Y, Wang W, et al. Accuracy of computational pressure-fluid dynamics applied to coronary angiography to derive fractional flow reserve:FLASH FFR. Cardiovasc Res. 2020;116:1349-1356.
56. Li C, Leng X, He J, et al. Diagnostic Performance of Angiography-Based Fractional Flow Reserve for Functional Evaluation of Coronary Artery Stenosis. Front Cardiovasc Med. 2021;8:714077.
57. Tu S, Ding D, Chang Y, Li C, Wijns W, Xu B.. Diagnostic accuracy of quantitative flow ratio for assessment of coronary stenosis significance from a single angiographic view:A novel method based on bifurcation fractal law. Catheter Cardiovasc Interv. 2021;97 Suppl 2:1040-1047.
58. Masdjedi K, Tanaka N, Van Belle E, et al. Vessel fractional flow reserve (vFFR) for the assessment of stenosis severity:the FAST II study. EuroIntervention. 2022;17:1498-1505.
59. Tomaniak M, Masdjedi K, van Zandvoort LJ, et al. Correlation between 3D-QCA based FFR and quantitative lumen assessment by IVUS for left main coronary artery stenoses. Catheter Cardiovasc Interv. 2021;97:E495-E501.
60. Neleman T, Scoccia A, Masdjedi K, et al. The prognostic value of angiography-based vessel fractional flow reserve after percutaneous coronary intervention:The FAST Outcome study. Int J Cardiol. 2022;359:14-19.
61. Westra J, Tu S, Campo G, et al. Diagnostic performance of quantitative flow ratio in prospectively enrolled patients:An individual patient-data meta-analysis. Catheter Cardiovasc Interv. 2019;94:693-701.
62. Choi KH, Lee SH, Lee JM, et al. Clinical relevance and prognostic implications of contrast quantitative flow ratio in patients with coronary artery disease. Int J Cardiol. 2021;325:23-29.
63. Lee KY, Hwang BH, Kim MJ, et al. Influence of lesion and disease subsets on the diagnostic performance of the quantitative flow ratio in real-world patients. Sci Rep. 2021;11:2995.
64. Lopez-Palop R, Carrillo P, Leithold G, et al. Accuracy of the angiography-based quantitative flow ratio in intermediate left main coronary artery lesions and comparison with visual estimation. Int J Cardiol. 2023;383:8-14.
65. Xu B, Tu S, Song L, et al. Angiographic quantitative flow ratio-guided coronary intervention (FAVOR III China):a multicentre, randomised, sham-controlled trial. Lancet. 2021;398:2149-2159.
66. Terentes-Printzios D, Gkini KP, Oikonomou D, et al. Prognostic Value of Post-PCI Angiography-Derived Fractional Flow Reserve:A Systematic Review and Meta-Analysis of Cohort Studies. J Pers Med. 2023;13:1251.
67. Witberg G, De Bruyne B, Fearon WF, et al. Diagnostic Performance of Angiogram-Derived Fractional Flow Reserve:A Pooled Analysis of 5 Prospective Cohort Studies. JACC Cardiovasc Interv. 2020;13:488-497.
68. Witberg G, Bental T, Levi A, et al. Clinical Outcomes of FFRangio-Guided Treatment for Coronary Artery Disease. JACC Cardiovasc Interv. 2022;15:468-470.
69. Chandan Deepak Bhavnani, Alan Yean Yip Fong, Keng Tat Koh, et al. Performance and 12-month Outcomes of a Wire-free Fractional Flow Reserve System for Assessment of Coronary Artery Disease. Journal of Asian Pacific Society of Cardiology 2022;1:28.
70. Zhou Z, Zhu B, Fan F, et al. Prognostic Value of Coronary Angiography-Derived Fractional Flow Reserve Immediately After Stenting. Front Cardiovasc Med. 2022;9:834553.
71. Kan J, Ge Z, Nie S, et al. Clinical prognostic value of a novel quantitative flow ratio from a single projection in patients with coronary bifurcation lesions treated with the provisional approach. AsiaIntervention. 2023;9:114-123.
72. Westra J, Sejr-Hansen M, Koltowski L, et al. Reproducibility of quantitative flow ratio:the QREP study. EuroIntervention. 2022;17:1252-1259.
- Uso de registros cardiovasculares en procesos regulatorios: perspectivas del Colaboratorio Cardiovascular EU-MDR
- Origen del stent coronario: una historia de éxito entre científicos innovadores e industria biotecnológica
- Insuficiencia mitral funcional auricular: ¿era necesaria esta nueva entidad?
- Oclusión coronaria posterior al implante percutáneo de válvula aórtica. Evaluación del riesgo y estrategias preventivas





