RESUMEN
Introducción y objetivos: Existen datos limitados sobre el impacto a muy largo plazo del vaso culpable después de un infarto de miocardio con elevación del segmento ST (IAMCEST). El objetivo fue analizar el efecto de la arteria descendente anterior (DA) como vaso culpable en el IAMCEST en los resultados a muy largo plazo.
Métodos: Se analizaron los pacientes incluidos en el estudio EXAMINATION-EXTEND (NCT04462315) que recibieron stents liberadores de everolimus o stents metálicos después de un IAMCEST (1.498 pacientes) y se estratificaron según el vaso culpable (DA frente a otros vasos). El objetivo primario fue el objetivo combinado orientado al paciente (POCE) que incluyó muerte por cualquier causa, infarto agudo de miocardio (IAM) o revascularización a los 10 años. Los objetivos secundarios fueron los componentes individuales del POCE, el evento compuesto orientado al dispositivo y sus componentes individuales, así como la trombosis del stent. Se realizaron análisis de puntos de referencia a 1 y 5 años. Todos los objetivos fueron ajustados mediante modelos de regresión de Cox multivariantes.
Resultados: De los 1.498 pacientes, la DA fue el vaso culpable en 631 (42%). El grupo IAMCEST-DA mostró mayor proporción de fumadores, una clase Killip más avanzada y una peor fracción de eyección del ventrículo izquierdo. En cambio, el grupo sin IAMCEST-DA mostró mayor prevalencia de enfermedad vascular periférica, IAM previo y angioplastia coronaria previa. A los 10 años no se observaron diferencias entre los grupos para el POCE (34,9 frente a 35,4%; hazard ratio, 0,95; intervalo de confianza del 95%, 0,79-1,13; p = 0,56) ni para otros objetivos. Hubo una mayor mortalidad por cualquier causa en el grupo IAMCEST-DA (p = 0,041) al primer año.
Conclusiones: En una cohorte contemporánea de pacientes con IAMCEST no hubo diferencias en cuanto al POCE entre la DA como vaso culpable en el IAMCEST y los otros vasos a los 10 años de seguimiento. Sin embargo, en el primer año después del IAMCEST, la mortalidad por cualquier causa fue más común en el grupo IAMCEST-DA.
Palabras clave: Infarto agudo de miocardio. IAMCEST. Angiografía. Coronaria. Intervención coronaria percutánea.
ABSTRACT
Introduction and objectives: There is limited data on the impact of the culprit vessel on very long-term outcomes after ST-elevation myocardial infarction (STEMI). The aim was to analyze the impact of the left anterior descending coronary artery (LAD) as the culprit vessel of STEMI on very long-term outcomes.
Methods: We analyzed patients included in the EXAMINATION-EXTEND study (NCT04462315) treated with everolimus-eluting stents or bare-metal stents after STEMI (1498 patients) and stratified according to the culprit vessel (LAD vs other vessels). The primary endpoint was the patient-oriented composite endpoint (POCE), including all-cause mortality, myocardial infarction (MI) or revascularization at 10 years. Secondary endpoints were individual components of POCE, device-oriented composite endpoint and its individual components and stent thrombosis. We performed landmark analyses at 1 and 5 years. All endpoints were adjusted with multivariable Cox regression models.
Results: The LAD was the culprit vessel in 631 (42%) out of 1498 patients. The LAD-STEMI group had more smokers, advanced Killip class and worse left ventricular ejection fraction. Conversely, non-LAD-STEMI group showed more peripheral vascular disease, previous MI, or previous PCI. At 10 years, no differences were observed between groups regarding POCE (34.9% vs 35.4%; adjusted hazard ratio [HR], 0.95; 95% confidence interval [95%CI], 0.79-1.13; P = .56) or other endpoints. The all-cause mortality rate was higher in the LAD-STEMI group (P = .041) at 1-year.
Conclusions: In a contemporary cohort of STEMI patients, there were no differences in POCE between LAD as the STEMI-related culprit vessel and other vessels at 10 years follow-up. However, all-cause mortality was more common in the LAD-STEMI group within the first year after STEMI.
Keywords: Acute myocardial infarction. STEMI. Angiography. Coronary. Percutaneous coronary intervention.
Abreviaturas
DA: descendente anterior. FEVI: fracción de eyección del ventrículo izquierdo. IAMCEST: infarto agudo de miocardio con elevación del segmento ST. ICP: intervención coronaria percutánea. IM: infarto de miocardio. POCE: objetivo combinado orientado al paciente.
INTRODUCCIÓN
La intervención coronaria percutánea (ICP) es el tratamiento de primera línea para pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST)1. El vaso culpable del IAMCEST suele considerarse uno de los factores pronósticos más importantes en estos pacientes2,3. Una suposición que procede de estudios realizados en la era pre-reperfusión o trombolítica que aseguraban que los IAMCEST de la descendente anterior (DA) tenían peores resultados clínicos que las lesiones localizadas en la coronaria derecha (CD) y circunfleja izquierda (CXI)4-9.
No obstante, en la era contemporánea de la ICP, son pocos los datos con que contamos sobre el impacto pronóstico de la DA como vaso culpable del IAMCEST, sobre todo, en seguimientos a muy largo plazo10,11.
En este sentido, el objetivo de este estudio fue investigar el impacto de la DA como vaso culpable del IAMCEST sobre los resultados clínicos a muy largo plazo en pacientes con IAMCEST tratados de ICP e inscritos en el estudio EXAMINATION-EXTEND (seguimiento a 10 años del ensayo EXAMINATION).
MÉTODOS
Diseño del estudio y pacientes
El EXAMINATION (NCT00828087) fue un estudio simple ciego, prospectivo, multicéntrico, controlado, aleatorizado en proporción 1:1 de 2 grupos realizado en 12 centros de 3 países para valorar la superioridad del SLE (Xience V) frente al SM Multilink Vision (Abbott Vascular) en pacientes con IAMCEST en base al objetivo primario de mortalidad por cualquier causa, cualquier infarto de miocardio y cualquier revascularización a 1 año. El estudio contó con amplios criterios de inclusión y pocos criterios de exclusión a fin de garantizar una población no seleccionada con IAMCEST representativa de la práctica clínica habitual. Los resultados del estudio informados llegan hasta el 5º año de seguimiento12,13. Con posterioridad a esta fecha, se reinició como el estudio EXAMINATION-EXTEND para valorar los objetivos combinados orientados a paciente y dispositivo a 10 años. Este último estudio está registrado en ClinicalTrials.gov (NCT04462315) como una ampliación promovida por investigadores del seguimiento del ensayo EXAMINATION. Un supervisor independiente del estudio (ADKNOMA, Barcelona, España) procedió a verificar la adecuación tanto del seguimiento ampliado como de los eventos informados. Todos los eventos fueron adjudicados y clasificados por un comité independiente de adjudicación de eventos ciego a los grupos de tratamiento (Barcicore Lab, Barcelona, España). Los resultados del objetivo primario a 10 años del estudio EXAMINATION-EXTEND ya se han publicados14. A efectos del presente estudio, tanto las características basales como de la intervención, así como los resultados fueron estratificados según el vaso culpable del IAMCEST (DA frente a otros). Todos los centros participantes en el ensayo EXAMINATION recibieron la aprobación de su Comité de Ética Médica y todos los pacientes inscritos firmaron, por adelantado, sus formularios de consentimiento informado. Se obtuvo la aprobación del Comité de Ética Médica para el EXAMINATION-EXTEND en los centros de los investigadores principales (Hospital Clínic y Hospital Bellvitge, Barcelona, España) quedando exenta la necesidad de obtener el consentimiento informado para recopilar información sobre eventos a 10 años. El estudio se llevó a cabo de conformidad con la Declaración de Helsinki.
Objetivos del estudio
El objetivo principal de este estudio fue el objetivo compuesto orientado al paciente de mortalidad por cualquier causa, cualquier infarto de miocardio o cualquier revascularización a 10 años. Los objetivos secundarios fueron cada uno de los componentes del objetivo principal, el objetivo compuesto orientado al dispositivo (muerte cardiaca, infarto de miocardio del vaso diana [IMVD], revascularización de la lesión diana), cada uno de los componentes y la trombosis del stent. Las descripciones detalladas tanto de los objetivos como de las definiciones del estudio ya han sido publicadas15.
Análisis estadístico
Las variables continuas se expresan como mediana (rango intercuartílico; RIC) y las categóricas como frecuencias absolutas y relativas (porcentajes).
Las características clínicas, angiográficas y de la intervención, a nivel basal, fueron comparadas entre los grupos estratificados según la arteria culpable del IAMCEST (DA frente a otros vasos) utilizando la prueba de rango de Wilcoxon, la prueba de X2 o la prueba exacta de Fisher, según correspondiera.
Las curvas de tiempo hasta evento para el POCE y la mortalidad por cualquier causa se trazaron utilizando uno menos la estimación de Kaplan-Meier y la función de incidencia acumulada para otros resultados. La incidencia de eventos durante el seguimiento se comparó entre grupos utilizando las pruebas de log-rank o Grey. También se realizaron análisis fijando puntos de referencia a 1 y 5 años.
La relación entre la DA como vaso culpable del IAMCEST y los eventos se analizó en modelos de regresión de Cox específicos uni y multivariados diseñados ajustados a una causa concreta. Las covariables se incorporaron al modelo multivariado en 2 bloques. El primer modelo incorporó todas las variables de las características basales clínicamente relevantes con p < 0,1 a la comparativa entre grupos (DA frente a otros vasos) tales como el sexo, el tabaquismo, la enfermedad vascular periférica, ICP y CABG previas, los infartos de miocardio previos, así como la clase de Killip. El segundo modelo (ajuste ampliado) incorporó tanto las características basales como la fracción de eyección del ventrículo izquierdo (FEVI) al alta.
Los valores de p bilateral < 0,05 se consideraron significativos a nivel estadístico. Todos los análisis estadísticos se realizaron utilizando R (R Core Team (2022). R: un lenguaje de cálculo estadístico. R Foundation for Statistical Computing, Austria) empleando los siguientes paquetes de software: survival, tidycmprsk, jskm y gtsummary.
RESULTADOS
Características de los pacientes
En 631 (42%) de los 1.498 pacientes con IAMCEST incluidos en el EXAMINATION EXTEND, la DA fue el vaso culpable (grupo IAMCEST-DA), no así en 867 pacientes (58%) (grupo IAMCEST-no DA). El diagrama de flujo de inclusión de los pacientes se muestra en la figura 1.
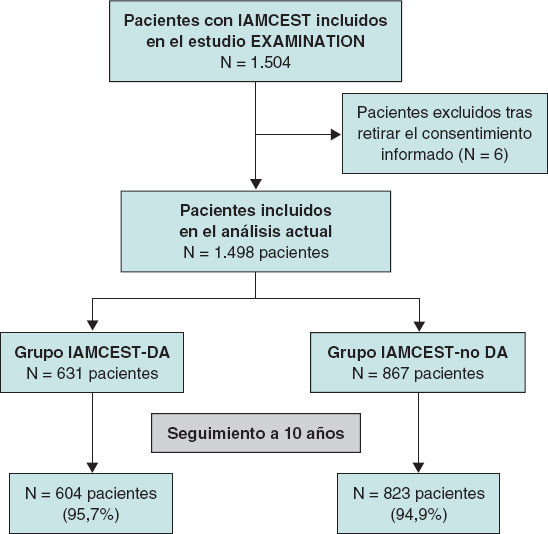
Figura 1. Diagrama de flujo del estudio. Inicialmente, se incluyeron un total de 1.498 pacientes. El seguimiento clínico a 10 años fue posible en el 95,2% de los pacientes. DA: descendente anterior; IAMCEST, infarto agudo de miocardio con elevación del segmento ST.
El grupo IAMCEST-DA tuvo una mayor incidencia de fumadores activos, clase Killip avanzada y una FEVI más deprimida que el grupo IAMCEST-no DA, que, sin embargo, tuvo una mayor incidencia de enfermedad vascular periférica, IM e ICP previos (tabla 1). Además, aunque no fue estadísticamente significativa, la frecuencia de pacientes tardíos e ICP de rescate fue numéricamente mayor en el grupo IAMCEST-DA.
Tabla 1. Características clínicas basales
| Características clínicas | Total (N = 1.498)a | Grupo IAMCEST-DA (N = 631)a | Grupo IAMCEST-no DA (N = 867)a | pb |
|---|---|---|---|---|
| Edad (años) | 61 [51-71] | 61 [51-71] | 61 [51-70] | 0,778 |
| Sexo (masculino) | 1.244 (83%) | 512 (81%) | 732 (84%) | 0,094 |
| Fumador actual | 415 (28%) | 197 (31%) | 218 (25%) | 0,009 |
| Hiperlipemia | 655 (44%) | 268 (43%) | 387 (45%) | 0,419 |
| Hipertensión | 725 (48%) | 307 (49%) | 418 (48%) | 0,843 |
| Enfermedad vascular periférica | 55 (3,7%) | 14 (2,2%) | 41 (4,7%) | 0,011 |
| ACV previo | 31 (2,1%) | 14 (2,2%) | 17 (2,0%) | 0,726 |
| Infarto de miocardio previo | 80 (5,3%) | 23 (3,7%) | 57 (6,6%) | 0,013 |
| ICP previa | 61 (4,1%) | 18 (2,9%) | 43 (5,0%) | 0,042 |
| CABG previa | 10 (0,7%) | 1 (0,2%) | 9 (1,0%) | 0,052 |
| Presentación clínica | 0,126 | |||
| ICP (< 12 h) | 1.268 (85%) | 520 (82%) | 748 (86%) | |
| ICP de rescate | 98 (6,5%) | 51 (8,1%) | 47 (5,4%) | |
| ICP tras trombólisis exitosa | 34 (2,3%) | 14 (2,2%) | 20 (2,3%) | |
| Llegada tardía pacientes (> 12 h y < 48 h) | 97 (6,5%) | 46 (7,3%) | 51 (5,9%) | |
| Clase de Killip | < 0,001 | |||
| I | 1.337 (90%) | 525 (83%) | 812 (94%) | |
| II | 115 (7,7%) | 76 (12%) | 39 (4,5%) | |
| III | 23 (1,5%) | 20 (3,2%) | 3 (0,3%) | |
| IV | 18 (1,2%) | 8 (1,3%) | 10 (1,2%) | |
| FEVI intrahospitalaria (%) | 52 (45, 58) | 46 [40-55] | 55 [50-60] | < 0,001 |
| Inicio síntomas hasta el primer contacto médico (horas) | 1,38 (0,70, 3,00) | 1,27 [0,67-3,00] | 1,47 [0,75-3,00] | 0,353 |
|
CABG: cirugía de revascularización coronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea. aMediana [rango intercuartílico] o frecuencia (%). bPrueba de suma de rangos de Wilcoxon; prueba de X2; prueba exacta de Fisher. |
||||
En cuanto a los datos de la intervención, el grupo IAMCEST-DA recibió stents de menor diámetro (3,12 frente a 3,26 mm; p = 0,001) y tuvo una menor incidencia de resolución del segmento ST que el grupo IAMCEST-no DA (73 frente al 50%; p = 0,001) (tabla 2). El uso de inhibidores GP IIb/IIIa fue numéricamente menor en el grupo IAMCEST-DA, aunque las diferencias entre los grupos no fueron estadísticamente significativas. Se debe mencionar que casi la mitad de los pacientes (46%) del grupo IAMCEST-DA presentaban lesiones en la DA proximal y el 44% en la DA media/distal.
Tabla 2. Características angiográficas y asociadas a la intervención
| Características de la intervención | Total (N = 1.498)a | Grupo IAMCEST-DA (N = 631)a | Grupo IAMCEST-no DA (N = 867)a | pb |
|---|---|---|---|---|
| Vaso culpable del IAMCEST | ND | |||
| DA | 631 (42) | 631 (100) | 0 (0) | |
| TCI | 3 (0,2) | 0 (0) | 3 (0,3) | |
| CD | 650 (43) | 0 (0) | 650 (75) | |
| CXI | 207 (14) | 0 (0) | 207 (24) | |
| IVS | 7 (0,5) | 0 (0) | 7 (0,8) | |
| Enfermedad multivaso | 188 (13) | 72 (11) | 116 (13) | 0,256 |
| Tiempo total de isquemia (horas) | 3,9 [2,7-6,8] | 4,0 [2,7-7,3] | 3,9 [2,7-6,3] | 0,366 |
| Trombectomía manual | 976 (65) | 405 (64) | 571 (66) | 0,502 |
| Inhibidores de la glicoproteína IIb/IIIa | 785 (52) | 312 (49) | 473 (55) | 0,051 |
| Implante directo del stent | 885 (60) | 390 (63) | 495 (59) | 0,113 |
| Tipo de stent | 0,312 | |||
| SFA | 751 (50) | 326 (52) | 425 (49) | |
| SM | 747 (50) | 305 (48) | 442 (51) | |
| Nº de stents | 1,39 (0,65) | 1,37 (0,63) | 1,40 (0,66) | 0,428 |
| Longitud total del stent (mm) | 23 (18-35) | 23 (18-33) | 23 (18-35) | 0,154 |
| Diámetro máximo del stent (mm) | 3,20 (0,45) | 3,12 (0,40) | 3,26 (0,47) | < 0,001 |
| Pos-dilatación | 221 (15) | 97 (15) | 124 (14) | 0,564 |
| Grado de flujo TIMI tras ICP | 0,607 | |||
| 0 | 26 (1,7) | 9 (1,4) | 17 (2,0) | |
| 1 | 12 (0,8) | 5 (0,8) | 7 (0,8) | |
| 2 | 59 (4,0) | 29 (4,6) | 30 (3,5) | |
| 3 | 1.396 (94) | 584 (93) | 812 (94) | |
| Resolución del segmento ST > 70% | 852 (63) | 285 (50) | 567 (73) | < 0,001 |
|
CABG: cirugía de revascularización coronaria; CD: coronaria derecha; CXI: circunfleja izquierda; DA: descendente anterior; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IVS: injerto de vena safena; SFA: stent farmacoactivo; SM: stent metálico; TCI: tronco común izquierdo; TIMI: thrombolysis in myocardial infarction. aMediana [rango intercuartílico]: media (desviación estándar) o frecuencia (%). bPrueba exacta de Fisher; prueba de X2; prueba de suma de rangos de Wilcoxon. |
||||
Resultados a 10 años
En el seguimiento a 10 años, el POCE no varió entre los grupos IAMCEST-DA e IAMCEST-no DA (HR ajustado = 0,95; IC95%, 0,79-1,13; p = 0,56) (figura 2). Tampoco se hallaron diferencias en cada componente del POCE (mortalidad por cualquier causa, IM, cualquier revascularización) (figura 3), así como tampoco en otros objetivos secundarios (figura 1 del material adicional). Por si esto fuera poco, tras realizar un ajuste ampliado (FEVI incluida) en el análisis multivariable tampoco se hallaron diferencias entre uno y otro grupo (tabla 3).
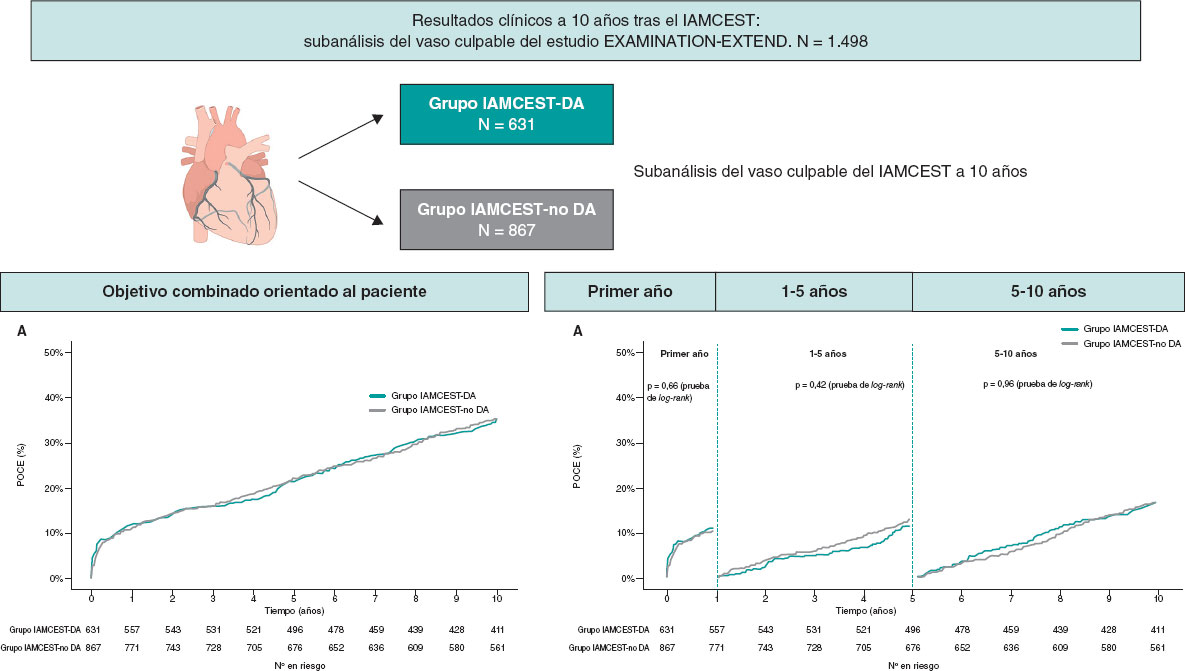
Figura 2. Ilustración central. Resultados de pacientes con infarto agudo de miocardio con elevación del segmento ST asociado a la arteria culpable en el seguimiento a 10 años. DA: descendente anterior; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; POCE: objetivo combinado orientado al paciente.

Figura 3. Curvas de tiempo hasta el evento para el objetivo combinado orientado al paciente (A), mortalidad por cualquier causa (B), infarto de miocardio (C) y cualquier revascularización (D) en pacientes estratificados según el vaso culpable. DA: descendente anterior; IM: infarto de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; POCE: objetivo combinado orientado al paciente.
Tabla 3. Resultados a 10 años
| Resultados a 10 años | Grupo IAMCEST-DA (N = 631) | Grupo IAMCEST-no DA (N = 867) | HR no ajustado (IC95%) | p | HR ajustado (IC95%) | pa | HR ajustado ampliado (IC95%) | pb |
|---|---|---|---|---|---|---|---|---|
| Objetivo combinado orientado al pacientec | 220 (34,9) | 307 (35,4) | 0,99 (0,83-1,17) | 0,87 | 0,95 (0,79-1,13) | 0,56 | 0,98 (0,78-1,23) | 0,86 |
| Mortalidad por cualquier causad | 131 (21,6) | 179 (21,2) | 1,02 (0,82-1,28) | 0,84 | 0,93 (0,74-1,18) | 0,56 | 0,81 (0,59-1,09) | 0,17 |
| Cualquier infarto de miocardioe | 33 (5,5) | 53 (6,3) | 0,86 (0,56-1,33) | 0,50 | 0,93 (0,60-1,45) | 0,76 | 1,14 (0,67-1,93) | 0,61 |
| Cualquier revascularización | 108 (17,4) | 161 (18,8) | 0,93 (0,73-1,18) | 0,55 | 0,96 (0,75-1,22) | 0,72 | 1,12 (0,83-1,52) | 0,45 |
| Objetivo combinado orientado al dispositivof | 94 (14,3) | 132 (14,2) | 0,98 (0,75-1,28) | 0,88 | 0,91 (0,70-1,20) | 0,50 | 0,95 (0,67-1,35) | 0,77 |
| Muerte cardiaca | 72 (9,8) | 95 (10,0) | 1,06 (0,78-1,44) | 0,71 | 0,89 (0,65-1,23) | 0,49 | 0,71 (0,47-1,09) | 0,12 |
| Infarto de miocardio del vaso diana | 16 (2,6) | 36 (4,2) | 0,62 (0,34-1,11) | 0,10 | 0,69 (0,38-1,25) | 0,22 | 0,87 (0,43-1,77) | 0,71 |
| Revascularización de la lesión diana | 44 (7,0) | 63 (7,3) | 0,97 (0,66-1,43) | 0,89 | 1,01 (0,68-1,49) | 0,96 | 1,20 (0,76-1,93) | 0,43 |
| Trombosis definitiva/probable del stentg | 17 (2,7) | 28 (3,3) | 0,84 (0,46-1,54) | 0,57 | 0,83 (0,45-1,55) | 0,57 | 0,80 (0,38-1,73) | 0,58 |
|
95%CI, 95% confidence interval; HR, hazard ratio; LAD, left anterior descending artery, STEMI: ST-elevation myocardial infarction. Los datos expresan Nº (%). aModelo de regresión de Cox específico ajustado a una causa concreta por sexo, situación tabáquica, enfermedad vascular periférica, intervención coronaria percutánea previa, cirugía de revascularización coronaria previa, infarto de miocardio previo y clase Killip. bModelo ampliado de regresión de Cox específico específico para una causa concreta y ajustado por comorbilidades basales y fracción de eyección del ventrículo izquierdo al alta. cObjetivo compuesto de muerte por cualquier causa, cualquier infarto de miocardio recurrente y cualquier revascularización. dLa mortalidad se adjudicó según definición del Academic Research Consortium. eEl infarto de miocardio se adjudicó según definición ampliada de la Organización Mundial de la Salud. fObjetivo compuesto de muerte cardiaca, infarto de miocardio del vaso diana, revascularización de la lesión diana y trombosis del stent. gDefinición de trombosis del stent se según el Academic Research Consortium. |
||||||||
Análisis de los puntos de referencia
El análisis de los puntos de referencia del POCE tampoco halló diferencias entre los 2 grupos en diferentes puntos temporales (figura 4A). Observando específicamente cada componente del POCE, el grupo IAMCEST-DA arrojó una tasa más alta de mortalidad por cualquier causa durante el primer año que el grupo IAMCEST-no DA (p = 0,041), aunque esta diferencia desaparecería pasado este tiempo (figura 4B). Entre los años 0 y 1, también se observó una tendencia hacia una tasa más baja de infarto de miocardio en el grupo IAMCEST-DA que en el IAMCEST-no DA (p = 0,081), que también desapareció trascurrido 1 año (figura 4C). Nunca se hallaron diferencias asociadas a cualquier revascularización (figura 4D) ni a otros objetivos secundarios entre uno y otro grupo (figura 2 del material adicional).

Figura 4. Análisis de puntos de referencia para el objetivo combinado orientado al paciente. (A), mortalidad por cualquier causa (B), infarto de miocardio (C) y cualquier revascularización (D) en pacientes estratificados según la arteria culpable. DA: descendente anterior; IM: infarto de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; POCE: objetivo combinado orientado al paciente.
DISCUSIÓN
Los principales hallazgos de este estudio pueden resumirse del siguiente modo:
a) los pacientes con IAMCEST asociado a la DA como vaso culpable tienen un perfil clínico basal distinto al de aquellos con IAMCEST asociado a otros vasos culpables; b) en la era contemporánea de la ICP, la DA como vaso culpable del IAMCEST no acarreó peores desenlaces a muy largo plazo frente a otros vasos coronarios; c) no obstante, entre los años 0 y 1, el grupo IAMCEST-DA tuvo una tasa más alta de mortalidad por cualquier causa, que luego se desapareció comparado con el grupo IAMCEST-no DA.
La comunidad cardiológica sabe (tal y como reflejan las guías clínicas de la ESC sobre el manejo del síndrome coronario agudo) que el IAMCEST con compromiso de la DA como vaso culpable es un marcador clínico de alto riesgo de eventos futuros1. Se calcula que el IAMCEST asociado a la DA representa entre el 40 y el 50% de todos los IAMCEST12,16. Su peor pronóstico se asocia a la gran cantidad de miocardio irrigado por el flujo de la DA comparado con el miocardio irrigado por otros vasos coronarios. Se debe mencionar que estos estudios se realizaron en la era pre-reperfusión4-7 y en los inicios de la era trombolítica/ICP8,9, cuando las ICP todavía no eran de uso habitual. En la era actual de las ICP, son poquísimos los estudios (con seguimientos a corto o medio plazo, de 1 a 3 años de duración) que aseguran que el IAMCEST asociado a la DA se asocia a un mayor riesgo de accidente cerebrovascular, insuficiencia cardiaca, mortalidad por cualquier causa10,17 y muerte cardiovascular11 tras una ICP.
En nuestro análisis, realizado en una cohorte en la que la que se realizaron un buen número de ICP, no parece que la DA como arteria culpable del IAMCEST tuviese un un peor pronóstico en los pacientes al año de seguimiento, ni siquiera a 10 años. Curiosamente, aquellos pacientes con IAMCEST no asociado a la DA mostraron las características clínicas clásicas de la DA, es decir, una clase de Killip avanzada en el momento de la presentación, una menor resolución del segmento ST y una menor FEVI, lo cual es similar a lo descrito en anteriores estudios8-11,17. Todas estas características clínicas desfavorables se deben a la gran cantidad de miocardio dañado en un IAMCEST asociado a la DA con la correspondiente insuficiencia cardiaca y arritmias ventriculares17-19. En cualquier caso, esto no se tradujo en peores resultados clínicos a largo plazo. De manera significativa, ni siquiera después de tener en cuenta variaciones en la FEVI (que abordamos por separado en nuestro modelo debido a su papel percibido en la cascada de resultados), hubo ninguna diferencia en los resultados, una observación que contrasta con la evidencia de que se disponía y que atribuía, parcialmente, la mayor tasa de mortalidad de esta cohorte al subsiguiente descenso en la FEVI tras el IAMCEST9,10.
Se pueden proponer varias explicaciones para entender nuestro principal hallazgo. Se podría plantear que los peores resultados asociados al IAMCEST en el segmento anterior fuese cosa del pasado tras la llegada de la ICP con rápida reperfusión miocárdica. El tratamiento farmacológico también ha mejorado de la era trombolítica a la era actual de la ICP, no solo en términos de agentes antiagregantes plaquetarios, sino también en términos de prevención secundaria (estatinas de alta intensidad e inhibidores de la enzima convertidora de angiotensina/bloqueadores de los receptores de angiotensina o inhibidores de los receptores de angiotensina/neprilisina para la disfunción del ventrículo izquierdo)20-23. Además, en nuestro estudio, el grupo IAMCEST-DA tenía un mayor número de fumadores activos. La cesación tabáquica sigue siendo la medida más importante para prevenir la enfermedad coronaria. La relación entre el tabaquismo y los resultados cardiovasculares ha sido objeto de debate ya que algunos estudios sugieren mejores resultados cardiovasculares, incluso a largo plazo, entre fumadores que han sufrido un IAMCEST24. No obstante, muchos de estos estudios son registros observacionales realizados en la era pre-ICP. La última evidencia de que se dispone asegura que el tabaquismo se asocia a peores resultados a largo plazo tras una ICP25. En este sentido, la llamada “paradoja del fumador” se explicaría por factores tales como una edad más joven y una menor prevalencia de otros factores de riesgo entre los fumadores. De hecho, en nuestro estudio, aunque había más fumadores en el grupo IAMCEST-DA, estos también tenían una menor prevalencia de otros factores de riesgo tales como enfermedad vascular periférica y antecedentes de ICP o IM previos.
Por último, aunque no por ello menos importante, al analizar los puntos de referencia hallamos que entre los años 0 y 1, la mortalidad por cualquier causa fue un evento más habitual en el grupo IAMCEST-DA. Se debe mencionar que, durante este periodo, numérica aunque no significativamente desde un punto de vista estadístico, hubo más muertes de origen cardiaco (p = 0.12), un hallazgo similar al de otras evidencias existentes que confirmaron una mortalidad relativamente más alta a corto plazo en el grupo IAMCEST-DA durante los primeros 30 días. En estos estudios, la elevada mortalidad a corto plazo se debió a secuelas agudas tales como insuficiencia cardiaca; también se especuló con que podría deberse a otras complicaciones mortales como arritmias ventriculares, shock cardiogénico o complicaciones mecánicas10,11. En nuestra cohorte, observamos una tendencia hacia una mayor tasa de reinfarto en el grupo IAMCEST-no DA (p = 0.081) que, en gran medida, no se asoció a la RLD, al IMVD ni a la trombosis del stent. Una observación que contrasta con la literatura previa que informó de más reinfartos durante el seguimiento en pacientes con IVS o DA8 (no así la CXI ni la CD9-11) como arterias culpables del infarto26.
Nuestro seguimiento a 10 años arrojó tasas similares de eventos clínicos entre los grupos IAMCEST-DA e IAMCEST-no DA, lo cual es indicativo de una ausencia de divergencia a largo plazo. Anteriores estudios mostraron un pronóstico favorable en la fase pos-aguda en pacientes con IAMCEST asociado a la DA10,11, lo cual coincide con nuestros hallazgos. De hecho, los factores no cardiacos parecen influir, más si cabe, en la mortalidad a largo plazo que la ubicación del infarto19. En este sentido, los pacientes con IAMCEST deberían recibir un manejo uniforme centrado en estrategias de prevención secundaria con independencia de la arteria culpable. Lamentablemente, la insuficiente recogida de datos a largo plazo limita una comprensión más profunda de estos resultados (como, por ejemplo, la presencia de insuficiencia cardiaca, el tratamiento médico óptimo u otras comorbilidades).
Limitaciones
El presente estudio no está exento de limitaciones. En primer lugar, se trata de un análisis post hoc no preespecificado del estudio EXAMINATION-EXTEND razón por la cual sus conclusiones deben entenderse, solo, como generadoras de hipótesis. La relación entre el infarto y los resultados podría deberse a factores de confusión no registrados en el estudio. Por si esto fuera poco, varias características clínicas y asociadas a la intervención no estuvieron disponibles para el análisis, tales como los datos clínicos específicos obtenidos durante la hospitalización o el seguimiento, incluido el tratamiento médico óptimo o la adherencia a la medicación durante el seguimiento.
CONCLUSIONES
En una cohorte contemporánea de pacientes con IAMCEST, no se observaron diferencias en el POCE entre la DA como vaso culpable del IAMCEST y otros vasos tras 10 años de seguimiento. No obstante, durante el primer año tras el IAMCEST, la mortalidad por cualquier causa fue más habitual en el grupo IAMCEST-DA. Nuestros resultados deben considerarse, por lo tanto, generadores de hipótesis únicamente. Se necesitan más estudios para evaluar específicamente la relación que existe entre la localización del infarto y los resultados en un entorno contemporáneo en el que los tratamientos intervencionistas y médicos están optimizados.
FINANCIACIÓN
El estudio EXAMINATION-EXTEND ha sido financiado por una subvención ilimitada de Abbott Vascular a la Sociedad Española de Cardiología (promotora). P. Vidal Calés ha recibido una beca de investigación otorgada por el Hospital Clínic de Barcelona (España).
CONSIDERACIONES ÉTICAS
El presente estudio se llevó a cabo de conformidad con la Declaración de Helsinki y fue aprobado por nuestro Comité de Revisión Institucional. Todos los pacientes firmaron el formulario de consentimiento informado antes de ser incluidos en el estudio. El comité de ética clínica dio su aprobación al análisis de los datos recogidos. En este trabajo, se han seguido las guías SAGER en relación al sesgo de sexo y género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se emplearon herramientas de inteligencia artificial durante la elaboración de este trabajo.
CONTRIBUCIÓN DE LOS AUTORES
Los autores confirmaron haber cumplido con todos los criterios y requisitos a efectos de autoría y haber revisado y aprobado el contenido del presente artículo. P. Vidal Calés, K. Bujak, R. Rinaldi, A. Salazar Rodríguez, S. Brugaletta y M. Sabaté contribuyeron a la idea, diseño, análisis de datos y redacción del manuscrito. Por su parte, L. Ortega-Paz, J. Gómez-Lara, V. Jiménez-Diaz, M. Jiménez, P. Jiménez-Quevedo, R. Diletti, P. Bordes, G. Campo, A. Silvestro, J. Maristany, X. Flores, A. De Miguel-Castro, A. Íñiguez, A. Ielasi, M. Tespili, M. Lenzen, N. Gonzalo, M. Tebaldi, S. Biscaglia, R. Romaguera, J. A. Gómez-Hospital y P. W. Serruys revisaron y editaron el manuscrito.
CONFLICTO DE INTERESES
M. Sabaté declaró haber recibido honorarios por su labor como consultor para Abbott Vascular e iVascular fuera del ámbito de aplicación del presente estudio. R. Romaguera es editor asociado de REC: Interventional Cardiology. Se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. El resto de los autores no ha declarado ningún conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- En pacientes con IAMCEST, la arteria culpable se considera un factor pronóstico clave.
- Esta suposición se basa en estudios previos realizados durante la era pre-reperfusión o trombolótca, que demostraron que los IAMCEST con compromiso de la descendente anterior (DA) se asociaban a peores resultados clínicos que IAMCEST con compromiso de otros vasos.
- En la era actual de la ICP, hay pocos datos sobre el impacto pronóstico a largo plazo de la DA como arteria culpable en pacientes con IAMCEST.
¿QUÉ APORTA DE NUEVO?
- Aquellos pacientes en quienes la DA es la arteria culpable de su IAMCEST tienen una mayor mortalidad por cualquier causa durante el primer año tras la ocurrencia del IAMCEST.
- No obstante, nuestro estudio encontró que esta diferencia no se mantiene más allá del primer año, lo cual sugiere que el impacto pronóstico de la arteria culpable podría asociarse al periodo inmediatamente posterior al IAMCEST.
- Además, nuestros resultados avalan que, con independencia de la ubicación del infarto, todos los pacientes con IAMCEST deben recibir atención médica uniforme a largo plazo enfocada en la implementación de estrategias de prevención secundaria.
BIBLIOGRAFÍA
1. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44:3720-3826.
2. De Luca G, Suryapranata H, van 't Hof AW, et al. Prognostic assessment of patients with acute myocardial infarction treated with primary angioplasty:implications for early discharge. Circulation. 2004;109:2737-2743.
3. Addala S, Grines CL, Dixon SR, et al. Predicting mortality in patients with ST-elevation myocardial infarction treated with primary percutaneous coronary intervention (PAMI risk score). Am J Cardiol. 2004;93:629-632.
4. Thanavaro S, Kleiger RE, Province MA, et al. Effect of infarct location on the in-hospital prognosis of patients with first transmural myocardial infarction. Circulation. 1982;66:742-747.
5. Stone PH, Raabe DS, Jaffe AS, et al. Prognostic significance of location and type of myocardial infarction:independent adverse outcome associated with anterior location. J Am Coll Cardiol. 1988;11:453-463.
6. Hands ME, Lloyd BL, Robinson JS, de Klerk N, Thompson PL. Prognostic significance of electrocardiographic site of infarction after correction for enzymatic size of infarction. Circulation. 1986;73:885-891.
7. Welty FK, Mittleman MA, Lewis SM, Healy RW, Shubrooks SJ, Jr., Muller JE. Significance of location (anterior versus inferior) and type (Q-wave versus non-Q-wave) of acute myocardial infarction in patients undergoing percutaneous transluminal coronary angioplasty for postinfarction ischemia. Am J Cardiol. 1995;76:431-435.
8. Kandzari DE, Tcheng JE, Gersh BJ, et al. Relationship between infarct artery location, epicardial flow, and myocardial perfusion after primary percutaneous revascularization in acute myocardial infarction. Am Heart J. 2006;151:1288-1295.
9. Elsman P, van 't Hof AW, de Boer MJ, et al. Impact of infarct location on left ventricular ejection fraction after correction for enzymatic infarct size in acute myocardial infarction treated with primary coronary intervention. Am Heart J. 2006;151:1239.
10. Entezarjou A, Mohammad MA, Andell P, Koul S. Culprit vessel:impact on short-term and long-term prognosis in patients with ST-elevation myocardial infarction. Open Heart. 2018;5:e000852.
11. Koga S, Honda S, Maemura K, et al. Effect of Infarction-Related Artery Location on Clinical Outcome of Patients With Acute Myocardial Infarction in the Contemporary Era of Percutaneous Coronary Intervention- Subanalysis From the Prospective Japan Acute Myocardial Infarction Registry (JAMIR). Circ J. 2022;86:651-659.
12. Sabate M, Cequier A, Iñiguez A, et al. Everolimus-eluting stent versus bare-metal stent in ST-segment elevation myocardial infarction (EXAMINATION):1 year results of a randomised controlled trial. Lancet. 2012;380:1482-1490.
13. SabatéM, Brugaletta S, Cequier A, et al. Clinical outcomes in patients with ST-segment elevation myocardial infarction treated with everolimus-eluting stents versus bare-metal stents (EXAMINATION):5-year results of a randomised trial. Lancet. 2016;387:357-366.
14. Brugaletta S, Gomez-Lara J, Ortega-Paz L, et al. 10-Year Follow-Up of Patients With Everolimus-Eluting Versus Bare-Metal Stents After ST-Segment Elevation Myocardial Infarction. J Am Coll Cardiol. 2021;77:1165-1178.
15. SabatéM, Cequier A, Iñiguez A, et al. Rationale and design of the EXAMINATION trial:a randomised comparison between everolimus-eluting stents and cobalt-chromium bare-metal stents in ST-elevation myocardial infarction. EuroIntervention. 2011;7:977-984.
16. Nabel EG, Braunwald E. A tale of coronary artery disease and myocardial infarction. N Engl J Med. 2012;366:54-63.
17. Reindl M, Holzknecht M, Tiller C, et al. Impact of infarct location and size on clinical outcome after ST-elevation myocardial infarction treated by primary percutaneous coronary intervention. Int J Cardiol. 2020;301:14-20.
18. Chen ZW, Yu ZQ, Yang HB, et al. Rapid predictors for the occurrence of reduced left ventricular ejection fraction between LAD and non-LAD related ST-elevation myocardial infarction. BMC Cardiovasc Disord. 2016;16:3.
19. Pedersen F, Butrymovich V, Kelbæk H, et al. Short- and long-term cause of death in patients treated with primary PCI for STEMI. J Am Coll Cardiol. 2014;64:2101-2108.
20. Wilt TJ, Bloomfield HE, MacDonald R, et al. Effectiveness of statin therapy in adults with coronary heart disease. Arch Intern Med. 2004;164:1427-1436.
21. Freemantle N, Cleland J, Young P, Mason J, Harrison J. beta Blockade after myocardial infarction:systematic review and meta regression analysis. BMJ. 1999;318:1730-1737.
22. Pfeffer MA, Greaves SC, Arnold JM, et al. Early versus delayed angiotensin-converting enzyme inhibition therapy in acute myocardial infarction. The healing and early afterload reducing therapy trial. Circulation. 1997;95:2643-2651.
23. Mehran R, Steg PG, Pfeffer MA, et al. The Effects of Angiotensin Receptor-Neprilysin Inhibition on Major Coronary Events in Patients With Acute Myocardial Infarction:Insights From the PARADISE-MI Trial. Circulation. 2022;146:1749-1757.
24. Barbash GI, White HD, Modan M, et al. Significance of smoking in patients receiving thrombolytic therapy for acute myocardial infarction. Experience gleaned from the International Tissue Plasminogen Activator/Streptokinase Mortality Trial. Circulation. 1993;87:53-58.
25. Yadav M, Mintz GS, Généreux P, et al. The Smoker's Paradox Revisited:A Patient-Level Pooled Analysis of 18 Randomized Controlled Trials. JACC Cardiovasc Interv. 2019;12:1941-1950.
26. Stone SG, Serrao GW, Mehran R, et al. Incidence, predictors, and implications of reinfarction after primary percutaneous coronary intervention in ST-segment-elevation myocardial infarction:the Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction Trial. Circ Cardiovasc Interv. 2014;7:543-551.

