Artículos de revisión
REC Interv Cardiol. 2019;1:41-50
Tratamiento antitrombótico tras revascularización percutánea en pacientes con indicación crónica de anticoagulación oral
Antithrombotic therapy after percutaneous revascularization in patients on chronic oral anticoagulation treatment
aServicio de Cardiología, Hospital General Universitario de Alicante, Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL), Alicante, España bÁrea de Enfermedades del Corazón, Hospital Universitario de Bellvitge – IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona, España
RESUMEN
La cardiopatía isquémica es la causa más común de mortalidad en todo el mundo. En pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST), la optimización de la intervención coronaria percutánea primaria es crucial para mejorar el pronóstico. Durante estos últimos años se han publicado muchos estudios sobre el valor de los stents de segunda generación, sobre estrategias para reducir el daño miocárdico, sobre cómo conseguir la revascularización completa y sobre dispositivos de apoyo circulatorio mecánico percutáneo que representan una opción terapéutica atractiva en pacientes con IAMCEST complicado con shock cardiogénico. En esta revisión se discute cómo se puede optimizar la intervención coronaria percutánea primaria con respecto a la selección de los stents y la estrategia de revascularización, con el fin de reducir el daño miocárdico y mejorar los resultados clínicos. Además, se revisan los datos publicados sobre el uso de dispositivos de apoyo circulatorio mecánico en pacientes con IAMCEST complicado por shock cardiogénico.
Palabras clave: Infarto de miocardio con elevación del segmento ST. Intervención coronaria percutánea. Stent farmacoactivo. Shock cardiogénico.
ABSTRACT
Ischemic heart disease is the most common cause of death worldwide. In patients with ST-segment elevation myocardial infarction (STEMI), optimizing primary percutaneous coronary intervention is crucial to improve prognosis. Over the years, many studies have been published on the value of second-generation stents, strategies to reduce myocardial damage, how to achieve complete revascularization and also on percutaneous mechanical circulatory support devices, which all are attractive therapeutic options to treat patients with STEMI complicated by cardiogenic shock. In this review we will be discussing how primary percutaneous coronary intervention can be optimized with respect to stent selection and revascularization strategy to reduce myocardial damage and improve clinical outcomes. In addition, we review published data on the use of mechanical circulatory support devices in patients with STEMI complicated by cardiogenic shock.
Keywords: ST-segment elevation myocardial infarction. Percutaneous coronary intervention. Drug eluting stent. Cardiogenic shock.
Abreviaturas
BIAC: balón intraaórtico de contrapulsación. ECMO-VA: oxigenador extracorpóreo de membrana venoarterial. EMV: enfermedad multivaso. IAMCEST: infarto agudo de miocardio con elevación del segmento ST. ICP: intervención coronaria percutánea. SC: shock cardiogénico. SFA: stent farmacoactivo. VI: ventrículo izquierdo.
INTRODUCCIÓN
La cardiopatía isquémica es la causa más común de muerte en todo el mundo. En las últimas décadas, gracias a las mejoras en la terapia de reperfusión, en la terapia antitrombótica y en la prevención primaria, la incidencia relativa del infarto de miocardio con elevación del segmento ST (IAMCEST), así como su mortalidad aguda y a largo plazo, han disminuido considerablemente1. Sin embargo, a pesar de esta disminución, la mortalidad de los pacientes con IAMCEST sigue siendo sustancial, con una mortalidad hospitalaria reportada que oscila entre el 4 y el 12% y una mortalidad a 1 año de aproximadamente el 10%2-4.
La mortalidad en pacientes con IAMCEST depende de varios factores, como la clase de Killip en el momento de la presentación, la edad avanzada, la presencia de factores de riesgo cardiovascular, la función ventricular izquierda, la extensión de la enfermedad de las arterias coronarias y el retraso en el tratamiento de reperfusión. El diagnóstico precoz y la pronta restauración del flujo sanguíneo del miocardio desde la aparición de los síntomas son esenciales para optimizar el rescate miocárdico y reducir la mortalidad5. La intervención coronaria percutánea (ICP) primaria es la estrategia de reperfusión de elección en los pacientes con IAMCEST cuando se realiza de manera oportuna5. La optimización de la estrategia primaria de reperfusión es crucial para reducir el daño miocárdico y prevenir lesiones de reperfusión.
La finalidad de esta revisión es proporcionar una visión general de los dispositivos percutáneos actuales y futuros que potencialmente mejoran el beneficio de la ICP primaria, incluidos los stents, las estrategias de revascularización y los dispositivos de soporte circulatorio mecánico para IAMCEST complicado con shock cardiogénico (SC), como el balón intraaórtico de contrapulsación (BIAC), el Impella (Abiomed, Danvers, Massachusetts, Estados Unidos), el TandemHeart (Pittsburgh, Pensilvania, Estados Unidos) y el oxigenador extracorpóreo de membrana venoarterial (ECMO-VA).
ASPIRACIÓN DEL TROMBO
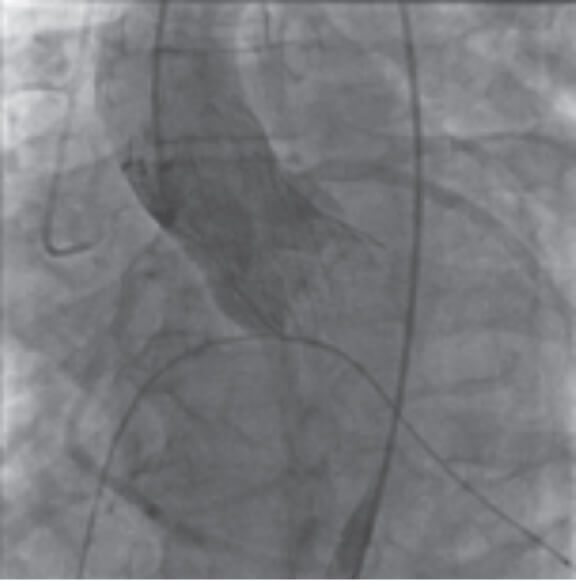
El trombo intracoronario se encuentra en la mayoría de los pacientes con IAMCEST. La embolización distal ocurre en el 5-10% de los casos y puede causar obstrucción, con sus consecuentes peores resultados6. Hace tiempo se propuso la técnica de trombectomía como una terapia adjunta para ayudar en la restauración del flujo sanguíneo coronario a nivel epicárdico, reduciendo la probabilidad de embolización distal y pudiendo reducir el fenómeno de no reflow y el tamaño del infarto. Además, podría disminuir la carga del trombo antes de la implantación del stent, y descender así la tasa de complicaciones relacionadas con el stent por su malaposición. La aspiración manual del trombo se recomendó sistemáticamente en la ICP primaria tras la realización de ensayos aleatorizados pequeños y de un metanálisis que mostraron mejoras en la reperfusión y una reducción en la mortalidad de causa cardiaca7-9. Sin embargo, tras la publicación de 2 grandes estudios aleatorizados, que fueron adecuadamente potenciados para detectar la superioridad de la aspiración manual sistemática frente a la ICP, solo se ha producido un cambio en la recomendación5. Tanto el ensayo clínico aleatorizado TOTAL (n = 10.732 pacientes) como el TASTE (n = 7.244 pacientes) no mostraron ninguna diferencia con la trombectomía en cuanto a resultados clínicos, en comparación con la ICP sola10,11. Además, se planteó un problema de seguridad en el ensayo TOTAL relacionado con el aumento del riesgo de ictus en los pacientes tratados con trombectomía frente a los de ICP sola12.
A raíz de estos datos, la aspiración de trombos ya no se recomienda como estrategia sistemática en los pacientes con IAMCEST tratados con ICP primaria. Sin embargo, se podría considerar en aquellos con alta carga de trombo después de la recanalización del vaso. Un subanálisis del ensayo EXAMINATION (n = 1.498) mostró que el uso de trombectomía se asociaba a una mayor tasa de colocación de stent directo, una menor tasa de posdilatación y un menor número de stents implantados con un tamaño de stent más grande13. Sin embargo, el resultado angiográfico optimizado no tuvo ningún impacto en los resultados a largo plazo, ya que no se observaron diferencias en los objetivos clínicos entre los grupos con un seguimiento de 2 años.
ELECCIÓN DEL TIPO DE STENT
El implante de un stent coronario es el tratamiento recomendado durante la ICP primaria en los pacientes con IAMCEST. La implantación directa de stents sin predilatación en lesiones causantes de un IAMCEST puede reducir la embolización de los componentes de la placa, disminuyendo la incidencia del fenómeno de no reflow y aumentando así la perfusión miocárdica14. Esta hipótesis se confirmó en el análisis post hoc del HORIZONS-AMI y en el registro EUROTRANSFER; ambos mostraron una reducción de la mortalidad a 1 año relacionada con el uso de la técnica de stent directo15,16.
También se ha propuesto la implantación diferida del stent tras la restauración del flujo coronario mediante una intervención mecánica minimalista con la finalidad de reducir el riesgo del fenómeno de no reflow17. Varios estudios observacionales mostraron un beneficio, en términos de mejora de la fracción de eyección ventricular izquierda y menor tasa de eventos adversos, con el implante diferido del stent en comparación con la colocación inmediata en pacientes con IAMCEST18,19. Además, en un estudio aleatorizado de prueba de concepto (DEFER-STEMI, n = 411) se comunicó una menor tasa de no reflow con el implante diferido de stent en una población de pacientes con IAMCEST20. Sin embargo, el ensayo DANAMI 3-DEFER aleatorizó a 1.215 pacientes con IAMCEST para recibir un implante de stent diferido o inmediato, y a los 2 años de seguimiento no se encontraron diferencias en el objetivo primario (mortalidad por todas las causas, ingreso hospitalario por insuficiencia cardiaca, infarto recurrente y cualquier revascularización no planeada) entre los grupos de estudio (18 frente a 17%; hazard ratio [HR] = 0,99; intervalo de confianza del 95% [IC95%], 0,76-1,29; p = 0,92)21. Más tarde, el ensayo aleatorizado MIMI (n = 140), en el que se excluyó a los pacientes con alta carga de trombos, y el estudio INNOVATION (n = 114) tampoco mostraron una disminución en el tamaño del infarto ni en la obstrucción microvascular con la estrategia de implante de stent diferido en comparación con el implante inmediato22,23. Finalmente, un metanálisis de ensayos aleatorizados y estudios observacionales no encontró ninguna mejora en las tasas de no reflow, muerte, infarto de miocardio ni revascularización repetida con la estrategia de implante diferido de stent en los pacientes con IAMCEST24. Sorprendentemente, sí se encontró una mejoría en la función del ventrículo izquierdo (VI) a largo plazo. Por todas estas razones, en la actualidad no se recomienda la estrategia de implante de stent diferido en la ICP primaria.
Otro aspecto que considerar en la ICP primaria es qué dispositivo implantar. Muchos ensayos aleatorizados y metanálisis evaluaron la primera generación de stents farmacoactivos (SFA), liberadores de sirolimus o paclitaxel, y mostraron una reducción en la tasa de reestenosis y de revascularización de la lesión diana en comparación con los stents convencionales de metal (BMS, bare metal stents)25-32. Sin embargo, pronto surgieron preocupaciones con respecto a la seguridad debido a un aumento de la tasa de trombosis tardía de los SFA de primera generación33-35.
Para superar este problema se desarrollaron SFA de segunda generación con diferentes fármacos, struts más finos y polímeros duraderos o bioabsorbibles más biocompatibles. En el ensayo COMFORTABLE AMI, 1.161 pacientes con IAMCEST fueron aleatorizados 1:1 para recibir BMS o SFA liberador de biolimus con polímero biodegradable. Tras 1 año de seguimiento, se encontró una tasa más baja de eventos cardiovasculares adversos mayores en el grupo de SFA de biolimus comparado con el de BMS (4,3 frente a 8,7%; HR = 0.49; IC95%, 0,30-0,80; p = 0,044), principalmente por el menor riesgo de infarto de miocardio espontáneo y la revascularización de la lesión diana36. Igualmente, a los 2 años de seguimiento se halló una menor tasa de eventos cardiacos mayores en el grupo con SFA de biolimus (5,8 frente a 11,9%; HR = 0,48; IC95%, 0,31-0,72]; p < 0,001)37. Tanto a 1 como a 2 años de seguimiento, las tasas de trombosis definitiva o probable del stent también fueron más bajas con el SFA, aunque sin significación estadística36,37.
En el estudio EXAMINATION38,39 se aleatorizó a 1.498 pacientes con IAMCEST para recibir un SFA de segunda generación liberador de everolimus (EES, everolimus-eluting stent) o un BMS. Tras 1 año de seguimiento, el EES resultó ser superior al BMS, con unas tasas significativamente más bajas de trombosis definitiva y de trombosis definitiva o probable (0,5 frente a 1,9% y 0,9 frente a 2,5%, respectivamente; p = 0,019 para ambas)38. Además, a los 5 años de seguimiento, en el grupo de EES se redujo significativamente la tasa de mortalidad por todas las causas en comparación con el de BMS (9 frente a 12%; HR = 0,72; IC95%, 0,52-0,10; p = 0,047)39. Por otro lado, en un metanálisis de los ensayos clínicos EXAMINATION y CONFORTABLE-AMI se encontró una reducción significativa del riesgo de trombosis definitiva con el uso del SFA (HR = 0,35; IC95%, 0,16-0,75; p = 0,006) en comparación con el BMS40. Dadas las conclusiones de estos estudios, el SFA es actualmente el dispositivo de elección según las guías de práctica clínica de la Sociedad Europea de Cardiología para el tratamiento del IAMCEST5.
Los investigadores del estudio EXAMINATION han comunicado los resultados del seguimiento a 10 años, que confirman la superioridad de los EES sobre los BMS en cuanto a eventos adversos cardiacos relacionados con el paciente o con el dispositivo. Entre 5 y 10 años de seguimiento, en ambos grupos se encontró una baja incidencia de eventos cardiovasculares adversos relacionados con un fallo del dispositivo41.
Los armazones totalmente bioabsorbibles (BVS, bioresorbable vascular scaffold) se desarrollaron con el objetivo de superar la limitación a largo plazo de la presencia permanente del metal dentro de la arteria coronaria. Los datos sobre su uso en el IAMCEST son limitados. Aunque ya no estén disponibles para uso clínico, creemos que es importante conocer los datos existentes. Las experiencias iniciales con el Absorb BVS (Abbott Vascular, Illinois, Estados Unidos) en el IAMCEST mostraron resultados clínicos tanto positivos como negativos42-44. El ensayo TROFI II aleatorizó a 191 pacientes con IAMCEST para recibir BVS o EES, y no encontró diferencias entre los 2 grupos en términos de cicatrización de la arteria relacionada con el infarto45. Sin embargo, en otros estudios surgieron preocupaciones por la alta tasa de trombosis con el dispositivo BVS. En el estudio BVS EXAMINATION se compararon la eficacia y la seguridad de los BVS frente a los EES en pacientes con IAMCEST, y a 1 y 2 años de seguimiento no se encontraron diferencias entre los grupos en la variable compuesta orientada al dispositivo46,47. Cabe destacar que, a 2 años de seguimiento, la tasa de trombosis definitiva tendió a ser más alta en el grupo de BVS que en el de EES (3,3 frente a 1,0%; p = 0,081). A los 5 años de seguimiento, el riesgo de la variable compuesta orientada al dispositivo fue mayor en el grupo de BVS, lo que sugiere que la probabilidad de obtener resultados favorables en un seguimiento a muy largo plazo es baja48.
Para reducir la tasa de eventos adversos se diseñó el estudio BVS STEMI STRATEGY-IT, que demostró que una estrategia de implantación de BVS preespecificada en pacientes con IAMCEST a quienes se había realizado una ICP primaria era factible y proporcionaba buenos resultados clínicos a 30 días y al año (tasa de trombosis del dispositivo: 0,2 y 0,4%, respectivamente)49,50.
Cabe destacar que los resultados a largo plazo de los ensayos aleatorizados en los que se demostró una incidencia significativamente mayor de trombosis con el BVS fueron el motivo de su retirada del mercado51-53.
El Magmaris (Biotronik, Bülach, Suiza) es un stent de magnesio absorbible liberador de sirolimus. Inicialmente ha mostrado resultados prometedores a 1 año de seguimiento en pacientes estables, con datos muy limitados sobre el IAMCEST54. El estudio MAGSTEMI es el único ensayo clínico aleatorizado que ha comparado la eficacia y la seguridad del Magmaris en pacientes con IAMCEST55. En dicho estudio se aleatorizaron 150 pacientes para ser tratados con ICP primaria con Magmaris o con stents liberadores de sirolimus utilizando una técnica de implantación preespecificada. En comparación con el stent liberador de sirolimus, el Magmaris demostró una mayor capacidad de respuesta vasomotora a los agentes farmacológicos (ya fueran independientes o dependientes del endotelio) a 1 año de seguimiento. Sin embargo, el Magmaris se asoció con una menor eficacia angiográfica y con una mayor tasa de reestenosis clínica, aunque sin problemas en cuanto a trombosis56. En el subestudio preespecificado MAGSTEMI-tomografía de coherencia óptica, tanto con el Magmaris como con el stent liberador de sirolimus se observó un bajo grado de curación de la neoíntima, pero las dimensiones de la luz fueron menores con el Magmaris a 1 año de seguimiento. Aunque el estado avanzado de biorresorción del Magmaris dificulta la evaluación del colapso del andamio, este parece ser el principal mecanismo de reestenosis57,58. También se han comunicado casos en los cuales la reabsorción del Magmaris se ha retrasado de manera significativa y se han encontrado restos intraluminales del andamio tras más de 2 años desde su implantación59.
ENFERMEDAD CORONARIA MULTIVASO
Aproximadamente el 50% de los pacientes con IAMCEST presentan enfermedad multivaso (EMV)60. Numerosos ensayos clínicos han evaluado cuál es la mejor estrategia de revascularización: tratamiento únicamente de la lesión causante o revascularización completa. El ensayo PRAMI aleatorizó a 465 pacientes con IAMCEST con EMV para recibir tratamiento solo de la lesión causante o revascularización de todas las lesiones obstructivas (estenosis angiográfica > 50%) durante el procedimiento índice. La revascularización completa en el momento del procedimiento índice se asoció a una reducción del riesgo relativo del 65% en el objetivo primario (muerte cardiaca, infarto o angina refractaria) en comparación con el tratamiento solo de la lesión culpable61. Del mismo modo, el ensayo CvLPRIT (n = 269) mostró que la revascularización completa (estenosis angiográfica > 70% ) durante la hospitalización índice fue superior a la ICP únicamente de la lesión culpable del infarto en la variable resultado compuesta de muerte, reinfarto, insuficiencia cardiaca y revascularización repetida, a los 12 meses de seguimiento62.
Se ha propuesto la medición de la reserva fraccional de flujo coronario para guiar la necesidad de revascularización de lesiones no culpables. El ensayo DANAMI-3-PRIMULTI (n = 627) mostró que la revascularización completa guiada por la reserva fraccional de flujo redujo significativamente el riesgo de eventos adversos cardiacos futuros en comparación con ninguna otra intervención invasiva después de la ICP primaria. Este efecto se debe a un número significativamente menor de revascularizaciones repetidas, porque la mortalidad por todas las causas y el reinfarto no mortal no difirieron entre los grupos63. Además, el ensayo Compare-Acute (n = 885) mostró que la revascularización completa guiada por la reserva fraccional de flujo durante el procedimiento índice redujo de manera significativa la incidencia de eventos adversos cardiacos64.
El ensayo clínico COMPLETE incluyó 4.041 pacientes que fueron aleatorizados para revascularización completa o tratamiento solo de la lesión causante, y que fueron seguidos durante 3 años. La revascularización completa fue superior a la ICP únicamente de la lesión causante para reducir el riesgo de muerte de causa cardiovascular o de infarto de miocardio, así como el riesgo de muerte de causa cardiovascular, de infarto de miocardio o de revascularización inducida por isquemia65. Actualmente, el estudio BioVasc (NCT03621501) está investigando cómo perfeccionar el algoritmo de tratamiento para los pacientes con síndrome coronario agudo y EMV en cuanto al momento óptimo para la revascularización completa, inmediata frente a diferida66.
De acuerdo con las guías de la Sociedad Europea de Cardiología, durante la hospitalización, antes del alta hospitalaria, se debe considerar la revascularización completa de las lesiones no culpables en los pacientes con IAMCEST y EMV5. Sin embargo, es probable que esta indicación cambie tras la publicación de los resultados del estudio COMPLETE.
En el caso específico de los pacientes con IAMCEST y SC, el ensayo CULPRIT-SHOCK aleatorizó a 1.075 pacientes con IAMCEST complicados por SC con EMV para ser tratados con ICP sobre la arteria relacionada con el infarto o con ICP multivaso de todas las lesiones (estenosis angiográfica > 70%). Tanto a los 30 días como a 1 año de seguimiento, se encontró que la ICP únicamente de la lesión culpable redujo de manera significativa el riesgo de muerte o de terapia de reemplazo renal67,68. La diferencia fue impulsada en especial por una mortalidad significativamente menor. En este sentido, la Sociedad Europea de Cardiología ha publicado una actualización de la guía de IAMCEST en la que, en caso de IAMCEST con SC y EMV, se recomienda el tratamiento solo de la lesión causante del evento agudo69.
SHOCK CARDIOGÉNICO
Alrededor del 5-8% de los pacientes con un IAMCEST también presentan SC, que se define como hipotensión persistente (presión sistólica < 90 mmHg) con signos de hipoperfusión periférica. El SC es una de las principales causas de muerte, con unas tasas de mortalidad intrahospitalaria que pueden superar el 50%70. En los pacientes con SC refractario al tratamiento farmacológico, el soporte circulatorio mecánico percutáneo puede reducir el trabajo del VI y la demanda de oxígeno, mantener la perfusión de los órganos y de las coronarias, y servir de puente a una terapia definitiva71,72. Actualmente existen dispositivos de asistencia del VI a la aorta (BIAC e Impella), de la aurícula izquierda a la circulación arterial sistémica (TandemHeart) y de la aurícula derecha a la circulación arterial sistémica (ECMO-VA). Las características técnicas de los dispositivos de soporte circulatorio mecánico percutáneo actualmente disponibles se detallan en la tabla 1.
Tabla 1. Características técnicas de los dispositivos de soporte circulatorio mecánico percutáneo disponibles
| BIAC | Impella | TandemHeart | ECMO-VA | |
|---|---|---|---|---|
| Efecto hemodinámico | Descarga de presión y volumen del VI | Descarga de presión y volumen del VI | Descarga de volumen del VI | Descarga de presión y volumen del VD y del VI |
| Mecanismo | Aorta | VI a aorta | AI a aorta | AD a aorta |
| Flujo cardiaco | 0,3-0,5 l/min | 1-5 l/min | 2,5-5 l/min | 3,0-7,0 l/min |
| Resistencias periféricas | ↓ | ↓ | ↑ | ↑↑↑ |
| Tamaño | 8 Fr | 13-22 Fr | 21 Fr de entrada y 15-17 Fr de salida | 18-21 Fr de entrada y 15-22 Fr de salida |
| Complejidad de la implantación | Baja | Moderada con Impella 2,5 Alta con Impella 5,0 | Alta | Alta |
| Duración recomendada del uso | Semanas | 7 días | 14 días | 7 días |
| Contraindicaciones | Insuficiencia aórtica grave Disección aórtica Vasculopatía periférica grave | Valvulopatía aórtica grave Válvula mecánica aórtica Trombo en el VI Vasculopatía periférica grave Contraindicación para la anticoagulación | Vasculopatía periférica grave Trombo en la AI Contraindicación para la anticoagulación Insuficiencia aórtica moderada a grave Defectos del tabique interventricular | Insuficiencia aórtica moderada a grave Vasculopatía periférica grave Contraindicación para la anticoagulación |
| Complicaciones* | Trombocitopenia Trombosis Obstrucción del flujo arterial por incorrecta posición Disección o rotura aórtica Embolia de placa o aire | Hemólisis Migración del dispositivo Lesión o insuficiencia aórtica Perforación o taponamiento del VI Arritmia ventricular | Migración de la cánula Perforación o taponamiento del VI Tromboembolia Embolia aérea durante la inserción de la cánula Desarrollo de derivación interauricular | Trombosis del circuito Hipoxia de la parte superior del cuerpo por oxigenación retrógrada incompleta Dilatación del VI Embolia gaseosa sistémica |
|
* Complicaciones comunes a todos los dispositivos: hemorragia e infecciones relacionadas o no con el sitio de punción, complicación vascular y daño neurológico. AD: aurícula derecha; AI: aurícula izquierda; BIAC: balón de contrapulsación aórtica; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; VD: ventrículo derecho; VI: ventrículo izquierdo. |
||||
Dispositivos de asistencia del ventrículo izquierdo a la aorta
Balón intraaórtico de contrapulsación
El balón intraaórtico de contrapulsación (BIAC) es el dispositivo de soporte mecánico que más se utilizó hasta 2010, pero desde entonces su uso ha disminuido de manera importante tras los resultados de los ensayos clínicos en los que se cuestionó su eficacia73. Requiere un introductor de 8 Fr en la arteria femoral o axilar, y consiste en un globo montado en un catéter que se coloca en la aorta descendente y que se infla durante la diástole y se desinfla durante la sístole. El BIAC aumenta la presión aórtica diastólica, reduce la presión sistólica aórtica, aumenta la presión arterial media sistémica, reduce el volumen y la presión diastólica del VI, y aumenta la presión de perfusión coronaria. Sin embargo, el soporte hemodinámico proporcionado por el BIAC se correlaciona estrictamente con la función del VI, ya que es menos eficaz cuando este presenta una disfunción grave.
Los ensayos observacionales y metanálisis han apoyado históricamente el uso de BIAC en los pacientes con IAMCEST complicado por SC74-76. No obstante, los ensayos aleatorizados prospectivos no demostraron ningún beneficio del tratamiento con BIAC en los pacientes con IAMCEST con o sin SC. El ensayo CRISP AMI (n = 337) mostró que la implantación de un BIAC inmediatamente antes de la ICP para un IAMCEST anterior sin SC no reducía el tamaño del infarto ni mejoraba la supervivencia a corto plazo77. El ensayo TACTICS aleatorizó a 57 pacientes con infarto agudo y posfibrinólisis a 48 horas para ser tratados con BIAC o con terapia médica óptima, y no se hallaron diferencias en la variable de mortalidad a 6 meses78. Además, el ensayo IABP SHOCK6 aleatorizó a 45 pacientes con IAMCEST y SC para recibir implante de BIAC o tratamiento médico habitual, y no se encontraron mejorías hemodinámicas significativas tras el tratamiento adicional con BIAC79.
El ensayo IABP SHOCK II aleatorizó a 600 pacientes con IAMCEST y SC no asociado a complicaciones mecánicas para comparar el implante de BIAC con la terapia médica óptima80. Se esperaba que todos los pacientes se sometieran a una revascularización temprana (predominantemente con ICP) y recibieran la mejor atención médica disponible. A los 30 días, no hubo diferencias con respecto a la mortalidad por todas las causas entre el BIAC y la terapia médica óptima (39,7 frente a 41,3%; riesgo relativo 0,96; IC95%, 0,79-1,17; p = 0,69), y tampoco en la duración de la estancia en la unidad de cuidados intensivos, la función renal, la hemorragia mayor, las complicaciones isquémicas periféricas, la sepsis y el accidente cerebrovascular80. A los 12 meses de seguimiento , seguía sin haber diferencias en cuanto a la mortalidad y los objetivos secundarios81. Un metanálisis de 12 ensayos controlados aleatorizados y 15 estudios observacionales no halló ningún beneficio de la terapia con BIAC en el IAMCEST en la mortalidad a 30 días, independientemente de la presencia (odds ratio [OR] = 0,94; IC95%, 0,69–1,28) o la ausencia (OR = 0,98; IC95%, 0,57-1,69) de SC. En la actualidad, de acuerdo con estos estudios, en la guía de práctica clínica de la Sociedad Europea de Cardiología no se indica el BIAC sistemáticamente en los pacientes con SC5.
Impella
El Impella es una bomba de flujo axial continuo que se coloca en el VI de forma retrógrada a través de la válvula aórtica y proporciona soporte activo mediante la expulsión de sangre succionada del VI en la aorta ascendente, restaurando así el flujo sanguíneo a los órganos isquémicos82. El Impella aumenta la presión arterial media, reduce la presión y el volumen del VI, y aumenta el flujo coronario. El sistema Impella está disponible en 3 tamaños diferentes: 2,5 (salida máxima de 2,5 l/min), 3,7 (Impella CP, salida máxima de 3,7 l/min) y 5,0 (salida máxima de 5 l/min); los dispositivos más pequeños se pueden colocar percutáneamente a través de un introductor de 12-14 Fr, mientras que el dispositivo 5,0 necesita un introductor de 22 Fr82.
Dos grandes registros han demostrado la seguridad del Impella 2,5 en la ICP compleja de alto riesgo83,84. El ensayo ISAR-SHOCK aleatorizó a 26 pacientes con IAMCEST y SC para recibir Impella 2,5 o BIAC. El objetivo, que era el cambio en el índice cardiaco desde el inicio hasta 30 minutos después de la implantación, mejoró significativamente en el grupo de Impella, pero los resultados para los objetivos secundarios, como la acidosis láctica, la hemólisis y la mortalidad después de 30 días, no fueron diferentes entre los 2 grupos85. A 30 días de seguimiento, la mortalidad total de la cohorte fue del 46%. El ensayo IMPRESS in Severe Shock aleatorizó a 48 pacientes con ventilación mecánica asociada a SC después de un IAMCEST para ser tratados con Impella o con BIAC. Cabe destacar que el momento de colocación del dispositivo lo decidía el médico tratante. El ensayo mostró que, en comparación con el BIAC, el Impella no redujo la mortalidad a 30 días, y la mortalidad global a 6 meses fue del 50%86. Tanto las complicaciones vasculares como las hemorragias graves fueron más frecuentes en el grupo de Impella.
Hay que recalcar que, hasta el momento, el dispositivo Impella no se ha comparado con la terapia estándar en los pacientes con SC en un ensayo clínico aleatorizado adecuadamente potenciado en muestra para eventos clínicos relevantes. En este sentido, el ensayo clínico DanGer Shock (NCT01633502) incluirá 360 pacientes con IAMCEST y SC, que serán aleatorizados para recibir soporte circulatorio con Impella o tratamiento médico habitual87. El estudio está aún en fase de inclusión de pacientes y su objetivo principal es la muerte por cualquier causa a los 6 meses de seguimiento.
En 2018 se introdujo un concepto innovador, que fue el uso de Impella para la descarga del VI para disminuir el tamaño del infarto de miocardio en modelos animales de IAMCEST sin SC88. Estos modelos animales llevaron al diseño y la realización del estudio piloto DTU-STEMI, que aleatorizó a 50 pacientes con IAMCEST sin SC para ser tratados con descarga del VI con Impella CP o recibir tratamiento médico óptimo. En este estudio se observó que la terapia de descarga del VI antes de la reperfusión del IAMCEST con Impella fue factible y no se asoció a un retraso importante de la reperfusión del IAMCEST89, aunque el uso de la terapia de descarga no se asoció a una disminución del tamaño del infarto a 1 mes de seguimiento. Actualmente se encuentra en fase de inclusión de pacientes el ensayo clínico DTU-STEMI (NCT03947619), con una muestra prevista de 668 pacientes, que probará la hipótesis del uso de la terapia de descarga del VI con Impella CP para la disminución del tamaño del infarto evaluado con resonancia magnética cardiaca.
Dispositivos de asistencia de la aurícula izquierda a la circulación arterial sistémica
TandemHeart
El TandemHeart es un dispositivo de asistencia extracorpórea que extrae sangre oxigenada de la aurícula izquierda y la bombea a la aorta abdominal inferior o a las arterias ilíacas para evitar pasar por el VI. La cánula de entrada se inserta mediante un acceso de venas femorales de 21 Fr y se avanza a través del tabique interatrial hacia la aurícula izquierda. La cánula arterial de salida oscila entre 15 y 17 Fr, y el sistema puede proporcionar hasta 5 l/min de flujo sanguíneo90. El dispositivo reduce esencialmente la precarga del VI y el volumen de la aurícula izquierda, desplazando la sangre de la aurícula izquierda y reduciendo así el estrés y el trabajo del VI, y por otro lado aumenta la presión arterial media sistémica y la perfusión miocárdica.
Existe poca experiencia en cuanto a registros y estudios con este dispositivo. Thiele et al.91 comunicaron su experiencia con el uso de TandemHeart en 18 pacientes con IAMCEST y SC, en los que el dispositivo proporcionó hasta 4 l/min de gasto cardiaco asistido. Los pacientes mostraron mejoras en el índice cardiaco y en la presión arterial media y la reducción de la arteria pulmonar, la presión capilar pulmonar y las presiones venosas centrales durante una media de 4 días de asistencia. Kar et al.92 publicaron una serie de 117 pacientes con SC tratados con TandemHeart, y el uso de este dispositivo revirtió rápidamente el compromiso hemodinámico terminal observado en los pacientes con IAMCEST con SC refractario al BIAC y al soporte vasopresor. En un ensayo clínico aleatorizado se incluyó a 42 pacientes que fueron tratados con BIAC (n = 14) o con TandemHeart (n = 19). El dispositivo TandemHeart mejoró significativamente los parámetros hemodinámicos, incluso en los pacientes refractarios al BIAC. Sin embargo, la mortalidad fue similar en ambos grupos93. Actualmente no tenemos conocimiento de ensayos clínicos aleatorizados relacionados con esta tecnología.
Dispositivos de la aurícula derecha a la circulación arterial sistémica
Oxigenador extracorpóreo de membrana
El ECMO-VA es un dispositivo de soporte cardiopulmonar que aspira sangre de la vena femoral o de la vena yugular interna a través de una cánula de 21 Fr. Mediante un pulmón de membrana artificial elimina el dióxido de carbono y agrega oxígeno a la sangre venosa, que luego se devuelve al sistema arterial a través de una cánula de salida de 15-22 Fr en la arteria femoral o axilar93. Una de las mayores ventajas del ECMO es que se puede colocar en casi todas partes (en la sala de emergencias, en la sala, en el laboratorio de cateterismo, etc.), ya que es completamente transportable y no se requiere fluoroscopia ni guía de ecocardiografía para una implantación exitosa. El dispositivo proporciona un soporte circulatorio de hasta 7 l/min en los pacientes con insuficiencia circulatoria y respiratoria. Como limitaciones, el sistema ECMO-VA no puede descargar el VI y puede causar un aumento de la poscarga, lo cual se asocia a distensión del VI, empeoramiento de la función del VI, trombo en el VI y edema o hemorragia pulmonar intratable94. Por estas razones se ha propuesto que se combine el ECMO con otros dispositivos, como el BIAC y el Impella, con el objetivo de disminuir las presiones arteriales pulmonares y reducir las dimensiones del VI95,96. En un estudio multicéntrico de cohorte internacional se analizaron 686 pacientes consecutivos con SC (no exclusivamente por IAMCEST) tratados con ECMO. Los pacientes en quienes se realizó una descarga del VI con Impella tuvieron un mejor pronóstico con una menor mortalidad, a pesar de presentar mayores tasas de complicaciones hemorrágicas y vasculares asociadas al sitio del implante97. Otros autores también recomiendan intervenciones como la septostomía auricular percutánea, para permitir la derivación de izquierda a derecha, o la administración de dobutamina para mejorar la contractilidad y disminuir la carga posterior94.
Son contraindicaciones absolutas para la implantación de ECMO la regurgitación aórtica, la disección aórtica, la enfermedad arterial periférica grave y ciertas consideraciones éticas90. La hemorragia activa es una contraindicación relativa, porque el ECMO requiere heparina para la anticoagulación; sin embargo, se ha utilizado sin he- parina en algún caso de alto riesgo, ya que era la única estrategia para salvar la vida del paciente98. Las complicaciones son principalmen- te vasculares, como isquemia de piernas, síndrome compartimental, sangrado mayor, accidente cerebrovascular, embolia aérea e infección significativa90.
A pesar de que el ECMO se utiliza ampliamente en centros experimentados, los datos que apoyan su uso en pacientes con infarto agudo de miocardio complicado por SC provienen en gran parte de pequeñas series de casos de un solo centro. Sheu et al.99 llevaron a cabo un registro observacional retrospectivo de un solo centro para comparar los resultados clínicos de los pacientes con IAMCEST tratados con ICP primaria. Los investigadores consideraron 2 periodos diferentes: 1993-2002 para la cohorte no ECMO y 2002-2009 para la cohorte ECMO. El estudio mostró que la ICP asistida con ECMO mejoró los resultados a 30 días. Sin embargo, la interpretación de estos resultados es difícil debido a las importantes discrepancias en las estrategias de tratamiento entre los grupos. En otro estudio, Muller et al.100 incluyeron 138 pacientes con IAMCEST tratados con ECMO. Desarrollaron una escala de puntuación del riesgo de mortalidad en la unidad de cuidados intensivos, llamada puntuación ENCOURAGE, y las variables asociadas a peor pronóstico fueron la edad > 60 años, el sexo femenino, el índice de masa corporal > 25, la puntuación en la escala de Glasgow < 6, la creatinina y el lactato séricos elevados, y el tiempo de protrombina < 50%. Las tasas de supervivencia a 6 meses y 1 año fueron del 41 y el 38%, respectivamente.
Actualmente se está estudiando el efecto del uso de ECMO-VA sobre la mortalidad de los pacientes con IAMCEST complicado con SC en 3 ensayos clínicos aleatorizados: EUROSHOCK (NCT03813134), ANCHOR (NCT04184635) y ECLS-SHOCK (NCT03637205)101. Además de evaluar la mortalidad, estos estudios serán una oportunidad para investigar la indicación, el modo y el efecto de la descarga del VI102.
CONCLUSIÓN
A pesar de las mejoras en la terapia de reperfusión, la mortalidad de los pacientes con IAMCEST sigue siendo alta. Junto con la terapia farmacológica, la rápida restauración del flujo coronario y la implantación de stents son las estrategias recomendadas (figura 1). No se indica de manera sistemática el uso de tromboaspiración manual debido a la ausencia de beneficio clínico en comparación con la ICP sola. Con respecto a la elección del tipo de dispositivo, los SFA de segunda generación son el tratamiento de elección en los pacientes con IAMCEST que reciben ICP primaria, dado que tienen mejores resultados tanto a corto como largo plazo cuando se comparan con los BMS y los SFA de primera generación. En los pacientes con IAMCEST y EMV, la evidencia actual lleva a que se recomiende la revascularización completa, aunque el mejor momento para realizarla aún es motivo de estudio. Exclusivamente en los pacientes con SC se recomienda la revascularización solo de la lesión relacionada con el infarto. Sin lugar a duda, el escenario clínico en el que no se ha avanzado de forma importante es el de los pacientes con IAMCEST complicado con SC, cuya mortalidad sigue siendo de un 40-50%. En la actualidad están en marcha diversos ensayos clínicos para evaluar el efecto de los dispositivos de asistencia circulatoria, específicamente el Impella y el ECMO-VA, en la mortalidad de estos pacientes.
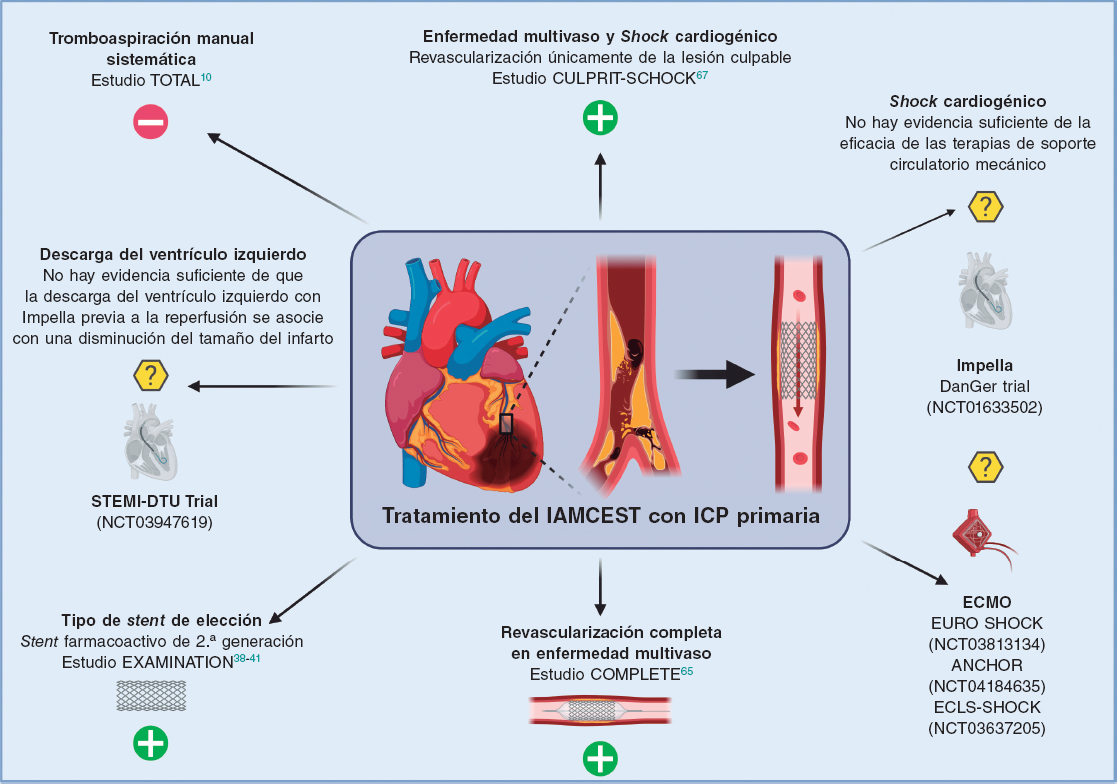
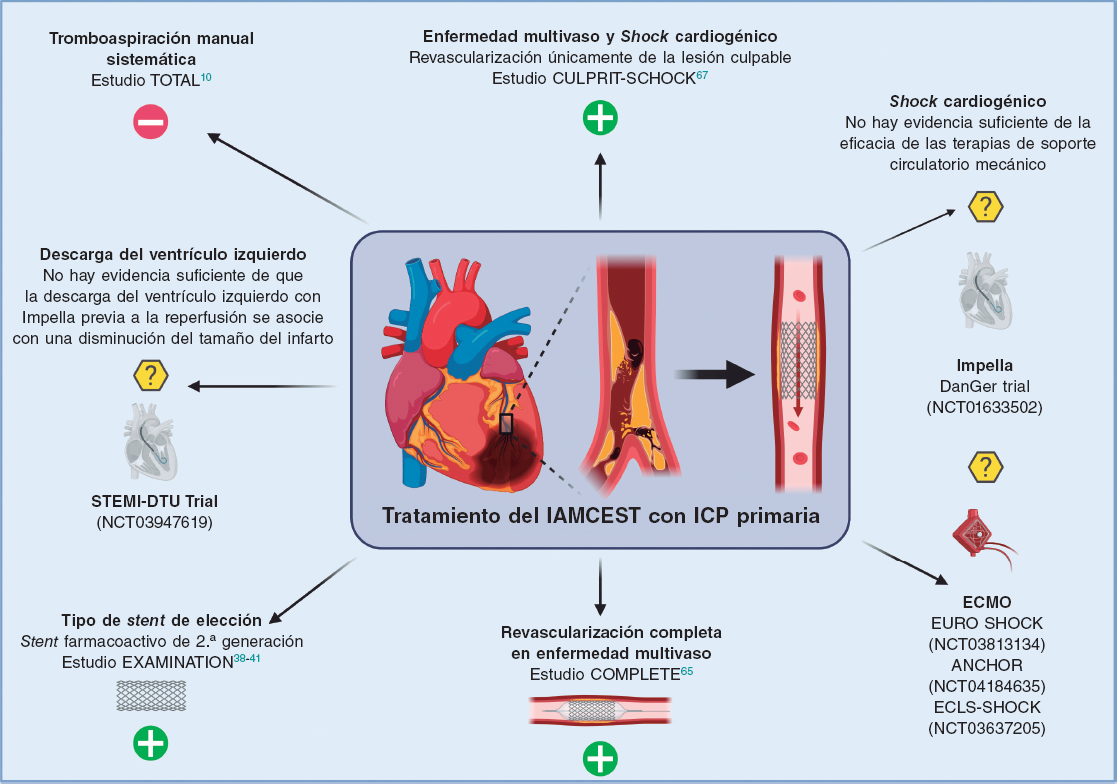
Figura 1. Evidencia actual y perspectivas futuras del intervencionismo percutáneo en el infarto de miocardio con elevación del segmento ST. El símbolo «+»en verde indica que es una intervención recomendada por las guías clínicas de la Sociedad Europea de Cardiología; el símbolo «–» en rojo significa no recomendado; el símbolo «?» en amarillo señala que no hay suficiente evidencia a favor ni en contra para su recomendación. ECMO: oxigenador extracorpóreo de membrana; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
L. Ortega-Paz escribió un borrador de la revisión sobre el estado actual del tratamiento intervencionista del infarto de miocardio. S. Brugaletta y M. Sabaté revisaron críticamente el manuscrito e hi- cieron los cambios oportunos en el contenido y formato del mismo.
CONFLICTO DE INTERESES
M. Sabaté ha realizado labores de consultoría para Abbott Vascular e IVascular sin relación con este trabajo. S. Brugaletta ha realizado labores de consultoría para Boston Scientific e IVascular sin relación con este trabajo. L. Ortega-Paz declara no tener ningún conflicto de intereses.
BIBLIOGRAFÍA
1. Sugiyama T, Hasegawa K, Kobayashi Y, Takahashi O, Fukui T, Tsugawa Y. Differential time trends of outcomes and costs of care for acute myocardial infarction hospitalizations by ST elevation and type of intervention in the United States, 2001-2011. J Am Heart Assoc. 2015;4:e001445.
2. Kristensen SD, Laut KG, Fajadet J, et al. Reperfusion therapy for ST elevation acute myocardial infarction 2010/2011:current status in 37 ESC countries. Eur Heart J. 2014;35:1957-1970.
3. Pedersen F, Butrymovich V, Kelbaek H, et al. Short- and long-term cause of death in patients treated with primary PCI for STEMI. J Am Coll Cardiol. 2014;64:2101-2108.
4. Fokkema ML, James SK, Albertsson P, et al. Population trends in percutaneous coronary intervention:20-year results from the SCAAR (Swedish Coronary Angiography and Angioplasty Registry). J Am Coll Cardiol. 2013;61:1222-1230.
5. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation:The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018;39:119-177.
6. Montalescot G, Barragan P, Wittenberg O, et al. Platelet glycoprotein IIb/IIIa inhibition with coronary stenting for acute myocardial infarction. N Engl J Med. 2001;344:1895-1903.
7. Sardella G, Mancone M, Bucciarelli-Ducci C, et al. Thrombus aspiration during primary percutaneous coronary intervention improves myocardial reperfusion and reduces infarct size:the EXPIRA (thrombectomy with export catheter in infarct-related artery during primary percutaneous coronary intervention) prospective, randomized trial. J Am Coll Cardiol. 2009;53:309-315.
8. Vlaar PJ, Svilaas T, van der Horst IC, et al. Cardiac death and reinfarction after 1 year in the Thrombus Aspiration during Percutaneous coronary intervention in Acute myocardial infarction Study (TAPAS):a 1-year follow-up study. Lancet. 2008;371:1915-1920.
9. Burzotta F, De Vita M, Gu YL, et al. Clinical impact of thrombectomy in acute ST-elevation myocardial infarction:an individual patient-data pooled analysis of 11 trials. Eur Heart J. 2009;30:2193-2203.
10. Jolly SS, Cairns JA, Yusuf S, et al. Randomized trial of primary PCI with or without routine manual thrombectomy. N Engl J Med. 2015;372:1389-1398.
11. Frobert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med. 2013;369:1587-1597.
12. Jolly SS, Cairns JA, Yusuf S, et al. Stroke in the TOTAL trial:a randomized trial of routine thrombectomy vs. percutaneous coronary intervention alone in ST elevation myocardial infarction. Eur Heart J. 2015;36:2364-2372.
13. Fernandez-Rodriguez D, Regueiro A, Brugaletta S, et al. Optimization in stent implantation by manual thrombus aspiration in ST-segment-elevation myocardial infarction:findings from the EXAMINATION trial. Circ Cardiovasc Interv. 2014;7:294-300.
14. Loubeyre C, Morice MC, Lefevre T, Piechaud JF, Louvard Y, Dumas P. A randomized comparison of direct stenting with conventional stent implantation in selected patients with acute myocardial infarction. J Am Coll Cardiol. 2002;39:15-21.
15. Dudek D, Siudak Z, Janzon M, et al. European registry on patients with ST-elevation myocardial infarction transferred for mechanical reperfusion with a special focus on early administration of abciximab —EUROTRANSFER Registry. Am Heart J. 2008;156:1147-1154.
16. Mockel M, Vollert J, Lansky AJ, et al. Comparison of direct stenting with conventional stent implantation in acute myocardial infarction. Am J Cardiol. 2011;108:1697-1703.
17. Isaaz K, Robin C, Cerisier A, et al. A new approach of primary angioplasty for ST-elevation acute myocardial infarction based on minimalist immediate mechanical intervention. Coron Artery Dis. 2006;17:261-269.
18. Meneveau N, Seronde MF, Descotes-Genon V, et al. Immediate versus delayed angioplasty in infarct-related arteries with TIMI III flow and ST segment recovery:a matched comparison in acute myocardial infarction patients. Clin Res Cardiol. 2009;98:257-264.
19. Pascal J, Veugeois A, Slama M, et al. Delayed Stenting for ST-Elevation Acute Myocardial Infarction in Daily Practice:A Single-Centre Experience. Can J Cardiol. 2016;32:988-995.
20. Carrick D, Oldroyd KG, McEntegart M, et al. A randomized trial of deferred stenting versus immediate stenting to prevent no- or slow-reflow in acute ST-segment elevation myocardial infarction (DEFER-STEMI). J Am Coll Cardiol. 2014;63:2088-2098.
21. Kelbaek H, Hofsten DE, Kober L, et al. Deferred versus conventional stent implantation in patients with ST-segment elevation myocardial infarction (DANAMI 3-DEFER):an open-label, randomised controlled trial. Lancet. 2016;387:2199-2206.
22. Belle L, Motreff P, Mangin L, et al. Comparison of Immediate With Delayed Stenting Using the Minimalist Immediate Mechanical Intervention Approach in Acute ST-Segment-Elevation Myocardial Infarction:The MIMI Study. Circ Cardiovasc Interv. 2016;9:e003388.
23. Kim JS, Lee HJ, Woong Yu C, et al. INNOVATION Study (Impact of Immediate Stent Implantation Versus Deferred Stent Implantation on Infarct Size and Microvascular Perfusion in Patients With ST-Segment-Elevation Myocardial Infarction). Circ Cardiovasc Interv. 2016;9:e004101.
24. Qiao J, Pan L, Zhang B, et al. Deferred Versus Immediate Stenting in Patients With ST-Segment Elevation Myocardial Infarction:A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2017;6:e004838.
25. Spaulding C, Teiger E, Commeau P, et al. Four-year follow-up of TYPHOON (trial to assess the use of the CYPHer sirolimus-eluting coronary stent in acute myocardial infarction treated with BallOON angioplasty). JACC Cardiovasc Interv. 2011;4:14-23.
26. Vink MA, Dirksen MT, Suttorp MJ, et al. 5-year follow-up after primary percutaneous coronary intervention with a paclitaxel-eluting stent versus a bare-metal stent in acute ST-segment elevation myocardial infarction:a follow-up study of the PASSION (Paclitaxel-Eluting Versus Conventional Stent in Myocardial Infarction with ST-Segment Elevation) trial. JACC Cardiovasc Interv. 2011;4:24-29.
27. Violini R, Musto C, De Felice F, et al. Maintenance of long-term clinical benefit with sirolimus-eluting stents in patients with ST-segment elevation myocardial infarction 3-year results of the SESAMI (sirolimus-eluting stent versus bare-metal stent in acute myocardial infarction) trial. J Am Coll Cardiol. 2010;55:810-814.
28. Valgimigli M, Percoco G, Malagutti P, et al. Tirofiban and sirolimus-eluting stent vs abciximab and bare-metal stent for acute myocardial infarction:a randomized trial. JAMA. 2005;293:2109-2117.
29. Valgimigli M, Campo G, Percoco G, et al. Comparison of angioplasty with infusion of tirofiban or abciximab and with implantation of sirolimus-eluting or uncoated stents for acute myocardial infarction:the MULTISTRATEGY randomized trial. JAMA. 2008;299:1788-1799.
30. Di Lorenzo E, De Luca G, Sauro R, et al. The PASEO (PaclitAxel or Sirolimus-Eluting Stent Versus Bare Metal Stent in Primary Angioplasty) Randomized Trial. JACC Cardiovasc Interv. 2009;2:515-523.
31. Stone GW, Lansky AJ, Pocock SJ, et al. Paclitaxel-eluting stents versus bare-metal stents in acute myocardial infarction. N Engl J Med. 2009;360:1946-1959.
32. Kastrati A, Dibra A, Spaulding C, et al. Meta-analysis of randomized trials on drug-eluting stents vs. bare-metal stents in patients with acute myocardial infarction. Eur Heart J. 2007;28:2706-2713.
33. Holmvang L, Kelbaek H, Kaltoft A, et al. Long-term outcome after drug-eluting versus bare-metal stent implantation in patients with ST-segment elevation myocardial infarction:5 years follow-up from the randomized DEDICATION trial (Drug Elution and Distal Protection in Acute Myocardial Infarction). JACC Cardiovasc Interv. 2013;6:548-553.
34. Camenzind E, Steg PG, Wijns W. Stent thrombosis late after implantation of first-generation drug-eluting stents:a cause for concern. Circulation. 2007;115:1440-1455.
35. Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans:delayed healing and late thrombotic risk. J Am Coll Cardiol. 2006;48:193-202.
36. Raber L, Kelbaek H, Ostojic M, et al. Effect of biolimus-eluting stents with biodegradable polymer vs bare-metal stents on cardiovascular events among patients with acute myocardial infarction:the COMFORTABLE AMI randomized trial. JAMA. 2012;308:777-787.
37. Raber L, Kelbaek H, Taniwaki M, et al. Biolimus-eluting stents with biodegradable polymer versus bare-metal stents in acute myocardial infarction:two-year clinical results of the COMFORTABLE AMI trial. Circ Cardiovasc Interv. 2014;7:355-364.
38. Sabate M, Cequier A, Iniguez A, et al. Everolimus-eluting stent versus bare-metal stent in ST-segment elevation myocardial infarction (EXAMINATION):1 year results of a randomised controlled trial. Lancet. 2012;380:1482-1490.
39. Sabate M, Brugaletta S, Cequier A, et al. Clinical outcomes in patients with ST-segment elevation myocardial infarction treated with everolimus-eluting stents versus bare-metal stents (EXAMINATION):5-year results of a randomised trial. Lancet. 2016;387:357-366.
40. Sabate M, Raber L, Heg D, et al. Comparison of newer-generation drug-eluting with bare-metal stents in patients with acute ST-segment elevation myocardial infarction:a pooled analysis of the EXAMINATION (clinical Evaluation of the Xience-V stent in Acute Myocardial INfArcTION) and COMFORTABLE-AMI (Comparison of Biolimus Eluted From an Erodible Stent Coating With Bare Metal Stents in Acute ST-Elevation Myocardial Infarction) trials. JACC Cardiovasc Interv. 2014;7:55-63.
41. Brugaletta S, Lara JG, Ortega-Paz L, et al. TCT CONNECT-7 Everolimus-Eluting Stent Versus Bare-Metal Stent in ST-Segment Elevation Myocardial Infarction:10-Year Follow-Up of the Multicenter Randomized Controlled Examination Trial. J Am Coll Cardiol. 2020;76(17 Supplement S):B4-B4.
42. Tousek P, Kocka V, Maly M, et al. Long-term follow-up after bioresorbable vascular scaffold implantation in STEMI patients:PRAGUE-19 study update. EuroIntervention. 2016;12:23-29.
43. Diletti R, Karanasos A, Muramatsu T, et al. Everolimus-eluting bioresorbable vascular scaffolds for treatment of patients presenting with ST-segment elevation myocardial infarction:BVS STEMI first study. Eur Heart J. 2014;35:777-786.
44. Cortese B, Ielasi A, Romagnoli E, et al. Clinical Comparison With Short-Term Follow-Up of Bioresorbable Vascular Scaffold Versus Everolimus-Eluting Stent in Primary Percutaneous Coronary Interventions. Am J Cardiol. 2015;116:705-710.
45. Sabate M, Windecker S, Iniguez A, et al. Everolimus-eluting bioresorbable stent vs. durable polymer everolimus-eluting metallic stent in patients with ST-segment elevation myocardial infarction:results of the randomized ABSORB ST-segment elevation myocardial infarction-TROFI II trial. Eur Heart J. 2016;37:229-240.
46. Brugaletta S, Gori T, Low AF, et al. Absorb bioresorbable vascular scaffold versus everolimus-eluting metallic stent in ST-segment elevation myocardial infarction:1-year results of a propensity score matching comparison:the BVS-EXAMINATION Study (bioresorbable vascular scaffold-a clinical evaluation of everolimus eluting coronary stents in the treatment of patients with ST-segment elevation myocardial infarction). JACC Cardiovasc Interv. 2015;8(1 Pt B):189-197.
47. Brugaletta S, Gori T, Low AF, et al. ABSORB bioresorbable vascular scaffold vs. everolimus-eluting metallic stent in ST-segment elevation myocardial infarction (BVS EXAMINATION study):2-year results from a propensity score matched comparison. Int J Cardiol. 2016;214:483-484.
48. Brugaletta S, Gori T, Tousek P, et al. Bioresorbable vascular scaffolds versus everolimus-eluting metallic stents in patients with ST-segment elevation myocardial infarction:5-year results of the BVS-EXAMINATION study. EuroIntervention. 2020;15:1436-1443.
49. Ielasi A, Campo G, Rapetto C, et al. A Prospective Evaluation of a Pre-Specified Absorb BVS Implantation Strategy in ST-Segment Elevation Myocardial Infarction:The BVS STEMI STRATEGY-IT Study. JACC Cardiovasc Interv. 2017;10:1855-1864.
50. Ielasi A, Campo G, Cortese B, et al. One-Year Results Following a Pre-Specified ABSORB Implantation Strategy in ST-Elevation Myocardial Infarction (BVS STEMI STRATEGY-IT Study). Cardiovasc Revasc Med. 2019;20:700-704.
51. Serruys PW, Chevalier B, Sotomi Y, et al. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent for the treatment of coronary artery stenosis (ABSORB II):a 3 year, randomised, controlled, single-blind, multicentre clinical trial. Lancet. 2016;388:2479-2491.
52. Wykrzykowska JJ, Kraak RP, Hofma SH, et al. Bioresorbable Scaffolds versus Metallic Stents in Routine PCI. N Engl J Med. 2017;376:2319-2328.
53. Kereiakes DJ, Ellis SG, Metzger C, et al. 3-Year Clinical Outcomes With Everolimus-Eluting Bioresorbable Coronary Scaffolds:The ABSORB III Trial. J Am Coll Cardiol. 2017;70:2852-2862.
54. Haude M, Ince H, Abizaid A, et al. Sustained safety and performance of the second-generation drug-eluting absorbable metal scaffold in patients with de novo coronary lesions:12-month clinical results and angiographic findings of the BIOSOLVE-II first-in-man trial. Eur Heart J. 2016;37:2701-2709.
55. Brugaletta S, Cequier A, Alfonso F, et al. MAGnesium-based bioresorbable scaffold and vasomotor function in patients with acute ST segment elevation myocardial infarction:The MAGSTEMI trial:Rationale and design. Catheter Cardiovasc Interv. 2019;93:64-70.
56. Sabate M, Alfonso F, Cequier A, et al. Magnesium-Based Resorbable Scaffold Versus Permanent Metallic Sirolimus-Eluting Stent in Patients With ST-Segment Elevation Myocardial Infarction:The MAGSTEMI Randomized Clinical Trial. Circulation. 2019;140:1904-1916.
57. Ortega-Paz L, Brugaletta S, Gomez-Lara J, et al. Target lesion revascularisation of bioresorbable metal scaffolds:a case series study and literature review. EuroIntervention. 2021;16:1100-1103.
58. Gomez-Lara J, Ortega-Paz L, Brugaletta S, et al. Bioresorbable scaffolds versus permanent sirolimus-eluting stents in patients with ST-segment elevation myocardial infarction:vascular healing outcomes from the MAGSTEMI trial. EuroIntervention. 2020;16:e913-e921.
59. Ortega-Paz L, Brugaletta S, Sabate M. Very-late restenosis of a magnesium-based resorbable scaffold. Eur Heart J. 2020;41:2602.
60. Dziewierz A, Siudak Z, Rakowski T, Zasada W, Dubiel JS, Dudek D. Impact of multivessel coronary artery disease and noninfarct-related artery revascularization on outcome of patients with ST-elevation myocardial infarction transferred for primary percutaneous coronary intervention (from the EUROTRANSFER Registry). Am J Cardiol. 2010;106:342-347.
61. Wald DS, Morris JK, Wald NJ, et al. Randomized trial of preventive angioplasty in myocardial infarction. N Engl J Med. 2013;369:1115-1123.
62. Gershlick AH, Khan JN, Kelly DJ, et al. Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease:the CvLPRIT trial. J Am Coll Cardiol. 2015;65:963-972.
63. Engstrom T, Kelbaek H, Helqvist S, et al. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3-PRIMULTI):an open-label, randomised controlled trial. Lancet. 2015;386:665-671.
64. Smits PC, Abdel-Wahab M, Neumann FJ, et al. Fractional Flow Reserve-Guided Multivessel Angioplasty in Myocardial Infarction. N Engl J Med. 2017;376:1234-1244.
65. Mehta SR, Wood DA, Storey RF, et al. Complete Revascularization with Multivessel PCI for Myocardial Infarction. N Engl J Med. 2019;381:1411-1421.
66. den Dekker WK, Van Mieghem NM, Bennett J, et al. Percutaneous complete revascularization strategies using sirolimus-eluting biodegradable polymer-coated stents in patients presenting with acute coronary syndrome and multivessel disease:Rationale and design of the BIOVASC trial. Am Heart J. 2020;227:111-117.
67. Thiele H, Akin I, Sandri M, et al. PCI Strategies in Patients with Acute Myocardial Infarction and Cardiogenic Shock. N Engl J Med. 2017;377:2419-2432.
68. Thiele H, Akin I, Sandri M, et al. One-Year Outcomes after PCI Strategies in Cardiogenic Shock. N Engl J Med. 2018;379:1699-1710.
69. Ibanez B, Halvorsen S, Roffi M, et al. Integrating the results of the CULPRIT-SHOCK trial in the 2017 ESC ST-elevation myocardial infarction guidelines:viewpoint of the task force. Eur Heart J. 2018;39:4239-4242.
70. Kolte D, Khera S, Aronow WS, et al. Trends in incidence, management, and outcomes of cardiogenic shock complicating ST-elevation myocardial infarction in the United States. J Am Heart Assoc. 2014;3:e000590.
71. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure:The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37:2129-2200.
72. Atkinson TM, Ohman EM, O'Neill WW, Rab T, Cigarroa JE, Interventional Scientific Council of the American College of Cardiology. A Practical Approach to Mechanical Circulatory Support in Patients Undergoing Percutaneous Coronary Intervention:An Interventional Perspective. JACC Cardiovasc Interv. 2016;9:871-883.
73. Helgestad OKL, Josiassen J, Hassager C, et al. Contemporary trends in use of mechanical circulatory support in patients with acute MI and cardiogenic shock. Open Heart. 2020;7:e001214.
74. Waksman R, Weiss AT, Gotsman MS, Hasin Y. Intra-aortic balloon counterpulsation improves survival in cardiogenic shock complicating acute myocardial infarction. Eur Heart J. 1993;14:71-74.
75. Bengtson JR, Kaplan AJ, Pieper KS, et al. Prognosis in cardiogenic shock after acute myocardial infarction in the interventional era. J Am Coll Cardiol. 1992;20:1482-1489.
76. Sjauw KD, Engstrom AE, Vis MM, et al. A systematic review and meta-analysis of intra-aortic balloon pump therapy in ST-elevation myocardial infarction:should we change the guidelines?Eur Heart J. 2009;30:459-468.
77. Patel MR, Smalling RW, Thiele H, et al. Intra-aortic balloon counterpulsation and infarct size in patients with acute anterior myocardial infarction without shock:the CRISP AMI randomized trial. JAMA. 2011 ;306:1329-1337.
78. Ohman EM, Nanas J, Stomel RJ, et al. Thrombolysis and counterpulsation to improve survival in myocardial infarction complicated by hypotension and suspected cardiogenic shock or heart failure:results of the TACTICS Trial. J Thromb Thrombolysis. 2005;19:33-39.
79. Prondzinsky R, Lemm H, Swyter M, et al. Intra-aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic shock:the prospective, randomized IABP SHOCK Trial for attenuation of multiorgan dysfunction syndrome. Crit Care Med. 2010;38:152-160.
80. Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med. 2012;367:1287-1296.
81. Thiele H, Zeymer U, Neumann FJ, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II):final 12 month results of a randomised, open-label trial. Lancet. 2013;382:1638-1645.
82. Iannaccone M, Albani S, Giannini F, et al. Short term outcomes of Impella in cardiogenic shock:A review and meta-analysis of observational studies. Int J Cardiol.2021;324:44-51.
83. Sjauw KD, Konorza T, Erbel R, et al. Supported high-risk percutaneous coronary intervention with the Impella 2.5 device the Europella registry. J Am Coll Cardiol. 2009;54:2430-2434.
84. Maini B, Naidu SS, Mulukutla S, et al. Real-world use of the Impella 2.5 circulatory support system in complex high-risk percutaneous coronary intervention:the USpella Registry. Catheter Cardiovasc Interv. 2012;80:717-725.
85. Seyfarth M, Sibbing D, Bauer I, et al. A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device versus intra-aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol. 2008;52:1584-1588.
86. Ouweneel DM, Eriksen E, Sjauw KD, et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. J Am Coll Cardiol. 2017;69:278-287.
87. Udesen NJ, Moller JE, Lindholm MG, et al. Rationale and design of DanGer shock:Danish-German cardiogenic shock trial. Am Heart J. 2019;214:60-68.
88. Watanabe S, Fish K, Kovacic JC, et al. Left Ventricular Unloading Using an Impella CP Improves Coronary Flow and Infarct Zone Perfusion in Ischemic Heart Failure. J Am Heart Assoc. 2018;7:e006462.
89. Kapur NK, Alkhouli MA, DeMartini TJ, et al. Unloading the Left Ventricle Before Reperfusion in Patients With Anterior ST-Segment-Elevation Myocardial Infarction. Circulation. 2019;139:337-346.
90. Combes A, Price S, Slutsky AS, Brodie D. Temporary circulatory support for cardiogenic shock. Lancet. 2020;396:199-212.
91. Thiele H, Lauer B, Hambrecht R, Boudriot E, Cohen HA, Schuler G. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 2001;104:2917-2922.
92. Kar B, Gregoric ID, Basra SS, Idelchik GM, Loyalka P. The percutaneous ventricular assist device in severe refractory cardiogenic shock. J Am Coll Cardiol. 2011;57:688-696.
93. Burkhoff D, Cohen H, Brunckhorst C, O'Neill WW, TandemHeart Investigators Group. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. Am Heart J. 2006;152:469e1-8.
94. Burkhoff D, Sayer G, Doshi D, Uriel N. Hemodynamics of Mechanical Circulatory Support. J Am Coll Cardiol. 2015;66:2663-2674.
95. Petroni T, Harrois A, Amour J, et al. Intra-aortic balloon pump effects on macrocirculation and microcirculation in cardiogenic shock patients supported by venoarterial extracorporeal membrane oxygenation. Crit Care Med. 2014;42:2075-2082.
96. Cheng A, Swartz MF, Massey HT. Impella to unload the left ventricle during peripheral extracorporeal membrane oxygenation. ASAIO J. 2013;59:533-536.
97. Schrage B, Becher PM, Bernhardt A, et al. Left Ventricular Unloading Is Associated With Lower Mortality in Patients With Cardiogenic Shock Treated With Venoarterial Extracorporeal Membrane Oxygenation:Results From an International, Multicenter Cohort Study. Circulation. 2020;142:2095-2106.
98. Abrams D, Agerstrand CL, Biscotti M, Burkart KM, Bacchetta M, Brodie D. Extracorporeal membrane oxygenation in the management of diffuse alveolar hemorrhage. ASAIO J. 2015;61:216-218.
99. Sheu JJ, Tsai TH, Lee FY, et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit Care Med. 2010;38:1810-1817.
100. Muller G, Flecher E, Lebreton G, et al. The ENCOURAGE mortality risk score and analysis of long-term outcomes after VA-ECMO for acute myocardial infarction with cardiogenic shock. Intensive Care Med. 2016;42:370-378.
101. Banning AS, Adriaenssens T, Berry C, et al. The EURO SHOCK Trial:Design, Aims and Objectives. EuroIntervention. 2020;EIJ-D-20-01076.
102. Lusebrink E, Orban M, Kupka D, et al. Prevention and treatment of pulmonary congestion in patients undergoing venoarterial extracorporeal membrane oxygenation for cardiogenic shock. Eur Heart J. 2020;41:3753-3761.
RESUMEN
Se presentan las indicaciones actuales, el material, las técnicas, las complicaciones, los resultados y las controversias de los procedimientos percutáneos que permiten abordar la patología valvular y de las ramas pulmonares. El presente artículo ofrece una perspectiva del material actualmente disponible de forma clara para el cardiólogo intervencionista.
Palabras clave: Valvuloplastia. Angioplastia. Valvulas percutaneas.
ABSTRACT
Brief review of current indications, materials, techniques, complications, results, and controversies around percutaneous procedures for the management of pulmonary valve and arterial branches disease. This article gives the interventional cardiologist a perspective on the material currently available.
Keywords: Valvuloplasty. Angioplasty. Percutaneous valve.
Abreviaturas AVP: atresia valvular pulmonar. CC: cardiopatía congénita. DCP: derivación cavopulmonar. EP: estenosis pulmonar. IP: insuficiencia pulmonar. RP: ramas pulmonares. TSVD: tracto de salida del ventrículo derecho. VD: ventrículo derecho.
ESTENOSIS VALVULAR PULMONAR
La estenosis pulmonar (EP) valvular es de origen casi exclusivamente congénito y supone el 7-10% de las cardiopatías congénitas (CC). Aunque con frecuencia es un defecto aislado, puede asociarse a otras malformaciones congénitas.
La estenosis adquirida es muy infrecuente, en relación con un síndrome carcinoide o con fiebre reumática. Una forma emergente es la estenosis de bioprótesis quirúrgicas o de conductos valvulados.
La EP valvular puede coexistir con estenosis infundibular o supravalvular pulmonar; esta última es frecuente en relación con los síndromes de Noonan, Williams o Alagille, así como en la rubeola congénita.
La presentación clínica es variable, desde la estenosis crítica o la atresia valvular pulmonar (AVP) en el recién nacido hasta la estenosis leve que no precisa tratamiento.
Aunque su presentación en la vida adulta suele ser asintomática, en casos de estenosis grave se han descrito disnea de esfuerzo, disfunción ventricular, arritmias y hasta muerte súbita. En este grupo puede presentarse como forma nativa o tras una cirugía o una valvuloplastia previa.
Etiología
La EP puede tener 3 formas anatomopatológicas1 (figura 1):
-
– EP típica. Es la forma más habitual: válvula típicamente tricomisural, con leve engrosamiento de velos y fusión comisural. El anillo valvular muestra un desarrollo normal y es frecuente la dilatación posestenótica. La apertura valvular es típicamente en cúpula con un orificio estenótico central. Rara vez presenta calcificación.
-
– EP por válvula displásica. Se presenta en aproximadamente el 20% de todos los casos de EP, aunque es frecuente en el síndrome de Noonan. Los velos valvulares están engrosados y mixomatosos, con apertura limitada y escasa fusión comisural. Puede llevar asociada hipoplasia anular e incluso de tronco pulmonar proximal.
-
– EP asociada a otras CC, como comunicación interauricular, comunicación interventricular, transposición de grandes arterias, doble salida del ventrículo derecho (VD) o tetralogía de Fallot. La válvula a menudo es bicúspide o incluso unicúspide. Puede llevar asociada estenosis infundibular o supravalvular pulmonar e hipoplasia de anillo.
Figura 1. A: estenosis valvular por válvula displásica. B: estenosis valvular típica.
Valvuloplastia pulmonar
Desde 1982, la valvuloplastia pulmonar percutánea es la técnica de elección para el tratamiento de la estenosis valvular pulmonar desde el recién nacido hasta la vida adulta. Su objetivo es la sobredistensión de los velos y el rasgado de estos a nivel del rafe comisural.
Esta técnica con frecuencia es curativa y tiene una baja tasa de reestenosis en el seguimiento, muchas veces tratable con un segundo procedimiento.
El grado de insuficiencia pulmonar (IP) residual inmediato no suele ser mayor que leve, aunque puede progresar a lo largo de los años. A pesar de ello, es infrecuente la necesidad de reemplazo valvular por este motivo.
Indicaciones
La evolución natural de la estenosis valvular pulmonar se relaciona con el grado de obstrucción. Aunque el gradiente Doppler medio se relaciona de manera más fiable con el gradiente hemodinámico pico-pico, las guías internacionales establecen el grado de obstrucción en función del gradiente Doppler pico instantáneo2,3:
-
– Estenosis leve (gradiente Doppler pico instantáneo < 36 mmHg o velocidad pico < 3 m/s). Curso normalmente benigno, compatible con una vida normal. En los pacientes adultos se considera suficiente la evaluación cada 5 años.
-
– Estenosis moderada (gradiente Doppler pico instantáneo 36-64 mmHg o velocidad pico 3-4 m/s). Aunque con frecuencia es asintomática, la limitación al gasto cardiaco del VD puede dar lugar a la aparición de disnea o de fatiga con el ejercicio. Un 20% puede evolucionar hacia un grado mayor de obstrucción. Se realizará evaluación cada 2 años.
-
– Estenosis grave (gradiente Doppler pico instantáneo > 64 mmHg, velocidad pico > 4 m/s o gradiente Doppler medio > 40 mmHg). Se asocia con la presencia de sintomatología, disfunción del VD o cianosis. Siempre se indicará tratamiento.
Las indicaciones para el tratamiento de la estenosis valvular pulmonar se detallan en la tabla 14,5.
Tabla 1. Indicaciones de tratamiento en estenosis valvular pulmonar
| Estenosis crítica del recién nacido |
| Estenosis valvular pulmonar grave (gradiente Doppler pico > 60 mmHg o medio |
| > 40 mmHg), en paciente asintomático |
| Estenosis valvular pulmonar moderada (gradiente Doppler pico instantáneo |
| > 50 mmHg o medio > 30 mmHg) en paciente sintomático |
| Se indicará cirugía en caso de asociación con: |
| Insuficiencia pulmonar moderada o grave |
| Estenosis subvalvular o supravalvular |
| Insuficiencia tricúspide grave |
| Dilatación sintomática de arteria pulmonar por compresión extrínseca de estructuras vecinas |
| Necesidad de corrección quirúrgica de otras anomalías asociadas o cirugía de arritmia (técnica Maze) |
| La valvuloplastia percutánea puede ser la primera opción en caso de válvulas displásicas, frente a la cirugía, aunque la tasa de éxito es menor |
Técnica y material
La técnica de la valvuloplastia pulmonar percutánea ha sido ampliamente descrita1 y se puede realizar bajo sedación consciente, con anestesia local o incluso con anestesia general en los pacientes pediátricos. Se administra heparina sódica a dosis de 100 UI/kg hasta un máximo de 5000 UI. La ecocardiografía transtorácica o transesofágica no es de uso sistemático.
El acceso venoso femoral es el más frecuente, aunque son posibles otros accesos alternativos, como la vena yugular o el acceso transhepático. En caso de anillo valvular pulmonar grande pueden ser necesarios 2 accesos venosos simultáneos para realizar la técnica de doble balón. El acceso arterial es opcional.
Tras el registro basal de las presiones se realizará una ventriculografía derecha preferentemente en los planos lateral y posteroanterior con 30° de inclinación craneal. La medición del anillo pulmonar se realiza en sístole a nivel de la unión con los velos valvulares.
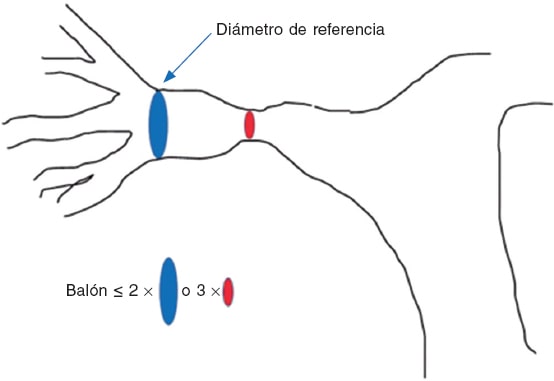
Tras cruzar con el catéter la válvula pulmonar, se posicionará una guía de intercambio y que provea alto soporte en la arteria pulmonar distal (preferentemente la arteria lobar inferior). Pueden emplearse diferentes tipos de catéter-balón y se recomienda un diámetro inicial 1,2-1,25 veces mayor que el diámetro del anillo pulmonar (figura 2A). En caso de persistir un gradiente hemodinámico > 30 mmHg y en ausencia de IP significativa, se recomienda repetir el procedimiento con un nuevo catéter-balón, hasta una relación de 1,4. No conviene sobrepasar una relación de 1,5, salvo en caso de válvulas displásicas. La longitud recomendable del balón es de 20 mm en los recién nacidos y los lactantes, de 30 mm en los pacientes pediátricos y de 40 mm en los adultos.
Figura 2. A: valvuloplastia pulmonar con un balón. B: valvuloplastia pulmonar con doble balón.
En caso de anillos valvulares grandes puede realizarse la técnica de doble balón (figura 2B); ambos balones deberán tener la misma longitud. Se ha descrito el diámetro efectivo de la combinación de 2 catéteres-balón6 (tabla 2), que puede estimarse de la siguiente forma:
Tabla 2. Diámetro efectivo con la técnica de doble balón
| Diámetro | 6 mm | 7 mm | 8 mm | 10 mm | 12 mm | 14 mm | 15 mm | 16 mm | 18 mm | 20 mm | 22 mm | 24 mm |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 6 mm | 9,0 | |||||||||||
| 7 mm | 10,7 | 11,5 | ||||||||||
| 8 mm | 11,5 | 12,3 | 13,1 | |||||||||
| 10 mm | 13,3 | 14,0 | 14,8 | 16,4 | ||||||||
| 12 mm | 15,1 | 15,8 | 16,5 | 18,0 | 19,6 | |||||||
| 14 mm | 16,9 | 17,6 | 18,3 | 19,7 | 21,3 | 22,9 | ||||||
| 15 mm | 17,8 | 18,5 | 19,2 | 20,6 | 22,1 | 23,7 | 24,5 | |||||
| 16 mm | 18,7 | 19,4 | 20,1 | 21,5 | 23,0 | 24,6 | 25,4 | 26,2 | ||||
| 18 mm | 20,6 | 21,2 | 21,9 | 23,3 | 24,7 | 26,3 | 27,0 | 27,8 | 29,5 | |||
| 20 mm | 22,5 | 23,1 | 23,7 | 25,1 | 26,5 | 28,0 | 28,8 | 29,5 | 31,1 | 32,7 | ||
| 22 mm | 24,4 | 25,0 | 25,6 | 26,9 | 28,3 | 29,7 | 30,5 | 31,2 | 32,8 | 34,4 | 36,0 | |
| 24 mm | 26,3 | 26,9 | 27,5 | 28,8 | 30,1 | 31,5 | 32,2 | 33,0 | 34,5 | 36,1 | 37,7 | 39,3 |
Diámetro efectivo = 0,82 (diámetro 1 + diámetro 2)
No se han demostrado diferencias significativas en términos de eficacia entre la valvuloplastia pulmonar percutánea con balón simple o con doble balón.
Resultados y seguimiento
La tasa de éxito inmediato del procedimiento es cercana al 90%, con una muy baja mortalidad (0,24%) y escasas complicaciones mayores (0,35%). En la válvula pulmonar displásica, la tasa de éxito es menor1. La cirugía puede reservarse como segunda opción en este tipo de anatomía valvular.
La tasa de reestenosis observada en el seguimiento es del 21% en series históricas y del 8-10% en estudios más recientes7-9. Los factores de riesgo son la presencia de válvula displásica, un gradiente hemodinámico residual ≥ 30 mmHg y el uso de una relación balón/anillo < 1,2.
En ausencia de IP de grado mayor a leve, la repetición de la valvuloplastia percutánea es de elección salvo en caso de displasia valvular, en la que puede indicarse la cirugía.
La IP está presente en el seguimiento en un 40-90% de los pacientes, con incremento a lo largo del seguimiento. Un mayor grado de estenosis inicial, una menor edad en el momento de la valvuloplastia y una mayor relación balón/anillo son factores de riesgo.
A pesar de ello, rara vez es necesario indicar el reemplazo valvular, con indicaciones que se basarán en la presencia de síntomas, así como en los volúmenes ventriculares y los parámetros de función del VD. Los estudios sugieren que podrían utilizarse los mismos parámetros de indicación que en la TOF corregida con IP residual10.
Situaciones especiales
Atresia valvular pulmonar
La AVP es una CC compleja caracterizada por la obstrucción completa al flujo pulmonar que se manifiesta en los primeros días de vida, tras el cierre fisiológico del conducto arterioso, y dejada a su evolución natural es incompatible con la vida.
El marcador anatómico fundamental es la atresia valvular, generalmente membranosa, con velos fusionados y anillo valvular hipodesarrollado. Son frecuentes otras lesiones secundarias a esta anomalía principal, entre las que destaca el hipodesarrollo variable del VD y de la válvula tricúspide, así como las anomalías en la circulación coronaria. El tronco y las arterias pulmonares suelen ser normales.
El tratamiento de estos pacientes incluye una estabilización inicial mediante el mantenimiento temporal de la permeabilidad ductal con infusión de prostaglandina E1. El enfoque de tratamiento definitivo dependerá de la gravedad de las lesiones acompañantes. En los pacientes con pronóstico más favorable, en términos de desarrollo suficiente del VD y de la válvula tricúspide, y en ausencia de circulación coronaria dependiente del VD, estará indicada la apertura inicial de la válvula.
Esta técnica se realiza frecuentemente por vía percutánea11,12 (vídeos 1 a 8 del material adicional), accediendo por vía venosa al VD y al tracto de salida del VD (TSVD), donde se posiciona un catéter con curva coronaria derecha (JR) o mamaria interna, bajo el plano valvular imperforado. Por su interior, una vez asegurada la adecuada posición, se avanza por un sistema compuesto por microcatéter y guía de radiofrecuencia, con la que se atraviesa el plano valvular, y con posterioridad se realiza una valvuloplastia secuencial con catéter-balón.
Aunque tras este procedimiento se consigue establecer un flujo anterógrado desde el VD, de forma muy infrecuente este flujo es suficiente para mantener una adecuada saturación de oxígeno arterial, debido a diferentes factores: persistencia de la obstrucción en el TSVD a nivel valvular/infundibular, comportamiento restrictivo del VD e hipodesarrollo de la válvula tricúspide. Todo ello condiciona un insuficiente flujo pulmonar por la vía natural y la persistencia de un importante cortocircuito interatrial de derecha a izquierda, con la consiguiente desaturación. Por este motivo, de forma habitual es necesaria una fuente accesoria de flujo pulmonar, que habrá de extenderse más allá del periodo neonatal.
Una alternativa emergente en los últimos años es el implante de un stent coronario en el conducto arterioso. Este procedimiento puede realizarse en la misma intervención o en un segundo procedimiento, mediante acceso anterógrado venoso o retrógrado arterial. El objetivo será implantar un stent coronario de 3-4 mm, de forma que cubra toda la longitud ductal, evitando su protrusión en el extremo aórtico o pulmonar.
Esta técnica permite mantener un flujo pulmonar y una saturación de oxígeno arterial suficientes hasta conseguir un adecuado desarrollo del VD. El stent ductal tiende al cierre espontáneo por proliferación endoluminal a lo largo del primer año de vida. En algunos casos, puede ser necesario un nuevo implante de stent intra-stent en el seguimiento.
Valvuloplastia pulmonar fetal
La valvuloplastia pulmonar fetal es una técnica poco frecuente, aplicable a fetos con diagnóstico prenatal de estenosis valvular pulmonar crítica o AVP, y riesgo de evolución hacia hipoplasia del VD. Habitualmente se realiza entre las semanas 21 y 28 de gestación. Su objetivo es promover un mayor desarrollo intrauterino de las estructuras cardiacas derechas, favoreciendo así una fisiología biventricular tras el nacimiento.
Mediante control ecográfico simultáneo, y tras conseguir una adecuada posición fetal, se realiza una punción transuterina, transtorácica fetal y cardiaca, y se accede al TSVD con una aguja de Chiva 22 G. La válvula pulmonar se atraviesa directamente mediante punción con la aguja en caso de atresia, posicionando distalmente una guía coronaria de 0,014 pulgadas. Sobre esta guía, por el interior de la aguja, se avanza un catéter-balón coronario de muy bajo perfil, con el que se realiza la dilatación valvular.
En cuanto a sus resultados, se trata de una técnica compleja, que requiere experiencia y colaboración multidisciplinaria. Una de sus dificultades reside en conseguir una adecuada orientación de la aguja, debido al pequeño tamaño de la cavidad del VD y a su compleja geometría. Presenta una alta frecuencia de complicaciones, que incluyen arritmias fetales, derrame pericárdico e incluso muerte fetal.
Un estudio internacional multicéntrico13 ha documentado la realización de este procedimiento en 58 fetos, con un 55% de complicaciones, incluyendo 7 muertes. Comparando la evolución de los pacientes tratados con una cohorte similar de fetos que no recibieron tratamiento, se evidenció posnatalmente una mayor tendencia a la fisiología biventricular en el primer grupo (87 frente a 43%). A pesar de ello, en la actualidad no están establecidos los criterios de indicación de esta técnica, y hay que sopesar en cada caso particular los riesgos, la experiencia del grupo y los beneficios esperables.
Válvulas pulmonares percutáneas
Muchas CC requieren una reconstrucción del TSVD, bien sea con un parche, con una bioprótesis o con un conducto entre el VD y la arteria pulmonar. En la tetralogía de Fallot, el 90% de los pacientes operados en edad infantil alcanzarán la edad adulta y un número significativo tendrán insuficiencia o EP como consecuencia de la sección del anillo o del empleo de conductos. Es motivo de controversia tanto el momento como la forma de tratarlas, pues no existe consenso entre los expertos y las guías clínicas americanas, canadienses y europeas5 establecen bases generales, con niveles de evidencia subóptimos; además, es frecuente que cada caso particular tenga características que no se recogen en los algoritmos propuestos.
Los cirujanos han utilizado distintos materiales para resolver las disfunciones: aloinjertos, prótesis biológicas de pericardio porcino –con y sin soporte–, prótesis mecánicas y conductos valvulados (artesanalmente) y no valvulados. En las dos últimas décadas, el intervencionismo percutáneo ha irrumpido con fuerza empujado por el desarrollo de la industria de bioprótesis, soportadas sobre stents, pero todavía es cuestionable cuándo tratar pacientes asintomáticos: la precocidad en el recambio se asocia a un deterioro más rápido y un mayor número de intervenciones –cada una con su propio riesgo–, mientras que las actuaciones tardías pueden no impedir o revertir el deterioro de la función y de los volúmenes ventriculares.
La morfología del TSVD disfuncional es muy compleja y determina el material del abordaje (la forma en «pirámide» es poco compatible con válvulas autoexpandibles), y además tiene un comportamiento muy dinámico. La ecocardiografía no es suficiente y se requiere la tomografía computarizada para conocer la anatomía coronaria; la resonancia magnética cardiaca (no puede realizarse en todos los casos, por problemas con clips, marcapasos o prótesis que generan interferencias) permite calcular los volúmenes y la función, y visualizar ese comportamiento dinámico. Actualmente se da más importancia a la función que al tamaño del VD, tanto para indicar el implante como para valorar el seguimiento. La anatomía coronaria no siempre refleja el comportamiento durante o después del implante, y de hecho, los cambios en las medidas del TSVD durante el implante no conllevan cambios lineales en las arterias coronarias, por lo que la coronariografía sigue siendo esencial. Las válvulas autoexpandibles tienen una longitud notablemente mayor que las expandibles por balón (y que las quirúrgicas), por lo que la distancia total en la zona prevista para el implante se convierte en crucial. Desde hace años se sabe que la válvula pulmonar no es igual que la válvula aórtica en arquitectura ni en funcionamiento, y que las mismas prótesis funcionan de manera distinta en posición aórtica o pulmonar (pueden llegar a no cerrar de manera efectiva)14.
Indicaciones y perspectiva histórica
Las indicaciones para las válvulas pulmonares percutáneas contempladas en las guías europeas5 y norteamericana15 son similares a las del recambio quirúrgico. Los pacientes sintomáticos plantean pocas dudas. Para los pacientes asintomáticos hay que recurrir a datos electrocardiográficos (prolongación absoluta del QRS > 180 o progresión de esta) y hemodinámicos (como una relación de presiones entre el VD y el ventrículo izquierdo > 0,7), gradientes Doppler pico y medios > 50 y > 30, respectivamente, y sobre todo a los hallazgos de la resonancia magnética en los casos de regurgitación pulmonar significativa (fracción de regurgitación > 30%): volúmenes telediastólicos ventriculares derechos > 160 ml/m2, volumen telediastólico derecho doble que el izquierdo, volumen telesistólico > 80 ml/m2 y fracción de eyección del VD < 0,40-0,45 (o evolución negativa de esta).
La primera válvula cardiaca implantada percutáneamente fue la pulmonar, por Bonhoeffer en el año 2000, a partir de la idea de suturar una vena yugular bovina con válvula en un stent vascular. Se comercializó con el nombre de Melody (Medtronic Inc, Estados Unidos), con marcado CE y canadiense en 2006 y de la Food and Drug Administration en 2010, y está indicada para pacientes mayores con conductos quirúrgicos disfuncionantes. Su utilización fuera de las indicaciones aprobadas ha crecido y se utiliza en pacientes de hasta 20 kg de peso y en TSVD nativos16, con modificaciones técnicas (implante de stent previo en la zona de implante) para minimizar algunas de las complicaciones más frecuentes (fractura del stent), pero con precauciones debido a las cifras significativas de endocarditis infecciosa (problema compartido por su homóloga bovina quirúrgica Contegra, Medtronic, Estados Unidos). Además, la limitación de tamaños disponibles de las válvulas (18, 20 y 22 mm) es otro problema porque muchos pacientes con regurgitación tienen grandes calibres del tronco pulmonar, hecho que ha generado numerosas soluciones imaginativas para extender su uso.
En 2008, la válvula Edwards SAPIEN (Edwards Lifesciences LLC, Estados Unidos) para posición aórtica empezó a utilizarse en posición derecha gracias al ensayo clínico COMPASSION, en el que se demostró que era segura y eficaz para conductos con regurgitación pulmonar moderada o grave, con o sin estenosis17. Sus tamaños son mayores (23, 26 y 29 mm), no presenta fracturas y la incidencia de endocarditis infecciosa es menor (aunque la literatura no es «robusta» en este aspecto). En 2016 obtuvo la aprobación de las agencias reguladoras europea y norteamericana la utilización de la Edwards SAPIEN XT en niños y adultos con insuficiencia o EP; la actual SAPIEN 3 solo está autorizada para posición aórtica, pero existen numerosos implantes fuera de indicación en posición pulmonar.
El procedimiento exige una cuidadosa planificación. Son necesarios un acceso arterial y 2 venosos, preferiblemente femoral, pero también puede implantarse por vía venosa yugular. El estudio angiográfico (figura 3) tiene 2 objetivos: a) estudiar la anatomía y las dimensiones del «tronco» o conducto y las ramas pulmonares (RP), para lo que son necesarias varias proyecciones (la salida del VD se delinea mejor en oblicua anterior derecha 20° y craneal 20°, y en lateral, pero exige modificaciones en cada caso) e inyectar contraste tanto en el tronco como en el VD mientras se ocluye el tronco con un catéter-balón, y b) estudiar las relaciones anatómicas de proximidad, porque las estructuras adyacentes pueden verse comprimidas (la propia aorta ascendente o las arterias coronarias). Para ello, mientras se mantiene el catéter-balón inflado en la arteria pulmonar se realiza un aortograma o una coronariografía, o ambos. El catéter-balón puede ser del tipo «tallado de comunicación interauricular» de 34 o 35 mm, que es muy distensible, pero que en no raras ocasiones se distiende más allá del diámetro objetivo del implante y causa compresión coronaria o aórtica, por lo que debe disponerse de otros tipos de balones de diámetro idéntico al objetivo del implante. Si se trata de un conducto calcificado, la aproximación será progresiva debido al riesgo de rotura. En caso de emplear una válvula Melody, previamente debe implantarse un stent en todos los casos –stent recubierto si el conducto está calcificado–, lo que no es obligado para el resto de las válvulas.
Figura 3. Ejemplos de angiografías. A: de tronco pulmonar, personalizada, en proyección oblicua anterior derecha 20° y craneal 40°. B: con catéter-balón de medición de comunicación interauricular para estimar medidas y morfología, en la misma proyección. C: en proyección lateral mostrando cómo la sobredistensión produce obstrucción de la arteria coronaria descendente anterior, que nace desde la coronaria derecha. D: coronariografía selectiva con balón del mismo diámetro de la válvula que se va a implantar, sin obstrucción coronaria, en la misma proyección que en A. E: con el mismo balón que en D, en proyección lateral.
No hay uniformidad acerca de si todo el procedimiento debe realizarse en una sola sesión o en dos, dedicando la primera al estudio anatómico/fisiológico y al implante del stent.
Prótesis valvulares pulmonares disponibles
Existen 2 grandes grupos de prótesis: las expandibles por balón y las autoexpandibles. Las primeras tienen más recorrido histórico, están aprobadas por las agencias reguladoras, se han realizado 10.000 implantes en todo el mundo, tienen mayor fuerza radial, permiten un mayor control del diámetro que se debe alcanzar, se acortan al dilatarlas y son muy exigentes desde el punto de vista técnico. Las autoexpandibles son más recientes, están en desarrollo con varios ensayos clínicos para obtener la aprobación, alcanzan mayores diámetros, son más largas y puede haber problemas en la porción distal del tronco pulmonar, ya que no se acortan y no se tiene control sobre el diámetro (alcanzan su valor nominal) ni permiten redilataciones. En la figura 4 se muestran las prótesis disponibles para uso pulmonar.
Figura 4. Válvulas pulmonares percutáneas. A: Melody (Medtronic, Estados Unidos). B: Edwards XT (Edwards Lifesciences LLC, Estados Unidos). C: Venus (Venus MedTech, China). D: Harmony (Medtronic, Estados Unidos). E: Pulsta (Taewoong Medical, Corea del Sur).
Melody TPV
La Melody TPV (Medtronic Inc, Estados Unidos)18 es una prótesis expandible por balón. Se construye a partir de vena yugular bovina con una válvula nativa de 18 mm suturada a un stent CP de platino-iridio (NuMED, Canadá). La longitud del conjunto es de 28 mm y se acorta de acuerdo con el diámetro final. Puede expandirse desde 16 hasta 22 mm de diámetro (y probablemente también funcione hasta los 24 mm). La válvula se crimpa a mano y se transporta y libera a través del sistema propio de Medtronic Ensemble –adaptación del doble balón de angioplastia BIB (NuMED Inc, Estados Unidos)– con un perfil de 22 Fr en su porción distal y de 16 Fr en su porción proximal, de 100 mm de longitud; se avanza a través de una guía de alto soporte alojada en una rama pulmonar (preferiblemente la izquierda).
Edwards SAPIEN
La prótesis valvular Edwards SAPIEN (Edwards Lifesciences LLC, Estados Unidos)18 es expandible sobre balón, con velos de pericardio porcino montado sobre un stent de cromocobalto y con menos altura que la Melody. El modelo SAPIEN XT THV es el autorizado para posición pulmonar y se fabrica en 23 (altura de 14,3 mm), 26 (altura de 17,2 mm) y 29 mm (altura de 19,1 mm). Se crimpa con un dispositivo específico, proximal a la posición del balón, y se «monta» sobre el mismo cuando ya se encuentra en la vena cava inferior, transportándose y liberándose a través de un sistema propio Novaflex (Edwards Lifesciences, Estados Unidos) de perfil 18, 19 o 20 Fr, según el diámetro de la válvula, muy rígido y no fácil de avanzar ni retirar, en especial si se ha realizado un implante previo de stent, y que puede dañar la válvula tricúspide. El modelo SAPIEN 3 THV se fabrica en los mismos diámetros (con alturas de 18, 20 y 22,5 mm), pero es una evolución cuya porción recubierta interna es bastante más corta (9,3, 10,2 y 11.6 mm), con una protección externa de tereftalato de polietileno para minimizar la posibilidad de fugas, y cuyo stent tiene geometrías diferentes en las porciones proximal y distal para que se acorte más en su extremo proximal; las de 23 y 26 mm se transportan a través del sistema «defectable» Edwards Commander Delivery System 14 Fr, y las de 29 mm a través de uno de 16 Fr con un introductor propio (Edwards eSheath). Existen comunicaciones en las que mediante un inflado con mayor volumen que el nominal la SAPIEN 3 puede llegar a los 30 mm.
Válvula Venus
La válvula Venus (Venus MedTech, China) está diseñada para tractos nativos. Es autoexpandible, trivalvar de pericardio porcino, con stent de nitinol de 30 mm de longitud, recubierto por pericardio porcino –excepto en su porción distal– que se dilata en ambos extremos (1 cm en cada extremo), con marcas radiopacas para facilitar su localización; el diámetro de la válvula es el de la porción no dilatada (18-34 mm). El sistema de transporte es propio, con un calibre distal de 20-22 Fr y proximal de 16 Fr, y necesita un introductor de 22-24 F. Se crimpa a mano, sumergida en solución salina fisiológica fría19.
Hay 2 ensayos clínicos para conseguir la marca CE, uno en China y otro en Europa, ambos concluidos y en fase de evaluación de datos, con criterios de inclusión similares a los utilizados para el resto de las válvulas.
Harmony mTPV 25
La prótesis Harmony mTPV 25 (Medtronic, Estados Unidos) consta de una estructura de nitinol autoexpandible, recubierto de poliéster y con una válvula de pericardio porcino cosida en el centro. Su desarrollo conceptual es enorme: los primeros ensayos empezaron en los Estados Unidos en 2013, pero la válvula sigue modificándose (Harmony TPV 22, Harmony TPV 25, Harmony TPV 25 modificada) y en la actualidad solo está disponible para investigación.
Válvula PULSTA
La válvula PULSTA20 (Taewoong Medical, Corea del Sur) está diseñada para tractos nativos. Es autoexpandible, de nitinol, trivalvar de pericardio porcino, recubierta también de pericardio porcino excepto en sus porciones proximal y distal (mayor), y tiene marcas radiopacas para delimitar la zona recubierta. La numeración corresponde a la zona más estrecha –que es el nivel de las comisuras–, desde los 18 a los 32 mm, y se escoge un diámetro 1-2 mm mayor que el del tronco pulmonar; la zona acampanada mide 4 mm más que la zona estrecha. Se fabrica en 2 longitudes: 33 y 38 mm. El calibre del sistema de transporte es de 18 Fr hasta los 28 mm y de 20 Fr para los tamaños mayores. Su fuerza radial es menor que la de las válvulas Melody y SAPIEN, y por ello no es de elección para conductos estenóticos.
En la actualidad, la mayoría de los implantes se han realizado en Asia y está en marcha un ensayo clínico en Europa, que comenzó en diciembre de 2019 y en el que participa España, con criterios de inclusión similares a los considerados para el resto de las válvulas.
Complicaciones y limitaciones
Las complicaciones y las limitaciones de estas prótesis son:
-
– Compresiones: aproximadamente en el 5% de los pacientes, durante el procedimiento, se identifica riesgo de compresión coronaria. Con las prótesis grandes puede producirse distorsión de la raíz aórtica con insuficiencia.
-
– Roturas: del conducto, sobre todo si está calcificado, durante la predilatación, que precisa implante inmediato de un stent cubierto; la navegación de las válvulas es difícil y requiere guías de alto soporte que pueden perforar las RP; durante el avance y la retirada puede dañarse la válvula tricúspide y producir insuficiencia.
A pesar de todo ello, la mortalidad durante el procedimiento es de alrededor del 1,4%21.
En el seguimiento, las fracturas fueron frecuentes (12,4%) con los antiguos implantes Melody cuando no se realizaba implante previo de stent, y los factores de riesgo eran la edad joven, el mayor gradiente antes del procedimiento y residual posterior, el menor tamaño del conducto, la proximidad al esternón y la observación de recoil tras la liberación22. La segunda complicación en frecuencia es la endocarditis infecciosa (4,9%), la mayoría sobre Melody, con una incidencia mayor que en los casos quirúrgicos y sobre la cual existen varias hipótesis: daño de la válvula durante el montaje, no observación estricta de esterilidad, endocarditis previa, resultado hemodinámico no satisfactorio, higiene dental deficiente, piercings y tatuajes, etc.)23.
Existen datos, procedentes de registros24 y de estudios multicéntricos, sobre la evolución de la válvula Melody a medio plazo y las reintervenciones sobre la misma25. En un periodo de seguimiento de algo más de 5 años, se realiza algún procedimiento en el 14,4-15% de los casos, la mayoría por fractura. Existe una gran variación de las indicaciones entre instituciones, y en el 65% de los procedimientos se ha realizado un reimplante sobre la válvula previa (valve in valve), lo que confirma que la endocarditis infecciosa sigue siendo el talón de Aquiles de la válvula Melody, con una incidencia de 2,4% pacientes-año. No existen datos suficientes sobre otro tipo de válvulas.
TRATAMIENTO PERCUTÁNEO DE LAS RAMAS PULMONARES
El abordaje percutáneo en estenosis de RP se ha generalizado gracias al desarrollo de nuevos materiales y avanzada tecnología, y hoy en día es la primera opción debido a los pobres resultados quirúrgicos. La estenosis de RP puede ser congénita, asociada a síndromes (Williams-Beuren, Alagille, etc.) o a infecciones connatales como la rubeola, o formar parte de CC complejas como la tetralogía de Fallot, la atresia pulmonar o el sling de la arteria pulmonar. Sin embargo, la estenosis es el resultado evolutivo o residual de la cirugía en esas mismas CC y en otras como en el switch arterial de Jatene (Lecompte), o cuando es necesario colocar un conducto entre el VD y las RP. El tratamiento percutáneo pretende mejorar el gasto cardiaco y aliviar la presión del VD, reequilibrar la distribución del flujo a ambos pulmones y mejorar la clase funcional, la capacidad de esfuerzo (VO2 y VE/VCO2) y el pronóstico en los pacientes con fisiología univentricular y biventricular. Como criterios de repercusión hemodinámica se consideran un gradiente ≥ 20 mmHg, una estenosis angiográfica ≥ 50%, una presión del VD o de la arteria pulmonar ≥ 60% de la sistémica (biventricular) o una asimetría ≥ 30% en la perfusión pulmonar por resonancia magnética o por gammagrafía; esta asimetría del flujo puede generar que estenosis unilaterales significativas no se traduzcan en gradientes de presión al tratarse de un flujo en paralelo26.
Generalidades
Angioplastia con balón
La angioplastia con balón se reserva para pacientes de bajo peso, cuando la anatomía impide colocar un stent o cuando se trata de segmentos implicados en futuras cirugías. La reestenosis, de hasta un 50% inmediatamente por recoil o compresión extrínseca, es más frecuente que con un stent. Es un procedimiento seguro, con menos del 1% de complicaciones mayores. Tomando como referencia del vaso el diámetro hiliar, se seleccionan balones de hasta el triple del diámetro crítico de la estenosis, sin sobrepasar el doble del diámetro de referencia (figura 5). Para que sea eficaz debe desaparecer la muesca y producirse un desgarro intimomedial controlado que remodele excéntricamente; es decir, los resultados pueden no ser inmediatos. Se considera exitoso el procedimiento si se produce un incremento de la luz ≥ 50% del diámetro mínimo, una reducción
Figura 5. Diámetros de referencia en el tratamiento percutáneo de las ramas pulmonares.
≥ 20% de presión en el VD o sistémica, o un incremento ≥ 20% en el flujo al pulmón tratado27. Utilizando los recientes balones de alta presión no distensibles y los balones con microtomos o cutting balloons mejoran los resultados en angioplastias que no responden a balones convencionales, o especialmente resistentes, como las de las ramas lobares en los pacientes con síndromes genéticos. Los cutting balloons habituales alcanzan los 8 mm de diámetro y precisan ser colocados en la zona que se va a tratar a través de una vaina para evitar lesionar la válvula tricúspide o la válvula pulmonar en su avance o retirada (figura 6).
Figura 6. A: cutting balloon. B: balón BIB con stent CP cubierto montado. C: stent BeGrow.
Angioplastia con stent
La angioplastia con stent, descrita por Mullins en los años 1980, proporciona el soporte estructural y evita la reestenosis inmediata por recoil o plegamiento, y sus resultados a medio y largo plazo son mejores que los de la angioplastia convencional. El perfeccionamiento de los perfiles y del diseño en celdas semiabiertas o abiertas, que permiten la redilatación, ha conseguido acercar esta técnica a pacientes de menor edad y peso, a expensas de sucesivas redilataciones necesarias para adaptarlos al tamaño del vaso por el crecimiento o para dilatar el origen de ramas enjauladas. Varios trabajos demuestran que estas redilataciones sucesivas son efectivas y seguras. Los stents de celda cerrada son más estables en el crimpado manual y tienen en general mayor fuerza radial. Habitualmente tienen que navegar sobre el balón dentro de una vaina hasta la estenosis para evitar dañar las válvulas derechas y la migración del stent, y para poder ser reposicionados antes de la implantación28. El perfil de esta vaina es proporcional al diámetro del balón sobre el que se monta y tienen mejor perfil los premontados de un tamaño equivalente; existen incluso algunos modelos que no requieren el uso de introductores largos para su implante. Uno de los balones más usados es el doble balón BIB, de 8-30 mm de diámetro, que consiste en dos balones concéntricos en los que el inflado del interior permite predecir el comportamiento del stent en la estenosis, expandir secuencialmente y reposicionar si es necesario (figura 6). Considerando un índice de Nakata normal de 250-300 mm2/m2, un paciente adulto de 2 m2 de superficie corporal necesitará un stent que pueda alcanzar un diámetro ideal de 18-20 mm en cada rama. Los stents autoexpandibles mejoran el perfil al no requerir balón para su implantación; no son redilatables, pero en la actualidad están aprobados para otras localizaciones, como la vía biliar y el eje femoropoplíteo29.
En general se implantan stents desnudos y se reservan los cubiertos para casos en los que se pretende reparar la pared del vaso lesionado o regular mediante una forma de diábolo el flujo a una u otra rama, o a través de un shunt sistémico pulmonar (tabla 3).
Tabla 3. Stents empleados actualmente en las ramas pulmonares
Nuevas tecnologías
Las nuevas tecnologías incluyen:
-
– Balones liberadores de fármacos: balones no expandibles revestidos de sustancias antiproliferativas, como los análogos de la rapamicina o paclitaxel, aprobados para estenosis arteriales periféricas, pero especialmente útiles para tratar la reestenosis por proliferación intimal en los stents30.
-
– Stents bioabsorbibles: evitan la necesidad de redilataciones en pacientes en crecimiento. Pueden estar compuestos de polímeros orgánicos o de aleaciones de metales corrosibles, como hierro o magnesio. Algunos trabajos muestran una respuesta inflamatoria en la pared del vaso y dudas en cuanto a reestenosis significativas. Todavía sin aprobación por la Food and Drug Administration, el Pediatric Bioresorbable Stent (480 Biomedical Stent Inc, Estados Unidos) es el diseño con estudios en fases más avanzadas y ha sido específicamente desarrollado para el tratamiento de estenosis de RP en CC en niños.
-
– Stents fracturables: celdas con bisagras programadas para su rotura con un balón, como el BeGrow (Bentley, Alemania), o su reabsorción, como el Growth Stent (QualiMeD, Alemania), que consiste en 2 mitades unidas por suturas biodegradables que desaparecen en 5 meses y permiten crecer al vaso (figura 6).
Complicaciones
Los procedimientos percutáneos sobre RP son de riesgo moderado (angioplastia) o alto (stent). Suelen realizarse con anestesia general y heparina no fraccionada a dosis de 100 UI/kg, con un máximo de 5.000 UI y un tiempo de coagulación activado ≥ 250 s. Las complicaciones más frecuentes y los factores de riesgo se detallan en la tabla 4; son más frecuentes cuando el procedimiento es urgente y cuanto menor es la edad del paciente, alcanzando el 38% en neonatos. Como norma general, se recomienda colocar la guía del soporte necesario en la rama lobar inferior y no volver a sondar con guías ni avanzar nuevamente la vaina por el segmento recién dilatado una vez retirados. La rotura o la disección son más frecuentes en la angioplastia simple. Muchas veces no tienen repercusión clínica, pero en caso contrario se deben tratar revirtiendo la anticoagulación, inflando de nuevo un balón en la zona de fuga, colocando un stent o recurriendo a la cirugía. La reestenosis de los stent se debe fundamentalmente a la proliferación intimal, pero también puede suceder si el stent se fractura y pierde su integridad estructural, o por compresión extrínseca. Ocurre con menos frecuencia con los diseños de celda semiabiertos y con la mayor flexibilidad de los autoexpandibles. No existen recomendaciones claras sobre el tratamiento antitrombótico tras el implante. La endotelización sucede a los 6 meses del implante y, aunque la trombosis es rara, la práctica habitual es mantener durante este tiempo un fármaco antiagregante31.
Tabla 4. Complicaciones y sus factores de riesgo más frecuentes
| Complicaciones | Factores de riesgo |
|---|---|
| Daño vascular | Sobredilatación, guía demasiado rígida, parches quirúrgicos, cirugía reciente |
| Trombosis | Derivación cavopulmonar, cianosis, ramas pequeñas, corto tiempo de coagulación activado, no antiagregación |
| Embolización del stent | Bajo peso, desproporción, bifurcación, malposición, emergencia, crimpado manual |
| Edema por reperfusión | Cianosis crónica, mayor edad |
| Discordancia | Implante precoz, diseño no dilatable |
| Reestenosis | Solapamiento corto, síndrome genético, derivación cavopulmonar, bifurcación, cintura residual, sobredimensión, compresión externa, stent autoexpandible |
Situaciones específicas
Bifurcaciones
Existen 2 opciones técnicas para reparar estas estenosis sin comprometer el flujo en la rama contralateral:
-
– Implantar 2 stents simultáneamente, cada uno sobre su guía y su vaina, procurando tamaños parecidos, e inflando ambos balones de manera progresiva y simultánea (figura 1A del material adicional).
-
– Colocar un stent largo, de celda abierta, desde una de las ramas hasta el tronco pulmonar para después recruzar hacia la rama contralateral con otra guía e implantar un segundo stent más corto (figura 1B del material adicional); esta técnica es útil cuando solo se dispone de un acceso venoso o se prevé colocar una prótesis pulmonar que precisa pre-stent.
Derivación cavopulmonar
En la frágil fisiología univentricular tipo Fontan –un circuito pulmonar no pulsátil y sin bomba– los criterios en los que se basa la indicación están en un umbral más bajo que en la fisiología biventricular, y prácticamente cualquier grado de estenosis angiográfica o gradiente hemodinámico son significativos, pues pueden generar grandes elevaciones de la presión venosa central y considerables asimetrías en la distribución del flujo a ambos pulmones. Asegurar una distribución lo más simétrica posible del flujo en los pulmones es esencial para evitar el desarrollo de fístulas arteriovenosas. Para esto puede ser necesario reducir el flujo de una fístula creada previamente o a una de las ramas mediante un stent cubierto en forma de diábolo (figura 2 del material adicional). Estos procedimientos son complejos por los accesos (femoral, yugular o transhepático) y porque son pacientes multiintervenidos, con mayor riesgo de trombosis (poliglobulia, flujo lento no pulsátil), con lechos quirúrgicos a veces recientes, de corta edad, etc. La angioplastia de RP es el procedimiento más frecuentemente realizado en una cohorte moderna extensa de pacientes con derivación cavopulmonar (DCP) total, tanto tras la DCP superior, como tras completarse la DCP inferior, solo por detrás de la angioplastia del conducto extracardiaco (figura 3 del material adicional). La estenosis es más frecuente en la RP izquierda (segmento proximal de la RP derecha originalmente) debido a su mayor recorrido, por la compresión de la vecina aorta ascendente y por presentar menor flujo en la fase entre el Glenn pulsátil y la DCP total32.
El tamaño final de las RP, y por tanto su flujo, están directamente relacionados con el éxito a largo plazo de esta fisiología y con la clase funcional de los pacientes, pero suele ser necesario revisar de manera invasiva y periódica el estado de los stents implantados para ajustarlos al crecimiento, pues los métodos no invasivos pueden no ser lo bastante sensibles. Tras el implante de un stent, las guías de la American Heart Association recomiendan tratamiento anticoagulante durante 3-6 meses.
Estado posoperatorio
La reparación de algunas CC conlleva un riesgo de estenosis residual o evolutiva de RP. Con la maniobra de Lecompte, asociada al switch arterial para reparar la d-transposición de grandes arterias, aparece estenosis de RP hasta en el 28% de forma precoz, y la estenosis supravalvular pulmonar es la principal causa de reintervención en la infancia. El tratamiento percutáneo es técnicamente demandante, pues son pacientes pequeños, con suturas a veces recientes, en bifurcación y con compromiso de espacio con la vena cava superior y la aorta ascendente (figuras 4 y 5 del material adicional). Por ello, la angioplastia simple puede ser la única opción, aunque es eficaz en menos de la mitad de los casos33.
Otras CC con frecuente estenosis residual de RP tras la cirugía son la tetralogía de Fallot, el truncus arterioso, el sling de arteria pulmonar, etc., y todas las condiciones que impliquen colocar un conducto entre el VD y las RP, como las intervenciones de Ross, Rastelli, Yasui, Sano, etc.
El desarrollo tecnológico actual, tanto en técnicas de imagen como en materiales y dispositivos, ha revolucionado las posibilidades del tratamiento percutáneo de las lesiones del tronco, las válvulas y las RP, por lo que las indicaciones referidas en las vías clínicas están siendo modificadas.
FINANCIACIÓN
Trabajo no financiado.
CONTRIBUCIÓN DE LOS AUTORES
F. Gutiérrez-Larraya Aguado ha coordinado el conjunto y revisado la edición final; C. Abelleira Pardeiro y E.J. Balbacid Domingo han redactado parte del texto y procurado figuras.
CONFLICTO DE INTERESES
No existen conflictos de los autores relativos al material expuesto.
MATERIAL ADICIONAL
Vídeo 1. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
Vídeo 2. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
Vídeo 3. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
Vídeo 4. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
Vídeo 5. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
Vídeo 6. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
Vídeo 7. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
Vídeo 8. Gutiérrez-Larraya Aguado F. DOI: 10.24875/RECIC.M20000193
BIBLIOGRAFÍA
1. Rao PS. Percutaneous Balloon Pulmonary Valvuloplasty:State of the Art. Catheter Cardiovasc Interv. 2007;69:747-763.
2. Baumgartner H, Hung J, Bermejo J, et al. Echocardiographic assessment of valve stenosis:EAE/ASE recommendations for clinical practice. American Society of Echocardiography, European Association of Echocardiography. J Am Soc Echocardiogr. 2009;22:1.
3. Silvilairat S, Cabalka AK, Cetta F, et al. Echocardiographic assessment of isolated pulmonary valve stenosis:which outpatient Doppler gradient has the most clinical validity. J Am Soc Echocardiogr. 2005;18:1137.
4. Warnes CA, Williams RG, Bashore, et al. TMACC/AHA 2008 Guidelines for the Management of Adults with Congenital Heart Disease:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2008;118:e714.
5. Baumgartner H, De Backer J, Babu-Narayan S, et al. 2020 ESC Guidelines for the management of adult congenital heart disease (ACHD). Eur Heart J. 2021;42:563-645.
6. Narang R, Das G, Dev V, et al. Effect of the balloon-annulus ratio on the intermediate and follow-up results of pulmonary balloon valvuloplasty. Cardiology. 1997;88:271-276.
7. McCrindle BW. Independent predictors of long-term results after balloon pulmonary valvuloplasty. Valvuloplasty and Angioplasty of Congenital Anomalies (VACA) Registry Investigators. Circulation. 1994;89:1751-1759.
8. Voet A, Rega F, Van de Bruaene A, et al. Long-term outcome after treatment of isolated pulmonary valve stenosis. Int J Cardiol. 2012;156:11-15.
9. Devanagondi R, Peck D, Sagi J, et al. Long-Term Outcomes of Balloon Valvuloplasty for Isolated Pulmonary Valve Stenosis. Pediatr Cardiol. 2017;38:247-254.
10. Ruckdeschel E, Kim YY. Pulmonary valve stenosis in the adult patient:pathophysiology, diagnosis and management. Heart. 2019;105:414-422.
11. Petit CJ, Glatz AC, Qureshi AM, et al. Outcomes After Decompression of the Right Ventricle in Infants With Pulmonary Atresia With Intact Ventricular Septum Are Associated With Degree of Tricuspid Regurgitation:Results From the Congenital Catheterization Research Collaborative. Circ Cardiovasc Interv. 2017;10:e004428.
12. Morgan GJ, Narayan SA, Goreczny S, et al. A low threshold for neonatal intervention yields a high rate of biventricular outcomes in pulmonary atresia with intact ventricular septum. Cardiol Young. 2020;30:649-655.
13. Hogan WJ, Grinenco S, Armstrong A, et al. Fetal Cardiac Intervention for Pulmonary Atresia with Intact Ventricular Septum:International Fetal Cardiac Intervention Registry. Fetal Diagn Ther. 2020;47:731-739.
14. Pragt H, van Melle JP, Verkerke GJ, Mariani MA Ebels T. Pulmonary versus aortic pressure behavior of a bovine pericardial valve. J Thorac Cardiovasc Surg. 2020;159:1051-1059.e1.
15. Stotut KK, Daniels CJ, Aboulhosn JA, et al. 2018 AHA/ACC guideline for the management of adults with congenital heart disease:executive summary:a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. Circulation. 2019;139:e637-697.
16. Boshoff DE, Cools BL, Heying R, et al. Off label use of percutaneous pulmonary valved stents in the right ventricular outflow tract:time to rewrite the label?Catheter Cardiovasc Interv. 2013;81:987-995.
17. Kenny D, Rhodes J, Fleming G, et al. 3-Year outcomes of the Edwards SAPIEN Transcatheter heart valve for conduit failure in the pulmonary position from the COMPASSION multicenter clinical trial. J Am Coll Cardiol Interv. 2018;11:1920-1929.
18. Fleming GA, Hill KD, Green AS, et al. Percutaneous pulmonary valve replacement. Prog Ped Cardiol. 2012;33:143-150.
19. Cao QL, Kenny D, Zhou D, et al. Early clinical experience with a novel self-expanding percutaneous stent-valve in the native right ventricular outflow tract. Catheter Cardiovasc Interv. 2014:84:1131-1137.
20. Kim GB, Song MK, Bae EJ, et al. Successful feasibility human trial of a new self-expandable percutaneous pulmonary valve (Pulsta valve) implantation using knitted nitinol wire backbone and trileaflet α-gal-free porcine pericardial valve in the native right ventricular outflow tract. Circulation Cardiovasc Interv. 2018;11:e006494.
21. Virk SA, Liou K, Chandrakumar D, Gupta S, Cao C. Percutaneous pulmonary valve implantation:a systematic review of clinical outcomes. Int J Cardiol. 2015;201:487-489.
22. Ansari MM, Cardoso R, Garcia D, et al. Percutaneous pulmonary valve implantation:present status and evolving future. J Am Coll Cardiol. 2015;66:2246-2255.
23. Sharma A, Cote AT, Hosking MCK, et al. A systematic review of infective endocarditis in patients with bovine jugular vein valves compared with other valve types. J Am Coll Cardiol Interv. 2017;10:1449-1458.
24. Nordmeyer J, Ewert P, Gewillig M, et al. Acute and midterm outcomes of the postapproval MELODY registry:a multicenter registry of transcatheter pulmonary valve implantation. Eur Heart J. 2019;40:2255-2264.
25. Shahanavaz S, Berger F, Jones TJ, et al. Outcomes of transcatheter reintervention for dysfunction of a previously implanted transcatheter pulmonary valve. J Am Coll Cardiol. 2020;13:1529-1540.
26. Feltes TF, Bacha E, Beekman RH, et al. Indications for Cardiac Catheterization and Intervention in Pediatric Cardiac Disease:A scientific Statement from the American Heart Association. Circulation. 2011;123:2607-2652.
27. Patel AB, Ratnayaka K, Bergersen L. A review:Percutaneous pulmonary artery stenosis therapy:state-of-the-art and look to the future. Cardiol Young. 2019;29:93-99.
28. Hiremath G, Qureshi AM, Prieto L, et al. Balloon Angioplasty and Stenting for Unilateral Branch Pulmonary Artery Stenosis Improve Exertional Performance. JACC Cardiovasc Interv. 2019;12:289-297.
29. Zablah JE, Morgan GJ. Pulmonary Artery Stenting. Interv Cardiol Clin. 2019;8:33-46.
30. Cohen JL, Glickstein JS, Crystal MA. Drug-Coated Balloon Angioplasty:A novel treatment for pulmonary artery in-stent stenosis in a patient with Williams syndrome. Pediatr Cardiol. 2017;38:1716-1721.
31. Giglia TM, Massicotte MP, Tweddell JS, et al. Prevention and treatment of thrombosis in pediatric and congenital heart disease:a scientific statement from the American Heart Association. Circulation. 2013;128:2622-2703.
32. Franco Díez E, Balbacid Domingo E, Arreo del Val V, et al. Percutaneous Interventions in Fontan Circulation. Int J Cardiol Heart Vasc. 2015;8:138-146.
33. Nakanishi T, Matsumoto Y, Seguchi M, et al. Balloon Angioplasty for Postoperative Pulmonary Artery Stenosis in Transposition of the Great Arteries. J Am Coll Cardiol. 1993;22:859-866.
RESUMEN
La enfermedad del tronco coronario izquierdo ha permanecido muchos años como la última frontera que se resistía al intervencionismo coronario percutáneo. Hasta hace poco tiempo, los estudios clínicos más relevantes en este campo, así como las guías clínicas, han sido favorables a la revascularización quirúrgica casi como forma exclusiva de tratamiento de esta patología. Los cambios ocurridos en los últimos 10-15 años, desde la aparición de los stents farmacoactivos y su mejora tecnológica, han sido vertiginosos. La realización de estudios aleatorizados que han comparado ambas modalidades de revascularización ha llevado al intervencionismo percutáneo a la altura de la cirugía en un alto porcentaje de pacientes. Los aspectos anatómicos, técnicos y de estrategia son fundamentales en el tratamiento percutáneo de estas lesiones, dada su enorme variabilidad clínica. En tanto los estudios clínicos futuros no se decanten definitivamente a favor de la revascularización percutánea o de la quirúrgica, la discusión individualizada de cada caso en un equipo multidisciplinario y las preferencias de los pacientes deberían guiar la decisión clínica.
Palabras clave: Enfermedad coronaria. Tronco coronario izquierdo. Intervencionismo coronario percutáneo. Cirugía de revascularización coronaria.
Abstract
For many years, the left main coronary artery disease has remained as the last frontier resisting percutaneous coronary intervention. Until recently, the most relevant clinical studies on this regard as well as clinical practice guidelines favored surgical revascularization almost as the only treatment pathway for the management of this condition. The changes that have occurred over the last 10 to 15 years since the appearance of drug-eluting stents and their technological advances have been extraordinary. This added to the publication of randomized clinical trials that compared both revascularization modalities has placed percutaneous coronary interventions at a similar level to surgery in a large number of patients. The anatomical, technical, and strategic aspects are essential for the percutaneous management of left main coronary artery lesions given their tremendous clinical variability. In this article we will be reviewing their anatomy, angiography, intracoronary diagnostic techniques, and different percutaneous revascularization strategies. As long as future clinical studies do not definitively favor percutaneous over surgical revascularization or vice versa, individual discussions on each particular case by the heart team and our patients’ preferences should guide our clinical decision-making process.
Keywords: Coronary artery disease. Left main coronary artery. Percutaneous coronary intervention. Coronary artery bypass graft.
Abreviaturas
CABG: cirugía de revascularización coronaria. Cx: arteria coronaria circunfleja. DA: arteria coronaria descendente anterior. ICP: intervención coronaria percutánea. IVUS: ecografía intravascular. RFF: reserva fraccional de flujo. TCI: tronco coronario izquierdo.
INTRODUCCIÓN
La enfermedad significativa del tronco coronario izquierdo (TCI) se encuentra en un 4-5% de todas las coronariografías1. Dado que el TCI aporta más del 75% del flujo sanguíneo miocárdico total, el riesgo asociado a sus lesiones es el más alto de todas las posibles lesiones coronarias. Sin revascularización, el pronóstico es infausto, con una mortalidad del 37% a 3 años2. La revascularización puede ser quirúrgica o percutánea, cada una de ellas con sus ventajas y limitaciones. La adecuada valoración de la extensión anatómica y la complejidad de la enfermedad coronaria, la comorbilidad del paciente y el dominio de las técnicas de intervención coronaria percutánea (ICP) complejas son los factores más decisivos para elegir la estrategia de revascularización idónea. Existen diversos modelos y escalas para guiar la selección del paciente, sin que ninguno de ellos se haya impuesto claramente3,4.
PERSPECTIVA HISTÓRICA
La cirugía de revascularización aortocoronaria (CABG, coronary artery bypass surgery) ha sido el tratamiento estándar para los pacientes con enfermedad del TCI, basándose en los estudios clínicos iniciales que demostraron el beneficio pronóstico en pacientes asignados a cirugía frente a terapia médica5. Los pacientes con enfermedad grave del TCI fueron excluidos de la mayoría de los primeros estudios y hasta hace pocos años no existía ninguno específico cuyo objetivo principal fuera comparar los resultados de la cirugía frente a la ICP6,7. Actualmente ya se dispone de estudios clínicos aleatorizados que han refrendado la utilidad de la ICP en la enfermedad del TCI; tanto es así que las guías clínicas americanas y europeas la posicionan como la estrategia recomendada en escenarios concretos8,9. Aproximadamente el 50% de este tipo de lesiones se revascularizan percutáneamente en nuestro medio, con un 5% de incremento anual10.
RECUERDO ANATÓMICO
Anatómicamente, el TCI se divide en tres porciones, ostial, media y distal; esta última es una bifurcación con un ángulo típicamente más amplio que el de otras bifurcaciones coronarias (> 70°). Aporta al menos el 75% del flujo coronario total. El calibre habitual del TCI es de 5 ± 0,5 mm11 y su longitud media es de 10,5 ± 5,3 mm12. Hasta en un 30% de los casos da origen a una tercera rama, el ramo intermedio o bisectriz (figura 1).
Figura 1. Características anatómicas principales del tronco coronario izquierdo (TCI).
La enfermedad ateroesclerótica del TCI suele ser difusa. Cuando la bifurcación está afectada (en un 70% de los casos) también suele haber placa en el origen de la arteria coronaria descendente anterior (DA) y de la arteria coronaria circunfleja (Cx)11. En ocasiones, la DA y la Cx presentan un origen independiente desde el seno coronario izquierdo, sin que exista propiamente TCI (0,41-0,67% de los casos)13,14. En un 0,03% de los pacientes, el TCI presenta un origen anómalo con un trayecto entre la aorta y la arteria pulmonar, patrón que se asocia con un riesgo elevado de muerte súbita14,15.
VALORACIÓN DEL TRONCO CORONARIO
Angiografía
Las guías de práctica clínica de la Sociedad Europea de Cardiología establecen que la revascularización del TCI está indicada para pacientes con estenosis angiográfica > 50% e isquemia miocárdica documentada16. El problema práctico es que la coronariografía presenta limitaciones para la valoración de la enfermedad del TCI, con una gran variabilidad intraobservador e interobservador17,18. Algunas lesiones ostiales pueden sobreestimarse debido a la superposición y artefacto del catéter o a un espasmo asociado, y las lesiones distales pueden ser difíciles de valorar debido a la afectación normalmente difusa de la bifurcación y la falta de vaso «sano» de referencia. La amortiguación o la ventricularización de la curva de presión son datos indirectos de afectación del TCI19.
Resulta imprescindible una correcta valoración de la gravedad del TCI dada la evidencia de que las lesiones funcionalmente no significativas presentan un pronóstico favorable sin revascularización20, así como del fallo precoz del injerto en lesiones no significativas21. A este respecto, las guías clínicas reconocen el valor de técnicas diagnósticas como la ecografía intravascular (IVUS, intravascular ultrasound) y la guía de presión en la estimación de la gravedad de la enfermedad del TCI.
Imagen intracoronaria
La IVUS permite obtener información acerca de la estructura y la anatomía del TCI , así como de la presencia de placa y su extensión, composición y calcificación. Diversos estudios han determinado un área luminal mínima (ALM) de > 6 mm² como punto de corte para determinar la gravedad22,23. El estudio español multicéntrico prospectivo LITRO demostró la seguridad de diferir la revascularización de las lesiones del TCI intermedias con ALM > 6 mm², con resultados favorables a 2 años de seguimiento24. Además, la IVUS ayuda a determinar si los ostia de la DA y la Cx presentan enfermedad significativa. Cuando está indicada la revascularización, orienta sobre el tamaño adecuado del stent y sobre la mejor estrategia en función de la anatomía y la carga de calcio del TCI y de la DA/Cx proximales; en lesiones por reestenosis de un stent previo, ayuda a caracterizar su etiología y la posible afectación de los bordes del stent. Realizar la ICP del TCI guiada con IVUS proporciona un beneficio en comparación con la ICP guiada por angiografía25. También puede valorar la necesidad de posdilatación del stent y la existencia de disección distal, y ayuda a determinar la necesidad de implante de un stent en la rama lateral o a excluir el compromiso de esta tras un stent provisional26. Se han descrito diversos parámetros que permiten optimizar la ICP del TCI mediante IVUS (figura 2 y figura 3). Un amplio metanálisis de pacientes de varios registros españoles ha mostrado que el uso de IVUS se asocia a una mejor evolución clínica, con reducción del objetivo de muerte e infarto, y también específicamente de la trombosis de los stents. Estos hallazgos resultaban especialmente significativos en las lesiones distales del tronco27. Otros registros y algún ensayo menor, así como el análisis conjunto de todos ellos, muestran el beneficio clínico significativo del uso de IVUS en la ICP del TCI, con reducción de muerte, infarto y trombosis28. Las guías de práctica clínica de la Sociedad Europea de Cardiología consideran como indicación IIa B el empleo de IVUS para estratificar la gravedad de toda lesión del TCI16.
Figura 2. Puntos clave para la optimización de la intervención coronaria percutánea de las porciones ostial y media del tronco coronario izquierdo mediante ecografía intravascular. ASM: área stent mínima; Cx: circunfleja; DA: descendente anterior; IVUS: ecografía intravascular; TCI: tronco coronario izquierdo. (Modificada con permiso de de la Torre Hernández et al.25.)
Figura 3. Puntos clave para la optimización de la intervención coronaria percutánea del tronco coronario izquierdo distal mediante ecografía intravascular. ASM: área stent mínima; Cx: circunfleja; DA: descendente anterior; IVUS: ecografía intravascular; TCI: tronco coronario izquierdo. (Modificada con permiso de de la Torre Hernández et al.25.)
La utilidad de la tomografía de coherencia óptica (OCT) en el TCI es algo más limitada, principalmente por la dificultad técnica de relleno completo con contraste y el área nativa de los segmentos ostiales. Otro inconveniente de su uso en el TCI es su profundidad de penetración limitada (2-3 mm) comparada con la de la IVUS (4-8 mm), y dado que el TCI suele presentar diámetros de 3,5-4,5 mm puede producirse una inadecuada valoración. Además, no se ha demostrado el valor de ningún punto de corte de ALM con OCT para el abordaje de las lesiones del TCI. Por otro lado, debido a las diferencias en la obtención de imágenes con ambas técnicas, los umbrales establecidos como puntos de corte en la IVUS no son extrapolables para la OCT.
Guía de presión
La guía de presión aporta información valiosa para estratificar la gravedad de la enfermedad del TCI16,29. Para evitar que una presumible enfermedad ostial afecte la medición, las presiones se han de ecualizar y medir con el catéter guía parcialmente «desintubado» del TCI. La obtención de índices de hiperemia, tanto desde la DA como desde la Cx, puede suponer una mejor valoración global de la gravedad de la enfermedad del TCI y una mayor seguridad en el momento de decidir el manejo. Algunos autores sugieren que, para asegurar la máxima hiperemia, la adenosina intravenosa es preferible a la intracoronaria4.
Otro aspecto importante de la valoración del TCI con guía de presión es la interdependencia fisiológica del árbol coronario, que puede alterar los valores de reserva fraccional de flujo (RFF). En particular, se ha descrito una sobreestimación de la RFF en presencia de enfermedad difusa de la DA y la Cx, así como una infraestimación en caso de enfermedad significativa de la rama lateral30. Por ello, ante una enfermedad concomitante de ramas distales, puede ser útil la medición de la RFF durante una retirada controlada30.
En cuanto al umbral patológico, parece que diferir la ICP con un valor de RFF > 0,8 es seguro31. Aunque el valor de otros índices de guía de presión que no requieren hiperemia, como el instantaneous wave-free ratio (iFR), no ha sido ampliamente evaluado en el TCI, un estudio ha demostrado la seguridad del uso del iFR para diferir la revascularización del TCI32. En la actualidad se está desarrollando en España el estudio multicéntrico iLITRO (NCT03767621), que probablemente arrojará luz sobre la utilidad del iFR y su umbral patológico en las lesiones del TCI.
Integración de técnicas
Es aconsejable integrar el uso de la IVUS y la guía de presión en la valoración del TCI de dudosa gravedad angiográfica, tal como se recomienda en un documento internacional de consenso de la European Association of Percutaneous Cardiovascular Interventions33 (figura 4). Así, en las lesiones ambiguas del TCI, un ALM > 6 mm2 indicaría no revascularizar, un ALM < 4,5-5 mm2 indicaría revascularizar y valores de ALM entre 4,5-5 y 6 mm2 harían recomendable el uso de la RFF/iFR para decidir.
Figura 4. Criterios de enfermedad significativa de lesiones del tronco coronario izquierdo. ALM: área luminal mínima; RFF: reserva fraccional de flujo. (Modificada de Johnson et al.33.)
REVASCULARIZACIÓN DEL TRONCO COMÚN
Revascularización quirúrgica
El CABG ha sido el tratamiento estándar para los pacientes con enfermedad del TCI desde los ensayos clásicos que demostraron el beneficio pronóstico en pacientes aleatorizados a cirugía frente a terapia médica5. El registro CASS comunicó una tasa de supervivencia a 4 años en pacientes operados del 88%, frente al 63% en los no revascularizados34. Otros estudios demostraron una reducción de la mortalidad del 65% a favor de la cirugía35. Esta permite una revascularización completa independientemente de las características de la lesión proximal, y los avances técnicos permiten procedimientos cada vez más rápidos sin necesidad de bomba extracorpórea. La principal desventaja sigue siendo la aún no despreciable morbimortalidad perioperatoria y posoperatoria. Algunos estudios han objetivado una tasa de muerte del 5,5-8,5%, de necesidad de revascularización guiada por isquemia del 7,1-9,4% y de ictus del 3,1-5,1% a 3 años36.
Revascularización percutánea
La introducción de los stents supuso una importante mejora de los resultados de la ICP sobre el TCI, aunque en un primer momento, utilizando stents convencionales, mostró peores resultados que la cirugía, con tasas de mortalidad del 14% con una fracción de eyección del ventrículo izquierdo (FEVI) > 40% y del 78% con FEVI < 40% a los 9 meses37. Con la llegada del stent farmacoactivo, las tasas de reestenosis y de eventos adversos disminuyeron lo suficiente como para equiparar la ICP con la CABG38-41, con tasas de supervivencia libre de eventos al año del 98% en pacientes con FEVI < 40%38. En pacientes rechazados para cirugía (EuroSCORE > 6 o Parsonnet > 15), las tasas de mortalidad y de supervivencia sin eventos cardiovasculares adversos mayores fueron del 3,5% y el 75,3%, respectivamente, a 6 meses42. Estos trabajos ya indicaban que la ICP sobre las porciones del TCI ostial y media parecía tener un mejor pronóstico que la ICP del TCI distal o la que implicaba bifurcación. La aparición de nuevos fármacos antiproliferativos, el desarrollo de mejores dispositivos y la realización de nuevas técnicas y estrategias en el tratamiento de las bifurcaciones han permitido mejorar los resultados, la eficacia y el buen pronóstico de la ICP sobre el TCI en centros con amplia experiencia.
Revascularización quirúrgica frente a percutánea
Han sido 6 los principales ensayos aleatorizados que han confrontado la estrategia percutánea con la quirúrgica (tabla 1 ). Los primeros (LE MANS43, SYNTAX44, Boudriot et al.45 y PRECOMBAT46) se realizaron con stents farmacoactivos de primera generación y comunicaron tasas similares del combinado de muerte, infarto y accidente cerebrovascular para ambas estrategias. Las principales diferencias fueron una mayor incidencia de accidente cerebrovascular en el grupo de CABG y una mayor tasa de necesidad de nueva revascularización tras la ICP. Los dos ensayos más recientes, los estudios EXCEL y NOBLE, emplearon stents farmacoactivos de segunda generación e incluyeron cohortes amplias de pacientes con enfermedad ateroesclerótica menos compleja, lo que quizás refleja mejor la práctica clínica real16,47. El distinto resultado que obtuvieron estos dos estudios suscitó mucha polémica, destacando las diferencias en la definición del objetivo primario y de infarto periprocedimiento como posibles condicionantes. Y es que el estudio NOBLE, al contrario que el EXCEL, excluyó el infarto periprocedimiento del combinado de eventos primario, a pesar de que su inclusión está recomendada por el Academic Research Consortium y forma parte de la definición universal de infarto de miocardio. Se ha demostrado que el infarto periprocedimiento asocia un peor pronóstico16. Por su parte, la amplia diferencia en la tasa de trombosis del stent (0,7% en el EXCEL frente a 3% en el NOBLE) apunta a la posible influencia del distinto tipo de stent que se empleó en cada estudio.
Tabla 1. Principales estudios comparativos entre revascularización percutánea y quirúrgica
| Estudio | Año | n | SYNTAX medio | Lesiones del TCI distal | Tipo de stent | Objetivo primario (ICP frente a CABG) | Objetivos secundarios (ICP frente a CABG) |
|---|---|---|---|---|---|---|---|
| LE MANS43 | 2008 | 105 | n/a | 58% | Convencional, stents recubiertos de primera generación | Cambio en FEVI a 1 año: 3,3 ± 6,7% frente a 0,5 ± 0,8%; p = 0,047 |
|
| SYNTAX LM44 | 2010 | 705 | 30 | 61% | Taxus | Muerte, ACV, IM o necesidad de revascularización a 1 año: 15,8% frente a 13,6%; p = 0,44 |
|
| Boudriot el al.45 | 2011 | 201 | 23 | 72% | Cypher | Muerte, IM o necesidad de revascularización a 1 año: 19,0% frente a 13,9%; p no inferioridad = 0,19 |
|
| PRECOMBAT46 | 2011 | 600 | 25 | 64% | Cypher | Muerte, ACV, IM, ID-TLR a 1 año: 8,7% frente a 6,7%; p no inferioridad = 0,01 |
|
| EXCEL16 | 2017 | 1.905 | 21 | 81% | Xience | Muerte, ACV o IM a 3 años: 15,4% frente a 14,7%: p no inferioridad = 0,02; p superioridad = 0,98 |
|
| NOBLE38 | 2017 | 1.201 | 22 | 81% | BioMatrix Otros stents recubiertos | Muerte, ACV, IM periprocedimiento o necesidad de revascularización a 5 años: 29% frente a 19%; p = 0,0066 |
|
|
ACV: accidente cerebrovascular; CABG: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; ID-TLR: revascularización guiada por isquemia (ischaemia-driven target lesion revascularization); FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; n/a: no aplicable; TCI: tronco coronario izquierdo. |
|||||||
En general, los resultados de estos estudios señalan que, siempre que se consiga la revascularización completa, la cirugía y la ICP logran resultados equivalentes para el combinado de muerte, infarto e ictus a 5 años de seguimiento48. No obstante, existe un beneficio temprano para la ICP en términos de infarto e ictus periprocedimiento, que se neutraliza por un mayor riesgo de infarto durante el seguimiento a largo plazo. El riesgo de necesidad de nueva revascularización sí es uniformemente mayor en los pacientes con ICP comparados con los tratados con cirugía.
Otro punto que hay que considerar es la relación entre los resultados de la ICP y la puntuación en la escala SYNTAX. Con los primeros ensayos ya se sugirió que una mayor puntuación probablemente se asociaba a un mejor pronóstico con el CABG. Algunos metanálisis han comunicado que, en conjunto, la mortalidad por causa cardiaca a largo plazo parece ser directamente proporcional a la complejidad angiográfica de la enfermedad del TCI. Así, los pacientes con una puntuación SYNTAX baja presentaron mejor pronóstico con ICP que los pacientes con una puntuación alta. Además, los pacientes con una puntuación SYNTAX alta presentaron una tendencia no significativa hacia una mayor supervivencia a 10 años con cirugía en comparación con ICP49,50. Uno de los principales inconvenientes de esta escala es que solo integra variables anatómicas. En la actualidad se dispone de otras escalas que combinan variables angiográficas, clínicas e incluso funcionales, pero su utilidad como marcadores de pronóstico a largo plazo en la enfermedad del TCI no ha sido debidamente evaluada51.
Las actuales guías de revascularización coronaria16 establecen la indicación de CABG o ICP en función de la puntuación SYNTAX (tabla 2). Si la complejidad es baja, la ICP del TCI está tan indicada como la cirugía (IA). La ICP es una alternativa a la cirugía en los pacientes con una puntuación SYNTAX intermedia (IIa A), y se necesita una mayor evidencia en aquellos con puntuación SYNTAX alta para recomendar claramente la ICP.
Tabla 2. Indicación, nivel y clase de evidencia de la enfermedad significativa de tronco coronario izquierdo según las guías de revascularización miocárdica de la Sociedad Europea de Cardiología 20188
| Enfermedad de tronco coronario izquierdo | Cirugía | ICP | ||
|---|---|---|---|---|
| SYNTAX bajo (0-22) | I | A | I | A |
| SYNTAX intermedio (23-32) | I | A | IIa | A |
| SYNTAX alto (≥ 33) | I | A | III | B |
Selección de los pacientes
Las guías europeas destacan la importancia de un equipo multidisciplinario en la decisión de la estrategia de revascularización en pacientes estables con enfermedad del TCI. El equipo debe estar constituido por cardiólogos clínicos e intervencionistas y cirujanos cardiacos. En cambio, en procedimientos emergentes, la cirugía no suele ser una opción factible por el retraso que supone y el empeoramiento progresivo del pronóstico en relación con el tiempo de isquemia. Pappalardo et al.52 comunicaron una mortalidad intrahospitalaria del 21% (principalmente por fallo multiorgánico) en pacientes con infarto agudo de miocardio y oclusión aguda del TCI. Sin embargo, los pacientes que sobrevivieron al ingreso y que fueron tratados con ICP presentaron buen pronóstico, con una supervivencia del 89,5% al año.
En el resto de los supuestos sería deseable no realizar el intervencionismo ad hoc tras el procedimiento diagnóstico. Deberían discutirse con el cardiólogo clínico, el cirujano cardiaco y especialmente el paciente las diferentes opciones de revascularización, informando a este de manera objetiva sobre las ventajas y los inconvenientes teóricos de cada técnica y los resultados particulares de su centro, haciéndole partícipe en la decisión. También hay que tener en cuenta otros factores clínicos, anatómicos y generales (tabla 3). Si se decide que la ICP del TCI es la mejor opción, una adecuada premedicación, la revisión en equipo y la planificación del procedimiento en cuanto a técnica y materiales conllevan una mayor tasa de éxito.
Tabla 3. Factores influyentes en la modalidad de revascularización del tronco coronario izquierdo
| A favor de la ICP | A favor de la CABG | |
|---|---|---|
| Factores generales |
|
|
| Factores clínicos |
|
|
| Factores anatómicos |
|
|
| Preferencias y necesidades del paciente | ||
|
CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble; TCI: tronco coronario izquierdo. |
||
Debido a que la mayoría de los ensayos clínicos se han realizado en centros con cirugía cardiaca, la realización de la ICP del TCI en centros sin cirugía ha estado en entredicho. No obstante, dado que existe evidencia del buen resultado de la ICP en centros sin cirugía53-55, se acepta que la ICP del TCI puede realizarse en estos centros con seguridad, siempre que se disponga de un equipo médico experimentado y de equipamiento técnico suficiente, con consentimiento informado del paciente y un protocolo previo bien establecido para el traslado urgente a un hospital con cirugía cardiaca en el hipotético caso de que se precisase una cirugía emergente.
Equipo médico y técnico
La ICP del TCI siempre debe considerarse un procedimiento de alto riesgo, en el que la experiencia de los operadores desempeña un papel fundamental. Hay evidencia de que los pacientes tratados en centros con un alto número de procedimientos de este tipo tienen mejor pronóstico56.
El equipamiento debe garantizar, por un lado, la correcta valoración del TCI (IVUS, guía de presión), y por otro la disponibilidad de todo tipo de material que pudiera ser necesario para la angioplastia y sus posibles complicaciones. Por ser un procedimiento de alto riesgo, los medios y los dispositivos de soporte hemodinámico, como el balón de contrapulsación intraaórtico y el Impella (Abiomed, Estados Unidos), ocupan un lugar importante.
LA ANGIOPLASTIA DEL TRONCO CORONARIO IZQUIERDO
Previamente al procedimiento es fundamental un estudio completo del caso para decidir la estrategia, la vía de acceso (radial o femoral), el calibre del introductor (por la presumible necesidad de técnica de 2 stents se recomiendan catéteres de 7 Fr por vía femoral o «7 en 6 Fr» por vía radial) y el tipo de catéter guía. Aunque el intervencionismo por vía radial ha desplazado en numerosos escenarios al femoral, probablemente la ICP sobre el TCI sea un nicho en el que el acceso femoral deba ser considerado, dado que conseguir el mejor apoyo posible puede ser clave y que permite el uso de catéteres de mayor calibre y la posibilidad de un implante rápido de un dispositivo de soporte hemodinámico.
La afectación del TCI distal o de la bifurcación implica que el procedimiento sea más complejo, con mayor probabilidad de necesidad de doble stent y peor pronóstico. Otros factores asociados a peor resultado y mal pronóstico son la calcificación y el pequeño diámetro del TCI, y la presencia de enfermedad no ostial en la DA o la Cx57.
Posicionamiento de guías (wiring) y preparación de la lesión
El empleo de al menos 2 guías de angioplastia (para las 2 ramas principales) será la norma en la ICP del TCI, con notables excepciones como son las lesiones del TCI protegido, si se precisa realizar rotablación o en algunos casos de enfermedad del TCI aislada y ostial. El uso de la doble guía modifica ligeramente el ángulo de la bifurcación, lo que facilita el acceso a la rama lateral y ayuda a mantener el flujo hacia esta. También posibilita localizarla en caso de oclusión, y algunos autores defienden la técnica de rescate con balón si se compromete el flujo tras el implante del stent en la rama principal58. Se debe evitar la predilatación del vaso principal sin haber protegido ambas ramas, debido al alto riesgo de modificar y desplazar la placa, que puede ocluir el ostium de alguna rama y dificultar su sondaje posterior.
Se puede considerar el empleo de técnicas de descarga de placa (rotablación o láser, entre otras) para modificar la anatomía y facilitar la angioplastia. Las lesiones ostiales del TCI suelen presentar abundante calcificación y gran cantidad de fibras musculares elásticas, lo que comporta un riesgo de retracción elástica de la lesión tanto tras la predilatación como tras el implante del stent. Por otra parte, la presencia de placas fibrocalcificadas suele condicionar el empleo de balones de corte como primer paso e incluso de rotablación, la cual ha demostrado ser beneficiosa en la angioplastia del TCI bifurcado previa al implante de un stent farmacoactivo59,60. En cuanto a la rama lateral, cuando presenta enfermedad grave ostial o muy calcificada, o cuando el acceso a ella ha sido muy dificultoso, se recomienda su predilatación con balones no distensibles y de pequeño tamaño.
Elección del stent
Al elegir el tamaño del stent deben diferenciarse 2 escenarios: que se vaya a tratar exclusivamente el TCI o que sea preciso tratar la bifurcación. Solo en casos de enfermedad ostial y medial aislada puede estar justificado tratar solo el TCI, y en tal situación debería escogerse un stent de tamaño nominal lo más cercano posible al tamaño del TCI. Otra opción es implantar un stent de tamaño inferior y sobreexpandirlo con un balón de alta presión de las dimensiones adecuadas. Diversas plataformas consiguen amplios grados de expansión sin que se pierda la integridad de su estructura61,62. Sin embargo, no existe evidencia acerca de si la sobreexpansión es una práctica segura, puesto que se expone a una cobertura subóptima de la íntima debido a la disminución de la ratio metal/arteria, y además podrían alterarse el polímero o la cinética de la liberación del fármaco del stent.
Cuando hay que tratar la bifurcación, el stent del TCI debe cubrir la porción proximal de una de las dos ramas principales, y su tamaño debe adecuarse al diámetro proximal de esa rama principal. Un aspecto fundamental es la necesidad posterior de realizar una optimización (POT, proximal optimisation technique) con un balón no distensible para adaptar el calibre proximal del stent al TCI, y en caso de que sea preciso, facilitar recruzar a la rama lateral o realizar la técnica de doble stent.
Los stents en el TCI están especialmente expuestos a una deformación proximal debido al continuo contacto con el catéter guía, la necesidad de POT y el roce con otros dispositivos que precisen pasar a su través una vez implantados63. Por tanto, la resistencia de cada stent a la compresión longitudinal es un parámetro que se debería tener en cuenta al seleccionar un stent. Otras características fundamentales que hay que considerar con el fin de elegir el stent ideal para la ICP del TCI son su perfil de seguridad y su precisión (figura 5).
Figura 5. Características técnicas del stent ideal para la intervención coronaria percutánea del tronco coronario izquierdo. Cx: circunfleja; DA: descendente anterior; TCI: tronco coronario izquierdo.
Selección de la técnica de bifurcación
Bifurcación no compleja
Cuando la enfermedad del TCI afecta una sola rama de la bifurcación o la Cx presenta un pequeño calibre (< 2,5 mm), la mejor estrategia es el stent provisional con un stent único desde el TCI hasta la rama principal. En general, la DA es la rama principal, mientras que solo en algunos casos sería la Cx. Posteriormente, la POT con balón no distensible de tamaño adecuado está recomendada de manera sistemática.
En numerosas ocasiones es necesario cubrir por completo la longitud del TCI, y es importante ser muy preciso al implantar el stent para no dejar sin tratar de manera adecuada el ostium ni que sobresalga significativamente el stent en la aorta.
Hay controversia acerca de si es necesario recruzar siempre hacia la rama lateral y optimizar con kissing balloon en la bifurcación después de realizar la POT, en caso de que el stent provisional parezca ser suficiente. El kissing balloon sí debe hacerse siempre que el resultado final sea subóptimo en la rama lateral, cuando la rama principal seleccionada haya sido la Cx y cuando no se pueda descartar la necesidad de ICP sobre la rama lateral en el futuro4.
Bifurcación compleja
Cuando la enfermedad afecta significativamente a ambas ramas de la bifurcación, se debe considerar el empleo de una técnica de doble stent. Sin embargo, dado que diversos registros comunican que las tasas de reestenosis y de nueva revascularización son menores con el empleo de un solo stent38,64-66, el abordaje inicial en muchos centros y en la mayoría de las bifurcaciones complejas suele ser el stent provisional con la posibilidad de acabar realizando una técnica de doble stent si finalmente es preciso. Cuando el resultado es subóptimo, el comité de expertos del European Bifurcation Group recomienda la realización de una técnica de doble stent en T, T and mall protrusion (TAP) o culotte como rescate tras el stent provisional67. Una vez implantado el segundo stent en la rama lateral, se recomienda la dilatación individual en ambas ramas con balones no distensibles para asegurar la expansión ostial del stent de DA y Cx, seguida de kissing balloon. Si este abarca un segmento considerable del TCI, se deberá realizar una nueva dilatación proximal (re-POT) que optimice el resultado.
Cuando se decide de inicio realizar una técnica de doble stent, la elección dependerá de diversos factores: las variables anatómicas y angiográficas, la localización de la lesión, las técnicas de imagen intracoronaria, la afectación de los ostia de la DA y la Cx, la situación clínica e incluso el dominio de cada técnica por parte del operador. A día de hoy no se dispone de evidencia suficiente para considerar una determinada técnica mejor que las demás. Se han descrito varios algoritmos y estrategias de tratamiento en función de estos parámetros, como el de Fajadet et al.68 o el de De Maria y Banning69. Sin embargo, ninguno ha conseguido imponerse de manera clara, probablemente debido a la enorme variabilidad de situaciones clínicas y angiográficas, y a la diferente experiencia en los distintos centros. En la actualidad, las técnicas de crush, crush modificado y culotte siguen siendo las más habituales. El doble kissing crush parece tener buenos resultados, pues se ha asociado a una reducción de la tasa de fallo de la lesión tratada y de trombosis del stent a 3 años (figura 6)70.
Figura 6. Ejemplo de doble kissing chrush. 1: angiografía basal. 2: stent implantado hacia la circunfleja. 3: primer inflado en kissing balloon. 4: stent hacia la descendente anterior. 5: segundo inflado en kissing balloon. 6: angiografía con el resultado final.
Optimización del resultado
La IVUS, la OCT y la guía de presión permiten optimizar el resultado de la angioplastia del TCI. Hay evidencia de que un resultado subóptimo de la angioplastia del TCI se asocia a un peor pronóstico clínico71. Si bien la OCT presenta las limitaciones antes expuestas (menos profundidad de imagen que la IVUS, posible relleno inadecuado), lo cierto es que ambas técnicas pueden detectar hallazgos relevantes, como la infraexpansión del stent, la malaposición de struts, la disección de bordes y el grado de compromiso de la rama lateral, que podrían requerir una optimización del resultado.
La herramienta para la que se dispone de más evidencia en la optimización del resultado de la angioplastia del TCI también es la IVUS, a la que se le reconoce un beneficio clínico neto26,72,73. El uso protocolizado de IVUS con el objetivo de una optimización parece que mejora adicionalmente el pronóstico de estos pacientes30. No obstante, un estudio en curso, el OPTIMAL (NCT04111770, Optimization of left main percutaneous coronary intervention with intravascular ultrasound randomized controlled trial), en el que se pretende incluir 800 pacientes, permitirá conocer el efecto pronóstico del uso de la IVUS en la ICP del TCI, frente al uso de angiografía sola.
Por su parte, la guía de presión cuenta con estudios acerca de su valor como predictor de eventos en caso de stent provisional, al estimar la reserva de flujo hacia la rama lateral74.
TRATAMIENTO MÉDICO TRAS LA INTERVENCIÓN CORONARIA PERCUTÁNEA Y SEGUIMIENTO
A pesar de que la angioplastia sobre la bifurcación es un predictor de eventos54,75, actualmente no hay evidencia para recomendar un régimen de tratamiento antiagregante específico en la angioplastia del TCI. Por tanto, el tratamiento debe pautarse en función de la presentación clínica y del perfil de riesgo isquémico y hemorrágico de cada paciente. Ahora bien, hay que tener en cuenta que el implante de stent en el TCI y la ICP sobre la bifurcación, principalmente si se emplean 2 stents, son criterios que añaden un mayor riesgo isquémico al perfil de estos pacientes76-79.
La reaparición de síntomas sugestivos o de isquemia documentada justifica un manejo invasivo. La coronariografía de revisión durante el primer año en pacientes con angioplastia del TCI tiene una indicación IIB C en las guías europeas16, y no está justificada en todos los casos. El ensayo aleatorizado ANGELINE (evaluación angiográfica después de la intervención percutánea del tronco) (NCT04604197) arrojará evidencias respecto a las potenciales ventajas de la revisión angiográfica sistemática.
CONCLUSIONES
La valoración de las lesiones del TCI resulta compleja, y es recomendable la realización de diferentes proyecciones angiográficas y el empleo de otras herramientas, como la IVUS o la guía de presión.
Actualmente, la puntuación SYNTAX, la posibilidad de una revascularización completa y la comorbilidad del paciente son los criterios principales que deben guiar la selección de una revascularización percutánea o quirúrgica.
En cuanto a la ICP sobre la lesión del TCI, se distinguen 2 grupos: las lesiones aisladas del TCI ostial o medio, que son técnicamente más sencillas de tratar y con excelente pronóstico, y las lesiones que comprenden la bifurcación, que tienen un abordaje más complejo.
Es fundamental la optimización de los procedimientos de ICP sobre el TCI, usando imagen intravascular, así como técnicas y stents que cuenten con las mayores evidencias en este contexto, y una adecuada cobertura farmacológica posterior.
En suma, la ICP en las lesiones del TCI sin duda hace mucho que cruzó su particular Rubicón. La suerte está echada (alea jacta est) y, en el futuro, los nuevos estudios aleatorizados sobre revascularización quirúrgica o percutánea y los avances técnicos en ambas modalidades serán los que decidan hacia qué lado se decanta la balanza. Mientras tanto, la práctica de una revascularización centrada en cada paciente concreto y la colaboración estrecha en el equipo multidisciplinario deben guiar la actuación de los cardiólogos clínicos e intervencionistas y de los cirujanos cardiacos.
FINANCIACIÓN
No se declara ninguna.
CONFLICTO DE INTERESES
Los autores no presentan conflictos de intereses al respecto del contenido del presente manuscrito.
BIBLIOGRAFÍA
1. Giannoglou GD, Antoniadis AP, Chatzizisis YS, et al. Prevalence of narrowing >or=50% of the left main coronary artery among 17,300 patients having coronary angiography. Am J Cardiol. 2006;98:1202-1205.
2. Taggart DP, Kaul S, Boden WE, et al. Revascularization for unprotected left main stem coronary artery stenosis stenting or surgery. J Am Coll Cardiol. 2008;51:885-892.
3. Garg S, Stone G, Kappetein AP, et al. Clinical and angio-graphic risk assessment in patients with left main stem stenosis. J Am Coll Cardiol Intv. 2010;3:891-901.
4. Lassen JF, Burzotta F, Banning AP, et al. Percutaneous coronary intervention for the left main stem and other bifurcation lesions:12th consensus document from the European Bifurcation Club. EuroIntervention. 2018;13:1540-1553.
5. Yusuf S, Zucker D, Peduzzi P, et al. Effect of coronary artery bypass graft surgery on survival:overview of 10-year results from randomized trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet. 1994;344:563-570.
6. Serruys PW, Unger F, Sousa JE, et al. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med. 2001;344:1117-1124.
7. Serruys PW, Onuma Y, Garg S, et al. 5-year clinical outcomes of the ARTS II (Arterial Revascularization Therapies Study II) of the sirolimus-eluting stent in the treatment of patients with multivessel de novo coronary artery lesions. J Am Coll Cardiol. 2010;55:1093-1101.
8. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on Myocardial Revascularization. Eur Heart J. 2019;40:87-165.
9. Patel MR, Calhoon JH, Dehmer GJ, et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease:A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2017;69:2212-2241.
10. Cid Álvarez AB, Rodríguez Leor O, Moreno R, Pérez de Prado A. Registro Español de Hemodinámica y Cardiología Intervencionista. XXVIII Informe Oficial de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología (1990-2018). Rev Esp Cardiol. 2019;72:1043-1053.
11. Oviedo C, Maehara A, Mintz GS, et al. Intravascular ultrasound classification of plaque distribution in left main coronary artery bifurcations:where is the plaque really located?Circ Cardiovasc Interv. 2010;3:105-112.
12. Medrano-Gracia P, Ormiston J, Webster M, et al. A computational atlas of normal coronary artery anatomy. EuroIntervention. 2016;12:845-854.
13. Yamanaka O, Hobbs RE. Coronary artery anomalies in 126.595 patients undergoing coronary arteriography. Cathet Cardiovasc Diagn. 1990;21:28-40.
14. Angelini P. Coronary artery anomalies:an entity in search of an identity. Circulation. 2007;115:1296-305.
15. Cheezum MK, Liberthson RR, Shah NR, et al. Anomalous aortic origin of a coronary artery from the inappropriate sinus of Valsalva. J Am Coll Cardiol. 2017;69:1592-1608.
16. Stone GW, Kappetein AP, Sabik JF, et al. Five-Year Outcomes after PCI or CABG for Left Main Coronary Disease. N Engl J Med. 2019;381:1820-1830.
17. Lindstaedt M, Spiecker M, Perings C, et al. How good are experienced interventional cardiologists at predicting the functional significance of intermediate or equivocal left main coronary artery stenosis?Int J Cardiol. 2007;120:254-261.
18. Fisher LD, Judkins MP, Lesperance J, et al. Reproducibility of coronary arteriographic reading in the coronary artery surgery study (CASS). Cathet Cardiovasc Diagn. 1982;8:565-575.
19. Kern MJ, Lim MJ, Boldstein JA. Hemodynamic Rounds:Interpretation of Cardiac Pathophysiology from Pressure Waveform Analysis. Oxford:John Wiley &Sons;2018. 342-343.
20. Kandzari DE, Colombo A, Park SJ, et al. Revascularization for unprotected left main disease:evolution of the evidence basis to redefine treatment standards. J Am Coll Cardiol. 2009;54:1576-1588.
21. Botman CJ, Schonberger J, Koolen S, et al Does stenosis severity of native vessels influence bypass graft patency?A prospective fractional flow reserve-guided study. Ann Thorac Surg. 2007;83:2093-2097.
22. Mintz GS, Lefèvre T, Lassen JF, et al. Intravascular ultrasound in the evaluation and treatment of left main coronary artery disease:a consensus statement from the European Bifurcation Club. EuroIntervention. 2018;14:e467-e474.
23. Kang SJ, Ahn JM, Song H. Comprehensive intravascular ultrasound assessment of stent area and its impact on restenosis and adverse cardiac events in 403 patients with unprotected left main disease. Circ Cardiovasc Interv. 2011;4:562-569.
24. De la Torre Hernández JM, Hernández F, Alfonso F, et al. Prospective application of pre-defined intravascular ultrasound criteria for assessment of intermediate left main coronary artery lesions results from the multicenter LITRO study. J Am Coll Cardiol. 2011;58:351-358.
25. De la Torre Hernández JM, García Camarero T, Baz Alonso JA, et al. Outcomes of predefined optimisation criteria for intravascular ultrasound guidance of left main stenting. EuroIntervention. 2020;16:210-217.
26. Kang SJ, Ahn JM, Kim WJ. Functional and morphological assessment of side branch after left main coronary artery bifurcation stenting with cross-over technique. Catheter Cardiovasc Interv. 2014;83:545-552.
27. De la Torre Hernández JM, JoséAntonio Baz JA, Gómez Hospital JA, et al. Clinical impact of intravascular ultrasound guidance in drug-eluting stent implantation for unprotected left main coronary disease:pooled analysis at patient level of 4 registries. JACC Cardiovasc Interv. 2014;7:244-254.
28. Wang Y, Mintz GS, Gu Z, et al. Meta-analysis and systematic review of intravascular ultrasound versus angiography-guided drug eluting stent implantation in left main coronary disease in 4592 patients. BMC Cardiovasc Disord. 2018;18:115.
29. Ramadan R, Boden WE, Kinlay S. Management of Left Main Coronary Artery Disease. J Am Heart Assoc. 2018;7:e008151.
30. Modi BN, van de Hoef TP, Piek JJ, et al. Physiological assessment of left main coronary artery disease. EuroIntervention. 2017;13:820-827.
31. Hamilos M, Muller O, Cuisset T, et al. Long-term clinical outcome after fractional flow reserve-guided treatment in patients with angiographically equivocal left main coronary artery stenosis. Circulation. 2009;120:1505-1512.
32. Warisawa T, Cook CM, Rajkumar C, et al. Safety of Revascularization Deferral of Left Main Stenosis Based on Instantaneous Wave-Free Ratio Evaluation. JACC Cardiovasc Interv. 2020;13:1655-1664.
33. Johnson TW, Räber L, di Mario C, et al. Clinical use of intracoronary imaging. Part 2:acute coronary syndromes, ambiguous coronary angiography findings, and guiding interventional decision-making:an expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2019;40:2566-2584.
34. Mock MB, Ringqvist I, Fisher LD, et al. Survival of medically treated patients in the coronary artery surgery study (CASS) registry. Circulation. 1982;66:562-568.
35. Yusuf S, Zucker D, Peduzzi P, et al. Effect of coronary artery bypass graft surgery on survival:overview of 10-year results from randomized trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet. 1994;344:563-570.
36. Modolo R, Chichareon P, Kogame N, et al. Contemporary Outcomes Following Coronary Artery Bypass Graft Surgery for Left Main Disease. J Am Coll Cardiol. 2019;73:1877-1886.
37. Ellis SG, Tamai H, Nobuyoshi M, et al. Contemporary percutaneous treatment of unprotected left main coronary stenosis:Initial results from a multicenter registry analysis 1994-1996. Circulation. 1997;96:3867-3872.
38. Park SJ, Kim YH, Lee BK, et al. Sirolimus-eluting stent implantation for unprotected left main coronary artery stenosis:Comparison with bare metal stent implantation. J Am Coll Cardiol. 2005;45:351-356.
39. Mehilli J, Kastrati A, Byrne R, et al. Paclitaxel- versus Sirolimus-eluting stents for unprotected left main coronary artery disease. J Am Coll Cardiol. 2009;53:1760-1768.
40. Valgimigli M, Chieffo A, Lefebre T, et al. Revisiting the incidence and temporal distribution of cardiac and sudden death in patients undergoing elective intervention for unprotected left main coronary artery stenosis in the drug eluting stent era. EuroIntervention. 2007;2:435-443.
41. Biondi-Zoccai GG, Lotrionte M, Moretti C, et al. A collaborative systematic review and meta-analysis on 1278 patients undergoing percutaneous drug-eluting stenting for unprotected left main coronary artery disease. Am Heart J. 2008;155:274-283.
42. Chieffo A, Stankovic G, Bonizzoni E, et al. Early and mid-term results of drug-eluting stent implantation in unprotected left main. Circulation. 2005;111:791-795.
43. Buszman PE, Buszman PP, Kiesz RS, et al. Early and long-term results of unprotected left main coronary artery stenting:the LE MANS (Left Main Coronary Artery Stenting) registry. J Am Coll Cardiol. 2009;54:1500-1511.
44. Morice MC, Serruys PW, Kappetein AP, et al. Outcomes in patients with de novo left main disease treated with either percutaneous coronary intervention using paclitaxel-eluting stents or coronary artery bypass graft treatment in the Synergy Between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery (SYNTAX) trial. Circulation. 2010;121:2645-2653.
45. Boudriot E, Thiele H, Walther T, et al. Randomized comparison of percutaneous coronary intervention with sirolimus-eluting stents versus coronary artery bypass grafting in unprotected left main stem stenosis. J Am Coll Cardiol. 2011;57:538-545.
46. Park SJ, Kim YH, Park DW, et al. Randomized trial of stents versus bypass surgery for left main coronary artery disease. N Engl J Med. 2011;364:1718-1727.
47. Holm NR, Mäkikallio T, Lindsay MM, et al. Percutaneous coronary angioplasty versus coronary artery bypass grafting in the treatment of unprotected left main stenosis:updated 5-year outcomes from the randomised, non-inferiority NOBLE trial. Lancet. 2020;395:191-199.
48. Giacoppo D, Colleran R, Cassese S, et al. Percutaneous coronary intervention vs coronary artery bypass grafting in patients with left main coronary artery stenosis:A systematic review and meta-analysis. JAMA Cardiol. 2017;2:1079-1088.
49. Palmerini T, Serruys P, Kappetein AP, et al. Clinical outcomes with percutaneous coronary revascularization vs coronary artery bypass grafting surgery in patients with unprotected left main coronary artery disease:A meta-analysis of 6 randomized trials and 4,686 patients. Am Heart J. 2017;190:54-63.
50. Rahouma M, Abouarab A, Di Franco A, et al. Percutaneous coronary intervention versus coronary bypass surgery for unprotected left main disease:a meta-analysis of randomized controlled trials. Ann Cardiothorac Surg. 2018;7:454-462.
51. Raber L, Juni P, Loffel L, et al. Impact of stent overlap on angiographic and long-term clinical outcome in patients undergoing drug-eluting stent implantation. J Am Coll Cardiol. 2010;55:1178-1188.
52. Pappalardo A, Mamas MA, Imola F, et al. Percutaneous coronary intervention of unprotected left main coronary artery disease as culprit lesion in patients with acute myocardial infarction. JACC Cardiovasc Interv. 2011;4:618-626.
53. Coughlan JJ, Blake N, Chongprasertpon N, et al. Revascularisation of left main stem disease:a prospective analysis of modern practice and outcomes in a non-surgical centre. Open Heart. 2018;5:e000804.
54. Cheng HY, Wang KT, Lin WH, et al. Percutaneous Coronary Intervention for Left Main Coronary Artery Disease —A Single Hospital Experience without On-Site Cardiac Surgery. Acta Cardiol Sin. 2015;31:267-279.
55. Piqueras Flores J, Sanchez Perez I, Lopez Lluva MT, Lozano F. Clinical results at a long-term follow-up of percutaneous coronary intervention in left main coronary artery disease [abstract]. Eur Heart J Suppl. 2018;7(supplement):S209.
56. Xu B, Redfors B, Yang Y, et al. Impact of Operator Experience and Volume on Outcomes After Left Main Coronary Artery Percutaneous Coronary Intervention. JACC Cardiovasc Interv. 2016;9:2086-2093.
57. Teirstein PS. Unprotected left main intervention:patient selection, operator technique, and clinical outcomes. JACC Cardiovasc Interv. 2008;1:5-13.
58. Burzotta F, Trani C. Jailed balloon protection and rescue balloon jailing techniques set the field for safer bifurcation provisional stenting. Int J Cardiol. 2015;201:376-377.
59. Tsuchikane T, Aizawa T, Tamai H, et al. Pre drug-eluting stent debulking of bifurcated coronary lesions. J Am Coll Cardiol. 2007;50:1941-1945.
60. Tanaka N, Terashima M, Kinoshita Y, et al. Unprotected left main coronary artery bifurcation stenosis:Impact of plaque debulking prior to single sirolimus-eluting stent implantation. J Invasive Cardiol. 2008;20:505-510.
61. Foin N, Sen S, Allegria E, et al. Maximal expansion capacity with current DES platforms:a critical factor for stent selection in the treatment of left main bifurcations?EuroIntervention. 2013;8:1315-1325.
62. Ng J, Foin N, Ang HY, et al. Over-expansion capacity and stent design model:An update with contemporary DES platforms. Int J Cardiol. 2016;221:171-179.
63. Rhee TM, Park KW, Lee JM, et al. Predictors and long-term clinical outcome of longitudinal stent deformation:insights from pooled analysis of Korean multicenter drug-eluting stent cohort. Circ Cardiovasc Interv. 2017;10:e005518.
64. Pandya S, Kim Y-H, Meyers S, et al. Drug-eluting versus bare-metal stents in unprotected left main stenosis. JACC Cardiovasc Interv. 2010;3:602-611.
65. Chieffo A, Morici N, Maisano F, et al. Percutaneous treatment with drug-eluting stent implantation versus bypass surgery for unprotected left main stenosis:a single-center experience. Circulation. 2006;113:2542-2547.
66. Carrie D, Lhermusier T, Hmem M, et al. Clinical and angiographic outcome of paclitaxel-eluting stent implantation for unprotected left main coronary artery bifurcation narrowing. Eurolntervention. 2006;1:396-402.
67. Burzotta F, Lassen JF, Banning AP, et al. Percutaneous coronary intervention in left main coronary artery disease:the 13th consensus document from the European Bifurcation Club. EuroIntervention. 2018;14:112-120.
68. Fajadet J, Capodanno D, Stone GW. Management of Left Main Disease:An Update. Eur Heart J. 2019;40:1454-1466.
69. De Maria GL, Banning AP. Use of Intravascular Ultrasound Imaging in Percutaneous Coronary Intervention to Treat Left Main Coronary Artery Disease. Interv Cardiol. 2017;12:8-12.
70. Chen X, Li X, Zhang JJ, et al. 3-Year Outcomes of the DKCRUSH-V Trial Comparing DK Crush With Provisional Stenting for Left Main Bifurcation Lesions. JACC Cardiovasc Interv. 2019;12:1927-1937.
71. Prati F, Romagnoli E, Gatto L, et al. Clinical Impact of Suboptimal Stenting and Residual Intrastent Plaque/Thrombus Protrusion in Patients With Acute Coronary Syndrome:The CLI-OPCI ACS Substudy (Centro per la Lotta Control L'Infarto-Optimization of Percutaneous Coronary Intervention in Acute Coronary Syndrome). Circ Cardiovasc Interv. 2016;9:e003726.
72. Kang SJ, Ahn JM, Song H, et al. Comprehensive intravascular ultrasound assessment of stent area and its impact on restenosis and adverse cardiac events in 403 patients with unprotected left main disease. Circ Cardiovasc Interv. 2011;4:562-569.
73. Park SJ, Kim YH, Park DW, et al. Impact of intravascular ultrasound guidance on long-term mortality in stenting for unprotected left main coronary artery stenosis. Circ Cardiovasc Interv. 2009;2:167-177.
74. Nam CW, Hur SH, Koo BK, et al. Fractional flow reserve versus angiography in left circumflex ostial intervention after left main crossover stenting. Korean Circ J. 2011;41:304-307.
75. Serruys PW, Chichareon P, Modolo R, et al. The SYNTAX score on its way out or …towards artificial intelligence:part I. EuroIntervention 2020;16:44-59.
76. Steigen TK, Maeng M, Wiseth R, et al. Randomized study on simple versus complex stenting of coronary artery bifurcation lesions:the Nordic bifurcation study. Circulation. 2006;114:1955-1961.
77. Colombo A, Bramucci E, Sacca S, et al. Randomized study of the crush technique versus provisional side-branch stenting in true coronary bifurcations:the CACTUS (Coronary Bifurcations:Application of the Crushing Technique Using Sirolimus-Eluting Stents) Study. Circulation. 2009;119:71-78.
78. Hildick-Smith D, De Belder AJ, Cooter N, et al. Randomized trial of simple versus complex drug-eluting stenting for bifurcation lesions:the British Bifurcation Coronary Study:old, new, and evolving strategies. Circulation. 2010;121:1235-1243.
79. Maeng M, Holm NR, Erglis A, et al. Long-term results after simple versus complex stenting of coronary artery bifurcation lesions:Nordic Bifurcation Study 5-year follow-up results. J Am Coll Cardiol. 2013;62:30-34.
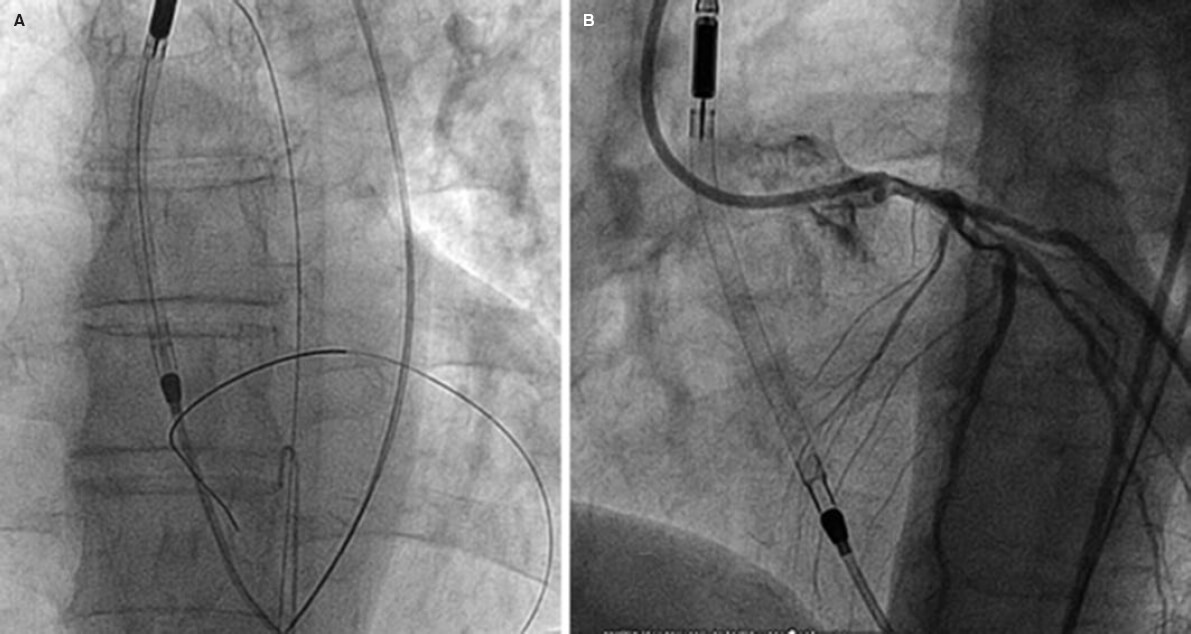
RESUMEN
La intervención coronaria percutánea (ICP) desempeña un papel fundamental en el tratamiento de los pacientes con enfermedad coronaria obstructiva. De ellos, un porcentaje significativo se someterán a un procedimiento de alto riesgo, en función de la presentación clínica, las características del paciente y su anatomía coronaria. Los dispositivos de asistencia ventricular izquierda, como el balón intraaórtico de contrapulsación, el dispositivo TandemHeart, el Impella, los dispositivos HeartMate PHP y las técnicas de oxigenación veno-arterial con oxigenador extracorpóreo de membrana (ECMO), son herramientas empleadas para proporcionar soporte circulatorio en la ICP de alto riesgo, con un impacto creciente en la práctica clínica. Existen numerosos trabajos en la literatura científica sobre su empleo en este escenario, con resultados controvertidos. Esta revisión proporciona una visión general de la evidencia disponible sobre el empleo de los distintos tipos de dispositivos, así como de su potencial papel en la ICP de alto riesgo.
Palabras clave: Balón intraaórtico de contrapulsación. Dispositivo de asistencia ventricular izquierda. Intervencionismo coronario percutáneo de alto riesgo. Shock cardiogénico. Ventrículo derecho.
ABSTRACT
Percutaneous coronary intervention (PCI) plays a key role in the management of patients with obstructive coronary artery disease. Besides, depending on the patients’ clinical presentation, characteristics, comorbidities, and coronary anatomy, an increasing number of patients will undergo a high-risk PCI. Left ventricular assist devices, as the intra-aortic balloon pump, TandemHeart, Impella, HeartMate PHP, and extracorporeal membrane oxygenation are useful tools to provide circulatory support for high-risk PCIs. Some studies and trials have assessed its impact on this clinical scenario with controversial results. This review provides an overview on the scientific evidence available on the use of left ventricular assist devices and their potential role in high-risk PCI.
Keywords: Intra-aortic balloon pump. Left ventricular assist device. High-risk percutaneous coronary intervention. Cardiogenic shock. Right ventricle.
Abreviaturas BCIAo: balón intraaórtico de contrapulsación. DAVI: dispositivo de asistencia ventricular izquierda. EC: enfermedad coronaria. ECMO: oxigenador extracorpóreo de membrana. IAM: infarto agudo de miocardio. ICP: intervención coronaria percutánea. TCI: tronco coronario izquierdo.
INTRODUCCIÓN
En los países occidentales, la enfermedad coronaria (EC) es un problema de salud pública. Así, entre la población estadounidense mayor de 20 años se estima que 15,5 millones de personas tienen EC y que aproximadamente 635.000 padecerán un nuevo evento coronario agudo cada año1. La intervención coronaria percutánea (ICP), como tratamiento de esta patología, continúa experimentando un crecimiento exponencial y actualmente es el método de elección para la revascularización1-3, excepto en algunos pacientes concretos con enfermedad multivaso o muy compleja4,5. La ICP tiene una recomendación de clase 1 para pacientes con un evento coronario agudo y es la primera opción en 3 contextos clínicos: la angina resistente a tratamiento médico, el shock cardiogénico como complicación del infarto agudo de miocardio (IAM) y el síndrome coronario agudo con elevación del segmento ST3,4.
INTERVENCIÓN CORONARIA PERCUTÁNEA DE ALTO RIESGO
El criterio para definir ICP de alto riesgo no está bien establecido, pero hay una serie de características que confieren un riesgo periprocedimiento elevado y que se dividen en 3 grupos: específicas del paciente, específicas del tipo de lesión y dependientes de la presentación clínica6-9.
Los factores inherentes al paciente son la edad avanzada, la diabetes mellitus, la enfermedad renal crónica, el infarto de miocardio previo, la enfermedad vascular periférica grave y la presencia de disfunción sistólica del ventrículo izquierdo, definida como un valor < 30-35%9,10.
Entre los factores dependientes de las características de la lesión coronaria se encuentran la enfermedad del tronco coronario izquierdo (TCI) —no protegido—, la enfermedad localizada en el ostium o en bifurcaciones, la lesión en bypass de la vena safena, la abundante calcificación y las oclusiones crónicas11,12. Finalmente, la presentación clínica desempeña un papel en el pronóstico, de tal modo que los enfermos en situación de shock cardiogénico o que ingresan como síndrome coronario agudo tienen un riesgo aumentado de eventos adversos durante la ICP13.
Hay que subrayar que el shock cardiogénico es la principal causa de mortalidad asociada al IAM, con una prevalencia del 5-15%13,14. Hay una evidencia creciente de que el pronóstico de los pacientes con IAM complicado con shock cardiogénico puede mejorar sustancialmente mediante la ICP lo más precoz posible y la angioplastia primaria15,16.
DISPOSITIVOS PERCUTÁNEOS DE ASISTENCIA CIRCULATORIA
Los dispositivos de asistencia ventricular izquierda (DAVI) se emplean para proporcionar soporte hemodinámico durante la ICP de alto riesgo. Estos dispositivos incluyen el balón de contrapulsación intraaórtico (BCIAo), el dispositivo TandemHeart (CardiacAssist, Estados Unidos), el Impella (Abiomed, Estados Unidos), los dispositivos HeartMate PHP (St. Jude Medical, Estados Unidos) y las técnicas de oxigenación veno-arterial con oxigenador extracorpóreo de membrana (ECMO)17. Sus principales características se describen de forma comparativa en la tabla 1.
Tabla 1. Comparación de los distintos tipos de dispositivos de asistencia circulatoria izquierda según sus características basales
| Dispositivo | Mecanismo de bomba | Cámaracardiaca de acción | Acceso vascular | Flujo |
|---|---|---|---|---|
| BCIAo | Contrapulsación | VI | 8-9 Fr | 1 l/min |
| ECMO | Centrífugo | Biventricular | Venoso 15-22 Fr Arterial 15-21 Fr | > 4,5 l/min |
| TandemHeart | Centrífugo | VI, VD o biventricular | Venoso 15-17 Fr Arterial 21 Fr | 4-5 l/min |
| Impella 2.5 | Axial | VI | 12 Fr | 2,5 l/min |
| Impella CP | Axial | VI | 14 Fr | 3,33 l/min |
| Impella 5.0 | Axial | VI | 21 Fr | 5 l/min |
|
BCIAo: balón intraaórtico de contrapulsación; ECMO: oxigenador extracorpóreo de membrana; VD: ventrículo derecho; VI: ventrículo izquierdo. |
||||
Balón de contrapulsación intraaórtico
Desde su introducción en la década de 1970, el BCIAo constituye un método de asistencia circulatoria para numerosas indicaciones. Su capacidad para aumentar el flujo coronario18,19, mejorar el flujo sistémico mediante un aumento del gasto cardiaco adicional de 0,5 l/min14,20,21 y disminuir el consumo miocárdico de oxígeno22 apoya su uso en cualquier paciente con necesidad de incrementar el flujo coronario y sistémico.
Recientemente, en las guías americanas3, el empleo del BCIAo ha pasado de recomendación de clase I a clase II b en el contexto del shock cardiogénico como complicación del IAM, y en las guías europeas23 a un grado de recomendación III, todo ello a raíz de estudios que cuestionan el valor del BCIAo como factor con un impacto en el pronóstico24. En el estudio IABP SHOCK se comparó el BCIAo tras la ICP con el abordaje estándar con inotrópicos y aminas vasoactivas, sin que se demostrara beneficio en la mortalidad a corto plazo25. Estos hallazgos se reforzaron tras el estudio IABP-SHOCK II, que no encontró diferencias en la mortalidad a los 30 días24 ni en la mortalidad por todas las causas a los 12 meses de seguimiento26 en pacientes con IAM complicado con shock cardiogénico.
Un metanálisis sugiere que el uso preoperatorio del BCIAo reduce la mortalidad preoperatoria y a los 30 días en pacientes de alto riesgo que van a someterse a cirugía electiva de revascularización miocárdica27-32, mientras que otros autores concluyen que el empleo de BCIAo no tiene ningún impacto en la mortalidad de los pacientes con IAM, con independencia de que presentaran o no shock cardiogénico14-33,34.
Estos resultados contrapuestos han sentado las bases de nuevos trabajos de investigación.
Situación actual en la ICP
El BCIAo se ha utilizado durante décadas en situaciones de ICP de alto riesgo debido a su función como soporte circulatorio9,35-38. Una serie de trabajos han comparado su implante electivo en este contexto frente a su empleo como rescate en pacientes estables que se van a someter a ICP de alto riesgo. Estos estudios sugieren que el implante electivo antes del procedimiento se asocia a una reducción de eventos adversos durante su realización39,40, con una tendencia a una menor tasa de eventos adversos cardiovasculares mayores. Mishra et al.38 describieron que el implante profiláctico de BCIAo antes de la ICP de alto riesgo se asociaba con una mayor supervivencia durante el ingreso hospitalario y a los 6 meses de seguimiento respecto a su implante de rescate, debido al desarrollo de compromiso hemodinámico durante el procedimiento. Todo ello se produjo a costa de un riesgo elevado de este grupo de complicaciones relacionadas con fenómenos de sangrado41. A pesar de lo relevante de estos datos, todos ellos proceden de trabajos retrospectivos.
Perera et al.39 realizaron en 2010 un estudio prospectivo, multicéntrico, aleatorizado y controlado sobre intervencionismo coronario asistido con balón de contrapulsación (BCIS-1), en el que se aleatorizó a 301 pacientes con EC y disfunción sistólica del ventrículo izquierdo < 30% para recibir o no un implante electivo de BCIAo. El objetivo primario fue la presencia de eventos adversos cardiovasculares a los 28 días, que ocurrió en el 15,2% de los pacientes en que se implantó el BCIAo de forma electiva, frente al 16% en el grupo sin implante planeado. El empleo electivo del BCIAo se asoció con menos sangrado y complicaciones locales que su empleo de rescate en el grupo sin implante planeado. Estos resultados son concordantes con los hallados en metanálisis publicados más recientemente34.
A tenor de los resultados de los ensayos clínicos se ha producido un descenso en el uso del BCIAo en la ICP de alto riesgo13,41, a la vez que ha aumentado el desarrollo y el empleo de otros DAVI en este escenario42.
TandemHeart
El TandemHeart (figura 1) es un dispositivo de asistencia circulatoria temporal, externo y capaz de proporcionar un flujo continuo de 4 l/min43. Contiene 3 subsistemas y es el único dispositivo diseñado para atravesar el septo interauricular, mediante una cánula de 21 Fr que queda alojada en la aurícula izquierda. La sangre oxigenada se succiona desde la aurícula izquierda y se retorna a través de una bomba centrífuga que proporciona un flujo continuo a través de una cánula de 12 Fr en la arteria femoral o de 15-17 Fr en la arteria ilíaca.
Figura 1. Esquema de funcionamiento del dispositivo TandemHeart con acceso periférico femoral. Drenaje de la sangre oxigenada por medio de una punción transeptal de la aurícula izquierda que retorna a través de la arteria femoral.
En un ensayo de cohortes llevado a cabo por Thiele et al.43 en 18 pacientes con shock cardiogénico tras un IAM se halló una mejoría significativa en los parámetros hemodinámicos tras su implante, a costa de una serie de complicaciones relacionadas con la inserción y el mantenimiento del catéter, con una mortalidad global a los 30 días del 44%. Además, este trabajo mostró que los DAVI se pueden implantar rápidamente, en menos de 30 minutos.
Otros estudios han comparado la eficacia del TandemHeart frente al BCIAo en el shock cardiogénico, como los desarrollados por Thiele et al.42 y Burkhoff et al.44, en los que se muestra la capacidad del TandemHeart para mejorar la situación hemodinámica, asumiendo un riesgo de complicaciones asociadas al dispositivo.
Situación actual en la ICP
El primer caso en que se empleó el dispositivo TandemHeart en la ICP de alto riesgo fue documentado por Vranckx et al.45. Desde entonces se han sucedido diversos estudios retrospectivos que han analizado su empleo. Uno de ellos incluyó 9 pacientes con lesión del TCI rechazados para cirugía, y logró un 100% de éxito en la ICP46. De los 9 pacientes, 4 desarrollaron complicaciones del acceso vascular, 2 de los cuales requirieron cirugía vascular por isquemia de miembros inferiores. La supervivencia a los 6 meses fue del 88,5%, en comparación con el 89,5% de la población total con enfermedad del TCI en el mismo centro hospitalario47,48.
Posteriormente, Aragon et al.49 analizaron el empleo del TandemHeart en 8 pacientes que se sometieron a ICP de alto riesgo y encontraron que la mejoría hemodinámica se puede lograr precozmente, con una tasa de éxito de la angioplastia cercana al 100% y sin complicaciones inmediatas tras la ICP.
En 2012, Alli et al.50 llevaron a cabo un estudio retrospectivo que analizó 54 pacientes que se sometieron a ICP bajo soporte con TandemHeart entre 2004 y 2009, con una tasa de éxito de la ICP del 97% (el 62% de los pacientes tenían enfermedad multivaso o del TCI). La supervivencia total a los 30 días fue del 90%, y se mantuvo a los 6 meses, pero destaca una tasa de complicaciones vasculares del 13%50,51.
Impella
Los dispositivos tipo Impella (figura 2) emplean un catéter por vía femoral, que cruza la válvula aórtica y se aloja en el ventrículo izquierdo, donde succiona sangre oxigenada, que es devuelta hacia la aorta ascendente. Existen diferentes modelos: Impella 2.5, Impella CP e Impella 5.0, que proporcionan 2,5, 4 y 5 l/min de flujo, respectivamente.
Figura 2. Intervención coronaria percutánea de alto riesgo bajo soporte circulatorio con dispositivo Impella 2.5. En A y B se observa la localización correcta del dispositivo cruzando la válvula aórtica.
En un estudio inicial llevado a cabo por Seyfarth et al.52, el dispositivo Impella 2.5 se comparó con el BCIAo en 25 pacientes con shock cardiogénico tras un IAM y se observó que proporcionó un soporte hemodinámico superior al del BCIAo, pero con una mayor tasa de transfusiones y de hemólisis que este, sin diferencias en la mortalidad a los 30 días (en torno al 46%). El registro EUROSHOCK53 recoge 120 pacientes con shock cardiogénico secundario a IAM que recibieron soporte circulatorio con un dispositivo Impella 2.5, y confirma que se trata de una alternativa real, con una mejoría de las concentraciones plasmáticas de lactato, a costa de una tasa de transfusiones de concentrados de hematíes del 24% y de un 4,2% de necesidad de cirugía hemostática. La mortalidad a los 30 días en este estudio de cohortes fue del 64%, y se atribuye a la presencia de un elevado porcentaje de pacientes que debutaron como parada cardiorrespiratoria.
Situación actual en la ICP
En marzo de 2015, la Food and Drug Administration aprobó el dispositivo Impella 2.5 como DAVI en la ICP de alto riesgo, bien sea electiva o urgente. Esto sucedió a raíz de numerosos trabajos que avalan la seguridad del dispositivo en este contexto54.
El registro Europella55 incluyó 144 pacientes que se sometieron a ICP de alto riesgo bajo soporte con Impella 2.5. El objetivo primario fue el desarrollo de eventos a los 30 días: muerte, sangrado mayor (que requiriera transfusión o cirugía), IAM, necesidad de cirugía de revascularización urgente o accidente cerebrovascular; incluyó asimismo eventos de seguridad relacionados con el dispositivo.
En el registro americano USpella56 de 175 pacientes y con objetivos similares (con excepción del sangrado, que se consideró un objetivo secundario), el objetivo primario de muerte ocurrió en 7 (4%), mientras que en el registro Europella ocurrió en 8 (5,5%). Los resultados de mortalidad fueron mejores que los estimados por la escala STS, predictor de mortalidad quirúrgica, lo que sugiere que el soporte con Impella en este tipo de ICP es una opción razonable. Las complicaciones relacionadas con la retirada del dispositivo ocurrieron en 8 (5,5%) y 17 (9,7%) pacientes, respectivamente, con necesidad de transfusión en 1 (0,7%) y 3 (1,7%) casos, a raíz de complicaciones vasculares mayores.
El dispositivo Impella CP también cuenta con un análisis retrospectivo que, en consonancia con los resultados previos, halló una mejoría en la supervivencia de los pacientes con shock cardiogénico secundario a IAM en comparación con el dispositivo Impella 2.557.
HeartMate PHP
Al igual que el dispositivo Impella, el HeartMate PHP emplea una bomba de flujo axial para succionar sangre del ventrículo izquierdo y expulsarla en la aorta ascendente; la diferencia principal es la existencia de una cánula que se expande al cruzar la válvula aórtica, se implanta por vía femoral con un introductor de 13-14 Fr, se expande la cánula hasta los 24 Fr al alcanzar su posición adecuada a través de la válvula aórtica y permite proporcionar un flujo de hasta 4 l/min58. Sin embargo, desde febrero de 2017 se ha interrumpido temporalmente su empleo y los estudios en curso a raíz de defectos menores de diseño, entre los que destaca el ensayo SHIELD II (NCT02468778).
Oxigenador extracorpóreo de membrana
El ECMO puede proporcionar soporte cardiopulmonar de for- ma similar a la bomba de circulación extracorpórea empleada durante la cirugía cardiaca. Su empleo ha sido bien estudiado en población pediátrica en el contexto de fallo cardiaco o respiratorio grave59,60.
El ECMO veno-arterial incluye un circuito con cánulas de sangre venosa y arterial, una bomba centrífuga y un oxigenador de membrana. Se puede implantar por vía periférica (femoral habitualmente) o central, y requiere una esternotomía media. La cánula venosa (20 Fr) drena sangre no oxigenada de la aurícula derecha hacia el oxigenador de membrana, donde se produce el intercambio gaseoso, y la sangre oxigenada se retorna al enfermo a través de la cánula arterial (17 Fr).
A pesar de ser el único dispositivo que proporciona un soporte circulatorio y respiratorio completo, como inconveniente destaca que puede incrementar la poscarga del ventrículo izquierdo y el estrés parietal (debido a un aumento en las presiones de llenado), lo que podría tener consecuencias negativas en la demanda miocárdica de oxígeno61-64.
Situación actual en la ICP
El empleo del ECMO en el contexto del fallo cardiaco o respiratorio grave se ha incrementado un 433% en el periodo 2006-201165. A pesar de ello, la experiencia en su uso como asistencia circulatoria en la ICP de alto riesgo es limitada y solo existen pequeños trabajos retrospectivos y series de casos66-68.
En 1989, Taub et al.65 documentaron 7 casos de utilización exitosa de ECMO en angioplastias de alto riesgo. La incidencia de hematoma complicado fue elevada (6 pacientes, de los que 4 requirieron transfusión); destaca como complicación un hematoma retroperitoneal que provocó el fallecimiento del paciente.
Para analizar el empleo del ECMO en la ICP de alto riesgo, Tomasello et al.69 publicaron su experiencia en un estudio prospectivo que incluyó 12 pacientes con EC compleja, de alto riesgo para revascularización quirúrgica, sin shock cardiogénico ni parada cardiaca, con implante de un ECMO veno-arterial antes de la ICP. Todos los enfermos toleraron el procedimiento, con solo una complicación del acceso vascular (un hematoma que no precisó transfusión). A los 6 meses de seguimiento no se habían producido eventos de mortalidad ni IAM, lo que sugiere que el ECMO puede ser una alternativa segura en este contexto.
BCIAo frente a otros DAVI en la ICP
Varios ensayos clínicos han comparado directamente el BCIAo con otros DAVI. En el estudio PROTECT II11 se comparó el dispositivo Impella 2.5 con el BCIAo en la ICP de alto riesgo. Se trata de un estudio multicéntrico prospectivo con 452 pacientes que iban a someterse a ICP de alto riesgo (definida como enfermedad del TCI y fracción de eyección del ventrículo izquierdo < 35%, o enfermedad multivaso con fracción de eyección del ventrículo izquierdo < 30%) y fueron aleatorizados para recibir soporte circulatorio con Impella 2.5 o con BCIAo durante el procedimiento. Se excluyó a los pacientes con IAM reciente. El objetivo primario a los 30 días fue un combinado de eventos cardiovasculares mayores y mortalidad. El Impella 2.5 proporcionó un mejor soporte hemodinámico que el BCIAo, sin diferencias estadísticamente significativas en el objetivo primario: 35,1% en el grupo con Impella 2.5 y 40,1% en el grupo con BCIAo (p = 0,227).
Patel et al.70 realizaron un estudio transversal en el periodo 2008-2012 que analizó pacientes sometidos a ICP que recibieron asistencia circulatoria con BCIAo o con otros DAVI (Impella, TandemHeart o combinación de BCIAo y DAVI). Se registraron 18.094 procedimientos (93% con BCIAo, 6% con Impella o TandemHeart, y 1% con BCIAo y DAVI). En primer lugar, destaca que los enfermos asistidos con DAVI eran de mayor edad y presentaban más comorbilidad (hipertensión arterial, diabetes mellitus, insuficiencia renal, enfermedad pulmonar) que los enfermos asistidos con BCIAo. La mortalidad global fue del 19,8% (20,1% con BCIAo, 12% con DAVI y 41% con la combinación de BCIAo y DAVI) y la tasa total de complicaciones fue del 35,5% (36% con BCIAo, 26% con DAVI y 52% con la combinación de BCIAo y DAVI). El empleo del BCIAo se asoció a una mayor incidencia de complicaciones cardiacas (9 frente a 4%) y respiratorias (19 frente a 11%), mientras que el empleo de otros DAVI implicó una mayor tasa de complicaciones vasculares (8,6 frente a 5,5%). Se realizó un análisis de subgrupos en función de la presencia o no de shock cardiogénico o IAM, y la principal conclusión fue que el empleo de DAVI fue un factor predictor de menor tasa de complicaciones y de baja mortalidad únicamente en el grupo de pacientes sin IAM ni shock cardiogénico, en comparación con el BCIAo.
Khera et al.71 realizaron un estudio similar al previo en el periodo 2004-2012, pero excluyeron a los enfermos que recibieron soporte con ambos dispositivos (combinación de BCIAo y otros DAVI). Un total de 26.556 pacientes se sometieron a ICP de alto riesgo bajo soporte con BCIAo (96%) o DAVI (4%). De los que recibieron soporte con DAVI, el 7% presentaban shock cardiogénico y el 2,2% tenían IAM. De manera similar al trabajo anterior, los autores hallaron que los pacientes que recibieron asistencia con DAVI eran de mayor edad y con más comorbilidad, pero con menor tasa de IAM, shock cardiogénico y parada cardiorrespiratoria que el grupo de pacientes que recibió BCIAo; no hubo diferencias significativas en la mortalidad total intrahospitalaria.
El ensayo IMPRESS72, publicado en octubre de 2016, aleatorizó a 48 pacientes ingresados por síndrome coronario agudo con elevación del segmento ST y shock cardiogénico secundario para recibir asistencia con Impella CP o con BCIAo en la ICP primaria de alto riesgo; fue el primer trabajo de estas características. En este estudio no se encontraron diferencias en el objetivo primario de mortalidad y eventos cardiovasculares a los 30 días (mortalidad del 46% en el grupo de Impella CP frente al 50% en el grupo de BCIAo; p = 0,92), así como tampoco en la mortalidad por todas las causas a los 6 meses (50% en ambos grupos), pero destaca una mayor tasa de complicaciones vasculares en el grupo que recibió asistencia con Impella CP (sangrado mayor: 33 frente a 8%), debido al mayor calibre de la cánula empleada por este dispositivo (14 frente a 7,5 Fr).
Resultan interesantes, asimismo, los resultados del trabajo publicado por Koen et al.73 en 2019. Se trata de un estudio retrospectivo, unicéntrico, en el que se analizaron la evolución y el pronóstico de los pacientes sometidos a ICP de alto riesgo en el periodo 2011-2018 en función de si recibieron soporte circulatorio mecánico o no. Se definió como objetivo primario un combinado de mortalidad periprocedimiento (< 24 h), parada cardiaca, necesidad de fármacos vasoactivos, necesidad de soporte circulatorio de rescate, intubación endotraqueal e isquemia periférica. Se incluyeron 198 pacientes sometidos a ICP de alto riesgo, de los cuales 69 (35%) se beneficiaron de soporte con DAVI: 18 con Impella CP, 25 con HeartMate PHP y 26 con Pulsecath iVAC 2L (PulseCath BV, Países Bajos; dispositivo transfemoral pulsátil que proporciona un gasto cardiaco de hasta 2 l/min). En el estudio destaca una incidencia del objetivo primario del 20% en el grupo de pacientes sin soporte circulatorio frente al 9% en el grupo que recibió soporte circulatorio periprocedimiento.
Amin et al.74 han publicado un trabajo retrospectivo que incluye 48.306 pacientes sometidos a ICP de alto riesgo con soporte circulatorio (43.524 con BCIAo y 4.782 con Impella). Este estudio se desarrolló a lo largo de 13 años (2004- 2016) en 432 hospitales de los Estados Unidos. Se definió una era pre-Impella hasta 2007 (el dispositivo Impella 2.5 fue aprobado por la Food and Drug Administration para su empleo en la ICP de alto riesgo en 2008) y se observó que el empleo de Impella fue aumentando exponencialmente hasta 2016. En el grupo de pacientes con Impella, los autores observaron un incremento de los eventos adversos en forma de mortalidad, fenómenos de sangrado y accidentes cerebrovasculares, sin tratarse de enfermos en una situación clínica más crítica que el grupo de pacientes que recibió BCIAo.
A raíz de estos hallazgos, surge una interesante discusión. A pesar del tamaño muestral, existen diferentes factores que pueden explicar tales resultados, que parecen insuficientes para dejar de recomendar el empleo del dispositivo en pacientes sometidos a ICP de alto riesgo. En primer lugar, se trata de un trabajo retrospectivo, y con diferencias sustanciales en la experiencia y el volumen de casos de cada centro. Asimismo, el empleo de nuevos antiagregantes plaquetarios, significativamente mayor a partir de 2009, podría justificar, en parte, el aumento de los fenómenos de sangrado.
Por otro lado, los autores no mencionan las características de la anatomía coronaria de los pacientes de forma detallada (solo se describe una mayor prevalencia de enfermedad multivaso, lesiones en bifurcaciones y oclusiones crónicas en el grupo con Impella), las tasas de éxito de la ICP ni la tolerancia clínica y hemodinámica del paciente al procedimiento, objetivo primordial del empleo de DAVI en este contexto, ni esclarecen las causas de la mortalidad observada. Los autores describen que los pacientes con soporte con Impella no se encontraban en una situación más crítica, ya que la incidencia de shock cardiogénico y la necesidad de ventilación mecánica invasiva fue menor que en los pacientes en los que se empleó BCIAo. Sin embargo, revisando con detalle los resultados, llama la atención que en el grupo con Impella había una mayor prevalencia de insuficiencia cardiaca previa, enfermedad pulmonar obstructiva crónica e insuficiencia renal crónica, comorbilidad que podría justificar los resultados. Además, hay que destacar que la estancia media, tanto en las unidades de cuidados intensivos como hospitalaria, fue menor en el grupo en que se empleó Impella como DAVI.
Por todo ello, considerando las mencionadas limitaciones, a pesar del importante tamaño muestral de este estudio y sus llamativos resultados, existen algunos factores de confusión asociados, por lo que parece aventurado dejar de recomendar totalmente los dispositivos tipo Impella en el contexto de la ICP de alto riesgo.
Fallo ventricular derecho en pacientes portadores de DAVI. Dispositivos de soporte derecho
De forma general, el fallo del ventrículo derecho (VD) ocurre aproximadamente en el 20-50% de los pacientes tras el implante de un DAVI75. Sin embargo, en la literatura no son uniformes los criterios para definir el fracaso del VD (tabla 2). Su patogenia es multifactorial. La descarga del ventrículo izquierdo llevada a cabo por los DAVI induce una pérdida de la contribución de la contracción septal a la función derecha (la contracción del septo supone el 60% de la fuerza contráctil del VD)76.
Tabla 2. Criterios definitorios de fallo del ventrículo derecho tras el implante de un dispositivo de asistencia ventricular izquierda
| Soporteposoperatorio con inotrópicosdurantemás de 14 días |
| Empleo de óxido nítrico inhalado durante más de 48 horas |
| Necesidad de tratamientoinotrópico al altahospitalaria |
| Asistenciacirculatoriaderecha |
| Dos o más de los siguientes parámetros hemodinámicos: |
| Presión arterial media < 55 mmHg |
| Presiónvenosa central > 16 mmHg |
| Saturaciónvenosamixta< 55% |
| Índicecardiaco (flujoproporcionadopor DAVI) < 20 l/min/m2 |
| Puntuación de soporteinotrópico> 20 U |
|
DAVI: dispositivo de asistencia ventricular izquierda. |
Por la importante morbimortalidad asociada, es fundamental una adecuada selección de los pacientes candidatos a DAVI. Existen algunos factores predictores de fracaso del VD77:
-
– Presión de la aurícula derecha previa al implante > 20 mmHg.
-
– Gradiente transpulmonar previo al implante > 16 mmHg.
-
– Descenso abrupto (> 10 mmHg) de la presión arterial pulmonar tras el implante.
-
– Ratio presión venosa central/presión de enclavamiento pul- monar > 0,63.
-
– Insuficiencia tricúspide de grado > III antes del implante.
-
– Ratio eje corto/eje largo del VD > 0,6.
-
– Necesidad de soporte circulatorio antes del implante de DAVI.
-
– Hipertransaminasemia, hiperbilirrubinemia o deterioro de la función renal.
-
– Necesidad de ventilación mecánica invasiva antes del implante.
-
– Deformación global longitudinal de la pared libre del VD < –9,6%.
En cuanto al manejo del fallo del VD, se centra principalmente en su prevención. Seleccionar de manera correcta a los enfermos candidatos a DAVI es una labor capital, así como también lo es optimizar su situación de precarga y poscarga del VD, tratando de reducir la presión venosa central. Como medidas generales, es fundamental realizar profilaxis antiinfecciosa, evitar las arritmias cardiacas y programar una ventilación mecánica protectora hacia el VD (con baja presión positiva teleespiratoria). La dobutamina, la adrenalina y la milrinona son los principales agentes inotrópicos empleados en el fallo del VD tras el implante de un DAVI, y pueden asociarse a agentes reductores de la presión arterial pulmonar.
Los dispositivos de asistencia circulatoria también tienen un papel en este contexto clínico. El ECMO veno-arterial, ya comentado en el presente documento, suple la función del VD. Dentro del grupo de los dispositivos Impella, recientemente se ha introducido el modelo Impella RP, con una única cánula de 22 Fr, que aspira sangre de la vena cava inferior, la eyecta hacia la arteria pulmonar y proporciona un flujo de 4 l/min, con resultados prometedores en el estudio RECOVER RIGHT78, en el que se incluyeron 30 pacientes con fallo agudo del VD (tras el implante de un DAVI y como consecuencia de un IAM con afectación derecha).
Impacto económico del empleo de DAVI
La huella económica de los progresos técnicos en el abordaje percutáneo de la patología cardiovascular está creciendo. Un análisis de los costes que implicarían los cuidados prestados en el estudio PROTECT II muestra que los gastos relativos a la hospitalización fueron mayores en el grupo que recibió asistencia con el dispositivo Impella que en el grupo con BCIAo (47.667 frente a 33.684 USD), diferencia que no se explica únicamente por los costes del dispositivo79. En contraposición, los costes debidos a la duración de la estancia y los reingresos fueron menores en el grupo de pacientes tratados con Impella 2.5 (11.007 frente a 21.834 USD).
CONCLUSIONES
El futuro aportará luz acerca del verdadero papel de los DAVI en el laboratorio de hemodinámica. Todos estos dispositivos se emplean con el objetivo de mejorar el gasto cardiaco, la presión arterial media y la perfusión coronaria, reduciendo la presión capilar pulmonar en pacientes con una reserva cardiaca disminuida.
A pesar de los resultados controvertidos de los diferentes estudios, registros y ensayos clínicos, el empleo de los DAVI está aumentando en la ICP de alto riesgo y permiten conservar la estabilidad hemodinámica durante el procedimiento.
FINANCIACIÓN
Los autores declaran la ausencia de fuentes de financiación para la realización del presente trabajo.
CONFLICTO DE INTERESES
Los autores declaran la ausencia de conflictos de intereses.
BIBLIOGRAFÍA
1. Mozaffarian D, Benjamin EJ, Go AS, et al. Heart disease and stroke statis-tics--2015 update:a report from the American Heart Association. Circulation. 2015;131:e29-322.
2. Pulido JN, Park SJ, Rihal CS. Percutaneous left ventricular assist devices:clinical uses, future applications, and anesthetic considerations. J Cardiothorac Vasc Anesth. 2010;24:478-486.
3. O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;127:e362-425.
4. Levine GN, Bates ER, Blankenship JC, et al. 2015 ACC/AHA/SCAI Focused Update on Primary Percutaneous Coronary Intervention for Patients With ST-Elevation Myocardial Infarction:An Update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention and the 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. J Am Coll Cardiol. 2016;67:1235-1250.
5. Epstein AJ, Polsky D, Yang F, Yang L, Groeneveld PW. Coronary revascularization trends in the United States, 2001-2008. JAMA. 2011;305:1769-1776.
6. Rihal CS, Naidu SS, Givertz MM, et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care:Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion;Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'Intervention. J Am Coll Cardiol. 2015;65:e7-e26.
7. Sakakura K, Ako J, Wada H, Kubo N, Momomura S. ACC/AHA classification of coronary lesions reflects medical resource use in current percutaneous coronary interventions. Catheter Cardiovasc Interv. 2012;80:370-376.
8. Krone RJ, Shaw RE, Klein LW, et al. Evaluation of the American College of Cardiology/American Heart Association and the Society for Coronary Angiography and Interventions lesion classification system in the current “stent era“of coronary interventions (from the ACC-National Cardiovascular Data Registry). Am J Cardiol. 2003;92:389-394.
9. Hartzler GO, Rutherford BD, McConahay DR, Johnson WL, Giorgi LV. “High-risk“percutaneous transluminal coronary angioplasty. Am J Cardiol. 1988;61:33G-37G.
10. Bass TA. High-Risk Percutaneous Coronary Interventions in Modern Day Clinical Practice:Current Concepts and Challenges. Circ Cardiovasc Interv. 2015;8:e003405.
11. O'Neill WW, Kleiman NS, Moses J, et al. A prospective, randomized clinical trial of hemodynamic support with Impella 2.5 versus intra-aortic balloon pump in patients undergoing high-risk percutaneous coronary intervention:the PROTECT II study. Circulation. 2012;126:1717-1727.
12. Teirstein PS, Vogel RA, Dorros G, et al. Prophylactic versus standby cardiopulmonary support for high risk percutaneous transluminal coronary angioplasty. J Am Coll Cardiol. 1993;21:590-596.
13. Carnendran L, Abboud R, Sleeper LA, et al. Trends in cardiogenic shock:report from the SHOCK Study. The SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK?Eur Heart J. 2001;22:472-478.
14. Goldberg RJ, Gore JM, Alpert JS, et al. Cardiogenic shock after acute myocardial infarction. Incidence and mortality from a community-wide perspective, 1975 to 1988. N Engl J Med. 1991;325:1117-1122.
15. Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med. 1999;341:625-634.
16. Yip HK, Wu CJ, Chang HW, et al. Comparison of impact of primary percutaneous transluminal coronary angioplasty and primary stenting on short-term mortality in patients with cardiogenic shock and evaluation of prognostic determinants. Am J Cardiol. 2001;87:1184-1188.
17. Stretch R, Sauer CM, Yuh DD, Bonde P. National trends in the utilization of short-term mechanical circulatory support:incidence, outcomes, and cost analysis. J Am Coll Cardiol. 2014;64:1407-1415.
18. Kern MJ, Aguirre F, Bach R, Donohue T, Siegel R, Segal J. Augmentation of coronary blood flow by intra-aortic balloon pumping in patients after coronary angioplasty. Circulation. 1993;87:500-511.
19. Fuchs RM, Brin KP, Brinker JA, Guzman PA, Heuser RR, Yin FC. Augmentation of regional coronary blood flow by intra-aortic balloon counterpulsation in patients with unstable angina. Circulation. 1983;68:117-123.
20. Bregman D, Kripke DC, Goetz RH. The effect of synchronous unidirectional intra-aortic balloon pumping on hemodynamics and coronary blood flow in cardiogenic shock. Trans Am Soc Artif Intern Organs. 1970;16:439-446.
21. Scheidt S, Wilner G, Mueller H, et al. Intra-aortic balloon counterpulsation in cardiogenic shock. Report of a co-operative clinical trial. N Engl J Med. 1973;288:979-984.
22. Williams DO, Korr KS, Gewirtz H, Most AS. The effect of intraaortic balloon counterpulsation on regional myocardial blood flow and oxygen consumption in the presence of coronary artery stenosis in patients with unstable angina. Circulation. 1982;66:593-597.
23. Windecker S, Kolh P, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization:The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35:2541-2619.
24. Thiele H, Schuler G, Neumann FJ, et al. Intraaortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock:design and rationale of the Intraaortic Balloon Pump in Cardiogenic Shock II (IABP-SHOCK II) trial. Am Heart J. 2012;163:938-945.
25. Prondzinsky R, Lemm H, Swyter M, et al. Intra-aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic shock:the prospective, randomized IABP SHOCK Trial for attenuation of multiorgan dysfunction syndrome. Crit Care Med. 2010;38:152-160.
26. Thiele H, Zeymer U, Neumann FJ, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II):final 12 month results of a randomised, open-label trial. Lancet. 2013;382:1638-1645.
27. Zangrillo A, Pappalardo F, Dossi R, et al. Preoperative intra-aortic balloon pump to reduce mortality in coronary artery bypass graft:a meta-analysis of randomized controlled trials. Crit Care. 2015;19:10.
28. Ranucci M, Castelvecchio S, Biondi A, et al.;Surgical and Clinical Outcome Research (SCORE) Group. A randomized controlled trial of preoperative intra-aortic balloon pump in coronary patients with poor left ventricular function undergoing coronary artery bypass surgery. Crit Care Med. 2013;41:2476-2483.
29. Christenson JT, Badel P, Simonet F, Schmuziger M. Preoperative intraaortic balloon pump enhances cardiac performance and improves the outcome of redo CABG. Ann Thorac Surg. 1997;64:1237-1244.
30. Christenson JT, Simonet F, Schmuziger M. The effect of preoperative intra-aortic balloon pump support in high risk patients requiring myocardial revascularization. J Cardiovasc Surg (Torino). 1997;38:397-402.
31. Lomivorotov VV, Cherniavskiy AM, Boboshko VA, Kornilov IA, Lomivorotov VN, Karaskov AM. Levosimendan vs. intra-aortic balloon pump in high-risk cardiac surgery. Asian Cardiovasc Thorac Ann. 2011;19:154-159.
32. Shi M, Huang J, Pang L, Wang Y. Preoperative insertion of an intra-aortic balloon pump improved the prognosis of high-risk patients undergoing off-pump coronary artery bypass grafting. J Int Med Res. 2011;39:1163-1168.
33. Ahmad Y, Sen S, Shun-Shin MJ, et al. Intra-aortic Balloon Pump Therapy for Acute Myocardial Infarction:A Meta-analysis. JAMA Intern Med. 2015;175:931-939.
34. Kantrowitz A, Tjonneland S, Freed PS, Phillips SJ, Butner AN, Sherman JL, Jr. Initial clinical experience with intraaortic balloon pumping in cardiogenic shock. JAMA. 1968;203:113-118.
35. Szatmary LJ, Marco J. Haemodynamic and antiischaemic protective effects of intra-aortic balloon counterpulsation in high risk coronary heart patients undergoing percutaneous transluminal coronary angioplasty. Cor Vasa. 1987;29:183-191.
36. Brodie BR, Stuckey TD, Hansen C, Muncy D. Intra-aortic balloon counterpulsation before primary percutaneous transluminal coronary angioplasty reduces catheterization laboratory events in high-risk patients with acute myocardial infarction. Am J Cardiol. 1999;84:18-23.
37. Briguori C, Sarais C, Pagnotta P, et al. Elective versus provisional intra-aortic balloon pumping in high-risk percutaneous transluminal coronary angioplasty. Am Heart J. 2003;145:700-707.
38. Mishra S, Chu WW, Torguson R, et al. Role of prophylactic intra-aortic balloon pump in high-risk patients undergoing percutaneous coronary intervention. Am J Cardiol. 2006;98:608-612.
39. Perera D, Stables R, Thomas M, et al. Elective intra-aortic balloon counterpulsation during high-risk percutaneous coronary intervention:a randomized controlled trial. JAMA. 2010;304:867-74.
40. Sandhu A, McCoy LA, Negi SI, et al. Use of mechanical circulatory support in patients undergoing percutaneous coronary intervention:insights from the National Cardiovascular Data Registry. Circulation. 2015;132:1243-1251.
41. Khera R, Cram P, Lu X, et al. Trends in the use of percutaneous ventricular assist devices:analysis of national inpatient sample data, 2007 through 2012. JAMA Intern Med. 2015;175:941-950.
42. Thiele H, Sick P, Boudriot E, et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J. 2005;26:1276-1283.
43. Thiele H, Lauer B, Hambrecht R, Boudriot E, Cohen HA, Schuler G. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 2001;104:2917-2922.
44. Burkhoff D, Cohen H, Brunckhorst C, O'Neill WW. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. Am Heart J. 2006;152:469.e1-8.
45. Vranckx P, Foley DP, de Feijter PJ, Vos J, Smits P, Serruys PW. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. Int J Cardiovasc Intervent. 2003;5:35-39.
46. Vranckx P, Schultz CJ, Valgimigli M, et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheter Cardiovasc Interv. 2009;74:302-310.
47. Valgimigli M, van Mieghem CA, Ong AT, et al. Short- and long-term clinical outcome after drug-eluting stent implantation for the percutaneous treatment of left main coronary artery disease:insights from the Rapamycin-Eluting and Taxus Stent Evaluated At Rotterdam Cardiology Hospital registries (RESEARCH and T-SEARCH). Circulation. 2005;111:1383-1389.
48. Kar B, Butkevich A, Civitello AB, et al. Hemodynamic support with a percutaneous left ventricular assist device during stenting of an unprotected left main coronary artery. Tex Heart Inst J. 2004;31:84-86.
49. Aragon J, Lee MS, Kar S, Makkar RR. Percutaneous left ventricular assist device:“TandemHeart“for high-risk coronary intervention. Catheter Cardiovasc Interv. 2005;65:346-352.
50. Alli OO, Singh IM, Holmes DR, Jr., Pulido JN, Park SJ, Rihal CS. Percutaneous left ventricular assist device with TandemHeart for high-risk percutaneous coronary intervention:the Mayo Clinic experience. Catheter Cardiovasc Interv. 2012;80:728-734.
51. Nascimbene A, Loyalka P, Gregoric ID, Kar B. Percutaneous coronary intervention with the TandemHeart percutaneous left ventricular assist device support:Six years of experience and outcomes. Catheter Cardiovasc Interv. 2016;87:1101-1110.
52. Seyfarth M, Sibbing D, Bauer I, et al. A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device versus intra-aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol. 2008;52:1584-1588.
53. Lauten A, Engstrom AE, Jung C, et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock:results of the Impella-EUROSHOCK-registry. Circ Heart Fail. 2013;6:23-30.
54. Henriques JP, Remmelink M, Baan J, Jr., et al. Safety and feasibility of elective high-risk percutaneous coronary intervention procedures with left ventricular support of the Impella Recover LP 2.5. Am J Cardiol. 2006;97:990-992.
55. Sjauw KD, Konorza T, Erbel R, et al. Supported high-risk percutaneous coronary intervention with the Impella 2.5 device the Europella registry. J Am Coll Cardiol. 2009;54:2430-2434.
56. Maini B, Naidu SS, Mulukutla S, et al. Real-world use of the Impella 2.5 circulatory support system in complex high-risk percutaneous coronary intervention:the USpella Registry. Catheter Cardiovasc Interv. 2012;80:717-725.
57. Algin A, Tonino CM. TCT-187. 30-day survival in patients with cardiogenic shock:Impella 2.5 versus Impella 4.0. J Am Coll Cardiol. 2015;66:B70.
58. Dudek D. Temporary Cardiac Support During High-Risk PCI:HeartMate PHP and the SHIELD I Study. En:27th Annual Transcatheter Cardiovascular Therapeutics;2015 Oct 14;San Francisco, United States. Disponible en:https://www.tctmd.com/slide/temporary-cardiac-support-during-high-risk-pci-heartmate-php-and-shield-i-study. Consultado 20 Abr 2020.
59. Bartlett RH, Gazzaniga AB, Jefferies MR, Huxtable RF, Haiduc NJ, Fong SW. Extracorporeal membrane oxygenation (ECMO) cardiopulmonary support in infancy. Trans Am Soc Artif Intern Organs. 1976;22:80-93.
60. Bartlett RH, Andrews AF, Toomasian JM, Haiduc NJ, Gazzaniga AB. Extracorporeal membrane oxygenation for newborn respiratory failure:forty-five cases. Surgery. 1982;92:425-433.
61. Anderson H, 3rd, Steimle C, Shapiro M, et al. Extracorporeal life support for adult cardiorespiratory failure. Surgery. 1993;114:161-172.
62. Kawashima D, Gojo S, Nishimura T, et al. Left ventricular mechanical support with Impella provides more ventricular unloading in heart failure than extracorporeal membrane oxygenation. ASAIO J. 2011;57:169-176.
63. Koeckert MS, Jorde UP, Naka Y, Moses JW, Takayama H. Impella LP 2.5 for left ventricular unloading during venoarterial extracorporeal membrane oxygenation support. J Card Surg. 2011;26:666-668.
64. Sauer CM, Yuh DD, Bonde P. Extracorporeal membrane oxygenation use has increased by 433% in adults in the United States from 2006 to 2011. ASAIO J. 2015;61:31-36.
65. Taub JO, L'Hommedieu BD, Raithel SC, et al. Extracorporeal membrane oxygenation for percutaneous coronary angioplasty in high risk patients. ASAIO Trans. 1989;35:664-666.
66. Ricciardi MJ, Moscucci M, Knight BP, Zivin A, Bartlett RH, Bates ER. Emergency extracorporeal membrane oxygenation (ECMO)-supported percutaneous coronary interventions in the fibrillating heart. Catheter Cardiovasc Interv. 1999;48:402-405.
67. Shammas NW, Roberts S, Early G. Extracorporeal membrane oxygenation for unprotected left main stenting in a patient with totally occluded right coronary artery and severe left ventricular dysfunction. J Invasive Cardiol. 2002;14:756-759.
68. Sheu JJ, Tsai TH, Lee FY, et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit Care Med. 2010;38:1810-1817.
69. Tomasello SD, Boukhris M, Ganyukov V, et al. Outcome of extracorporeal membrane oxygenation support for complex high-risk elective percutaneous coronary interventions:A single-center experience. Heart Lung. 2015;44:309-313.
70. Myat A, Patel N, Tehrani S, Banning AP, Redwood SR, Bhatt DL. Percutaneous circulatory assist devices for high-risk coronary intervention. JACC Cardiovasc Interv. 2015;8:229-244.
71. Khera R, Cram P, Vaughan-Sarrazin M, Horwitz PA, Girotra S. Use of Mechanical Circulatory Support in Percutaneous Coronary Intervention in the United States. Am J Cardiol. 2016;117:10-16.
72. Ouweneel DM, Eriksen E, Sjauw KD, et al. Impella CP versus Intra-aortic balloon pump in acute myocardial infarction complicated by cardiogenic shock. The IMPRESS trial. J Am Coll Cardiol. 2017;69:278-287.
73. Ameloot K, Bastos MB, Daemen J, et al. New-generation mechanical circulatory support during high-risk PCI:a cross-sectional analysis. EuroIntervention. 2019;15:427-433.
74. Amin AP, Spertus JA, Curtis JP, et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention with Mechanical Circulatory Support. Circulation. 2020;141:273-284.
75. Gregory D, Scotti DJ, de Lissovoy G, et al. A value-based analysis of hemodynamic support strategies for high-risk heart failure patients undergoing a percutaneous coronary intervention. Am Health Drug Benefits. 2013;6:88-99.
76. Kaul TK, Fields BL. Postoperative acute refractory right ventricular failure:Incidence, pathogenesis, management and prognosis. Cardiovasc Surg. 2000;8:1-9.
77. Cordtz J, Nilsson JC, Hansen PB, et al. Right ventricular failure after implantation of a continuous-flow left ventricular assist device:Early haemodynamic predictors. Eur J Cardiothorac Surg. 2014;45:847-853.
78. Anderson MB, Goldstein J, Milano C, et al. Benefits of a novel percutaneous ventricular assist device for right heart failure:The prospective RECOVER RIGHT study of the Impella RP device. J Heart Lung Transplant. 2015;34:1549-1560.
79. Roos JB, Doshi SN, Konorza T, et al. The cost-effectiveness of a new percutaneous ventricular assist device for high-risk PCI patients:mid-stage evaluation from the European perspective. J Med Econ. 2013;16:381-390.
RESUMEN
El implante percutáneo de válvula aórtica (TAVI) es la técnica de intervencionismo estructural cardiaco más extendida. Inicialmente, el procedimiento se realizaba solo en pacientes con estenosis aórtica grave sintomática, con riesgo prohibitivo para el reemplazo valvular aórtico quirúrgico. En pocos años, esta técnica se extendió a pacientes con riesgo quirúrgico intermedio y, más recientemente, gracias a los resultados de los estudios PARTNER 3 y Evolut Low Risk, se ha abierto esta indicación para pacientes de bajo riesgo. Sin embargo, existen algunas indicaciones controvertidas que marcan la frontera en la evidencia del uso de TAVI, incluidas pacientes con riesgo quirúrgico intermedio-bajo y válvula aórtica bicúspide, procedimientos válvula en válvula, casos de insuficiencia aórtica pura y pacientes con secuelas valvulares graves tras una endocarditis infecciosa «curada». Nuestro objetivo es resumir la evidencia disponible –fundamentalmente basada en series de casos y registros retrospectivos referente al empleo de TAVI en estas nuevas indicaciones.
Palabras clave: TAVI. Válvula aórtica bicúspide. Insuficiencia aórtica. Bioprótesis aórtica.
Abstract
Transcatheter aortic valve implantation (TAVI) is the most commonly used structural technique in the field of interventional cardiology. Initially, this procedure was only used in patients with severe symptomatic aortic stenosis and prohibitive risk for surgical aortic valve replacement. In just 1 decade, TAVI indications have extended to patients at intermediate surgical risk. More recently, the results of the PARTNER 3 and Evolut Low Risk clinical trials has opened that door for patients at low surgical risk. However, there are still some controversial indications that represent the boundaries of TAVI including patients at lower risk with bicuspid aortic valve, valve-in-valve procedures, pure aortic regurgitation or severe valvular heart disease after healed infective endocarditis. Our objective was to summarize the evidence available –mostly case series and retrospective registries– that supports the use of TAVI for these new indications.
Keywords: TAVI. Bicuspid aortic valve. Aortic regurgitation. Aortic bioprosthesis.
Abreviaturas DVE: degeneración valvular estructural. EI: endocarditis infecciosa. IA: insuficiencia aórtica. RVA: recambio valvular aórtico. TAVI: implante de prótesis aórtica percutánea. VAB: válvula aórtica bicúspide. ViV: válvula en válvula.
INTRODUCCIÓN
La cada vez mayor incidencia de la estenosis aórtica (EAo) asociada a la edad ha convertido la válvula aórtica en la válvula cardiaca más tratada de todas, tanto quirúrgica como percutáneamente, en Europa y Estados Unidos1. Desde el primer uso para una indicación no recogida en la ficha técnica (off-label) de un implante de prótesis aórtica percutánea (TAVI) en 20022, la experiencia internacional acumulada con el uso de TAVI ha ido en aumento. Simultáneamente ha habido un aumento de indicaciones fuera de ficha para esta tecnología. Estas indicaciones han provocado que las guías de práctica clínica hayan incluido paulatinamente más recomendaciones. Aceptado universalmente para pacientes de riesgo quirúrgico alto e intermedio3-6, el TAVI ha cambiado drásticamente el tratamiento de la EAo durante la última década. No obstante, la reciente publicación de los estudios PARTNER 37 y Evolut Low Risk8, que reveló que los resultados del TAVI al año de seguimiento eran similares a los del recambio valvular aórtico (RVA) quirúrgico, plantea la duda de cuáles son los límites de esta tecnología o de si, en algún momento, se convertirá en el tratamiento estándar. Las dudas sobre su durabilidad a largo plazo, algo esencial para una indicación extendida en pacientes más jóvenes es más la espada de Damocles que el talón de Aquiles de esta tecnología por los defensores de la opción quirúrgica que permanecen ajenos al curso de los acontecimientos.
Aunque va más allá del ámbito de actuación de este trabajo, vale la pena mencionar que otra de las actuales limitaciones del TAVI es el desafío que supone el abordaje transvascular. Aunque el acceso transfemoral es el tratamiento estándar, este abordaje no es factible o es demasiado arriesgado en el 15% de los pacientes9. El abordaje transcarotídeo tiene resultados prometedores, mejor que todos los demás abordajes transtorácicos, pero todavía está lejos de los resultados obtenidos con los casos transfemorales10. Cabe destacar que un reciente metanálisis reveló que el abordaje transubclavio podría ser no solo una vía alternativa al abordaje transfemoral sino también una vía competitiva en ciertos pacientes de mayor riesgo de sufrir complicaciones en la arteria femoral11.
Las nuevas indicaciones y abordajes alternativos para el TAVI han aumentado gradualmente precedidos por su uso como alternativa compasiva. En este estudio se describen los límites que tienen estas indicaciones en la actualidad y se revisan los usos fuera de ficha del TAVI, así como los resultados descritos en escenarios difíciles.
INDICACIONES ESPECÍFICAS PARA TAVI
Hoy en día hay varias indicaciones de TAVI que son controvertidas; no obstante, hemos decidido excluir algunas poco frecuentes y centrarnos en las siguientes indicaciones: a) TAVI para el tratamiento de la EAo bicúspide; b) TAVI para realizar intervenciones válvula en válvula (ViV); c) TAVI para el tratamiento de la insuficiencia aórtica (IA) pura; y d) TAVI para el tratamiento de la disfunción valvular grave tras endocarditis infecciosa (EI) curada.
TAVI para el tratamiento de la EAo bicúspide
Incidencia y desafíos específicos de la EAo bicúspide
La válvula aórtica bicúspide (VAB) es el defecto valvular congénito más común. Se ha descrito en el 1-2% de la población general12. Es más frecuente en pacientes más jóvenes con EAo grave, aunque también se da en pacientes ancianos. Se asocia a un mayor estrés mecánico que predispone a calcificaciones y al desarrollo de EAo13. La estenosis de la VAB se considera todo un desafío anatómico para TAVI por estas razones: a) la forma del anillo suele ser extremadamente elíptica y tender a la dilatación aórtica comparado con la característica forma ovalada del anillo de la válvula aórtica tricúspide (VAT) que se asocia a fugas mucho mayores; b) la VAB suele tener un punto de coaptación de las cúspides más alto, lo cual puede ser un factor de confusión durante la intervención y aumentar el riesgo de embolización de la válvula (figura 1) y c) la distribución asimétrica del calcio tendente a formaciones voluminosas aumenta el riesgo de fuga periprotésica y rotura del anillo14. Todos estos elementos han de tenerse en cuenta a la hora de pensar en una intervención TAVI para pacientes con VAB ya que la mala aposición del stent es más habitual en pacientes con estas anomalías y se asocia a una incidencia más alta de insuficiencia periprotésica, disfunción valvular o degeneración precoz de la válvula implantada15.
Figura 1. Ejemplo de TAVI con balón expandible (Myval, Meril Lifesciences, India) en una estenosis aórtica bicúspide. La posición relativamente alta se debe al alto nivel de coaptación de los velos propio de las válvulas aórticas bicúspides.
Evidencias actuales de TAVI para el tratamiento de la VAB
No se han incluido pacientes con VAB en los principales estudios sobre dispositivos TAVI. Aquellos pacientes cuya válvula aórtica precisa ser reemplazada por presentar EAo a una edad más temprana (< 60 años) suelen tener VAB congénita. Por esta razón, los pacientes con VAB suelen tener menos comorbilidades y el equipo multidisciplinar suele optar por el RVA. Cuando la opción preferida es TAVI, dimensionar adecuadamente la prótesis valvular y planificar la intervención es esencial para tener buenos resultados16. En la actualidad, todos los estudios específicos dedicados a analizar los diferentes resultados de TAVI en el tratamiento de pacientes con VAB y TAV han sido estudios retrospectivos. Identificamos 13 estudios que confirmaron el perfil de factibilidad y seguridad de TAVI en el tratamiento de la estenosis de la VAB. Las principales características basales y resultados de la intervención se muestran en la tabla 1 y tabla 216-28. En su metanálisis, Quintana et al.29 revisaron principalmente los resultados de estudios sobre dispositivos de primera generación16-20. Este análisis confirmó que la terapia TAVI resultó factible y segura en el tratamiento de la enfermedad de la VAB. El objetivo primario de mortalidad por cualquier causa al cabo de 1 año reveló un índice de mortalidad del 11,8% en pacientes con VAB y del 15,06% en pacientes con VAT. No se observó ninguna diferencia entre los 2 grupos (riesgo relativo [RR] = 1,03; intervalo de confianza del 95% [IC95%], 0,70-1,51). No obstante, el grupo con VAB se asoció a un menor éxito de la intervención con el dispositivo y a una insuficiencia valvular más significativa post-TAVI que el grupo con VAT. Yoon et al.22 compararon los resultados de la intervención y clínicos en pacientes con VAB frente a VAT incluidos dispositivos de última generación. En el grupo que recibió dispositivos de primera generación, la VAB presentó lesiones en la raíz aórtica con mayor frecuencia (4,5 frente al 0,0%; p = 0,015) cuando se usaron dispositivos balón-expandibles y fuga periprotésica de moderada a grave (19,4 frente al 10,5%; p = 0,02) cuando se emplearon dispositivos autoexpandibles. Sin embargo, en pacientes con dispositivos de última generación los resultados de la intervención fueron similares con diferentes válvulas. Los índices de mortalidad por cualquier causa acumulada a los 2 años fueron parecidos entre la EAo bicúspide y tricúspide (del 17,2 frente al 19,4%; p = 0,28). Takagi et al.30 llevaron a cabo el último metanálisis disponible hasta la fecha que no reveló ninguna diferencia significativa a nivel estadístico en los índices de implante de marcapasos y mortalidad precoz y a medio plazo (RR = 1,35; IC95%, 0,94-1,93 y RR = 1,00; IC95, 0,77-1,31, respectivamente). No obstante, el grupo con VAB presentaba más insuficiencia valvular aórtica que el grupo con VAT (RR = 1,42; IC95%, 1,11-1,82). Este contratiempo fue menos habitual cuando se emplearon dispositivos de balón-expandibles que cuando se usaron dispositivos autoexpandibles. Quizá por esta razón, tal y como se muestra en la tabla 1, los dispositivos de balón-expandibles han sido la primera opción en la mayoría de los estudios publicados recientemente.
Tabla 1. Comparativa entre estenosis aórtica bicúspide y tricúspide. Datos basales y características de la intervención
| Referencia, año | N | Edad (años) | Puntuación escala STS (%) | Modelo EuroSCORE logístico (%) | Abordaje TF (%) | Balón expandible (%) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| VAB | VAT | VAB | VAT | VAB | VAT | VAB | VAT | VAB | VAT | VAB | VAT | |
| Hayashida et al.,17 2013 | 21 | 208 | 82,0 ± 7,0 | 83,2 ± 6,5 | N/A | N/A | 19,9 ± 11,9 | 20,1 ± 11,4 | 61,9 | 50,5 | 52,4 | 83,7 |
| Bauer et al.,18 2014 | 38 | 1.357 | 80,7 ± 6,6 | 81,8 ± 6,2 | N/A | N/A | 18,0 ± 10,0 | 20,0 ± 13,0 | 81,6 | 88,0 | 31,6 | 18,0 |
| Costopoulos et al.,16 2014 | 21 | 447 | 76,7 ± 7,1 | 79,8 ± 7,4 | 7,6 ± 4,2 | 7,8 ± 7,3 | 23,9 ± 12,0 | 24,4 ± 17,3 | 71,4 | 83,9 | 38,1 | 58,6 |
| Kochman et al.,19 2014 | 28 | 84 | 77,6 ± 5,5 | 79,1 ± 6,8 | N/A | N/A | 19,2 ± 9,0 | 18,8 ± 8,7 | 78,6 | 77,4 | 17,9 | 17,9 |
| Liu et al.,20 2015 | 15 | 25 | 75,4 ± 5,7 | 75,8 ± 5,5 | 5,6 ± 4,1 | 7,5 ± 5,9 | 16,1 ± 11,1 | 21,8 ± 14,7 | 86,7 | 92,0 | 0,0 | 0,0 |
| Sannino et al.,21 2017 | 88 | 735 | 80,2 ± 8,4 | 81,8 ± 7,9 | 7,4 ± 3,9 | 7,6 ± 3,9 | N/A | N/A | 88,6 | 87,1 | 52,3 | 59,7 |
| Yoon et al.,22 2017 | 546 | 546 | 77,2 ± 8,2 | 77,2 ± 8,8 | 4,6 ± 4,6 | 4,3 ± 3,0 | 16,1 ± 12,0 | 16,9 ± 13,9 | 79,1 | 78,8 | 57,7 | 57,1 |
| Arai et al.,23 2017 | 10 | 143 | 81,3 ± 5,1 | 82,6 ± 6,2 | N/A | N/A | 19,0 ± 12,5 | 18,1 ± 11,0 | 70,0 | 87,4 | 100,0 | 100,0 |
| Liao et al.,24 2018 | 87 | 70 | 80,2 ± 8,4 | 81,8 ± 7,9 | 7,9 ± 4,0 | 8,6 ± 4,4 | N/A | N/A | 100,0 | 100,0 | 0,0 | 0,0 |
| De Biase et al.,25 2018 | 83 | 166 | 81,4 ± 7,6 | 82,9 ± 5,7 | 5,1 ± 3,3 | 5,1 ± 2,9 | N/A | N/A | 98,8 | 98,8 | 60,2 | 36,7 |
| Xiong et al.,26 2018 | 67 | 49 | 74,0 (68,0–77,0) | 75,0 (68,0-79,0) | 6,5 (4,4–9,3) | 8,3 (5,2–9,5) | N/A | N/A | 98,5 | 100,0 | 0,0 | 0,0 |
| Kawamori et al.,27 2018 | 41 | 239 | 80 (70,5–83,0) | 83 (78,0–87,0) | N/A | N/A | N/A | N/A | 97,6 | 98,7 | 100,0 | 100,0 |
| Makkar et al.,28 2019 | 2.691 | 2.691 | 74,0 (66,0–81,0) | 74,0 (66,0–81,0) | 4,9 ± 4,0 | 5,1 ± 4,2 | N/A | N/A | 93,6 | 93,9 | 100,0 | 100,0 |
|
Escala STS: riesgo de mortalidad predicho por la Society of Thoracic Surgeons; N/A: no disponible; TF: transfemoral; VAB: válvula aórtica bicúspide; VAT: válvula aórtica tricúspide. Los datos expresan media ± desviación estándar o mediana (rango intercuartílico) o n (%). |
||||||||||||
Tabla 2. Comparativa entre estenosis aórtica bicúspide y tricúspide. Principales resultados
| Referencia, año | Gradiente protésico medio (mmHg) | IA valvular > 2 (%) | Marcapasos permanente (%) | Mortalidad a 30 días (%) | ||||
|---|---|---|---|---|---|---|---|---|
| BAV | TAV | BAV | TAV | BAV | TAV | BAV | TAV | |
| Hayashida et al.,17 2013 | 10,0 ± 3,4 | 9,7 ± 4,1 | 19,0 | 14,9 | 14,3 | 7,2 | 1 (4,8) | 17 (8,2) |
| Bauer et al.,18 2014 | 5,5 ± 7,1 | 5,9 ± 6,8 | 23,7 | 15,0 | 15,8 | 35,0 | 4 (10,5) | 5 (11,0) |
| Costopoulos et al.,16 2014 | 10,3 ± 5,7 | 10,5 ± 4,7 | 23,8 | 21,7 | 14,3 | 15,0 | 3 (14,3) | 3,6 (3,6) |
| Kochman et al.,19 2014 | 11,5 ± 6,4 | 10,4 ± 4,5 | 32,1 | 22,6 | 28,6 | 33,3 | 1 (3,6) | 6 (7,1) |
| Liu et al.,20 2015 | 9,6 ± 3,1 | 11,0 ± 4,2 | 0,0 | 4,0 | 13,3 | 12,0 | 1 (6,7) | 2 (8,0) |
| Sannino et al.,21 2017 | 7,96 ± 4,15 | 8,5 ± 4,2 | 5,3 | 5,0 | 22,7 | 18,1 | 3 (3,4) | 23 (3,1) |
| Yoon et al.,22 2017 | 10,8 ± 6,7 | 10,2 ± 4,4 | 10,4 | 6,8 | 15,4 | 15,4 | 20 (3,7) | 18 (3,3) |
| Arai et al.,23 2017 | N/A | N/A | 0,0 | 6,0 | 0,0 | 8,4 | 0 (0,0) | 1 (0,7) |
| Liao et al.,24 2018 | 13,7 ± 8,4 | 13,0 ± 7,5 | 1,2 | 0,0 | 24,1 | 28,6 | 8 (9,2) | 3 (4,3) |
| De Biase et al.,25 2018 | 10,0 ± 4,0 | 9,8 ± 4,5 | 3,6 | 2,4 | 14,5 | 10,2 | 4 (4,8) | 5 (3,0) |
| Xiong et al.,26 2018 | 13,5 (10,0 - 17,0) | 13,0 (10,0 - 18,0) | N/A | N/A | 25,4 | 22,4 | 6 (9,0) | 2 (4,1) |
| Kawamori et al.,27 2018 | 11,9 ± 4,2 | 10,8 ± 4,0 | 2,4 | 1,3 | 22,0 | 9,6 | 0 (0,0) | 1 (0,4) |
| Makkar et al.,28 2019 | N/A | N/A | N/A | N/A | 9,1 | 7,5 | 66 (2,6) | 63 (2,5) |
|
IA: insuficiencia aórtica; N/A: no disponible; VAB: válvula aórtica bicúspide; VAT: válvula aórtica tricúspide. Los datos expresan media ± desviación estándar o mediana (rango intercuartílico) o n (%). |
||||||||
¿Se convertirá el TAVI en el tratamiento estándar para el tratamiento de la VAB?
El TAVI ha demostrado ser una excelente opción para casos seleccionados de VAB, lo cual coincide con los datos recogidos hasta la fecha. Para ampliar sus indicaciones, Elbadawi et al.31 realizaron una comparativa entre TAVI y RVA que arrojó índices de mortalidad hospitalaria parecidos (del 3,1 frente al. 3,1%; odds ratio [OR] = 1,00; IC95%, 0,60-1,67). No se observó ninguna diferencia entre TAVI y RVA en los índices de complicaciones de la intervención ni en los resultados precoces tales como parada cardiaca, shock cardiogénico, daño renal agudo, taponamiento cardiaco o accidente cerebrovascular agudo. TAVI se asoció a índices más bajos de infarto agudo de miocardio, complicaciones hemorrágicas posoperatorias y estancias hospitalarias más cortas. No obstante, TAVI se asoció a índices más altos de bloqueo AV completo e implantación de marcapasos permanente (del 13,8 frente al 4,6%; OR = 3,32; IC95%, 2,34-4,71; p < 0,001).
Puntos clave: empleo de TAVI para el tratamiento de la VAB
En conclusión, el uso de TAVI para el tratamiento de la VAB parece una buena alternativa en lo que a la mortalidad y a las complicaciones graves se refiere. No obstante, es posible que los dispositivos balón-expandibles tengan una incidencia algo más alta de rotura del anillo y los autoexpandibles una incidencia más alta de implante de marcapasos y fuga periprotésica como en otros escenarios alternativos. La realización de ensayos aleatorizados específicos comparativos de TAVI frente a RVA está plenamente justificada en el futuro y quizá abra la puerta a un nuevo estándar de tratamiento en pacientes más jóvenes con VAB.
TAVI para intervenciones ViV
Deterioro estructural de la válvula bioprotésica
Comparadas con las válvulas mecánicas, las bioprotésicas tienen una durabilidad limitada y terminan fallando entre 5 y 20 años después de ser implantadas; no obstante, cuando esto ocurre se pueden realizar intervenciones ViV para evitar el uso de válvulas mecánicas. Además, las válvulas bioprotésicas no precisan anticoagulación, lo cual minimiza los riesgos asociados a esta intervención32,33. Estos factores han contribuido a un significativo aumento del uso de estas intervenciones durante las 2 últimas décadas
La degeneración valvular estructural (DVE) es una anomalía intrínseca adquirida de la válvula bioprotésica que se define como el deterioro de los velos o estructuras de soporte que resulta en el engrosamiento, calcificación, rotura o alteración de los materiales de la válvula protésica y que acarrea disfunción hemodinámica valvular. La DVE se puede presentar como estenosis, insuficiencia o ambas. El estrés mecánico, la alteración de las fibras de colágeno y la calcificación de los tejidos son los principales factores que contribuyen a este proceso32. Aunque no hay una definición estándar de DVE33-35, el creciente uso de TAVI para intervenciones ViV con ciertos casos indicados erróneamente para tratar fenómenos graves preexistentes de mismatch obliga a establecer unos criterios diagnósticos claros sobre la indicación de ViV.34 Dvir et al.32 propusieron una definición práctica de DVE en el registro internacional de datos válvula en válvula (VIVID) y dieron recomendaciones sobre cuál es el mejor momento para realizar valoraciones clínicas y mediante técnicas imágenes durante el seguimiento. La DVE se divide en diferentes fases, cada una de las cuales está asociada a una recomendación específica que muestra la DVE como un continuo y no como una variable categórica binaria. En consecuencia, la fase 1 se asocia a cambios morfológicos en los velos sin efectos hemodinámicos. La DVE fase 2 se refiere a anomalías morfológicas de los velos valvulares asociadas a disfunción hemodinámica. Dependiendo del tipo de disfunción esta fase se divide en: estenosis (fase 2S) o insuficiencia (fase 2R) puesto que las implicaciones clínicas y avance del deterioro varían entre estos 2 modos de fracaso. Los investigadores han clasificado los cuadros clínicos de estenosis/insuficiencia moderada como fase 2RS.
En la DVE fase 2 encontramos pacientes sintomáticos aptos para volver a ser intervenidos. La fase de DVE más grave (fase 3) es desarrollar estenosis o insuficiencia graves.
Indicación de ViV para el tratamiento de la DVE bioprotésica
Hasta la última década, cuando la DVE alcanzaba la fase 3, el tratamiento habitual del deterioro de la válvula bioprotésica era sustituir la válvula. La prueba de concepto de la ViV fue descrita por Walther et al. en 2007.36 Desde entonces, y dada su naturaleza menos invasiva y más atractiva, tanto para pacientes como para operadores, comparado con tener que volver a realizar cirugías a corazón abierto, el número de intervenciones ViV ha experimentado un rápido crecimiento32 incluso sin la aprobación de marca CE para algunos de los actuales dispositivos. Desde entonces se han publicado series relativamente pequeñas y algunos registros extensos sobre los dispositivos empleados. Los resultados de los estudios incorporan más de 20 casos de intervenciones ViV y se muestran en la tabla 337-49.
Tabla 3. Series de casos (> 20 pacientes) y registros de intervenciones válvula en válvula
| Referencia, año | N | THV | Edad (años) | Escala STS (%) | Modelo EuroSCORE logístico (%) | Éxito de la interven- ción (%) | Gradiente medio tras ViV (mmHg) | IA > 2 (%) | IMP (%) | Malpo- sición de THV (%) | Mortalidad a 30 días (%) | Morta- lidad a 1 año (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Eggebrecht et al.,37 2011 | 47 | ES | 79,8 ± 7,1 | 11,6 ± 8,5 | 35,0 ± 18,5 | 100 | 17,0 ± 10 | 2 | N/A | 8 | 17 | N/A |
| Bedogni et al.,38 2011 | 25 | CV | 82,4 ± 3,2 | 8,2 ± 4,2 | 31,5 ± 14,8 | 100 | 13,8 | 0 | 12 | N/A | 12 | 16 |
| Bapat et al.,39 2012 | 23 | ES | 76,9 (43-92) | 7,6 ± 3,8 | 31,8 ± 15,3 | 100 | 9,1 | 0 | 0 | 4,3 | 0 | 12,5 |
| Linke et al.,40 2012 | 27 | CV | 74,8 ± 8 | N/A | 31,3 ± 17 | 100 | 18 ± 8 | 7,4 | 3,7 | 3,7 | 7,4 | 12,5 |
| Dvir et al.,41 2012 | 202 | CV/ES | 77,7 ± 10,4 | 11,8 ± 9,9 | 31,1 ± 16,4 | 93,1 | 15,9 ± 8,6 | 5,0 | 7,4 | 15,3 | 8,4 | 14,2 |
| Dvir et al.,42 2014 | 459 | CV/ES | 77,6 ± 9,8 | 9,8 (6,2-16,1) | 29 (19,1-42,3) | 93,1 | 15,8 ± 8,9 | 5,4 | 8,3 | 15,3 | 7,6 | 16,8 |
| Ihlberg et al.,43 2013 | 45 | CV/ES | 80,6 (61-91) | 15,0 ± 10,8 | 35,4 ± 16,1 | 95,6 | 16,4 ± 8,7 | 2 | 7 | 2,2 | 4,4 | 11,9 |
| Camboni et al.,44 2015 | 31 | CV/ES/ME/SA | 77,8 ± 6,3 | 20,9 ± 8,8% | N/A | 88 | 16,1 ± 7,2 | N/A | 6 | N/A | 22,5 | N/A |
| Webb et al.,45 2017 | 365 | ES | 78,9 ± 10,2 | 9,1 ± 4,7 | 12,3 ± 9,8 | 97,5* | 17,6 (16,2 – 19,1) | 1,9 | 1,9 | 2,7 | 12,4 | |
| Zenses et al.,46 2018 | 79 | CV/ES/P | 74,5 ± 11,0 | N/A | 10,2 ± 2,7 | 78,5 | 22,2 ± 9,3 | 3,9 | 3,8 | N/A | N/A | N/A |
| de Freitas Campos Guimaraes et al.,47 2018 | 116 | CV/ES | 76 ± 11 | 8,0±5,1% | N/A | 94,8 | 18,5±10,5 | 4,3 | 5,2 | N/A | 6,9 | 25,9 (3 años) |
| Tuzcu et al.,48 2018 | 1.150 | CV/ES | 79 (74–85) | 6,9 (4,5-10,8) | N/A | 96,9* | 16,0 (10,0-22,0) | 3,5 | 3,0 | < 1% | 2,9 | 11,7 |
| Holzamer et al.,49 2019 | 85 | AN | 77 ± 8 | 6,8 ± 6,0 | 11,4 ± 7,9 | 99 | 16 ± 8 | 10 | 1 | N/A | 5 | 8 |
|
Los datos expresan media ± desviación estándar o mediana (rango intercuartílico) o n (%). * No explicitado en el texto. Éxito de la intervención según los criterios del Valve Academic Research Consortium (VARC). AN: ACURATE neo; CV: CoreValve; ES: Edwars Sapien; Escala STS: riesgo de mortalidad predicho por la Society of Thoracic Surgeons; IA: insuficiencia aórtica; IMP: implante de marcapasos permanente; ME: Medtronic Engager; N/A: no disponible; P: Portico; SA: Symetis ACURATE; THV: prótesis valvular cardiaca percutánea; ViV: válvula en válvula. |
||||||||||||
Aunque en 2012 Dvir et al.41 sugirieron que la intervención ViV era muy exigente a nivel técnico y debería quedar reservada solo a centros altamente experimentados, en la actualidad, esta intervención se realiza en todos los centros con capacidad para realizar TAVI. Además, al contrario de lo que vaticinaron Dvir et al., probablemente ya no se considera un escenario complejo. No obstante, los operadores deben tener experiencia en el tratamiento de la malposiciónde la válvula, en técnicas de recuperación, implantación de un segundo dispositivo TAVI, así como en el tratamiento de la temida oclusión coronaria. Durante la fase de cribado, el equipo multidisciplinar debe tener en cuenta todos estos factores. Además, el mecanismo de la DVE debe ser valorado por expertos en imagen cardiaca familiarizados con la realización de intervenciones estructurales y tenido en cuenta a la hora de elegir el modelo de TAVI y el dimensionamiento adecuado.
Nuevas técnicas y desafíos para las intervenciones ViV
El posicionamiento durante una intervención ViV puede ser todo un desafío ya que es predictivo del riesgo de obstrucción coronaria que es más probable cuando los velos se suturan fuera del anillo de sutura o en válvulas sin stent49. Se están desarrollando rápidamente dispositivos mejores y técnicas dedicadas para que los operadores tengan mejores resultados incluido fracturar el anillo durante la posdilatación para mejorar los gradientes transvalvulares de pacientes con válvulas bioprotésicas pequeñas previas y cierto grado de mismatch50 o la técnica BASILICA (laceración intencionada del festón aórtico bioprotésico o nativo para prevenir la obstrucción de las coronarias)51. Estas intervenciones se basan en series cortas de casos, pero están aumentando rápidamente gracias a los prometedores resultados cosechados.
Un problema relativamente nuevo pero que irá en aumento es la intervención TAVI en TAVI. Poco se sabe de la durabilidad de las válvulas aórticas transcatéter a medio y largo plazo más allá de la primera década de implantación52. Aunque la intervención ViV transcatéter está aceptada ahora como una buena alternativa a la cirugía en pacientes de alto riesgo con válvulas bioprotésicas quirúrgicas fallidas, la intervención TAVI en TAVI se asocia a riesgos específicos en función del dispositivo empleado. Por un lado, las válvulas autoexpandibles supraanulares pueden acarrear un mayor riesgo de oclusión coronaria si se tratan con los dispositivos actuales, lo que convierte el acceso a los ostium coronarios en un desafío mayor si cabe. Por otro lado, los dispositivos intraanulares pueden tener peores gradientes residuales tras la ViV o un mayor riesgo de rotura del anillo durante la posdilatación. En líneas generales, los escasos datos actuales sobre este nuevo escenario parecen favorables52,53.
Puntos clave: ViV
A pesar de la tendencia a infravalorar los riesgos de ViV o el impacto a largo plazo de unos resultados hemodinámicos agudos no optimos, lo cierto es que la intervención ViV todavía está lejos de ser una técnica bien establecida aun cuando se ha realizado gran número de casos hasta la fecha. Para tener resultados óptimos, primero hacen falta mejoras técnicas y dispositivos nuevos tanto en el campo transcatéter como en el quirúrgico.
TAVI para el tratamiento de la IA pura
Mecanismos de la IA y tratamiento en la actualidad
La IA se caracteriza por su prolongado y silencioso curso clínico. Cuando los pacientes con IA grave cursan síntomas presentan insuficiencia cardiaca congestiva por sobrecarga de volumen, un mayor estrés de la pared y disfunción del ventrículo izquierdo1. Hay otras diferencias con la EAo. Por un lado, la anatomía de los pacientes con insuficiencia de la válvula aórtica nativa suele ser un desafío con una raíz aórtica y aorta ascendente dilatadas y, a menudo, un anillo elíptico54. Por otro lado, los pacientes con IA suelen ser derivados para sustituirles la válvula a una edad más joven por los diferentes mecanismos implicados en la IA tales como enfermedad degenerativa, congénita, reumática y, con menor frecuencia, infecciosa o por radioterapia55. Por estas razones, el RVA es el tratamiento estándar.1
El papel de TAVI en el tratamiento de pacientes con IA
No obstante, los avances en la tecnología de las válvulas y la experiencia acumulada han fomentado el uso fuera de ficha técnica del TAVI para el tratamiento de pacientes inoperables o de alto riesgo con IA56. De hecho, el TAVI está contraindicado para el tratamiento de la IA pura por la ausencia de calcificación valvular, lo que hace que arreglar el dispositivo sea un desafío todavía mayor57. Desde que Roy et al.55 publicaran la primera serie de casos de TAVI para el tratamiento de la IA nativa pura, se han publicado otros estudios retrospectivos para intentar generar evidencia y mostrar la factibilidad y seguridad del TAVI para esta indicación. Como ocurre con otras indicaciones TAVI, debería ser obligatorio realizar una ecocardiografía preoperatoria y una tomografía computarizada multicorte tridimensional. Resulta esencial realizar una evaluación meticulosa de los diámetros del anillo y seno de Valsalva y luego medir el diámetro aórtico ascendente. El dimensionamiento de la válvula debe basarse en el área y el perímetro. No obstante, lograr un adecuado realce con contraste del anillo suele ser un desafío durante la realización de la tomografía computarizada; además, las dimensiones del anillo pueden variar rápidamente si la intervención no se realiza inmediatamente después de valorar las imágenes.
Tanto la tabla 4 como la tabla 5 muestran los principales registros sobre esta cuestión55,57-65. Los estudios se han dispuesto cronológicamente y, al igual que hicieron Takagi et al.66 en su reciente metanálisis, la información se ha clasificado en dispositivos de primera y nueva generación con fines formativos.
Tabla 4. Series de casos (> 20 pacientes) y registros de TAVI sobre el tratamiento de la insuficiencia aórtica pura. Datos basales clínicos y ecocardiográficos
| Referencia, año | N | THV | Edad (años) | Escala STS (%) | Modelo EuroSCORE logístico (%) | FEVI media (%) | DTDVI media (mm) | IM significativa* (%) |
|---|---|---|---|---|---|---|---|---|
| Roy et al.,55 2013 | 43 | CV | 75,3 ± 8,8 | 10,2 ± 5,3 | 26,9 ± 17,9 | 45,5 ± 12,9 | 59,4 ± 13,7 | 32,6 |
| Seiffert et al.,58 2014 | 31 | JE | 73,8 ± 9,1 | 5,4 ± 3,6 | 23,6 ± 14,5 | 46,8 ± 16,1 | N/A | 20,0 |
| Testa et al.,59 2014 | 26 | CV | 73 ± 10 | 13,1 ± 2 | 24 ± 8 | 45 ± 14 | N/A | 50,0 |
| Frerker et al.,60 2015 | 22 | CV/ES | 80 ± 7,6 | N/A | 25 ± 18 | N/A | N/A | N/A |
| Zhu et al.,61 2016 | 33 | JV | 74,2 ± 5,2 | N/A | 24,4 ± 5,1 | N/A | N/A | N/A |
| Yoon et al.,57 EGD 2017 | 119 | CV/ES | 74,2 ± 13,1 | 7,6 ± 6,7 | N/A | 44,5 ± 14,3 | 62 ± 11 | 35,1 |
| Yoon et al.,57 NGD 2017 | 212 | CV/ES/JE/JV/SA/DF/ME/LO/P | 74,2 ± 11,6 | 6,2 ± 6,7 | N/A | 46,3 ± 14,8 | 60 ± 11 | 35,6 |
| Sawaya et al.,62 2017 | 78 | CV/ES/JE/DF/LO | 74 ± 10 | 6,7 ± 4,8 | 23,6 ± 14,5 | 42,7 ± 13,8 | 58,5 ± 10,2 | 43,3 |
| Liu et al.,63 2018 | 43 | JV | 73,9 ± 5,7 | N/A | 25,5 ± 5,3 | 55,9 ± 10,8 | 60,5 ± 8,4 | 9,3 |
| De Backer et al.,64 EGD 2018 | 109 | CV/ES | 74 ± 13 | 6,9 ± 7,5 | N/A | 44 ± 15 | N/A | 42,9 |
| De Backer et al.,64 NGD 2018 | 145 | CV/ES/JE/SA/DF/ME/LO/P | 75 ± 10 | 6,2 ± 4,9 | N/A | 45 ± 15 | N/A | 43,5 |
| Silaschi et al.,65 2018 | 30 | JE | 74,4 ± 9,3 | 17,7 ± 14,8 | 4,9 ± 3,5 | 49,6 ± 13,3 | N/A | 50,0 |
|
Los datos expresan media ± desviación estándar. * IM significativa: insuficiencia mitral (al menos grado). CV: CoreValve; DF: Direct Flow; DPG: dispositivos de primera generación; DTDVI: dimensión telediastólica del ventrículo izquierdo; DUG: dispositivos de última generación; ES: Edwards Sapien; Escala STS: riesgo de mortalidad predicho por la Society of Thoracic Surgeons; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral; JE: JenaValve; JV: J Valve; LO: Lotus; ME: Medtronic Engager; N/A: no disponible; P: Portico; SA: Symetis ACURATE; TAVI: implante de prótesis aórtica percutánea; THV: prótesis valvular cardiaca percutánea. |
||||||||
Tabla 5. Series de casos (> 20 pacientes) y registros de TAVI sobre el tratamiento de la insuficiencia aórtica pura. Resultados de la intervención y durante el seguimiento
| Referencia, año | Éxito de la intervención (%) | Conversión a cirugía abierta | THV en THV (%) | Rotura del anillo | Nueva intervención | IMP (%) | ≥ FPP moderada | Mortalidad a 30 días (%) |
|---|---|---|---|---|---|---|---|---|
| Roy et al.,55 2013 | 74,4 | 2,3 | 18,6 | N/A | N/A | 16,3 | 4,7 | 9,3 |
| Seiffert et al.,58 2014 | 96,8 | 0,0 | 0,0 | 0,0 | N/A | 6,5 | 0,0 | 12,9 |
| Testa et al.,59 2014 | 76,9 | 0,0 | 19,2 | N/A | N/A | 7,7 | 23,1 | 23,1 |
| Frerker et al.,60 2015 | 81,8 | N/A | N/A | N/A | N/A | 27,3 | N/A | 22,7 |
| Zhu et al.,61 2016 | 93,9 | 3,0 | N/A | N/A | N/A | 6,1 | 3,0 | 3,0 |
| Yoon et al.,57 EGD 2017 | 61,3 | 3,4 | 24,4 | 1,7 | 5,0 | 17,5 | 18,8 | 13,4 |
| Yoon et al.,57 NGD 2017 | 81,1 | 3,8 | 12,7 | 1,4 | 3,8 | 18,6 | 4,2 | 9,4 |
| Sawaya et al.,62 2017 | 70,5 | N/A | 16,7 | N/A | 2,6 | 18,5 | 13,4 | 14,3 |
| Liu et al.,63 2018 | 97,7 | 2,3 | 0,0 | 0,0 | 4,7 | 2,3 | 2,4 | 2,3 |
| De Backer et al.,64 EGD 2018 | 46,5 | N/A | N/A | N/A | 3,7 | N/A | 25,5 | 17,1 |
| De Backer et al.,64 NGD 2018 | 82,5 | N/A | N/A | N/A | 4,4 | N/A | 4,7 | 7,7 |
| Silaschi et al.,65 2018 | 88,9 | 3,7 | 0,0 | 0,0 | 3,3 | 3,8 | 0,0 | 10,0 |
|
DPG: dispositivos de primera generación; DUG: dispositivos de última generación; FPP: fuga periprotésica; IMP: implante de marcapasos permanente; N/A: no disponible; TAVI: implante de prótesis aórtica percutánea; THV: prótesis valvular cardiaca percutánea. |
||||||||
Dispositivos TAVI alternativos para el tratamiento de la IA
La Medtronic CoreValve (Medtronic, Estados Unidos) fue la opción preferida en la mayoría de los primeros casos descritos de TAVI en pacientes con IA nativa pura60,67-74. Se creía que sus propiedades autoexpandibles conferían estabilidad durante el implante y garantiza- ban la fijación de la válvula incluso sin calcificación extensa (figura 2). No obstante, la habitual necesidad de implantación de un segundo dispositivo y los índices entre moderado y alto de la IA posoperatoria grado III-IV (tabla 5, resultados de Roy et al.55 y Testa et al.59) provocaron un tímido cambio en la definición de éxito del dispositivo según los criterios del Valve Academic Research Consortium35. Esto fue una llamada de atención sobre las limitaciones de este dispositivo para su uso en el marco de esta indicación específica fuera de ficha técnica54. Otras válvulas transcatéter autoexpandibles como la ACURATE neo (Boston Scientific, Estados Unidos), Lotus (Boston Scientific, Estados Unidos), Portico (Abbott, Estados Unidos) y la Edwards SAPIEN XT/S3 balón-expandible (Edwards Life-sciences, Estados Unidos) se han empleado en el tratamiento de la IA (tabla 4) con diferentes resultados pero, en cualquier caso, peores resultados que en el tratamiento de pacientes con EAo.
Figura 2. Ejemplo de TAVI autoexpandible (Evolut R, Medtronic, Estados Unidos) en una insuficiencia aórtica pura. Véase que, en este caso, la valoración angiográfica no revela signos de insuficiencia aórtica residual.
Se han desarrollado dispositivos nuevos para el tratamiento de pacientes con IA grave pura. El dispositivo JenaValve (JenaValve Technology, Alemania) era la única válvula reposicionable de última generación con geometría de auto-posicionamiento y mecanismos específicos de fijación con marca de la Comisión Europea para el tratamiento de la IA. El stent de nitinol alberga una válvula pericárdica porcina con 3 velos y 3 postes que permiten la correcta orientación anatómica de la válvula más un mecanismo especial de sujeción que fija el dispositivo a los velos nativos. El primer caso clínico de una intervención TAVI realizada con la válvula JenaValve incluyó a 5 pacientes con IA de moderada a grave y alto riesgo quirúrgico; la intervención tuvo éxito en todos los casos y no se reportaron muertes ni accidentes cerebrovasculares tras 30 días de seguimiento75. Se observó un rendimiento similar en registros más largos tal y como muestran la tabla 4 y la tabla 5. En cualquier caso, este dispositivo ya no se comercializa. El sistema J-Valve61,76 (JieCheng Medical Technology, China), todavía no disponible en Europa, es un dispositivo de 3 pinzas orientadas anatómicamente y en forma de U para «autoposicionarse» durante el implante de la prótesis valvular y proporcionar fijación radial abrazando los velos de la válvula mediante un mecanismo de sujeción. El sistema de implante de válvula aórtica transcatéter de Direct Flow Medical (Direct Flow Medical, Estados Unidos) consta de 2 sistemas de anillos (ventricular y aórtico) que se inflan independientemente con una mezcla de contraste-solución salina durante la fase del implante más un polímero que se solidifica y confiere un soporte adicional mientras el dispositivo queda fijado en su posición final. Schofer et al.77 describieron su experiencia con este dispositivo en 11 pacientes de alto riesgo y reportaron un éxito del dispositivo del 100% y un índice precoz de seguridad del 91% según los criterios del VARC-235.
Puntos clave: TAVI para el tratamiento de la IA pura
El uso de TAVI para el tratamiento de la IA nativa pura con dispositivos de primera generación se asocia a índices relativamente altos de complicaciones durante la intervención. El desarrollo de dispositivos de última generación mejoró los resultados de la intervención con índices más bajos de necesidad de segundo implante valvular57 o IA posoperatoria significativa (≥ grado 2)57,64. No obstante, estudios publicados recientemente57 demuestran que un descenso significativo del grado de IA no basta ya que la IA posoperatoria ≥ 2 se asocia a índices más altos de rehospitalización y mortalidad por cualquier causa. Esto indica que todavía falta mucho hasta llegar al nivel de evidencia disponible en la actualidad para TAVI en el tratamiento de pacientes con EAo. Necesitamos nuevos dispositivos sobre la fisiopatología de la IA pero, de momento, el TAVI debería reservarse solo para casos seleccionados de IA no calcificada y tras valoración clínica y por imágenes.
TAVI para el tratamiento de la disfunción grave de la prótesis valvular tras EI curada
Importancia de la EI en la actualidad
La EI afecta entre 1 y 10 casos por cada 100.000 individuos cada año78,79. La detección, abordaje y tratamiento han ido mejorando paulatinamente durante los últimos años, aunque se ha descrito un aumento concomitante en su incidencia80,81. Además, los índices de mortalidad y complicaciones se mantienen estables81. El aspecto amenazante para la vida de esta entidad es evidente en sus índices de mortalidad (entre el 15 y el 30%) dependiendo de las condiciones basales del paciente, el organismo causante y la presencia de complicaciones tales como eventos cerebrovasculares78. Aproximadamente, la mitad de los pacientes afectados por EI necesitan cirugía cardiaca para tratar la infección o las complicaciones asociadas. No obstante, muchos pacientes con una indicación para cirugía por presentar lesiones valvulares residuales no son aptos para la misma por ser sujetos de alto riesgo quirúrgico. Cuando la válvula aórtica está dañada, TAVI podría ser una opción terapéutica a tener en cuenta a pesar de la actual contraindicación que señalan las guías por el riesgo de reinfección. No obstante, la válvula dañada sí puede tratarse mediante TAVI tras resolver la infección78.
Experiencia con TAVI en el marco de una EI curada con daños residuales en la válvula protésica
Hay muy pocos casos descritos en la literatura médica sobre el uso de TAVI después de una EI. En 2013, Albu et al.82 describieron el primer caso de una estenosis grave de homoinjerto aórtico asociada a un EI curada y tratada, con éxito, con un TAVI autoexpandible. En 2015, Nguyen et al.83 describieron el primer caso de una intervención válvula en válvula para tratar una EI curada en un paciente tratado con TAVI dentro de una válvula bioprotésica quirúrgica. Ambos casos dieron buenos resultados clínicos en el seguimiento a medio plazo (6 y 12 meses, respectivamente). No hay series más extensas que confirmen los buenos resultados de TAVI en EI curadas que hayan dejado válvulas disfuncionantes. No obstante, en un subanálisis de su registro a largo plazo de tratamiento quirúrgico en pacientes con EAo, Pechlivanidis et al.84 sugirieron la posibilidad de usar válvulas transcatéter para el tratamiento de pacientes que habían superado una EI y corrían un riesgo muy alto de ser tratados mediante cirugía convencional.
Evidencias que avalan el uso de TAVI tras una EI curada
Que nosotros sepamos la revisión más completa de posibles candidatos para TAVI tras EI fue el estudio realizado por Garcia-Granja et al.85 Analizaron 182 pacientes tratados con cirugía de la válvula aórtica por EI y buscaron predictores de infección local activa en el momento en que se realizó la intervención mediante cultivos de explantes. Los principales predictores independientes de infección local activa fueron diabetes mellitus, Staphylococcus aureus y válvula mitral comprometida concomitante. En cambio, intervalos entre el diagnóstico y la intervención de más de 9 días fueron predictivos de infección curada. Sin criterios predisponentes para infección activa, el riesgo de cultivos positivos en el tejido explantado fue ~3%. Este estudio generador de hipótesis avala el uso de TAVI en casos seleccionados con infecciones curadas, pero también con daño valvular residual, alto riesgo quirúrgico y ausencia de criterios predisponentes para infección local activa.
Puntos clave: uso de TAVI tras EI curada
En pacientes no aptos para cirugía pero con riesgo bajo de infección local según el «equipo EI», TAVI puede ser una opción a tener en cuenta para tratar los daños residuales de la válvula aórtica. No obstante, necesitamos más evidencias a este respecto antes de descartar la actual contraindicación de TAVI en este marco.
CONCLUSIONES
Aunque puede ser algo controvertido, hay un interés cada vez mayor por los usos off-label de los dispositivos TAVI para resolver diferentes escenarios clínicos no cubiertos. No obstante, el nivel de evidencia es variable en todas estas indicaciones y todavía harán falta avances tecnológicos y ensayos clínicos controlados. Aunque un gran número de estudios avalan el uso de TAVI en pacientes con EAo bicúspide o degeneración de una válvula bioprotésica quirúrgica anterior, la indicación para el tratamiento de la IA nativa pura o EI curada con disfunción residual de la válvula aórtica sigue siendo, al menos de momento, objeto de debate como último recurso.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
2. Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis:first human case description. Circulation. 2002;106:3006-3008
3. Leon MB, Smith CR, Mack M, et al.;PARTNER Trial Investigators. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
4. Arnold SV, Reynolds MR, Wang K, et al. Health status after transcatheter or surgical aortic valve replacement in patients with severe aortic stenosis at increased surgical risk:results from the CoreValve US pivotal trial. JACC Cardiovasc Interv. 2015;8:1207-1217.
5. Reardon MJ, Van Mieghem NM, Popma JJ, et al., for the SURTAVI Investigators. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376:1321-1231.
6. Leon MB, Smith CR, Mack MJ, et al., for the PARTNER 2 Investigators. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374:1609-1220.
7. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Eng J Med. 2019;380:1695-1705.
8. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. N Engl J Med. 2019;380:1706-1715.
9. Guedeney P, Mehran R. Non-femoral TAVR:Time to stratify alternative vascular approaches. Catheter Cardiovasc Interv. 2018;92:1194-1195.
10. Overtchouk P, Folliguet T, Pinaud F, et al. Transcarotid Approach for Transcatheter Aortic Valve Replacement With the SAPIEN 3 Prosthesis: A Multicenter French Registry. JACC Cardiovasc Interv. 2019;12:413-419.
11. Amat-Santos IJ, Rojas P, Gutiérrez H, et al. Transubclavian approach: A competitive access for transcatheter aortic valve implantation as compared to transfemoral. Catheter Cardiovasc Interv. 2018;92:935-944.
12. Michelena HI, Desjardins VA, Avierinos JF, et al. Natural history of asymptomatic patients with normally functioning or minimally dysfunctional bicuspid aortic valve in the community. Circulation. 2008;117:2776-2784.
13. Roberts WC, Janning KG, Ko JM, Filardo G, Matter GJ. Frequency of congenitally bicuspid aortic valves in patients ≥80 years of age undergoing aortic valve replacement for aortic stenosis (with or without aortic re-gurgitation) and implications for transcatheter aortic valve implantation. Am J Cardiol. 2012;109:1632e1636.
14. Watkins C, Gupta A, Griffith BP. Preoperative imaging. In:Transcatheter Aortic Valve Replacement A How-to Guide for Cardiologists and Cardiac Surgeons. Watkins C, Gupta A, Griffith BP, eds. 1st ed. Springer;2018. 40-41.
15. Buellesfeld L, Stortecky S, Kalesan B, et al. Aortic root dimensions among patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2013;1:72-83.
16. Costopoulos C, Latib A, Maisano F, et al. Comparison of results of transcatheter aortic valve implantation in patients with severely stenotic bicuspid versus tricuspid or nonbicuspid valves. Am J Cardiol. 2014;113:1390-1393.
17. Hayashida K, Bouvier E, Lefèvre T, et al. Transcatheter aortic valve implantation for patients with severe bicuspid aortic valve stenosis. Circ Cardiovasc Interv. 2013;6:284-291.
18. Bauer T, Linke A, Sievert H, et al. Comparison of the effectiveness of transcatheter aortic valve implantation in patients with stenotic bicuspid versus tricuspid aortic valves (from the German TAVI Registry). Am J Cardiol.2014;113:518-521.
19. Kochman J, Huczek Z, Scisło P, et al. Comparison of one- and 12-month outcomes of transcatheter aortic valve replacement in patients with severely stenotic bicuspid versus tricuspid aortic valves (results from a multicenter registry). Am J Cardiol. 2014;114:757-762.
20. Liu XB, Jiang JB, Zhou QJ, et al. Evaluation of the safety and efficacy of transcatheter aortic valve implantation in patients with a severe stenotic bicuspid aortic valve in a Chinese population. J Zhejiang Univ Sci B. 2015;16:208-214.
21. Sannino A, Cedars A, Stoler RC, Szerlip M, Mack MJ, Grayburn PA. Comparison of efficacy and safety of transcatheter aortic valve implantation in patients with bicuspid versus tricuspid aortic valves. Am J Cardiol. 2017;120:1601-1606.
22. Yoon SH, Bleiziffer S, De Backer, O et al. Outcomes in transcatheter aortic valve replacement for bicuspid versus tricuspid aortic valve stenosis. J Am Coll Cardiol. 2017;69:2579-2589.
23. Arai T, Lefèvre T, Hovasse T, et al. The feasibility of transcatheter aortic valve implantation using the Edwards SAPIEN 3 for patients with severe bicuspid aortic stenosis. J Cardiol. 2017;70:220-224.
24. Liao YB, Li YJ, Xiong TY, et al. Comparison of procedural, clinical and valve performance results of transcatheter aortic valve replacement in patients with bicuspid versus tricuspid aortic stenosis. Int J Cardiol. 2018;254:69-74.
25. De Biase C, Mastrokostopoulos A, Philippart R, et al. Aortic valve anatomy and outcomes after transcatheter aortic valve implantation in bicuspid aortic valves. Int J Cardiol. 2018;266:56-60.
26. Xiong TY, Wang X, Li YJ, et al. Less pronounced reverse left ventricular remodeling in patients with bicuspid aortic stenosis treated with transcatheter aortic valve replacement compared to tricuspid aortic stenosis. Int J Cardiovasc Imaging. 2018;34:1761-1767.
27. Kawamori H, Yoon SH, Chakravarty T, et al. Computed tomography characteristics of the aortic valve and the geometry of SAPIEN 3 transcatheter heart valve in patients with bicuspid aortic valve disease. Eur Heart J Cardiovasc Imaging. 2018;19:1408-1418.
28. Makkar RR, Yoon SH, Leon MB, et al. Association Between Transcatheter Aortic Valve Replacement for Bicuspid vs Tricuspid Aortic Stenosis and Mortality or Stroke. JAMA. 2019;321:2193-2202.
29. Quintana RA, Monlezun DJ, DaSilva-DeAbreu A, et al. One- Year Mortality in Patients Undergoing Transcatheter Aortic valve Replacement for Stenotic Bicuspid versus Tricuspid Aortic Valves:A Meta-Analysis and Meta- Regression. J Interv Cardiol. 2019;2019:8947204.
30. Takagi H, Hari Y, Kawai N, et al. Meta-analysis of transcatheter aortic valve implantation for bicuspid versus tricuspid aortic valves. J Cardiovasc Med. 2019;20:237-244.
31. Elbadawi A, Saad M, Elgendy IY, et al. Temporal Trends and Outcomes of Transcatheter Versus Surgical Aortic Valve Replacement for Bicuspid Aortic Valve Stenosis. JACC Cardiovasc Interv. 2019;12:1811-1822.
32. Dvir D, Bourguignon T, Otto CM, et al. Standardized definition of structural valve degeneration for surgical and transcatheter bioprosthetic aortic valves. Circulation. 2018;137:388-399.
33. Paradis JM, Del Trigo M, Puri R, Rodés-Cabau J. Transcatheter valve-in-valve and valve-in-ring for treating aortic and mitral surgical prosthetic dysfunction. J Am Coll Cardiol. 2015;66:2019-2037.
34. Rodriguez-Gabella T, Voisine P, Puri R, et al. Aortic bioprosthetic valve durability. J Am Coll Cardiol. 2017;70:1013-1028.
35. Kappetein AJ, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation:The Valve Academic Research Consortium-2 consensus document. J Thorac Cardiovasc Surg. 2013;145:6-23.
36. Walther T, Falk V, Dewey T, et al. Valve-in-a- valve concept for transcatheter minimally invasive repeat xenograft implantation. J Am Coll Cardiol. 2007;50:56-60.
37. Eggebrecht H, Schäfer U, Treede H, et al. Valve-in-valve transcatheter aortic valve implantation for degenerated bioprosthetic heart valves. JACC Cardiovasc Interv. 2011;4:1218-1227.
38. Bedogni F, Laudisa ML, Pizzocri S, et al. Transcatheter valve-in-valve implantation using Corevalve Revalving System for failed surgical aortic bioprostheses. JACC Cardiovasc Interv. 2011;4:1228-1234.
39. Bapat V, Attia R, Redwood S, et al. Use of transcatheter heart valves for a valve-in- valve implantation in patients with degenerated aortic bioprosthesis:technical considerations and results. J Thorac Cardiovasc Surg. 2012;144:1372-1379.
40. Linke A, Woitek F, Merx MW, et al. Valve- in-valve implantation of Medtronic CoreValve prosthesis in patients with failing bioprosthetic aortic valves. Circ Cardiovasc Interv. 2012;5:689-697.
41. Dvir D, Webb JG, Brecker, et al. Transcatheter Aortic Valve Replacement for Degenerative Bioprosthetic Surgical Valves:Results From the Global Valve-in-Valve Registry. Circulation. 2012;126:2335-2344.
42. Dvir D, Webb JG, Bleiziffer S, et al. Transcatheter aortic valve implantation in failed bioprosthetic surgical valves. JAMA. 2014;312:162-170.
43. Ihlberg L, Nissen H, Nielsen NE, et al. Early clinical outcome of aortic transcatheter valve- in-valve implantation in the Nordic countries. J Thorac Cardiovasc Surg. 2013;146:1047-1054.
44. Camboni D, Holzamer A, Flörchinger B, et al. Single institution experience with transcatheter valve-in-valve implantation emphasizing strategies for coronary protection. Ann Thorac Surg. 2015;99:1532-1538.
45. Webb JG, Mack MJ, White JM, et al. Transcatheter Aortic Valve Implantation Within Degenerated Aortic Surgical Bioprostheses:PARTNER 2 Valve-in-Valve Registry. J Am Coll Cardiol. 2017;69:2253-2262.
46. Zenses AS, Dahou A, Salaun E, et al. Haemodynamic outcomes following aortic valve- in-valve procedure. Open Heart. 2018;5:e000854.
47. de Freitas Campos Guimaraes, Urena M, Wijeysundera HC, et al. Long-Term Outcomes After Transcatheter Aortic Valve-in-Valve Replacement. Circ Cardiovasc Interv. 2018;11:e007038.
48. Tuzcu EM, Kapadia SR, Vemulapalli S, et al. Transcatheter Aortic Valve Replacement of Failed Surgically Implanted Bioprostheses:The STS/ACC Registry. J Am Coll Cardiol. 2018;72:370-382.
49. Holzamer A, Kim WK, Andreas Rück, et al. Valve-in-Valve Implantation Using the ACURATE Neo in Degenerated Aortic Bioprostheses. An International Multicenter Analysis. JACC Cardiovasc Interv. 2019;12:2309-2316.
50. Amat-Santos IJ, Gutiérrez H, Sathananthan J, Webb JG. Fracture of small Mitroflow aortic bioprosthesis following valve-in-valve transcatheter aortic valve replacement with ACURATE neo valve valve –From bench testing to clinical practice. Catheter Cardiovasc Interv. 2019;10:e005216.
51. Khan JM, Dvir D, Greenbaum AB, et al. Transcatheter laceration of aortic leaflets to prevent coronary obstruction during transcatheter aortic valve replacement:concept to first-in-human. JACC Cardiovasc Interv. 2018;11:677-89.
52. Salaun E, Zenses AS, Clavel MA, et al. Valve-in-Valve Procedure in Failed Transcatheter Aortic Valves. JACC Cardiovasc Imaging. 2019;12:198-202.
53. Barbanti M, Webb JG, Tamburino C, et al. Outcomes of redo transcatheter aortic valve replacement for the treatment of postprocedural and late occurrence of paravalvular regurgitation and transcatheter valve failure. Circ Cardiovasc Interv. 2016;9:e003930.
54. Franzone A, Piccolo R, Siontis GCM, et al. Transcatheter aortic valve replacement for the treatment of pure native aortic valve regurgitation:a systematic review. JACC Cardiovasc Interv. 2016;9:2308-2317.
55. Roy DA, Schaefer U, Guetta V, et al. Transcatheter aortic valve implantation for pure severe native aortic valve regurgitation. J Am Coll Cardiol. 2013;61:1577-1584.
56. Hira RS, Vemulapalli S, Li Z, et al. Trends and outcomes of off-label use of transcatheter aortic valve replacement:insights from the NCDR STS/ACC TVT registry. JAMA Cardiol. 2017;2:846-854.
57. Yoon SH, Schmidt T, Bleiziffer S, et al. Transcatheter aortic valve replacement in pure native aortic valve regurgitation. J Am Coll Cardiol. 2017;70:2752-2763.
58. Seiffert M, Bader R, Kappert U, et al. Initial German experience with transapical implantation of a second-generation transcatheter heart valve for the treatment of aortic regurgitation. JACC Cardiovasc Interv. 2014;7:1168-1174.
59. Testa L, Latib A, Rossi ML, et al. CoreValve implantation for severe aortic regurgitation:a multicentre registry. EuroIntervention. 2014;10:739-745.
60. Frerker C, Schewe lJ, Schewel D, et al. Expansion of the indication of transcatheter aortic valve implantation —feasibility and outcome in “off-label“patients compared with “on-label“patients. J Invasive Cardiol. 2015;27:229-236.
61. Zhu D, Wei L, Cheung A, et al. Treatment of pure aortic regurgitation using a second-generation transcatheter aortic valve implantation system. J Am Coll Cardiol. 2016;67:2803-2805.
62. Sawaya FJ, Deutsch MA, Seiffert M, et al. Safety and efficacy of transcatheter aortic valve replacement in the treatment of pure aortic regurgitation in native valves and failing surgical bioprostheses:results from an international registry study. JACC Cardiovasc Interv. 2017;10:1048-1056.
63. Liu H, Yang Y, Wang W, et al. Transapical transcatheter aortic valve replacement for aortic regurgitation with a second-generation heart valve. J Thorac Cardiovasc Surg. 2018;156:106-116.
64. De Backer O, Pilgrim T, Simonato M, et al. Usefulness of transcatheter aortic valve implantation for treatment of pure native aortic valve regurgitation. Am J Cardiol. 2018;122:1028-1035.
65. Silaschi M, Conradi L, Wendler O, et al. The JUPITER registry:one-year outcomes of transapical aortic valve implantation using a second generation transcatheter heart valve for aortic regurgitation. Catheter Cardiovasc Interv. 2018;91:1345-1351.
66. Takagi H, Hari Y, Kawai N, Ando T;ALICE (All-Literature Investigation of Cardiovascular Evidence) Group. Meta-Analysis and Meta-Regression of Transcatheter Aortic Valve Implantation for Pure Native Aortic Regurgitation. Heart Lung Circ. 2019. https://doi.org/10.1016/j.hlc.2019.04.012.
67. Rossi ML, Barbaro C, Pagnotta P, Lucarelli C, Mennuni M, Presbitero P. Transcatheter aortic valve implantation in patients with pure severe native aortic regurgitation:results after 3 year of follow-up [abstract]. J Am Coll Cardiol. 2014;64(Suppl B):B220-B221.
68. Munoz-Garcia E, Munoz-Garcia M, Munoz- Garcia AJ, et al. Safety of transcatheter aortic valve implantation in patients with pure native aortic valve regurgitation [abstract]. Eur Heart J. 2015;36(Supl 1):793.
69. Seiffert M, Diemert P, Koschyk D, et al. Transapical implantation of a second-generation transcatheter heart valve in patients with noncalcified aortic regurgitation. JACC Cardiovasc Interv. 2013;6:590-597.
70. Cabasa AS, Eleid MF, Suri RM. Transcatheter aortic valve replacement for native aortic valve regurgitation as bridge to liver transplantation. Catheter Cardiovasc Interv. 2016;88:665-670.
71. Nakamura Y, Teefy P, Kiaii B, et al. Transcatheter aortic valve implantation in a patient with severe aortic insufficiency and minimal aortic annular calcification. Can J Cardiol. 2013;29:1138.e9-11.
72. Hildebrandt HA, Erbel R, Kahlert P. Compas- sionate use of the self-expandable Medtronic CoreValve prosthesis for the treatment of pure aortic regurgitation in a patient at prohibitive risk for surgical valve replacement. Catheter Cardiovasc Interv. 2013;82:E939-943.
73. Stachon P, Kaier K, Heidt T, et al. Nationwide outcomes of aortic valve replacement for pure aortic regurgitation in Germany 2008-2015. Catheter Cardiovasc Interv. 2019. https://doi.org/10.1002/ccd.28361.
74. Dumonteil N, Marcheix B, Lairez O, Laborde JC. Transcatheter aortic valve implantation for severe, non-calcified aortic regurgitation and narrow aortic root:description from a case report of a new approach to potentially avoid coronary artery obstruction. Catheter Cardiovasc Interv. 2013;82:E124-127.
75. Seiffert M, Diemert P, Koschyk D, et al. Transapical implantation of a second-generation transcatheter heart valve in patients with non- calcified aortic regurgitation. JACC Cardiovasc Interv. 2013;6:590-597.
76. Zhu D, Hu J, Meng W, Guo Y. Successful transcatheter aortic valve implantation for pure aortic regurgitation using a new second generation self-expanding J-Valve™system –the first-in-man implantation. Heart Lung Circ. 2015;24:411-414.
77. Schofer J, Nietlispach F, Bijuklic K, et al. Transfemoral implantation of a fully reposition- able and retrievable transcatheter valve for non- calcified pure aortic regurgitation. JACC Cardiovasc Interv. 2015;8:1842-1849.
78. Habib G, Lancellotti P, Antunes MJ, et al. ESC Guidelines for the management of infective endocarditis:The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Eur Heart J. 2015;36:3075-3128.
79. Fernández-Hidalgo N, Tornos Mas P. Epidemiology of Infective Endocarditis in Spain in the Last 20 Years. Rev Esp Cardiol. 2013;66:728-733.
80. Pant S, Patel NJ, Deshmukh A, et al. Trends in Infective Endocarditis Incidence, Microbiology, and Valve Replacement in the United States From 2000 to 2011. J Am Coll Cardiol. 2015;65:2070-2076.
81. Dayer MJ, Jones S, Prendergast B, Baddour LM, Lockhart PB, Thornhill MH. Incidence of infective endocarditis in England, 2000-13:a secular trend, interrupted time-series analysis. Lancet. 2015;385:1219-1228.
82. Albu C, Swaans MJ, ten Berg JM. With the back against the wall:TAVI in a patient with endocarditis. Catheter Cardiovasc Interv. 2013;82:E595-E597.
83. Nguyen C, Cheong AP, Himbert D. Valve-in-valve-in-valve:Treating endocarditis of a transcatheter heart valve. Catheter Cardiovasc Interv. 2015;86:E200-E204.
84. Pechlivanidis K, Onorati F, Petrilli G, et al. In which patients is transcatheter aortic valve replacement potentially better indicated than surgery for redo aortic valve disease?Long-term results of a 10-year surgical experience. J Thorac Cardiovasc Surg. 2014;148:500-508.
85. García-Granja PE, Amat-Santos IJ, Vilacosta I, Olmos C, Gómez I, San Román Calvar JA. Predictors of Sterile Aortic Valve Following Aortic Infective Endocarditis. Preliminary Analysis of Potential Candidates for TAVI. Rev Esp Cardiol. 2019;72:428-430.
- Opciones actuales para el tratamiento de las lesiones calcificadas
- Actualización del intervencionismo percutáneo en la oclusión total crónica
- Revascularización percutánea de las lesiones en bifurcación
- Tratamiento antitrombótico tras revascularización percutánea en pacientes con indicación crónica de anticoagulación oral