RESUMEN
La cardiopatía isquémica es la causa más común de mortalidad en todo el mundo. En pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST), la optimización de la intervención coronaria percutánea primaria es crucial para mejorar el pronóstico. Durante estos últimos años se han publicado muchos estudios sobre el valor de los stents de segunda generación, sobre estrategias para reducir el daño miocárdico, sobre cómo conseguir la revascularización completa y sobre dispositivos de apoyo circulatorio mecánico percutáneo que representan una opción terapéutica atractiva en pacientes con IAMCEST complicado con shock cardiogénico. En esta revisión se discute cómo se puede optimizar la intervención coronaria percutánea primaria con respecto a la selección de los stents y la estrategia de revascularización, con el fin de reducir el daño miocárdico y mejorar los resultados clínicos. Además, se revisan los datos publicados sobre el uso de dispositivos de apoyo circulatorio mecánico en pacientes con IAMCEST complicado por shock cardiogénico.
Palabras clave: Infarto de miocardio con elevación del segmento ST. Intervención coronaria percutánea. Stent farmacoactivo. Shock cardiogénico.
ABSTRACT
Ischemic heart disease is the most common cause of death worldwide. In patients with ST-segment elevation myocardial infarction (STEMI), optimizing primary percutaneous coronary intervention is crucial to improve prognosis. Over the years, many studies have been published on the value of second-generation stents, strategies to reduce myocardial damage, how to achieve complete revascularization and also on percutaneous mechanical circulatory support devices, which all are attractive therapeutic options to treat patients with STEMI complicated by cardiogenic shock. In this review we will be discussing how primary percutaneous coronary intervention can be optimized with respect to stent selection and revascularization strategy to reduce myocardial damage and improve clinical outcomes. In addition, we review published data on the use of mechanical circulatory support devices in patients with STEMI complicated by cardiogenic shock.
Keywords: ST-segment elevation myocardial infarction. Percutaneous coronary intervention. Drug eluting stent. Cardiogenic shock.
Abreviaturas
BIAC: balón intraaórtico de contrapulsación. ECMO-VA: oxigenador extracorpóreo de membrana venoarterial. EMV: enfermedad multivaso. IAMCEST: infarto agudo de miocardio con elevación del segmento ST. ICP: intervención coronaria percutánea. SC: shock cardiogénico. SFA: stent farmacoactivo. VI: ventrículo izquierdo.
INTRODUCCIÓN
La cardiopatía isquémica es la causa más común de muerte en todo el mundo. En las últimas décadas, gracias a las mejoras en la terapia de reperfusión, en la terapia antitrombótica y en la prevención primaria, la incidencia relativa del infarto de miocardio con elevación del segmento ST (IAMCEST), así como su mortalidad aguda y a largo plazo, han disminuido considerablemente1. Sin embargo, a pesar de esta disminución, la mortalidad de los pacientes con IAMCEST sigue siendo sustancial, con una mortalidad hospitalaria reportada que oscila entre el 4 y el 12% y una mortalidad a 1 año de aproximadamente el 10%2-4.
La mortalidad en pacientes con IAMCEST depende de varios factores, como la clase de Killip en el momento de la presentación, la edad avanzada, la presencia de factores de riesgo cardiovascular, la función ventricular izquierda, la extensión de la enfermedad de las arterias coronarias y el retraso en el tratamiento de reperfusión. El diagnóstico precoz y la pronta restauración del flujo sanguíneo del miocardio desde la aparición de los síntomas son esenciales para optimizar el rescate miocárdico y reducir la mortalidad5. La intervención coronaria percutánea (ICP) primaria es la estrategia de reperfusión de elección en los pacientes con IAMCEST cuando se realiza de manera oportuna5. La optimización de la estrategia primaria de reperfusión es crucial para reducir el daño miocárdico y prevenir lesiones de reperfusión.
La finalidad de esta revisión es proporcionar una visión general de los dispositivos percutáneos actuales y futuros que potencialmente mejoran el beneficio de la ICP primaria, incluidos los stents, las estrategias de revascularización y los dispositivos de soporte circulatorio mecánico para IAMCEST complicado con shock cardiogénico (SC), como el balón intraaórtico de contrapulsación (BIAC), el Impella (Abiomed, Danvers, Massachusetts, Estados Unidos), el TandemHeart (Pittsburgh, Pensilvania, Estados Unidos) y el oxigenador extracorpóreo de membrana venoarterial (ECMO-VA).
ASPIRACIÓN DEL TROMBO
El trombo intracoronario se encuentra en la mayoría de los pacientes con IAMCEST. La embolización distal ocurre en el 5-10% de los casos y puede causar obstrucción, con sus consecuentes peores resultados6. Hace tiempo se propuso la técnica de trombectomía como una terapia adjunta para ayudar en la restauración del flujo sanguíneo coronario a nivel epicárdico, reduciendo la probabilidad de embolización distal y pudiendo reducir el fenómeno de no reflow y el tamaño del infarto. Además, podría disminuir la carga del trombo antes de la implantación del stent, y descender así la tasa de complicaciones relacionadas con el stent por su malaposición. La aspiración manual del trombo se recomendó sistemáticamente en la ICP primaria tras la realización de ensayos aleatorizados pequeños y de un metanálisis que mostraron mejoras en la reperfusión y una reducción en la mortalidad de causa cardiaca7-9. Sin embargo, tras la publicación de 2 grandes estudios aleatorizados, que fueron adecuadamente potenciados para detectar la superioridad de la aspiración manual sistemática frente a la ICP, solo se ha producido un cambio en la recomendación5. Tanto el ensayo clínico aleatorizado TOTAL (n = 10.732 pacientes) como el TASTE (n = 7.244 pacientes) no mostraron ninguna diferencia con la trombectomía en cuanto a resultados clínicos, en comparación con la ICP sola10,11. Además, se planteó un problema de seguridad en el ensayo TOTAL relacionado con el aumento del riesgo de ictus en los pacientes tratados con trombectomía frente a los de ICP sola12.
A raíz de estos datos, la aspiración de trombos ya no se recomienda como estrategia sistemática en los pacientes con IAMCEST tratados con ICP primaria. Sin embargo, se podría considerar en aquellos con alta carga de trombo después de la recanalización del vaso. Un subanálisis del ensayo EXAMINATION (n = 1.498) mostró que el uso de trombectomía se asociaba a una mayor tasa de colocación de stent directo, una menor tasa de posdilatación y un menor número de stents implantados con un tamaño de stent más grande13. Sin embargo, el resultado angiográfico optimizado no tuvo ningún impacto en los resultados a largo plazo, ya que no se observaron diferencias en los objetivos clínicos entre los grupos con un seguimiento de 2 años.
ELECCIÓN DEL TIPO DE STENT
El implante de un stent coronario es el tratamiento recomendado durante la ICP primaria en los pacientes con IAMCEST. La implantación directa de stents sin predilatación en lesiones causantes de un IAMCEST puede reducir la embolización de los componentes de la placa, disminuyendo la incidencia del fenómeno de no reflow y aumentando así la perfusión miocárdica14. Esta hipótesis se confirmó en el análisis post hoc del HORIZONS-AMI y en el registro EUROTRANSFER; ambos mostraron una reducción de la mortalidad a 1 año relacionada con el uso de la técnica de stent directo15,16.
También se ha propuesto la implantación diferida del stent tras la restauración del flujo coronario mediante una intervención mecánica minimalista con la finalidad de reducir el riesgo del fenómeno de no reflow17. Varios estudios observacionales mostraron un beneficio, en términos de mejora de la fracción de eyección ventricular izquierda y menor tasa de eventos adversos, con el implante diferido del stent en comparación con la colocación inmediata en pacientes con IAMCEST18,19. Además, en un estudio aleatorizado de prueba de concepto (DEFER-STEMI, n = 411) se comunicó una menor tasa de no reflow con el implante diferido de stent en una población de pacientes con IAMCEST20. Sin embargo, el ensayo DANAMI 3-DEFER aleatorizó a 1.215 pacientes con IAMCEST para recibir un implante de stent diferido o inmediato, y a los 2 años de seguimiento no se encontraron diferencias en el objetivo primario (mortalidad por todas las causas, ingreso hospitalario por insuficiencia cardiaca, infarto recurrente y cualquier revascularización no planeada) entre los grupos de estudio (18 frente a 17%; hazard ratio [HR] = 0,99; intervalo de confianza del 95% [IC95%], 0,76-1,29; p = 0,92)21. Más tarde, el ensayo aleatorizado MIMI (n = 140), en el que se excluyó a los pacientes con alta carga de trombos, y el estudio INNOVATION (n = 114) tampoco mostraron una disminución en el tamaño del infarto ni en la obstrucción microvascular con la estrategia de implante de stent diferido en comparación con el implante inmediato22,23. Finalmente, un metanálisis de ensayos aleatorizados y estudios observacionales no encontró ninguna mejora en las tasas de no reflow, muerte, infarto de miocardio ni revascularización repetida con la estrategia de implante diferido de stent en los pacientes con IAMCEST24. Sorprendentemente, sí se encontró una mejoría en la función del ventrículo izquierdo (VI) a largo plazo. Por todas estas razones, en la actualidad no se recomienda la estrategia de implante de stent diferido en la ICP primaria.
Otro aspecto que considerar en la ICP primaria es qué dispositivo implantar. Muchos ensayos aleatorizados y metanálisis evaluaron la primera generación de stents farmacoactivos (SFA), liberadores de sirolimus o paclitaxel, y mostraron una reducción en la tasa de reestenosis y de revascularización de la lesión diana en comparación con los stents convencionales de metal (BMS, bare metal stents)25-32. Sin embargo, pronto surgieron preocupaciones con respecto a la seguridad debido a un aumento de la tasa de trombosis tardía de los SFA de primera generación33-35.
Para superar este problema se desarrollaron SFA de segunda generación con diferentes fármacos, struts más finos y polímeros duraderos o bioabsorbibles más biocompatibles. En el ensayo COMFORTABLE AMI, 1.161 pacientes con IAMCEST fueron aleatorizados 1:1 para recibir BMS o SFA liberador de biolimus con polímero biodegradable. Tras 1 año de seguimiento, se encontró una tasa más baja de eventos cardiovasculares adversos mayores en el grupo de SFA de biolimus comparado con el de BMS (4,3 frente a 8,7%; HR = 0.49; IC95%, 0,30-0,80; p = 0,044), principalmente por el menor riesgo de infarto de miocardio espontáneo y la revascularización de la lesión diana36. Igualmente, a los 2 años de seguimiento se halló una menor tasa de eventos cardiacos mayores en el grupo con SFA de biolimus (5,8 frente a 11,9%; HR = 0,48; IC95%, 0,31-0,72]; p < 0,001)37. Tanto a 1 como a 2 años de seguimiento, las tasas de trombosis definitiva o probable del stent también fueron más bajas con el SFA, aunque sin significación estadística36,37.
En el estudio EXAMINATION38,39 se aleatorizó a 1.498 pacientes con IAMCEST para recibir un SFA de segunda generación liberador de everolimus (EES, everolimus-eluting stent) o un BMS. Tras 1 año de seguimiento, el EES resultó ser superior al BMS, con unas tasas significativamente más bajas de trombosis definitiva y de trombosis definitiva o probable (0,5 frente a 1,9% y 0,9 frente a 2,5%, respectivamente; p = 0,019 para ambas)38. Además, a los 5 años de seguimiento, en el grupo de EES se redujo significativamente la tasa de mortalidad por todas las causas en comparación con el de BMS (9 frente a 12%; HR = 0,72; IC95%, 0,52-0,10; p = 0,047)39. Por otro lado, en un metanálisis de los ensayos clínicos EXAMINATION y CONFORTABLE-AMI se encontró una reducción significativa del riesgo de trombosis definitiva con el uso del SFA (HR = 0,35; IC95%, 0,16-0,75; p = 0,006) en comparación con el BMS40. Dadas las conclusiones de estos estudios, el SFA es actualmente el dispositivo de elección según las guías de práctica clínica de la Sociedad Europea de Cardiología para el tratamiento del IAMCEST5.
Los investigadores del estudio EXAMINATION han comunicado los resultados del seguimiento a 10 años, que confirman la superioridad de los EES sobre los BMS en cuanto a eventos adversos cardiacos relacionados con el paciente o con el dispositivo. Entre 5 y 10 años de seguimiento, en ambos grupos se encontró una baja incidencia de eventos cardiovasculares adversos relacionados con un fallo del dispositivo41.
Los armazones totalmente bioabsorbibles (BVS, bioresorbable vascular scaffold) se desarrollaron con el objetivo de superar la limitación a largo plazo de la presencia permanente del metal dentro de la arteria coronaria. Los datos sobre su uso en el IAMCEST son limitados. Aunque ya no estén disponibles para uso clínico, creemos que es importante conocer los datos existentes. Las experiencias iniciales con el Absorb BVS (Abbott Vascular, Illinois, Estados Unidos) en el IAMCEST mostraron resultados clínicos tanto positivos como negativos42-44. El ensayo TROFI II aleatorizó a 191 pacientes con IAMCEST para recibir BVS o EES, y no encontró diferencias entre los 2 grupos en términos de cicatrización de la arteria relacionada con el infarto45. Sin embargo, en otros estudios surgieron preocupaciones por la alta tasa de trombosis con el dispositivo BVS. En el estudio BVS EXAMINATION se compararon la eficacia y la seguridad de los BVS frente a los EES en pacientes con IAMCEST, y a 1 y 2 años de seguimiento no se encontraron diferencias entre los grupos en la variable compuesta orientada al dispositivo46,47. Cabe destacar que, a 2 años de seguimiento, la tasa de trombosis definitiva tendió a ser más alta en el grupo de BVS que en el de EES (3,3 frente a 1,0%; p = 0,081). A los 5 años de seguimiento, el riesgo de la variable compuesta orientada al dispositivo fue mayor en el grupo de BVS, lo que sugiere que la probabilidad de obtener resultados favorables en un seguimiento a muy largo plazo es baja48.
Para reducir la tasa de eventos adversos se diseñó el estudio BVS STEMI STRATEGY-IT, que demostró que una estrategia de implantación de BVS preespecificada en pacientes con IAMCEST a quienes se había realizado una ICP primaria era factible y proporcionaba buenos resultados clínicos a 30 días y al año (tasa de trombosis del dispositivo: 0,2 y 0,4%, respectivamente)49,50.
Cabe destacar que los resultados a largo plazo de los ensayos aleatorizados en los que se demostró una incidencia significativamente mayor de trombosis con el BVS fueron el motivo de su retirada del mercado51-53.
El Magmaris (Biotronik, Bülach, Suiza) es un stent de magnesio absorbible liberador de sirolimus. Inicialmente ha mostrado resultados prometedores a 1 año de seguimiento en pacientes estables, con datos muy limitados sobre el IAMCEST54. El estudio MAGSTEMI es el único ensayo clínico aleatorizado que ha comparado la eficacia y la seguridad del Magmaris en pacientes con IAMCEST55. En dicho estudio se aleatorizaron 150 pacientes para ser tratados con ICP primaria con Magmaris o con stents liberadores de sirolimus utilizando una técnica de implantación preespecificada. En comparación con el stent liberador de sirolimus, el Magmaris demostró una mayor capacidad de respuesta vasomotora a los agentes farmacológicos (ya fueran independientes o dependientes del endotelio) a 1 año de seguimiento. Sin embargo, el Magmaris se asoció con una menor eficacia angiográfica y con una mayor tasa de reestenosis clínica, aunque sin problemas en cuanto a trombosis56. En el subestudio preespecificado MAGSTEMI-tomografía de coherencia óptica, tanto con el Magmaris como con el stent liberador de sirolimus se observó un bajo grado de curación de la neoíntima, pero las dimensiones de la luz fueron menores con el Magmaris a 1 año de seguimiento. Aunque el estado avanzado de biorresorción del Magmaris dificulta la evaluación del colapso del andamio, este parece ser el principal mecanismo de reestenosis57,58. También se han comunicado casos en los cuales la reabsorción del Magmaris se ha retrasado de manera significativa y se han encontrado restos intraluminales del andamio tras más de 2 años desde su implantación59.
ENFERMEDAD CORONARIA MULTIVASO
Aproximadamente el 50% de los pacientes con IAMCEST presentan enfermedad multivaso (EMV)60. Numerosos ensayos clínicos han evaluado cuál es la mejor estrategia de revascularización: tratamiento únicamente de la lesión causante o revascularización completa. El ensayo PRAMI aleatorizó a 465 pacientes con IAMCEST con EMV para recibir tratamiento solo de la lesión causante o revascularización de todas las lesiones obstructivas (estenosis angiográfica > 50%) durante el procedimiento índice. La revascularización completa en el momento del procedimiento índice se asoció a una reducción del riesgo relativo del 65% en el objetivo primario (muerte cardiaca, infarto o angina refractaria) en comparación con el tratamiento solo de la lesión culpable61. Del mismo modo, el ensayo CvLPRIT (n = 269) mostró que la revascularización completa (estenosis angiográfica > 70% ) durante la hospitalización índice fue superior a la ICP únicamente de la lesión culpable del infarto en la variable resultado compuesta de muerte, reinfarto, insuficiencia cardiaca y revascularización repetida, a los 12 meses de seguimiento62.
Se ha propuesto la medición de la reserva fraccional de flujo coronario para guiar la necesidad de revascularización de lesiones no culpables. El ensayo DANAMI-3-PRIMULTI (n = 627) mostró que la revascularización completa guiada por la reserva fraccional de flujo redujo significativamente el riesgo de eventos adversos cardiacos futuros en comparación con ninguna otra intervención invasiva después de la ICP primaria. Este efecto se debe a un número significativamente menor de revascularizaciones repetidas, porque la mortalidad por todas las causas y el reinfarto no mortal no difirieron entre los grupos63. Además, el ensayo Compare-Acute (n = 885) mostró que la revascularización completa guiada por la reserva fraccional de flujo durante el procedimiento índice redujo de manera significativa la incidencia de eventos adversos cardiacos64.
El ensayo clínico COMPLETE incluyó 4.041 pacientes que fueron aleatorizados para revascularización completa o tratamiento solo de la lesión causante, y que fueron seguidos durante 3 años. La revascularización completa fue superior a la ICP únicamente de la lesión causante para reducir el riesgo de muerte de causa cardiovascular o de infarto de miocardio, así como el riesgo de muerte de causa cardiovascular, de infarto de miocardio o de revascularización inducida por isquemia65. Actualmente, el estudio BioVasc (NCT03621501) está investigando cómo perfeccionar el algoritmo de tratamiento para los pacientes con síndrome coronario agudo y EMV en cuanto al momento óptimo para la revascularización completa, inmediata frente a diferida66.
De acuerdo con las guías de la Sociedad Europea de Cardiología, durante la hospitalización, antes del alta hospitalaria, se debe considerar la revascularización completa de las lesiones no culpables en los pacientes con IAMCEST y EMV5. Sin embargo, es probable que esta indicación cambie tras la publicación de los resultados del estudio COMPLETE.
En el caso específico de los pacientes con IAMCEST y SC, el ensayo CULPRIT-SHOCK aleatorizó a 1.075 pacientes con IAMCEST complicados por SC con EMV para ser tratados con ICP sobre la arteria relacionada con el infarto o con ICP multivaso de todas las lesiones (estenosis angiográfica > 70%). Tanto a los 30 días como a 1 año de seguimiento, se encontró que la ICP únicamente de la lesión culpable redujo de manera significativa el riesgo de muerte o de terapia de reemplazo renal67,68. La diferencia fue impulsada en especial por una mortalidad significativamente menor. En este sentido, la Sociedad Europea de Cardiología ha publicado una actualización de la guía de IAMCEST en la que, en caso de IAMCEST con SC y EMV, se recomienda el tratamiento solo de la lesión causante del evento agudo69.
SHOCK CARDIOGÉNICO
Alrededor del 5-8% de los pacientes con un IAMCEST también presentan SC, que se define como hipotensión persistente (presión sistólica < 90 mmHg) con signos de hipoperfusión periférica. El SC es una de las principales causas de muerte, con unas tasas de mortalidad intrahospitalaria que pueden superar el 50%70. En los pacientes con SC refractario al tratamiento farmacológico, el soporte circulatorio mecánico percutáneo puede reducir el trabajo del VI y la demanda de oxígeno, mantener la perfusión de los órganos y de las coronarias, y servir de puente a una terapia definitiva71,72. Actualmente existen dispositivos de asistencia del VI a la aorta (BIAC e Impella), de la aurícula izquierda a la circulación arterial sistémica (TandemHeart) y de la aurícula derecha a la circulación arterial sistémica (ECMO-VA). Las características técnicas de los dispositivos de soporte circulatorio mecánico percutáneo actualmente disponibles se detallan en la tabla 1.
Tabla 1. Características técnicas de los dispositivos de soporte circulatorio mecánico percutáneo disponibles
| BIAC | Impella | TandemHeart | ECMO-VA | |
|---|---|---|---|---|
| Efecto hemodinámico | Descarga de presión y volumen del VI | Descarga de presión y volumen del VI | Descarga de volumen del VI | Descarga de presión y volumen del VD y del VI |
| Mecanismo | Aorta | VI a aorta | AI a aorta | AD a aorta |
| Flujo cardiaco | 0,3-0,5 l/min | 1-5 l/min | 2,5-5 l/min | 3,0-7,0 l/min |
| Resistencias periféricas | ↓ | ↓ | ↑ | ↑↑↑ |
| Tamaño | 8 Fr | 13-22 Fr | 21 Fr de entrada y 15-17 Fr de salida | 18-21 Fr de entrada y 15-22 Fr de salida |
| Complejidad de la implantación | Baja | Moderada con Impella 2,5 Alta con Impella 5,0 | Alta | Alta |
| Duración recomendada del uso | Semanas | 7 días | 14 días | 7 días |
| Contraindicaciones | Insuficiencia aórtica grave Disección aórtica Vasculopatía periférica grave | Valvulopatía aórtica grave Válvula mecánica aórtica Trombo en el VI Vasculopatía periférica grave Contraindicación para la anticoagulación | Vasculopatía periférica grave Trombo en la AI Contraindicación para la anticoagulación Insuficiencia aórtica moderada a grave Defectos del tabique interventricular | Insuficiencia aórtica moderada a grave Vasculopatía periférica grave Contraindicación para la anticoagulación |
| Complicaciones* | Trombocitopenia Trombosis Obstrucción del flujo arterial por incorrecta posición Disección o rotura aórtica Embolia de placa o aire | Hemólisis Migración del dispositivo Lesión o insuficiencia aórtica Perforación o taponamiento del VI Arritmia ventricular | Migración de la cánula Perforación o taponamiento del VI Tromboembolia Embolia aérea durante la inserción de la cánula Desarrollo de derivación interauricular | Trombosis del circuito Hipoxia de la parte superior del cuerpo por oxigenación retrógrada incompleta Dilatación del VI Embolia gaseosa sistémica |
|
* Complicaciones comunes a todos los dispositivos: hemorragia e infecciones relacionadas o no con el sitio de punción, complicación vascular y daño neurológico. AD: aurícula derecha; AI: aurícula izquierda; BIAC: balón de contrapulsación aórtica; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; VD: ventrículo derecho; VI: ventrículo izquierdo. |
||||
Dispositivos de asistencia del ventrículo izquierdo a la aorta
Balón intraaórtico de contrapulsación
El balón intraaórtico de contrapulsación (BIAC) es el dispositivo de soporte mecánico que más se utilizó hasta 2010, pero desde entonces su uso ha disminuido de manera importante tras los resultados de los ensayos clínicos en los que se cuestionó su eficacia73. Requiere un introductor de 8 Fr en la arteria femoral o axilar, y consiste en un globo montado en un catéter que se coloca en la aorta descendente y que se infla durante la diástole y se desinfla durante la sístole. El BIAC aumenta la presión aórtica diastólica, reduce la presión sistólica aórtica, aumenta la presión arterial media sistémica, reduce el volumen y la presión diastólica del VI, y aumenta la presión de perfusión coronaria. Sin embargo, el soporte hemodinámico proporcionado por el BIAC se correlaciona estrictamente con la función del VI, ya que es menos eficaz cuando este presenta una disfunción grave.
Los ensayos observacionales y metanálisis han apoyado históricamente el uso de BIAC en los pacientes con IAMCEST complicado por SC74-76. No obstante, los ensayos aleatorizados prospectivos no demostraron ningún beneficio del tratamiento con BIAC en los pacientes con IAMCEST con o sin SC. El ensayo CRISP AMI (n = 337) mostró que la implantación de un BIAC inmediatamente antes de la ICP para un IAMCEST anterior sin SC no reducía el tamaño del infarto ni mejoraba la supervivencia a corto plazo77. El ensayo TACTICS aleatorizó a 57 pacientes con infarto agudo y posfibrinólisis a 48 horas para ser tratados con BIAC o con terapia médica óptima, y no se hallaron diferencias en la variable de mortalidad a 6 meses78. Además, el ensayo IABP SHOCK6 aleatorizó a 45 pacientes con IAMCEST y SC para recibir implante de BIAC o tratamiento médico habitual, y no se encontraron mejorías hemodinámicas significativas tras el tratamiento adicional con BIAC79.
El ensayo IABP SHOCK II aleatorizó a 600 pacientes con IAMCEST y SC no asociado a complicaciones mecánicas para comparar el implante de BIAC con la terapia médica óptima80. Se esperaba que todos los pacientes se sometieran a una revascularización temprana (predominantemente con ICP) y recibieran la mejor atención médica disponible. A los 30 días, no hubo diferencias con respecto a la mortalidad por todas las causas entre el BIAC y la terapia médica óptima (39,7 frente a 41,3%; riesgo relativo 0,96; IC95%, 0,79-1,17; p = 0,69), y tampoco en la duración de la estancia en la unidad de cuidados intensivos, la función renal, la hemorragia mayor, las complicaciones isquémicas periféricas, la sepsis y el accidente cerebrovascular80. A los 12 meses de seguimiento , seguía sin haber diferencias en cuanto a la mortalidad y los objetivos secundarios81. Un metanálisis de 12 ensayos controlados aleatorizados y 15 estudios observacionales no halló ningún beneficio de la terapia con BIAC en el IAMCEST en la mortalidad a 30 días, independientemente de la presencia (odds ratio [OR] = 0,94; IC95%, 0,69–1,28) o la ausencia (OR = 0,98; IC95%, 0,57-1,69) de SC. En la actualidad, de acuerdo con estos estudios, en la guía de práctica clínica de la Sociedad Europea de Cardiología no se indica el BIAC sistemáticamente en los pacientes con SC5.
Impella
El Impella es una bomba de flujo axial continuo que se coloca en el VI de forma retrógrada a través de la válvula aórtica y proporciona soporte activo mediante la expulsión de sangre succionada del VI en la aorta ascendente, restaurando así el flujo sanguíneo a los órganos isquémicos82. El Impella aumenta la presión arterial media, reduce la presión y el volumen del VI, y aumenta el flujo coronario. El sistema Impella está disponible en 3 tamaños diferentes: 2,5 (salida máxima de 2,5 l/min), 3,7 (Impella CP, salida máxima de 3,7 l/min) y 5,0 (salida máxima de 5 l/min); los dispositivos más pequeños se pueden colocar percutáneamente a través de un introductor de 12-14 Fr, mientras que el dispositivo 5,0 necesita un introductor de 22 Fr82.
Dos grandes registros han demostrado la seguridad del Impella 2,5 en la ICP compleja de alto riesgo83,84. El ensayo ISAR-SHOCK aleatorizó a 26 pacientes con IAMCEST y SC para recibir Impella 2,5 o BIAC. El objetivo, que era el cambio en el índice cardiaco desde el inicio hasta 30 minutos después de la implantación, mejoró significativamente en el grupo de Impella, pero los resultados para los objetivos secundarios, como la acidosis láctica, la hemólisis y la mortalidad después de 30 días, no fueron diferentes entre los 2 grupos85. A 30 días de seguimiento, la mortalidad total de la cohorte fue del 46%. El ensayo IMPRESS in Severe Shock aleatorizó a 48 pacientes con ventilación mecánica asociada a SC después de un IAMCEST para ser tratados con Impella o con BIAC. Cabe destacar que el momento de colocación del dispositivo lo decidía el médico tratante. El ensayo mostró que, en comparación con el BIAC, el Impella no redujo la mortalidad a 30 días, y la mortalidad global a 6 meses fue del 50%86. Tanto las complicaciones vasculares como las hemorragias graves fueron más frecuentes en el grupo de Impella.
Hay que recalcar que, hasta el momento, el dispositivo Impella no se ha comparado con la terapia estándar en los pacientes con SC en un ensayo clínico aleatorizado adecuadamente potenciado en muestra para eventos clínicos relevantes. En este sentido, el ensayo clínico DanGer Shock (NCT01633502) incluirá 360 pacientes con IAMCEST y SC, que serán aleatorizados para recibir soporte circulatorio con Impella o tratamiento médico habitual87. El estudio está aún en fase de inclusión de pacientes y su objetivo principal es la muerte por cualquier causa a los 6 meses de seguimiento.
En 2018 se introdujo un concepto innovador, que fue el uso de Impella para la descarga del VI para disminuir el tamaño del infarto de miocardio en modelos animales de IAMCEST sin SC88. Estos modelos animales llevaron al diseño y la realización del estudio piloto DTU-STEMI, que aleatorizó a 50 pacientes con IAMCEST sin SC para ser tratados con descarga del VI con Impella CP o recibir tratamiento médico óptimo. En este estudio se observó que la terapia de descarga del VI antes de la reperfusión del IAMCEST con Impella fue factible y no se asoció a un retraso importante de la reperfusión del IAMCEST89, aunque el uso de la terapia de descarga no se asoció a una disminución del tamaño del infarto a 1 mes de seguimiento. Actualmente se encuentra en fase de inclusión de pacientes el ensayo clínico DTU-STEMI (NCT03947619), con una muestra prevista de 668 pacientes, que probará la hipótesis del uso de la terapia de descarga del VI con Impella CP para la disminución del tamaño del infarto evaluado con resonancia magnética cardiaca.
Dispositivos de asistencia de la aurícula izquierda a la circulación arterial sistémica
TandemHeart
El TandemHeart es un dispositivo de asistencia extracorpórea que extrae sangre oxigenada de la aurícula izquierda y la bombea a la aorta abdominal inferior o a las arterias ilíacas para evitar pasar por el VI. La cánula de entrada se inserta mediante un acceso de venas femorales de 21 Fr y se avanza a través del tabique interatrial hacia la aurícula izquierda. La cánula arterial de salida oscila entre 15 y 17 Fr, y el sistema puede proporcionar hasta 5 l/min de flujo sanguíneo90. El dispositivo reduce esencialmente la precarga del VI y el volumen de la aurícula izquierda, desplazando la sangre de la aurícula izquierda y reduciendo así el estrés y el trabajo del VI, y por otro lado aumenta la presión arterial media sistémica y la perfusión miocárdica.
Existe poca experiencia en cuanto a registros y estudios con este dispositivo. Thiele et al.91 comunicaron su experiencia con el uso de TandemHeart en 18 pacientes con IAMCEST y SC, en los que el dispositivo proporcionó hasta 4 l/min de gasto cardiaco asistido. Los pacientes mostraron mejoras en el índice cardiaco y en la presión arterial media y la reducción de la arteria pulmonar, la presión capilar pulmonar y las presiones venosas centrales durante una media de 4 días de asistencia. Kar et al.92 publicaron una serie de 117 pacientes con SC tratados con TandemHeart, y el uso de este dispositivo revirtió rápidamente el compromiso hemodinámico terminal observado en los pacientes con IAMCEST con SC refractario al BIAC y al soporte vasopresor. En un ensayo clínico aleatorizado se incluyó a 42 pacientes que fueron tratados con BIAC (n = 14) o con TandemHeart (n = 19). El dispositivo TandemHeart mejoró significativamente los parámetros hemodinámicos, incluso en los pacientes refractarios al BIAC. Sin embargo, la mortalidad fue similar en ambos grupos93. Actualmente no tenemos conocimiento de ensayos clínicos aleatorizados relacionados con esta tecnología.
Dispositivos de la aurícula derecha a la circulación arterial sistémica
Oxigenador extracorpóreo de membrana
El ECMO-VA es un dispositivo de soporte cardiopulmonar que aspira sangre de la vena femoral o de la vena yugular interna a través de una cánula de 21 Fr. Mediante un pulmón de membrana artificial elimina el dióxido de carbono y agrega oxígeno a la sangre venosa, que luego se devuelve al sistema arterial a través de una cánula de salida de 15-22 Fr en la arteria femoral o axilar93. Una de las mayores ventajas del ECMO es que se puede colocar en casi todas partes (en la sala de emergencias, en la sala, en el laboratorio de cateterismo, etc.), ya que es completamente transportable y no se requiere fluoroscopia ni guía de ecocardiografía para una implantación exitosa. El dispositivo proporciona un soporte circulatorio de hasta 7 l/min en los pacientes con insuficiencia circulatoria y respiratoria. Como limitaciones, el sistema ECMO-VA no puede descargar el VI y puede causar un aumento de la poscarga, lo cual se asocia a distensión del VI, empeoramiento de la función del VI, trombo en el VI y edema o hemorragia pulmonar intratable94. Por estas razones se ha propuesto que se combine el ECMO con otros dispositivos, como el BIAC y el Impella, con el objetivo de disminuir las presiones arteriales pulmonares y reducir las dimensiones del VI95,96. En un estudio multicéntrico de cohorte internacional se analizaron 686 pacientes consecutivos con SC (no exclusivamente por IAMCEST) tratados con ECMO. Los pacientes en quienes se realizó una descarga del VI con Impella tuvieron un mejor pronóstico con una menor mortalidad, a pesar de presentar mayores tasas de complicaciones hemorrágicas y vasculares asociadas al sitio del implante97. Otros autores también recomiendan intervenciones como la septostomía auricular percutánea, para permitir la derivación de izquierda a derecha, o la administración de dobutamina para mejorar la contractilidad y disminuir la carga posterior94.
Son contraindicaciones absolutas para la implantación de ECMO la regurgitación aórtica, la disección aórtica, la enfermedad arterial periférica grave y ciertas consideraciones éticas90. La hemorragia activa es una contraindicación relativa, porque el ECMO requiere heparina para la anticoagulación; sin embargo, se ha utilizado sin he- parina en algún caso de alto riesgo, ya que era la única estrategia para salvar la vida del paciente98. Las complicaciones son principalmen- te vasculares, como isquemia de piernas, síndrome compartimental, sangrado mayor, accidente cerebrovascular, embolia aérea e infección significativa90.
A pesar de que el ECMO se utiliza ampliamente en centros experimentados, los datos que apoyan su uso en pacientes con infarto agudo de miocardio complicado por SC provienen en gran parte de pequeñas series de casos de un solo centro. Sheu et al.99 llevaron a cabo un registro observacional retrospectivo de un solo centro para comparar los resultados clínicos de los pacientes con IAMCEST tratados con ICP primaria. Los investigadores consideraron 2 periodos diferentes: 1993-2002 para la cohorte no ECMO y 2002-2009 para la cohorte ECMO. El estudio mostró que la ICP asistida con ECMO mejoró los resultados a 30 días. Sin embargo, la interpretación de estos resultados es difícil debido a las importantes discrepancias en las estrategias de tratamiento entre los grupos. En otro estudio, Muller et al.100 incluyeron 138 pacientes con IAMCEST tratados con ECMO. Desarrollaron una escala de puntuación del riesgo de mortalidad en la unidad de cuidados intensivos, llamada puntuación ENCOURAGE, y las variables asociadas a peor pronóstico fueron la edad > 60 años, el sexo femenino, el índice de masa corporal > 25, la puntuación en la escala de Glasgow < 6, la creatinina y el lactato séricos elevados, y el tiempo de protrombina < 50%. Las tasas de supervivencia a 6 meses y 1 año fueron del 41 y el 38%, respectivamente.
Actualmente se está estudiando el efecto del uso de ECMO-VA sobre la mortalidad de los pacientes con IAMCEST complicado con SC en 3 ensayos clínicos aleatorizados: EUROSHOCK (NCT03813134), ANCHOR (NCT04184635) y ECLS-SHOCK (NCT03637205)101. Además de evaluar la mortalidad, estos estudios serán una oportunidad para investigar la indicación, el modo y el efecto de la descarga del VI102.
CONCLUSIÓN
A pesar de las mejoras en la terapia de reperfusión, la mortalidad de los pacientes con IAMCEST sigue siendo alta. Junto con la terapia farmacológica, la rápida restauración del flujo coronario y la implantación de stents son las estrategias recomendadas (figura 1). No se indica de manera sistemática el uso de tromboaspiración manual debido a la ausencia de beneficio clínico en comparación con la ICP sola. Con respecto a la elección del tipo de dispositivo, los SFA de segunda generación son el tratamiento de elección en los pacientes con IAMCEST que reciben ICP primaria, dado que tienen mejores resultados tanto a corto como largo plazo cuando se comparan con los BMS y los SFA de primera generación. En los pacientes con IAMCEST y EMV, la evidencia actual lleva a que se recomiende la revascularización completa, aunque el mejor momento para realizarla aún es motivo de estudio. Exclusivamente en los pacientes con SC se recomienda la revascularización solo de la lesión relacionada con el infarto. Sin lugar a duda, el escenario clínico en el que no se ha avanzado de forma importante es el de los pacientes con IAMCEST complicado con SC, cuya mortalidad sigue siendo de un 40-50%. En la actualidad están en marcha diversos ensayos clínicos para evaluar el efecto de los dispositivos de asistencia circulatoria, específicamente el Impella y el ECMO-VA, en la mortalidad de estos pacientes.
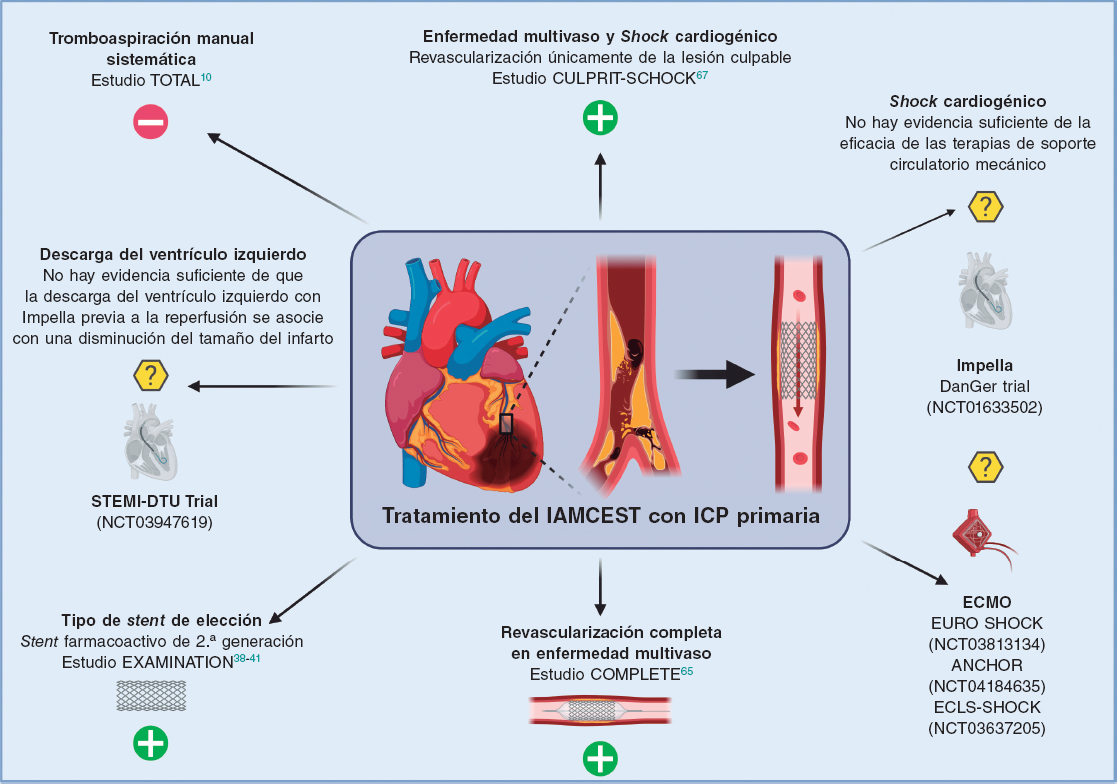
Figura 1. Evidencia actual y perspectivas futuras del intervencionismo percutáneo en el infarto de miocardio con elevación del segmento ST. El símbolo «+»en verde indica que es una intervención recomendada por las guías clínicas de la Sociedad Europea de Cardiología; el símbolo «–» en rojo significa no recomendado; el símbolo «?» en amarillo señala que no hay suficiente evidencia a favor ni en contra para su recomendación. ECMO: oxigenador extracorpóreo de membrana; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
L. Ortega-Paz escribió un borrador de la revisión sobre el estado actual del tratamiento intervencionista del infarto de miocardio. S. Brugaletta y M. Sabaté revisaron críticamente el manuscrito e hi- cieron los cambios oportunos en el contenido y formato del mismo.
CONFLICTO DE INTERESES
M. Sabaté ha realizado labores de consultoría para Abbott Vascular e IVascular sin relación con este trabajo. S. Brugaletta ha realizado labores de consultoría para Boston Scientific e IVascular sin relación con este trabajo. L. Ortega-Paz declara no tener ningún conflicto de intereses.
BIBLIOGRAFÍA
1. Sugiyama T, Hasegawa K, Kobayashi Y, Takahashi O, Fukui T, Tsugawa Y. Differential time trends of outcomes and costs of care for acute myocardial infarction hospitalizations by ST elevation and type of intervention in the United States, 2001-2011. J Am Heart Assoc. 2015;4:e001445.
2. Kristensen SD, Laut KG, Fajadet J, et al. Reperfusion therapy for ST elevation acute myocardial infarction 2010/2011:current status in 37 ESC countries. Eur Heart J. 2014;35:1957-1970.
3. Pedersen F, Butrymovich V, Kelbaek H, et al. Short- and long-term cause of death in patients treated with primary PCI for STEMI. J Am Coll Cardiol. 2014;64:2101-2108.
4. Fokkema ML, James SK, Albertsson P, et al. Population trends in percutaneous coronary intervention:20-year results from the SCAAR (Swedish Coronary Angiography and Angioplasty Registry). J Am Coll Cardiol. 2013;61:1222-1230.
5. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation:The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018;39:119-177.
6. Montalescot G, Barragan P, Wittenberg O, et al. Platelet glycoprotein IIb/IIIa inhibition with coronary stenting for acute myocardial infarction. N Engl J Med. 2001;344:1895-1903.
7. Sardella G, Mancone M, Bucciarelli-Ducci C, et al. Thrombus aspiration during primary percutaneous coronary intervention improves myocardial reperfusion and reduces infarct size:the EXPIRA (thrombectomy with export catheter in infarct-related artery during primary percutaneous coronary intervention) prospective, randomized trial. J Am Coll Cardiol. 2009;53:309-315.
8. Vlaar PJ, Svilaas T, van der Horst IC, et al. Cardiac death and reinfarction after 1 year in the Thrombus Aspiration during Percutaneous coronary intervention in Acute myocardial infarction Study (TAPAS):a 1-year follow-up study. Lancet. 2008;371:1915-1920.
9. Burzotta F, De Vita M, Gu YL, et al. Clinical impact of thrombectomy in acute ST-elevation myocardial infarction:an individual patient-data pooled analysis of 11 trials. Eur Heart J. 2009;30:2193-2203.
10. Jolly SS, Cairns JA, Yusuf S, et al. Randomized trial of primary PCI with or without routine manual thrombectomy. N Engl J Med. 2015;372:1389-1398.
11. Frobert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med. 2013;369:1587-1597.
12. Jolly SS, Cairns JA, Yusuf S, et al. Stroke in the TOTAL trial:a randomized trial of routine thrombectomy vs. percutaneous coronary intervention alone in ST elevation myocardial infarction. Eur Heart J. 2015;36:2364-2372.
13. Fernandez-Rodriguez D, Regueiro A, Brugaletta S, et al. Optimization in stent implantation by manual thrombus aspiration in ST-segment-elevation myocardial infarction:findings from the EXAMINATION trial. Circ Cardiovasc Interv. 2014;7:294-300.
14. Loubeyre C, Morice MC, Lefevre T, Piechaud JF, Louvard Y, Dumas P. A randomized comparison of direct stenting with conventional stent implantation in selected patients with acute myocardial infarction. J Am Coll Cardiol. 2002;39:15-21.
15. Dudek D, Siudak Z, Janzon M, et al. European registry on patients with ST-elevation myocardial infarction transferred for mechanical reperfusion with a special focus on early administration of abciximab —EUROTRANSFER Registry. Am Heart J. 2008;156:1147-1154.
16. Mockel M, Vollert J, Lansky AJ, et al. Comparison of direct stenting with conventional stent implantation in acute myocardial infarction. Am J Cardiol. 2011;108:1697-1703.
17. Isaaz K, Robin C, Cerisier A, et al. A new approach of primary angioplasty for ST-elevation acute myocardial infarction based on minimalist immediate mechanical intervention. Coron Artery Dis. 2006;17:261-269.
18. Meneveau N, Seronde MF, Descotes-Genon V, et al. Immediate versus delayed angioplasty in infarct-related arteries with TIMI III flow and ST segment recovery:a matched comparison in acute myocardial infarction patients. Clin Res Cardiol. 2009;98:257-264.
19. Pascal J, Veugeois A, Slama M, et al. Delayed Stenting for ST-Elevation Acute Myocardial Infarction in Daily Practice:A Single-Centre Experience. Can J Cardiol. 2016;32:988-995.
20. Carrick D, Oldroyd KG, McEntegart M, et al. A randomized trial of deferred stenting versus immediate stenting to prevent no- or slow-reflow in acute ST-segment elevation myocardial infarction (DEFER-STEMI). J Am Coll Cardiol. 2014;63:2088-2098.
21. Kelbaek H, Hofsten DE, Kober L, et al. Deferred versus conventional stent implantation in patients with ST-segment elevation myocardial infarction (DANAMI 3-DEFER):an open-label, randomised controlled trial. Lancet. 2016;387:2199-2206.
22. Belle L, Motreff P, Mangin L, et al. Comparison of Immediate With Delayed Stenting Using the Minimalist Immediate Mechanical Intervention Approach in Acute ST-Segment-Elevation Myocardial Infarction:The MIMI Study. Circ Cardiovasc Interv. 2016;9:e003388.
23. Kim JS, Lee HJ, Woong Yu C, et al. INNOVATION Study (Impact of Immediate Stent Implantation Versus Deferred Stent Implantation on Infarct Size and Microvascular Perfusion in Patients With ST-Segment-Elevation Myocardial Infarction). Circ Cardiovasc Interv. 2016;9:e004101.
24. Qiao J, Pan L, Zhang B, et al. Deferred Versus Immediate Stenting in Patients With ST-Segment Elevation Myocardial Infarction:A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2017;6:e004838.
25. Spaulding C, Teiger E, Commeau P, et al. Four-year follow-up of TYPHOON (trial to assess the use of the CYPHer sirolimus-eluting coronary stent in acute myocardial infarction treated with BallOON angioplasty). JACC Cardiovasc Interv. 2011;4:14-23.
26. Vink MA, Dirksen MT, Suttorp MJ, et al. 5-year follow-up after primary percutaneous coronary intervention with a paclitaxel-eluting stent versus a bare-metal stent in acute ST-segment elevation myocardial infarction:a follow-up study of the PASSION (Paclitaxel-Eluting Versus Conventional Stent in Myocardial Infarction with ST-Segment Elevation) trial. JACC Cardiovasc Interv. 2011;4:24-29.
27. Violini R, Musto C, De Felice F, et al. Maintenance of long-term clinical benefit with sirolimus-eluting stents in patients with ST-segment elevation myocardial infarction 3-year results of the SESAMI (sirolimus-eluting stent versus bare-metal stent in acute myocardial infarction) trial. J Am Coll Cardiol. 2010;55:810-814.
28. Valgimigli M, Percoco G, Malagutti P, et al. Tirofiban and sirolimus-eluting stent vs abciximab and bare-metal stent for acute myocardial infarction:a randomized trial. JAMA. 2005;293:2109-2117.
29. Valgimigli M, Campo G, Percoco G, et al. Comparison of angioplasty with infusion of tirofiban or abciximab and with implantation of sirolimus-eluting or uncoated stents for acute myocardial infarction:the MULTISTRATEGY randomized trial. JAMA. 2008;299:1788-1799.
30. Di Lorenzo E, De Luca G, Sauro R, et al. The PASEO (PaclitAxel or Sirolimus-Eluting Stent Versus Bare Metal Stent in Primary Angioplasty) Randomized Trial. JACC Cardiovasc Interv. 2009;2:515-523.
31. Stone GW, Lansky AJ, Pocock SJ, et al. Paclitaxel-eluting stents versus bare-metal stents in acute myocardial infarction. N Engl J Med. 2009;360:1946-1959.
32. Kastrati A, Dibra A, Spaulding C, et al. Meta-analysis of randomized trials on drug-eluting stents vs. bare-metal stents in patients with acute myocardial infarction. Eur Heart J. 2007;28:2706-2713.
33. Holmvang L, Kelbaek H, Kaltoft A, et al. Long-term outcome after drug-eluting versus bare-metal stent implantation in patients with ST-segment elevation myocardial infarction:5 years follow-up from the randomized DEDICATION trial (Drug Elution and Distal Protection in Acute Myocardial Infarction). JACC Cardiovasc Interv. 2013;6:548-553.
34. Camenzind E, Steg PG, Wijns W. Stent thrombosis late after implantation of first-generation drug-eluting stents:a cause for concern. Circulation. 2007;115:1440-1455.
35. Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans:delayed healing and late thrombotic risk. J Am Coll Cardiol. 2006;48:193-202.
36. Raber L, Kelbaek H, Ostojic M, et al. Effect of biolimus-eluting stents with biodegradable polymer vs bare-metal stents on cardiovascular events among patients with acute myocardial infarction:the COMFORTABLE AMI randomized trial. JAMA. 2012;308:777-787.
37. Raber L, Kelbaek H, Taniwaki M, et al. Biolimus-eluting stents with biodegradable polymer versus bare-metal stents in acute myocardial infarction:two-year clinical results of the COMFORTABLE AMI trial. Circ Cardiovasc Interv. 2014;7:355-364.
38. Sabate M, Cequier A, Iniguez A, et al. Everolimus-eluting stent versus bare-metal stent in ST-segment elevation myocardial infarction (EXAMINATION):1 year results of a randomised controlled trial. Lancet. 2012;380:1482-1490.
39. Sabate M, Brugaletta S, Cequier A, et al. Clinical outcomes in patients with ST-segment elevation myocardial infarction treated with everolimus-eluting stents versus bare-metal stents (EXAMINATION):5-year results of a randomised trial. Lancet. 2016;387:357-366.
40. Sabate M, Raber L, Heg D, et al. Comparison of newer-generation drug-eluting with bare-metal stents in patients with acute ST-segment elevation myocardial infarction:a pooled analysis of the EXAMINATION (clinical Evaluation of the Xience-V stent in Acute Myocardial INfArcTION) and COMFORTABLE-AMI (Comparison of Biolimus Eluted From an Erodible Stent Coating With Bare Metal Stents in Acute ST-Elevation Myocardial Infarction) trials. JACC Cardiovasc Interv. 2014;7:55-63.
41. Brugaletta S, Lara JG, Ortega-Paz L, et al. TCT CONNECT-7 Everolimus-Eluting Stent Versus Bare-Metal Stent in ST-Segment Elevation Myocardial Infarction:10-Year Follow-Up of the Multicenter Randomized Controlled Examination Trial. J Am Coll Cardiol. 2020;76(17 Supplement S):B4-B4.
42. Tousek P, Kocka V, Maly M, et al. Long-term follow-up after bioresorbable vascular scaffold implantation in STEMI patients:PRAGUE-19 study update. EuroIntervention. 2016;12:23-29.
43. Diletti R, Karanasos A, Muramatsu T, et al. Everolimus-eluting bioresorbable vascular scaffolds for treatment of patients presenting with ST-segment elevation myocardial infarction:BVS STEMI first study. Eur Heart J. 2014;35:777-786.
44. Cortese B, Ielasi A, Romagnoli E, et al. Clinical Comparison With Short-Term Follow-Up of Bioresorbable Vascular Scaffold Versus Everolimus-Eluting Stent in Primary Percutaneous Coronary Interventions. Am J Cardiol. 2015;116:705-710.
45. Sabate M, Windecker S, Iniguez A, et al. Everolimus-eluting bioresorbable stent vs. durable polymer everolimus-eluting metallic stent in patients with ST-segment elevation myocardial infarction:results of the randomized ABSORB ST-segment elevation myocardial infarction-TROFI II trial. Eur Heart J. 2016;37:229-240.
46. Brugaletta S, Gori T, Low AF, et al. Absorb bioresorbable vascular scaffold versus everolimus-eluting metallic stent in ST-segment elevation myocardial infarction:1-year results of a propensity score matching comparison:the BVS-EXAMINATION Study (bioresorbable vascular scaffold-a clinical evaluation of everolimus eluting coronary stents in the treatment of patients with ST-segment elevation myocardial infarction). JACC Cardiovasc Interv. 2015;8(1 Pt B):189-197.
47. Brugaletta S, Gori T, Low AF, et al. ABSORB bioresorbable vascular scaffold vs. everolimus-eluting metallic stent in ST-segment elevation myocardial infarction (BVS EXAMINATION study):2-year results from a propensity score matched comparison. Int J Cardiol. 2016;214:483-484.
48. Brugaletta S, Gori T, Tousek P, et al. Bioresorbable vascular scaffolds versus everolimus-eluting metallic stents in patients with ST-segment elevation myocardial infarction:5-year results of the BVS-EXAMINATION study. EuroIntervention. 2020;15:1436-1443.
49. Ielasi A, Campo G, Rapetto C, et al. A Prospective Evaluation of a Pre-Specified Absorb BVS Implantation Strategy in ST-Segment Elevation Myocardial Infarction:The BVS STEMI STRATEGY-IT Study. JACC Cardiovasc Interv. 2017;10:1855-1864.
50. Ielasi A, Campo G, Cortese B, et al. One-Year Results Following a Pre-Specified ABSORB Implantation Strategy in ST-Elevation Myocardial Infarction (BVS STEMI STRATEGY-IT Study). Cardiovasc Revasc Med. 2019;20:700-704.
51. Serruys PW, Chevalier B, Sotomi Y, et al. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent for the treatment of coronary artery stenosis (ABSORB II):a 3 year, randomised, controlled, single-blind, multicentre clinical trial. Lancet. 2016;388:2479-2491.
52. Wykrzykowska JJ, Kraak RP, Hofma SH, et al. Bioresorbable Scaffolds versus Metallic Stents in Routine PCI. N Engl J Med. 2017;376:2319-2328.
53. Kereiakes DJ, Ellis SG, Metzger C, et al. 3-Year Clinical Outcomes With Everolimus-Eluting Bioresorbable Coronary Scaffolds:The ABSORB III Trial. J Am Coll Cardiol. 2017;70:2852-2862.
54. Haude M, Ince H, Abizaid A, et al. Sustained safety and performance of the second-generation drug-eluting absorbable metal scaffold in patients with de novo coronary lesions:12-month clinical results and angiographic findings of the BIOSOLVE-II first-in-man trial. Eur Heart J. 2016;37:2701-2709.
55. Brugaletta S, Cequier A, Alfonso F, et al. MAGnesium-based bioresorbable scaffold and vasomotor function in patients with acute ST segment elevation myocardial infarction:The MAGSTEMI trial:Rationale and design. Catheter Cardiovasc Interv. 2019;93:64-70.
56. Sabate M, Alfonso F, Cequier A, et al. Magnesium-Based Resorbable Scaffold Versus Permanent Metallic Sirolimus-Eluting Stent in Patients With ST-Segment Elevation Myocardial Infarction:The MAGSTEMI Randomized Clinical Trial. Circulation. 2019;140:1904-1916.
57. Ortega-Paz L, Brugaletta S, Gomez-Lara J, et al. Target lesion revascularisation of bioresorbable metal scaffolds:a case series study and literature review. EuroIntervention. 2021;16:1100-1103.
58. Gomez-Lara J, Ortega-Paz L, Brugaletta S, et al. Bioresorbable scaffolds versus permanent sirolimus-eluting stents in patients with ST-segment elevation myocardial infarction:vascular healing outcomes from the MAGSTEMI trial. EuroIntervention. 2020;16:e913-e921.
59. Ortega-Paz L, Brugaletta S, Sabate M. Very-late restenosis of a magnesium-based resorbable scaffold. Eur Heart J. 2020;41:2602.
60. Dziewierz A, Siudak Z, Rakowski T, Zasada W, Dubiel JS, Dudek D. Impact of multivessel coronary artery disease and noninfarct-related artery revascularization on outcome of patients with ST-elevation myocardial infarction transferred for primary percutaneous coronary intervention (from the EUROTRANSFER Registry). Am J Cardiol. 2010;106:342-347.
61. Wald DS, Morris JK, Wald NJ, et al. Randomized trial of preventive angioplasty in myocardial infarction. N Engl J Med. 2013;369:1115-1123.
62. Gershlick AH, Khan JN, Kelly DJ, et al. Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease:the CvLPRIT trial. J Am Coll Cardiol. 2015;65:963-972.
63. Engstrom T, Kelbaek H, Helqvist S, et al. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3-PRIMULTI):an open-label, randomised controlled trial. Lancet. 2015;386:665-671.
64. Smits PC, Abdel-Wahab M, Neumann FJ, et al. Fractional Flow Reserve-Guided Multivessel Angioplasty in Myocardial Infarction. N Engl J Med. 2017;376:1234-1244.
65. Mehta SR, Wood DA, Storey RF, et al. Complete Revascularization with Multivessel PCI for Myocardial Infarction. N Engl J Med. 2019;381:1411-1421.
66. den Dekker WK, Van Mieghem NM, Bennett J, et al. Percutaneous complete revascularization strategies using sirolimus-eluting biodegradable polymer-coated stents in patients presenting with acute coronary syndrome and multivessel disease:Rationale and design of the BIOVASC trial. Am Heart J. 2020;227:111-117.
67. Thiele H, Akin I, Sandri M, et al. PCI Strategies in Patients with Acute Myocardial Infarction and Cardiogenic Shock. N Engl J Med. 2017;377:2419-2432.
68. Thiele H, Akin I, Sandri M, et al. One-Year Outcomes after PCI Strategies in Cardiogenic Shock. N Engl J Med. 2018;379:1699-1710.
69. Ibanez B, Halvorsen S, Roffi M, et al. Integrating the results of the CULPRIT-SHOCK trial in the 2017 ESC ST-elevation myocardial infarction guidelines:viewpoint of the task force. Eur Heart J. 2018;39:4239-4242.
70. Kolte D, Khera S, Aronow WS, et al. Trends in incidence, management, and outcomes of cardiogenic shock complicating ST-elevation myocardial infarction in the United States. J Am Heart Assoc. 2014;3:e000590.
71. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure:The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37:2129-2200.
72. Atkinson TM, Ohman EM, O'Neill WW, Rab T, Cigarroa JE, Interventional Scientific Council of the American College of Cardiology. A Practical Approach to Mechanical Circulatory Support in Patients Undergoing Percutaneous Coronary Intervention:An Interventional Perspective. JACC Cardiovasc Interv. 2016;9:871-883.
73. Helgestad OKL, Josiassen J, Hassager C, et al. Contemporary trends in use of mechanical circulatory support in patients with acute MI and cardiogenic shock. Open Heart. 2020;7:e001214.
74. Waksman R, Weiss AT, Gotsman MS, Hasin Y. Intra-aortic balloon counterpulsation improves survival in cardiogenic shock complicating acute myocardial infarction. Eur Heart J. 1993;14:71-74.
75. Bengtson JR, Kaplan AJ, Pieper KS, et al. Prognosis in cardiogenic shock after acute myocardial infarction in the interventional era. J Am Coll Cardiol. 1992;20:1482-1489.
76. Sjauw KD, Engstrom AE, Vis MM, et al. A systematic review and meta-analysis of intra-aortic balloon pump therapy in ST-elevation myocardial infarction:should we change the guidelines?Eur Heart J. 2009;30:459-468.
77. Patel MR, Smalling RW, Thiele H, et al. Intra-aortic balloon counterpulsation and infarct size in patients with acute anterior myocardial infarction without shock:the CRISP AMI randomized trial. JAMA. 2011 ;306:1329-1337.
78. Ohman EM, Nanas J, Stomel RJ, et al. Thrombolysis and counterpulsation to improve survival in myocardial infarction complicated by hypotension and suspected cardiogenic shock or heart failure:results of the TACTICS Trial. J Thromb Thrombolysis. 2005;19:33-39.
79. Prondzinsky R, Lemm H, Swyter M, et al. Intra-aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic shock:the prospective, randomized IABP SHOCK Trial for attenuation of multiorgan dysfunction syndrome. Crit Care Med. 2010;38:152-160.
80. Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med. 2012;367:1287-1296.
81. Thiele H, Zeymer U, Neumann FJ, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II):final 12 month results of a randomised, open-label trial. Lancet. 2013;382:1638-1645.
82. Iannaccone M, Albani S, Giannini F, et al. Short term outcomes of Impella in cardiogenic shock:A review and meta-analysis of observational studies. Int J Cardiol.2021;324:44-51.
83. Sjauw KD, Konorza T, Erbel R, et al. Supported high-risk percutaneous coronary intervention with the Impella 2.5 device the Europella registry. J Am Coll Cardiol. 2009;54:2430-2434.
84. Maini B, Naidu SS, Mulukutla S, et al. Real-world use of the Impella 2.5 circulatory support system in complex high-risk percutaneous coronary intervention:the USpella Registry. Catheter Cardiovasc Interv. 2012;80:717-725.
85. Seyfarth M, Sibbing D, Bauer I, et al. A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device versus intra-aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol. 2008;52:1584-1588.
86. Ouweneel DM, Eriksen E, Sjauw KD, et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. J Am Coll Cardiol. 2017;69:278-287.
87. Udesen NJ, Moller JE, Lindholm MG, et al. Rationale and design of DanGer shock:Danish-German cardiogenic shock trial. Am Heart J. 2019;214:60-68.
88. Watanabe S, Fish K, Kovacic JC, et al. Left Ventricular Unloading Using an Impella CP Improves Coronary Flow and Infarct Zone Perfusion in Ischemic Heart Failure. J Am Heart Assoc. 2018;7:e006462.
89. Kapur NK, Alkhouli MA, DeMartini TJ, et al. Unloading the Left Ventricle Before Reperfusion in Patients With Anterior ST-Segment-Elevation Myocardial Infarction. Circulation. 2019;139:337-346.
90. Combes A, Price S, Slutsky AS, Brodie D. Temporary circulatory support for cardiogenic shock. Lancet. 2020;396:199-212.
91. Thiele H, Lauer B, Hambrecht R, Boudriot E, Cohen HA, Schuler G. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 2001;104:2917-2922.
92. Kar B, Gregoric ID, Basra SS, Idelchik GM, Loyalka P. The percutaneous ventricular assist device in severe refractory cardiogenic shock. J Am Coll Cardiol. 2011;57:688-696.
93. Burkhoff D, Cohen H, Brunckhorst C, O'Neill WW, TandemHeart Investigators Group. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. Am Heart J. 2006;152:469e1-8.
94. Burkhoff D, Sayer G, Doshi D, Uriel N. Hemodynamics of Mechanical Circulatory Support. J Am Coll Cardiol. 2015;66:2663-2674.
95. Petroni T, Harrois A, Amour J, et al. Intra-aortic balloon pump effects on macrocirculation and microcirculation in cardiogenic shock patients supported by venoarterial extracorporeal membrane oxygenation. Crit Care Med. 2014;42:2075-2082.
96. Cheng A, Swartz MF, Massey HT. Impella to unload the left ventricle during peripheral extracorporeal membrane oxygenation. ASAIO J. 2013;59:533-536.
97. Schrage B, Becher PM, Bernhardt A, et al. Left Ventricular Unloading Is Associated With Lower Mortality in Patients With Cardiogenic Shock Treated With Venoarterial Extracorporeal Membrane Oxygenation:Results From an International, Multicenter Cohort Study. Circulation. 2020;142:2095-2106.
98. Abrams D, Agerstrand CL, Biscotti M, Burkart KM, Bacchetta M, Brodie D. Extracorporeal membrane oxygenation in the management of diffuse alveolar hemorrhage. ASAIO J. 2015;61:216-218.
99. Sheu JJ, Tsai TH, Lee FY, et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit Care Med. 2010;38:1810-1817.
100. Muller G, Flecher E, Lebreton G, et al. The ENCOURAGE mortality risk score and analysis of long-term outcomes after VA-ECMO for acute myocardial infarction with cardiogenic shock. Intensive Care Med. 2016;42:370-378.
101. Banning AS, Adriaenssens T, Berry C, et al. The EURO SHOCK Trial:Design, Aims and Objectives. EuroIntervention. 2020;EIJ-D-20-01076.
102. Lusebrink E, Orban M, Kupka D, et al. Prevention and treatment of pulmonary congestion in patients undergoing venoarterial extracorporeal membrane oxygenation for cardiogenic shock. Eur Heart J. 2020;41:3753-3761.