RESUMEN
Introducción y objetivos: El implante percutáneo de válvula aórtica (TAVI) se ha establecido como una alternativa menos invasiva al recambio valvular aórtico (RVAo). El strain longitudinal global del ventrículo izquierdo (SLG-VI) puede detectar cambios en el funcionamiento ventricular izquierdo antes de que se deteriore la fracción de eyección. Nuestro objetivo fue presentar y evaluar la experiencia de nuestro centro en cuanto al remodelado inverso ventricular izquierdo a corto y largo plazo, utilizando el SLG-VI mediante rastreo de marcas, o speckle tracking, bidimensional, después de TAVI en comparación con los resultados tras RVAo.
Métodos: El equipo cardiológico multidisciplinario evaluó 65 pacientes remitidos para RVAo por estenosis aórtica grave, con riesgo quirúrgico alto, intermedio o bajo. Los pacientes se clasificaron según fueran tratados con TAVI (prótesis autoexpandible Evolut-R) o RVAo. Se realizó ecocardiograma antes del procedimiento, al mes y al año de llevarlo a cabo.
Resultados: 31 pacientes se trataron con TAVI y 34 con RVAo. En el grupo de TAVI hubo mayores tasas de regurgitación valvular y paravalvular. Se observó un remodelado ventricular izquierdo más favorable, con una disminución significativa del índice de masa del ventrículo izquierdo, un índice E/e’ tras el procedimiento y una mejoría precoz del SLG-VI de −8,18 ± 1,81 a −14,52 ± 2,52, que al año fue −16,12 ± 2,69 (p < 0,0001), sin que esta mejoría precoz en dicho parámetro se evidenciara en el grupo de RVAo. En el grupo de TAVI se mantuvo la función ventricular derecha sin afectar al desplazamiento sistólico del plano tricúspide y sin aumentar la presión sistólica de la arteria pulmonar estimada.
Conclusiones: Los pacientes que recibieron un TAVI tuvieron un mayor y más precoz remodelado ventricular izquierdo, con una reducción precoz del índice de masa del ventrículo izquierdo y del índice E/e’, y una mejoría significativa precoz del SLG-VI, sin alteración de la fracción de eyección del ventrículo izquierdo ni deterioro de la función ventricular derecha.
Palabras clave: Remodelado ventricular izquierdo. Implante percutáneo de válvula aórtica. Recambio valvular aórtico. Speckle tracking bidimensional. TAVI. RVAo.
ABSTRACT
Introduction and objectives: Transcatheter aortic valve implantation (TAVI) has emerged as an alternative and less invasive treatment to surgical aortic valve replacement (SAVR). Left ventricular global longitudinal strain (LV-GLS) can reveal changes in left ventricular performance before involvement of ejection fraction. Our aim was to present and evaluate our center’s experience regarding short- and long-term reverse left ventricular remodeling using two-dimensional-speckle tracking echocardiography-derived LV-GLS after TAVI compared with SAVR.
Methods: Our multidisciplinary cardiac team carefully evaluated 65 patients for SAVR who presented with severe symptomatic aortic stenosis and who had high, intermediate, or low surgical risk. The patients underwent either TAVI with an Evolut-R self-expanding valve or SAVR. Echocardiographic evaluation was performed before, 1 month, and 1 year after the procedure.
Results: TAVI was performed in 31 patients and SAVR in 34 patients. The incidence of valvular and paravalvular leak was higher in the TAVI group despite early favorable LV remodeling with a significant decrease in left ventricular mass index and E/e’ shortly after the procedure and an early detectable improvement in LV-GLS from −8.18 ± 1.81 to −14.52 ± 2.52, reaching −16.12 ± 2.69 at 1 year (P < .001). This early improvement was not observed in the SAVR group. TAVI preserved right ventricular function without affecting tricuspid annular plane systolic excursion or increasing estimated pulmonary artery pressure.
Conclusions: Patients who underwent TAVI had earlier and significantly better LV remodeling with early reduction in left ventricular mass index, E/e’ ratio, and significant early improvement in LV-GLS without concomitant impairment of left ventricular ejection fraction percentage or deterioration of right ventricular function.
Keywords: Left ventricular remodeling. Transcatheter aortic valve implantation. Surgical aortic valve replacement. Two-dimensional speckle tracking. TAVI. SAVR.
Abreviaturas
EA: estenosis aórtica. FEVI: fracción de eyección del ventrículo izquierdo. RVAo: recambio valvular aórtico. SLG-VI: strain longitudinal global del ventrículo izquierdo. TAVI: implante percutáneo de válvula aórtica. VI: ventrículo izquierdo.
INTRODUCCIÓN
La estenosis aórtica (EA) calcificada degenerativa es la valvulopatía más común en todo el mundo. En casos sintomáticos graves, el recambio valvular aórtico (RVAo) ha sido el patrón oro desde hace décadas1.
No obstante, desde su introducción en 2002, el implante percutáneo de válvula aórtica (TAVI) se ha convertido en un tratamiento alternativo menos invasivo con un tiempo de recuperación más corto y una tasa de mortalidad perioperatoria más baja. Inicialmente, esta intervención se empleó en pacientes de riesgo quirúrgico alto2,3 e intermedio4,5. Sin embargo, los avances en la técnica y las habilidades del operador han ampliado su uso a pacientes de bajo riesgo quirúrgico6,7.
Es bien sabido que el principal problema en personas con EA aislada es una mayor poscarga que provoca disfunción diastólica y culmina en una disfunción sistólica del ventrículo izquierdo (VI)8. El momento óptimo para la intervención, ya sea quirúrgica o percutánea, depende de la gravedad o grado de estenosis, los síntomas y la disfunción del VI9. El recambio valvular aórtico mediante TAVI o RVAo influye significativamente en el remodelado del VI, reduce los síntomas y aumenta la supervivencia general7.
Las guías vigentes emplean el porcentaje de fracción de eyección del ventrículo izquierdo (FEVI) para valorar la función sistólica del VI. No obstante, pueden presentarse cuadros de disfunción miocárdica subclínica a pesar de un porcentaje normal de FEVI. Los cambios fibróticos inducidos por la EA afectan principalmente a la función longitudinal del VI y la fracción de eyección viene determinada por la función miocárdica radial. La mayoría de los casos de EA grave que precisan intervención presentan porcentajes de fracción de eyección mantenida antes y después de la intervención, y solo se describen porcentajes bajos en algunos casos tardíos y descuidados de mal pronóstico cuando ambas funciones, radial y longitudinal, se ven afectadas8. Por tanto, valorar la función o el remodelado del VI antes o después de la intervención no debe basarse solo en la FEVI. Se necesita otro método fiable para valorar íntegramente el impacto del recambio valvular aórtico en la función del VI10.
Analizar la deformación o strain longitudinal global (GLS) ha demostrado ser útil para caracterizar de manera precisa la función sistólica miocárdica regional y global. Este análisis puede detectar cambios en el rendimiento del VI y superar limitaciones propias de la fracción de eyección, tales como la considerable variabilidad entre observadores, la ausencia de diferencias regionales sutiles y ventanas acústicas inadecuadas, con una validez pronóstica superior a la del porcentaje de FEVI10.
En el Hospital Universitario de Tanta, Egipto, se ha introducido recientemente el TAVI. El objetivo de este estudio fue presentar y valorar la experiencia de nuestro equipo y estudiar el impacto del recambio valvular aórtico en factores como la hemodinámica de la prótesis valvular, la fuga valvular o periprotésica significativa y la necesidad de implantar un nuevo marcapasos. También nos propusimos valorar el remodelado inverso del VI a corto y largo plazo evaluando parámetros ecocardiográficos convencionales. También se empleó el strain longitudinal global del VI mediante rastreo de marcas o speckle tracking (SLG-VI), más fiable y preciso, tras el TAVI y se compararon estos parámetros con el patrón oro (RVAo).
Pacientes y diseño del estudio
Muestra de pacientes y criterios de inclusión
Este estudio longitudinal, prospectivo, no aleatorizado y unicéntrico se llevó a cabo en el Departamento de Cardiología de la Facultad de Medicina del Hospital Universitario de Tanta entre mayo de 2022 y octubre de 2023. Un total de 65 pacientes diagnosticados de EA sintomática grave, clasificados como de alto, intermedio o bajo riesgo quirúrgico y programados para una intervención de recambio valvular aórtico, recibieron un examen exhaustivo por parte del equipo multidisciplinario. Tras seleccionar la intervención adecuada, se trató a los pacientes aptos mediante TAVI transfemoral con una válvula autoexpandible Evolut-R (Medtronic, Estados Unidos) o RVAo.
Los pacientes se clasificaron en 2 grupos:
-
– Grupo I: pacientes con síntomas clínicos como dolor torácico, síncope o disnea, así como evidencias ecocardiográficas de EA grave (definida como un área valvular ≤ 1 cm2 o un área valvular indexada ≤ 0,6 cm2/m2, un gradiente medio de presión ≥ 40 mmHg y una velocidad máxima transaórtica ≥ 4 m/s)9. Los pacientes que cumplían estos criterios se consideraron aptos para recibir el TAVI.
-
– Grupo II: pacientes diagnosticados de EA grave sintomática según hallazgos clínicos y ecocardiográficos (considerados aptos para recibir el RVAo).
Criterios de exclusión
Se excluyó a los pacientes que presentaban alguna de las siguientes patologías: valvulopatía significativa concomitante distinta de EA, insuficiencia renal aguda (tasa de filtrado glomerular < 30 ml/min/ 1,73 m2), recambio previo de válvula biológica o de metal sin recubrir, enfermedad coronaria o carotídea significativa, aneurisma de aorta abdominal, insuficiencia cardiaca inestable, fibrilación auricular, flutter auricular o cualquier alteración significativa del ritmo, insuficiencia aórtica predominante, endocarditis infecciosa o disfunción grave del VI (fracción de eyección < 35%). También se excluyó a los pacientes que fallecieron durante el periodo del estudio o de quienes no se tenían datos ecocardiográficos antes o después de la sustitución valvular.
MÉTODOS
Se llevó a cabo una evaluación integral de la historia y de la clínica de todos los pacientes. Los datos sobre la duración de la estancia hospitalaria, las complicaciones perioperatorias y el seguimiento clínico se recopilaron mediante revisión de los registros médicos.
La intervención de TAVI
Tras la selección de los pacientes y de las válvulas adecuadas, la intervención se realizó en 5 pasos secuenciales: abordaje, cruce de la válvula, valvuloplastia aórtica con balón, implante de la válvula y cierre de la vía de acceso. Algunas consideraciones adicionales que se tuvieron en cuenta fueron la elección de la anestesia (local con sedación o anestesia general) y el implante del cable de un marcapasos temporal en el ventrículo derecho. En la mayoría de los pacientes, la intervención se llevó a cabo bajo sedación consciente. Los dispositivos empleados fueron las válvulas autoexpandibles Evolut-R (26, 29 o 34 mm)11.
Estudio ecocardiográfico estándar
Las mediciones ecocardiográficas se realizaron según las guías de la American Society of Echocardiographya y la European Association of Cardiovascular Imaging12. Empleando el sistema de ultrasonido cardiovascular Vivid E9 (GE Vingmed Ultrasound, Noruega), equipado con un transductor de matriz en fase M5S (2,5-5,0 MHz) y un software dedicado, las imágenes y datos se almacenaron digitalmente para su análisis offline antes de intervención, poco tiempo después (1 mes) y entre 9 y 12 meses tras el recambio valvular. Todos los parámetros ecocardiográficos los adquirieron 2 observadores entrenados. Se registró una media de 3-5 latidos consecutivos.
Se obtuvieron las dimensiones del VI, el grosor de la pared vascular, el porcentaje de FEVI y el índice de masa del VI. Los gradientes de presión máxima y media transaórticos se calcularon a partir de la velocidad aórtica obtenida mediante evaluación Doppler continuo multiventana con la ecuación de Bernoulli modificada.
El área del orificio efectivo de la válvula aórtica se determinó con la ecuación de continuidad y se indexó el área de superficie corporal como el volumen sistólico calculado en el tracto de salida del ventrículo izquierdo (TSVI) dividido por la integral tiempo-velocidad del chorro o jet aórtico calculada mediante Doppler continuo. El volumen sistólico del TSVI se calculó como el área de la sección transversal del TSVI multiplicada por la integral tiempo-velocidad del TSVI calculada mediante Doppler pulsado.
Tras el recambio valvular aórtico, se obtuvieron la velocidad y el diámetro del TSVI justo apical a la endoprótsesis de la válvula o al anillo de sutura. La presencia y la cuantificación de cualquier fuga valvular o periprotésica se evaluaron mediante Doppler color y continuo.
Se obtuvieron parámetros ecocardiográficos adicionales para valorar la función diastólica del VI, principalmente el flujo transmitral, incluidas las mediciones de las velocidades máximas de flujo temprano (E) y auricular (A) y de la relación E/A. La velocidad media máxima diastólica temprana (e’) se adquirió desde el lado septal del anillo mitral en el plano apical tetracameral empleando configuraciones de Doppler tisular. Después, se calculó la relación E/e’, que sirvió de indicador de las presiones de llenado del VI.
Se emplearon parámetros convencionales para valorar la función del lado derecho, incluidas mediciones de la excursión sistólica del plano del anillo tricuspídeo y valoraciones de la velocidad máxima de insuficiencia tricuspídea con imágenes de flujo Doppler color. La presión sistólica estimada de la arteria pulmonar se calculó empleando la fórmula: presión sistólica estimada de la arteria pulmonar = presión auricular derecha + 4 V2, siendo V la velocidad de insuficiencia tricuspídea.
Ecocardiografía speckle tracking 2D, strain longitudinal global del ventrículo izquierdo
Se llevó a cabo una valoración offline del strain longitudinal global máximo sistólico. Los bordes endocárdicos se trazaron manualmente y se visualizaron como una secuencia codificada por colores en clips individuales. Después, se combinaron en un gráfico en forma de diana. El software calculó el strain regional y promedio de los planos apical bicameral, tetracameral y tricameral de los 17 segmentos en un frame telesistólico. Se excluyeron las imágenes con una tasa de frames < 5013. Se registró y se documentó el strain longitudinal global máximo medio para cada estudio.
Análisis estadístico
El análisis estadístico llevó a cabo con el Paquete Estadístico para Ciencias Sociales (IBM SPSS Statistics) para Windows, versión 26 (IBM Corp., Estados Unidos). Las variables cualitativas (el sexo, por ejemplo) se expresan como frecuencias, y la asociación entre los grupos y las variables categóricas se valoraron con la prueba de X2 para independencia, la prueba exacta de Fisher-Freeman-Halton o la prueba exacta de Fisher, según corresponda. Las variables cuantitativas (la edad y todas las mediciones ecocardiográficas) se expresan como media ± desviación estándar (DE).
Las diferencias observadas en las variables cuantitativas entre los grupos se evaluaron con la prueba T para muestras independientes para características y mediciones basales o con el análisis de modelos lineales mixtos con grupos de tratamiento como factor y valores basales como covariable. Las comparativas de las mediciones repetidas obtenidas en cada grupo se realizaron analizando el modelo lineal mixto para medidas repetidas con el tiempo de tratamiento como factor. El grado de insuficiencia mitral en diferentes momentos se comparó mediante la prueba de McNemar y el grado de fuga periprotésica se evaluó en diferentes momentos con la prueba de homogeneidad marginal. Se eligió un nivel de significancia de p < 0,05 para todas las pruebas estadísticas.
RESULTADOS
La tabla 1 muestra los datos demográficos de los 2 grupos: el TAVI se realizó en 31 pacientes y el RVAo en 34. La edad fue mayor en el grupo TAVI (p < 0,001) que en el grupo RVAo.
Tabla 1. Datos demográficos, comorbilidades y porcentaje de diferentes complicaciones en las 2 intervenciones
| TAVI (31) | RVAo (34) | p | ||
|---|---|---|---|---|
| Edad | Media ± DE | 68,86 ± 2,61 | 66,00 ± 1,74 | < 0,001* |
| Sexo | Femenino | 7 (22,6%) | 9 (26,5%) | 0,716 |
| Masculino | 24 (77,4%) | 25 (73,5%) | ||
| IMC | Media ± DE | 32,71 ± 3,13 | 32,83 ± 2,76 | 0,893 |
| Comorbilidades | Hipertensión | 15 (48,4%) | 18 (52,9%) | 0,714 |
| Diabetes | 11 (35,5%) | 13 (38,2%) | 0,818 | |
| Dislipidemia | 13 (41,9%) | 13 (38,2%) | 0,761 | |
| EC | 7 (22,6%) | 12 (35,3%) | 0,260 | |
| Complicaciones Resultado clínico | No | 22 (71,0%) | 30 (88,2%) | 0,082 |
| Alteración de la conducción | 4 (12,9%) | 0 (0,0%) | 0,046* | |
| Daño renal agudo | 3 (6,4%) | 0 (0,0%) | 0,103 | |
| Neurológico | 0 (0,0%) | 2 (5,9%) | 0,493 | |
| Complicaciones asociadas a los vasos | 5 (16,1%) | 0 (0,0%) | 0,021* | |
| Rehospitalización | 1 (3,2%) | 2 (5,9%) | 0,999 | |
|
DE: desviación estándar; EC: enfermedad cardiovascular; IMC: índice de masa corporal; MPP: marcapasos permanente; RVAo: recambio valvular aórtica; TAVI: implante percutáneo de válvula aórtica. * Significativo a p < 0,05. |
||||
No hubo incidentes peri ni posoperatorios en la mayoría de los pacientes, y se observaron menos síntomas en ambos grupos. No obstante, sí hubo algunas complicaciones perioperatorias y al año de seguimiento: 4 pacientes desarrollaron anomalías de la conducción y presentaron bloqueo cardiaco completo durante su hospitalización, con implante de marcapasos permanente bicameral; 3 pacientes desarrollaron nefropatía inducida por contraste, que se corrigió antes del alta (2 de ellos tenían diabetes de larga data); 5 pacientes desarrollaron complicaciones vasculares en forma de hemorragia entre leve y moderada desde el sitio de acceso que no requirió transfusiones ni intervenciones; y solo 1 paciente fue rehospitalizado por presentar edema pulmonar hipertensivo (el paciente tenía hipertensión crónica no controlada) en el grupo TAVI. Falleció 1 paciente 10 días después del TAVI y fue excluido.
En el grupo RVAo, 2 pacientes desarrollaron accidente cerebrovascular isquémico secundario a una anticoagulación ineficaz y otros 2 fueron rehospitalizados tras desarrollar toxicidad a la warfarina complicada con una hemorragia gastrointestinal que requirió hospitalización para transfusión de sangre hasta controlar la hemorragia. Ninguno de los pacientes en este grupo desarrolló daño renal agudo, anomalías de la conducción ni complicaciones vasculares perioperatorias durante su hospitalización (tabla 1).
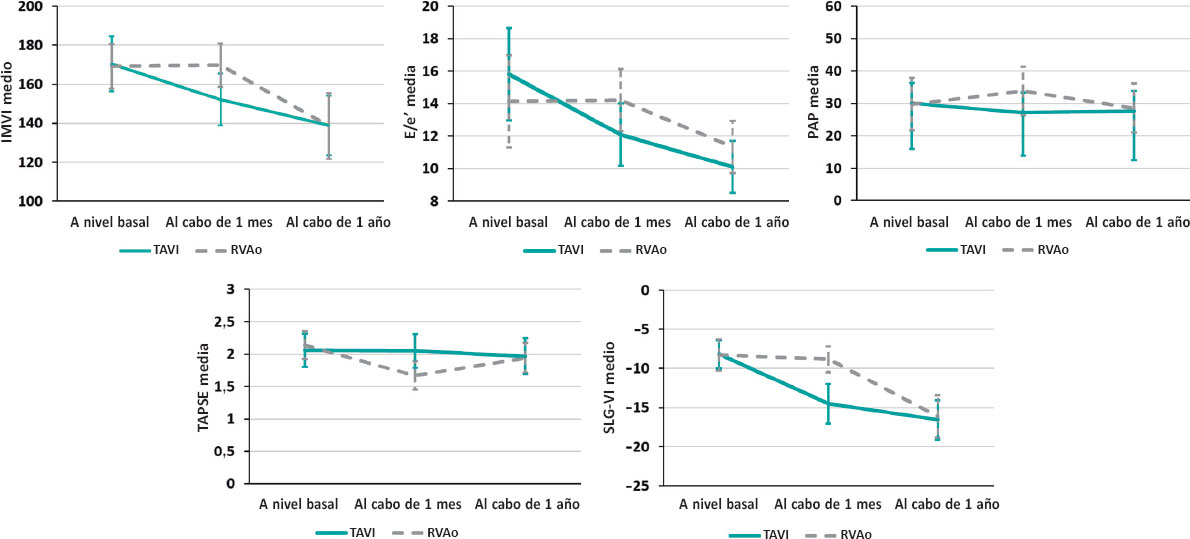
En los 2 grupos, todas las variables ecocardiográficas se recopilaron al inicio (antes de la intervención), al cabo de 1 mes y 1 año después de la intervención. Todos estos datos se muestran en la tabla 2. En la tabla 3 se muestra una comparativa de los cambios relativos descritos en cada parámetro en diferentes momentos de la valoración en ambos grupos, representada gráficamente en la figura 1.
Tabla 2. Parámetros eco-Doppler para ambas intervenciones en cada momento de la valoración
| Variables | A nivel basal | Al cabo 1 mes | Al cabo 1 año | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TAVI | RVAo | p | TAVI | RVAo | p | TAVI | RVAo | p | ||||
| DTDVI (cm) | 5,09 ± 0,32 | 5,15 ± 0,43 | 0,632 | 5,01 ± 0,33 | 5,13 ± 0,41 | 0,133 | 4,99 ± 0,29 | 4,95 ± 0,29 | 0,380 | |||
| DTSVI (cm) | 3,30 ± 0,28 | 3,51 ± 0,46 | 0,069 | 3,23 ± 0,28 | 3,50 ± 0,47 | 0,136 | 3,20 ± 0,22 | 3,27 ± 0,21 | 0,941 | |||
| IMVI (g/m²) | 170,33 ± 14,10 | 169,17 ± 11,39 | 0,760 | 152,14 ± 13,28 | 169,63 ± 11,05 | < 0,001* | 138,81 ± 15,16 | 138,54 ± 17,03 | 0,952 | |||
| sept VI (cm) | 1,53 ± 0,12 | 1,52 ± 0,10 | 0,707 | 1,44 ± 0,14 | 1,46 ± 0,13 | 0,107 | 1,21 ± 0,17 | 1,25 ± 0,13 | 0,280 | |||
| FEVI % | 63,33 ± 5,86 | 57,44 ± 13,66 | 0,074 | 63,67 ± 6,05 | 59,71 ± 6,89 | 0,207 | 64,48 ± 5,12 | 62,54 ± 4,29 | 0,524 | |||
| PAPSE (mmHg) | 30,00 ± 6,32 | 29,79 ± 8,06 | 0,924 | 27,14 ± 6,08 | 33,79 ± 7,49 | < 0,001* | 27,62 ± 6,21 | 28,54 ± 7,59 | 0,491 | |||
| E/A | 0,63 ± 0,37 | 0,60 ± 0,39 | 0,801 | 0,65 ± 0,43 | 0,62 ± 0,39 | 0,899 | 0,67 ± 0,43 | 0,62 ± 0,38 | 0,504 | |||
| E/e’ | 15,81 ± 2,84 | 14,13 ± 3,05 | 0,063 | 12,10 ± 1,92 | 14,21 ± 2,67 | < 0,001* | 10,10 ± 1,61 | 11,33 ± 1,90 | 0,007* | |||
| TAPSE (cm) | 2,06 ± 0,26 | 2,14 ± 0,22 | 0,239 | 2,05 ± 0,26 | 1,67 ± 0,22 | < 0,001* | 1,97 ± 0,28 | 1,94 ± 0,23 | 0,199 | |||
| Vmax-VA (m/s) | 4,92 ± 0,22 | 4,95 ± 0,24 | 0,655 | 1,64 ± 0,16 | 1,91 ± 0,15 | < 0,001* | 1,68 ± 0,16 | 1,85 ± 0,09 | < 0,001* | |||
| GM-VA (mmHg) | 58,38 ± 7,17 | 58,08 ± 7,67 | 0,894 | 9,85 ± 1,65 | 13,23 ± 1,95 | < 0,001* | 9,21 ± 1,21 | 12,85 ± 1,93 | < 0,001* | |||
| AVA-I (cm²/m²) | 0,47 ± 0,10 | 0,47 ± 0,10 | 0,984 | 1,20 ± 0,11 | 1,23 ± 0,07 | 0,358 | 1,22 ± 0,10 | 1,26 ± 0,08 | 0,201 | |||
| SLG-VI % | –8,18 ± 1,81 | –8,30 ± 1,99 | 0,829 | –14,52 ± 2,52 | –8,82 ± 1,68 | < 0,001* | –16,57 ± 2,52 | –16,12 ± 2,69 | 0,511 | |||
| Grado de IM | Leve | 26 (83,9%) | 21 (61,8%) | 0,057 | 28 (90,3%) | 23 (67,6%) | 0,028* | 27 (87,1%) | 21 (61,8%) | 0,020* | ||
| ≥ Moderado | 5 (16,1%) | 13 (38,3%) | 3 (9,7%) | 11 (32,4%) | 4 (12,9%) | 13 (38,2%) | ||||||
| Grado de FV o FPP | Ninguno | − | − | 17 (54,8%) | 28 (82,4%) | 0,011* | 15 (48,4%) | 25 (73,5%) | 0,042* | |||
| Leve | − | − | 12 (38,7%) | 6 (17,6%) | 13 (41,9%) | 8 (23,5%) | ||||||
| ≥ Moderado | − | − | 2 (6,5%) | 0 (0,0%) | 3 (9,7%) | 1 (2,9%) | ||||||
|
AVA-I: área valvular aórtica indexada; DTDVI: dimensión telediastólica del ventrículo izquierdo; DTSVI: dimensión telesistólica del ventrículo izquierdo; E/A: relación velocidad de flujo mitral diastólica temprana/velocidad de flujo mitral diastólica tardía; E/e’: relación velocidad de flujo mitral diastólica temprana/velocidad diastólica temprana derivada de Doppler tisular del anillo mitral septal; FEVI: fracción de eyección del ventrículo izquierdo; FV o FPP: fuga valvular o fuga periprotésica; GM-VA: gradiente de presión medio de la válvula aórtica; IM: insuficiencia mitral; IMVI: índice de masa del ventrículo izquierdo; PAPSE: presión arterial pulmonar sistólica estimada; RVAo: recambio valvular aórtico; sept VI: grosor del septo del ventrículo izquierdo; SLG-VI: strain longitudinal global del ventrículo izquierdo; TAPSE: excursión sistólica del plano anular tricuspídeo; TAVI: implante percutáneo de válvula aórtica; Vmax-VA: velocidad máxima de la válvula aórtica. * Significativo a p < 0,05. Los datos expresan media ± desviación estándar. |
||||||||||||
Tabla 3. Comparativa de mediciones repetidas al cabo de 1 mes y 1 año tras intervención frente a mediciones basales
| TAVI | RVAo | |||
|---|---|---|---|---|
| 1 mes frente a valores basales p |
1 año frente a valores basales p |
1 mes frente a valores basales p |
1 año frente a valores basales p |
|
| DTDVI | 0,092 | 0,202 | 0,999 | 0,024* |
| DTSVI | 0,157 | 0,064 | 0,999 | 0,008* |
| IMVI | < 0,001* | < 0,001* | 0,999 | < 0,001* |
| Sept VI | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| FEVI % | 0,999 | 0,430 | 0,736 | 0,110 |
| PAPSE | 0,001* | 0,036* | 0,005* | 0,752 |
| E/A | 0,768 | 0,117 | 0,406 | 0,761 |
| E/e’ | < 0,001* | < 0,001* | 0,999 | < 0,001* |
| TAPSE | 0,999 | 0,076 | < 0,001* | 0,002* |
| Vmax-VA | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| GM-VA | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| AVA-I | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| SLG-VI | < 0,001* | < 0,001* | 0,443 | < 0,001* |
| Grado de IM | 0,500 | 1,000 | 0,500 | 1,000 |
| - | - | 1 año frente a 1 mes p | - | 1 año frente a 1 mes p |
| Grado de FV o FPP | - | 0,083 | - | 0,046* |
|
AVA-I: área valvular aórtica indexada; DTDVI: dimensión telediastólica del ventrículo izquierdo; DTSVI: dimensión telesistólica del ventrículo izquierdo; E/A: relación velocidad de flujo mitral diastólica temprana/velocidad de flujo mitral diastólica tardía; E/e’: relación velocidad de flujo mitral diastólica temprana/velocidad diastólica temprana derivada de Doppler tisular del anillo mitral septal; FEVI: fracción de eyección del ventrículo izquierdo; FV o FPP: fuga valvular o fuga periprotésica; GM-VA: gradiente de presión medio de la válvula aórtica; IM: insuficiencia mitral; IMVI: índice de masa del ventrículo izquierdo; PAPSE: presión arterial pulmonar sistólica estimada; RVAo: recambio valvular aórtico; sept VI: grosor del septo del ventrículo izquierdo; SLG-VI: strain longitudinal global del ventrículo izquierdo; TAPSE: excursión sistólica del plano anular tricuspídeo; TAVI: implante percutáneo de válvula aórtica; Vmax-VA: velocidad máxima de la válvula aórtica. p obtenido del análisis del modelo lineal mixto para medidas repetidas empleando el tiempo de tratamiento como factor. * Significativo a p < 0,05. |
||||
Figura 1. Cambios relativos de cada parámetro a lo largo del estudio desde nivel basal hasta 1 año en ambos grupos con descensos relativos del IMVI, E/e, presión arterial pulmonar sistólica estimada y aumentos relativos del SLG-VI sin cambios en TAPSE poco después (1 mes) del TAVI frente a cambios no detectables en el IMVI, la E/e o el SLG-VI, un descenso relativo de la TAPSE y aumentos de la presión arterial pulmonar sistólica estimada en el grupo RVAo. Trascurrido 1 año, los parámetros eran casi los mismos en los 2 grupos. E/e’: relación entre la velocidad del flujo mitral diastólico temprano pico y la velocidad diastólica temprana derivada del Doppler tisular con onda pulsada desde el anillo mitral septal; IMVI: índice de masa del ventrículo izquierdo; PAP, presión arterial pulmonar; RVAo: recambio valvular aórtico; SLG-VI: strain longitudinal global del ventrículo izquierdo; TAPSE: excursión sistólica del plano del anillo tricuspídeo; TAVI: implante percutáneo de válvula aórtica.
Todas las variables ecocardiográficas basales fueron parecidas entre los 2 grupos.
Hemodinámica valvular
Tras ambas intervenciones, se observó una mejora significativa de la velocidad máxima de la válvula aórtica (Vmax-VA) y del gradiente medio de presión de la válvula aórtica (GM-VA), así como del área valvular aórtica (AVA) (p < 0,001 para todos). Esta mejora se mantuvo durante todo el año, al tiempo que se observó una mejora temprana y al cabo de 1 año relativamente más pronunciada en la Vmax-VA y el GM-VA (p < 0,001 para ambos) en el grupo TAVI con respecto al RVAo. Ningún paciente de ninguno de los 2 grupos desarrolló desajuste paciente-prótesis.
Dimensiones y funciones del ventrículo izquierdo
Se observó una mejora constante y significativa en el grosor septal del VI tras la intervención en ambos grupos en diferentes momentos de la valoración; también una mejora ligera pero significativa en las dimensiones del VI (dimensión telediastólica del VI y dimensión telesistólica del VI) en el grupo RVAo a 1 año con respecto al TAVI. En concreto, la dimensión telediastólica del VI pasó de 5,15 ± 0,43 a 4,95 ± 0,29 (p = 0,024) en el grupo RVAo a 5,09 ± 0,32 a 4,99 ± 0,29 (p = 0,202) en el grupo TAVI. Asimismo, la dimensión telesistólica del VI pasó de 3,51 ± 0,46 a 3,27 ± 0,21 (p = 0,008) en el grupo RVAo a 3,30 ± 0,28 a 3,20 ± 0,22, p = 0,064 en el TAVI.
Se observó un resultado temprano favorable en el grupo TAVI con un descenso significativo del índice de masa del VI y E/e’ poco después de la intervención, que se mantuvo al cabo de 1 año. El índice de masa del VI pasó de 170,33 ± 14,10 a 152,14 ± 13,28 (p < 0,001) en el grupo TAVI frente a 169,17 ± 11,39 a 169,63 ± 11.05 (p = 0,999) en el RVAo. E/e’ pasó de 15,81 ± 2,84 a 12,10 ± 1,92 (p < 0,001) en el grupo de TAVI frente a 14,13 ± 3,05 a 14,21 ± 2,67 (p = 0,999) en el RVAo (figura 1).
Aunque la insuficiencia mitral experimentó una mejora relativa en el grupo TAVI con respecto al grupo RVAo tras 1 mes (p = 0,028) y 1 año de seguimiento (p = 0,020), no cambió significativamente dentro de cada grupo en diferentes momentos de la valoración. La insuficiencia mitral leve fue prevalente en ambos grupos.
Valoración del ventrículo derecho
No se observó ningún cambio significativo en la excursión sistólica del plano del anillo tricuspídeo tras la intervención en el grupo TAVI. Sin embargo, en el grupo RVAo sí se redujo significativamente poco después de la intervención pasando de 2,14 ± 0,22 a 1,67 ± 0,22 (p < 0,001). Como se muestra en la figura 1, aunque la presión arterial pulmonar sistólica estimada experimentó un descenso significativo de 30,00 ± 6,32 a 27,14 ± 6,08 (p = 0,001) poco después del TAVI, aumentó significativamente de 29,79 ± 8,06 a 33,79 ± 7.49 tras el RVAo (p = 0,005).
Strain longitudinal global del ventrículo izquierdo
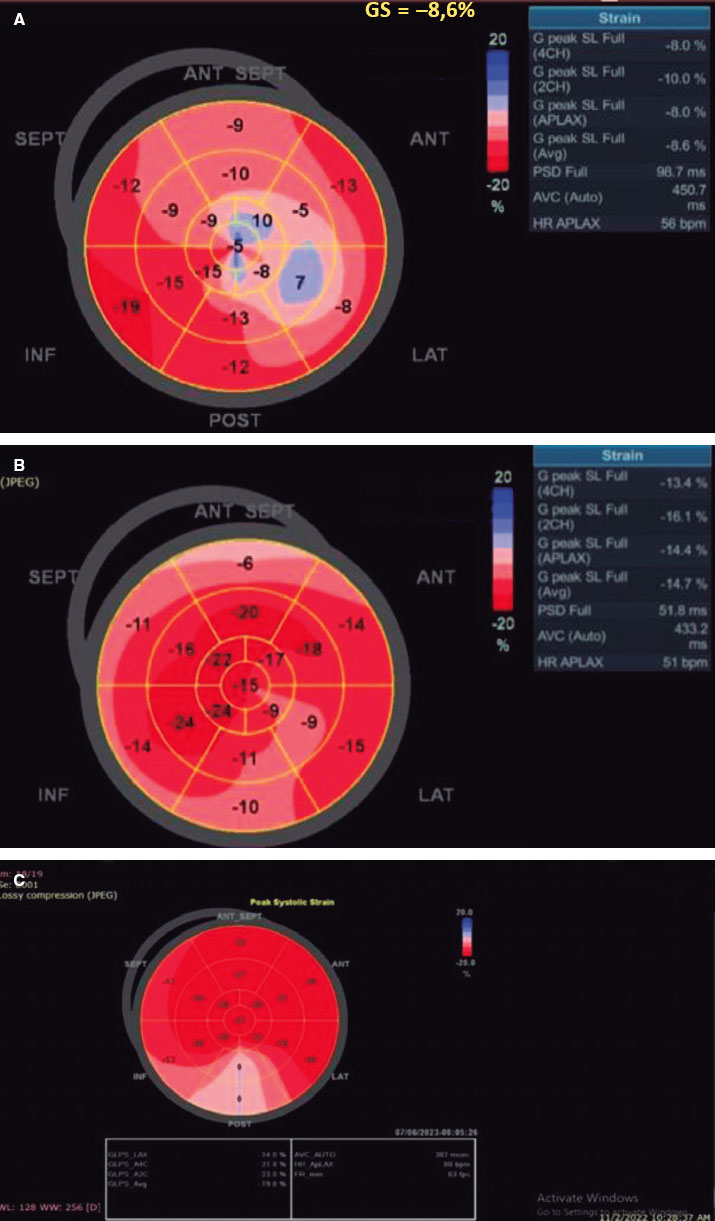
Se observó una diferencia estadísticamente significativa entre los 2 grupos (p < 0,001) que fue favorable al grupo TAVI con una mejora detectable temprana del SLG-VI que pasó de -8,18 ± 1,81 a -14,52 ± 2,52, p < 0,001 al cabo de 1 mes hasta -16,57 ± 2,52 al cabo de 1 año. No obstante, esta mejora temprana no se observó en el grupo RVAo, con la primera mejora detectable observada al año (-8,30 ± 1,99 a -16,12 ± 2,69; p < 0,001) (figura 2).
Figura 2. A: a nivel basal: bajo strain longitudinal global del ventrículo izquierdo (SLG-VI) previo al TAVI. B: 1 mes después de la intervención, el SLG-VI aumentó significativamente de -8,6 a -14,7. C: 1 año después del TAVI, el SLG-VI siguó mejorando y pasó de -14,7 a -19,8. ANT SEPT: anteroseptal; ANT: anterior; INF: inferior; LAT: lateral; POST: posterior; SEPT: septal.
Fuga valvular o periprotésica
Más pacientes del grupo TAVI desarrollaron fuga periprotésica leve o ≥ moderada, con 12 (38,7%) y 2 (6,5%) pacientes, respectivamente, en el seguimiento inmediato. Estos números aumentaron a 13 (41,9%) y 3 (9,7%) pacientes, respectivamente, al cabo de 1 año. Ninguno de los pacientes del grupo RVAo desarrolló fuga periprotésica ≥ moderada y solo 6 (17,6%) experimentaron fuga periprotésica leve no significativa al cabo de 1 mes. Un paciente pasó de fuga paravalvular leve a moderada al año, con una diferencia estadísticamente significativa entre los 2 grupos (p = 0,011 al mes y p = 0,042 al año).
Variabilidad inter e intraobservador
El coeficiente de correlación para la reproducibilidad interobservador del SLG-VI fue de 0,933 (intervalo de confianza del 95%: 0,894-0,957) y para el acuerdo intraobservador de aproximadamente 0,985 (IC95%, 0,976-0,991).
DISCUSIÓN
La ecocardiografía es el abordaje más efectivo para valorar el rendimiento de las válvulas protésicas, las complicaciones asocia- das a la prótesis, la geometría de las cámaras, el remodelado y la función cardiaca tras cualquier intervención valvular, quirúrgica o percutánea.
Nuestro estudio incluyó todas las categorías de riesgo quirúrgico. Siempre que fue posible, el TAVI fue la estrategia preferida para el recambio valvular aórtico para aumentar la experiencia de nuestro centro, salvo que estuviera contraindicado en opinión del equipo multidisciplinario (por un tamaño inadecuado del anillo, trombo en el VI, calcificación asimétrica de la válvula, distancia corta entre el anillo y el ostium coronario, acceso vascular inadecuado, trombos móviles en el arco o en la aorta ascendente, válvula bicúspide, valvulopatía o enfermedad coronaria significativas concomitantes que requieran intervención, o por la improbable mejora en la calidad de vida tras el TAVI por comorbilidades asociadas). El TAVI no fue inferior al RVAo en lo que se refiere a la mejora posoperatoria de los síntomas y a una hemodinámica valvular mejorada con mejores Vmax-VA, gradiente medio de presión medio de la VA y del área valvular aórtica indexada e incluso con mejores Vmax-VA y gradiente medio de presión de la AV en el seguimiento a corto y largo plazo. Estos hallazgos vienen avalados por la reciente actualización de las guías en materia de indicaciones para el TAVI14, que establecen firmemente este abordaje como alternativa al RVAo en el tratamiento de la EA en todas las categorías de riesgo quirúrgico tras la evolución continua del TAVI y los resultados de múltiples ensayos aleatorizados.
Las principales características fisiopatológicas de la EA son una mayor poscarga, el remodelado del VI, el aumento de la presión de llenado, la disfunción diastólica del VI y los síntomas de insuficiencia cardiaca. La disfunción diastólica es lo que primero sobreviene seguida de un aumento en la masa del VI15. Tras el TAVI, se observan descensos significativos inmediatos de los gradientes de presión transvalvular que se traducen en descensos inmediatos de la poscarga del VI, con un aumento en E y e’ secundario a una relajación diastólica temprana tras el TAVI en relación del RVAo.
Tras el RVAo, la disfunción transitoria perioperatoria del VI secundaria a la circulación extracorpórea es un factor bien conocido que puede influir negativamente en el remodelado del VI16. Esta disfunción transitoria del VI está asociada a marcadores bioquímicos elevados, como péptidos natriuréticos cerebrales y troponina I poco después del RVAo17,18. No obstante, estas consecuencias asociadas a la circulación extracorpórea no se observan tras el TAVI. En este sentido, el remodelado del VI puede reducirse poco después de la intervención gracias a una menor estimulación neurohormonal, lo cual mejora la hipertrofia del VI preoperatoria16.
Incluso con la función sistólica del VI mantenida tras la cirugía cardiaca, el grado de la relación E/e’ ha demostrado estar estrechamente vinculado a los niveles de péptidos natriuréticos cerebrales. Una presión auricular izquierda elevada acompañada de disfunción diastólica son los principales determinantes de la liberación de péptidos natriuréticos cerebrales en entornos clínicos19. El presente estudio destaca cómo la recuperación temprana de la presión de llenado del VI, indicada por un descenso temprano de Vmax-VA, GM-VA, relación E/e’ e índice de masa del VI, influye positivamente en el remodelado del VI, lo que a su vez se traduce en una mejora temprana de los parámetros de deformación del SLG-VI incluso sin cambios significativos en el porcentaje de FEVI tras el TAVI. Estos fenómenos podrían ayudar a explicar la evidencia de un mejor pronóstico a corto plazo en pacientes con EA grave tratados con TAVI20. Tras 1 año de seguimiento, ya no se observaban los mecanismos iniciales responsables de estos mejores resultados precoces, razón por la cual la distribución de cambios en la función diastólica del grupo RVAo fue parecida a la del TAVI15.
Aunque no parece que la insuficiencia de la válvula mitral se viera significativamente afectada dentro del mismo grupo en diferentes momentos de la valoración, sí mejoró en el grupo TAVI con respecto al RVAo.
Estos resultados contrastan con datos previamente publicados por Gonçalves et al.21. Aunque estos autores calcularon parámetros de la función diastólica del VI antes y minutos después del TAVI, no incluyeron una comparativa con un grupo quirúrgico. Encontraron un aumento significativo en el tiempo de desaceleración de la onda E, la velocidad de la onda E, así como un marcado descenso de la presión telediastólica del VI.
Además, Jin Ha et al.22 compararon el efecto que tuvo el TAVI frente al RVAo inmediatamente y 3 meses después del recambio valvular aórtico tanto en la función del VI como en los parámetros diastólicos. Encontraron que más pacientes mejoraron el grado de función diastólica del VI en el grupo TAVI que en el RVAo (42 frente al 11%). Se observó una mejora temprana en el grado de función diastólica acompañado de un descenso significativo inmediato de la relación E/e’ y la presión arterial pulmonar sistólica estimada en el grupo TAVI. Parecido a nuestro estudio, tanto la dimensión telediastólica como telesistólica del VI cambiaron significativamente a los 3 meses tras el RVAo. Este resultado podría explicarse por el uso frecuente de diuréticos tras la cirugía para tratar el derrame pleural y el posible edema pulmonar. No obstante, la insuficiencia de la válvula mitral no varió significativamente entre los 2 grupos y el índice de masa del VI tampoco experimentó un cambio significativo inmediato en ninguno de los grupos y comenzó a disminuir trascurridos 3 meses.
Guarracino et al.16 analizaron los péptidos natriuréticos cerebrales y la función diastólica del VI a través de la velocidad de propagación del flujo mitral y la velocidad diastólica temprana del anillo mitral antes y después de las intervenciones valvulares, y registraron una mejora de los parámetros diastólicos del VI en el grupo TAVI con subidas de los niveles de péptidos natriuréticos cerebrales en el grupo quirúrgico.
Asimismo, Fairbairn et al.23 hayaron una regresión temprana de la masa y un remodelado inverso del VI tras el TAVI frente al RVAo.
En cambio, Ngo et al.24 compararon a pacientes tratados de RVAo frente TAVI al cabo de 3 y 12 meses y hallaron descensos similares en el grosor relativo de la pared vascular en ambos grupos, y descensos más marcados del índice de masa del VI en pacientes tratados de RVAo (17,5 frente al 7,2%; p < 0,001).
En nuestro estudio, la función del ventrículo derecho no cambió mucho en los pacientes tratados con TAVI, y no se observaron cambios en la excursión sistólica del plano del anillo tricuspídeo ni subidas adicionales de la presión arterial pulmonar sistólica estimada con respecto a los pacientes tratados con RVAo. Kempny et al.25 confirmaron que, aunque el TAVI no influyó en la función del ventrículo derecho, esta sí empeoró en pacientes tratados con RVAo.
El aumento de la masa del VI y el mayor grosor relativo de la pared vascular provocado por una mayor poscarga del VI en pacientes con EA grave se asocian a una menor deformación miocárdica regional y global del VI según la ecocardiografía speckle tracking (rastreo de marcas) 2D. En este sentido, el SLG-VI es capaz de estimar, de manera precisa, la contractilidad miocárdica del VI y detectar cambios subclínicos en el rendimiento del VI en pacientes con EA26, lo cual mejora tras el recambio valvular aórtico27.
Son muchos los estudios que han demostrado que el TAVI se asocia a mejoras significativas tempranas de los parámetros de deformación del VI28,30 y que, a su vez, estas mejoras están asociadas a pronósticos más favorables25. Parecido a lo descrito en nuestro estudio, aunque el SLG-VI mejoró significativamente justo después del TAVI, este no fue el caso con la fracción de eyección.
Tsampasian et al.31 valoraron el SLG-VI antes y después del TAVI en 85 pacientes, con un seguimiento medio de 49 ± 39 días. El TAVI provocó mejoras significativas tempranas en el SLG (que pasó de -13,96 a -15,25, p = 0,01) y en la regresión temprana de la masa del VI sin que se observaran cambios en el porcentaje de fracción de eyección. El tipo de válvula no influyó en la función ni en el remodelado del VI tras el TAVI.
La fuga periprotésica leve o moderada persistente es un conocido predictor de malos resultados tras el TAVI32. Sin embargo, en nuestro estudio, aunque más pacientes desarrollaron fuga periprotésica significativa tras el TAVI que tras el RVAo en seguimientos a corto y largo plazo, el SLG-VI mejoró poco después del TAVI. Este hallazgo viene avalado por los hallazgos hechos por Kampaktsis et al.33 que estudiaron el impacto de la fuga periprotésica en el remodelado del VI y SLG-VI y describieron mejoras significativas del SLG-VI con independencia de la fuga periprotésica, al tiempo que esta influyó negativamente en el porcentaje de FEVI, la regresión de la masa del VI y la función diastólica. Como un número reducido de nuestros pacientes incluidos podría haber influido negativamente en el potencial estadístico de estos hallazgos, los pacientes con, ante todo, insuficiencia aórtica o disfunción grave del VI (FE < 35%) fueron excluidos para eliminar el efecto adverso de tales factores de confusión en el remodelado del VI.
Limitaciones
Este estudio tiene algunas limitaciones. La primera es el tamaño reducido de la muestra debido al número limitado de pacientes tratados con TAVI en nuestro centro en el momento de la inscripción. Un tamaño de muestra más grande habría mejorado el potencial estadístico y la extrapolación de los hallazgos. En segundo lugar, se trata de un estudio unicéntrico no aleatorizado, lo cual podría introducir sesgo de selección y potencialmente afectar la validez de la comparativa entre ambas intervenciones. En tercer lugar, no estudiamos otros factores de confusión que influyen en el remodelado posoperatorio del VI, tales como la hipertensión, la insuficiencia renal y la disfunción ventricular basal. En cuarto lugar, el estudio comunicó datos de seguimiento a 1 mes y 1 año tras la intervención. Un seguimiento a más largo plazo proporcionaría una comprensión más completa de los resultados del remodelado del VI.
CONCLUSIONES
Comparados con los pacientes tratados con RVAo, los tratados con TAVI mejoraron antes el remodelado y la función diastólica del VI, con descensos precoces del índice de masa del VI, la relación E/e’ y mejoras significativas tempranas del SLG-VI sin cambios concomitantes en el porcentaje de FEVI, mientras mantenían la función del ventrículo derecho. No obstante, estos pacientes también mostraron un deterioro rápido de la válvula y una incidencia más alta de fugas valvulares y periprotésicas. Más pacientes tratados con TAVI experimentaron bloqueo auriculoventricular completo, hubo que implantarles marcapasos permanentes y tuvieron complicaciones vasculares relacionadas con el sitio de acceso.
FINANCIACIÓN
Ninguna.
CONSIDERACIONES ÉTICAS
Se obtuvo el consentimiento informado por escrito de todos los participantes del estudio. El estudio fue aprobado por el Comité de Ética local de la Facultad de Medicina de Tanta University Hospital (código de aprobación: 36264PR12/1/23). No se tuvieron en cuenta las variables de sexo ni de género según las directrices SAGER.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial en la preparación de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORES
S.B. El-Saied: diseño del estudio, realización de ecocardiografías para los pacientes y redacción del manuscrito. R. Atlm y M. Elbarbary: obtención y análisis de datos y revisión del manuscrito y los resultados. A. Ghoneim y M.H. Sherif: contribuyeron a la redacción del manuscrito, obtención y análisis de datos y revisión del manuscrito y los resultados. S.B. El-Saied, R. Atlm, A. Ghoneim, M.H. Sherif y M. Elbarbary revisaron el trabajo y aprobaron la versión final para su publicación.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- La EA calcificada degenerativa es la valvulopatía más prevalente a nivel mundial. El RVAo es el patrón oro para casos graves.
- El TAVI se ha convertido en un tratamiento alternativo menos invasivo con una recuperación más rápida y una menor mortalidad perioperatoria.
- El recambio valvular aórtico influye significativamente en el remodelado del VI, reduce los síntomas y aumenta la supervivencia general.
- Aunque las guías actuales utilizan el porcentaje de FEVI para valorar la función del VI, puede sobrevenir disfunción miocárdica subclínica a pesar de un porcentaje normal de FEVI.
- El análisis de SLG se ha utilizado para caracterizar con precisión la función sistólica miocárdica regional y global, superando las limitaciones de la fracción de eyección.
¿QUÉ APORTA DE NUEVO?
- El estudio comparó el impacto que tuvo el recambio valvular aórtico utilizando TAVI o RVAo en parámetros como la hemodinámica de la prótesis, la fuga valvular, el implante de marcapasos y el remodelado del VI.
- El TAVI se asoció a mejoras más precoces en el remodelado y función diastólica del VI comparado con el RVAo, descensos en el índice de masa del VI, la relación E/e’ y mejoras en el SLG-VI con mantenimiento de la función del VD.
- No obstante, el TAVI se asoció a deterioro valvular, fuga valvular, así como a una mayor incidencia de implante de marcapasos y complicaciones vasculares.
BIBLIOGRAFÍA
1. Thaden JJ, Nkomo VT, Enriquez-Sarano M. The global burden of aortic stenosis. Prog Cardiovasc Dis. 2014;56:565-571.
2. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374:1609-1620.
3. Kodali SK, Williams MR, Smith CR, et al. Two-year outcomes after transcatheter or surgical aortic-valve replacement. N Engl J Med. 2012;366:1686-1695.
4. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
5. Wenaweser P, Stortecky S, Schwander S, et al. Clinical outcomes of patients with estimated low or intermediate surgical risk undergoing transcatheter aortic valve implantation. Eur Heart J. 2013;34:1894-1905.
6. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. N Engl J Med. 2019;380:1706-1715.
7. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med. 2019;380:1695-1705.
8. Hein S, Arnon E, Kostin S, et al. Progression from compensated hypertrophy to failure in the pressure-overloaded human heart:structural deterioration and compensatory mechanisms. Circulation. 2003;107:984-991.
9. Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease:a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135:e1159-e1195.
10. Reisner SA, Lysyansky P, Agmon Y, Mutlak D, Lessick J, Friedman Z. Global longitudinal strain:a novel index of left ventricular systolic function. J Am Soc Echocardiogr. 2004;17:630-633.
11. Popma JJ, Adams DH, Reardon MJ, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll of Cardiol. 2014;63:1972-1981.
12. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults:an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;16:233-271.
13. Notomi Y, Shiota T, Popovic´ZB, et al. Measurement of ventricular torsion by two-dimensional ultrasound speckle tracking imaging. J Am Coll Cardiol. 2005;45:2034-2041.
14. Sundt TM, Jneid H. Guideline update on indications for transcatheter aortic valve implantation based on the 2020 American College of Cardiology/American Heart Association guidelines for management of valvular heart disease. JAMA Cardiol. 2021;6:1088-1089.
15. Douglas PS, Berko B, Lesh M, Reichek N. Alterations in diastolic function in response to progressive left ventricular hypertrophy. J Am Coll Cardiol. 1989;13:461-467.
16. Guarracino F, Talini E, Landoni G, Petronio S, Giannini C, Di Bello V. Effect of aortic valve surgery on left ventricular diastole assessed by echocardiography and neuroendocrine response:percutaneous versus surgical approach. J Cardiothorac Vasc Anesth. 2010;24:25-29.
17. Provenchère S, Berroeta C, Reynaud C, et al. Plasma brain natriuretic peptide and cardiac troponin I concentrations after adult cardiac surgery:association with postoperative cardiac dysfunction and 1-year mortality. Crit Care Med. 2006;34:995-1000.
18. Rieck ÅE, Gerdts E, Lønnebakken MT, et al. Global left ventricular load in asymptomatic aortic stenosis:covariates and prognostic implication (the SEAS trial). Cardiovasc Ultrasound. 2012;10:1-8.
19. Salustri A, Cerquetani E, Piccoli M, et al. Relationship between B-type natriuretic peptide levels and echocardiographic indices of left ventricular filling pressures in post-cardiac surgery patients. Cardiovasc Ultrasound. 2009;7:1-7.
20. Bleiziffer S, Ruge H, Mazzitelli D, et al. Survival after transapical and transfemoral aortic valve implantation:talking about two different patient populations. J Thoracic Cardiovasc Surg. 2009;138:1073-1080.
21. Gonçalves A, Marcos-Alberca P, Almeria C, et al. Acute left ventricle diastolic function improvement after transcatheter aortic valve implantation. Eur J Echocardiogr. 2011;12:790-797.
22. Ha SJ, Yoo SY, Hong MK, Hong GR. Immediate and evolutionary recovery of left ventricular diastolic function after transcatheter aortic valve replacement:comparison with surgery. Yonsei Med J. 2020;61:30.
23. Fairbairn TA, Steadman CD, Mather AN, et al. Assessment of valve haemodynamics, reverse ventricular remodelling and myocardial fibrosis following transcatheter aortic valve implantation compared to surgical aortic valve replacement:a cardiovascular magnetic resonance study. Heart. 2013;99:1185-91.
24. Ngo A, Hassager C, Thyregod HGH, et al. Differences in left ventricular remodelling in patients with aortic stenosis treated with transcatheter aortic valve replacement with corevalve prostheses compared to surgery with porcine or bovine biological prostheses. Eur Heart J Cardiovasc Imaging. 2018;19:39-46.
25. Kempny A, Diller GP, Kaleschke G, et al. Impact of transcatheter aortic valve implantation or surgical aortic valve replacement on right ventricular function. Heart. 2012;98:1299-304
26. Weideman F, Jamal F, Kowalski M, et al. Can strain rate and strain quantify changes in regional systolic function during dobutamine infusion, B-blockade, and atrial pacing—implications for quantitative stress echocardiography. J Am Soc Echocardiogr. 2002;15:416-424.
27. Delgado V, Tops LF, van Bommel RJ, et al. Strain analysis in patients with severe aortic stenosis and preserved left ventricular ejection fraction undergoing surgical valve replacement. Eur Heart J. 2009;30:3037-3047.
28. Giannini C, Petronio AS, Talini E, et al. Early and late improvement of global and regional left ventricular function after transcatheter aortic valve implantation in patients with severe aortic stenosis:an echocardiographic study. Am J Cardiovasc Dis. 2011;1:264-273.
29. Kempny A, Diller GP, Kaleschke G, et al. Longitudinal left ventricular 2D strain is superior to ejection fraction in predicting myocardial recovery and symptomatic improvement after aortic valve implantation. Int J Cardiol. 2013;167:2239-2243.
30. Schattke S, Baldenhofer G, Prauka I, et al. Acute regional improvement of myocardial function after interventional transfemoral aortic valve replacement in aortic stenosis:A speckle tracking echocardiography study. Cardiovasc Ultrasound. 2012;10:15.
31. Tsampasian V, Panoulas V, Jabbour RJ, et al. Left ventricular speckle tracking echocardiographic evaluation before and after TAVI. Echo Res Pract. 2020;7:29-38.
32. SáMP, Jacquemyn X, Van den Eynde J, et al. Impact of Paravalvular Leak on Outcomes After Transcatheter Aortic Valve Implantation:Meta-Analysis of Kaplan-Meier-derived Individual Patient Data. Struct Heart. 2023;7:100118.
33. Kampaktsis PN, Subramayam P, Sherifi I, et al. Impact of paravalvular leak on left ventricular remodeling and global longitudinal strain 1 year after transcatheter aortic valve replacement. Future Cardiology. 2021;17:337-345.