RESUMEN
La insuficiencia cardiaca (IC) es la principal causa de hospitalización en los países desarrollados. A pesar de las mejoras en el diagnóstico y las terapias, una proporción importante de pacientes con IC aún persisten muy sintomáticos o con pobre calidad de vida. La mayoría de estos pacientes, además, no son candidatos a trasplante cardiaco ni a asistencia ventricular de destino. Así pues, existe una necesidad clínica no cubierta de tratar a este creciente subgrupo de pacientes. Los nuevos dispositivos percutáneos para IC son una opción de tratamiento para mejorar los síntomas y la calidad de vida de estos pacientes. Los primeros estudios en humanos con estos dispositivos han mostrado unos resultados prometedores en términos de factibilidad, seguridad e integridad de los dispositivos. No obstante, todavía hay pocos datos sobre su eficacia. En esta revisión nos centramos en describir las características, las ventajas y los inconvenientes, así como las evidencias, de los 3 tipos principales de dispositivos percutáneos para la IC, con especial énfasis en la base fisiopatológica subyacente que justifica su diseño: los dispositivos de derivación interauriculares, que pretenden descomprimir la presión de la aurícula izquierda y así evitar el edema pulmonar; los dispositivos de ventriculoplastia, que restauran físicamente el ventrículo izquierdo en situaciones de mal remodelado ventricular; y los dispositivos de modulación del flujo cardiorrenal, diseñados para mejorar la diuresis en situación de IC aguda descompensada con síndrome cardiorrenal asociado.
Palabras clave: Insuficiencia cardiaca. Nuevas terapias. Cardiología intervencionista.
ABSTRACT
Heart failure (HF) is the leading cause of hospitalization in the Western world. Despite improvements in diagnostic tools and therapies, a substantial number of patients with HF still remain highly symptomatic, with a poor quality of life. Most of these patients are ineligible for heart transplantation or left ventricular assist device placement, which underscores an unmet clinical need in this population. Novel device-based HF therapies represent therapeutic options for these patients to improve their symptoms and quality of life. First-in-man studies showed promising results in terms of feasibility, and device performances. However, there is still scarce data regarding efficacy. In this review, we focus on the pathophysiological rationale, emerging data, concerns, and future perspective behind the 3 most studied type of device-based HF therapy: interatrial shunt devices, designed to decompress the left atrium and prevent pulmonary edema; ventriculoplasty devices, designed to physically restore the left ventricle in patients with maladaptive left ventricular remodeling; and cardiorenal flow modulator devices, designed to improve diuresis and renal function in acute decompensated heart failure with cardiorenal syndrome.
Keywords: Heart failure. Novel devices. Interventional cardiology.
Abreviaturas
DDIA: dispositivo de derivación interauricular; IC: insuficiencia cardiaca; ICAD: insuficiencia cardiaca aguda descompensada; ICFEr: insuficiencia cardiaca con fracción de eyección reducida; TMOG: tratamiento médico optimizado según guías. VD: ventrículo derecho; VI: ventrículo izquierdo.
INTRODUCCIÓN
La insuficiencia cardiaca (IC) es la principal causa de hospitalización en Occidente además de un grave problema de salud pública. En los países desarrollados, la prevalencia estimada de la IC está en torno al 1-2% en la población adulta llegando al 10% en pacientes > 70 años1. A pesar de las mejoras en las herramientas diagnósticas y los tratamientos médicos, como, por ejemplo, la monitorización continua de la presión arterial pulmonar o fármacos como el sacubitrilo o los inhibidores del cotransportador sodio-glucosa tipo 2, una proporción significativa de pacientes con IC siguen sintomáticos y con mala calidad de vida2-4. Según los últimos datos europeos, los índices anuales de mortalidad y rehospitalización en pacientes con IC se sitúan en torno al 7-17% y al 34-44%, respectivamente4. En su mayoría estos pacientes no son aptos para recibir un trasplante cardiaco ni un dispositivo de asistencia ventricular izquierda, lo cual revela una necesidad clínica no cubierta en este subgrupo poblacional que está en continuo crecimiento. Esto ha dado a lugar al desarrollo de nuevos tratamientos mínimamente invasivos que se basan en el uso de nuevos dispositivos diseñados específicamente para trata la IC en distintos contextos. Estas nuevas terapias pueden ser una opción real para mejorar la calidad de vida y reducir las rehospitalizaciones por IC o incluso la mortalidad de estos pacientes, qué, a pesar de estar bajo tratamiento médico optimizado según guías (TMOG) aún persisten severamente sintomáticos y con pobre calidad de vida. Todo ello está contribuyendo a la creación de una nueva subespecialidad dentro de la cardiología intervencionista: la terapia intervencionista en IC.
En este artículo se revisa la base fisiopatológica que justifica el diseño de algunos de estos dispositivos, así como los datos a favor y en contra que conocemos hasta la fecha.
DISPOSITIVOS DE DERIVACIÓN INTERAURICULAR
El primer signo de afectación del ventrículo izquierdo (VI) (independientemente de la fracción de eyección) es la elevación de la presión telediastólica del ventrículo izquierdo, que se transmite de forma retrógrada a la aurícula izquierda y de esta al capilar pulmonar provocando la aparición de síntomas como la disnea y, en última instancia y si no se trata, el edema pulmonar5. Los dispositivos de derivación interauricular (DDIA) crean una comunicación interauricular permanente mediante un abordaje transeptal percutáneo convencional. El objetivo es descomprimir la presión de la aurícula izquierda para atenuar o incluso revertir el mecanismo subyacente del edema pulmonar6. No obstante, el shunt interauricular izquierda-derecha puede aumentar la precarga ventricular derecha (VD) y, en última instancia, causar una dilatación de las cavidades derechas. Estudios publicados sugieren que el tamaño del shunt juega un papel clave. El tamaño ideal del shunt debería permitir rebajar la presión de la aurícula izquierda sin causar un perjuicio de la función cardiaca derecha: DDIA demasiado grandes pueden provocar un aumento de la relación Qp/Qs que puede afectar al VD; por otro lado, DDIA demasiado pequeños pueden tener efectos de descompresión clínica y hemodinámicamente insignificantes. Los primeros estudios realizados en humanos sugieren que un shunt de < 10 mm probablemente no sea hemodinámicamente significativo (por ejemplo, una relación Qp/Qs > 1,5) como para comprometer el tamaño o la función del VD7. Los 2 dispositivos de shunt más estudiados hasta la fecha tienen aperturas con diámetros de 5mm (dispositivo V-Wave, V-Wave Ltd., Israel) y 8 mm (Dispositivo de Derivación Interauricular, Corvia Medical, Estados Unidos) (figura 1A, figura 1B y tabla 1)8. Los pacientes con aurículas (o VD) rígidas o fibróticas también son motivo de preocupación. En este escenario, ni la aurícula derecha ni el VD pueden asumir una mayor precarga. Por todas estas razones, los pacientes con miocardiopatía restrictiva, hipertensión pulmonar (resistencia vascular pulmonar > 4 unidades Wood) o disfunción VD son excluidos de estudios que evalúan shunts interatriales. Por último, también son motivo de preocupación la potencial aparición de eventuales accidentes cerebrovasculares paradójicos secundarios a una eventual inversión transitoria del flujo (de derecha a izquierda) asociados al uso de esta tecnología.
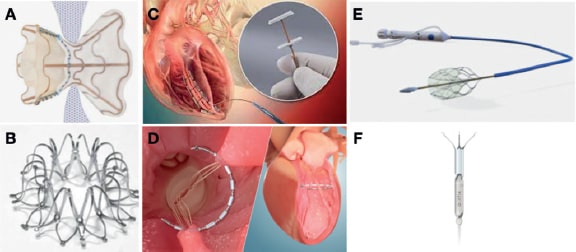
Figura 1. Dispositivos empleados en terapéutica intervencionista en insuficiencia cardiaca A: V-Wave (V-Wave Ltd., Israel) es un dispositivo de derivación interauricular con un marco de nitinol autoexpandible en forma de reloj de arena y una falda de PTFE expandida con un agujero central de 5 mm. B: Dispositivo de Derivación Interauricular (Corvia Medical, Estados Unidos) con un agujero central de 8 mm. C: Sistema de remodelado ventricular AccuCinch (Ancora Heart, Estados Unidos): dispositivo de ventriculoplastia izquierda completamente percutáneo. D: Sistema TC Revivent (BioVentrix Inc., Estados Unidos): dispositivo de ventriculoplastia izquierda que emplea microanclas para excluir cicatrices mediante un abordaje híbrido (yugular más minitoracotomía lateral). E: Catéter Doraya (Revamp Medical, Israel): reduce tanto la hipertensión renal venosa como la precarga para mejorar la diuresis en el tratamiento de la insuficiencia cardiaca aguda descompensada (ICAD) con síndrome cardiorrenal (SCR). F: Dispositivo Aortix (Procyrion Inc., Estados Unidos): bomba que mejora la presión de perfusión de las arterias renales y reduce la post-carga del ventrículo izquierdo. Se espera que Aortix sirva, también, para mejorar la diuresis en el tratamiento de la ICAD con SCR.
Tabla 1. Mecanismo de los dispositivos, características y evidencia de los dispositivos empleados en terapéutica intervencionista en insuficiencia cardiaca
| Dispositivo | Mecanismo y características del dispositivo | Estudio | Diseño del estudio | Principales criterios de inclusión | N | Principales resultados |
|---|---|---|---|---|---|---|
| V-Wave | – Shunt interauricular (abordaje transeptal) – Completamente percutáneo (vía vena femoral mediante un sistema de liberación de 12 Fr) – Dispositivo en forma de reloj de arena montado sobre un marco de nitinol autoexpandible con una falda de PTFE expandida – Diámetro luminal: 5 mm – La segunda generación no dispone de válvula unidireccional que garantice el shunt izquierda-derecha |
VW-SP-1 + cohorte canadiense8 | Multicéntrico, abierto, de un único grupo, fase I y con un seguimiento de 12 meses de duración | – Clase III-IV según NYHA; ≥ 1 Hospitalización por IC durante el último año con valores PNC ↑ |
38 (30 con ICFEr) | – Incidencia de MACE al año: 2,6% (1 taponamiento) – Mejoras significativas de la clase NYHA, CdV, KCCQ – Aumento significativo de la relación Qp/Qs |
| RELIEVE-HF NCT03499236 |
ECA multicéntrico, controlado simulado, ciego, con una ratio de asignación 1:1 y un seguimiento de entre 1 y 2 años de duración | – Clase II-IV según NYHA; ≥ 1 Hospitalización por IC durante el último año con valores PNC ↑ PEP > PAD; RVP < 4 UW; apto para abordaje transeptal |
500 (en curso) | En fase de inclusión (se completará en 2022) – Objetivos: EADM, MACE, NYHA, KCCQ y PM6M |
||
| Dispositivo de Derivación Interauricular | – Shunt interauricular (abordaje transeptal) – Completamente percutáneo (vía vena femoral) – Marco metálico de nitinol autoexpandible con un diseño en doble disco y una abertura en el centro – Agujero central de 8 mm |
REDUCE LAP-HF NCT01913613 |
Multicéntrico, abierto, de un único grupo y con un seguimiento de 6 meses de duración | – Clase II-IV según NYHA; FEVI > 40%; PEP ≥ 15 mmHg (o 25 mmHg en ejercicio) | 64 | – No MACE, el 52% experimentó un descenso de la PEP en reposo, el 54% un descenso de la PEP en ejercicio acompañado de una mejoría de la clase NYHA, CdV y PM6M |
| REDUCE LAP-HF I NCT02600234 |
ECA multicéntrico, controlado simulado, doble ciego, con una ratio de asignación 1:1 y un seguimiento de 1 año de duración | – Clase III-IV según NYHA; FEVI > 40%; PEP en ejercicio ≥ 25 mmHg; PEP-PAD ≥ 5 mmHg; hospitalización por IC previa o valores PNC ↑ | 44 | – Descenso de la PEP en ejercicio, incidencia similar de MACCE y ausencia de accidentes cerebrovasculares en ninguno de los 2 grupos – Tendencias hacia menos hospitalizaciones por IC, mejor CdV y tamaño del VD en el grupo tratado con el dispositivo |
||
| Sistema TC Revivent | – Ventriculoplastia – Híbrido (vena yugular + minitoracotomía lateral) – Anclas y cierre externo en la superficie epicárdica del VI |
REVIVE-HF NCT03845127 |
ECA multicéntrico y prospectivo con un seguimiento de 6 meses de duración (ratio de asignación 2:1; dispositivo frente a tratamiento médico optimizado según guías) | – Síntomas de IC con infarto de miocardio previo, mayor volumen sistólico VI y cicatriz contigua localizada en la pared anterior/apical del VI | 180 (en curso) | En fase de inclusión (se completará en 2022) – Objetivos: distancia PM6M a los 6 meses, CdV a los 6 meses, cambio en la clase NYHA a los 6 meses, VTDVIi a los 6 meses y FEVI a los 6 meses |
| Sistema de remodelado ventricular AccuCinch | – Ventriculoplastia – Completamente percutáneo; vía arteria femoral, abordaje aórtico retrógrado; diseñado inicialmente para la insuficiencia mitral – Se aseguran las anclas al aparato subvalvular mitral |
CORCINCH-HF NCT04331769 |
ECA multicéntrico, abierto y con un seguimiento de 5 años de duración | – Clase II-IV según NYHA; FEVI entre el 20 y el 40%; y DTVI > 55 mm; distancia PM6M entre 100 y 450 m | 400 (en curso) | En fase de inclusión (se completará en 2025) – Objetivos: EAM a los 6 meses y 1 año, cambios en la puntuación obtenida en el KCCQ, cambios en la PM6M, compuesto de mortalidad por cualquier causa, implante de DAVI o trasplante cardiaco, hospitalizaciones por IC y cambios en la puntuación obtenida en el KCCQ |
| Cerclaje de los músculos papilares | – Ventriculoplastia – Vía arteria femoral, abordaje aórtico retrógrado – Injerto de PTFE de 4 mm que se implanta alrededor de la base de los músculos papilares y, luego, se tensa |
NCT04475315 | ECA abierto de un único centro (ratio de asignación 1:1; CABG frente a CABG + cerclaje) con un seguimiento de 5 años de duración | – Clase II-IV según NYHA; DTVI ≥ 55; FEVI entre el 20 y el 40%; IMF ≤ 2+; distancia de separación interpapilar telediastólica ≥ 20 mm; miocardiopatía isquémica o no isquémica | 40 (en curso) | En fase de inclusión (se completará en 2026) – Objetivos: cambios en FEVI, volumen del VI, mortalidad, MACE, gravedad de la insuficiencia mitral funcional, CdV, PM6M, rehospitalización por cualquier causa, rehospitalización por IC, así como en el área de tenting de la valvas de la válvula mitral |
| Catéter Doraya | – Modulador del flujo renal venoso vía vena femoral (mediante un sistema de liberación de 12 Fr) – Descenso de la hipertensión renal y precarga VD |
NCT03234647 | Primer estudio multicéntrico y de un único centro realizado en humanos sobre viabilidad y seguridad | – ICAD con mala respuesta diurética | 9 | La fase de inclusión finalizó en mayo de 2021 – Adversos eventos graves asociados al dispositivo o a la intervención al cabo de 60 días |
| Aortix | – Modulador del flujo de las arterias renales vía vena femoral (mediante un sistema de liberación de 18 Fr) – Una bomba aumenta el flujo aórtico (hasta 5 l/min) y la presión de perfusión renal y reduce la poscarga del VI |
NCT04145635 | Estudio no controlado ni aleatorizado multicéntrico y prospectivo de viabilidad y seguridad | – ICAD con ICFEr o ICFEc – Empeoramiento de la función real tras 48 horas a tratamiento diurético IV (incremento de 0,3 mg/dl) – Congestión persistente (PEP ≥ 20 o presión venosa central ≥ 12 mmHg) |
60 (en curso) | En fase de inclusión (se completará en 2022) – Objetivos: eventos adversos graves a los 30 días, eventos adversos graves asociados a la intervención, rendimiento del dispositivo, descenso de la presión venosa central a los 7 días o PEP > 20%, cambios en la producción de orina y niveles de PNC más bajos en un 20% |
|
CABG: cirugía de revascularización coronaria; CdV: calidad de vida; DAVI: dispositivo de asistencia ventricular izquierda; DTVI: diámetro telediastólico del ventrículo izquierdo; EADM, eventos adversos asociados a dispositivos médicos; EAM: eventos adversos mayores; ECA: ensayo clínico aleatorizado; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; ICAD: insuficiencia cardiaca aguda descompensada; ICFEc: insuficiencia cardiaca con fracción de eyección conservada; ICFEr: insuficiencia cardiaca con fracción de eyección reducida; IV: intravenoso; KCCQ: Kansas City Cardiomyopathy Questionnaire; MACCE: eventos cardiovasculares y cerebrovasculares adversos mayores; MACE: eventos cardiovasculares adversos mayores; NYHA: New York Heart Association; PAD: presión auricular derecha; PEP: presión de enclavamiento pulmonar; PM6M: prueba de marcha de 6 minutos; PNC: péptido natriurético cerebral; RVP: resistencia vascular pulmonar; VD: ventrículo derecho; VI: ventrículo izquierdo; VTDVIi: volume telediastólico del ventrículo izquierdo indexado. |
||||||
La primera experiencia en humanos con los dispositivos V-wave y Corvia Medical confirmó mejoras importantes de la calidad de vida de los pacientes, así como alivio sintomático de la IC y mejoras en la capacidad de ejercicio6,8-9. En la actualidad, se están llevando a cabo varios estudios y ensayos clínicos aleatorizados con dispositivos DDIA en pacientes con IC sintomática a pesar del TMOG, tanto en pacientes con función sistólica del VI reducida como conservada, (tabla 1, estudios REDUCE LAP-ICFER [NCT03093961], REDUCE LAP-IC II [NCT03088033] y REDUCE LAP-IC IV [NCT04632160]).
VENTRICULOPLASTIA (REMODELADO DEL VENTRÍULO IZQUIERDO)
El VI tiene una arquitectura única con 3 orientaciones diferentes de las miofibrillas y una forma elipsoide elongada que son esenciales para su óptima función. Diferentes estados patológicos pueden provocar cambios tanto a nivel molecular como celular que alteren la oblicuidad de estas miofibrillas, que pasan a tener una disposición más horizontal lo cual provoca, a nivel macroscópico, la dilatación de las cámaras cardiacas y una mayor esfericidad. Esta respuesta adaptativa precoz es, en última instancia, perjudicial y tiende a la autoperpetuacion entrando en un círculo vicioso que resulta en una pérdida de función ventricular (remodelado maladaptativo). El remodelado maladaptativo del VI está claramente asociado a un mal pronóstico10.
La ventriculoplastia es una intervención que modifica anatómicamente la geometría del VI. Se basa en la ley de Laplace, en virtud de la cual la presión y la tensión sobre la pared del VI disminuye cuanto menor es el radio de la cavidad. Así pues, al reducir físicamente el radio del VI se revierte o atenua el remodelado maladaptativo del VI al disminuir la tensión sobre la pared de este. De esta forma, la ventirculoplastia pretende sacar del circulo vicioso en la que se encuentra un VI con remodelado maladaptativo. No obstante, la experiencia previa con la ventriculoplastia quirúrgica no mostró los resultados esperados, probablemente debido a desviaciones del protocolo de estudio y por problemas en la selección de los pacientes. Todo ello contribuyó a que la reducción del volumen del VI fuera menor a la esperada. Sin embargo, debemos mencionar que un análisis post hoc del citado estudio sí mostró buenos resultados en términos de descensos significativos de mortalidad a los 6 años en el subgrupo de pacientes con un volumen telesistólico del VI indexado < 70 ml/m2. Además, también se observó una clara tendencia a mayor supervivencia en los pacientes con reducción del 30% del volumen indexado telesistólico del VI11. A pesar de los controvertidos resultados de la ventriculoplastia quirúrgica del VI, la ventriculoplastia percutánea aún suscita un enorme interés, sobre todo, en pacientes con IC con fracción de eyección reducida (ICFEr). Hasta la fecha, se han desarrollado varios métodos para realizar la ventriculoplastia izquierda percutánea. En esta revisión nos centrarnos en los 3 métodos que han mostrado mejores resultados en los estudios iniciales: el sistema Revivent TC (BioVentrix Inc., Estados Unidos), el AccuCinch (Ancora Heart, Estados Unidos) y el cerclaje de los músculos papilares.
El sistema Revivent TC de BioVentrix se implanta mediante una intervención híbrida, transcatéte por abordaje yugular más minitoracotomía lateral quirúrgica. El sistema está diseñado para excluir cualquier aneurisma o cicatriz localizados en la pared anterior o apical del VI. Se coloca un ancla articulada en el lado derecho del septo interventricular distal (mediante abordaje yugular) y otra ancla externa de cierre sobre la superficie epicárdica del VI (vía minitoracotomía). Después, se utiliza un cable de amarre para juntar las 2 anclas hasta que las 2 paredes opuestas se toquen. Esta acción se repite por todo el eje largo del VI resultando en la exclusión del tejido cicatricial disfuncional (figura 1C). Los datos procedentes de un estudio de 86 pacientes mostraron la factibilidad y seguridad del sistema, así como evidencias en la mejora tanto en la fracción de eyección como en los volúmenes del VI, la calidad de vida y el estado funcional12. En la actualidad, hay 2 estudios en marcha analizando este tratamiento (el REVIVE-IC [NCT03845127] y el ALIVE [NCT02931240]) (tabla 1).
El sistema de remodelado ventricular AccuCinch incorpora un catéter con un trayecto prediseñado que se coloca mediante abordaje aórtico retrógrado para rodear el septo basal del VI y anclar una banda al segmento basal del miocardio del VI. Luego, se aplica tensión a un cable que reduce los diámetros de la pared basal y los volúmenes del VI13 (figura 1D). Aunque este dispositivo se diseñó originalmente para el tratamiento de la insuficiencia mitral funcional, hoy se emplea en pacientes con ICFEr. En la actualidad, se está llevando a cabo un importante ensayo clínico aleatorizado para analizar el uso de este dispositivo en pacientes con ICFEr frente a TMOG (tabla 1, CORCINCH-IC [NCT04331769]).
El sistema percutáneo de cerclaje de los músculos papilares está basado en una intervención quirúrgica ya existente que pretende reducir la distancia de separación de los músculos interpapilares laterales. Se emplea un cerclaje mediante abordaje aórtico retrógrado. En la actualidad, hay un estudio clínico que está analizado esta técnica en una cohorte quirúrgica (tabla 1, NCT04475315).
MODULACIÓN DEL FLUJO CARDIORRENAL
La IC aguda descompensada (ICAD) en pacientes con afectación de la función renal previas y/o síndrome cardiorrenal plantea un escenario extremadamente complejo para el manejo médico de estos pacientes. La fisiopatología del síndrome cardiorrenal es compleja, dinámica y multifactorial e incluye alteraciones tanto a nivel hemodinámico como del eje neurohumoral14. Datos de estudios previos sugieren que el gradiente de presión arteriovenosa a nivel del glomérulo renal debe ser lo bastante grande como para permitir un flujo sanguíneo renal y una filtración glomerular adecuados. Mantener este mecanismo hemodinámico parece esencial en pacientes con una afectación de la función renal preexistentes. En pacientes con ICAD y síndrome cardiorrenal se observa un descenso de la perfusión pre-renal junto con una hipertensión venosa renal. Esta última aumenta la resistencia renal que, a su vez, altera el flujo sanguíneo intrarrenal. El descenso de la perfusión renal se agrava por la vasoconstricción pre-glomerular que provoca la activación neurohumoral del eje renina-angiotensina-aldosterona, que resulta en una mayor reabsorción de sodio y agua en el túbulo proximal para mantener un volumen plasmático efectivo. Esto provoca oliguria, un empeoramiento de los síntomas congestivos y resistencia diurética. La relación que existe entre la resistencia diurética y mal pronóstico clínico en este contexto está bien establecida14.
Básicamente existen 2 tipos de dispositivos diseñados para interrumpir el círculo vicioso del síndrome cardiorrenal en la ICAD: los que reducen la hipertensión venosa renal como el catéter Doraya (Revamp Medical, Israel), y los que aumentan la presión de perfusión de las arterias renales como los dispositivos Aortix (Procyrion Inc., Estados Unidos) y Second Heart Assist (Second Heart LLC, Estados Unidos).
El catéter Doraya consta de un marco flexible de nitinol autoexpandible que está recubierto en su segmento distal para limitar el flujo sanguíneo. Se coloca en la vena cava inferior por debajo de la vena renal vía vena femoral empleando un sistema de liberación de 12 Fr. Actúa como un regulador temporal del flujo durante 24 horas. El Doraya provoca una caída temporal de la presión venosa central a nivel de las venas renales, lo cual además de aumentar el gradiente de presión a nivel glomerular mejorando la diuresis, reduce la precarga cardiaca y contribuye a la descarga del VI15 (figura 1E). El primer estudio clínico realizado en humanos para evaluar la seguridad, viabilidad y efectos hemodinámicos de este dispositivo en pacientes con ICAD, congestión y una respuesta inadecuada a los diuréticos finalizó la fase de inclusión en mayo de 2021 (tabla 1, NCT03234647).
Aortix es una bomba axial percutánea que se coloca en la aorta descendente a nivel suprarrenal vía abordaje transfemoral mediante un sistema de liberación de 18 Fr. Este dispositivo aumenta el flujo aórtico, reduce la post-carga y es capaz de bombear hasta 5 l/min (figura 1F). Un estudio realizado en pacientes sometidos a intervenciones coronarias percutáneas mostró un aumento de 10 veces en la producción de orina16. En la actualidad está en marcha un estudio para evaluar el perfil de viabilidad, seguridad y eficacia de Aortix en pacientes con ICAD (IC con fracción de eyección conservada e ICFEr) y síndrome cardiorrenal (tabla 1, NCT04145635).
En resumen, a pesar de las importantes mejoras en el manejo de la IC de los últimos años, aún persiste una proporción significativa de pacientes que persisten severamente sintomáticos y con mala calidad de vida. La terapia intervencionista en insuficiencia cardiaca es un campo nuevo y prometedor dentro de la cardiología intervencionista que puede ofrecer a estos pacientes una solución basada en la implantación de dispositivos percutáneos. Los shunts interauriculares, las ventriculoplastias percutáneas y los moduladores del flujo cardiorrenal son algunos de los dispositivos más importantes en este emergente campo de la cardiología.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Los autores han contribuido por igual en todas las fases de diseño y redacción de este manuscrito.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Ponikowski P, Voors AA, Anker SD, et al.;ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2016;37:2129-2200.
2. Bayes-Genis A, Codina P, Abdul-Jawad Altisent O, et al. Advanced remote care for heart failure in times of COVID-19 using an implantable pulmonary artery pressure sensor:the new normal. Eur Heart J Suppl. 2020;22:P29-P32.
3. Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375:323-334.
4. Maggioni AP, Dahlström U, Filippatos G, et al. EURObservationalResearch Programme:regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail. 2013;15:808-817.
5. Ritzema J, Troughton R, Melton I, et al. Physician-Directed Patient Self-Management of Left Atrial Pressure in Advanced Chronic Heart Failure. Circulation. 2010;121:1086-1095.
6. Del Trigo M, Bergeron S, Bernier M, et al. Unidirectional left-to-right interatrial shunting for treatment of patients with heart failure with reduced ejection fraction:a safety and proof-of-principle cohort study. Lancet. 2016;387:1290-1297.
7. Kaye DM, HasenfußG, Neuzil P, et al. One-Year Outcomes After Transcatheter Insertion of an Interatrial Shunt Device for the Management of Heart Failure With Preserved Ejection Fraction. Circ Heart Fail. 2016;9:e003662.
8. Rodés-Cabau J, Bernier M, Amat-Santos IJ, et al. Interatrial Shunting for Heart Failure:Early and Late Results From the First-in-Human Experience With the V-Wave System. JACC Cardiovasc Interv. 2018;11:2300-2310.
9. Feldman T, Mauri L, Kahwash R, et al. Transcatheter Interatrial Shunt Device for the Treatment of Heart Failure With Preserved Ejection Fraction (REDUCE LAP-HF I [Reduce Elevated Left Atrial Pressure in Patients With Heart Failure]). Circulation. 2018;137:364-375.
10. Adhyapak SM, Parachuri VR. Architecture of the left ventricle:insights for optimal surgical ventricular restoration. Heart Fail Rev. 2009;15:73-83.
11. Michler RE, Rouleau JL, Al-Khalidi HR, et al. Insights from the STICH trial:change in left ventricular size after coronary artery bypass grafting with and without surgical ventricular reconstruction. J Thorac Cardiovasc Surg. 2013;146:1139-1145.e6.
12. Klein P, Anker SD, Wechsler A, et al. Less invasive ventricular reconstruction for ischaemic heart failure. Eur J Heart Fail. 2019;21:1638-1650.
13. Gooley RP, Meredith IT. The Accucinch transcatheter direct mitral valve annuloplasty system. EuroIntervention. 2015;11(Suppl W):W60-1.
14. Rangaswami J, Bhalla V, Blair JEA, et al. Cardiorenal Syndrome:Classification, Pathophysiology, Diagnosis, and Treatment Strategies:A Scientific Statement From the American Heart Association. Circulation. 2019;139:e840-e878.
15. Dierckx R, Vanderheyden M, Heggermont W, Goethals M, Verstreken S, Bartunek J. Treatment of Diuretic Resistance with a Novel Percutaneous Blood Flow Regulator:Concept and Initial Experience. J Card Fail. 2019;25:932-934.
16. Vora AN, Schuyler Jones W, DeVore AD, Ebner A, Clifton W, Patel MR. First-in-human experience with Aortix intraaortic pump. Catheter Cardiovasc Interv. 2019;93:428-433.