RESUMEN
Inicialmente el clip mitral surge como alternativa a la cirugía en pacientes con insuficiencia mitral (IM) grave y alto riesgo quirúrgico. Sin embargo, recientemente se ha posicionado también como tratamiento de primera línea en pacientes con fracción de eyección del ventrículo izquierdo del 20-50%, con diámetro telesistólico ventricular izquierdo < 70 mm y presión sistólica pulmonar < 70 mmHg. Su éxito depende de la disminución de la gravedad de la IM. Los parámetros usados para cuantificar la IM nativa no se han validado de manera adecuada en presencia de clip, por lo que resulta controvertido establecer cuál es el método de elección para valorar la IM residual en la ecocardiografía transesofágica intraprocedimiento. La escasa evidencia disponible carece de estudios de validación. Pese a sus limitaciones, parece que el Doppler color, el área de superficie de isovelocidad proximal y su área derivada, la señal del Doppler continuo, el flujo transmitral y el volumen regurgitante no son fiables debido a los artefactos producidos por el clip. La combinación de la anchura de la vena contracta, el área de la vena contracta medida por ecografía tridimensional y el patrón del flujo en las venas pulmonares parece arrojar resultados satisfactorios. La evaluación integral con varios parámetros es lo más completo.
Palabras clave: Clip mitral. Insuficiencia mitral. Ecocardiografia transesofagica intraprocedimiento. Cuantificacion de la insuficiencia mitral.
ABSTRACT
Initially, percutaneous mitral clip emerges as an alternative to surgery in patients with severe mitral regurgitation (MR) and high surgical risk. Nonetheless, it is now also considered a first-line treatment in patients with left ventricular ejection fractions somewhere between 20% and 50%, end-systolic diameters < 70 mm, and pulmonary systolic pressures < 70 mmHg. Successful results depend on reducing the severity of MR. The common parameters used to evaluate native MR have not been properly validated in this context. Therefore, the parameters that should be used to quantify residual MR during intraprocedural transesophageal echocardiography are still under discussion. There is scarce evidence and no validation studies. Although these have limitations, color Doppler echocardiography, proximal isovelocity surface area (PISA) and its derived area, continuous-wave Doppler signal, transmitral flow, and regurgitant flow are not accurate parameters to quantify residual MR due to clip artifacts. On the other hand, the width of the vena contracta, the 3D-vena contracta area, and pulmonary venous flow are associated with a satisfactory approach. Using a comprehensive method is the most practical thing to do.
Keywords: Mitral clip. Mitral regurgitation. Intraoperative transesophageal echocardiography. Mitral regurgitation assessment.
Abreviaturas
IM: insuficiencia mitral. PISA: area de isovelocidad proximal. ETE: ecocardiografia transesofagica.
INTRODUCCIÓN
La reparación mitral percutánea con clip se desarrolló inicialmente como una alternativa terapéutica a la cirugía mitral en caso de riesgo quirúrgico inaceptable e insuficiencia mitral (IM) grave sintomática1,2. De acuerdo con la última evidencia científica, la Sociedad Europea de Cardiología y la American Heart Association han considerado el clip como tratamiento de primera línea en pacientes con IM grave sintomática pese a recibir un tratamiento médico óptimo, con fracción de eyección del ventrículo izquierdo del 20-50%, diámetro telesistólico ventricular izquierdo < 70 mm y presión sistólica pulmonar < 70 mmHg3,4. El procedimiento consiste en una aproximación central de los bordes libres de los velos, creando un doble orificio a ambos lados del dispositivo5.
La cuantificación de la IM sobre la válvula nativa supone un reto en la práctica clínica debido a la forma de la válvula (ovalada, 2 comisuras en distintos planos, dividida en 3 festones anteriores y 3 posteriores), la limitación de la ecocardiografía transtorácica y transesofágica en 2 y 3 dimensiones (2D y 3D) con respecto a la orientación del transductor y los cortes de los planos, y la dependencia del operador. Si se modifica la morfología de la válvula mediante un clip, la valoración aún puede ser más complicada.
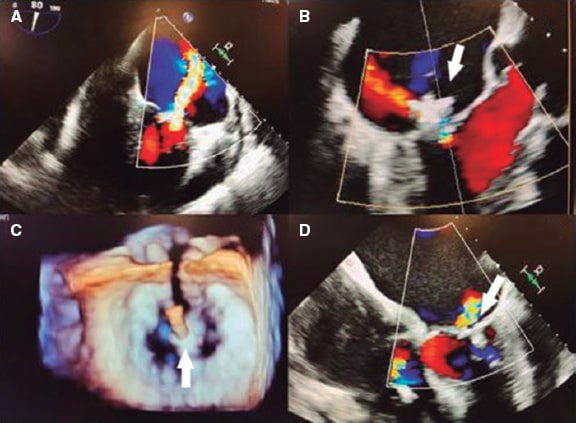
Cuando el clip aproxima los bordes libres de los festones centrales anterior y posterior (A2-P2) se producen una serie de modificacio- nes en el plano de coaptación que afectan a su valoración (figura 1)6: a) se crean 2 o más orificios de regurgitación (según el número de clips implantados) en la línea de coaptación, adyacentes al dispositivo; b) los nuevos orificios adoptan una geometría irregular en la que no deben aplicarse asunciones geométricas circulares o elípticas; y c) el dispositivo genera una sombra acústica sobre la válvula, que interfiere en la imagen del Doppler color (figura 2)7.
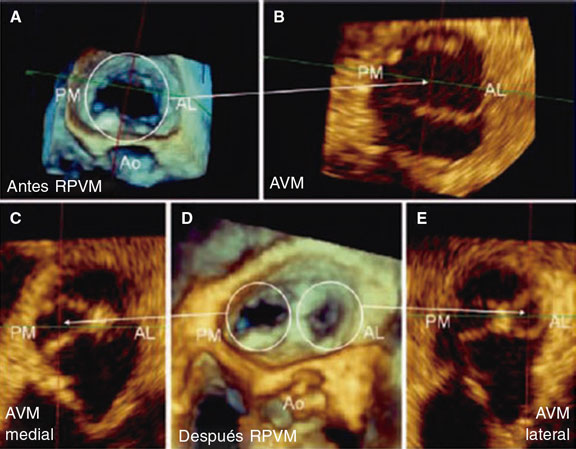
Figura 1. Imagen de ecocardiografía transesofágica tridimensional. A: área valvular mitral (AVM) antes de la reparación percutánea (antes RPVM), señalada dentro del círculo. B: comisura anterolateral (AL) y posteromedial (PM) antes de colocar el clip. La flecha indica el área valvular mitral. C: área valvular mitral del orificio) medial (AVM medial) tras colocar el clip (señalado con la flecha), delimitado por la comisura PM. D: doble orificio residual tras colocar el clip (después RPVM); el PM y el AL se señalan con círculos. E: área valvular mitral del orificio lateral (AVM lateral) residual tras colocar el clip (señalado con la flecha), delimitado por la comisura AL. Ambos orificios residuales se encuentran en distintos planos. Ao: aorta. Reproducida con permiso de Ikenaga et al.5.
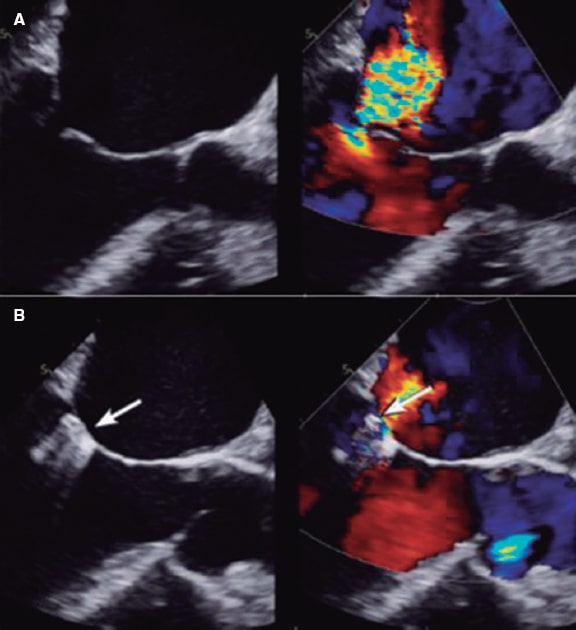
Figura 2. Imagen de ecocardiografía transesofágica bidimensional. A: insuficiencia mitral previa a la colocación del clip. B: se aprecia el clip como una sombra acústica. En la imagen en color se ve la dificultad de valorar el radio del área de isovelocidad proximal y la vena contracta por interferencia del dispositivo (señalado con la flecha). Reproducida con permiso de Mayo Clinic7.
Debido a esto, actualmente los parámetros de valoración de la IM clásicos no se deben aplicar a la IM residual tras el implante de un clip. No obstante, es importante una valoración adecuada, ya que determina el éxito del procedimiento y tiene valor pronóstico8. La IM residual > 2/4 supone un mayor riesgo de eventos cardiacos mayores, muerte cardiaca y cirugía de válvula mitral o re-do de reparación percutánea con clip, así como un mayor riesgo de progresión en el tiempo, más sintomatología y peor supervivencia a los 12 meses8-11. Por otro lado, el implante de excesivos clips puede aumentar el gradiente transmitral y producir estenosis mitral, lo cual también aumenta la mortalidad a los 12 meses12,13. Pese a esta importancia pronóstica, no hay un parámetro bien establecido ni guías con recomendaciones detalladas que basen los resultados en estudios observacionales y tomen como referencia la evaluación por operadores expertos.
Los estudios iniciales (EVEREST I14, COAPT15 y MITRA-FR16) realizaron las medidas en laboratorios centrales. En el caso del estudio EVEREST I14, la valoración de la gravedad de la IM residual se hizo mediante el área de color del chorro, el patrón del flujo en las venas pulmonares, el volumen regurgitante y la fracción regurgitante. Se describe específicamente que no se usan el área de isovelocidad proximal (PISA) ni la anchura de la vena contracta por las limitaciones visuales que el dispositivo genera al interferir en la imagen (figura 2)7. En el COAPT-Trial se especifica que no se obtuvo el PISA por la misma razón, y para la anchura de la vena contracta se escogía la del chorro predominante en caso de múltiples chorros, o bien se sumaba la de todos ellos17. Sin embargo, el estudio MITRA-FR reporta únicamente el área del orificio efectivo 2D y el volumen regurgitante16. Como puede apreciarse, hay disparidades entre los parámetros utilizados, lo que refleja la falta de consenso.
La evidencia científica tiene resultados controvertidos. Únicamente se dispone de una guía de la American Society of Echocardiography de 20192 y de un consenso de expertos de la Sociedad Europea de Ecocardiografía y la American Society of Echocardiography18. Basándose en esto, las recomendaciones hacen referencia a la valoración de la insuficiencia mediante ecocardiografía transesofágica (ETE) intraprocedimiento e inmediatamente posterior, teniendo en cuenta el efecto de la sedación o de la anestesia general2. Estas guías intentan orientar la valoración de la gravedad de la IM residual, pero sin directrices específicas, lo que genera variabilidad en los resultados de cada centro y deja la valoración sujeta a la experiencia del operador.
MÉTODOS
Se hizo una búsqueda bibliográfica en las principales bases de da- tos internacionales (PubMed, Embase y Cochrane), usando los si- guientes términos MeSH: “mitral regurgitation AND MitraClip AND echocardiographic assessment “, “severity of residual mitral regurgitation after MitraClip”, “3D vena contracta area after MitraClip”, “TEE vena contracta after MitraClip”, “vena contracta area and MitraClip”, “vena contracta area after MitraClip”, “pulmonary venous flow after MitraClip”, “MitraClip and pulmonary flow”,” pulmonary venous flow and prediction of MitraClip”, “continuous doppler mitral regurgitation after MitraClip”, “mitral regurgitation doppler signal after MitraClip”, “doppler wave after MitraClip”, “transmitral doppler after MitraClip”, “E-wave after MitraClip”, “spontaneous contrast in LA after MitraClip”, “ratio VTI mitral and VTI LVOT after MitraClip”, “stroke volume after MitraClip”, “PISA after MitraClip” y “EROA and PISA and MitraClip”. Se usaron los filtros de idioma en español e inglés, y no se especificó ningún límite de antigüedad.
RESULTADOS
La evidencia se basa en estudios de pequeño o mediano tamaño muestral, observacionales, que usan como referencia la valoración por un operador experto o los parámetros de los estudios originales que no están validados. Según las recomendaciones del consenso más reciente2, a continuación se resume la evidencia específica para cada parámetro.
Doppler color
Es una valoración visual del tamaño del chorro, del número de chorros y de su origen y dirección. Tiende a sobreestimar la gravedad en caso de chorros múltiples y a infraestimarla en caso de chorros excéntricos19, si bien sirve para hacer un barrido inicial de los chorros residuales. Lin et al.20 y Altiok et al.6 señalan que aunque el volumen regurgitante de una IM sea el mismo por un chorro que por varios, el área en color es mayor cuando son múltiples chorros y se sobreestima la gravedad (figura 3)20. Por estos motivos, se desestima en los estudios como parámetro aislado.
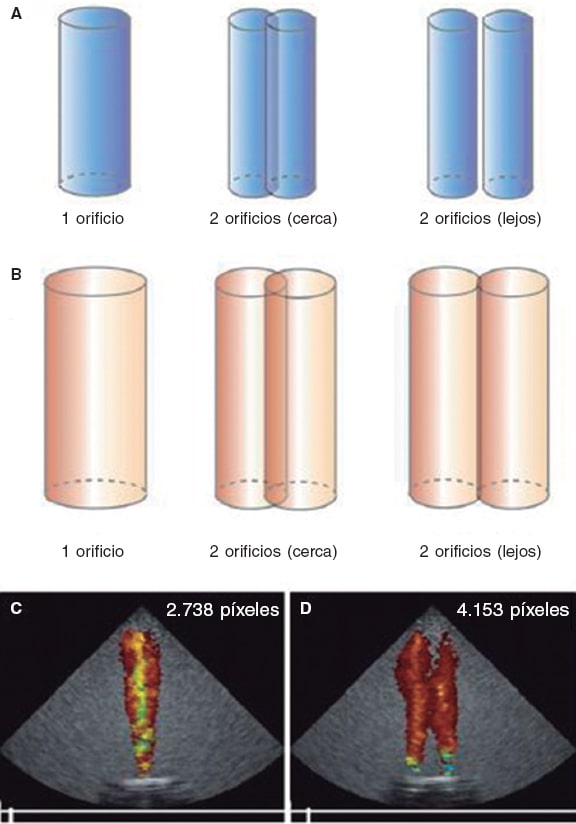
Figura 3. Influencia de la dinámica de fluidos en el área del chorro en color. El volumen de regurgitación desde el ventrículo hacia la aurícula genera una interfase de velocidad entre este y la sangre de la aurícula, creando una superficie de cizallamiento donde se producen vórtices de sangre que encarrilan más sangre de su alrededor. El área en color del chorro aparece magnificada con respecto al volumen de regurgitación inicial. En A y B se ve que cuando el mismo volumen pasa a través de 2 orificios, cercanos o distantes entre sí, ambos chorros se funden debido a la formación de vórtices y da la impresión de una mayor gravedad. En C y D se aprecia que, para un mismo volumen (10 ml), se duplica el número de píxeles generados en función del número de orificios. Reproducida con permiso de Lin et al.20.
Convergencia del flujo (radio del PISA)
Para el cálculo del radio del PISA y del área del orificio regurgitante derivada deben crearse hemiesferas de isovelocidad del flujo convergente. Cuando se interpone un clip, no pueden crearse estas hemiesferas y la medición es técnicamente errónea2. Así, en caso de múltiples chorros, de chorros excéntricos o de gran sombra acústica se tiende a infraestimar o sobrestimar la gravedad. No está definida la gravedad de la regurgitación según la suma de múltiples PISA, por lo que no puede aplicarse. Debido a estas limitaciones, en los estudios originales de la reparación percutánea con clip14-16 no se estudió el PISA (figura 2 y figura 4)7,21.
Figura 4. Imagen de ecocardiografía transesofágica bidimensional. Pue- de verse la sombra acústica producida por el clip (flecha). Reproducida con permiso de Lesevic et al.21.
Anchura de la vena contracta
Si el orificio regurgitante no se aprecia bien (chorro pequeño o excéntrico, interferencia del clip), la medida puede presentar un artefacto (figura 5)22. Se debe usar con precaución, pues no está validada y tampoco se han establecido valores de gravedad en caso de múltiples chorros14. No hay estudios que evalúen este parámetro específicamente. Las guías americanas2 solo establecen que un valor ≥ 7 mm es específico de gravedad, y dado que el estudio COAPT lo utilizó en su valoración de IM residual17, podría considerarse en la práctica, sobre todo en caso de un chorro predominante no excéntrico. En los chorros excéntricos, la medida es menos fiable (similar a la IM nativa) y se recomienda promediar varios latidos2, pero se desestima como parámetro aislado.
Figura 5. Imágenes de ecocardiografía transesofágica bidimensional y tridimensional. A: insuficiencia mitral grave inicial. B: insuficiencia mitral residual tras la colocación del clip; se aprecia la interferencia del dispositivo (flecha) en la visualización de la vena contracta. C: imagen tridimensional del clip (flecha) y los 2 orificios residuales. D: Doppler color que muestra la insuficiencia mitral residual sin que pueda visualizarse la vena contracta por interferencia del clip (flecha). Reproducida con permiso de Elbey et al.22.
Área de la vena contracta tridimensional
Permite una mejor delineación del orificio regurgitante, pero con riesgo de efecto blooming (magnificación del área por una alta ganancia del Doppler color). Según el consenso citado2, se debe hacer de cada chorro por separado y luego sumar las áreas.
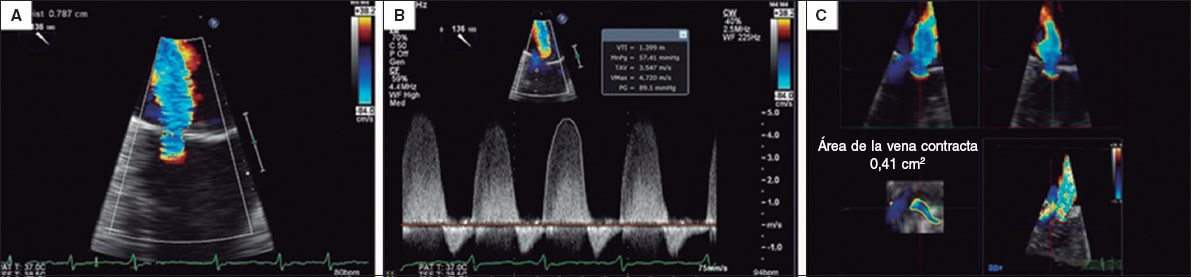
El área de la vena contracta por planimetría 3D es uno de los parámetros más estudiados para evaluar la IM tras la implantación de un clip, por su precisión y reproducibilidad, con escasa variabilidad interobservador21,23. Si bien no fue un parámetro usado en los primeros estudios14, ha ido ganando protagonismo. Esto se debe a la mejor delineación del orificio, sin asunciones geométricas, y a que no presenta los inconvenientes de los artefactos creados en otras medidas (figura 6)24. Su uso se apoya en que el parámetro más sólido para cuantificar la IM nativa es el área del orificio regurgitante19. Para su cálculo, varios estudios han demostrado que la planimetría 3D directa por ETE es el método más reproducible y preciso6,13,23.
Figura 6. Imagen de ecocardiografía transesofágica bidimensional. En A y B se calcula el área efectiva del orificio regurgitante según el área de isovelocidad proximal, con un resultado de 0,32 cm2. Cálculo del área de isovelocidad proximal 2D: área efectiva del orificio regurgitante = 2π × r2 × velocidad de aliasing / velocidad máxima de la insuficiencia mitral = [6,28 × (0,79) 2 × 38,2] / 472 = 150 / 472 = 0,32 cm2. C: cuando se realiza la medida por planimetría directa 3D, el resultado es de 0,41 cm2. La determinación directa por planimetría 3D permite una medida más fiable del orificio al eliminar los artefactos derivados de la medida indirecta. Reproducida con permiso de Katz et al.24.
Hyodo et al.25 valoraron si era adecuada la medida 3D de múltiples áreas de la vena contracta para cuantificar la gravedad de la IM en válvulas nativas. Hasta entonces se conocía su utilidad en chorros únicos, pero este fue el primer estudio en aportar resultados con múltiples chorros. Aunque se trata de un estudio de pequeño tamaño muestral (n = 60), en él se demostró una alta correlación entre el área 3D y el área del orificio regurgitante medida por termodilución como método de referencia. La correlación era más evidente en chorros moderados o graves, mientras que se sobrestimaba en caso de chorros ligeros. Tras su implementación en la IM sobre válvula nativa, se valoró su utilidad en los pacientes con clip mitral. En esta línea, Avenatti et al.13 llevaron a cabo un estudio retrospectivo con 155 pacientes. Se aplicó la suma de las áreas de múltiples chorros y se compararon los resultados entre el laboratorio de ecocardiografía local y ecocardiografistas expertos de 2 centros de alto volumen. En las curvas ROC (receiver operating characteristic) determinaron un umbral de 0,27 cm2 para identificar IM moderada o más grave, con un área bajo la curva de 0,81 y un valor predictivo negativo del 92%. Aunque presenta limitaciones, sus resultados son congruentes con los de otros registros y estudios observacionales rea- lizados en centros expertos14,26, que abogan por el uso de esta nueva medida, pero con la necesidad de estudios de validación. Sin embargo, hay que ser precavido respecto a la suma de las áreas de varios chorros, pues solo se cuenta con los 2 estudios mencionados, que en total suman 215 pacientes.
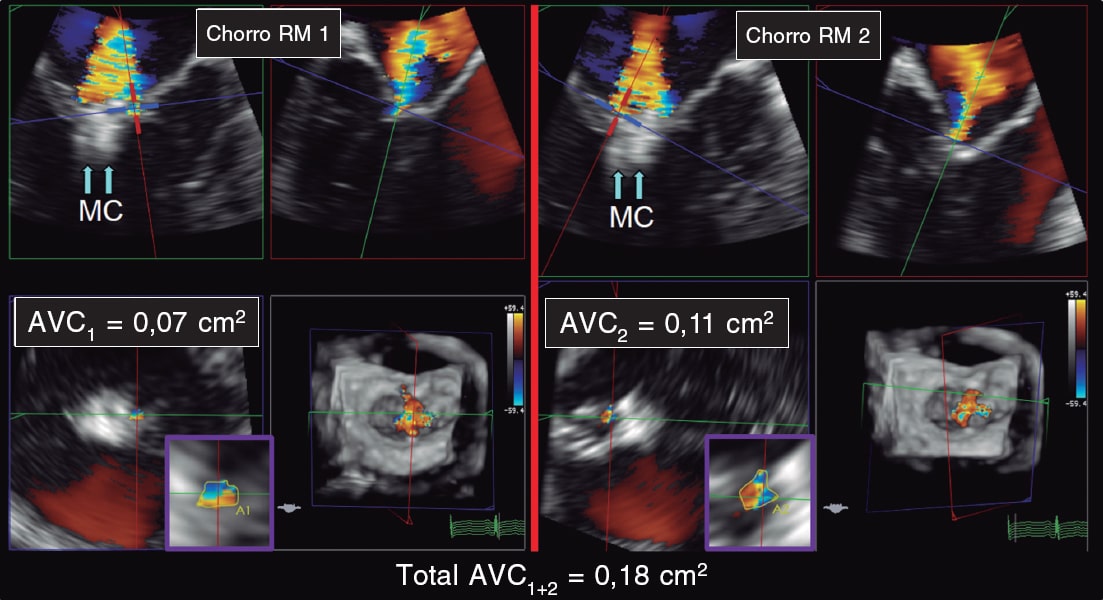
Por último, Altiok et al.6 aportaron más luz sobre la utilidad del área de la vena contracta medida por ecocardiografía 3D en la IM residual. En 39 pacientes, compararon las medidas del área del orificio regurgitante de la IM residual obtenidas por ecocardiografía transtorácica 2D (a través del PISA) con ETE 3D (área por planimetría de la vena contracta). En sus resultados, la variabilidad interobservador era mayor con la 2D que con la 3D, lo que pone de manifiesto la precisión que otorga la visualización directa del orificio regurgitante comparada con la medida indirecta a través del PISA, que infraestima la gravedad. De esta manera, aunque tampoco es un estudio de validación del área por ETE 3D de la vena contracta, puede concluirse que la medida directa del área por ETE 3D es reproducible y factible en esta población (figura 7 y figura 8)13.
Figura 7. Imágenes de ecocardiografía transesofágica bidimensional y tridimensional. A: se aprecia un primer chorro de insuficiencia mitral (chorro RM 1) tras la colocación del clip (flechas, MC). B: se aprecia un segundo chorro (chorro RM 2) tras la colocación del clip (flechas, MC). C: cálculo del área 3D con la vena contracta (VCA1) del primer chorro, con resultado de 0,07 cm2. D: cálculo del área 3D con la vena contracta (VCA2) del segundo chorro, con resultado de 0,11 cm2. La suma de las áreas 3D por vena contracta (total VCA1+2) es de 0,18 cm2. AVC: área de la vena contracta; MC: MitraClip; RM: regurgitación mitral. Reproducida con permiso de Avenatti et al.13.
Figura 8. Imágenes de ecocardiografía transesofágica tridimensional para valorar el área de la vena contracta. A: Doppler color 3D de insuficiencia mitral residual tras la colocación del clip. B: alineación de los ejes para obtener el área 3D de la vena contracta. C: trazado de la planimetría 3D. Reproducida con permiso de Avenatti et al.13.
En conclusión, el área de la vena contracta por ETE 3D es un parámetro prometedor, y el único que permitiría la suma de varios chorros12, aunque su uso está en fase precoz y es necesaria más evidencia. Es un método laborioso, pues requiere análisis con software y está sujeto al efecto blooming, que puede sobrestimar el área. Además, en caso de hacer la medida del área del orificio regurgitante con color, esta se ve afectada por la resolución temporal y la configuración de la velocidad de aliasing (saturación de la señal), que no está estandarizada en los distintos software12. Debido a estas limitaciones, en la práctica es difícil de aplicar y no es el principal parámetro utilizado. Posiblemente su utilidad sea mayor en caso de chorros excéntricos27, dado que en estos tiende a haber una asimetría inicial entre los velos, por lo que el chorro residual puede ser excéntrico aunque se implante adecuadamente un clip. La planimetría directa por 3D será más precisa, como muestra el estudio de Utsonomiya et al.27, si bien no hay más literatura al respecto.
Patrón del flujo en las venas pulmonares
Este parámetro cobra relevancia dadas las limitaciones de la valoración de la IM en la propia válvula. En caso de insuficiencia grave (3/4 o 4/4), el flujo sistólico pulmonar se invierte por completo o parcialmente en una o más venas pulmonares19,28 respecto al aumento de la presión de la aurícula izquierda (figura 9)29.
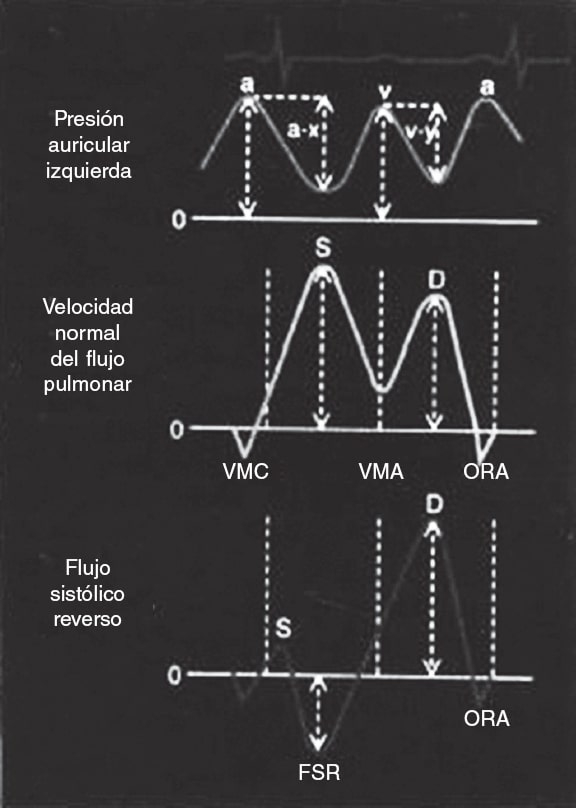
Figura 9. Esquema de las ondas de presión auriculares y el flujo pulmonar. Arriba: presión de la aurícula izquierda con las ondas correspondientes. Centro: flujo normal de las venas pulmonares, con una onda sistólica > diastólica. Abajo: flujo en las venas pulmonares con onda sistólica reversa en presencia de insuficiencia mitral grave. FSR: flujo sistólico reverso; ORA: onda reversa atrial; VMA: válvula mitral abierta; VMC: válvula mitral cerrada. Reproducida con permiso de Klein et al.29.
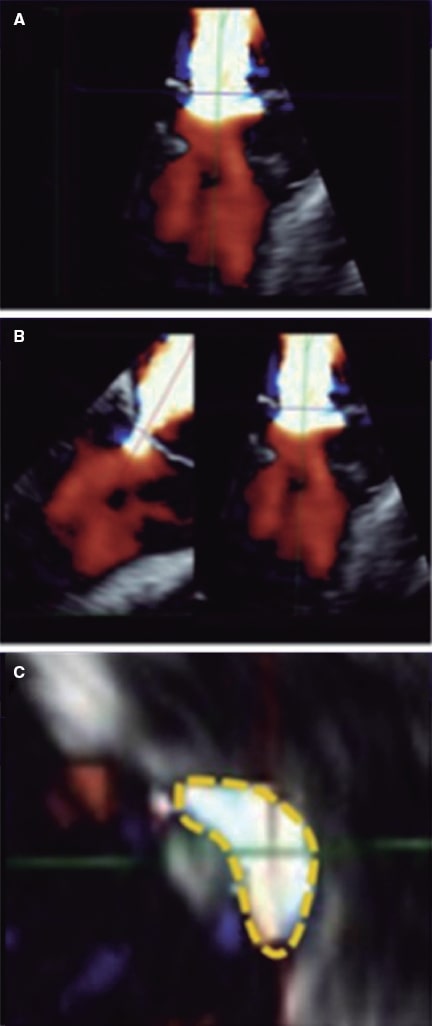
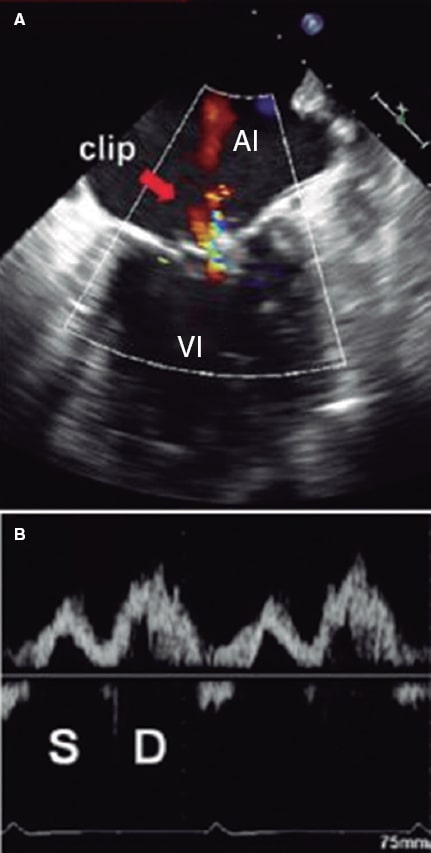
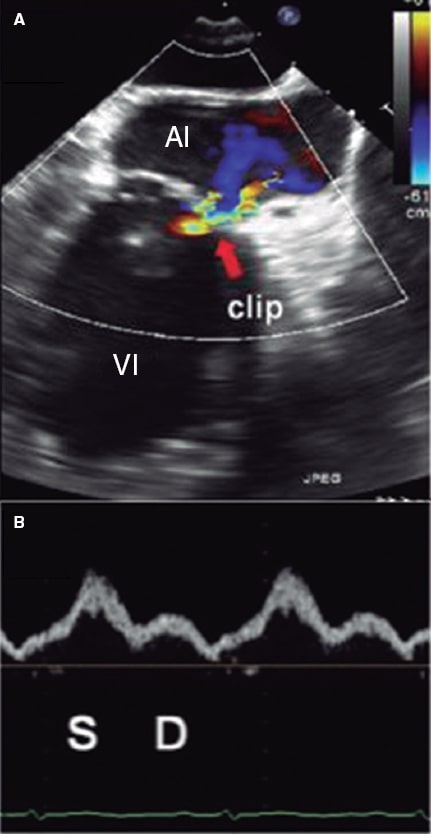
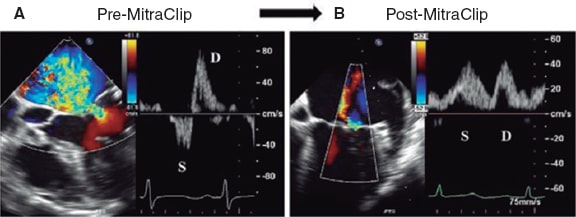
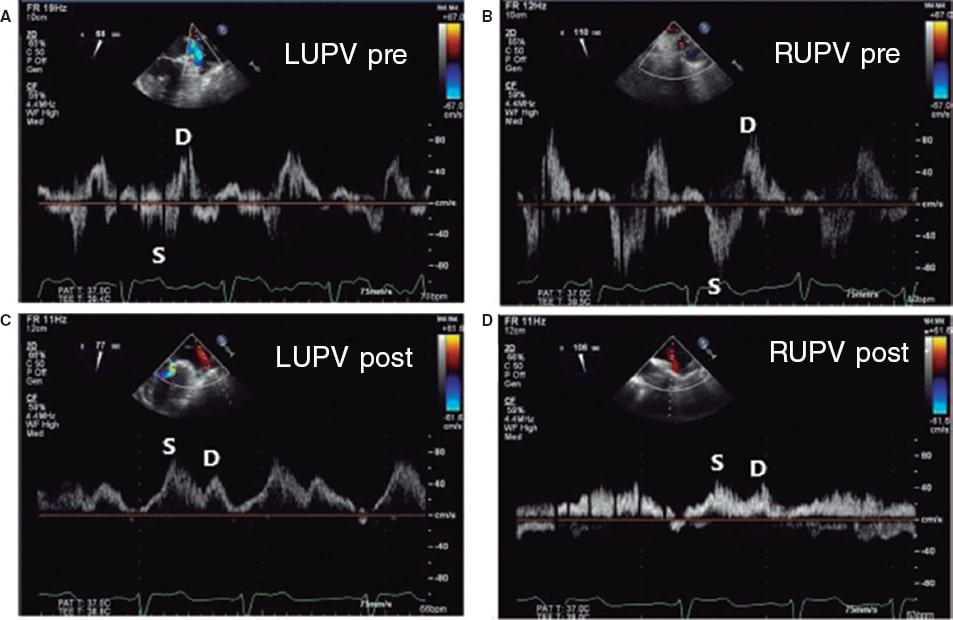
Asimismo, se ha estudiado su potencial como variable pronóstica. Ikenaga et al.28 valoraron la ratio integral velocidad/tiempo (IVT) sistólica/IVT diastólica medida en la vena pulmonar superior izquierda (salvo que las derechas fueran visibles y tuvieran mayor afectación). Con las curvas ROC, establecieron que el punto de corte de 0,72 tuvo la mejor área bajo la curva (0,67), con una sensibilidad del 61% y una especificidad del 73%. Así, una ratio < 0,72 se relacionó con más eventos cardiacos mayores (hazard ratio [HR] ajustada de 1,26; intervalo de confianza del 95% [IC95%], 1,01-1,54; p = 0,047). Dado que la curva del flujo pulmonar puede ser difícil de obtener, se hicieron los mismos cálculos con la relación pico de velocidad sistólico/pico de velocidad diastólico, y el punto de corte con mejor área bajo la curva (0,62) fue 0,83. Este parámetro también se asoció de manera significativa con eventos cardiacos mayores a los 12 meses (HR ajustada = 3,05; IC95%, 1,53-6,30; p = 0,002). Puesto que el flujo en las venas pulmonares se correlaciona con la presión auricular izquierda30, cuando se reduce la IM disminuye la presión en la aurícula izquierda y aumenta el componente sistólico venoso pulmonar. Al hacer de nuevo una curva ROC, la ratio velocidad pico sistólico/velocidad pico diastólico > 1,09 predijo una presión auricular izquierda ≤ 12 mmHg (normal) con una sensibilidad del 71% y una especificidad del 62%. La ratio pico sistólico de velocidad/pico diastólico de velocidad < 0,98 predijo una presión en la aurícula izquierda ≥ 20 mmHg con una sensibilidad del 77% y una especificidad del 71% (figura 10 y figura 11)28. Sin embargo, no está exento de limitaciones5,28, pues en caso de fibrilación auricular el flujo sistólico se reduce por la pérdida de contracción y relajación auricular, y en pacientes de edad avanzada aumenta la rigidez de la aurícula y disminuye la ratio flujo sistólico/flujo diastólico. No hay valores de corte estandarizados y en ocasiones no es posible hacer la medida por la dirección del chorro; si los chorros son excéntricos, estos afectan diferencialmente a cada par de venas pulmonares y pueden producir artefactos que interfieran en la valoración de la IM. En los estudios que valoran el flujo en las venas pulmonares28 se afronta esto comparando siempre la misma vena pulmonar basalmente y tras la colocación del clip. Todavía hay pocos estudios, pero en combinación con otros parámetros puede formar parte de una valoración integral, sobre todo haciendo una comparación entre antes y después de poner el clip (figura 12 y figura 13)24,31.
Figura 10. Imagen de ecocardiografía transesofágica bidimensional. A: Doppler color de la insuficiencia mitral residual tras la colocación del clip (flecha). B: se expone el flujo en la vena pulmonar superior izquierda correspondiente, con atenuación de la onda sistólica (S) con respecto a la diastólica (D). La integral velocidad/tiempo sistólica es de 7,5 cm y la diastólica es de 14 cm. La ratio entre ambas es de 0,54, que indicaría un riesgo más alto de eventos cardiovasculares mayores. En este caso, la colocación del clip es subóptima. AI: aurícula izquierda; VI: ventrículo izquierdo. Reproducida con permiso de Ikenaga et al.28.
Figura 11. Imagen de ecocardiografía transesofágica bidimensional. A: Doppler color de la insuficiencia mitral residual tras colocar el clip (flecha). B: flujo en la vena pulmonar superior izquierda con onda sistólica (S) mayor que onda diastólica (D). La integral velocidad/tiempo sistólica fue de 23 cm y la diastólica de 10 cm, con una ratio de 2,3, compatible con un resultado óptimo en el seguimiento. AI: aurícula izquierda; VI: ventrículo izquierdo. Reproducida con permiso de Ikenaga et al.28.
Figura 12. Imágenes de ecocardiografía transesofágica bidimensional. A: Doppler color de insuficiencia mitral grave (previa al clip mitral) con el patrón de flujo de las venas pulmonares. La onda sistólica (S) está invertida. B: se observa la insuficiencia mitral tras colocar el clip, con un patrón de flujo en las venas pulmonares corregido (onda sistólica [S] > onda diastólica [D]). Reproducida con permiso de Ikenaga et al.31.
Figura 13. Imágenes del flujo en las venas pulmonares. A: flujo pulmonar en la vena pulmonar superior izquierda (LUPV) previo al clip, con onda sistólica (S) invertida con respecto a la onda diastólica (D). B: flujo en la vena pulmonar superior derecha (RUPV) previo al clip, con onda S invertida con respecto a la onda D. C: flujo en la LUPV posterior al clip, con onda S mayor que onda D. D: flujo en la RUPV posterior al clip, con onda S mayor que onda D. Reproducida con permiso de Katz et al.24.
Doppler continuo del chorro
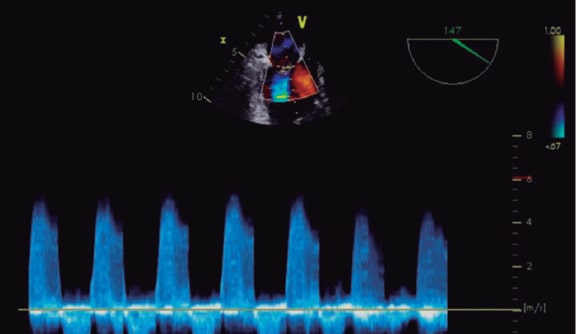
En la IM valvular nativa, el Doppler continuo del chorro puede orientar, pero no es lo bastante sensible como para usarlo de manera aislada o guiar un tratamiento19. Igualmente, en caso de implante de clip, cuanto mayor sea la densidad de la señal del Doppler color mayor es la probabilidad de gravedad, pero en caso de múltiples chorros no puede valorarse de manera adecuada2 (figura 14)30. Tampoco se han llevado a cabo estudios sobre su utilidad.
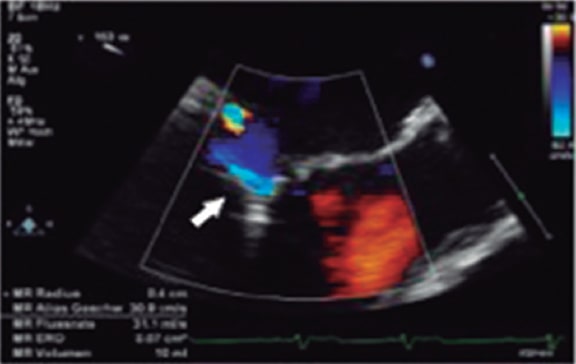
Figura 14. Imagen de ecocardiografía transesofágica. Se observa el Doppler de un único chorro de insuficiencia mitral grave. La forma es triangular y la densidad es alta, sugestivo de gravedad. Reproducida con permiso de López-Opitz y Moreno-Urrutia30.
Doppler del flujo transmitral
El descenso en la velocidad de la onda E sugiere una menor gravedad de la IM nativa, sin cuantificarla2. No es útil para la evaluación de la IM residual tras la colocación de un clip, dado que al aproximar los bordes de los velos mitrales se genera un aumento del gradiente transmitral30. Por tanto, una velocidad aumentada no es indicativa de IM residual significativa.
Presión en la aurícula izquierda con aparición de contraste espontáneo
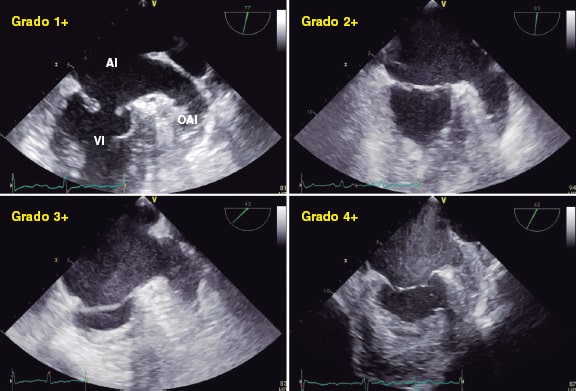
Al disminuir el volumen de IM aparece estasis en la aurícula (figura 15)32. Puede indicar menor gravedad si aparece contraste espontáneo2, pero no hay estudios que lo valoren.
Figura 15. Imágenes de ecocardiografía transesofágica bidimensional. Se observan 4 grados de contraste espontáneo en la aurícula y la orejuela izquierda, de menor a mayor intensidad (1+ a 4+). AI: aurícula izquierda; OAI: orejuela aurícula izquierda; VI: ventrículo izquierdo. Reproducida con permiso de Ito y Suwa32.
Aumento del volumen latido en el tracto de salida del ventrículo izquierdo
Igual que el anterior, el aumento del volumen latido puede sugerir una reducción de la insuficiencia. Sin embargo, no se ha estudiado la relación entre el volumen latido del ventrículo izquierdo y la gravedad de la IM, aunque se sabe que, si mejora, la IM será menor2.
Cálculo del volumen de regurgitación
No se ha validado en este contexto2 ni tampoco en caso de múltiples chorros.
DISCUSIÓN
La IM residual tras la colocación de un clip condiciona el pronóstico del paciente. Cuando es moderada o grave, la mortalidad a los 12 meses puede llegar a ser el doble que la de aquellos pacientes con IM ligera13. La IM residual más que moderada supone la persistencia de la clínica inicial y un aumento de volumen del ventrículo iz- quierdo y del remodelado cardiaco. Asimismo, si no se hace una adecuada valoración de la gravedad de la IM intraprocedimiento, no es posible precisar el número de clips necesarios. Si estos son excesivos, aumenta el riesgo de estenosis mitral residual, que también empeora el pronóstico.
La principal limitación de los estudios es que el método de referencia utilizado es la evaluación por un operador experto. No hay una herramienta única capaz de evaluar la IM de forma simple, reproducible e independiente del operador, por lo que no se pueden llevar a cabo estudios de validación. Otra de las limitaciones es que las medidas se toman bajo anestesia general, que produce vasodilatación, disminución de la poscarga ventricular y reducción de la IM. No obstante, hay estudios13,23 en que los resultados son reproducibles hasta 4 semanas posprocedimiento, fundamentalmente con el área 3D de la vena contracta. No se ha demostrado que la valoración intraprocedimiento bajo anestesia general infraestime la gravedad de la insuficiencia residual con respecto al seguimiento.
Cada vez más, los estudios se centran en el área 3D de la vena contracta o en el flujo en las venas pulmonares. Si bien tienen limitaciones, los resultados son reproducibles y consistentes. El área 3D de la vena contracta parece ser el parámetro más preciso, dado que la valoración por planimetría 3D es directa, pero está condicionado por su laboriosidad y aplicabilidad a la práctica clínica. Con perspectiva de que esto cambie, los grupos de trabajo se centran en ella por la escasa variabilidad interobservador y la buena correlación con la gravedad de la IM medida por operadores expertos.
El flujo en las venas pulmonares tiene un interés creciente porque traduce la presión auricular izquierda, que está determinada por la gravedad de la IM (aunque la edad y el ritmo auricular influyen). Aun así, cuando se compara el flujo antes y después de la intervención, la diferencia se atribuye al efecto del clip. No obstante, en la IM de válvula nativa es un parámetro muy específico, pero poco sensible. Esto podría extrapolarse a la insuficiencia residual tras el procedimiento.
CONCLUSIONES
La correcta valoración de la IM residual tras el implante de clip mitral tiene implicaciones pronósticas. Sin embargo, no pueden extrapolarse los parámetros utilizados en la IM nativa, dado que el clip genera una serie de artefactos y cambios morfológicos en la válvula. Así como algunos de estos no han demostrado utilidad (Doppler color, flujo transmitral, volumen de regurgitación, etc.), otros parecen prometedores. El área 3D de la vena contracta y el patrón de flujo de las venas pulmonares son los parámetros más prometedores, sobre todo por su correlación con el pronóstico en el seguimiento, si bien no se dispone de estudios de validación. La estandarización de los softwares en todos los centros y la disponibilidad de la ETE 3D son fundamentales para seguir avanzando en el estudio de esta valvulopatía.
La IM residual tras la colocación de un clip tiene unas peculiaridades que no la hacen subsidiaria de ser valorada por los mismos parámetros y valores que la IM nativa. En la práctica se recomienda una aproximación integral y eficiente, usando la anchura de la vena contracta y la variación del flujo en las venas pulmonares, y si es posible, el área 3D de la vena contracta.
Debido al rápido avance de esta técnica, es necesario contar con documentos actualizados que sinteticen la información y permitan acceder a la literatura. Además, deben enfatizar la importancia pronóstica de la IM residual e incentivar estudios de calidad científica, para así en un futuro contar con estudios de validación de parámetros y estandarizar la evaluación de la IM residual tras la colocación de un clip mitral.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
S.P. Cabrera Huerta realizó la búsqueda bibliográfica, seleccionó los artículos de interés y redactó el manuscrito. J.A. De Agustín orientó el trabajo y su contenido, verificó las fuentes bibliográficas referidas y revisó la búsqueda.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
2. Zoghbi W, Asch FM, Bruce C, et al. Guidelines for the evaluation of valvular regurgitation after percutaneous valve repair or replacement. A report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr. 2019;32:431-475.
3. Coats AJS, Anker SD, Baumbach A, et al. The management of secondary mitral regurgitation in patients with heart failure:a joint position statement from the Heart Failure Association (HFA), European Association of Cardiovascular Imaging (EACVI), European Heart Rhythm Association (EHRA), and European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC. Eur Heart J. 2021;42,1254-1269.
4. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease. A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e72-e227.
5. Ikenaga H, Makar M, Rader F, et al. Mechanisms of mitral regurgitation after percutaneous mitral valve repair with the MitraClip. Eur Heart J. 2020;10:1131-1143.
6. Altiok E, Hamada S, Brehmer K, et al. Analysis of procedural effects of percutaneous edge-to-edge mitral valve repair by 2D and 3D echocardiography. Circ Cardiovasc Imaging. 2012;6:748-755.
7. Mayo Clinic. MitraClip treatment of mitral regurgitation after cardiac transplant:Case report. 2020. Disponible en:https://www.mayoclinic.org/medical-professionals/cardiovascular-diseases/news/mitraclip-treatment-of-mitral-regurgitation-after-cardiac-transplant-case-report/mcc-20502193.Consultado 23 Mar 2021.
8. Buzzatti N, De Bonis M, Denti P, et al. What is a “good“result after transcatheter mitral repair?Impact of 2+residual mitral regurgitation. J Thorac Cardiovasc Surg. 2016;1:88-96.
9. Reichart D, Kalbacher D, Rübsamen N, et al. The impact of residual mitral regurgitation after MitraClip therapy in functional mitral regurgitation. Eur J Heart Fail. 2020;22:1840-1848.
10. Paranskaya L, D'Ancona G, Bozdag-Turan I, et al. Residual Mitral Valve Regurgitation After Percutaneous Mitral Valve Repair with the MitraClip System is a Risk Factor for Adverse One-Year Outcome. Catheter Cardiovasc Interv. 2013;81:609-617.
11. Feldman T, Foster E, Glower DD, et al. Percutaneous Repair or Surgery for Mitral Regurgitation. N Engl J Med. 2011;364:1395-1406.
12. Grayburn PA. The Challenge of Assessing Residual Mitral Regurgitation During MitraClip Procedures. Is 3D Vena Contracta Area the Answer? JACC Cardiovasc Interv. 2019:12;592-594.
13. Avenatti E, Mackensen B, El-Tallawi KC, et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC Cardiovasc Interv. 2019;12:582-591.
14. Foster E, Wasserman HS, Gray W, et al. Quantitative Assessment of Severity of Mitral Regurgitation by Serial Echocardiography in a Multicenter Clinical Trial of Percutaneous Mitral Valve Repair. Am J Cardiol. 2007;100:1577-1583.
15. Stone GW, Lindenfeld JA, Abraham WT, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med. 2018;379:2307-2318.
16. Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous Repair or Medial Treatment for Secondary Mitral Regurgitation. N Engl J Med. 2018;379:2297-2306.
17. Asch FM, Grayburn PA, Siegel RJ, et al. Echocardiographic Outcomes After Transcatheter Leaflet Approximation in Patients With Secondary Mitral Regurgitation. The COAPT Trial. J Am Coll Cardiol. 2019;74:2969-2979.
18. Zamorano JL, Badano LP, Bruce C, et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter intervention for valvular heart disease. Eur Heart J. 2011;32:2189-2214.
19. Lancellotti P, Tribouilloy C, Hagendorff A, et al. Recommendations for the echocardiographic assessment of native valvular regurgitation:an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2013;7:611-644.
20. Lin BA, Forouhar AS, Pahlevan NM, et al. Color Doppler jet area overestimates regurgitant volume when multiple jets are present. J Am Soc Echocardiogr. 2010;9:993-1000.
21. Lesevic H, Sonne C, Kasel AM, et al. Implantation of a MitraClip between two previously implanted MitraClips to treat recurrent severe mitral regurgitation. J Cardiol Cases. 2017;15:50-52.
22. Elbey MA, Palma Dallan LA, Ferragut G. Value of MitraClip in Reducing Funtional Mitral Regurgitation. US Cardiol Rev. 2019;13:30-34.
23. Dietl A, Prieschenk C, Eckert F, et al. 3D vena contracta area after MitraClip procedure:precise quantification of residual mitral regurgitation and identification of prognostic information. Cardiovasc Ultrasound. 2018;16:1-10.
24. Katz WE, Conrad Smith AJ, Wrock FW, et al. Echocardiographic evaluation and guidance for Mitraclip procedure. Cardiovasc Diagn The. 2017;7:616-632.
25. Hyodo E, Iwata S, Tugcu A, et al. Direct measurement of multiple vena contracta areas for assessing the severity of mitral regurgitation using 3D TEE. JACC Cardiovasc Imaging. 2012;5:669-676.
26. Glower DD, Kar S, Trento A, et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients:results of the EVEREST II study. J Am Coll Cardiol. 2014;64:172-181.
27. Utsonomiya H, Itabashi Y, Kobayashi S, et al. Comparison of mitral valve geometrical effect of percutaneous edge-to-edge repair between central and eccentric functional mitral regurgitation:clinical implications. Eur Heart J. 2019;4:455-466.
28. Ikenaga H, Yoshida J, Hayashi A, et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes After Percutaneous Mitral Valve Repair With the MitraClip. JACC Cardiovasc Interv. 2019;12:140-150.
29. Klein A, Stewart WJ, Bartlett J, et al. Effects of Mitral Regurgitation on Pulmonary Venous Flow and Left Atrial Pressure:An Intraoperative Transesophageal Echocardiography Study. J Am Coll Cardiol. 1992;20:1345-1352.
30. López-Opitz JA, Moreno-Urrutia O. Insuficiencia mitral grave por perforación del velo mitral posterior. RETIC. 2016;2:13-16.
31. Ikenaga H, Hayashi A, Nagaura T, et al. Relation Between Pulmonary Venous Flow and Left Atrial Pressure During Percutaneous Mitral Valve Repair With the MitraClip. Am J Cardiol. 2018;122:1379-1386.
32. Ito T, Suwa M. Left atrial spontaneous echo contrast:relationship with clinical and echocardiographic parameters. Echo Res Pract. 2019;6:65-73.