RESUMEN
La obstrucción de las arterias coronarias (OC) es una complicación rara, pero potencialmente fatal, del implante percutáneo de válvula aórtica (TAVI). El objetivo de esta revisión es resumir la evidencia sobre los factores de riesgo de OC y las estrategias preventivas. Se realizó una revisión integral de la literatura centrada en estos aspectos. El análisis consideró estudios que abordaran las características del paciente, los factores procedimentales y la efectividad de diferentes técnicas preventivas para reducir el riesgo de OC. Se describen los factores relacionados con el paciente y del procedimiento que condicionan un mayor riesgo de OC. A lo largo del texto se detallan las técnicas para disminuir el riesgo de OC, incluidos el stent en chimenea y la técnica BASILICA. Además, se aporta una descripción general de los dispositivos diseñados para abordar esta complicación. En conclusión, la identificación de los factores de riesgo de OC es crucial para optimizar los resultados del TAVI. La evaluación exhaustiva mediante imagen multimodal, junto a estrategias preventivas apropiadas, como la técnica BASILICA, pueden mitigar el riesgo de OC y mejorar los resultados. Aún se requiere más investigación para validar los dispositivos emergentes.
Palabras clave: Implante percutáneo de válvula aórtica. Obstrucción de arterias coronarias. Técnicas de protección coronaria.
ABSTRACT
Coronary obstruction (CO) is a rare but potentially fatal complication of transcatheter aortic valve implantation (TAVI). The present article aims to summarize the evidence on CO risk factors and provide an overview of preventive strategies. We performed a comprehensive literature review focused on these items. The analysis included studies addressing patient-specific characteristics, procedural aspects, and the effectiveness of various prevention techniques in mitigating CO risk. Specific risk factors for CO, which can be assessed by evaluating patient characteristics using computed tomography, are described. Procedural factors associated with an increased risk of CO are discussed. Preventive techniques, including the chimney stent and bioprosthetic aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction (BASILICA), are also described, highlighting the advantages and disadvantages of each method. The present review also provides an overview of emerging dedicated devices designed to address this complication. In conclusion, identifying patients at risk for CO is crucial for optimizing TAVI outcomes. Comprehensive imaging assessment and appropriate preventive strategies, such as the BASILICA technique, can mitigate the risk of CO and improve patient outcomes. Further research is needed to validate emerging dedicated devices.
Keywords: Transcatheter aortic valve replacement. Coronary artery obstruction. Coronary protection techniques.
Abreviaturas DVC: distancia válvula-coronaria. OC: obstrucción coronaria. PVB: prótesis valvular biológica. RQVA: reemplazo quirúrgico de válvula aórtica. SDV: seno de Valsalva. TAVI: implante percutáneo de válvula aórtica. THV: prótesis valvular cardiaca percutánea. UST: unión sinotubular.
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI) ha tenido una evolución rápida logrando un perfil de seguridad y eficacia notables1,2. No obstante, complicaciones tales como trastornos de la conducción, complicaciones relacionadas con el sitio de acceso y obstrucciones coronarias (OC) siguen preocupando por la morbimortalidad asociada a dichas complicaciones. La OC es una complicación rara (descrita entre el 0,5 y el 8% de los casos) pero potencialmente fatal durante el TAVI3-5. La tasa de mortalidad intrahospitalaria a los 30 días asociada a este evento está en torno al 30-50%6-8. Las OC pueden sobrevenir en un entorno agudo durante el implante de la válvula, antes de que el paciente haya salido de quirófano, o ser tardías y sobrevenir después de que el paciente haya abandonado el quirófano tras un TAVI exitoso. Las OC tardías se puede clasificar como OC tempranas (0-7 días) o tardías (> 7 días)9.
Existen 2 mecanismos principales en las OC. El primero es la obstrucción directa por desplazamiento de un velo nativo o protésico deteriorado por la prótesis valvular cardiaca percutánea (THV). Se ha descrito con mayor frecuencia en pacientes con orígenes coronarios bajos y senos de Valsalva (SDV) estrechos4. El segundo mecanismo es una obstrucción indirecta en la que también se desplaza el velo obstruyendo la unión sinotubular (UST) con el consiguiente secuestro de los senos de Valsalva. Se ha descrito con mayor frecuencia en UST bajas y estrechas. La mayoría de las OC sobrevienen en el ostium coronario (92%) y principalmente en la descendente anterior (78%)4. Otras causas de OC incluyen la embolización y obstrucción directa de los ostium coronarios por la prótesis TAVI3-5,7,10-12.
Tras realizar una evaluación exhaustiva, las características anatómicas de alto riesgo podrían llegar favorecer el reemplazo quirúrgico de válvula aórtica (RVAO). No obstante, si el riesgo quirúrgico es prohibitivo, es necesario proceder con el TAVI. En tales situaciones, usar técnicas de protección de las coronarias resulta clave a la hora de aumentar la seguridad y minimizar los riesgos13,14.
Esta revisión tiene como objetivo resumir y analizar los predictores de OC y las técnicas y estrategias que se emplean en la actualidad para prevenir esta complicación en el contexto del TAVI.
FACTORES ASOCIADOS A LA OBSTRUCCIÓN DE LAS CORONARIAS TRAS EL TAVI
Una planificación meticulosa del TAVI sumado a una comprensión integral de los mecanismos subyacentes que predisponen a la ocurrencia de complicaciones son de una importancia capital para mejorar los resultados. La tomografía computarizada (TC) es esencial a la hora de valorar a los posibles candidatos a un TAVI, incluida una estimación de las posibles complicaciones que pueden darse15. Los principales predictores de OC asociados al TAVI se resumen en la tabla 1.
Tabla 1. Factores vinculados a oclusiones coronarias asociadas al TAVI
| Predictores | Comentario |
|---|---|
| Factores anatómicos | Altura de los ostium coronarios < 12 mm (< 10 mm: riesgo máximo)a |
| Diámetro del seno de Valsalva < 30 mma | |
| Altura de la cúspide > altura coronaria | |
| Baja altura y diámetro estrecho de la UST | |
| DVC ≤ 4 mm | |
| Calcificación del velo culpable > 600 mm3 | |
| TAVI ViV | DVC ≤ 4 mma,b |
| PVB sin stent o PVB con stent con velos montados externamenteb | |
| Sexo femenino | Probablemente asociado a la anatomía más pequeña de las mujeres |
| Factores de la THV y de la intervención | Las prótesis expandibles con balón se asocian a un mayor índice de OC agudas |
| Las prótesis expandibles con balón se asocian a la ocurrencia tardía de OC | |
| Faldón externo | |
| Implante alto | |
|
DVC: distancia válvula-coronaria; OC: obstrucción coronaria; PVB: prótesis valvular biológica; TAVI: implante percutáneo de válvula aórtica; THV: prótesis valvular cardiaca percutánea; UST: unión sinotubular. |
|
Factores anatómicos que contribuyen a la ocurrencia de OC en pacientes con válvulas aóticas nativas
El principal predictor es la altura baja de los ostium coronarios medida por TC desde el plano del anillo aórtico. Un consenso de expertos previo sugirió un valor de corte para la altura de los ostium coronarios inferior a 10 mm como indicativa de riesgo máximo16,17. No obstante, los datos de un registro multicéntrico confirmaron que la altura del ostium coronario del tronco común izquierdo (TCI) de casi el 80% de los pacientes con OC era inferior a 12 mm (altura media: 11 mm)3. Además, Ribeiro et al. informaron que en torno al 60% de los pacientes con OC presentaban ostium coronarios con alturas superiores a 10 mm, lo cual sugiere que el valor de corte debería subirse hasta los 12 mm18. El ostium de la coronaria derecha (CD) se vio afectado solo en solo el 11% de todos los casos de OC en un registro previo3 debido al origen más alto de esta arteria comparado con el TCI en la mayoría de los casos19, lo cual viene a subrayar lo importante que son estas mediciones.
Otro factor de riesgo es una raíz aórtica estrecha con un diámetro de los SDV < 30 mm7,11. La distancia válvula-coronaria (DVC) es la distancia que hay desde los ostium coronarios hasta la posición final anticipada de los velos bioprotésicos desplazadas tras del TAVI15. Para calcular la DVC mediante TC, se utiliza un cilindro virtual que representa la THV y se mide la distancia horizontal entre dicho cilindro y los ostium coronarios15. Si la DVC es superior a 6 mm, el riesgo de OC es bajo; entre 4 y 6 mm, el riesgo es límite y si es inferior a 4 mm, el riesgo es máximo7,15. No obstante, las mediciones de la DVC no son 100% específicas, lo cual podría deberse a las diferencias existentes entre las DVC estimada y observada descritas por Tzimas et al.20.
La relación entre la altura de la cúspide aórtica y la altura coronaria es un criterio relativamente nuevo. La altura de la cúspide es la distancia vertical desde el plano anular hasta la parte superior de la unión comisural de la cúspide. Esta medida es probablemente más reproducible que la longitud del velo.
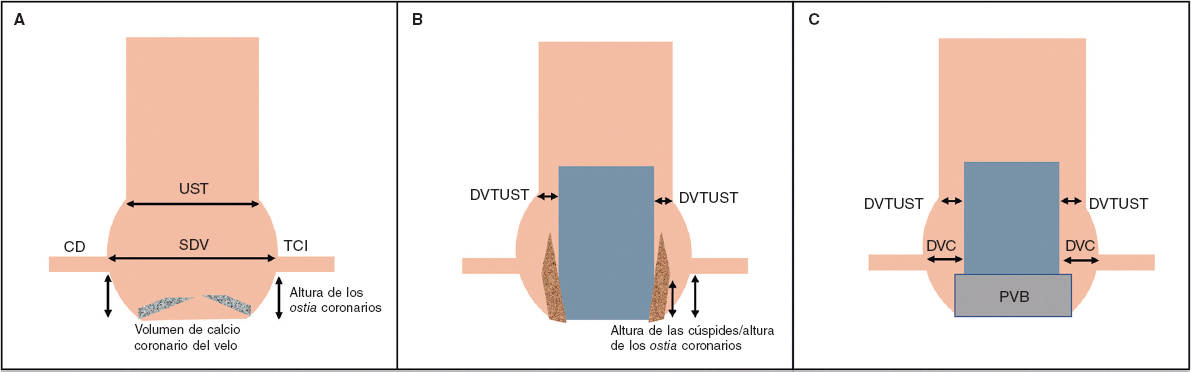
El riesgo de OC indirecta por secuestro de seno es mayor cuando el diámetro anular es mayor que el de la UST y la altura de la cúspide es mayor que la de la UST21. Al igual que ocurre con la DVC, se debe calcular la distancia virtual desde la THV hasta la UST (DVTUST). La figura 1 muestra una representación esquemática de las mediciones asociadas a un valor predictivo para las OC.
Figura 1. Representación esquemática de la raíz aórtica y predictores de OC. A: válvula aórtica nativa. La altura de los ostium coronarios y la anchura de los SDV son predictores de la ocurrencia de OC. El volumen de calcio coronario de los velos también influye en los resultados en este contexto. B: velos de una válvula aórtica nativa desplazados por una THV representadas en esta figura. Una DVTUST más estrecha y una mayor altura de los velos con relación a la altura de los ostium coronarios se asocian al riesgo de OC. C: raíz aórtica con una PVB. El TAVI ViV es un factor de riesgo per se para la ocurrencia de OC; no obstante, este riesgo aumenta cuanto menor es la DVC. Por otro lado, se ha sugerido que una UST estrecha es otro factor contribuyente al riesgo de OC. CD: coronaria derecha; DVC: distancia válvula-coronaria; DVTUST: distancia virtual desde la THV hasta la UST; PVB: prótesis valvular biológica; SDV: seno de Valsalva; TCI: tronco común izquierdo; THV: prótesis valvular cardiaca percutánea; UST: unión sinotubular.
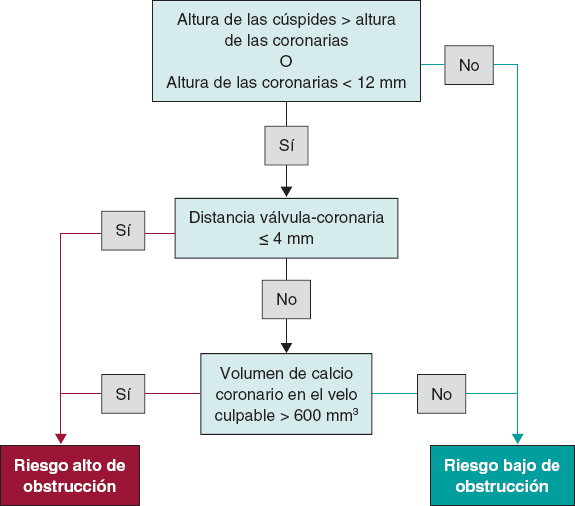
Khan et al. han desarrollado un algoritmo predictivo para valorar el riesgo de OC4. El algoritmo tiene en cuenta alturas de las cúspides mayores que las de las coronarias y cualquiera de las siguientes condiciones: DVC ≤ 4 mm o un volumen de calcio en el velo culpable > 600 mm3. El modelo tuvo un excelente rendimiento a la hora de predecir la obstrucción de los ostium coronarios izquierdo y derecho. La figura 2 muestra un diagrama de flujo para valorar el riesgo de OC en pacientes con válvulas aórticas nativas.
Figura 2. Valoración del riesgo de obstrucción coronaria en pacientes tratados de TAVI para válvulas aórticas nativas.
Características de los pacientes asociadas a la ocurrencia de OC
El sexo femenino está asociado a una mayor incidencia de OC. En torno al 80% de los pacientes de los registros de OC son mujeres18, una relación que probablemente se deba a las diferencias anatómicas entre ambos sexos. Las mujeres suelen tener raíces aórticas más pequeñas, SDV de menor tamaño y ostium coronarios más bajos19.
En cuanto a la historia del paciente, los antecedentes de cirugía de revascularización coronaria están asociados a una menor incidencia de OC sintomática por el «efecto protector» de proporcionar un flujo sanguíneo alternativo18. No obstante, la permeabilidad del injerto siempre debe valorarse antes del TAVI22.
Factores de la intervención que influyen en la ocurrencia de OC
El tipo de THV podría, también, influir en los resultados. Las prótesis expandibles con balón se asocian a un mayor riesgo de OC agudas que las prótesis autoexpandibles11,18. No obstante, esta diferencia podría explicarse, en parte, por las características de la armadura y el mecanismo de implantación18. No obstante, un registro posterior que evaluó la ocurrencia de OC tardías vino a confirmar que las prótesis autoexpandibles se asociaban a índices más altos de esta complicación que las prótesis expandibles con balón. Quizás esto se deba a que las válvulas autoexpandibles están hechas de nitinol y siguen expandiéndose tras el implante inicial9. Otros factores que podrían contribuir a la ocurrencia de OC en este contexto son la estancación del flujo y la micromigración de la prótesis. Jabbour et al. plantean que tanto la endotelización como la embolización de los trombos podrían guardan relación con la ocurrencia de OC tardías9.
Válvulas bioprotésicas quirúrgicas y TAVI «válvula dentro de otra válvula»
El TAVI se ha convertido en una nueva alternativa al RVAO en pacientes con una prótesis valvular biológica (PVB) fallida y riesgo perioperatorio alto o prohibitivo1,2. El TAVI «válvula dentro de otra válvula» (ViV) supone en torno al 5% de todos los TAVI que se realizan en Estados Unidos23. El índice de OC es entre 4 y 6 veces mayor en los TAVI ViV que en las válvulas nativas9. El riesgo más alto de sufrir OC probablemente se deba al diseño supraanular de la mayoría de las PVB que rebaja la altura de los ostium coronarios al tiempo que la sutura de la válvula aproxima las coronarias, reduciendo, así, la anchura del seno24.
Es conveniente contar con un informe preoperatorio integral23. Se deben investigar los detalles de la intervención previa, incluido el modelo y tamaño exactos de la PVB25. Esta diferenciación es esencial porque las válvulas sin stent (como la Freedom [Sorin Biomedica, Italia], la Toronto SPV [St Jude Medical, Estados Unidos], la Freestyle [Medtronic, Estados Unidos]) y las válvulas con stent con velos montados externamente (como la Mitroflow [Sorin Biomedica, Italia] y la Trifecta [St Jude Medical, Estados Unidos]) tienen asociado un mayor riesgo de OC25. Ribeiro et al. han informado de una incidencia mucho mayor de OC en pacientes con válvulas sin stent (3,7%) y válvulas con stent y velos montados externamente (6,4%) que en pacientes con válvulas con stent y velos montados internamente (0,7%). De hecho, el mismo registro demostró que la presencia de estos tipos de válvulas resultó ser un predictor independiente de OC7.
La DVC estimada por TC es uno de los predictores más precisos de OC tras un TAVI ViV7,26. También se ha de tener en cuenta la altura de los ostium coronarios y el diámetro medio de los SDV3,7,15. Otro posible factor de riesgo anatómico para la ocurrencia de OC en una intervención ViV es una UST estrecha, la posición supraanular y un perfil alto de los velos de la PVB27,28.
Redo-TAVI. Implicaciones en la obstrucción coronaria
La tendencia actual en el manejo de la enfermedad aórtica sugiere que dentro de poco, en pacientes con mayor esperanza de vida se empleará el TAVI y no el RVAO. En este sentido, el redo-TAVI quizá juegue un papel esencial en el tratamiento de pacientes con THV fallidas. No obstante, los datos con que contamos sobre predictores para evitar complicaciones en este contexto siguen siendo escasos.
En algunos de los primeros registros y revisiones sistemáticas que entraron a valorar el redo-TAVI o el TAVI en TAVI, los investigadores informaron tasas muy bajas de complicaciones perioperatorias de entre el 0 y el 0,9% de OC30-32. Esto probablemente se deba a un meticuloso análisis de la anatomía con conocimiento de los factores predictivos citados anteriormente, excluyendo a los pacientes de mayor riesgo y con un mayor sesgo de selección.
El redo-TAVI también se asocia a un cierto riesgo de OC y accesos coronarios comprometidos33. El implante de una segunda THV superpone las armaduras de los stents de ambas prótesis con el riesgo que de comprimir los velos de la primera THV, creando un cilindro cubierto hasta el borde de estos34. La superposición de las armaduras de los stents y la pérdida de flujo libre influyen en el flujo coronario y en la posibilidad de canulación.
En pacientes tratados de TAVI en TAVI, la UST juega un papel esencial a la hora de acceder a las coronarias a modo de cuello de botella anatómico. Una UST más alta y ancha ofrece más espacio entre la primera THV y la pared aórtica facilitando el acceso a los ostium coronarios y minimizando la probabilidad de obstrucción del flujo34. Además, la altura de los velos de la primera THV implantada también podría influir en el acceso y el flujo. Las THV previas con velos supraanulares y las THV implantadas en altura aumentan el riesgo de interacción con la UST y obstrucción del flujo en el supuesto de tener que implantar una segunda THV34,35. En este sentido, se sugiere calcular la DVTUST, sobre todo, en intervenciones TAVI en TAVI y TAVI «válvula dentro de otra válvula»36.
Tarantini et al. propusieron un algoritmo para predecir el riesgo de OC y la viabilidad de futuros accesos coronarios. Estos autores tuvieron en cuenta la valoración mediante TC de la altura de los ostium coronarios en relación con la primera THV, una distancia de 2 mm desde la THV hasta la pared aórtica y la confirmación de la posibilidad de canulación coronaria con la anterior válvula en su sitio. Si los ostium coronarios se encuentran por debajo del plano de riesgo de la anterior THV, la distancia hasta la pared aórtica es < 2 mm, lo cual hace inviable la canulación coronaria lo cual, a su vez, descarta la posibilidad de TAVI en TAVI33,37. La anchura de la raíz aórtica también es importante para valorar el riesgo de OC en este contexto.
Redondo et al. han destacado otro aspecto a considerar en la planificación y ejecución del TAVI en TAVI: el alineamiento de los postes comisurales de la anterior THV con respecto a la actual ubicación de los ostium coronarios. Si un paciente con una THV previa corre un riesgo alto de OC, se puede lacerar a propósito el festón aórtico bioprotésico o nativo mientras se emplea la técnica TAVI (BASILICA) para evitar la obstrucción iatrogénica de la coronaria y así mitigar dicho riesgo. Esta estrategia, consistente en lacerar el velo anterior para posibilitar un flujo coronario normal y que se detalla a continuación, podría no resultar con alineamientos inadecuados de los ostium coronarios en relación con los postes comisurales de la primera THV por una ubicación excéntrica de los ostium coronarios38.
ESTRATEGIAS PARA EVITAR OBSTRUCCIONES CORONARIAS TRAS EL TAVI
Tal y como venimos subrayando, el primer paso y el más importante para evitar la ocurrencia de complicaciones perioperatorias asociadas al TAVI es realizar valoraciones integrales con la ayuda de imágenes y una planificación adecuada. Ante el riesgo alto de OC, una nueva valoración del riesgo podría favorecer optar por el RQVA Un riesgo quirúrgico excesivo que requiera continuar con la estrategia percutánea requiere técnicas de protección coronaria22.
Protección coronaria con guía
Esta es la técnica de protección más simple en el contexto del TAVI con alto riesgo de OC y una de las primeras estrategias de protección informadas. La técnica consiste en la colocación de una guía de 0,014 pulgadas en 1 o ambas arterias a través de catéteres guía tras cruzar la válvula aórtica con la guía rígida. Dependiendo de las preferencias del operador, se avanza un balón de angioplastia con un diámetro de entre 2,5 y 3.5 mm a través de la guía para estar preparados ante una posible dilatación en caso de obstrucción súbita14,39,40. Si sobreviene una OC aguda, la guía se emplea para realizar una angioplastia ostial con un balón o implantar un stent para recuperar el flujo coronario.
El perfil de seguridad y la viabilidad de esta técnica han quedado demostrados en estudios ya publicados13,14. No obstante, se necesitan más evidencias de ensayos clínicos aleatorizados, lo cual quizá haga difícil extrapolar la efectividad de este abordaje. La ausencia de guías estandarizadas de cómo realizar la intervención quizá, contribuya, también a la variabilidad en su aplicación y resultados. A pesar de estos desafíos, lo que más preocupa sigue siendo el riesgo persistente de oclusión incluso después de haber retirado la guía, tal y como ha quedado demostrado en el registro de la Sociedad Española de Cardiología5.
Técnica del stent «en chimenea/snorkel»
La técnica del stent en chimenea es una estrategia basada en la colocación de una guía con un stent sin desplegar en una o ambas arterias coronarias. El stent se implanta si sobreviene una OC, de tal forma que sobresale por el exterior y parte superior del ostium coronario a modo de «chimenea» o snorkel. Chakravarty et al. fueron quienes dieron a conocer esta estrategia por primera vez para el tratamiento de una OC aguda anticipada del tronco común izquierdo (TCI) en un paciente con una PVB degenerada41. Son varios los informes de casos que han confirmado su perfil de seguridad y eficacia42,43.
El seguimiento clínico ha confirmado resultados aceptables a medio plazo (tiempo de seguimiento de 612 días, rango intercuartílico: entre 405 y 842 días) en un registro con un único caso de fracaso del stent y 1 posible caso de trombosis tardía del stent44. Se requieren resultados de seguimiento a más largo plazo que respondan a todas las cuestiones en torno a los resultados asociados al stent. Cabe esperar reaccesos coronarios difíciles a través del snorkel, lo cual plantea dudas sobre posibles complicaciones coronarias a futuro. Los posibles mecanismos del eventual fracaso del stent son un flujo turbulento persistente a través de la THV y el stent, la corrosión galvánica y los procesos inflamatorios locales10.
Detalles de la intervención
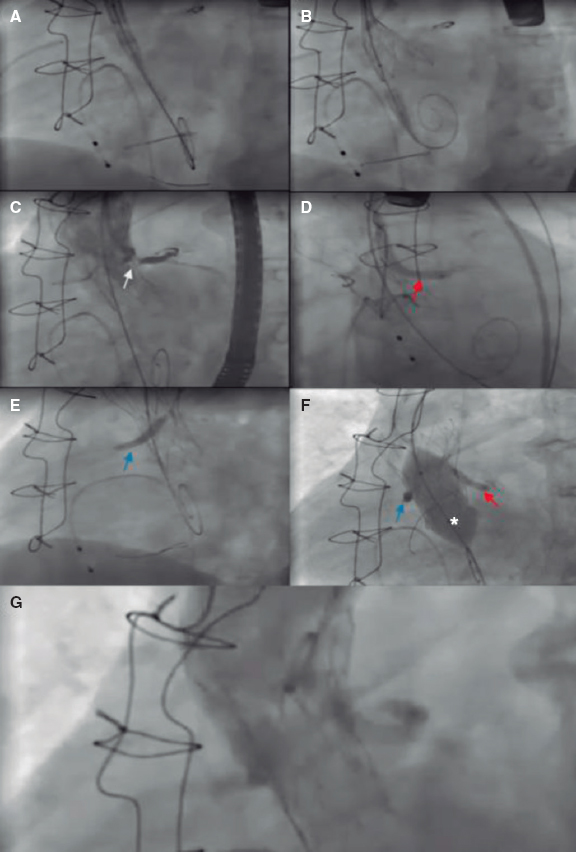
La técnica de la chimenea implica una serie de pasos críticos que pueden variar tímidamente de una sala de hemodinámica a otra y que se basan en la literatura médica y experiencia existentes en la actualidad. Al igual que ocurre con cualquier intervención compleja, se debe realizar por un equipo de intervencionistas experimentados. La figura 3 muestra un ejemplo de un caso real empleando la técnica del stent chimenea/snorkel para la protección de un paciente de alto riesgo de OC.
Figura 3. Pasos principales del TAVI «válvula dentro de otra válvula» (válvula Freedom [Sorin Biomedica, Italia]) empleando una técnica de chimenea bilateral para proteger ambas coronarias. A: previo al implante de la válvula, se colocaron stents farmacoactivos no desplegados tanto en la coronaria derecha (3,5 × 28 mm) como en el TCI (4 × 33 mm) en preparación para una posible intervención coronaria percutánea ante posibles obstrucciones coronarias agudas. B: luego se avanzó una válvula Portico (Abbott Vascular, Estados Unidos) y se inició el implante. C: durante la liberación de la válvula, se administraron inyecciones de contraste para valorar la permeabilidad de los ostium coronarios. Se observa el momento de la obstrucción del ostium del TCI (flecha blanca). D: ante el riesgo de obstrucción coronaria aguda, se implantó el stent del TCI (flecha roja). E: posteriormente, debido al alto riesgo, también se implantó el stent de la coronaria derecha (flecha azul). F: se optó por posdilatación con un balón de valvuloplastia (*) para mejorar la expansión de la prótesis valvular cardiaca percutánea. Para no comprimir los stents, los balones de los stents se inflaron al mismo tiempo que el balón aórtico. G: el seguimiento angiográfico final confirma la permeabilidad de los 2 ostium coronarios y la ausencia de insuficiencia aórtica. TCI: tronco común izquierdo.
Primer paso: valorar al paciente
-
– Una valoración preoperatoria integral resulta esencial. La intervención debe realizarse después de que el caso haya sido estudiado por un equipo multidisciplinario compuesto por cardiólogos intervencionistas y cirujanos cardiacos con suficiente experiencia.
Segundo paso: accesos vasculares
-
– Lograr acceso radial para abordajes secundarios (catéter pigtail). Cuando se protegen ambas coronarias, se pueden usar catéteres guía para administrar inyecciones de contraste y dirigir el implante de la THV y valorar la permeabilidad de los ostium coronarios.
-
– Acceder a la arteria femoral común para implantar la THV o un acceso alternativo si fuese necesario.
-
– Usar la arteria femoral contralateral para insertar un catéter guía para protección coronaria. Lo ideal es emplear un catéter de 7 Fr (Extra back-up [EBU] o Judkins izquierdo [JL] para el TCI y Judkins derecho [JR] para la CD).
-
– Lograr acceso venoso para el marcapasos si fuese necesario.
Tercer paso: preparar la protección coronaria y desplegar la THV
-
– Cruzar la válvula aórtica y colocar la guía TAVI en el ventrículo izquierdo (VI).
-
– Colocar la guía de 0,014 pulgadas en la arteria en riesgo.
-
– Avanzar los stents sobre las guías, asegurándonos de que sean lo bastante largos como para anclarse y sobresalir por encima de los velos de la THV. Puede emplearse un extensor de catéter guía para que el stent no interactúe con la THV.
-
– Realizar una valvuloplastia, caso de ser necesario, y evaluar el flujo coronario durante todo el proceso8,43.
-
– Avanzar la THV por la guía del VI y desplegarla, haciendo seguimiento del flujo coronario empleando inyecciones de contraste.
Cuarto paso: implantar el stent y realizar una evaluación posoperatoria
-
– Si el flujo coronario se hubiese visto afectado durante el implante de la THV, retirar los stents sin desplegar que sobresalen de la aorta y desplegarlos.
-
– Mantener un umbral bajo para el implante de los stents ante la dificultad de volver a cruzar la estructura de la THV.
-
– Posible dilatación del segmento proximal del stent con un balón para mejorar y anticiparse a un posible nuevo acceso a las coronarias.
-
– Posdilatar si es necesario empleando la técnica de kissing balloon para no comprimir el stent43.
-
– Realizar una valoración ecocardiográfica y angiográfica final para confirmar el éxito de los resultados antes de finalizar la intervención.
Tratamiento posoperatorio
El tratamiento antiagregante plaquetario óptima para estos pacientes no termina de estar claro. En líneas generales, se recomienda un curso de tratamiento antiagregante plaquetario doble (ácido acetilsalicílico más clopidogrel) de, como mínimo, 6 meses. No obstante, en personas mayores con comorbilidades, se debe tener en cuenta, además, el riesgo de sangrado. En pacientes a tratamiento anticoagulante, se puede usar un curso de terapia triple de 1 semana de duración, seguido de entre 3 y 6 meses de terapia doble (clopidogrel más anticoagulante) antes de continuar, solo, con el anticoagulante. Se necesitan, no obstante, más evidencias para determinar la mejor estrategia en estos casos.
La técnica BASILICA
La técnica BASILICA es otra estrategia sugerida para evitar la ocurrencia de OC. Esta estrategia se desarrolló como medida preventiva previa al implante de la THV, lacerando los velos para evitar su compresión contra los ostium coronarios, lo cual podría provocar oclusiones agudas24,45. La creación de un «triángulo de flujo» facilita el flujo sanguíneo hacia las coronarias46. BASILICA se diseñó como una alternativa a las técnicas basadas en stents con posibles limitaciones tales como una potencial compresión extrínseca, un riesgo de trombosis a largo plazo desconocido y accesos coronarios difíciles10.
Khan et al. informaron de los resultados a 30 días de 30 pacientes tratados con la técnica BASILICA, sin informar OC y con intervenciones exitosas en 28 pacientes. Los resultados de seguridad, incluidas las complicaciones cardiovasculares mayores, los accidentes cerebrovasculares, las lesiones renales y la muerte se informaron en el 70% de los pacientes, aunque no tuvieron nada que ver con la técnica BASILICA36. Recientemente, se demostró que esta intervención se puede realizar con un riesgo muy bajo de eventos cardiovasculares adversos mayores y una alta tasa de éxito en pacientes con válvulas aórticas nativas y protésicas47. La inestabilidad hemodinámica que sobreviene tras la laceración de la válvula fue rara y se resolvió tras implantar la THV. Las intervenciones fallidas se debieron, probablemente, a la calcificación grave de los velos, lo cual evitó su perforación antes de dividirse45. Los resultados a 1 año confirmaron la ausencia de más accidentes cerebrovasculares o infartos de miocardio y solo 2 muertes más48. Kitamura et al. informaron resultados aún mejores, sin complicaciones vasculares mayores, necesidad de soporte circulatorio mecánico, accidentes cerebrovasculares ni mortalidad a 30 días49. El empleo de la técnica BASILICA en THV fallidas es limitado por el diseño de algunos tipos de THV y el alineamiento comisural. Los modelos en estudio confirmaron que la división de los velos fue efectiva en las válvulas Sapien XT de generaciones anteriores, aunque menos en las válvulas Sapien 3 (Edwards Lifesciences, Estados Unidos) y EVOLUT (Medtronic, Estados Unidos) de última generación50. Además, aún en el caso de una laceración factible, las nuevas comisuras de la THV podrían alinearse de forma desfavorable y un posicionamiento demasiado alto del faldón de la nueva THV podría llegar a obstruir el velo lacerado.
Las contraindicaciones aún no se han definido claramente, pero la técnica podría resultar ineficaz ante SDV muy estrechos, ostium coronarios excéntricos o cúspides gravemente calcificadas. Además, se debería evitar en casos de endocarditis o trombosis valvular46. En lo que a la excentricidad se refiere, podría ser uno de los obstáculos más importantes que tener en cuenta para una protección efectiva de los ostium coronarios, sobre todo en pacientes tratados de TAVI en TAVI tal y como como sugirió Redondo et al. en una publicación anterior. En estos casos, si los ostium coronarios están en una posición excéntrica dentro de los SDV, la laceración probablemente no se alinee con los ostium, suprimiendo, así, su eficacia38.
Detalles de la intervención
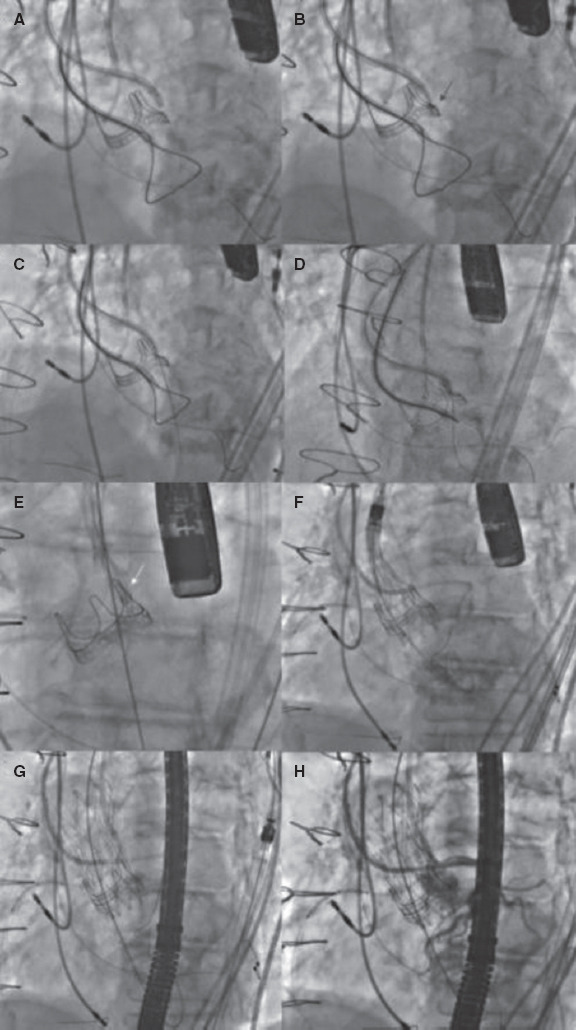
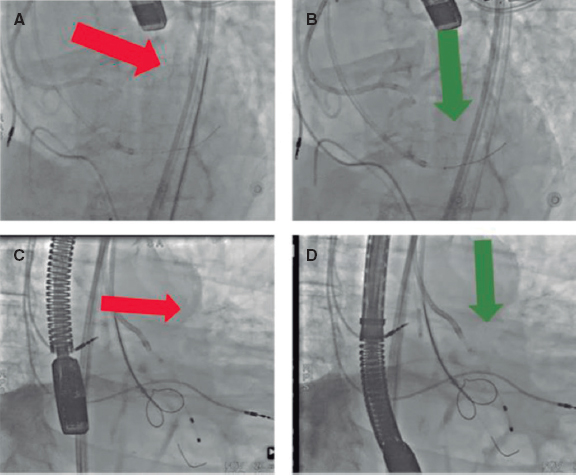
La intervención se debe realizar bajo guiado ecocardiográfico transesofágico (ETE) para garantizar los mejores resultados posibles y facilitar el abordaje. La anestesia general es obligatoria. Algunos operadores prefieren emplear la ecocardiografía intracardiaca no haciéndose necesario, en estos casos, el uso de anestesia general. La figura 4 muestra un TAVI ViV con el uso de la técnica BASILICA para proteger el TCI por el alto riesgo de oclusión.
Figura 4. Pasos principales del TAVI «válvula dentro de otra válvula» con la técnica BASILICA. A: primero, se colocó un catéter guía JR (8 Fr) en el ventrículo izquierdo con un lazo y un pigtail en la aorta ascendente para una aortografía. Luego, se colocó un catéter diagnóstico JR de 5 Fr dentro de un catéter guía AL 3 de 8 Fr sobre el velo de la prótesis aórtica con un microcatéter Finecross 130 y una guía Astato XS 20 (Asahi Intecc, Estados Unidos) en su interior. B: tras identificar el punto óptimo de perforación del velo izquierdo mediante guiado eco y angiográfico, se colocó correctamente la guía, se electrificó y se perforó el velo (flecha roja). C: posteriormente, la guía quedó atrapada en el lazo colocado en el tracto de salida del ventrículo izquierdo y se tiró de ella hacia el interior del catéter guía JR (D, E) previo a externalizar la guía; se creó una «forma de V» en la zona central de la guía. Luego, se avanzó, y cuando la «forma de V» entró en contacto con el velo (E, flecha blanca), la guía volvió a electrificarse al tiempo que se tiró de ambos extremos lacerando el velo. F, G: se implantó una prótesis valvular cardiaca percutánea y autoexpandible confirmándose, finalmente, la permeabilidad coronaria (H). BASILICA, laceración intencionada del festón aórtico bioprotésico para evitar obstrucciones coronarias iatrogénicas; JR: Judkins derecho.
Primer paso: valoración del paciente
-
– Siempre se debe hacer una valoración de los pacientes tratados de TAVI. La planificación de la intervención deberá incluir una valoración con imágenes (las imágenes por TC aquí son clave).
Segundo paso: accesos vasculares
-
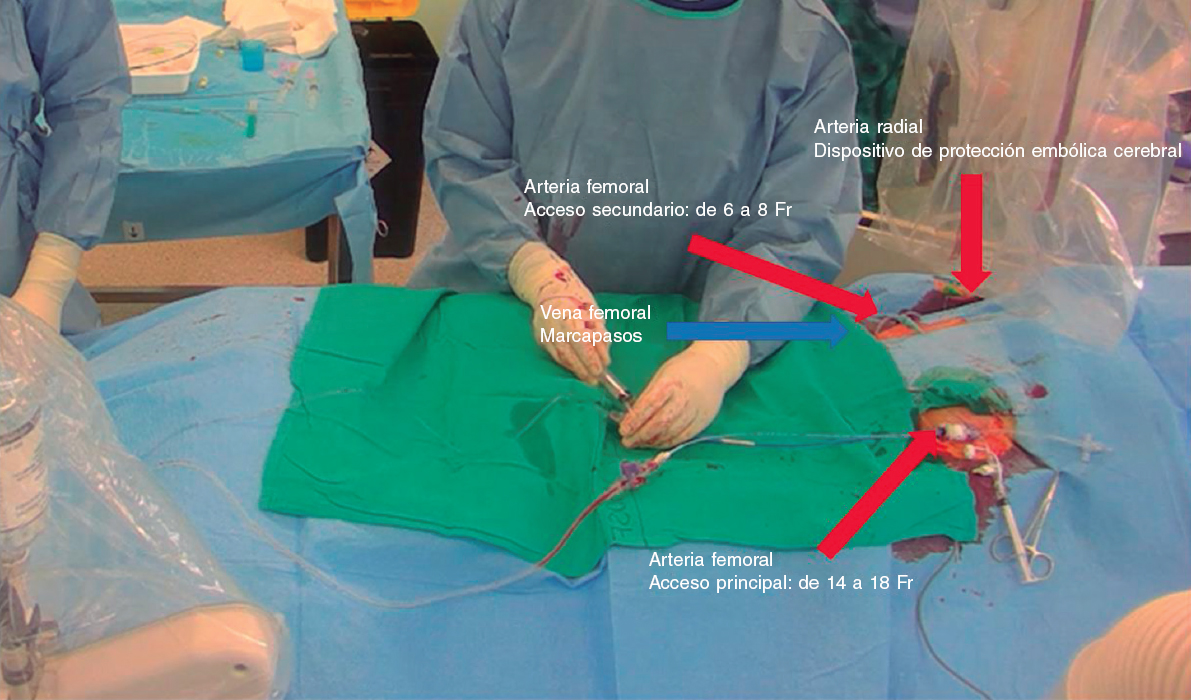
– Inicialmente, se necesitan, como mínimo, 3 accesos arteriales para esta técnica (figura 5)24.
-
– Se utiliza un introductor de 14 Fr (como mínimo) para el acceso principal. Se recomienda usar un introductor Dryseal (GORE, Estados Unidos) puesto que es capaz de acomodar 2 catéteres guía y mantener la hemostasia, a saber, 1 catéter guía (de entre 7 y 8 Fr) para perforar el velo y otro catéter pigtail para desplegarlo en el VI.
-
– Ante anatomías iliofemorales complejas, se recomienda utilizar un introductor femoral que se pueda desplegar para hacer avanzar la THV. De este modo, el cardiólogo intervencionista se asegura de que la THV avance sin problemas tras la laceración del velo.
-
– El segundo acceso se coloca en la arteria femoral común contralateral para insertar un catéter que se usa para colocar un lazo en el VI.
-
– El tercer acceso se inserta en la arteria radial para colocar un dispositivo de protección embólica cerebral (Sentinel [Boston Scientific, Estados Unidos]).
-
– En el caso de ser necesario, se debe obtener acceso venoso para implantar un marcapasos temporal.
Figura 5. Preparación del paciente con 3 accesos arteriales (radial derecho para el dispositivo de protección embólica cerebral y 2 femorales) y 1 acceso venoso para implantar el marcapasos temporal.
Tercer paso: perforación de los velos
-
– La válvula aórtica debe cruzarse y posteriormente, se debe colocar un catéter guía multipropósito de 6 Fr en el tracto de salida del ventrículo izquierdo (LVOT). Utilizando dicho catéter, se coloca un lazo en cuello de ganso del mismo tamaño que el LVOT (entre 20 y 30 mm) en el LVOT. Paralelo al lazo, empleando el mismo catéter multipropósito, se coloca una guía de 0,018 pulgadas en el VI hasta alcanzar al ápex; esta guía permite redirigir el lazo al VI si se tira de él. En lugar de un catéter multipropósito, se puede usar un catéter JR de 6 Fr dependiendo de lo angulada que sea la anatomía.
-
– Luego, se deben elegir diferentes catéteres, lo ideal es que sean de 7-8 Fr dependiendo de la cúspide a lacerar. Para el abordaje del velo izquierdo, la primera opción suele ser emplear un Amplatz izquierdo (AL) 3; no obstante, dependiendo de cómo sea la anatomía de la raíz aórtica, también se pueden usar catéteres AL1, AL2, AL4, EBU 3.5 y 4. Para el velo derecho, se suele usar un catéter multipropósito o un JR si la aorta es horizontal.
-
– Para perforar el velo izquierdo se hace necesario un catéter diagnóstico largo de 5 Fr en el interior de un catéter de 8 Fr (madre-hijo). La primera opción es un catéter mamario interno diagnóstico de 125 cm o un catéter JR 4.
-
– Con una serie de dispositivos telescopados, se coloca una guía de 300 cm (se sugiere la Astato XS 20 de 300 cm [Asahi Intecc, Estados Unidos]) y un microcatéter, ambos dentro de los catéteres mamario interno de 5 Fr y guía de 8 Fr.
-
– Los dispositivos telescopados se orientan, entonces, hacia la base de la cúspide diana, con la orientación correcta para evitar perforaciones no deseadas guiadas por fluoroscopia y ETE. El velo diana debe proyectarse en 2 ángulos fluoroscópicos, «vista frontal» y «lateral». Estas proyecciones, estimadas mediante evaluación por TC, ayudan a acceder a los velos con precisión. Las inyecciones de contraste también sirven para estimar la relación espacial de la válvula (figura 6).
-
– Una vez se logra la posición óptima del «telescopio» con un «ángulo de ataque» correcto, se intenta perforar el velo. Tras apuntalar el complejo catéteres-guía, se aproxima el microcatéter al velo y se electrifica la guía para realizar la perforación.
-
– Para electrificar la guía, se raspan entre 1 y 3 cm de su parte posterior con una hoja de bisturí hasta que la parte metálica queda expuesta; luego se conecta a un lápiz eléctrico con una pinza mosquito. El generador electroquirúrgico se ajusta al modo «corte puro» y la potencia se ajusta al velo; 30 vatios para velos porcinos, 50 para bovinos o nativos y 70 para velos gravemente calcificados. La electrificación ha de ser breve (< 1 segundo) y detenerse inmediatamente después de que la guía haya franqueado el velo46.
-
– Tras la perforación, la guía de 300 cm se coloca en el TSVI, intentando cruzarlo a través del lazo, que se debe situar en la parte alta del TSVI para no lesionar la válvula mitral. Tras capturarla, se tira de la guía de 300 cm hacia el interior de la guía con el lazo sin exteriorizarla.
-
– Se debe emplear guiado por ETE para que la guía no se enrede con el aparato mitral.
Figura 6. Orientación de los catéteres para la perforación del velo. A: vista lateral con dirección fuera de eje. B: vista lateral con dirección correcta. C: vista frontal con dirección fuera de eje. D: vista frontal con dirección correcta.
Cuarto paso: preparación de la THV
-
– Tras perforar el velo y antes de la laceración, se debe preparar la THV para que esté lista para un implante rápido una vez se haya modificado el velo ya perforar el velo puede llevar tiempo. La válvula no puede permanecer crimpada mucho tiempo porque puede aumentar el riesgo de dañar la THV.
-
– Tras perforar el velo, se debe volver a cruzar la válvula aórtica para colocar un catéter pigtail desde el acceso arterial principal e implantar rápidamente a la THV ante la presencia de inestabilidad hemodinámica tras la laceración del velo.
Quinto paso: laceración del velo
-
– Antes de externalizar la guía de 300 cm, se debe crear una «forma en V» en la región central de la misma acodando y recortando la guía con una hoja de bisturí de 10 mm, en la parte acodada (figura 7). Luego, se debe avanzar la guía hasta que la forma en V entre en contacto con el velo.
-
– La posición del microcatéter se fija con un dispositivo de torsión para identificar la «V voladora».
-
– Cuando la forma en V está en posición correcta, se tira de los 2 extremos de la guía, lo cual coincide con una nueva electrificación de esta con el lápiz conectado al mismo lugar empleando para la perforación. En este caso, la potencia a aplicar es mayor y depende del tipo de velo: 50 vatios para velos porcinos, 70 para bovinos o nativos y 100 para velos gravemente calcificados.
-
– La inyección de una solución de dextrosa en cada catéter guía se puede realizar simultáneamente con la laceración. No obstante, si no se usar dextrosa, los catéteres deben lavarse antes de la laceración para retirar todo el contenido sanguíneo.
-
– Para evitar la inestabilidad hemodinámica provocada por la laceración prolongada de un velo sin implante de una THV, ambos velos deben abordarse simultáneamente para proteger ambos 2 ostium coronarios, si fuese necesario. Esto requiere accesos vasculares adicionales tales como el uso de un introductor de 14 a 18 Fr en una arteria femoral para 1 velo y acceso doble con 2 vainas (de 6 a 8 Fr) en la otra arteria femoral o el uso de otro introductor grande (de 14 a 18 Fr) en la otra femoral, pero con un mayor riesgo de sangrado y vascular.
Figura 7. Astato XS 20 (Asahi Intecc, Estados Unidos) con forma de «V voladora» para laceración del velo.
Sexto paso: Implante de la THV y posdilatación
-
– La THV se debe implantar inmediatamente después de la laceración. Luego, se retiran los catéteres empleados en la laceración. El pigtail colocado en el VI se usa para avanzar la guía rígida e implantar la THV. La altura de implantación debe compensar el riesgo de gradientes altos con una posición baja y el riesgo de OC con un implante demasiado alto. Un implante demasiado alto puede hacer que el faldón cubra el «triángulo de flujo»46. Se deben seguir las recomendaciones para cada tipo de THV, intentando mantener el rango inferior de profundidad recomendado, por ejemplo, para un dispositivo EVOLUT Pro+ (Medtronic, Estados Unidos) este rango es de 3 mm de profundidad utilizando la proyección de solapamiento de cúspides. Esto es de una importancia capital en las THV supraanulares.
-
– Los operadores deben ser muy cautos a la hora de posdilatar y con la fractura del anillo de la PVB en las intervenciones realizadas con la técnica BASILICA porque se puede aumentar el riesgo de CO.
-
– Si el riesgo de OC es demasiado alto, los operadores pueden proteger las coronarias con guías y stents no desplegados a discreción24.
-
– Tras implantar la THV, se debe comprobar la permeabilidad de los ostium coronarios mediante una aortografía(preferible a una inyección selectiva). Además, una valoración mediante ETE ayudaría a comprobar los resultados hemodinámicos y la ausencia de otras posibles complicaciones.
-
– Al igual que ocurre durante la realización de otros TAVI, la intervención debe concluir con una hemostasia adecuada y con la comprobación de los accesos.
Dispositivos de corte
Aunque los resultados de la técnica BASILICA son prometedores, se trata de una intervención compleja que requiere un equipo altamente experimentado. El ShortCut (Pi-Cardia, Israel) se diseñó para simplificar la laceración y separar los velos51. Inicialmente pensados para las PVB, estos dispositivos constan de un mango, un sistema de liberación y una unidad distal y se introducen a través de un introductor de 16 Fr en la arteria femoral común. La ETE ayuda a guiar su posicionamiento actuando mecánicamente sobre el velo51.
Dvir et al. informaron de los hallazgos de la experiencia preclínica y primera en seres humanos con este dispositivo. Estos autores probaron el dispositivo en 8 pacientes con PVB fallidas. En todos los pacientes, el TAVI tuvo éxito y no sobrevino ninguna OC. Tampoco se informaron eventos neurológicos y los pacientes fueron dados de alta con un buen estado clínico51. Aunque los resultados iniciales son prometedores, sigue habiendo una brecha de evidencia. Los resultados de registros más grandes o incluso ensayos comparadores de este dispositivo con la técnica BASILICA podrían confirmar la utilidad de este dispositivo en el futuro.
Intervención UNICORN
La intervención UNICORN (minimización de la obstrucción coronaria iatrogénica con aguja de radiofrecuencia) es una nueva técnica para el manejo del riesgo de OC en pacientes tratados de TAVI en TAVI. La primera experiencia llevada a cabo en seres humanos con esta nueva estrategia fue reportada por Chan et al. Estos autores emplearon una guía dentro de un sistema telescópico compuesto por 1 catéter guía Amplatz izquierdo-1 de 7 Fr (Cordis, Estados Unidos) y 1 catéter de soporte Navicross de 135 cm (Terumo, Japón) para atravesar un velo protésico mediante un impulso de radiofrecuencia52. Tras perforar el velo, se realizaron sucesivas dilataciones de la fenestración con balones de mayor calibre. El último paso permitió avanzar una prótesis expandible con balón a través del velo perforado con posterior despliegue de la prótesis valvular cardiaca percutánea52.
El implante de la prótesis expandible con balón a través de la fenestración finaliza el proceso de laceración y captura del velo anterior, minimizando el riesgo de retroceso del velo y la posible obstrucción o embolización del ostium coronario52. La primera experiencia tuvo éxito y demostró la viabilidad de esta estrategia; no obstante, se necesitan más datos sobre los resultados a largo plazo.
CONCLUSIONES
Para optimizar los resultados en intervenciones TAVI, es esencial identificar a aquellos pacientes en riesgo de OC. La mejor forma de identificarlos es realizando una valoración estructurada que incluya mediciones específicas mediante TC de la altura de la cúspide y la coronaria, la DVC, el volumen de calcio coronario y otras características anatómicas y de riesgos asociados a la intervención. Sumada a intervenciones preventivas apropiadas tales como la técnica BASILICA, esta valoración integral del paciente ayuda a reducir el riesgo de OC. No obstante, se necesitan más estudios que nos ayuden a validar las diferentes estrategias y los dispositivos dedicados emergentes para prevenir esta complicación. A medida que las intervenciones TAVI se vayan popularizando, la identificación y manejo del riesgo de OC seguirán siendo esenciales para optimizar los resultados y mejorar la seguridad de los pacientes.
FINANCIACIÓN
Ninguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial.
CONFLICTO DE INTERESES
A. Regueiro es consultor de Abbott Vascular, Meril Life y OpSens. X. Freixa es consultor de Abbott Vascular fuera del trabajo presentado. M. Sabaté es consultor de Abbott Vascular e iVascular fuera del trabajo presentado. Los demás autores no declararon ningún conflicto de intereses.
AGRADECIMIENTOS
F. Spione ha recibido una beca de investigación dentro del programa de doctorado Cardiopath.
BIBLIOGRAFÍA
1. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease:Executive Summary:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e35-e71.
2. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
3. Ribeiro HB, Webb JG, Makkar RR, et al. Predictive factors, management, and clinical outcomes of coronary obstruction following transcatheter aortic valve implantation:insights from a large multicenter registry. J Am Coll Cardiol. 2013;62:1552-1562.
4. Khan JM, Kamioka N, Lisko JC, et al. Coronary Obstruction From TAVR in Native Aortic Stenosis:Development and Validation of Multivariate Prediction Model. JACC Cardiovasc Interv. 2023;16:415-425.
5. Ojeda S, González-Manzanares R, Jimenez-Quevedo P, et al. Coronary Obstruction after Transcatheter Aortic Valve Implantation. Insights from the Spanish TAVI Registry. JACC Cardiovasc Interv. 2023;16:1208-1217.
6. Holmes DR, Jr., Nishimura RA, Grover FL, et al. Annual Outcomes With Transcatheter Valve Therapy:From the STS/ACC TVT Registry. J Am Coll Cardiol. 2015;66:2813-2823.
7. Ribeiro HB, Rodés-Cabau J, Blanke P, et al. Incidence, predictors, and clinical outcomes of coronary obstruction following transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves:insights from the VIVID registry. Eur Heart J. 2018;39:687-695.
8. Akinseye OA, Jha SK, Ibebuogu UN. Clinical outcomes of coronary occlusion following transcatheter aortic valve replacement:A systematic review. Cardiovasc Revasc Med. 2018;19:229-236.
9. Jabbour RJ, Tanaka A, Finkelstein A, et al. Delayed Coronary Obstruction After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2018;71:1513-1524.
10. Lederman RJ, Babaliaros VC, Rogers T, et al. Preventing Coronary Obstruction During Transcatheter Aortic Valve Replacement:From Computed Tomography to BASILICA. JACC Cardiovasc Interv. 2019;12:1197-1216.
11. Arai T, Lefévre T, Hovasse T, et al. Incidence and predictors of coronary obstruction following transcatheter aortic valve implantation in the real world. Catheter Cardiovasc Interv. 2017;90:1192-1197.
12. Dvir D, Webb J, Brecker S, et al. Transcatheter aortic valve replacement for degenerative bioprosthetic surgical valves:results from the global valve-in-valve registry. Circulation. 2012;126:2335-2344.
13. Abramowitz Y, Chakravarty T, Jilaihawi H, et al. Clinical impact of coronary protection during transcatheter aortic valve implantation:first reported series of patients. EuroIntervention. 2015;11:572-581.
14. Yamamoto M, Shimura T, Kano S, et al. Impact of preparatory coronary protection in patients at high anatomical risk of acute coronary obstruction during transcatheter aortic valve implantation. Int J Cardiol. 2016;217:58-63.
15. Blanke P, Soon J, Dvir D, et al. Computed tomography assessment for transcatheter aortic valve in valve implantation:The vancouver approach to predict anatomical risk for coronary obstruction and other considerations. J Cardiovasc Comput Tomogr. 2016;10:491-499.
16. Achenbach S, Delgado V, Hausleiter J, Schoenhagen P, Min JK, Leipsic JA. SCCT expert consensus document on computed tomography imaging before transcatheter aortic valve implantation (TAVI)/transcatheter aortic valve replacement (TAVR). J Cardiovasc Comput Tomogr. 2012;6:366-80.
17. Holmes DR, Jr., Mack MJ, Kaul S, et al. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement. J Am Coll Cardiol. 2012;59:1200-1254.
18. Ribeiro HB, Nombela-Franco L, Urena M, et al. Coronary obstruction following transcatheter aortic valve implantation:a systematic review. JACC Cardiovasc Interv. 2013;6:452-461.
19. Buellesfeld L, Stortecky S, Kalesan B, et al. Aortic root dimensions among patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2013;6:72-83.
20. Tzimas G, Akodad M, Meier D, et al. Predicted vs Observed Valve to Coronary Distance in Valve-in-Valve TAVR:A Computed Tomography Study. JACC Cardiovasc Interv. 2023;16:2021-2030.
21. Pilgrim T, Tomii D. Predicting Coronary Obstruction After TAVR:Better Safe Than Sorry. JACC Cardiovasc Interv. 2023;16:426-428.
22. Fetahovic T, Hayman S, Cox S, Cole C, Rafter T, Camuglia A. The Prophylactic Chimney Snorkel Technique for the Prevention of Acute Coronary Occlusion in High Risk for Coronary Obstruction Transcatheter Aortic Valve Replacement/Implantation Cases. Heart Lung Circ. 2019;28:e126-e130.
23. Vemulapalli S, Carroll JD, Mack MJ, et al. Procedural Volume and Outcomes for Transcatheter Aortic-Valve Replacement. N Engl J Med. 2019;380:2541-2550.
24. Khan JM, Dvir D, Greenbaum AB, et al. Transcatheter Laceration of Aortic Leaflets to Prevent Coronary Obstruction During Transcatheter Aortic Valve Replacement:Concept to First-in- Human. JACC Cardiovasc Interv. 2018;11:677-689.
25. Bapat V. Technical pitfalls and tips for the valve-in-valve procedure. Ann Cardiothorac Surg. 2017;6:541-552.
26. Barbanti M. Avoiding Coronary Occlusion and Root Rupture in TAVI - The Role of Pre- procedural Imaging and Prosthesis Selection. Interv Cardiol. 2015;10:94-97.
27. Dvir D, Leipsic J, Blanke P, et al. Coronary obstruction in transcatheter aortic valve-in- valve implantation:preprocedural evaluation, device selection, protection, and treatment. Circ Cardiovasc Interv. 2015;8:e002079.
28. Valvo R, Costa G, Barbanti M. How to Avoid Coronary Occlusion During TAVR Valve-in- Valve Procedures. Front Cardiovasc Med. 2019;6:168.
29. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
30. Landes U, Webb JG, De Backer O, et al. Repeat Transcatheter Aortic Valve Replacement for Transcatheter Prosthesis Dysfunction. J Am Coll Cardiol. 2020;75:1882-1893.
31. Gallo M, Fovino LN, Blitzer D, et al. Transcatheter aortic valve replacement for structural degeneration of previously implanted transcatheter valves (TAVR-in-TAVR):a systematic review. Eur J Cardiothorac Surg. 2022;61:967-976.
32. Barbanti M, Webb JG, Tamburino C, et al. Outcomes of Redo Transcatheter Aortic Valve Replacement for the Treatment of Postprocedural and Late Occurrence of Paravalvular Regurgitation and Transcatheter Valve Failure. Circ Cardiovasc Interv. 2016;9:e003930.
33. Tarantini G, Fabris T, Nai Fovino L. TAVR-in-TAVR and coronary access:importance of preprocedural planning. EuroIntervention. 2020;16:e129-e132.
34. Buzzatti N, Romano V, De Backer O, et al. Coronary Access After Repeated Transcatheter Aortic Valve Implantation:A Glimpse Into the Future. JACC Cardiovasc Imaging. 2020;13:508-515.
35. Percy ED, Harloff MT, Hirji S, et al. Nationally Representative Repeat Transcatheter Aortic Valve Replacement Outcomes:Report From the Centers for Medicare and Medicaid Services. JACC Cardiovasc Interv. 2021;14:1717-1726.
36. Komatsu I, Mackensen GB, Aldea GS, Reisman M, Dvir D. Bioprosthetic or native aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction. Part 1:how to evaluate patients for BASILICA. EuroIntervention. 2019;15:47-54.
37. Nai Fovino L, Scotti A, Massussi M, et al. Coronary Angiography After Transcatheter Aortic Valve Replacement (TAVR) to Evaluate the Risk of Coronary Access Impairment After TAVR-in-TAVR. J Am Heart Assoc. 2020;9:e016446.
38. Redondo A, Baladrón Zorita C, Tchétché D, et al. Commissural Versus Coronary Optimized Alignment During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2022;15:135-146.
39. Rodés-Cabau J, Webb JG, Cheung A, et al. Transcatheter aortic valve implantation for the treatment of severe symptomatic aortic stenosis in patients at very high or prohibitive surgical risk:acute and late outcomes of the multicenter Canadian experience. J Am Coll Cardiol. 2010;55:1080-1090.
40. Thomas M, Schymik G, Walther T, et al. Thirty-day results of the SAPIEN aortic Bioprosthesis European Outcome (SOURCE) Registry:A European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve. Circulation. 2010;122:62-69.
41. Chakravarty T, Jilaihawi H, Nakamura M, et al. Pre-emptive positioning of a coronary stent in the left anterior descending artery for left main protection:a prerequisite for transcatheter aortic valve-in-valve implantation for failing stentless bioprostheses?Catheter Cardiovasc Interv. 2013;82:E630-E636.
42. González LF, Mata RB, Roman KG-S, Villa JA. Emergent Chimney Stent to Treat Left Main Occlusion Following Valve-In-Valve Transfemoral Aortic Implantation Chimney Stent Following Valve-In-Valve TAVI. J Cardiovasc Thorac Surg.2018;3:1-2.
43. Spaziano M, Akodad M, Hovasse T, Lefévre T, Bouvier E, Chevalier B. Simultaneous TAVR and Left Main «Chimney»Stenting in a Patient With Low Left Main Height. JACC Cardiovasc Interv. Oct 23 2017;10:e185-e187.
44. Mercanti F, Rosseel L, Neylon A, et al. Chimney Stenting for Coronary Occlusion During TAVR:Insights From the Chimney Registry. JACC Cardiovasc Interv. 2020;13:751-761.
45. Khan JM, Greenbaum AB, Babaliaros VC, et al. The BASILICA Trial:Prospective Multicenter Investigation of Intentional Leaflet Laceration to Prevent TAVR Coronary Obstruction. JACC Cardiovasc Interv. 2019;12:1240-1252.
46. Komatsu I, Mackensen GB, Aldea GS, Reisman M, Dvir D. Bioprosthetic or native aortic scallop intentional laceration to prevent iatrogenic coronary artery obstruction. Part 2:how to perform BASILICA. EuroIntervention. 2019;15:55-66.
47. Cepas-Guillén P, Gabani R, Giménez-Milá M, Sanchis L, Freixa X, Regueiro A. Safety and efficacy of the BASILICA technique in patients at high risk of coronary obstruction undergoing TAVI. Rev Esp Cardiol. 2024;77:181-183.
48. Khan JM, Greenbaum AB, Babaliaros VC, et al. BASILICA Trial:One-Year Outcomes of Transcatheter Electrosurgical Leaflet Laceration to Prevent TAVR Coronary Obstruction. Circ Cardiovasc Interv. 2021;14:e010238.
49. Kitamura M, Majunke N, Holzhey D, et al. Systematic use of intentional leaflet laceration to prevent TAVI-induced coronary obstruction:feasibility and early clinical outcomes of the BASILICA technique. EuroIntervention. 2020;16:682-690.
50. Khan JM, Bruce CG, Babaliaros VC, Greenbaum AB, Rogers T, Lederman RJ. TAVR Roulette:Caution Regarding BASILICA Laceration for TAVR-in-TAVR. JACC Cardiovasc Interv. 2020;13:787-789.
51. Dvir D, Leon MB, Abdel-Wahab M, et al. First-in-Human Dedicated Leaflet Splitting Device for Prevention of Coronary Obstruction in Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2023;16:94-102.
52. Chan KE, Tai-Leung Chan D, Lam CS, et al. First-in-Human Undermining Iatrogenic Coronary Obstruction With Radiofrequency Needle (UNICORN) Procedure During Valve-in-Valve Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2022;15:928-931.
* Autor para correspondencia.
Correo electrónico: (A. Regueiro).
@anderregueiro; @victorArevalos; @freixa_xavier; @sbrugaletta; @lsanchisruiz; @fraspio; @hospitalclinic