RESUMEN
El intervencionismo coronario complejo es aún un escenario desafiante que todavía se asocia con resultados subóptimos. A lo largo de los años han surgido diferentes estrategias y tecnologías con el objetivo de mejorar dichos resultados. En concreto, el desarrollo y la evolución de herramientas de imagen intravascular para guiar el procedimiento han permitido perfeccionar la evaluación de la lesión y su preparación, y asegurar su optimización. No obstante, los posibles beneficios de su uso en este escenario particular son aún objeto de estudio. En este artículo, el objetivo es resumir brevemente los principales estudios realizados previamente con estas técnicas, así como los ensayos que en la actualidad están en marcha en intervencionismo coronario complejo guiado por imagen.
Palabras clave: Intervencionismo coronario complejo. Tomografía de coherencia óptica. Ecografía intravascular.
ABSTRACT
Percutaneous coronary intervention of complex coronary artery disease remains challenging and is still associated with suboptimal cardiovascular outcomes. Over the years, different strategies and technologies have been developed to improve these results. Particularly, the development and evolution of intravascular imaging modalities to guide the procedure have improved lesion assessment and preparation, and stent optimization. However, whether these advantages are beneficial in this particular setting is still under discussion. In this article we intend to briefly summarize previous imaging-guided trials and give an outline on the ongoing large trials that are being conducted on imaging-guided interventions in complex coronary disease.
Keywords: Complex percutaneous coronary intervention. Optical coherence tomography. Intravascular ultrasound.
Abreviaturas
ICP: intervención coronaria percutánea. IVUS: ecografía intravascular. OCT: tomografía de coherencia óptica.
INTRODUCCIÓN
En el abordaje de la enfermedad coronaria compleja, -que incluye lesiones coronarias extensamente calcificadas, bifurcaciones (incluidas las bifurcaciones del tronco coronario izquierdo), reestenosis del stent, oclusiones crónicas y lesiones largas-, la intervención coronaria percutánea (ICP) sigue asociándose a resultados cardiovasculares subóptimos a largo plazo. La posibilidad de reducir ese riesgo gracias a los avances en la tecnología de los stents y las técnicas de imagen intracoronaria sigue siendo objeto de debate. A continuación, se ofrece un breve recorrido histórico a través de los distintos estudios guiados por imagen intracoronaria realizados, así como un breve resumen de los ensayos clínicos aleatorizados actualmente en fase de desarrollo.
Tras 4 décadas de ser la angiografía el pilar de la angioplastia con balón y de las intervenciones con implante de stent, la evolución de la ecografía intravascular (IVUS) y de la tomografía de coherencia óptima (OCT) de forma paralela al desarrollo y mejora de los stents farmacoactivos y armazones bioabsorbibles de última generación ha promovido la adopción paulatina de ambas técnicas de imagen intravascular para guiar la ICP. A lo largo de los años, se han llevado a cabo diferentes ensayos clínicos y revisiones sistemáticas para comparar los resultados a largo plazo de la ICP guiada por angiografía con la ICP guiada por imagen intracoronaria, con importantes hallazgos1-12. Las últimas guías de práctica clínica publicadas recomiendan ambas técnicas de imagen para guiar el intervencionismo coronario solo en un subgrupo seleccionado de pacientes (el guiado por IVUS tiene una recomendación clase IIa y el guiado por OCT, una recomendación clase IIb)13,14. Esto abre nuevas oportunidades para realizar ensayos clínicos en las poblaciones de alto riesgo, que son las que más podrían beneficiarse de estas intervenciones.
Aunque las publicaciones, incluidos los ensayos multicéntricos y las revisiones sistemáticas, ya han confirmado los beneficios de la ICP guiada por técnicas de imagen intravascular frente a la ICP guiada por angiografía, se han comunicado diferentes hallazgos, posiblemente por diferencias en a) los pacientes y tipos de lesión incluidos en los estudios; b) la definición de criterios de optimización específicos basado en la imagen intravascular y las diferencias descritas en dichos criterios en los distintos estudios; c) la duración del seguimiento y d) los objetivos de los distintos estudios. Invariablemente, la omisión o falta de representación de ciertos grupos de lesiones angiográficamente complejas en estudios anteriores ha obligado a hacer estudios focalizados en esta cuestión2,3,7,9,15-20.
La tabla 1 ofrece algunos detalles de estudios previamente publicados en revascularización guiada por imagen, así como de los hallazgos descritos.
Tabla 1. Principales estudios publicados sobre ICP guiada por imagen intravascular
| Estudio (n), NCT | Año | Criterios de guiado | Técnica de imagen | Objetivos | Principales hallazgos |
|---|---|---|---|---|---|
| MUSIC (n = 161) NCT ND | 1998 | Aposición completa de todo el stent sobre la pared vascular; ALM: ALM del stent ≥ 90% del área luminal media de referencia o ≥ 100% del segmento de referencia con la menor área luminal de todas; ALM del stent de la entrada proximal del stent ≥ 90% del área luminal proximal de referencia. Si el ALM del stent > 9,0 mm2, el ALM del stent ≥ 80% del área luminal media de referencia o ≥ 90% del segmento de referencia con la menor área luminal de todas; ALM del stent de la entrada proximal del stent ≥ 90% del área luminal proximal de referencia; expansión simétrica del stent definida por el diámetro luminal mínimo dividido por un diámetro luminal máximo ≥ 0,7 | IVUS | Muerte, IM, cirugía de revascularización coronaria y RLD y oclusión trombótica (sub) aguda del stent clínica y/o documentada angiográficamente 30 días después del implante | Resultado angiográfico a los 6 meses en el grupo implantado guiado por IVUS: incidencia de RLD del 5,7% y de reestenosis del stent del 9,7% con el mayor DLM: 2,12 ± 0,67 mm |
| AVID (n = 800) NCT ND | 2000 | El AMS debería ser ≥ 90% del área transversal luminal del vaso distal de referencia; stent completamente apuesto; disecciones cubiertas por el stent | IVUS | Objetivo primario: incidencia de RLD a los 12 meses detectada en el seguimiento clínico sin necesidad de tener que repetir la angiografía | Los resultados a 12 meses revelaron una incidencia de la RLD del 10,1% en el grupo angiográfico frente a una incidencia del 4,3% en el grupo IVUS (p = 0,01; IC95%: −10,6% a −1,2%) |
| SIPS (n = 269) NCT ND | 2000 | Aposición completa de todo el stent a la pared vascular; ALM ≥ 90% del área luminal media de referencia o ≥ 100% del área luminal del segmento de referencia con un ALM > 9,0 mm2; ALM ≥ 80% del área luminal media de referencia o ≥ 90% del área luminal del segmento de referencia con la menor área luminal. Expansión simétrica del stent | IVUS | El objetivo primario del estudio fue el DLM angiográfico a los 6 meses. Los objetivos secundarios fueron el DLM agudo, el coste agudo y crónico, la calidad de vida, la incidencia del objetivo compuesto de eventos clínicos y la RLD por motivos clínicos | El seguimiento clínico (602 ± 307 días) reveló un importante descenso de la RLD por motivos clínicos en el grupo IVUS frente al grupo sometido a guiado estándar (17 frente a 29%, respectivamente; p = 0,02) |
| MAIN-COMPARE (n = 975) NCT ND | 2009 | Criterios específicos para guiado por IVUS no facilitados | IVUS | El objetivo primario del estudio fue la mortalidad. Los objetivos secundarios fueron el IM, la revascularización del vaso diana (RVD) o un objetivo compuesto de eventos | Comparado con el guiado angiográfico convencional, el guiado por IVUS, sobre todo durante el implante de stents farmacoactivos, reduce la tasa de mortalidad a largo plazo en el tratamiento de la estenosis de tronco coronario izquierdo no protegido |
| HOME DES (n = 210) NCT ND | 2010 | Buena aposición; aposición de todos los struts del stent a la pared vascular; expansión óptima del stent (con un AMS = 5 mm2) o un área transversal > 90% del área transversal luminal distal de referencia para vasos pequeños/y sin disección de los bordes (márgenes de 5 mm en proximales y distales al stent) | IVUS | MACE (muerte, IM y nueva intervención) | No se observaron diferencias importantes entre los 2 grupos tras 18 meses de seguimiento en lo que a la incidencia de MACE se refiere (11 frente a 12%; p = NS) |
| CLI-OICP (n = 670) NCT ND | 2012 | La infraexpansión del stent se definió en base a criterios IVUS establecidos de expansión óptima del stent (por ejemplo, área luminal mínima del stent ≥ 90% del área luminal media de referencia o ≥ 100% del área luminal del segmento de referencia con la menor área luminal de todas) | OCT | El objetivo primario fue la incidencia de muerte cardiovascular o IM al cabo de 1 año | El grupo OCT tuvo una incidencia mucho más baja, al cabo de 1 año, de muerte cardiovascular (1,2 frente a 4,5%; p = 0,010), muerte por causas cardiacas o IM (6,6 frente a 13,0%; p = 0,006), así como del objetivo compuesto de muerte por causas cardiaca, IM o nueva revascularización (9,6 frente a 14,8%, p = 0,044) |
| AVIO (n = 284) NCT ND | 2013 | AMS final de, al menos, el 70% de la hipotética área transversal del balón completamente inflado a efectos de posdilatación. El tamaño óptimo del balón a efectos de posdilatación es el promedio de los diámetros de la media-a-media de los segmentos distal y proximal del stent y de los lugares de mayor estrechamiento del stent. El valor se redondea a los valores más bajos de 0,00 o 0,50 mm. Para valores ≥ 3,5 mm el operador puede reducir el diámetro del balón según juicio clínico | IVUS | El objetivo primario del estudio fue el diámetro luminal mínimo de la lesión posoperatoria. Los objetivos secundarios fueron un compuesto de MACE, RLD, revascularización del vaso diana, IM y trombosis del stent al cabo de 1, 6, 9, 12 y 24 meses | IVUS optimizó el implante del SFA tal y como confirmó el diámetro luminal mínimo posoperatorio de las lesiones complejas. No se observaron diferencias significativas en la incidencia de MACE tras 24 meses de seguimiento |
| RESET (n = 1.574) NCT ND | 2013 | Criterios específicos para guiado IVUS no facilitados | IVUS | MACE, incluida la muerte cardiovascular, el IM o la revascularización del vaso diana al año de seguimiento tras implante de SFA en lesiones de poca longitud | No se observaron diferencias significativas en lo referente a la incidencia de MACE entre el grupo guiado por IVUS y el guiado por angiografía |
| AIR CTO (n = 230) NCT ND | 2015 | Buena aposición, AMS > 80% del área del vaso de referencia, índice de simetría > 70% y ausencia de disección > tipo B | IVUS | El objetivo primario fue la pérdida luminal tardía intra stent tras 1 año de seguimiento | La pérdida luminal tardía intra stent del grupo guiado por IVUS fue mucho menor que la del grupo guiado por angiografía al año de seguimiento (0,28 ± 0,48 mm frente a 0,46 ± 0,68 mm; p = 0,025) observándose una diferencia notable de la reestenosis del stent entre los 2 grupos (3,9 frente a 13,7%; p = 0,021) |
| CTO IVUS (n = 402) NCT01563952 | 2015 | a) AMS ≥ área luminal distal de referencia; b) área del stent en el segmento de la OTC ≥ 5 mm2 si lo permite el área del vaso; y c) aposición completa del stent | IVUS | El objetivo primario fue la ocurrencia de muerte cardiovascular. El objetivo secundario fue la incidencia de MACE definidos como un compuesto de muerte cardiovascular, IM o revascularización del vaso diana tras 12 meses de seguimiento | La estrategia guiada por IVUS no redujo la mortalidad cardiovascular significativamente. La ocurrencia de MACE fue mucho menor en el grupo guiado por IVUS que en el guiado por angiografía (2,6 frente a 7,1%) |
| IVUS-XPL (n = 1.400) NCT01308281 | 2016 | AMS mayor que el área transversal luminal en los segmentos distales de referencia post-ICP | IVUS | El objetivo primario fue un compuesto de MACE, incluida la muerte cardiovascular, el IM del vaso diana o la RLD motivada por la isquemia tras 1 año de seguimiento analizado por intención de tratar | El implante del stent guiado por IVUS se asoció a un significativo descenso absoluto del 2,9% y relativo del 48% del riesgo de MACE al cabo de 1 año comparado con el implante del stent guiado por angiografía |
| ILUMIEN III (n = 450) NCT02471586 | 2016 | AMS: expansión aceptable del stent (un área mínima del stent de, al menos, el 90% en ambas mitades proximal y distal del stent en relación al segmento de referencia más cercano) Expansión aceptable del stent: un AMS del segmento proximal ≥ 90% y < 95% del área luminal proximal de referencia y un MSA del segmento distal ≥ 90% y < 95% del área luminal distal de referencia | IVUS, OCT | El objetivo primario de eficacia fue el área mínima del stent post-ICP según la OCT realizada en un laboratorio central independiente y ciego tras completar el reclutamiento en todos los participantes aleatorizados de los que se tenían datos sobre los resultados primarios. El objetivo primario de seguridad fue la incidencia de MACE durante la intervención | El guiado por OCT no fue inferior al guiado por IVUS (intervalo de confianza unilateral del 97,5%: −0,70 mm²; p = 0,001), pero tampoco superior al guiado por IVUS (p = 0,42) ni al guiado angiográfico (p = 0,12). No se observaron diferencias significativas en los resultados MACE |
| OPINION (n = 800) NCT01873222 | 2016 | AML del stent ≥ 90% del área luminal media de referencia; aposición completa de todo el stent sobre la pared vascular; expansión simétrica del stent definida por el diámetro luminal mínimo dividido por el diámetro luminal máximo ≥ 0,7 sin protrusión de la placa, trombo ni disección de los bordes con posibilidad de provocar perturbaciones del flujo | IVUS, OCT | El objetivo primario fue el FVD definido como un compuesto de muerte cardiovascular, IM del vaso diana y revascularización del vaso diana motivada por la isquemia 12 meses después de la ICP | El FVD sobrevino en 21 (5,2%) de los 401 pacientes tratados de ICP guiada por OFDI y en 19 (4,9%) de los 390 pacientes tratados de ICP guiada por IVUS, lo cual vino a demostrar la no inferioridad de la ICP guiada por OFDI con respecto a la ICP guiada por IVUS (hazard ratio, 1,07; límite superior del intervalo de confianza unilateral del 95%: 1,80; valores p para no inferioridad = 0,042) |
| ULTIMATE (n = 1.448) NCT02215915 | 2021 | a) AML del stent > 5,0 mm o el 90% del AML en los segmentos distales de referencia; b) carga de placa a 5 mm de los bordes proximal o distal del stent < 50%; y c) ninguna disección de los bordes compromete la túnica media y una longitud > 3 mm. | IVUS | El objetivo primario fue el riesgo de FVD a los 3 años de seguimiento | El implante de SFA guiado por IVUS se asoció a una incidencia mucho menor de FVD y trombosis del stent a los 3 años en pacientes no seleccionados |
|
ALM: área luminal mínima; AMS: área mínima del stent; DLM: diámetro luminal mínimo; FVD: fracaso del vaso diana; IC95%, intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecografía intravascular; MACE: eventos adversos cardiovasculares mayores; ND: no disponible; NS: no significativo; OCT, tomografía de coherencia óptica; OFDI: imágenes de dominio de frecuencia óptica; OTC, oclusión coronaria total crónica; RLD: revascularización de la lesión diana; SFA: stent farmacoactivo. |
|||||
Actualmente existen nuevos estudios que buscan determinar el efecto en el resultado clínico a más largo plazo del intervencionismo guiado por imagen y el valor de estas modalidades en el tratamiento de subgrupos específicos de lesiones tales como la reestenosis del stent, las lesiones calcificadas y las lesiones largas. La tabla 2 recoge los estudios en marcha de ICP guiada por imagen intravascular.
Tabla 2. Estudios en curso sobre ICP guiadas por imagen intravascular
| Estudio, NCT | Técnica de imagen | Diseño del estudio | Objetivo del estudio | Criterios de las técnicas de imagen | Objetivos clínicos |
|---|---|---|---|---|---|
| IMPROVE, NCT04221815 | IVUS frente a angiografía | Estudio prospectivo, multicéntrico, internacional, investigación clínica de simple ciego. Nº aproximado de sujetos: entre 2.500 y 3.100 sujetos aleatorizados Periodo de seguimiento: 2 años | Demostrar la superioridad de una estrategia de implante del stent guiada por IVUS frente a una estrategia guiada por angiografía para lograr mayores dimensiones luminales post-ICP y mejorar los resultados cardiovasculares clínicos de pacientes con lesiones angiográficas complejas | Se considera que se ha logrado implantar el stent de forma óptima cuando se cumplen los siguientes 3 criterios en la IVUS final: AMS > 90% del área luminal distal de referencia. Ninguna disección de los bordes comprometiendo la capa media con un arco > 60º y una longitud > 3mm. Ausencia de pérdida geográfica definida como una carga de placa > 50% a 5 mm de los bordes proximal o distal del stent o ambos | Fracaso del vaso diana a los 12 meses definido como un compuesto de muerte cardiovascular, IM del vaso diana o revascularización del vaso diana por motivos clínicos |
| IVUS-CHIP, NCT04854070 | IVUS frente a angiografía | Estudio aleatorizado, controlado, multicéntrico, internacional, poscomercialización y basado en eventos. Alrededor de 2.020 pacientes serán aleatorizados en proporción 1:1 al grupo de ICP guiada por IVUS y al de ICP guiada por angiografía | Demostrar la superioridad del guiado por IVUS frente al guiado por angiografía respecto al fracaso del vaso diana | AMS final > 5 mm2 o AMS < 90% de la luz distal de referencia. Carga de placa > 50% a 5 mm de los bordes proximal o distal del stent. Ninguna disección de los bordes comprometiendo la capa media y una longitud > 3 mm | Fracaso del vaso diana definido como un compuesto de muerte cardiovascular, IM del vaso diana o revascularización del vaso diana por motivos clínicos |
| OPTIMAL, NCT04111770 | IVUS frente a angiografía | Estudio internacional, multicéntrico, controlado y aleatorizado | Demostrar la superioridad del implante de stent guiado por IVUS frente al guiado angiográfico en pacientes con enfermedad del TCI y, también, en la mejora de los resultados clínicos | AMS > 5 (CXI), > 6 (DA), > 7 (punto de bifurcación), > 8 (TCI). Mala aposición < 0,4 mm. Ausencia de disección de los bordes definida como ≥ 60° y una longitud ≥ 2 mm. Carga de placa en los bordes del stent < 50% | Objetivo combinado orientado al paciente (POCE): un compuesto de mortalidad por cualquier causa, cualquier accidente cerebrovascular, cualquier IM y cualquier revascularización por motivos clínicos tras 2 años de seguimiento |
| ILUMIEN IV, NCT03507777 | OCT frente a angiografía | Estudio clínico prospectivo, multicéntrico, aleatorizado y controlado. Nº de sujetos: entre 2.490 y 3.656 Periodo de seguimiento: 2 años. Duración estimada del estudio: aproximadamente 2 años | Demostrar la superioridad del implante de stent guiado por OCT frente al guiado angiográfico estándar en los resultados clínicos de los pacientes | Una expansión aceptable del stent (una AMS de, al menos, el 90% en los segmentos proximal y distal del stent con relación al segmento de referencia más próximo). Ambos segmentos de referencia, proximal y distal, tienen un área luminal mínima ≥ 4,5 mm2. Ausencia de una disección mayor de los bordes definida como ≥ 60° de la circunferencia del vaso en el punto de disección y una longitud ≥ 3 mm | Fracaso del vaso diana, un compuesto de muerte cardiovascular, IM del vaso diana o revascularización del vaso diana motivada por la isquemia |
| DKCRUSH VIII NCT0377065 | Ivus frente a angiografía | Estudio randomizado, controlado, multicéntrico. Muestra: 556 pacientes Aleatorización 1:1 | Evaluar la superioridad de la estrategia de DKCrush en bifurcaciones complejas guiado por IVUS frente a guiado por angiografía | Para TCI: AMS de al menos 10 mm2 (TCI), 7 mm2 (DA), 6 mm2 (Cx) Expansión del stent al menos 90% respecto al área luminal de referencia distal en Cx Índice de simetría > 0,8 Para no-TCI AMS de al menos 6 mm2 en el vaso principal y 5 mm2 en ostium de rama secundaria Expansión del stent al menos 90% del área luminal de la referencia distal Índice de simetría > 0,8 | El objetivo primario es el fracaso de vaso diana a 12 meses: muerte cardiaca, infarto de miocardio atribuído a vaso diana, revascularización de vaso diana guiado por clínica |
| OCTOBER, NCT03171311 | OCT frente a angiografía | Estudio aleatorizado, multicéntrico e iniciado por investigadores. El tamaño calculado de la muestra es de 1.200 pacientes aleatorizados en proporción 1:1 | Demostrar la superioridad del implante de stent guiado por OCT frente al guiado angiográfico estándar en lesiones en bifurcación | Expansión adecuada de stent y vaso (> 90%). Aposición completa del stent. Cobertura óptima de la lesión | El objetivo primario es un compuesto de muerte cardiovascular, infarto de miocardio de la lesión diana y revascularización de la lesión diana motivada por isquemia a los 2 años |
| OCTIVUS NCT03394079 | OCT frente a IVUS | Estudio multicéntrico, aleatorizado y controlado. Todos los pacientes que vayan a ser sometidos a ICP son elegibles Tamaño de la muestra: 2.000 pacientes Aleatorización 1:1 | Comparar la seguridad y eficacia clínia de la estrategia guiada por OCT frente a la guiada por IVUS | Criterios de optimización por IVUS u OCT: Expansión del stent > 80% de la media del área luminal de referencia Ausencia de disecciones mayores (> 60º, > 2 mm de longitud, flap que se extiende a media o adventicia) Ausencia de malaposición Bordes del stent en segmentos con carga de placa < 50% y sin placa rica en lípidos Tamaño del stent basado en referencia luminal distal (0,25 mm redondeado al alza) o basado en referencia membrana elástica externa a membrana elástica externa (0,25 mm redondeado a la baja) | El objetivo primario es el fracaso de vaso diana: muerte cardiaca, infarto de miocardio atribuído a vaso diana o revascularización guiada por isquemia del vaso diana a 1 año |
|
AMS: área mínima del stent; CXI, circunfleja izquierda; DA: descendente anterior; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecografía intravascular; OCT, tomografía de coherencia óptica; TCI: tronco coronario izquierdo. |
|||||
ENSAYOS CLÍNICOS EN CURSO SOBRE INTERVENCIONISMO GUIADO POR ECOGRAFÍA INTRAVASCULAR
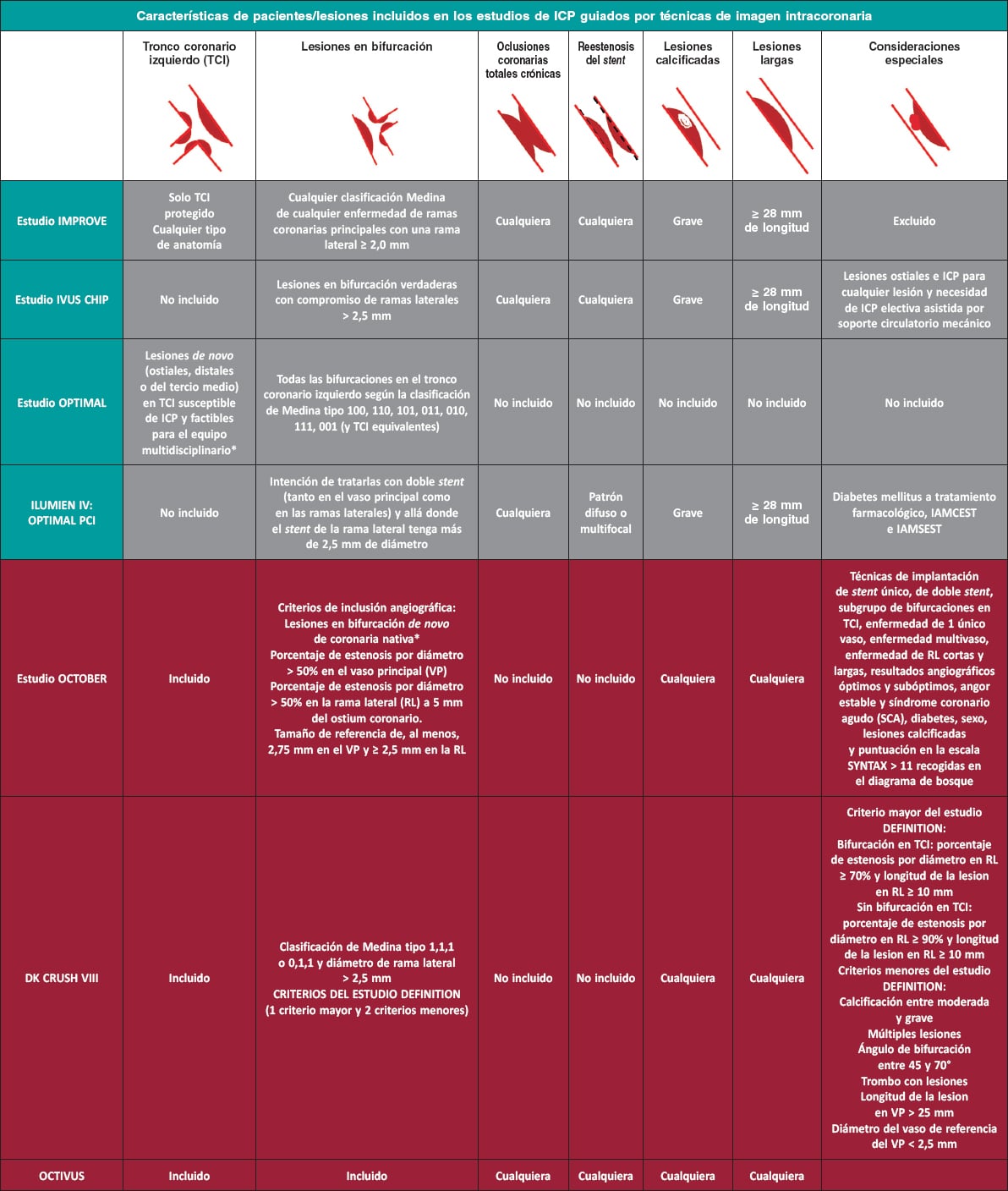
El IMPROVE (Impact on revascularization outcomes of IVUS-guided treatment of complex lesions and economic impact, NCT04221815)17 es un estudio multicéntrico, prospectivo y simple ciego que incluirá a 3.100 pacientes. Su objetivo es demostrar la superioridad del implante de stent guiado por IVUS sobre el guiado por angiografía en lesiones complejas (incluidas oclusiones crónicas, lesiones calcificadas, lesiones largas, bifurcaciones y reestenosis del stent) basándose en el área mínima intrastent post-ICP y fracaso del vaso diana definido como un objetivo compuesto de muerte cardiovascular, infarto de miocardio del vaso diana y revascularización del vaso diana motivada por la isquemia a los 12 meses de seguimiento. (tabla 2 y figura 1).
Figura 1. Principales características de pacientes y lesiones incluidos en estudios actualmente en curso sobre intervencionismo guiado por imagen intracoronaria. * Criterios de inclusión funcional: significación funcional de la lesión del vaso principal o isquemia documentada del territorio del vaso principal u otra documentación objetiva de la significación de la lesión. Se requiere evidencia objetiva de isquemia para todas las lesiones diana excepto para aquellas con un porcentaje de estenosis por diámetro > 80% que se consideraría significativo. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; RL: rama lateral.
El IVUS-CHIP (Intravascular ultrasound guidance for complex high-risk indicated procedures, NCT04854070) es un estudio internacional, aleatorizado, controlado, multicéntrico, de poscomercialización y basado en eventos. Aleatoriza, en proporción 1:1, a 2.020 participantes con lesiones coronarias complejas (calcificaciones angiográficas graves, lesiones ostiales, lesiones coronarias con bifurcaciones verdaderas, lesiones en tronco coronario izquierdo, oclusiones crónicas, reestenosis del stent, lesiones largas) o que precisen una ICP electiva asistida por soporte circulatorio mecánico a recibir una ICP guiada por IVUS o por angiografía. El objetivo del estudio es demostrar la superioridad de la estrategia de ICP guiada por IVUS en lo que al objetivo primario se refiere, que es el fracaso del vaso diana definido como un compuesto de muerte cardiovascular, infarto de miocardio por afectación del vaso diana o revascularización del vaso diana por motivos clínicos (tabla 2 y figura 1).
El OPTIMAL (Optimization of left main PCI with intravascular ultrasound, NCT04111770) es un estudio internacional, aleatorizado, controlado y multicéntrico. Aleatorizará, en proporción 1:1, a 800 pacientes para recibir una ICP guiada por IVUS o por angiografía. Este estudio incluirá a pacientes con lesiones de novo (ostiales, distales o del tercio medio) del tronco coronario izquierdo aptos para recibir una ICP según el equipo multidisciplinar, así como lesiones de todas las bifurcaciones en el tronco coronario izquierdo según la clasificación de Medina tipo 100, 110, 101, 011, 010, 111, 001 (y TCI equivalentes). Por último, incluirá a pacientes con cirugías de revascularización coronaria previas que no tengan puentes coronarios permeables hacia la coronaria izquierda. El objetivo primario del estudio es un objetivo compuesto orientado al paciente: un compuesto de mortalidad por cualquier causa, cualquier accidente cerebrovascular, cualquier infarto de miocardio y cualquier revascularización por motivos clínicos tras 2 años de seguimiento (tabla 2 y figura 1).
El DK CRUSH VIII (NCT03770650) es un ensaya clínico controlado, multicéntrico y aleatorizado cuyo objetivo es valorar la superioridad de la revascularización mediante técnica de DK crush guiada por IVUS respecto a la guiada por angiografía. Incluirá a 556 pacientes con lesiones en bifurcaciones complejas basadas en los criterios DEFINITION. El objetivo primario incluye la muerte cardiaca, el fallo del vaso diana, el infarto de miocardio atribuido a vaso diana o la revascularización del vaso diana a 12 meses (tabla 2 y figura 1).
ENSAYOS CLÍNICOS EN CURSO SOBRE INTERVENCIONISMO GUIADO POR TOMOGRAFÍA DE COHERENCIA ÓPTICA
En el pasado, el ILUMIEN III (NCT02471586), que estudió la no inferioridad de la OCT frente a la IVUS (área mínima del stent; intervalo de confianza unilateral del 97,5% más bajo: –0,70 mm²; p = 0,001), demostró la superioridad de la estrategia de implante de stent guiado por OCT sobre el guiado angiográfico, ya que lograba mayores dimensiones luminales post-ICP y mejoraba los resultados cardiovasculares de pacientes con características clínicas de riesgo alto o lesiones angiográficas de alto riesgo. El estudio ILUMIEN IV (NCT03507777), que ha completado ya la fase de reclutamiento de pacientes (unos 3.600 programados inicialmente), pretende demostrar la superioridad de una estrategia de implante de stent guiado por OCT sobre el guiado angiográfico logrando mayores dimensiones luminales post-ICP y mejorando los resultados cardiovasculares clínicos de pacientes con características clínicas de alto riesgo como diabetes o lesiones angiográficas de alto riesgo. Se espera que los resultados de ambos estudios y sus similares objetivos arrojen luz sobre el papel de la OCT en el guiado de la ICP sobre lesiones coronarias complejas (tabla 2 y figura 1).
Otro estudio en el que se valora el papel de la OCT es el ensayo europeo multicéntrico, aleatorizado e iniciado por investigadores OCTOBER (European trial on optical coherence tomography optimized bifurcation event reduction; NCY3171311), cuyo objetivo es demostrar la superioridad del implante de stent guiado por OCT frente al guiado por angiografía estándar en lesiones en bifurcación. La aleatorización se encuentra estratificada como: a) enfermedad de tronco coronario izquierdo o no y b) técnica inicial de implantación de stent único seguido de inflado final con la técnica de kissing balloon o de doble stent18.
Se ha programado una comparativa directa entre OCT e IVUS en el OCTIVUS (NCT03394079), un estudio multicéntrico y controlado de una población de pacientes no seleccionados que serán aleatorizados a recibir una ICP guiada por OCT o por IVUS20. El objetivo primario es un compuesto de muerte, infarto de miocardio del vaso diana y revascularización del vaso diana motivada por la isquemia al cabo de 1 año (tabla 2 y figura 1).
CONCLUSIONES
No cabe duda de que la imagen intravascular tiene un papel esencial a la hora de optimizar el implante de stent. No obstante, todavía se desconoce la magnitud de este beneficio en poblaciones com- plejas. Según la evidencia arrojada por estudios ya publicados favorables a la ICP guiada por imagen intravascular, se espera que los ensayos clínicos aleatorizados y todavía en curso que presentamos confirmen un descenso de los eventos cardiovasculares adversos mayores y, en última instancia, avalen el uso de la imagen intracoronaria en esta población. Incluso se podría predecir un aumento importante en el uso de IVUS/OCT basándose en los resultados positivos obtenidos y al acceso a mayores reembolsos con la esperanza de que se produzcan cambios en las recomendaciones de las guías clínicas de las distintas sociedades científicas.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
H. M. Garcia-Garcia es el responsable del diseño del estudio y de la redacción del manuscrito. E. Fernández-Peregrina, K.O. Kuku y R. Diletti también redactaron el manuscrito y realizaron la revisión crítica del mismo.
CONFLICTO DE INTERESES
H. M. Garcia-Garcia y K. O. Kuku declaran que sus respectivos centros recibieron becas de investigación de Biotronik, Boston Scientific, Medtronic, Abbott Vascular, Neovasc, Shockwave, Phillips y Corflow. R. Diletti declara haber recibido becas de investigación para su centro de Biotronik y Boston Scientific. E. Fernández-Peregrina declara haber recibido una beca de investigación de la Sociedad Española de Cardiología.
BIBLIOGRAFÍA
1. de Jaegere P, Mudra H, Figulla H, et al. Intravascular ultrasound-guided optimized stent deployment. Immediate and 6 months clinical and angiographic results from the Multicenter Ultrasound Stenting in Coronaries Study (MUSIC Study). Eur Heart J. 1998;19:1214-1223.
2. Chieffo A, Latib A, Caussin C, et al. A prospective, randomized trial of intravascular-ultrasound guided compared to angiography guided stent implantation in complex coronary lesions:the AVIO trial. Am Heart J. 2013;165):65-72.
3. Tian N-L, Gami S-K, Ye F, et al. Angiographic and clinical comparisons of intravascular ultrasound- versus angiography-guided drug-eluting stent implantation for patients with chronic total occlusion lesions:two-year results from a randomised AIR-CTO study. EuroIntervention. 2015;10:1409-1417.
4. Kim B-K, Shin D-H, Hong M-K, et al. Clinical Impact of Intravascular Ultrasound-Guided Chronic Total Occlusion Intervention With Zotarolimus-Eluting Versus Biolimus-Eluting Stent Implantation:Randomized Study. Circ Cardiovasc Interv. 2015;8:e002592.
5. Hong S-J, Kim B-K, Shin D-H, et al. Effect of Intravascular Ultrasound-Guided vs Angiography-Guided Everolimus-Eluting Stent Implantation:The IVUS-XPL Randomized Clinical Trial. JAMA. 2015;314:2155-2163.
6. Park S-J, Kim Y-H, Park D-W, et al. Impact of Intravascular Ultrasound Guidance on Long-Term Mortality in Stenting for Unprotected Left Main Coronary Artery Stenosis. Circ Cardiovasc Interv. 2009;2:167-177.
7. Jakabcin J, Spacek R, Bystron M, et al. Long-term health outcome and mortality evaluation after invasive coronary treatment using drug eluting stents with or without the IVUS guidance. Randomized control trial. HOME DES IVUS. Catheter Cardiovasc Interv. 2010;75:578-583.
8. Kim J-S, Kang T-S, Mintz GS, et al. Randomized comparison of clinical outcomes between intravascular ultrasound and angiography-guided drug-eluting stent implantation for long coronary artery stenoses. JACC Cardiovasc Interv. 2013;6:369-376.
9. Sheth TN, Kajander OA, Lavi S, et al. Optical Coherence Tomography-Guided Percutaneous Coronary Intervention in ST-Segment-Elevation Myocardial Infarction:A Prospective Propensity-Matched Cohort of the Thrombectomy Versus Percutaneous Coronary Intervention Alone Trial. Circ Cardiovasc Interv. 2016;9:e003414.
10. Kim I-C, Yoon H-J, Shin E-S, et al. Usefulness of Frequency Domain Optical Coherence Tomography Compared with Intravascular Ultrasound as a Guidance for Percutaneous Coronary Intervention. J Interv Cardiol. 2016;29:216-224.
11. Steinvil A, Zhang Y-J, Lee SY, et al. Intravascular ultrasound-guided drug-eluting stent implantation:An updated meta-analysis of randomized control trials and observational studies. Int J Cardiol. 2016;216:133-139.
12. Shin D-H, Hong S-J, Mintz GS, et al. Effects of Intravascular Ultrasound-Guided Versus Angiography-Guided New-Generation Drug-Eluting Stent Implantation:Meta-Analysis With Individual Patient-Level Data From 2,345 Randomized Patients. JACC Cardiovasc Interv. 2016;9:2232-2239.
13. Levine GN, Bates ER, Blankenship JC, et al. 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. J Am Coll Cardiol. 2011;58:e44-122.
14. Kolh P, Windecker S, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization:the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur J Cardiothorac Surg. 2014;46:517-592.
15. Bavishi C, Sardar P, Chatterjee S, et al. Intravascular ultrasound-guided vs angiography-guided drug-eluting stent implantation in complex coronary lesions:Meta-analysis of randomized trials. Am Heart J. 2017;185:26-34.
16. Ali Z, Landmesser U, Karimi Galougahi K, et al. Optical coherence tomography-guided coronary stent implantation compared to angiography:a multicentre randomised trial in PCI - design and rationale of ILUMIEN IV:OPTIMAL PCI. EuroIntervention. 2021;16:1092-1099.
17. Shlofmitz E, Torguson R, Mintz GS, et al. The IMPact on Revascularization Outcomes of intraVascular ultrasound-guided treatment of complex lesions and Economic impact (IMPROVE) trial:Study design and rationale. Am Heart J. 2020;228:65-71.
18. Holm NR, Andreasen LN, Walsh S, et al. Rational and design of the European randomized Optical Coherence Tomography Optimized Bifurcation Event Reduction Trial (OCTOBER). Am Heart J. 2018;205:97-109.
19. Ge Z, Kan J, Gao XF et al. Comparison of intravascular ultrasound-guided with angiography-guided double kissing crush stenting for patients with complex coronary bifurcation lesions:Rationale and design of a prospective, randomized, and multicenter DK CRUSH VIII Trial. Am Heart J. 2021;234:101-110.
20. Kang DY, Ahn JM, Park H et al. Comparison of optical coherence tomography-guided percutaneous coronary intervention:Rationale and design of a randomized, controlled OCTIVUS trial. Am Heart J. 2020;228:72-80.