RESUMEN
El calcio coronario aumenta la complejidad del intervencionismo coronario percutáneo. La calcificación grave dificulta la preparación de la lesión, impide la adecuada expansión y la aposición del stent, y aumenta el riesgo de trombosis y de reestenosis. Las técnicas de modificación de placa se pueden dividir en 2 tipos según el tipo de dispositivo: sin balón y con balón. La aterectomía rotacional ha sido la técnica por excelencia para el tratamiento de lesiones gravemente calcificadas. Actualmente existen nuevos dispositivos que facilitan la preparación de la lesión, como el novedoso balón de litoplastia, que utiliza pulsos de alta energía mecánica para fragmentar el calcio coronario. La litoplastia coronaria es una técnica sencilla, con una curva de aprendizaje corta, que parece tener efecto sobre el calcio profundo y aumentar la distensibilidad luminal, lo que podría suponer un gran cambio en el enfoque del tratamiento de las lesiones calcificadas. Cabe destacar la relevancia de la imagen intravascular al seleccionar el dispositivo de modificación de placa más adecuado, así como para evaluar el resultado final del stent. Esta revisión proporciona una visión general sobre las técnicas disponibles y la evidencia de los dispositivos aprobados para el tratamiento de las lesiones calcificadas.
Palabras clave: Aterectomía rotacional. Aterectomía orbital. Láser de excímeros. Litoplastia coronaria.
ABSTRACT
Severe coronary calcium increases the complexity of percutaneous coronary interventions. It may affect the adequate preparation of the lesion, proper stent expansion and apposition and increase the risk of stent thrombosis and restenosis. The techniques available for the management of severe calcified lesions can be divided into 2 groups: non-balloon and balloon-based technologies. Rotational atherectomy has been the predominant technique to treat severe calcified lesions. As a matter of fact, there are new devices available that facilitate the modification of the plaque such as the new lithoplasty balloon that involves the use of highenergy mechanical pulses to crack coronary calcium. Coronary lithoplasty is an easy technique with a short learning curve that seems to be more effective on deep calcium by increasing luminal compliance. This may revolutionize the standard approach for the management of severe calcified coronary lesions. Also, the role of intravascular imaging is essential to select the most appropriate plaque-modification device and assess the optimal stent result. This review provides an overview of the techniques available and evidence on the currently approved devices to treat calcified lesions.
Keywords: Rotational atherectomy. Orbital atherectomy. Excimer laser. Coronary lithoplasty.
Abreviatruras ACLE: aterectomía coronaria con láser de excímeros. AO: aterectomía orbital. AR: aterectomía rotacional. ICP: intervención coronaria percutánea. IVUS: ecografía intravascular. LC: litoplastia coronaria. LCGC: lesión coronaria gravemente calcificada. OCT: tomografía de coherencia óptica.
INTRODUCCIÓN
Las lesiones coronarias gravemente calcificadas (LCGC) suponen un gran desafío para el éxito de las intervenciones coronarias percutáneas (ICP)1. La edad avanzada, la diabetes mellitus, la enfermedad renal crónica y el tabaquismo se asocian con un incremento de la calcificación coronaria2. El calcio coronario se puede infraestimar mediante fluoroscopia y coronariografía, y es necesario utilizar técnicas de imagen intravascular, como la ecografía intravascular (IVUS) y la tomografía de coherencia óptica (OCT), que permiten la evaluación de la gravedad y la caracterización de la placa con precisión3.
La calcificación coronaria grave aumenta la complejidad de la ICP4. Puede perjudicar el cruce de la lesión, impedir la adecuada expansión y aposición del stent, dañar el polímero liberador del fármaco, aumentar el riesgo de trombosis y de reestenosis del stent, y afectar de forma negativa a los resultados a corto y largo plazo5. El enfoque óptimo para el tratamiento de las LCGC requiere el conocimiento de varios factores: las características de la lesión, la distribución del calcio, las técnicas de imagen intravascular y el mecanismo de acción de cada dispositivo de modificación de placa6.
Actualmente, las técnicas de modificación de placa se pueden dividir en 2 grupos según el tipo de dispositivos: sin balón y con balón6,7. Entre las intervenciones con dispositivos basados en tecnología sin balón cabe señalar la aterectomía rotacional ([AR], Rotablator y ROTAPro; Boston Scientific, Natick, MA, Estados Unidos), la aterectomía orbital ([AO], Diamondback 360; Cardiovascular Systems, Inc., St Paul, MN, Estados Unidos) y la AR con láser de excímeros (CVX-300 Excimer Laser System, Philips, Andover, MA, Estados Unidos)8,9. Entre las intervenciones con dispositivos basados en tecnología con balón se encuentran cutting balloon (WOLVERINE, Boston Scientific, Marlborough, MA, Estados Unidos) y scoring balloon, de los que destacan AngioSculpt (Biotronik, Berlín, Alemania), Scoreflex (OrbusNeich, Hong Kong, China) y NSE Alpha (B. Braun, Melsungen, Alemania); el balón no distensible (NC, por sus siglas en inglés) de muy alta presión OPN (SIS Medical AG, Winterthur, Suiza); y el dispositivo de litoplastia coronaria ([LC], Shockwave Medical, Inc., Fremont, CA, Estados Unidos)8,9.
El uso generalizado de estas técnicas y dispositivos se ve limitado por el riesgo de complicaciones, el grado de dificultad técnica, la experiencia del operador y el consumo de recursos sanitarios que conlleva. La presente revisión se centra en las técnicas disponibles y en la evidencia de los dispositivos aprobados para el tratamiento de las LCGC.
ATERECTOMÍA ROTACIONAL
Definición
La AR es un procedimiento endovascular destinado a la modificación de la placa aterosclerótica mediante el avance de una oliva metálica giratoria recubierta de diamante10,11.
Principios operativos
El dispositivo de AR (Boston Scientific, Marlborough, Massachusetts, Estados Unidos) consiste en una oliva de forma elíptica recubierta de cristales de diamante en su tercio distal, que rota a alta velocidad y realiza un corte diferencial al avanzar hacia delante (figura 1 del material adicional). La AR pulveriza los componentes fibrocalcificados de la placa a la vez que preserva el tejido elástico adyacente, liberando las micropartículas a la circulación coronaria distal7,10.
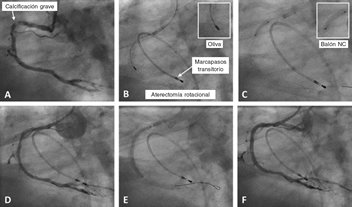
Figura 1. Caso de aterectomía rotacional sobre lesión calcificada en coronaria derecha. A: angiografía basal. B: rotablación de la lesión calcificada con oliva de 1,5 mm. C: predilatación con balón no distensible de 3 × 12 mm. D: resultado angiográfico tras la rotablación. E: implantación de stent farmacoactivo de 3 × 38 mm. F: resultado angiográfico final tras la posdilatación. NC: non-compliant balloon (balón no distensible).
La oliva se encuentra disponible en diferentes tamaños (de 1,25 a 2,5 mm) y está montada sobre un eje de transmisión que se encuentra conectado a una consola que aporta la energía rotacional. Posee 3 conexiones (actualmente van en un solo cable con 3 salidas que se conectan a la consola): un cable tacómetro, una conexión de corriente y una conexión de aire/nitrógeno comprimido. Desde la consola, el aire/nitrógeno comprimido proporciona una presión que permite que el motor gire a las revoluciones seleccionadas. Asimismo, hay una conexión de solución salina fisiológica a la que se suelen añadir heparina y vasodilatadores, permitiendo lubricar la vaina y refrigerar el motor (figura 1 del material adicional). Se recomienda una relación entre el tamaño de la oliva y el vaso de 0,5:0,6. La oliva se avanza sobre una guía específica de 0,009 pulgadas (RotaWire, Boston Scientific, Natrick, MA, Estados Unidos)10,11. Es relevante destacar que la guía RotaWire tiene a lo largo de su longitud diferentes diámetros: el cable es de 0,009 pulgadas y la parte radioopaca es de 0,014 pulgadas. La oliva es compatible con la parte proximal de la guía de 0,009 pulgadas. Se encuentran disponibles 2 versiones de RotaWire (RotaWire Extra Support y RotaWire Floppy), que se utilizarán dependiendo de las características de la placa y del soporte necesario10,11 (figura 1 del material adicional).
Se recomienda una velocidad de rotación entre 135.000 y 180.000 rpm, evitar la desaceleración > 5.000 rpm, realizar un avance gradual de la oliva con movimientos suaves adelante-atrás y tiempos de rotablación no superiores a 20 segundos con pausas entre cada ciclo. Una vez realizada la rotablación, la oliva se retira activando el modo dynaglide. Habitualmente, la desaceleración, salvo que haya un problema técnico, indica una resistencia importante al avance de la oliva debido a la gravedad y la calcificación de la lesión, produciendo un ruido específico. Se recomienda escuchar con atención durante la AR, ya que la desaceleración puede indicar riesgo de atrapamiento de la oliva7,10,11 (tabla 1).
Tabla 1. Características generales de los dispositivos de modificación de placa basados en tecnología sin balón
| Aterectomía rotacional | Aterectomía orbital | Aterectomía coronaria de láser de excímeros | |
|---|---|---|---|
| Principios operativos | |||
| Tipo de dispositivo | Oliva rotadora de alta velocidad | Corona con rotación elíptica de alta velocidad | Catéter láser de luz de alta energía |
| Mecanismo de acción | Corte diferencial anterógrado | Lijado diferencial anterógrado y retrógrado | Fotoablación |
| Curva de aprendizaje | Larga | Larga | Larga |
| Tamaño del dispositivo | Oliva de 1,25-2,5 mm | Corona de 1,25 mm | Catéter de 0,9-2 mm |
| Catéter compatible | 6-8 Fr | 6 Fr | 5-8 Fr |
| Tipo de guía | RotaWire de 0,009/0,0014 in | ViperWire de 0,012/0,014 in | Guía de 0,014 in |
| Equipo de consola | Pequeña sin pedal (ROTAPro) | Pequeña sin pedal | Muy grande con pedal |
| Indicaciones | |||
| Indicación principal | Modificación de placa | Modificación de placa | Lesiones difíciles de cruzar, como oclusión total crónica |
| Localización óptima del calcio | Luminal | Luminal | Luminal |
| Reestenosis del stent | Sí | Sí | Sí |
| Complicaciones | |||
| Disección | Riesgo moderado | Riesgo moderado | Riesgo moderado |
| Perforación | Riesgo moderado | Riesgo moderado | Riesgo moderado |
| Slow-flow/no-reflow | Riesgo moderado | Riesgo moderado | Riesgo moderado |
| Atrapamiento de oliva/corona | Riesgo moderado | Riesgo bajo | N/A |
| Consejos prácticos | |||
| Velocidad | 135.000-180.000 | 80.000-120.000 | N/A |
| Relación entre dispositivo y vaso | 0,5:0,6 | N/A | 0,5:0,6 |
| Recomendaciones | Movimientos de picoteo Ciclos cortos Pausas entre ciclos Evitar con tortuosidad significativa | Desplazamiento continuo y lento de avance y retroceso Ciclos cortos Pausas entre ciclos | Requiere infusión continua de líquido |
|
N/A: no aplica. |
|||
Está disponible una actualización del dispositivo, el ROTAPro, que facilita la manipulación por un solo operador y ofrece una interfaz de usuario mejorada con los controles integrados en el dispositivo de avance. El pedal ha sido reemplazado por un botón ubicado en la parte superior del controlador de avance de la oliva. Hay otro botón en la parte trasera del dispositivo que permite cambiar al modo dynaglide. La consola es más pequeña, tiene una pantalla digital y requiere menos tiempo de configuración (figura 2 del material adicional).
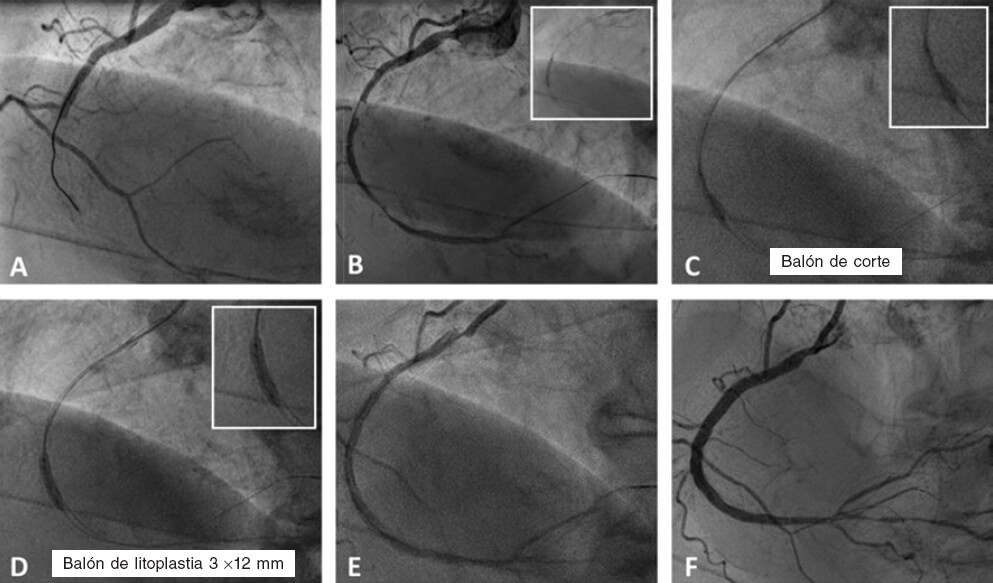
Figura 2. Caso de litoplastia coronaria en paciente con síndrome coronario agudo con elevación del segmento ST inferior. A: angiografía basal. B: resultado tras la predilatación con balón semidistensible de 2 × 15 mm. C: predilatación con balón no distensible de 2,5 × 8 mm y balón de corte de 2,5 × 6 mm sin éxito. D: litotricia coronaria con balón de litoplastia de 3 × 12 mm. E: resultado angiográfico tras la litoplastia coronaria. F: resultado final tras la implantación de dos stents farmacoactivos solapados (2,75 × 33 mm y 3 × 38 mm) y posdilatación con balón no distensible de 3 × 12 mm.
Indicaciones
La principal indicación de la AR es el tratamiento de LCGC no dilatables por métodos convencionales, mediante la modificación de placa, lo que facilita la adecuada expansión y la buena aposición del stent 10,11 (figura 1).
Los siguientes factores influyen de manera significativa en el resultado de la AR: la excentricidad del calcio, el área luminal y el tamaño de la oliva. El escenario óptimo para conseguir una ganancia luminal adecuada es una lesión concéntrica, con una distribución circunferencial del calcio y con un área luminal mínima menor que el tamaño de la oliva7. Otra indicación más controvertida es el tratamiento de la reestenosis del stent por una infraexpansión de este. Las lesiones excéntricas y con tortuosidad significativa son menos favorables para el tratamiento con AR, ya que conllevan un incremento del riesgo de complicaciones9.
La AR se puede plantear como estrategia primaria para la modificación de lesiones calcificadas o como estrategia de rescate tras el intento fallido de una predilatación de la lesión con balón9. Es una técnica segura en ambos casos, aunque la estrategia primaria se asocia con una disminución de los tiempos de procedimiento y fluoroscopia, del volumen de contraste y del número de balones de predilatación utilizados10 (tabla 1).
Datos clínicos
En la actualidad existe controversia en cuanto al uso sistemático de la AR, ya que no se ha demostrado claramente su beneficio clínico12-15. El ensayo ROTAXUS16 incluyó 240 pacientes con calcificación moderada-grave, que se aleatorizaron a AR y stent farmacoactivo o predilatación con balón y stent farmacoactivo. La AR mostró una mayor tasa de éxito del procedimiento y una mayor ganancia luminal inicial (1,56 ± 0,43 frente a 1,44 ± 0,49 mm; p = 0,01), y se observó una mayor pérdida luminal tardía del stent a los 9 meses de seguimiento (0,44 ± 0,58 frente a 0,31 ± 0,52 mm; p = 0,04). No se encontraron diferencias significativas en cuanto a la tasa de reestenosis ni de trombosis del stent, la necesidad de nueva revascularización de la lesión diana ni la tasa de eventos cardiovasculares adversos mayores (MACE, por sus siglas en inglés) a los 9 meses de seguimiento16.
En el estudio PREPARE-CALC17 se incluyeron 200 pacientes con LCGC que fueron aleatorizados 1:1 a tratamiento con cutting/scoring balloon o AR. No se hallaron diferencias significativas en cuanto a las complicaciones entre ambos grupos. No obstante, se observó una mayor tasa de éxito del procedimiento con la AR, con un menor porcentaje de estenosis residual (98 frente a 81%; p = 0,0001). No hubo diferencias significativas entre ambos grupos respecto a la pérdida luminal en el stent ni a los resultados clínicos a los 9 meses de seguimiento17.
En el registro multicéntrico ROTATE18 se incluyeron 1.176 pacientes con LCGC tratadas mediante AR y stent farmacoactivo, y se observó una tasa de MACE del 16% al año de seguimiento. El registro multicéntrico europeo de AR incluyó datos de 963 pacientes, en los que se logró el éxito clínico en el 92%, con una tasa de mortalidad del 12,5% y una tasa de MACE del 17% al año de seguimiento (resultados presentados en el congreso EuroPCR 2019)19.
Complicaciones
Las complicaciones más temidas de la AR son el atrapamiento de la oliva, la perforación y la disección coronaria (tabla 2)10,20.
Tabla 2. Complicaciones de la aterectomía rotacional, estrategia de prevención y tratamiento
| Estrategia de prevención | Tratamiento | |
|---|---|---|
| Slow-flow/no-reflow | Uso de olivas de menor tamaño Evitar velocidades de rotación elevadas Realizar ciclos cortos con pausas entre ellos |
Administración intracoronaria de nitratos, nitroprusiato, adenosina Mantener una perfusión adecuada si hay hipotensión |
| Disección | En relación con lesiones localizadas en segmentos con tortuosidad significativa | Si se observa una disección significativa se recomienda no continuar con la aterectomía Se recomienda el manejo estándar de la disección |
| Perforación | Relacionado con la elección de olivas grandes, la tortuosidad significativa del vaso y la selección de una velocidad de rotación no adecuada | Se recomienda el tratamiento estándar (incluido el uso de stents recubiertos y la pericardiocentesis de urgencia) |
| Atrapamiento de la oliva | Complicación rara; habitualmente se puede evitar con la selección adecuada de los casos y con la realización de una buena técnica | Realizar movimientos controlados de avance y retroceso Posicionar una segunda guía para avanzar un balón con la intención de liberar la oliva Aumentar el soporte mediante la intubación activa o con el uso de un extensor de catéter para aumentar la tracción El tratamiento mediante cirugía cardiaca puede ser necesario |
En cuanto al atrapamiento de la oliva, se diferencian 2 tipos: a) atrapamiento en la lesión (no permite el avance ni el retroceso de la oliva) y b) atrapamiento distal (la oliva no se puede retirar, pero sí avanzar). Diversos factores, como lesiones importantes y olivas muy pequeñas, predisponen a esta complicación. En caso de atrapamiento de la oliva no se recomienda activar la rotablación ni el modo dynaglide 10,11. Para solventarlo, se puede intentar realizar las siguientes maniobras: a) empuje y tracción controlados con una intubación activa del catéter; b) cortar el catéter del dispositivo y avanzar lo máximo posible un extensor de catéter guía con el objetivo de traccionar con mayor fuerza; o c) posicionar un segundo catéter guía a través del cual se avanzan una segunda guía y un balón con la intención de liberar la oliva11. Esta complicación es muy grave y en ocasiones requiere cirugía cardiaca emergente21.
La tortuosidad significativa, así como la falta de coaxialidad adecuada del catéter guía en el tratamiento de lesiones ostiales, pueden facilitar la disección coronaria y aumentar el riesgo de perforación10,11.
El fenómeno de slow-flow/no-reflow (flujo lento o ausencia de flujo) es la complicación relativamente más frecuente, aunque su incidencia ha disminuido hasta un 2,6% con la mejora de la técnica y la mayor experiencia de los operadores7,21. Existe más riesgo de que se produzca este fenómeno en lesiones largas y significativas en las que se realizan múltiples ablaciones, y cuando existe mal vaso distal. Se produce por embolización de residuos a la microvasculatura11. Se puede prevenir realizando ciclos cortos de rotablación, utilizando en primer lugar olivas de pequeño tamaño, haciendo pausas entre los ciclos y controlando angiográficamente el flujo. Una vez establecido el diagnóstico se trata administrando fluidoterapia, vasodilatadores locales a nivel distal y aminas vasoactivas si hay hipotensión, así como atropina en caso de bradicardia10,11.
ATERECTOMÍA ORBITAL
Definición
La AO es un procedimiento endovascular destinado a modificar la placa calcificada mediante una corona recubierta de diamante, cuyo mecanismo de acción consiste en la modificación de la placa tanto anterógrada como retrógrada7.
Principios operativos
El dispositivo estándar de AO es el Diamondback 360 (Cardiovascular Systems, Inc., St. Paul, MN, Estados Unidos), que consta de una corona de tamaño único (1,25 mm) recubierta de diamante que se encuentra conectada a un eje de transmisión y a un controlador alimentado por una consola neumática (figura 3 del material adicional). La corona se avanza sobre una guía específica de 0,012/0,014 pulgadas (ViperWire; Cardiovascular Systems, Inc., St. Paul, MN, Estados Unidos). La fuerza centrífuga generada durante la rotación comprime la corona contra la placa, produciendo su modificación y aumentando la distensibilidad22,23.
El mecanismo de acción de la AO consiste en una rotación elíptica de la corona, que consigue un aumento progresivo del diámetro orbital a medida que se aumenta la velocidad de rotación de 80.000 a 120.000 rpm22. Al incrementar la órbita con la mayor velocidad de rotación permite el lijado diferencial de lesiones calcificadas en vasos de hasta 3,5 mm utilizando la corona de 1,25 mm7. Para conseguir un resultado óptimo, la corona debe desplazarse de manera lenta y gradual a través de la lesión, en general a una velocidad de 1-3 mm/s, lo que permite una mayor ganancia luminal y una disminución de la tasa de complicaciones en comparación con velocidades de desplazamiento más altas7,22.
El efecto de la AO es dependiente del tiempo; se recomiendan ciclos de 30 segundos con pausas de 30 segundos entre ellos22. Es necesaria la infusión continua de una solución lubricante (ViperSlide) para ayudar a minimizar las lesiones térmicas durante la AO; además, se administran aproximadamente 18 ml/min de líquido para ayudar a refrigerar el dispositivo y a eliminar los residuos, disminuyendo así la isquemia y la embolización distal22,24.
Se encuentra disponible el sistema Micro Crown (Cardiovascular Systems, Inc., St. Paul, MN, Estados Unidos), que representa un avance tecnológico destinado a mejorar la eficiencia de la AO. Consta de un eje de transmisión con un nuevo diseño que posibilita un avance más fácil de la corona hasta la lesión. Permite la modificación de la placa con velocidades menores (50.000-70.000 rpm)9,22 (tabla 1).
Indicaciones
La principal indicación de la AO es el tratamiento de las lesiones calcificadas no dilatables por métodos convencionales, con el objetivo de modificar la placa y aumentar la distensibilidad del vaso para permitir una adecuada expansión del stent 22,23. Con el nuevo sistema de AO Micro Crown se pueden tratar lesiones ostiales y suboclusivas9 (tabla 1).
Datos clínicos
El estudio ORBIT I25, que incluyó 50 pacientes, demostró la seguridad y la eficacia de la AO para el tratamiento de las lesiones calcificadas. El éxito del procedimiento se logró en el 94% de los pacientes, y se observó una tasa de MACE del 8% a los 6 meses.
En el estudio ORBIT II26 se incluyeron 443 pacientes. Se logró el éxito del dispositivo en el 98,6%, la tasa de disecciones significativas fue del 2,3% y la tasa de MACE a 30 días fue del 10,4%. Los resultados a los 3 años de seguimiento señalaron una tasa de MACE del 23,5%27.
El estudio COAST28, en el que se utilizó el nuevo sistema Micro Crown, incluyó 100 pacientes y se observó el éxito del procedimiento en el 85%, con una tasa de MACE del 22,2% al año de seguimiento. Se está llevando a cabo el estudio ECLIPSE (NCT03108456), que incluirá 2.000 pacientes con LCGC aleatorizados a AO y stent farmacoactivo o a predilatación con balón y stent farmacoactivo.
Complicaciones
Las complicaciones son similares a las descritas para la AR. No obstante, comparada con la AR, la AO, al realizar un lijado anterógrado y retrógrado, disminuye la probabilidad de atrapamiento de la corona en la lesión. Los residuos que se producen son de menor tamaño y además no impide el flujo coronario durante su aplicación, reduciendo el riesgo de fenómeno de slow-flow/no-reflow, así como la lesión térmica del endotelio coronario7,24. La perforación coronaria es una de las complicaciones más graves de la AO, con una incidencia del 0,7-2%26-28. No se recomienda realizar AO cuando la anatomía coronaria presenta tortuosidad significativa (angulaciones > 90°).
ATERECTOMÍA CORONARIA CON LÁSER DE EXCÍMEROS
Definición
La aterectomía coronaria con láser de excímeros (ACLE) es un procedimiento endovascular destinado al tratamiento de lesiones significativas y calcificadas no dilatables con las técnicas habituales, mediante un mecanismo de acción fotoquímico, fototérmico y fotomecánico que se deriva de la aplicación de luz de alta energía29,30.
Principios operativos
El sistema de ACLE Philips CVX-300 utiliza cloruro de xenón y emite pulsos de luz ultravioleta a longitudes de onda de 308 nm. Los pulsos ultravioleta generados solo penetran 50 µm en profundidad y, por lo tanto, producen la desintegración de la placa calcificada mediante un mecanismo de ablación sin dañar la capa media ni la adventicia (figura 4 del material adicional)31. Hay disponibles 4 tamaños de catéter monorraíl ACLE (0,9, 0,14, 1,7 y 2,0 mm), que se puede avanzar sobre una guía de 0,014 pulgadas. La selección del tamaño adecuado se basa en una relación entre el catéter y el vaso de 0,5:0,67.
El efecto fotomecánico tiene lugar cuando el láser actúa en un medio líquido (solución salina, contraste o sangre), con la consiguiente liberación de burbujas expansivas que actúan sobre la placa aterosclerótica32. Un avance lento del dispositivo favorece el incremento de la ganancia luminal a nivel de la lesión. El número de pulsos, su longitud y el tiempo total de tratamiento con ACLE deben individualizarse según las características de la lesión. Las partículas generadas tienen un diámetro inferior a 10 µm, por lo que son reabsorbidas por el sistema reticuloendotelial y se evita la obstrucción microvascular31 (tabla 1).
Indicaciones
El uso clínico del ACLE es limitado. Su principal indicación es el tratamiento de las lesiones no dilatables por métodos convencionales. Rara vez se utiliza como estrategia de primera línea para el tratamiento de las LCGC, pero es la única opción cuando la lesión no puede cruzarse con un microcatéter o directamente con las guías RotaWire/ViperWire, como ocurre en las oclusiones crónicas33,34.
Otras indicaciones más controvertidas son el tratamiento de la reestenosis del stent no dilatable por métodos habituales cuando se debe a una infraexpansión de este35, las lesiones ostiales, las oclusiones de injertos de vena safena36 y las lesiones con contenido trombótico37-39. Se recomienda evitar realizar esta técnica en lesiones de tronco común no protegido, ante la presencia de tortuosidad significativa y cuando la lesión es bifurcada (tabla 1).
Datos clínicos
Los datos disponibles en la literatura procedentes de estudios aleatorizados (predilatación con balón frente a ACLE) son antiguos y no mostraron diferencias significativas en cuanto a sus resultados29,30,40.
En el infarto agudo de miocardio, los resultados del estudio multicéntrico CARMEL39, que incluyó 151 pacientes con lesiones trombóticas, mostraron el éxito del dispositivo en el 95% de los casos. El registro multicéntrico CORAL36 incluyó 98 pacientes con estenosis significativa del injerto de vena safena y observó una tasa de MACE del 18,4% a los 30 días.
Un estudio en el que se incluyeron 81 lesiones con reestenosis del stent por infraexpansión ha señalado la superioridad de la ACLE sobre la predilatación con balón de alta presión, observando mediante OCT la fractura del calcio por detrás de los struts producido por la ACLE35.
Complicaciones
Las potenciales complicaciones de la ACLE son similares a las descritas para la AR y la AO. Las principales son la disección coronaria, con una incidencia del 7%, y la perforación coronaria, con una incidencia del 0,5-8%29,30,33. No obstante, las mejoras en el diseño, el uso de una técnica con infusión continua de solución salina y el empleo de catéteres de menor calibre han permitido reducir la tasa de complicaciones33,34.
LITOPLASTIA CORONARIA
Definición
La LC es una técnica innovadora que emplea pulsos de alta energía mecánica, administrados por un balón semicompatible, que modifican la placa mediante fragmentación del calcio coronario41,42.
Principios operativos
El dispositivo disponible es el Coronary Rx Lithoplasty System (Shockwave Medical, Inc., Fremont, CA, Estados Unidos). El balón de litoplastia (BL) es un balón de angioplastia de un solo uso, con una longitud de 12 mm y diámetros disponibles de 2,5 a 4 mm, que se avanza sobre una guía de 0,014 pulgadas42,43. Emite pulsos de presión acústica circunferencial, lo que permite el tratamiento de lesiones calcificadas concéntricas (figura 5 del material adicional).
El BL se infla a nivel de la lesión calcificada a una presión de 4 atm y se administran ondas de choque a una frecuencia de 1 Hz43,44. La energía mecánica se transmite a la lesión cuando el BL entra en contacto con la capa íntima arterial, lo que permite la fractura del calcio en las capas tanto superficiales como profundas de la pared del vaso7, y con ello se facilitan la adecuada expansión y una buena aposición del stent 7,42,43.
Una vez situado el BL en la lesión, se conecta a una unidad externa que genera ondas mecánicas pulsátiles (figura 5 del material adicional). Se recomienda que la relación entre el tamaño del BL y el vaso sea 1:141,42. El BL se infla inicialmente a una presión de 4 atm y se administran 10 pulsos (requieren unos 10 segundos). A continuación, el BL se infla a una presión de 6 atm y después se desinfla para restaurar el flujo. Se continúan así nuevos ciclos; se puede llegar hasta un total de 8 terapias (80 pulsos) por balón y por lesión42,43. Debido al tamaño del BL, si la longitud de la lesión supera los 12 mm, el BL puede ser reposicionado para tratar la lesión en su totalidad. El uso del BL es sencillo, con una curva de aprendizaje corta, y simplifica la ICP7,42 (tabla 3).
Indicaciones
La principal indicación de la LC son las lesiones calcificadas concéntricas con una distribución circunferencial del calcio41,42. Parece tener más efecto sobre el calcio más profundo que otras técnicas de modificación de la placa45-47. La LC es efectiva en vasos de gran calibre, pues existen balones de litoplastia de hasta 4 mm de diámetro. Este dispositivo se puede utilizar en lesiones bifurcadas, ya que permite situar 2 guías durante el procedimiento para proteger la rama lateral. Asimismo, el BL parece seguro y efectivo ante la presencia de tortuosidad significativa, reestenosis del stent debida a infraexpansión48,49 y lesión calcificada en el tronco común con disfunción ventricular izquierda grave50,51 (tabla 3). Otra indicación más discutible puede ser el tratamiento de LCGC en el contexto de un infarto agudo de miocardio con elevación del ST52 (figura 2).
Tabla 3. Características generales de los dispositivos de modificación de placa basados en tecnología con balón
| Litoplastia coronaria | Cutting/scoring balloon | Balón de muy alta presión | |
|---|---|---|---|
| Principios operativos | |||
| Tecnología | Balón semidistensible que emite pulsos de alta energía mecánica | Balón NC con microcuchillas/balón semidistensible con filamentos en espiral | Balón NC de doble capa |
| Mecanismo de acción | Litotricia/fragmentación de calcio | Corte de la superficie luminal de la placa | Permite el inflado a 35-40 atm |
| Curva de aprendizaje | Corta | Corta | Corta |
| Tamaño del dispositivo | 2,5-4 mm | 2,75-3,5 mm/2,0-3,5 mm | 1,5-4,5 mm |
| Catéter compatible | 6 Fr | 6 Fr | 6 Fr |
| Indicaciones | |||
| Indicación principal | Preparación de lesiones calcificadas | Reestenosis del stent | Optimización del stent |
| Localización óptima del calcio | Luminal con distribución circunferencial | Luminal | Luminal |
| Reestenosis del stent | Sí | Sí | Sí |
| Complicaciones | |||
| Dificultad de cruce | Sí, mejorado con el BL de nueva generación | Sí/no | Sí |
| Disección | Riesgo bajo | Riesgo moderado | Riesgo moderado |
| Perforación | Riesgo bajo | Riesgo bajo | Riesgo bajo |
| Slow-flow/no-reflow | Riesgo bajo | Riesgo bajo | Riesgo bajo |
| Consejos prácticos | |||
| Pulsos administrados | Hasta 80 pulsos (8 ciclos) | N/A | N/A |
| Relación entre dispositivo y vaso | 1:1 | 0,8:1 | 1:1 |
| Recomendaciones | Inflado a 4 atm, 10 pulsos; después se sube a 6 atm y se desinfla Útil con tortuosidad Útil en bifurcaciones | Inflado lento y gradual | Inflado lento y gradual Permite posdilatar el stent a altas atm |
|
BL: balón de litoplastia; N/A: no aplica. NC: non-compliant balloon (balón no distensible). |
|||
Datos clínicos
El ensayo DISRUPT CAD I fue un estudio previo a la comercialización, que demostró la seguridad y la efectividad de la LC en LCGC previamente a la implantación del stent; la tasa de MACE fue del 8% a los 6 meses45. El estudio DISRUPT CAD II, con 120 pacientes, demostró la seguridad de la LC antes de la implantación del stent, con una tasa de MACE a los 30 días del 7,6%46. No obstante, se precisan estudios más grandes y con periodos de seguimiento más largos para confirmar estos resultados. El DISRUPT CAD III (NCT03595176) es un estudio multicéntrico, con una inclusión estimada de 392 pacientes, que evaluará la seguridad y la efectividad del BL con el fin de obtener la aprobación de la Food and Drug Administration para el uso del dispositivo en los Estados Unidos (tabla 4).
Tabla 4. Características y resultados de los principales estudios sobre diferentes técnicas de modificación de placa
| Estudio y año | N.º pacientes y grupos de tratamiento | Características de la lesión | Resultados del estudio | |
|---|---|---|---|---|
| Aterectomía rotacional | ||||
| ROTAXUS16 (2014) | 240 pacientes AR + stent frente a ICP estándar |
Lesión con calcificación moderada-grave | Pérdida luminal en el stent a los 9 meses Tasa de MACE a los 9 meses |
0,44 frente a 0,31 mm; p = 0,04 24,2 frente a 28,3%, p = 0,46 |
| PREPARE-CALC17 (2018) | 200 pacientes Cutting/scoring balloon frente a AR |
Lesión gravemente calcificada | Pérdida luminal a los 9 meses Revascularización de la lesión diana |
0,16 ± 0,39 frente a 0,22 ± 0,40 mm; p = 0,21 7% frente a 2%; p = 0,17 |
| ROTATE18 (2016) | 1.176 pacientes AR + stent farmacoactivo |
Lesión gravemente calcificada | Tasa de MACE a 1 año Tasa de MACE a 2 años |
16% 24,9% |
| Registro Europeo de AR19 (2019) | 963 pacientes | Lesión gravemente calcificada | Éxito clínico Tasa de MACE a 1 año |
92% 17% |
| Aterectomía orbital | ||||
| ORBIT I25 (2013) | 50 pacientes | Lesión calcificada | Éxito del procedimiento Tasa de MACE a 6 meses |
94% 8% |
| ORBIT II26,27 (2014) | 443 pacientes | Lesión gravemente calcificada | Éxito del procedimiento ZTasa de MACE a 1 y 3 años |
98,6% 16,4 y 23,5% |
| COAST28 (2017) | 100 pacientes Micro Crown AO |
Lesión gravemente calcificada | Éxito del procedimiento Tasa de MACE a 1 año |
85% 22,2% |
| Aterectomía coronaria con láser de excímeros | ||||
| AMRO29 (1996) | 308 pacientes (157/151) ICP estándar/láser |
Lesión gravemente calcificada/reestenosis del stent | Ganancia luminal a 6 meses Tasa de MACE a 6 meses |
0,48 frente a 0,44 mm, p = 0,34 29,9 frente a 33,1%, p = 0,55 |
| LAVA30 (1997) | 215 pacientes (98/117) ICP estándar/láser |
Lesión gravemente calcificada/reestenosis del stent | Éxito del procedimiento Al año de seguimiento |
96,9 frente a 96,6%, p = 0,88 Sin diferencias significativas |
| ERBAC40 (1997) | 222/232/231 pacientes ICP estándar frente a ACLE frente a AR |
Lesión con calcificación moderada-grave | Éxito del procedimiento Revascularización de la lesión diana |
80 frente a 77 frente a 89%; p = 0,0019 32 frente a 46 frente a 42,4%; p = 0,013 |
| Litoplastia coronaria | ||||
| DISRUPT CAD I44 (2019) | 60 pacientes | Lesión gravemente calcificada | Éxito angiográfico Tasa de MACE a 6 meses |
100% 8,3% |
| DISRUPT CAD II45 (2019) | 120 pacientes | Lesión gravemente calcificada | Éxito angiográfico Tasa de MACE a 30 días |
100% 7,6% |
|
ACLE: aterectomía coronaria con láser de excímeros; AMRO: Amsterdam-Rotterdam trial; AO: aterectomía orbital; AR: aterectomía rotacional; COAST: Coronary Orbital Atherectomy System Study; ERBAC: Excimer Laser, Rotational Atherectomy, and Balloon Angioplasty Comparison; ICP: intervención coronaria percutánea; LAVA: Laser Angioplasty Versus Angioplasty; MACE: eventos cardiovasculares adversos mayores; ROTAXUS: Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease. |
||||
Complicaciones
Cabe destacar que las complicaciones durante el procedimiento son inciertas (disección y perforación). A pesar del éxito del dispositivo a corto plazo, existen pocos datos del mundo real publicados sobre el uso del BL. Parece ser que la fragmentación del calcio producida por el BL permanece in situ sin producir embolización distal, lo que disminuye la incidencia del fenómeno de slow-flow/no-reflow 7,42,43.
OTRAS TÉCNICAS Y OTROS DISPOSITIVOS
Balón no distensible
El balón NC presenta mínimos cambios de dimensión incluso a altas presiones, lo que permite concentrar la fuerza en un punto en concreto para permitir la dilatación de la lesión calcificada sin producir una dilatación excesiva en otros segmentos del vaso. Se suele utilizar para posdilatar el stent y garantizar una adecuada expansión y una buena aposición53. Hay que tener precaución, ya que el empleo de un balón NC en LCGC puede provocar la perforación coronaria o la disección de los bordes del stent cuando se utiliza para posdilatar53.
Balón de muy alta presión
El balón de muy alta presión consiste en un sistema de doble capa que permite una expansión uniforme del balón, reduciendo el riesgo de rotura y de perforación coronaria54. El dispositivo OPN (SIS Medical AG, Winterthur, Suiza) proporciona una presión de hasta 35-40 atm sin que se produzca la rotura del balón (tabla 3). Estas características permiten el tratamiento de la infraexpansión del stent cuando otras opciones han fallado. La principal limitación de este tipo de balón es su perfil de cruce, debido a su mayor rigidez y a la tecnología de doble capa7,54.
Cutting balloon y scoring balloon
El balón de corte (cutting balloon) WOLVERINE (Boston Scientific, Marlborough, MA, Estados Unidos) consiste en un balón NC con 3 microcuchillas dispuestas longitudinalmente sobre su superficie con el objetivo de crear incisiones dentro de la lesión calcificada durante el inflado del balón; se recomienda realizar un inflado secuencial hasta 6 atm55. Las principales limitaciones son su perfil de cruce y el riesgo de disección y perforación coronaria (tabla 3). El perfil de cruce y la navegabilidad del balón han mejorado con una nueva generación del dispositivo, el scoring ballon (tabla 3): AngioSculpt, Scoreflex y NSE Alpha. Consiste en un balón semidistensible de bajo perfil rodeado por 3 filamentos de nitinol dispuestos en espiral que permiten un mayor anclaje a la placa, con menos probabilidad de deslizamiento del balón y menor riesgo de disección y perforación56.
COMBINACIÓN DE TÉCNICAS
La combinación de AR y balón de corte en las LCGC facilita la fractura del calcio y permite una mejor expansión y aposición del stent57.
La técnica RASER consiste en la combinación de ACLE y AR o AO58. Esta combinación se puede utilizar en lesiones que no permiten el avance de un microcatéter. El láser puede proporcionar una modificación suficiente de la placa para avanzar el microcatéter y realizar el intercambio por una RotaWire/ViperWire que permita llevar a cabo AR o AO para lograr una adecuada expansión del stent58.
La combinación de AR y LC (técnica RotaTripsy) ha sido descrita recientemente59. Puede ser útil en lesiones muy graves y calcificadas con distribución circunferencial del calcio. En este tipo de lesiones, en las que es difícil posicionar directamente el BL en la lesión diana, la AR puede conseguir la modificación de placa inicial para permitir avanzar el BL y, de este modo, aumentar la distensibilidad luminal con el fin de lograr una adecuada expansión del stent59.
IMAGEN INTRAVASCULAR EN LAS LESIONES CALCIFICADAS
Las técnicas de imagen intravascular (IVUS y OCT) mejoran la identificación de las LCGC y permiten una evaluación meticulosa de la carga, la distribución y la excentricidad del calcio7,42.
Debido a la mayor penetración de los ultrasonidos, la IVUS es capaz de detectar depósitos calcificados en las capas más profundas de la pared del vaso. Sin embargo, debido a la sombra acústica, solo permite la definición del arco cálcico, sin poder ofrecer información sobre su espesor60,61. La OCT tiene mayor resolución espacial y ofrece una definición más precisa. El calcio se visualiza como un área de atenuación con un borde luminal bien delimitado. Parece ser una técnica más precisa que la IVUS para definir la carga de calcio, ya que proporciona información sobre los grados del arco cálcico, el área, el espesor, la longitud y el volumen de distribución del calcio42,61-63.
La imagen intravascular es esencial para seleccionar el dispositivo de modificación de la placa y para evaluar el resultado final del stent. La OCT presenta mayor sensibilidad para detectar la infraexpansión y la malaposición del stent, así como para evaluar el resultado tras la posdilatación7,61.
CONCLUSIONES
La calcificación coronaria se encuentra asociada a lesiones complejas y pacientes con importante comorbilidad, lo cual es un predictor de mal pronóstico a corto y medio plazo. En la actualidad se tratan pacientes cada vez más complejos y con lesiones más calcificadas, por lo que la preparación de la placa es clave en estos casos para favorecer la adecuada expansión y la buena aposición del stent, y de este modo evitar la reestenosis y la trombosis del stent.
El dispositivo de modificación de la placa ideal sería aquel que resultara fácil de implementar, de uso sencillo, eficaz y seguro durante el procedimiento, y con buenos resultados a medio y largo plazo. Con la aparición de la LC y la actualización del Rotablator y del balón de corte, parece que este campo presenta un resurgir positivo. En la actualidad se dispone de muchos dispositivos, que se pueden clasificar en técnicas de modificación de placa con balón y sin balón.
Todavía falta mucha evidencia procedente de estudios aleatorizados y de registros del mundo real para conocer con exactitud el papel de cada una de las técnicas, así como el beneficio de sus combinaciones, ya que, lejos de ser técnicas excluyentes, podrían ser complementarias. Con independencia de la técnica de modificación de la placa utilizada, se recomienda realizar imagen intravascular para asegurar la adecuada expansión y aposición del stent.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Bourantas CV, Zhang YJ, Garg S, et al. Prognostic implications of coronary calcification in patients with obstructive coronary artery disease treated by percutaneous coronary intervention:a patient-level pooled analysis of 7 contemporary stent trials. Heart. 2014;100:1158-1164.
2. Otsuka F, Sakakura K, Yahagi K, et al. Has our understanding of calcification in human coronary atherosclerosis progressed?Arterioscler Thromb Vasc Biol. 2014;34:724-736.
3. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
4. Généreux P, Madhavan MV, Mintz GS, et al. Ischemic outcomes after coronary intervention of calcified vessels in acute coronary syndromes. Pooled analysis from the HORIZONS-AMI (Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction) and ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) TRIALS. J Am Coll Cardiol. 2014;63:1845-1854.
5. Maehara A, Mintz GS, Witzenbichler B, et al. Relationship between intravascular ultrasound guidance and clinical outcomes after drug-eluting stents:the assessment of dual antiplatelet therapy with drug-eluting stents (ADAPT-DES) study. Circulation. 2014;129:463-470.
6. Barbato E, Shlofmitz E, Milkas A, Shlofmitz R, Azzalini L, Colombo A. State of the art:evolving concepts in the treatment of heavily calcified and undilatable coronary stenoses —from debulking to plaque modification, a 40-year-long journey. EuroIntervention. 2017;13:696-705.
7. De Maria GL, Scarsini R, Banning AP. Management of Calcific Coronary Artery Lesions:Is it Time to Change Our Interventional Therapeutic Approach?JACC Cardiovasc Interv. 2019;12:1465-1478.
8. Kassimis G, Raina T, Kontogiannis N. How should we treat heavily calcified coronary artery disease in contemporary practice?From atherectomy to intravascular lithotripsy. Cardiovasc Revasc Med. 2019. https://doi.org/10.1016/j.carrev.2019.01.010.
9. Shavadia JS, Vo MN, Bainey KR. Challenges With Severe Coronary Artery Calcification in Percutaneous Coronary Intervention:A Narrative Review of Therapeutic Options. Can J Cardiol. 2018;34:1564-1572.
10. Sharma SK, Tomey MI, Teirstein PS, et al. North American Expert Review of Rotational Atherectomy. Circ Cardiovasc Interv. 2019;12:e007448.
11. Barbato E, CarriéD, Dardas P, et al. European expert consensus on rotational atherectomy. EuroIntervention. 2015;11:30-36.
12. Bittl JA, Chew DP, Topol EJ, et al. Meta-analysis of randomized trials of percutaneous transluminal coronary angioplasty versus atherectomy, cutting balloon atherotomy, or laser angioplasty. J Am Coll Cardiol. 2004;43:936-942.
13. Whitlow PL, Bass TA, Kipperman RM, et al. Results of the study to determine Rotablator and transluminal angioplasty strategy (STRATAS). Am J Cardiol. 2001;87:699-705.
14. Safian RD, Feldman T, Muller DW, et al. Coronary angioplasty and Rotablator atherectomy trial (CARAT):immediate and late results of a prospective multicenter randomized trial. Catheter Cardiovasc Interv. 2001;53:213-220.
15. Sakakura K, Inohara T, Kohsaka S, et al. Incidence and Determinants of Complications in Rotational Atherectomy:Insights From the National Clinical Data (J-PCI Registry). Circ Cardiovasc Interv. 2016;9:e004278.
16. Abdel-Wahab M, Richardt G, Joachim Buttner H, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions:the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6:10-19.
17. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. The Randomized PREPARE-CALC. Circ Cardiovasc Interv. 2018;11:e007415.
18. Kawamoto H, Latib A, Ruparelia N., et al. In-hospital and midterm clinical outcomes of rotational atherectomy followed by stent implantation:The ROTATE multicentre registry. EuroIntervention. 2016;12:1448-1456.
19. Carrié D, Reczuch K, Dobrzycki K, et al.;on behalf of the EURO4C Registry investigators. Results of the prospective European Registry on Rotational Atherectomy. EuroPCR Congress 2019. Disponible en:https://media.pcronline.com/diapos/EuroPCR2019/3355-20190523_1630_Theatre_Bordeaux_Carrie_Didier_1111_(12324)/Carrie_Didier_20190523_1630_Theatre_Bordeaux.pdf. Consultado 12 Nov 2019.
20. Sulimov DS, Abdel-Wahab M, Toelg R. Stuck Rotablator:the nightmare of rotational atherectomy. EuroIntervention. 2013;9:251-258.
21. Tomey MI, Kini AS, Sharma SK. Current status of rotational atherectomy. JACC Cardiovasc Interv. 2014;7:345-353.
22. Shlofmitz E, Shlofmitz R, Lee MS. Orbital Atherectomy:A Comprehensive Review. Interv Cardiol Clin. 2019;8:161-171.
23. Sotomi Y, Cavalcante R, Shlofmitz RA, et al. Quantification by optical coherence tomography imaging of the ablation volume obtained with the orbital atherectomy system in calcified coronary lesions. EuroIntervention. 2016;12:1126-1134.
24. Yamamoto MH, Maehara A, Karimi Galougahi K, et al. Mechanisms of orbital versus rotational atherectomy plaque modification in severely calcified lesions assessed by optical coherence tomography. JACC Cardiovasc Interv. 2017;10:2584-2586.
25. Parikh K, Chandra P, Choksi N, et al. Safety and feasibility of orbital atherectomy for the treatment of calcified coronary lesions:the ORBIT I trial. Catheter Cardiovasc Interv. 2013;81:1134-1139.
26. Chambers JW, Feldman RL, Himmelstein SI, et al. Pivotal trial to evaluate the safety and efficacy of the orbital atherectomy system in treating de novo, severely calcified coronary lesions (ORBIT II). JACC Cardiovasc Interv. 2014;7:510-518.
27. Lee M, Genereux P, Shlofmitz R, et al. Orbital atherectomy for treating de novo, severely calcified coronary lesions:3-year results of the pivotal ORBIT II trial. Cardiovasc Revasc Med. 2017;18:261-264.
28. Sharma S, Saito S, Shlofmitz R, et al. LBT-3 treatment of severely calcified coronary lesions with the coronary orbital atherectomy system Micro Crown:1-year results from the COAST trial. JACC Cardiovasc Interv. 2017;3:S1-2.
29. Appelman YE, Piek JJ, Strikwerda S, et al. Randomized trial of excimer laser angioplasty versus balloon angioplasty for treatment of obstructive coronary artery disease. Lancet. 1996;347:79-84.
30. Stone GW, de Marchena E, Dageforde D, et al. Prospective, randomized, multicenter comparison of laser-facilitated balloon angioplasty versus stand-alone balloon angioplasty in patients with obstructive coronary artery disease. The Laser Angioplasty Versus Angioplasty (LAVA) Trial Investigators. J Am Coll Cardiol. 1997;30:1714-1721.
31. Ambrosini V, Sorropago G, Laurenzano E, et al. Early outcome of high energy laser (Excimer) facilitated coronary angioplasty on hard and complex calcified and balloon-resistant coronary lesions:LEONARDO Study. Cardiovasc Revasc Med. 2015;16:141-146.
32. Deckelbaum LI, Natarajan MK, Bittl JA, et al. Effect of intracoronary saline infusion on dissection during excimer laser coronary angioplasty:a randomized trial. The Percutaneous Excimer Laser Coronary Angioplasty (PELCA) Investigators. J Am Coll Cardiol. 1995;26:1264-1269.
33. Fernandez JP, Hobson AR, McKenzie D, et al. Beyond the balloon:excimer coronary laser atherectomy used alone or in combination with rotational atherectomy in the treatment of chronic total occlusions, non-crossable and nonexpansible coronary lesions. EuroIntervention. 2013;9:243-250.
34. Mohandes M, Rojas S, Moreno C, Fernández F, Fuertes M, Guarinos J. Excimer laser in percutaneous coronary intervention of device uncrossable chronic total and functional occlusions. Cardiovasc Revasc Med. 2019. < a href="https://doi.org/10.1016/j.carrev.2019.08.022" target="_blank">https://doi.org/10.1016/j.carrev.2019.08.022.
35. Lee T, Shlofmitz RA, Song L, et al. The effectiveness of excimer laser angioplasty to treat coronary in-stent restenosis with peri-stent calcium as assessed by optical coherence tomography. EuroIntervention 2019;15:e279-288.
36. Giugliano GR, Falcone MW, Mego D, et al. A prospective multicenter registry of laser therapy for degenerated saphenous vein graft stenosis:the COronary graft Results following Atherectomy with Laser (CORAL) trial. Cardiovasc Revasc Med. 2012;13:84-89.
37. Nishino M, Mori N, Takiuchi S, et al. Indications and outcomes of excimer laser coronary atherectomy:Efficacy and safety for thrombotic lesions —The ULTRAMAN registry. J Cardiol. 2017;69:314-319.
38. Dorr M, Vogelgesang D, Hummel A, et al. Excimer laser thrombus elimination for prevention of distal embolization and no-reflow in patients with acute ST elevation myocardial infarction:results from the randomized LaserAMI study. Int J Cardiol. 2007;116:20-26.
39. Topaz O, Ebersole D, Das T, et al. Excimer laser angioplasty in acute myocardial infarction (the CARMEL multicenter trial). Am J Cardiol. 2004;93:694-701.
40. Reifart N, Vandormael M, Krajcar M, et al. Randomized comparison of angioplasty of complex coronary lesions at a single center. Excimer Laser, Rotational Atherectomy, and Balloon Angioplasty Comparison (ERBAC) Study. Circulation. 1997;96:91-98.
41. De Silva K, Roy J, Webb I, et al. A Calcific, Undilatable Stenosis:Lithoplasty, a New Tool in the Box?JACC Cardiovasc Interv. 2017;10:304-306.
42. Ali ZA, Brinton TJ, Hill JM, et al. Optical Coherence Tomography Characterization of Coronary Lithoplasty for Treatment of Calcified Lesions:First Description. JACC Cardiovasc Imaging. 2017;10:897-906.
43. Serruys PW, Katagiri Y, Onuma Y. Shaking and Breaking Calcified Plaque:Lithoplasty, a Breakthrough in Interventional Armamentarium?JACC Cardiovasc Imaging. 2017;10:907-911.
44. Rodriguez Costoya I, Tizón Marcos H, Vaquerizo Montilla B, et al. Coronary Lithoplasty:Initial Experience in Coronary Calcified Lesions. Rev Esp Cardiol. 2019;72:788-790.
45. Brinton TJ, Ali ZA, Hill JM, et al. Feasibility of Shockwave Coronary Intravascular Lithotripsy for the Treatment of Calcified Coronary Stenoses. Circulation. 2019;139:834-836.
46. Ali ZA, Nef H, Escaned J, et al. Safety and Effectiveness of Coronary Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Stenoses:The Disrupt CAD II Study. Circ Cardiovasc Interv. 2019;12:e008434.
47. Wong B, El-Jack S, Newcombe R, Glenie T, Armstrong G, Khan A. Shockwave Intravascular Lithotripsy for Calcified Coronary Lesions:First Real-World Experience. J Invasive Cardiol. 2019;31:46-48.
48. Tovar Forero MN, Wilschut J, Van Mieghem NM, Daemen J. Coronary lithoplasty:a novel treatment for stent underexpansion. Eur Heart J. 2019;40:221.
49. Watkins S, Good R, Hill J, Brinton TJ, Oldroyd KG. Intravascular lithotripsy to treat a severely underexpanded coronary stent. EuroIntervention. 2019;15:124-125.
50. Wong B, E-Jack S, Khan A, et al. Treatment of Heavily Calcified Unprotected Left Main Disease With Lithotripsy:The First Case Series. J Invasive Cardiol. 2019;31:E143-E147.
51. Ristalli F, Maiani S, Mattesini A, et al. Intravascular lithotripsy and Impella support to assist complex LM angioplasty. Cardiovasc Revasc Med. 2019. https://doi.org/10.1016/j.carrev.2019.06.014.
52. Wong B, El-Jack S, Newcombe R, et al. Shockwave Intravascular Lithotripsy of Calcified Coronary Lesions in ST-Elevation Myocardial Infarction:First-in-Man Experience. J Invasive Cardiol. 2019;31:E73-E75.
53. Romagnoli E, Sangiorgi GM, Cosgrave J, et al. Drug-eluting stenting:the case for post-dilation. JACC Cardiovasc Interv. 2008;1:22-31.
54. Secco GG, Ghione M, Mattesini A, et. al. Very high-pressure dilatation for undilatable coronary lesions:indications and results with a new dedicated balloon. EuroIntervention. 2016;12:359-365.
55. Mauri L, Bonan R, Weiner BH, et al. Cutting balloon angioplasty for the prevention of restenosis:results of the Cutting Balloon Global Randomized Trial. Am J Cardiol. 2002;90:1079-1083.
56. de Ribamar Costa JJr, Mintz GS, Carlier SG, et al. Nonrandomized comparison of coronary stenting under intravascular ultrasound guidance of direct stenting without predilation versus conventional predilation with a semi-compliant balloon versus predilation with a new scoring balloon. Am J Cardiol. 2007;100:812-817.
57. Amemiya K, Yamamoto MH, Maehara A, et al. Effect of cutting balloon after rotational atherectomy in severely calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019. https://doi.org/10.1002/ccd.28278.
58. Fernandez JP, Hobson AR, McKenzie D, et al. Beyond the balloon:excimer coronary laser atherectomy used alone or in combination with rotational atherectomy in the treatment of chronic total occlusions, non-crossable and nonexpansible coronary lesions. EuroIntervention. 2013;9:243-250.
59. Jurado-Román A, Gonzálvez A, Galeote G, Jiménez-Valero S, Moreno R. RotaTripsy:Combination of Rotational Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified Lesions. JACC Cardiovasc Interv. 2019;12:e127-e129.
60. Hoffmann R, Mintz GS, Popma JJ, et al. Treatment of calcified coronary lesions with Palmaz-Schatz stents. An intravascular ultrasound study. Eur Heart J. 1998;19:1224-1231.
61. Sharma SK, Vengrenyuk Y, Kini AS. IVUS, OCT, and coronary artery calcification:is there a bone of contention?JACC Cardiovasc Imaging. 2017;10:880-882.
62. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
63. Zhang M, Matsumura M, Usui E, et al. TCT 51:IVUS Predictors of Stent Expansion in Severely Calcified Lesions. J Am Coll Cardiol. 2019;74(13 Supplement) B51. http://www.onlinejacc.org/content/74/13_Supplement/B51.