Resumen
El tratamiento antitrombótico tras una revascularización percutánea en los pacientes con indicación de anticoagulación oral crónica ha sido siempre un tema de máximo interés y de gran complejidad, debido sobre todo al alto riesgo isquémico y tromboembólico intrínseco de esta población, y al elevado riesgo hemorrágico que comporta la combinación de fármacos antiagregantes y anticoagulantes. El manejo invasivo actual de la cardiopatía isquémica hace que esta población esté en crecimiento, aspecto que incrementa el interés por definir cuáles son los mejores fármacos y estrategias terapéuticas. A pesar de la escasa evidencia científica, a lo largo de los últimos años se han estudiado diferentes regímenes antitrombóticos, buscando fundamentalmente una reducción de los eventos hemorrágicos, sin que esto repercutiera en la eficacia de las nuevas combinaciones. Las estrategias estudiadas se han basado en el acortamiento de la duración del tratamiento triple e incluso en el uso del tratamiento doble (anticoagulación más un único antiagregante) priorizando el clopidogrel. Sin embargo, ha sido la llegada de los anticoagulantes de acción directa, con la realización de importantes ensayos clínicos en esta población, lo que está aportando información relevante y trascendente que, sin lugar a dudas, contribuirá a modificar la práctica clínica.
Palabras clave: Anticoagulación oral. Fibrilación auricular. Intervencionismo coronario percutáneo. Stent.
Abstract
The antithrombotic treatment after percutaneous revascularization in patients with chronic indication for oral anticoagulation has always been a matter of great interest and complexity, basically because of the high ischemic and thromboembolic risk of this population and high hemorrhagic risk associated with combination therapy with antiplatelet and anticoagulant drugs. The actual invasive management of ischemic cardiomyopathy has made this population of patients grow and raised concerns on which the optimal drugs and therapeutic strategies really are. Yet despite the scarce scientific evidence available, different antithrombotic regimens have been studied over the last few years in an attempt to reduce hemorrhagic events without affecting the efficacy of the new combination therapies. The strategies studied have been based on shortening the duration of triple anticoagulation therapy, and even on the use of double anticoagulation therapy (anticoagulation plus one single antiplatelet drug) prioritizing clopidogrel. But it has been the arrival of direct-acting anticoagulants, with important clinical trials conducted on this population, that has provided us with relevant and fundamental information that will undoubtedly contribute to change the actual clinical practice.
Keywords: Atrial fibrillation. Percutaneous coronary intervention. Stent. Oral anticoagulation.
Abreviaturas: AAS: ácido acetilsalicílico. ACO: anticoagulación oral. ACOD: anticoagulantes orales de acción directa. AVK: antagonistas de la vitamina K. FA: fibrilación auricular. ICP: intervencionismo coronario percutáneo. IP2Y12: inhibidores del receptor P2Y12 SCA: síndrome coronario agudo. TAD: tratamiento antitrombótico doble. TAPD: tratamiento antiagregante plaquetario doble. TAT: tratamiento antitrombótico triple.
Introducción
El manejo antitrombótico del paciente con fibrilación auricular (FA) sometido a intervencionismo coronario percutáneo (ICP) ha sido, es y seguirá siendo motivo de estudio, discusión e investigación. La complejidad de esta población con alta comorbilidad hace que presente un mal pronóstico en el medio y largo plazo, con un alto índice de eventos isquémicos. Por otro lado, el uso de tratamientos antitrombóticos combinados (anticoagulación y antiagregación doble o simple) dirigidos a mejorar el pronóstico isquémico de estos pacientes genera un número de complicaciones hemorrágicas no despreciable que ha llevado a la búsqueda de regímenes antitrombóticos más seguros (en intensidad y tiempo), sin repercutir en la eficacia.
La complejidad de estos pacientes y la dificultad para incluirlos en ensayos clínicos realmente representativos de la vida real han hecho que la mayor parte de la información sobre el régimen antitrombótico óptimo proceda de registros, metanálisis y recomendaciones de expertos y grupos de trabajo.
Precisamente, ha sido la llegada de los anticoagulantes orales de acción directa (ACOD), fármacos más seguros y al menos igual de eficaces que los antagonistas de la vitamina K (AVK) para el tratamiento de la FA, la que está aportando y aportará más evidencia. La existencia de un importante número de pacientes con FA tratados con stent ha llevado a la realización de 4 grandes ensayos clínicos que comparan la seguridad y la eficacia de los ACOD frente a los AVK, con el uso de diferentes regímenes antitrombóticos.
A lo largo de este artículo se revisa la evidencia existente sobre esta población tan trascendental, importante por su elevada prevalencia, por su mal pronóstico y por las grandes novedades que ha habido en estos últimos años y que se presentarán en los próximos.
Magnitud del problema y pronóstico
La prevalencia de los pacientes con FA tratados con ICP varía entre el 6% y el 10% dependiendo de los diferentes registros, las poblaciones incluidas y los síndromes tratados. Parece haber una mayor prevalencia de FA en los pacientes revascularizados por angina estable que en aquellos que lo son por síndrome coronario agudo (SCA). Así, Rohla et al.1 describen una prevalencia de un 10,2% en los pacientes estables frente a un 6,5% en los revascularizados por SCA. Esta prevalencia se incrementa en los registros españoles de SCA hasta el 8-9%2,3. Se trata, por tanto, de unos pacientes nada excepcionales en el día a día de los servicios de cardiología y las salas de hemodinámica.
Sin embargo, lo realmente importante es conocer cómo la presencia de FA en los pacientes revascularizados percutáneamente es uno de los predictores de peor pronóstico. De forma general, y sin valorar la influencia del tratamiento, en el medio plazo (seguimiento de 20 meses) 1 de cada 3 pacientes (32,3%) presentará un evento adverso mayor y casi 1 de cada 4 (22,6%) fallecerá4. Al comparar esta población con los pacientes sin FA se observa cómo la mortalidad en el largo plazo (56 meses) se triplica por el hecho de tener FA (41% frente a 13%), y la presencia de arritmia es uno de los grandes predictores de mortalidad1.
Otro aspecto que debe considerarse es la aparición de FA de novo en los pacientes que ingresan por SCA. La información del registro ARIAM (Análisis del Retraso en el Infarto Agudo de Miocardio)2 describe cómo los pacientes con FA de novo pueden suponer hasta un 55% del total de los pacientes con FA ingresados por un SCA. Lo importante no solo es el alto porcentaje de esta presentación, sino el mal pronóstico hospitalario con el que se relaciona, que es un predictor independiente de mortalidad hospitalaria además de estar relacionado con una mayor presencia de reinfarto, arritmias malignas e insuficiencia cardiaca.
El peor pronóstico de estos pacientes viene determinado por su edad más avanzada, mayor comorbilidad y, en muchas ocasiones, por su infratratamiento tanto con estrategias (menor realización de cateterismos y de revascularizaciones percutáneas) como con fármacos recomendados2,5.
El otro aspecto fundamental que confiere un pronóstico tórpido es el uso, precisamente, de los tratamientos antitrombóticos recomendados. El alto riesgo isquémico de estos pacientes demanda regímenes basados en la combinación de anticoagulación y antiagregación doble o simple. La búsqueda de la reducción de estos eventos isquémicos genera un aumento de las hemorragias graves provocadas por fármacos correctamente indicados, y estas complicaciones hemorrágicas terminan siendo muchas veces determinantes en el pronóstico del paciente.
Por tanto, es crucial identificar a esta población y su riesgo, para así intentar aportar las estrategias de tratamiento y las medidas óptimas durante el ingreso hospitalario, al alta y en el seguimiento, con el objetivo final de mejorar un pronóstico de por sí grave.
Tratamiento antitrombótico con antagonistas de la vitamina K: Tratamiento doble o triple
La anticoagulación oral (ACO) crónica es superior al tratamiento antiagregante (en monoterapia o doble) en cuanto a la prevención de las complicaciones tromboembólicas (ictus y embolia sistémica) de la FA6,7, mientras que el tratamiento antiagregante plaquetario doble con ácido acetilsalicílico (AAS) y un inhibidor del receptor P2Y12 (IP2Y12) es el tratamiento antitrombótico de elección para prevenir eventos isquémicos aterotrombóticos (infarto de miocardio y trombosis de stent) en los pacientes en quienes se realiza un ICP (en el contexto o no de un SCA)8,9. Al asociarse ambas situaciones es cuando la elección del tratamiento antitrombótico se convierte en un problema clínico, porque la que sería la elección más simple, es decir, el uso de tratamiento antitrombótico triple (TAT, combinación de ACO y antiagregación doble), es sabido que incrementa el riesgo de sangrado mayor al menos 2 a 3 veces respecto a cualquier otro régimen antitrombótico, ya sea antiagregación doble o tratamiento antitrombótico doble (TAD, combinación de ACO y un antiagregante)10-12. Surge por tanto la controversia entre el temor a emplear TAT por el comentado aumento de las complicaciones hemorrágicas y el posible aumento de los eventos isquémicos en caso de emplear estrategias menos «agresivas» como el TAD.
El aumento del riesgo hemorrágico asociado al uso de TAT se ha evidenciado de manera consistente en numerosos estudios observacionales (incluyendo registros a gran escala), mientras que los hallazgos referentes a la prevención de eventos aterotrombóticos han sido más dispares, aunque en general no se han encontrado diferencias entre el TAT y el TAD en lo que respecta a la reducción de eventos isquémicos12-14. Es importante señalar que el aumento del riesgo hemorrágico con TAT se mantiene durante toda la duración de este12, por lo que, si se decide iniciarlo, la evidencia disponible señala que debería mantenerse el mínimo tiempo que se considere estrictamente necesario para obtener un beneficio en cuanto a reducción de eventos aterotrombóticos. Por otra parte, merece la pena echar la vista atrás y retrotraerse a los estudios de finales de los años 1990 que sentaron la indicación de usar doble antiagregación plaquetaria en el contexto del ICP con implante de stent coronario15-18. En estos estudios, la antiagregación plaquetaria doble (AAS y tienopiridina) tuvo un beneficio franco en cuanto a reducción de eventos isquémicos, en especial en el primer mes tras el ICP, comparada con una estrategia de TAD (AAS y AVK) (tabla 1). Además, es relevante señalar que los eventos isquémicos (infarto de miocardio o trombosis de stent) en el primer mes tras el ICP tienen un pronóstico peor en términos de mortalidad que los que se presentan de forma más tardía19,20.
Tabla 1. Ensayos clínicos aleatorizados que comparan el tratamiento antiagregante doble (AAS y AVK) con el tratamiento antitrombótico doble tras el implante de un stent coronario
| Ensayo clínico | Grupos de tratamiento | Eventos adversos cardiacos mayores | Eventos hemorrágicos | ||
| Definició | Resultados | Definició | Resultados | ||
| ISAR15 n = 517) |
TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK) | Muerte de causa cardiaca, IM, cirugía de revascularización o reintervención a los 30 días | 1,6% frente a 6,2%; p = 0,01 |
Cualquier sangrado a los 30 días | 0% frente a 6,5%; p < 0,01 |
| STARS16 (n = 1.653) |
AAS frente a TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK)* | Muerte, IM, TS o revascularización de la lesión diana a los 30 días | 0,5% frente a 2,7%; p = 0,01 |
Cualquier sangrado a los 30 días | 5,5% frente a 6,2%; p = 0,99 |
| MATTIS17 (n = 350) |
TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK) | Muerte CV, IM o repetición de revascularización a los 30 días | 5,6% frente a 11,0%; p = 0,07 |
Hemorragia mayor o complicación vascular mayor a los 30 días | 1,7% frente a 6,9%; p = 0,02 |
| FANTASTIC18 (n = 485) |
TAPD (AAS + ticlopidina) frente a TAD (AAS + AVK) | Muerte, IM u oclusión del stent a las 6 semanas | 5,7% frente a 8,3%; p = 0,37 |
Cualquier sangrado a las 6 semanas | 13,5% frente a 21,0%; p = 0,03 |
|
AAS: ácido acetilsalicílico; AVK: antagonistas de la vitamina K; CV: cardiovascular; IM: infarto de miocardio; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble; TS: trombosis del stent. * Se comunican solo los resultados de la comparación entre antiagregación plaquetaria doble y tratamiento antitrombótico doble. |
|||||
Sin embargo, hay que ser muy prudente al extraer argumentos o conclusiones a favor o en contra del TAT basándose en estudios observacionales, pues al fin y al cabo tienen la limitación de la falta de aleatorización que puede condicionar sesgos relevantes (como podría ser, en el caso que nos ocupa, el sesgo de confusión por indicación de los diferentes regímenes antitrombóticos según las características de los pacientes). Por todo ello, conviene enfatizar los resultados de los ensayos clínicos aleatorizados, aunque como veremos a continuación tampoco están exentos de limitaciones, en especial en lo que respecta a la valoración de la eficacia (prevención de eventos isquémicos).
Antes de entrar en lo que podemos llamar la era de los ACOD, se realizaron 2 ensayos clínicos aleatorizados que evaluaron la seguridad de diferentes estrategias antitrombóticas con AVK: el WOEST y el ISAR-TRIPLE21,22. El ensayo WOEST incluyó 573 pacientes con necesidad de ACO (por diversas indicaciones, el 69% con FA o aleteo auricular) que fueron aleatorizados para recibir TAT con AVK frente a TAD consistente en clopidogrel y AVK, y se apreció una reducción importante del riesgo de sangrado (evento hemorrágico de cualquier tipo) al año de seguimiento en los pacientes que recibieron TAD (19,4% frente a 44,4%; hazard ratio [HR], 0,36; intervalo de confianza del 95% [IC95%], 0,26-0,50; p < 0,001)21, aunque este beneficio se debió principalmente a una reducción de los sangrados menores, y no se evidenció ningún incremento de los eventos aterotrombóticos en el grupo con TAD (figura 1). El estudio ha recibido críticas por contar con numerosas limitaciones, entre las que destacan la falta de poder estadístico para evaluar las variables de eficacia, la inclusión de pacientes de relativo bajo riesgo de eventos isquémicos (poco más del 25% con SCA) y la presencia de otros aspectos que pueden favorecer un aumento en la incidencia de hemorragias, como una duración excesiva del TAT en el grupo control (1 año, que es más de lo recomendado), el acceso femoral en la mayoría de los casos y la baja utilización de inhibidores de la bomba de protones23. A pesar de todo, la relevancia del estudio WOEST es manifiesta, pues fue el primero en cuestionar la necesidad de TAT y en poner sobre la mesa la posibilidad de usar TAD inmediatamente tras el ICP en este escenario.
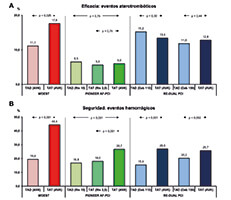
Figura 1. Resultados de ensayos clínicos aleatorizados de tratamiento triple frente a tratamiento doble antitrombótico en pacientes con indicación de anticoagulación oral crónica en los que se realiza intervencionismo coronario percutáneo. Seguridad: eventos hemorrágicos (A). Eficacia: eventos adversos cardiacos mayores (B). Las definiciones de la variable principal de seguridad varían según el estudio: WOEST, cualquier evento hemorrágico a los 12 meses; PIONEER AF-PCI, hemorragia clínicamente significativa (TIMI) a los 12 meses; RE-DUAL PCI, hemorragia mayor o clínicamente relevante (ISTH) en el seguimiento (14 meses de media). Las definiciones de los eventos adversos cardiacos mayores varían según el estudio: WOEST, muerte, infarto de miocardio, ictus, revascularización de vaso diana o trombosis de stent a los 12 meses; PIONEER AF-PCI, muerte de causa cardiovascular, infarto de miocardio o ictus a los 12 meses; RE-DUAL PCI, muerte, evento tromboembólico (infarto de miocardio, ictus o embolia sistémica) o revascularización no planeada en el seguimiento. AVK: antagonista de la vitamina K; Dab 110: dabigatrán 110 mg/12 h; Dab 150: dabigatrán 150 mg/12 h; TAD: tratamiento antitrombótico doble; Riv 2,5: rivaroxabán 2,5 mg/12 h; Riv 15: rivaroxabán 15 mg/24 h; TAT: tratamiento antitrombótico triple.
El ensayo ISAR-TRIPLE aleatorizó 614 pacientes con indicación de ACO (83,9% con FA) en los que se realizaba ICP con implante de stent liberador de fármaco y 2 diferentes duraciones de TAT, una larga de 6 meses frente a una corta de 6 semanas (ambas consistentes en AAS, clopidogrel y AVK seguidos de AAS y AVK)22. No se hallaron diferencias entre las 2 duraciones de TAT en cuanto a la variable principal (un combinado de muerte, infarto de miocardio, trombosis de stent definitiva, ictus y sangrado mayor según la escala Thrombolysis in Myocardial Infarction [TIMI]) a los 9 meses (9,8% frente a 8,8%; HR, 1,14; IC95%, 0,68-1,91; p = 0,63), y tampoco se encontraron diferencias significativas en los eventos isquémicos y los eventos hemorrágicos por separado. No obstante, en un análisis de los eventos sucedidos a partir de las 6 semanas (una vez abandonado el clopidogrel en el brazo de TAT corto) sí se apreció un ligero aumento de las hemorragias de cualquier tipo según la clasificación del Bleeding Academic Research Consortium (no con la clasificación TIMI) en el grupo de TAT largo. Pese a las limitaciones de ambos estudios, siendo la principal la ausencia de poder estadístico para evaluar convenientemente la eficacia de las distintas estrategias analizadas en cuanto a prevención de eventos aterotrombóticos, sus resultados sugieren que la duración del TAT no debe prolongarse de manera injustificada para no incrementar el riesgo hemorrágico más de lo estrictamente necesario.
Posicionamiento de los anticoagulantes orales de acción directa
Entre las estrategias para reducir las complicaciones hemorrágicas derivadas del uso de fármacos antritrombóticos, además de la reducción de la duración del tiempo del TAT o de la suspensión del AAS en determinados grupos de alto riesgo, se encuentra el uso de ACOD.
El mejor perfil de seguridad de estos nuevos anticoagulantes, junto al interés lógico por posicionarse en una población grande en número y con posibilidades de mejoría, ha llevado a la reali-zación de un ensayo clínico para cada uno de los 4 ACOD aprobados.
Con la información disponible actualmente, las últimas guías europeas de práctica clínica se han decantado de manera clara a favor del uso de los ACOD en esta población, en detrimento de los AVK8,24.
Si bien los 4 ensayos clínicos comparan en pacientes con FA revascularizados con ICP la seguridad de los nuevos anticoagulantes frente al TAT (AVK, AAS y clopidogrel), y presentan criterios de inclusión y exclusión bastante similares, existen diferencias importantes en los regímenes antitrombóticos utilizados y en las dosis de los fármacos, que pueden tener alguna influencia en las conclusiones de los estudios y en su repercusión práctica. A continuación se resumen por orden cronológico los 4 grandes ensayos clínicos que ya están publicados o se encuentran en fase de seguimiento, y se presentan los aspectos más relevantes y los más cuestionados. En la tabla 225 se detallan el diseño, los objetivos y los principales hallazgos de cada uno de ellos.
Tabla 2. Características diferenciales y hallazgos fundamentales de los 4 ensayos clínicos que comparan anticoagulantes orales de acción directa frente a anticoagulantes antivitamina K en pacientes con fibrilación auricular revascularizados percutáneamente
| Estudio | Población | Pacientes | Grupos de estudio | Grupos de control | Objetivo primario de seguridad | Principales hallazgos | Eficacia | |||
| PIONEER AF-PCI26 |
Pacientes con FA sometidos a ICP | 2.124 | Ribaroxabán 15 mg/24 h + IP2Y12 |
Ribaroxabán 2,5 mg/12 h + IP2Y12 + AAS |
Warfarina + IP2Y12 + AAS |
Sangrado clínicamente significativo (clasificación TIMI) | Sangrados TIMI mayor (12%), menor (7%) o que requieren atención médica (85%) | El porcentaje de sangrados fue menor en los dos grupos de rivaroxabán (16,8% y 18%) que en el grupo control (26,7%); p < 0,0001 | No inferior. Estudio sin poder estadístico para detectar diferencias de eficacia |
|
| RE-DUAL PCI29 |
Pacientes con FA sometidos a ICP | 2.725 | Dabigatrán 150 mg/12 h + IP2Y12 |
Dabigatrán 110 mg/12h + IP2Y12 |
Warfarina + IP2Y12 + AAS |
Sangrado mayor o sangrado clínicamente relevante no mayor (clasificación ISTH) | Sangrado mayor ISTH (32%) o clínicamente relevante no mayor (68%) | El porcentaje de sangrados fue menor en los dos grupos de dabigatrán (20,2% y 15,4%) que en el grupo control (25,7% y 26,9% respectivamente); p < 0,0001 | No inferior. Estudio sin poder estadístico para detectar diferencias de eficacia |
|
| AUGUSTUS31 | Pacientes con SCA o ICP | 4.614 | Apixabán 5 o 2,5 mg/12 h + IP2Y12 + AAS |
Apixabán 5 o 2,5 mg/12 h + IP2Y12 |
Warfarina + IP2Y12 + AAS |
Warfarina + IP2Y12 |
Sangrado mayor o sangrado clínicamente relevante no mayor (clasificación ISTH) | El porcentaje de sangrados fue menor con apixabán que con AVK (10,5 y 14,7%; p < 0,001) y con placebo frente a AAS (9 y 16,1%; p < 0,001) | Menos ingresos hospitalarios en apixabán y similar incidencia de eventos isquémicos | |
| ENTRUST-AF PCI32 |
1.500 | Edoxabán 60 mg/24 h + IP2Y12 |
Warfarina + IP2Y12 + AAS |
Sangrado mayor o sangrado clínicamente relevante no mayor (clasificación ISTH) | En fase de seguimiento | En fase de seguimiento | ||||
|
AAS: ácido acetilsalicílico; FA: fibrilación auricular; ICP: intervencionismo coronario percutáneo; IP2Y12: inhibidor del receptor P2Y12; ISTH: International Society on Thrombosis and Haemostasis; SCA: síndrome coronario agudo; TIMI: Thrombolysis in Myocardial Infarction. |
||||||||||
Estudio PIONEER AF-PCI
El estudio PIONEER AF-PCI fue el primero en publicarse. Es un ensayo clínico multicéntrico e internacional que aleatorizó a 2.124 pacientes con FA revascularizados con stent a 3 estrategias de tratamiento: rivaroxabán 15 mg/día e IP2Y12; rivaroxabán 2,5 mg/12 h y AAS más IP2Y12; o TAT (AVK, AAS y clopidogrel)26. El objetivo primario fue la ocurrencia de hemorragias clínicamente significativas (sangrados mayores o menores de la clasificación TIMI) o de hemorragias que requiriesen atención médica.
El objetivo del estudio se alcanzó para los 2 grupos de rivaroxabán (16,8% y 18% frente a 26,7%; p < 0,001). En términos de eficacia, los eventos isquémicos (muerte de causa cardiovascular, infarto o ictus) y la mortalidad global fueron similares en los 3 grupos, si bien el estudio no tenía potencia estadística para evaluar diferencias en cuanto a eficacia. Los autores concluyen que el tratamiento con rivaroxabán 15 mg/día más clopidogrel o con rivaroxabán 2,5 mg/12 h más clopidogrel y AAS es más seguro que el TAT con AVK, clopidogrel y AAS.
Este fue el primer estudio que posicionó a los ACOD en esta población, pero son varios los aspectos que deben comentarse al respecto. Se desconoce si estas 2 dosis de rivaroxabán son suficientes para la prevención del ictus en los pacientes con FA, comparadas con los AVK o con el rivaroxabán a dosis de 20 mg/día en pacientes con función renal normal27,28. La dosis de rivaroxabán de 15 mg/24 h no está estudiada de forma generalizada en los pacientes con FA en la prevención tromboembólica, y puede generar dudas sobre su recomendación a todo tipo de pacientes. Y lo mismo ocurre con la dosis de 2,5 mg/12 h, que ha sido estudiada en la cardiopatía isquémica pero no en la FA y que se presume como claramente insuficiente.
El uso de estas dosis no aprobadas para el tratamiento de la FA, si bien ha posicionado al rivaroxabán como el primer ACOD estudiado en esta población y con un perfil de seguridad positivo, ha generado una indicación con evidencia tan solo IIbB en la guía europea de antiagregación doble (rivaroxabán 15 mg/día)8, curiosamente inferior a la otorgada al uso de rivaroxabán a dosis de 20 o 15 mg/día (según la función renal), basado en su estudio general y en subestudios (IIaC)8,27.
Estudio RE-DUAL PCI
El ensayo clínico RE-DUAL PCI aleatorizó a 2.725 pacientes en 3 grupos (TAT con AVK, tratamiento doble con dabigatrán 150 mg/12 h y tratamiento doble con dabigatrán 110 mg/12 h), partiendo de la hipótesis de que un tratamiento doble con dabigatrán y un IP2Y12 puede ser más seguro que el tratamiento estándar basado en TAT en pacientes con FA sometidos a ICP29. La incidencia del evento primario (sangrado mayor o clínicamente relevante de la International Society on Thrombosis and Haemostasis [ISTH]) fue del 15,4% para el dabigatrán a dosis de 110 mg y del 26,9% para el TAT (HR, 0,52; p < 0,0001 para no inferioridad y superioridad), y del 20,7% para el dabigatrán a dosis de 150 mg frente al 25,7% para el TAT (HR, 0,72; p < 0,0001 para no inferioridad). La incidencia del evento combinado para eficacia fue similar en los 3 grupos. El estudio concluye que en los pacientes con FA sometidos a ICP el riesgo de sangrado fue menor en ambos grupos de dabigatrán comparados con el TAT, sin hallar diferencias en eficacia.
El aspecto más relevante, sin duda, es el perfil de seguridad que aporta el dabigatrán con reducciones del 48% en los sangrados en los pacientes tratados con dabigatrán a dosis de 110 mg y del 24% en los tratados con dabigatrán a dosis de 150 mg. En favor de este estudio hay que mencionar que las dosis utilizadas fueron las mismas que en el estudio RELY30, en el que se demostraron su eficacia y seguridad para el tratamiento de la FA no valvular, que fueron confirmadas posteriormente en amplios registros de la vida real.
La principal duda tras este estudio vino determinada por el hallazgo de una incidencia de trombosis del stent del 1,5% en el grupo de dabigatrán 110 mg frente al 0,8% en el grupo con TAT (p = 0,15), así como un aumento del infarto (4,5% frente a 3,0%; p = 0,09). Hay que mencionar que estas tasas de trombosis y de infarto no se observaron con la dosis más alta de 150 mg/12 h. Si bien las diferencias no fueron estadísticamente significativas, estos datos deben llevar a plantear si no se estará pasando de regímenes antitrombóticos muy potentes a otros demasiado livianos en aras de priorizar la seguridad sobre la eficacia. Y la segunda cuestión no solucionada es conocer si el mejor perfil de seguridad del dabigatrán lo es por la mayor seguridad del fármaco o por la no exposición al AAS. Al fin y al cabo, estos 2 ensayos clínicos no comparan estrategias similares (tratamiento triple frente a doble) y por tanto no podrán resolver cuestiones que son absolutamente clave.
A pesar de todo, el REDUAL-PCI debe considerarse como un estudio de gran importancia que permite valorar con mucha fuerza esta nueva opción terapéutica en los pacientes con FA tratados con stent, y quizás de forma más concreta en aquellos que muestren un alto riesgo hemorrágico.
Estudio AUGUSTUS
El estudio AUGUSTUS31 es sin duda el mejor planteado o al menos el que va a poder dar respuesta a un mayor número de preguntas.
El ensayo presenta un diseño factorial 2 × 2 diseñado para comparar apixabán con AVK y AAS frente a placebo en pacientes con FA que presentan un SCA o se les realiza ICP y están recibiendo un IP2Y12. Es el estudio con mayor número de pacientes, pues incluye 4.614.
El objetivo primario es el combinado de sangrados mayores y no mayores clínicamente relevantes siguiendo la clasificación de la ISTH. Los objetivos secundarios del estudio son la mortalidad por cualquier causa, la hospitalización por cualquier causa y los eventos isquémicos.
La incidencia del evento primario se produjo en el 10,5% del grupo apixabán frente al 14,7% en el grupo AVK (HR = 0,69; p < 0,001 para inferioridad y superioridad) y en el 16,1% de los pacientes que recibieron AAS frente al 9% de los que recibieron placebo (HR = 1,89; p < 0,001). Los pacientes del grupo del apixabán tuvieron una menor incidencia de hospitalización que los del grupo de AVK con similar número de eventos isquémicos.
No cabe duda de que este estudio confirma la superioridad de los ACOD en esta población por su claro mejor perfil de seguridad. Pero probablemente no genera evidencia suficiente para una discontinuación de la AAS de forma rutinaria en estos pacientes. Debemos señalar la presencia de más eventos trombóticos en el grupo placebo frente al grupo AAS con el doble de trombosis del stent, diferencias que si bien no alcanzaron significación estadística pueden generar dudas por la falta de poder estadístico para detectar eventos isquémicos. Y no debemos olvidar que los pacientes fueron aleatorizados días o semanas después del evento isquémico, habiendo todos tomado AAS hasta la aleatorización.
Estudio ENTRUST-AF PCI
El ensayo clínico ENTRUST-AF PCI32 se encuentra en fase de seguimiento y ha aleatorizado a 1.500 pacientes con FA, bajo tratamiento anticoagulante y revascularizados con ICP, a 2 estrategias terapéuticas: edoxabán 60 mg/24 h (o 30 mg si se reúnen los criterios para esta dosis) más un IP2Y12 frente a TAT con AVK. El objetivo primario de seguridad vuelve a ser la incidencia de sangrados mayores y no mayores clínicamente relevantes siguiendo la clasificación de la ISTH, y el objetivo primario de eficacia es el combinado de muerte de causa cardiovascular, ictus, embolia, infarto o trombosis definitiva de stent.
El pequeño tamaño del estudio solo permitirá dar respuesta a la pregunta de si un régimen de tratamiento doble con edoxabán es más seguro que un TAT con AVK. Es fácil hipotetizar que así será, pues al fin y al cabo no se comparan en idénticas condiciones al eliminar el AAS del grupo de edoxabán, igual que se hizo en el estudio REDUAL-PCI. Además, la falta de potencia estadística no permitirá mostrar diferencias entre la eficacia de ambas estrategias.
Consideraciones de las guías de práctica clínica
En los últimos años se han elaborado diversas guías de práctica clínica por parte de las sociedades científicas y documentos de consenso específicos por grupos de expertos que han aportado una serie de recomendaciones sobre el manejo del tratamiento antitrombótico en los pacientes con necesidad de ACO crónica en los que se realiza ICP7,8,24,25,33,34. El hecho de que las recomendaciones de estos documentos no siempre coincidan, y que presenten mayoritariamente un nivel de evidencia bajo, pone de manifiesto la complejidad de este escenario.
En lo que respecta al tratamiento antitrombótico tras el ICP, las recomendaciones más recientes (incorporando los resultados de los estudios con ACOD) de las sociedades científicas europeas pueden resumirse de manera sucinta en los siguientes puntos8,24,25:
- TAT con AAS, clopidogrel y ACO durante 1 mes es la estrategia por defecto en los pacientes en los que se implanta un stent, con independencia del tipo de dispositivo implantado.
- TAT al menos 1 mes en pacientes con alto riesgo isquémico por SCA o con otras características anatómicas o del procedimiento, que supera al riesgo hemorrágico.
- TAD inicial con ACO y clopidogrel (de preferencia) o AAS en pacientes con riesgo hemorrágico elevado y superior al riesgo isquémico.
- En pacientes con FA no valvular debe recomendarse los ACOD de manera rutinaria.
- Los ACOD deben usarse a la mínima dosis efectiva para la prevención del ictus que haya sido evaluada en los ensayos de FA.
- Puede considerarse el uso de la dosis de 15 mg de rivaroxabán (en lugar de 20 mg), aunque su eficacia en la prevención del ictus no ha sido suficientemente evaluada.
- Cuando se usa en TAD, la dosis de dabigatrán preferida es la de 150 mg/12 h.
- En caso de usar AVK, el International Normalized Ratio objetivo debe estar en el rango bajo y el tiempo en rango terapéutico debe ser > 65%.
- El uso de ticagrelor o de prasugrel como parte del TAT no está recomendado.
- Debería considerarse la interrupción del tratamiento antiagregante y dejar solo ACO al cabo de 12 meses tras el procedimiento, aunque puede continuarse añadiendo un antiagregante en casos seleccionados según el riesgo isquémico.
En este apartado merece la pena comentar un documento de consenso de expertos norteamericanos que ha generado cierta polémica por recomendar, entre otros aspectos, el TAD como estrategia por defecto en la mayoría de los pacientes y dejar el TAT hasta 1 mes como máximo únicamente para pacientes de alto riesgo isquémico y bajo riesgo hemorrágico34. En definitiva, estas divergencias vienen a subrayar la dificultad del manejo de estos pacientes, la disparidad en las interpretaciones de los estudios disponibles y la imperiosa necesidad de tener más evidencia científica al respecto.
Optimizar el equilibrio entre eficacia y seguridad. Consideraciones prácticas
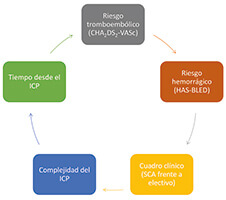
Una vez repasada la evidencia generada por los estudios y las guías de práctica clínica, lo que queda meridianamente claro es la necesidad de realizar una valoración minuciosa y pormenorizada del riesgo individual de cada paciente de sufrir eventos isquémicos, tromboembólicos y hemorrágicos (figura 2). Esta valoración individualizada debe incorporar la evaluación de factores relacionados con el paciente y con el procedimiento realizado.
Figura 2. Variables que deben considerarse al decidir el tratamiento antitrombótico óptimo en los pacientes con fibrilación auricular sometidos a intervencionismo coronario percutáneo. FA: fibrilación auricular; ICP: intervencionismo coronario percutáneo; SCA: síndrome coronario agudo.
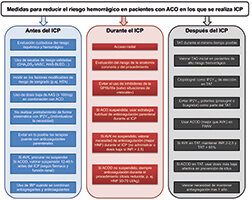
Así pues, existen características clínicas (presentación en forma de SCA, antecedentes de infarto de miocardio o de trombosis de stent, presencia de comorbilidad como diabetes mellitus, insuficiencia renal o enfermedad arterial periférica, etc.), de la anatomía coronaria (enfermedad difusa multivaso) y del ICP (procedimientos complejos con tratamiento de varias lesiones, implante de varios stents o de una gran longitud total, técnicas de 2 stents en bifurcaciones, oclusiones crónicas, etc.) que sugieren un mayor riesgo isquémico y que deben considerarse al optar por regímenes más potentes y más prolongados8,35. La otra cara de la moneda serían aquellos factores que podrían condicionar un mayor riesgo hemorrágico (antecedente de sangrado mayor o ictus hemorrágico, esperanza de vida corta, presencia de anemia, edad avanzada, neoplasia activa, insuficiencia renal grave, fragilidad, etc.) y que, por tanto, deben tenerse en cuenta al optar por estrategias antitrombóticas menos potentes y más cortas. En cuanto al tipo de stent implantado, en la actualidad está demostrada la mayor seguridad de los stents liberadores de fármaco de última generación en los pacientes de alto riesgo hemorrágico24,36, y su uso debe ser generalizado. En cualquier caso, desde el punto de vista práctico, el primer paso en todos los pacientes es considerar y aplicar dentro de lo posible una serie de medidas que contribuyen a minimizar el riesgo de sangrado y que pueden realizarse antes, durante y después del ICP (figura 3).
Figura 3. Medidas que deben tenerse en cuenta para reducir el riesgo hemorrágico en los pacientes con indicación de anticoagulación oral crónica en los que se realiza intervencionismo coronario percutáneo. AAS: ácido acetilsalicílico; ACO: anticoagulación oral; ACOD: anticoagulantes orales de acción directa; AVK: antagonista de la vitamina K; FANV: fibrilación auricular no valvular; GP: glucoproteína; HNF: heparina no fraccionada; HTA: hipertensión arterial; IBP: inhibidor de la bomba de protones; ICP: intervencionismo coronario percutáneo; IP2Y12: inhibidor del receptor P2Y12; TAD: tratamiento antitrombótico doble; TAT: tratamiento antitrombótico triple; TRT: tiempo en rango terapéutico.
Tanto los ensayos clínicos comentados, que han comparado TAT con AVK frente a estrategias de TAD con AVK o ACOD21,26,29, como algunos metanálisis que han agrupado los datos de dichos ensayos37,38, han evidenciado un aumento del riesgo hemorrágico con el uso de TAT sin encontrar un beneficio claro de este régimen en cuanto a reducción de los eventos isquémicos. Sin embargo, existen varias razones por las que no parece justificado, con la evidencia actual, descartar totalmente el TAT en este escenario: 1) ninguno de los ensayos clínicos tenía una potencia estadística suficiente para evaluar de manera adecuada las variables de eficacia (eventos isquémicos y tromboembólicos); 2) otra limitación de estos ensayos fue la inclusión de pacientes con un riesgo relativamente bajo de eventos aterotrombóticos, por lo que puede argüirse que no existen datos suficientes que aseguren la eficacia de los regímenes de TAD en sujetos con un alto riesgo de eventos isquémicos o ictus; y 3) los eventos isquémicos (infarto de miocardio y trombosis del stent) que se producen de manera temprana tras el ICP tienen un peor pronóstico, lo que también iría a favor de no prescindir del TAT al menos en el periodo inicial tras el procedimiento. Por todo ello, la opinión de los autores (en consonancia con las guías europeas) es que, con la evidencia actual, parece aconsejable, siempre tras una evaluación personalizada y muy cuidadosa del riesgo isquémico y del riesgo hemorrágico, una estrategia inicial de TAT durante el mínimo tiempo posible (en el que cada paciente tenga una mayor probabilidad de padecer un evento adverso isquémico) para no aumentar de manera innecesaria el riesgo de sangrado, dejando el TAD como alternativa en aquellos sujetos con un riesgo hemorrágico elevado y superior al isquémico, en los que se considere, por tanto, que no existe una contrapartida clara del uso de TAT para la prevención de eventos aterotrombóticos. Como recomendación práctica, aunque empírica, 1 mes de TAT parece suficiente en la mayoría de los pacientes con ICP en el contexto de una cardiopatía isquémica estable, mientras que en los pacientes con un SCA cabría moverse en un intervalo de entre 1 y 6 meses de TAT, siempre individualizando según el balance ya comentado de riesgos, aunque la duración de 6 meses parece recomendable únicamente para los pacientes con un riesgo de eventos isquémicos francamente elevado.
En lo que respecta a la elección del fármaco anticoagulante, los ACOD, por su mejor perfil de seguridad, parecen los idóneos en un escenario clínico en el que el riesgo de sangrado es muy elevado por la necesaria combinación de fármacos antiagregantes24. En lo que respecta a la dosis de ACOD, en el TAT debe utilizarse la dosis mínima que ha demostrado eficacia para la prevención de ictus en los ensayos de referencia de FA8,24. Este punto es relevante porque cada vez aparecen más evidencias que muestran que utilizar innecesariamente dosis «reducidas» de ACOD (sin cumplir los criterios de ajuste de dosis especificados en la ficha técnica) se asocia con un incremento de los eventos tromboembólicos en el seguimiento39. En el supuesto de escoger dabigatrán, se recomienda usar la dosis de 110 mg durante el TAT y la de 150 mg si el paciente recibe TAD.
En cuanto a los fármacos antiagregantes, el IP2Y12 recomendado para el TAT es claramente el clopidogrel. Pese a que los datos provenientes de los ensayos clínicos sobre la combinación de ACO con un IP2Y12 potente son tremendamente escasos (< 6% en el PIONEER AF-PCI y aproximadamente un 12% de ticagrelor en el RE-DUAL PCI), en algunos estudios observacionales se han apreciado unas tasas de sangrado muy altas con el uso de prasugrel o ticagrelor como parte del TAT40,41. La elección de AAS o de clopidogrel como parte del TAD puede resultar algo más controvertida; si bien las guías muestran su preferencia por clopidogrel como el antiagregante de elección en este contexto, la combinación de AAS y ACO también es válida y puede contemplarse, en especial si se tiene en cuenta que un porcentaje no despreciable de pacientes (aproximadamente el 15-30% en nuestro medio) presentan una respuesta insuficiente al clopidogrel42.
Conclusiones
El paciente con tratamiento anticoagulante que es revascularizado percutáneamente presenta en general un mal pronóstico en el medio y largo plazo, con una alta incidencia de eventos isquémicos, tromboembólicos y hemorrágicos.
A modo de resumen pueden hacerse las siguientes recomendaciones, siempre de forma global, teniendo en cuenta que la complejidad de estos pacientes exigirá siempre una individualización del tratamiento:
- La intensidad y la duración del tratamiento antitrombótico tienen que estar determinadas por el cuadro clínico que establece la revascularización y por los riesgos isquémico, tromboembólico y hemorrágico del paciente. El tipo de stent ha dejado de ser una variable que influya en la decisión del tratamiento antitrombótico de esta población, y la mayoría de los pacientes deberán ser tratados con stents farmacoactivos, por su mayor eficacia respecto a los convencionales y por su mayor seguridad.
- Cuando se opte por el TAT, su duración debe reducirse lo máximo posible y se centrará en el periodo de mayor riesgo isquémico y de trombosis del stent, con el fin de poder minimizar el riesgo hemorrágico. Con la información disponible, parece justificado el uso de TAT en aquellos pacientes en los que se priorice el riesgo isquémico y en los que sea asumible el riesgo hemorrágico.
- En los pacientes en los que se priorice el riesgo hemorrágico sobre el isquémico podrá indicarse TAD (anticoagulación más un único antiagregante, siendo clopidogrel el preferido por las guías de práctica clínica) desde la revascularización.
- El uso de nuevos antiagregantes (prasugrel o ticagrelor) está claramente desaconsejado en esta población. Deben estar contraindicados como parte del TAT (salvo en contadas excepciones) y no hay apenas evidencia sobre su uso en regímenes de TAD.
- El empleo de ACOD en este escenario parece particularmente beneficioso y está recomendado por las guías de práctica clínica más recientes de forma preferente sobre los AVK. Si bien no se dispone de estudios con suficiente potencia estadística como para determinar diferencias en cuanto a eficacia, toda la evidencia orienta a la superioridad de los ACOD como fármacos más seguros y con similar eficacia. Es importante destacar que hay que indicar las dosis de ACOD que hayan demostrado eficacia para la prevención de eventos tromboembólicos en los estudios generales en pacientes con FA.
- Independientemente de las recomendaciones antitrombóticas, deben aplicarse siempre medidas generales relacionadas con el procedimiento con el fin de reducir los eventos hemorrágicos (acceso radial, evitar tratamientos puente cuando sea posible o contraindicar el uso de inhibidores de la glucoproteína IIb/IIIa salvo en situaciones de «rescate»).
Conflicto de intereses
J.M. Ruiz-Nodar declara haber recibido honorarios por ponencias de AstraZeneca, Biosensor, Boston Scientific, Medtronic y Terumo. J.L. Ferreiro declara haber recibido honorarios por ponencias de Eli Lilly Co., Daiichi Sankyo, Inc., AstraZeneca, Roche Diagnostics, Pfizer y Boehringer Ingelheim; por consultoría, de AstraZeneca, Eli Lilly Co. y Ferrer; y becas de investigación de AstraZeneca.
Bibliografía
1. Rohla M, Vennekate CK, Tentzeris I, et al. Long-term mortality of patients with atrial fibrillation undergoing percutaneous coronary intervention with stent implantation for acute and stable coronary artery disease. Int J Cardiol.2015;184;108-114.
2. Almendro-Delia M, Valle-Caballero MJ, Garcia-Rubira JC, et al. Prognostic impact of atrial fibrillation in acute coronary syndromes: results from the ARIAM registry. Eur Heart J Acute Cardiovasc Care. 2014;3:141-148.
3. Ruiz-Nodar JM, Cequier A, Lozano T, et al. Impacto del tipo de hospital en el tratamiento y evolución de los pacientes con síndrome coronario agudo sin elevación del ST. Rev Esp Cardiol. 2010;63:390-399.
4. Ruiz-Nodar JM, Marín F, Hurtado JA, et al. Anticoagulant and antiplatelet therapy use in 426 patients with atrial fibrillation undergoing percutaneous coronary intervention and stent implantation: implications for bleeding risk and prognosis. J Am Coll Cardiol. 2008;51:818-825.
5. Lopes RD, Li L, Granger CB, et al. Atrial fibrillation and acute myocardial infarction: antithrombotic therapy and outcomes. Am J Med. 2012:125:897-905.
6. Connolly S, Pogue J, Hart R, et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet. 2006;367:1903-1912.
7. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37:2893-2962.
8. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39:213-260.
9. Lugo LM, Ferreiro JL. Dual antiplatelet therapy after coronary stent implantation: individualizing the optimal duration. J Cardiol. 2018;72:94-104.
10. Rubboli A, Agewall S, Huber K, Lip GY. New-onset atrial fibrillation after recent coronary stenting: warfarin or non-vitamin K-antagonist oral anticoagulants to be added to aspirin and clopidogrel? A viewpoint. Int J Cardiol. 2015;196:133-138.
11. Sørensen R, Hansen ML, Abildstrom SZ, et al. Risk of bleeding in patients with acute myocardial infarction treated with different combinations of aspirin, clopidogrel, and vitamin K antagonists in Denmark: a retrospective analysis of nationwide registry data. Lancet. 2009;374:1967-1974.
12. Lamberts M, Olesen JB, Ruwald MH, et al. Bleeding after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation. 2012;126:1185-1193.
13. Wustrow I, Sarafoff N, Haller B, et al. Real clinical experiences of dual versus triple antithrombotic therapy after percutaneous coronary intervention. Catheter Cardiovasc Interv. 2018;92:1239-1246.
14. Kawai H, Watanabe E, Yamamoto M, et al. Major bleeding complications related to combined antithrombotic therapy in atrial fibrillation patients 12 months after coronary artery stenting. J Cardiol. 2015;65:197-202.
15. Schömig A, Neumann FJ, Kastrati A, et al. A randomized comparison of antiplatelet and anticoagulant therapy after the placement of coronary-artery stents. N Engl J Med. 1996;334:1084-1089.
16. Leon MB, Baim DS, Popma JJ, et al. A clinical trial comparing three antithrombotic-drug regimens after coronary-artery stenting. Stent Anticoagulation Restenosis Study Investigators. N Engl J Med. 1998;339:1665-1671.
17. Urban P, Macaya C, Rupprecht HJ, et al. Randomized evaluation of anticoagulation versus antiplatelet therapy after coronary stent implantation in high-risk patients: the multicenter aspirin and ticlopidine trial after intra-coronary stenting (MATTIS). Circulation. 1998;98:2126-2132.
18. Bertrand ME, Legrand V, Boland J, et al. Randomized multicenter comparison of conventional anticoagulation versus antiplatelet therapy in unplanned and elective coronary stenting. The full anticoagulation versus aspirin and ticlopidine (fantastic) study. Circulation. 1998;98:1597-1603.
19. Brener SJ, Kirtane AJ, Stuckey TD, et al. The Impact of Timing of Ischemic and Hemorrhagic Events on Mortality After Percutaneous Coronary Intervention: The ADAPT-DES Study. JACC Cardiovasc Interv. 2016;9:1450-1457.
20. Secemsky EA, Matteau A, Yeh RW, et al. Comparison of Short- and Long-Term Cardiac Mortality in Early Versus Late Stent Thrombosis (from Pooled PROTECT Trials). Am J Cardiol. 2015;115:1678-1684.
21. Dewilde WJ, Oirbans T, Verheugt FW, et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet. 2013;381:1107-1115.
22. Fiedler KA, Maeng M, Mehilli J, et al. Duration of Triple Therapy in Patients Requiring Oral Anticoagulation After Drug-Eluting Stent Implantation: The ISAR-TRIPLE Trial. J Am Coll Cardiol. 2015;65:1619-1629.
23. Capodanno D, Lip GY. Triple therapy for atrial fibrillation and ACS with or without PCI: don’t drop aspirin just yet. J Am Coll Cardiol. 2015;65:515-516.
24. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
25. Lip GYH, Collet JP, Haude M, et al. 2018 Joint European consensus document on the management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous cardiovascular interventions: a joint consensus document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). Europace. 2018. https://doi.org/10.1093/europace/euy174
26. Gibson CM, Mehran R, Bode C, et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med. 2016;375:2423-2434.
27. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365:883-891.
28. Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J. 2018:39:1330-1393.
29. Cannon CP, Bhatt DL, Oldgren J, et al. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med. 2017;377:1513-1524.
30. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139-1151.
31. Lopes RD, Heizer G, Aronson R, et al. Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. N Engl J Med. 2019. https://doi.org/10.1056/NEJMoa1817083
32. Vranckx P, Lewalter T, Valgimigli M, et al. Evaluation of the safety and efficacy of an edoxaban-based antithrombotic regimen in patients with atrial fibrillation following successful percutaneous coronary intervention (PCI) with stent placement: rationale and design of the ENTRUST-AF PCI trial. Am Heart J. 2018;196:105-112.
33. Levine GN, Bates ER, Bittl JA, et al. 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines. Am Coll Cardiol. 2016;68:1082-1115.
34. Angiolillo DJ, Goodman SG, Bhatt DL, et al. Antithrombotic Therapy in Patients With Atrial Fibrillation Treated With Oral Anticoagulation Undergoing Percutaneous Coronary Intervention. A North American Perspective – 2018 Update. Circulation. 2018;138:527-536.
35. Giustino G, Chieffo A, Palmerini T, et al. Efficacy and Safety of Dual Anti-platelet Therapy After Complex PCI. J Am Coll Cardiol. 2016;68:1851-1864.
36. Urban P, Meredith IT, Abizaid A, et al. Polymer-free drug-coated coronary stents in patients at high bleeding risk. N Engl J Med. 2015;373:2038-2047.
37. Cavallari I, Patti G. Meta-Analysis Comparing the Safety and Efficacy of Dual Versus Triple Antithrombotic Therapy in Patients With Atrial Fibrillation Undergoing Percutaneous Coronary Intervention. Am J Cardiol. 2018;121:718-724.
38. Golwala HB, Cannon CP, Steg PG, et al. Safety and efficacy of dual vs. triple antithrombotic therapy in patients with atrial fibrillation following percutaneous coronary intervention: a systematic review and meta-analysis of randomized clinical trials. Eur Heart J. 2018;39:1726-1735a.
39. Yao X, Shah ND, Sangaralingham LR, Gersh BJ, Noseworthy PA. Non-Vi-tamin K Antagonist Oral Anticoagulant Dosing in Patients With Atrial Fibrillation and Renal Dysfunction. J Am Coll Cardiol. 2017;69:2779-2790.
40. Sarafoff N, Martischnig A, Wealer J, et al. Triple therapy with aspirin, prasugrel, and vitamin K antagonists in patients with drug-eluting stent implantation and an indication for oral anticoagulation. J Am Coll Cardiol. 2013;61:2060-2066.
41. Verlinden NJ, Coons JC, Iasella CJ, Kane-Gill SL. Triple Antithrombotic Therapy With Aspirin, IP2Y12 Inhibitor, and Warfarin After Percutaneous Coronary Intervention: An Evaluation of Prasugrel or Ticagrelor Versus Clopidogrel. J Cardiovasc Pharmacol Ther. 2017;22:546-551.
42. Angiolillo DJ, Ferreiro JL. Platelet adenosine diphosphate P2Y12 receptor antagonism: benefits and limitations of current treatment strategies and future directions. Rev Esp Cardiol. 2010;63:60-76.