RESUMEN
Introducción y objetivos: Existe un creciente interés en el desarrollo de dispositivos para el tratamiento de la insuficiencia mitral (IM) de forma mínimamente invasiva. Para este propósito, disponer de un modelo experimental que reproduzca las condiciones de la enfermedad sería de gran utilidad. Nuestro objetivo fue validar un modelo experimental de IM en cerdos.
Métodos: Para esta fase de creación del modelo se han utilizado 3 cerdos de raza large white, de 2 meses de edad y un peso de 25 ± 3 kg. Se provocó un infarto en el territorio de la arteria circunfleja que afectó la perfusión del músculo papilar posteromedial, y posteriormente se sometió al animal a una sobrecarga de volumen mediante creación de un shunt arteriovenoso, con la conexión de la aorta y la pulmonar mediante un tubo de dacrón. Se realizó análisis mediante ecocardiografía y resonancia magnética antes de la intervención y a las 8 semanas, y posteriormente el animal fue eutanasiado para realizar el estudio anatomopatológico.
Resultados: De los 3 cerdos, 1 falleció durante la intervención por fibrilación ventricular y los otros 2 sobrevivieron al procedimiento y fueron eutanasiados como estaba previsto a las 8 semanas. En ambos se produjo un infarto transmural, uno lateral y otro posteroinferior, con IM moderada secundaria. Las dimensiones y los volúmenes ventriculares aumentaron, y la contractilidad global se mantuvo a pesar de las alteraciones segmentarias.
Conclusiones: El modelo experimental de IM crónica basado en el daño isquémico del músculo papilar posteromedial asociado a una sobrecarga de volumen es factible, seguro y reproducible, y puede ser de gran utilidad para comprobar la seguridad y la eficacia de los futuros dispositivos para el tratamiento de esta afección.
Palabras clave: Insuficiencia mitral. Modelo experimental. Modelo porcino.
ABSTRACT
Introduction and objectives: There is great interest in the development of devices for the percutaneous management of mitral regurgitation (MR). For this reason, having an experimental model that reproduces the conditions of the disease is of great importance. Our objective was to validate an experimental model of MR in a porcine model.
Methods: For the model creation phase 3, 2-month-old 25 ± 3 kg large white pigs were used. An acute myocardial infarction was caused in the circumflex artery territory that hampered the perfusion of the posteromedial papillary muscle. Then, volume overload was induced in the animal by creating an arteriovenous shunt and connecting the aorta and the pulmonary artery using a Dacron tube. Echocardiography and magnetic resonance imaging were performed before the intervention and on week 8. Afterwards, the animal was euthanized to conduct the pathological study.
Results: One out of the 3 pigs died during the intervention due to ventricular fibrillation. The remaining 2 pigs survived the procedure and were euthanized as scheduled on week 8. In both cases a transmural infarction occurred, 1 at lateral level and the other one at posteroinferior level with moderate secondary mitral regurgitation. Ventricular dimensions and volumes increased and the overall contractility was maintained despite segmental alterations.
Conclusions: The experimental model of chronic MR based on the ischemic damage of the posteromedial papillary muscle associated with volume overload is feasible, safe and reproducible. Also, it can be very useful to test the safety and efficacy of future devices for the management of this condition.
Keywords: Mitral regurgitation. Experimental model. Porcine model.
Abreviaturas
IM: insuficiencia mitral.
INTRODUCCIÓN
La cirugía valvular mitral es el tratamiento estándar de los pacientes con insuficiencia mitral (IM) grave que cumplen los criterios y las indicaciones propuestos en las guías de práctica clínica1. Sin embargo, casi un 50% de los pacientes remitidos a cirugía no son operados2,3, debido fundamentalmente a la presencia de comorbilidad, disfunción del ventrículo izquierdo o la edad4. En estos casos, el tratamiento mediante técnicas transcatéter se ha convertido en una alternativa válida.
Debido a la gran complejidad de la válvula mitral, existen numerosos dispositivos en investigación para poder reducir el grado de insuficiencia de forma transcatéter5,6. De todos estos dispositivos, muy pocos han alcanzado aplicación en el tratamiento de pacientes, y de ellos, solo el MitraClip, que está inspirado en la técnica de Alfieri, ha demostrado una amplia utilidad clínica7-9.
Por ello, es de gran relevancia disponer de un modelo animal de IM para poder comprobar la seguridad, la eficacia y la respuesta tisular de estos nuevos dispositivos en un escenario lo más similar posible a las futuras situaciones clínicas. Nuestro objetivo fue valorar la factibilidad de la creación de un modelo experimental de IM que reproduzca las condiciones reales con grados aceptables de seguridad y eficacia.
MÉTODOS
Modelo animal
Se han descrito en la literatura diversos modelos experimentales para producir una IM, que van desde la provocación de un daño isquémico mediante la oclusión selectiva de la circunfleja acompañado de la rotura de una cuerda mitral10, la producción de isquemia combinada de la circunfleja y la coronaria derecha11, o la producción de isquemia selectiva de las arterias marginales que irrigan el músculo papilar12. Un grupo español estudió la influencia del infarto auricular en la IM isquémica y el remodelado auricular y ventricular mediante la oclusión de la circunfleja antes o después del origen de la rama auricular13. Los modelos basados únicamente en la producción de daño isquémico produjeron IM de grado moderado, y solo en el modelo de Cui et al.10, que asociaba una rotura de cuerdas con la consiguiente sobrecarga volumétrica, se producía una regurgitación grave. Nuestro grupo ha diseñado un nuevo modelo de producción de IM mediante la asociación de un daño isquémico y la creación de un shunt aortopulmonar como mecanismo de sobrecarga volumétrica.
En este estudio experimental se han utilizado para la creación del modelo 3 cerdos domésticos, raza large White, de 2 meses de edad y 25 ± 3 kg de peso. Todos los procedimientos se realizaron de acuerdo con la regulación legal nacional (Real Decreto 53/2013, de 1 de febrero, sobre estándares básicos para la protección de animales de experimentación) y la Directiva Europea 2010/63/UE.
Los estudios ecocardiográficos se efectuaron con un equipo Vivid I GE, con sonda cardiaca sectorial 3S (1,5-4 MHz), realizando cortes paraesternales largos, paraesternal en el eje corto y apicales de 4 cámaras.
El estudio por resonancia se llevó a cabo con un equipo Signa HDx 3.0 T GE mediante secuencias multifarias balanceadas FIESTA en los planos cardiacos específicos (de 2, 3 y 4 cámaras, y en el eje corto) para evaluación de la anatomía y la funcionalidad cardiaca. Todas las imágenes se procesaron con el software ReportCard 4.0.
Concepción del modelo experimental
Procedimiento anestésico para la realización de la intervención destinada a producir IM y estudio mediante resonancia magnética
El día de la intervención quirúrgica se administró una premedicación anestésica consistente en una combinación de midazolam (0,35 mg/kg, Midazolam Normon, Normon), ketamina (5 mg/kg, Imalgene 1000, Merial) y metadona (0,1 mg/kg, Semfortan, Dechra) aplicada por vía intramuscular. Una vez comprobada la correcta sedación, se procedió a una preoxigenación con mascarilla con oxígeno al 100%. A continuación, se realizó la venoclisis en la vena auricular marginal con un catéter endovenoso de 20 GA, y se administró fluidoterapia de mantenimiento con Ringer lactato a un ritmo de infusión de 10 ml/kg por hora. La inducción anestésica se realizó con propofol (2-4 mg/kg, Propovet, Esteve), tras lo cual se hizo una intubación traqueal convencional. El mantenimiento anestésico se mantuvo con sevoflurano (Sevorane, Abbot) a 1-1,5 CAM. Como agente analgésico intraoperatorio se usó un bolo intravenoso lento de 5 µg/kg de fentanilo (Fentanest, Janssen), seguido de infusión continua a dosis de 6 µg/kg por hora durante todo el procedimiento, aplicando dosis de rescate en caso necesario.
Previamente a la toracotomía se administró como bloqueante neuromuscular atracurio (Tracrium, Glaxo SmithKline) a dosis de 0,25 mg/kg por vía intravenosa, dosis que fue repetida a los 30 minutos en caso necesario.
Como medida adicional de analgesia, antes de la toracotomía se realizó un bloqueo intercostal con bupivacaína al 0,5% (Buvacaína, Braun), a dosis de 2 mg/kg, en 5 puntos: en el espacio intercostal del abordaje quirúrgico, dos espacios craneales y dos caudales a este.
El tratamiento anticoagulante administrado fue heparina sódica a dosis de 200 UI/kg por vía intravenosa, y como terapia antiarrítmica se empleó una infusión de amiodarona (Trangorex, Sanofi-Aventis) a dosis de 5 mg/kg por hora.
Se aplicó ventilación controlada por volumen durante el procedimiento. Los parámetros ventilatorios utilizados fueron: fracción inspirada de oxígeno de 0,4, volumen corriente de 10 ml/kg, controlando la presión máxima inspiratoria y ajustando la frecuencia respiratoria en función del volumen por minuto y la presión parcial de dióxido de carbono, relación entre tiempo inspiratorio y espiratorio 1:2-1:3 (en función de la oxigenación arterial y de las presiones arteriales), tiempo de pausa inspiratoria del 10% y presión positiva al final de la espiración de 4, pasando a 8 de forma gradual tras la toracotomía. Se realizaron maniobras de reclutamiento alveolar cada 20 minutos para evitar el colapso alveolar y las atelectasias.
Se monitorizaron las constantes vitales cada 10 minutos y se realizaron gasometrías arteriales con medición de parámetros durante el procedimiento.
En el posoperatorio inmediato se administraron 1,6 mg/kg de furosemida (Seguril, Aventis) y 4 mg/kg de carprofeno (Rimadyl, Pfizer) por vía intravenosa. Como medida analgésica posoperatoria se usó fentanilo transdérmico (Durogesic, Janssen) a dosis de 50 µg/h las primeras 72 horas, seguido de buprenorfina (Buprex, Life) a dosis de 0,01 mg/kg por vía subcutánea cada 8 horas durante 3 días. Asimismo, se administraron carprofeno (Rimadyl) a dosis de 4 mg/kg cada 24 horas por vía oral como terapia antiinflamatoria durante 5 días y amoxicilina-ácido clavulánico (Synulox, Pfizer) a dosis de 20 mg/kg cada 12 horas por vía oral como terapia antibiótica durante 9 días.
El protocolo para la realización de la resonancia magnética consistió en la administración, el día del procedimiento, de premedicación anestésica: una combinación de midazolam (0,35 mg/kg, Midazolam Normon) y ketamina (5 mg/kg, Imalgene 1000) por vía intramuscular. Una vez comprobada la correcta sedación de los animales, fueron trasladados a la zona de preparación y se procedió a una preoxigenación con mascarilla con oxígeno al 100%. A continuación, se realizó la venoclisis en la vena auricular marginal con un catéter endovenoso de 20 GA. Para la inducción anestésica se administró propofol (2-4 mg/kg, Propovet), tras lo cual se realizó la intubación traqueal convencional. El mantenimiento anestésico se llevó a cabo con sevoflurano (Sevorane) a 1-1,5 CAM.
La ventilación mecánica se hizo con los mismos parámetros que durante el procedimiento, con monitorización periódica de las constantes vitales y gasometrías arteriales.
Producción del infarto en el territorio de la arteria circunfleja
Tras la anestesia del animal se procedió a la apertura del tórax y la disección del pericardio para acceder a la arteria coronaria circunfleja y producir el infarto en esta mediante una ligadura quirúrgica. Previamente se comprobó mediante inyección de contraste y estudio ecocardiográfico qué ramas de esta irrigaban el músculo papilar posteromedial. Una vez identificadas, se procedió a la ligadura, intentando ocluir las arterias obtusas marginales 2 y 3 para no inducir una IM masiva.
Creación de un shunt arteriovenoso
Tras el infarto se procedió a la sobrecarga de volumen mediante la creación de un shunt arteriovenoso, que se llevó a cabo conectando una rama de la arteria pulmonar con la aorta usando un tubo de dacrón. Este procedimiento se realizó con clampaje y sin circulación extracorpórea.
Una vez realizados los procedimientos, se cerró el tórax y se trasladó el cerdo al animalario para su control y cuidado.
Seguimiento
La presencia de IM, así como el efecto en el remodelado cardiaco, se evaluaron mediante ecocardiografía y resonancia magnética a las 8 semanas del procedimiento y mediante ventriculografía en el momento de la eutanasia.
Se clasificó el grado de IM por ecografía utilizando métodos semicuantitativos (estimación de área de color, vena contracta). En estos estudios ecográficos y en los de resonancia magnética se midieron los volúmenes de las cámaras cardiacas (diámetros y volúmenes de los ventrículos izquierdo y derecho, diámetros y volúmenes de la aurícula izquierda) y su función.
Estudio anatomopatológico
A las 8 semanas se realizó la eutanasia de los animales, siguiendo las directrices del RD 53/2013 sobre protección animal.
Se llevó a cabo una necropsia completa, ordenada y sistemática de cada uno de los animales, con el fin de identificar y diagnosticar posibles patologías asociadas al procedimiento, y se obtuvieron muestras que se fijaron en formol tamponado al 10% para su estudio histopatológico. En el estudio macroscópico del corazón se recogió el peso y se examinaron las cavidades, las paredes, los músculos papilares, las cuerdas tendinosas, el anillo y los velos valvulares, y se documentaron mediante fotografías las posibles anomalías observadas en estas estructuras. Después se recogieron los velos desde su punto de inserción hasta su borde libre, incluyendo las cuerdas tendinosas, y fueron fijadas en formol tamponado al 10% e incluidas en parafina para su estudio histopatológico. Se tiñeron secciones seriadas de 3 µm de grosor con la técnica habitual de hematoxilina y eosina; con elastina de Van Gieson para evaluar tanto fibras elásticas como colágenas; con tricrómico de Masson para la diferenciación de fibras musculares y colágenas; y con PAS-azul alcián para la detección de mucopolisacáridos. Los cambios histopatológicos identificados fueron evaluados de manera semicuantitativa estableciendo grados de daño.
Una vez obtenidos los velos, con el objetivo de caracterizar el infarto se realizaron 4 cortes transversales, desde el vértice del corazón hasta la base, que se pesaron y tiñeron mediante la tinción histoquímica trifeniltetrazolio, que permite distinguir el área viable (color rojo) de la región necrosada (color blanco). Para ello, los niveles establecidos se sumergieron en una solución al 1% de cloruro de trifeniltetrazolio (Sigma-Aldrich) en tampón fosfato salino a pH 7,4, durante 5-10 minutos a 37 °C, y a continuación se introdujeron en formol tamponado al 10%. Las secciones fueron fotografiadas y las áreas se midieron con el sistema ImageJ. De cada nivel se recogieron muestras del área de infarto, límite y área no infartada, que fueron incluidas en parafina y teñidas con hematoxilina y eosina, y con tricrómico de Masson, con el fin de caracterizar el daño isquémico.
RESULTADOS
El primer animal falleció durante el procedimiento, debido a una fibrilación ventricular sin respuesta; los otros dos completaron el seguimiento planteado de 8 semanas sin complicaciones.
Estudio ecocardiográfico
Animal 1
Los datos del estudio ecocardiográfico basal y a las 8 semanas en el eje paraesternal largo y en cortes apicales de 4 cámaras se recogen en la tabla 1. En el estudio basal, los grosores ventriculares a nivel anteroseptal fueron de 10,6 mm y a nivel posteroinferior fueron de 9 mm. La válvula mitral era morfológicamente normal, con velos finos de movimiento normal, sin que se apreciara regurgitación por Doppler color. A las 8 semanas se observaron alteraciones segmentarias de la contractilidad de tipo hipocinesia grave en los 3 segmentos de la cara lateral, con hipercontractilidad del resto de los segmentos, una válvula mitral con velo posterior engrosado y con disminución de la motilidad, y regurgitación mitral moderada en forma de chorro de regurgitación excéntrico dirigido posteriormente.
Tabla 1. Datos del estudio ecocardiográfico basal y a las 8 semanas del animal 1
| DTDVI (mm) | DTSVI (mm) | FA (%) | FE (%) | Área color (cm2) | Vena contracta (mm) | |
|---|---|---|---|---|---|---|
| Basal | 46 | 30 | 34 | 62 | 0 | 0 |
| 8 semanas | 49 | 32 | 34 | 60 | 4 | 4 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FA: fracción de acortamiento; FE: fracción de eyección. |
||||||
Animal 2
Los datos del estudio ecocardiográfico basal y a las 8 semanas se muestran en la tabla 2. En el estudio basal, los grosores ventriculares a nivel anteroseptal fueron de 9 mm y a nivel posteroinferior fueron de 6 mm. La válvula mitral era morfológicamente normal, con velos finos de movimiento normal, sin que se apreciara regurgitación por Doppler color. A las 8 semanas se apreciaban alteraciones de la contractilidad en los segmentos basal y medio en la cara posterior, válvula mitral con engrosamiento de ambos velos y regurgitación mitral moderada en forma de chorro regurgitante central.
Tabla 2. Datos del estudio ecocardiográfico basal y a las 8 semanas del animal 2
| DTDVI (mm) | DTSVI (mm) | FA (%) | FE (%) | Área color (cm2) | Vena contracta (mm) | |
|---|---|---|---|---|---|---|
| Basal | 44 | 28 | 36 | 65 | 0 | 0 |
| 8 semanas | 47 | 30 | 36 | 63 | 6 | 5 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FA: fracción de acortamiento; FE: fracción de eyección. |
||||||
Resonancia magnética
El estudio basal mostró unos ventrículos de dimensiones, grosores y contractilidad global y segmentaria normales para nuestro laboratorio en poblaciones similares.
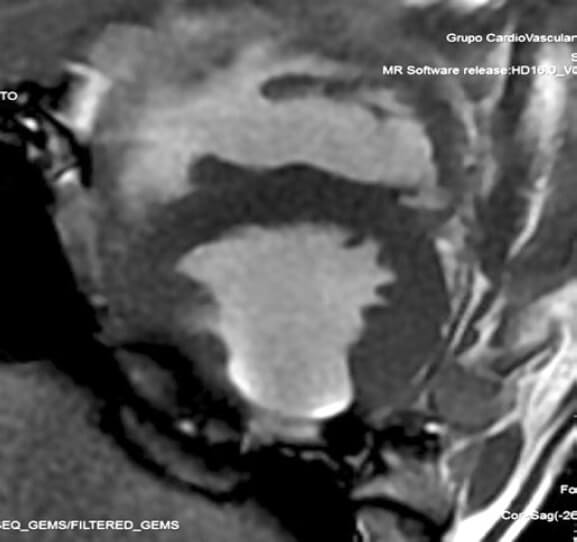
El estudio a las 8 semanas reveló alteraciones segmentarias de la contractilidad y adelgazamiento de la pared lateral y transformación grasa posterior en el cerdo 1, y a nivel posteroinferior en el cerdo 2 (figura 1). Los volúmenes ventriculares crecieron un 10 y un 7%, respectivamente.
Figura 1. Resonancia magnética del animal 2. Eje corto del ventrículo izquierdo. Se aprecia transformación grasa a nivel posterior.
Los valores recogidos mediante este estudio se muestran en la tabla 3 y la tabla 4.
Tabla 3. Datos del estudio por resonancia basal y a las 8 semanas del animal 1
| DTDVI (mm) | DTSVI (mm) | VTDVI (ml) | VTSVI (ml) | FE (%) | Aurículaizquierda (cm2) | |
|---|---|---|---|---|---|---|
| Basal | 46 | 31 | 68 | 29 | 57 | 12 |
| 8 semanas | 49 | 32 | 75 | 30 | 60 | 14 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FE: fracción de eyección; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo. |
||||||
Tabla 4. Datos del estudio por resonancia basal y a las 8 semanas del animal 2
| DTDVI (mm) | DTSVI (mm) | VTDVI (ml) | VTSVI (ml) | FE (%) | Aurículaizquierda (cm2) | |
|---|---|---|---|---|---|---|
| Basal | 42 | 29 | 58 | 29 | 50 | 10 |
| 8 semanas | 44 | 31 | 62 | 30 | 52 | 11 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FE: fracción de eyección; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo. |
||||||
Estudio anatomopatológico
Animal 1
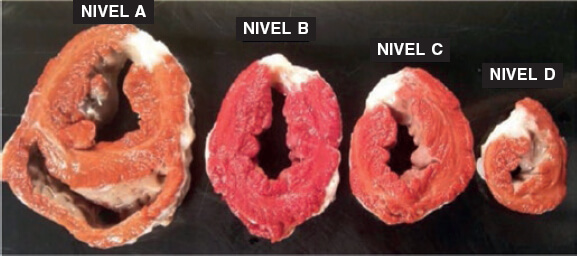
En el examen macroscópico se observó un área de infarto en la cara lateral que se extendía desde el nivel apical al basal. El empleo de trifeniltetrazolio determinó que se trataba de un infarto transparietal (figura 2), cuyo tamaño aparece recogido en la tabla 1 del material adicional, junto al peso de cada nivel.
Figura 2. Animal 1. Presencia de áreas de infarto transparietal desde el nivel basal (A) hasta el apical (D). Tinción de trifeniltetrazolio.
La válvula mitral presentaba un velo posterior engrosado, mientras que el anterior no estaba afectado. Microscópicamente, en el velo posterior se apreció un engrosamiento focal, con incremento del depósito de mucopolisacáridos y vascularización de la parte proximal, con reducción distal del número de vasos. Las áreas de infarto se caracterizaban histológicamente por la presencia de tejido conjuntivo maduro, entre el que se disponían islotes de fibras musculares cardiacas y células inflamatorias.
Animal 2
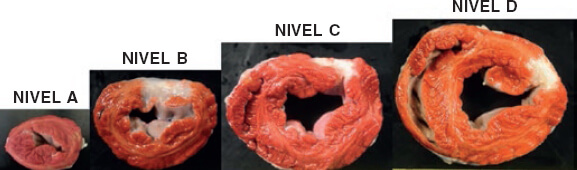
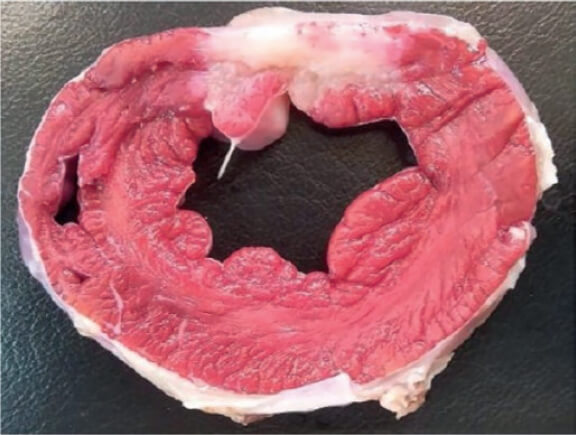
La evaluación macroscópica puso de manifiesto la presencia de un área de infarto transparietal en la cara posterior que afectaba a los segmentos medios y basales (figura 3), así como al músculo papilar (figura 4). La extensión de esta lesión en los diferentes niveles se muestra en la tabla 2 del material adicional.
Figura 3. Animal 2. Presencia de áreas de infarto transparietal que se extienden desde el nivel medio (B) hasta el basal (D). Tinción de trifeniltetrazolio.
Figura 4. Lesión del músculo papilar. Parte inferior del nivel C. Tinción de trifeniltetrazolio.
En el examen macroscópico, la válvula mitral presentaba velos engrosados, con hemorragias en su superficie atrial (figura 1A del material adicional). Histológicamente, además de las hemorragias citadas, ambos velos mostraban engrosamiento por depósito de mucopolisacáridos, sobre todo en la capa media (figura 1B,C del material adicional). También se observaron vasos de pequeño calibre junto con una leve respuesta inflamatoria (figura 2 del material adicional). Las áreas de infarto se caracterizaban por la presencia de tejido conjuntivo maduro entre el que se disponían islotes de fibras musculares cardiacas con características similares a las descritas en el animal 1.
DISCUSIÓN
Nuestro grupo ha desarrollado un modelo experimental porcino seguro y factible para producir IM isquémica tras provocar un infarto, asociada a sobrecarga de volumen mediante shunt aortopulmonar.
En la actualidad existen diversas publicaciones sobre modelos experimentales, en cerdo y oveja fundamentalmente, destinados a la producción y el mantenimiento de IM. Todos ellos tienen ventajas e inconvenientes, y remedan diversas etiologías de IM, desde la miocardiopatía dilatada hasta la rotura de cuerdas, pasando por la IM isquémica.
En el modelo de IM isquémica, Llaneras et al.14 consiguieron producir IM en ovejas mediante la ligadura de las arterias obtusas marginales. Los autores demostraron que para la aparición de este evento es preciso que concurran dos condiciones: una, que se infarte el músculo papilar, y otra, que el ventrículo se dilate. Ninguna de las condiciones por separado lo produciría. En sus resultados, la ligadura de las marginales 2 y 3 daba lugar a una IM que se desarrollaba paulatinamente, mientras que la ligadura de las marginales 2, 3 y además la posterolateral llevaría a una IM masiva, con alta letalidad.
Este modelo ha sido modificado posteriormente mediante la producción de IM por rotura de una cuerda tendinosa y la asociación de un evento isquémico en el territorio de la circunfleja por medio de la implantación de un aneroide10. Esto producía una lesión isquémica con disfunción del músculo papilar a la vez que una sobrecarga de volumen. Sin embargo, la rotura no controlada de cuerdas tendinosas puede conllevar una alta mortalidad en los animales al producirse una IM masiva, que suele ser mal tolerada. En este estudio no se detallan los eventos adversos de los animales ni si alguno falleció durante el procedimiento.
En vista de los pros y los contras de los modelos descritos, nuestro objetivo fue crear un modelo sostenible de IM isquémica, que a la luz de la literatura parece ser reproducible. Para ello, teniendo en cuenta lo descrito en estudios previos, el modelo de daño isquémico del músculo papilar posteromedial asociado a una sobrecarga de volumen parece el más seguro y efectivo. Dado que la sobrecarga de volumen mediante la rotura de una cuerda o la producción de un gran infarto puede llevar a una IM masiva y un deterioro grave del animal, nuestra intención fue crear un shunt arteriovenoso como forma segura de inducir la sobrecarga de volumen, pues trabajos previos han demostrado que la creación de un shunt sistémico pulmonar produce un remodelado biventricular15.
En nuestro estudio produjimos un infarto agudo de miocardio de pequeño tamaño, probablemente por la oclusión aislada de las arterias coronarias obtusas marginales. Otros autores ocluyeron las marginales junto con la posterolaterales, lo cual produjo infartos agudos de miocardio de mayor tamaño, pero con el precio de un significativo aumento de la mortalidad, motivo por el cual en nuestro estudio se optó por ocluir solo las marginales.
Puede que el pequeño tamaño del infarto agudo de miocardio haya sido la causa de que la IM fuera solo de grado moderado, con un remodelado ventricular discreto (incremento de un 10 y un 7% en los cerdos 1 y 2) a pesar de las alteraciones segmentarias de la contractilidad, aunque no se puede descartar que un shunt arteriovenoso de insuficiente magnitud pueda haber contribuido a este hecho.
Por último, es destacable que en este modelo se produce una etiología mixta de la regurgitación mitral: los análisis anatomopatológicos revelaron anomalías morfológicas en los velos mitrales, por lo que la regurgitación no sería, en sentido estricto, únicamente funcional. Esto abre nuevas hipótesis acerca de la repercusión de una sobrecarga hemodinámica sobre los velos mitrales que puede ir más allá de la dilatación del anillo o la restricción isquémica de su movimiento.
Limitaciones
Las limitaciones de nuestro estudio se derivan fundamentalmente de su pequeño tamaño muestral, lo que dificulta extraer conclusiones definitivas. Sin embargo, consideramos muy útil comunicar un nuevo modelo experimental para producir IM isquémica mediante ligadura coronaria y sobrecarga volumétrica por shunt aortopulmonar, que deberá ser confirmado en estudios posteriores.
Se desconoce el impacto en el remodelado ventricular de la creación del shunt aortopulmonar. Dados los resultados de este trabajo, en futuras fases de estudio de este modelo se plantea analizar la magnitud del shunt y su influencia sobre el remodelado ventricular.
Los infartos creados mediante la ligadura quirúrgica de la circunfleja fueron pequeños. Es probable que la implantación de un coil u otro dispositivo de oclusión en la circunfleja proximal hubiera conseguido infartos de mayor tamaño. En cualquier caso, en el diseño del estudio se planteó el abordaje quirúrgico, ya que era necesaria una toracotomía para la realización del shunt arteriovenoso.
Otra posible limitación puede ser el corto seguimiento de los animales (8 semanas), lo que podría explicar que el proceso de remodelado tras el infarto agudo de miocardio no se hubiera terminado de completar, motivo por el que los volúmenes ventriculares no alcanzaron mayores dimensiones.
CONCLUSIONES
El modelo experimental de IM crónica basado en el daño isquémico del músculo papilar posteromedial asociado a una sobrecarga de volumen es factible, seguro y reproducible en nuestra experiencia inicial. Podría ser de utilidad para comprobar la seguridad y la eficacia de los futuros dispositivos para el tratamiento de esta afección.
FINANCIACIÓN
Este trabajo ha sido financiado parcialmente por una ayuda concedida por la Gerencia Regional de Salud de Castilla y León (GRS1396_A_16).
CONFLICTO DE INTERESES
R. Estévez-Loureiro es proctor de MitraClip y ha recibido una beca de investigación de Abbott Vascular. A. Pérez de Prado ha participado y recibido honorarios en asesorías Boston Scientific e iVascular SL, y en charlas para Abbott, Braun Surgical, Terumo Medical Corporation y Philips Volcano. Los demás autores no reportan conflictos de intereses relacionados con este artículo.
¿QUÉ SE SABE DEL TEMA?
- La IM es la segunda valvulopatía mas frecuente. La cirugía valvular mitral es el tratamiento estándar, pero más del 50% de los pacientes no son operados por su comorbilidad.
- Existen numerosos dispositivos en investigación para poder reducir el grado de insuficiencia de forma transcatéter y diversas publicaciones sobre modelos experimentales, destinados a la producción y el mantenimiento de una IM para probar estos dispositivos. Todos ellos presentan ventajas e inconvenientes, y remedan diversas etiologías de la IM, desde miocardiopatía dilatada, pasando por IM isquémica, hasta la rotura de cuerdas.
- Tras los modelos publicados, parece que para que se produzca un modelo de IM sostenible son necesarias dos condiciones: lesión isquémica con afectación del músculo papilar y dilatación ventricular.
¿QUÉ APORTA DE NUEVO?
- Se describe un nuevo modelo experimental para causar IM isquémica mediante la producción combinada de daño isquémico por oclusión coronaria de las ramas que irrigan el músculo papilar y sobrecarga volumétrica del ventrículo izquierdo con shunt aortopulmonar por implantación de un tubo de dacrón entre la aorta y una rama pulmonar.
- Cabe destacar que ninguno de los animales que sobrevivió al acto quirúrgico murió en el seguimiento, lo que puede constituir un modelo factible y seguro de IM isquémica.
BIBLIOGRAFÍA
1. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
2. Mirabel M, Iung B, Baron G, et al. What are the characteristics of patients with severe, symptomatic, mitral regurgitation who are denied surgery?Eur Heart J. 2007;28:1358-1365.
3. Borger MA, Alam A, Murphy PM, Doenst T, David TE. Chronic ischemic mitral regurgitation:repair, replace or rethink?Ann Thorac Surg. 2006;81:1153-1161.
4. Jamieson WR, Edwards FH, Schwartz M, Bero JW, Clark RE, Grover FL. Risk stratification for cardiac valve replacement. National Cardiac Surgery. Ann Thorac Surg. 1999;67:943-951.
5. Herrmann HC, Maisano F. Transcatheter therapy of mitral regurgitation. Circulation. 2014;130:1712-1722.
6. Maisano F, Alfieri O, Banai S, et al. The future of transcatheter mitral valve interventions:competitive or complementary role of repair vs. replacement?Eur Heart J. 2015;36:1651-1659.
7. Mauri L, Foster E, Glower DD, et al. 4-year results of a randomized controlled trial of percutaneous repair versus surgery for mitral regurgitation. J Am Coll Cardiol. 2013;62:317-328.
8. Nickenig G, Estevez-Loureiro R, Franzen O, et al. Percutaneous Mitral Valve Edge-to-Edge Repair:In-Hospital Results and 1-Year Follow-Up of 628 Patients of the 2011-2012 Pilot European Sentinel Registry. J Am Coll Cardiol. 2014;64:875-84.
9. Maisano F, Franzen O, Baldus S, et al. Percutaneous mitral valve interventions in the real world:early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. J Am Coll Cardiol. 2013;62:1052-1061.
10. Cui YC, Li K, Tian Y, et al. A pig model of ischemic mitral regurgitation induced by mitral chordae tendinae rupture and implantation of an ameroid constrictor. PloS One. 2014;9:e111689.
11. Minakawa M, Robb JD, Morital M, et al. A model of ischemic mitral regurgitation in pigs with three-dimensional echocardiographic assessment. J Heart Valve Dis. 2014;23:713-720.
12. Hamza O, Kiss A, Kramer AM, Tillmann KE, Podesser BK. Characterization of a novel percutaneous closed chest swine model of ischemic mitral regurgitation guided by contrast echocardiography. Eurointervention. 2019. pii:EIJ-D-19-00095.
13. Aguero J, Galan-Arriola C, Fernandez-Jimenez R, et al. Atrial Infarction and Ischemic Mitral Regurgitation Contribute to post-MI Remodeling of the Left Atrium. J Am Coll Cardiol. 2017;70:2878-2889.
14. Llaneras MR, Nance ML, Streicher JT, et al. Large animal model of ischemic mitral regurgitation. Ann Thorac Surg. 1994;57:432-439
15. Pereda D, García-Lunar I, Sierra F, et al. Magnetic Resonance Characterization of Cardiac Adaptation and Myocardial Fibrosis in Pulmonary Hypertension Secondary to Systemic-To-Pulmonary Shunt. Circ Cardiovasc Imaging. 2016;9:e004566.