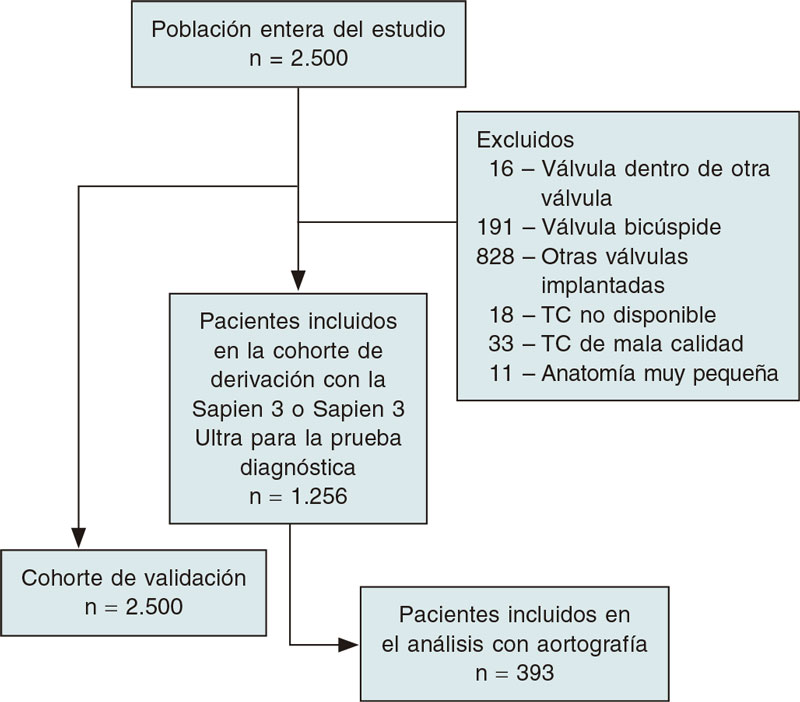
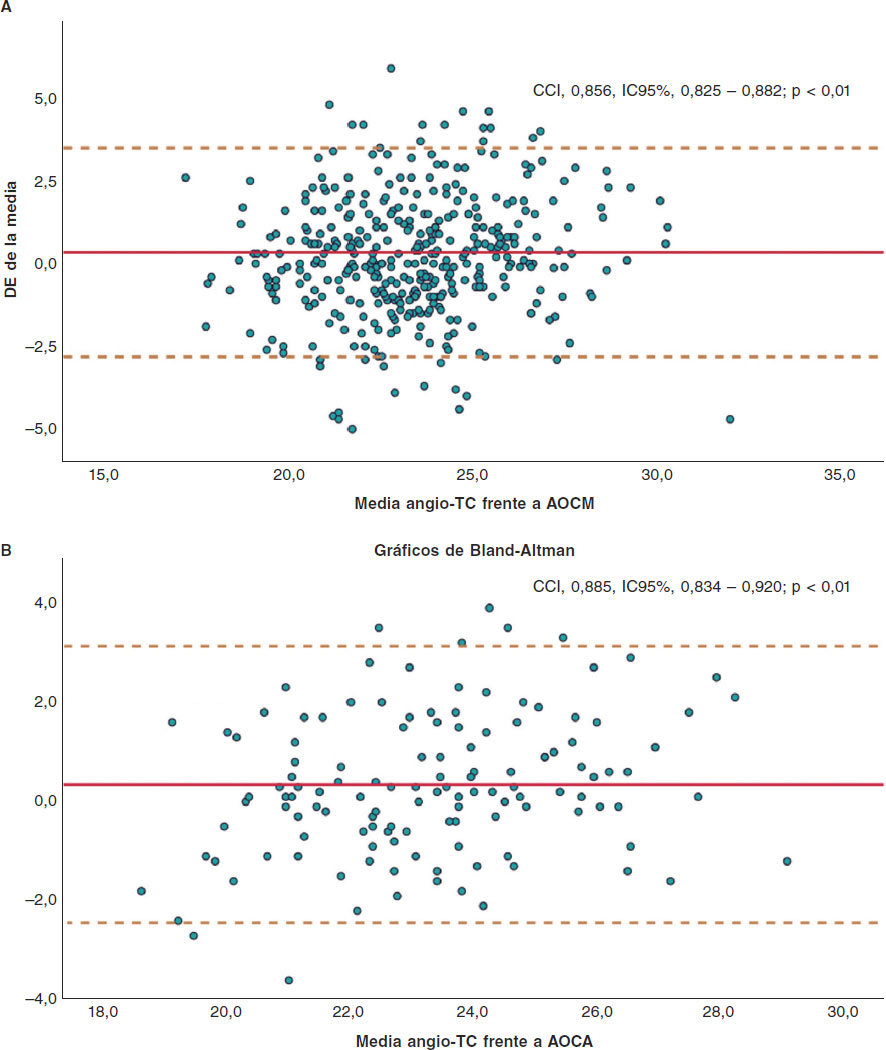
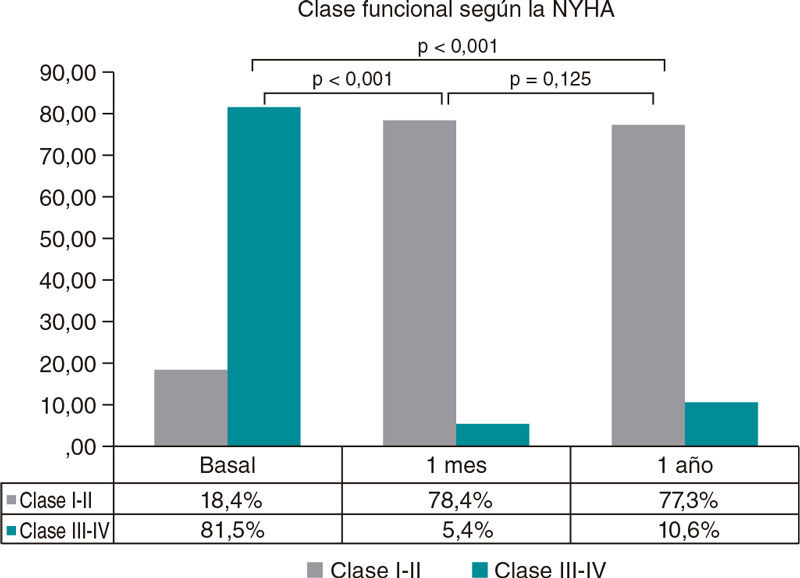
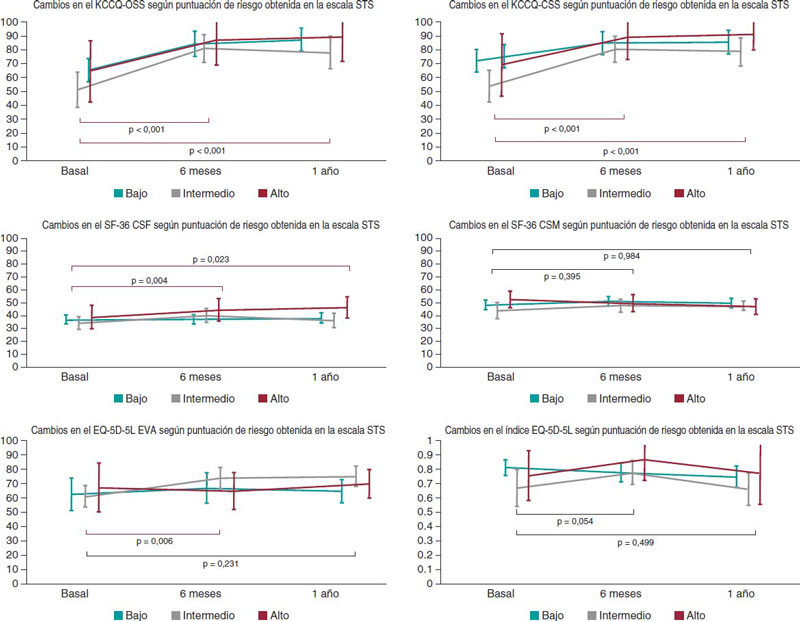
Enfermedad valvular
REC Interv Cardiol. 2019;1:34-40
Cambios morfológicos anulares tras reparación mitral transcatéter: repercusión clínica y relevancia de la etiología
Changes in mitral annular morphology following transcatheter mitral valve repair. Clinical repercussion and importance of etiology
Área del Corazón, Hospital Universitario Central de Asturias, Oviedo, Asturias, España
RESUMEN
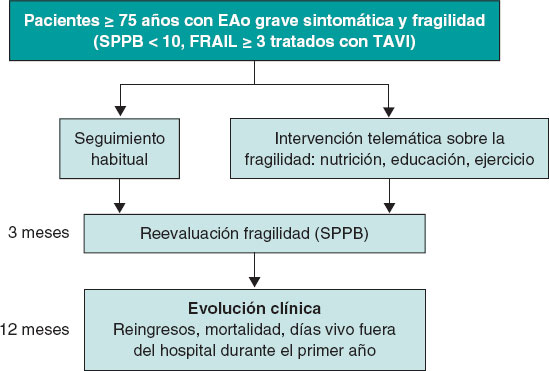
Introducción y objetivos: El implante percutáneo de válvula aórtica (TAVI) constituye un tratamiento de primera línea en la estenosis aórtica (EAo), aunque en pacientes frágiles su beneficio podría ser menor. Para el abordaje de la fragilidad se recomiendan los programas de ejercicio físico y soporte nutricional. No existe experiencia sobre la aplicación de la telemedicina en este contexto. El objetivo de este estudio es analizar, en pacientes mayores con EAo tratados con TAVI, el efecto de una intervención telemática en la reversión de la fragilidad en comparación con el abordaje convencional.
Métodos: Estudio multicéntrico aleatorizado. Se incluirán pacientes ≥ 75 años con EAo grave (gradiente aórtico medio > 40 mmHg o área valvular aórtica < 0,8 cm2 en el ecocardiograma) con criterios de fragilidad basal (Short Physical Performance Battery [SPPB] < 10 y escala FRAIL ≥ 3) tratados con TAVI. Los pacientes serán aleatorizados antes del alta para recibir: a) intervención telemática durante los primeros 3 meses (soporte nutricional + ejercicio físico tutelado + educación sanitaria) o b) abordaje habitual. El criterio de valoración principal será el porcentaje de pacientes con reversión de la fragilidad (SPPB ≥ 10) a los 3 meses. El tamaño muestral planteado es de 206 pacientes (103 en cada rama).
Conclusiones: La hipótesis del estudio es que una intervención telemática permitirá un mayor porcentaje de reversión de la fragilidad a los 3 meses del TAVI en comparación con el seguimiento habitual. Se espera que los resultados de este estudio aporten información novedosa para el abordaje del paciente frágil con EAo tratado con TAVI.
Ensayo registrado en ClinicalTrials.gov (NCT06742970).
Palabras clave: Estenosis aórtica. TAVI. Telemedicina. Fragilidad.
ABSTRACT
Introduction and objectives: Although transcatheter aortic valve implantation (TAVI) is the first-line therapy for aortic stenosis (AS), its benefit could be lower (or even disappear) in frail patients. Physical exercise and nutritional support programs are recommended to address frailty. Data on the application of telemedicine strategies in this context is scarce. The objective of this study is to analyze, in older patients with AS undergoing TAVI, the effect of a telematic intervention on the reversal of frailty vs standard of care.
Methods: We will be conducting a randomized multicenter study including patients aged ≥ 75 years with severe AS (mean aortic gradient > 40 mmHg, or aortic valve area < 0.8 8 cm2 on echocardiogram) with baseline frailty criteria (Short Physical Performance Battery [SPPB ] < 10 and FRAIL scale ≥ 3) undergoing TAVI. Prior to discharge, patients will be randomized to a) a telematic intervention within the first 3 months (nutritional support plus supervised physical exercise plus health education); or b) standard of care. The primary endpoint will be the percentage of patients with frailty reversal (SPPB ≥ 10) at 3 months. The estimated sample size is 206 patients (103 in each arm).
Conclusions: The hypothesis of this study is that telematic intervention will allow a higher percentage of frailty reversal at 3 months vs standard of care after TAVI. The results of this study may provide novel information on this approach to frail patients with AS undergoing TAVI.
ClinicalTrials.gov registered trial (NCT06742970).
Keywords: Aortic stenosis. TAVI. Telemedicine. Frailty.
Abreviaturas
EAo: estenosis aórtica. SPPB: Short Physical Performance Battery. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
La estenosis aórtica (EAo) degenerativa es la valvulopatía más frecuente en los países occidentales, en buena parte por el aumento en la esperanza de vida y el envejecimiento progresivo de la población. El implante percutáneo de válvula aórtica (TAVI) está suponiendo una revolución en el tratamiento de la EAo al haberse documentado su eficacia en pacientes inoperables1, en pacientes de alto riesgo quirúrgico2 y, más recientemente, en pacientes de riesgo bajo o intermedio3,4. Esta evidencia creciente ha motivado un incremento progresivo en el número de procedimientos de TAVI realizados cada año5, generando en el sistema sanitario la necesidad de adaptarse a esta demanda y optimizar los circuitos asistenciales y las estancias hospitalarias6.
La EAo es una condición eminentemente asociada al envejecimiento. La presencia de fragilidad, comorbilidad y otros síndromes geriátricos tiene una fuerte asociación con la incidencia de complicaciones, la necesidad de reingreso y la mortalidad tanto en los pacientes tratados de forma conservadora7 como en los que reciben cirugía8 o TAVI9. La fragilidad y la carga de comorbilidad también se asocian con una mayor incidencia de complicaciones derivadas del procedimiento10, a pesar de que el desarrollo tecnológico de los dispositivos hace que sea una intervención cada vez menos invasiva. Además, datos previos sugieren que en los pacientes con mayor carga de comorbilidad hay una mayor incidencia de reingresos y de mortalidad de causa extracardiaca, lo que condiciona el beneficio del TAVI y hasta lo hace desaparecer en algunos pacientes con más comorbilidad11. Por todo ello, optimizar la selección de los pacientes para evitar la futilidad del procedimiento sigue siendo uno de los retos clínicos más relevantes.
Por otro lado, el fenotipo de fragilidad es un estado de vulnerabilidad ante potenciales estresores externos, que podría ser reversible12,13. En pacientes con enfermedades cardiovasculares, una parte significativa de esta fragilidad se debe a la propia cardiopatía, y por tanto es potencialmente reversible con su tratamiento específico. A pesar de ello, en pacientes con mayor carga de comorbilidad puede resultar difícil saber qué proporción de la fragilidad se debe a otras condiciones de salud. Se ha postulado que el tratamiento del paciente con fragilidad incipiente requiere un abordaje global para su reversión14, incluyendo ejercicio físico, nutrición adecuada y un control estricto de la comorbilidad que puede acelerar el desarrollo de fragilidad. Algunas publicaciones han mostrado que un programa de ejercicio físico puede revertir parcialmente la fragilidad en diferentes escenarios cardiovasculares, incluidos pacientes con EAo15-17. Sin embargo, la implementación de estas estrategias en la práctica clínica se encuentra con grandes obstáculos, tanto por el gasto que supone incluir este perfil de pacientes en constante crecimiento demográfico en programas de rehabilitación cardiaca como por la dificultad para conseguir una adherencia sostenida de los pacientes a estos programas. Experiencias previas muestran una baja adherencia a los programas de ejercicio físico hospitalario (alrededor del 30%), incluso en entornos tan controlados como los de los ensayos clínicos18.
La telemedicina presenta posibles ventajas especialmente evidentes en el tratamiento del paciente mayor con criterios de fragilidad y enfermedad cardiovascular, ya que puede permitir un seguimiento adecuado al evitar barreras logísticas (necesidad de desplazamiento, adherencia subóptima), en particular relevantes en este contexto. Diferentes herramientas relacionadas con la telemedicina han mostrado su utilidad para mejorar el pronóstico de los pacientes con insuficiencia cardiaca19, permitiendo detectar precozmente el desarrollo de descompensaciones y evitar ingresos hospitalarios y otras complicaciones. Sin embargo, no existe experiencia sobre la aplicación de la telemedicina en pacientes frágiles con EAo tratados con TAVI.
Por todo lo anterior, el objetivo principal del ensayo clínico TELE-FRAIL TAVI es analizar, en pacientes con EAo tratados con TAVI, el efecto de una intervención telemática global en la reversión de la fragilidad a los 3 meses de la intervención, en comparación con el abordaje convencional.
MÉTODOS
Diseño
Estudio prospectivo multicéntrico aleatorizado (1:1) que pretende comparar una intervención telemática global sobre la fragilidad frente al abordaje habitual posterior al alta en pacientes con EAo ≥ 75 años y con criterios de fragilidad tratados con TAVI. El estudio está promovido por la Sección de Cardiología Geriátrica de la Sociedad Española de Cardiología y se desarrollará en 20 hospitales españoles, con la participación de cardiólogos clínicos e intervencionistas o geriatras y facultativos expertos en el tratamiento de estos pacientes, así como personal de enfermería entrenado. El ensayo se registró en ClinicalTrials.gov (NCT06742970).
Población de estudio
Serán elegibles aquellos pacientes que cumplan los siguientes criterios de inclusión: a) EAo grave, definida por la presencia de un gradiente aórtico medio > 40 mmHg o un área valvular aórtica < 0,8 8 cm2 en el ecocardiograma; b) edad ≥ 75 años; c) tratados con TAVI durante el ingreso, y d) que cumplan criterios de fragilidad basal (preprocedimiento) definidos por una puntuación < 10 en la Short Physical Performance Battery (SPPB)20 y ≥ 3 en la escala FRAIL (Fatigue, Resistance, Ambulation, Illnesses, Loss of weight)21.
Como criterios de exclusión se considerarán los siguientes: a) negativa a participar en el estudio; b) incapacidad para realizar las pruebas geriátricas o seguir los procedimientos del estudio; c) incapacidad para entender o firmar el consentimiento informado, y d) esperanza de vida < 12 meses.
Además de los criterios definidos, la inclusión del paciente en el estudio y los procedimientos derivados de este deberán ser considerados razonables a criterio del equipo médico responsable del paciente. En caso de que el paciente haya presentado complicaciones durante el ingreso, se habrán tenido que resolver de forma razonable como requisito para ser incluido en el estudio.
Protocolo de tratamiento
Antes de la realización del TAVI se habrá llevado a cabo una evaluación geriátrica basal mediante entrevista con el paciente, la familia o los cuidadores; se hará de manera multidisciplinaria por personal entrenado en los centros participantes en el estudio. La capacidad funcional para las actividades básicas de la vida diaria será evaluada mediante el índice de Barthel22, que se trata de una escala ordinal con una puntuación total de 0 a 100, cuyos rangos ayudan a evaluar los diferentes grados de dependencia: total (0-20), grave (21-40), moderada (41-60), ligera (61-90) e independiente (> 90). Por otra parte, las actividades instrumentales se evaluarán mediante la escala de Lawton y Brody23. El estado cognitivo será evaluado con el test de Pfeiffer24 y con el Mini Mental State Examination25. La fragilidad se determinará con la SPPB20, que incluye: a) equilibrio en tres posiciones (pies juntos, semitándem y tándem); b) velocidad de la marcha (4 m) y c) levantarse y sentarse en una silla 5 veces. La puntuación total de la SPPB es la suma de las 3 puntuaciones, que van de 0 a 12. Una calificación < 10 indica un mayor riesgo de discapacidad y de caídas. La fragilidad también se evaluará mediante la escala FRAIL21, que incluye la evaluación de fatiga, resistencia, deambulación, enfermedades concomitantes y pérdida de peso). Además, se añadirá la información de la Clinical Frailty Scale26 y del Essential Frailty Toolset8, que incluye: a) prueba de levantarse 5 veces de la silla; b) Mini Mental State Examination25; c) valores de hemoglobina, y d) valores de albúmina. Para la evaluación de la comorbilidad se aplicará el índice de Charlson27, con una puntuación máxima de 37 puntos. También se registrará el número de fármacos de prescripción crónica antes del ingreso. La evaluación del riesgo nutricional se realizará con el Mini Nutritional Assessment-Short Form (MNA-SF)28, cuyo valor oscila entre 0 y 14 puntos, y considera que una puntuación < 11 identifica a los pacientes en riesgo de desnutrición. La calidad de vida se determinará mediante el cuestionario EQ-5D-5L29.
Los pacientes con criterios de fragilidad que acepten participar en el estudio serán aleatorizados antes del alta hospitalaria (tras el procedimiento de TAVI) a 2 posibles grupos de tratamiento: a) intervención telemática global (nutrición + ejercicio físico tutelado + educación sanitaria) durante los primeros 90 días, o b) tratamiento habitual posterior al alta. Los pacientes serán asignados a los grupos de tratamiento mediante un esquema aleatorio generado por ordenador en una proporción 1:1. La asignación al azar será a través de un sitio web, ocultando el proceso a los investigadores hasta la asignación de las intervenciones. El tratamiento médico durante el ingreso se hará conforme a las guías de práctica clínica y a criterio del equipo responsable del paciente.
Intervención sobre la fragilidad
La intervención se realizará en los pacientes asignados a recibirla en los 90 días siguientes al alta hospitalaria, de forma telemática y centralizada por parte de una empresa especializada. Personal sanitario experto en apoyo nutricional y ejercicio físico adaptado al paciente frágil hará videollamadas a la semana del alta, a los 15 días y cada 2 semanas en los primeros 3 meses.
Para el ejercicio físico se usará una adaptación del programa VIVI FRAIL30. Durante la primera semana, se realizará la pauta A de ejercicio, y posteriormente, tras la llamada, si hay buena tolerancia clínica, se pasará a la pauta de ejercicio B hasta los 30 días del alta. Durante el segundo y el tercer mes se realizará la pauta de ejercicio C. Todo el proceso será tutelado mediante videoconferencias periódicas por parte de personal especialista en ejercicio físico adaptado al paciente anciano. Además, los pacientes y sus familiares dispondrán de un teléfono para resolver dudas, que estará disponible en horario laboral de lunes a viernes a lo largo de todo el proceso.
En cuanto al soporte nutricional, a los pacientes asignados a la rama de intervención sobre la fragilidad se les proporcionará la información nutricional más adecuada al perfil de cada paciente tras el alta hospitalaria. El equipo investigador proporcionará suplementos nutricionales para los 3 meses posteriores al alta. Los pacientes recibirán suplementación nutricional con una fórmula hipercalórica e hiperproteica. Los suplementos nutricionales se tomarán una vez al día después de la realización de la pauta de ejercicio correspondiente durante ese periodo (3 meses).
La educación sanitaria consistirá, en las sucesivas videollamadas durante los primeros 3 meses, en complementar la información recibida sobre nutrición y ejercicio, y resolver dudas al respecto. Se proporcionará asimismo información para optimizar la adherencia terapéutica y el control de los factores de riesgo cardiovascular.
Criterios de valoración del estudio
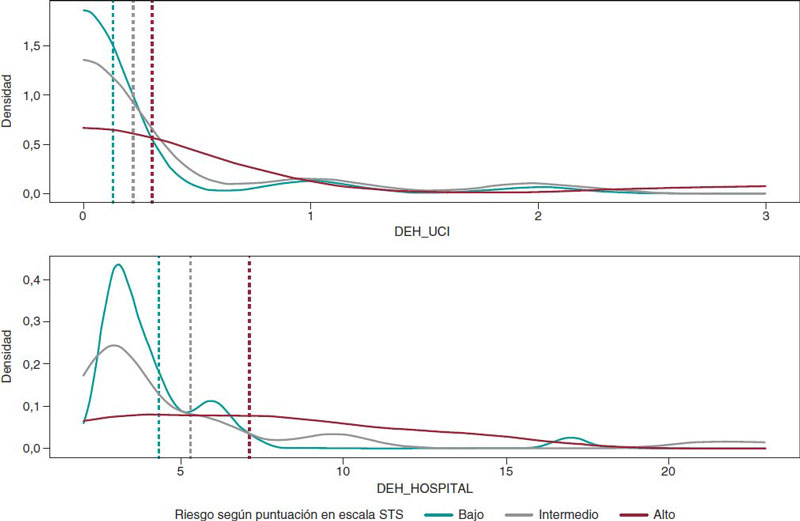
El criterio de valoración principal será el porcentaje de pacientes en los que se revierta la fragilidad medida por SPPB20 (es decir, que pasen a tener SPPB ≥ 10) a los 3 meses del alta. Esta valoración la llevará a cabo el personal de los centros participantes, de forma ciega a la rama de tratamiento asignado (figura 1).

Figura 1. Diseño del estudio TELE-FRAIL TAVI. EAo: estenosis aórtica; SPPB: Short Physical Performance Battery; TAVI: implante percutáneo de válvula aórtica.
Como criterios secundarios se analizarán los siguientes:
- – Número de días vivo fuera del hospital durante el primer año31 tras el TAVI.
- – Necesidad de reingreso (por causa cardiaca o extracardiaca) a los 3 meses y al año del TAVI.
- – Mortalidad global y cardiovascular a los 3 meses y al año del TAVI.
- – Incidencia de eventos cardiovasculares (infarto de miocardio, ictus o revascularización) al año del TAVI.
- – Porcentaje de pacientes que persisten robustos (SPPB20 > 10) al año del TAVI.
- – Discapacidad (definida por el índice de Barthel22) a los 3 meses y al año del TAVI.
- – Riesgo nutricional (definido por el MNA-SF28) a los 3 meses y al año del TAVI.
- – Calidad de vida (definida por EQ-5D-5L29) a los 3 meses y al año del TAVI.
Evaluación geriátrica durante el seguimiento
La evaluación geriátrica se hará de forma presencial por personal entrenado en los centros participantes en el estudio, de forma ciega a la rama de tratamiento asignado. A los 3 meses y al año del TAVI se reevaluarán la capacidad funcional (índice de Barthel), las actividades instrumentales (índice de Lawton Brody), el riesgo nutricional (MNA-SF), la capacidad cognitiva (test de Pfeiffer), la calidad de vida (EQ-5D-5L) y la fragilidad mediante las escalas FRAIL, Clinical Frailty Scale, SPPB y Essential Frailty Toolset. El seguimiento clínico incluye una visita presencial a los 3 meses y al año.
Comisiones de estudio
Este proyecto es un ensayo clínico independiente, sin financiación por parte de la industria. Un comité directivo será responsable de supervisar los aspectos científicos y operativos del estudio. Los pacientes y los investigadores no serán enmascarados a la asignación de las ramas de tratamiento, pero los eventos clínicos los evaluará un comité de asignación de eventos ciego a las ramas de tratamiento para evitar sesgos. Del mismo modo, una junta de monitorización de seguridad de los datos será responsable de hacer las recomendaciones pertinentes al comité directivo en lo referente a los criterios de valoración, así como cualquier posible observación relacionada con la seguridad del paciente.
Análisis estadístico y tamaño muestral
Los datos previos de pacientes ancianos con EAo y criterios de fragilidad tratados con TAVI muestran una proporción aproximada de un 50% de reversión de la fragilidad tras el TAVI. Suponiendo un porcentaje estimado del 70% de reversión de la fragilidad en el grupo asignado a la intervención telemática posterior al alta, con un poder estadístico del 80% y un error alfa bilateral de 0,05, y asumiendo un 10% de pérdidas de seguimiento, se calcula un tamaño muestral de 206 pacientes (103 en cada grupo). Para alcanzar el tamaño muestral planteado es necesario un abordaje multicéntrico.
Todas las comparaciones estadísticas se harán bajo el principio de intención de tratar. Los resultados se presentarán como frecuencia y porcentaje o como mediana y desviación estándar, según corresponda. Las comparaciones entre grupos se realizarán utilizando la prueba exacta de Fisher. El seguimiento del paciente será censurado en el momento de su muerte o al final del estudio. Los criterios de valoración primaria se compararán entre los dos grupos mediante un modelo de regresión logística, considerando la reversión de la fragilidad como variable dependiente, la intervención como variable independiente fija y el resto de covariables con asociación significativa con la exposición en el modelo estadístico final. Además de los criterios de valoración secundarios, el efecto de la intervención sobre los eventos clínicos se describirá utilizando el método de Kaplan-Meier, y para su evaluación se utilizará el modelo de regresión de Cox. Se calcularán la razón de riesgos (hazard ratio) y sus intervalos de confianza del 95%. Para todos los análisis se considerará estadísticamente significativo un valor p bilateral < 0,05. En caso de apreciar diferencias importantes en la distribución de covariables entre ambos grupos (control frente a intervención), se incluirán en el análisis ajustado todas aquellas variables con una distribución significativamente diferente entre ambos grupos, además del grupo de tratamiento asignado. Se realizarán subanálisis preespecificados en función del sexo y la carga de comorbilidad (índice de Charlson).
Aspectos éticos
Los participantes y sus familias recibirán información detallada sobre los posibles riesgos y beneficios de la participación en el estudio. Tanto el protocolo del estudio como el consentimiento informado han sido evaluados por el comité de ética de referencia. Los participantes tendrán la oportunidad de leer con atención el documento de consentimiento y plantear dudas antes de firmarlo. Todos los participantes deberán firmar el documento de consentimiento informado antes de ser incluidos en el estudio. Se proporcionará una copia del documento de consentimiento informado a los participantes. Se protegerán los derechos y el beneficio de los participantes, haciendo énfasis en que la calidad de la atención médica no se verá afectada negativamente si rechazan participar en el estudio.
DISCUSIÓN
A pesar de que el TAVI se ha impuesto como terapia de elección en un porcentaje mayoritario de pacientes ancianos con EAo, evitar la futilidad en aquellos con mayor carga de comorbilidad, fragilidad y discapacidad es un reto clínico. En este sentido, un porcentaje considerable de pacientes ancianos con EAo presentan fragilidad, en parte debido a su cardiopatía (potencialmente reversible con un tratamiento específico) y en parte por otra comorbilidad que puedan presentar. Se ha descrito que, en los pacientes con mayor carga de comorbilidad, el tratamiento aislado de su EAo podría no aportar beneficio clínico en ausencia de otras medidas11. Conocer detalladamente el perfil de cada paciente es crucial para un correcto abordaje terapéutico tanto de la EAo como de su situación global una vez corregida la valvulopatía.
La fragilidad se considera un estado intermedio en la transición hacia la discapacidad que es potencialmente reversible, en especial en sus fases iniciales13. Para ello, es importante un abordaje holístico multidisciplinario que se apoye en pilares como el ejercicio físico, una nutrición adecuada y un control estricto de las diferentes enfermedades de base14. Se ha descrito que algunos programas de ejercicio físico pueden revertir parcialmente la fragilidad en diferentes escenarios cardiovasculares, también en pacientes con EAo15-17. Sin embargo, la implementación de estas estrategias en la práctica clínica encuentra obstáculos relevantes, tanto por su coste económico como en relación con la dificultad para conseguir una adherencia sostenida de los pacientes a estos programas18. El ensayo clínico TELE-FRAIL TAVI pretende analizar el posible impacto de una intervención global en la reversión de la fragilidad y en el pronóstico de pacientes ancianos frágiles tratados con TAVI. Se espera que la naturaleza telemática de la intervención permita una adherencia elevada a las recomendaciones sobre ejercicio físico y nutrición que contribuya a la reversión de la fragilidad, junto con la corrección de la EAo mediante TAVI. El diseño del estudio debería permitir averiguar el porcentaje de pacientes en los que se revierte la fragilidad mediante esta estrategia combinada en comparación con la estrategia de TAVI y seguimiento convencional, así como conocer el perfil clínico y geriátrico de los pacientes en los que esta estrategia fracasa y, por lo tanto, existe una alta probabilidad de que el TAVI resulte fútil.
CONCLUSIONES
Se espera que los resultados del ensayo clínico TELE-FRAIL TAVI aporten luz al abordaje de los pacientes ancianos frágiles con EAo tratados con TAVI, ya que la optimización del tratamiento y el pronóstico de estos complejos pacientes puede tener importantes implicaciones clínicas, económicas y sociales.
FINANCIACIÓN
Este proyecto ha recibido financiación de la Sociedad Española de Cardiología (Proyectos de Investigación Clínica SEC 2024, SEC/FEC-INVCLI 24/21) y de la Societat Catalana de Cardiologia (Beca 2024).
CONSIDERACIONES ÉTICAS
Tanto el protocolo del estudio como el documento de consentimiento informado han sido evaluados por el comité de ética de referencia. Todos los participantes deberán firmar el documento de consentimiento informado antes de ser incluidos en el estudio.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha utilizado.
CONTRIBUCIÓN DE LOS AUTORES
E. Bernal-Labrador, R. Romaguera, F. Formiga y A. Ariza-Solé contribuyeron a la concepción del estudio y la escritura del artículo. S. García-Blas, A. Regueiro, V. Serra, H. Tizón-Marcos, L. Asmarats, V. Agudelo, C. Scardino, J.M. Casanova-Sandoval, T. Rodríguez-Gabella, C. Jiménez-Méndez, A. Pérez-Rivera, C. Robles-Gamboa, A. Ayesta, P. Díez-Villanueva, S. Raposeiras-Roubín, I. Amat-Santos, A. Esteve-Pastor, G. Veiga-Fernández, M. Anguita, D. Martí-Sánchez, N. Martínez-Velilla, L. Cortés, E. Calvo-Barriuso y S. Asimbaya contribuyeron a la revisión crítica del texto.
CONFLICTO DE INTERESES
R. Romaguera es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. Los demás autores declaran no tener conflictos de intereses.
¿QUÉ SE SABE DEL TEMA?
- El trasplante percutáneo de válvula aórtica (TAVI) es una terapia de primera línea en pacientes con estenosis aórtica (EAo), pero en pacientes frágiles con comorbilidad su beneficio puede ser sensiblemente menor.
- Se recomienda un abordaje global (ejercicio físico, nutrición adecuada y control de la comorbilidad) para revertir la fragilidad, aunque la implementación de estas estrategias en la práctica clínica encuentra obstáculos relevantes.
- La telemedicina podría permitir un seguimiento adecuado y una mejor adherencia a estos programas en el paciente anciano frágil.
- No existe experiencia sobre la aplicación de la telemedicina en pacientes frágiles tratados con TAVI.
¿QUÉ APORTA DE NUEVO?
- El ensayo clínico TELE-FRAIL TAVI analizará, en pacientes con EAo tratados con TAVI, el efecto de una intervención telemática global en la reversión de la fragilidad a los 3 meses del TAVI, en comparación con el abordaje convencional.
- El diseño del estudio debería permitir averiguar el porcentaje de pacientes en los que se revierte la fragilidad mediante esta estrategia combinada en comparación con el seguimiento convencional, así como conocer el perfil de los pacientes en los que esta estrategia fracasa y, por lo tanto, existe una alta probabilidad de que el TAVI resulte fútil.
BIBLIOGRAFÍA
1. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
2. UK TAVI Trial Investigators;Toff WD, Hildick-Smith D, Kovac J, et al. Effect of Transcatheter Aortic Valve Implantation vs Surgical Aortic Valve Replacement on All-Cause Mortality in Patients With Aortic Stenosis:A Randomized Clinical Trial. JAMA. 2022;327:1875-1887.
3. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
4. Jørgensen TH, Thyregod HGH, Ihlemann N, et al. Eight-year outcomes for patients with aortic valve stenosis at low surgical risk randomized to transcatheter vs. surgical aortic valve replacement. Eur Heart J. 2021;42:2912-2919.
5. Jurado-Román A, Freixa X, Cid B, et al. Spanish cardiac catheterization and coronary intervention registry. 32nd official report of the Interventional Cardiology Association of the Spanish Society of Cardiology (1990-2022). Rev Esp Cardiol. 2023;76:1021-1031.
6. Bezzeccheri A, Vermeersch P, Verheye S, et al. Trends and outcomes in transcatheter aortic valve implantation in Belgium:a 13-year single centre experience. Acta Cardiol. 2022;77:960-969.
7. Rodríguez-Pascual C, Paredes-Galán E, Ferrero-Martínez AI, et al. The frailty syndrome and mortality among very old patients with symptomatic severe aortic stenosis under different treatments. Int J Cardiol. 2016;224:125-131.
8. Afilalo J, Lauck S, Kim DH, et al. Frailty in Older Adults Undergoing Aortic Valve Replacement:The FRAILTY-AVR Study. J Am Coll Cardiol. 2017;70:689-700.
9. Shimura T, Yamamoto M, Kano S, et al.;OCEAN-TAVI Investigators. Impact of the Clinical Frailty Scale on Outcomes After Transcatheter Aortic Valve Replacement. Circulation. 2017;135:2013-2024.
10. Patel JN, Ahmad M, Kim M, et al. Relation of Frailty to Cost for Patients Undergoing Transcatheter Aortic Valve Implantation. Am J Cardiol. 2020;125:469-474.
11. Martínez-Sellés M, Díez-Villanueva P, Sánchez-Sendin D, et al.;PEGASO Registry Group. Comorbidity and intervention in octogenarians with severe symptomatic aortic stenosis. Int J Cardiol. 2015;189:61-66.
12. Woolford SJ, Sohan O, Dennison EM, et al. Approaches to the diagnosis and prevention of frailty. Aging Clin Exp Res. 2020;32:1629-1637.
13. Díez-Villanueva P, Ariza-SoléA, Vidán MT, et al. Recommendations of the Geriatric Cardiology Section of the Spanish Society of Cardiology for the Assessment of Frailty in Elderly Patients With Heart Disease. Rev Esp Cardiol. 2019;72:63-71.
14. Ijaz N, Buta B, Xue QL, et al. Interventions for Frailty Among Older Adults With Cardiovascular Disease:JACC State-of-the-Art Review. J Am Coll Cardiol. 2022;79:482-503.
15. Tamulevicˇiu¯te˙-Prasciene˙E, Beigiene˙A, Thompson MJ, et al. The impact of additional resistance and balance training in exercise-based cardiac rehabilitation in older patients after valve surgery or intervention:randomized control trial. BMC Geriatr. 2021;21:23.
16. Li Z, Song W, Yang N, Ding Y. Exercise-based cardiac rehabilitation programmers for patients after transcatheter aortic valve implantation:A systematic review and meta-analysis. Medicine (Baltimore). 2023;102:e34478.
17. Yu Z, Zhao Q, Ye Y, et al. Comprehensive Geriatric Assessment and Exercise Capacity in Cardiac Rehabilitation for Patients Referred to Transcatheter Aortic Valve Implantation. Am J Cardiol. 2021;158:98-103.
18. Sanchis J, Sastre C, Ruescas A, et al. Randomized Comparison of Exercise Intervention Versus Usual Care in Older Adult Patients with Frailty After Acute Myocardial Infarction. Am J Med. 2021;134:383-390.e2.
19. Yun S, Enjuanes C, Calero-Molina E, et al. Effectiveness of telemedicine in patients with heart failure according to frailty phenotypes:Insights from the iCOR randomised controlled trial. Eur J Intern Med. 2022;96:49-59.
20. Guralnik JM, Ferrucci L, Pieper CF, et al. Lower extremity function and subsequent disability:consistency across studies, predictive models, and value of gait speed alone compared with the short physical performance battery. J Gerontol A Biol Sci Med Sci. 2000;55:M221-31.
21. Abellan van Kan G, Rolland Y, Bergman H, Morley JE, Kritchevsky SB, Vellas B. The I.A.N.A. Task Force on frailty assessment of older people in clinical practice. J Nutr Health Aging. 2008;12:29-37.
22. Mahoney FI, Barthel DW. Functional evaluation:the Barthel Index. A simple index of independence useful in scoring improvement in the rehabilitation of the chronically ill. Md State Med J. 1965;14:61-65.
23. Lawton MP, Brody EM. Assessment of older people:self-maintaining and instrumental activities of daily living. Gerontologist. 1969;9:179-186.
24. Pfeiffer E. A short portable mental status questionnaire for the assessment of organic brain deficit in elderly patients. J Am Geriatr Soc. 1975;23:433-441.
25. Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975;12:189-198.
26. Rockwood K, Song X, MacKnight C, et al. A global clinical measure of fitness and frailty in elderly people. CMAJ. 2005;173:489-495.
27. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies:development and validation. J Chronic Dis. 1987;40:373-383.
28. Rubenstein LZ, Harker JO, SalvàA, Guigoz Y, Vellas B. Screening for undernutrition in geriatric practice:developing the short-form mini-nutritional assessment (MNA-SF). J Gerontol A Biol Sci Med Sci. 2001;56:M366-M372.
29. Buanes EA, Gramstad A, Søvig KK, et al. Cognitive function and health-related quality of life four years after cardiac arrest. Resuscitation. 2015;89:13-18.
30. Proyecto VIVIFRAIL. Disponible en: https://vivifrail.com/wp-content/uploads/2020/02/Ruedas.pdf. Consultado 25 Abr 2025.
31. Jerath A, Austin PC, Wijeysundera DN. Days Alive and Out of Hospital:Validation of a Patient-centered Outcome for Perioperative Medicine. Anesthesiology. 2019;131:84-93.
RESUMEN
Introducción y objetivos: El implante percutáneo de válvula aórtica (TAVI) se ha establecido como una alternativa menos invasiva al recambio valvular aórtico (RVAo). El strain longitudinal global del ventrículo izquierdo (SLG-VI) puede detectar cambios en el funcionamiento ventricular izquierdo antes de que se deteriore la fracción de eyección. Nuestro objetivo fue presentar y evaluar la experiencia de nuestro centro en cuanto al remodelado inverso ventricular izquierdo a corto y largo plazo, utilizando el SLG-VI mediante rastreo de marcas, o speckle tracking, bidimensional, después de TAVI en comparación con los resultados tras RVAo.
Métodos: El equipo cardiológico multidisciplinario evaluó 65 pacientes remitidos para RVAo por estenosis aórtica grave, con riesgo quirúrgico alto, intermedio o bajo. Los pacientes se clasificaron según fueran tratados con TAVI (prótesis autoexpandible Evolut-R) o RVAo. Se realizó ecocardiograma antes del procedimiento, al mes y al año de llevarlo a cabo.
Resultados: 31 pacientes se trataron con TAVI y 34 con RVAo. En el grupo de TAVI hubo mayores tasas de regurgitación valvular y paravalvular. Se observó un remodelado ventricular izquierdo más favorable, con una disminución significativa del índice de masa del ventrículo izquierdo, un índice E/e’ tras el procedimiento y una mejoría precoz del SLG-VI de −8,18 ± 1,81 a −14,52 ± 2,52, que al año fue −16,12 ± 2,69 (p < 0,0001), sin que esta mejoría precoz en dicho parámetro se evidenciara en el grupo de RVAo. En el grupo de TAVI se mantuvo la función ventricular derecha sin afectar al desplazamiento sistólico del plano tricúspide y sin aumentar la presión sistólica de la arteria pulmonar estimada.
Conclusiones: Los pacientes que recibieron un TAVI tuvieron un mayor y más precoz remodelado ventricular izquierdo, con una reducción precoz del índice de masa del ventrículo izquierdo y del índice E/e’, y una mejoría significativa precoz del SLG-VI, sin alteración de la fracción de eyección del ventrículo izquierdo ni deterioro de la función ventricular derecha.
Palabras clave: Remodelado ventricular izquierdo. Implante percutáneo de válvula aórtica. Recambio valvular aórtico. Speckle tracking bidimensional. TAVI. RVAo.
ABSTRACT
Introduction and objectives: Transcatheter aortic valve implantation (TAVI) has emerged as an alternative and less invasive treatment to surgical aortic valve replacement (SAVR). Left ventricular global longitudinal strain (LV-GLS) can reveal changes in left ventricular performance before involvement of ejection fraction. Our aim was to present and evaluate our center’s experience regarding short- and long-term reverse left ventricular remodeling using two-dimensional-speckle tracking echocardiography-derived LV-GLS after TAVI compared with SAVR.
Methods: Our multidisciplinary cardiac team carefully evaluated 65 patients for SAVR who presented with severe symptomatic aortic stenosis and who had high, intermediate, or low surgical risk. The patients underwent either TAVI with an Evolut-R self-expanding valve or SAVR. Echocardiographic evaluation was performed before, 1 month, and 1 year after the procedure.
Results: TAVI was performed in 31 patients and SAVR in 34 patients. The incidence of valvular and paravalvular leak was higher in the TAVI group despite early favorable LV remodeling with a significant decrease in left ventricular mass index and E/e’ shortly after the procedure and an early detectable improvement in LV-GLS from −8.18 ± 1.81 to −14.52 ± 2.52, reaching −16.12 ± 2.69 at 1 year (P < .001). This early improvement was not observed in the SAVR group. TAVI preserved right ventricular function without affecting tricuspid annular plane systolic excursion or increasing estimated pulmonary artery pressure.
Conclusions: Patients who underwent TAVI had earlier and significantly better LV remodeling with early reduction in left ventricular mass index, E/e’ ratio, and significant early improvement in LV-GLS without concomitant impairment of left ventricular ejection fraction percentage or deterioration of right ventricular function.
Keywords: Left ventricular remodeling. Transcatheter aortic valve implantation. Surgical aortic valve replacement. Two-dimensional speckle tracking. TAVI. SAVR.
Abreviaturas
EA: estenosis aórtica. FEVI: fracción de eyección del ventrículo izquierdo. RVAo: recambio valvular aórtico. SLG-VI: strain longitudinal global del ventrículo izquierdo. TAVI: implante percutáneo de válvula aórtica. VI: ventrículo izquierdo.
INTRODUCCIÓN
La estenosis aórtica (EA) calcificada degenerativa es la valvulopatía más común en todo el mundo. En casos sintomáticos graves, el recambio valvular aórtico (RVAo) ha sido el patrón oro desde hace décadas1.
No obstante, desde su introducción en 2002, el implante percutáneo de válvula aórtica (TAVI) se ha convertido en un tratamiento alternativo menos invasivo con un tiempo de recuperación más corto y una tasa de mortalidad perioperatoria más baja. Inicialmente, esta intervención se empleó en pacientes de riesgo quirúrgico alto2,3 e intermedio4,5. Sin embargo, los avances en la técnica y las habilidades del operador han ampliado su uso a pacientes de bajo riesgo quirúrgico6,7.
Es bien sabido que el principal problema en personas con EA aislada es una mayor poscarga que provoca disfunción diastólica y culmina en una disfunción sistólica del ventrículo izquierdo (VI)8. El momento óptimo para la intervención, ya sea quirúrgica o percutánea, depende de la gravedad o grado de estenosis, los síntomas y la disfunción del VI9. El recambio valvular aórtico mediante TAVI o RVAo influye significativamente en el remodelado del VI, reduce los síntomas y aumenta la supervivencia general7.
Las guías vigentes emplean el porcentaje de fracción de eyección del ventrículo izquierdo (FEVI) para valorar la función sistólica del VI. No obstante, pueden presentarse cuadros de disfunción miocárdica subclínica a pesar de un porcentaje normal de FEVI. Los cambios fibróticos inducidos por la EA afectan principalmente a la función longitudinal del VI y la fracción de eyección viene determinada por la función miocárdica radial. La mayoría de los casos de EA grave que precisan intervención presentan porcentajes de fracción de eyección mantenida antes y después de la intervención, y solo se describen porcentajes bajos en algunos casos tardíos y descuidados de mal pronóstico cuando ambas funciones, radial y longitudinal, se ven afectadas8. Por tanto, valorar la función o el remodelado del VI antes o después de la intervención no debe basarse solo en la FEVI. Se necesita otro método fiable para valorar íntegramente el impacto del recambio valvular aórtico en la función del VI10.
Analizar la deformación o strain longitudinal global (GLS) ha demostrado ser útil para caracterizar de manera precisa la función sistólica miocárdica regional y global. Este análisis puede detectar cambios en el rendimiento del VI y superar limitaciones propias de la fracción de eyección, tales como la considerable variabilidad entre observadores, la ausencia de diferencias regionales sutiles y ventanas acústicas inadecuadas, con una validez pronóstica superior a la del porcentaje de FEVI10.
En el Hospital Universitario de Tanta, Egipto, se ha introducido recientemente el TAVI. El objetivo de este estudio fue presentar y valorar la experiencia de nuestro equipo y estudiar el impacto del recambio valvular aórtico en factores como la hemodinámica de la prótesis valvular, la fuga valvular o periprotésica significativa y la necesidad de implantar un nuevo marcapasos. También nos propusimos valorar el remodelado inverso del VI a corto y largo plazo evaluando parámetros ecocardiográficos convencionales. También se empleó el strain longitudinal global del VI mediante rastreo de marcas o speckle tracking (SLG-VI), más fiable y preciso, tras el TAVI y se compararon estos parámetros con el patrón oro (RVAo).
Pacientes y diseño del estudio
Muestra de pacientes y criterios de inclusión
Este estudio longitudinal, prospectivo, no aleatorizado y unicéntrico se llevó a cabo en el Departamento de Cardiología de la Facultad de Medicina del Hospital Universitario de Tanta entre mayo de 2022 y octubre de 2023. Un total de 65 pacientes diagnosticados de EA sintomática grave, clasificados como de alto, intermedio o bajo riesgo quirúrgico y programados para una intervención de recambio valvular aórtico, recibieron un examen exhaustivo por parte del equipo multidisciplinario. Tras seleccionar la intervención adecuada, se trató a los pacientes aptos mediante TAVI transfemoral con una válvula autoexpandible Evolut-R (Medtronic, Estados Unidos) o RVAo.
Los pacientes se clasificaron en 2 grupos:
-
– Grupo I: pacientes con síntomas clínicos como dolor torácico, síncope o disnea, así como evidencias ecocardiográficas de EA grave (definida como un área valvular ≤ 1 cm2 o un área valvular indexada ≤ 0,6 cm2/m2, un gradiente medio de presión ≥ 40 mmHg y una velocidad máxima transaórtica ≥ 4 m/s)9. Los pacientes que cumplían estos criterios se consideraron aptos para recibir el TAVI.
-
– Grupo II: pacientes diagnosticados de EA grave sintomática según hallazgos clínicos y ecocardiográficos (considerados aptos para recibir el RVAo).
Criterios de exclusión
Se excluyó a los pacientes que presentaban alguna de las siguientes patologías: valvulopatía significativa concomitante distinta de EA, insuficiencia renal aguda (tasa de filtrado glomerular < 30 ml/min/ 1,73 m2), recambio previo de válvula biológica o de metal sin recubrir, enfermedad coronaria o carotídea significativa, aneurisma de aorta abdominal, insuficiencia cardiaca inestable, fibrilación auricular, flutter auricular o cualquier alteración significativa del ritmo, insuficiencia aórtica predominante, endocarditis infecciosa o disfunción grave del VI (fracción de eyección < 35%). También se excluyó a los pacientes que fallecieron durante el periodo del estudio o de quienes no se tenían datos ecocardiográficos antes o después de la sustitución valvular.
MÉTODOS
Se llevó a cabo una evaluación integral de la historia y de la clínica de todos los pacientes. Los datos sobre la duración de la estancia hospitalaria, las complicaciones perioperatorias y el seguimiento clínico se recopilaron mediante revisión de los registros médicos.
La intervención de TAVI
Tras la selección de los pacientes y de las válvulas adecuadas, la intervención se realizó en 5 pasos secuenciales: abordaje, cruce de la válvula, valvuloplastia aórtica con balón, implante de la válvula y cierre de la vía de acceso. Algunas consideraciones adicionales que se tuvieron en cuenta fueron la elección de la anestesia (local con sedación o anestesia general) y el implante del cable de un marcapasos temporal en el ventrículo derecho. En la mayoría de los pacientes, la intervención se llevó a cabo bajo sedación consciente. Los dispositivos empleados fueron las válvulas autoexpandibles Evolut-R (26, 29 o 34 mm)11.
Estudio ecocardiográfico estándar
Las mediciones ecocardiográficas se realizaron según las guías de la American Society of Echocardiographya y la European Association of Cardiovascular Imaging12. Empleando el sistema de ultrasonido cardiovascular Vivid E9 (GE Vingmed Ultrasound, Noruega), equipado con un transductor de matriz en fase M5S (2,5-5,0 MHz) y un software dedicado, las imágenes y datos se almacenaron digitalmente para su análisis offline antes de intervención, poco tiempo después (1 mes) y entre 9 y 12 meses tras el recambio valvular. Todos los parámetros ecocardiográficos los adquirieron 2 observadores entrenados. Se registró una media de 3-5 latidos consecutivos.
Se obtuvieron las dimensiones del VI, el grosor de la pared vascular, el porcentaje de FEVI y el índice de masa del VI. Los gradientes de presión máxima y media transaórticos se calcularon a partir de la velocidad aórtica obtenida mediante evaluación Doppler continuo multiventana con la ecuación de Bernoulli modificada.
El área del orificio efectivo de la válvula aórtica se determinó con la ecuación de continuidad y se indexó el área de superficie corporal como el volumen sistólico calculado en el tracto de salida del ventrículo izquierdo (TSVI) dividido por la integral tiempo-velocidad del chorro o jet aórtico calculada mediante Doppler continuo. El volumen sistólico del TSVI se calculó como el área de la sección transversal del TSVI multiplicada por la integral tiempo-velocidad del TSVI calculada mediante Doppler pulsado.
Tras el recambio valvular aórtico, se obtuvieron la velocidad y el diámetro del TSVI justo apical a la endoprótsesis de la válvula o al anillo de sutura. La presencia y la cuantificación de cualquier fuga valvular o periprotésica se evaluaron mediante Doppler color y continuo.
Se obtuvieron parámetros ecocardiográficos adicionales para valorar la función diastólica del VI, principalmente el flujo transmitral, incluidas las mediciones de las velocidades máximas de flujo temprano (E) y auricular (A) y de la relación E/A. La velocidad media máxima diastólica temprana (e’) se adquirió desde el lado septal del anillo mitral en el plano apical tetracameral empleando configuraciones de Doppler tisular. Después, se calculó la relación E/e’, que sirvió de indicador de las presiones de llenado del VI.
Se emplearon parámetros convencionales para valorar la función del lado derecho, incluidas mediciones de la excursión sistólica del plano del anillo tricuspídeo y valoraciones de la velocidad máxima de insuficiencia tricuspídea con imágenes de flujo Doppler color. La presión sistólica estimada de la arteria pulmonar se calculó empleando la fórmula: presión sistólica estimada de la arteria pulmonar = presión auricular derecha + 4 V2, siendo V la velocidad de insuficiencia tricuspídea.
Ecocardiografía speckle tracking 2D, strain longitudinal global del ventrículo izquierdo
Se llevó a cabo una valoración offline del strain longitudinal global máximo sistólico. Los bordes endocárdicos se trazaron manualmente y se visualizaron como una secuencia codificada por colores en clips individuales. Después, se combinaron en un gráfico en forma de diana. El software calculó el strain regional y promedio de los planos apical bicameral, tetracameral y tricameral de los 17 segmentos en un frame telesistólico. Se excluyeron las imágenes con una tasa de frames < 5013. Se registró y se documentó el strain longitudinal global máximo medio para cada estudio.
Análisis estadístico
El análisis estadístico llevó a cabo con el Paquete Estadístico para Ciencias Sociales (IBM SPSS Statistics) para Windows, versión 26 (IBM Corp., Estados Unidos). Las variables cualitativas (el sexo, por ejemplo) se expresan como frecuencias, y la asociación entre los grupos y las variables categóricas se valoraron con la prueba de X2 para independencia, la prueba exacta de Fisher-Freeman-Halton o la prueba exacta de Fisher, según corresponda. Las variables cuantitativas (la edad y todas las mediciones ecocardiográficas) se expresan como media ± desviación estándar (DE).
Las diferencias observadas en las variables cuantitativas entre los grupos se evaluaron con la prueba T para muestras independientes para características y mediciones basales o con el análisis de modelos lineales mixtos con grupos de tratamiento como factor y valores basales como covariable. Las comparativas de las mediciones repetidas obtenidas en cada grupo se realizaron analizando el modelo lineal mixto para medidas repetidas con el tiempo de tratamiento como factor. El grado de insuficiencia mitral en diferentes momentos se comparó mediante la prueba de McNemar y el grado de fuga periprotésica se evaluó en diferentes momentos con la prueba de homogeneidad marginal. Se eligió un nivel de significancia de p < 0,05 para todas las pruebas estadísticas.
RESULTADOS
La tabla 1 muestra los datos demográficos de los 2 grupos: el TAVI se realizó en 31 pacientes y el RVAo en 34. La edad fue mayor en el grupo TAVI (p < 0,001) que en el grupo RVAo.
Tabla 1. Datos demográficos, comorbilidades y porcentaje de diferentes complicaciones en las 2 intervenciones
| TAVI (31) | RVAo (34) | p | ||
|---|---|---|---|---|
| Edad | Media ± DE | 68,86 ± 2,61 | 66,00 ± 1,74 | < 0,001* |
| Sexo | Femenino | 7 (22,6%) | 9 (26,5%) | 0,716 |
| Masculino | 24 (77,4%) | 25 (73,5%) | ||
| IMC | Media ± DE | 32,71 ± 3,13 | 32,83 ± 2,76 | 0,893 |
| Comorbilidades | Hipertensión | 15 (48,4%) | 18 (52,9%) | 0,714 |
| Diabetes | 11 (35,5%) | 13 (38,2%) | 0,818 | |
| Dislipidemia | 13 (41,9%) | 13 (38,2%) | 0,761 | |
| EC | 7 (22,6%) | 12 (35,3%) | 0,260 | |
| Complicaciones Resultado clínico | No | 22 (71,0%) | 30 (88,2%) | 0,082 |
| Alteración de la conducción | 4 (12,9%) | 0 (0,0%) | 0,046* | |
| Daño renal agudo | 3 (6,4%) | 0 (0,0%) | 0,103 | |
| Neurológico | 0 (0,0%) | 2 (5,9%) | 0,493 | |
| Complicaciones asociadas a los vasos | 5 (16,1%) | 0 (0,0%) | 0,021* | |
| Rehospitalización | 1 (3,2%) | 2 (5,9%) | 0,999 | |
|
DE: desviación estándar; EC: enfermedad cardiovascular; IMC: índice de masa corporal; MPP: marcapasos permanente; RVAo: recambio valvular aórtica; TAVI: implante percutáneo de válvula aórtica. * Significativo a p < 0,05. |
||||
No hubo incidentes peri ni posoperatorios en la mayoría de los pacientes, y se observaron menos síntomas en ambos grupos. No obstante, sí hubo algunas complicaciones perioperatorias y al año de seguimiento: 4 pacientes desarrollaron anomalías de la conducción y presentaron bloqueo cardiaco completo durante su hospitalización, con implante de marcapasos permanente bicameral; 3 pacientes desarrollaron nefropatía inducida por contraste, que se corrigió antes del alta (2 de ellos tenían diabetes de larga data); 5 pacientes desarrollaron complicaciones vasculares en forma de hemorragia entre leve y moderada desde el sitio de acceso que no requirió transfusiones ni intervenciones; y solo 1 paciente fue rehospitalizado por presentar edema pulmonar hipertensivo (el paciente tenía hipertensión crónica no controlada) en el grupo TAVI. Falleció 1 paciente 10 días después del TAVI y fue excluido.
En el grupo RVAo, 2 pacientes desarrollaron accidente cerebrovascular isquémico secundario a una anticoagulación ineficaz y otros 2 fueron rehospitalizados tras desarrollar toxicidad a la warfarina complicada con una hemorragia gastrointestinal que requirió hospitalización para transfusión de sangre hasta controlar la hemorragia. Ninguno de los pacientes en este grupo desarrolló daño renal agudo, anomalías de la conducción ni complicaciones vasculares perioperatorias durante su hospitalización (tabla 1).
En los 2 grupos, todas las variables ecocardiográficas se recopilaron al inicio (antes de la intervención), al cabo de 1 mes y 1 año después de la intervención. Todos estos datos se muestran en la tabla 2. En la tabla 3 se muestra una comparativa de los cambios relativos descritos en cada parámetro en diferentes momentos de la valoración en ambos grupos, representada gráficamente en la figura 1.
Tabla 2. Parámetros eco-Doppler para ambas intervenciones en cada momento de la valoración
| Variables | A nivel basal | Al cabo 1 mes | Al cabo 1 año | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TAVI | RVAo | p | TAVI | RVAo | p | TAVI | RVAo | p | ||||
| DTDVI (cm) | 5,09 ± 0,32 | 5,15 ± 0,43 | 0,632 | 5,01 ± 0,33 | 5,13 ± 0,41 | 0,133 | 4,99 ± 0,29 | 4,95 ± 0,29 | 0,380 | |||
| DTSVI (cm) | 3,30 ± 0,28 | 3,51 ± 0,46 | 0,069 | 3,23 ± 0,28 | 3,50 ± 0,47 | 0,136 | 3,20 ± 0,22 | 3,27 ± 0,21 | 0,941 | |||
| IMVI (g/m²) | 170,33 ± 14,10 | 169,17 ± 11,39 | 0,760 | 152,14 ± 13,28 | 169,63 ± 11,05 | < 0,001* | 138,81 ± 15,16 | 138,54 ± 17,03 | 0,952 | |||
| sept VI (cm) | 1,53 ± 0,12 | 1,52 ± 0,10 | 0,707 | 1,44 ± 0,14 | 1,46 ± 0,13 | 0,107 | 1,21 ± 0,17 | 1,25 ± 0,13 | 0,280 | |||
| FEVI % | 63,33 ± 5,86 | 57,44 ± 13,66 | 0,074 | 63,67 ± 6,05 | 59,71 ± 6,89 | 0,207 | 64,48 ± 5,12 | 62,54 ± 4,29 | 0,524 | |||
| PAPSE (mmHg) | 30,00 ± 6,32 | 29,79 ± 8,06 | 0,924 | 27,14 ± 6,08 | 33,79 ± 7,49 | < 0,001* | 27,62 ± 6,21 | 28,54 ± 7,59 | 0,491 | |||
| E/A | 0,63 ± 0,37 | 0,60 ± 0,39 | 0,801 | 0,65 ± 0,43 | 0,62 ± 0,39 | 0,899 | 0,67 ± 0,43 | 0,62 ± 0,38 | 0,504 | |||
| E/e’ | 15,81 ± 2,84 | 14,13 ± 3,05 | 0,063 | 12,10 ± 1,92 | 14,21 ± 2,67 | < 0,001* | 10,10 ± 1,61 | 11,33 ± 1,90 | 0,007* | |||
| TAPSE (cm) | 2,06 ± 0,26 | 2,14 ± 0,22 | 0,239 | 2,05 ± 0,26 | 1,67 ± 0,22 | < 0,001* | 1,97 ± 0,28 | 1,94 ± 0,23 | 0,199 | |||
| Vmax-VA (m/s) | 4,92 ± 0,22 | 4,95 ± 0,24 | 0,655 | 1,64 ± 0,16 | 1,91 ± 0,15 | < 0,001* | 1,68 ± 0,16 | 1,85 ± 0,09 | < 0,001* | |||
| GM-VA (mmHg) | 58,38 ± 7,17 | 58,08 ± 7,67 | 0,894 | 9,85 ± 1,65 | 13,23 ± 1,95 | < 0,001* | 9,21 ± 1,21 | 12,85 ± 1,93 | < 0,001* | |||
| AVA-I (cm²/m²) | 0,47 ± 0,10 | 0,47 ± 0,10 | 0,984 | 1,20 ± 0,11 | 1,23 ± 0,07 | 0,358 | 1,22 ± 0,10 | 1,26 ± 0,08 | 0,201 | |||
| SLG-VI % | –8,18 ± 1,81 | –8,30 ± 1,99 | 0,829 | –14,52 ± 2,52 | –8,82 ± 1,68 | < 0,001* | –16,57 ± 2,52 | –16,12 ± 2,69 | 0,511 | |||
| Grado de IM | Leve | 26 (83,9%) | 21 (61,8%) | 0,057 | 28 (90,3%) | 23 (67,6%) | 0,028* | 27 (87,1%) | 21 (61,8%) | 0,020* | ||
| ≥ Moderado | 5 (16,1%) | 13 (38,3%) | 3 (9,7%) | 11 (32,4%) | 4 (12,9%) | 13 (38,2%) | ||||||
| Grado de FV o FPP | Ninguno | − | − | 17 (54,8%) | 28 (82,4%) | 0,011* | 15 (48,4%) | 25 (73,5%) | 0,042* | |||
| Leve | − | − | 12 (38,7%) | 6 (17,6%) | 13 (41,9%) | 8 (23,5%) | ||||||
| ≥ Moderado | − | − | 2 (6,5%) | 0 (0,0%) | 3 (9,7%) | 1 (2,9%) | ||||||
|
AVA-I: área valvular aórtica indexada; DTDVI: dimensión telediastólica del ventrículo izquierdo; DTSVI: dimensión telesistólica del ventrículo izquierdo; E/A: relación velocidad de flujo mitral diastólica temprana/velocidad de flujo mitral diastólica tardía; E/e’: relación velocidad de flujo mitral diastólica temprana/velocidad diastólica temprana derivada de Doppler tisular del anillo mitral septal; FEVI: fracción de eyección del ventrículo izquierdo; FV o FPP: fuga valvular o fuga periprotésica; GM-VA: gradiente de presión medio de la válvula aórtica; IM: insuficiencia mitral; IMVI: índice de masa del ventrículo izquierdo; PAPSE: presión arterial pulmonar sistólica estimada; RVAo: recambio valvular aórtico; sept VI: grosor del septo del ventrículo izquierdo; SLG-VI: strain longitudinal global del ventrículo izquierdo; TAPSE: excursión sistólica del plano anular tricuspídeo; TAVI: implante percutáneo de válvula aórtica; Vmax-VA: velocidad máxima de la válvula aórtica. * Significativo a p < 0,05. Los datos expresan media ± desviación estándar. |
||||||||||||
Tabla 3. Comparativa de mediciones repetidas al cabo de 1 mes y 1 año tras intervención frente a mediciones basales
| TAVI | RVAo | |||
|---|---|---|---|---|
| 1 mes frente a valores basales p |
1 año frente a valores basales p |
1 mes frente a valores basales p |
1 año frente a valores basales p |
|
| DTDVI | 0,092 | 0,202 | 0,999 | 0,024* |
| DTSVI | 0,157 | 0,064 | 0,999 | 0,008* |
| IMVI | < 0,001* | < 0,001* | 0,999 | < 0,001* |
| Sept VI | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| FEVI % | 0,999 | 0,430 | 0,736 | 0,110 |
| PAPSE | 0,001* | 0,036* | 0,005* | 0,752 |
| E/A | 0,768 | 0,117 | 0,406 | 0,761 |
| E/e’ | < 0,001* | < 0,001* | 0,999 | < 0,001* |
| TAPSE | 0,999 | 0,076 | < 0,001* | 0,002* |
| Vmax-VA | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| GM-VA | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| AVA-I | < 0,001* | < 0,001* | < 0,001* | < 0,001* |
| SLG-VI | < 0,001* | < 0,001* | 0,443 | < 0,001* |
| Grado de IM | 0,500 | 1,000 | 0,500 | 1,000 |
| - | - | 1 año frente a 1 mes p | - | 1 año frente a 1 mes p |
| Grado de FV o FPP | - | 0,083 | - | 0,046* |
|
AVA-I: área valvular aórtica indexada; DTDVI: dimensión telediastólica del ventrículo izquierdo; DTSVI: dimensión telesistólica del ventrículo izquierdo; E/A: relación velocidad de flujo mitral diastólica temprana/velocidad de flujo mitral diastólica tardía; E/e’: relación velocidad de flujo mitral diastólica temprana/velocidad diastólica temprana derivada de Doppler tisular del anillo mitral septal; FEVI: fracción de eyección del ventrículo izquierdo; FV o FPP: fuga valvular o fuga periprotésica; GM-VA: gradiente de presión medio de la válvula aórtica; IM: insuficiencia mitral; IMVI: índice de masa del ventrículo izquierdo; PAPSE: presión arterial pulmonar sistólica estimada; RVAo: recambio valvular aórtico; sept VI: grosor del septo del ventrículo izquierdo; SLG-VI: strain longitudinal global del ventrículo izquierdo; TAPSE: excursión sistólica del plano anular tricuspídeo; TAVI: implante percutáneo de válvula aórtica; Vmax-VA: velocidad máxima de la válvula aórtica. p obtenido del análisis del modelo lineal mixto para medidas repetidas empleando el tiempo de tratamiento como factor. * Significativo a p < 0,05. |
||||
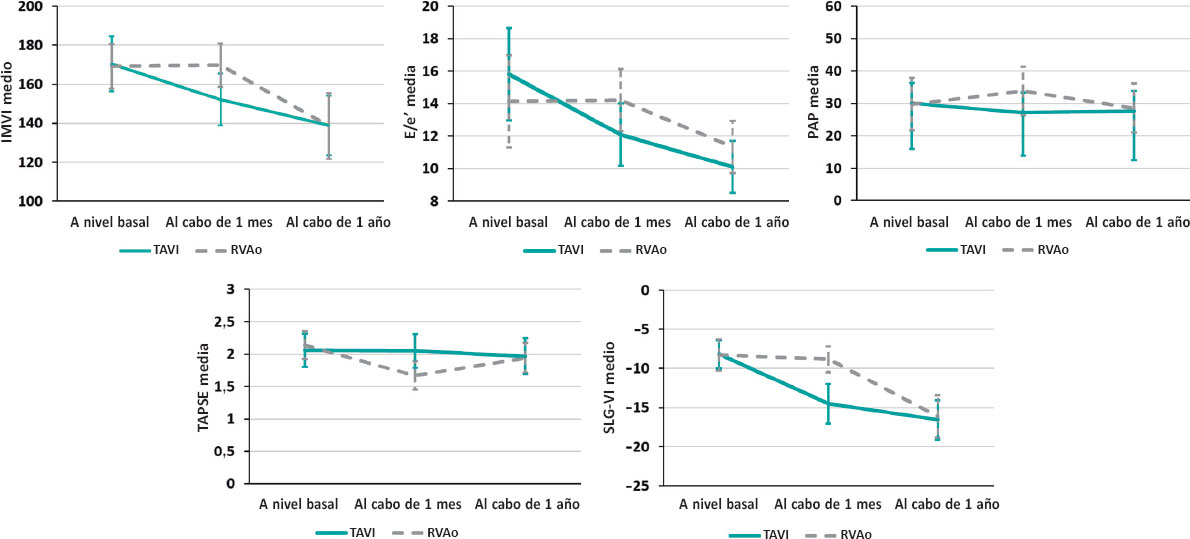
Figura 1. Cambios relativos de cada parámetro a lo largo del estudio desde nivel basal hasta 1 año en ambos grupos con descensos relativos del IMVI, E/e, presión arterial pulmonar sistólica estimada y aumentos relativos del SLG-VI sin cambios en TAPSE poco después (1 mes) del TAVI frente a cambios no detectables en el IMVI, la E/e o el SLG-VI, un descenso relativo de la TAPSE y aumentos de la presión arterial pulmonar sistólica estimada en el grupo RVAo. Trascurrido 1 año, los parámetros eran casi los mismos en los 2 grupos. E/e’: relación entre la velocidad del flujo mitral diastólico temprano pico y la velocidad diastólica temprana derivada del Doppler tisular con onda pulsada desde el anillo mitral septal; IMVI: índice de masa del ventrículo izquierdo; PAP, presión arterial pulmonar; RVAo: recambio valvular aórtico; SLG-VI: strain longitudinal global del ventrículo izquierdo; TAPSE: excursión sistólica del plano del anillo tricuspídeo; TAVI: implante percutáneo de válvula aórtica.
Todas las variables ecocardiográficas basales fueron parecidas entre los 2 grupos.
Hemodinámica valvular
Tras ambas intervenciones, se observó una mejora significativa de la velocidad máxima de la válvula aórtica (Vmax-VA) y del gradiente medio de presión de la válvula aórtica (GM-VA), así como del área valvular aórtica (AVA) (p < 0,001 para todos). Esta mejora se mantuvo durante todo el año, al tiempo que se observó una mejora temprana y al cabo de 1 año relativamente más pronunciada en la Vmax-VA y el GM-VA (p < 0,001 para ambos) en el grupo TAVI con respecto al RVAo. Ningún paciente de ninguno de los 2 grupos desarrolló desajuste paciente-prótesis.
Dimensiones y funciones del ventrículo izquierdo
Se observó una mejora constante y significativa en el grosor septal del VI tras la intervención en ambos grupos en diferentes momentos de la valoración; también una mejora ligera pero significativa en las dimensiones del VI (dimensión telediastólica del VI y dimensión telesistólica del VI) en el grupo RVAo a 1 año con respecto al TAVI. En concreto, la dimensión telediastólica del VI pasó de 5,15 ± 0,43 a 4,95 ± 0,29 (p = 0,024) en el grupo RVAo a 5,09 ± 0,32 a 4,99 ± 0,29 (p = 0,202) en el grupo TAVI. Asimismo, la dimensión telesistólica del VI pasó de 3,51 ± 0,46 a 3,27 ± 0,21 (p = 0,008) en el grupo RVAo a 3,30 ± 0,28 a 3,20 ± 0,22, p = 0,064 en el TAVI.
Se observó un resultado temprano favorable en el grupo TAVI con un descenso significativo del índice de masa del VI y E/e’ poco después de la intervención, que se mantuvo al cabo de 1 año. El índice de masa del VI pasó de 170,33 ± 14,10 a 152,14 ± 13,28 (p < 0,001) en el grupo TAVI frente a 169,17 ± 11,39 a 169,63 ± 11.05 (p = 0,999) en el RVAo. E/e’ pasó de 15,81 ± 2,84 a 12,10 ± 1,92 (p < 0,001) en el grupo de TAVI frente a 14,13 ± 3,05 a 14,21 ± 2,67 (p = 0,999) en el RVAo (figura 1).
Aunque la insuficiencia mitral experimentó una mejora relativa en el grupo TAVI con respecto al grupo RVAo tras 1 mes (p = 0,028) y 1 año de seguimiento (p = 0,020), no cambió significativamente dentro de cada grupo en diferentes momentos de la valoración. La insuficiencia mitral leve fue prevalente en ambos grupos.
Valoración del ventrículo derecho
No se observó ningún cambio significativo en la excursión sistólica del plano del anillo tricuspídeo tras la intervención en el grupo TAVI. Sin embargo, en el grupo RVAo sí se redujo significativamente poco después de la intervención pasando de 2,14 ± 0,22 a 1,67 ± 0,22 (p < 0,001). Como se muestra en la figura 1, aunque la presión arterial pulmonar sistólica estimada experimentó un descenso significativo de 30,00 ± 6,32 a 27,14 ± 6,08 (p = 0,001) poco después del TAVI, aumentó significativamente de 29,79 ± 8,06 a 33,79 ± 7.49 tras el RVAo (p = 0,005).
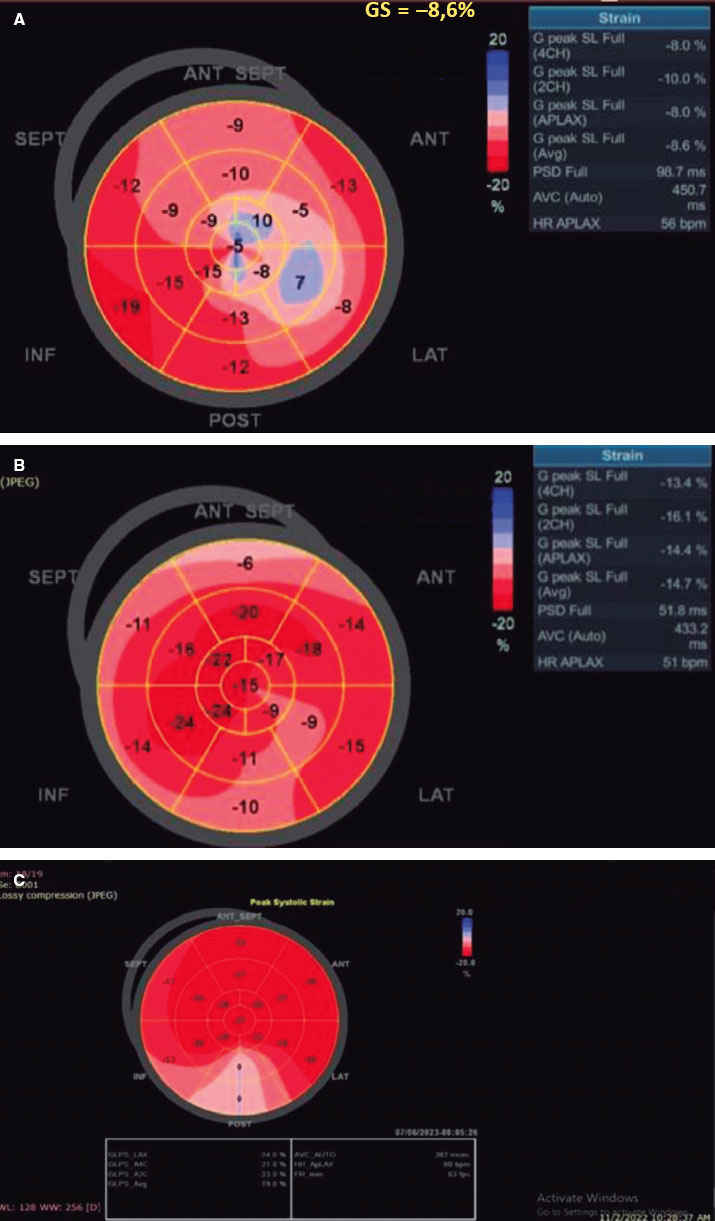
Strain longitudinal global del ventrículo izquierdo
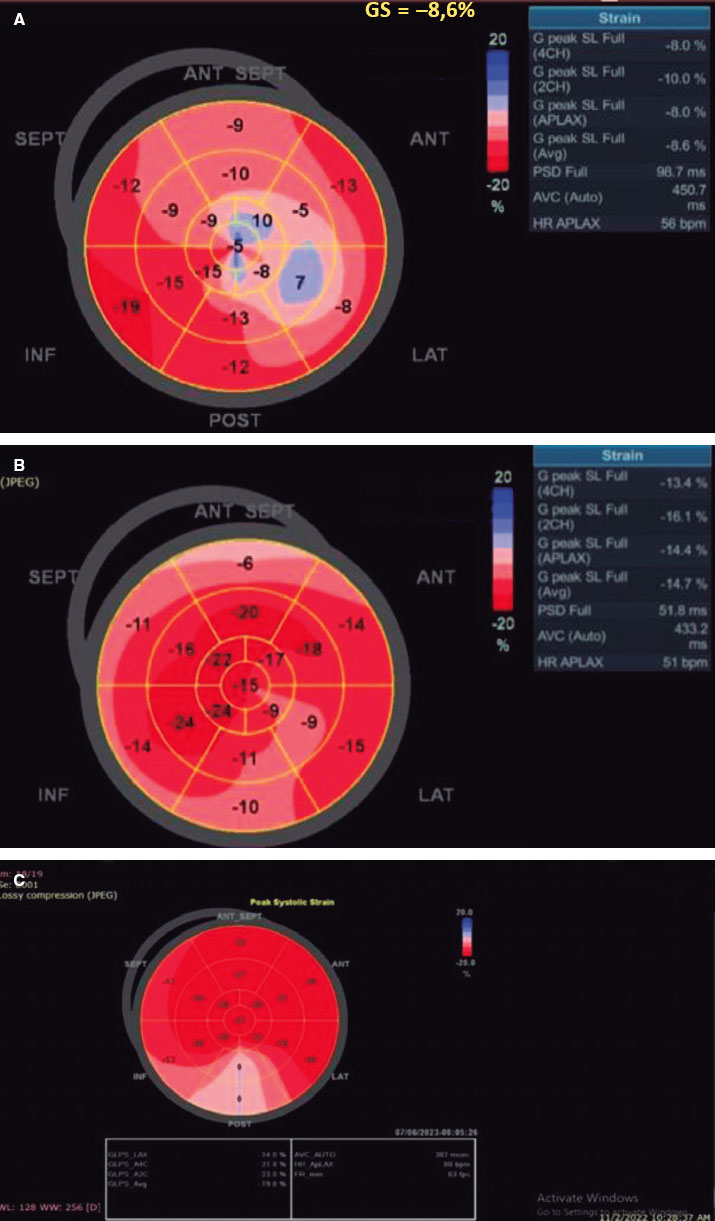
Se observó una diferencia estadísticamente significativa entre los 2 grupos (p < 0,001) que fue favorable al grupo TAVI con una mejora detectable temprana del SLG-VI que pasó de -8,18 ± 1,81 a -14,52 ± 2,52, p < 0,001 al cabo de 1 mes hasta -16,57 ± 2,52 al cabo de 1 año. No obstante, esta mejora temprana no se observó en el grupo RVAo, con la primera mejora detectable observada al año (-8,30 ± 1,99 a -16,12 ± 2,69; p < 0,001) (figura 2).
Figura 2. A: a nivel basal: bajo strain longitudinal global del ventrículo izquierdo (SLG-VI) previo al TAVI. B: 1 mes después de la intervención, el SLG-VI aumentó significativamente de -8,6 a -14,7. C: 1 año después del TAVI, el SLG-VI siguó mejorando y pasó de -14,7 a -19,8. ANT SEPT: anteroseptal; ANT: anterior; INF: inferior; LAT: lateral; POST: posterior; SEPT: septal.
Fuga valvular o periprotésica
Más pacientes del grupo TAVI desarrollaron fuga periprotésica leve o ≥ moderada, con 12 (38,7%) y 2 (6,5%) pacientes, respectivamente, en el seguimiento inmediato. Estos números aumentaron a 13 (41,9%) y 3 (9,7%) pacientes, respectivamente, al cabo de 1 año. Ninguno de los pacientes del grupo RVAo desarrolló fuga periprotésica ≥ moderada y solo 6 (17,6%) experimentaron fuga periprotésica leve no significativa al cabo de 1 mes. Un paciente pasó de fuga paravalvular leve a moderada al año, con una diferencia estadísticamente significativa entre los 2 grupos (p = 0,011 al mes y p = 0,042 al año).
Variabilidad inter e intraobservador
El coeficiente de correlación para la reproducibilidad interobservador del SLG-VI fue de 0,933 (intervalo de confianza del 95%: 0,894-0,957) y para el acuerdo intraobservador de aproximadamente 0,985 (IC95%, 0,976-0,991).
DISCUSIÓN
La ecocardiografía es el abordaje más efectivo para valorar el rendimiento de las válvulas protésicas, las complicaciones asocia- das a la prótesis, la geometría de las cámaras, el remodelado y la función cardiaca tras cualquier intervención valvular, quirúrgica o percutánea.
Nuestro estudio incluyó todas las categorías de riesgo quirúrgico. Siempre que fue posible, el TAVI fue la estrategia preferida para el recambio valvular aórtico para aumentar la experiencia de nuestro centro, salvo que estuviera contraindicado en opinión del equipo multidisciplinario (por un tamaño inadecuado del anillo, trombo en el VI, calcificación asimétrica de la válvula, distancia corta entre el anillo y el ostium coronario, acceso vascular inadecuado, trombos móviles en el arco o en la aorta ascendente, válvula bicúspide, valvulopatía o enfermedad coronaria significativas concomitantes que requieran intervención, o por la improbable mejora en la calidad de vida tras el TAVI por comorbilidades asociadas). El TAVI no fue inferior al RVAo en lo que se refiere a la mejora posoperatoria de los síntomas y a una hemodinámica valvular mejorada con mejores Vmax-VA, gradiente medio de presión medio de la VA y del área valvular aórtica indexada e incluso con mejores Vmax-VA y gradiente medio de presión de la AV en el seguimiento a corto y largo plazo. Estos hallazgos vienen avalados por la reciente actualización de las guías en materia de indicaciones para el TAVI14, que establecen firmemente este abordaje como alternativa al RVAo en el tratamiento de la EA en todas las categorías de riesgo quirúrgico tras la evolución continua del TAVI y los resultados de múltiples ensayos aleatorizados.
Las principales características fisiopatológicas de la EA son una mayor poscarga, el remodelado del VI, el aumento de la presión de llenado, la disfunción diastólica del VI y los síntomas de insuficiencia cardiaca. La disfunción diastólica es lo que primero sobreviene seguida de un aumento en la masa del VI15. Tras el TAVI, se observan descensos significativos inmediatos de los gradientes de presión transvalvular que se traducen en descensos inmediatos de la poscarga del VI, con un aumento en E y e’ secundario a una relajación diastólica temprana tras el TAVI en relación del RVAo.
Tras el RVAo, la disfunción transitoria perioperatoria del VI secundaria a la circulación extracorpórea es un factor bien conocido que puede influir negativamente en el remodelado del VI16. Esta disfunción transitoria del VI está asociada a marcadores bioquímicos elevados, como péptidos natriuréticos cerebrales y troponina I poco después del RVAo17,18. No obstante, estas consecuencias asociadas a la circulación extracorpórea no se observan tras el TAVI. En este sentido, el remodelado del VI puede reducirse poco después de la intervención gracias a una menor estimulación neurohormonal, lo cual mejora la hipertrofia del VI preoperatoria16.
Incluso con la función sistólica del VI mantenida tras la cirugía cardiaca, el grado de la relación E/e’ ha demostrado estar estrechamente vinculado a los niveles de péptidos natriuréticos cerebrales. Una presión auricular izquierda elevada acompañada de disfunción diastólica son los principales determinantes de la liberación de péptidos natriuréticos cerebrales en entornos clínicos19. El presente estudio destaca cómo la recuperación temprana de la presión de llenado del VI, indicada por un descenso temprano de Vmax-VA, GM-VA, relación E/e’ e índice de masa del VI, influye positivamente en el remodelado del VI, lo que a su vez se traduce en una mejora temprana de los parámetros de deformación del SLG-VI incluso sin cambios significativos en el porcentaje de FEVI tras el TAVI. Estos fenómenos podrían ayudar a explicar la evidencia de un mejor pronóstico a corto plazo en pacientes con EA grave tratados con TAVI20. Tras 1 año de seguimiento, ya no se observaban los mecanismos iniciales responsables de estos mejores resultados precoces, razón por la cual la distribución de cambios en la función diastólica del grupo RVAo fue parecida a la del TAVI15.
Aunque no parece que la insuficiencia de la válvula mitral se viera significativamente afectada dentro del mismo grupo en diferentes momentos de la valoración, sí mejoró en el grupo TAVI con respecto al RVAo.
Estos resultados contrastan con datos previamente publicados por Gonçalves et al.21. Aunque estos autores calcularon parámetros de la función diastólica del VI antes y minutos después del TAVI, no incluyeron una comparativa con un grupo quirúrgico. Encontraron un aumento significativo en el tiempo de desaceleración de la onda E, la velocidad de la onda E, así como un marcado descenso de la presión telediastólica del VI.
Además, Jin Ha et al.22 compararon el efecto que tuvo el TAVI frente al RVAo inmediatamente y 3 meses después del recambio valvular aórtico tanto en la función del VI como en los parámetros diastólicos. Encontraron que más pacientes mejoraron el grado de función diastólica del VI en el grupo TAVI que en el RVAo (42 frente al 11%). Se observó una mejora temprana en el grado de función diastólica acompañado de un descenso significativo inmediato de la relación E/e’ y la presión arterial pulmonar sistólica estimada en el grupo TAVI. Parecido a nuestro estudio, tanto la dimensión telediastólica como telesistólica del VI cambiaron significativamente a los 3 meses tras el RVAo. Este resultado podría explicarse por el uso frecuente de diuréticos tras la cirugía para tratar el derrame pleural y el posible edema pulmonar. No obstante, la insuficiencia de la válvula mitral no varió significativamente entre los 2 grupos y el índice de masa del VI tampoco experimentó un cambio significativo inmediato en ninguno de los grupos y comenzó a disminuir trascurridos 3 meses.
Guarracino et al.16 analizaron los péptidos natriuréticos cerebrales y la función diastólica del VI a través de la velocidad de propagación del flujo mitral y la velocidad diastólica temprana del anillo mitral antes y después de las intervenciones valvulares, y registraron una mejora de los parámetros diastólicos del VI en el grupo TAVI con subidas de los niveles de péptidos natriuréticos cerebrales en el grupo quirúrgico.
Asimismo, Fairbairn et al.23 hayaron una regresión temprana de la masa y un remodelado inverso del VI tras el TAVI frente al RVAo.
En cambio, Ngo et al.24 compararon a pacientes tratados de RVAo frente TAVI al cabo de 3 y 12 meses y hallaron descensos similares en el grosor relativo de la pared vascular en ambos grupos, y descensos más marcados del índice de masa del VI en pacientes tratados de RVAo (17,5 frente al 7,2%; p < 0,001).
En nuestro estudio, la función del ventrículo derecho no cambió mucho en los pacientes tratados con TAVI, y no se observaron cambios en la excursión sistólica del plano del anillo tricuspídeo ni subidas adicionales de la presión arterial pulmonar sistólica estimada con respecto a los pacientes tratados con RVAo. Kempny et al.25 confirmaron que, aunque el TAVI no influyó en la función del ventrículo derecho, esta sí empeoró en pacientes tratados con RVAo.
El aumento de la masa del VI y el mayor grosor relativo de la pared vascular provocado por una mayor poscarga del VI en pacientes con EA grave se asocian a una menor deformación miocárdica regional y global del VI según la ecocardiografía speckle tracking (rastreo de marcas) 2D. En este sentido, el SLG-VI es capaz de estimar, de manera precisa, la contractilidad miocárdica del VI y detectar cambios subclínicos en el rendimiento del VI en pacientes con EA26, lo cual mejora tras el recambio valvular aórtico27.
Son muchos los estudios que han demostrado que el TAVI se asocia a mejoras significativas tempranas de los parámetros de deformación del VI28,30 y que, a su vez, estas mejoras están asociadas a pronósticos más favorables25. Parecido a lo descrito en nuestro estudio, aunque el SLG-VI mejoró significativamente justo después del TAVI, este no fue el caso con la fracción de eyección.
Tsampasian et al.31 valoraron el SLG-VI antes y después del TAVI en 85 pacientes, con un seguimiento medio de 49 ± 39 días. El TAVI provocó mejoras significativas tempranas en el SLG (que pasó de -13,96 a -15,25, p = 0,01) y en la regresión temprana de la masa del VI sin que se observaran cambios en el porcentaje de fracción de eyección. El tipo de válvula no influyó en la función ni en el remodelado del VI tras el TAVI.
La fuga periprotésica leve o moderada persistente es un conocido predictor de malos resultados tras el TAVI32. Sin embargo, en nuestro estudio, aunque más pacientes desarrollaron fuga periprotésica significativa tras el TAVI que tras el RVAo en seguimientos a corto y largo plazo, el SLG-VI mejoró poco después del TAVI. Este hallazgo viene avalado por los hallazgos hechos por Kampaktsis et al.33 que estudiaron el impacto de la fuga periprotésica en el remodelado del VI y SLG-VI y describieron mejoras significativas del SLG-VI con independencia de la fuga periprotésica, al tiempo que esta influyó negativamente en el porcentaje de FEVI, la regresión de la masa del VI y la función diastólica. Como un número reducido de nuestros pacientes incluidos podría haber influido negativamente en el potencial estadístico de estos hallazgos, los pacientes con, ante todo, insuficiencia aórtica o disfunción grave del VI (FE < 35%) fueron excluidos para eliminar el efecto adverso de tales factores de confusión en el remodelado del VI.
Limitaciones
Este estudio tiene algunas limitaciones. La primera es el tamaño reducido de la muestra debido al número limitado de pacientes tratados con TAVI en nuestro centro en el momento de la inscripción. Un tamaño de muestra más grande habría mejorado el potencial estadístico y la extrapolación de los hallazgos. En segundo lugar, se trata de un estudio unicéntrico no aleatorizado, lo cual podría introducir sesgo de selección y potencialmente afectar la validez de la comparativa entre ambas intervenciones. En tercer lugar, no estudiamos otros factores de confusión que influyen en el remodelado posoperatorio del VI, tales como la hipertensión, la insuficiencia renal y la disfunción ventricular basal. En cuarto lugar, el estudio comunicó datos de seguimiento a 1 mes y 1 año tras la intervención. Un seguimiento a más largo plazo proporcionaría una comprensión más completa de los resultados del remodelado del VI.
CONCLUSIONES
Comparados con los pacientes tratados con RVAo, los tratados con TAVI mejoraron antes el remodelado y la función diastólica del VI, con descensos precoces del índice de masa del VI, la relación E/e’ y mejoras significativas tempranas del SLG-VI sin cambios concomitantes en el porcentaje de FEVI, mientras mantenían la función del ventrículo derecho. No obstante, estos pacientes también mostraron un deterioro rápido de la válvula y una incidencia más alta de fugas valvulares y periprotésicas. Más pacientes tratados con TAVI experimentaron bloqueo auriculoventricular completo, hubo que implantarles marcapasos permanentes y tuvieron complicaciones vasculares relacionadas con el sitio de acceso.
FINANCIACIÓN
Ninguna.
CONSIDERACIONES ÉTICAS
Se obtuvo el consentimiento informado por escrito de todos los participantes del estudio. El estudio fue aprobado por el Comité de Ética local de la Facultad de Medicina de Tanta University Hospital (código de aprobación: 36264PR12/1/23). No se tuvieron en cuenta las variables de sexo ni de género según las directrices SAGER.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial en la preparación de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORES
S.B. El-Saied: diseño del estudio, realización de ecocardiografías para los pacientes y redacción del manuscrito. R. Atlm y M. Elbarbary: obtención y análisis de datos y revisión del manuscrito y los resultados. A. Ghoneim y M.H. Sherif: contribuyeron a la redacción del manuscrito, obtención y análisis de datos y revisión del manuscrito y los resultados. S.B. El-Saied, R. Atlm, A. Ghoneim, M.H. Sherif y M. Elbarbary revisaron el trabajo y aprobaron la versión final para su publicación.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- La EA calcificada degenerativa es la valvulopatía más prevalente a nivel mundial. El RVAo es el patrón oro para casos graves.
- El TAVI se ha convertido en un tratamiento alternativo menos invasivo con una recuperación más rápida y una menor mortalidad perioperatoria.
- El recambio valvular aórtico influye significativamente en el remodelado del VI, reduce los síntomas y aumenta la supervivencia general.
- Aunque las guías actuales utilizan el porcentaje de FEVI para valorar la función del VI, puede sobrevenir disfunción miocárdica subclínica a pesar de un porcentaje normal de FEVI.
- El análisis de SLG se ha utilizado para caracterizar con precisión la función sistólica miocárdica regional y global, superando las limitaciones de la fracción de eyección.
¿QUÉ APORTA DE NUEVO?
- El estudio comparó el impacto que tuvo el recambio valvular aórtico utilizando TAVI o RVAo en parámetros como la hemodinámica de la prótesis, la fuga valvular, el implante de marcapasos y el remodelado del VI.
- El TAVI se asoció a mejoras más precoces en el remodelado y función diastólica del VI comparado con el RVAo, descensos en el índice de masa del VI, la relación E/e’ y mejoras en el SLG-VI con mantenimiento de la función del VD.
- No obstante, el TAVI se asoció a deterioro valvular, fuga valvular, así como a una mayor incidencia de implante de marcapasos y complicaciones vasculares.
BIBLIOGRAFÍA
1. Thaden JJ, Nkomo VT, Enriquez-Sarano M. The global burden of aortic stenosis. Prog Cardiovasc Dis. 2014;56:565-571.
2. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374:1609-1620.
3. Kodali SK, Williams MR, Smith CR, et al. Two-year outcomes after transcatheter or surgical aortic-valve replacement. N Engl J Med. 2012;366:1686-1695.
4. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
5. Wenaweser P, Stortecky S, Schwander S, et al. Clinical outcomes of patients with estimated low or intermediate surgical risk undergoing transcatheter aortic valve implantation. Eur Heart J. 2013;34:1894-1905.
6. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. N Engl J Med. 2019;380:1706-1715.
7. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med. 2019;380:1695-1705.
8. Hein S, Arnon E, Kostin S, et al. Progression from compensated hypertrophy to failure in the pressure-overloaded human heart:structural deterioration and compensatory mechanisms. Circulation. 2003;107:984-991.
9. Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease:a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135:e1159-e1195.
10. Reisner SA, Lysyansky P, Agmon Y, Mutlak D, Lessick J, Friedman Z. Global longitudinal strain:a novel index of left ventricular systolic function. J Am Soc Echocardiogr. 2004;17:630-633.
11. Popma JJ, Adams DH, Reardon MJ, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll of Cardiol. 2014;63:1972-1981.
12. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults:an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;16:233-271.
13. Notomi Y, Shiota T, Popovic´ZB, et al. Measurement of ventricular torsion by two-dimensional ultrasound speckle tracking imaging. J Am Coll Cardiol. 2005;45:2034-2041.
14. Sundt TM, Jneid H. Guideline update on indications for transcatheter aortic valve implantation based on the 2020 American College of Cardiology/American Heart Association guidelines for management of valvular heart disease. JAMA Cardiol. 2021;6:1088-1089.
15. Douglas PS, Berko B, Lesh M, Reichek N. Alterations in diastolic function in response to progressive left ventricular hypertrophy. J Am Coll Cardiol. 1989;13:461-467.
16. Guarracino F, Talini E, Landoni G, Petronio S, Giannini C, Di Bello V. Effect of aortic valve surgery on left ventricular diastole assessed by echocardiography and neuroendocrine response:percutaneous versus surgical approach. J Cardiothorac Vasc Anesth. 2010;24:25-29.
17. Provenchère S, Berroeta C, Reynaud C, et al. Plasma brain natriuretic peptide and cardiac troponin I concentrations after adult cardiac surgery:association with postoperative cardiac dysfunction and 1-year mortality. Crit Care Med. 2006;34:995-1000.
18. Rieck ÅE, Gerdts E, Lønnebakken MT, et al. Global left ventricular load in asymptomatic aortic stenosis:covariates and prognostic implication (the SEAS trial). Cardiovasc Ultrasound. 2012;10:1-8.
19. Salustri A, Cerquetani E, Piccoli M, et al. Relationship between B-type natriuretic peptide levels and echocardiographic indices of left ventricular filling pressures in post-cardiac surgery patients. Cardiovasc Ultrasound. 2009;7:1-7.
20. Bleiziffer S, Ruge H, Mazzitelli D, et al. Survival after transapical and transfemoral aortic valve implantation:talking about two different patient populations. J Thoracic Cardiovasc Surg. 2009;138:1073-1080.
21. Gonçalves A, Marcos-Alberca P, Almeria C, et al. Acute left ventricle diastolic function improvement after transcatheter aortic valve implantation. Eur J Echocardiogr. 2011;12:790-797.
22. Ha SJ, Yoo SY, Hong MK, Hong GR. Immediate and evolutionary recovery of left ventricular diastolic function after transcatheter aortic valve replacement:comparison with surgery. Yonsei Med J. 2020;61:30.
23. Fairbairn TA, Steadman CD, Mather AN, et al. Assessment of valve haemodynamics, reverse ventricular remodelling and myocardial fibrosis following transcatheter aortic valve implantation compared to surgical aortic valve replacement:a cardiovascular magnetic resonance study. Heart. 2013;99:1185-91.
24. Ngo A, Hassager C, Thyregod HGH, et al. Differences in left ventricular remodelling in patients with aortic stenosis treated with transcatheter aortic valve replacement with corevalve prostheses compared to surgery with porcine or bovine biological prostheses. Eur Heart J Cardiovasc Imaging. 2018;19:39-46.
25. Kempny A, Diller GP, Kaleschke G, et al. Impact of transcatheter aortic valve implantation or surgical aortic valve replacement on right ventricular function. Heart. 2012;98:1299-304
26. Weideman F, Jamal F, Kowalski M, et al. Can strain rate and strain quantify changes in regional systolic function during dobutamine infusion, B-blockade, and atrial pacing—implications for quantitative stress echocardiography. J Am Soc Echocardiogr. 2002;15:416-424.
27. Delgado V, Tops LF, van Bommel RJ, et al. Strain analysis in patients with severe aortic stenosis and preserved left ventricular ejection fraction undergoing surgical valve replacement. Eur Heart J. 2009;30:3037-3047.
28. Giannini C, Petronio AS, Talini E, et al. Early and late improvement of global and regional left ventricular function after transcatheter aortic valve implantation in patients with severe aortic stenosis:an echocardiographic study. Am J Cardiovasc Dis. 2011;1:264-273.
29. Kempny A, Diller GP, Kaleschke G, et al. Longitudinal left ventricular 2D strain is superior to ejection fraction in predicting myocardial recovery and symptomatic improvement after aortic valve implantation. Int J Cardiol. 2013;167:2239-2243.
30. Schattke S, Baldenhofer G, Prauka I, et al. Acute regional improvement of myocardial function after interventional transfemoral aortic valve replacement in aortic stenosis:A speckle tracking echocardiography study. Cardiovasc Ultrasound. 2012;10:15.
31. Tsampasian V, Panoulas V, Jabbour RJ, et al. Left ventricular speckle tracking echocardiographic evaluation before and after TAVI. Echo Res Pract. 2020;7:29-38.
32. SáMP, Jacquemyn X, Van den Eynde J, et al. Impact of Paravalvular Leak on Outcomes After Transcatheter Aortic Valve Implantation:Meta-Analysis of Kaplan-Meier-derived Individual Patient Data. Struct Heart. 2023;7:100118.
33. Kampaktsis PN, Subramayam P, Sherifi I, et al. Impact of paravalvular leak on left ventricular remodeling and global longitudinal strain 1 year after transcatheter aortic valve replacement. Future Cardiology. 2021;17:337-345.
RESUMEN
Introducción y objetivos: La angiografía por tomografía computarizada (angio-TC) es el estándar para medir el anillo aórtico en pacientes tratados mediante implante percutáneo de válvula aórtica (TAVI), aunque en algunos casos podría no ser factible. Debería evaluarse la precisión de las medición del anillo aórtico angiográfica (AAA) durante el TAVI como alternativa para elegir el tamaño correcto de la válvula cardiaca percutánea. Por ello, investigamos la correlación entre las mediciones angiográficas y por angio-TC para elegir el tamaño adecuado de la válvula en pacientes que reciben un TAVI.
Métodos: Se incluyeron pacientes de TAVI con prótesis de balón expandible y angio-TC de alta calidad. Las mediciones del AAA se obtuvieron de la angiografía de la raíz aórtica en proyección de 3 cúspides. Se comparó la distancia angiográfica entre la cúspide izquierda y no coronariana con las mediciones de angio-TC. Se evaluaron la prueba diagnóstica y la correlación entre las medidas angiográficas y de angio-TC, así como la eficacia (éxito técnico, posición correcta y desempeño intencionado) y la seguridad (múltiples válvulas, embolización, implante de marcapasos e insuficiencia valvular moderada o mayor) definida por VARC-3.
Resultados: Para válvulas con balón expandible de 23 mm, la distancia en la aortografía tuvo una correlación de 0,528 (p < 0,01) comparada con las mediciones de angio-TC; para las de 26 mm, la correlación fue de 0,451 (< 0,01), y para las de 29 mm fue de 0,579 (< 0,01). No hubo diferencia en cuanto a eficacia (94,2 frente a 96,0%; p = 0,60) y seguridad (90,9 frente a 91,9%; p = 0,84) entre casos con medidas concordantes y discordantes.
Conclusiones: Las mediciones del AAA mostraron un moderado valor de prueba diagnóstica y de correlación Spearman en comparación con la angio-TC para elegir el tamaño de la válvula cardiaca percutánea. Esta estrategia podría permitir un TAVI en situaciones en que la angio-TC no esté disponible.
Palabras clave: Cúspide no coronariana. Cúspide coronaria izquierda. Aortografía. Mediciones angiográficas del anillo aórtico. Implante percutáneo de válvula aórtica.
ABSTRACT
Introduction and objectives: Coronary computed tomography angiography (CCTA) has become the gold standard to measure the size of the aortic annulus and better select the size of transcatheter heart valves (THV) in patients undergoing transcatheter aortic valve implantation (TAVI). However, in selected cases, CCTA may not be feasible. Angiographic aortic annulus (AAA) measurements during TAVI may be an alternative and should be evaluated for precision regarding the proper selection of THV sizes. We sought to investigate the correlation between AAA and CCTA measurements for the proper selection of balloon-expandable valve (BEV) sizes in patients undergoing TAVI.
Methods: Patients undergoing TAVI with BEV and high-quality CCTA were included. AAA measurements were obtained in the standard 3-cusp view after aortic root aortography. Angiographic distance between non- and left coronary cusps were compared to CCTA annulus measurements. Endpoints were diagnostic tests and correlations between angiographic and CCTA measurements, and the composite endpoint of the VARC-3-defined efficacy (technical success, correct position, and intended performance), and safety profile (multiple valves, valve embolization, pacemaker implantation, and more than moderate valvular regurgitation).
Results: Regarding the Sapien family of THV, aortography-based distance measurements showed a correlation of 0.528 (P < .01), 0.451 (P < .01), and 0.579 (P < .01) for 23 mm, 26 mm, and 29 mm valves with CCTA-based distance measurements. No difference was seen regarding the VARC-3-defined efficacy (94.2% vs 96.0%; P = .60) and safety profile (90.9% vs 91.9%; P = .84) among cases showing discordant and concordant pairs of measurements.
Conclusions: AAA measurement showed a moderate diagnostic test and Spearman’s correlation coefficient compared to CCTA-based annulus assessment for perioperative THV size selection. This strategy could potentially enable TAVI in patients in whom access to preoperative CCTA is not available.
Keywords: Non-coronary cusp. Left coronary cusp. Aortography. Angiographic aortic annulus measurements. Transcatheter aortic valve implantation.
Abreviaturas
Angio-TC: angiotomografía computarizada. CCI: cúspide coronaria izquierda. CNC: cúspide no coronaria. TAVI: implante percutáneo de válvula aórtica. VBE: válvula de balón expandible. VCP: válvula cardiaca percutánea.
INTRODUCCIÓN
Durante el implante percutáneo de válvula aórtica (TAVI), la angiotomografía computarizada (angio-TC) sigue siendo el factor clave para determinar las características de la válvula aórtica y predefinir las dimensiones del anillo a fin de seleccionar la válvula cardiaca percutánea (VCP) adecuada1,2. Se han descrito diversos protocolos angio-TC para obtener mediciones fidedignas y reproducibles del anillo aórtico3,4. Las mediciones obtenidas mediante ecocardiografía transtorácica y transesofágica también han mostrado una buena correlación, a la hora de determinar las dimensiones del anillo aórtico, con el patrón oro de mediciones directamente quirúrgicas y obtenidas mediante angio-TC5,6. En cualquier caso, la angio-TC proporcionó imágenes de mejor calidad y una valoración detallada del anillo aórtico, así como de otras anatomías que son útiles para acometer TAVI transfemorales (vasos aorto-ilíaco-femorales)7, lo cual convierte a la angio-TC en la estrategia por defecto a efectos de planificación preoperatoria.
La adecuada selección del tamaño de la VCP es un factor que tener en cuenta para evitar desajustes paciente-prótesis, reducir el riesgo de sobre o infradimensionamiento y, por ende, el mayor riesgo de mortalidad por cualquier causa y reintervenciones no programadas6,8,9. Aunque la angio-TC se ha establecido como el patrón oro para dimensionar el anillo previo al TAVI4, también se ha descrito la relación que existe entre la exposición a la radiación y el cáncer y entre el agente de contraste empleado y la nefropatía10,11. Además, en casos seleccionados, la angio-TC puede no ser viable previa al TAVI por una indicación clínica emergente o por el propio estado de inestabilidad del paciente.
La medición del anillo solo mediante aortografía se ha descrito como una técnica eficiente para determinar las dimensiones del anillo aórtico y seleccionar el tamaño de la VCP12,13. Partiendo de la proyección de las 3 cúspides, la determinación angiográfica de las dimensiones anatómicas con el agente de contraste (o dimensionamiento del balón) ayuda a identificar las dimensiones correctas del anillo cuando este dimensionamiento no se puede llevar a cabo mediante angio-TC14-17. Las mediciones obtenidas mediante aortografía guardan relación con las mediciones anatómicas perioperatorias directas del anillo aórtico13.
Con este trasfondo, nos propusimos investigar si las mediciones angiográficas del anillo aórtico entre la cúspide no coronaria (CNC) y la cúspide coronaria izquierda (CCI) guardan algún tipo de relación con las mediciones obtenidas por angio-TC a la hora de seleccionar el tamaño apropiado de VCP en una cohorte retrospectiva de pacientes no seleccionados de un único centro tratados con TAVI.
MÉTODOS
Población del estudio
Este análisis retrospectivo y observacional evaluó a todos los pacientes consecutivos tratados con TAVI transfemoral tras valoración del equipo multidisciplinar de la unidad de enfermedades cardiovasculares del German Heart Centre con sede en Múnich (Alemania). El TAVI transfemoral se llevó a cabo con un abordaje minimalista18 en todos los casos. Por su parte, la selección del tamaño de la VCP corrió a cargo de los operadores según una tabla de tamaños, las mediciones obtenidas mediante angio-TC y factores anatómicos tales como la distribución y gravedad del calcio coronario, las dimensiones del anillo aórtico, la altura y enfermedad coronarias.
Se incluyó en este estudio a todos los pacientes con valvulopatía tricuspídea calcificada nativa y una angio-TC de alta calidad aptos para el TAVI. La información de la intervención se obtuvo de una base de datos individualizada y cribada para todos los pacientes tratados con TAVI entre enero de 2014 y diciembre de 2021 en el German Heart Centre de Múnich (Alemania). Durante este periodo, se realizaron 2.500 TAVI por abordaje transfemoral con VCP autoexpandibles (365) y de balón expandible (1.865). Solo se incluyó en este análisis a los pacientes que recibieron válvulas de balón expandible (VBE) SAPIEN 3 o SAPIEN 3 Ultra (Edwards Lifesciences, Estados Unidos).
El estudio se llevó a cab de conformidad con los principios establecidos en la Declaración de Helsinki y todos los pacientes dieron su consentimiento informado previo a la intervención. La aprobación ética se obtuvo del comité de ética de la Technical University Munich con nº de registro OBSERVTAVI (#525/17). Las mediciones angio-TC se obtuvieron antes de implantar la VCP. Las mediciones angiográficas del anillo aórtico entre la CNC y la CCI se obtuvieron offline y quedaron documentadas en la base de datos. Las características clínicas basales, de la intervención (incluido el tamaño de la VCP implantada y la insuficiencia aórtica angiográfica tras el implante) y los resultados de las pruebas de laboratorio se obtuvieron de los datos del registro o de las propias historias clínicas de los pacientes, lo que fuese más apropiado. Se monitorizó y registró el seguimiento intrahospitalario y al alta atendiendo a los resultados de seguridad y eficacia definidos por los criterios estándar del Valve Academic Research Consortium 3 (VARC-3). También se estableció un periodo de seguimiento de 30 días por vía telefónica, visitas hospitalarias o cartas de seguimiento.
Mediciones obtenidas mediante angiotomografía computarizada
La angio-TC la analizaba 1 operador experimentado (HA) y la muestra de 40 casos para determinar la variabilidad interobservador la analizaba un segundo cardiólogo experimentado (JM). En la reconstrucción de la tomografía computarizada multicorte se obtuvieron medidas cuantitativas de las dimensiones del anillo aórtico (diámetro, perímetro y área mínimos, máximos y medios) según protocolos predefinidos2 con el software 3-Mensio (Pie Medical Imaging, Países Bajos). En resumen, se detectaron y seleccionaron los 3 puntos bisagra de las cúspides aórticas. Tras la identificación de los 3 puntos bisagra, la reconstrucción multiplanar automática mostró el anillo aórtico. Las mediciones de este se obtuvieron 0,5 mm por debajo de los puntos bisagra y se trazó el contorno anular para calcular área y diámetro derivados del perímetro (figura 1A). Para definir la medición uniplanar directa entre la CNC y la CCI (N-CCI) en la angio-TC se trazó 1 línea recta entre los puntos bisagra rojo (CCI) y amarillo (CNC) para determinar la longitud (figura 1B-C). El tamaño más apropiado de VCP se eligió siguiendo las recomendaciones de la tabla de tamaños y las consideraciones anatómicas (figura 1D). Las mediciones y cálculos obtenidos en la angio-TC se usaron para saber qué tamaño debía tener la VCP según las tablas de tamaño del fabricante. El área y diámetro medios del anillo aórtico se emplearon para seleccionar el tamaño de la VCP (23, 26 y 29 mm) y se codificaron como variable binaria paca cada categoría de tamaño. Solo cuando hubo 1 medida dentro del rango propuesto para un tamaño determinado de VCP según la tabla de tamaños del fabricante (dentro de la zona gris), se usó el área para decidir cuál debía ser el tamaño de la VCP.
Figura 1. Figura central. A: mediciones del anillo aórtico por angio-TC del diámetro mínimo (19,6 mm), máximo (25,9 mm) y medio (22,8 mm), perímetro (73 mm) y área (394 mm2). B: medición por angio-TC desde el punto más bajo entre la cúspide coronaria izquierda (punto rojo) y la no coronaria (punto amarillo) con una distancia de 23,0 mm. C: predicción de la angulación angiográfica por angio-TC para obtener la proyección estándar de las 3 cúspides (proyección oblicua anterior izquierda de los nervios craneales primero y séptimo) con la cúspide coronaria izquierda a 1 lado (punto rojo) y la no coronaria al otro (punto amarillo) y la distancia entre ambos (23,0 mm). D: resultado angiográfico tras implante de válvula de balón expandible según las mediciones tomográficas de la figura 1 A (SAPIEN 3 Ultra 23 mm).
Mediciones aortográficas
Todas las intervenciones las llevaron a cabo operadores experimentados en TAVI empleando un sistema monoplano de radiografía digital (Allura Xper FD 10 C, Royal Philips, Países Bajos) en una sala de hemodinámica híbrida dedicada. Todas las imágenes fluoroscópicas de la proyección de las 3 cúspides se analizaron después de la intervención y se guardaron con las medidas de la distancia obtenidas. Las mediciones angiográficas se obtuvieron offline de la inyección angiográfica de la raíz aórtica (anillo nativo sin la VCP implantada) con un catéter pigtail de 5 Fr colocado en la cúspide coronaria derecha en la proyección de las 3 cúspides14,15. La distancia entre los puntos bisagra de la CNC y la CCI la calcularon cardiólogos experimentados (HA y JM) con un software dedicado de Phillips (figura 2A-H). Las mediciones angiográficas se obtuvieron tras calibración automática (basada en el factor de calibración determinado por el software) y manual (empleando el catéter de 5 Fr como factor de calibración de referencia) para determinar la distancia en milímetros.
Figura 2. A: proyección oblicua anterior derecha estándar, en sentido craneal, de las 3 cúspides de los pares craneales primero y séptimo (círculo rojo) para determinar la medición longitudinal (flecha amarilla) en la mejor imagen contrastada (círculo verde). B: opción de calibración según la mejor imagen disponible (flecha amarilla). C: opción de medición (flecha roja) para determinar la distancia sobre el anillo aórtico (flecha amarilla) en las imágenes guardadas (círculo verde). D: imagen guardada (flecha roja) para «iniciar el análisis» (flecha amarilla). E: calibración manual mediante catéter 5 Fr (flecha y punta de flecha rojas) dibujando 2 líneas sobre el catéter (círculo rojo) comparando el factor de calibración dado por el software (0,1451 mm/ píxeles, flecha amarilla) con el obtenido mediante calibración manual (0,1486 mm/píxeles, punta de flecha amarilla). F: para hacer 1 «medición longitudinal» (flecha roja) dibujar una línea en el punto bisagra de las cúspides coronaria izquierda y no coronaria (círculo rojo). G: para calibración automática, seleccionar «aceptar calibración automática» (flecha amarilla); el factor de calibración dado por el software (0,1451 mm/píxeles) se empleará a efectos de medición (punta de flecha amarilla, factor de calibración de 0,1451 mm/píxeles). H: medición del anillo aórtico mediante calibración automática seleccionando la «medición longitudinal» (flecha roja) y dibujando 1 línea entre los puntos bisagra de las cúspides coronaria izquierda y no coronaria (círculo rojo).
Objetivos
Los objetivos fueron la correlación entre las mediciones angiográficas y obtenidas mediante angio-TC de la distancia entre la CNC y la CCI. También se analizaron los índices de eficacia definida según los criterios estándar del VARC-3 (éxito técnico, posición correcta y rendimiento pretendido según las definiciones del VARC-319) y el perfil de seguridad (múltiples válvulas, embolización de las mismas, implante de marcapasos e insuficiencia valvular más que moderada según las definiciones del VARC-3) en pacientes con mediciones concordantes y discordantes entre las mediciones angiográficas y las obtenidas mediante angio-TC.
También se comunicaron los índices de complicaciones intrahospitalarias definidos como conversión a cirugía, mortalidad perioperatoria, hemorragias amenazantes para la vida, hemorragias mayores y menores, complicaciones vasculares mayores y menores y mortalidad intrahospitalaria en pacientes con mediciones concordantes y discordantes. La mortalidad a 30 días, la insuficiencia cardia-
ca crónica, los accidentes cerebrovasculares, la disfunción valvular, el gradiente aórtico medio y la insuficiencia aórtica también se recogieron.
Análisis estadístico
Las variables categóricas se expresaron como frecuencias y proporciones y se compararon con la prueba de la χ2 y la prueba exacta de Fisher, la que fuese más conveniente. La normalidad de los datos continuos se comprobó empleando la prueba de Shapiro-Wilk y estos se expresaron como media (± desviación estándar) o mediana (rango intercuartil [RIQ]), lo que fuese más conveniente y se compararon, respectivamente, empleando la prueba t no emparejada o la prueba U de Whitney-Wilcoxon.
La población del estudio se clasificó en cohorte de derivación (n = 1.256) y de validación (n = 40 cases). El grupo de interés del estudio se obtuvo de la cohorte de derivación (n = 393). En dicha cohorte, la selección de los tamaños específicos de las VCP (23, 26 y 29 mm) según valoración de la angio-TC (patrón oro) se clasificó como 1 variable binaria y a continuación se comparó a la selección del tamaño de la VCP según la aortografía. Después, se hizo un análisis de regresión logística con la variable binaria derivada de la selección de la VCP según la angio-TC como variable dependiente y las mediciones de la distancia aortográfica se consideraron como 1 variable independiente. Luego se hizo un análisis de las curvas ROC (receiver operating characteristic) para identificar los criterios de corte óptimos (distancia en mm, índice de Youden) y determinar los rangos de cada diámetro según las medidas angiográficas de la distancia para cada tamaño de VCP. El valor más bajo de la VCP más pequeña y el más alto de la más grande se determinaron usando el RIQ (diferencia entre el percentil 75 y el 25) obtenido de la distribución de la población de derivación. El tamaño de las VCP se propuso según la aortografía con calibración manual o automática. Se emplearon la sensibilidad, especificidad, valores predictivos positivo y negativo y probabilidad positiva y negativa para determinar el índice de precisión diagnóstica. Se emplearon gráficos de Bland-Altman para comprobar la correlación entre las CNC-CCI según angio-TC, CNC-CCI según aortografía con calibración manual y CNC-CCI según aortografía con calibración automática.
Dos cardiólogos independientes llevaron a cabo un análisis inter e intraobservador que empleó los coeficientes de correlación interclase (con acuerdo absoluto) y de Pearson para datos dicotomizados en una muestra de 40 casos.
A efectos de validación interna, se aplicaron valores de corte establecidos previamente para determinar el tamaño de la VCP mediante aortografía en una cohorte independiente de 40 pacientes (cohorte de validación) que se compararon con el patrón oro (determinación del tamaño mediante angio-TC).
Las parejas de tamaños resultantes según la angiografía y la angio-TC se generaron como un grupo de interés del estudio y se clasificaron como concordantes o discordantes tras 1 comparativa que empleó la prueba de la χ2 o la prueba exacta de Fisher, la prueba t no pareada o la prueba U de Whitney-Wilcoxon, la que fuese más conveniente. El análisis estadístico se hizo con el paquete de software estadístico IBM SPSS (versión 27, IBM Corporation, Estados Unidos). Todas las pruebas fueron bilaterales. Los valores p = 0,05 se consideraron significativos a nivel estadístico.
RESULTADOS
Tras la fase de exclusión, se valoró a 1.256/2.500 pacientes tratados con VBE (50,2%) en la cohorte de validación (figura 3). Las mediciones del diámetro según la aortografía fueron viables en 393 de estos pacientes (15,7%) (grupo de interés del estudio).
Figura 3. Diagrama de flujo de la fase de inclusión del estudio.
Tanto las características basales como las de la angio-TTC se detallan en la tabla 1. La mediana de edad de toda la población fue 81 años (77-85) (34,3% mujeres) con una función de eyección del ventrículo izquierdo del 60% [47-60] y una puntuación media en la escala EuroScore II de 3,74 (2,14-6,24).
Tabla 1. Características basales
| Válvula de balón expandible (n = 393) | |
|---|---|
| Edad, años | 81 [77 - 85] |
| Varones | 257 (65,7) |
| IMC, kg/m2 | 26,2 [23,8-29,5] |
| ASC, m2 | ASC, m2 |
| Clase funcional III-IV según la NYHA | 238 (60,9) |
| Clase III-IV según la CCS | 32 (8,2) |
| Hipertensión arterial | 353 (90,3) |
| Diabetes mellitus | 131 (33,5) |
| Dislipemia | 265 (67,8) |
| EPOC | 19 (4,9) |
| Antecedentes tabáquicos | 123 (31,5) |
| EAP | 77 (19,7) |
| ICP previa | 162 (41,4) |
| EC | 341 (87,2) |
| 1 vaso | 204 (52,2) |
| 2 vasos | 57 (14,6) |
| 3 vasos | 80 (20,5) |
| Implante de marcapasos | 36 (9,2) |
| IM previo | 43 (11) |
| CABG previa | 37 (9,5) |
| Accidente cerebrovascular/AIT previos | 60 (15,3) |
| Fibrilación auricular | 149 (38,1) |
| Niveles de creatinina, mg/dl | 1,11 [0,89-1,37] |
| TFGe, ml/min | 60 [46-76] |
| Diálisis | 3 (0,8) |
| Insuficiencia aórtica grado 2+ | 39 (10) |
| AVA, mm2 | 0,70 [0,60-0,84] |
| FEVI, % | 60 [47-60] |
| Gradiente Ao medio, mmHg | 42 [36-49] |
| Gradiente Ao máximo, mmHg | 68 [59-80] |
| PAPs, mmHg | 42 [33-45] |
| EuroScore I, % | 11,84 [7,82-19,46] |
| EuroScore II, % | 3,74 [2,14 - 6,24] |
| Mediciones obtenidas mediante angio-TC | |
| Diámetro mínimo, mm | 21,6 [20,1-23,2] |
| Diámetro máximo, mm | 27,9 [26,2-29,6] |
| Diámetro medio, mm | 24,8 [23,2-26,3] |
| Área, mm2 | 474 [414-533] |
| Perímetro, mm | 79 [74-84] |
| Estimación visual de la gravedad de la calcificación valvular | |
| Leve | 80 (20,5) |
| Moderada | 185 (47,3) |
| Grave | 126 (32,2) |
| Estimación visual de la gravedad de la calcificación anular | |
| Ninguna | 55 (14,1) |
| Leve | 268 (68,5) |
| Moderada | 67 (17,1) |
| Grave | 1 (0,3) |
| Estimación visual de la gravedad de la calcificación del TSVI | |
| Ninguna | 223 (57) |
| Leve | 145 (37,1) |
| Moderada | 23 (5,9) |
|
Los datos expresan n (%) o media ± desviación estándar o mediana [rango intercuartil]. %: porcentaje; AIT: accidente isquémico transitorio; angio-TC: angiotomografía computarizada; Ao: aórtico; ASC: área de superficie corporal; AVA, área valvular aórtica; CABG: cirugía de revascularización coronaria; CCS: clasificación de la gravedad de la angina según la Canadian Cardiovascular Society; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IMC: índice de masa corporal; mg/dl: miligramos por decilitro; ml/min: mililitros por minuto; mm2: milímetros cuadrados; mmHg: milímetros de mercurio; NYHA: clasificación funcional de la New York Heart Association; PAPs: presión arterial pulmonar sistólica; TFGe: tasa de filtrado glomerular estimada; TSVI: tracto de salida del ventrículo izquierdo. |
|
Las características de la intervención se muestran en la tabla 2. El tiempo de la intervención, la dosis fluoroscópica y el tiempo de fluoroscopia fueron 48 minutos [38-59], 919 cGys/cm2 [444-1.712] y 10,9 [8,2-14,7] minutos, respectivamente. La tasa de éxito técnico se alcanzó en el 95,4% de los casos. En cuanto a las complicaciones intrahospitalarias (tabla 3), los índices de eventos hemorrágicos mayores, complicaciones vasculares mayores y mortalidad intrahospitalaria fueron del 16,1%, 14,6% y 1,5%, respectivamente.
Tabla 2. Comparativa entre el grupo transyugular y el transfemoral (casos exitosos)
| Válvula de balón expandible (n = 393) | |
|---|---|
| Electiva | 389 (99,5) |
| Necesidad de intubación | |
| Profiláctica | 5 (1,3) |
| Urgente | 8 (2) |
| Uso de ECMO | |
| Profiláctico | 0 (0) |
| Urgente | 1 (0,3) |
| Uso de dispositivo de protección cerebral | 16 (4,1) |
| Tamaño de la válvula implantada | |
| 23 mm | 118 (30,2) |
| 26 mm | 207 (52,9) |
| 29 mm | 66 (16,9) |
| VCP implantada | |
| SAPIEN 3 | 95 (24,3) |
| SAPIEN 3 Ultra | 296 (75,7) |
| Predilatación | 166 (42,5) |
| Posdilatación | 54 (13,8) |
| Medio de contraste, ml | 139 [110-172] |
| Tiempo de fluoroscopia, min | 10,9 [8,2-14,7] |
| Dosis de fluoroscopia, cGys/cm2 | 919 [444-1712] |
| Tiempo de la intervención, min | 48 [38 - 59] |
| Éxito técnico | 373 (95,4) |
| Éxito de la intervención | 384 (98,2) |
| Rendimiento pretendido | 380 (97,2) |
| Posición correcta | 389 (99,5) |
| Múltiples válvulas | 1 (0,3) |
| Complicaciones en el punto de acceso | 18 (4,6) |
| Embolización de la VCP | 1 (0,3) |
| Taponamiento cardiaco | 5 (1,3) |
| Rotura anular | 3 (0,8) |
| Deterioro coronario | 0 (0) |
| RCP operatoria | 2 (0,5) |
| Conversión a cirugía | 4 (1) |
| Mortalidad operatoria | 3 (0,8) |
| IA angiográfica ≥ moderada | 5 (1,3) |
| Gradiente medio posoperatorio, mmHg | 9 [5-10] |
| Días en la UCI | 1 [1-1] |
|
Los datos expresan n (%) o media ± desviación estándar o mediana [rango intercuartil]. cGys/cm2: centiGrays por centímetro cuadrado; ECMO: oxigenador extracorpóreo de membrana; IA: insuficiencia aórtica; min: minutes; ml: mililitros; mm: milímetros; RCP: reanimación cardiopulmonar; UCI: unidad de cuidados intensivos; VCP: válvula cardiaca percutánea. |
|
Tabla 3. Complicaciones intrahospitalarias
| Válvula de balón expandible (n = 393) | |
|---|---|
| Hemorragias amenazantes para la vida | 11 (2,8) |
| Hemorragias mayores | 63 (16,1) |
| Hemorragias menores | 65 (16,6) |
| Complicaciones vasculares mayores | 57 (14,6) |
| Complicaciones vasculares menores | 80 (20,5) |
| AIT | 0 (0) |
| Accidente cerebrovascular mayor | 4 (1) |
| Accidente cerebrovascular menor | 5 (1,3) |
| Infarto de miocardio | 3 (0,8) |
| Nuevo implante de marcapasos | 26 (6,6) |
| Mortalidad intrahospitalaria | 6 (1,5) |
|
Los datos expresan n (%). |
|
No se observó ninguna diferencia en las tasas de eficacia (94,2 frente al 96%; p = 0,60) ni en el perfil seguridad (90,9 frente al 91,9%;
p = 0,84) entre las parejas discordantes y las concordantes en lo que respecta a las mediciones tomográficas y angiográficas, respectivamente, empleando la aortografía con calibración manual (tabla 4).
Tabla 4. Complicaciones operatorias en tamaños valvulares concordantes y discordantes empleando la calibración manual y automática en aortografía frente a angio-TC (n = 393)
| Todas (n = 393) |
Discordantes (n = 121) |
Concordantes (n = 272) |
p | |
|---|---|---|---|---|
| Eficacia | 375 (95,4) | 114 (94,2) | 261 (96,0) | 0,60a |
| Éxito técnico | 386 (98,2) | 118 (97,5) | 268 (98,5) | 0,44b |
| Posición correcta | 391 (99,5) | 120 (99,2) | 271 (99,6) | 0,52b |
| Rendimiento pretendido | 382 (97,2) | 117 (96,7) | 265 (97,4) | 0,74b |
| Seguridad | 360 (91,6) | 110 (90,9) | 250 (91,9) | 0,84a |
| Múltiples válvulas | 1 (0,3) | 0 (0) | 1 (0,4) | > 0,99b |
| Embolización de la VCP | 1 (0,3) | 0 (0) | 1 (0,4) | > 0,99b |
| Nuevo implante de marcapasos |
27 (6,9) | 9 (7,4) | 18 (6,6) | 0,83a |
| IA > moderada tras implante de la válvula | 5 (1,3) | 2 (1,7) | 3 (1,1) | 0,64b |
| Conversión a cirugía | 4 (1,0) | 1 (0,8) | 3 (1,1) | > 0,99b |
| Mortalidad operatoria | 3 (0,8) | 1 (0,8) | 2 (0,7) | > 0,99b |
| Hemorragias amenazantes para la vida | 11 (2,8) | 5 (4,1) | 6 (2,2) | 0,32b |
| Hemorragias mayores | 64 (16,3) | 20 (16,5) | 44 (16,2) | > 0,99a |
| Hemorragias menores | 66 (16,8) | 16 (13,2) | 50 (18,4) | 0,24a |
| Complicaciones vasculares mayores |
58 (14,8) | 17 (14) | 41 (15,1) | 0,87a |
| Complicaciones vasculares menores |
81 (20,6) | 22 (18,2) | 59 (21,7) | 0,50a |
| Mortalidad intrahospitalaria |
6 (1,5) | 2 (1,7) | 4 (1,5) | > 0,99b |
|
Los datos expresan n (%). |
||||
Se observó una tímida correlación entre el tamaño de las VCP según la angio-TC y la aortografía: tamaños de 23, 26 y 29 mm se asociaron a coeficiente de correlación de Spearman de 0,528 (p < 0,01), 0,451 (p < 0,01) y 0,579 (p < 0,01). Para más información, consultar las tablas 1-3 del material adicional.
Los valores de corte angiográficos sugeridos para cada tamaño de VCP se muestran en la tabla 5. En resumen, los mejores rangos de diámetro para optar por VBE de 23, 26 y 29 mm fueron de 18,46 a 22,55 mm, 21,55 a 24,55 mm y ≥ 24,25 a < 28,50 mm, respectivamente. Los coeficientes de correlación interclase intra e interobservador fueron 0,931 (IC95%, 0,869-0,963; p < 0,01) y 0,902 (IC95%, 0,814-0,948; p < 0,01), respectivamente (ver tabla 4 del material adicional). La distancia CNC-CCI según la angio-TC y CNC-CCI tuvo un coeficiente de correlación interclase de 0,885 (IC95%, 0,834-0,920; p < 0,01) (figura 4).
Tabla 5. Tabla con tamaños angiográficos sugeridos para la válvula de balón expandible SAPIEN
| 23 mm | 26 mm | 29 mm | |
|---|---|---|---|
| Distancia CNC-CCI | 18,46–22,55 | 21,55–24,55 | 24,25–28,50 |
|
CNC-CCI: cúspide no coronaria a coronaria izquierda; mm: milímetros; mm2: milímetros cuadrados. |
|||
Figura 4. Gráficos de Bland-Altman: A: angio-TC frente a AOCM; B: angio-TC frente a AOCA. Angio-TC: angiotomografía computarizada; AOCA: aortografía con calibración automática; AOCM: aortografía con calibración manual; CCI: coeficiente de correlación interclase; DE: desviación estándar; IC: intervalo de confianza.
Los valores obtenidos se comprobaron con los de la cohorte de validación (n = 40) y dieron como resultado un análisis diagnóstico de moderado a bueno, un buen coeficiente de correlación de Spearman [0,711 (IC95%, 0,506-0,840; p < 0,01)] y una moderada precisión diagnóstica (tabla 5 del material adicional). La cohorte de validación de 40 pacientes se muestra en las tablas 6-10 del material adicional.
El seguimiento a 30 día se muestra en la tabla 6. No se observó ninguna diferencia en la mortalidad a 30 días entre las mediciones tomográficas y angiográficas discordantes y concordantes (1,7 frente al 2,6%; p = 0,73). Tampoco se observó ninguna diferencia a los 30 días en el gradiente medio (11 [10-16] frente a 12 [10-15] mmHg; p = 0,76) y una insuficiencia aórtica más que moderada (3,2 frente al 1,1%; p = 0,34) según la aortografía con calibración manual entre las mediciones tomográficas y angiográficas discordantes y concordantes, respectivamente.
DISCUSIÓN
Este estudio observacional, retrospectivo y de un único centro investigó la correlación y precisión diagnóstica existentes entre las mediciones angiográficas y tomográficas a la hora de determinar el tamaño de las VCP según 1 única medición angiográfica obtenida entre la CNC y la CCI en pacientes que recibieron VBE.
En relación a este objetivo, los hallazgos más significativos son: a) la determinación de las dimensiones del anillo aórtico a partir de las mediciones de la distancia entre las CNC y CCI es reproducible; b) la precisión diagnóstica entre la determinación de las dimensiones del anillo aórtico según la angio-TC y la angiografía es moderadamente sólida (tabla 5 del material adicional) y c) la validación interna de rangos de diámetro previamente establecidos para la determinación de las dimensiones del anillo aórtico según la angiografía tuvo una precisión diagnóstica moderada.
Se observó una precisión diagnóstica global moderada, así como una correlación entre las mediciones angiográficas y las obtenidas mediante angio-TC en la determinación de las dimensiones del anillo aórtico para la selección de VCP. El uso de, solo, mediciones angiográficas podría ampliar el abordaje minimalista del TAVI a escenarios en los que la angio-TC no es una opción viable.
El método patrón oro para dimensionar el anillo aórtico es la medición quirúrgica directa que resulta imposible en el contexto del TAVI. En este estudio se han empleado diferentes métodos reproducibles no invasivos para determinar las dimensiones del anillo aórtico3,5-7,20. No obstante, la angio-TC se ha convertido en la herramienta diagnóstica por excelencia para determinar las dimensiones4 del anillo aórtico gracias a su extraordinaria reproducibilidad. Antes de que la angio-TC se convirtiera en el método patrón oro, se empleaban mediciones angiográficas que tenían una buena correlación con las mediciones perioperatorias directas obtenidas en pacientes tratados de reemplazo quirúrgico de válvula aórtica (r = 0,93)13. La comparativa entre ecocardiografía transesofágica y angio-TC y mediciones directas perioperatorias descrita por Wang et al.20 reveló una correlación moderada. Nuestro estudio confirmó una precisión diagnóstica y correlación moderadas entre las mediciones angiográficas y tomográficas obtenidas para determinar el tamaño de la VCP. Se obtuvieron resultados parecidos en una pequeña muestra de 50 pacientes en la que se dimensionaron adecuadamente el 60% de las válvulas con una coincidencia en las mediciones entre buena y moderada en las selecciones de la angiografía y la angio-TC12. Esto viene a demostrar que las mediciones angiográficas podrían emplearse, también, en escenarios en los que la angio-TC no está disponible o comporta más riesgos.
Exposición a la radiación durante valoración por angio-TC
Ha quedado demostrado que, potencialmente, los estudios de imágenes asociados al TAVI pueden aumentar la exposición a la radiación de 15,4 a 79 milisieverts (mSv). Solo el TAVI está asociado a una dosis efectiva de 26.9 ± 8 mSv y a un producto dosis-área de 2006,3 ± 1152,2 centiGrays/cm2 (cGys/cm2). Esta exposición a la radiación se asocia a un mayor riesgo de muerte por cáncer de pulmón en mujeres y varones del 70 y 50%, respectivamente y a un mayor riesgo de leucemia entre el 12 y el 21% y el 23 y el 33% en mujeres y varones, respectivamente10. Se debe mencionar que la población de nuestro estudio estuvo menos expuesta a la radiación de la intervención (919 [444-1712] cGys/cm2) durante el TAVI incluido el dimensionamiento del anillo aórtico lo cual, a su vez, reduciría el riesgo asociado de cáncer. En pacientes tratados con TAVI, el uso intraoperatorio de protocolos con dosis bajas de radiación consigue eficacias similares a las que se obtienen con los protocolos estándar sin comprometer la seguridad en modo alguno21, lo cual reduce la exposición a la radiación y sus riesgos asociados. Además, el dimensionamiento del balón sumado a nuestras mediciones angiográficas propuestas aumentaría la precisión a la hora de determinar el tamaño más apropiado de la VCP. Sobre todo, cuando la medición aortográfica del anillo se acerca al valor de corte entre 2 tamaños distintos de VCP, se puede emplear el dimensionamiento de balón para confirmar el uso del dispositivo más grande o más pequeño15. Aunque el empleo adicional del dimensionamiento del balón puede aumentar la exposición a la radiación por la adquisición extra de imágenes, el uso de un protocolo con dosis bajas de radiación reduce este riesgo sin afectación sobre el resultado final21.
Nefropatía inducida por contraste
Al margen de los beneficios que supone minimizar los riesgos asociados a la radiación, preocupa enormemente la nefropatía inducida por contraste en pacientes tratados con TAVI. La insuficiencia renal crónica se da en el 38% de los pacientes con estenosis valvular aórtica, el 55, 30 y 15% de los cuales presentan insuficiencia renal crónica leve, moderada y grave, respectivamente22. La administración de agentes de contraste puede exacerbar la insuficiencia renal crónica en pacientes con la enfermedad en grado entre moderado y grave (del 2 al 17%)11 y aumentar la tasa de mortalidad estimada a los 5 años22.
La literatura médica ya ha confirmado el perfil de seguridad y eficacia del TAVI frente al reemplazo quirúrgico de válvula aórtica en todos los rangos de riesgo quirúrgico23-28. Contra este trasfondo, nuestros datos sugieren que el uso de la aortografía para dimensionar correctamente VCP en indicaciones seleccionadas es seguro. En los casos en los que el dimensionamiento de la VCP mediante aortografía coincidía con el tamaño de la VCP según la angio-TC, los favorables resultados de seguridad y eficacia se parecían a los de estudios ya publicados en categorías similares de pacientes de riesgo.
Limitaciones del estudio
Este estudio está limitado por su propia naturaleza observacional y de un único centro. Haría falta un estudio aleatorizado o prospectivo que confirmara nuestros resultados. Además, haber utilizado 1 único modelo equipo de fluoroscopia podría limitar la aplicabilidad de los hallazgos a otros equipos de otros fabricantes. Además, por problemas de espacio, no siempre pudimos contar con un equipo de angiografía para determinar las dimensiones del anillo mediante calibración manual o automática. Tanto los valores más altos como los más bajos de la tabla de tamaños sugerida se determinaron según el rango intercuartil de los percentiles 75 y 25, respectivamente, por la falta de valores fuera de rango más altos o bajos que nos permitiría determinar estos valores.
CONCLUSIONES
Las mediciones angiográficas del anillo aórtico son reproducibles y revelan una correlación y precisión diagnóstica moderadas frente a mediciones obtenidas mediante angio-TC a la hora de seleccionar el tamaño adecuado de la VCP de balón expandible. Una técnica que podría ser útil en situaciones en las que no se puede hacer una angio-TC, para evitar exposiciones a radiaciones altas, en pacientes en estado crítico y para minimizar el riesgo de nefropatía inducida por contraste. Esta estrategia podría contribuir al abordaje minimalista del TAVI en pacientes seleccionados.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
H. A. Alvarez-Covarrubias: diseño, metodología, análisis formal, investigación, recursos y redacción del artículo original. M. Kasel: diseño, redacción y edición del artículo original. J.M. Michel: redacción del artículo original y análisis formal. S. Cassese: visualización e investigación: S. Kufner: supervisión y recogida de datos. C. Duesmann, C. Pellegrini, T. Rheude y N. P. Mayr: recursos y recogida de datos. H. Schunkert: supervisión, redacción del artículo y edición de la visualización. A. Kastrati: supervisión, visualización, redacción, revisión y edición del artículo. E. Xhepa: redacción y supervisión del artículo y análisis formal. G. Borrayo-Sánchez y M. Joner: diseño, redacción y revisión del artículo y gestión del proyecto.
CONFLICTO DE INTERESES
M. Kasel declaró ser proctor y consultor de Edwards Lifesciences, aunque sin relación alguna con este artículo; J. M. Michel declaró ser proctor para Boston Scientific, aunque sin relación alguna con este artículo; S. Cassese declaró haber recibido subvenciones de Abbott Vascular, Boston Scientific y SIS Medical AG, honorarios como asesor de SIS Medical AG y como conferenciante de Abiomed, Astra Zeneca, SIS Medical AG y Teleflex, aunque sin relación alguna con este artículo; S. Kufner declaró haber recibido honorarios como conferenciante y consultor de AstraZeneca, Bristol Myers Squibb, Bentley y Translumina, aunque sin relación alguna con este artículo; C. Pellegrini declaró haber recibido una subvención de Else-Kröner Fresenius Memorial Stipendium, aunque sin relación alguna con este artículo; T. Rheude declaró haber recibido honorarios como conferenciante de SIS Medical AG y Astra Zeneca, aunque sin relación alguna con este artículo; H. Schunkert declaró haber recibido honorarios como consultor y conferenciante de AMGEN, Daiichi-Sankyo, MSD SHARP&DOHME, Astra Zeneca, Bayer Vital, Boehring-Ingelheim, Novartis, Servier y Synlab, aunque sin relación alguna con este artículo; A. Kastrati declaró tener una patente con número de registro PCT/EP2021/053116 y haber participado en la Junta de Monitorización de Datos y Seguridad del ensayo DSMB-TARGET, aunque sin relación alguna con este artículo; E. Xhepa declaró haber recibido honorarios como conferenciante de Astra Zeneca, Boston Scientific y SIS Medical AG y asistente de congresos organizados por Abbott Vascular, aunque sin relación alguna con este artículo; G. Borrayo declaró haber sido presidente de la Asociación Nacional de Cardiólogos de México entre 2020 y 2022; M. Joner declaró haber recibido subvenciones de Boston Scientific, Cardiac Dimensions, Edwards Lifesciences, Infraredx, honorarios como asesor de Biotronik, TriCares, Veryan y Shockwave y como conferenciante de Abbott Vascular, Biotronik, Boston Scientific, Edwards Lifesciences, Cardiac Dimensions, Astra Zeneca, Recor Medical y Shockwave, aunque sin relación alguna con este artículo. Los demás autores no han declarado ningún conflicto de intereses. Este artículo es parte de un programa de máster y doctorado en ciencias médicas de la Universidad Nacional Autónoma de México (UNAM).
¿QUÉ SE SABE DEL TEMA?
- Se ha investigado poco la implementación de la aortografía como herramienta diagnóstica para determinar las dimensiones del anillo aórtico .
- Estudios publicados emplean la aortografía para determinar las dimensiones del balón en el tratamiento de la valvuloplastia en la era pre-TAVI.
- La aortografía lleva tiempo empleándose en la era TAVI como método para determinar el plano anular y desplegar la válvula.
¿QUÉ APORTA DE NUEVO?
- La aortografía como técnica de imágenes complementaria a la angiotomografía computarizada (angio-TC) puede ayudar a determinar qué tamaño debe tener la válvula.
- Las mediciones obtenidas mediante aortografía no son reproducibles y ofrecen una precisión moderada a la hora de decidir el mejor tamaño de la válvula en casos en los que la angio-TC no está disponible y los pacientes pre-
cisan tratamiento inmediato.
BIBLIOGRAFÍA
1. Clavel M-A, Messika-Zeitoun D, Pibarot P, et al. The complex nature of discordant severe calcified aortic valve disease grading: new insights from combined Doppler echocardiographic and computed tomographic study. J Am Col Cardiol. 2013;62:2329-2338.
2. Kasel AM, Cassese S, Bleiziffer S, et al. Standardized Imaging for Aortic Annular Sizing: Implications for Transcatheter Valve Selection. JACC: Cardiovasc Imaging. 2013;6(2):249-62.
3. Francone M, Budde RPJ, Bremerich J, et al. CT and MR imaging prior to transcatheter aortic valve implantation: standardisation of scanning protocols, measurements and reporting-a consensus document by the European Society of Cardiovascular Radiology (ESCR). Eur Radiol. 2020;30:2627-2650.
4. Blanke P, Weir-McCall JR, Achenbach S, et al. Computed Tomography Imaging in the Context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR): An Expert Consensus Document of the Society of Cardiovascular Computed Tomography. JACC: Cardiovasc Imaging. 2019;12:1-24.
5. Fox H, Hemmann K, Lehmann R. Comparison of transthoracic and transesophageal echocardiography for transcatheter aortic valve replacement sizing in high-risk patients. J Echocardiogr. 2020;18:47-56.
6. Vo AT, Nakajima T, Nguyen TTT, et al. Aortic prosthetic size predictor in aortic valve replacement. J Cardiothorac Surg. 2021;16:221.
7. Cerillo AG, Mariani M, Berti S, Glauber M. Sizing the aortic annulus. Ann Cardiothorac Surg. 2012;1:245-256.
8. Okuno T, Heg D, Lanz J, et al. Heart valve sizing and clinical outcomes in patients undergoing transcatheter aortic valve implantation. Catheter Cardiovasc Interv. 2021;98:E768-e79.
9. Medalion B, Blackstone EH, Lytle BW, White J, Arnold JH, Cosgrove DM. Aortic valve replacement: is valve size important? J Thorac Cardiovasc Surg. 2000;119:963-974.
10. Karambatsakidou A, Omar A, Chehrazi B, Rück A, Scherp Nilsson J, Fransson A. Skin dose, effective dose and related risk in transcatheter aortic valve implantation (TAVI) procedures: is the cancer risk acceptable for younger patients? Radiat Prot Dosimetry. 2016;169:225-231.
11. Davenport MS, Perazella MA, Yee J, et al. Use of Intravenous Iodinated Contrast Media in Patients with Kidney Disease: Consensus Statements from the American College of Radiology and the National Kidney Foundation. Radiology. 2020;294:660-668.
12. Gansera L, Ulm B, Bramlage P, et al. Utility of conventional aortic root shot angiography for SAPIEN 3 prosthesis sizing in TAVI: feasibility and inter-reader variability. Open Heart. 2019;6:e001201.
13. Mukharji J, Sloan TJ, Estrera AS, Lipscomb KM. Measurement of aortic root size by biplane angiography before cardiac valve replacement. Am J Cardiol. 1984;53:1084-1086.
14. Kasel AM, Cassese S, Leber AW, von Scheidt W, Kastrati A. Fluoroscopy-guided aortic root imaging for TAVR: “follow the right cusp” rule. JACC Cardiovasc Imaging. 2013;6:274-275.
15. Shivaraju A, Thilo C, Ott I, et al. Tools and Techniques - Clinical: Fluoroscopic balloon sizing of the aortic annulus before transcatheter aortic valve replacement (TAVR) - follow the “right cusp rule”. EuroIntervention. 2015;
11:840-842.
16. Shivaraju A, Ott I, Cassese S, et al. Fluoroscopic calcification-guided optimal deployment projection during transcatheter aortic valve replacement - “The eye of the pigtail.” (Follow the right cusp rule- Part II). Catheter Cardiovasc Interv. 2016;87:996-998.
17. Kasel AM, Shivaraju A, Scheidt Wv, Kastrati A, Thilo C. Anatomic Guided Crossing of a Stenotic Aortic Valve Under Fluoroscopy: “Right Cusp Rule, Part III”. JACC: Cardiovasc Interv. 2015 Jan;8(1 Pt A):119-120.
18. Frangieh AH, Ott I, Michel J, et al. Standardized Minimalistic Transfemoral Transcatheter Aortic Valve Replacement (TAVR) Using the SAPIEN 3 Device: Stepwise Description, Feasibility, and Safety from a Large Consecutive Single-Center Single-Operator Cohort. Struct Heart. 2017;1:169-178.
19. Généreux P, Piazza N, Alu MC, et al. Valve Academic Research Consortium 3: updated endpoint definitions for aortic valve clinical research. Eur Heart J. 2021;42:1825-1857.
20. Wang H, Hanna JM, Ganapathi A, et al. Comparison of aortic annulus size by transesophageal echocardiography and computed tomography angiography with direct surgical measurement. Am J Cardiol. 2015;115:1568-1573.
21. Michel JM, Hashorva D, Kretschmer A, et al. Evaluation of a Low-Dose Radiation Protocol During Transcatheter Aortic Valve Implantation. Am J Cardiol. 2021;139:71-78.
22. Bohbot Y, Candellier A, Diouf M, et al. Severe Aortic Stenosis and Chronic Kidney Disease: Outcomes and Impact of Aortic Valve Replacement. J Am Heart Assoc. 2020;9:e017190.
23. Leon MB, Smith CR, Mack M, et al. Transcatheter Aortic-Valve Implantation for Aortic Stenosis in Patients Who Cannot Undergo Surgery. N Engl J Med. 2010;363:1597-1607.
24. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus Surgical Aortic-Valve Replacement in High-Risk Patients. N Engl J Med. 2011;364:2187-2198.
25. Thyregod HGH, Steinbrüchel DA, Ihlemann N, et al. Transcatheter Versus Surgical Aortic Valve Replacement in Patients With Severe Aortic Valve Stenosis. J Am Coll Cardiol. 2015;65:2184-2194.
26. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
27. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
28. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.

RESUMEN
Introducción y objetivos: El uso del implante percutáneo de válvula aórtica (TAVI, transcatheter aortic valve implantation) está aumentando en el tratamiento de la estenosis aórtica grave. Por ello, el uso de TAVI en la vida real debe monitorizarse. Evaluamos los resultados del TAVI en términos de calidad de vida relacionada con la salud (CVRS), resultados clínicos y uso de recursos teniendo en cuenta un marcador de riesgo válido.
Métodos: Estudio observacional prospectivo incluyendo todos los pacientes consecutivos con estenosis aórtica grave tratados con TAVI (Edwards SAPIEN 3, acceso transfemoral) en 2018. Se evaluaron de forma sistemática la CVRS (EQ-5D-5L, Short Form-36 Health Survey, Kansas City Cardiomyopathy Questionnaire), los resultados clínicos y el uso de recursos (estancia en planta/unidad de cuidados intensivos). La evaluación se hizo antes de la intervención (basal), al alta y después de 1,6 y 12 meses del implante. Se aplicaron modelos de regresión multivariante para evaluar los resultados mientras se controlaba el riesgo del paciente (por ejemplo, escala de riesgo de la Society of Thoracic Surgeons).
Resultados: Se incluyó a 76 pacientes (el 50% mujeres), con una edad media de 82,05 ± 4,76, y el 55% con riesgo intermedio-alto. Hubo un 97,37% de éxito del implante y la tasa de muerte de causa cardiovascular fue del 2,63% al año. Se consiguieron reducciones significativas en los gradientes medios y máximos, y se mantuvieron durante las visitas de seguimiento. Las estancias medias en planta (5,26 ± 4,05 días) y en la unidad de cuidados intensivos (0,22 ± 0,64 días) fueron bajas. Se detectaron mejoras significativas (todo ajustado p < 0,05) en el Kansas City Cardiomyopathy Questionnaire (puntuaciones generales), el EQ-5D-5L y el Short Form-36 (componente físico).
Conclusiones: Esta investigación destaca resultados clínicos positivos que se traducen en mejoras significativas en términos de calidad de vida de los pacientes. El uso de recursos, que fue en general bajo, también fue dependiente de la escala de riesgo de la Society of Thoracic Surgeons. (Estudio SARU, código: 2017-01, Murcia, España).
Palabras clave: Estenosis valvular aórtica. Calidad de vida. Recursos sanitarios. Estancia. Resultado clínico. Carga de la enfermedad.
ABSTRACT
Introduction and objectives: Transcatheter aortic valve implantation (TAVI) is an increasingly used procedure to treat severe aortic stenosis (AS) that should be monitored in the real-world routine clinical practice. We assessed TAVI outcomes (SAPIEN 3) in terms of the patient’s health-related quality of life (HRQoL), clinical endpoints, and resource utilization considering a valid risk score.
Methods: This was an observational prospective study including all consecutive patients with severe AS treated with TAVI (Edwards SAPIEN 3, transfemoral access) conducted during the calendar year of 2018. A systematic assessment of the patients’ HRQoL (EQ-5D-5L, the 36-item Short Form Health Survey, and the Kansas City Cardiomyopathy Questionnaire), clinical endpoints, and resource utilization (length of stay at the hospital/intensive care unit setting) was implemented. Assessment was scheduled before the procedure (baseline), at discharge, and 1, 6, and 12 months after implantation. Multivariate regression models were applied to test outcomes while controlling the patients’ risk (eg, Society of Thoracic Surgeons risk score).
Results: A total of 76 patients (50% female) with a mean age of 82.05 ± 4.76 years, and 55% with intermediate-high risk were included. The rates of successful impantation and cardiac death were 97.37% and 2.63%, respectively, at 1 year. Significant reductions in mean and maximum gradients were achieved and maintained at follow-up. The mean length of stay at the hospital (5.2 6 ± 4.05) and intensive care unit setting (0.22 ± 0.64) was short. Significant improvements (all adjusted P < .05) were detected in the Kansas City Cardiomyopathy Questionnaire overall summary scores, EQ-5D-5L, and the 36-item Short Form (physical component summary).
Conclusions: This research highlights how positive clinical outcomes translated into significant improvements in relation to the patients’ HRQoL. Use of resources —generally low— was based on the Society of Thoracic Surgeons risk score. (SARU Study; code: 2017-01, Murcia, Spain).
Keywords: Aortic valve stenosis. Quality of life. Health resources. Length of stay. Clinical endpoint. Burden of illness.
Abreviaturas
CVRS: calidad de vida relacionada con la salud. EA: estenosis aórtica. KCCQ: Kansas City Cardiomyopathy Questionnaire. STS: Society of Thoracic Surgeons. TAVI: implante valvular aórtico transcatéter. URS: utilización de recursos sanitarios.
INTRODUCCIÓN
La estenosis aórtica (EA) es la causa más frecuente de valvulopatía1 con una prevalencia estimada de entre el 3 y el 5% en personas
≥ 65 años y hasta el 7,4% en personas > 85 años2,3. La EA grave es la causa principal de las cirugías valvulares que se practican en adultos y tiene un período latente variable pero largo (asintomático) seguido de un avance rápido tras cursar síntomas (disnea, angina, síncope…). Tiene, además, mal pronóstico si la válvula aórtica no se cambia en el momento oportuno4,5.
Aunque la cirugía a corazón abierto lleva años siendo el patrón oro, las intervenciones de la valvulares aórticas han ido convirtiéndose poco a poco en procedimientos cada vez menos invasivos. El implante valvular aórtico transcatéter (TAVI) se ha convertido en el tratamiento de elección para pacientes inoperables con EA grave y asintomática6 y en una alternativa viable para pacientes de riesgo quirúrgico alto e intermedio, que arroja mejores resultados clínicos de supervivencia y capacidad funcional7,8. Asimismo, las nuevas evidencias que nos ofrecen los últimos estudios clínicos publicados indican que el TAVI también puede ampliarse a pacientes de riesgo bajo9,10.
Según las guías actuales de práctica clínica11, las decisiones multidisciplinares que rodean a las intervenciones para tratar la EA requieren de una adecuada valoración individualizada de los candidatos para optimizar los beneficios que se logran en estos pacientes (una mejor supervivencia y alivio sintomático). En este sentido, importantes factores influyen en el riesgo quirúrgico de estos (como el compuesto ajustado por el riesgo específico del cirujano según puntuación obtenida en la Society of Thoracic Surgeons [STS]), los años de vida ajustados por calidad de los pacientes, características basales tales como la fragilidad (puntuación ≥ 2 en la escala Katz), los factores de riesgo modificables y las comorbilidades (enfermedad pulmonar obstructiva crónica, hipertensión pulmonar, enfermedad hepática, accidente cerebrovascular previo, anemia y otras patologías sistémicas). En Europa, las últimas guías publicadas recomiendan el TAVI en pacientes > 75 años. Asimismo, que todos los pacientes de entre 70 y 75 años con EA sean derivados para valoración TAVI con independencia de su riesgo quirúrgico12.
Debido a las cada vez más amplias indicaciones para el TAVI y al factor demográfico de envejecimiento de los países occidentales3, el TAVI se emplea cada vez más en la práctica clínica habitual en toda Europa. Esto subraya la importancia de monitorizar los resultados del TAVI, sobre todo en pacientes ancianos, para caracterizar mejor el rendimiento de esta intervención en la práctica del mundo real.
Nuestro objetivo fue realizar una valoración prospectiva tanto de los resultados del TAVI (SAPIEN 3, Edwards Lifesciences, Estados Unidos) de calidad de vida relacionada con la salud (CVRS) como de los resultados clínicos considerando su riesgo quirúrgico. El objetivo secundario fue una descripción de los recursos sanitarios empleados ajustados por el riesgo quirúrgico (puntuación obtenida en la escala STS).
MÉTODOS
Diseño del estudio
Estudio prospectivo y observacional de todos los pacientes consecutivos con EA sintomática grave tratados con TAVI electivo mediante abordaje transfemoral con el dispositivo SAPIEN 3 en el Hospital Universitario Virgen de la Arrixaca, un hospital terciario regional de referencia especializado en cirugía cardiotorácica y cardiología intervencionista ubicado en Murcia (España). Los pacientes recibieron el TAVI con independencia del estudio como parte de la práctica clínica habitual del hospital. La fase de reclutamiento de los pacientes se prolongó durante todo el año 2018. En este estudio, se presentan los resultados obtenidos en la valoración sistemática realizada 1 año después del TAVI.
Según las guías de ESC/EACTS6, la decisión de proceder con el TAVI la tomó el equipo multidisciplinar y todas las intervenciones siguieron las recomendaciones establecidas en las instrucciones de uso proporcionadas por el fabricante de la válvula SAPIEN 3. Todos los pacientes fueron seguidos durante, como mínimo, 12 meses tras el TAVI y valorados sistemáticamente con arreglo al protocolo de actuación clínica del hospital. Todos los pacientes recibieron información por escrito al respecto y firmaron el formulario de consentimiento informado para la recogida de datos antes de ser incluidos en el estudio de conformidad con las recomendaciones en materia de investigación biomédica en seres humanos adoptadas por la XVIII Asociación Médica Mundial en Helsinki (Finlandia) en 1964. El protocolo del estudio fue aprobado por el comité de ética correspondiente (Murcia, Estudio SARU; código: 2017-01. fecha de entrada en vigor, 06/02/2017).
La valoración clínica se realizó basalmente (preoperatorio), después de la intervención (perioperatorio), y 30 días, 6 meses y 1 año después de la misma. Las principales variables clínicas objetivas fueron las medidas ecocardiográficas (insuficiencia periprotésica y aórtica total, fracción de eyección del ventrículo izquierdo, gradiente valvular aórtico medio y máximo, área del orificio regurgitante efectivo) y los eventos clínicos mayores disponibles automáticamente en las historias clínicas (mortalidad por cualquier causa y cardiovascular, accidente cerebrovascular, complicaciones hemorrágicas, infarto de miocardio, fibrilación auricular de nueva aparición, complicaciones vasculares mayores, implante de marcapasos definitivo, rehospitalización y daño renal agudo). También se registró la clase funcional IV según la New York Heart Association (NYHA) de los pacientes. Su perfil de riesgo se caracterizó según a la puntuación de riesgo obtenida en la escala STS, validada para los índices de mortalidad intrahospitalaria y a 30 días tras el reemplazo quirúrgico de válvula aórtica13. También se definieron las complicaciones posoperatorias en base a una versión modificada de los criterios estandarizados del Valve Academic Research Consortium14. Luego, se aplicó de forma rutinaria esta escala según los protocolos clínicos de nuestro hospital terciario de referencia.
Por último, la duración de la estancia hospitalaria (DEH), tanto en el hospital como en la unidad de cuidados intensivos (UCI) asociada al TAVI se registró automáticamente para cada paciente según la historia clínica hospitalaria, y se describió como el objetivo secundario de esta investigación.
Medición de la calidad de vida relacionada con la salud de los pacientes
Se implementaron 1 valoración integral combinando una herramienta específica de la enfermedad descrita por el paciente que tiene una capacidad alta para capturar cambios en el estado de salud de los pacientes durante el periodo de observación y 2 herramientas genéricas para establecer comparativas con los hallazgos de otras intervenciones o enfermedades y con la población normal española. La calidad de vida relacionada con la salud de los pacientes se evaluó basalmente y durante las visitas médicas de seguimiento a los 6 meses y 1 año después del TAVI, según protocolo.
Herramientas específicas de la enfermedad
El Kansas City Cardiomyopathy Questionnaire (KCCQ)15 en un cuestionario específico de enfermedad de 23 ítems, autoadministrado, y desarrollado, originariamente, para pacientes con insuficiencia cardiaca para monitorizar los síntomas de estos y valorar cómo y hasta qué punto la insuficiencia cardiaca que padecen influye en su calidad de vida (CV) en un periodo de 2 semanas. El KCCQ incorpora 6 dominios distintos (función física, síntomas, estabilidad sintomática, limitación social, autoeficacia y calidad de vida) y 2 puntuaciones resumen: la puntuación del sumario clínico (CSS) y la del sumario total (OSS). Las puntuaciones resumen pueden transformarse en escalas de 0 a 100; las puntuaciones más altas serían indicativas de mejores niveles de bienestar para facilitar la interpretación de estas. Esta herramienta ha sido revisada y aprobada recientemente para su uso en pacientes con insuficiencia cardiaca por la Food and Drug Administration de Estados Unidos16 con diferencias clínicas importantes mínimas definidas como cambios de 5 puntos en las escalas de puntuaciones resumen17. El KCCQ también funciona bien a nivel sicométrico a la hora de calcular el estado funcional y la CVRS de pacientes con EA sintomática grave18.
Herramientas genéricas para medir la calidad de vida relacionada con la salud
El EQ-5D-519, un cuestionario que completa el propio paciente, incorpora un sistema descriptivo y la escala visual analógica EQ (EQ-5D-5L EVA). La primera incorpora 5 dominios: movilidad, conductas de autocuidados, actividades diarias, dolor/molestias y ansiedad/depresión. Se asignó a las respuestas al cuestionario descriptivo EQ-5D-5L una relevancia o peso determinado (utilidad) para la población española. El EQ-5D-5L EVA refleja la salud descrita por el propio paciente en una escala visual analógica verti-
cal que va de 0 (la peor salud imaginable) a 100 (la mejor salud imaginable)20,21.
El cuestionario de salud SF-3622 es uno de los más empleados para evaluar cuestionarios CVRS genéricos. Incorpora 8 dimensiones y 2 puntuaciones resumen (componente sumario físico [CSF] y componente sumario mental [CSM]). En este estudio se empleó una estandarización de las puntuaciones resumen según la edad y el sexo empleando datos normativos de la población española23.
Abordaje estadístico
En primer lugar, se hizo un análisis exploratorio para caracterizar la cohorte analítica presentada en este artículo. Se empleó estadística descriptiva para las variables continuas (media, error estándar de cálculo) y tablas de frecuencia o proporciones para las variables discretas. Se utilizó la prueba de McNemar para muestras dependientes a fin de comparar los estados de salud según la NYHA durante el seguimiento. En cuanto al objetivo de estudio, se calcularon modelos multivariados (modelos generales lineales con mediciones repetidas en diferentes momentos temporales—basalmente, a 6 y 12 meses—y factores intra-sujeto) para valorar mejor los posibles beneficios de ambos en lo referente a los objetivos clínicos y a la CVRS de los pacientes durante el seguimiento (basalmente, a 6 y 12 meses). También se tuvieron en cuenta las comorbilidades y el perfil basal de riesgo de los pacientes. En consecuencia, se incluyó el riesgo de mortalidad predicho en la escala STS al ser un índice ponderado del riesgo de los pacientes calculado, de forma sólida, a partir de un modelo jerárquico bayesiano para la mortalidad y las complicaciones mayores. Este modelo tuvo en cuenta 24 importantes variables preoperatorias tales como la edad, el sexo, el área de superficie corporal, la fibrilación auricular, la insuficiencia cardiaca crónica, la clasificación funcional según la NYHA, la enfermedad pulmonar obstructiva crónica, la diabetes mellitus, la insulinodependencia, la hipertensión arterial, las cirugías cardiacas previas, las estenosis mitral concomitante, la angina inestable, las intervenciones coronarias percutáneas previas y demás variables. Según la puntuación obtenida en la escala STS, se incluyó a los pacientes en 3 grupos de riesgo: riesgo de mortalidad alto (≥ 8%), intermedio (≥ 4%) y bajo (< 4%)13. Se debe mencionar que esta puntuación también se tuvo en cuenta en el objetivo secundario asociado a la descripción de la DEH (tanto en el hospital como en la UCI) asociada al TAVI.
El tamaño de la muestra requirió hacer los análisis ajustados previamente descritos, el tamaño mínimo estimado de la muestra se fijó en 60 pacientes tratados de TAVI para realizar una comparativa entre e intrasujetos de las diferencias descritas en 3 momentos distintos, el tamaño del efecto (f) fue 0,25, el potencial estadístico (1-β), 0,9 y el riesgo de error tipo I (1-α), 0.95 suponiendo una correlación débil entre las diferentes mediciones obtenidas (0,3).
Se empleó el paquete de software estadístico SPSS 27.0 para Windows (IBM Corp., Estados Unidos) y el R software (The R Project for Statistical Computing, Institute for Statistics and Mathematics, Austria) para el análisis estadístico.
RESULTADOS
Se trató a un total de 76 pacientes consecutivos (el 50% mujeres; media de edad, 82,05 ± 4,76 años) de TAVI electivo durante el periodo del estudio que incluyó a la cohorte analítica. La puntuación de riesgo quirúrgico obtenida en la escala STS fue 5,4 ± 3,41. El 42,5%, 43,8% y 13,7% de los casos se clasificaron como pacientes de riesgo bajo, intermedio y alto, respectivamente. La descripción completa de las comorbilidades se muestra en la tabla 1. Un paciente tenía antecedentes de cirugía de revascularización coronaria previa. Un total de 6 casos (7,9%) fueron intervenciones de válvula dentro de otra válvula y 71 casos (93,4%) fueron mediante abordaje vascular a través de la arteria femoral derecha. Solo 1 paciente precisó anestesia general previa al TAVI (tabla 1 del material adicional). El estado funcional basal de los pacientes (clasificación según la NYHA) se vio comprometido significativamente en la mayoría de los casos. Así, el 61,84 y 19,74% de los pacientes presentaban clase funcional III y IV según la NYHA, respectivamente.
Tabla 1. Características preoperatorias de pacientes tratados con TAVI (n = 76)
| Enfermedad previa | n | % | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Dislipemia | 51 | 67,11 | |||||||
| Hipertensión arterial | 66 | 86,84 | |||||||
| Accidente cerebrovascular previo | |||||||||
| Con efectos | 1 | 1,32 | |||||||
| Sin efectos | 4 | 5,26 | |||||||
| AIT | 4 | 5,26 | |||||||
| Enfermedad hepática | 0 | 0,00 | |||||||
| Diabetes mellitus | |||||||||
| DM Dieta | 1 | 1,32 | |||||||
| DM II Agentes orales | 22 | 28,95 | |||||||
| DM II Insulina | 17 | 22,37 | |||||||
| DM II Sin tratamiento | 1 | 1,32 | |||||||
| IRC | 26 | 34,21 | |||||||
| Fumador | |||||||||
| Activo | 2 | 2,63 | |||||||
| No es fumador | 48 | 63,16 | |||||||
| Exfumador | 25 | 32,89 | |||||||
| Enfermedad oncológica | 8 | 10,53 | |||||||
| EPOC | 9 | 11,84 | |||||||
|
AIT: accidente isquémico transitorio; DM, diabetes mellitus; EPOC: enfermedad pulmo- |
|||||||||
Resultados clínicos
El implante tuvo éxito en 74 casos (97,37%) y 2 pacientes (2,63%) fallecieron durante los primeros 30 días con posterioridad a la intervención (ambos de causas cardiovasculares). En este periodo, la tasa de complicaciones mayores o rehospitalizaciones fue baja (tabla 2) y fue necesario implantar marcapasos definitivos a 5 pacientes. Un año después del TAVI, no se comunicó ninguna otra muerte cardiovascular. No obstante, 7 pacientes fallecieron por otras causas (tabla 2). Se debe mencionar que la tasa de mortalidad de la muestra fue similar a la de la población general (figura 1 del material adicional). Según las mediciones ecocardiográficas, se observaron beneficios significativos en los gradientes medio y máximo y en la insuficiencia aórtica que se mantuvieron durante el seguimiento (figura 2 del material adicional). Se debe mencionar que, entre los supervivientes, el 78,4% de los pacientes presentaban una clase funcional I-I según la NYHA al cabo de 1 mes, un beneficio que se mantuvo trascurrido 1 año en el 77,3% de los pacientes en estos niveles funcionales.
Tabla 2. Resultados clínicos a 30 días y 1 año (n = 76)
| Variable | n | % | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Implante exitoso | 74 | 97,37 | |||||||
| Mortalidad (30 días) | 2 | 2,63 | |||||||
| Mortalidad cardiovascular (30 días) | 2 | 2,63 | |||||||
| IAM (30 días) | 0 | 0,00 | |||||||
| Accidente cerebrovascular (30 días) | 3 | 3,95 | |||||||
| Hemorragia mayor (30 días) | 4 | 5,26 | |||||||
| Rehospitalización por cualquier causa (30 días) | 4 | 5,26 | |||||||
| Implante marcapasos definitivo (30 días) | 5 | 6,60 | |||||||
| Rehospitalización CV (30 días) | 2 | 2,63 | |||||||
| Todas las muertes (1 año*) | 9 | 11,84 | |||||||
| Todas las muertes cardiovasculares (1 año) | 2 | 2,63 | |||||||
|
* Todas las muertes descritas al cabo de 1 año: mieloma múltiple: n = 1; sepsis (infección de vías respiratorias): n = 1; sepsis (enfermedad renal): n = 1; enfermedad pulmonar: |
|||||||||
Valoración de la CVRS
La CVRS de los pacientes a lo largo de todo el periodo observacional según la puntuación basal obtenida en la escala de riesgo STS se muestra en la figura 1. En ambas puntuaciones resumen del KCCQ (OSS y CSS) se observaron mejoras estadísticas y clínicas significativas tras el TAVI. En el caso de la OSS, las diferencias medias descritas entre el momento basal y 6 meses después oscilaron entre los 18,94 (riesgo bajo) y los 29,97 puntos (riesgo intermedio) indicativo de un beneficio importante (todos los valores p < 0,001). Asimismo, las diferencias medias observadas en la CSS oscilaron entre los 13,03 y 27,3 puntos (riesgo bajo e intermedio, respectivamente). Además, en las 2 escalas, el beneficio observado se mantuvo durante el periodo de seguimiento y no se observó ninguna diferencia al cabo de 6 meses ni 1 año (p > 0,8 en ambas escalas de puntuaciones resumen). Se debe mencionar que estas mejoras se repitieron en los 3 grupos de riesgo (figura 2).
Figura 1. Clase funcional según la New York Heart Association (NYHA) durante el seguimiento.
Figura 2. Cambios en la calidad de vida relacionada con la salud (CVRS) de los pacientes durante el seguimiento (n = 55, en 67 supervivientes al cabo de 1 año; el 82,1% de la muestra). No se observaron diferencias en los valores medios/medianos basales en ninguna de las mediciones de la CVRS obtenidas entre los pacientes que completaron todas las mediciones y aquellos con valores faltantes durante el periodo del estudio. EQ-5D-5 EVA: escala visual analógica EQ; KCCQ-CSS: puntuación del sumario clínico en el KCCQ; KCCQ-OSS: puntuación del sumario total en el KCCQ; KCCQ: Kansas City Cardiomyopathy Questionnaire; SF-36 CSF: cuestionario de salud SF-36 para el componente sumario físico; SF-36 CSM: cuestionario de salud SF-36 para el componente sumario mental.
En lo referente a los cuestionarios genéricos, también se observó un impacto positivo en las puntuaciones obtenidas, posoperatoriamente, en los cuestionarios EQ-5D-5L EVA y SF-36 para el componente sumario físico, en todos los pacientes (p < 0,006 y p < 0,004, respectivamente). No obstante, el tamaño de las diferencias detectadas fue menor considerando las respectivas escalas. No se observaron diferencias estadísticas significativas en el componente sumario mental (p = 0,395). Además, los valores de todos los grupos fueron parecidos a los de la población normativa según edad y sexo con respecto a los valores basales (media—intervalo de confianza del 95% [IC95%]— basal: 47,44, 44,70 y 50,18; a los 6 meses: 49.77, 47.36, and 52.17 y al cabo de 1 año: 48,64, 46,04 y 50,83-; p = 0,52). Por último, los valores índices del EQ-5D-5L fueron muy similares en cualquier momento y se observó un tímido aumento a los 6 meses (p = 0,054 comparado con el momento basal) y un leve descenso, aunque no estadísticamente significativo, al cabo de 1 año con respecto a los valores basales (media—IC95%— basal: 0,77, 0,71 y 0.83; a los 6 meses: 0,80, 0,75 y 0,85 y al cabo de 1 año: 0,74, 0,68 y 0,80; p = 0,499).
Objetivo secundario: descripción de la duración de la estancia hospitalaria asociada a la intervención
La DEH media en el hospital fue limitada, con una estancia media de 5,26 días (± 4.05); solo requirieron cuidados intensivos 10 pacientes (13.2%), 5 de los cuales (el 6,6% de toda la muestra) permanecieron ingresados en la UCI ≤ 1 día, 3 (3.9%) permanecieron 2 días y 2 (2,6%) un máximo de 3 días. En la figura 3, las estancias en UCI y hospital se muestran según el riesgo basal de los pacientes (ambas muy cortas en todos los subgrupos).
Figura 3. Duración de la estancia hospitalaria (tanto en el hospital como en la UCI) según puntuación obtenida en la escala STS PROM; n = 76 y n = 73 para la DEH (hospital e ICU, respectivamente). DEH: duración de la estancia hospitalaria; STS: Society of Thoracic Surgeons; UCI: unidad de cuidados intensivos.
DISCUSIÓN
Lo ideal sería tratar la EA grave sintomática con una válvula que se implantase de forma mínimamente invasiva para correr el menor riesgo posible, tanto perioperatorio como a largo plazo, optimizar la respuesta hemodinámica, evitar la dependencia de los pacientes al tratamiento anticoagulante de por vida y maximizar tanto la capacidad de realizar actividades básicas de la vida diaria como el bienestar de los pacientes. Lo que nos enseñan los estudios clínicos realizados hasta ahora es que el tratamiento de la EA va en este sentido7,9. No obstante, sigue siendo importante probar cada innovación que se produzca en la práctica clínica real. Este estudio ofrece nuevas evidencias sobre el rendimiento del TAVI en pacientes ancianos (media de edad > 80 años) en una práctica clínica real a través de un análisis prospectivo sistemático de los resultados clínicos, la DEH y los resultados descritos por los propios pacientes 1 año después de la intervención.
En nuestro estudio, se observó un evidente efecto clínico positivo del TAVI en todos los subgrupos de la escala de riesgo STS. Tanto los gradientes aórticos medio y máximo como la insuficiencia valvular mejoraron significativamente tras la intervención y las complicaciones mayores se mantuvieron a raya en tasas muy razonables. Estos resultados clínicos fueron muy parecidos a los publicados recientemente sobre la válvula SAPIEN 324. Según la NYHA, el porcentaje de pacientes con un estado funcional satisfactorio aumentó inmediatamente después de la intervención, y se mantuvo al cabo de 1 año entre los supervivientes.
Se debe mencionar que estos beneficios clínicos se tradujeron en mejoras sustanciales de la CVRS de los pacientes. En concreto, la OSS del KCCQ reveló un cambio medio con respecto a los valores basales de 18,9 puntos en pacientes de riesgo bajo hasta casi 30 puntos en aquellos de riesgo intermedio 6 meses después del tratamiento. Este beneficio también se mantuvo al cabo de 1 año con rangos entre 21,9 puntos en pacientes de riesgo bajo y 26,7 puntos en aquellos de riesgo intermedio. Estos incrementos descritos en el KCCQ estuvieron claramente por encima de las diferencias mínimas clínicamente importantes descritas en la literatura médica para esta herramienta17. Estos resultados son sumamente importantes si tenemos en cuenta que una caída de 10 puntos en la OSS del KCCQ resultó ser un factor pronóstico para pacientes con EA asociado a un 34% más de posibilidades de fallecer a los 12 meses18. En este sentido, la CVRS de pacientes ancianos que sobrevivieron 1 año mejoró significativamente. Nuestros resultados son parecidos a los de otro estudio publicado que analizó los resultados clínicos del TAVI en ensayos clínicos y registros sobre la válvula SAPIEN 3. Por ejemplo, Baron et al.24, según datos del registro de riesgo intermedio SAPIEN 3, observaron cambios a 1 año del TAVI en la OSS de 23,1 puntos (21,8-24,9; p > 0,001) en pacientes de riesgo intermedio. Su cohorte tuvo unas características basales similares y se trató de TAVI con el mismo dispositivo (incluyeron, no obstante, los abordajes transfemoral y transapical). En nuestro estudio, se vio que esta mejoría de la salud percibida por el propio paciente también se mantuvo en pacientes ancianos clasificados de riesgo bajo y alto.
En lo que respecta a las herramientas genéricas, también se detectó una cierta tendencia positiva tanto en el EQ-5D-5L EVA como en el SF-36 CSF (un componente sumario más centrado en el rendimiento funcional global de los pacientes) con diferencias significativas al cabo de 6 meses y 1 año. Se debe mencionar que, durante el seguimiento, no se observaron diferencias en el componente sumario mental. La salud mental de los pacientes también fue un poco mejor que la descrita en su población de referencia con respecto a los valores basales. Asimismo, en lo referente a las utilidades estimadas del EQ-5D-5L, se observó una tendencia positiva global a los 6 meses con respecto a los valores basales y un ligero descenso al cabo de 1 año. No obstante, todos los cambios detectados con esta herramienta fueron mínimos. Este hallazgo fue sorprendente teniendo en cuenta el gran beneficio demostrado con las puntuaciones OSS y CSS del KCCQ. No obstante, como el EQ-5D-5L recoge la calidad de vida relacionada con la salud de una forma más global e incorpora la media de edad de los pacientes incluidos, el tímido descenso observado podría reflejar un deterioro general del estado de salud acumulado durante el periodo observacional de 1 año (media de edad de la muestra > 80 años).
Coincidiendo, además, con experiencias recientes descritas en centros de excelencia TAVI de Italia, Países Bajos y Reino Unido, donde los autores probaron nuevas vías de tratamiento clínico estandarizadas para optimizar el proceso con altas rápidas que generaron menos complicaciones y DEH cortas25, observamos estancias hospitalarias muy cortas y pocos ingresos UCI (13%) (el 6,5% de los pacientes permanecieron 3 días en la UCI). En nuestro centro, tras implementar un protocolo individualizado para pacientes aptos para recibir el TAVI, se obtuvieron resultados de muy alta calidad en pacientes ancianos y se observó que la DEH asociada a esta intervención se redujo.
Limitaciones
Debido a la propia naturaleza de este estudio observacional, nuestros hallazgos están sujetos a algunas limitaciones. En primer lugar, proceden de la experiencia de un único centro en un hospital terciario de referencia muy familiarizado con la intervención, de ahí que la extrapolación de estos resultados pudiera verse afectada por la experiencia del equipo multidisciplinar. Se debe mencionar que el tamaño de la muestra, sobre todo en el grupo de alto riesgo, fue limitado y sujeto a una alta dispersión de valores y datos faltantes durante el seguimiento. Por eso, nuevos estudios con muchos más pacientes estratificados en función del riesgo deberían poder confirmar nuestros hallazgos. A pesar de esta limitación, se debe mencionar que nuestros resultados observados en el grupo de riesgo intermedio son parecidos a los descritos en muestras más grandes de cohortes ajustadas por puntuación de propensión24.
También en este análisis se decidió emplear la escala de riesgo STS como medida para caracterizar el riesgo de los pacientes porque, aunque reconocemos que esta escala se desarrolló originariamente para el reemplazo quirúrgico de válvula aórtica, es un índice pronóstico válido de la mortalidad y las complicaciones mayores asociadas al TAVI que ofrece una valoración integral del estado de salud de los pacientes13,26. No obstante, tal y como se ha descrito en un estudio reciente27,28, también sería útil medir la fragilidad para completar los ajustes. Lamentablemente, esta información no se recogió en un formulario estándar de forma rutinaria como parte del manejo clínico habitual cuando se llevó a cabo este estudio. No obstante, se debe mencionar que, en nuestro centro, el equipo multidisciplinar que participó en el proceso de toma de decisiones sobre el tratamiento individualizado de la patología de cada paciente siempre considera la fragilidad como un parámetro clave para un mejor ajuste del tratamiento. De hecho, precisamente debido a esta valoración preoperatoria, la mayoría de los pacientes clasificados como pacientes de riesgo bajo por la escala STS (42,5%) fueron tratados con TAVI y no con cirugía abierta. Parece obvio que la fragilidad desempeña un papel clave en este proceso al igual que otros factores importantes tales como la preferencia del paciente, los antecedentes de radiación torácica, la cirugía de revascularización coronaria previa o la aorta de porcelana y otros. Aunque se ha observado una tendencia consistente y positiva en los resultados clínicos descritos por los propios pacientes gracias a un análisis integral, se debe mencionar que nuestros resultados proceden de una cohorte de pacientes tratados en 2018. En consecuencia, sería interesante realizar un nuevo estudio en múltiples centros para obtener datos que poder comparar con la evolución que han tenido los resultados de la práctica clínica actual con respecto a los de 2018. En este sentido, parece justificado acometer más estudios que sigan haciendo un seguimiento de los resultados en muestras más amplias de pacientes.
CONCLUSIONES
En conclusión, esta investigación ofrece evidencias tanto clínicas como descritas por los propios pacientes sobre el rendimiento del TAVI en pacientes ancianos con beneficios clínicos que se mantuvieron 1 año después de la intervención. Además, la corta estancia hospitalaria observada ofrece datos exploratorios sobre los beneficios de los protocolos estandarizados diseñados para el manejo de pacientes de riesgo entre bajo y alto de forma segura y eficaz.
FINANCIACIÓN
Edwards Lifesciences proporcionó los fondos necesarios para poder realizar el análisis de este estudio que se llevó a cabo y fue interpretado, de manera independiente, por clínicos y expertos en metodología.
CONTRIBUCIÓN DE LOS AUTORES
E. Pinar, J. García de Lara, J. Hurtado, B. Martí-Sánchez, G. Leithold y J. Cuervo participaron tanto en la idea y diseño del estudio como en el análisis de datos. Todos los autores participaron en la interpretación de los resultados, en la revisión crítica del artículo en lo referente a su contenido intelectual y enviaron la versión definitiva del mismo para su publicación.
CONFLICTO DE INTERESES
J. Cuervo, que trabaja para Axentiva Solutions, declaró que esta empresa ha recibido financiación (pagos en calidad de consultoría para Edwards Lifesciences) para sufragar los gastos derivados del diseño y análisis del estudio y redacción del artículo. B. Martí-Sánchez y P. González trabajan, ambos, para Edwards Lifesciences. E. Pinar, J. García de Lara, J. Hurtado, M. Robles, G. Leithold y K. Rand no declararon ningún conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- La EA grave es la causa principal de cirugía valvular en adultos.
- El TAVI se ha convertido en el tratamiento elegido para pacientes inoperables con EA grave y sintomática y en una alternativa válida para pacientes de riesgo quirúrgico entre alto e intermedio con mejores resultados clínicos de supervivencia y capacidad funcional.
- Son muchos los factores que influyen en los resultados del TAVI como el riesgo quirúrgico, la esperanza de vida del paciente, las características basales, los factores de riesgo modificables y las comorbilidades.
¿QUÉ APORTA DE NUEVO?
- A través de una valoración integral de las variables clí-
nicas, funcionales y de calidad de vida, este estudio avala el rendimiento positivo del TAVI en pacientes ancianos durante el seguimiento. - Mejoras observadas en los gradientes aórticos medio y máximo, así como en la insuficiencia valvular.
- Un porcentaje más alto de pacientes con estado funcional satisfactorio según la NYHA tras la intervención.
- Los beneficios clínicos también se tradujeron en mejoras de la CVRS, un efecto que pudo observarse en todos los grupos de riesgo.
- En líneas generales, en esta muestra consecutiva de pacientes, la DEH (hospital) asociada al TAVI fue corta.
BIBLIOGRAFÍA
1. Iung B, Delgado V, Rosenhek R, et al. Contemporary Presentation and Management of Valvular Heart Disease: The EURObservational Research Programme Valvular Heart Disease II Survey. Circulation. 2019;140:1156-1169.
2. Ferreira-González I, Pinar-Sopena J, Ribera A, et al. Prevalence of calcific aortic valve disease in the elderly and associated risk factors: A population-based study in a Mediterranean area. Eur J Prev Cardiol. 2013;20:1022-1030.
3. Durko AP, Osnabrugge RL, Van Mieghem NM, et al. Annual number of candidates for transcatheter aortic valve implantation per country: current estimates and future projections. Eur Heart J. 2018;39:2635-2642.
4. Otto CM, Lind BK, Kitzman DW, Gersh BJ, Siscovick DS. Association of Aortic-Valve Sclerosis with Cardiovascular Mortality and Morbidity in the Elderly. N Engl J Med. 1999;341:142-147.
5. Otto CM, Burwash IG, Legget ME, et al. Prospective study of asymptomatic valvular aortic stenosis: Clinical, echocardiographic, and exercise predictors of outcome. Circulation. 1997;95:2262-2270.
6. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Hear J. 2017;38:2739-2791.
7. Thourani VH, Kodali S, Makkar RR, et al. Transcatheter aortic valve replacement versus surgical valve replacement in intermediate-risk patients: a propensity score analysis. Lancet. 2016;387:2218-2225.
8. Herrmann HC, Thourani VH, Kodali SK, et al. One-Year Clinical Outcomes With SAPIEN 3 Transcatheter Aortic Valve Replacement in High-Risk and Inoperable Patients With Severe Aortic Stenosis. Circulation. 2016;134:
130-140.
9. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
10. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
11. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice. Circulation. 2021;143:e35-e71.
12. Kuck K-H, Bleiziffer S, Eggebrecht H, et al. Konsensuspapier der Deutschen Gesellschaft für Kardiologie (DGK) und der Deutschen Gesellschaft für Thorax-, Herz- und Gefäßchirurgie (DGTHG) zur kathetergestützten Aortenklappenimplantation (TAVI) 2020. Der Kardiol. 2020;14:182-204.
13. Kumar A, Sato K, Narayanswami J, et al. Current Society of Thoracic Surgeons Model Reclassifies Mortality Risk in Patients Undergoing Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2018;11:e006664.
14. Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: The valve academic research consortium-2 consensus document. J Am Coll Cardiol. 2012;60:1438-1454.
15. Green CP, Porter CB, Bresnahan DR, Spertus JA. Development and evaluation of the Kansas City Cardiomyopathy Questionnaire: a new health status measure for heart failure. J Am Coll Cardiol. 2000;35:1245-1255.
16. US Food and Drug Administration -Center for Devices and Radiological Health. Medical Device Development Tool (MDDT) Qualification Decision Summary For Kansas City Cardiomyopathy Questionnaire (KCCQ). 2021. Disponible en https://www.fda.gov/medical-devices/science-and-research-medical-devices/medical-device-development-tools-mddt. Consultado 20 Nov 2022.
17. Butler J, Khan MS, Mori C, et al. Minimal clinically important difference in quality of life scores for patients with heart failure and reduced ejection fraction. Eur J Heart Fail. 2020;22:999-1005.
18. Arnold S V, Spertus JA, Lei Y, et al. Use of the Kansas City Cardiomyopathy Questionnaire for monitoring health status in patients with aortic stenosis. Circ Heart Fail. 2013;6:61-67.
19. Herdman M, Gudex C, Lloyd A, et al. Development and preliminary testing of the new five-level version of EQ-5D (EQ-5D-5L). Qual Life Res. 2011;20:
1727-1736.
20. Hernandez G, Garin O, Pardo Y, et al. Validity of the EQ-5D-5L and reference norms for the Spanish population. Qual Life Res. 2018;27:2337-2348.
21. Ramos-Goñi JM, Pinto-Prades JL, Oppe M, Cabasés JM, Serrano-Aguilar P, Rivero-Arias O. Valuation and Modeling of EQ-5D-5L Health States Using a Hybrid Approach. Med Care. 2017;55:e51-e58.
22. Ware JE, Sherbourne CD. The MOS 36-item short-form health survey (SF-36). I. Conceptual framework and item selection. Med Care. 1992;30:473-483.
23. Vilagut G, Ferrer M, Rajmil L, et al. The Spanish version of the Short Form 36 Health Survey: a decade of experience and new developments. Gac Sanit. 2005;19:135-150.
24. Baron SJ, Thourani VH, Kodali S, et al. Effect of SAPIEN 3 Transcatheter Valve Implantation on Health Status in Patients With Severe Aortic Stenosis at Intermediate Surgical Risk: Results From the PARTNER S3i Trial. JACC Cardiovasc Interv. 2018;11:1188-1198.
25. Barbanti M, van Mourik MS, Spence MS, et al. Optimising patient discharge management after transfemoral transcatheter aortic valve implantation: the multicentre European FAST-TAVI trial. EuroIntervention. 2019;15:147-154.
26. Hemmann K, Sirotina M, De Rosa S, et al. The STS score is the strongest predictor of long-term survival following transcatheter aortic valve implantation, whereas access route (transapical versus transfemoral) has no predictive value beyond the periprocedural phase. Interact Cardiovasc Thorac Surg. 2013;17:359-364.
27. Green P, Arnold S V, Cohen DJ, et al. Relation of frailty to outcomes after transcatheter aortic valve replacement (from the PARTNER trial). Am J Cardiol. 2015;116:264-269.
28. Goudzwaard JA, de Ronde-Tillmans MJAG, El Faquir N, et al. The Erasmus Frailty Score is associated with delirium and 1-year mortality after Transcatheter Aortic Valve Implantation in older patients. The TAVI Care & Cure program. Int J Cardiol. 2019;276:48-52.
RESUMEN
Introducción y objetivos: Los avances en la tecnología de implante percutáneo de válvula aórtica (TAVI) han dado lugar a mejores resultados y menos complicaciones en comparación con las generaciones anteriores. Se estudió la incidencia y los determinantes de las fugas periprotésicas (FPP) con las válvulas Evolut PRO y SAPIEN 3, así como otros resultados periprocedimiento y hospitalarios.
Métodos: Se seleccionó aleatoriamente a 110 pacientes consecutivos con estenosis aórtica grave programados para TAVI transfemoral para recibir una válvula SAPIEN 3 (n = 59) o una Evolut PRO (n = 51). Las dimensiones anulares se determinaron mediante el dimensionamiento del balón guiado por ecocardiografía transesofágica. Tras el procedimiento y durante la hospitalización se evaluaron los siguientes objetivos: FPV, defectos de conducción, embolización de la válvula, necesidad de una segunda válvula, rotura anular, accidente vascular cerebral, complicaciones vasculares, daño renal agudo y mortalidad intrahospitalaria. También se estudiaron los posibles determinantes anatómicos de la FPV.
Resultados: No hubo diferencias basales relevantes entre los 2 grupos en cuanto a las características clínicas y ecocardiográficas. Las complicaciones intrahospitalarias fueron comparables entre ambos tipos de válvulas, excepto una incidencia significativamente mayor de FPV (de grado II o superior) inmediata tras el procedimiento y al alta con las válvulas Evolut PRO en comparación con las SAPIEN 3 (19,6 frente a 6,8% y 5,9 frente a 1,7%, respectivamente). De las variables anatómicas, el ángulo entre el tracto de salida del ventrículo izquierdo y la aorta ascendente, la angulación aórtica y la calcificación tuvieron un impacto significativo en la FPV en las válvulas Evolut PRO. El ángulo entre el tracto de salida del ventrículo izquierdo y la aorta ascendente tuvo una correlación negativa con la profundidad de implantación en las válvulas Evolut PRO, pero no en las válvulas SAPIEN 3.
Conclusiones: Ambas válvulas demostraron resultados favorables comparables, excepto por una incidencia significativamente mayor de FPV en los pacientes con válvulas Evolut PRO.
Palabras clave: Estenosis aórtica. Implante percutáneo de válvula aórtica. TAVI. SAPIEN 3. Evolut PRO.
ABSTRACT
Introduction and objectives: Advances made in transcatheter aortic valve implantation (TAVI) valvular technology have resulted in better outcomes and fewer complications compared with older generations. We studied the rate and determinants of paravalvular leak (PVL) using Evolut PRO vs SAPIEN 3 valves as well as other perioperative and in-hospital outcomes.
Methods: A total of 110 consecutive patients with severe aortic stenosis scheduled for transfemoral TAVI were randomly selected to receive the SAPIEN 3 (N = 59) or the Evolut PRO valve (N = 51). Annular dimensions were determined by transesophageal echocardiography guided balloon sizing. The following postoperative and in-hospital endpoints were assessed: PVL, conduction defects, valve embolization, need for a second valve, annular rupture, stroke, vascular complications, acute kidney injury, and in-hospital mortality. We also studied the possible anatomical determinants of PVL.
Results: There were no relevant baseline differences between the 2 groups regarding clinical and echocardiographic characteristics. In-hospital complications were comparable between both valves apart from a significantly higher rate of immediate postoperative PVL and at discharge (≥ grade II) between the Evolut PRO and the SAPIEN 3 valves (19.6% vs 6.8%) and (5.9% vs 1.7%), respectively. Of the anatomical variables described, the left ventricular outflow tract/ascending aorta angle, aortic angulation, and calcification had a significant impact on PVL in the Evolut PRO valves. The left ventricular outflow tract/ascending aorta angle revealed a negative correlation with implantation depth in the Evolut PRO valves but not in the SAPIEN 3 ones.
Conclusions: Both valves demonstrated favorable comparable outcomes except for a significantly higher rate of PVL in patients implanted with Evolut PRO valves.
Keywords: Aortic stenosis. Transcatheter aortic valve implantation. TAVI. SAPIEN 3. Evolut PRO.
Abreviaturas
EA: estenosis aórtica; FPP: fuga periprotésica; TAVI: implante percutáneo de válvula aórtica. VARC: Valve Academic Research Consortium.
INTRODUCCIÓN
Durante la pasada década, la válvula autoexpandible CoreValve (Medtronic Ltd, Estados Unidos) y la prótesis balón expandible SAPIEN (Edwards Lifesciences Ltd, Estados Unidos) han sido las más empleadas para realizar implantes transcatéter de válvula aórtica (TAVI)1.
Son pocos los estudios que han comparado ambas válvulas, Evolut PRO (Medtronic Ldt, Estados Unidos) y SAPIEN 3 (Edwards Lifesciences Ltd, Estados Unidos), como el SMART, que estudió anillos aórticos pequeños2, y el registro de pacientes no seleccionado ALSTER-TAVI3. No obstante, no hay ensayos clínicos aleatorizados comparativos. Por eso se diseñó este estudio aleatorizado para realizar una comparativa directa entre ambas válvulas incluyendo datos de la intervención y resultados intrahospitalarios, sobre todo, de la fuga periprotésica (FPP). Aunque las prótesis valvulares cardiacas percutáneas empleadas en este estudio no son las válvulas de última generación de las familias CoreValve y SAPIEN (en la actualidad, la Evolut-Pro Plus y la SAPIEN Ultra), este es el primer estudio clínico aleatorizado que compara una válvula autoexpandible con falda externa de sellado y una válvula de balón autoexpandible (también con falda externa).
MÉTODOS
Población del estudio
Se aleatorizó a un total de 110 pacientes consecutivos con estenosis aórtica sintomática grave aptos para el TAVI a recibir la válvula Evolut PRO (51 pacientes) o la SAPIEN 3 (59 pacientes) en el Duisburg Heart Center de Duisburg (Alemania) entre diciembre de 2019 y mayo de 2020. Se incluyó a todos los pacientes tratados de TAVI por estenosis aórtica grave con la SAPIEN 3 y la Evolut PRO mediante abordaje femoral. Se excluyó a los pacientes tratados de TAVI con otros tipos de dispositivos tales como válvulas aórticas implantadas transapicalmente, válvulas aórticas bicúspides e implantes de prótesis valvulares biológicas de «válvula dentro de otra válvula». Todas las intervenciones se realizaron tras obtener el consentimiento informado, por escrito, de los pacientes de acuerdo con los estándares éticos del comité nacional de investigación.
Aspectos de la intervención
El TAVI se realizó bajo anestesia local y sedación consciente. Se empleó en todos los pacientes. Se realizaron incisiones femorales en todos los pacientes. Las dimensiones anulares se obtuvieron mediante dimensionamiento del balón guiado por ecocardiografía transesofágica durante la intervención. Gracias a esta técnica se pudieron medir los anillos mediante ecocardiografía transesofágica para luego elegir un balón del mismo tamaño que el anillo. El inflado del balón, tanto durante la estimulación cardiaca rápida como durante la angiografía aórtica, se realizó teniendo 3 posibilidades distintas en mente: a) el balón llena el anillo por completo sin fuga periprotésica ni cintura, lo cual es indicativo de que el tamaño del anillo y del balón es el mismo; b) la fuga parabalón es indicativa de que el anillo es entre 1 y 2 mm más grande que el tamaño del balón; c) la cintura del balón es indicativa de que el anillo es entre 1 y 2 mm más pequeño que el tamaño del balón4. El tipo de válvula (SAPIEN 3 o Evolut PRO) se seleccionó aleatoriamente (empleando el método de aleatorización simple; los casos de los lunes con la Evolut y los de los jueves con la SAPIEN). El tamaño de la válvula estuvo en función de las dimensiones anulares sugeridas por los fabricantes. Según los diámetros anular y valvular finalmente seleccionados, se calculó el llamado índice de cobertura5.
Objetivos
Nuestros objetivos primarios fueron la FPP, la mortalidad intrahospitalaria y el índice de implante de marcapasos permanente (IMP). Los objetivos secundarios fueron la embolización de la válvula, la necesidad de una segunda prótesis, la rotura o disección aórticas, el accidente cerebrovascular o el accidente isquémico transitorio, las complicaciones vasculares mayores y el daño renal agudo. Los objetivos se definieron según las definiciones del Valve Academic Research Consortium-2 (VARC-2)6.
Valoración de la FPP
La FPP inmediata se valoró semicuantitativamente con la clasificación de Seller 7: 0/4 (ausente), 1/4 (leve), 2/4 (moderada), 3/4 (moderada a grave) y 4/4 (grave)7. Los gradientes de presión transvalvular se obtuvieron invasivamente empleando el método de retirada automática. Se calculó, asimismo, la incidencia de la insuficiencia aórtica (IA)8.
En presencia de FPP significativa ≥ grado II, caso de ser necesario, se posdilató con los balones VACS III o NUCLEUS (NuMED, Estados Unidos) o se empleó una segunda válvula. Al alta hospitalaria se empleó la ETT para cuantificar el grado de FPP según los principales criterios del VARC-29.
Valoración de los factores anatómicos asociados posiblemente a la FPP
Se tomaron las siguientes mediciones empleando software de Philips (Philips Medical, Países Bajos): el ángulo del tracto de salida del ventrículo izquierdo/aorta ascendente (TSVI/AA) se definió como el ángulo descrito entre el eje de los primeros 4 cm de la aorta ascendente (superficie de contacto con la parte superior de la prótesis) y el eje del TSVI (zona de anclaje) indicado por una línea perpendicular al plano del anillo valvular aórtico)10.
El ángulo de angulación aórtica (AngA) se definió como el ángulo descrito entre el plano horizontal y el plano del anillo aórtico11. Se clasificó en < 48° y ≥ 48°12.
Ambos ángulos se midieron en la posición fluoroscópica óptima de despliegue con las 3 cúspides coronarias en el mismo plano (figura 1). La profundidad de implantación de la válvula se midió en la posición de despliegue en la fluoroscopia desde el margen anular aórtico nativo del lado de la cúspide no coronaria (CNC) y cúspide coronaria izquierda hasta el borde proximal de la válvula desplegada en el lado correspondiente13 (figura 2). A nivel fluoroscópico, la calcificación de la raíz aórtica fue prácticamente inexistente, leve (puntos calcificados aislados pequeños), moderada (muchos puntos calcificados grandes) o grave (calcificación extensa)13. También se registró la presencia o ausencia del TSVI, así como la calcificación anual mitral.
Figura 1. Medición de los diferentes ángulos. AngA: angulación aórtica (49,62º). B: ángulo TSVI/AA (18,74º). AA: aorta ascendente; TSVI: tracto de salida del ventrículo izquierdo.
Figura 2. Medición de la profundidad de implantación de las válvulas Evolut PRO. A: [A = 1,17 mm asociada a la CNC y B = 4,91 mm asociada a la CCI] y SAPIEN 3. B: [A = 5,65 mm asociada a la CNC y B = 7,31 mm asociada a la CCI]. Adviértase la mayor profundidad de implantación asociada a la CNC por el mayor ángulo TSVI/AA de la Evolut PRO (A) a diferencia de la SAPIEN 3 (B). AA: aorta ascendente; CCI, cúspide coronaria izquierda; CNC, cúspide no coronaria; TSVI: tracto de salida del ventrículo izquierdo.
Análisis estadístico
Los datos se recopilaron y analizaron con el paquete de software estadístico SPSS (Statistical Software Package for the Social Sciences, versión 20, IBM, Estados Unidos). Los datos continuos se expresaron con media ± DE o mediana (rango). Los datos nominales se expresaron como frecuencia (porcentaje). Para comparar los datos nominales y continuos se emplearon la prueba de la X2 y la prueba de la t de Student, respectivamente. Se usó el coeficiente de correlación Pearson para la correlación existente entre la profundidad de implantación con los ángulos TSVI y AngA según el tipo de válvula empleada. El nivel de confianza se mantuvo en el 95%, razón por la cual los valores p < 0,05 se consideraron estadísticamente significativos. Se realizó un análisis de regresión logística univariable para los predictores de FPP significativa. El análisis ROC se realizó para el valor óptimo de corte del ángulo TSVI/AA para el resultado de FPP significativa.
En lo que al tamaño de la muestra se refiere, asumiendo una proporción de 1:1 en las asignaciones del tratamiento y un índice estimado del objetivo primario compuesto (FPP, mortalidad intrahospitalaria e índice de implante de marcapasos) del 8% en cada grupo, calculamos que harían falta 52 pacientes en cada grupo para que el estudio alcanzase un potencial estadístico del 80% a un nivel alfa unilateral del 0,05.
RESULTADOS
Características basales
Se aleatorizó a 110 pacientes consecutivos con estenosis aórtica sintomática grave aptos para el TAVI a recibir las válvulas Evolut PRO (51 pacientes) o SAPIEN 3 (59 pacientes). No hubo cruzamientos entre uno y otro grupo del estudio. Las características clínicas basales fueron parecidas entre los 2 tipos de válvulas salvo por un índice de masa corporal que fue mucho mayor en los pacientes del grupo SAPIEN 3 y un bloqueo basal de rama derecha, también mucho mayor en el grupo SAPIEN (tabla 1).
Tabla 1. Características de los pacientes asociadas al tipo de válvula implantada
| Tipo de válvula | p | ||
|---|---|---|---|
| Evolut PRO (n = 51) |
SAPIEN 3 (n = 59) |
||
| Edad (años) | 82,6 ± 6,4 | 81,2 ± 5,8 | 0,22 |
| Sexo | 0,39 | ||
| Hombre | 54,9 | 59,3 | |
| Mujer | 45,1 | 40,7 | |
| Índice de masa corporal (kg/m2) | 26,4± 4,7 | 28,7 ± 4,7 | 0,01a |
| Área de superficie corporal (m2) | 1,9 ± 0,4 | 1,9 ± 0,2 | 0,08 |
| Enfermedad arterial periférica | 11,8 | 6,8 | 0,28 |
| Hipertensión | 76,5 | 83,1 | 0,26 |
| Diabetes mellitus | 29,4 | 37,3 | 0,25 |
| Cardiopatía isquémica | 62,0 | 45,8 | 0,06 |
| Revascularización previa (ICP/CABG) | 41,2 | 37,3 | 0,53 |
| Antecedentes de accidente cerebrovascular | 5,9 | 5,1 | 0,58 |
| Marcapasos previo | 9,8 | 6,8 | 0,40 |
| Enfermedad torácica crónica | 9,8 | 23,7 | 0,31 |
| Clase NYHA | 0,09 | ||
| II | 13,7 | 15,3 | |
| III | 86,3 | 78,0 | |
| IV | 0,0 | 6,8 | |
| Puntuación STS | 3,8 ± 2,6 | 3,5 ± 2,2 | 0,51 |
| Clase STS (%) | 0,65 | ||
| Baja (< 4%) | 58,8 | 66,1 | |
| Intermedia (del 4 al 8%) | 35,3 | 27,1 | |
| Alta (> 8%) | 5,9 | 6,8 | |
| Hallazgos ECG | 0,95 | ||
| Ritmos sinusales | 43,1 | 45,8 | |
| Estimulación o pacing | 7,8 | 6,8 | |
| Fibrilación auricular | 49,0 | 47,5 | |
| Trastornos en la conducción cardiaca preoperatorios totales | 19,6 | 22,0 | 0,47 |
| BRD basal | 0,0 | 16,9 | 0,001b |
|
A menos que se indique lo contrario, los datos expresan n (%). Los trastornos en la conducción cardiaca preoperatorios incluyeron bloqueo auriculoventricular, retraso de la conducción intraventricular, hemibloqueo anterior izquierdo, bloqueo de rama izquierda y BRD. BRD: bloqueo de rama derecha; CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructive crónica; ICP: intervención coronaria percutánea; SAOS: síndrome de apnea obstructive del sueño; STS: escala de riesgo de la Society of Thoracic Surgery. |
|||
Hallazgos ecocardiográficos y fluoroscópicos
Los hallazgos basales ecocardiográficos y fluoroscópicos de los 2 grupos fueron parecidos (tabla 2).
Tabla 2. Datos ecocardiográficos y fluoroscópicos entre los diferentes grupos de estudio
| Tipo de válvula | p | ||
|---|---|---|---|
| Evolut PRO (n = 51) |
SAPIEN 3 (n = 59) |
||
| GP medio (mmHg) | 42,3 ± 7,7 | 42,8 ± 9,9 | 0,78 |
| GP máximo (mmHg) | 68,5 ± 10,5 | 67,3 ± 12,0 | 0,56 |
| Área valvular aórtica (mm) | 0,9 ± 0,7 | 0,9 ± 0,2 | 0,46 |
| Fracción de eyección (%) | |||
| Fracción de eyección | 48,4 ± 11,7 | 50,9 ± 11,7 | 0,25 0,76 |
| Conservada (> 50%) | 62,7 | 67,8 | |
| Levemente deteriorada (del 40 al 50%) | 17,6 | 15,3 | |
| Moderadamente deteriorada (del 30 al 40%) | 9,8 | 11,9 | |
| Gravemente deteriorada (< 30%) | 9,8 | 5,1 | |
| Gradiente / flujo (%) | |||
| AFAG | 74,5 | 71,2 | 0,91 |
| BFBG/FE deteriorada | 19,6 | 22,0 | |
| BFBG/FE conservada | 5,9 | 6,8 | |
| Mediciones aórticas (mediante ETE) | |||
| Área valvular aórtica (mm) | 0,7 ± 0,1 | 0,7 ± 0,2 | 0,22 |
| Anillo (mm) | 23,8 ± 2,1 | 24,5 ± 1,9 | 0,07 |
| TSVI (mm) | 21,1 ± 2,1 | 21,6 ± 2,4 | 0,26 |
| Seno de Valsalva (mm) | 30,7 ± 3,6 | 31,2 ± 3,8 | 0,45 |
| Unión sinotubular (mm) | 25,9 ± 3,1 | 26,4 ± 3,5 | 0,37 |
| Aorta ascendente (mm) | 33,3 ± 5,9 | 33,7 ± 4,6 | 0,68 |
| Distancia UST/TSVI (mm) | 20,1 ± 10,5 | 19,4 ±3,2 | 0,62 |
| Calcificación de la raíz aórtica (%) | |||
| Calcificación anular | 0,49 | ||
| Leve | 66,7 | 71,2 | |
| Moderada | 27,5 | 27,1 | |
| Grave | 5,9 | 1,7 | |
| Calcificación sinotubular | 5,9 | 8,5 | 0,44 |
| Calcificación del TSVI | 19,6 | 11,9 | 0,19 |
| Calcificación anular mitral | 15,7 | 18,6 | 0,44 |
| Ángulo TSVI/AA (°) | 13,7 ± 5,1 | 13,9 ± 5,2 | 0,84 |
| Ángulo AngA (°) | 46,5 ± 9,4 | 47,5 ± 12,1 | 0,62 |
|
A: aorta; AngA: angulación aórtica; AFAG: alto flujo-alto gradiente; BFBG: bajo flujo-bajo gradiente; ETE: ecocardiografía transesofágica; FE: fracción de eyección; GP: gradiente de presión; TSVI: tracto de salida del ventrículo izquierdo; UST: unión sinotubular. |
|||
Datos de la intervención según el tipo de válvula empleada
Se observaron pocas diferencias en los datos de la intervención en lo relativo al diseño de la válvula y al tamaño de la vaina tal y como se muestra en la tabla 3.
Tabla 3. Datos de la intervención asociados a cada tipo de válvula
| Tipo de válvula | p | ||
|---|---|---|---|
| Evolut PRO (n = 51) |
SAPIEN 3 (n = 59) |
||
| Vía de acceso (%) | 0,51 | ||
| Femoral derecha | 60,8 | 59,3 | |
| Femoral izquierda | 39,2 | 40,7 | |
| Anillo mediante ETE (mm) | 23,8 ± 2,1 | 24,5 ± 1,9 | 0,07 |
| Tamaño del balón (mm) | 22,5 ± 1,9 | 22,6 ± 1,9 | 0,63 |
| Dimensionamiento del balón (mm) | 23,4 ± 1,7 | 23,6 ± 1,9 | 0,44 |
| Tamaño de la válvula (%) | |||
| 23 | 0,0 | 30,5 | |
| 26 | 43,1 | 45,8 | |
| 29 | 56,9 | 23,7 | |
| Tamaño de la vaina (Fr) | 16,0 | 14,5 ± 0,9 | < 0,001 |
| Diámetro exterior de la vaina (mm) | 7,3 ± 0,1 | 6,2 ± 0,3 | < 0,001 |
| Diámetro de la arteria femoral (mm) | 7,9 ±1,1 | 8,2 ± 0,9 | 0,20 |
| Coeficiente vaina a arteria femoral | 0,9 ± 0,1 | 0,8 ± 0,1 | < 0,001 |
| Índice de cobertura (%) | |||
| ETE | 16,4 ± 5,6 | 5,2 ± 4,2 | < 0,001 |
| Balón | 18,3± 3,3 | 8,9 ± 3,3 | < 0,001 |
| Gradiente presión protésico medio | 9,8 | 12,2 | 0,01 |
| Incidencia de IA (%) | 28,4 ± 7,8 | 30,7 ± 7,4 | 0,11 |
| Profundidad de implantación (mm) | |||
| CCI | 5,8 ± 2,3 | 4,2 ± 1,7 | < 0,001 |
| CNC | 6,3 ± 2,5 | 5,27 ± 1,7 | 0,01 |
| Cantidad de contraste (ml) | 145,5 ± 48,8 | 128,6 ± 33,2 | 0,03 |
| Radiación (mGy) | 4944,4 ± 2294,8 | 4557,8 ± 3133,9 | 0,46 |
|
CCI: cúspide coronaria izquierda; CNC: cúspide no coronaria; ETE, ecocardiografía transesofágica; IA: insuficiencia aórtica. |
|||
Resultados según el tipo de válvula empleada
Sí se observó una diferencia significativa en la FPP (tanto inmediata como al alta hospitalaria) y, consecuentemente, más posdilatación con balón en el grupo Evolute que en el SAPIEN 3. El uso de cantidades mucho mayores contraste con las válvulas Evolut PRO explicaría el mayor daño renal agudo descrito en este grupo comparado con el SAPIEN. Los resultados fueron favorables a la válvula SAPIEN 3 con independencia de los objetivos de accidente cerebrovascular o mortalidad intrahospitalaria. No obstante, no se observó ninguna diferencia significativa. Los índices de éxito del dispositivo (ausencia de FPP significativa [≥ grado II] al alta hospitalaria, necesidad de implantar una segunda válvula, embolización de la prótesis, rendimiento de la prótesis valvular y mortalidad) fueron del 86 y 98% con las válvulas Evolut PRO y SAPIEN 3, respectivamente; p = 0,01 (tabla 4).
Tabla 4. Resultados intrahospitalarios en pacientes tratados con la válvula Evolut PRO frente a la SAPIEN 3
| Tipo de válvula | p | ||
|---|---|---|---|
| Evolut PRO (n = 51) |
SAPIEN 3 (n = 59) |
||
| FPP inmediata | 0,01 | ||
| Sin rastro | 19 (37,3) | 46 (78) | |
| Grado I | 22 (43,1) | 9 (15,2) | |
| ≥ grado II | 10 (19,6) | 4 (6,8) | |
| Posdilatación con balón | 8 (15,7) | 3 (5,1) | 0,35 |
| FPP al alta | 0,01 | ||
| Sin rastro | 26 (50,9) | 49 (83,1) | |
| Grado I | 22 (43,1) | 9 (15,3) | |
| Grado II | 2 (3,9) | 1 (1,7) | |
| Grado III | 1 (2) | 0 | |
| Grado IV | 0 | 0 | |
| Trastornos de la conducción cardiaca globales de nueva aparición | 9 (17,6) | 10 (16,9) | 0,56 |
| BRI de nueva aparición | 4 (7,8) | 4 (6,7) | 0,40 |
| Implante posoperatorio de marcapasos | 4 (7,8) | 3 (5,1) | 0,25 |
| Complicaciones vasculares | 0,66 | ||
| Complicaciones vasculares mayores | 2 (3,9) | 2 (3,4) | |
| Complicaciones vasculares menores | 4 (7,9) | 3 (5,1) | |
| Complicaciones hemorrágicas | 0 | 0 | |
| Daño renal agudo* | 3 (5,9) | 2 (3,4) | 0,28 |
| Accidente cerebrovascular | 1 (2) | 0 | 0,46 |
| Embolización de la válvula | 1 (2) | 0 | 0,46 |
| Necesidad de una segunda válvula | 2 (3,9) | 0 | 0,30 |
| Incidencia de mortalidad intrahospitalaria | 2 (3,9) | 0 | 0,30 |
|
Los datos expresan n (%). FPP: fuga periprotésica. |
|||
Impacto de los factores anatómicos en la FPP
La calcificación y el ángulo TSVI/AA influyeron más en la FPP de la válvula Evolut PRO que en la de la SAPIEN 3. El ángulo TSVI/AA se clasificó según el valor de corte para el objetivo de FPP significativa ≥ grado II obtenido a partir de la curva receiver operating characteristic (ROC): valor de corte = 11º, sensibilidad del 80% y especificidad del 35,8%, área bajo la curva (0,57; intervalo de confianza del 95%, 0,474-0,666; p = 0,37.) Por otro lado, no se observó una relación estrecha ni significativa entre el ángulo AngA y la FPP en ninguno de los 2 grupos (tabla 5).
Tabla 5. Relación entre los factores anatómicos y la FPP en pacientes tratados con las válvulas Evolut PRO o SAPIEN 3
| Válvula Evolut PRO (n = 51) | Válvula SAPIEN 3 (n = 59) | pa | pb | pc | |||
|---|---|---|---|---|---|---|---|
| < FPP leve | ≥ FPP leve | < FPP leve | ≥ FPP leve | ||||
| Número | 37,3 | 62,7 | 77,9 | 22,0 | 0,010 | ||
| Calcificación anular | 0,03 | 0,2 | |||||
| Leve | 31,4 | 35,3 | 59,3 | 11,9 | 0,001 | ||
| Moderada | 5,9 | 21,6 | 16,9 | 10,2 | 0,024 | ||
| Grave | 0,0 | 5,9 | 1,7 | 0,0 | 0,046 | ||
| Calcificación del TSVI | 1,7 | 17,6 | 3,4 | 8,5 | 0,04 | 0,001 | 0,323 |
| Calcificación anular mitral | 0,0 | 15,7 | 15,3 | 3,4 | 0,001 | 0,2 | 0,035 |
| Ángulo TSVI/AAa | 0,01 | 0,001 | |||||
| < 11° | 17,6 | 15,7 | 25,4 | 1,7 | 0,02 | ||
| ≥ 11° | 19,6 | 47,1 | 52,5 | 20,3 | 0,03 | ||
| Ángulo AngA (%) | 0,78 | 0,34 | |||||
| < 48º | 23,5 | 37,2 | 45,8 | 15,2 | 0,03 | ||
| > 48º | 13,7 | 25,5 | 32,2 | 6,8 | 0,01 | ||
| AA: aorta ascendente; AngA: angulación aórtica; TSVI: tracto de salida del ventrículo izquierdo. Un ángulo TSVI/AA del 11º es el valor de corte para la incidencia de FPP detectado por la curva ROC. Los datos expresan porcentaje (%). a Valor p dentro del grupo Evolut PRO. b Valor p dentro del grupo SAPIEN 3. c Valor p en base a la puntuación de la X2 entre los 2 grupos. |
|||||||
La tabla 6 revela el análisis univariado de predictores de FPP ≥ grado II inmediatamente después de la intervención FPP. Tal y como quedó demostrado, la calcificación valvular moderada y grave, la calcificación del TSVI y el ángulo TSVI/AA contribuyen a la FPP significativamente.
Tabla 6. Análisis univariado de predictores de FPP posoperatoria inmediata significativa (grado ≥ 2)
| Variable | Univariado | |
|---|---|---|
| OR (IC95%) | p | |
| Calcificación grave | 35,000 (3,138-390,431) | 0,004 |
| Calcificación del TSVI | 10,921 (3,208-37,174) | < 0,001 |
| Ángulo TSVI/AA | 1,047 (0,940-1,165) | 0,003 |
| AngA | 1,016 (0,967-1,067) | 0,524 |
| Tipo de válvula (Evolut PRO) | 2,750 (0,872-8,669) | 0,084 |
| Índice de cobertura según ETE | 1,099 (1,018-1,188) | 0,016 |
| Índice de cobertura según dimensionamiento del balón | 1,108 (1,001-1,226) | 0,049 |
| Profundidad de implantación asociada a la CCI | 1,199 (0,953-1,510) | 0,122 |
| Profundidad de implantación asociada a la CCD | 1,167 (0,914-1,489) | 0,215 |
|
Los valores p < 0,05 se consideraron significativos a nivel estadístico. AA: aorta ascendente; AngA: angulación aórtica; CCD: cúspide coronaria derecha; CCI: cúspide coronaria izquierda; ETE: ecocardiografía transesofágica; FPP: fuga periprotésica; IA: insuficiencia aórtica; IC95%: intervalo de confianza del 95%; TSVI: tracto de salida del ventrículo izquierdo. |
||
Impacto de los ángulos TSVI/AA y AngA en la profundidad de implantación
Se observó una correlación significativamente negativa entre la profundidad de implantación de la válvula Evolut PRO en la CNC y los ángulos TSVI/AA (r = -0.38; p = 0,01), correlación que no se observó con la válvula SAPIEN 3 (tabla 7).
Tabla 7. Correlación de la profundidad de implantación (en las 2 válvulas) con los ángulos TSVI/AA y AngA
| Tipo de válvula | ||||
|---|---|---|---|---|
| Evolut PRO | SAPIEN 3 | |||
| CCI | CNC | CCI | CNC | |
| Ángulo TSVI/AA (°) | -0,23 (0,09) | -0,38 (0,01) | 0,09 (0,46) | 0,16 (0,21) |
| Ángulo AngA (°) | 0,13 (0,33) | 0,06 (0,65) | 0,02 (0,87) | 0,06 (0,61) |
|
Los valores r y p se refieren, respectivamente, a la fortaleza de la correlación y a la significación de la misma. Los valores p < 0,05 fueron significativos a nivel estadístico. AA: aorta ascendente; AngA: angulación aórtica; CCI: cúspide coronaria izquierda; CNC: cúspide no coronaria; TSVI: tracto de salida del ventrículo izquierdo. |
||||
DISCUSIÓN
En este estudio, se hicieron 2 importantes hallazgos. En primer lugar, el implante de la válvula Evolut PRO se asoció a un mayor riesgo de FPP significativa comparada con la SAPIEN 3. En segundo lugar, el índice de IMP fue el mismo en los 2 grupos. Por lo demás, las 2 válvulas tuvieron resultados similares.
Reducir la FPP supone un reto importante a la hora de realizar el TAVI puesto que se asocia a peores resultados, sobre todo, al emplear estos dispositivos, en la actualidad, en pacientes de menor riesgo14.
Una comparativa aleatorizada entre las válvulas CoreValve y SAPIEN XT realizada en el estudio CHOICE reveló una incidencia más baja de FPP de moderada a grave en el grupo SAPIEN XT15. En el estudio SOLVE-TAVI se describió la no inferioridad de las 2 válvulas (SAPIEN 3 y Evolut R) en el objetivo compuesto primario de eficacia (muerte, accidente cerebrovascular, insuficiencia periprotésica y nuevo implante de marcapasos)16. En la actualidad, los primeros resultados obtenidos con las válvulas SAPIEN 3 Ultra y Evolut PRO+ han sido favorables17.
En nuestro estudio, la FPP significativa (≥ grado II) fue más habitual en los pacientes que recibieron la Evolut PRO que en los que recibieron la SAPIEN 3 (9,6 frente al 6,8%, respectivamente). Enríquez-Rodríguez et al. describieron una incidencia más baja (2,5%) de FPP de moderada a grave con las válvulas SAPIEN 3 debido, posiblemente, a la presencia del manguito de sellado externo18.
Es obvio que los factores anatómicos contribuyen a la ocurrencia de la FPP. Se observó que un mayor ángulo TSVI/AA estuvo asociado a una incidencia más alta de FPP, sobre todo, en la válvula Evolut PRO. Sherif et al. demostraron que el riesgo de FPP aumenta cuanto mayores son los ángulos TSVI/AA10. También se observó que el ángulo TSVI/AA influye en la profundidad de implantación asociada a la CNC con la Evolut PRO, no así con la SAPIEN 3. No es, pues, de extrañar que la profundidad de implantación influya en la incidencia de la FPP.
Sherif et al. fueron los primeros en describir la relación que existe entre ángulos AngA más grandes y la FPP posoperatoria en las válvulas autoexpandibles10. Posteriormente, un estudio retrospectivo realizado por Abramowitz et al. describió un mayor índice de complicaciones (tales como FPP posoperatoria) en pacientes con aortas horizontales (definidas por AngA ≥ 48º observados en la TC cardiaca) tratados con válvulas autoexpandibles11. Se pudo observar cómo los ángulos AngA influían en la FPP de pacientes que recibieron válvulas Evolut PRO aunque ángulos fueran < 48º, no observándose ninguna otra diferencia significativa en la incidencia de FPP para ángulos AngA < 48º o ≥ 48º.
En este estudio también se observó a 6 pacientes con ángulos AngA ≤ 30º (3 pacientes con la válvula Evolut PRO y otros 3 con la SAPIEN 3). Todos quedaron libres de FPP inmediatamente después de desplegar la válvula. Se podría especular con la posibilidad de los ángulos AngA ≤ 30º son los que mejor funcionan al implantar la Evolut PRO, aunque lo cierto es que, con una muestra de este tamaño, no se pueden extraer conclusiones definitivas.
En nuestro estudio, los índices de éxito del dispositivo determinados por la ausencia de FPP significativa (≥ grado II) al alta hospitalaria, la necesidad de implantar una segunda válvula, la embolización de la prótesis valvular, el rendimiento de la misma y la mortalidad según la definición del VARC9 fueron del 86 y 98% con las válvulas Evolut PRO y SAPIEN 3, respectivamente. Asimismo, Li et. al confirmaron un índice de éxito del dispositivo parecido tanto con la SAPIEN 3 como con la Evolut R (94 y 96%, respectivamente)19.
Se hallaron índices similares de trastornos de la conducción cardiaca posoperatorios e IMP tanto en la Evolut PRO como en la SAPIEN 3 (del 7,8 y 5,1%, respectivamente). Popma et al.20 y Vlastra et al.21 describieron índices más bajos de IMP con prótesis balón expandible de nueva generación que con válvulas autoexpandibles de nueva generación. Los índices parecidos de trastornos de la conducción e IMP descritos con una y otra válvula en nuestro estudio probablemente se debieron a una menor profundidad de implantación de las válvulas Evolut PRO.
Li et al. describieron índices más altos de posdilatación de hasta el 30% con la válvula Evolut R que con la SAPIEN 3.19 No obstante, esto es algo que no detectamos en nuestro estudio (15,7 y 5,1%, respectivamente; p = 0,35) probablemente por el correcto posicionamiento de la Evolut PRO y predilatación rutinaria de todos nuestros casos.
En este estudio, la mortalidad intrahospitalaria fue parecida en los 2 grupos valvulares. Li et al. también aseguraron que la mortalidad no se asoció al tipo de válvula implantada19. El estudio CHOICE también mostró un índice de mortalidad parecido al de las válvulas de antigua generación (CoreValve y SAPIEN XT)15.
La incidencia de los accidentes cerebrovasculares fue parecida tanto con la Evolut PRO como con la SAPIEN 3 aunque menor que la descrita en dispositivos de antigua generación15,19,22,23. La experiencia de los operadores y las mejoras experimentadas por los sistemas de liberación probablemente sean la razón del menor riesgo de complicaciones tromboembólicas descrito.
Con independencia del tipo de válvula empleado, parece que el daño renal agudo fue algo más habitual en nuestro estudio (5,9 y 3,5% para la Evolut PRO y la SAPIEN 3, respectivamente) que lo descrito anteriormente. Husser et al.24 describieron una incidencia del 2,7% en las válvulas SAPIEN 3 mientras que Kodali et al.25 hablan de incidencias cercanas al 1,7%. No obstante, los estudios multicéntricos grandes suelen tener criterios de inclusión más estrictos, razón por la cual la función renal basal de los pacientes incluidos fue mejor19.
A pesar de que los coeficientes vaina a arteria femoral de la Evolut PRO fueron mayores, el índice de hemorragias o complicaciones vasculares fue parecido al de la SAPIEN 3. Li et al.19 y Panchal et al.26 describieron resultados similares.
Limitaciones
Este fue un estudio de un único centro con una muestra de pequeño tamaño y un potencial estadístico limitado. Como en nuestro estudio no se realizaron tomografías computarizadas de forma rutinaria no se obtuvo información específica sobre la anatomía de la raíz aórtica ni se realizaron ajustes en base a las dimensiones anulares o al grado/distribución de la calcificación anular aórtica. Por otro lado, las mediciones angiográficas de los ángulos TSVI/AA y AngA podrían no ser exactas. No obstante, esto podría haber ayudado a excluir el sesgo de selección de algunos operadores que son reacios a usar válvulas autoexpandibles en presencia de calcificaciones mayores o angulaciones graves.
El seguimiento se limitó a la duración de la estancia hospitalaria (de media, 1 semana). No obstante, parece razonable pues nos centramos en los aspectos de la intervención. Además, en otros estudios similares, los resultados intrahospitalarios y del seguimiento a 30 días fueron bastante parecidos.
CONCLUSIONES
Este estudio aleatorizado arrojó resultados de la intervención e intrahospitalarios parecidos entre las válvulas Evolut PRO y SAPIEN 3 salvo por una incidencia mucho mayor de FPP asociada a las válvulas Evolut PRO. La FPP descrita se asoció al ángulo TSVI/AA en el grupo Evolut PRO, lo cual podría haber influido negativamente en la profundidad de implantación de este tipo de válvula.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Idea y diseño: H. M. Elnaggar, M. S. Mahmoud, W. Schoels y Y. T. Kishk. Apoyo administrativo: W. Schoels, M. Kullmer y M. Dia. Provisión de materiales del estudio o pacientes: M. S. Mahmoud, M. Algowhary y H. M. Elnaggar. Recopilación y organización de datos: M. S. Mahmoud, M. Kullmer y M. Dia. Análisis e interpretación de los datos: M. S. Mahmoud, Y. T. Kishk, M. Algowhary y H. M. Elnaggar. Redacción del manuscrito y aprobación final: todos los autores.
CONFLICTOS DE INTERÉS
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- Tanto las válvulas autoexpandibles (Evolut platform) como las prótesis balón expandible (serie SAPIEN) son los dispositivos TAVI más empleados.
- Los resultados obtenidos entre las 2 válvulas son parecidos, salvo un relativo aumento de la FPP y los trastornos en la conducción cardiaca con la válvula Evolut.
- También se plantean ciertos retos anatómicos durante el despliegue de las válvulas autoexpandibles como, por ejemplo, la angulación aórtica grave (aorta horizontal).
- No existe ningún ensayo clínico aleatorizado prospectivo que compare las válvulas Evolut PRO (válvula autoexpandible con falda externa de sellado) y SAPIEN 3.
¿QUÉ APORTA DE NUEVO?
- Se trata del primer ensayo clínico aleatorizado y prospectivo en realizar una comparativa entre las válvulas Evolut PRO (válvula autoexpandible con falda externa de sellado) y SAPIEN 3.
- Este estudio demostró resultados favorables parecidos entre ambas válvulas con independencia de una FPP mucho mayor en el grupo Evolut PRO.
- También en nuestro estudio, la angulación TSVI/AA y AngA influyeron en la FPP del grupo Evolut PRO frente al SAPIEN 3. No obstante, la angulación AngA no influyó en la FPP en ninguno de los 2 grupos
- El ángulo TSVI/AA se asoció negativamente a la profundidad de implantación en el caso de la válvula Evolut PRO sin ningún efecto sobre la SAPIEN 3, lo cual podría haber influido en el desarrollo de la FPP del grupo Evolut PRO.
BIBLIOGRAFÍA
1. Athappan G, Patvardhan E, Tuzcu EM, et al. Incidence, predictors, and outcomes of aortic regurgitation after transcatheter aortic valve replacement: meta-analysis and systematic review of literature. J Am Coll Cardiol. 2013;61:1585-1595.
2. Herrmann HC, Abdel-Wahab M, Attizzani GF, et al, Rationale and design of the SMall Annuli Randomized to Evolut or SAPIEN Trial (SMART Trial). Am Heart J. 2022;243:92-102.
3. Paitazoglou C, Meincke F, Thorsten Hanke M, et al. The ALSTER-TAVI All-Comers Registry: Procedural and 1-Year Clinical Outcomes of Balloon-Expandable vs Self-Expanding Contemporary TAVI Valves. J Invasive Cardiol. 2021;33:E356-E364.
4. Mahmoud MS, Kishk YT, Algowhary M, et al. Balloon Sizing for Transcatheter Aortic Valve Implantation Using 3 rd Generation Valves, Does It Still Work? Int Med J. 2021;28:604-609.
5. Détaint D, Lepage L, Himbert D, et al. Determinants of significant paravalvular regurgitation after transcatheter aortic valve implantation: impact of device and annulus discongruence. JACC Cardiovasc Interv. 2009;2:821-827.
6. Wang J, Yu W, Jin Q, et al. Risk factors for post-TAVI bleeding according to the VARC-2 bleeding definition and effect of the bleeding on short-term mortality: a meta-analysis. Can J Cardiol. 2017;33:525-534.
7. Sellers RD, Levy MJ, Amplatz K, Lillehei CW. Left retrograde cardioangiography in acquired cardiac disease: Technic, indications and interpretations in 700 cases. Am J Cardiol. 1964;14:437-447.
8. Sinning JM, Hammerstingl C, Vasa-Nicotera M, et al. Aortic regurgitation index defines severity of peri-prosthetic regurgitation and predicts outcome in patients after transcatheter aortic valve implantation. J Am Col Cardiol. 2012;59:1134-1141.
9. Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: the Valve Academic Research Consortium-2 consensus document. J Thorac Cardiovasc Surg. 2013;145:6-23.
10. Sherif MA, Abdel-Wahab M, Stöcker B, et al. Anatomic and procedural predictors of paravalvular aortic regurgitation after implantation of the Medtronic CoreValve bioprosthesis. J Am Col Cardiol. 2010;56:1623-1629.
11. Abramowitz Y, Maeno Y, Chakravarty T, et al., Aortic angulation attenuates procedural success following self-expandable but not balloon-expandable TAVR. JACC Cardiovasc Imaging. 2016;9:964-972.
12. Di Stefano D, Colombo A, Mangieri A, et al. Impact of horizontal aorta on procedural and clinical outcomes in second-generation transcatheter aortic valve implantation. EuroIntervention. 2019;15:e749-e756.
13. Mostafa AE, Richardt G, and Abdel-Wahab M. Clinical utility of a predictive model for paravalvular aortic regurgitation after transcatheter aortic valve implantation with a self-expandable prosthesis. Egypt Heart J. 2017;69:253-259.
14. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376:1321-1331.
15. Abdel-Wahab M, Mehilli J, Frerker C, et al. Comparison of balloon-expandable vs self-expandable valves in patients undergoing transcatheter aortic valve replacement: the CHOICE randomized clinical trial. JAMA Cardiol. 2014;311:1503-1514.
16. Webb J, Wood D, Sathananthan J, Landes U. Balloon-expandable or self-expandable transcatheter heart valves. Which are best? Eur Heart J. 2020;41:1900-1902.
17. Jiang T, Hasan SM, Faluk M, Patel J. Evolution of Transcatheter Aortic Valve Replacement| Review of Literature. Curr Probl Cardiol. 2021;46:100600.
18. Enríquez-Rodríguez E, Amat-Santos IJ Jiménez-Quevedo P, et al. Comparison of the hemodynamic performance of the balloon-expandable SAPIEN 3 versus self-expandable Evolut R transcatheter valve: a case-matched study. Rev Esp Cardiol. 2018;71:735-742.
19. Li Y-M, Tsauo J-Y, Liao Y-B, Zhao Z-G, Chen M. Comparison of Third Generation Balloon-Expandable Edwards Sapien 3 Versus Self-Expandable Evolut R in Transcatheter Aortic Valve Implantation: A Meta-Analysis. Ann Palliat Med. 2020;9:700-708.
20. Popma JJ, Reardon MJ, Khabbaz K, et al. Early clinical outcomes after transcatheter aortic valve replacement using a novel self-expanding bioprosthesis in patients with severe aortic stenosis who are suboptimal for surgery: results of the Evolut R US study. JACC Cardiovasc Interv. 2017;10:268-275.
21. Vlastra W, Chandrasekhar J, Muñoz-Garcia AJ, et al. Comparison of balloon-expandable vs. self-expandable valves in patients undergoing transfemoral transcatheter aortic valve implantation: from the CENTER-collaboration. Eur Heart J. 2019;40:456-465.
22. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
23. Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
24. Husser O, W.-K. Kim, et al. Multicenter comparison of novel self-expanding versus balloon-expandable transcatheter heart valves. JACC Cardiovasc Interv. 2017;10:2078-2087.
25. Kodali S, Thourani VH, White J, et al. Early clinical and echocardiographic outcomes after SAPIEN 3 transcatheter aortic valve replacement in inoperable, high-risk and intermediate-risk patients with aortic stenosis. Eur Heart J. 2016;37:2252-2262.
26. Panchal HB, Barry N, Bhatheja S, Albalbissi K, Mukherjee D, Paul T. Mortality and major adverse cardiovascular events after transcatheter aortic valve replacement using Edwards valve versus CoreValve: A meta-analysis. Cardiovasc Revasc Med. 2016;17:24-33.
- Coste-efectividad del implante percutáneo de válvula aórtica con SAPIEN 3 en pacientes con bajo riesgo de mortalidad quirúrgica en España
- Resultados del implante percutáneo de válvula aórtica en España mediante el Registro de Actividad de Atención Especializada
- Una solución sencilla cuando fracasa el cierre con sutura en el acceso vascular del TAVI
- Pronóstico de pacientes nonagenarios tras implante percutáneo de válvula aórtica