RESUMEN
Introducción y objetivos: El objetivo primario de este estudio fue presentar la mortalidad total intrahospitalaria del registro español de implante percutáneo de válvula aórtica (TAVI) desde su inicio hasta el año 2018, y como objetivos secundarios otros eventos clínicos intrahospitalarios, la mortalidad total a los 30 días y la evaluación de cuál ha sido la evolución temporal de este registro.
Métodos: Fueron analizados todos los pacientes consecutivos incluidos en el registro español de TAVI. En este análisis temporal se dividió la población en pacientes tratados antes de 2014 (cohorte A: 2009-2013) y pacientes tratados entre los años 2014 y 2018 (cohorte B).
Resultados: Desde agosto de 2007 hasta junio de 2018 se incluyeron 7.180 pacientes. La edad media fue de 81,2 ± 6,5 años y el 53% eran mujeres. El EuroSCORE logístico fue del 12% (8-20). Se utilizó un acceso transfemoral en el 89%. La mortalidad total intrahospitalaria fue del 4,7% y a los 30 días fue del 5,7%. En el análisis temporal durante la fase hospitalaria, las tasas de infarto, accidente cerebrovascular, necesidad de marcapasos, taponamiento, obstrucción coronaria y complicaciones vasculares fueron similares en ambos grupos. Sin embargo, en la cohorte B se observó una reducción de la necesidad de conversión a cirugía y de mala posición de la válvula, y además la tasa de éxito del implante fue mayor (93 frente a 96%; p < 0,001). La mortalidad por cualquier causa ajustada tanto intrahospitalaria como a los 30 días, fue significativamente menor en la cohorte B (odds ratio [OR] = 0,65; intervalo de confianza del 95% [IC95%], 0,48-0,86; p = 0,003; y OR = 0,71; IC95%, 0,54-0,92; p = 0,002, respectivamente).
Conclusiones: En el análisis temporal del registro español de TAVI se observan un cambio en el perfil clínico de los pacientes y una mejora en la evolución clínica tanto intrahospitalaria como a los 30 días en los pacientes tratados en los últimos años.
Palabras clave: Tratamiento transcatéter de la válvula aórtica. Registros. Estenosis aórtica grave.
ABSTRACT
Introduction and objectives: This study primary endpoint was to present the in-hospital all-cause mortality of the Spanish TAVI registry from its inception until 2018. Secondary endpoints included other in-hospital clinical events, 30-day all-cause mortality, and an assessment of the time trend of this registry.
Methods: All consecutive patients included in the Spanish TAVI registry were analyzed. In this time-based analysis, the population was been divided into patients treated before 2014 (cohort A: 2009-2013) and patients treated between 2014 and 2018 (cohort B).
Results: From August 2007 to June 2018, 7180 patients were included. The mean age was 81.2 ± 6.5 years and 53% were women. The logistic EuroSCORE was 12% (8-20). Transfemoral access was used in 89%. In-hospital and 30-day all-cause mortality was 4.7% and 5.7%, respectively. On the time-based analyses during the hospital stay, the rate of myocardial infarction, stroke, need for pacemakers, tamponade, coronary obstruction, and vascular complications was similar between both groups. However, cohort B showed less need for conversion to surgery and malapposition of the valve. Also, the implant success rate increased from 93% to 96% (P < .001). In-hospital and 30-day all-cause mortality was significantly lower in cohort B, ([OR, 0.65; IC95%, 0.48-0.86; P = .003] and [OR, 0.71; IC95%, 0.54-0.92; P = .002], respectively).
Conclusions: The time trend analysis of the Spanish TAVI registry showed a change in the patients’ clinical profile and an improvement in the in-hospital clinical outcomes and 30-day all-cause mortality in patients treated more recently.
Keywords: Transcatheter treatment of the aortic valve. Records. Severe aortic stenosis.
Abreviaturas TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI) constituye actualmente la mejor opción terapéutica en la mayoría de los pacientes ancianos con estenosis aórtica grave degenerativa1,4. La evidencia que respalda esta indicación proviene de rigurosos ensayos clínicos aleatorizados realizados tanto con prótesis balón-expandible5-7 como con prótesis autoexpandibles8-10. En este sentido, recientemente esta técnica se ha consolidado tras la publicación de los resultados iniciales de nuevos estudios realizados en pacientes con bajo riesgo11,12.
Con el paso de los años, la técnica de implantación y el tipo de pacientes se han ido modificando13,14. Estos factores, junto con la aparición de nuevas generaciones de válvulas que incluyen mejoras técnicas, han facilitado la disminución de los eventos cardiacos y cerebrales mayores tanto intrahospitalarios como en el seguimiento a largo plazo15,16. En el registro francés de TAVI (n = 16.969 pacientes) se ha observado una reducción del riesgo quirúrgico de los pacientes intervenidos, una mayor simplificación de la técnica por vía transfemoral y un descenso de la mortalidad a corto plazo en los últimos años (2013-2015) en comparación con el primer periodo estudiado (2010-2012). Sin embargo, en el análisis temporal del registro inglés (n = 3.980) no se encontraron estas diferencias.
El objetivo primario de este estudio fue presentar la mortalidad por cualquier causa intrahospitalaria del registro español de TAVI desde su inicio hasta el año 2018. Como objetivos secundarios se incluyeron otros eventos clínicos intrahospitalarios, la mortalidad total a los 30 días y el análisis de la evolución temporal en 2 periodos de tiempo bien definidos: desde agosto de 2007 hasta diciembre de 2013 (cohorte A) y desde enero de 2014 hasta junio de 2018 (cohorte B), evaluando las diferencias en las características clínicas basales y en la aparición de eventos clínicos entre ambos grupos.
MÉTODOS
El registro español de TAVI está promovido por la junta directiva de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología. Desde el año 2010, todos los centros que realizan TAVI en España son invitados cada año a participar en el registro e introducir los datos de todos los pacientes con estenosis aórtica grave tratados con TAVI. Los datos provienen de los servicios de cardiología y de cirugía cardiaca, y se introducen en una base de datos dedicada online que se revisa de manera periódica. A pesar de que no existe una auditoría formal, sistemáticamente se realiza una revisión de los datos introducidos en el registro para buscar inconsistencias o ausencia de datos; la revisión la lleva a cabo una persona experta en bases de datos, que contacta con los centros para solventar las incidencias encontradas. En el registro han participado 46 centros de España (anexo 1 del material adicional), y aunque comenzó en el año 2010, se han introducido 232 pacientes de forma retrospectiva tratados entre los años 2007 y 2009, que han sido incluidos en el análisis.
En este estudio se han analizado todos los pacientes consecutivos incluidos en el registro español de TAVI. En el análisis temporal se dividió la población en pacientes tratados antes de 2014 (cohorte A: 2009-2013) y pacientes tratados entre 2014 y 2018 (cohorte B), dado que 2014 es el año en que se comenzaron a implantar las nuevas generaciones de las 2 válvulas más utilizadas en nuestro país: la Edwards y la CoreValve.
Variables del estudio
Los eventos se definieron según las recomendaciones del Valve Academic Research Consortium17 en la cohorte A y según las recomendaciones del Valve Academic Research Consortium II18 en la cohorte B. Se definió alto riesgo quirúrgico como un valor del EuroSCORE logístico > 20% y un valor del Society of Thoracic Surgeons’ risk model > 8%.
Análisis estadístico
Una vez comprobada la distribución normal (test de normalidad de Kolmogorov-Smirnov), los datos cuantitativos se presentaron en forma de media ± desviación estándar o mediana y rango intercuartílico, según procediera, y los cualitativos como valor absoluto y porcentaje. Para evaluar los predictores de mortalidad hospitalaria se utilizó un modelo de regresión logística multivariable. Se incluyeron en los análisis las variables con un valor de probabilidad < 0,1 en el análisis univariable o clínicamente relevantes. Para evaluar los predictores de mortalidad a los 30 días se realizó un modelo de regresión de Cox con pasos hacia atrás. La curva de supervivencia se obtuvo mediante el método de Kaplan-Meier. Se consideró estadísticamente significativo un valor de p bilateral < 0,05. El análisis estadístico se realizó con el paquete estadístico SPSS 19.
RESULTADOS
Resultados totales
Características basales y del procedimiento
Desde agosto de 2007 hasta junio de 2018 se incluyeron consecutivamente en el registro español de TAVI 7.180 pacientes. La edad media fue de 81,2 ± 6,5 años y el 53% eran mujeres. El EuroSCORE logístico fue del 12% (8-20). Se utilizó un acceso transfemoral en el 89% de los casos, de los cuales el 78% fueron por punción percutánea y el resto por disección quirúrgica. El tipo de prótesis más frecuente fue el sistema autoexpandible tipo CoreValve (49%), seguida muy de cerca por la familia de prótesis balón-expandible Edwards (46%). El tamaño de la prótesis más frecuente fue el número 26. El éxito del dispositivo fue del 94% (tabla 1 y tabla 2).
Tabla 1. Características clínicas y ecocardiográficas basales de los pacientes incluidos en el estudio
| Características basales | Todos los pacientes (n = 7.180) | Cohorte A (años 2009-2013) (n = 3.075) | Cohorte B (años 2014-2018) (n = 4.105) | p |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad | 81,2 ± 6,5 7.171 | 81,0 ± 6,4 3.075 | 81,2 ± 6,7 4.096 | 0,19 |
| Mujeres | 3.796 / 7.166 (53,0) | 1.636 / 3.075 (53,2) | 2.160 / 4.091 (52,8) | 0,79 |
| Peso, kg | 72,6 ± 14 7.087 | 70,9 ± 13 3.069 | 72,1 ± 14 4.018 | < 0,001 |
| Altura, cm | 160 ± 9 6.714 | 159 ± 9 2.879 | 160 ± 9 3.835 | < 0,001 |
| Índice de masa corporal | 28,01 ± 4,9 6.838 | 27,99 ± 4,9 2.879 | 28,16 ± 4,9 3.959 | 0,143 |
| Hipertensión | 5.728 / 7.081 (80,9) | 2.437 / 3.073 (79,3) | 3.291 / 4.008 (82,1) | 0,003 |
| Dislipemia | 3.903 / 6.698 (58,3) | 1.586 / 2.875 (55,1) | 2.317 / 3.823 (60,6) | < 0,001 |
| Diabetes mellitus | 2.447 / 6.752 (36,2) | 998 / 2.875 (34,7) | 1.449 / 3.877 (37,4) | 0,02 |
| Antecedentes | ||||
| ACV previo | 764 / 6.797 (11,3) | 342 / 2.879 (11,9) | 422 / 3.918 (10,7) | 0,15 |
| Enfermedad vascular periférica | 1.009 / 6.903 (14,6) | 484 / 3.071 (15,7) | 525 / 3.832 (13,7) | 0,02 |
| Enfermedad coronaria | 2.090 / 7.105 (29,4) | 1.231 / 3.075 (40,0) | 1.576 / 4.030 (39,1) | 0,43 |
| IAM previo | 919 / 6.565 (13,9) | 396 / 2.878 (13,7) | 523 / 3.687 (14,2) | 0,62 |
| ICP previa | 1.476 / 6.879 (21,4) | 651 / 3.065 (21,2) | 825 / 3.814 (21,6) | 0,70 |
| Cirugía de revascularización previa | 645 / 6.689 (9,6) | 336 / 3.059 (10,9) | 309 / 3.630 (8,5) | 0,001 |
| Recambio valvular aórtico previo | 210 / 4.245 (4,9) | 44 / 931 (4,7) | 166 / 3.314 (5,0) | 0,73 |
| Recambio valvular mitral previo | 81 / 4.245 (1,1) | 6 / 931 (0,6) | 75 / 3.314 (2,3) | 0,001 |
| Fibrilación auricular | 1.905 / 7.037 (27,1) | 855 / 3.067 (27,9) | 1.050 / 3.970 (26,4) | 0,18 |
| Marcapasos | 520 / 7.037 (7,3) | 216 / 3.067 (7,0) | 304 / 3.970 (7,6) | 0,33 |
| Aclaramiento renal (ml/min/1,73 m2) | 55 ± 25 6.638 | 50 ± 47 2.874 | 58 ± 27 3.764 | < 0,001 |
| Disnea clase III-IV | 4.726 / 6.810 (69,4) | 2.136 / 2.877 (74,2) | 2.590 / 3.933 (66,8) | < 0,001 |
| Angina clase III-IV | 567 / 7.062 (8,0) | 303 / 3.073 (9,8) | 264 / 3.989 (7) | < 0,001 |
| EuroSCORE logístico | 12 (8-20) 6.738 | 14 (9-22) 3.027 | 11 (7-18) 3.711 | < 0,001 |
| Escala STS | 5 (3-9) 3.190 | 7 (4-18) 1.024 | 5 (3-7) 2.166 | < 0,001 |
| Alto riesgo quirúrgico | 2.010 (28,0%) | 1.139 (37%) | 871 (22%) | < 0,001 |
| Contraindicación quirúrgica | 1.854 / 7.180 (25,8) | 971 / 3.075 (31,6) | 883 / 4.105 (21,5) | < 0,001 |
| Datos ecocardiográficos preprocedimiento | ||||
| FEVI (%) | 56,9 ± 13 6.927 | 56,9 ± 14 3.056 | 56,8 ± 13 3.871 | 0,66 |
| Gradiente transvalvular aórtico medio, mmHg | 48 ± 15 6.599 | 49 ± 15 3.026 | 47 ± 15 3.573 | < 0,001 |
| Gradiente transvalvular aórtico máximo, mmHg | 79 ± 23 6.606 | 81 ± 23 3.033 | 77 ± 23 3.573 | < 0,001 |
| Área valvular indexada, cm2 | 0,65 ± 0,2 4.267 | 0,62 ± 0,2 1.679 | 0,68 ± 0,2 2.588 | < 0,001 |
| Presión de la arteria pulmonar, mmHg | 47 ± 18 3.046 | 48 ± 16 1.188 | 47 ± 20 1.858 | 0,17 |
| Diámetro del anillo aórtico, mm | 23,2 ± 3 3.935 | 22,9 ± 2 1.224 | 23,2 ± 3 2.711 | 0,001 |
| Insuficiencia mitral grado III-IV | 410 / 5.857 (7,0) | 159 / 2.368 (6,7) | 251 / 3.489 (7,2) | 0,48 |
| Insuficiencia aórtica grado III-IV | 121 / 3.172 (3,8) | 56 / 691 (8,1) | 65 / 2.481 (2,6) | < 0,001 |
|
ACV: accidente cerebrovascular; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; STS: Society of Thoracic Surgeons’ risk model. |
||||
Tabla 2. Características del procedimiento
| Todos los pacientes (n = 7.180) | Cohorte A (años 2009-2013) (n = 3.075) | Cohorte B (años 2014-2018) (n = 4.105) | p | |
|---|---|---|---|---|
| Acceso | < 0,001 | |||
| Transaórtico | 56 / 7.180 (0,8) | 28 / 3.075 (0,9) | 28 / 4.105 (0,7) | |
| Axilar subclavio | 144 / 7.180 (2,0) | 58 / 3.075 (1,8) | 86 / 4.105 (2,0) | |
| Transapical | 568 / 7.180 (7,9) | 431 / 3.075 (14,0) | 137 / 4.105 (3,3) | |
| Transfemoral | 6.412 / 7.180 (89,3) | 2.558 / 3.075 (83,2) | 3.804 / 4.105 (92,6) | |
| Tipo de acceso | 0,57 | |||
| Disección | 1.378 / 6.225 (22,1) | 526 / 2.417 (21,7) | 852 / 3.808 (22,4) | |
| Punción | 4.847 / 6.225 (77,8) | 1.891 / 2.417 (78,2) | 2.956 / 3.808 (77,6) | |
| Tipo de prótesis | < 0,0001 | |||
| Engager | 5 / 7.180 (0,1) | 0 / 3.075 (0) | 5 / 4.105 (0,1) | |
| Direct Flow | 8 / 7.180 (0,1) | 3 / 3.075 (0,1) | 5 / 4.105 (0,1) | |
| Allegra | 5 / 7.180 (0,1) | 0 / 3.075 (0,1) | 16 / 4.105 (0,4) | |
| Lotus | 60 / 7.180 (0,8) | 1 / 3.075 (0,03) | 59 / 4.105 (1,4) | |
| Symetis | 105 / 7.180 (1,5) | 0 / 3.075 (0) | 105 / 4.105 (2,6) | |
| Portico | 172 / 7.180 (2,4) | 0 / 3.075 (0) | 172 / 4.105 (4,1) | |
| Edwards | 3.309 / 7.180 (46,1) | 1.468 / 3.075 (47,7) | 1.841 / 4.105 (44,8) | |
| CoreValve | 3.516 / 7.180 (48,9) | 1.603 / 3.075 (52,1) | 1.913 / 4.105 (46,6) | |
| Tamaño de la prótesis | < 0,001 | |||
| 23 | 1.746 / 6.712 (26,0) | 742 / 2.865 (25,9) | 1.004 / 3.847 (26,1) | |
| 26 | 2.742 / 6.712 (40,9) | 1.402 / 2.865 (48,9) | 1.340 / 3.847 (34,8) | |
| 29 | 1.791 / 6.712 (26,7) | 681 / 2.865 (23,8) | 1.110 / 3.847 (28,8) | |
| > 29 | 247 / 6.712 (3,6) | 37 / 2.865 (1,2) | 210 / 3.847 (5,4) | |
| Otros tamaños | 186 / 6.712 (2,7) | 3 / 865 (0,04) | 183 / 3.847 (4,7) | |
| Predilatación | 2.072 / 3.748 (55,3) | 707 / 809 (87,4) | 1.365 / 2.939 (46,4) | < 0,0001 |
| Posdilatación | 1.457 / 6.767 (21,5) | 561 / 3.071 (18,3) | 897 / 3.696 (24,3) | < 0,0001 |
| Sala | < 0,0001 | |||
| Quirófano | 288 / 7.180 (4,0) | 223 / 3.075 (7,2) | 65 / 4.105 (1,5) | |
| Sala de hemodinámica | 6.575 / 7.180 (91,6) | 2.759 / 3.075 (89,7) | 3.816 / 4.105 (92,5) | |
| Híbrida | 317 / 7.180 (4,4) | 93 / 3.075 (3,0) | 224 / 4.105 (5,4) | |
| Duración, minutos (media ± desviación estándar) | 105 ± 45 | 106 ± 47 | 105 ± 43 | 0,48 |
| Mediana | 95 (72-121) 5.514 | 95 (72-122) 2.834 | 95 (72-120) 2.680 | 0,94 |
| Duración ingreso, días (media ± desviación estándar) | 8,3 ± 8 | 8,6 ± 8 | 8,0 ± 7 | 0,002 |
| Mediana | 6 (5-9) 6.459 | 6 (5-9) 2.751 | 6 (4-8) 3.708 | 0,15 |
| Éxito del implante | 6.778 / 7.153 (94,8) | 2.848 / 3.062 (93,0) | 3.930 / 4.091 (96,1) | < 0,001 |
Complicaciones intrahospitalarias y en el seguimiento
Durante la hospitalización, la tasa de infarto agudo de miocardio fue del 0,9%, la de accidente cerebrovascular fue del 1,9%, la de complicaciones vasculares fue del 10,7% y la de hemorragia fue del 7,6%. La necesidad de implante de marcapasos fue del 14%. La mortalidad total intrahospitalaria fue del 4,7% y a los 30 días del 5,7% (tabla 3).
Tabla 3. Eventos hospitalarios
| Todos | Cohorte A (años 2009-2013) (n = 3.075) | Cohorte B (años 2014-2018) (n = 4.105) | p | OR no ajustada | OR ajustada | p | |
|---|---|---|---|---|---|---|---|
| Conversión cirugía | 58 / 7.076 (0,8) | 34 / 3.005 (1,1) | 24 / 4.062 (0,6) | 0,013 | 0,52 (0,31-0,88) | 0,49 (0,24-0,98) | 0,04 |
| Taponamiento | 57 / 6.899 (0,8) | 19 / 2.900 (0,7) | 38 / 3.999 (1,0) | 0,18 | 1,45 (0,83-2,56) | 2,17 (1,08-3,85) | 0,03 |
| Obstrucción coronaria | 23 / 6.889 (0,3) | 12 / 2.897 (0,4) | 11 / 3.992 (0,3) | 0,33 | 0,66 (0,29-1,52) | 0,69 (0,28-1,69) | 0,42 |
| Malaposición | 153 / 6.884 (2,2) | 92 / 2.897 (3,2) | 61 / 3.987 (1,5) | < 0,001 | 0,47 (0,34-0,66) | 0,46 (0,32-0,66) | 0,001 |
| Migración | 119 / 6.884 (1,7) | 76 / 2.897 (2,5) | 43 / 3.987 (1) | ||||
| Embolización | 12 / 6.884 (0,2) | 2 / 2.897 (0,1) | 10 / 3.987 (0,2) | ||||
| Desconocido | 22 / 6.884 (0,3) | 14 / 2.897 (0,2) | 8 / 3.987 (0,1) | ||||
| IAM | 64 / 7.055 (0,9) | 28 / 3.053 (0,9) | 36 / 4.001 (0,9) | 0,94 | 0,98 (0,60-1,61) | 0,97 (0,53-1,79) | 0,93 |
| Complicaciones vasculares | 769 / 7.055 (10,7) | 268 / 3.053 (8,8) | 501 / 4.001 (12,5) | < 0,001 | 1,49 (1,27-1,72) | 1,18 (0,98-1,41) | 0,09 |
| Hemorragias | 544 / 7.054 (7,6) | 169 / 3.053 (5,5) | 375 / 4.001 (9,4) | < 0,001 | 1,75 (1,47-2,13) | 1,79 (1,43-2,22) | < 0,001 |
| Complicaciones renales | 377 / 7.054 (5,3) | 140 / 3.053 (4,6) | 237 / 4.001 (5,9) | 0,01 | 1,32 (1,05-1,61) | 1,32 (1,03-1,69) | 0,028 |
| ACV | 133 / 7.055 (1,9) | 55 / 3.053 (1,8) | 78 / 4.001 (1,9) | 0,65 | 1,09 (0,76-1,54) | 0,84 (0,55-1,28) | 0,43 |
| Marcapasos | 1.016 / 7.092 (14,3) | 416 / 3.053 (13,6) | 600 / 4.001 (15,0) | 0,14 | 1,11 (0,96-1,27) | 0,99 (0,84-1,16) | 0,91 |
| Mortalidad hospitalaria | 340 / 7.054 (4,7) | 200 / 3.053 (6,6) | 140 / 4.001 (3,5) | < 0,001 | 0,52 (0,41-0,65) | 0,65 (0,48-0,86) | 0,003 |
|
ACV: accidente cerebrovascular; IAM: infarto agudo de miocardio; OR: odds ratio. |
|||||||
Resultados del análisis temporal
Características basales y del procedimiento
No se observaron diferencias entre los grupos en cuanto a la edad media y el sexo de los pacientes. Sin embargo, la cohorte B presentó con más frecuencia factores de riesgo cardiovascular y cirugía previa de la válvula mitral, pero menos enfermedad vascular periférica. A pesar de que la incidencia de enfermedad coronaria fue similar en ambos grupos, el antecedente de revascularización coronaria quirúrgica fue menos frecuente en la cohorte B. Las cifras de aclaramiento de creatinina fueron mayores en la cohorte B. Con respecto a la situación clínica, la presencia de síntomas graves (clase funcional III-IV), tanto para disnea (New York Heart Association) como para angina (clasificación canadiense), fue significativamente menor en la cohorte B. El riesgo quirúrgico según el EuroSCORE logístico y el Society of Thoracic Surgeons’ risk model fue significativamente menor en la cohorte B. En la cohorte B también hubo menos pacientes inoperables o con alto riesgo quirúrgico. En este grupo, la gravedad de la estenosis fue menor (mayor área valvular indexada, menor gradiente medio transvalvular) y el diámetro del anillo fue mayor. Con respecto al tipo de acceso, a partir del año 2014 aumentó de manera muy significativa el acceso transfemoral, que pasó de un 83 a un 94%, debido fundamentalmente a una reducción del acceso transapical del 14 al 3%. El tipo de válvula fue casi exclusivamente Edwards SAPIEN XT y CoreValve en la cohorte A, mientras que en la cohorte B se introdujeron las nuevas generaciones de estas válvulas (Edwards SAPIEN 3 y Evolut R), así como otro tipo de válvulas autoexpandibles como Portico (4,1%), ACURATE neo (2,6%) y la válvula Lotus (1,4%). El tamaño de válvula más frecuente fue de 26 mm en ambos grupos. La tasa de predilatación disminuyó en la cohorte B, pero aumentó la tasa de posdilatación. El éxito del implante se incrementó significativamente en el último periodo y pasó de un 93% (cohorte A) a un 96% (cohorte B). También se modificó de manera significativa el espacio de trabajo donde se efectuó el TAVI; aunque la sala de hemodinámica fue el más habitual en ambas cohortes, en la B se observó una reducción de los implantes en el quirófano y un incremento en las salas híbridas.
Eventos intrahospitalarios y a los 30 días de seguimiento
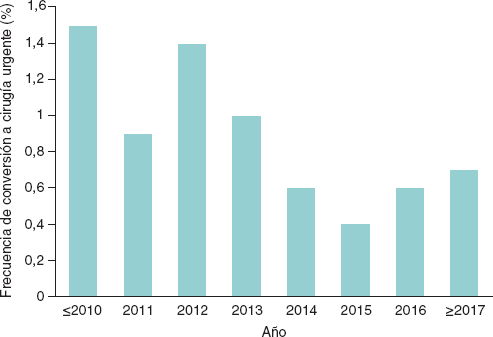
La duración del ingreso se redujo de manera significativa en la cohorte B. En la fase hospitalaria, las tasas de infarto agudo de miocardio, accidente cerebrovascular, necesidad de marcapasos y obstrucción coronaria fueron similares en ambos grupos. Sin embargo, la incidencia de conversión a cirugía (figura 1) y de mala posición de la válvula se redujo significativamente en los pacientes tratados a partir del año 2014. No hubo diferencias entre los grupos en cuanto a complicaciones vasculares, pero las tasas de hemorragias totales y de complicaciones renales fueron más altas en la cohorte B. La mortalidad ajustada por cualquier causa hospitalaria fue notablemente menor en la cohorte B, con una reducción del 47% (odds ratio [OR] = 0,65; intervalo de confianza del 95% [IC95%], 0,48-0,86; p = 0,003).
Figura 1. Tasa de conversión a cirugía urgente a lo largo de los años.
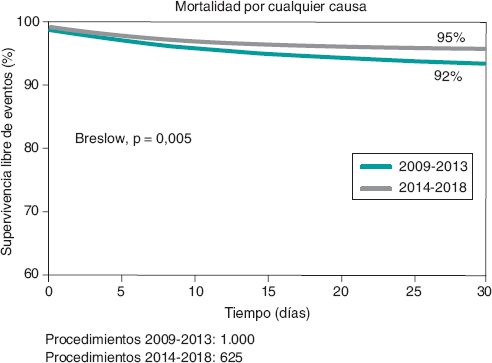
En el seguimiento clínico a los 30 días, la mortalidad se redujo un 32% en la cohorte B (6,9 frente a 4,7%) (OR = 0,71; IC95%, 0,54-0,92; p = 0,002) (figura 2 y figura 3). Los predictores de mortalidad a los 30 días se detallan en la tabla 4.
Figura 2. Tasa de supervivencia al año de seguimiento en los pacientes incluidos en el registro español de TAVI tratados en los años 2009-2013 y 2014-2018.
Figura 3. Tasa de supervivencia al año de seguimiento en los pacientes solo con alto riesgo quirúrgico tratados en 2009-2013 y 2014-2018.
Tabla 4. Predictores independientes de mortalidad a los 30 días de seguimiento
| Variables predictoras de muerte a 30 días | OR univariable (IC95%) | p | OR multivariable ajustada (IC95%) previa al procedimiento | p | OR multivariable ajustada (IC95%) previa y posterior al procedimiento | p |
|---|---|---|---|---|---|---|
| Preprocedimiento | ||||||
| Años 2014-2018 | 0,52 (0,41-0,65) | < 0,001 | 0,59 (0,46-0,76) | < 0,001 | 0,71 (0,54-0,92) | 0,01 |
| Índice de masa corporal | 0,97 (0,95-0,99) | 0,007 | ||||
| Dislipemia | 0,93 (0,74-0,93) | 0,54 | 0,94 (0,74-1,21) | 0,64 | 0,89 (0,69-1,14) | 0,35 |
| Aclaramiento de creatinina | 0,99 (0,98-0,99) | < 0,001 | * | * | ||
| Enfermedad vascular periférica | 1,49 (1,13-1,97) | 0,005 | * | * | ||
| Gradiente aórtico medio, mmHg | 1,003 (0,99-1,01) | 0,47 | 1,002 (0,99-1,01) | 0,57 | 1,003 (0,99-1,01) | 0,54 |
| Insuficiencia mitral III-IV | 1,98 (1,34-2,92) | 0,001 | * | * | ||
| Insuficiencia aórtica III-IV | 2,06 (1,01-4,19) | 0,05 | * | * | ||
| Angina III-IV | 1,08 (0,73-1,61) | 0,69 | 1,16 (0,76-1,78) | 0,50 | 1,16 (0,74-1,81) | 0,52 |
| Disnea III-IV | 1,48 (1,13-1,96) | 0,005 | * | * | ||
| Riesgo quirúrgico | 1,38 (1,09-1,74) | 0,007 | 1,33 (1,03-1,71) | 0,029 | 1,26 (0,96-1,64) | 0,09 |
| Posprocedimiento | ||||||
| Tipo acceso transfemoral | 0,50 (0,38-0,66) | < 0,001 | 0,49 (0,36-0,67) | < 0,001 | ||
| Éxito del implante | 0,10 (0,08-0,13) | < 0,001 | 0,11 (0,09-0,15) | < 0,001 | ||
|
IC95%: intervalo de confianza del 95%; OR: odds ratio. Estas variables no se han introducido en el modelo porque se utilizan para calcular el riesgo quirúrgico. |
||||||
DISCUSIÓN
Los principales hallazgos de este estudio fueron: a) existe una evolución temporal en el tipo de pacientes tratados con TAVI en España a lo largo de los años; b) se demuestra que ha habido modificaciones, con un aumento del acceso transfemoral, un aumento de la posdilatación, una disminución de la tasa de mala posición, una disminución de la necesidad de conversión a cirugía y, lo que es más importante, un incremento significativo de la tasa de éxito del implante a partir del año 2014; y c) se observa una reducción significativa de la mortalidad por cualquier causa, tanto intrahospitalaria como a los 30 días, en los pacientes tratados a partir del año 2014.
Diferencias en las características basales
En el presente estudio se observó un cambio temporal en el perfil de riesgo de los pacientes tratados con TAVI en España. El porcentaje de pacientes con alto riesgo en el primer periodo fue del 37%, frente al 22% a partir de 2014. Estos hallazgos concuerdan con los descritos en el análisis temporal del registro francés15, en el que se redujo el EuroSCORE logístico de un 21,7 ± 14,2% a un 17,9 ± 12,3. En este sentido, los hechos que explican estos hallazgos son la aparición de estudios aleatorizados que usan el TAVI en pacientes de menor riesgo2,7. Entre los años 2015 y 2016 se dispuso de los resultados de los estudios NOTION (The Nordic Aortic Valve Intervention) y PARTNER II (Placement of Aortic Transcatheter Valves), realizados en pacientes de riesgo bajo e intermedio, respectivamente. En el estudio NOTION no se encontraron diferencias significativas entre los pacientes tratados con TAVI o con recambio valvular aórtico quirúrgico en términos del objetivo combinado de muerte, accidente cerebrovascular o infarto agudo de miocardio al año y a los 5 años. En el estudio PARTNER II7 se aleatorizaron 2.032 pacientes con riesgo intermedio para ser tratados con TAVI o con cirugía, y no hubo diferencias significativas en el objetivo primario de muerte por cualquier causa o accidente cerebrovascular discapacitante a los 2 años de seguimiento. Sin embargo, al estudiar solo la cohorte tratada mediante acceso transfemoral, el TAVI tuvo unas tasas notablemente menores de muerte y de accidente cerebrovascular discapacitante.
Diferencias en el procedimiento
En el presente estudio se describen cambios temporales que parecen tener un impacto en el aumento de la tasa de éxito del implante, lo cual es un factor íntimamente relacionado con la mortalidad. La diferencia encontrada sería un descenso de la mala posición. Además, se describe un incremento del acceso transfemoral. Todos estos cambios se explican por la mayor experiencia con la técnica de implantación, cuya tendencia es a la simplificación, y por las mejoras en el diseño de las prótesis. A lo largo de 2014 se comenzaron a implantar las nuevas generaciones de válvulas (Edwards SAPIEN 3 y Evolut R), que aportan mejoras técnicas como la reducción del tamaño del sistema liberador y propician un mayor uso por vía transfemoral en la cohorte B. La incorporación de la falda externa se asoció a una menor tasa de fuga periprotésica, con un mayor éxito del dispositivo y una menor necesidad de sobredimensionamiento de la prótesis, lo que disminuye potencialmente la incidencia de rotura del anillo y la necesidad de conversión a cirugía (procedimiento con una alta mortalidad). Además, en el caso de la prótesis Evolut R la incorporación de una plataforma totalmente recapturable puede haber tenido un papel en la disminución de la incidencia de mala posición y, también, en el aumento de la tasa de éxito del implante que se observa a partir de 2014.
Reducción de la mortalidad
En el año 2013 se publicaron los datos de 1.416 pacientes incluidos en los años 2010 y 2011 en el registro español de TAVI19. En este análisis se reportó una tasa de éxito del implante del 94% y una mortalidad hospitalaria del 8%. En el presente estudio, la tasa de mortalidad total fue del 4,7%. Un aspecto reseñable de este análisis temporal del registro español es que se demuestra una clara disminución de la mortalidad en el segundo periodo estudiado (cohorte B), que es independiente de las características basales de los pacientes. Estos resultados están en consonancia con el análisis temporal del registro francés, en el que se demostró una reducción de la mortalidad hospitalaria y a los 30 días de los pacientes incluidos en el periodo 2013-201515. Por el contrario, en el análisis temporal del registro inglés16, que abarcó los años 2007 a 2012, no hubo diferencias en las características basales ni el riesgo quirúrgico de los pacientes incluidos en esos años, pero aumentó el porcentaje de pacientes con disfunción ventricular. En este registro solo se observó un descenso en la mortalidad en los 2 primeros años de seguimiento en los pacientes tratados en 2012 y un descenso en los días de hospitalización. Los autores achacan estos resultados a la adquisición con el tiempo de mayor experiencia para seleccionar mejor a los pacientes que se benefician más del TAVI, hecho que también puede haber afectado a los resultados del presente estudio.
En este registro, al igual que en el francés, se encontró un aumento de la tasa de taponamiento en el último periodo estudiado. Sin embargo, la tasa de conversión a cirugía fue menor, lo que sugiere que la consolidación del procedimiento y el diagnóstico precoz de las complicaciones pueden haber influenciado los resultados.
Un aspecto destacable es el incremento de las hemorragias totales y de la disfunción renal observado en la cohorte B. Estos resultados deben considerarse con precaución, pues falta información sobre la gravedad y la causa de estos eventos. No obstante, dada la disminución de la mortalidad en este periodo, se puede inferir que no deben aumentar de manera importante las hemorragias mayores, aunque esto sería una especulación, ya que no se dispone de más información.
Limitaciones
La principal limitación de este estudio radica en que se trata de un registro cuyos datos no han sido sometidos a auditoría externa, y además es un registro voluntario en el que no participan todos los centros que realizan TAVI en España. Alguna variable está recogida en el 50% de los pacientes, lo cual es excepcional, ya que la gran mayoría de las variables constan en más del 90% de los casos. En el caso de las complicaciones vasculares (hemorragia e insuficiencia renal) no se dispone del grado o de las causas, y en consecuencia los datos deben tomarse con precaución. Por otro lado, el cambio en la adjudicación de eventos derivado de la distinta definición utilizada en el primer y en el segundo periodo (Valve Academic Research Consortium y Valve Academic Research Consortium II, respectivamente) podría variar en algún paciente, aunque se considera que sería excepcional.
CONCLUSIONES
En el presente estudio se demuestra un mejor perfil de riesgo de los pacientes tratados en los últimos años, junto con una mejora fundamentalmente en el éxito del implante, lo que ha conllevado una disminución de la mortalidad por cualquier causa tanto hospitalaria como a los 30 días de seguimiento.
AGRADECIMIENTOS
Los autores desean agradecer a la Dra. María José Pérez-Vizcayno su ayuda en la revisión de los datos y en el análisis estadístico. Los autores están muy agradecidos a todas las personas involucradas y todos los centros participantes en el registro nacional español de TAVI.
FINANCIACIÓN
La Sección de Hemodinámica y Cardiología Intervencionista financia el mantenimiento y la explotación de la base de datos.
CONFLICTO DE INTERESES
R. Trillo-Nouche es proctor de válvulas de TAVI para Medtronic y Boston Scientific. M. Pan ha participado y recibido honorarios en charlas para Abbott, Terumo Medical Corporation y Philips Volcano. R. Moreno es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. R. Moreno ha participado y recibido honorarios por charlas, asesoría y asistencia a congresos por parte de Edwards Lifesciences, y es proctor de válvulas Lotus y ACURATE neo, ambas de Boston Scientific. R. Moreno también ha participado en charlas, asesoría y asistencia a congresos para Boston Scientific, y es proctor de la válvula Allegra de New Vascular Therapy. I. Amat-Santos es proctor de Boston Scientific. R. Romaguera ha participado y recibido honorarios de Medtronic y Palex Medical. A. Pérez de Prado ha participado y recibido honorarios por asesorías a Boston Scientifice iVascular, y por charlas para Abbott, B Braun Surgical, Terumo Medical Corporation y Philips Volcano. L. Nombela-Franco es proctor para Abbott y ha participado y recibido honorarios por charlas de Edwards Lifesciences. F. Alfonso es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. J. M. de la Torre Hernández es editor jefe de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. El resto de los autores no tienen conflictos de intereses.
¿QUÉ SE SABE DEL TEMA?
- En registros nacionales, como el francés, ya se ha observado un cambio temporal en el perfil clínico y en la evolución clínica de los pacientes tratados con TAVI. Sin embargo, estos hallazgos no se han producido en el análisis temporal del registro inglés.
¿QUÉ APORTA DE NUEVO?
- El principal aporte de este estudio es la publicación de los datos totales del registro de nuestro país y que en la literatura queden reflejados los resultados, además de mostrar la existencia de un cambio temporal en el perfil de los pacientes y en los resultados clínicos, que refleja el aumento de la experiencia con la técnica de implantación y las mejoras en el diseño de las prótesis.
BIBLIOGRAFÍA
1. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
2. Thyregod HG, Steinbrüchel DA, I hlemann N, et al. Transcatheter Versus Surgical Aortic Valve Replacement in Patients With Severe Aortic Valve Stenosis:1-Year Results From the All-Comers NOTION Randomized Clinical Trial. J Am Coll Cardiol. 2015;65:2184-2194.
3. Makkar RR, Fontana GP, Jilaihawi H, et al. Transcatheter aortic-valve replacement for inoperable severe aortic stenosis. N Engl J Med. 2012;366:1696-1704.
4. Thourani VH, Kodali S, Makkar RR, et al. Transcatheter aortic valve replacement versus surgical valve replacement in intermediate-risk patients:a propensity score analysis. Lancet. 2016;387:2218-2225.
5. Kodali SK, Williams MR, Smith CR, et al. Two-year outcomes after transcatheter or surgical aortic-valve replacement. N Engl J Med. 2012;366:1686-1695.
6. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
7. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
8. Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
9. Popma JJ, Adams DH, Reardon MJ, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63:1972-1981.
10. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic- Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
11. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
12. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
13. Islas F, Almería C, García-Fernández E, et al. Usefulness of echocardiographic criteria for transcatheter aortic valve implantation without balloon predilation:a single-center experience. J Am Soc Echocardiogr. 2015;28:423-429.
14. García E, Almería C, UnzuéL, Jiménez-Quevedo P, Cuadrado A, Macaya C. Transfemoral implantation of Edwards Sapien XT aortic valve without previous valvuloplasty:role of 2D/3D transesophageal echocardiography. Catheter Cardiovasc Interv. 2014;84:868-876.
15. Auffret V, Lefevre T, Van Belle E, et al. Temporal Trends in Transcatheter Aortic Valve Replacement in France:FRANCE 2 to FRANCE TAVI. J Am Coll Cardiol. 2017;70:42-55.
16. Ludman PF, Moat N, de Belder MA, et al. Transcatheter aortic valve implantation in the United Kingdom:temporal trends, predictors of outcome, and 6-year follow-up:a report from the UK Transcatheter Aortic Valve Implantation (TAVI) Registry, 2007 to 2012. Circulation. 2015;131:1181-1190.
17. Leon MB, Piazza N, Nikolsky E, et al. Standardized endpoint definitions for transcatheter aortic valve implantation clinical trials:a consensus report from the Valve Academic Research Consortium. Eur Heart J. 2011;32:205-217.
18. Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation:the Valve Academic Research Consortium-2 consensus document. Eur Heart J. 2012;33:2403-2418.
19. SabatéM, Cánovas S, García E, et al. In-hospital and mid-term predictors of mortality after transcatheter aortic valve implantation:data from the TAVI National Registry 2010-2011. Rev Esp Cardiol. 2013;66:949-958.