RESUMEN
Introducción y objetivos: La estimulación ventricular rápida reduce el gasto cardiaco, proporcionando estabilidad durante el implante percutáneo de válvula aórtica (TAVI). Nuestro objetivo fue evaluar la eficacia y la seguridad de la estimulación ventricular izquierda a través de la guía de alto soporte utilizada para el implante y una guía situada en la aurícula derecha (AD) que actúa como ánodo.
Métodos: La estimulación ventricular izquierda se realiza conectando el extremo externo de una guía Safari2 preformada situada en el ventrículo izquierdo al cátodo de un marcapasos temporal, y el ánodo al cuerpo de una guía Emerald insertada en la aurícula mediante un catéter Judkins Right diagnóstico a través de un acceso venoso femoral (punción ecoguiada). El marcapasos se programa con salida máxima (20 V) y sensibilidad anulada.
Resultados: Se realizó TAVI transfemoral a 62 pacientes seleccionados (mediana de edad: 79,4 ± 6,5 años) utilizando la técnica de estimulación descrita (25 SAPIEN 3 Ultra, 13 Navitor, 9 ACURATE neo2, 14 Evolut-PRO+ y 1 Myvalve), con éxito en todos los casos (hubo 1 fallo de captura atribuido a la programación del generador del marcapasos). Dos pacientes necesitaron marcapasos transitorio y definitivo posterior por bloqueo auriculoventricular completo durante el procedimiento. No se documentaron complicaciones vasculares derivadas del acceso venoso ni del posicionamiento de la guía en la AD. No aumentaron de manera significativa el tiempo del procedimiento ni la fluoroscopia. La mediana de estancia hospitalaria tras el implante fue de 2 días.
Conclusiones: En nuestra serie, la estimulación ventricular izquierda utilizando como ánodo la guía situada en la AD ha demostrado ser una técnica eficaz y segura, sin aumentar significativamente el tiempo de procedimiento, y además aporta la ventaja de disponer de acceso venoso central para un posible marcapasos transitorio urgente.
Palabras clave: Estenosis aórtica. Implante percutáneo de válvula aórtica. Estimulación ventricular izquierda. Aurícula derecha. Acceso venoso femoral.
ABSTRACT
Introduction and objectives: Rapid ventricular pacing reduces cardiac output by providing stability during transcatheter aortic valve implantation (TAVI). Our objective is to assess the efficacy and safety profile of left ventricular pacing through the high-support guidewire used for implantation and a guidewire located in the right atrium (RA) functioning as an anode.
Methods: Left ventricular pacing is performed by connecting the external end of a Safari2 pre-shaped guidewire located in the left ventricle to the cathode of a temporary pacemaker, and the anode to the body of an Emerald guidewire inserted into the RA using a diagnostic Judkins Right catheter (via ultrasound-guided femoral venous access). Pacemaker was programmed with maximum output (20 V) and null sensitivity.
Results: A total of 62 selected patients (median 79.4 ± 6.5 years old) underwent transfemoral TAVI using the pacing technique described (25 patients the SAPIEN 3 Ultra; 13 the Navitor, 9 the ACURATE neo2, 14 the Evolut PRO+, and 1 patient the Myvalve). Procedure was successful in all cases (there was 1 capture failure due to pacemaker programming). Two patients required a temporary and permanent pacemaker due to high-grade atrioventricular block. No vascular complications from venous access were documented, not even from the RA guidewire. Procedural time did not increase significantly, and the median length of stay after implantation was 2 days.
Conclusions: In our series, left ventricular pacing using the RA-positioned wire as the anode proved to be effective and safe without increasing procedural time significantly. This procedure also provides the advantage of being able to use the central venous access for possible emergency temporary pacemaker implantation.
Keywords: Aortic stenosis. Transcatheter aortic valve implantation. Left ventricular pacing. Right atrium. Femoral venous access.
Abreviaturas
AD: aurícula derecha. BAV: bloqueo auriculoventricular. BCRIHH: bloqueo completo de rama izquierda del haz de His. JR: catéter Judkins Right. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
Han pasado 20 años desde que A. Cribier realizó el primer implante percutáneo de válvula aórtica (TAVI) en humanos1. Desde 2002 hasta nuestros días, los estudios publicados han demostrado la no inferioridad del TAVI respecto a la sustitución valvular aórtica quirúrgica en pacientes de alto (PARTNER 1A)2, moderado (PARTNER 2 y SURTAVI)3,4 y bajo riesgo quirúrgico (PARTNER 3 y Evolut Low Risk)5,6, demostrándose además en el PARTNER 3 la superioridad del TAVI transfemoral con SAPIEN 3 (Edwards Lifesciences, Estados Unidos) expandible con balón. Todo ello ha modificado nuestra práctica clínica habitual y las guías europeas de valvulopatías7 publicadas en 2021 recomiendan el TAVI transfemoral como el tratamiento de elección para los pacientes con estenosis aórtica grave mayores de 75 años, independientemente de su riesgo quirúrgico.
Durante estos años, la técnica de implante se ha simplificado gracias a la estandarización del procedimiento, la experiencia de los operadores, la evolución tecnológica de los dispositivos y la tendencia a realizar un abordaje minimalista8 que permita reducir las complicaciones y lograr una más pronta recuperación de los pacientes.
La estimulación ventricular rápida, necesaria para reducir el gasto cardiaco y proporcionar estabilidad durante la valvuloplastia con balón, el despliegue valvular o la posdilatación, tradicionalmente se ha efectuado mediante la inserción de un marcapasos temporal en el ventrículo derecho (VD). Una manera de simplificar el procedimiento y reducir el coste, que ha demostrado ser eficaz y segura, es realizar la estimulación mediante la guía de alto soporte situada en el ventrículo izquierdo (VI)9, la cual se conecta al cátodo (electrodo negativo) del generador de un marcapasos transitorio. En la mayoría de los casos descritos en la literatura, el ánodo (electrodo positivo) se conecta a una aguja insertada en la piel o en el tejido celular subcutáneo del paciente.
En este trabajo se presenta una modificación de la técnica de estimulación ventricular izquierda en la cual una guía insertada en la aurícula derecha (AD) actúa como ánodo. Se evalúan su eficacia y su seguridad, y se describen sus ventajas respecto a las técnicas tradicionales.
MÉTODOS
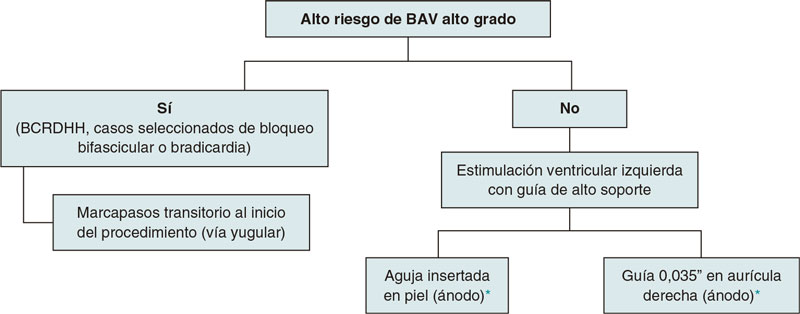
Se presenta un registro observacional unicéntrico y prospectivo de pacientes con valvulopatía aórtica grave tratados con TAVI transfemoral entre noviembre de 2021 y septiembre de 2022. En los pacientes con alteraciones basales de la conducción que implicaban mayor riesgo de bloqueo auriculoventricular (BAV) de alto grado durante o tras el procedimiento (bloqueo completo de rama derecha del haz de His, casos seleccionados de bloqueo bifascicular o de bradicardia a criterio de los cardiólogos intervencionistas que realizaban el procedimiento), el método de estimulación seleccionado fue el implante de un marcapasos transitorio en el VD por la vena yugular al inicio del procedimiento. En los pacientes con bajo riesgo de BAV de alto grado, independientemente del tipo de válvula implantada (expandible con balón o autoexpandible), se realizó estimulación ventricular rápida mediante la guía de alto soporte posicionada en el VI, dejándose también a elección de los cardiólogos intervencionistas que realizaban el implante utilizar como ánodo una aguja insertada en el tejido celular subcutáneo o bien una guía insertada en la AD. En los pacientes portadores de marcapasos definitivo se hizo la sobreestimulación mediante la programación externa de su propio marcapasos (figura 1).
Figura 1. Protocolo de selección del tipo de estimulación aplicada durante el implante percutáneo de válvula aórtica. BAV: bloqueo auriculoventricular; BCRIHH: bloqueo completo de rama izquierda del haz de His.
* A criterio del operador que realiza el procedimiento.
Descripción de la técnica
Tras cruzar la válvula aórtica con una guía recta y un catéter diagnóstico AL-1, se intercambia la guía recta por una guía de alto soporte Safari2 preformada (Boston Scientific, Estados Unidos) XS o S, en función del tamaño ventricular, que queda alojada en el VI; esta guía se utiliza sistemáticamente en nuestro centro para llevar a cabo el implante valvular. El extremo externo de la guía se conecta al electrodo negativo (cátodo) del generador de un marcapasos transitorio mediante unas pinzas de cocodrilo. Por otra parte, el ánodo (electrodo positivo) del generador del marcapasos temporal se conecta de la misma forma al cuerpo de una guía de 0,035” insertada en la AD a través de un acceso venoso femoral (en todos los casos se hace una punción ecoguiada y se inserta un introductor femoral 6 Fr a este nivel).
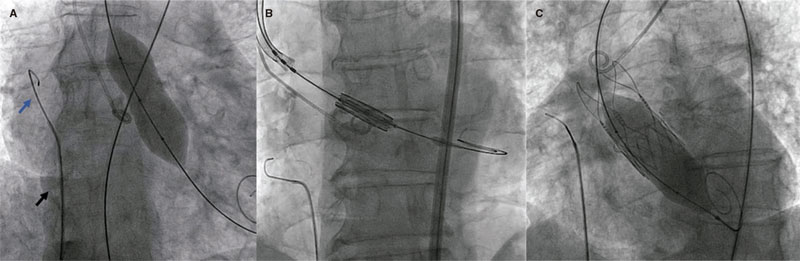
La guía de 0,035” utilizada es la Emerald (Cordis, Suiza) con curva en J atraumática en su extremo distal, habitual en nuestro laboratorio de hemodinámica para realizar el intercambio de catéteres, que queda cubierta en todo su recorrido por un catéter diagnóstico Judkins Right (JR) que actúa como aislante eléctrico durante la estimulación para evitar dañar las estructuras vasculares que recorre la guía y conducir la carga eléctrica hacia el sitio de interés; a excepción del extremo distal de la guía, que debe quedar en contacto estrecho con las paredes de la AD (figura 2).
Figura 2. Imágenes angiográficas de la sobreestimulación ventricular. Catéter JR (A, flecha negra) y guía de 0,035” (A, flecha azul) en la aurícula derecha realizando sobreestimulación ventricular durante una valvuloplastia (A), durante el implante de una válvula expandible con balón (B) y durante la posdilatación de una válvula autoexpandible (C).
Esta guía también podría insertarse a través de un acceso venoso yugular; sin embargo, en nuestra experiencia, la canalización de la vena femoral es una técnica sencilla, muy segura y rápida, con la que el cardiólogo intervencionista está en general más familiarizado.
Una vez hechas las conexiones, se programa el generador del marcapasos con la máxima salida permitida (20-25 V) y sensibilidad anulada, y se comprueba que la captura es adecuada y que al realizar una estimulación rápida la presión arterial cae por debajo de 50 mmHg. Finalmente, se lleva a cabo la sobreestimulación a 120-180 latidos por minuto, según sea necesario en cada caso. Es importante tener en cuenta que una inadecuada posición de la guía en la AD puede condicionar fallos en la captura, por lo que es recomendable comprobar su localización antes de iniciar la estimulación.
Criterios para el implante de un marcapasos temporal
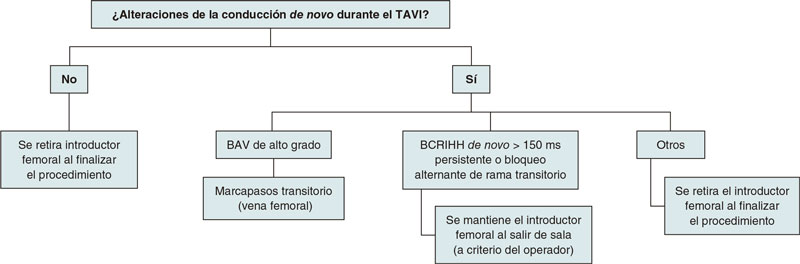
En caso de que el paciente desarrolle un BAV de alto grado durante el procedimiento (tanto persistente como transitorio) se implanta en el laboratorio de hemodinámica un marcapasos transitorio (utilizando el acceso venoso femoral antes canalizado)10. En los casos de BAV completo sin escape ventricular a < 30 latidos por minuto, o con escape más alto pero con mala tolerancia hemodinámica, se mantiene la estimulación ventricular izquierda con la guía de alto soporte posicionada en el VI y una aguja insertada en la piel que actúa como ánodo, hasta implantar un electrocatéter de marcapasos transitorio en el VD por vía femoral. En los casos de bloqueo completo de rama izquierda del haz de His (BCRIHH) con QRS > 150 ms de novo o bloqueo de rama alternante (transitorio) se mantiene el introductor femoral; de lo contrario, este es retirado al finalizar el procedimiento y se hace compresión mecánica a este nivel (figura 3).
Figura 3. Criterios para el implante de un marcapasos temporal durante el procedimiento. BAV: bloqueo auriculoventricular; BCRIHH: bloqueo completo de rama izquierda del haz de His; TAVI: implante percutáneo de válvula aórtica.
Tras el TAVI, el paciente ingresa en la unidad de cuidados intermedios de cardiología, donde se monitoriza el ritmo cardiaco durante un mínimo de 24 h, siguiendo a continuación las recomendaciones sobre mantener la monitorización cardiaca, la medición de intervalo HV o el implante de un marcapasos definitivo de las guías europeas de cardiología de 2021 sobre estimulación cardiaca11. En nuestro centro disponemos de una sala con escopia en la planta de cardiología, por lo que si un marcapasos transitorio es necesario, es implantado de forma rápida por el cardiólogo de la unidad de cuidados intermedios o el cardiólogo de guardia.
Análisis estadístico
Se utilizó estadística descriptiva estándar para las características basales de todos los pacientes, las características del procedimiento y los resultados clínicos. Las variables continuas se presentan como media y desviación estándar o como mediana y rango intercuartílico, según la distribución normal de la muestra. Las variables categóricas se presentan en porcentaje. Todos los análisis estadísticos fueron realizados utilizando el software SPSS V25 (IBM, Estados Unidos).
RESULTADOS
Durante el periodo de tiempo incluido en este análisis fueron tratados con TAVI 130 pacientes. En 62 casos (58 estenosis aórticas graves y 4 insuficiencias aórticas graves puras) se realizó estimulación ventricular rápida mediante la guía de alto soporte situada en el VI y la guía de 0,035” insertada en la AD. En 36 pacientes se implantó un marcapasos transitorio desde el inicio del procedimiento y en el resto (29 pacientes) se realizó estimulación ventricular izquierda utilizando como ánodo una aguja insertada en la piel del paciente.
Las características basales de la cohorte de pacientes estimulados con la guía en la AD y del procedimiento se muestran en la tabla 1. La técnica de estimulación descrita se ha utilizado en el implante de válvulas tanto expandibles con balón (42%) como autoexpandibles (58%), y hubo 8 procedimientos (12,9%) valve-in-valve, siendo la anatomía del paciente (tamaño del anillo, aorta horizontal, riesgo de obstrucción coronaria, calcificación valvular, insuficiencia aórtica pura, etc.) el principal determinante del tipo de válvula seleccionada.
Tabla 1. Características demográficas, clínicas y del procedimiento de la cohorte
| Características basales | |||
|---|---|---|---|
| Edad, años | 79,4 ± 6,5 | ||
| Sexo (varones), % | 56,3 | ||
| Factores de riesgo cardiovascular, % | Hipertensión arterial 87 | ||
| Diabetes mellitus tipo 2 44,8 | |||
| Dislipidemia 58,1 | |||
| Tabaquismo 24 | |||
| IMC promedio 29,7 ± 5,4 kg/m2 | |||
| Cardiopatía isquémica crónica, % | 41,9 | ||
| Puntuación STS, % | 4,7 ± 3,97 | ||
| Alteraciones basales de la conducción, n | |||
| BCRDHH | 0 | ||
| BIRDHH | 1 | ||
| HBAI | 1 | ||
| HBPI | 0 | ||
| BCRIHH | 3 | ||
| BAV 1.º | 6 | ||
| Datos ecocardiográficos y de la TC | |||
| Área valvular pre-TAVI, cm2 | 0,7 ± 0,2 | ||
| Gradiente medio pre-TAVI, mmHg | 46 ± 14 | ||
| Área promedio del anillo por TC, mm2 | 454,65 | ||
| Perímetro, cm | 77,6 | ||
| Calcificación valvular grave por TC, n | 31 | ||
| Datos del procedimiento | |||
| Procedimientos emergentes, n | 2 (shock cardiogénico) | ||
| Sedación consciente + anestesia local, n | 60 | ||
| Anestesia general, n | 2 (procedimientos emergentes) | ||
| Predilatación, n | 26 (balón promedio 22,3 ± 2,8 mm) | ||
| Válvulas autoexpandibles | 13 Navitor | ||
| 14 Evolut PRO+ | |||
| 9 ACURATE neo2 | |||
| Válvulas expandibles con balón | 25 SAPIEN 3 Ultra | ||
| 1 Myvalve | |||
| Posdilatación, n | 14 (balón promedio 23 ± 2,5 mm) | ||
| Tiempo de escopia, min | 19 ± 3 | ||
| Tipo de cierre, % | Tapón de colágeno (MANTA) 98,4 | ||
| ProGlide + Angio-Seal 1,64 | |||
| Tiempo de procedimiento, min | 47 ± 10 | ||
| BCRIHH secundario al procedimiento, n | |||
| 9 transitorios (2 necesitaron estimulación definitiva)* | |||
| 6 persistentes (sin indicación de estimulación definitiva) | |||
| BAV completo posterior, n | |||
| Intraprocedimiento | 2 | ||
| Intrahospitalario | 1 (a las 24 h)* | ||
| Ambulatorio | 1 (a los 5 días tras el alta)* | ||
| Bloqueo alternante de rama tras el procedimiento, n | 0 | ||
| BAV 1.º tras el procedimiento > 240 ms, n | 1 | ||
| Éxito inmediato del procedimiento, % | 95,2 | ||
| Éxito a los 30 días del procedimiento, % | 93,5 | ||
|
BAV: bloqueo auriculoventricular; BCRDHH: bloqueo completo de rama derecha del haz de His; BCRIHH: bloqueo completo de rama izquierda del haz de His; BIRDHH: bloqueo incompleto de rama derecha del haz de His; HBAI: hemibloqueo anterior izquierdo; HBPI: hemibloqueo posterior izquierdo; IMC: índice de masa corporal; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica; TC: tomografía computarizada. |
|||
En 1 paciente hubo un fallo de captura (aunque se sospecha que la causa estuvo en la programación del generador del marcapasos), sin repercusión final en la posición de la válvula, siendo exitosa en el resto de los casos. Hay que destacar el comportamiento óptimo de la técnica en las válvulas expandibles con balón, en las que un fallo en la captura podría tener mayor penalización en el éxito inmediato del procedimiento. En nuestra serie completa de TAVI, el porcentaje global de fallo de captura al utilizar como ánodo la piel del paciente es del 2,7%, y del 0,8% en los casos en que se implantó un marcapasos transitorio.
Trastornos del ritmo tras el implante percutáneo de válvula aórtica
En dos pacientes se produjo BAV completo durante el procedimiento (1 Evolut PRO+ [Medtronic, Estados Unidos] y 1 Navitor [Abbott, Estados Unidos]). El primero de ellos tenía un electrocardiograma basal con QRS estrecho (100 ms) e imagen de bloqueo incompleto de rama derecha, y desarrolló un BAV completo tras la valvuloplastia. El segundo paciente no tenía alteraciones basales de la conducción (PR 120 ms, QRS 90 ms) y desarrolló un BAV completo tras el despliegue valvular. En ambos se realizó estimulación ventricular izquierda con la guía Safari2 preformada (utilizando una aguja insertada en el tejido celular subcutáneo conectada al electrodo positivo del generador del marcapasos) hasta insertar un electrocatéter en el VD por el acceso venoso femoral previamente canalizado, sin complicaciones, y se implantó un marcapasos definitivo a las 24 h por persistencia del BAV alto grado.
Un 24,2% de los casos (15 pacientes) desarrollaron un BCRIHH tras el implante valvular. En 9 pacientes (14,5%) el bloqueo de rama fue transitorio, resolviéndose en la sala o en las horas posteriores al procedimiento; sin embargo, uno de ellos desarrolló un BAV completo a las 24 h del procedimiento (detectado en la monitorización con telemetría) y otro reingresó a los 5 días del implante valvular por BAV completo sintomático (síncopes de repetición). En estos dos últimos casos se implantó un marcapasos definitivo (ambos pacientes con válvulas autoexpandibles). En el resto, el BCRIHH fue persistente (12,3%): en 1 paciente se redujo la anchura del QRS de 130 a 120 ms durante el ingreso (4 días de monitorización), 3 pacientes habían sido sometidos previamente a un procedimiento valve-in-valve y durante 5 días de ingreso y monitorización mantuvieron la misma anchura del QRS sin otros trastornos de la conducción, y en 2 pacientes se midió el intervalo HV por persistencia de un QRS de 140 y 150 ms (HV 55 y 58 ms, respectivamente), por lo que todos ellos fueron dados de alta sin necesidad de estimulación definitiva y ninguno ha necesitado implante de marcapasos definitivo durante el seguimiento. Es interesante señalar que, en esta cohorte de pacientes, las prótesis expandibles con balón tuvieron una tasa de marcapasos definitivo del 0%.
En los 3 pacientes que presentaban BCRIHH basal (2 de ellos con BAV 1.º) no se produjeron modificaciones de los electrocardiogramas basales ni trastornos de la conducción durante su monitorización, y no han precisado estimulación definitiva en el seguimiento.
La baja tasa de implante de marcapasos en esta cohorte (6,5% en los primeros 30 días tras el TAVI), a pesar de que el 58% de las válvulas eran autoexpandibles, la atribuimos principalmente a la selección de los pacientes, ya que, como se ha mencionado antes, en los casos en que existen trastornos basales de la conducción que impliquen un riesgo alto de BAV de alto grado tras el TAVI se realiza la estimulación mediante el implante de marcapasos transitorio desde el inicio del procedimiento. En nuestra serie completa de pacientes, la tasa de implante de marcapasos en los primeros 30 días tras el TAVI en el último año ha sido del 15,5% (siendo un 69% las válvulas autoexpandibles implantadas en los últimos 12 meses).
Éxito del procedimiento y eventos adversos cardiovasculares mayores
El éxito inmediato del procedimiento (según la definición VARC-3)12 fue del 95,2% y el éxito a los 30 días del 93,5%, con una mortalidad intrahospitalaria del 3,2% (2 pacientes) por causa cardiovascular y una mortalidad desde el alta a los 30 días del 0%. En 1 paciente fue necesario implantar una segunda válvula por posición supraanular de la primera implantada (ACURATE neo2 [Boston Scientific, Estados Unidos]) y se implantó una SAPIEN 3 Ultra. En los procedimientos realizados de forma emergente, el éxito inmediato y a los 30 días fue del 100%.
En esta cohorte no se registraron eventos adversos neurológicos a los 30 días (en 2 casos se utilizó un dispositivo Sentinel [Boston Scientific, Estados Unidos] para protección cerebral) ni oclusiones coronarias tras el TAVI, y la tasa de insuficiencia aórtica mayor o igual a grado III tras el implante fue del 0%.
No se documentaron complicaciones derivadas del acceso venoso femoral ni secundarias al posicionamiento de la guía en la AD. En el 98,3% de los casos se cerró la arteria femoral con tapón de colágeno MANTA, y fue necesario implantar un stent recubierto en 2 pacientes por fallo de cierre del dispositivo. Por otra parte, se produjo una isquemia arterial aguda en 1 paciente con arteriopatía periférica grave.
El tiempo medio de escopia fue de 19 ± 3 minutos y el del procedimiento fue de 48 ± 10 minutos, sin diferencias significativas entre los 3 tipos de estimulación descritos. La mediana de estancia hospitalaria tras el TAVI fue de 2 días, habiendo realizado un abordaje minimalista en todos los casos.
Los resultados, en cuanto al éxito inmediato del procedimiento y la mortalidad, son similares con las 3 técnicas de estimulación mencionadas, sin mayores tasas de embolización de la válvula, necesidad de segunda válvula o insuficiencia aórtica significativa tras el procedimiento en los casos en que se realizó estimulación ventricular izquierda utilizando como ánodo la guía situada en la AD. En nuestra serie global de TAVI, la incidencia de taponamiento cardiaco secundario a perforación del VD por el electrocatéter del marcapasos transitorio es del 1,9%.
DISCUSIÓN
La estimulación ventricular rápida permite una reducción del gasto cardiaco mantenida que proporciona la estabilidad necesaria para el despliegue valvular. Un fallo en la captura ventricular durante la sobreestimulación conlleva un riesgo de embolización o malaposición valvular, con consecuencias potencialmente devastadoras, por lo que es crucial conseguir una sobreestimulación eficaz.
Tradicionalmente, la estimulación ventricular se ha realizado mediante la inserción de un marcapasos temporal en el VD. El electrocatéter estándar que se ha utilizado para la estimulación transitoria tiene un electrodo rígido en la punta distal que aumenta el riesgo de perforación miocárdica. Existen otros electrodos utilizados con más frecuencia en la actualidad durante el TAVI que tienen un pequeño balón en la punta distal y son menos traumáticos, pero debido a que son más blandos y flexibles su implante tiende a ser más complejo y su posición menos estable, lo que aumenta los tiempos del procedimiento y de fluoroscopia, así como el riesgo de fallo de captura durante la sobreestimulación9.
En 2007 se describió por primera vez la estimulación ventricular con la guía posicionada en el VI en una serie de pacientes pediátricos con estenosis aórtica grave congénita13, demostrando ser una técnica eficaz y segura, con menor tasa de complicaciones vasculares, menor tiempo de procedimiento y menor coste que el implante sistemático de un electrodo de marcapasos transitorio.
En 2019 se publicó el estudio EASY TAVI9, primer ensayo aleatorizado que comparó las dos técnicas de estimulación mencionadas y demostró que la estimulación ventricular izquierda (utilizando en todos los casos una aguja insertada en la piel del paciente como ánodo) tenía similar eficacia y permitía simplificar el procedimiento y reducir su duración, así como el tiempo de fluoroscopia, el coste y las complicaciones (con mayor tasa de taponamiento cardiaco debido a perforación del VD por el catéter del marcapasos). Sin embargo, el estudio se hizo únicamente en pacientes con válvulas expandibles con balón (SAPIEN 3), con las cuales el riesgo de BAV de alto grado es menor que con las autoexpandibles.
En nuestro centro, el porcentaje de válvulas autoexpandibles implantadas es alto (el 69% en el último año), lo que lleva asociado un mayor riesgo de BAV de alto grado y, por tanto, de implante de marcapasos definitivo. En este sentido, la estimulación ventricular izquierda utilizando como ánodo (electrodo positivo) una guía en la AD es una técnica muy eficaz, que permite disponer de un acceso venoso desde el inicio del procedimiento, por lo que en caso de BAV de alto grado el implante de un marcapasos transitorio se puede hacer de forma rápida y, de esta manera, se evita el implante sistemático de un electrocatéter en el VD, lo que reduce el coste del procedimiento y la tasa de complicaciones. Por otra parte, respecto a las válvulas expandibles con balón, en las que un fallo de captura durante la sobreestimulación podría afectar el éxito inmediato del procedimiento, esta técnica ha mostrado un comportamiento óptimo.
Hay que señalar también que el hecho de implantar un marcapasos transitorio desde el inicio del procedimiento condiciona un umbral más bajo para mantenerlo al salir de la sala de hemodinámica, lo que aumenta el riesgo de complicaciones infecciosas, vasculares, tromboembólicas o cardiacas, y retrasa el inicio de la movilización del paciente. En los casos de estimulación ventricular izquierda y guía en la AD, únicamente se mantuvo el marcapasos transitorio al salir del laboratorio en los 2 pacientes que presentaron BAV de alto grado durante el implante. Por el contrario, en los pacientes en quienes se implantó un marcapasos transitorio desde el inicio, el 88,9% (32 pacientes) salieron de la sala con marcapasos transitorio, el cual se mantuvo una media de 24 h; finalmente, el 37% de ellos (13) tuvieron indicación de estimulación definitiva.
En cuanto al uso del acceso venoso femoral, hay que mencionar que tiene desventajas14 respecto a la vena yugular, fundamentalmente que es un acceso menos directo hacia el VD, menos aséptico y que limita más la movilidad del paciente hasta el implante del marcapasos definitivo. Sin embargo, la canalización de la vena femoral es una técnica sencilla, segura y rápida para el cardiólogo intervencionista, en general menos familiarizado con el acceso venoso yugular, que suele ser canalizado por el anestesista que asiste el procedimiento y no está exento de complicaciones para operadores menos experimentados. En nuestro caso, la punción venosa femoral se hace siempre ecoguiada y la tasa de complicaciones a este nivel ha sido del 0%, retirando el introductor al finalizar el procedimiento en todos los pacientes que no precisaron marcapasos transitorio ni vía central. En los casos que necesitaron estimulación definitiva, el marcapasos se implantó a las 24 h (lo que reduce las complicaciones y minimiza la estancia media de los pacientes).
En la literatura existe un único estudio, observacional y unicéntrico15, con inclusión prospectiva de pacientes y análisis retrospectivo, en el que realizaron la estimulación ventricular izquierda con la guía de alto soporte utilizada para el implante (Safari) y una guía estándar insertada en la vena cava inferior (sin introductor) en 226 pacientes no seleccionados tratados con TAVI entre marzo de 2017 y septiembre de 2018 (27,4% Corevalve, 16,4% SAPIEN y 56,2% ACURATE neo). La eficacia de la estimulación fue del 99,1% (2 pacientes necesitaron implante de marcapasos transitorio por fallos de captura con la guía), y adicionalmente, en un 7,6% de los pacientes fue necesario implantar un marcapasos temporal por alteraciones de la conducción durante el procedimiento. Las complicaciones vasculares ocurrieron en el 2,7% de los pacientes y la tasa de implante de marcapasos definitivo fue del 14%.
Una de las principales diferencias con nuestro estudio es la selección previa de los casos en nuestro centro, siendo los pacientes con bajo riesgo basal de desarrollar BAV tras el TAVI los que más se benefician de la estimulación con guía de alto soporte en el VI. Por el contrario, se debe considerar el implante de un marcapasos transitorio desde el inicio del procedimiento si existen alteraciones basales de la conducción que aumenten el riesgo de BAV de alto grado (principalmente bloqueo completo de rama derecha del haz de His); en estos pacientes, dada la mayor probabilidad de estimulación definitiva, si es posible se debe utilizar un acceso venoso yugular por las ventajas antes mencionadas. Por otra parte, las diferencias técnicas consisten en que la guía se inserta en la AD en lugar de en la vena cava inferior (lo que nos permite comprobar su posición en todo momento para minimizar los fallos de captura), que se cubre la guía con un catéter diagnóstico que funciona como aislante, y por último, que se utiliza un introductor femoral que permite agilizar aún más el implante de un electrocatéter en el VD si fuera necesario y tener una vía central durante el procedimiento.
En definitiva, nuestro estudio demuestra la eficacia y la seguridad de la técnica de estimulación descrita en nuestra población de pacientes tratados con TAVI transfemoral, obteniendo unos resultados satisfactorios, reduciendo el número de marcapasos transitorios implantados en el último año, y por tanto el coste del procedimiento, y sin complicaciones derivadas del acceso venoso femoral, ni de posicionar la guía en la AD.
Limitaciones
La principal limitación de este trabajo es que se trata de un estudio unicéntrico observacional con una muestra pequeña de pacientes, en el que se describen todos los resultados desde que se utilizó por primera vez la técnica en nuestro centro, inicialmente llevada a cabo solo por dos operadores y en casos muy seleccionados. Sin embargo, en la actualidad, la técnica de estimulación descrita forma parte de la práctica intervencionista habitual de nuestras salas de hemodinámica.
CONCLUSIONES
En nuestra experiencia, la estimulación ventricular izquierda utilizando como ánodo una guía situada en la AD ha demostrado ser una técnica muy eficaz y segura en pacientes con bajo riesgo de BAV secundario a TAVI, sin aumentar de manera significativa el tiempo del procedimiento. Con esta técnica se reduce el coste económico que conlleva el uso sistemático de un marcapasos transitorio, y además aporta la ventaja de disponer de un acceso venoso desde el inicio del procedimiento para un posible marcapasos transitorio urgente.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores contribuyeron al diseño del estudio, revisaron críticamente el manuscrito, otorgaron la aprobación final y se hacen responsables de todos los aspectos del trabajo, asegurando su integridad y exactitud.
CONFLICTO DE INTERESES
Los autores declaran no tener conflictos de intereses.
¿QUÉ SE SABE DEL TEMA?
- La estimulación ventricular rápida es necesaria para reducir el gasto cardiaco y proporcionar estabilidad durante el TAVI. Para ello, se ha utilizado tradicionalmente un marcapasos transitorio transvenoso posicionado en el VD. Sin embargo, su uso sistemático aumenta el riesgo del procedimiento, el tiempo de fluoroscopia y, sobre todo, el coste total. La estimulación ventricular izquierda realizada a través de la guía de alto soporte utilizada para el implante simplifica el procedimiento, ha demostrado ser segura y tiene una eficacia similar.
¿QUÉ APORTA DE NUEVO?
- En este trabajo se muestra una modificación de la técnica de estimulación ventricular izquierda en la que se utilizan la guía de alto soporte situada en el VI (conectada al electrodo negativo de un marcapasos transitorio) y una guía posicionada en la AD (conectada al electrodo positivo). En nuestra experiencia, es una técnica segura y eficaz, sin diferencias significativas en los tiempos del procedimiento y de fluoroscopia con respecto a la forma clásica de estimulación con la guía en el VI. Además, permite disponer de un acceso venoso desde el inicio del procedimiento que facilita el implante rápido de un electrocatéter en el VD en caso de BAV de alto grado.
BIBLIOGRAFÍA
1. Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous Transcatheter Implantation of an Aortic Valve Prosthesis for Calcific Aortic Stenosis First Human Case Description. Circulation. 2002;106:3006-3008.
2. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
3. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk patients. N Engl J Med. 2016;374:1609-1620.
4. Reardon MJ, Van Mieghem NM, Pompa JJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk patients. N Engl J Med. 2017;376:1321-1331.
5. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
6. Pompa JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
7. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
8. Lauck SB, Wood DA, Baumbusch J, et al. Vancouver Transcatheter Aortic Valve Replacement Clinical Pathway: Minimalist Approach, Standardized Care, and Discharge Criteria to Reduce Length of Stay. Circ Cardiovasc Qual Outcomes. 2016;9:312-321.
9. Faurie B, Souteyrand G, Staat P, et al. Left Ventricular Rapid Pacing Via the Valve Delivery Guidewire in Transcathter Aortic Valve Replacment. JACC Cardiovasc Interv. 2018;11:1663-1665.
10. Jorgensen TH, De Backer O, Gerds TA, et al. Inmediate Post-Proceedural 12-Lead Electrocardiography as Predictor of Late Conduction Defects After Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2018;11:1509-1518.
11. Glikson M, Nielsen JC, Kronborg MB, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 2021;42:3427-3520.
12. Généreux P, Piazza N, Alu MC, et al. Valve Academic Research Consortium 3: Updated Endpoint Definitions for Aortic Valve Clinical Research. J Am Coll Cardiol. 2021;77:2717-2746.
13. Karagöz T, Aypar E, Erdogan I, et al. Congenital aortic stenosis: a novel technique for ventricular pacing during valvuloplasty. Catheter Cardiovasc Interv. 2008;72:527-530.
14. Chun KJ, Gwag HB, Hwang JK, et al. Is transjugular insertion of a temporary pacemaker a safe and effective approach? PLoS One. 2020;15:e0233129.
15. Scarsini R, Kotronias RA, De Maria GL, et al. Routine Left Ventricular Pacing for Patients Undergoing Transcatheter Aortic Valve Replacement. Structural Heart. 2019;3:478-482.