RESUMEN
Introducción y objetivos: Las guías de práctica clínica actuales recomiendan el tratamiento antiagregante plaquetario doble con ácido acetilsalicílico y clopidogrel como estrategia antitrombótica tras el implante percutáneo de válvula aórtica (TAVI) en pacientes sin indicación de anticoagulación oral a largo plazo. Sin embargo, estas recomendaciones no se han desarrollado de acuerdo con los resultados de grandes ensayos aleatorizados. Por ello, el objetivo de esta investigación es comparar la terapia antiplaquetaria en monoterapia con el tratamiento antiagregante doble en pacientes sin indicación de anticoagulación a largo plazo después de un TAVI.
Métodos: Se realizaron búsquedas en PubMed, Embase y los principales congresos internacionales para encontrar ensayos clínicos aleatorizados que compararan el tratamiento antiagregante único con el tratamiento antiplaquetario doble después de un TAVI. Los datos se agruparon en un metanálisis mediante un modelo de efectos aleatorios. El objetivo principal del estudio fue la hemorragia grave o potencialmente mortal.
Resultados: Se incluyeron cuatro ensayos que en total incluyeron a 1.086 pacientes. Los pacientes bajo tratamiento antiagregante en monoterapia, en comparación con aquellos con tratamiento antiagregante plaquetario doble, tuvieron menor riesgo de hemorragia grave o potencialmente mortal (odds ratio [OR] = 0,44; intervalo de confianza del 95% [IC95%], 0,27-0,70) y de cualquier sangrado (OR = 0,51; IC95%, 0,36-0,71). No se observaron diferencias entre los pacientes tratados con monoterapia y los tratados tratamiento antiagregante plaquetario doble en cuanto a muerte por cualquier causa (OR = 1,01; IC95%, 0,61-1,68), infarto de miocardio (OR = 0,50; IC95%: 0,17-1,41) y accidente cerebrovascular (OR = 0,98; IC95%, 0,54-1,77).
Conclusiones: En los pacientes sin indicación de anticoagulación a largo plazo sometidos a TAVI, la monoterapia con ácido acetilsalicílico en comparación el tratamiento antiagregante doble se asocia con un menor riesgo de hemorragia grave o potencialmente mortal y con un riesgo comparable de muerte por cualquier causa, infarto de miocardio y accidente cerebrovascular.
Palabras clave: Tratamiento antitrombótico. TAVI. Tratamiento antiagregante. Ácido acetilsalicílico. Sangrado.
Abstract
Introduction and objectives: Current expert consensus guidelines recommend dual antiplatelet therapy (DAPT) with aspirin and clopidogrel as antithrombotic strategy after transcatheter aortic valve implantation (TAVI) in patients without an indication for long-term oral anticoagulation. However, these recommendations have not been developed based on the results of large randomized clinical trials. The objective of this study is to compare single antiplatelet therapy (SAPT) to DAPT in patients without an indication for long-term anticoagulation after TAVI.
Methods: The PubMed, Embase, and the main international conference proceedings were reviewed in the search for randomized controlled trials comparing SAPT to DAPT after TAVI. Data were pooled using a meta-analysis and a random effects model. The primary endpoint was life-threatening or major bleeding.
Results: Four trials enrolling 1086 patients were included. Compared to patients treated with DAPT, those treated with SAPT showed a lower risk of life-threatening or major bleeding (OR, 0.44; 95%CI, 0.27-0.70), and any bleeding (OR, 0.51; 95%CI, 0.36-0.71). No differences were observed between patients treated with SAPT compared to those treated with DAPT regarding all-cause mortality (OR, 1.01; 95%CI, 0.61-1.68), myocardial infarction (OR, 0.50; 95%CI 0.17-1.41), and stroke (OR, 0.98; 95%CI, 0.54-1.77).
Conclusions: In patients without an indication for long-term anticoagulation undergoing TAVI, single antiplatelet therapy with aspirin compared to DAPT is associated with a lower risk of life-threatening or major bleeding and a comparable risk of all-cause mortality, myocardial infarction, and stroke.
Keywords: Antithrombotic therapy. TAVI. Antiplatelet therapy. Aspirin. Bleeding.
Abreviaturas:
TAPD: tratamiento antiagregante plaquetario doble. ICP: intervención coronaria percutánea. ECA: ensayo clínico aleatorizado. TAP: tratamiento antiagregante plaquetario. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
Durante los últimos 20 años, el implante percutáneo de válvula aórtica (TAVI) se ha convertido en una estrategia terapéutica de éxito, alternativa a la cirugía para tratar la estenosis valvular aórtica en pacientes de riesgo quirúrgico alto, intermedio y bajo1,6.
Las complicaciones isquémicas y hemorrágicas no son raras tras un TAVI y pueden ser mortales. Recientemente, los estudios clínicos PARTNER 3 y Evolut Low han mostrado incidencias bajas, aunque nada despreciables, de accidentes cerebrovasculares y hemorragias mayores en los 30 días siguientes a un TAVI5,6.
En la actualidad, el tratamiento antiagregante plaquetario doble (TAPD) con ácido acetilsalicílico y clopidogrel es el régimen antitrombótico más usado tras un TAVI en pacientes sin indicación de anticoagulación oral a largo plazo inscritos en estudios clínicos. Las recomendaciones que dan las guías de diferentes sociedades sugieren cursos de 1 a 3, 3 a 6 o 6 meses de tratamiento con clopidogrel acompañado de dosis bajas de ácido acetilsalicílico. No obstante, estas recomendaciones no se han desarrollado basándose en los resultados de grandes ensayos clínicos aleatorizados7,10. Los datos sobre duraciones del tratamiento realizados en la última década sugieren un efecto neutro o beneficioso del tratamiento antiagregante plaquetario en monoterapia (TAP) frente a un curso inicial de TAPD seguido de TAP en lo que se refiere a las complicaciones vasculares y a las hemorragias mayores o amenazantes para la vida. Estos informes no sugieren mayor riesgo de sufrir infartos de miocardio ni accidentes cerebrovasculares11,13. Recientemente, el ácido acetilsalicílico en monoterapia ha demostrado ser superior a un tratamiento de 3 meses de ácido acetilsalicílico y clopidogrel seguido de ácido acetilsalicílico en lo que se refiere no solo a las hemorragias sino también a las complicaciones tromboembólicas tras 1 año de seguimiento14.
Se realizó un metanálisis de estudios clínicos aleatorizados disponibles para hacer una valoración integral y cuantitativa de la evidencia disponible sobre el perfil de seguridad y eficacia de TAP frente a TAPD tras TAVI en pacientes sin indicación de anticoagulación oral a largo plazo.
MÉTODOS
Estrategia de búsqueda y criterios de selección
Se valoraron ensayos clínicos aleatorizados (ECA) con pacientes tratados de TAVI para incluirlos en este metanálisis. Los estudios elegibles debían cumplir los siguientes criterios de inclusión preespecificados: a) ECA que compararan TAP con TAPD tras un TAVI y b) disponibilidad de datos clínicos. Los criterios de exclusión fueron: a) ECA que incluyeran a pacientes que precisaran anticoagulación oral, b) ausencia de diseño aleatorizado, c) ausencia de datos sobre los resultados clínicos.
Tanto la estrategia de búsqueda, la selección de los estudios, como la extracción y análisis de datos se hicieron siguiendo las directrices de la Colaboración Cochrane y los ítems de referencia para publicar Revisiones Sistemáticas y Metanálisis (PRISMA)15.
El pasado 31 de agosto de 2020, se llevó a cabo una búsqueda en las bases de datos de PubMed y Embase, así como de los resúmenes presentados en importantes congresos científicos (American Heart Association, American College of Cardiology, Sociedad Europea de Cardiología, EuroPCR y Transcatheter Cardiovascular Therapeutics). También se empleó el método backward snowballing (revisión de referencias bibliográficas dentro artículos identificados y revisiones pertinentes). La estrategia de búsqueda está disponible en el material adicional.
Extracción de los datos
Tres investigadores (J. Sanz-Sánchez, C. A. Pivato y P. P. Leone) realizaron una valoración independiente de los estudios con potencial para ser incluidos. El investigador principal (G. G. Stefanini) fue el encargado de resolver cualquier posible discrepancia. Se excluyeron los artículos que no fuesen relevantes en función del título y el resumen. Estos investigadores extrajeron, también de manera independiente, datos sobre el diseño y medidas del estudio, características de los pacientes y resultados con ayuda de un formulario estandarizado para la extracción de datos. Los conflictos sobre a la extracción de datos se debatieron y los resolvió el investigador principal (G. G. Stefanini).
Se recopilaron datos sobre los autores, el año de publicación, los criterios de inclusión y exclusión, el tamaño de la muestra, las características basales de los pacientes, las definiciones de los objetivos, la estimación del efecto conseguido y el tiempo de seguimiento.
Resultados de interés
El objetivo primario preespecificado fue la hemorragia mayor o amenazante para la vida. Los objetivos clínicos secundarios fueron la mortalidad por cualquier causa, el infarto de miocardio, el accidente cerebrovascular y cualquier hemorragia. Cada objetivo se valoró atendiendo a las definiciones descritas en los protocolos originales del estudio que se detallan en la tabla 1 del material adicional.
Tabla 1. Principales características de los estudios
| Estudio | Año de publicación | Diseñodel estudio | Número de pacientes | Multicéntrico | Seguimiento | Duración del TAPD | ||
|---|---|---|---|---|---|---|---|---|
| Global | TAPD | TAP | ||||||
| POPular TAVI14 | 2020 | ECA | 665 | 334 | 331 | Sí | 12 meses | 3 meses |
| ARTE11 | 2017 | ECA | 222 | 111 | 111 | Sí | 3 meses | 3 meses |
| SAT-TAVI12 | 2014 | ECA | 120 | 60 | 60 | No | 6 meses | 6 meses |
| Ussia et al.13 | 2011 | ECA | 79 | 40 | 39 | No | 6 meses | 3 meses |
|
ECA: ensayo clínico aleatorizado; TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble. |
||||||||
Riesgo de sesgo
El riesgo de sesgo de cada estudio se valoró con la herramienta revisada de evaluación del riesgo de sesgo de la Colaboración Cochrane (RoB 2.0)16. Tres investigadores (J. Sanz-Sánchez, C. A. Pivato y P. P. Leone) realizaron una valoración independiente de 5 dominios de sesgo en cada ECA: 1) proceso de aleatorización, 2) desviaciones de las intervenciones pretendidas, 3) datos de resultados faltantes, 4) medidas de los resultados y 5) selección de los resultados descritos (tabla 2 del material adicional).
Tabla 2. Características clínicas basales de los pacientes incluidos
| Estudio | Edad (años) | Varones | Diabetes | Hipertensión | Fibrilación auricular | NYHA ≥ III | FEVI | Puntuación en la escala STS-PROM | Accidente cerebrovascular previo | IM previo | Abordaje transfemoral | Implante valve-in-valve | Indicación para TAVI: estenosis aórtica |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| POPular TAVI14 | 80 | 50 | 24 | 75 | – | 65 | – | 2,5 | 4 | 9 | 89 | 6 | 98 |
| ARTE11 | 79 | 58 | 35 | 79 | – | – | 54 | 6,3 | – | 21 | 69 | – | – |
| SAT-TAVI12 | 81 | 37 | 27 | 95 | – | 89 | 52 | 10.0 | – | – | 100 | – | 100 |
| Ussia et al.13 | 81 | 46 | 27 | 84 | 13 | 62 | 52 | 7,3 | 8 | 14 | ?97 | 0 | 100 |
| Global | 80 | 50 | 27 | 79 | – | 68 | 53 | 4,4 | – | 12 | 87 | – | 98 |
|
FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; NYHA: New York Heart Association; STS-PROM: riesgo de mortalidad predicho por la escala de la Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica. Los datos expresan porcentajes (%). |
|||||||||||||
Análisis estadístico
Tanto los odds ratios (OR) como los intervalos de confianza (IC) del 95% se calcularon con el modelo de efectos aleatorios de DerSimonian y Laird tomándose el cálculo de la heterogeneidad del método de Mantel-Haenszel. El número de pacientes que es necesario tratar (NNT) para evitar 1 evento se calculó a partir de medidas ponderadas de OR combinados empleando el modelo meta-analítico de efectos aleatorios. La presencia de heterogeneidad entre los diferentes estudios se evaluó con la prueba Q de Cochran según una distribución de X2. Los valores de p ≤ 0,10 se consideraron estadísticamente significativos y la inconsistencia se analizó con la prueba del estadístico I2. Valores del 0% fueron indicativos de ausencia de heterogeneidad observada y valores del ≤ 25%, ≤ 50% y > 50% de la presencia de una heterogeneidad baja, moderada y alta, respectivamente. El sesgo de publicación se valoró por estimación visual a través de gráficos de embudo. Se realizó un análisis de sensibilidad de validación cruzada para el objetivo primario retirando, repetidamente, un estudio cada vez para confirmar que nuestros hallazgos no eran fruto de un único estudio. Los demás análisis de sensibilidad se hicieron calculando los OR con un IC95% a partir de un modelo de efectos fijos con el método de Mantel-Haenszel y los cocientes de tasas de incidencia con un IC95% a partir de modelos de efectos tanto fijos como aleatorios. El nivel de significación estadística se obtuvo a partir de valores de p bilateral < 0,05. Los análisis estadísticos se realizaron empleando el software Stata, versión 13.1 (StataCorp LP, College Station, Estados Unidos).
RESULTADOS
Resultados de la búsqueda
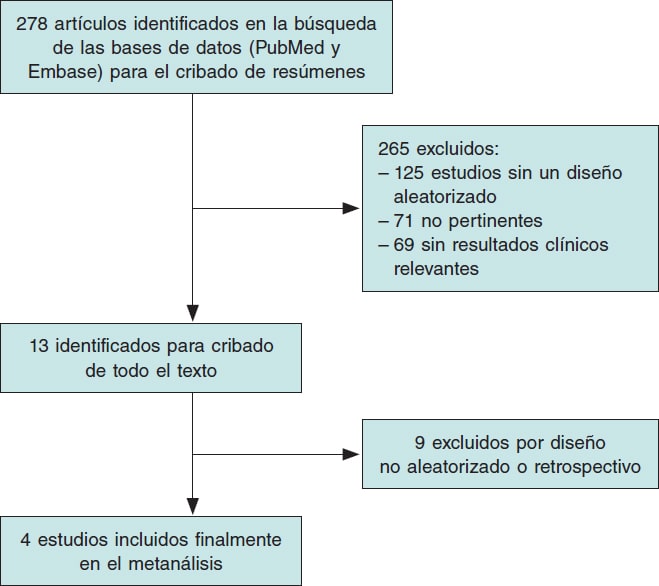
La figura 1 muestra la búsqueda de estudios y el proceso de selección de los mismos según la declaración PRISMA. Se identificó un total de 4 ECA que fueron incluidos en este análisis. Las principales características de los estudios incluidos se muestran en la tabla 1.
Figura 1. Flujograma del proceso de selección de los estudios.
Se incluyó a un total de 541 pacientes en tratamiento con ácido acetilsalicílico y 545 pacientes en tratamiento con TAPD tras TAVI.
Características basales
Las principales características basales de los pacientes incluidos se muestran en la tabla 2. La mayoría de los pacientes recibió un TAVI por presentar estenosis aórtica. El riesgo medio de mortalidad estimada según la Society of Thoracic Surgeons fue del 4,4%, la mayoría de las intervenciones fueron mediante abordaje transfemoral.
Sesgo de publicación y asimetría
Las distribuciones en gráficos de embudo de los resultados preespecificados indican la ausencia de sesgo de publicación para todas las variables clínicas (figuras 1, 5 del material adicional).
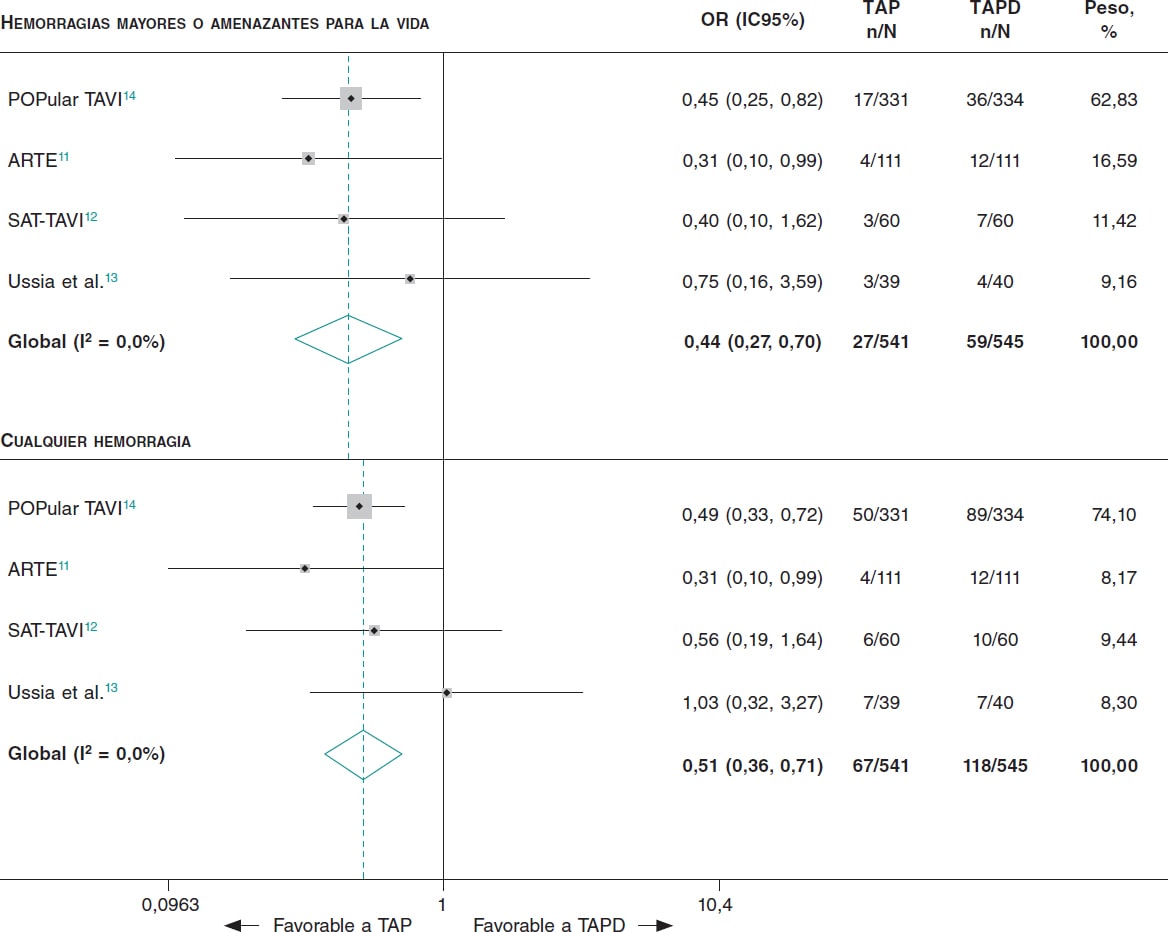
Figura 2. Resultados hemorrágicos en pacientes a tratamiento con TAP frente a TAPD tras un TAVI. TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble; TAVI: implante percutáneo de válvula aórtica.
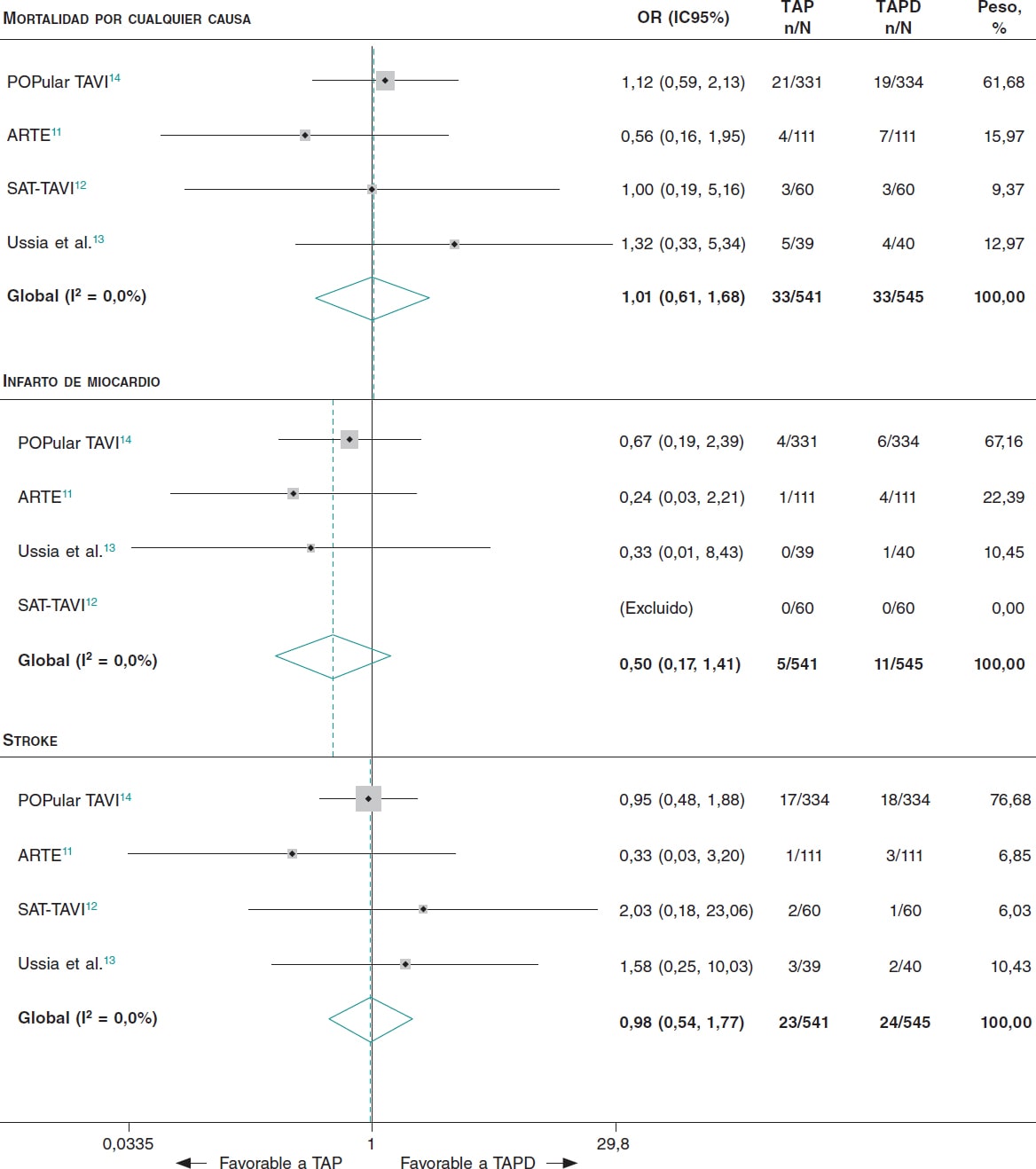
Figura 3. Mortalidad por cualquier causa y resultados de eficacia en pacientes a tratamiento con TAP frente a TAPD tras un TAVI. TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble; TAVI: implante percutáneo de válvula aórtica.
Resultados
Comparados con los tratados con TAPD, los pacientes tratados con TAP tenían menor riesgo de sufrir hemorragias mayores o amenazantes para la vida (OR = 0,44; IC95%, 0,27-0,70; I2 = 0%) y cualquier tipo de hemorragia (OR = 0,51; IC95%, 0,36-0,71; I2 = 0%) (figura 2). No se observaron diferencias entre los pacientes tratados con TAP y los tratados con TAPD en lo que se refiere a la mortalidad por cualquier causa (OR = 1,01; IC95%, 0,61-1,68; I2 = 0%), los infartos de miocardio (OR = 0,50; IC95%, 0,17-1,41; I2 = 0%) y los accidentes cerebrovasculares (OR = 0,98; IC95%, 0,54-1,77; I2 = 0%) (figura 3). El NNT para evitar 1 hemorragia mayor o amenazante para la vida fue de 17 pacientes y el NNT para evitar cualquier tipo de hemorragia fue de 11 pacientes
Evaluación del riesgo de sesgo
La tabla 2 del material adicional muestra los resultados de la evaluación del riesgo de sesgo con la herramienta RoB 2.0. Se consideró que 2 estudios presentaban un riesgo global de sesgo bajo11,14, aunque otros 2 estudios tenían un riesgo algo más alto12,13.
Análisis de sensibilidad
Los hallazgos fueron concordantes con los del análisis principal tras calcular los OR a partir de un modelo de efectos fijos y los cocientes de tasas de incidencias a partir de modelos de efectos tanto fijos como aleatorios (tabla 3 del material adicional).
Los resultados del análisis de sensibilidad de validación cruzada retirando repetidamente un estudio cada vez coincidieron con el análisis primario (tabla 4 del material adicional).
DISCUSIÓN
El presente metanálisis evaluó los ECA disponibles realizando una comparativa entre el TAP con ácido acetilsalicílico y el TAPD en pacientes que recibieron un TAVI sin una indicación para recibir anticoagulación oral a largo plazo. Estos fueron los principales hallazgos:
-
1) El riesgo de sufrir hemorragias mayores o amenazantes para la vida o cualquier otra hemorragia es menor en pacientes tratados con TAP que en aquellos pacientes tratados con TAPD.
-
2) El riesgo de mortalidad por cualquier causa, infarto de miocardio y accidente cerebrovascular no varió entre las 2 estrategias de tratamiento.
En la actualidad, las guías de práctica clínica recomiendan cursos de TAPD de entre 1 y 6 meses de duración tras un TAVI en pacientes sin una indicación para recibir anticoagulación oral a largo plazo7,9. Sin embargo, este régimen no está avalado por las evidencias de que se dispone hoy en día. Esta práctica proviene del campo de las intervenciones coronarias percutáneas en el que la incorporación de un inhibidor del receptor plaquetario P2Y12 al ácido acetilsalicílico, en comparación con una monoterapia con ácido acetilsalicílico, redujo el riesgo de complicaciones isquémicas, sobre todo, la trombosis del stent17. La incorporación de clopidogrel al ácido acetilsalicílico tras un TAVI tiene un potencial teórico de reducir la incidencia de eventos cardiovasculares isquémicos, infartos de miocardio y trombosis valvulares.
El accidente cerebrovascular isquémico es una de las peores complicaciones que se pueden dar tras un TAVI. Su incidencia más alta se da durante las primeras 24 horas después de la intervención. Parece asociarse, principalmente, a la presencia de restos de tejidos embolizados durante el TAVI debido a la dilatación de la válvula calcificada o a la navegación a través del arco aórtico18,20. En cambio, el accidente cerebrovascular subagudo (entre 1 y 30 días después de la intervención), representativo de un cuarto del número total de eventos al cabo de 2 años4,21, con frecuencia se asocia a la fibrilación auricular de nueva aparición22,24, contra la que el TAPD tiene poca efectividad.
Otra motivación teórica para recetar TAPD tras un TAVI es limitar la incidencia de infarto de miocardio. No obstante, la incidencia del infarto de miocardio descrita tras un TAVI es relativamente baja4,21 y la enfermedad coronaria concomitante se suele tratar percutáneamente antes del TAVI. Por lo tanto, la incorporación de un inhibidor del receptor plaquetario P2Y12 al ácido acetilsalicílico tras un TAVI no parece ofrecer ninguna ventaja adicional frente a una monoterapia de ácido acetilsalicílico en lo referente a la reducción del riesgo de infarto de miocardio tal y como confirmaron nuestros resultados.
Por último, aunque la trombosis valvular sintomática es una enfermedad rara (< 1%), la trombosis subclínica tiene una incidencia mucho más alta (entre el 10 y el 40% según diferentes series)25,27. El impacto clínico de este fenómeno todavía se desconoce: podría no solo afectar a la durabilidad de la válvula por la formación de pannus, sino también acarrear una incidencia más alta de accidente isquémico transitorio25,26. En este contexto, la fisiopatología de la formación de trombos tras TAVI sigue siendo objeto de debate ya que todavía hay que establecer el peso relativo que tienen la hemostasia primaria y secundaria. Por otro lado, las lesiones endoteliales y un entorno de alta tensión de cizallamiento alrededor de la estructura endoprotésica de la válvula previo a la re-endotelización podría favorecer la agregación plaquetaria y, por ende, la formación de trombos ricos en plaquetas. Esto es, de algún modo, parecido a lo que sucede durante la trombosis del stent contra la cual el TAPD ha demostrado ser el tratamiento más efectivo17. Por otro lado, el seno bioprotésico de las valvas de la válvula podría favorecer un estado de baja tensión de cizallamiento y turbulencia de flujo y predisponer al desarrollo de trombos ricos en trombina. TAPD parece no ofrecer ningún beneficio sobre TAP en términos de reducir la trombosis de la válvula bioprotésica, pero los anticoagulantes orales sí han demostrado ser capaces de prevenir y resolver esta complicación25,27. No obstante, hasta la fecha, el único estudio que ha entrado a valorar el papel del tratamiento anticoagulante tras un TAVI en pacientes sin una indicación para recibir anticoagulación oral a largo plazo es el GALILEO. El estudio fue interrumpido tras observarse importantes problemas de seguridad en los análisis provisionales que revelaron incidencias más altas de complicaciones con dosis bajas de rivaroxaban/ácido acetilsalicílico frente a TAPD, incluidoseventos clínicos tan importantes como la mortalidad (6,8 frente al 3,3%)28.
En líneas generales, los eventos isquémicos post-TAVI parecen eludir la acción antiagregante plaquetaria de las tienopiridinas y el ácido acetilsalicílico. El presente metanálisis confirma que la incorporación de un inhibidor del receptor plaquetario P2Y12 no reduce el riesgo de sufrir eventos isquémicos (tales como infartos de miocardio y accidentes cerebrovasculares). Más bien predispone a los pacientes a un mayor riesgo de sufrir hemorragias mayores o amenazantes para la vida. El menor riesgo hemorrágico con TAP frente a TAPD descrito en este metanálisis es de una gran importancia clínica con un NNT de tan solo 11 pacientes para evitar cualquier hemorragia y un NNT de 17 pacientes para evitar 1 hemorragia mayor o amenazante para la vida. Además, como la mayoría de los eventos hemorrágicos ocurren dentro de los 30 días siguientes a la intervención, probablemente debido al tratamiento antitrombótico perioperatorio y a las complicaciones hemorrágicas en el sitio de acceso1,4,29, incluso un curso corto de TAPD plantea problemas de seguridad en lo que se refiere a los eventos hemorrágicos.
En base a las evidencias publicadas hasta la fecha y a los resultados de esta investigación, en pacientes sin una indicación para recibir anticoagulación a largo plazo tratados de TAVI, la monoterapia con ácido acetilsalicílico debería preferirse en detrimento del TAPD. No obstante, aún se necesitan estudios extensos que ayuden a determinar si las estrategias antiagregantes plaquetarias deben se individualizadas en función de la válvula implantada (con balón expandible frente a autoexpandible) o en el contexto particular del implante valve-in-valve; así como dilucidar qué papel pueden tener regímenes antiagregantes plaquetarios alternativos (tales como monoterapia con inhibidores del receptor plaquetario P2Y12) y los anticoagulantes orales.
Limitaciones
Los resultados de nuestro estudio se deberían interpretar con cautela teniendo en cuenta ciertas limitaciones. En primer lugar, se trató de un metanálisis a nivel de estudios que ofreció datos sobre los efectos medios del tratamiento. Asimismo, la falta de datos a nivel individual de los pacientes nos impide valorar qué impacto tuvieron las características basales clínicas y la intervención sobre los efectos del tratamiento. En segundo lugar, se observaron pequeñas diferencias en la definición empleada en las variables clínicas isquémicas entre los distintos estudios, lo cual limitó la fiabilidad de las estimaciones del efecto conseguido. No obstante, en lo referente a los eventos hemorrágicos, se usó la definición del VARC en todos los estudios incluidos, lo que aporta solidez a nuestros hallazgos. Por último, el limitado número de estudios y pacientes y el bajo número de eventos para variables como el infarto de miocardio podrían haber atenuado el poder estadístico para detectar cualquier diferencia significativa entre los grupos a estudio.
Se proporcionaran nuevas evidencias por una serie de ECA actualmente en curso: el estudio ATLANTIS (estrategia antitrombótica tras implantación percutánea de válvula aórtica para el tratamiento de la estenosis aórtica; NCT02664649) analizará los beneficios derivados de un tratamiento con una dosis estándar de apixaban frente al tratamiento estándar; el ATAPD-TAVR (anticoagulantes frente a tratamiento antiagregante plaquetario doble para prevenir la trombosis de las valvas y la embolización cerebral tras un implante percutáneo de válvula aórtica; NCT03284827) realizará una comparativa entre un tratamiento con una dosis estándar de edoxaban y el TAPD. Por último, el estudio AUREA (tratamiento antiagregante plaquetario doble frente a un curso corto de anticoagulación para prevenir los embolismos cerebrales tras un TAVI; NCT01642134) valorará una estrategia con antagonistas de la vitamina K frente a un curso de TAPD de 3 meses de duración.
CONCLUSIONES
En pacientes sin una indicación para recibir anticoagulación a largo plazo tratados de TAVI, la monoterapia con ácido acetilsalicílico se asocia a un menor riesgo de sufrir hemorragias mayores o amenazantes para la vida comparado con TAPD y a un riesgo parecido de mortalidad por cualquier causa, infarto de miocardio y accidente cerebrovascular.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
J. Sanz-Sánchez, C. A. Pivato, P. P. Leone y M. Chiarito contribuyeron al diseño, análisis y redacción de este manuscrito. D. Regazzoli y G. Petriello contribuyeron al diseño y redacción del manuscrito. B. Reimers, G. Condorelli y G. G. Stefanini contribuyeron al diseño, redacción y supervisión de este estudio.
CONFLICTO DE INTERESES
G. G. Stefanini declara haber recibido una beca de investigación de Boston Scientific y honorarios por su labor como conferenciante/consultor para B. Braun, Biosensor y Boston Scientific. D. Regazzoli declara honorarios por su labor como conferenciante para Amgen y Boehringer. Los demás autores no declaran conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- Las complicaciones isquémicas y hemorrágicas no son raras tras un TAVI y pueden ser amenazantes para la vida. Con el objetivo de reducir la incidencia de accidentes cerebrovasculares, infartos de miocardio y trombosis valvular, las guías de práctica clínica recomiendan un curso de entre 1 y 6 meses de TAPD tras un TAVI en pacientes sin una indicación para recibir anticoagulación oral a largo plazo. No obstante, este régimen no está avalado por las evidencias disponibles en la actualidad y, en líneas generales, los eventos isquémicos post-TAVI parecen eludir la acción antiagregante plaquetaria de las tienopiridinas y el ácido acetilsalicílico. De hecho, los datos que existen sobre duraciones del tratamiento realizados en la última década sugieren un efecto neutro o beneficioso de la monoterapia con ácido acetilsalicílico frente a un curso inicial de TAPD seguido de ácido acetilsalicílico en monoterapia en lo referente a las complicaciones vasculares y hemorragias mayores o amenazantes para la vida.
¿QUÉ APORTA DE NUEVO?
- El presente estudio confirma que la incorporación de tienopiridinas al ácido acetilsalicílico no reduce el riesgo de sufrir eventos isquémicos (tales como infartos de miocardio y accidentes cerebrovasculares). Más bien predispone a los pacientes a un mayor riesgo de sufrir hemorragias mayores o amenazantes para la vida. La reducción del riesgo hemorrágico observada con el ácido acetilsalicílico frente al TAPD es de gran importancia clínica con un NNT de solo 11 pacientes para evitar cualquier hemorragia y un NNT de 17 pacientes para evitar 1 hemorragia mayor o amenazante para la vida. En base a las evidencias disponibles publicadas hasta la fecha y a los resultados de este estudio, en pacientes sin una indicación para recibir anticoagulación a largo plazo tratados de TAVI, es preferible una monoterapia con ácido acetilsalicílico en lugar de TAPD.
BIBLIOGRAFÍA
1. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
2. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
3. Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
4. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
5. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019:NEJMoa1816885.
6. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med. 2019;380:1695-705.
7. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
8. Webb J, Rodés-Cabau J, Fremes S, et al. Transcatheter Aortic Valve Implantation:A Canadian Cardiovascular Society Position Statement. Can J Cardiol. 2012;28:520-528.
9. Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients with Valvular Heart Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135:e1159-1195.
10. Mangieri A, Jabbour RJ, Montalto C, et al. Single-Antiplatelet Therapy in Patients with Contraindication to Dual-Antiplatelet Therapy After Transcatheter Aortic Valve Implantation. Am J Cardiol. 2017;119:1088-1093.
11. Rodés-Cabau J, Masson JB, Welsh RC, et al. Aspirin Versus Aspirin Plus Clopidogrel as Antithrombotic Treatment Following Transcatheter Aortic Valve Replacement With a Balloon-Expandable Valve:The ARTE (Aspirin Versus Aspirin +Clopidogrel Following Transcatheter Aortic Valve Implantation) Randomized Clinical Trial. JACC Cardiovasc Interv. 2017;10:1357-1365.
12. Stabile E, Pucciarelli A, Cota L, et al. SAT-TAVI (single antiplatelet therapy for TAVI) study:A pilot randomized study comparing double to single antiplatelet therapy for transcatheter aortic valve implantation. Int J Cardiol. 2014;174:624-627.
13. Ussia GP, Scarabelli M, Mul M, et al. Dual antiplatelet therapy versus aspirin alone in patients undergoing transcatheter aortic valve implantation. Am J Cardiol. 2011;108:1772-1776.
14. Brouwer J, Nijenhuis VJ, Delewi R, et al. Aspirin with or without Clopidogrel after Transcatheter Aortic-Valve Implantation. N Engl J Med. 2020:NEJMoa2017815–NEJMoa2017815.
15. Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions:explanation and elaboration. BMJ. 2009;339:b2700.
16. Risk of bias tools - Current version of RoB 2 n.d. https://www.riskofbias.info/welcome/rob-2-0-tool/current-version-of-rob-2. Consultado 23 Jun 2019.
17. Stefanini GG, Holmes DR. Drug-Eluting Coronary-Artery Stents. N Engl J Med. 2013;368:254-265.
18. Van Mieghem NM, El Faquir N, Rahhab Z, et al. Incidence and predictors of debris embolizing to the brain during transcatheter aortic valve implantation. JACC Cardiovasc Interv. 2015;8:718-724.
19. Schmidt T, Leon MB, Mehran R, et al. Debris Heterogeneity Across Different Valve Types Captured by a Cerebral Protection System During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2018;11:1262-1273.
20. Kahlert P, Al-Rashid F, Döttger P, et al. Cerebral embolization during transcatheter aortic valve implantation:A transcranial doppler study. Circulation. 2012;126:1245-1255.
21. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376:1321-1331.
22. Nombela-Franco L, Webb JG, De Jaegere PP, et al. Timing, predictive factors, and prognostic value of cerebrovascular events in a large cohort of patients undergoing transcatheter aortic valve implantation. Circulation. 2012;126:3041-3053.
23. Siontis GCM, Praz F, Lanz J, et al. New-onset arrhythmias following transcatheter aortic valve implantation:A systematic review and meta-analysis. Heart. 2018;104:1208-1215.
24. Vora AN, Dai D, Matsuoka R, et al. Incidence, Management, and Associated Clinical Outcomes of New-Onset Atrial Fibrillation Following Transcatheter Aortic Valve Replacement:An Analysis From the STS/ACC TVT Registry. JACC Cardiovasc Interv. 2018;11:1746-1756.
25. Makkar RR, Fontana G, Jilaihawi H, et al. Possible subclinical leaflet thrombosis in bioprosthetic aortic valves. N Engl J Med. 2015;373:2015-2024.
26. Chakravarty T, Søndergaard L, Friedman J, et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves:an observational study. Lancet. 2017;389:2383-2392.
27. Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuated leaflet thickening in balloon-expandable transcatheter aortic heart valves. Eur Heart J. 2016;37:2263-2271.
28. Dangas GD, Tijssen JGP, Wöhrle J, et al. A controlled trial of rivaroxaban after transcatheter aortic-valve replacement. N Engl J Med. 2020;382:120-129.
29. Piccolo R, Pilgrim T, Franzone A, et al. Frequency, Timing, and Impact of Access-Site and Non–Access-Site Bleeding on Mortality Among Patients Undergoing Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2017;10:1436-1446.