Enfermedad valvular
REC Interv Cardiol. 2019;1:34-40
Cambios morfológicos anulares tras reparación mitral transcatéter: repercusión clínica y relevancia de la etiología
Changes in mitral annular morphology following transcatheter mitral valve repair. Clinical repercussion and importance of etiology
Área del Corazón, Hospital Universitario Central de Asturias, Oviedo, Asturias, España
RESUMEN
Introducción y objetivos: El implante percutáneo de válvula aórtica (TAVI) se introdujo en 2007 como una alternativa a la cirugía a corazón abierto para tratar a pacientes con estenosis aórtica grave sintomática, y desde entonces han aumentado las indicaciones autorizadas. Recientemente, el Placement of Aortic Transcatheter Valve Study (PARTNER) 3 ha demostrado beneficios clínicos con el TAVI con la válvula SAPIEN 3 frente al reemplazo quirúrgico de válvula aórtica (RVAo) en pacientes seleccionados con bajo riesgo de mortalidad quirúrgica. Utilizando los datos del PARTNER 3 junto con datos económicos de España, se evaluó la relación coste-efectividad del TAVI en comparación con el RVAo en pacientes con estenosis aórtica grave sintomática con bajo riesgo de mortalidad quirúrgica.
Métodos: Se utilizó un modelo en dos etapas para estimar los costes directos sanitarios y los datos de calidad de vida relacionadas con la salud para TAVI con la válvula SAPIEN 3 y RVAo. Los eventos adversos tempranos relacionados con TAVI del PARTNER 3 se incluyeron en un modelo de Markov, que capturó los resultados a más largo plazo tras TAVI o RVAo.
Resultados: El TAVI con SAPIEN 3 mejoró los años de vida ajustados por calidad por paciente (+1,00), con un aumento en el coste frente al RVAo de 6.971 € por paciente. Esto representó una ratio coste-efectividad incremental por año de vida ganado ajustado por calidad de 6.952 € por paciente. Los resultados fueron robustos en los diversos análisis de sensibilidad realizados, en los que el TAVI con SAPIEN 3 se mantiene como una opción coste-efectiva.
Conclusiones: El TAVI con SAPIEN 3 es coste-efectivo en comparación con el RVAo en pacientes con estenosis aórtica grave sintomática con bajo riesgo de mortalidad quirúrgica. Estos resultados pueden informar a los decisores políticos en España para facilitar el desarrollo de políticas sobre la selección de opciones terapéuticas en esta población de pacientes.
Palabras clave: España. Implante percutáneo de válvula aórtica. Cirugía cardiaca. Prótesis valvular cardiaca. Reemplazo quirúrgico de válvula aórtica. Análisis coste-beneficio. Análisis coste-efectividad. Estenosis aórtica. Bajo riesgo.
ABSTRACT
Introduction and objectives: Transcatheter aortic valve implantation (TAVI) was first introduced in 2007 as an alternative to open heart surgery to treat patients with severe symptomatic aortic stenosis (sSAS) with various indication expansions since that date. Recently, the PARTNER 3 study (Placement of aortic transcatheter valve) demonstrated clinical benefits with TAVI with the SAPIEN 3 valve vs surgical aortic valve replacement (SAVR) in selected low surgical mortality risk patients. We reviewed data from the PARTNER 3 and economic data from Spain to assess the cost-effectiveness ratio of TAVI vs SAVR in patients with sSAS and low surgical mortality risk.
Methods: A 2-stage model was used to estimate direct healthcare costs and health-related quality of life data regarding TAVI with the SAPIEN 3 valve and SAVR. Early adverse events associated with TAVI from the PARTNER 3 were fed into a Markov model that captured longer-term outcomes after TAVI or SAVR.
Results: TAVI with SAPIEN 3 improved quality-adjusted life years per patient (+ 1.00) with an increase in costs vs SAVR (€6971 per patient). This meant an incremental cost-effectiveness ratio/quality-adjusted life year of €6952 per patient. The results were robust with TAVI with the SAPIEN 3 valve remaining cost-effective across several sensitivity analyses.
Conclusions: TAVI with the SAPIEN 3 valve is cost effective compared to SAVR in patients with sSAS and low surgical mortality risk. These findings can inform policymakers to facilitate policy development in Spain on intervention selection in this patient population.
Keywords: Spain. Transcatheter aortic valve replacement. Heart procedures and surgeries. Prosthetic heart valve. Surgical aortic valve replacement. Cost-benefit analysis. Cost-effectiveness analysis. Aortic stenosis. Low-risk.
Abreviaturas
AVAC: años de vida ajustados por calidad. EAGs: estenosis aórtica grave sintomática. ICER: ratio coste-efectividad incremental. RVAo: reemplazo quirúrgico de válvula aórtica. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
La estenosis aórtica afecta a casi el 3% de la población adulta de más de 65 años.1 Suele tener un periodo latente asintomático inicial, pero a medida que la enfermedad avanza, se hacen evidentes los signos de insuficiencia cardiaca, angina o síncope1,2. Se recomienda sustituir la válvula aórtica en la mayoría de los pacientes sintomáticos con evidencias ecocardiográficas de estenosis aórtica significativa, así como también en ciertos pacientes asintomáticos1,2.
Desde que se realizó el primer implante percutáneo de válvula aórtica (TAVI) como opción terapéutica para tratar una estenosis aórtica grave sintomática (EAGs) hace casi 20 años, las evidencias de los ensayos clínicos han seguido avalando el uso de este procedimiento3. En 2013, el TAVI se convirtió en el tratamiento de elección para pacientes inoperables con EAGs y pacientes con riesgo alto de mortalidad quirúrgica. En los últimos tiempos, este tratamiento de elección se ha ido ampliando hasta incluir a pacientes con un riesgo intermedio/bajo de mortalidad quirúrgica4,5.
El estudio PARTNER 3 (Placement of aortic transcatheter valve study), publicado recientemente, forma parte de la cada vez mayor y más sólida evidencia clínica disponible. Se trata de un estudio pivotal controlado, aleatorizado y multicéntrico de pacientes con EAGs y un riesgo bajo de mortalidad quirúrgica6,7. Este estudio comparó los diferentes resultados de tratamiento obtenidos con el reemplazo quirúrgico de válvula aórtica (RVAo) y el TAVI con la prótesis valvular cardiaca percutánea SAPIEN 3 mediante abordaje transfemoral6,7. Comparado con el RVAo, el TAVI con la válvula SAPIEN 3 redujo el riesgo en la variable agregada compuesta por muerte, accidente cerebrovascular o rehospitalización en el seguimiento a 1 y 2 años6,7. Gracias a estos avances clínicos tan satisfactorios, las guías elaboradas conjuntamente por la European Society of Cardiology (ESC)/European Association for Cardio-Thoracic Surgery (EACTS) recomiendan, ahora, el RVAo en pacientes más jóvenes de bajo riesgo y el TAVI como tratamiento de elección en pacientes de mayor edad. También se puede considerar en todos los pacientes con EAGs tras una minuciosa evaluación de las características clínicas, anatómicas y quirúrgicas de cada paciente por parte del equipo multidisciplinar5.
Aunque en España no se cuenta con guías de tratamiento específicas sobre el uso del TAVI, la Sociedad Española de Cardiología, como miembro de la ESC, avala las guías de ésta, siendo las que se siguen por los profesionales sanitarios españoles5. Con independencia de estas guías, en España, el TAVI sigue empleándose poco en comparación con otros países europeos. A pesar de contar con una mayor infraestructura8, definida como el número de centros TAVI por millón de habitantes, los índices de intervenciones TAVI realizadas varían mucho de una región española a otra9. En 2021, casi 5.000 pacientes se beneficiaron en España de esta transformadora tecnología mínimamente invasiva. Según un estudio publicado recientemente10, el número anual de pacientes aptos para recibir el TAVI en España se sitúa en torno a los 15.783 pacientes, incluidos los de riesgo bajo. Si a esto le sumamos los cada vez mayores y evidentes beneficios clínicos del TAVI en pacientes con EAGs, parece relevante realizar un análisis coste-efectividad del uso del TAVI frente al RVAo en pacientes con EAGs de bajo riesgo quirúrgico para quienes el TAVI está ahora recomendado en las últimas guías publicadas5. Además, comparado con el RVAo, el TAVI transfemoral con la válvula SAPIEN 3 ha demostrado ser coste-efectivo en población española de riesgo intermedio y alto11. Esto no hace sino poner de manifiesto que se necesitan más evidencias sobre el análisis coste-efectividad del TAVI con la válvula SAPIEN 3 en la población española de pacientes de riesgo quirúrgico bajo con EAGs. Así pues, el objetivo de este artículo es revisar los resultados del PARTNER 3 y los datos económicos de España para evaluar el coste-efectividad del uso del TAVI frente al RVAo en pacientes con EAGs y riesgo bajo de mortalidad quirúrgica.
MÉTODOS
Se desarrolló un análisis coste-utilidad empleando metodología validada para poblaciones francesas12 e italianas13 para calcular cualquier cambio tanto en los costes sanitarios directos y calidad de vida relacionada con la salud derivados del uso del TAVI con la válvula SAPIEN 3 frente al RVAo en pacientes con EAGs y riesgo bajo de mortalidad quirúrgica (puntuación en la Society of Thoracic Surgeons < 4%) desde la perspectiva del Sistema Nacional de Salud de España. Los costes se calcularon según la cotización del euro de 2021 y los beneficios se midieron en años de vida ajustados por calidad (AVAC) ganados. La ratio coste-efectividad incremental (ICER) se calculó dividiendo la diferencia de costes entre los 2 grupos de tratamiento por la diferencia en AVAC. Al igual que en otros estudios publicados11,14, se empleó una ICER < 30.000 € por AVAC ganado como el umbral de disponibilidad a pagar (DAP) de un coste-efectividad aceptable.
Estructura del modelo
Los detalles de la estructura del modelo en 2 etapas ya se han descrito en la población francesa12. En resumen, se incorporaron en un árbol de decisión los eventos adversos tempranos secundarios al TAVI obtenidos de los datos del estudio PARTNER 3 a 30 días6 (figura 1A). Posteriormente, estos datos fueron incorporaron a un modelo de Markov que incluyó 4 estados de salud distintos (‘vivo y estable’, ‘fibrilación auricular [FA] tratada’, ‘accidente cerebrovascular discapacitante’ y ‘muerto’) para reflejar los resultados clínicos a más largo plazo de pacientes tratados mediante TAVI o RVAo (figura 1B). Todos los autores consideraron el modelo apto para el contexto español según sus conocimientos en materia clínica y económica.
Figura 1. Figura central. El modelo de coste-efectividad tiene 2 etapas: a) los EA tempranos del PARTNER 3 se incorporaron a un árbol de decisión que se usó para alimentar b) un modelo de Markov que incorporó los resultados a más largo plazo de pacientes clasificados en 4 estados de salud: ‘Vivo y Estable’ = pacientes intervenidos que sobrevivieron con solo algún EA a corto plazo o sin ningún EA; los pacientes de este estado de salud pueden pasar a ‘accidente cerebrovascular discapacitante’, ‘FA en tratamiento’ o ‘muerto’ en cualquier momento durante el tiempo de duración del modelo. ‘FA en tratamiento’ = pacientes intervenidos que sobrevivieron y terminaron desarrollando FA que precisó tratamiento específico. Esto puede ocurrir durante los primeros 30 días o durante el resto del tiempo de duración del modelo. Los pacientes de este estado de salud pueden pasar a ‘accidente cerebrovascular discapacitante’ o ‘muerto’ en cualquier momento durante el tiempo de duración del modelo. ‘Accidente cerebrovascular discapacitante’ = pacientes intervenidos que sobrevivieron y terminaron sufriendo un accidente cerebrovascular discapacitante. Esto puede ocurrir durante los primeros 30 días o durante el tiempo de duración del modelo. Los pacientes de este estado de salud sólo pueden pasar al estado ‘muerto’ en cualquier momento durante el tiempo de duración del modelo. ‘Muerto’ = este es el estado absorbente del modelo: todos los pacientes del modelo corren el riesgo de fallecer por mortalidad general de cualquier causa; los pacientes con FA en tratamiento y accidente cerebrovascular corren un mayor riesgo de muerte.
Reproducido con permiso de Gilard M, et al. Value Health 202112 bajo los términos de la licencia Creative Commons.44 EA: evento adverso; FA: fibrilación auricular; RVAo: reemplazo quirúrgico de válvula aórtica; TAVI: implante percutáneo de válvula aórtica.
Dado que el tratamiento de elección de la EAGs durante la supervivencia consiste en el reemplazo valvular, se escogió un periodo de tiempo de esperanza de vida máximo de 50 años para realizar el análisis coste-utilidad, con un factor anual de descuento del 3% aplicado a costes y beneficios futuros, según las recomendaciones específicas para España15. Se optó por este marco temporal para reflejar todas las posibles consecuencias para pacientes con EAGs a lo largo de la vida. Tanto los costes sanitarios como la calidad de vida relacionada con la salud se calcularon empleando AVAC.
Inputs del modelo
Resumen del estudio
El modelo se construyó sobre la base de la población del estudio PARTNER 3 que excluyó a pacientes con fragilidad clínica, válvulas aórticas bicúspides o cualquier otra característica anatómica que aumentara el riesgo de complicaciones asociadas a la cirugía o al TAVI. El PARTNER 3 reclutó a 1.000 pacientes, 503 de los cuales fueron aleatorizados a recibir TAVI y 497 RVAo con grupos ‘tratados’ de 496 y 454 pacientes, respectivamente6. El objetivo primario del estudio fue una variable agregada compuesta de mortalidad por cualquier causa, accidente cerebrovascular o rehospitalización al año tras la intervención.
Eventos clínicos
Las probabilidades de los eventos clínicos empleados en el modelo (tabla 1 del material adicional) se basaron en un árbol de decisión que incorporó todos los eventos adversos tempranos experimentados en el PARTNER 3 hasta 30 días después de la intervención. Se calcularon las probabilidades de transición mensual entre los diferentes estados de salud del modelo de Markov. Para calcular la transición entre los estados ‘vivo y estable’ y ‘FA en tratamiento’, se emplearon datos del PARTNER 3 sobre FA en tratamiento de nueva aparición entre 30 días y 1 año6. Otras fuentes bibliográficas ofrecieron cálculos más realistas sobre las otras 2 transiciones debido a la escasez de estos eventos en el PARTNER 3. Se usaron datos sobre la carga de accidentes cerebrovasculares en España (Stroke Alliance for Europe)16 para la transición de ‘vivo y estable’ a ‘accidente cerebrovascular discapacitante’ y datos de una revisión sistemática/metanálisis de 104 estudios de cohortes elegibles para la transición de FA en tratamiento’ a ‘accidente cerebrovascular discapacitante’17. El infarto de miocardio, el accidente isquémico transitorio y las hemorragias graves o amenazantes para la vida se reflejaron como eventos clínicos intercurrentes ocurridos entre 30 días y 1 año según datos del PARTNER 36. También se tuvieron en cuenta otros eventos importantes tales como las tasas de rehospitalización según datos del PARTNER 36, reintervención por deterioro de la válvula (datos de seguimiento del PARTNER 3 hasta los 2 años)6,7 y los resultados a 20 años de la bioprótesis valvular aórtica de los 3 años en adelante18 (tabla 1 del material adicional). En el caso base se empleó la misma tasa de reintervenciones tanto para el grupo TAVI como para el RVAo, este supuesto simplificador permitió usar mejor los datos disponibles. En el escenario 1 se asumieron tasas más altas de reintervención para el TAVI con la válvula SAPIEN 3 que para el RVAo según los datos a 5 años del PARTNER 219. En el escenario 2, en cambio, se asumió un mayor riesgo de accidentes cerebrovasculares, lo cual coincide con los resultados del PARTNER 3.
Extrapolación de la supervivencia
Hubo 2 opciones en lo referente a la extrapolación de la supervivencia. En la opción 1 las probabilidades de transición de un estado a otro se tomaron de la literatura médica (riesgo relativo de muerte con FA y con accidente cerebrovascular discapacitante de 1,517 y 2,0520, respectivamente). En la opción 2 el ajuste paramétrico de la supervivencia se realizó empleando los datos del modelo de Kaplan-Meier extraídos del PARTNER 3. Se emplearon 3 distribuciones paramétricas (Weibull, Exponential, Gompertz) que se ajustaron a la supervivencia de toda la población española. Por lo tanto, en el caso base, la supervivencia se calculó teniendo en cuenta las probabilidades de transición por la inmadurez de los datos de supervivencia del estudio. El riesgo anual de mortalidad para el estado ‘vivo y estable’, así como otros riesgos relativos para diferentes estados de salud se muestran en la tabla 2 del material adicional. La opción 2 (análisis paramétrico de la supervivencia) se exploró empleando hazard ratios (HR) alternativos en el escenario 3: HR = 0.75 según datos del PARTNER 3 a los 2 años ajustados por la mortalidad global de la población española. Un 4º escenario adicional eliminó cualquier posible beneficio sobre la supervivencia con la válvula SAPIEN 3 (HR = 1).
Utilidades de salud
Hubo 2 opciones para determinar el decremento de las utilidades de salud: la opción 1 empleó decrementos de las utilidades de salud según la literatura médica ajustados por edad y estándares de la población española21. Esta fue la opción preferida dados los pocos eventos descritos el PARTNER 3 y porque las estimaciones a partir de la literatura médica se consideraron realistas. Los decrementos ajustados por estándares etarios y poblacionales fueron 0,1622 y 0,42 para la FA y el accidente cerebrovascular discapacitante, respectivamente23. La opción 2 empleó las opciones de tratamiento del PARTNER 3 y se analizó dentro del escenario 5. En la opción 2 cada decremento en las utilidades de salud se extrajo individualmente del PARTNER 3 en el momento basal, a los 30 días, 6 meses y 1 año; después, se convirtieron a utilidades de salud españolas24.
Inputs en materia de costes
Los costes asociados al TAVI y al RVAo (intervención, complicaciones y largo plazo) se muestran en la tabla 3 del material adicional. La información de los costes del procedimiento se extrajo del SERGAS25. Se debe mencionar que el coste del SERGAS incluye tanto el valor de mercado de la válvula como el precio del material complementario. Los costes de personal se calcularon como coste por hora para los distintos profesionales sanitarios. Los costes correspondientes a las complicaciones y a los estados de salud se extrajeron de la literatura médica y de grupos relacionados por el diagnóstico (GRD). El coste desglosado del TAVI y el RVAo se muestra en la tabla 4 del material adicional. Los micro-costes se obtuvieron del estudio realizado por Bayón et al.26 y fueron actualizados para reflejar la actual práctica TAVI en pacientes españoles de bajo riesgo con EAGs. Como los costes varían según la región española de que se trate, se exploraron 3 escenarios adicionales: 6A, 6B y 6C con información sobre costes que se ajustó para reflejar la práctica clínica habitual en Murcia, Huelva y País Vasco. También se incluyó un 7.º escenario con el coste de los eventos adversos tempranos a 30 días.
Outputs del modelo
Los principales outputs del modelo fueron los costes globales por paciente y los AVAC de cada brazo y la ICER.
Análisis de sensibilidad
Para calcular la incertidumbre, se realizaron análisis de sensibilidad determinísticos variando diferentes inputs empleando intervalos de confianza y rangos descritos en la literatura médica, si los hubiere y, en su defecto, rangos plausibles (tabla 5 del material adicional). Se modificaron diversos parámetros y se analizó el impacto en los resultados. La incertidumbre global de los parámetros se abordó empleando 1 análisis de sensibilidad probabilístico (ASP) (tabla 6 del material adicional). Se analizaron diferentes escenarios para estudiar el impacto de los principales supuestos estructurales tal y como se muestran en la tabla 7 del material adicional. Todos los análisis se realizaron empleando la hoja de cálculo Excel de Microsoft (Microsoft Corporation, Estados Unidos).
RESULTADOS
Caso base
El TAVI con la válvula SAPIEN 3 mejoró los AVAC por paciente (+ 1,0) a un mayor coste que el RVAo (alrededor de 6.971 € por paciente). Esto supuso una ICER de 6.952 € por AVAC, inferior al umbral de DAP de 30.000 €/AVAC referenciado habitualmente en el contexto español. Los resultados a 50 años del caso base se muestran en la tabla 1. El desglose de los costes del TAVI frente al RVAo confirmó que aunque, en el modelo, los costes iniciales de la intervención fueron más altos para el TAVI, los costes del ‘accidente cerebrovascular discapacitante’ y la ‘FA en tratamiento’ fueron algo más bajos (tabla 1 y figura 1 del material adicional).
Tabla 1. Resultados del caso base con costes agudos y durante la supervivencia
| Resumen de resultados | TAVI con SAPIEN 3 | RVAo | Incremental |
|---|---|---|---|
| Coste por paciente | 39.052 € | 32.081 € | 6.971 € |
| Año de vida ganado (no descontado) | 14,08 | 13,22 | 0,86 |
| Mediana de supervivencia (años) | 16,50 | 14,50 | 2,00 |
| AVAC por paciente | 8,66 | 7,66 | 1,00 |
| Ratio coste-efectividad incremental (ICER) | 6.952 € | ||
| Beneficio monetario neto incremental (NMB) | 23.111 € | ||
| Beneficio de salud neto incremental (NHB) | 0,77 | ||
| Coste fase aguda (primera hospitalización y rehabilitación) | |||
| Primera Hospitalización | 24.781 € | 13.779 € | 11.003 € |
| Rehabilitación | 114 € | 461 € | - 347 € |
| Implante de marcapasos | 506 € | 311 € | 195 € |
| Costes derivados de la fase aguda | 25.401 € | 14.550 € | 10.656 € |
| Costes adicionales al año | |||
| IM | 181 € | 92 € | 89 € |
| Costes derivados de complicaciones asociadas al implante de marcapasos | 38 € | 23 € | 15 € |
| Costes de hospitalización | 212 € | 316 € | -104 € |
| Costes de reintervención | 117 € | 147 € | -30 € |
| Costes del estado de salud «vivo y estable» | 1.258 € | 844 € | 415 € |
| Costes del estado de salud «FA en tratamiento» | 48 € | 376 € | -328 € |
| Costes del estado de salud «accidente cerebrovascular discapacitante» | 11 € | 221 € | -210 € |
| Costes derivados de la mortalidad | 0 € | 0 € | 0 € |
| Coste global a 1 año | 27.267 € | 16.570 € | 10.698 € |
| Costes adicionales durante la supervivencia | |||
| Costes derivados de complicaciones asociadas al implante de marcapasos | 433 € | 251 € | 182 € |
| Costes de hospitalización | 374 € | 353 € | 21 € |
| Costes de reintervención | 4.464 € | 4.941 € | -477 € |
| Costes del estado de salud «vivo y estable» | 4.120 € | 2.590 € | 1.530 € |
| Costes del estado de salud «FA en tratamiento» | 970 € | 3.963 € | -2.993 € |
| Costes del estado de salud «accidente cerebrovascular discapacitante» | 1.424 € | 3.414 € | -1.990 € |
| Costes adicionales durante la supervivencia | 11.785 € | 15.512 € | -3.727 € |
| Costes totales durante la supervivencia | 39.052 € | 32.081 € | 6.971 € |
| AVAC: años de vida ajustados por calidad; FA: fibrilación auricular; IM: infarto de miocardio. | |||
Análisis de sensibilidad determinísticos
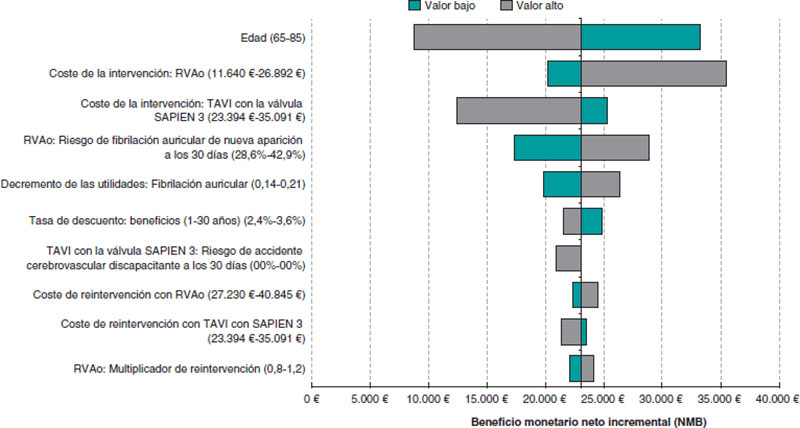
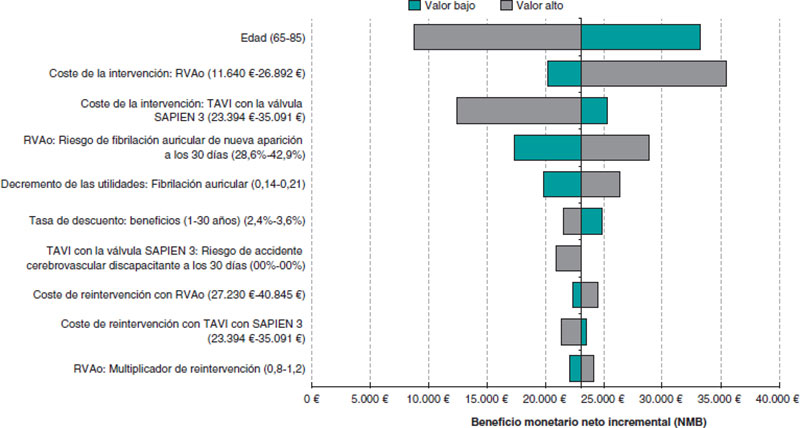
Los análisis de sensibilidad univariados se muestran en el diagrama de tornado (figura 2). El TAVI con la válvula SAPIEN 3 siguió siendo coste-efectivo con independencia de cualquier posible cambio sobre parámetros individuales del modelo (nota: se muestran en el diagrama los 20 parámetros con mayor influencia sobre el modelo). El modelo fue más sensible a la edad, a los costes del RVAo y al riesgo de accidente cerebrovascular a los 30 días asociado al TAVI.
Figura 2. Diagrama de tornado con los 20 parámetros de más influencia del modelo (análisis de sensibilidad determinístico).
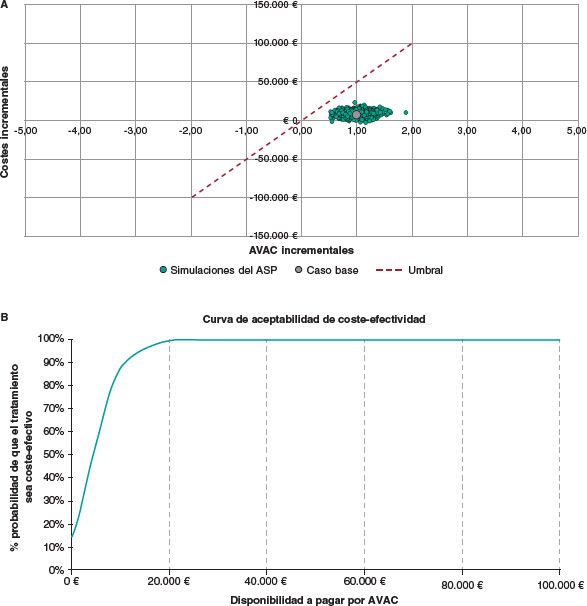
Análisis de sensibilidad probabilístico
Los resultados del ASP vienen a confirmar los resultados del análisis del caso base. En el umbral convencional de DAP de 30.000 €/AVAC, el TAVI con la válvula SAPIEN 3 sigue siendo coste-efectivo comparado con el RVAo en el 100% de las simulaciones realizadas en el modelo (figura 3A). Además, la curva de aceptabilidad indica que el tratamiento con TAVI con la válvula SAPIEN 3 tiene una probabilidad del 99,9% de ser coste-efectivo con un umbral de DAP de 30.000 €/AVAC (figura 3B). Los supuestos del ASP se muestran en la tabla 5 del material adicional.
Figura 3. Análisis de sensibilidad probabilístico: A: Diagrama de dispersión del coste-efectividad y B: Curva de aceptabilidad del coste-efectividad. ASP: análisis de sensibilidad probabilístico; AVAC: años de vida ajustados por calidad.
Análisis de los escenarios
Se analizaron varios escenarios para ver qué impacto tendría cambiar distintos supuestos sobre los resultados del modelo y la solidez del mismo. El TAVI con la válvula SAPIEN 3 sigue siendo coste-efectivo comparado con el RVAo en casi todos los escenarios descritos (tabla 6 del material adicional) incluidos aquellos con marcos temporales distintos (10, 15, 20 y 30 años). Los resultados de los análisis de los distintos escenarios vienen a confirmar la solidez comparativa del modelo descrito.
DISCUSIÓN
Este análisis sugiere que, en España, el TAVI con la válvula SAPIEN 3 probablemente sea una opción coste-efectiva de reemplazo valvular para pacientes con EAGs y un riesgo bajo de mortalidad quirúrgica. El TAVI con la válvula SAPIEN 3 mejoró los AVAC (+ 1,0) que se asocian a costes algo mayores que el RVAo (unos 6.971 € por paciente). Los beneficios de la ICER para el TAVI con la válvula SAPIEN 3 descritos en este modelo nos hablan de una intervención muy coste-efectiva (ICER/AVAC, 6.952 €) en el actual sistema español con un umbral de DAP de 30.000 €/AVAC. La incertidumbre se estudió en varios análisis de sensibilidad y los resultados fueron sólidos.
Los hallazgos de este estudio vienen avalados por otros estudios de coste-efectividad que aseguran que el TAVI con la SAPIEN 3 es dominante o coste-efectivo en pacientes de bajo riesgo de mortalidad quirúrgica27-31. Los hallazgos españoles también coinciden con otros análisis de coste-efectividad del TAVI con la SAPIEN 3 frente al RVAo realizados en Francia12 e Italia13 con la misma estructura de modelo.
Este análisis es importante porque el TAVI ofrece a los pacientes una opción de tratamiento mínimamente invasiva con un menor riesgo de complicaciones y/o rehospitalizaciones, tasas más altas de recuperación y una mejor calidad de vida. Desde la perspectiva de los proveedores sanitarios, el TAVI también es eficiente porque reduce el uso de recursos sanitarios, minimiza las complicaciones posoperatorias y acorta la estancia hospitalaria (incluso en unidades de cuidados intensivos [UCI])32. Acortar las estancias hospitalarias significa tratar a más pacientes en el mismo hospital, algo importante en un ya de por sí colapsado sistema sanitario y con largas listas de espera. Estas eficiencias del TAVI también reducen el riesgo de infección y contaminación33, algo apreciado durante la reciente pandemia de la COVID-19. Por último, el TAVI reduce el periodo de recuperación y la vuelta a las actividades diarias normales, aspectos que no se incluyeron en este análisis. También puede que haya otros beneficios indirectos no considerados en este análisis que se sumen a los beneficios globales de esta tecnología, como actividades de voluntariado, cuidado de nietos o menor necesidad de ayuda de cuidadores34.
Los resultados de este análisis pueden ayudar a que un mayor número de pacientes españoles con EAGs puedan tener acceso al TAVI. Estudios recientes confirman el perfil de seguridad y eficacia del TAVI transfemoral en España9. Esto, sumado a las guías europeas publicadas recientemente, sugiere que el número de TAVI irá en aumento y hará que muchos pacientes de bajo riesgo quirúrgico con EAGs sean pacientes aptos para recibir esta intervención. Además, con el tiempo, el TAVI probablemente se simplifique aún más con tiempos de ingreso más cortos35, lo cual debería reducir los costes del TAVI en el futuro. A este respecto, los resultados de este estudio pueden ser de utilidad para los decisores políticos y sanitarios en lo referente al manejo de pacientes con EAGs en España.
Limitaciones
Este estudio no está exento de limitaciones. La primera tiene que ver con ciertos inputs del modelo y con la elaboración de supuestos. En este modelo, los datos de las hospitalizaciones se basaron en los datos a 1 y 2 años del estudio PARTNER 3 asumiendo que esta tasa se mantenía constante durante el marco temporal del modelo después de 2 años. El impacto que tuvo este supuesto se desconoce porque los sujetos de ambos grupos a tratamiento del modelo siguieron estando en riesgo de hospitalización. La tasa de reintervenciones se mantuvo constante después de 22 años; el impacto que tuvo esta asunción sobre los resultados del modelo se consideró mínimo ante la expectativa de que casi el 11% de los pacientes seguirían vivos en el modelo después de este tiempo con una necesidad limitada de tener que ser reintervenidos. A pesar de esto, no puede descartarse la incertidumbre en torno a la durabilidad a más largo plazo del dispositivo TAVI ni los subsiguientes índices de reintervenciones en pacientes más jóvenes. No se incluyeron desutilidades para ningún evento intercurrente porque se puede correr el riesgo de duplicarlas tras haberse aplicado las utilidades a pacientes de los estados de salud ‘FA en tratamiento’ y ‘accidente cerebrovascular discapacitante’. Se trató de una asunción conservadora pues, aparte de las complicaciones asociadas al marcapasos, los índices de eventos intercurrentes suelen ser más bajos para el TAVI con la válvula SAPIEN 3 que para el RVAo.6-
Una segunda limitación del estudio es la extrapolación de los resultados. Las conclusiones no pueden extrapolarse a la población general con estenosis aórtica porque, entre otros, los pacientes con anatomías coronarias desfavorables fueron excluidos del estudio PARTNER 3. Además, se ha de actuar con cautela a la hora de extrapolar cualquier hallazgo de este modelo a poblaciones fuera del territorio español.
Por último, se debe mencionar que los costes quirúrgicos en las distintas regiones españolas son heterogéneos. En este estudio, se emplearon datos públicos de una región española y nuestro abordaje fue conservador pues dio cuenta de la práctica clínica habitual. También se analizaron distintos escenarios con otros datos de costes disponibles.
CONCLUSIONES
Los datos del PARTNER 3 sugieren que el uso del TAVI con la válvula SAPIEN 3 es más favorable, a nivel clínico, que el RVAo en pacientes con EAGs y bajo riesgo de mortalidad quirúrgica. Los resultados de este modelo de coste-efectividad nos indican que, en España, el TAVI podría ser una opción coste-efectiva con respecto al RVAo en esta población con un valor ICER/AVAC estimado muy por debajo del umbral nacional. El modelo fue sólido y la incertidumbre se valoró en diferentes análisis de sensibilidad. Los resultados de este análisis de coste-efectividad servirán para que tanto los decisores políticos y sanitarios como los responsables de los presupuestos sanitarios optimicen el manejo de pacientes españoles con EAGs.
FINANCIACIÓN
Edwards Lifesciences SA, Suiza financió este estudio económico, y formó parte del análisis y la redacción de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORES
J.M. Vázquez recopiló los datos económicos, participó en la validación del modelo y en el proceso de revisión del manuscrito. E Pinar recopiló los datos económicos y participó en la validación del modelo. J. Zamorano participó en la recopilación de datos, así como en el proceso de validación del modelo. J. Burgos participó tanto en el proceso de recopilación de datos como en la validación del modelo. J. Díaz participó tanto en el proceso de recopilación de datos, así como en la validación del modelo. B. García del Blanco participó tanto en el proceso de recopilación de datos, así como en la validación del modelo. A. Sarmah participó en la recopilación y análisis de datos, la preparación de los resultados, así como en la redacción y revisión del manuscrito. P. Candolfi participó en el análisis de costes y en la redacción del manuscrito. J Shore participó en el proceso de desarrollo del modelo, así como en la revisión del manuscrito. M. Green participó, también, en el proceso de desarrollo del modelo y en el proceso de revisión del manuscrito.
CONFLICTO DE INTERESES
J.M. Vázquez Rodríguez declaró que su departamento recibió becas de formación o investigación de Edwards Lifesciences, Medtronic y Boston Scientific y él dijo haber recibido honorarios como consultor de Medtronic y Boston Scientific. J.L. Zamorano declaró que su centro recibió becas de investigación de Abbott y Medtronic y él, por su parte, honorarios como conferenciante de Edwards Lifesciences, Bayer, Novo Nordisk y Daiichi Sankyo. J. Moreu Burgos declaró haber recibido honorarios de Biosensors, Boston Scientific, Cardiva, Edwards Lifesciences y Medtronic. A. Sarmah declaró ser empleado de Edwards Lifesciences y tener opciones sobre acciones. P. Candolfi declaró ser empleado de Edwards Lifesciences y tener opciones sobre acciones. J. Shore declaró haber recibido honorarios como consultor para el desarrollo del modelo económico. M. Green declaró haber recibido honorarios como consultor para el desarrollo del modelo económico. Ni E. Pinar, J.F. Díaz-Fernández ni B. García del Blanco declararon ningún conflicto de intereses.
AGRADECIMIENTOS
La redacción de este manuscrito ha sido posible gracias al apoyo de Zenith Healthcare Communications Ltd (Chester, Reino unido) y a la financiación de Edwards Lifesciences.
¿QUÉ SE SABE DEL TEMA?
- Un reciente ensayo clínico confirma los beneficios clínicos del TAVI con la válvula SAPIEN 3 en una población de bajo riesgo quirúrgico frente al RVAo. Además, a raíz de las últimas actualizaciones de las guías europeas y norteamericanas, el TAVI puede considerarse ya una opción terapéutica viable para pacientes de bajo riesgo quirúrgico con EAGs. No obstante, con respecto a la evidencia económica, únicamente se ha demostrado que el TAVI con la válvula SAPIEN 3, comparado con el RVAo, es coste-efectivo en pacientes españoles de riesgo alto e intermedio con EAGs.
¿QUÉ APORTA DE NUEVO?
- Los datos del PARTNER 3 sugieren que el uso del TAVI con la válvula SAPIEN 3 fue más favorable, a nivel clínico, que el RVAo en pacientes con EAGs y bajo riesgo de mortalidad quirúrgica. Los resultados de este sólido análisis de coste-efectividad indican que, en España, el TAVI podría ser más coste-efectivo que el RVAo en esta población de pacientes con un valor ICER/AVAC estimado muy por debajo del umbral nacional. Conjuntamente, los datos del PARTNER 3 sumados a los de este análisis de coste-efectividad servirán para que tanto los decisores políticos y sanitarios como los responsables del presupuesto sanitario optimicen el manejo de pacientes españoles con EAGs.
BIBLIOGRAFÍA
1. Grimard BH, Larson JM. Aortic Stenosis: Diagnosis and Treatment. Am Fam Physician. 2016;93:371-378.
2. Marquis-Gravel G, Redfors B, Leon MB, Généreux P. Medical treatment of Aortic Stenosis. Circulation. 2016;134:1766-1784.
3. Cribier A. Development of Transcatheter Aortic Valve Implantation (TAVI): A 20-year Odyssey. Arch Cardiovasc Dis. 2012;105:146-152.
4. Falk, V, Baumgartner H, Bax, JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur J Cardiothorac Surg. 2017;52:616-664.
5. Beyersdorf F, Vahanian A, Milojevic M, et al. 2021 ESC/EACTS Guidelines for the Management of Valvular Heart Disease. Eur J Cardiothorac Surg. 2021;60:727-800.
6. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement With a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
7. Leon MB, Mack MJ, Hahn RT, et al. Outcomes 2 Years After Transcatheter Aortic Valve Replacement in Patients at Low Surgical Risk. J Am Coll Cardiol. 2021;77:1149-1161.
8. Ali N, Faour A, Rawlins J, et al. ‘Valve for Life’: tackling the deficit in transcatheter treatment of heart valve disease in the UK. Open Heart. 2021;8:e001547.
9. Íñiguez-Romo A, Javier Zueco-Gil J, Álvarez-Bartolomé M, et al. Outcomes of transcatheter aortic valve implantation in Spain through the Activity Registry of Specialized Health Care. REC Interv Cardiol. 2022;4:123-131.
10. Durko, AP, Osnabrugge RL, Van Mieghem NM, et al. Annual number of candidates for transcatheter aortic valve implantation per country: current estimates and future projections. European Heart Journal. 2018;39:2635-2642.
11. Pinar E, García de Lara J, Hurtado J, et al. Análisis coste-efectividad del implante percutáneo de válvula aórtica SAPIEN 3 en pacientes con estenosis aórtica grave sintomática. Rev Esp Cardiol. 2021;75:325-333.
12. Gilard M, Eltchaninoff H, Lung B, et al. Cost-Effectiveness Analysis of SAPIEN 3 Transcatheter Aortic Valve Implantation Procedure Compared with Surgery in Patients with Severe Aortic Stenosis at Low Risk of Surgical Mortality in France. Value Health. 2022;25:605-613.
13. Mennini FS, Meucci F, Gabriele Pesarini G, et al. Cost-effectiveness of transcatheter aortic valve implantation vs surgical aortic valve replacement in low surgical risk aortic stenosis patients. Int J Cardiol. 2022;357:26-32.
14. Sacristán JA, Oliva J, Del Llano J, Prieto L, Pinto JL. What is an efficient health technology in Spain? Gac Sanit. 2002;16:334-343.
15. Lopez-Bastida J, Oliva J, Antoñanzas F, et al. Spanish recommendations on economic evaluation of health technologies. Eur J Health Econ. 2010;11: 513-20.
16. SAFE 2017. The Burden of Stroke in Spain. Disponible en: https://www.safestroke.eu/wp-content/uploads/2017/12/SAFE_STROKE_SPAIN.pdf. Acessed 22 May 2022.
17. Odutayo A, Wong CX, Hsiao AJ, et al. Atrial fibrillation and risks of cardiovascular disease, renal disease, and death: systematic review and meta-analysis. BMJ. 2016;354:i4482.
18. Bourguignon T, Bouquiaux-Stablo A-L, Candolfi P, et al. Very long-term outcomes of the Carpentier-Edwards Perimount valve in aortic position. Ann Thorac Surg. 2015;99:831-837.
19. Makkar RR, Thourani VH, Mack MJ, et al. Five-Year Outcomes of Transcatheter or Surgical Aortic-Valve Replacement. N Engl J Med. 2020;382:799-809.
20. de Andrés-Nogales F, Álvarez M, de Miquel MÁ, et al. Cost-effectiveness of mechanical thrombectomy using stent retriever after intravenous tissue plasminogen activator compared with intravenous tissue plasminogen activator alone in the treatment of acute ischaemic stroke due to large vessel occlusion in Spain. Eur Stroke J. 2017;2:272-284.
21. Szende A, Janssen B, Cabases J, editors. Self-Reported Population Health: An International Perspective based on EQ-5D. Dordrecht (NL): Springer; 2014. p. 30.
22. Oyagüez I, Suárez C, López-Sendón JL, et al. Cost-Effectiveness Analysis of Apixaban Vs Edoxaban in Patients with Atrial Fibrillation for Stroke Prevention. Pharmacoecon Open. 2020;4:485-497.
23. Lopez-Bastida J, Oliva Moreno J, Worbes Cerezo M, et al. Social and economic costs and health-related quality of life in stroke survivors in the Canary Islands, Spain. BMC Health Serv Res. 2012;12:315.
24. Ramos-Goñi JM, Craig BM, Oppe M, et al. Handling Data Quality Issues to Estimate the Spanish EQ-5D-5L Value Set Using a Hybrid Interval Regression Approach. Value Health. 2018;21:596-604.
25. SERGAS 2014. DECRETO 56/2014, de 30 de abril, por el que se establecen las tarifas de los servicios sanitarios prestados en los centros dependientes del Servicio Gallego de Salud y en las fundaciones públicas sanitarias. DOG 96. 2014. Disponible en: https://www.xunta.gal/dog/Publicados/2014/20140521/AnuncioC3K1-140514-0001_es.html. Consultado 22 May 2022.
26. Bayón Yusta JC, Gutiérrez Iglesias A, Mateos del Pino M, IIbarrola Gutiérrez MI, Gómez Inhiesto E, Acaiturri Ayesta MT. Análisis coste-efectividad del recambio valvular aórtico mediante prótesis valvular percutánea frente al tratamiento quirúrgico habitual. Ministerio de Sanidad, Servicios Sociales e Igualdad; Servicio de Evaluación de Tecnologías Sanitarias del País Vasco. Informes de Evaluación de Tecnologías Sanitarias: OSTEBA (2014). Disponible en: https://www.euskadi.eus/contenidos/informacion/biblioteca_central/es_9528/scp/215765.pdf. Consultado 22 May 2022.
27. Tam DY, Azizi PM, Fremes SE, Chikwe J, Gaudino M, Wijeysundera HC. The Cost-Effectiveness of Transcatheter Aortic Valve Replacement in Low Surgical Risk Patients With Severe Aortic Stenosis. Eur Heart J Qual Care Clin Outcomes. 2021;7:556-563.
28. Zhou JY, Liew D, Duffy SJ, Walton A, Htun N, Stub D. Cost-Effectiveness of Transcatheter Vs Surgical Aortic Valve Replacement in Low-Risk Patients with Severe Aortic Stenosis. Heart Lung Circ. 2021;30:547-554.
29. Health Information and Quality Authority (HIQA) Health Technology Assessment of transcatheter aortic valve implantation (TAVI) in patients with severe symptomatic aortic stenosis at low and intermediate risk of surgical complications. 2019. Disponible en: https://www.hiqa.ie/sites/default/files/2019-12/TAVI_HTA.pdf. Consultado 22 May 2022.
30. Norwegian Institute of Public Health (NIPH) Transcatheter aortic valve implantation (TAVI) vs surgical aortic valve replacement (SAVR) for patients with severe aortic stenosis and low surgical risk and across surgical risk groups: a health technology assessment. 2021. Disponible en: https://www.fhi.no/en/publ/2021/TAVI-vs-SAVR-for-patients-with-severe-aortic-stenosis-and-low-surgical-risk-and-across-surgical-risk-groups/. Consultado 22 May 2022.
31. Haute Autorité de Santé (HAS) Traitement de la sténose aortique sévère symptomatique en France chez les patients à faible risqué chirurgical. 2021. Disponible en: https://www.has-sante.fr/upload/docs/application/pdf/2021-04/sapien3_9022021_avis_economique_vf2.pdf. Consultado 22 May 2022.
32. Valdebenito, M, Massalha E, Barbash IM et al. Transcatheter aortic valve implantation during the COVID-19 pandemic. Am J Cardiol. 2021;145:97-101.
33. Noad RL, Johnston N, McKinley A, et al. A pathway to earlier discharge following TAVI: Assessment of safety and resource utilization. Catheter Cardiovasc Interv. 2016;87:134-142.
34. Huygens SA, van der Kley F, Bekkers JA, Bogers AJJC, Tekkenberg JJM, Rutten-van Mölken MPMH. Beyond the clinical impact of aortic and pulmonary valve implantation: health-related quality of life, informal care and productivity. Eur J Cardiothorac Surg. 2019;55:751-759.
35. Martínez-Sellés M. Coste-efectividad del implante percutáneo de válvula aórtica en 2022. Rev Esp Cardiol. 2022;75(10):853.
36. Instituto Nacional de Estadística. National Life Tables Spain (2019) Disponible en: https://www.ine.es/dyngs/INEbase/en/operacion.htm?c=Estadistica_C&cid=1254736177004&menu=ultiDatos&idp=1254735573002. Consultado 22 May 2022.
37. de Andrés-Nogales F, Vivancos Mora J, Barriga Hernández FJ, et al. Use of healthcare resources and costs of acute cardioembolic stroke management in the Region of Madrid: The CODICE Study. Neurología. 2015;30:536-544.
38. Esquivias, GB, Albaladejo GE, Zamorano JL, et al. Cost-effectiveness analysis comparing apixaban and acenocoumarol in the prevention of stroke in patients with nonvalvular atrial fibrillation in Spain. Rev Esp Cardiol. 2015;68:680-690.
39. Rubio-Terrés, C, Graefenhain de Codeset R, Rubio-Rodríguez D, Evers T, Grau Cerrato SG. Cost-effectiveness analysis of rivaroxaban vs acenocoumarol in the prevention of stroke in patients with non-valvular atrial fibrillation in Spain. JHEOR. 2016;4:19-34.
40. Alvarez-Sabín J, Quintana M, Masiuan J, et al. Economic impact of patients admitted to stroke units in Spain. Eur J Health Econ. 2017;18:449-458.
41. Ministerio de Sanidad de España. GRD APR 190/191 (2019). Registro de Altas de los Hospitales Generales del Sistema Nacional de Salud. CMBD. Norma Estatal de Años Anteriores Disponible en: https://www.sanidad.gob.es/estadEstudios/estadisticas/cmbdAnteriores.htm. Consultado 22 May 2022.
42. Crespo C, Linhart M, Acosta J, et al. Optimisation of cardiac resynchronisation therapy device selection guided by cardiac magnetic resonance imaging: cost-effectiveness analysis. Eur J Prev Cardiol. 2020;27:622-632.
43. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016; 374: 1609-1620.
44. Attribution 4.0 International (CC BY 4.0). Disponible en: https://creativecommons.org/licenses/by/4.0/. Consultado 25 Ago 2022.
* Autor para correspondencia.
Correo electrónico: (A. Sarmah).
@jmvazrod; @CorazonHuvr; @pepp183; @PascalCandolfi; @CIBER_CV
RESUMEN
Introducción y objetivos: El implante percutáneo de válvula aórtica (TAVI) se ha consolidado como tratamiento de la estenosis aórtica grave. Como toda intervención, su seguridad y su efectividad deben monitorizarse en condiciones de práctica real. Para ello, se han analizado los datos del Sistema Nacional de Salud disponibles entre los años 2014 y 2017.
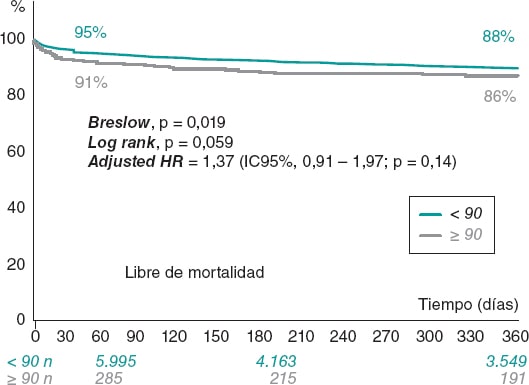
Métodos: Se evaluaron todos los pacientes mayores de 50 años con TAVI por vía transfemoral incluidos en el Registro de Actividad de Atención Especializada entre 2014 y 2017 procedentes de centros públicos o concertados. Se hicieron análisis de regresión logísticos para evaluar los factores asociados con la mortalidad y las complicaciones, y modelos binomiales negativos para la estancia media hospitalaria. Se usaron tasas estandarizadas para ajustar diferencias en las variables de efectividad y seguridad entre las diferentes comunidades autónomas, de acuerdo con el alto y bajo volumen de implantación de la técnica, considerando como referencia la mediana nacional (37 implantes por 105 habitantes) durante el periodo de tiempo analizado.
Resultados: En total se analizaron 5.454 casos de TAVI. La mortalidad intrahospitalaria pasó del 4,89% en 2014 al 2,7% en 2017. La estancia media hospitalaria descendió de 13,1 días en 2014 a 11,3 en 2017. A pesar de no observar diferencias en la mortalidad entre comunidades autónomas, aquellas con mayor volumen de implantes tuvieron una menor estancia media hospitalaria (OR = 0,88; IC95%, 0,86-0,91; p < 0,01), menor riesgo de infecciones (OR = 0,54; IC95%, 0,32-0,9; p = 0,02) y menor necesidad de marcapasos permanente (OR = 0,77; IC95%, 0,65-0,91; p < 0,01).
Conclusiones: El uso de TAVI crece progresivamente en España con resultados cada vez mejores respecto al éxito del implante y la morbimortalidad perioperatoria. La variabilidad interregional en las tasas de implante no se relaciona con la mortalidad observada, pero sí con la morbilidad y la estancia hospitalaria.
Palabras clave: Estenosis aórtica. Reemplazo de la válvula aórtica. Registro de Actividad de Atención Especializada. Enfermedad de las válvulas cardiacas. Implante percutáneo de válvula aórtica. TAVI.
Abstract
Introduction and objectives: Transcatheter aortic valve implantation (TAVI) has become the treatment of choice for the management of symptomatic severe aortic stenosis. As it happens with all procedures, the safety and effectiveness of TAVI must be monitored. To this end, we assessed the data available from the Spanish National Health Service from 2014 through 2017.
Methods: The study included patients aged > 50 years treated with TAVI and registered in the Activity Registry of Specialized Health Care from 2014 through 2017 from public and private hospitals in compliance with the National Health System. Multivariate logistic regression analyses were performed to identify factors associated with mortality and complications, and negative binomial models for the mean hospital length of stay (LoS). Standardized rates were used to discriminate both the effectiveness and safety among regions with higher and lower levels of implementation of the technique using the national median as the threshold, (37 implants x 105 habitants) in the 4-year period.
Results: A total of 5454 TAVIs were analyzed. The in-hospital mortality rate dropped from 4.89% in 2014 to 2.7% in 2017. The LoS decreased from 13.1 days in 2014 to 11.3 days in 2017. No differences in mortality were observed among the regions. However, the LoS of regions with a high volume of implants was significantly lower (OR, 0.88; 95%CI, 0.86-0.91; P < .01), as well as the risk of infections (OR, 0.54; 95%CI, 0.32-0.9; P = .02), and pacemaker implantation (OR, 0.77; 95%CI, 0.65-0.91; P < .01).
Conclusions: The use of TAVI in Spain is safe and has grown progressively with improved outcomes regarding morbidity and mortality. Differences among regions have been highlighted regarding patient access to TAVI. This heterogeneity was not associated with mortality but with differences in the morbidity rates.
Keywords: Aortic stenosis. Surgical aortic valve replacement. Valvular heart disease. Activity Registry of Specialized Health Care. Transcatheter aortic valve implantation. TAVI
Abreviaturas
EmH: estancia media hospitalaria. MPP: implante de marcapasos permanente. RAE-CMBD: Registro de Actividad de Atención Especializada - Conjunto Mínimo Básico de Datos. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
La estenosis aórtica es la valvulopatía adquirida más frecuente, con una prevalencia en torno al 3% en la población ≥ 65 años, que llega hasta el 7,4% en edades más avanzadas (≥ 85 años)1. Es además la primera causa de cirugía valvular en adultos2. Entre los factores de riesgo, destacan la edad y el sexo (mayor incidencia en varones)3,4. Una vez que aparecen los síntomas, presenta una elevada mortalidad (hasta del 50%) en los años siguientes5,6. En nuestro país, debido al progresivo incremento de la población de mayor edad7, se prevé una importante carga de la enfermedad asociada a la estenosis aórtica8, con el consiguiente desafío asistencial.
Hasta hace 14-15 años, la única opción terapéutica era el reemplazo quirúrgico de la válvula. En los pacientes considerados como inoperables, bien por su edad o por su comorbilidad, la alternativa de tratamiento se limitaba al control sintomático. El implante percutáneo (mínimamente invasivo) de válvula aórtica (TAVI) abrió un nuevo escenario de oportunidad terapéutica, en principio para los pacientes inoperables o de riesgo elevado, luego para los de riesgo intermedio y, finalmente, para los de bajo riesgo9-13. A pesar de esto, la tasa de tratamiento con TAVI en España es significativamente inferior a la del resto de los países europeos14. Si bien en Europa son numerosas las publicaciones y los registros sobre los resultados clínicos del TAVI, en España existe poca evidencia sobre los resultados autóctonos con fuentes de titularidad pública, a pesar de haber transcurrido más de 10 años desde el primer implante en abril de 200714.
En este trabajo se presenta la evidencia de la práctica clínica real disponible en nuestro país sobre el uso de TAVI, con la descripción del perfil de los casos tratados, los resultados obtenidos en términos de mortalidad, complicaciones y estancia media hospitalaria (EmH), y se analizan los principales factores asociados, siempre desde la perspectiva del Sistema Nacional de Salud, empleando como fuente de información el Registro de Actividad de Atención Especializada (RAE-CMBD) del Ministerio de Sanidad, Consumo y Bienestar Social.
MÉTODOS
Conjunto Mínimo Básico de Datos
Este trabajo se nutre de la información recogida en el RAE-CMBD del Ministerio de Sanidad, Consumo y Bienestar Social. Incluye el detalle sobre las características demográficas de los pacientes ingresados, variables administrativas y variables clínicas relacionadas con los diagnósticos y los procedimientos, tanto del paciente como del episodio de atención recibida. Los diagnósticos y los procedimientos registrados se codifican de acuerdo con la Clasificación Internacional de Enfermedades, 9.ª edición, Modificación Clínica (CIE-9-MC) para los años 2014-2015 y la Clasificación Internacional de Enfermedades, 10.ª edición, Modificación Clínica (CIE-10-ES) para 2016 y 2017, lo que permite una mayor especificidad en los diagnósticos.
En el presente análisis se incluyeron todos los episodios registrados entre 2014 y 2017 de pacientes mayores de 50 años, con ingreso en centro público o concertado debido a la realización de los procedimientos «Sustitución endovascular de válvula aórtica» (código 35.05 de la CIE-9-MC) y «Sustitución de válvula aórtica, con tejido zooplástico, abordaje percutáneo» (código 02RF38Z de la CIE-10-ES). Se excluyeron los casos en que se realizó un procedimiento de circulación extracorpórea (código 39.61 de la CIE-9-MC y código 5A1221Z de la CIE-10-ES) por considerar que el TAVI no precisa esta técnica y, por tanto, podría ser un error de codificación del episodio. Igualmente, se eliminaron los episodios de reingreso hospitalario para finalizar la recuperación del paciente.
Para el análisis de seguridad se incluyeron las complicaciones codificadas en la CIE-9-MC en el capítulo 17, específicamente con los códigos de la categoría 996, «Complicaciones propias de ciertos procedimientos especificados», que incluye las complicaciones, no clasificadas bajo otros conceptos, en el empleo de sustitutos artificiales que implican el implante de dispositivos internos, entre otros. Por su parte, en la más reciente clasificación CIE-10-ES, este tipo de complicaciones se encuentran en la categoría T82, «Complicaciones de prótesis, implantes e injertos cardiacos y vasculares». Además, por su potencial relación con el TAVI y su gran interés desde el punto de vista clínico, se consideraron también eventos como el fallo renal agudo, el infarto agudo de miocardio, la disección de aorta, el ictus, la sepsis y el implante de marcapasos permanente (MPP).
Análisis estadístico
Se hizo un análisis descriptivo de las variables de estudio, expresando las continuas como medias y desviación estándar, y las categóricas como frecuencias absolutas y relativas. Las diferencias entre 2 grupos independientes se contrastaron con los estadísticos t de Student o U de Mann-Whitney-Wilcoxon, en función de su distribución (paramétrica o no paramétrica, respectivamente). En las variables categóricas se usó la prueba de χ2 o la prueba exacta de Fisher. Se implementaron modelos multivariados para identificar los factores asociados con el riesgo de mortalidad intrahospitalaria y complicaciones importantes (regresión logística) y EmH (regresión binomial negativa). Como variables explicativas, se exploraron variables demográficas y clínicas: edad, sexo o tasa de implantes en la comunidad autónoma donde se llevó a cabo el procedimiento, complicaciones y gravedad de cada caso, según la clasificación RAE-CMBD (estratificado, según las características del paciente, los diagnósticos y los procedimientos, en 4 niveles15,16: menor, moderado, mayor o extremo —Grupos Relacionados por el Diagnóstico [GRD] severidad—).
Para analizar posibles diferencias entre comunidades autónomas en el volumen de TAVI, se calcularon las tasas de implante estandarizadas por 100.000 habitantes (105). Se tomó como referencia la población estacional de cada región en el periodo, ajustando por grupo de edad (50-74, 75-84 y ≥ 85 años) y sexo17. La discriminación entre regiones de alto y bajo volumen se hizo mediante la categorización de las tasas de implante, y se consideraron de alto volumen aquellas con una tasa superior a la mediana nacional (37 implantes por 105 habitantes) durante el periodo considerado. Las diferencias en las características basales de los pacientes tratados en las comunidades autónomas de alto y bajo volumen se tuvieron en cuenta al ajustar los modelos multivariados.
Las variables independientes de todos los modelos de regresión logística y binomial negativa fueron revisadas por los expertos clínicos para asegurar su sentido clínico, y seleccionadas posteriormente de manera que el modelo resultante minimizara el criterio de información de Akaike18. Una vez determinado el mejor modelo en cada caso, se calcularon las odds ratios (OR) y sus intervalos de confianza del 95% (IC95%) para determinar si un determinado factor se asociaba a un mayor riesgo (OR > 1) ante un resultado particular y comparar la magnitud de varios factores.
En relación con el análisis multivariante de las complicaciones, cuando el número de casos registrados era reducido y, por tanto, la potencia estadística del contraste era limitada, se agruparon las complicaciones relevantes, siguiendo de nuevo el criterio clínico. De esta forma, se identificaron y evaluaron los factores relacionados con el riesgo de hemorragia y punción o laceración accidental (CIE-9-MC 998.11 y 998.2 | CIE-10-ES: I97.4, I97.6 y I97.5*), infarto agudo de miocardio (CIE-9-MC 410.*1 | CIE-10-ES: I21*), MPP (CIE-9-MC 37.8 | CIE-10-ES: 5A1223Z), sepsis e infecciones (CIE-9-MC 995.91, 995.92 y 998.5 | CIE-10-ES: T81.4XXA y A41*), fallo renal agudo (CIE-9-MC: 584 | CIE-10-ES: N17*) y accidente cerebrovascular (CIE-9-MC 997.02, 434 y 435 | CIE-10-ES: I97.8*0, I66, I63.3, I63.4, I63.5, G45*, I67.82).
Todos los contrastes estadísticos fueron bilaterales y las diferencias se consideraron estadísticamente significativas cuando el valor de p era < 0,05. El análisis se llevó a cabo con el programa estadístico R (versión 3.6.1).
RESULTADOS
En total se contabilizaron 5.454 pacientes a quienes se implantó percutáneamente por vía transfemoral una prótesis aórtica: 763 casos registrados en 2014, 1.171 en 2015, 1.477 en 2016 y 2.043 en 2017. El implante fue más frecuente en las mujeres (52,2%), mayoritariamente en pacientes entre 81 y 85 años, tanto en varones (37%) como en mujeres (44%), y la edad media fue de 81,12 ± 6,43 años durante todo el periodo. En conjunto, los diagnósticos más frecuentes que motivaron el ingreso de los pacientes fueron los de trastornos de la válvula aórtica (79,7%, códigos CIE-9-MC: 424.1 y CIE-10-ES: I35), insuficiencia de válvula mitral y estenosis reumática (3,1%, códigos CIE-9-MC: 396.2 y CIE-10-ES: T82.0*XA) e insuficiencia cardiaca congestiva (2,9%, códigos CIE-9-MC: 428.0 y CIE-10-ES: I08.0).
Tasa de TAVI transfemoral, mortalidad y estancia hospitalaria
El número de procedimientos de TAVI, aunque variable a lo largo de los años, creció progresivamente, con un incremento notable entre 2014 y 2017, tanto en el número de centros que llevan a cabo el procedimiento como en el total de TAVI realizados. Así, la tasa de implante nacional (por 105 habitantes) se duplicó, y la media durante el periodo de estudio fue de 33 intervenciones por 105 habitantes (tabla 1).
Tabla 1. Tasa de implante por 100.000 habitantes, estancia media hospitalaria y mortalidad intrahospitalaria por comunidad autónoma
| TI total periodo 2014-2017 | Estancia | Mortalidad | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ajustada | 2014 | 2015 | 2016 | 2017 | Total periodo | Porcentaje registrado en periodo | ||||||||||
| Comunidad autónoma | TAVI (n) | Población estacional | Est (x 105 hab) | IC95% LI | IC95% LS | EmH | DE | EmH | DE | EmH | DE | EmH | DE | EmH | DE | |
| 1 | 945 | 2.805.282 | 37 | 34,6 | 39 | 14,8 | 11,9 | 13,2 | 12,7 | 12,1 | 10,3 | 11,7 | 11,3 | 12,7 | 11,5 | 4,2 |
| 2 | 62 | 520.240 | 11 | 8,2 | 14 | 24,6 | 34,2 | 14,6 | 9,9 | 20,8 | 20 | 12,4 | 6,4 | 16,3 | 16,9 | 1,6 |
| 3 | 238 | 486.637 | 45 | 39,5 | 51 | 9,8 | 7,6 | 10,9 | 9,2 | 11,1 | 10,3 | 8,6 | 5,9 | 10 | 8,4 | 5,5 |
| 4 | 49 | 357.975 | 16 | 11,6 | 21 | 14,5 | 9,5 | 11,7 | 10,3 | 8,2 | 3,5 | 12 | 8,9 | 11,4 | 8,4 | 6,1 |
| 5 | 112 | 699.707 | 20 | 16,3 | 24 | 17,9 | 15,3 | 20,1 | 15,7 | 16,3 | 19,5 | 23,2 | 22,7 | 20,4 | 19,5 | 2,7 |
| 6 | 204 | 232.793 | 85 | 73,5 | 97 | 12,7 | 9,6 | 11,2 | 5,7 | 10,6 | 6,5 | 9,1 | 4 | 10,7 | 6,5 | 1,5 |
| 7 | 114 | 720.493 | 14 | 11,7 | 17 | 15,7 | 9,3 | 11,2 | 8,1 | 15 | 14 | 13 | 10 | 13,4 | 10,6 | 2,6 |
| 8 | 413 | 1.067.664 | 32 | 29,0 | 35 | 12 | 6,5 | 13,9 | 14,5 | 9,7 | 7,5 | 11,8 | 9,7 | 11,6 | 9,9 | 2,9 |
| 9 | 671 | 2.656.228 | 25 | 23,3 | 27 | 12,9 | 11,7 | 14,2 | 11,8 | 15,4 | 13,5 | 13,8 | 13,7 | 14,2 | 13,2 | 3,7 |
| 10 | 251 | 1.798.755 | 15 | 13,1 | 17 | 8,6 | 5,3 | 9,3 | 7,8 | 10,4 | 9,4 | 7,2 | 7,8 | 8,9 | 8,1 | 3,6 |
| 11 | 69 | 418.558 | 15 | 12,0 | 19 | 11,4 | 6,2 | 15 | 14,6 | 12,6 | 6,8 | 9,7 | 5,2 | 11,7 | 8,4 | 7,2 |
| 12 | 673 | 1.153.586 | 50 | 46,6 | 54 | 10,6 | 9,2 | 10,2 | 10,4 | 10,5 | 11,9 | 11,1 | 9,5 | 10,7 | 10,2 | 3,7 |
| 13 | 1.126 | 2.206.886 | 53 | 49,9 | 56 | 14,8 | 16,3 | 12,6 | 17 | 12,2 | 12,8 | 10,1 | 7,9 | 11,9 | 13 | 2,9 |
| 14 | 211 | 456.332 | 49 | 42,9 | 57 | 8,2 | 7,1 | 6 | 4,9 | 6,7 | 6,2 | 7,8 | 9,9 | 7,1 | 7,5 | 3,3 |
| 15* | 91 | 236.596 | 37 | 29,4 | 45 | 11 | 7,1 | 13,6 | 12,7 | 10,9 | 7,6 | 9,9 | 8,1 | 11 | 8,7 | 5,5 |
| 16* | 225 | 890.671 | 25 | 21,5 | 28 | 13,7 | 14,8 | 9,6 | 6,1 | 11,1 | 7,2 | 10,2 | 8,2 | 10,9 | 9,2 | 3,1 |
| Nacional | 5.454 | 16.708.405 | 33 | 31,8 | 34 | 13,1 | 12,5 | 12,1 | 12,6 | 11,9 | 11,3 | 11,3 | 10,6 | 11,9 | 11,5 | 3,6 |
|
DE: desviación estándar; EmH: estancia media hospitalaria (días); IC95%: intervalo de confianza del 95%; LI: límite inferior; LS: límite superior; TAVI: implante percutáneo de válvula aórtica; TI: tasa de implante. * Debido a las particularidades en la prestación del servicio en estas regiones, la tasa de implante puede desviarse respecto a la clínica habitual en ellas. Los valores de mortalidad más altos vienen dados por resultados negativos en los primeros años (por ejemplo: en la comunidad autónoma 3 se parte en 2014 del 16,7% y se llega en 2017 al 3,3%; en la 4: del 25% en 2014 al 7,4% en 2017; en la 11: del 14,3% en 2014 al 6,7% en 2017). En todos los casos se observó una tendencia claramente positiva en la reducción de la mortalidad asociada al procedimiento. |
||||||||||||||||
La mortalidad global en todo el periodo considerado fue del 3,6%, con un claro decremento entre 2014 (4,8%) y 2017 (2,7%), a pesar de que el perfil de gravedad asignado a los pacientes se mantuvo constante en los 4 años evaluados (el 70% presentaban un grado de GRD extremo).
Respecto a la duración del ingreso asociado al procedimiento, la EmH observada en 2014 fue de 13,1 ± 12,5 días, y disminuyó de forma progresiva hasta los 11,3 ± 10,6 días en 2017, con una gran variabilidad entre comunidades autónomas (tabla 1). Cuando se eliminaron los casos extremos (definidos como aquellos con duraciones por encima de 2 desviaciones estándar de la media), la estancia media nacional fue de 8,9 ± 4,69 días y las diferencias entre comunidades autónomas disminuyeron, oscilando entre 6,07 ± 4,8 y 11,35 ± 4,31 días (tabla 1).
Complicaciones asociadas al TAVI
La tabla 2 describe las complicaciones asociadas al TAVI. Igual que en la mortalidad, se observó una disminución progresiva en la incidencia de complicaciones más relevantes desde 2014 hasta 2017. La necesidad de MPP fue del 12,2%, también con gran variabilidad de esta complicación entre comunidades autónomas.
Tabla 2. Complicaciones asociadas al TAVI
| Complicación | Total | CIE-9-MC | 2014 | 2015 | CIE-10-ES | 2016 | 2017 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |||
| Complicación mecánica prótesis válvula cardiaca | 218 | 4 | 996.02 | 56 | 7,3 | 47 | 4 | T82.0*XA | 49 | 3,3 | 66 | 3,2 |
| Otra complicación implante de prótesis válvula cardiaca | 143 | 2,6 | 996.71 | 13 | 1,7 | 27 | 2,3 | T82.8*7A, T82.9XXA | 39 | 2,6 | 64 | 3,1 |
| Disección de aorta | 15 | 0,3 | 441 | 2 | 0,3 | 3 | 0,3 | I71.0* | 3 | 0,2 | 7 | 0,3 |
| Hemorragia o infarto cerebrovascular iatrogénico | 40 | 0,7 | 997.02 | 4 | 0,5 | 9 | 0,8 | I97.8*0 | 11 | 0,7 | 16 | 0,8 |
| Oclusión de arterias cerebrales | 46 | 0,8 | 434 | 8 | 1 | 11 | 0,9 | I66, I63.3, I63.4, I63.5 | 11 | 0,7 | 16 | 0,8 |
| Isquemia cerebral transitoria | 27 | 0,5 | 435 | 3 | 0,4 | 6 | 0,5 | G45*, I67.82 | 9 | 0,6 | 9 | 0,4 |
| Infarto agudo de miocardio | 87 | 1,6 | 410.*1 | 14 | 1,8 | 14 | 1,2 | I21* | 25 | 1,7 | 34 | 1,7 |
| Implante de marcapasos permanente | 663 | 12,2 | 37.8 | 146 | 19,1 | 149 | 12,7 | 5A1223Z | 155 | 10,5 | 213 | 10,4 |
| Fallo renal agudo | 441 | 8,1 | 584 | 74 | 9,7 | 90 | 7,7 | N17* | 119 | 8,1 | 158 | 7,7 |
| Shock posoperatorio | 55 | 1 | 998 | 10 | 1,3 | 14 | 1,2 | T81.1*XA | 16 | 1,1 | 15 | 0,7 |
| Hemorragia que complica un procedimiento | 314 | 5,8 | 998.11 | 54 | 7,1 | 63 | 5,4 | I97.4*, I97.6* | 90 | 6,1 | 107 | 5,2 |
| Punción o laceración accidental durante un procedimiento | 156 | 2,9 | 998.2 | 31 | 4,1 | 45 | 3,8 | I97.5* | 36 | 2,4 | 44 | 2,2 |
| Infección posoperatoria | 45 | 0,8 | 998.5 | 11 | 1,4 | 13 | 1,1 | T81.4XXA | 12 | 0,8 | 9 | 0,4 |
| Sepsis | 28 | 0,5 | 995.91, 995.92 | 6 | 0,8 | 6 | 0,5 | A41* | 8 | 0,5 | 8 | 0,4 |
|
TAVI: implante percutáneo de válvula aórtica. Códigos (CIE-10-ES): T82.0*XA Complicación mecánica de prótesis valvular cardiaca (contacto inicial); T82.8*7A Otras complicaciones especificadas de prótesis, implantes e injertos cardiacos y vasculares (contacto inicial); T82.9XXA Complicación no especificada de prótesis, implantes e injertos cardiacos y vasculares (contacto inicial); I71.0* Disección de aorta; I97.8*0 Otras complicaciones intraoperatorias y trastornos posprocedimiento del aparato circulatorio (cirugía cardiaca); I66 Oclusión y estenosis de las arterias cerebrales; I63.3 Infarto cerebral debido a trombosis de las arterias cerebrales; I63.4 Infarto cerebral debido a embolia de las arterias cerebrales; I63.5 Infarto cerebral debido a oclusión o estenosis no especificada de las arterias cerebrales; G45 Accidentes isquémicos cerebrales transitorios y síndromes relacionados; I67.82 Isquemia cerebral; I21 Infarto agudo de miocardio; 5A1223Z Implante de marcapasos permanente; N17 Fallo renal agudo; T81.1*XA Shock después de un procedimiento (contacto inicial); I97.4* Hemorragia y hematoma intraoperatorios de órgano o estructura de aparato circulatorio que complica un procedimiento; I97.6* Hemorragia, hematoma y seroma posprocedimiento de un órgano o estructura del aparato circulatorio después de un procedimiento; I97.5* Punción y desgarro accidentales de órgano o estructura del aparato circulatorio durante un procedimiento; T81.4XXA Infección después de un procedimiento (contacto inicial); A41 Sepsis. |
||||||||||||
Factores relacionados con el riesgo de mortalidad, estancia hospitalaria y complicaciones asociadas al TAVI
En la tabla 3 se describe el perfil de los casos atendidos y los resultados de los procedimientos en las regiones de alto y bajo volumen. Las comunidades autónomas de mayor volumen trataron a pacientes más añosos (80,47 frente a 81,91; p < 0,001) y con un índice de riesgo extremo ligeramente más bajo (70,3%, en las comunidades autónomas de bajo volumen frente al 67,1% en las de alto volumen; p = 0,013). En estas comunidades autónomas también se observó en la población intervenida una menor incidencia de comorbilidad, como diabetes, hipertensión arterial, insuficiencia cardiaca, enfermedad pulmonar obstructiva crónica o tabaquismo (tabla 3).
Tabla 3. Análisis comparativo entre comunidades autónomas de alto y bajo volumen de TAVI
| Bajo volumen (n = 3.002) | Alto volumen (n = 2.452) | p | |||
|---|---|---|---|---|---|
| Características del paciente | |||||
| Edad (años); media (DE) | 80,47 | 6,48 | 81,91 | 6,29 | < 0,001* |
| Grupo de edad (años); n (%) | |||||
| 50-74 | 455 | 15,2 | 275 | 11,2 | < 0,001* |
| 75-84 | 1.749 | 58,3 | 1.228 | 50,1 | |
| ≥ 85 | 798 | 26,6 | 949 | 38,7 | |
| Sexo (% mujeres), n (%) | 1.520 | 50,6 | 1.327 | 54,1 | 0,011* |
| Nivel de gravedad, n (%) | |||||
| Menor | 13 | 0,4 | 20 | 0,8 | 0,013* |
| Moderado | 44 | 1,5 | 18 | 0,7 | |
| Mayor | 835 | 27,8 | 768 | 31,3 | |
| Extremo | 2.110 | 70,3 | 1.646 | 67,1 | |
| Diabetes mellitus; n (%) | 1.059 | 35,3 | 706 | 28,8 | < 0,001* |
| Hipercolesterolemia; n (%) | 1.365 | 45,5 | 1.070 | 43,6 | 0,185 |
| Obesidad; n (%) | 381 | 12,7 | 273 | 11,1 | 0,085 |
| Hipertensión arterial; n (%) | 1.742 | 58,0 | 1.234 | 50,3 | < 0,001* |
| Fibrilación auricular; n (%) | 1.037 | 34,5 | 904 | 36,9 | 0,079 |
| Insuficiencia cardiaca; n (%) | 611 | 20,4 | 357 | 14,6 | < 0,001* |
| EPOC; n (%) | 330 | 11,0 | 207 | 8,4 | 0,002* |
| Insuficiencia renal crónica; n (%) | 634 | 21,1 | 482 | 19,7 | 0,194* |
| Tabaquismo; n (%) | 450 | 15,0 | 283 | 11,5 | < 0,001* |
| Uso de anticoagulantes; n (%) | 511 | 17,0 | 485 | 19,8 | 0,01* |
| Resultados del procedimiento | |||||
| Fallecimiento; n (%) | 113 | 3,8 | 81 | 3,3 | 0,401 |
| Estancia hospitalaria (días); media (DE) | 12,72 | 11,82 | 10,85 | 11,08 | < 0,001* |
| Punción/laceración; n (%) | 89 | 3,0 | 67 | 2,7 | 0,667 |
| Hemorragia que complica el procedimiento; n (%) | 156 | 5,2 | 158 | 6,4 | 0,056 |
| IAM; n (%) | 56 | 1,9 | 31 | 1,3 | 0,098 |
| Implante de marcapasos permanente; n (%) | 400 | 13,3 | 263 | 10,7 | 0,004* |
| Sepsis y eventos infecciosos; n (%) | 47 | 1,6 | 21 | 0,9 | 0,026 |
| Fallo renal agudo; n (%) | 215 | 7,2 | 226 | 9,2 | 0,007 |
| Accidente cerebrovascular; n (%) | 54 | 1,8 | 41 | 1,7 | 0,801 |
|
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio. * Diferencias estadísticamente significativas entre las comunidades autónomas de bajo y alto volumen. Alto volumen de implantes definido como tasa implante mayor que la mediana nacional de 37 implantes por 105 habitantes. Nivel de gravedad según la clasificación RAE-CMBD. |
|||||
Los resultados del procedimiento también variaron entre las comunidades autónomas de alto y bajo volumen: en las de alto volumen se observó una duración menor de la EmH y un menor riesgo de aparición de algunas complicaciones, como necesidad de MPP y sepsis o infecciones. Sin embargo, presentaron un riesgo mayor de fallo renal agudo en el análisis bivariante (tabla 3).
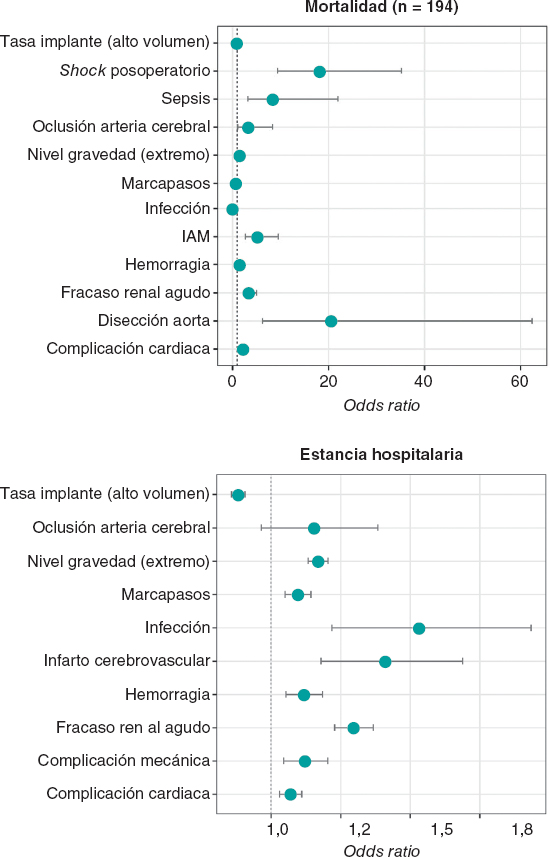
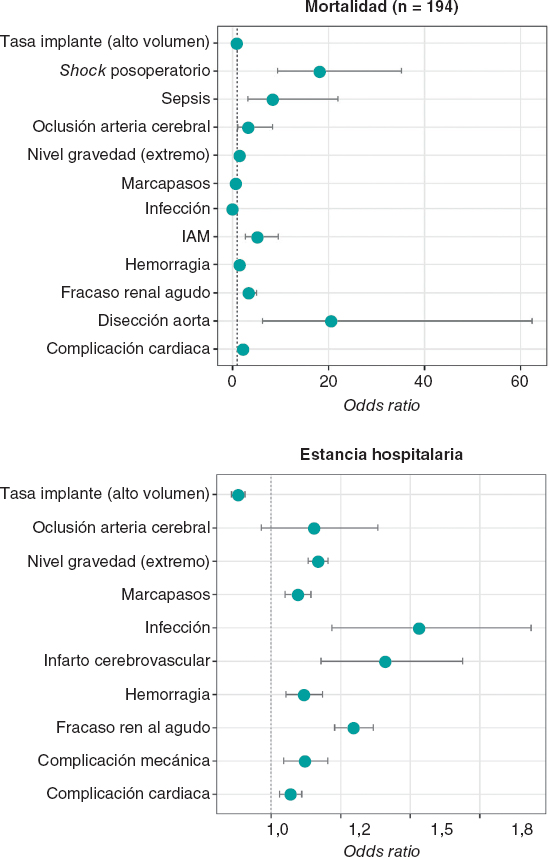
Debido a estas diferencias, la edad, el sexo y el nivel de gravedad de cada caso se consideraron en los modelos multivariantes programados para ajustar los análisis de las variables explicativas asociadas a la mortalidad hospitalaria. La figura 1 muestra que la disección de aorta (OR = 20,58; IC95%, 6,27-62,40; p < 0,01) y el shock posoperatorio (OR = 18,16; IC95%, 9,43-35,16; p < 0,01) se asociaron de manera significativa con la tasa de mortalidad tras la intervención. El peso explicativo de otras complicaciones, como el infarto agudo de miocardio, el fallo renal agudo, la oclusión arterial cerebral o las complicaciones cardiacas, fue significativamente menor. Las diferencias en mortalidad entre las comunidades autónomas de alto y bajo volumen no alcanzaron significación estadística en el conjunto del periodo analizado (figura 1).
Figura 1. Mortalidad y estancia hospitalaria registradas de acuerdo con las tasas de implante y de aparición de complicaciones en los procedimientos. Las figuras representan la influencia sobre cada complicación de las variables independientes seleccionadas en los modelos multivariados logísticos (mortalidad) o binomial negativa (estancia hospitalaria). Entre las variables candidatas siempre se consideraron el sexo, la edad, el volumen de implantes ajustado por región y el nivel de gravedad (RAE-CMBD). Los ejes en el plano de coordenadas varían debido a las magnitudes de las odds ratios presentadas. IAM: Infarto agudo de miocardio.
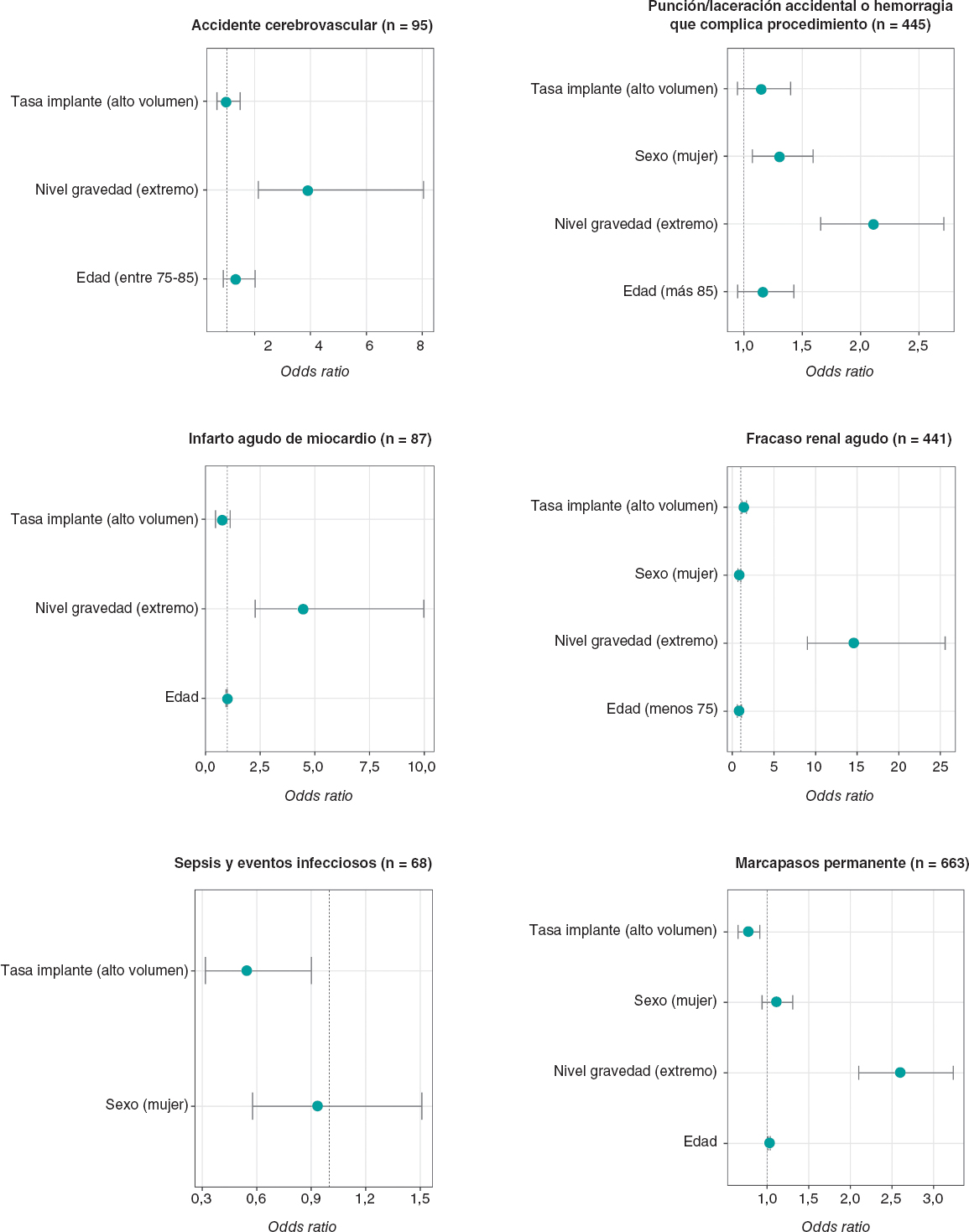
Por otra parte, la mayor gravedad de los casos y la aparición de algunas complicaciones contribuyeron a un aumento significativo de la duración de la EmH (figura 1). El grado de gravedad fue también el factor más fuertemente relacionado con la aparición de complicaciones como hemorragias y punción o laceración accidental, infarto agudo de miocardio, MPP, fallo renal agudo y accidente cerebrovascular (figura 2). En las comunidades autónomas de alto volumen, el riesgo de sepsis o infecciones y de requerir MPP fue significativamente inferior que en las de bajo volumen (OR = 0,77; IC95%, 0,65-0,91; p < 0,01, y OR = 0,54; IC95%, 0,32-0,9; p = 0.02, respectivamente). Finalmente, hay que indicar que las comunidades autónomas de alto volumen también presentaban una reducción significativa de la EmH, que era un 12% menor que en las de bajo volumen (OR = 0,88; IC95%, 0,86-0,91; p < 0,01), como se muestra en la figura 1.
Figura 2. Resultados del análisis de regresión logística sobre el riesgo de complicaciones clínicas. Las figuras representan la influencia sobre cada complicación de las variables independientes seleccionadas en los modelos multivariados (selección mediante algoritmo genético, siguiendo el criterio de información de Akaike). Entre las variables candidatas siempre se consideraron el sexo, la edad, el volumen de implantes ajustado por región y el nivel de gravedad (RAE-CMBD). Los ejes en el plano de coordenadas varían debido a las magnitudes de las odds ratios presentadas.
DISCUSIÓN
El principal hallazgo de nuestro estudio es que el implante transfemoral de una prótesis aórtica es efectivo y seguro en España. En segundo lugar, con el incremento del número de procedimientos realizados por año, y por tanto también de la experiencia obtenida, la tasa de complicaciones no mortales, así como la tasa de mortalidad (2,7% en el último año evaluado), se han ido reduciendo de manera progresiva.
Es indudable que el TAVI es un procedimiento seguro y efectivo, a juzgar también por la evidencia científica procedente de estudios clínicos12,13,19 y metanálisis20,21, y de ahí probablemente que su indicación se haya ampliado desde los pacientes inoperables a los de alto riesgo y luego a los de riesgo intermedio y bajo. El presente trabajo aporta evidencia basada en las fuentes propias del Ministerio de Sanidad, Consumo y Bienestar Social, con datos de la práctica asistencial real en nuestro país.
En España, tanto los datos del Registro Nacional de Actividad en Cardiología Intervencionista de la Sociedad Española de Cardiología, Sección de Hemodinámica y Cardiología Intervencionista22, como nuestros datos procedentes del RAE-CMBD, muestran un considerable aumento en todas las comunidades autónomas del número de casos tratados en el periodo 2014-201722. Aun así, en España la tasa de TAVI sigue siendo significativamente inferior a la de otros países14. Es importante destacar la mejora progresiva tanto de las tasas de mortalidad (reducción del 56,25% en el periodo considerado) como de las complicaciones no mortales, así como de la EmH. Y esto, a pesar de unos porcentajes elevados (en torno al 70%) de casos con gravedad extrema, según la codificación de casos en el RAE-CMBD.
Los datos no muestran diferencias importantes por sexo, a diferencia de trabajos previos que reflejaban un peor pronóstico en los varones tras el implante23. Los factores que efectivamente parecen asociados a un mayor riesgo de mortalidad son el shock posoperatorio, la sepsis, la disección de la aorta y el infarto de miocardio. En este caso, el índice de riesgo del paciente y el volumen de implante no se asocian claramente a una diferente tasa de mortalidad, lo que podría estar relacionado con la ganancia de experiencia en el procedimiento en el conjunto del país. En esta misma línea, también se ha descrito, con datos del CMBD, una mejora en la mortalidad tras la cirugía convencional de reemplazo valvular aórtico, que se situaba en 2017 en un 3,3% (3,6% en pacientes de 70-80 años y 4,3% en pacientes > 80 años)24.
La tasa de MPP encontrada fue comparable a la publicada por otros autores en nuestro país22. En este caso, la codificación de la gravedad de los casos intervenidos sí se asoció con un mayor riesgo. La necesidad de MPP tras el TAVI se ha asociado sobre todo al tipo de válvula utilizada (mayor con las autoexpandibles)25. En nuestro análisis no es posible diferenciar el tipo de válvula por no recogerse en la base de datos del RAE-CMBD. Tanto la necesidad de MPP posimplante como la aparición de procesos infecciosos y sepsis secundarios a la intervención se asociaron inversamente con un mayor volumen de intervenciones. Esta asociación entre volumen de procedimientos y reducción de las complicaciones ha sido muy señalada en diferentes contextos, como tras la revascularización coronaria26 o tras la cirugía convencional de reemplazo valvular aórtico24, entre otros.
Además de los beneficios clínicos, el TAVI se ha consolidado como una alternativa coste-eficaz respecto a la cirugía de sustitución valvular aórtica convencional. Que los resultados del procedimiento de TAVI hayan sido progresivamente más seguros y efectivos, con menor morbimortalidad y una reducción de la EmH, es probable que esté relacionado con el incremento de la experiencia de los cirujanos, con el volumen de procedimientos realizados y con los avances técnicos y tecnológicos acontecidos24.
El aumento de la población anciana en nuestro país y la expansión de las indicaciones son causa del aumento considerable en el número de pacientes candidatos a TAVI1,11. En este sentido, es importante sumar nuevas evidencias que contribuyan a la evaluación en términos de resultados de salud de estos procedimientos27, con el objeto de garantizar unos servicios de calidad homogénea en nuestro Sistema Nacional de Salud y dotar de mecanismos de evaluación a las líneas estratégicas definidas en salud cardiovascular28, ya que el TAVI se ha consolidado como una alternativa coste-eficaz respecto a la cirugía aórtica convencional29,30.
Limitaciones
El uso de una base de datos administrativa para obtener información tiene claras ventajas e inconvenientes. Por una parte, permite contar con gran parte del censo nacional, por su carácter de obligatoriedad de registro, y una alta estandarización de los datos, lo que es uno de los principales puntos fuertes27. Sin embargo, teniendo en cuenta que el RAE-CMBD es un registro administrativo cuyas variables clínicas se basan en el informe de alta, la exhaustividad de la codificación y las posibles inconsistencias entre los centros en cuanto a la aplicación de los códigos podrían influir en la precisión de los resultados. No obstante, como el periodo analizado es de 4 años, se podría inferir que no habría cambios sustanciales en la codificación que pudieran variar en gran medi- da los resultados. Aun así, se debe hacer constar que es posible que los códigos específicos de complicaciones de la CIE-9-MC no recojan todas las complicaciones que pueden acontecer duran- te un procedimiento de TAVI. A pesar de ello, en este trabajo se analizan todas las complicaciones de mayor significancia desde el punto de vista clínico para el análisis de los resultados de los procedimientos. Por otro lado, en el análisis que se ha llevado a cabo se han considerado los datos del RAE CMBD hasta 2017, los más recientes hasta el momento, y sería conveniente analizar los datos de los últimos años para ver la evolución de los resultados. Cabría esperar que estos fueran incluso mejores, considerando el aumento del volumen de intervenciones transcatéter, la mayor experiencia de los cirujanos y la mejora de la tecnología disponi- ble. Esta cuestión debe ser objeto de estudio en publicaciones posteriores.
Además de lo anterior, se debe indicar que la información que se recoge en este análisis proviene de procedimientos registrados en centros públicos o privados con actividad concertada, y por tanto pueden existir discrepancias con los datos publicados por el Registro Nacional de Actividad en Cardiología Intervencionista de la Sociedad Española de Cardiología, Sección de Hemodinámica y Cardiología Intervencionista, en términos absolutos22. Aun así, ambas fuentes apenas difieren en el porcentaje de casos que requieren MPP (diferencia total del 2% en 2016 y del 0,1% en 2017, siendo mayor el dato del Registro de la Sección de Hemodinámica y Cardiología Intervencionista).
Una última limitación del análisis reside en que solo se puede analizar el episodio en que se hace el implante y no hay posibilidad de obtener el resultado a largo plazo, lo cual aportaría información de gran valor para evaluar todo el alcance y el coste de la atención sanitaria. No obstante, los resultados del presente trabajo son de interés en la medida en que aportan información clave sobre aspectos que permiten abundar en la generación de argumentos de gestión asistencial de calidad.
CONCLUSIONES
El TAVI es un procedimiento seguro y efectivo, cuya realización está aumentando, aunque en España existe una gran variabilidad entre comunidades autónomas y hospitales. Es una intervención que se realiza fundamentalmente en pacientes mayores de 75 años, con unas cifras de morbimortalidad bajas y absolutamente comparables a las de la cirugía convencional, y que han ido disminuyendo en los 4 años analizados (2014-2017), con una reducción también progresiva de la EmH tras la intervención, en especial en las comunidades autónomas con mayor tasa de implante.
FINANCIACIÓN
El presente trabajo ha sido financiado por Edwards Lifesciences S.L.
CONTRIBUCIÓN DE LOS AUTORES
M. Álvarez-Bartolomé y J. Cuervo llevaron a cabo la validación de los datos y el tratamiento estadístico. Todos los autores contribuyeron al diseño del estudio, revisaron críticamente el manuscrito, dieron la aprobación final y se hacen responsables de todos los aspectos del trabajo, asegurando su integridad y exactitud.
CONFLICTO DE INTERESES
B. Martí-Sánchez es miembro de Edwards Lifesciences S.L., que ha financiado el presente trabajo. J. Cuervo es miembro de Axentiva Solutions, que recibió honorarios de consultoría científica de Edwards Lifesciences S.L.
¿QUÉ SE SABE DEL TEMA?
- La tasa de TAVI por vía transfemoral es significativamente menor en España que en el resto de los países europeos. Además, tras haber transcurrido más de una década desde el primer implante, aún hay poca evidencia sobre el uso y los resultados de este procedimiento en nuestro país.
¿QUÉ APORTA DE NUEVO?
- El estudio aporta información sólida y precisa sobre la seguridad, la efectividad y los resultados del uso de TAVI en la población española.
- Existe variabilidad interterritorial en el uso de TAVI, pero los resultados muestran una tasa de morbimortalidad baja y una disminución progresiva en la estancia media hospitalaria en el periodo considerado.
- La incidencia de complicaciones y la mortalidad parecen disminuir a medida que aumenta el número de procedimientos TAVI realizados.
- Una mayor tasa de implante se relacionó con una menor estancia hospitalaria y con menos riesgo de implante de marcapasos permanente y de infecciones durante el ingreso.
BIBLIOGRAFÍA
1. Ferreira-González I, Pinar-Sopena J, Ribera A, et al. Prevalence of calcific aortic valve disease in the elderly and associated risk factors:a population-based study in a Mediterranean area. Eur J Preventive Cardiol. 2013;20:1022-1030.
2. Salinas P, Moreno R, Calvo L, et al. Seguimiento a largo plazo tras implante percutáneo de válvula aórtica por estenosis aórtica grave. Rev Esp Cardiol. 2016;69:37-44.
3. Izquierdo-Gómez MM, Hernández-Betancor I, García-Niebla J, Marí-López B, Laynez-Cerdeña I, Lacalzada-Almeida J. Valve Calcification in Aortic Stenosis:Etiology and Diagnostic Imaging Techniques. BioMed Res Int. 2017;5178:1-12.
4. Stewart BF, Siscovick D, Lind BK, et al. Clinical Factors Associated With Calcific Aortic Valve Disease fn1fn1This study was supported in part by Contracts NO1-HC85079 through HC-850086 from the National Heart, Lung, and Blood Institute, National Institutes of Health, Bethesda, Maryland. J Am Coll Cardiol. 1997;29:630-634.
5. Ramaraj R, Sorrell VL. Degenerative aortic stenosis. BMJ. 2008;336:550-555.
6. Otto CM, Lind BK, Kitzman DW, Gersh BJ, Siscovick DS. Association of Aortic-Valve Sclerosis with Cardiovascular Mortality and Morbidity in the Elderly. N Engl J Med. 1999;341:142-147.
7. INE. Nota de prensa 20 de octubre de 2016. Proyecciones de Población 2016-2066. 2016;2066. Disponible en: https://www.ine.es/prensa/np994.pdf. Consultado 29 Jun 2020.
8. Thaden JJ, Nkomo VT, Enriquez-Sarano M. The Global Burden of Aortic Stenosis. Prog Cardiovasc Dis. 2014;56:565-571.
9. Leon MB, Smith CR, Mack M, et al. Transcatheter Aortic-Valve Implantation for Aortic Stenosis in Patients Who Cannot Undergo Surgery. N Engl J Med. 2010;363:1597-1607.
10. Duncan A, Ludman P, Banya W, et al. Long-term outcomes after transcatheter aortic valve replacement in high-risk patients with severe aortic stenosis:the U.K. Transcatheter Aortic Valve Implantation Registry. JACC Cardiovasc Interv. 2015;8:645-653.
11. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
12. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
13. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
14. Biagioni C, Tirado-Conte G, Nombela-Franco L, et al. Situación actual del implante transcatéter de válvula aórtica en España. Rev Esp Cardiol. 2017;70(Supl 1):6-8.
15. Ministerio de Sanidad, Consumo y Bienestar Social. Grupos Relacionados de Diagnóstico APR-GRD V32. Norma Estatal 2017;2019. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/docs/CMBD/Nota_difus_Norma_Estatal_2017.pdf. Consultado 3 Jul 2020.
16. Subdirección General de Información Sanitaria e Innovación. Ministerio de Sanidad, Servicios Sociales e Igualdad. Norma Estatal RAE-CMBD 2016 –NotaInformativa;2018. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/docs/CMBD/Nota_difus_Norma_Estatal_2016.pdf. Consultado 29 Jun 2020.
17. Instituto Nacional de Estadística. Tablas de Mortalidad por Año, Comunidades y Ciudades Autónomas, Sexo, Edad y Funciones. Disponible en: https://www.ine.es/jaxiT3/Tabla.htm?t=27154&L=0. Consultado 29 Jun 2020.
18. Calcagno V, de Mazancourt C. glmulti:An R Package for Easy Automated Model Selection with (Generalized) Linear Models. J Statistical Software. 2010;34:1-29.
19. Castrodeza J, Amat-Santos IJ, Blanco M, et al. Propensity score matched comparison of transcatheter aortic valve implantation versus conventional surgery in intermediate and low risk aortic stenosis patients:A hint of real-world. Cardiol J. 2016;23:541-551.
20. Sardar P, Kundu A, Chatterjee S, et al. Transcatheter versus surgical aortic valve replacement in intermediate-risk patients:Evidence from a meta-analysis. Catheter Cardiovasc Interv. 2017;90:504-515.
21. Khan SU, Lone AN, Saleem MA, Kaluski E. Transcatheter vs surgical aortic-valve replacement in low- to intermediate-surgical-risk candidates:A meta-analysis and systematic review. Clin Cardiol. 2017;40:974-981.
22. Sección de Hemodinámica y Cardiología Intervencionista. Sociedad Española de Cardiología. Registro Nacional de Actividad en Cardiología Intervencionista 2017;2018. Disponible en: https://www.hemodinamica.com/wp-content/uploads/2018/11/PRESENTACIO%CC%81N-DEFINITIVA-REGISTRO-2017.pdf. Consultado 27 Jun 2020.
23. European Society of Cardiology. Women less likely to die after TAVI than men. Published online 2013. Disponible en: https://www.escardio.org/The-ESC/Press-Office/Press-releases/Women-less-likely-to-die-after-TAVI-than-men. Consultado 29 Jun 2020.
24. Carnero-Alcázar M, Maroto-Castellanos LC, Hernández-Vaquero D, et al. Isolated aortic valve replacement in Spain:national trends in risks, valve types, and mortality from 1998 to 2017. Rev Esp Cardiol. 2021;74:700-707.
25. Deharo P, Bisson A, Herbert J, et al. Impact of Sapien 3 Balloon-Expandable Versus Evolut R Self-Expandable Transcatheter Aortic Valve Implantation in Patients With Aortic Stenosis:Data From a Nationwide Analysis. Circulation. 2020;141:260-268.
26. Goicolea Ruigómez FJ, Elola FJ, Durante-López A, Fernández Pérez C, Bernal JL, Macaya C. Coronary artery bypass grafting in Spain. Influence of procedural volume on outcomes. Rev Esp Cardiol. 2020;73:488-494.
27. Íñiguez Romo A, Bertomeu Martínez V, Rodríguez Padial L, et al. The RECALCAR Project. Healthcare in the Cardiology Units of the Spanish National Health System, 2011 to 2014. Rev Esp Cardiol. 2017;70:567-575.
28. Ministerio de Sanidad. El Ministerio de Sanidad traslada a las CCAA el borrador de la Estrategia en Salud Cardiovascular del SNS. Disponible en: https://www.mscbs.gob.es/gabinete/notasPrensa.do?id=4993. Consultado 20 Oct 2020.
29. Ribera A, Slof J, Andrea R, et al. Transfemoral transcatheter aortic valve replacement compared with surgical replacement in patients with severe aortic stenosis and comparable risk:Cost-utility and its determinants. International J Cardiol. 2015;182:321-328.
30. Baron SJ, Wang K, House JA, et al. Cost-Effectiveness of Transcatheter Versus Surgical Aortic Valve Replacement in Patients With Severe Aortic Stenosis at Intermediate Risk. Circulation. 2019;139:877-888.
RESUMEN
Introducción y objetivos: Entre las potenciales complicaciones del implante percutáneo de válvula aórtica (TAVI) se encuentran las complicaciones vasculares. Los dispositivos de sutura son los más utilizados para el cierre vascular, pero algunos sistemas de cierre con colágeno (MANTA, Essential Medical Inc., Estados Unidos) ofrecen una solución de rescate cuando los de sutura fallan. Para la correcta implantación de este dispositivo es necesario conocer la profundidad exacta de la arteria femoral antes de la inserción del introductor del TAVI. El objetivo de este estudio fue validar 2 técnicas diferentes de medida, la tomografía computarizada con multidetector (TCMD) y una técnica alternativa que emplea el dispositivo Angio-Seal (Terumo Medical Corporation, Estados Unidos), en comparación con el sistema específico de medida del dispositivo MANTA.
Métodos: En pacientes que recibieron TAVI, se midió la profundidad de la arteria femoral mediante TCMD antes y durante el procedimiento con un dispositivo Angio-Seal. Ambas medidas se correlacionaron con la real obtenida tras la punción mediante el medidor del dispositivo MANTA.
Resultados: En 168 pacientes a quienes se realizó TAVI transfemoral, se midió la profundidad de la arteria femoral antes y durante el procedimiento. La medida con TCMD previa al procedimiento mostró una correlación moderada con las medidas durante el procedimiento (r = 0,64; p < 0,001). La medida con el dispositivo Angio-Seal mostró una alta correlación con la herramienta de medición (r = 0,99; p < 0,001). En total, 10 pacientes necesitaron rescate con dispositivo MANTA por fracaso de los dispositivos de sutura.
Conclusiones: En caso de fracaso de los dispositivos de sutura tras TAVI, el dispositivo de tapón de colágeno MANTA puede actuar como técnica de rescate. Sin embargo, la medida antes del procedimiento obtenida con TCMD no es precisa para implantar correctamente el dispositivo MANTA. La medición con un dispositivo Angio-Seal antes de la inserción del introductor del TAVI puede ser una solución sencilla para conocer las medidas con exactitud y para la inserción de rescate de un dispositivo MANTA, cuando fracasan los dispositivos de cierre por sutura.
Palabras clave: TAVI. Transfemoral. Complicaciones en punto de acceso. Cierre vascular.
ABSTRACT
Introduction and objectives: Vascular complications remain a potential problem after transcatheter aortic valve implantation (TAVI). Although suture-based vascular closure devices are most often used for vascular closure purposes, alternative plug-based vascular closure devices like the MANTA (Essential Medical Inc., United States) stand as a bail-out option for patients with failed suture-based closure devices. Since knowing the exact vessel depth is essential to use this device correctly before inserting the large introducer, we aimed to validate 2 different measurement techniques including preoperative multidetector computer tomography (MDCT) plus an alternative technique with the Angio-Seal device (Terumo Medical Corporation, United States) compared to a vendor specific measuring tool.
Methods: In patients eligible for TAVI, the depth of the femoral artery was measured preoperatively using MDCT, and then perioperatively with the Angio-Seal device. Both measurements were associated with the actual depth after puncture using the vendor-specific tool of the MANTA device.
Results: In a total of 168 patients treated with transfemoral TAVI, the depth of the vessel was measured both pre and perioperatively. The measurements obtained from the preoperative MDCT revealed the existence of a moderate correlation compared to the preoperative measurements obtained (r = 0.64; P < .001). Measurements obtained with the Angio-Seal device revealed a high correlation with the measuring tool included (r = 0.99; P < .001). Overall, 10 patients required the bail-out option with the MANTA device due to failed suture-based vascular closure devices.
Conclusions: In case of a failed suture-based vascular closure device after TAVI, the plug-based MANTA device can be used as a bail-out strategy. However, the measurement of the vessel depth obtained from preoperative MDCTs is not accurate enough for safe MANTA insertions. Measurements with the Angio-Seal device before inserting the large TAVI sheath stand as a simple solution to obtain exact measurements facilitating the use of the bail-out MANTA in case of failed suture-based closure vascular devices after TAVI.
Keywords: TAVI. Transfemoral. Access site complication. Vascular closure.
Abreviaturas
TCMD: tomografía computarizada cardiaca multidetector. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
A pesar de la experiencia acumulada y de haber desarrollo de nuevos dispositivos de cierre, los índices de complicaciones vasculares tras un implante percutáneo de válvula aórtica (TAVI) siguen siendo altos (entre el 5% y el 18%)1-6. Recientemente, se ha presentado un nuevo dispositivo con tapón de colágeno. Se han descrito resultados favorables en el índice de complicaciones vasculares asociadas a este nuevo dispositivo MANTA de cierre vascular basado en un sistema de sellado con colágeno (Essential Medical Inc., Estados Unidos) comparado con los resultados de los dispositivos de cierre por sutura7-9. No obstante, debido a potenciales inconvenientes tales como más eventos hemorrágicos mayores (con índices que van del 1% hasta el 16%), a la escasez de datos sobre la futura accesibilidad de los vasos y a unos costes exorbitados, el uso rutinario de este nuevo dispositivo se ha puesto en duda comparado con los dispositivos de cierre por sutura7,10,11. Como los puntos de punción se pueden cerrar, de forma segura, con dispositivos de cierre por sutura, la nueva generación de sistemas basados en tapones puede convertirse en una valiosa alternativa, como estrategia de rescate, allá donde fracasan el cierre por sutura.
No obstante, uno de los inconvenientes de usar el sistema MANTA como dispositivo de rescate es que requiere conocer, con exactitud, la distancia existente entre la incisión cutánea y el vaso a efectos de una implantación y funcionalidad seguras previo a la inserción de una vaina introductora de gran calibre. Lamentablemente, la herramienta de medición específica del vendedor no se puede desplegar por separado, al menos hasta el momento de este estudio. Así pues, nuestro objetivo fue validar 2 técnicas alternativas de medición incluida la tomografía computarizada cardiaca multidetector (TCMD) y el dispositivo Angio-Seal previo a la inserción de una vaina introductora de gran calibre para obtener información relevante sobre la profundidad del vaso sin tener que desplegar el dispositivo.
MÉTODOS
Características de los pacientes y de la intervención
Los pacientes dieron su consentimiento al análisis retrospectivo y anónimo de los datos. Se incluyó a un total de 168 pacientes consecutivos con estenosis aórtica grave programados para recibir una intervención de TAVI. Todos los pacientes fueron evaluados por equipos multi e interdisciplinarios. A todos ellos se les realizó una TCMD como procedimiento estándar para preparar el TAVI. Todas las intervenciones se llevaron a cabo bajo anestesia local y en todos los casos se emplearon ambas arterias femorales. Una para la vaina del TAVI y la otra para el catéter pigtail para la angiografía más un catéter arterial de 7 Fr para monitorización hemodinámica. Se procedió al cierre rutinario con sendos dispositivos Proglide y Angio-Seal de 6 Fr para el lado TAVI más otro Angio-Seal de 6 Fr para el lado contralateral.
Medición de la profundidad del vaso
La profundidad del vaso se midió antes de la intervención con una TCMD en una pantalla dividida en 2 empleando el sistema de archivo radiológico PACS (Picture Archiving and Communication System). Las mediciones se obtuvieron perpendicularmente en todos los pacientes a nivel cutáneo, en dirección a la femoral y a mitad de la cabeza femoral (figura 1).
Figura 1. Técnica de medición de la profundidad del vaso a mitad de la cabeza femoral (25 mm + 10 mm = 35 mm de profundidad MANTA).
Antes de la intervención, se obtuvieron las medidas usando la vaina introductora de un dispositivo Angio-Seal de 6 Fr del siguiente modo. La vaina introductora llega hasta el vaso cuando sobreviene el sangrado a través del canal indicador de la vaina introductora (figura 2A). En esta posición, se anota la letra o punto en el exterior de la vaina introductora y se traduce en distancia empleando la representación esquemática que se muestra en la figura 2B y tabla 1. Siguiendo las instrucciones de uso del dispositivo de cierre vascular MANTA, hubo que añadir 1 cm. Después, se observó la profundidad de despliegue del dispositivo MANTA12.
Figura 2. A: medición de la profundidad del vaso igual a ‘O’. B: traducción en distancia usando el esquema que se muestra en la tabla 1 y que, finalmente, termina con una profundidad MANTA de 5,5 cm.
Tabla 1. Profundidad del vaso calculada con el dispositivo Angio-Seal. Al final, hubo que añadir 1 cm para poder emplear el dispositivo de rescate MANTA
| Angio-Seal | Profundidad del vaso (cm) |
|---|---|
| A | 0,5 |
| N | 1,5 |
| G | 2,5 |
| I | 3,5 |
| O | 4,5 |
| * | 5,5 |
| S | 6,5 |
| E | 7,5 |
| A | 8,5 |
| L | 9,5 |
Siguiendo todas estas medidas preventivas, se insertó 1 dispositivo de cierre por sutura Proglide y el TAVI pudo realizarse como de costumbre.
Cierre vascular
Durante el cierre, los operadores se marcaron objetivos de presión arterial sistólica < 160 mmHg. El uso de heparina y protamina se dejó a criterio del operador. La vaina de liberación se retiró empleando una guía in situ y el punto de acceso se cerró usando el sistema Proglide preparado y un dispositivo adicional Angio-Seal de 6 Fr. En caso de rotura del sistema de sutura preparado o en presencia de sangrado residual grave tras la inserción de la vaina introductora del Angio-Seal de 8 Fr, se procede a retirar la vaina del Angio-Seal sin implantar el tapón, a insertar el dispositivo de cierre vascular MANTA y, luego, a desplegarlo según la profundidad del vaso predefinida. La guía se retira después de la angiografía final para identificar cualquier posible complicación en el punto de acceso. El lado contralateral se cerró empleando un dispositivo Angio-Seal de 6 Fr.
Se administró una dosis de carga posoperatoria de 300 mg de clopidogrel salvo en aquellos pacientes que ya estaban a tratamiento con clopidogrel. Los pacientes a tratamiento anticoagulante oral tuvieron que interrumpir dicho tratamiento antes de recibir la intervención. Todos los operadores estaban familiarizados con los dispositivos de cierre vascular empleados.
Seguimiento posoperatorio
Se empleó vendaje compresivo en todos los pacientes, en el punto de punción, durante 6 horas y estos fueron monitorizados en una unidad de cuidados intermedios durante, al menos, 24 horas. Se documentaron la atención médica dispensada en el punto de punción por sangrado residual, así como todas las imágenes posoperatorias obtenidas mediante TCMD o ecografía dúplex hasta el alta hospitalaria.
Análisis estadístico
Las variables categóricas se expresaron como recuentos (porcentajes) y las continuas como medianas (rangos intercuartílicos). La correlación entre las distintas mediciones se calculó empleando el coeficiente de correlación de Spearman.
Los datos que avalan los hallazgos de este estudio están disponibles a través del autor para correspondencia mediante petición motivada.
RESULTADOS
Se incluyó a un total de 168 pacientes tratados de TAVI transfemoral. Estos eran pacientes TAVI habituales. Las características basales de los pacientes se muestran en la tabla 2.
Tabla 2. Características basales
| Características clínicas | n = 168 |
|---|---|
| Edad (años) | 83 [79,3-86,0] |
| Sexo (varón) (%) | 66 (39,0%) |
| Índice de masa corporal (kg/m2) | 26,9 [24,2-30,5] |
| NYHA ≥ III (%) | 144 (85,2) |
| Escala EuroSCORE I logístico (%) | 16,8 [12,2-22,8] |
| Hipertensión arterial (%) | 152 (89,9%) |
| Enfermedad coronaria (%) | 113 (66,8%) |
| e/p ICP (%) | 62 (36,6%) |
| e/p CABG (%) | 17 (10,1) |
| Fibrilación auricular (%) | 67 (39,6) |
| Hipertensión pulmonar (%) | 12 (7,1%) |
| Diabetes mellitus (%) | 59 (34,9%) |
| Enfermedad arterial periférica (%) | 29 (17,1%) |
| EPOC (%) | 34 (20,1%) |
| e/p accidente cerebrovascular (%) | 17 (10,1%) |
|
CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; e/p: estado post; ICP: intervención coronaria percutánea; NYHA: New York Heart Association. |
|
Las mediciones de las TCMD preoperatorias obtenidas de todos los pacientes revelaron la existencia de una correlación moderada comparado con las mediciones perioperatorias obtenidas con la herramienta de medición MANTA específica del vendedor (r = 0,64; p < 0,001; figura 3).
Figura 3. Correlación entre la profundidad del vaso medida en la tomografía computarizada con multidetector previa y en la herramienta de medición específica del vendedor. TC: tomografía computarizada.
Las mediciones obtenidas con el dispositivo Angio-Seal de todos los pacientes también fueron optimas, lo cual sugiere la existencia de una alta correlación con la herramienta de medición MANTA específica del vendedor (r = 0,99; p < 0,001).
El cierre vascular resultó un éxito en los 158 casos tratados con cierres estándar incluido el sistema de cierre por sutura Proglide y el dispositivo Angio-Seal de 6 Fr. El dispositivo de rescate MANTA se hizo necesario en 10 pacientes (5,9%) por la rotura de las suturas del Proglide (n = 5) o por la presencia de sangrado grave residual tras la inserción de la vaina introductora del Angio-Seal (n = 5). El dispositivo de cierre MANTA se insertó con éxito gracias a las mediciones obtenidas con el dispositivo Angio-Seal previo a la inserción de la vaina de gran calibre. Un total de 40 pacientes (23%) precisaron atención médica en el punto de punción, incluido vendaje compresivo prolongado, una TC o una ecografía dúplex. Un total de 7 pacientes (4,1%) precisaron cirugía posoperatoria en el punto de punción. Un paciente portador de un dispositivo de rescate MANTA sufrió una oclusión vascular completa por enfermedad oclusiva arterial conocida. Un total de 4 pacientes sufrieron un seudoaneurisma tras el uso rutinario del Proglide y el Angio-Seal que no se pudo tratar inyectando trombina.
DISCUSIÓN
Aunque el índice de complicaciones vasculares en el punto de acceso tras TAVI ha descendido durante los últimos años, estas complicaciones siguen estando asociadas a índices más altos de mortalidad y morbilidad2,3,6,13. En este contexto, dispositivos de cierre por sutura como el Prostar o el Proglide son herramientas seguras y efectivas que, además, se utilizan con frecuencia14. Aunque el uso del Prostar se asocia a un menor riesgo de estenosis vascular, el uso del Proglide acarrea índices más bajos de eventos adversos tales como mal funcionamiento del dispositivo o sangrados residuales2,13,15,16. No obstante, ambos sistemas se basan en una técnica de cierre por sutura parecida que requiere una cuidada preparación previa a la inserción de la vaina de liberación de gran calibre. Se debe mencionar que el uso seguro de estos dispositivos de cierre tras la inserción de vainas de liberación de gran calibre ya no es posible. Por eso, si fracasan los dispositivos de sutura y sobrevienen hemorragias graves, implantar un stent recubierto usando la técnica de cambio de vía de acceso vascular o cirugía para lograr la hemostasia puede ser la única opción válida llegados a este punto. Aunque implantar un stent recubierto es una opción terapéutica efectiva para controlar el sangrado, emplear la técnica de cambio de vía de acceso vascular puede ser todo un reto. Además, las femorales común e ilíaca externa se exponen a la flexión de la articulación de la cadera provocando una mayor compresión del stent y fracturas17-19. Además, el coste de un stent recubierto es alto.
Llegados a este punto, la cirugía debe ser el último recurso puesto que ha de llevarse a cabo bajo anestesia general y hay mucha pérdida de sangre hasta que se prepara la incisión quirúrgica. Además, se corre el riesgo de infección de la herida o fístulas linfáticas retrasando la vuelta a la movilidad del paciente tras el TAVI y pudiendo acarrear neumonía o trombosis.
Recientemente, el nuevo dispositivo de cierre vascular con tapón de colágeno MANTA ha irrumpido en el panorama médico hasta el punto de demostrar su perfil de seguridad y eficacia tras una intervención de TAVI. Las primeras publicaciones hablan de una hemostasia rápida e índices bajos de complicaciones tras el implante de uno de estos dispositivos, más bajos, incluso, que los de los dispositivos de cierre vascular Prostar y Proglide9. No obstante, un estudio clínico aleatorizado publicado recientemente ha arrojado resultados similares en lo que a las hemorragias en el punto de acceso se refiere comparado con el sistema Proglide. En cualquier caso, aunque el cierre por sutura suele requerir dispositivos de cierre adicionales como el Proglide o el Angio-Seal, numéricamente hablando, el MANTA precisa maniobras complejas como estrategias de stents recubiertos o de rescate quirúrgico. La razón podría ser el cruce de la guía a través del anclaje, al que ya no puede accederse con dispositivos adicionales como el Angio-Seal o el Proglide20.
El enorme coste de este dispositivo, 4 veces más caro que el Proglide, el, todavía, desconocido efecto que ejerce sobre la pared de la femoral y cuestiones relacionadas con nuevos accesos tras el implante del dispositivo han retrasado tanto su llegada al mercado como su uso habitual.
No obstante, si se opta por utilizar el dispositivo de cierre vascular MANTA es importantísimo medir con precisión la distancia existente entre piel y vaso para garantizar la liberación precisa del anclaje. Durante una intervención programada con el dispositivo MANTA, esta medición se obtiene, de manera rutinaria, previo a la inserción de la vaina introductora de gran calibre con un dispositivo dedicado de 8 Fr que viene con el dispositivo MANTA en el paquete estéril. Esta medición puede resultar muy ardua y dar valores inexactos si se toma después de insertar la vaina de gran calibre, dado el grado de sangrado asociado a este dispositivo. Así pues, analizamos 2 técnicas distintas para obtener este dato tan importante antes de insertar el dispositivo introductor de gran calibre sin tener que desembalar el dispositivo para prepararlo para un posible uso de rescate. Comparado con anteriores datos, demostramos que existe una correlación moderada en las mediciones obtenidas solo mediante TCMD preoperatorias que no son lo bastante buenas como para usar el dispositivo MANTA de forma segura21. Desplegar el sistema de forma imprecisa puede provocar la mala aposición del dispositivo con hemorragias mayores persistentes, sobre todo, en vasos pequeños o muy calcificados y hasta la oclusión total del vaso en cuestión. Esta imprecisión se explica por el menor ángulo descrito en la dirección de los puntos de sutura comparado con las mediciones perpendiculares obtenidas en la TCMD o por la desigual distribución o posición de un pliegue cutáneo en pacientes muy obesos tanto durante la TCMD como a lo largo de la intervención.
En cambio, las mediciones obtenidas con el dispositivo Angio-Seal seguidas de predefinición basada en imágenes de la correspondiente profundidad de implantación del dispositivo MANTA guardaban una estrecha relación con las mediciones obtenidas con el medidor del MANTA. Con esta información a nuestra disposición, la femoral se puede cerrar con todas las garantías tras el fracaso del sistema Proglide. El fracaso irresoluble del dispositivo de cierre por sutura con un Angio-Seal o Proglide adicionales por la presencia de hemorragias graves o rotura de las suturas sobreviene en el 5,9% de los pacientes. La inserción de rescate del dispositivo MANTA resultó exitosa en todos los pacientes. Solo 1 precisó cirugía por una oclusión vascular completa (grado de flujo TIMI 0) asociada al dispositivo MANTA. Volviendo la vista atrás, una TCMD previa había revelado la presencia de un vaso con un diámetro demasiado pequeño y calcificación de la pared vascular en el punto de punción. En estos pacientes, la vía de acceso elegida habría sido la incisión quirúrgica.
El método aquí presentado también es útil en otros escenarios clínicos sin TCMD previas en los que se usan vainas de gran calibre como en cierres tardíos tras oxigenación de urgencia con membrana extracorpórea o tras implantar dispositivos Impella (Abiomed Inc., Estados Unidos. En estos casos, se puede insertar una guía a través de la cánula arterial o del introductor del Impella CP y lograr un cierre vascular tardío, de forma segura, con el dispositivo de cierre vascular MANTA. Para no tener que desembalar el dispositivo estéril antes de proceder a la medición, se puede usar un dispositivo Angio-Seal, es rentable, apenas se tarda tiempo y facilita información para referencias futuras.
Limitaciones
Tanto la falta de aleatorización como el pequeño número de pacientes son limitaciones evidentes de este estudio que deben tenerse en cuenta a la hora de analizar los datospresentados.
CONCLUSIONES
Comparadas con las mediciones obtenidas mediante TCMD, las mediciones rutinarias de la profundidad del vaso obtenidas con el dispositivo Angio-Seal son una opción sencilla para obtener valores exactos que permitan un uso de rescate con el dispositivo MANTA ante el fracaso de un dispositivo de cierre por sutura tras el TAVI. Este método es también efectivo en casos de cierres vasculares tardíos de explantaciones tardías de dispositivos Impella o canulaciones de emergencia para oxigenación con membrana extracorpórea venoarterial.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
J. Blumenstein, T. Maruskin, O. Husser y H. Möllmann contribuyeron al diseño, análisis y redacción de este manuscrito. D. Sötemann, C. Eckel, C. Grothusen, G. Dohmen, C. Tesche y H. Al.Terki contribuyeron tanto a la redacción como a la supervisión del manuscrito.
CONFLICTO DE INTERESES
Ninguno de los autores ha declarado ningún conflicto de intereses con relación a este manuscrito y todos ellos han cumplido los requisitos y criterios establecidos por el Comité Internacional de Editores de Revistas Médicas en materia de autoría de artículos científicos.
¿QUÉ SE SABE DEL TEMA?
- El cierre vascular suele ser seguro cuando se emplean dispositivos de cierre por sutura post-TAVI. No obstante, si se rompen las suturas o si los cierres son insuficientes se puede dar lugar a complicaciones vasculares mayores. En estos casos, el cierre puede abordarse usando un dispositivo de sellado colagénico diferente (como por ejemplo el dispositivo Manta). No obstante, uno de los inconvenientes de este dispositivo es que requiere conocer, con precisión, la distancia existente entre la incisión cutánea y el vaso a efectos de una implantación y funcionalidad seguras previo a la inserción de una vaina introductora de gran calibre.
¿QUÉ APORTA DE NUEVO?
- Este estudio vino a demostrar que las TCMD preoperatorias obtuvieron mediciones inexactas de la profundidad del vaso. No obstante, se puede establecer una nueva técnica de medición con el dispositivo Angio-Seal antes de insertar una vaina introductora de gran calibre. Si los dispositivos de cierre por sutura fracasan, es necesario saber cuál es la profundidad exacta del vaso para poder usar el dispositivo Manta en situaciones de cierres de rescate. Esta técnica también resulta efectiva en casos de cierres vasculares tardíos de explantaciones tardías de dispositivos Impella o canulaciones de emergencia para oxigenación con membrana extracorpórea venoarterial.
BIBLIOGRAFÍA
1. Barbanti M, Binder RK, Freeman M, et al. Impact of low-profile sheaths on vascular complications during transfemoral transcatheter aortic valve replacement. EuroIntervention. 2013;9:929-935.
2. Barbash IM, Barbanti M, Webb J, et al. Comparison of vascular closure devices for access site closure after transfemoral aortic valve implantation. Eur Heart J. 2015;36:3370-3379.
3. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
4. Thourani VH, Kodali S, Makkar RR, et al. Transcatheter aortic valve replacement versus surgical valve replacement in intermediate-risk patients:a propensity score analysis. Lancet. 2016;387:2218-2225.
5. Toggweiler S, Leipsic J, Binder RK, et al. Management of vascular access in transcatheter aortic valve replacement:part 2:Vascular complications. JACC Cardiovasc Interv. 2013;6:767-776.
6. Van Mieghem NM, Tchetche D, Chieffo A, et al. Incidence, predictors, and implications of access site complications with transfemoral transcatheter aortic valve implantation. Am J Cardiol. 2012;110:1361-1367.
7. Biancari F, Romppanen H, Savontaus M, et al. MANTA versus ProGlide vascular closure devices in transfemoral transcatheter aortic valve implantation. Int J Cardiol. 2018;263:29-31.
8. Gheorghe L, Brouwer J, Mathijssen H, et al. Early Outcomes After Percutaneous Closure of Access Site in Transfemoral Transcatheter Valve Implantation Using the Novel Vascular Closure Device Collagen Plug-Based MANTA. Am J Cardiol. 2019;124:1265-1271.
9. Moriyama N, Lindstrom L, Laine M. Propensity-matched comparison of vascular closure devices after transcatheter aortic valve replacement using MANTA versus ProGlide. EuroIntervention. 2019;14:e1558-e1565.
10. Moccetti F, Brinkert M, Seelos R, et al. Insights From a Multidisciplinary Introduction of the MANTA Vascular Closure Device. JACC Cardiovasc Interv. 2019;12:1730-1736.
11. Hoffmann P, Al-Ani A, von Lueder T, et al. Access site complications after transfemoral aortic valve implantation - a comparison of MANTA and ProGlide. CVIR Endovasc. 2018;1:20.
12. Van Mieghem NM, Latib A, van der Heyden J, et al. Percutaneous Plug-Based Arteriotomy Closure Device for Large-Bore Access:A Multicenter Prospective Study. JACC Cardiovasc Interv. 2017;10:613-619.
13. Barbanti M, Capranzano P, Ohno Y, et al. Comparison of suture-based vascular closure devices in transfemoral transcatheter aortic valve implantation. EuroIntervention. 2015;11:690-697.
14. Toggweiler S, Leipsic J, Binder RK, et al. Management of vascular access in transcatheter aortic valve replacement:part 1:basic anatomy, imaging, sheaths, wires, and access routes. JACC Cardiovasc Interv. 2013;6:643-653.
15. Dimitriadis Z, Scholtz W, Borgermann J, Wiemer M, Piper C, Vlachojannis M, Gummert J, Horstkotte D, Ensminger S, Faber L, Scholtz S. Impact of closure devices on vascular complication and mortality rates in TAVI procedures. Int J Cardiol. 2017;241:133-137.
16. Giordano A, Corcione N, Ferraro P, et al. Comparison of ProGlide vs. Prostar in patients undergoing transcatheter aortic valve implantation. Minerva Cardioangiol. 2019;67:443-449.
17. Calligaro KD, Balraj P, Moudgill N, Rao A, Dougherty MJ, Eisenberg J. Results of polytetrafluoroethylene-covered nitinol stents crossing the inguinal ligament. J Vasc Surg. 2013;57:421-426.
18. De Backer O, Arnous S, Sandholt B, et al. Safety and efficacy of using the Viabahn endoprosthesis for percutaneous treatment of vascular access complications after transfemoral aortic valve implantation. Am J Cardiol. 2015;115:1123-1129.
19. Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG, Rutherford RB, Group TIW. Inter-society consensus for the management of peripheral arterial disease. Int Angiol. 2007;26:81-157.
20. van Wiechen MP, Tchetche D, Ooms JF, Hokken TW, Kroon H, Ziviello F, Ghattas A, Siddiqui S, Laperche C, Spitzer E, Daemen J, de Jaegere PP, Dumonteil N, Van Mieghem NM. Suture- or Plug-Based Large-Bore Arteriotomy Closure:A Pilot Randomized Controlled Trial. JACC Cardiovasc Interv. 2020.
21. Hassan MF, Lawrence M, Lee D, Velazco J, Martin C, Reddy R. Simplified percutaneous VA ECMO decannulation using the MANTA vascular closure device:Initial US experience. J Card Surg. 2020;35:217-221.
RESUMEN
Introducción y objetivos: Los nonagenarios son un grupo de edad en rápido crecimiento entre los pacientes cardiovasculares, en especial con estenosis aórtica, pero los datos sobre su pronóstico después de la implantación transcatéter de válvula aórtica (TAVI) son escasos. El objetivo de este estudio es analizar las características basales de los nonagenarios tratados con TAVI y determinar si la edad "65; 90 años está relacionada con un peor pronóstico en comparación con los pacientes no nonagenarios.
Métodos: Se incluyó a todos los pacientes "65; 75 años inscritos en el registro prospectivo multicéntrico español de TAVI entre 2009 y 2018. Se excluyó a aquellos < 75 años.
Resultados: Se inscribieron en el registro español de TAVI 8.073 pacientes "65; 75 años de 46 centros de España; 7.686 de > 75 a 90 años (95,2%) y 387 nonagenarios (4,79%). Se observó un aumento progresivo de los nonagenarios. El acceso transfemoral se utilizó en el 91,6% de los casos, predominantemente en los nonagenarios (91,4 frente a 95,1%; p = 0,01). Los nonagenarios tenían más probabilidades de morir durante la hospitalización (4,3 frente a 7,0%; p = 0,01). Sin embargo, no hubo diferencia en la tasa de mortalidad por cualquier causa al año de seguimiento (8,8 frente a 11,3%; p = 0,07). En el análisis multivariable, la edad "65; 90 años no se asoció de forma independiente con un aumento de la mortalidad por cualquier causa ajustada (HR = 1,37; IC95%, 0,91-1,97; p = 0,14). La creatinina basal y las complicaciones hemorrágicas intrahospitalarias se asociaron a un peor pronóstico a largo plazo en pacientes nonagenarios tratados con TAVI.
Conclusiones: Los nonagenarios son una población creciente y de muy alto riesgo, con estenosis aórtica grave, para quienes la TAVI podría representar una estrategia segura y efectiva. Una cuidadosa selección de los pacientes por un equipo multidisciplinario la máxima eficiencia en esta población, en la que la función renal basal y las complicaciones hemorrágicas pueden determinar el pronóstico a largo plazo tras la TAVI.
Palabras clave: TAVI. Estenosis aórtica. Nonagenarios. Ancianos.
ABSTRACT
Introduction and objectives: Nonagenarians are a fast-growing age group among cardiovascular patients, especially with aortic stenosis, but data about their prognosis after transcatheter aortic valve implantation (TAVI) is scarce. The objective of our study is to analyze the baseline characteristics of nonagenarians treated with TAVI and determine whether age "65; 90 years is associated with a worse prognosis compared to non-nonagenarian patients.
Methods: We included all patients "65;75 years enrolled in the multicenter prospective Spanish TAVI registry between 2009 and 2018. Patients < 75 years were excluded.
Results: A total of 8073 elderly patients ("65; 75 years) from 46 Spanish centers were enrolled in the Spanish TAVI registry; 7686 were between "65; 75 and < 90 years old (95.2%), and 387 were nonagenarian patients (4.79%). A gradual increase of nonagenarians was observed. The transfemoral access was used in 91.6% of the cases, predominantly among the nonagenarian patients (91.4% frente a 95.1%, P = .01). Nonagenarians were more likely to die during their hospital stay (4.3% frente a 7.0% among nonagenarians, P = .01). However, no difference was seen in the all-cause mortality rates reported at the 1-year follow-up (8.8% frente a 11.3%, P = .07). In the multivariate analysis, age "65; 90 years was not independently associated with a higher adjusted all-cause mortality rate (HR, 1.37, 95%CI, 0.91- 1.97, P = .14). The baseline creatinine levels, and the in-hospital bleeding complications were all associated with a worse long-term prognosis in nonagenarians treated with TAVI.
Conclusions: Nonagenarians are a very high-risk and growing population with severe AS in whom TAVI may be a safe and effective team is mandatory to achieve maximum efficiency in this population where baseline kidney function and bleeding complications may determine the long-term prognosis after TAVI.
Keywords: TAVI. Aortic stenosis. Nonagenarians. Elderly.
Abreviaturas
TAVI: implante transcatéter de válvula aórtica. EAo: estenosis aórtica. SVA: sustitución quirúrgica de válvula aórtica.
INTRODUCCIÓN
El desarrollo del implante transcateter de valvula aórtica (TAVI) ha sido todo un hito en el tratamiento de la estenosis aórtica (EAo) grave. Gracias a su abordaje mínimamente invasivo, el TAVI permite tratar a pacientes con EAo grave inoperables o de alto riesgo quirúrgico y mejorar su pronóstico y calidad de vida comparado con el tratamiento estándar y la sustitución quirúrgica de válvula aórtica (SVA), respectivamente1,2. Según los resultados de los estudios, los pacientes ancianos son los que más se benefician por su mayor riesgo quirúrgico. Teniendo en cuenta la actual tendencia hacia el envejecimiento poblacional3 en países desarrollados y la cada vez mayor prevalencia de la EAo grave correspondiente4 parece razonable esperar que el número de pacientes mayores con EAo grave que precisen tratamiento con TAVI en las próximas décadas vaya en aumento. En este sentido, los nonagenarios constituyen un segmento poblacional de alto riesgo y rápido crecimiento sobre quienes no se tienen demasiados datos sobre los resultados específicos del TAVI. Debido a su corta esperanza de vida y elevada carga de comorbilidades, el TAVI puede ser una opción excelente para ellos. No obstante, se debe subrayar que el coste absoluto de TAVI es alto5. Así pues, hay una necesidad todavía no satisfecha de datos del mundo real antes de poder valorar el impacto de esta cara y beneficiosa técnica en una población de alto riesgo y en aumento como la de los nonagenarios. A tal fin, el objetivo de nuestro estudio fue describir las características basales, valorar los resultados clínicos e identificar las características de futilidad de este subgrupo de pacientes de alto riesgo en base a los resultados obtenidos en el registro español TAVI6.
MÉTODOS
Selección de pacientes y seguimiento
Se trata de un registro prospectivo y multicéntrico que incluyó a todos los pacientes consecutivos con EAo grave tratados mediante TAVI en 46 centros españoles (ver tabla 1 del material adicional). Este registro español TAVI está auspiciado por la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología. A efectos de nuestro análisis, se incluyó a todos los pacientes "65; 75 años del registro español TAVI entre 2009 y 2018. Los pacientes < 75 años fueron excluidos. Se registraron las características basales, los hallazgos ecocardiográficos y los resultados de la intervención. El protocolo de seguimiento incluyó una consulta médica al cabo de 30 días y 1 año del alta hospitalaria. El registro cumple con la legislación vigente española en materia de protección de datos y ha sido aprobado por un comité de ética. La participación de cada centro en este registro fue voluntaria y todos los participantes dieron su consentimiento informado. Todos los datos se incluyeron en el estudio prospectiva y sistemáticamente mientras se buscaron posibles inconsistencias o falta de datos. Los datos recopilados incluyeron las características demográficas de los pacientes, su historia clínica, las características clínicas basales, los hallazgos ecocardiográficos, las características de la intervención, los resultados clínicos intrahospitalarios y durante el seguimiento.
Tabla 1. Características clínicas
| Variable | Todos los pacientes (n = 8.073) | Ancianos < 90 años (n = 7.686) | Nonagenarios (n = 387) | p |
|---|---|---|---|---|
| Demográfica | ||||
| Edad, años | 82,9 ± 4,01 | 82,6 ± 3,66 | 91,1 ± 1,29 | < 0,001 |
| Mujeres | 4.476 (55,5%) | 4.250 (55,3%) | 226 (58,4%) | 0,23 |
| Índice de masa corporal (kg/m2) | 27,8 ± 4,60 | 27,9 ± 4,70 | 26,3 ± 4,20 | < 0,001 |
| Historia clínica | ||||
| Hipertensión | 6.572 (82,9%) | 6.259 (83,0%) | 313 (81,9%) | 0,59 |
| Hiperlipemia | 4.502 (59,7%) | 4.313 (59,2%) | 189 (49,7%) | < 0,001 |
| Diabetes mellitus | 2.660 (34,5%) | 2.586 (35,3%) | 74 (19,3%) | < 0,001 |
| Fumador | 1.254 (20,4%) | 1.207 (20,6%) | 47 (15,9%) | 0,05 |
| Enfermedad arterial Periférica | 972 (12,9%) | 943 (13,2%) | 29 (8,4%) | 0,01 |
| Insuficiencia renal crónica | ||||
| Hemodiálisis | 98 (1,4) | 98 (1,5) | 0 | 0,02 |
| Tasa basal de filtrado glomerular estimado (ml/min) | 54,0 ± 27 | 54,5 ± 27 | 44,5 ± 21 | < 0,001 |
| Antecedentes de tabaquismo | 847 (11,1%) | 805 (11,1%) | 42 (11,1%) | 0,99 |
| Enfermedad cardiovascular | ||||
| Cardiopatía isquémica previa | 4.553 (57,9%) | 4.346 (59,9%) | 207 (55,3%) | 0,08 |
| Infarto de miocardio previo | 935 (12,6%) | 904 (12,8%) | 31 (8,8%) | 0,03 |
| Intervención coronaria percutánea previa | 1.563 (20,6%) | 1.508 (20,9%) | 55 (14,9%) | 0,006 |
| Intervención coronaria percutánea 1 mes antes | 1.888 (24,8%) | 1.816 (25,0%) | 72 (19,5%) | 0,02 |
| Cirugía de revascularización coronaria previa | 539 (7,30%) | 536 (7,6%) | 3 (0,9%) | < 0,001 |
| Cirugía de reparación valvular previa | ||||
| Aórtica | 227 (2,9%) | 223 (3,0%) | 4 (1,1%) | 0,03 |
| Mitral | 115 (1,5%) | 113 (1,5%) | 2 (0,5%) | 0,12 |
| Fibrilación auricular | 2.169 (27,9%) | 2.075 (28,1%) | 94 (24,9%) | 0,19 |
| Implante previo de marcapasos o DAI | 582 (7,50%) | 552 (7,50%) | 30 (8,00%) | 0,73 |
| Escalas de riesgo | ||||
| EuroSCORE logístico, % | 16,72 ± 11,6 | 16,54 ± 11,6 | 20,31 ± 11,9 | < 0,001 |
| Síntoma de presentación | ||||
| Angina | 578 (7,30%) | 559 (7,40%) | 19 (4,90%) | 0,06 |
| Disnea | 5.000 (67,0%) | 4.730 (66,7%) | 270 (72,4%) | 0,02 |
| Características ecocardiográficas | ||||
| FEVI, % | 57,4 ± 15,4 | 57,4 ± 15,5 | 58,8 ± 11,8 | 0,47 |
| Gradiente medio, mmHg | 48,2 ± 15,0 | 48,1 ± 14,9 | 51,0 ± 15,1 | < 0,001 |
| Gradiente máximo, mmHg | 78,9 ± 22,9 | 78,7 ± 22,8 | 83,8 ± 23,0 | < 0,001 |
| Área valvular aórtica, cm2 | 0,66 ± 0,2 | 0,66 ± 0,2 | 0,62 ± 0,2 | 0,06 |
| Insuficiencia mitral moderada o grave | 469 (6,9%) | 444 (6,9%) | 25 (7,8%) | 0,57 |
| Insuficiencia aórtica moderada o grave | 151 (3,1%) | 143 (3,0%) | 8 (3,3%) | 0,79 |
| Presión sistólica arterial pulmonar, mmHg | 46,55 ± 18,0 | 46,24 ± 13,6 | 46,56± 18,2 | 0,83 |
| Diámetro del anillo aórtico, mm | 23,90 ± 2,8 | 23,07 ± 2,8 | 22,70± 2,7 | 0,08 |
| Indicación para TAVI | 0,10 | |||
| Contraindicación | 1.656 (29,3%) | 1.584 (29,5%) | 72 (25,3%) | |
| Alto riesgo | 2.379 (42,0%) | 2.242 (41,7%) | 137 (48,1%) | |
| Riesgo intermedio | 1.626 (28,7%) | 1.550 (28,8%) | 76 (26,7%) | |
|
DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; TAVI: implante transcatéter de válvula aórtica. Los datos expresan n (%) o media ± desviación estándar. |
||||
Objetivos del estudio y definiciones
Se emplearon definiciones estándar de todas las variables asociadas a los pacientes, así como de los diagnósticos clínicos, complicaciones y resultados intrahospitalarios según las definiciones del Valve Academic Research Consortium (VARC)7,8. El objetivo primario fue la mortalidad por cualquier causa sobrevenida durante el primer año tras el TAVI entre nonagenarios y pacientes ancianos no nonagenarios. Asimismo, se llevó a cabo una comparativa entre los índices de mortalidad intrahospitalaria, accidente cerebrovascular, infarto de miocardio, hemorragias mayores o amenazantes para la vida definidos según los criterios del VARC8,9 e implante de marcapasos permanente. El riesgo quirúrgico alto se definió como valores > 20% en la escala logística EuroSCORE o valores > 8% en el modelo predictivo de riesgo de la Society of Thoracic Surgeons (STS). También se analizaron, en la cohorte general, los índices de mortalidad ajustados y no ajustados a corto (intrahospitalarios) y largo plazo (durante el primer año tras TAVI).
Análisis estadístico
Las variables categóricas se expresaron como frecuencias (porcentajes) y las diferencias se analizaron empleando la prueba de la χ2 (o la prueba exacta de Fisher si fuera necesario). Las variables continuas se expresaron como media ± desviación estándar o como mediana (rango intercuartil). La prueba de Kolmogorov-Smirnov se usó para garantizar una distribución normal de las variables. Las variables continuas se compararon empleando el análisis de varianza (ANOVA) o la prueba de Kruskal-Wallis cuando fuese necesario. Con todos los datos de seguimiento disponibles se dibujaron las curvas de supervivencia para las variables de tiempo hasta el evento de interés con ayuda del método de Kaplan-Meier. El modelo multivariado de regresión de riesgos proporcionales de Cox se usó para identificar los predictores independientes de mortalidad por cualquier causa entre la cohorte general durante el primer año. El supuesto de riesgos proporcionales se analizó mediante gráficas log-log. Además, los modelos de riesgo proporcional de Cox para el objetivo primario vinieron a satisfacer el supuesto de riesgos proporcionales. En todos los análisis, valores de p bilateral < 0,05 se consideraron significativos a nivel estadístico. El seguimiento se programó para que finalizase el día del último seguimiento o al cabo de 1 año, lo que sucediese primero. Los análisis se realizaron con el software de análisis estadístico IBM SPSS (V 19.0, IBM, Estados Unidos).
RESULTADOS
Características basales y ecocardiográficas
Entre enero de 2012 y diciembre de 2018, se incluyó a un total de 8.073 pacientes ancianos ("65; 75 años) de 46 centros españoles en el registro español TAVI; 7.686 (95,2%) eran pacientes ancianos no nonagenarios ("65; 75- < 90 años) y 387 (4,79%) pacientes nonagenarios ("65; 90 años). Las características basales de los pacientes se muestran en la tabla 1. La edad media ± desviación estándar del grupo de pacientes no nonagenarios eran 82,6 ± 3,66 años (91,06 ± 1,29 años en el grupo de los nonagenarios). Las mujeres eran predominantes en ambos grupos (55,3 frente a 58,4% en el grupo de los nonagenarios; p = 0,23), entre quienes la diabetes mellitus, la enfermedad arterial periférica o el infarto de miocardio previo eran menos prevalentes. Por otro lado, tenían una tasa basal más baja de filtrado glomerular estimada y puntuaciones más altas en el modelo EuroSCORE I. No se observaron diferencias en las indicaciones TAVI entre los 2 grupos. La figura 1 muestra el número y porcentaje de nonagenarios tratados de TAVI a lo largo de los años. En términos absolutos, se observa un incremento paulatino de nonagenarios desde los 11 pacientes descritos en 2011 hasta los 78 de 2018.
Figura 1. Número absoluto y porcentaje de nonagenarios tratados de TAVI a lo largo de los años. Tanto el gráfico de barras como la gráfica lineal, respectivamente, expresan el número e índice de pacientes nonagenarios con estenosis aórtica grave tratados de TAVI entre 2009 y 2018. TAVI: implante transcatéter de válvula aórtica.
Características de la intervención
Tanto los hallazgos ecocardiográficos de TAVI posimplante como las características de la intervención se muestran en la tabla 2. El abordaje transfemoral se usó en el 91,6% de los casos, principalmente entre los nonagenarios (91,4 frente a 95,1%; p = 0,01). No hubo ninguna diferencia en el tipo ni en el tamaño de las prótesis valvulares empleadas. El éxito del implante que se logró en ambos grupos fue alto (94,9 frente a 95,6%; p = 0,55).
Tabla 2. Características de la intervención
| Variable | Todos los pacientes (n = 8.073) | Ancianos < 90 años (n = 7.686) | Nonagenarios (n = 387) | p |
|---|---|---|---|---|
| Características de la intervención | ||||
| Válvula de balón expandible | 3.663 (45,7%) | 3.477 (45,6%) | 186 (48,1%) | 0,34 |
| Válvula autoexpandible | 4.356 (54,3%) | 4.155 (54,4%) | 201 (51,9%) | |
| Tamaño de la válvula | 0,82 | |||
| < 23 | 2.126 (28,3%) | 2.017 (28,3%) | 109 (29,1%) | |
| 24-28 | 3.146 (41,9%) | 2.987 (41,9%) | 159 (42,5%) | |
| < 29 | 2.236 (29,8%) | 2.130 (29,9%) | 106 (28,3%) | |
| Abordaje transfemoral | 7.360 (91,6%) | 6.993 (91,4%) | 367 (95,1%) | 0,01 |
| Predilatación | 2.617 (49,9%) | 2.508 (50,2%) | 109 (44,0%) | 0,06 |
| Posdilatación | 1.671 (22,4%) | 1.593 (22,3%) | 78 (22,7%) | 0,86 |
| Índice de éxito del implante del dispositivo | 7.666 (95,0%) | 7.296 (94,9%) | 370 (95,6%) | 0,55 |
| Duración de la intervención, min | 104,2 ± 48 | 103,9 ± 48 | 109,7 ± 51 | 0,05 |
| Características ecocardiográficas post-TAVI | ||||
| Gradiente medio, mmHg | 10,1 ± 5,5 | 10,1 ± 5,5 | 9,5 ± 4,3 | 0,18 |
| Gradiente máximo, mmHg | 18,9 ± 9,9 | 18,9 ± 10,0 | 18,0 ± 8,3 | 0,14 |
|
FEVI: fracción de eyección del ventrículo izquierdo; TAVI: implante transcatéter de válvula aórtica. Los datos expresan n (%) o media ± desviación estándar. |
||||
Resultados clínicos
La tabla 3 muestra una comparativa de los resultados clínicos obtenidos entre el grupo de no nonagenarios y el de nonagenarios. Comparados con los primeros, los nonagenarios eran más propensos a fallecer durante la hospitalización (4,3 frente a 7,0% entre los no nonagenarios; p = 0,01) y a presentar hemorragias mayores o amenazantes para la vida (1,2 frente a 3,1%; p < 0,05). No se observaron diferencias en los índices de accidente cerebrovascular, infarto de miocardio, complicaciones vasculares, implante de marcapasos permanente o daño renal agudo. La mediana de seguimiento fue 308 días (31-365). Tras 1 año de seguimiento, fallecieron un total de 719 pacientes (8,9%). El riesgo no ajustado de mortalidad por cualquier causa al cabo de 1 año fue similar entre nonagenarios y no nonagenarios (8,8 frente a 11,6%; p = 0,07) (figura 2).
| Variable | Todos los pacientes (n = 8.073) | Ancianos < 90 años (n = 7.686) | Nonagenarios (n = 387) | p |
|---|---|---|---|---|
| Intervención | ||||
| Conversión a cirugía abierta | 54 (0,7%) | 51 (0,7%) | 3 (0,8%) | 0,74 |
| Intrahospitalaria | ||||
| Muerte | 357 (4,4%) | 330 (4,3%) | 27 (7,0%) | 0,01 |
| Accidente cerebrovascular | 148 (1,8%) | 144 (1,9%) | 4 (1,0%) | 0,23 |
| Infarto de miocardio | 99 (1,2%) | 94 (1,2%) | 5 (1,3%) | 0,81 |
| Complicación vascular | 976 (12,1%) | 919 (12,0%) | 57 (14,7%) | 0,10 |
| Hemorragias mayores/amenazantes para la vida | 108 (1,3%) | 96 (1,2%) | 12 (3,1%) | 0,002 |
| Implante de marcapasos permanente | 1.213 (15,0%) | 1.155 (15,0%) | 58 (15,0%) | 0,98 |
| DRA > 1 | 466 (5,8%) | 440 (5,5%) | 26 (6,7%) | 0,41 |
| Seguimiento | ||||
| Mediana de seguimiento a 1 año | 308 (31-365) | 306 (31-365) | 362 (19-365) | 0,60 |
| Incidencia de mortalidad por cualquier causa a 1 año | 719 (8,9%) | 674 (8,8%) | 45 (11,6%) | 0,072 |
|
DRA: daño renal agudo. Los datos expresan n (%) o media ± desviación estándar. |
||||
Figura 2. Curvas de supervivencia de Kaplan-Meier tanto para la mortalidad por cualquier causa al cabo de 1 año como para los índices de supervivencia. HR, hazard ratio; IC95%: intervalo de confianza del 95%.
Los modelos multivariados de riesgo proporcional de Cox identificaron, en la cohorte, a los predictores independientes de mortalidad por cualquier causa (tabla 4). La edad "65; 90 años no se asoció independientemente a una incidencia ajustada de mortalidad por cualquier causa más alta (hazard ratio [HR], 1,37; intervalo de confianza del 95% [IC95%], 0,91- 1,97; p = 0,14), Los niveles basales de creatinina previos a la intervención (HR = 1,28; IC95%, 1,15- 1,44; p < 0,001), la disnea como síntoma predominante de la EAo grave (HR = 1,49, IC95% 1,14- 1,3, p < 0,01), la valoración del riesgo quirúrgico como alto o inoperable (HR = 1,34; IC95%, 1,01- 1,79; p = 0,04) y la fibrilación auricular (HR = 1,37; IC95%, 1,09- 1,73; p = 0,008) se asociaron independientemente a una incidencia ajustada más alta de mortalidad por cualquier causa. Por otro lado, el índice de masa corporal (HR = 0,97; IC95%, 0,95-0,99; p = 0,02), el uso del abordaje femoral (HR = 0,68; IC95%, 0,51- 0,92; p = 0,02) y el índice de éxito del implante del dispositivo (HR = 0,18; IC95%, 0,13- 0,23; p < 0,001) se asociaron a una incidencia ajustada más baja de mortalidad por cualquier causa en el seguimiento.
Tabla 4. Predictores independientes de la mortalidad por cualquier causa
| Variable | Análisis univariado | Análisis multivariado | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad "65; 90 años | 1,59 (1,16-2,18) | 0,007 | 1,37 (0,91 – 1,97) | 0,14 |
| Mujeres | 0,94 (0,80-1,11) | 0,49 | – | – |
| Índice de masa corporal (kg/m2) | 0,97 (0,95-0,98) | < 0,001 | 0,97 (0,95-0,99) | 0,02 |
| Enfermedad vascular periférica | 1,34 (1,07-1,68) | 0,06 | – | – |
| Niveles basales de creatinina (ml/min) | 1,22 (1,11-1,34) | < 0,001 | 1,28 (1,15-1,44) | < 0,001 |
| Fibrilación auricular | 1,28 (1,07-1,52) | 0,008 | 1,37 (1,09-1,73) | 0,008 |
| Marcapasos o DAI previo | 0,70 (0,49-1,01) | 0,05 | – | – |
| FEVI, % | 0,99 (0,98-0,99) | 0,007 | – | – |
| Insuficiencia mitral moderada o grave | 1,39 (1,02-1,89) | 0,05 | – | – |
| Insuficiencia aórtica moderada o grave | 1,49 (0,88-2,56) | 0,16 | ||
| Disnea | 1,26 (1,04-1,52) | 0,02 | 1,49 (1,14-1,93) | 0,002 |
| Riesgo alto/inoperable | 1,57 (1,23-2,00) | < 0,001 | 1,34 (1,01-1,79) | 0,04 |
| Abordaje transfemoral | 0,61 (0,48-0,78) | < 0,001 | 0,68 (0,51-0,92) | 0,02 |
| Índice de éxito del implante del dispositivo | 0,19 (0,15-0,23) | < 0,001 | 0,18 (0,13-0,23) | < 0,001 |
|
DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%. Tanto los hazard ratios como sus intervalos de confianza del 95% se calcularon mediante un análisis multivariado de regresión de Cox. |
||||
La tabla 2 del material adicional muestra las diferencias en las características basales, hallazgos ecocardiográficos y características de la intervención entre los pacientes nonagenarios que fallecieron durante el seguimiento y los que no. Los nonagenarios que fallecieron tras la intervención de TAVI presentaban niveles basales más altos de creatinina (1,16 ± 0,42 frente a 1,34 ± 0,56; p = 0,02) y también más complicaciones intrahospitalarias: complicaciones vasculares (12,2 frente a 35,7%; p = 0,001), hemorragias graves o amenazantes para la vida (0,9 frente a 21,4%; p < 0,001) y daño renal agudo (5,2 frente a 19,0%; p = 0,004).
DISCUSIÓN
Nuestro estudio llegó a 3 conclusiones principalmente. En primer lugar, el número absoluto de nonagenarios tratados de TAVI ha ido en aumento con el paso del tiempo. En segundo lugar, la edad "65; 90 años no se asoció independientemente a una incidencia ajustada más alta de mortalidad por cualquier causa. En tercer lugar, tanto la función renal basal como las complicaciones intrahospitalarias están asociadas al pronóstico de pacientes nonagenarios tratados con TAVI.
El número de nonagenarios tratados con TAVI ha aumentado paulatinamente con el tiempo
La estenosis aórtica es una enfermedad cardiovascular progresiva que si no se trata tiene mal pronóstico pocos años después de la aparición de los síntomas. La sustitución quirúrgica de válvula aórtica (SVA) es el único tratamiento efectivo de la EAo grave desde hace años. Esto ha condicionado que un porcentaje alto de pacientes con EAo grave hayan quedado sin tratamiento porque los riesgos que conlleva esta intervención quirúrgica sobrepasan sus posibles beneficios. Durante los últimos años, el desarrollo de la intervención de TAVI mínimamente invasiva ha cambiado, radicalmente, el proceso de toma de decisiones con respecto a las intervenciones valvulares10. Presentada inicialmente como terapia ’de rescate’ para pacientes inoperables con EAo grave, el TAVI es en la actualidad una opción viable para pacientes de riesgo alto e intermedio11, lo cual amplía el espectro de pacientes con EAo grave aptos para ser tratados y se aleja de los pobres resultados asociados al tratamiento estándar (un riesgo de mortalidad por cualquier causa a los 5 años de casi el 93%)1. Los grandes beneficiados son los pacientes ancianos que solían considerarse no aptos para SVA tal y como confirmó el registro CURRENT AS (Resultados contemporáneos tras cirugía y tratamiento médico en pacientes con estenosis aórtica grave)12.
En nuestro estudio vimos un incremento en el número absoluto de nonagenarios tratados de TAVI que pasó de solo 11 casos descritos con anterioridad a 2009 a 78 casos en 2018 (figura 1). Este incremento escalonado del número de nonagenarios derivados para recibir TAVI se explica por el mayor conocimiento adquirido en esta técnica, por los excelentes resultados descritos6, por el mayor número de intervenciones de TAVI realizadas y por el paulatino envejecimiento de la población que es ya un fenómeno global. En 2019 había 703 millones de personas en el mundo "65; 65 años. Se espera que se duplique el número de ancianos hasta llegar a los 1.500 millones en 20503. Se cree que en 2040 la esperanza de vida en España sobrepasará los 85 años en ambos sexos13. Otro estudio asegura que hay más de un 50% de posibilidades de que en 2030 la esperanza de vida de las mujeres supere la barrera de los 90 años, algo impensable a principios del siglo XXI. Corea del Sur tendría, entre las mujeres, la esperanza de vida más alta de todas seguida de Francia, España y Japón14. Si se tienen en cuenta estos datos, la evolución natural de la valvulopatía, los avances con los dispositivos de TAVI y los resultados de esta intervención15, se espera que el número de nonagenarios con EAo grave aumente en un futuro. Esto debería posibilitar evaluaciones más rutinarias de estos pacientes por parte del equipo multidisciplinar con vistas a una posible intervención de TAVI.
En la intervención de TAVI ser nonagenario no se asocia a una incidencia ajustada más alta de mortalidad por cualquier causa
Durante la pasada década, el gasto sanitario se ha disparado más rápidamente de lo que lo ha hecho el producto interior bruto, lo cual pone en peligro la sostenibilidad de los sistemas sanitarios16. Se han identificado una serie de factores que han contribuido a este incremento del gasto, entre ellos, el envejecimiento de la población y el desarrollo de nuevas tecnologías médicas17. nuestro estudio versa Sobre ambos. Si se tienen en cuenta las implicaciones económicas de la intervención TAVI18, debe ser prioritario identificar a aquellos pacientes en quienes TAVI probablemente sea una intervención fútil según el objetivo compuesto de muerte y/o falta de mejora funcional durante el seguimiento posoperatorio a corto plazo (de 6 meses a 1 año)19. En nuestro estudio, la edad "65; 90 años no se asoció independientemente a una incidencia ajustada más alta de mortalidad por cualquier causa. Esto podría deberse al hecho de que los nonagenarios tratados de TAVI son una población altamente seleccionada con un perfil clínico más saludable que el de pacientes más jóvenes. Este es un sesgo de selección introducido por el equipo multidisciplinario que selecciona a los nonagenarios más sanos susceptibles de TAVI al tiempo que se tiene en cuenta el mayor beneficio posible, lo cual se traduce en un uso preferencial del abordaje femoral. Nuestros resultados coinciden con los de otras cohortes de nonagenarios tratados de TAVI20,21. Además, varios estudios demuestran que el beneficio de la intervención va más allá de un índice más alto de supervivencia ya que, también, mejora la calidad de vida22,23. Este es un aspecto destacable en el manejo de ancianos: el concepto de “añadir vida a los años” y no “años a la vida”. No obstante, se debe tener cautela a la hora de interpretar los resultados: 1 de cada 10 nonagenarios tratados de TAVI fallecieron durante los primeros 30 días.
El pronóstico de esta población de alto riesgo mejora cuando la intervención de TAVI se realiza con antelación en pacientes asintomáticos con EAo grave. Detectar los primeros síntomas es complicado en muchos pacientes ancianos sedentarios y en mala forma física en quienes la descompensación ventricular izquierda irreversible puede haber aparecido en el mismo momento de ser detectada. Esta estrategia está avalada por las evidencias que ofrece el estudio RECOVERY (Comparación aleatorizada de cirugía temprana frente a tratamiento convencional en estenosis aórtica muy grave) recientemente publicado24. Se diseñó para comparar los resultados clínicos a largo plazo de la sustitución quirúrgica de válvula aórtica con los del tratamiento conservador en pacientes asintomáticos con estenosis aórtica muy grave (velocidad transvalvular "65; 4,5 m/s) con arreglo a las actuales guías de práctica clínica. Se halló que la incidencia del objetivo compuesto de mortalidad operatoria o cardiovascular en el seguimiento fue mucho menor en pacientes tratados de sustitución quirúrgica de válvula aórtica de forma temprana que en aquellos a tratamiento conservador [1 frente a 15%; HR, IC95%, 0,009 (0,001- 0,67)]. El rendimiento de TAVI como intervención menos invasiva que la cirugía se puede justificar fácilmente como medida preventiva en nonagenarios para no tener que esperar a la aparición de los primeros síntomas para realizar esta intervención valvular. En la actualidad, 2 ensayos controlados aleatorizados, el EARLY-TAVR (Evaluación del implante transcatéter de válvula aórtica frente a vigilancia clínica en pacientes con estenosis aórtica grave; NCT03042104) y el EVoLVeD (Reemplazo valvular precoz guiado por biomarcadores de descompensación del ventrículo izquierdo en pacientes asintomáticos con estenosis aórtica grave)25 están inscribiendo pacientes asintomáticos con EAo para estudiar si, comparado con el tratamiento estándar, un abordaje terapéutico temprano podría mejorar los resultados. Estos estudios podrían cambiar la práctica clínica y reducir el umbral de realización de esta intervención26.
Hallazgo de características de futilidad a medio plazo en nonagenarios
Este es el tercer y último punto que nos gustaría subrayar. En nuestra cohorte, se identificaron varias características asociadas a un peor pronóstico (tabla 2 del material adicional). Reconocerlas puede ayudar a los médicos a decidir qué nonagenarios podrían ser aptos para TAVI. De entre todas estas características, 2 merecen especial atención: la presencia de insuficiencia renal crónica y las hemorragias como complicaciones intrahospitalarias. Se sabe que la insuficiencia renal crónica es uno de los peores factores pronósticos en pacientes tratados de SVA27 y se han descrito resultados similares en intervenciones de TAVI28. En nuestro estudio, los niveles basales más altos de creatinina durante la hospitalización se asociaron a un peor pronóstico a largo plazo. Nuestros resultados coinciden con los de diferentes registros en virtud de los cuales la presencia de insuficiencia renal crónica se asocia consistentemente a peores resultados tras el TAVI7. Yamamoto et al29 estudiaron el valor pronóstico de una función renal deteriorada atendiendo a una clasificación de insuficiencia renal crónica en pacientes muy ancianos tratados con TAVI. Se halló que en los pacientes en fase 4 (TFGe < 30 ml/min/1,73 m2), la incidencia acumulada de mortalidad a 30 días, 1 y 2 años fue del 26,2, 47,8 y 68,2%, respectivamente. Por otro lado, algo que explicaría la incidencia más alta de mortalidad intrahospitalaria entre nonagenarios comparados con pacientes más jóvenes es la presencia de hemorragias mayores o amenazantes para la vida. Los pacientes tratados con TAVI tienen mayor riesgo basal de sufrir hemorragias: vasculopatía periférica, insuficiencia renal crónica, enfermedad de von Willebrand adquirida y reversible y trombocitopenia adquirida30, y también un mayor riesgo de sufrir episodios hemorrágicos31. La edad se asocia a la ocurrencia de episodios hemorrágicos tras TAVI (inmediatamente después o más adelante)32, insuficiencia renal crónica y comorbilidades. Ni la edad ni las comorbilidades son variables que puedan modificarse, por lo que las variables modificables asociadas a las hemorragias como son el abordaje vascular33 y el tratamiento antitrombótico sí deben controlarse. En este sentido, los regímenes antitrombóticos intensivos con tratamiento antiagregante plaquetario doble con ácido acetilsalicílico y clopidogrel son el tratamiento antitrombótico estándar al alta hospitalaria tras una intervención de TAVI34. Esto puede tener un impacto sumamente negativo entre la población de nonagenarios porque la edad es uno de los principales predictores de hemorragias cuando se está en tratamiento antiagregante doble35. El estudio POPular TAVI, recientemente publicado36, reveló que, en pacientes tratados con TAVI sin una indicación para anticoagulación, la administración de ácido acetilsalicílico solo ya se asociaba a menos hemorragias y complicaciones hemorrágicas no operatorias que la administración de ácido acetilsalicílico más clopidogrel. Adoptar un régimen de tratamiento antiagregante simple, y no doble, tras el TAVI puede reducir el número de hemorragias mayores en estos pacientes de alto riesgo y mejorar la eficacia y el pronóstico a largo plazo de TAVI en esta población. Respecto a la capacidad predictiva de las escalas de riesgo quirúrgico, la STS-PROM es la única capaz de predecir con precisión el riesgo de mortalidad en nonagenarios20. Por último, aunque la presencia de fibrilación auricular es menos frecuente entre los pacientes que fallecieron durante el seguimiento que entre los que sobrevivieron, se piensa que esta correlación es falsa, teniendo en cuenta los resultados de otras series de pacientes nonagenarios tratados de TAVI que confirmaron que la presencia de fibrilación auricular se asoció a un peor pronóstico21.
Limitaciones del estudio
La principal limitación de este estudio es su diseño observacional, que acarrea el correspondiente sesgo de selección. También resultó difícil capturar y controlar todos los posibles factores de confusión, como la tendencia temporal de la técnica empleada y el tipo de pacientes15. Nuestros datos proceden de un registro voluntario cuyos datos no se han auditado externamente y que no incluye a todos los centros españoles con capacidad para realizar intervenciones de TAVI. Esto limita la validez externa de nuestros resultados. El tamaño de la muestra no tiene el potencial estadístico necesario como para poder detectar otras diferencias estadísticamente significativas en los resultados descritos. Tampoco permite desarrollar un análisis multivariado para valorar cuáles son los predictores independientes de la mortalidad por cualquier causa en una cohorte de pacientes nonagenarios. La falta de tratamiento antitrombótico al alta tampoco permite determinar su verdadero impacto en esta población. Tampoco tenemos datos sobre la calidad de vida durante el seguimiento, un aspecto importante en la población anciana, ni sobre el pronóstico de la intervención tras 1 año de seguimiento. Es necesario incluir a nonagenarios en estudios clínicos aleatorizados bien diseñados para determinar de modo concluyente cuál es el posible beneficio del TAVI en esta cohorte de pacientes de alto riesgo.
CONCLUSIONES
Los nonagenarios son una población de alto riesgo con EAo grave que va en aumento, para quienes el procedimiento de TAVI podría resultar una opción segura y efectiva. Es necesario llevar a cabo una cuidada selección de los pacientes por parte del equipo multidisciplinario de TAVI para lograr una eficiencia máxima en una población en la que tanto la función renal basal como las complicaciones hemorrágicas son determinantes en el pronóstico a largo plazo tras una intervención de TAVI.
FINANCIACIÓN
La Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología ha costeado el mantenimiento y explotación de la base de datos utilizada.
CONTRIBUCIÓN DE LOS AUTORES
P. L. Cepas-Guillén, X. Freira y M. Sabaté diseñaron el estudio. A. Regueiro, D. Sanmiguel Cervera, R. Blanco Mata, J. F. Oteo, I. Amat-Santos, F. Ten, J. M. Nogales, E. Fernández-Nofrerías, V. Mainar, G. Lasa-Larraya, L. Andraka, J. A. Baz-Alonso, M. Cruz Ferrer, E. Pinar, R. Romaguera, C. Cuellas Ramón, F. Alfonso, C. A. Urbano-Carrillo, S. García-Blas, A. Piñero, A. Albarrán, R. Ruíz-Salmerón, J. Moreu, Ó. Gil-Albarova, J. M. Melero y T. Heredia-Cambra supervisaron la recogida de los datos, reclutaron tanto a los centros participantes como a los pacientes y gestionaron los datos. P. L. Cepas-Guillén, A. Regueiro y M. Sabaté proporcionaron asesoramiento estadístico sobre el diseño del estudio y analizaron los datos. P. L. Cepas-Guillén, M. Sabaté y X. Freira redactaron el manuscrito y todos los autores contribuyeron sustancialmente al proceso revisión. P. L. Cepas-Guillén y M. Sabaté asumen toda responsabilidad con relación a este manuscrito. Asimismo, los autores que enviaron el manuscrito asumen toda responsabilidad por el contenido de este de conformidad con lo establecido por el Comité Internacional de Editores de Revistas Médicas.
CONFLICTO DE INTERESES
M. Sabaté declaró haber recibido honorarios por su trabajo para Abbott Vascular e Ivascular al margen de este manuscrito.
AGRADECIMIENTOS
Queremos mostrar nuestro agradecimiento a las Dras. Pilar Jimenez-Quevedo y María José Pérez Vizcayno por su apoyo durante la preparación de este manuscrito.
¿QUÉ SE SABE DEL TEMA?
- Los nonagenarios son un grupo etario que va en aumento entre los pacientes cardiovasculares, sobre todo aquellos con estenosis aortica.
- Gracias a su naturaleza minimamente invasiva, comparadacon el tratamiento estandar, la intervencion de TAVI permite tratar a pacientes con estenosis aortica grave inoperables o de alto riesgo quirurgico, mejorando asi su pronostico y calidad de vida.
- Debido a su corta esperanza de vida y carga de comorbilidades, el TAVI puede ser una opcion excelente para pacientes nonagenarios con estenosis aortica grave, aunque los datos disponibles sobre su pronostico tras el TAVI siguen siendo escasos.
¿QUÉ APORTA DE NUEVO?
- Se trata del primer estudio que analiza el pronostico de la poblacion de nonagenarios tratados con TAVI en nuestro medio.
- Se observo un incremento gradual del numero de nonagenarios y, debido al envejecimiento poblacional, se espera que cada vez haya mas nonagenarios con estenosis aortica grave en un futuro proximo.
- Ser nonagenario no se asocio a una incidencia ajustada mas alta de mortalidad por cualquier causa tras el TAVI; mas bien es con la cuidada seleccion de los pacientes con la que se logra una mayor eficiencia en esta poblacion de alto riesgo.
BIBLIOGRAFÍA
1. Kapadia SR, Leon MB, Makkar RR, et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): A randomised controlled trial. Lancet. 2015;385:2485-2491.
2. Mack MJ, Leon MB, Smith CR, et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): A randomised controlled trial. Lancet. 2015;385:2477-2484.
3. United Nations, Department of Economic and Social Affairs, Population Division. World Population Ageing 2019: Highlights (ST/ESA/SER.A/430). Disponible en https://www.un.org/en/development/desa/population/publications/pdf/ageing/WorldPopulationAgeing2019-Highlights.pdf. Consultado 19 Mar 2021.
4. Coffey S, Cairns BJ, Iung B. The modern epidemiology of heart valve disease. Heart. 2016;102:75-85.
5. Alkhouli M, Alqahtani F, Ziada KM, Aljohani S, Holmes DR, Mathew V. Contemporary trends in themanagement of aortic stenosis in the USA. Eur Heart J. 2020;41:921-928.
6. Sabaté M, Cánovas S, García E, et al. In-hospital and Mid-term Predictors of Mortality After Transcatheter Aortic Valve Implantation: Data From the TAVI National Registry 2010-2011. Rev Esp Cardiol. 2013;66:949-958.
7. Allende R, Webb JG, Munoz-Garcia AJ, et al. Advanced chronic kidney disease in patients undergoing transcatheter aortic valve implantation: Insights on clinical outcomes and prognostic markers froma large cohort of patients. Eur Heart J. 2014;35:2685-2696.
8. Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: The Valve Academic Research Consortium-2 consensus document. Eur Heart J. 2012;33:2403-2418.
9. Leon MB, Piazza N, Nikolsky E, et al. Standardized endpoint definitions for transcatheter aortic valve implantation clinical trials: A consensus report from the Valve Academic Research Consortium. Eur Heart J. 2011;32:205-217.
10. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus Surgical Aortic-Valve Replacement in High-Risk Patients. N Engl J Med. 2011;364:2187-2198.
11. Makkar RR, Thourani VH, Mack MJ, et al. Five-Year Outcomes of Transcatheter or Surgical Aortic-Valve Replacement. N Engl J Med. 2020;382:799-809.
12. Taniguchi T, Morimoto T, Takeji Y, Kato T, Kimura T. Contemporary issues in severe aortic stenosis: Review of current and future strategies from the Contemporary Outcomes after Surgery and Medical Treatment in Patients with Severe Aortic Stenosis registry. Heart. 2020;106:802-809.
13. Foreman KJ, Marquez N, Dolgert A, et al. Forecasting life expectancy, years of life lost, and all-cause and cause-specific mortality for 250 causes of death: reference and alternative scenarios for 2016–40 for 195 countries and territories. Lancet. 2018;392:2052-2090.
14. Kontis V, Bennett JE, Mathers CD, Li G, Foreman K, Ezzati M. Future life expectancy in 35 industrialised countries: projections with a Bayesian model ensemble. Lancet. 2017;389:1323-1335.
15. Jiménez-Quevedo P, Muñoz-García A, Trillo-Nouche R, et al. Evolución temporal en el tratamiento transcatéter de la estenosis aórtica: análisis del registro español de TAVI. REC Interv Cardiol. 2020;2:96-105.
16. OECD, Health at a Glance 2019: OECD Indicators, OECD Publishing, Paris, 2019. Disponible en https://doi.org/10.1787/4dd50c09-en. Consultado 19 Mar 2021.
17. Sorenson C, Drummond M, Khan BB. Medical technology as a key driver of rising health expenditure: Disentangling the relationship. Clin Outcomes Res. 2013;5:223-234.
18. Fontes-Carvalho R, Guerreiro C, Oliveira EI, Braga P. Present and future economic impact of transcatheter aortic valve replacement on the Portuguese national healthcare system. Rev Port Cardiol. 2020;39:479-488.
19. Puri R, Iung B, Cohen DJ, Rodé S-Cabau J. TAVI or No TAVI: identifying patients unlikely to benefit from transcatheter aortic valve implantation. Eur Heart J. 2016;37:2217–2225.
20. Vlastra W, Chandrasekhar J, Vendrik J, et al. Transfemoral TAVR in Nonagenarians: From the CENTER Collaboration. JACC Cardiovasc Interv. 2019;12:911-920.
21. Deharo P, Bisson A, Herbert J, et al. Outcomes in nonagenarians undergoing transcatheter aortic valve implantation (TAVI): data from a nationwide analysis. EuroIntervention. 2020. http://dx.doi.org/10.4244/EIJ-D-19-00647.
22. Arsalan M, Szerlip M, Vemulapalli S, et al. Should Transcatheter Aortic Valve Replacement Be Performed in Nonagenarians? Insights from the STS/ACC TVT Registry. J Am Coll Cardiol. 2016;67:1387-1395.
23. Orvin K, Assali A, Vaknin-Assa H, et al. Efficacy and Safety of Transcatheter Aortic Valve Implantation in Aortic Stenosis Patients With Extreme Age. J Invasive Cardiol. 2015;27:475-480.
24. Kang D-H, Park S-J, Lee S-A, et al. Early Surgery or Conservative Care for Asymptomatic Aortic Stenosis. N Engl J Med. 2020;382:111-119.
25. Bing R, Everett RJ, Tuck C, et al. Rationale and design of the randomized, controlled Early Valve Replacement Guided by Biomarkers of Left Ventricular Decompensation in Asymptomatic Patients with Severe Aortic Stenosis (EVOLVED) trial. Am Heart J. 2019;212:91-100.
26. Lindman BR, Dweck MR, Lancellotti P, et al. Management of Asymptomatic Severe Aortic Stenosis: Evolving Concepts in Timing of Valve Replacement. JACC Cardiovasc Imaging. 2020;13:481-493.
27. Brown JM, O'Brien SM, Wu C, Sikora JAH, Griffith BP, Gammie JS. Isolated aortic valve replacement in North America comprising 108,687 patients in 10 years: Changes in risks, valve types, and outcomes in the Society of Thoracic Surgeons National Database. J Thorac Cardiovasc Surg. 2009;137:82-90.
28. Ferro CJ, Chue CD, de Belder MA, et al. Impact of renal function on survival after transcatheter aortic valve implantation (TAVI): an analysis of the UK TAVI registry. Heart. 2015;101:546-552.
29. Yamamoto M, Hayashida K, Mouillet G, et al. Prognostic value of chronic kidney disease after transcatheter aortic valve implantation. J Am Coll Cardiol. 2013;62:869-877.
30. Hernández-Enríquez M, Regueiro A, Romaguera R, et al. Thrombocytopenia after transcatheter aortic valve implantation. A comparison between balloon-expandable and self-expanding valves. Catheter Cardiovasc Interv. 2019;93:1344-1351.
31. Mangieri A, Montalto C, Poletti E, et al. Thrombotic Versus Bleeding Risk After Transcatheter Aortic Valve Replacement: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;74:2088-2101.
32. Piccolo R, Pilgrim T, Franzone A, et al. Frequency, Timing, and Impact of Access-Site and Non–Access-Site Bleeding on Mortality Among Patients Undergoing Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2017;10:1436-1446.
33. Hernández-Enriquez M, Andrea R, Brugaletta S, et al. Puncture Versus Surgical Cutdown Complications of Transfemoral Aortic Valve Implantation (from the Spanish TAVI Registry). Am J Cardiol. 2016;118:578-584.
34. Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2017;70:252-289.
35. Costa F, van Klaveren D, James S, et al. Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual antiplatelet therapy (PRECISE-DAPT) score: a pooled analysis of individual-patient datasets from clinical trials. Lancet. 2017;389:1025-1034.
36. Brouwer J, Nijenhuis VJ, Delewi R, et al. Aspirin with or without Clopidogrel after Transcatheter Aortic-Valve Implantation. N Engl J Med. 2020;383:1447-1457.

RESUMEN
Introducción y objetivos: Las guías de práctica clínica actuales recomiendan el tratamiento antiagregante plaquetario doble con ácido acetilsalicílico y clopidogrel como estrategia antitrombótica tras el implante percutáneo de válvula aórtica (TAVI) en pacientes sin indicación de anticoagulación oral a largo plazo. Sin embargo, estas recomendaciones no se han desarrollado de acuerdo con los resultados de grandes ensayos aleatorizados. Por ello, el objetivo de esta investigación es comparar la terapia antiplaquetaria en monoterapia con el tratamiento antiagregante doble en pacientes sin indicación de anticoagulación a largo plazo después de un TAVI.
Métodos: Se realizaron búsquedas en PubMed, Embase y los principales congresos internacionales para encontrar ensayos clínicos aleatorizados que compararan el tratamiento antiagregante único con el tratamiento antiplaquetario doble después de un TAVI. Los datos se agruparon en un metanálisis mediante un modelo de efectos aleatorios. El objetivo principal del estudio fue la hemorragia grave o potencialmente mortal.
Resultados: Se incluyeron cuatro ensayos que en total incluyeron a 1.086 pacientes. Los pacientes bajo tratamiento antiagregante en monoterapia, en comparación con aquellos con tratamiento antiagregante plaquetario doble, tuvieron menor riesgo de hemorragia grave o potencialmente mortal (odds ratio [OR] = 0,44; intervalo de confianza del 95% [IC95%], 0,27-0,70) y de cualquier sangrado (OR = 0,51; IC95%, 0,36-0,71). No se observaron diferencias entre los pacientes tratados con monoterapia y los tratados tratamiento antiagregante plaquetario doble en cuanto a muerte por cualquier causa (OR = 1,01; IC95%, 0,61-1,68), infarto de miocardio (OR = 0,50; IC95%: 0,17-1,41) y accidente cerebrovascular (OR = 0,98; IC95%, 0,54-1,77).
Conclusiones: En los pacientes sin indicación de anticoagulación a largo plazo sometidos a TAVI, la monoterapia con ácido acetilsalicílico en comparación el tratamiento antiagregante doble se asocia con un menor riesgo de hemorragia grave o potencialmente mortal y con un riesgo comparable de muerte por cualquier causa, infarto de miocardio y accidente cerebrovascular.
Palabras clave: Tratamiento antitrombótico. TAVI. Tratamiento antiagregante. Ácido acetilsalicílico. Sangrado.
Abstract
Introduction and objectives: Current expert consensus guidelines recommend dual antiplatelet therapy (DAPT) with aspirin and clopidogrel as antithrombotic strategy after transcatheter aortic valve implantation (TAVI) in patients without an indication for long-term oral anticoagulation. However, these recommendations have not been developed based on the results of large randomized clinical trials. The objective of this study is to compare single antiplatelet therapy (SAPT) to DAPT in patients without an indication for long-term anticoagulation after TAVI.
Methods: The PubMed, Embase, and the main international conference proceedings were reviewed in the search for randomized controlled trials comparing SAPT to DAPT after TAVI. Data were pooled using a meta-analysis and a random effects model. The primary endpoint was life-threatening or major bleeding.
Results: Four trials enrolling 1086 patients were included. Compared to patients treated with DAPT, those treated with SAPT showed a lower risk of life-threatening or major bleeding (OR, 0.44; 95%CI, 0.27-0.70), and any bleeding (OR, 0.51; 95%CI, 0.36-0.71). No differences were observed between patients treated with SAPT compared to those treated with DAPT regarding all-cause mortality (OR, 1.01; 95%CI, 0.61-1.68), myocardial infarction (OR, 0.50; 95%CI 0.17-1.41), and stroke (OR, 0.98; 95%CI, 0.54-1.77).
Conclusions: In patients without an indication for long-term anticoagulation undergoing TAVI, single antiplatelet therapy with aspirin compared to DAPT is associated with a lower risk of life-threatening or major bleeding and a comparable risk of all-cause mortality, myocardial infarction, and stroke.
Keywords: Antithrombotic therapy. TAVI. Antiplatelet therapy. Aspirin. Bleeding.
Abreviaturas:
TAPD: tratamiento antiagregante plaquetario doble. ICP: intervención coronaria percutánea. ECA: ensayo clínico aleatorizado. TAP: tratamiento antiagregante plaquetario. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
Durante los últimos 20 años, el implante percutáneo de válvula aórtica (TAVI) se ha convertido en una estrategia terapéutica de éxito, alternativa a la cirugía para tratar la estenosis valvular aórtica en pacientes de riesgo quirúrgico alto, intermedio y bajo1,6.
Las complicaciones isquémicas y hemorrágicas no son raras tras un TAVI y pueden ser mortales. Recientemente, los estudios clínicos PARTNER 3 y Evolut Low han mostrado incidencias bajas, aunque nada despreciables, de accidentes cerebrovasculares y hemorragias mayores en los 30 días siguientes a un TAVI5,6.
En la actualidad, el tratamiento antiagregante plaquetario doble (TAPD) con ácido acetilsalicílico y clopidogrel es el régimen antitrombótico más usado tras un TAVI en pacientes sin indicación de anticoagulación oral a largo plazo inscritos en estudios clínicos. Las recomendaciones que dan las guías de diferentes sociedades sugieren cursos de 1 a 3, 3 a 6 o 6 meses de tratamiento con clopidogrel acompañado de dosis bajas de ácido acetilsalicílico. No obstante, estas recomendaciones no se han desarrollado basándose en los resultados de grandes ensayos clínicos aleatorizados7,10. Los datos sobre duraciones del tratamiento realizados en la última década sugieren un efecto neutro o beneficioso del tratamiento antiagregante plaquetario en monoterapia (TAP) frente a un curso inicial de TAPD seguido de TAP en lo que se refiere a las complicaciones vasculares y a las hemorragias mayores o amenazantes para la vida. Estos informes no sugieren mayor riesgo de sufrir infartos de miocardio ni accidentes cerebrovasculares11,13. Recientemente, el ácido acetilsalicílico en monoterapia ha demostrado ser superior a un tratamiento de 3 meses de ácido acetilsalicílico y clopidogrel seguido de ácido acetilsalicílico en lo que se refiere no solo a las hemorragias sino también a las complicaciones tromboembólicas tras 1 año de seguimiento14.
Se realizó un metanálisis de estudios clínicos aleatorizados disponibles para hacer una valoración integral y cuantitativa de la evidencia disponible sobre el perfil de seguridad y eficacia de TAP frente a TAPD tras TAVI en pacientes sin indicación de anticoagulación oral a largo plazo.
MÉTODOS
Estrategia de búsqueda y criterios de selección
Se valoraron ensayos clínicos aleatorizados (ECA) con pacientes tratados de TAVI para incluirlos en este metanálisis. Los estudios elegibles debían cumplir los siguientes criterios de inclusión preespecificados: a) ECA que compararan TAP con TAPD tras un TAVI y b) disponibilidad de datos clínicos. Los criterios de exclusión fueron: a) ECA que incluyeran a pacientes que precisaran anticoagulación oral, b) ausencia de diseño aleatorizado, c) ausencia de datos sobre los resultados clínicos.
Tanto la estrategia de búsqueda, la selección de los estudios, como la extracción y análisis de datos se hicieron siguiendo las directrices de la Colaboración Cochrane y los ítems de referencia para publicar Revisiones Sistemáticas y Metanálisis (PRISMA)15.
El pasado 31 de agosto de 2020, se llevó a cabo una búsqueda en las bases de datos de PubMed y Embase, así como de los resúmenes presentados en importantes congresos científicos (American Heart Association, American College of Cardiology, Sociedad Europea de Cardiología, EuroPCR y Transcatheter Cardiovascular Therapeutics). También se empleó el método backward snowballing (revisión de referencias bibliográficas dentro artículos identificados y revisiones pertinentes). La estrategia de búsqueda está disponible en el material adicional.
Extracción de los datos
Tres investigadores (J. Sanz-Sánchez, C. A. Pivato y P. P. Leone) realizaron una valoración independiente de los estudios con potencial para ser incluidos. El investigador principal (G. G. Stefanini) fue el encargado de resolver cualquier posible discrepancia. Se excluyeron los artículos que no fuesen relevantes en función del título y el resumen. Estos investigadores extrajeron, también de manera independiente, datos sobre el diseño y medidas del estudio, características de los pacientes y resultados con ayuda de un formulario estandarizado para la extracción de datos. Los conflictos sobre a la extracción de datos se debatieron y los resolvió el investigador principal (G. G. Stefanini).
Se recopilaron datos sobre los autores, el año de publicación, los criterios de inclusión y exclusión, el tamaño de la muestra, las características basales de los pacientes, las definiciones de los objetivos, la estimación del efecto conseguido y el tiempo de seguimiento.
Resultados de interés
El objetivo primario preespecificado fue la hemorragia mayor o amenazante para la vida. Los objetivos clínicos secundarios fueron la mortalidad por cualquier causa, el infarto de miocardio, el accidente cerebrovascular y cualquier hemorragia. Cada objetivo se valoró atendiendo a las definiciones descritas en los protocolos originales del estudio que se detallan en la tabla 1 del material adicional.
Tabla 1. Principales características de los estudios
| Estudio | Año de publicación | Diseñodel estudio | Número de pacientes | Multicéntrico | Seguimiento | Duración del TAPD | ||
|---|---|---|---|---|---|---|---|---|
| Global | TAPD | TAP | ||||||
| POPular TAVI14 | 2020 | ECA | 665 | 334 | 331 | Sí | 12 meses | 3 meses |
| ARTE11 | 2017 | ECA | 222 | 111 | 111 | Sí | 3 meses | 3 meses |
| SAT-TAVI12 | 2014 | ECA | 120 | 60 | 60 | No | 6 meses | 6 meses |
| Ussia et al.13 | 2011 | ECA | 79 | 40 | 39 | No | 6 meses | 3 meses |
|
ECA: ensayo clínico aleatorizado; TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble. |
||||||||
Riesgo de sesgo
El riesgo de sesgo de cada estudio se valoró con la herramienta revisada de evaluación del riesgo de sesgo de la Colaboración Cochrane (RoB 2.0)16. Tres investigadores (J. Sanz-Sánchez, C. A. Pivato y P. P. Leone) realizaron una valoración independiente de 5 dominios de sesgo en cada ECA: 1) proceso de aleatorización, 2) desviaciones de las intervenciones pretendidas, 3) datos de resultados faltantes, 4) medidas de los resultados y 5) selección de los resultados descritos (tabla 2 del material adicional).
Tabla 2. Características clínicas basales de los pacientes incluidos
| Estudio | Edad (años) | Varones | Diabetes | Hipertensión | Fibrilación auricular | NYHA ≥ III | FEVI | Puntuación en la escala STS-PROM | Accidente cerebrovascular previo | IM previo | Abordaje transfemoral | Implante valve-in-valve | Indicación para TAVI: estenosis aórtica |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| POPular TAVI14 | 80 | 50 | 24 | 75 | – | 65 | – | 2,5 | 4 | 9 | 89 | 6 | 98 |
| ARTE11 | 79 | 58 | 35 | 79 | – | – | 54 | 6,3 | – | 21 | 69 | – | – |
| SAT-TAVI12 | 81 | 37 | 27 | 95 | – | 89 | 52 | 10.0 | – | – | 100 | – | 100 |
| Ussia et al.13 | 81 | 46 | 27 | 84 | 13 | 62 | 52 | 7,3 | 8 | 14 | ?97 | 0 | 100 |
| Global | 80 | 50 | 27 | 79 | – | 68 | 53 | 4,4 | – | 12 | 87 | – | 98 |
|
FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; NYHA: New York Heart Association; STS-PROM: riesgo de mortalidad predicho por la escala de la Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica. Los datos expresan porcentajes (%). |
|||||||||||||
Análisis estadístico
Tanto los odds ratios (OR) como los intervalos de confianza (IC) del 95% se calcularon con el modelo de efectos aleatorios de DerSimonian y Laird tomándose el cálculo de la heterogeneidad del método de Mantel-Haenszel. El número de pacientes que es necesario tratar (NNT) para evitar 1 evento se calculó a partir de medidas ponderadas de OR combinados empleando el modelo meta-analítico de efectos aleatorios. La presencia de heterogeneidad entre los diferentes estudios se evaluó con la prueba Q de Cochran según una distribución de X2. Los valores de p ≤ 0,10 se consideraron estadísticamente significativos y la inconsistencia se analizó con la prueba del estadístico I2. Valores del 0% fueron indicativos de ausencia de heterogeneidad observada y valores del ≤ 25%, ≤ 50% y > 50% de la presencia de una heterogeneidad baja, moderada y alta, respectivamente. El sesgo de publicación se valoró por estimación visual a través de gráficos de embudo. Se realizó un análisis de sensibilidad de validación cruzada para el objetivo primario retirando, repetidamente, un estudio cada vez para confirmar que nuestros hallazgos no eran fruto de un único estudio. Los demás análisis de sensibilidad se hicieron calculando los OR con un IC95% a partir de un modelo de efectos fijos con el método de Mantel-Haenszel y los cocientes de tasas de incidencia con un IC95% a partir de modelos de efectos tanto fijos como aleatorios. El nivel de significación estadística se obtuvo a partir de valores de p bilateral < 0,05. Los análisis estadísticos se realizaron empleando el software Stata, versión 13.1 (StataCorp LP, College Station, Estados Unidos).
RESULTADOS
Resultados de la búsqueda
La figura 1 muestra la búsqueda de estudios y el proceso de selección de los mismos según la declaración PRISMA. Se identificó un total de 4 ECA que fueron incluidos en este análisis. Las principales características de los estudios incluidos se muestran en la tabla 1.
Figura 1. Flujograma del proceso de selección de los estudios.
Se incluyó a un total de 541 pacientes en tratamiento con ácido acetilsalicílico y 545 pacientes en tratamiento con TAPD tras TAVI.
Características basales
Las principales características basales de los pacientes incluidos se muestran en la tabla 2. La mayoría de los pacientes recibió un TAVI por presentar estenosis aórtica. El riesgo medio de mortalidad estimada según la Society of Thoracic Surgeons fue del 4,4%, la mayoría de las intervenciones fueron mediante abordaje transfemoral.
Sesgo de publicación y asimetría
Las distribuciones en gráficos de embudo de los resultados preespecificados indican la ausencia de sesgo de publicación para todas las variables clínicas (figuras 1, 5 del material adicional).
Figura 2. Resultados hemorrágicos en pacientes a tratamiento con TAP frente a TAPD tras un TAVI. TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble; TAVI: implante percutáneo de válvula aórtica.
Figura 3. Mortalidad por cualquier causa y resultados de eficacia en pacientes a tratamiento con TAP frente a TAPD tras un TAVI. TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble; TAVI: implante percutáneo de válvula aórtica.
Resultados
Comparados con los tratados con TAPD, los pacientes tratados con TAP tenían menor riesgo de sufrir hemorragias mayores o amenazantes para la vida (OR = 0,44; IC95%, 0,27-0,70; I2 = 0%) y cualquier tipo de hemorragia (OR = 0,51; IC95%, 0,36-0,71; I2 = 0%) (figura 2). No se observaron diferencias entre los pacientes tratados con TAP y los tratados con TAPD en lo que se refiere a la mortalidad por cualquier causa (OR = 1,01; IC95%, 0,61-1,68; I2 = 0%), los infartos de miocardio (OR = 0,50; IC95%, 0,17-1,41; I2 = 0%) y los accidentes cerebrovasculares (OR = 0,98; IC95%, 0,54-1,77; I2 = 0%) (figura 3). El NNT para evitar 1 hemorragia mayor o amenazante para la vida fue de 17 pacientes y el NNT para evitar cualquier tipo de hemorragia fue de 11 pacientes
Evaluación del riesgo de sesgo
La tabla 2 del material adicional muestra los resultados de la evaluación del riesgo de sesgo con la herramienta RoB 2.0. Se consideró que 2 estudios presentaban un riesgo global de sesgo bajo11,14, aunque otros 2 estudios tenían un riesgo algo más alto12,13.
Análisis de sensibilidad
Los hallazgos fueron concordantes con los del análisis principal tras calcular los OR a partir de un modelo de efectos fijos y los cocientes de tasas de incidencias a partir de modelos de efectos tanto fijos como aleatorios (tabla 3 del material adicional).
Los resultados del análisis de sensibilidad de validación cruzada retirando repetidamente un estudio cada vez coincidieron con el análisis primario (tabla 4 del material adicional).
DISCUSIÓN
El presente metanálisis evaluó los ECA disponibles realizando una comparativa entre el TAP con ácido acetilsalicílico y el TAPD en pacientes que recibieron un TAVI sin una indicación para recibir anticoagulación oral a largo plazo. Estos fueron los principales hallazgos:
-
1) El riesgo de sufrir hemorragias mayores o amenazantes para la vida o cualquier otra hemorragia es menor en pacientes tratados con TAP que en aquellos pacientes tratados con TAPD.
-
2) El riesgo de mortalidad por cualquier causa, infarto de miocardio y accidente cerebrovascular no varió entre las 2 estrategias de tratamiento.
En la actualidad, las guías de práctica clínica recomiendan cursos de TAPD de entre 1 y 6 meses de duración tras un TAVI en pacientes sin una indicación para recibir anticoagulación oral a largo plazo7,9. Sin embargo, este régimen no está avalado por las evidencias de que se dispone hoy en día. Esta práctica proviene del campo de las intervenciones coronarias percutáneas en el que la incorporación de un inhibidor del receptor plaquetario P2Y12 al ácido acetilsalicílico, en comparación con una monoterapia con ácido acetilsalicílico, redujo el riesgo de complicaciones isquémicas, sobre todo, la trombosis del stent17. La incorporación de clopidogrel al ácido acetilsalicílico tras un TAVI tiene un potencial teórico de reducir la incidencia de eventos cardiovasculares isquémicos, infartos de miocardio y trombosis valvulares.
El accidente cerebrovascular isquémico es una de las peores complicaciones que se pueden dar tras un TAVI. Su incidencia más alta se da durante las primeras 24 horas después de la intervención. Parece asociarse, principalmente, a la presencia de restos de tejidos embolizados durante el TAVI debido a la dilatación de la válvula calcificada o a la navegación a través del arco aórtico18,20. En cambio, el accidente cerebrovascular subagudo (entre 1 y 30 días después de la intervención), representativo de un cuarto del número total de eventos al cabo de 2 años4,21, con frecuencia se asocia a la fibrilación auricular de nueva aparición22,24, contra la que el TAPD tiene poca efectividad.
Otra motivación teórica para recetar TAPD tras un TAVI es limitar la incidencia de infarto de miocardio. No obstante, la incidencia del infarto de miocardio descrita tras un TAVI es relativamente baja4,21 y la enfermedad coronaria concomitante se suele tratar percutáneamente antes del TAVI. Por lo tanto, la incorporación de un inhibidor del receptor plaquetario P2Y12 al ácido acetilsalicílico tras un TAVI no parece ofrecer ninguna ventaja adicional frente a una monoterapia de ácido acetilsalicílico en lo referente a la reducción del riesgo de infarto de miocardio tal y como confirmaron nuestros resultados.
Por último, aunque la trombosis valvular sintomática es una enfermedad rara (< 1%), la trombosis subclínica tiene una incidencia mucho más alta (entre el 10 y el 40% según diferentes series)25,27. El impacto clínico de este fenómeno todavía se desconoce: podría no solo afectar a la durabilidad de la válvula por la formación de pannus, sino también acarrear una incidencia más alta de accidente isquémico transitorio25,26. En este contexto, la fisiopatología de la formación de trombos tras TAVI sigue siendo objeto de debate ya que todavía hay que establecer el peso relativo que tienen la hemostasia primaria y secundaria. Por otro lado, las lesiones endoteliales y un entorno de alta tensión de cizallamiento alrededor de la estructura endoprotésica de la válvula previo a la re-endotelización podría favorecer la agregación plaquetaria y, por ende, la formación de trombos ricos en plaquetas. Esto es, de algún modo, parecido a lo que sucede durante la trombosis del stent contra la cual el TAPD ha demostrado ser el tratamiento más efectivo17. Por otro lado, el seno bioprotésico de las valvas de la válvula podría favorecer un estado de baja tensión de cizallamiento y turbulencia de flujo y predisponer al desarrollo de trombos ricos en trombina. TAPD parece no ofrecer ningún beneficio sobre TAP en términos de reducir la trombosis de la válvula bioprotésica, pero los anticoagulantes orales sí han demostrado ser capaces de prevenir y resolver esta complicación25,27. No obstante, hasta la fecha, el único estudio que ha entrado a valorar el papel del tratamiento anticoagulante tras un TAVI en pacientes sin una indicación para recibir anticoagulación oral a largo plazo es el GALILEO. El estudio fue interrumpido tras observarse importantes problemas de seguridad en los análisis provisionales que revelaron incidencias más altas de complicaciones con dosis bajas de rivaroxaban/ácido acetilsalicílico frente a TAPD, incluidoseventos clínicos tan importantes como la mortalidad (6,8 frente al 3,3%)28.
En líneas generales, los eventos isquémicos post-TAVI parecen eludir la acción antiagregante plaquetaria de las tienopiridinas y el ácido acetilsalicílico. El presente metanálisis confirma que la incorporación de un inhibidor del receptor plaquetario P2Y12 no reduce el riesgo de sufrir eventos isquémicos (tales como infartos de miocardio y accidentes cerebrovasculares). Más bien predispone a los pacientes a un mayor riesgo de sufrir hemorragias mayores o amenazantes para la vida. El menor riesgo hemorrágico con TAP frente a TAPD descrito en este metanálisis es de una gran importancia clínica con un NNT de tan solo 11 pacientes para evitar cualquier hemorragia y un NNT de 17 pacientes para evitar 1 hemorragia mayor o amenazante para la vida. Además, como la mayoría de los eventos hemorrágicos ocurren dentro de los 30 días siguientes a la intervención, probablemente debido al tratamiento antitrombótico perioperatorio y a las complicaciones hemorrágicas en el sitio de acceso1,4,29, incluso un curso corto de TAPD plantea problemas de seguridad en lo que se refiere a los eventos hemorrágicos.
En base a las evidencias publicadas hasta la fecha y a los resultados de esta investigación, en pacientes sin una indicación para recibir anticoagulación a largo plazo tratados de TAVI, la monoterapia con ácido acetilsalicílico debería preferirse en detrimento del TAPD. No obstante, aún se necesitan estudios extensos que ayuden a determinar si las estrategias antiagregantes plaquetarias deben se individualizadas en función de la válvula implantada (con balón expandible frente a autoexpandible) o en el contexto particular del implante valve-in-valve; así como dilucidar qué papel pueden tener regímenes antiagregantes plaquetarios alternativos (tales como monoterapia con inhibidores del receptor plaquetario P2Y12) y los anticoagulantes orales.
Limitaciones
Los resultados de nuestro estudio se deberían interpretar con cautela teniendo en cuenta ciertas limitaciones. En primer lugar, se trató de un metanálisis a nivel de estudios que ofreció datos sobre los efectos medios del tratamiento. Asimismo, la falta de datos a nivel individual de los pacientes nos impide valorar qué impacto tuvieron las características basales clínicas y la intervención sobre los efectos del tratamiento. En segundo lugar, se observaron pequeñas diferencias en la definición empleada en las variables clínicas isquémicas entre los distintos estudios, lo cual limitó la fiabilidad de las estimaciones del efecto conseguido. No obstante, en lo referente a los eventos hemorrágicos, se usó la definición del VARC en todos los estudios incluidos, lo que aporta solidez a nuestros hallazgos. Por último, el limitado número de estudios y pacientes y el bajo número de eventos para variables como el infarto de miocardio podrían haber atenuado el poder estadístico para detectar cualquier diferencia significativa entre los grupos a estudio.
Se proporcionaran nuevas evidencias por una serie de ECA actualmente en curso: el estudio ATLANTIS (estrategia antitrombótica tras implantación percutánea de válvula aórtica para el tratamiento de la estenosis aórtica; NCT02664649) analizará los beneficios derivados de un tratamiento con una dosis estándar de apixaban frente al tratamiento estándar; el ATAPD-TAVR (anticoagulantes frente a tratamiento antiagregante plaquetario doble para prevenir la trombosis de las valvas y la embolización cerebral tras un implante percutáneo de válvula aórtica; NCT03284827) realizará una comparativa entre un tratamiento con una dosis estándar de edoxaban y el TAPD. Por último, el estudio AUREA (tratamiento antiagregante plaquetario doble frente a un curso corto de anticoagulación para prevenir los embolismos cerebrales tras un TAVI; NCT01642134) valorará una estrategia con antagonistas de la vitamina K frente a un curso de TAPD de 3 meses de duración.
CONCLUSIONES
En pacientes sin una indicación para recibir anticoagulación a largo plazo tratados de TAVI, la monoterapia con ácido acetilsalicílico se asocia a un menor riesgo de sufrir hemorragias mayores o amenazantes para la vida comparado con TAPD y a un riesgo parecido de mortalidad por cualquier causa, infarto de miocardio y accidente cerebrovascular.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
J. Sanz-Sánchez, C. A. Pivato, P. P. Leone y M. Chiarito contribuyeron al diseño, análisis y redacción de este manuscrito. D. Regazzoli y G. Petriello contribuyeron al diseño y redacción del manuscrito. B. Reimers, G. Condorelli y G. G. Stefanini contribuyeron al diseño, redacción y supervisión de este estudio.
CONFLICTO DE INTERESES
G. G. Stefanini declara haber recibido una beca de investigación de Boston Scientific y honorarios por su labor como conferenciante/consultor para B. Braun, Biosensor y Boston Scientific. D. Regazzoli declara honorarios por su labor como conferenciante para Amgen y Boehringer. Los demás autores no declaran conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- Las complicaciones isquémicas y hemorrágicas no son raras tras un TAVI y pueden ser amenazantes para la vida. Con el objetivo de reducir la incidencia de accidentes cerebrovasculares, infartos de miocardio y trombosis valvular, las guías de práctica clínica recomiendan un curso de entre 1 y 6 meses de TAPD tras un TAVI en pacientes sin una indicación para recibir anticoagulación oral a largo plazo. No obstante, este régimen no está avalado por las evidencias disponibles en la actualidad y, en líneas generales, los eventos isquémicos post-TAVI parecen eludir la acción antiagregante plaquetaria de las tienopiridinas y el ácido acetilsalicílico. De hecho, los datos que existen sobre duraciones del tratamiento realizados en la última década sugieren un efecto neutro o beneficioso de la monoterapia con ácido acetilsalicílico frente a un curso inicial de TAPD seguido de ácido acetilsalicílico en monoterapia en lo referente a las complicaciones vasculares y hemorragias mayores o amenazantes para la vida.
¿QUÉ APORTA DE NUEVO?
- El presente estudio confirma que la incorporación de tienopiridinas al ácido acetilsalicílico no reduce el riesgo de sufrir eventos isquémicos (tales como infartos de miocardio y accidentes cerebrovasculares). Más bien predispone a los pacientes a un mayor riesgo de sufrir hemorragias mayores o amenazantes para la vida. La reducción del riesgo hemorrágico observada con el ácido acetilsalicílico frente al TAPD es de gran importancia clínica con un NNT de solo 11 pacientes para evitar cualquier hemorragia y un NNT de 17 pacientes para evitar 1 hemorragia mayor o amenazante para la vida. En base a las evidencias disponibles publicadas hasta la fecha y a los resultados de este estudio, en pacientes sin una indicación para recibir anticoagulación a largo plazo tratados de TAVI, es preferible una monoterapia con ácido acetilsalicílico en lugar de TAPD.
BIBLIOGRAFÍA
1. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
2. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
3. Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
4. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
5. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019:NEJMoa1816885.
6. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med. 2019;380:1695-705.
7. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
8. Webb J, Rodés-Cabau J, Fremes S, et al. Transcatheter Aortic Valve Implantation:A Canadian Cardiovascular Society Position Statement. Can J Cardiol. 2012;28:520-528.
9. Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients with Valvular Heart Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135:e1159-1195.
10. Mangieri A, Jabbour RJ, Montalto C, et al. Single-Antiplatelet Therapy in Patients with Contraindication to Dual-Antiplatelet Therapy After Transcatheter Aortic Valve Implantation. Am J Cardiol. 2017;119:1088-1093.
11. Rodés-Cabau J, Masson JB, Welsh RC, et al. Aspirin Versus Aspirin Plus Clopidogrel as Antithrombotic Treatment Following Transcatheter Aortic Valve Replacement With a Balloon-Expandable Valve:The ARTE (Aspirin Versus Aspirin +Clopidogrel Following Transcatheter Aortic Valve Implantation) Randomized Clinical Trial. JACC Cardiovasc Interv. 2017;10:1357-1365.
12. Stabile E, Pucciarelli A, Cota L, et al. SAT-TAVI (single antiplatelet therapy for TAVI) study:A pilot randomized study comparing double to single antiplatelet therapy for transcatheter aortic valve implantation. Int J Cardiol. 2014;174:624-627.
13. Ussia GP, Scarabelli M, Mul M, et al. Dual antiplatelet therapy versus aspirin alone in patients undergoing transcatheter aortic valve implantation. Am J Cardiol. 2011;108:1772-1776.
14. Brouwer J, Nijenhuis VJ, Delewi R, et al. Aspirin with or without Clopidogrel after Transcatheter Aortic-Valve Implantation. N Engl J Med. 2020:NEJMoa2017815–NEJMoa2017815.
15. Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions:explanation and elaboration. BMJ. 2009;339:b2700.
16. Risk of bias tools - Current version of RoB 2 n.d. https://www.riskofbias.info/welcome/rob-2-0-tool/current-version-of-rob-2. Consultado 23 Jun 2019.
17. Stefanini GG, Holmes DR. Drug-Eluting Coronary-Artery Stents. N Engl J Med. 2013;368:254-265.
18. Van Mieghem NM, El Faquir N, Rahhab Z, et al. Incidence and predictors of debris embolizing to the brain during transcatheter aortic valve implantation. JACC Cardiovasc Interv. 2015;8:718-724.
19. Schmidt T, Leon MB, Mehran R, et al. Debris Heterogeneity Across Different Valve Types Captured by a Cerebral Protection System During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2018;11:1262-1273.
20. Kahlert P, Al-Rashid F, Döttger P, et al. Cerebral embolization during transcatheter aortic valve implantation:A transcranial doppler study. Circulation. 2012;126:1245-1255.
21. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376:1321-1331.
22. Nombela-Franco L, Webb JG, De Jaegere PP, et al. Timing, predictive factors, and prognostic value of cerebrovascular events in a large cohort of patients undergoing transcatheter aortic valve implantation. Circulation. 2012;126:3041-3053.
23. Siontis GCM, Praz F, Lanz J, et al. New-onset arrhythmias following transcatheter aortic valve implantation:A systematic review and meta-analysis. Heart. 2018;104:1208-1215.
24. Vora AN, Dai D, Matsuoka R, et al. Incidence, Management, and Associated Clinical Outcomes of New-Onset Atrial Fibrillation Following Transcatheter Aortic Valve Replacement:An Analysis From the STS/ACC TVT Registry. JACC Cardiovasc Interv. 2018;11:1746-1756.
25. Makkar RR, Fontana G, Jilaihawi H, et al. Possible subclinical leaflet thrombosis in bioprosthetic aortic valves. N Engl J Med. 2015;373:2015-2024.
26. Chakravarty T, Søndergaard L, Friedman J, et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves:an observational study. Lancet. 2017;389:2383-2392.
27. Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuated leaflet thickening in balloon-expandable transcatheter aortic heart valves. Eur Heart J. 2016;37:2263-2271.
28. Dangas GD, Tijssen JGP, Wöhrle J, et al. A controlled trial of rivaroxaban after transcatheter aortic-valve replacement. N Engl J Med. 2020;382:120-129.
29. Piccolo R, Pilgrim T, Franzone A, et al. Frequency, Timing, and Impact of Access-Site and Non–Access-Site Bleeding on Mortality Among Patients Undergoing Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2017;10:1436-1446.
- Resultados del TAVI emergente comparado con el procedimiento electivo: metanálisis
- Reemplazo valvular aórtico percutáneo y quirúrgico. Influencia del volumen y del tipo de centro tratante en los resultados
- Modelo experimental de insuficiencia mitral en modelo animal porcino
- Dosis baja de apixabán en pacientes con implante transcatéter de prótesis valvular aórtica y fibrilación auricular