Enfermedad valvular
REC Interv Cardiol. 2019;1:34-40
Cambios morfológicos anulares tras reparación mitral transcatéter: repercusión clínica y relevancia de la etiología
Changes in mitral annular morphology following transcatheter mitral valve repair. Clinical repercussion and importance of etiology
Área del Corazón, Hospital Universitario Central de Asturias, Oviedo, Asturias, España
RESUMEN
Introducción y objetivos: El implante percutáneo de válvula aórtica (TAVI) ha demostrado ser seguro y eficaz en pacientes tanto de bajo como de alto riesgo, pero los procedimientos emergentes se han excluido en los principales estudios. El objetivo fue determinar los resultados actuales y los condicionantes del pronóstico durante el TAVI emergente.
Métodos: Se realizó una búsqueda sistemática en PubMed y Google Scholar de cualquier estudio que comparara el TAVI electivo frente al emergente. Los términos empleados fueron «emergent» y/o «urgent», «elective», y «transcatheter valve replacement» y/o «heart failure» y/o «cardiogenic shock». Se consideró TAVI emergente todo procedimiento no programado realizado para tratar la insuficiencia cardiaca refractaria o el shock cardiogénico. Se utilizó un modelo de efectos aleatorios.
Resultados: Se incluyeron 7 estudios (84.427 pacientes) tratados con TAVI (14.241 emergentes y 70.186 electivos). Los casos electivos presentaron una mayor puntuación de riesgo (EuroSCORE logístico 65,9 ± 21 frente a 29,4 ± 18%, p < 0,001; Society of Thoracic Surgeons Risk Score 29,4 ± 27,4 frente a 13,7 ± 11,6%, p < 0,001). Presentaron una enfermedad cardiaca más avanzada, con peor función ventricular izquierda (39,5 ± 17,8 frente a 52,5 ± 12,8%; p < 0,001) y mayor diámetro telediastólico del ventrículo izquierdo (55 ± 9 frente a 48 ± 7 mm; p < 0,001), pese a tener similar área valvular aórtica y gradientes. El TAVI electivo tuvo mayor tasa de éxito (93,6 frente a 92,5%; odds ratio [OR] = 0,84; IC95%, 0,74-0,95; p = 0,005), con menor tasa de fallo renal agudo y menos necesidad de diálisis y de soporte circulatorio mecánico. En conjunto, los casos no emergentes tuvieron menor mortalidad intrahospitalaria (3,3 frente a 5,7%; p < 0,001), a 30 días (4,4 frente a 8,8%; p < 0,001) y a 1 año (19,7 frente a 34,75%; p = 0,0001). Los principales determinantes de mortalidad fueron la nueva necesidad de diálisis (OR = 2.26; IC95%, 1,84-2,76; p < 0,001) o requerir soporte circulatorio mecánico (OR = 2,55; IC95%, 1,14-5,67; p < 0,001).
Conclusiones: Los receptores de TAVI emergente presentaron peor riesgo basal y enfermedad cardiaca más avanzada, que determinaron una mayor mortalidad intrahospitalaria, a 30 días y a 1 año. La identificación precoz del riesgo de precisar soporte circulatorio mecánico o diálisis podría ayudar a una optimización de la indicación de TAVI emergente.
Palabras clave: Shock cardiogénico. Insuficiencia cardiaca. Implante percutáneo de válvula aórtica. Estenosis aórtica.
ABSTRACT
Introduction and objectives: Transcatheter aortic valve implantation (TAVI) has proven safe and effective in low-to-high risk patients, but emergency procedures have been excluded from the landmark trials. We aimed to assess the current outcomes and main factors conditioning the prognosis during emergency TAVI.
Methods: A systematic search in PubMed and Google Scholar was conducted for all studies comparing elective vs emergency TAVI. Searched terms were “emergency” and/or “urgent”, “elective”, and “transcatheter valve replacement” and/or “heart failure” and/or “cardiogenic shock”. Emergency TAVI was considered as any unscheduled TAVI performed to treat refractory heart failure or cardiogenic shock. A random-effects model was used.
Results: A total of 7 studies with 84 427 TAVI patients were included (14 241 emergency procedures; 70 186 elective TAVIs). Emergency cases presented higher risk scores (logistic EuroSCORE 65.9% ± 21% vs 29.4% ± 18%, P < .001; Society of Thoracic Surgeons Risk Score 29.4% ± 27.4% vs 13.7% ± 11.6%, P < .001). More advanced heart disease was observed with deterioration of left ventricular (LV) function (39.5% ± 17.8% vs 52.5% ± 12.8%; P < .001) and larger LV end-diastolic diameters (55 ± 9 mm vs 48 ± 7 mm; P < .001) despite similar aortic valve areas and gradients. Elective TAVIs presented a greater success rate (93.6% vs 92.5%; odds ratio [OR] = 0.84; 95%CI, 0.74-0.95; P = .005), less acute kidney injury, and a lower need for dialysis and mechanical circulatory support. Overall, non-emergency cases had lower in-hospital (3.3% vs 5.7%; P < .001), 30-day (4.4% vs 8.8%; P < .001) and 1-year mortality rates (19.7% vs 34.75%; P = .0001). The main determinants of mortality were need for new dialysis (OR = 2.26; 95%CI, 1.84-2.76; P < .001) or mechanical circulatory support (OR = 2.55; 95%CI, 1.14-5.67; P < .001).
Conclusions: Emergency TAVI recipients presented worse baseline risk and more advanced cardiac disease that determined greater in-hospital, 30-day, and 1-year mortality rates. The early identification of patients at risk for requiring mechanical circulatory support or dialysis may contribute to a better indication of TAVI in emergency scenarios.
Keywords: Cardiogenic shock. Heart failure. Transcatheter aortic valve replacement. Aortic stenosis.
Abreviaturas:
EA: estenosis aórtica. IRC: insuficiencia renal crónica. SC: shock cardiogénico. IC: insuficiencia cardiaca. RVAQ: reemplazo valvular aórtico quirúrgico. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
La estenosis aórtica (EA) es la valvulopatía más tratada en los países occidentales1. En un porcentaje relativamente pequeño pero creciente de pacientes (de entre el 3,5 y el 12%), la EA puede presentarse como shock cardiogénico (SC) con un índice de mortalidad estimado a corto plazo de hasta el 70% si no se trata, de forma definitiva, bien quirúrgica o percutáneamente2. El SC se caracteriza por una inadecuada perfusión tisular que es resultado de una enfermedad cardiaca descompensada y que se traduce en un estado de bajo gasto cardiaco. El tratamiento inicial consiste en mantener un perfil hemodinámico estable y garantizar la oxigenación de los tejidos mediante medicación y soporte avanzado3. No obstante, se necesitan tratamientos específicos si se quiere garantizar una resolución completa, si bien el reemplazo valvular aórtico quirúrgico (RVAQ) convencional suele asociarse a un riesgo muy alto de mortalidad2.
Varios estudios han demostrado que el implante percutáneo de válvula aórtica (TAVI) resulta una alternativa segura al RVAQ en pacientes de riesgo entre bajo y alto y en situaciones estables. En la actualidad, se considera la opción de elección en pacientes con un elevado riesgo quirúrgico4-7. En cualquier caso, se calcularon las escalas de riesgo para los principales estudios que fijaron las evidencias para el TAVI tras excluir a pacientes con SC. Como consecuencia, los principales resultados en esta situación tan desafiante no se han comparados aleatoriamente a los de la cirugía. Esta comparativa quizás nunca llegue a realizarse debido al perfil basal tan variable y la desigual disponibilidad de recursos, como los dispositivos de asistencia mecánica circulatoria. Además, los diferentes resultados del TAVI de urgencia y electivos tampoco se han estudiado mucho; aun así, son clave para mejorar los resultados del peor escenario clínico posible. Nuestro objetivo fue valorar los resultados actuales del TAVI en condiciones de emergencia/urgencia, así como los principales factores condicionantes de su pronóstico a través de una revisión sistemática y un metanálisis.
MÉTODOS
Estrategia de búsqueda en la literatura científica
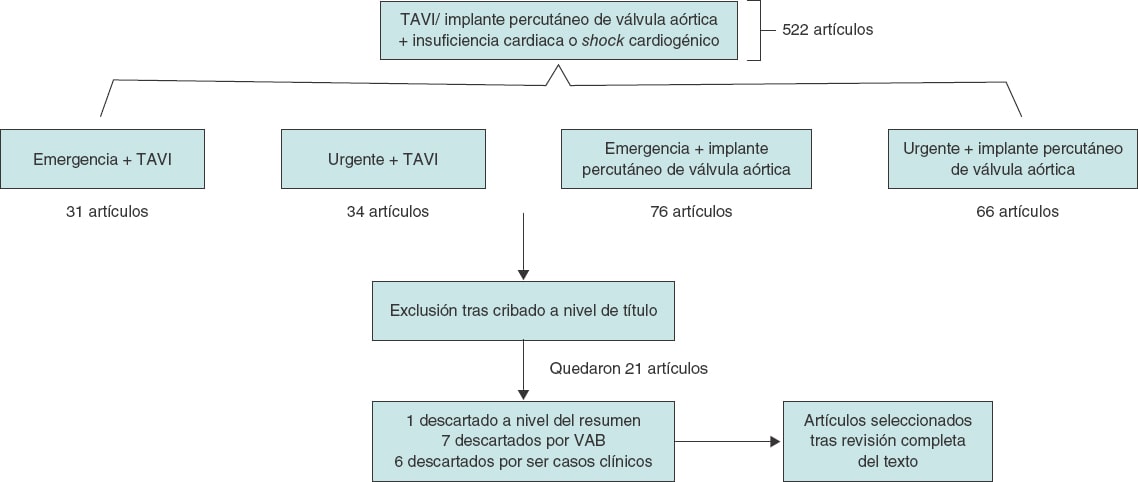
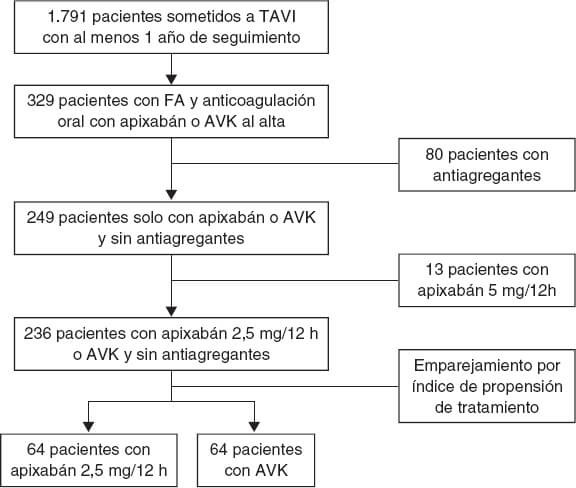
Entre enero de 2014 y enero de 2020, 2 autores independientes (AA y MCM) llevaron a cabo una revisión sistemática de todos los artículos publicados en las bases de datos de PubMed y Google Scholar sobre TAVI en condiciones de emergencia/urgencia frente a TAVI electivo para el tratamiento de la EA grave. Los términos objeto de la búsqueda fueron: «Emergente», «urgent», «elective» y «transcatheter valve replacement», «TAVR», «heart failure» o «cardiogenic shock». La definición de intervención en condiciones de emergencia/urgencia fue variable, si bien el consenso que se alcanzó para este artículo fue la inclusión de pacientes que necesitaron un TAVI no programado para tratar su insuficiencia cardiaca o SC refractarios y corregir esta patología durante las 72 horas siguientes a la hospitalización. Se escogió un total de 7 estudios8-14 y los criterios de inclusión establecidos por nuestro grupo fueron: a) la población del estudio incluyó a pacientes con estenosis aórtica que recibieron TAVI; b) solo se incluyeron estudios que hubieran comparado TAVI realizados en condiciones de emergencia o urgencia frente a procedimientos electivos; c) solo se escogieron artículos escritos completamente en inglés revisados por pares de los que se tenían suficientes datos. Los criterios de exclusión seleccionados fueron: a) resúmenes; b) casos clínicos; c) editoriales; d) opiniones de expertos y e) estudios repetitivos. Las discrepancias entre los revisores se resolvieron mediante discusión y consenso. La figura 1 muestra un diagrama de flujo y la tabla 1 del material adicional, las características principales de los estudios incluidos.
Figura 1. Diagrama de flujo con los resultados y selección de los estudios incluidos en el metanálisis.
Tabla 1. Características clínicas y ecocardiográficas basales de pacientes tratados con TAVI electivo o emergente
| Variable | Nº de pacientes | Población TAVI global n = 84.427 | TAVI electivo n = 70.186 (83,1%) | TAVI emergente/urgente n = 14.241 (16,9%) | p |
|---|---|---|---|---|---|
| Características clínicas | |||||
| Sexo (varón) (%) | 84.427 | 43.735/84.427 (51,8%) | 36.576/70.186 (52,11%) | 7.159/14.241 (50,27%) | < 0,001 |
| Edad (años) | 44.385 | 81,12 ± 8,47 | 81,16 ± 8,27 | 80,96 ± 9,08 | 0,041 |
| EuroSCORE (%) | 1.387 | 31,24 ± 18,15 | 29,42 ± 17,99 | 68,88 ± 20,97 | < 0,001 |
| Escala STS (%) | 985 | 14,76 ± 13,34 | 13,66 ± 11,61 | 29,39 ± 27,39 | < 0,001 |
| Anemia (%) | 42.524 | 11.415/42.524 (26,84%) | 8.004/32.382 (24,71%) | 3.411/10.142 (33,63%) | < 0,001 |
| Fibrilación auricular (%) | 41.185 | 17.373/41.885 (41,47%) | 15.304/37.780 (40,51%) | 2.069/4.105 (50,40%) | < 0,001 |
| EC (%) | 41.329 | 25.723/41.329 (62,24%) | 23.178/37.308 (62,13%) | 2.545/4.021 (63,29%) | 0,147 |
| ERC (%) | 83.308 | 17.948 /83.308 (21,54%) | 13.368/69.187 (19,32%) | 4.580/14.121 (32,43%) | < 0,001 |
| EPOC (%) | 84.398 | 25.081/84.398 (29,72%) | 20.315/70.157 (28,96%) | 4.766/14.241 (33,47%) | < 0,001 |
| Diabetes (%) | 84.040 | 29.670/84.040 (35,30%) | 24.571/69.820 (35,19%) | 5.099/14.220 (35,86%) | 0,130 |
| Hipertensión (%) | 83.308 | 70.608/83.308 (84,75%) | 59.117/69.187 (85,44%) | 11.491/14.121 (81,38%) | < 0,001 |
| NYHA III-IV (%) | 41.143 | 33.056/41.143 (80,34%) | 29.297/37.065 (79,04%) | 3.759/4.078 (92,17%) | < 0,001 |
| EAP (%) | 84.069 | 25.236/84.069 (30,02%) | 20.933/69.849 (29,96%) | 4.303/14.220 (30,26%) | 0,490 |
| Aorta de porcelana (%) | 40.669 | 2.158/40.669 (5,3%) | 1.914/36.669 (5,22%) | 244/4.000 (6,1%) | 0,018 |
| RVA previo (%) | 40.658 | 1.599/40.658 (3,93%) | 1.292/36.664 (3,53%) | 307/3.994 (7,69%) | < 0,001 |
| CABG previo (%) | 83.656 | 20.924/83.656 (25,01%) | 18.000/69.442 (25,92%) | 2.924/14.214 (20,57%) | < 0,001 |
| IM previo (%) | 83.040 | 15.173/83.040 (18,27%) | 12.597/68.868 (18,29%) | 2.576/14.172 (18,18%) | 0,747 |
| ICP previa (%) | 83.029 | 22.118/83.029 (26,64%) | 18.979/68.863 (27,56%) | 3.139/14.166 (22,16%) | < 0,001 |
| MP/DCI previo | 40.774 | 8.304/40.774 (20,36%) | 7.401/36.723 (20,15%) | 903/4.051 (22,29%) | 0,001 |
| ACV/AIT previo (%) | 42.244 | 8.815/42.244 (20,87%) | 7.884/38.118 (20,68%) | 931/4.126 (22,57%) | 0,005 |
| Características ecocardiográficas | |||||
| Área valvular aórtica (cm²) | 2.230 | 0,7 ± 0,23 | 0,7 ± 0,23 | 0,66 ± 0,21 | 0,308 |
| DTDVI (mm) | 616 | 48,98 ± 7,34 | 48,53 ± 7,20 | 55,05 ± 9,03 | < 0,001 |
| FEVI (%) | 1.861 | 51,51 ± 13,24 | 52,23 ± 12,71 | 29,58 ± 14,89 | < 0,001 |
| Gradiente medio (mmHg) | 1.398 | 43,71 ± 16,42 | 43,91 ± 16,31 | 40,26 ± 18,29 | 0,061 |
| IA III-IV (%) | 41.032 | 8.156/41.032 (19,88%) | 7.159/37.033 (19,33%) | 997/3.999 (24,93%) | < 0,001 |
| HTP (%) | 43.251 | 2.003/43.251 (4,63%) | 1.536/33.088 (4,64%) | 467/10.163 (4,6%) | 0,843 |
|
DCI: desfibrilador-cardioversor implantable; DTDVI: diámetro telediastólico del ventrículo izquierdo; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IA: insuficiencia aórtica; HTP: hipertensión pulmonar; ICP: intervención coronaria percutánea; IM: infarto de miocardio; ERC: enfermedad renal crónica; MP: marcapasos; NYHA: New York Heart Association; RVA: reemplazo valvular aórtico; STS: Society of Thoracic Surgeons score; TAVI: implante percutáneo de válvula aórtica. |
|||||
Objetivos primarios
Los objetivos primarios fueron la mortalidad a corto plazo y el éxito de la intervención. Los objetivos secundarios fueron las complicaciones perioperatorias. Las complicaciones se reportaron utilizando, principalmente, las definiciones establecidas por el Valve Academic Research Consortium-215.
Análisis estadístico
Las variables cualitativas se expresaron como frecuencia absoluta y porcentaje; las continuas, como media ± desviación estándar salvo que se especificara de otro modo. Para comparar las variables demográficas y los factores de riesgo entre ambos grupos se emplearon la prueba de la X2 o la prueba exacta de Fisher para el estudio de las variables categóricas. La prueba t de Student se empleó para comparar las variables continuas, si así fuese necesario.
Como medida del efecto combinado, los estudios incorporaron el odds ratio (OR), un intervalo de confianza del 95% y significación estadística. La homogeneidad entre los distintos estudios se comparó utilizando la estadística QH. Con respecto a la baja sensibilidad de esta prueba, valores p < 0,10 se consideraron significativos. Para superar, de alguna forma, esta limitación se calculó también el índice estadístico I2, que mide el porcentaje de variación global de los estudios explicado por la heterogeneidad y por su IC95%. Se empleó un modelo de efectos aleatorios para casos con índices estadísticos I2 > 50%y un modelo de efectos fijos para los casos contrarios. El posible seso de publicación se valoró mediante un gráfico de embudo y empleando la prueba de Egger y la de correlación de rango ajustado de Begg y Mazumdar. En presencia de sesgo de publicación, se empleó el método de recorte y relleno para volver a valorar el OR combinado. También se realizaron análisis de sensibilidad para eliminar secuencialmente estudios distintos.
Todos los valores de p fueron bilaterales. Los análisis estadísticos se realizaron utilizando el software R, versión 3.6.1 (proyecto R para estadística computacional) y Review Manager 5.3.
RESULTADOS
Distribución de los pacientes y características basales
Se seleccionaron 7 estudios con un total de 84.427 pacientes tratados con TAVI [70.186 procedimientos electivos (83,1%) y 14.241 emergentes (16,9%)]. Las principales características basales según el carácter electivo o emergente del procedimiento se muestran en la tabla 1 y los análisis de sensibilidad y asimetría en la tabla 2 del material adicional y figura 1 del material adicional. Se detectó asimetría en el daño renal agudo, por lo que hubo que emplear el método de recorte y relleno para volver a valorar el odds ratio. El porcentaje de varones que recibieron procedimientos electivos (52,1%) fue mayor que el de aquellos que recibieron procedimientos de emergencia (50,27%, p < 0,01). En líneas generales, los pacientes tratados en condiciones de emergencia/urgencia tuvieron más comorbilidades tal y como revelaron la escala EuroSCORE logistic (65,9% ± 21% frente al 29,4% ± 18%, p < 0,001) y el modelo de riesgo de la escala de riesgo de la Society of Thoracic Surgeons (STS) (29,4 ± 27,4 frente a 13,7 ± 11,6, p < 0,001). No obstante, los factores tradicionales de riesgo cardiovascular no variaron entre los distintos grupos (hipertensión y diabetes mellitus) y los índices de infarto de miocardio e intervención coronaria percutánea fueron similares. Por el contrario, los pacientes más propensos a ser tratados en condiciones de urgencia ya habían sido tratados mediante reemplazo valvular aórtico quirúrgico previo. En lo que a las principales características ecocardiográficas se refiere, los procedimientos emergentes se realizaron en pacientes con deterioro de la función del ventrículo izquierdo (VI) (39,5% ± 17,8% frente al 52,5% ± 12,8%; p < 0,001), diámetros telediastólicos VI más grandes (55 ± 9 frente a 48 ± 7; p < 0,001), pero áreas valvulares aórticas (0,66 ± 0,21 frente a 0,70 ± 0,23; p < 0,308) y gradientes medios transaórticos similares (40,3 ± 18,3 frente a 43,9 ± 16,3; p < 0,061).
Tabla 2. Características de la intervención de pacientes tratados con TAVI electivo o emergente/urgente
| Variable | Nº de pacientes | Población TAVI global | TAVI electivo | TAVI emergente/urgente | p |
|---|---|---|---|---|---|
| Índice de éxito (%) | 41.140 | 38.765/41.440 (93,54%) | 35.038/37.413 (93,65%) | 3.727/4.027 (92,55%) | 0,007 |
| Migración del dispositivo (%) | 40.042 | 105/40.042 (0,26%) | 90/36.090 (0,25%) | 15/3.952 (0,38%) | 0,129 |
| Anestesia general (%) | 40.669 | 34.419/40.669 (84,6%) | 31.004/36.669 (84,55%) | 3.415/4.000 (85,37%) | 0,170 |
| Transapical (%) | 83.953 | 14.742/83.953 (17,56%) | 12.194/69.790 (17,47%) | 2.548/14.163 (18%) | 0,139 |
| Transfemoral (%) | 83.811 | 66.526/83.811 (79,38%) | 55.196/69.612 (79,29%) | 11.330/14.199 (79,79%) | 0,177 |
| Transubclavio (%) | 40.813 | 643/40.813 (1,57%) | 573/36.834 (1,55%) | 70/3.979 (1,76%) | 0,327 |
| Soporte circulatorio mecánico (%) | 83.326 | 1.858/83.326 (2,29%) | 1.355/69.211 (1,96%) | 503/14.115 (3,56%) | < 0,001 |
|
TAVI: implante percutáneo de válvula aórtica. |
|||||
Características perioperatorias
Los resultados de la intervención en los estudios incluidos se muestran en la tabla 2. El abordaje transfemoral (79,3% frente al 76.8%; p = 0,177) y el uso de anestesia general (84.5% frente a 85.4%; p = 0,17) fueron los abordajes preferidos en los 2 grupos. El índice de éxito quirúrgico de los procedimientos electivos fue mayor (93,6% frente al 92,5%; p = 0,007) y la necesidad de soporte circulatorio mecánico menor (1,96% frente al 3,56 %; p < 0,001). Otros resultados de la intervención fueron comparables entre ambas cohortes.
Resultados posoperatorios
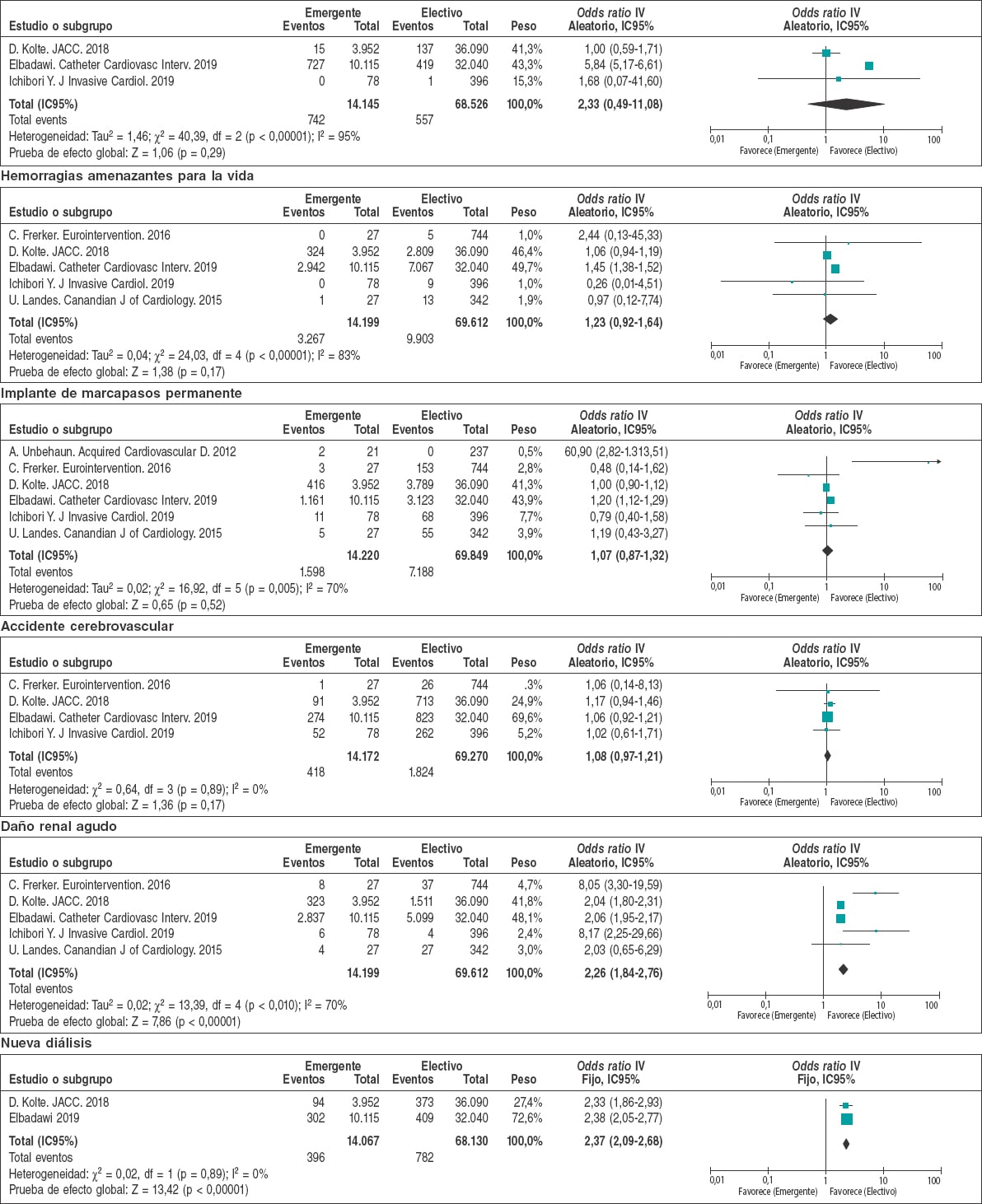
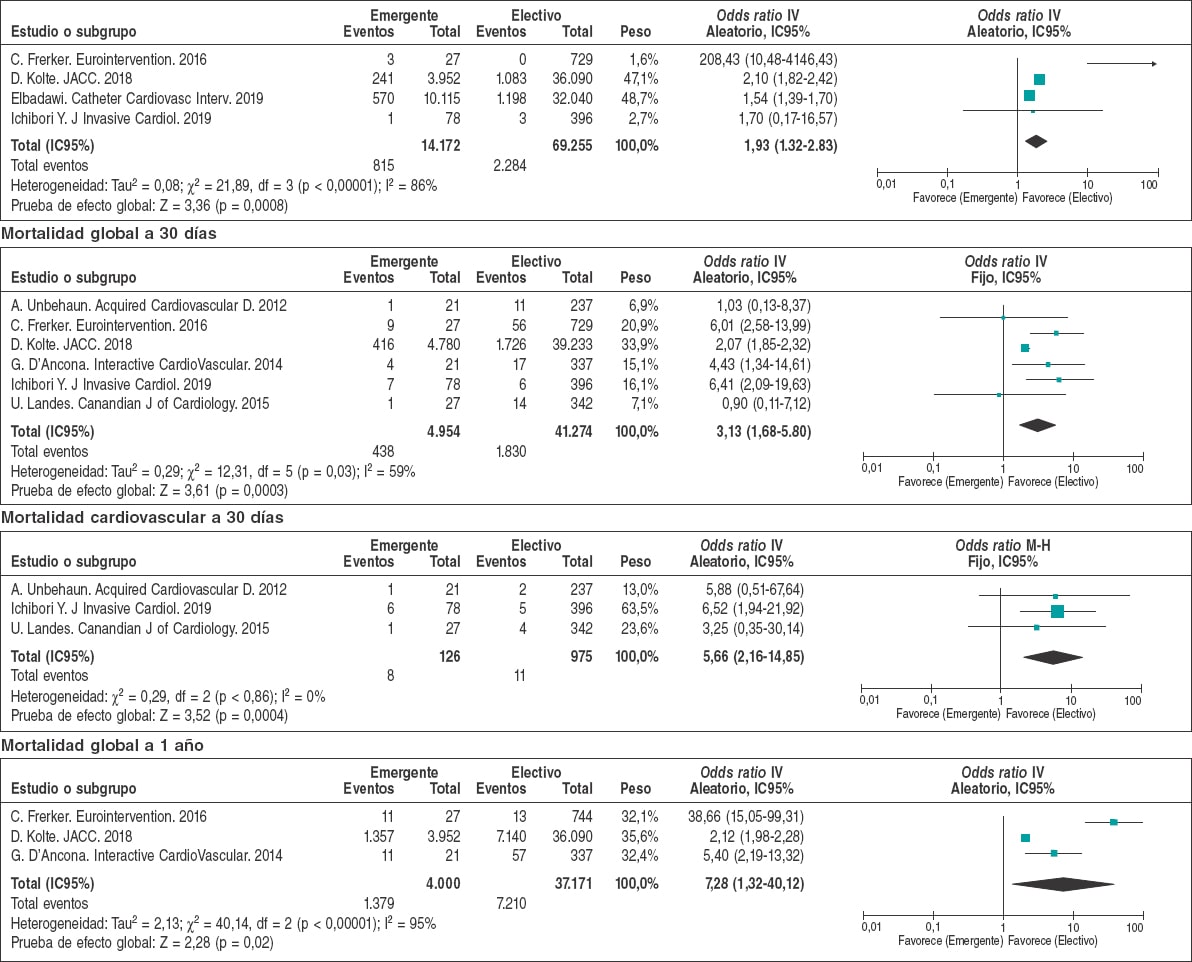
Los principales resultados posoperatorios se muestran en la tabla 3 y en la figura 2. Los OR para el infarto de miocardio, hemorragias amenazantes para la vida, necesidad de implantar un marcapasos permanente y accidentes cerebrovasculares perioperatorios fueron similares con independencia de que el procedimiento fuera programado o emergente. Por el contrario, la cohorte electiva tuvo índices más bajos de daño renal agudo (9,6% frente al 22,4%; OR = 2,26; IC95%, 1,84-2,76; p < 0,001) y necesidad de diálisis (1,1% frente al 2,8%; OR = 2,37; IC95%, 2,09-2,68; p < 0,001). En líneas generales, esto se tradujo en estancias hospitalarias más cortas para los casos electivos y en índices, también más bajos, de mortalidad intrahospitalaria (3,3% frente al 5,75%; OR = 1,32; IC95%, 1,32-2,83; p < 0,001), a los 30 días (4,43% frente al 8,84%; OR = 3,13; IC95%, 1,68-5,80; p < 0,001) y a 1 año (19,7% frente al 34,47%; OR = 2,87; IC95%, 1,67-4,94; p = 0,0001) para los procedimientos electivos (figura 3).
Tabla 3. Principales resultados posoperatorios de pacientes tratados con TAVI electivo o emergente/urgente
| Variable | Nº de pacientes | Población TAVI global | TAVI electivo | TAVI emergente/urgente | p |
|---|---|---|---|---|---|
| Resultados clínicos | |||||
| Hemorragias amenazantes para la vida (%) | 83.811 | 13.170/83.811 (15,71%) | 9.903/69.612 (14,22%) | 3.267/14.199 (23,01%) | < 0,001 |
| Hemorragias mayores (%) | 43.400 | 14.725/43.400 (33,93%) | 11.065/33.180 (33,35%) | 3.660/10.220 (35,81%) | < 0,001 |
| Complicaciones vasculares mayores (%) | 41.656 | 513/41.656 (1,23%) | 460/37.572 (1,22%) | 53/4.084 (1,29%) | 0,686 |
| Infarto de miocardio (%) | 82.671 | 1.299/82.671 (1,57%) | 557/68.526 (0,81%) | 742/14.145 (5,24%) | < 0,001 |
| Daño renal agudo (%) | 83.811 | 9.856/83.811 (11,75%) | 6.678/69.612 (9,59%) | 3.178/14.199 (22,38%) | < 0,001 |
| Necesidad de diálisis (%) | 82.197 | 1.178/82.197 (1,43%) | 782/68.130 (1,15%) | 396/14.067 (2,81%) | < 0,001 |
| IMP (%) | 84.069 | 8.786/84.069 (10,45%) | 7.188/69.849 (10,29%) | 1.598/14.220 (11,24%) | < 0,001 |
| ACV (%) | 83.442 | 2.242/83.442 (2,69%) | 1.824/69.270 (2,63%) | 418/14.172 (2,94%) | 0,034 |
| Índice de mortalidad intrahospitalaria | 83.427 | 3.099/83.427 (3,71%) | 2.284/69.255 (3,3%) | 815/14.172 (5,75%) | < 0,001 |
| Índice de mortalidad a 30 días | 46.228 | 2.268/46.228 (4,9%) | 1.830/41.274 (4,43%) | 430/4.954 (8,84%) | < 0,001 |
| Índice de mortalidad a 1 año | 41.156 | 8.706/41.156 (21 15%) | 7.327/37.156 (19,72%) | 1.379/4.000 (34,75%) | < 0,001 |
| Resultados ecocardiográficos | |||||
| Gradiente medio (mmHg) | 369 | 7,75 ± 4,15 | 7,82 ± 4,22 | 6,9 ± 3,2 | 0,269 |
| IA III-IV (%) | 17.977 | 1.465/17.977 (8,15%) | 1.299/16.125 (8,05%) | 166/1.852 (8,96%) | 0,176 |
|
ACV: accidente cerebrovascular; IA: insuficiencia aórtica; IMP: implante de marcapasos permanente; TAVI: implante percutáneo de válvula aórtica. |
|||||
Figura 2. Diagrama de bosque con las principales complicaciones posoperatorias de pacientes incluidos en el metanálisis.* * La línea vertical representa un punto «sin diferencia» entre los grupos de TAVI emergente o electivo. Las líneas horizontales representan el IC95%. Los cuadrados representan el OR para cada estudio (el tamaño de cada cuadrado es la cantidad de información proporcionada por cada estudio). Los rombos representan los OR combinados de todos los estudios.
Figura 3. Diagrama de bosque con los índices de mortalidad intrahospitalaria y a 1 año de pacientes incluidos en el metanálisis.* * La línea vertical representa un punto «sin diferencia» entre los grupos de TAVI emergente o electivo. Las líneas horizontales representan el IC95%. Los cuadrados representan el OR para cada estudio (el tamaño de cada cuadrado es la cantidad de información proporcionada por cada estudio). Los rombos representan los OR combinados de todos los estudios.
DISCUSIÓN
Cuando pacientes con EA presentan insuficiencia cardiaca (IC) aguda grave o SC, la mortalidad por cualquier causa al cabo de 5 años está por encima del 60% a pesar de la implementación de terapias para tratar la valvulopatía, un índice que no resiste la comparación en pacientes sin IC (~20%) ni síntomas de IC crónica (~30%) en este marco (16). Determinar qué factores condicionan un índice de mortalidad tan alto es clave para mejorar el manejo de este grupo de pacientes que va en aumento. Los principales hallazgos de este estudio son: a) los pacientes que precisaron TAVI emergentes presentaban un riesgo basal más alto que los que precisaron procedimientos programados, no solo por la situación de emergencia sino también por la alta carga de comorbilidades y deterioro de la función VI; b) aunque el índice de éxito de la intervención fue mucho mayor en los casos programados, la diferencia fue poca (93,6% frente al 92,5%; p = 0,007). Esto sugiere que los índices más altos de mortalidad a corto y medio plazo de los casos emergentes se debieron, principalmente, a las complicaciones posoperatorias y no al procedimiento propiamente dicho; c) la necesidad de soporte circulatorio mecánico y diálisis fue mayor después de los casos emergentes. Identificar precozmente qué pacientes de riesgo podrían requerir estos tratamientos es útil para una mejor indicación de TAVI en situaciones de emergencia.
Características basales y mortalidad estimada
En nuestro estudio, los pacientes con TAVI emergente/urgente presentaban muchas más comorbilidades que los que recibieron el procedimiento electivo. Se debe mencionar que la escala de STS se viene empleando para valorar el riesgo de mortalidad en pacientes con RVAQ17. En cualquier caso, es posible que la escala desarrollada por el grupo de trabajo Transcatheter Valve Therapy (TVT) para evaluar los índices de mortalidad intrahospitalaria y al cabo de 30 días18 sea más precisa. Según esa escala, el pronóstico tiene mucho que ver con la presencia de enfermedad renal crónica (ERC), enfermedad pulmonar obstructiva crónica y necesidad de TAVI emergente. Cabe destacar que la EA con ERC concomitante se asocia a índices de mortalidad por cualquier causa y cardiovascular más altos que la EA sin dicha patología; de hecho, esta mayor mortalidad por cualquier causa se correlaciona exponencialmente con un descenso de la tasa de filtración glomerular19. Además, tanto el índice más alto de anemia20 como el mayor riesgo hemorrágico de pacientes con ERC son bien conocidos, lo cual condiciona una mayor necesidad de transfusión de glóbulos rojos21 y, paralelamente, el deterioro de la función renal y del índice de supervivencia.
La función del VI es un factor pronóstico bien conocido de la valvulopatía y su deterioro condiciona el tratamiento quirúrgico o percutáneo de la válvula aórtica, incluso en pacientes asintomáticos22. Se debe mencionar que el similar gradiente transaórtico, a pesar de una función VI reducida en los casos basales emergentes, y el mayor índice de insuficiencia aórtica de esta cohorte sugieren la presencia de una valvulopatía más grave y de probables válvulas nativas más calcificadas y degeneradas. Por esta razón, un abordaje multidisciplinario y con múltiples imágenes podría ser especialmente útil a efectos de programar la intervención y con vistas a mejorar los resultados23.
Mortalidad y complicaciones asociadas a la intervención
La mayoría de las complicaciones asociadas a la intervención fueron similares tanto en los procedimientos electivos como en los emergentes. Aunque esto podría explicarse, en parte, por la mayor experiencia de los operadores, a nivel internacional, y por la falta de diferencias en el índice de abordaje transfemoral24, el mayor uso de dispositivos de soporte circulatorio mecánico podría haber sido especialmente relevante en cohortes emergentes/urgentes. De hecho, la reserva contráctil del VI más limitada de este grupo de pacientes puede condicionar un rápido deterioro en presencia de complicaciones tales como shunt perianular, insuficiencia aórtica severa u obstrucción coronaria. Por lo tanto, la presencia de factores de riesgo para estas complicaciones sugiere la necesidad de implantar dispositivos de soporte circulatorio en determinados casos antes implantar la prótesis valvular como posible estrategia para evitar los pronósticos nefastos que pueden llegar a darse en los procedimientos emergentes25-27. Anteriores experiencias con el dispositivo Impella y el oxigenador extracorpóreo de membrana (ECMO) se pueden consultar en la tabla 3 del material adicional; no obstante, si hay diferencias de mortalidad entre pacientes con y sin soporte mecánico es algo que se debe seguir investigando. Como el éxito de la intervención fue similar al que se obtiene en el ámbito estándar, la traducción clínica que se puede hacer de esto es que, aunque estos casos pueden resolverse con éxito en todos los centros que realizan TAVI, este perfil de pacientes solo debería tratarse en centros que dispongan de dispositivos de soporte circulatorio mecánico, sobre todo ECMO. Los centros de bajo volumen o los no quirúrgicos quedarían excluidos.
El presente metanálisis no incluyó ningún caso tratado exclusivamente mediante valvuloplastia aórtica. Esta estrategia tiene un nivel de evidencia clase IIb-C en la última versión de las guías clínicas, pero se suele emplear como terapia puente hasta el TAVI definitivo en pacientes hemodinámicamente inestables28,29. Un estudio retrospectivo de un único centro halló que el procedimiento de TAVI podría ser superior solo a la valvuloplastia aórtica y al tratamiento médico en pacientes con EA y SC graves, ya que la valvuloplastia aórtica aislada no está exenta de complicaciones (~25%) y presenta índices de mortalidad más altos30. A pesar de esto, se echan en falta extensos estudios controlados y aleatorizados que exploren este escenario con TAVI.
Complicaciones posoperatorias asociadas a un índice más alto de mortalidad
En esta revisión sistemática y metanálisis, se descubrió que los procedimientos TAVI realizados en condiciones de emergencia/urgencia tenían un índice mucho más alto de daño renal agudo (DRA), hemodiálisis y mortalidad. Esto coincide con lo descrito en casos anteriores que confirmaron que los pacientes con DRA post-TAVI eran más propensos a fallecer. El DRA es, además, un predictor de la sepsis, que es, a su vez, un predictor independiente de la mortalidad. Los principales factores que aumentan el riesgo de DRA son la ERC, enfermedad arterial periférica, la diabetes mellitus y el deterioro de la función VI31,32. La estrategia profiláctica va desde la simple hidratación con una solución salina normal hasta diuresis forzada con medidas de soporte precoz33; de hecho, se ha explorado el uso de diálisis profiláctica en pacientes tratados con TAVI y alto riesgo de DRA que podría ser especialmente útil en el ámbito de la emergencia.
Limitaciones del estudio
Son varias las limitaciones asociadas a esta revisión sistemática y metanálisis. En primer lugar, los estudios incluidos fueron observacionales porque no se pudo encontrar ningún estudio aleatorizado multicéntrico que abordara específicamente esta cuestión. En segundo lugar, la definición de procedimiento emergente/urgente fue variable en los diferentes estudios, si bien el equipo del estudio logró elaborar una definición inclusiva. Por último, los resultados podrían no ser extrapolables por lo que deberían interpretarse con cautela debido a la alta heterogeneidad descrita, lo cual estaría asociado a la variabilidad de las muestras y diseños de los estudios.
CONCLUSIONES
La relación entre TAVI en condiciones de emergencia/urgencia y un índice más alto de mortalidad a corto/medio plazo se debe, principalmente, a un perfil basal de riesgo alto, a la fase avanzada de la enfermedad cardiaca y a un índice más alto de daño renal agudo. La identificación y derivación precoces de pacientes de alto riesgo de colapso circulatorio o DRA se debe llevar a cabo convenientemente para reducir el índice de mortalidad asociado a TAVI. Se necesitan seguir investigando para determinar el papel del TAVI en escenarios emergentes o urgentes.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
I.J. Amat-Santos es proctor de Boston Scientific.
¿QUÉ SE SABE DEL TEMA?
- El TAVI se realiza, principalmente, en pacientes estables a nivel hemodinámico. De lo contrario, la valvuloplastia aórtica es el tratamiento empírico preferido como terapia puente hasta poder realizar el TAVI. No obstante, son pocos los estudios que han analizado el TAVI en escenarios amenazantes para la vida e inexistentes los estudios controlados aleatorizados y multicéntricos realizados a este respecto.
¿QUÉ APORTA DE NUEVO?
- En este extenso metanálisis combinado (n = 84.427) los TAVI emergentes no fueron algo excepcional sino que se asociaron a índices más altos de mortalidad intrahospitalaria, a 30 días y 1 año comparados con los TAVI electivos. La necesidad de diálisis o soporte circulatorio mecánico condicionó el índice de mortalidad post-TAVI emergente. La identificación precoz de pacientes en riesgo de colapso circulatorio o daño renal agudo podría ayudar a determinar si el TAVI es fútil en este ámbito.
BIBLIOGRAFÍA
1. Thaden JJ., Nkomo VT., Enriquez-Sarano M. The Global Burden of Aortic Stenosis. Prog Cardiovasc Dis. 2014;56:565-571.
2. Akodad M., Schurtz G., Adda J., Leclercq F., Roubille F. Management of valvulopathies with acute severe heart failure and cardiogenic shock. Arch Cardiovasc Dis. 2019;112:773-780.
3. Castrodeza J, Serrador Frutos AM, Amat-Santos IJ, et al. Prophylactic percutaneous circulatory support in high risk transcatheter aortic valve implantation. Cardiol J. 2019;26:424-426.
4. Smith CR., Leon MB., Mack MJ., et al. Transcatheter versus Surgical Aortic-Valve Replacement in High-Risk Patients. New Engl J Med. 2011;364:2187-2198.
5. Leon MB., Smith CR., Mack MJ., et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. New Engl J Medicine. 2016;374:1609-1620.
6. Reardon MJ., Mieghem NMV., Popma JJ., et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. New Engl J Medicine 2017;376:1321-1331.
7. Waksman R., Rogers T., Torguson R., et al. Transcatheter Aortic Valve Replacement in Low-Risk Patients with Symptomatic Severe Aortic Stenosis. J Am Coll Cardiol. 2018;72:2095-2105.
8. D'Ancona G., Pasic M., Buz S., et al. Transapical transcatheter aortic valve replacement in patients with cardiogenic shock. Interact Cardiov Th. 2012;14:426-430.
9. Unbehaun A., Pasic M., Buz S., et al. Transapical aortic valve implantation in patients with severely depressed left ventricular function. J Thorac Cardiovasc Surg. 2012;143:1356-1363.
10. Landes U., Orvin K., Codner P., et al. Urgent Transcatheter Aortic Valve Implantation in Patients With Severe Aortic Stenosis and Acute Heart Failure:Procedural and 30-Day Outcomes. Can J Cardiol. 2016;32:726-31.
11. Frerker C., Schewel J., Schlüter M., et al. Emergente transcatheter aortic valve replacement in patients with cardiogenic shock due to acutely decompensated aortic stenosis. Eurointervention. 2016;11:1530-1536.
12. Kolte D., Khera S., Vemulapalli S., et al. Outcomes Following Urgent/Emergency Transcatheter Aortic Valve Replacement:Insights from the STS/ACC TVT Registry. Jacc Cardiovasc Interventions 2018;11:1175-1185.
13. Elbadawi A., Elgendy IY., Mentias A., et al. Outcomes of urgent versus nonurgent transcatheter aortic valve replacement. Catheter Cardiovasc Interv. 2020 Jul;96:189-195.
14. Ichibori Y., Li J., Patel T., et al. Short-Term and Long-Term Outcomes of Patients Undergoing Urgent Transcatheter Aortic Valve Replacement Under a Minimalist Strategy. J Invasive Cardiol. 2019:E30-E36.
15. Kappetein AP., Head SJ., Généreux P., et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation:the Valve Academic Research Consortium-2 consensus document. Eur Heart J. 2012;33:2403-2418.
16. Nagao K., Taniguchi T., Morimoto T., et al. Acute Heart Failure in Patients With Severe Aortic Stenosis- Insights From the CURRENT AS Registry. Circ J. 2018;82:874-885.
17. Yakubov SJ., Adams DH., Watson DR., et al. 2-Year Outcomes After Iliofemoral Self-Expanding Transcatheter Aortic Valve Replacement in Patients With Severe Aortic Stenosis Deemed Extreme Risk for Surgery. J Am Coll Cardiol. 2015;66:1327-1334.
18. Arnold SV., O'Brien SM., Vemulapalli S., et al. Inclusion of Functional Status Measures in the Risk Adjustment of 30-Day Mortality After Transcatheter Aortic Valve Replacement A Report From the Society of Thoracic Surgeons/American College of Cardiology TVT Registry. JACC Cardiovasc Interv. 2018;11:581-589.
19. Patel KK., Shah SY., Arrigain S., et al. Characteristics and Outcomes of Patients With Aortic Stenosis and Chronic Kidney Disease. J Am Heart Assoc. 2019 Feb 5;8:e009980.
20. DeLarochellière H., Urena M., Amat-Santos IJ., et al. Effect on Outcomes and Exercise Performance of Anemia in Patients With Aortic Stenosis Who Underwent Transcatheter Aortic Valve Replacement. Am J Cardiol. 2015;115:472-479.
21. Kanjanahattakij N., Rattanawong P., Krishnamoorthy P., et al. Anaemia and mortality in patients with transcatheter aortic valve replacement:a systematic review and meta-analysis. Acta Cardiol. 2018;74:1-7.
22. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
23. Fassa A-A., Himbert D., Vahanian A. Mechanisms and management of TAVR-related complications. Nat Rev Cardiol. 2013;10:685-695.
24. TerréJA., George I., Smith CR. Pros and cons of transcatheter aortic valve implantation (TAVI). Ann Cardiothorac Surg. 2017;6:444-452.
25. Chieffo A., Ancona MB., Burzotta F., et al. Observational multicentre registry of patients treated with IMPella mechanical circulatory support device in ITaly:the IMP-IT registry. EuroIntervention. 2020 Feb 7;15:e1343-e1350.
26. Singh V., Damluji AA., Mendirichaga R., et al. Elective or Emergency Use of Mechanical Circulatory Support Devices During Transcatheter Aortic Valve Replacement. J Interv Cardiol. 2016;29:513-522.
27. Shreenivas SS., Lilly SM., Szeto WY., et al. Cardiopulmonary bypass and intra?aortic balloon pump use is associated with higher short and long term mortality after transcatheter aortic valve replacement:A PARTNER trial substudy. Catheter Cardiovasc Interv. 2015:316-322.
28. Singh V, Damluji AA, Mendirichaga R, et al. Elective or Emergency Use of Mechanical Circulatory Support Devices During Transcatheter Aortic Valve Replacement. J Interv Cardiol. 2016;29:513-522.
29. Baumgartner H., Falk V., Bax JJ., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
30. Saia F., Marrozzini C., Ciuca C., et al. Emerging indications, in-hospital and long-term outcome of balloon aortic valvuloplasty in the transcatheter aortic valve implantation era. Eurointervention. 2013;8:1388-1397.
31. Ram P., Mezue K., Pressman G., Rangaswami J. Acute kidney injury post-transcatheter aortic valve replacement. Clin Cardiol. 2017;40:1357-1362.
32. Wang J., Yu W., Zhou Y., et al. Independent Risk Factors Contributing to Acute Kidney Injury According to Updated Valve Academic Research Consortium-2 Criteria After Transcatheter Aortic Valve Implantation:A Meta-analysis and Meta-regression of 13 Studies. J Cardiothor Vasc An. 2017;31:816-826.
33. Putzu A, Berto MB, Belletti A, et al. Prevention of contrast-induced acute kidney injury by furosemide with matched hydration in patients undergoing interventional procedures:a systematic review and meta-analysis of randomized trials. JACC Cardiovasc Interv. 2017;10:355-363.

RESUMEN
Introducción y objetivos: Analizar la asociación entre algunas variables estructurales de los centros tratantes (disponibilidad de cirugía cardiaca y de unidad de cuidados intensivos cardiológicos [UCIC]), así como su volumen de procedimientos, con los resultados del reemplazo quirúrgico de válvula aórtica (RQVA) o transcatéter (TAVI).
Métodos: Estudio observacional retrospectivo de todos los pacientes dados de alta en los hospitales del Sistema Nacional de Salud español a quienes se realizó un procedimiento RQVA o TAVI en los años 2014 y 2015. La fuente de los datos fue el Conjunto Mínimo Básico de Datos. Las variables de resultados analizadas fueron la mortalidad intrahospitalaria, la duración de la estancia (ambas ajustadas por el riesgo) y la presencia de complicaciones. La disponibilidad de cirugía cardiaca y la disponibilidad de UCIC se utilizaron como variables estructurales de los centros.
Resultados: Se analizaron 2.055 TAVI y 15.146 RQVA. Los modelos de ajuste para la mortalidad intrahospitalaria mostraron una buena discriminación (área bajo la curva
ROC para el modelo conjunto de TAVI y RQVA: 0,84; IC95%, 0,82-0,85) y calibración (p < 0,001). La odds ratio mediana del modelo fue de 1,73, lo que señala una elevada variabilidad interhospitalaria. Los hospitales con mayor volumen de actividad, con servicio de cirugía cardiaca y dotados de UCIC muestran menor mortalidad ajustada al riesgo en ambos procedimientos.
Conclusiones: Se observa una asociación consistente entre las características estructurales de los centros tratantes y los resultados del reemplazo valvular aórtico, tanto quirúrgico como transcatéter. Además, la disponibilidad de UCIC podría ser un factor relevante en los resultados de dichos procedimientos.
Palabras clave: TAVI. Volumen. Resultados. Estenosis aórtica. Cirugía.
ABSTRACT
Introduction and objectives: To analyze if there is an association between certain structural variables of the treating centres (availability of cardiac surgery and an intensive care unit [CICU] led by cardiologists) and the volume of procedures performed that may be impacting the results of surgical (SAVR) or transcatheter (TAVI) aortic valve treatment.
Methods: Retrospective and observational study of all patients discharged from hospitals from the Spanish National Health System who underwent a SAVR or a TAVI procedure. The source of the data was the administrative minimum basic data set. The outcome variables analyzed were in-hospital mortality, length of stay (both of them risk-adjusted), and presence of complications. As structural variables for the centers studied we used the availability of cardiac surgeries and CICU.
Results: A total of 2055 TAVI and 15 146 SAVR episodes were identified. The adjustment models for in-hospital mortality showed good discrimination (
AUC for the SAVR and TAVI model: 0.84; 95%CI, 0.82-0.85) and calibration (P < .001). The model median odds ratio was 1.73, indicative of a high inter-hospital variability. High-volume hospitals, with cardiac surgery services, and CICU-capable centers had the lowest risk-adjusted mortality rate in both procedures.
Conclusions:A consistent association is observed between the structural characteristics of the treating centers and the results of aortic valve management both surgical and transcatheter. Also, the availability of a CICU could be a relevant factor in the outcomes of these procedures.
Keywords: TAVI. Volume. Results. Aortic stenosis. Surgery.
Abreviaturas
CMBD: conjunto mínimo básico de datos. RAMER: razón de mortalidad hospitalaria estandarizada por riesgo. REAR: razón de estancia ajustada por riesgo. RQVA: reemplazo quirúrgico de válvula aórtica. TAVI: implantación de válvula aórtica transcatéter.
INTRODUCCIÓN
La estenosis aórtica grave es una enfermedad frecuente en nuestro medio, con una alta morbimortalidad, cuyo tratamiento básico es el reemplazo valvular1. Al clásico reemplazo quirúrgico de válvula aórtica (RQVA) se ha sumado en las últimas dos décadas el implante percutáneo de válvula aórtica (TAVI)2.
Existen datos claros de la asociación entre los resultados y determinadas características de los centros. El hecho más descrito en la literatura es que se obtienen mejores resultados, en cuanto a mortalidad y complicaciones, en los centros que alcanzan un umbral de actividad (por centro y por operador) para determinados procesos y procedimientos3-7, incluyendo la cirugía de revascularización aortocoronaria (CABG)5,8 y la angioplastia primaria9-11. La asociación entre el volumen y los resultados para el TAVI se ha descrito en hospitales de los Estados Unidos12-14. En Alemania, esta asociación es menos evidente15. En España, la asociación entre volumen y resultados también se ha descrito para la CABG16.
Menos frecuentes son los estudios que analizan las características estructurales de los centros, relacionadas a su vez con las características propias de los sistemas sanitarios de cada país, y los resultados. En España, Bertomeu et al.17 hallaron una menor mortalidad en los pacientes con infarto agudo de miocardio (IAM) en los centros de mayor volumen y complejidad. Worner et al.18 describieron una menor mortalidad en el IAM en hospitales con unidad de cuidados intensivos cardiológicos (UCIC), y Rodríguez-Padial et al.19 hallaron mejores resultados en el IAM en hospitales con mayor volumen asistencial. La asociación entre disponibilidad de UCIC y mejores resultados también se ha descrito, en nuestro medio, para el manejo del shock cardiogénico asociado a IAM con elevación del segmento ST20.
Nuestro objetivo fue analizar variables estructurales de los centros tratantes (disponibilidad de cirugía cardiaca y de UCIC), así como el volumen de procedimientos, en relación con los resultados del reemplazo valvular aórtico de cualquier tipo (TAVI o RQVA).
MÉTODOS
Población y fuentes de datos
Estudio observacional retrospectivo de todos los pacientes dados de alta en los hospitales del Sistema Nacional de Salud español a quienes se realizó un procedimiento RQVA o TAVI. La fuente de los datos fue el Conjunto Mínimo Básico de Datos (CMBD) del Sistema Nacional de Salud correspondiente a los años 2014 y 2015 (únicos años disponibles con código específico para TAVI en el CMBD). Los resultados clínicos en pacientes transferidos se asignaron a los centros desde los cuales los pacientes fueron finalmente dados de alta. Cuando en un mismo episodio coincidía un procedimiento de TAVI con otro de RQVA, se consideró como TAVI y el RQVA como complicación del anterior. Las variables principales de resultados fueron la mortalidad intrahospitalaria, la duración de la estancia y las complicaciones intrahospitalarias. Los códigos utilizados para las complicaciones se muestran en la tabla 1 del material adicional.
Tabla 1. Diferencias en el perfil de pacientes y en los resultados del implante percutáneo de válvula aórtica según las características estructurales de los centros (2014-2015)
| Hospitales tipo 3 | Hospitales tipo 4 | p | |||
|---|---|---|---|---|---|
| No UCIC | UCIC | No UCIC | UCIC | ||
| N.º episodios | 85 | 25 | 865 | 1.064 | |
| Edad | 81,3 ± 5,9 | 82,4 ± 2,5 | 80,6 ± 6,9 | 80,8 ± 6,8 | 0,408 |
| Sexo | 54,1 | 44 | 52,1 | 50,4 | 0,705 |
| Índice de Charlson | 7,6 ± 1,5 | 7,2 ± 1,8 | 7,1 ± 1,6 | 7,3 ± 1,7 | 0,022 |
| Shock cardiogénico | 1,2 | 0,0 | 0,8 | 1,1 | 0,854 |
| Antecedentes de angioplastia coronaria transluminal percutánea | 12,9 | 24,0 | 20,6 | 15,7 | 0,02 |
| Endocarditis infecciosa | 0,0 | 0,0 | 0,1 | 0,2 | 0,952 |
| CABG en el episodio | 0,0 | 0,0 | 0,5 | 0,3 | 0,836 |
| Angioplastia coronaria transluminal percutánea en el episodio | 2,4 | 0,0 | 3,7 | 5,4 | 0,155 |
| Antecedentes de CABG en el episodio | 3,5 | 8,0 | 9,1 | 7,9 | 0,311 |
| Cáncer; cáncer metastásico y leucemia aguda (CC8_14) | 3,5 | 4,0 | 3,2 | 5,0 | 0,293 |
| Desnutrición proteico-calórica (CC21) | 0,0 | 0,0 | 0,5 | 0,3 | 0,836 |
| Obesidad mórbida; otros trastornos endocrinos/metabólicos/ nutricionales (CC22_25_26) | 50,6 | 64,0 | 55,1 | 48,1 | 0,011 |
| Enfermedad vascular o circulatoria (CC27_32) | 5,9 | 0,0 | 3,1 | 5,1 | 0,103 |
| Otros trastornos gastrointestinales (CC38) | 16,5 | 8,0 | 10,6 | 11,3 | 0,404 |
| Demencia u otros trastornos cerebrales específicos (CC51_53) | 1,2 | 0,0 | 1,4 | 2,4 | 0,307 |
| Hemiplejia, paraplejia, parálisis, discapacidad funcional (CC70_74_103_104_189_190) | 0,0 | 0,0 | 1,2 | 2,0 | 0,27 |
| Insuficiencia cardiaca congestiva (CC85) | 43,5 | 44,0 | 28,8 | 32,0 | 0,014 |
| Infarto agudo de miocardio (CC86) | 1,2 | 0,0 | 0,7 | 0,9 | 0,878 |
| Angina inestable y otras cardiopatías isquémicas agudas (CC87) | 0,0 | 0,0 | 0,9 | 0,6 | 0,634 |
| Angina; infarto de miocardio antiguo (CC88) | 3,5 | 12,0 | 2,4 | 2,7 | 0,036 |
| Hipertensión (CC95) | 43,5 | 56,0 | 58,6 | 51,9 | 0,005 |
| Ictus (CC99_100) | 2,4 | 0,0 | 1,3 | 0,8 | 0,492 |
| Enfermedad vascular o circulatoria (CC106_109) | 17,6 | 28,0 | 18,6 | 21,6 | 0,267 |
| Enfermedad pulmonar obstructiva crónica (CC111) | 9,4 | 24,0 | 13,4 | 12,7 | 0,277 |
| Neumonía (CC114_116) | 1,2 | 0,0 | 1,2 | 2,3 | 0,259 |
| Diálisis renal (CC134) | 2,4 | 0,0 | 0,3 | 0,8 | 0,139 |
| Insuficiencia renal (CC135_140) | 36,5 | 24,0 | 23,9 | 27,8 | 0,04 |
| Úlcera de decúbito o úlcera cutánea crónica (CC157_160) | 1,2 | 4,0 | 0,5 | 0,3 | 0,031 |
| Úlcera crónica de la piel, excepto presión (CC161) | 0,0 | 0,0 | 0,6 | 0,0 | 0,078 |
| Diabetes mellitus o complicaciones de la diabetes, excepto retinopatía proliferativa (CC17_19_123) | 34,1 | 32,0 | 34,7 | 32,9 | 0,868 |
|
CABG: cirugía de revascularización aortocoronaria; CC: Condition Categories25; UCIC: unidad de cuidados intensivos cardiológicos. Nota: 16 episodios no pudieron clasificarse en los 4 grupos de hospitales. Los datos expresan n (%) o media ± desviación estándar. |
|||||
Variables estructurales de los hospitales
Para analizar la posible asociación de las variables estructurales de los centros con los resultados en el implante valvular aórtico se tuvieron en cuenta tanto el volumen de intervenciones como los recursos cardiológicos. Los hospitales se clasificaron según la disponibilidad de recursos relacionados con cardiología utilizando criterios RECALCAR21 (tabla 2 del material adicional). A efectos de este estudio, para los contrastes entre centros solo se incluyeron centros con hemodinámica sin (tipo 3) y con cirugía cardiaca (tipo 4). Además, se averiguó la disponibilidad de UCIC a partir de la encuesta previamente realizada por la Sociedad Española de Cardiología22. Las características para considerar la presencia de UCIC fueron: a) una capacidad integral de gestión de los pacientes en estado crítico, incluida ventilación mecánica invasiva, y b) la adscripción administrativa de la UCIC al propio servicio de cardiología.
Tabla 2. Diferencias en el perfil de pacientes y en los resultados del reemplazo quirúrgico de válvula aórtica según las características estructurales de los centros (2014-2015)
| Hospitales tipo 4 | p | ||
|---|---|---|---|
| No UCIC | UCIC | ||
| N.º episodios | 6.456 | 7.523 | |
| Edad | 69,3 ± 11,2 | 69,6 ± 11,3 | 0,053 |
| Sexo | 41,7 | 41,8 | 0,823 |
| Índice de Charlson | 6,5 ± 1,8 | 6,5 ± 1,9 | 0,885 |
| Shock cardiogénico | 2,0 | 1,3 | 0,001 |
| Antecedentes de angioplastia coronaria transluminal percutánea | 4,9 | 3,9 | 0,004 |
| Endocarditis infecciosa | 1,5 | 1,4 | 0,507 |
| CABG en el episodio | 18,9 | 18,9 | 0,894 |
| Angioplastia coronaria transluminal percutánea en el episodio | 0,5 | 0,8 | 0,116 |
| Antecedentes de CABG en el episodio | 2,4 | 3,5 | < 0,001 |
| Cáncer; cáncer metastásico y leucemia aguda (CC8_14) | 2,0 | 2,6 | 0,023 |
| Desnutrición proteico-calórica (CC21) | 0,6 | 0,2 | < 0,001 |
| Obesidad mórbida; otros trastornos endocrinos/metabólicos/nutricionales (CC22_25_26) | 49,7 | 49,5 | 0,789 |
| Enfermedad vascular o circulatoria (CC27_32) | 4,1 | 3,7 | 0,209 |
| Otros trastornos gastrointestinales (CC38) | 7,0 | 8,2 | 0,006 |
| Demencia u otros trastornos cerebrales específicos (CC51_53) | 0,8 | 0,8 | 0,666 |
| Hemiplejia, paraplejia, parálisis, discapacidad funcional (CC70_74_103_104_189_190) | 1,7 | 1,7 | 0,737 |
| Insuficiencia cardiaca congestiva (CC85) | 19,2 | 24,1 | < 0,001 |
| Infarto agudo de miocardio (CC86) | 1,4 | 1,4 | 0,670 |
| Angina inestable y otras cardiopatías isquémicas agudas (CC87) | 1,7 | 1,6 | 0,528 |
| Angina; infarto de miocardio antiguo (CC88) | 1,2 | 1,4 | 0,242 |
| Hipertensión (CC95) | 55,6 | 53,5 | 0,015 |
| Ictus (CC99_100) | 1,7 | 2,0 | 0,140 |
| Enfermedad vascular o circulatoria (CC106_109) | 19,7 | 21,1 | 0,034 |
| Enfermedad pulmonar obstructiva crónica (CC111) | 7,7 | 7,7 | 0,893 |
| Neumonía (CC114_116) | 1,9 | 2,1 | 0,309 |
| Diálisis renal (CC134) | 0,3 | 0,4 | 0,857 |
| Insuficiencia renal (CC135_140) | 18,9 | 18,5 | 0,576 |
| Úlcera de decúbito o úlcera cutánea crónica (CC157_160) | 0,8 | 0,5 | 0,058 |
| Úlcera crónica de la piel, excepto presión (CC161) | 0,2 | 0,2 | 0,707 |
| Diabetes mellitus o complicaciones de diabetes, excepto retinopatía proliferativa (CC17_19_123) | 25,3 | 23,3 | 0,007 |
|
CABG: cirugía de revascularización aortocoronaria; CC: Condition Categories25;UCIC: unidad de cuidados intensivos cardiológicos. Nota: 1.167 episodios no pudieron clasificarse en los dos grupos de hospitales. Los datos expresan n (%) o media ± desviación estándar. Se muestran únicamente los factores con significación estadística y OR > 1. |
|||
AnáLisis estadístico
Se especificaron modelos de ajuste de riesgo basados en la metodología de los Centres for Medicare and Medicaid Services (CMS), considerando como variables independientes las incluidas en el modelo de mortalidad a 30 días en la CABG23, e incorporando algunas variables que, contempladas en la escala de la Society of Thoracic Surgeons24 para el reemplazo valvular aórtico, pueden identificarse en el CMBD, adaptando el modelo de los CMS a la estructura de datos del CMBD, previa agrupación de los diagnósticos secundarios según categorías clínicas25. Se ajustaron modelos de regresión logística multinivel26,27. Para el modelo de ajuste solo se consideró la comorbilidad con significación estadística y odds ratio (OR) > 1,0.
A partir de los modelos especificados se calcularon las razones de mortalidad intrahospitalaria estandarizadas por riesgo (RAMER)28. Para el ajuste de la duración de la estancia se utilizó un modelo de regresión de Poisson y se consideraron como factores de riesgo, además del año del alta, la edad y el sexo del paciente, así como los niveles de gravedad de los grupos relacionados por el diagnóstico refinados. La duración esperada de la estancia se obtuvo a partir de las predicciones individuales del modelo ajustado, y se calculó la razón de la duración de la estancia ajustada por riesgo (REAR) como el cociente entre la estancia observada y la estancia esperada.
Para discriminar entre hospitales de alto y bajo volumen (según el número de episodios atendidos) se utilizó un algoritmo de agrupación por conglomerados. Para ello, el modelo matemático usado se desarrolló con dos tercios del conjunto de datos y se validó con el tercio restante. Dicho algoritmo discriminó como centros de alto volumen para TAVI aquellos que realizaron 46 o más procedimientos, y para RQVA aquellos que realizaron 240 o más procedimientos en los 2 años de estudio (2014-2015).
Las variables cuantitativas se expresaron como medias ± desviación estándar, y las cualitativas, como frecuencias y porcentajes. La correlación entre variables cuantitativas se analizó con el coeficiente r de Pearson y para su comparación se utilizó el test t de Student para 2 categorías y análisis de la varianza (ANOVA), con corrección del nivel de significación con el método de Bonferroni, para 3 o más. Las comparaciones entre variables categóricas se realizaron mediante la prueba de ji al cuadrado o el estadístico exacto de Fisher.
Todos los contrastes realizados fueron bilaterales y las diferencias se consideraron significativas cuando p < 0,05. Los análisis estadísticos se realizaron con STATA 13 y SPSS v21.0.
RESULTADOS
Se analizaron 2.055 TAVI y 15.146 RQVA. En 2014 se realizaron 812 TAVI en 47 centros, y en 2015 fueron 1.243 en 53 centros.
Las diferencias en el perfil de los pacientes intervenidos mediante TAVI y RQVA se muestran en la tabla 1 y la tabla 2, respectivamente, en función del tipo de hospital donde se llevaron a cabo las intervenciones. Para los pacientes sometidos a TAVI no se hallaron diferencias estadísticamente significativas en la edad y el sexo entre los 4 grupos de centros, pero la comorbilidad fue significativamente mayor (índice de Charlson más alto, mayor porcentaje de insuficiencia cardiaca) en los atendidos en hospitales de tipo 3 sin UCIC.
Para los pacientes sometidos a RQVA, por definición en hospitales de tipo 4, no se hallaron diferencias estadísticamente significativas en la edad, el sexo ni la presencia de comorbilidad entre los pacientes tratados con y sin UCIC, excepto una mayor presencia de shock cardiogénico y de antecedentes de intervencionismo percutáneo en los hospitales sin UCIC (2,0 frente a 1,3%, p < 0,001; y 4,9 frente a 3,9%, p = 0,004, respectivamente) (tabla 2).
El modelo de ajuste para la mortalidad intrahospitalaria del reemplazo de válvula aórtica mostró unas buenas discriminación (área bajo la curva ROC: 0,84; intervalo de confianza del 95% [IC95%], 0,82-0,85) y calibración (p < 0,001). La odds ratio mediana del modelo fue de 1,73, lo que indica una elevada variabilidad interhospitalaria.
El modelo de ajuste de riesgo para la mortalidad intrahospitalaria específico para RQVA también mostró una discriminación y una calibración excelentes (área bajo la curva ROC, 0,84; IC95%, 0,83-0,84; calibración, p < 0,001), que fueron ligeramente menores para el modelo de ajuste específico para TAVI (área bajo la curva ROC, 0,79; IC95%, 0,74-0,84; calibración, p < 0,001).
Características del centro tratante en los resultados del TAVI
Los hospitales de tipo 4 tenían una RAMER significativamente menor que los de tipo 3 (4,04 ± 0,98 frente a 4,47 ± 0,79). No se observaron diferencias estadísticamente significativas en relación con la REAR (0,99 ± 0,81 frents a 1,07 ± 0,81; p = 0,278). La presencia de UCIC se asoció con una ligera, pero estadísticamente significativa, menor RAMER (4,03 ± 0,87 frente a 4,1 ± 1,07; p < 0,001). La asociación entre UCIC y menor RAMER se halló asimismo en los hospitales de tipo 4 (4,03 ± 0,88 frente a 4,05 ± 1,08; p < 0,001) y de tipo 3 (4,09 ± 0,06 frente a 4,59 ± 0,87; p < 0,001) (tabla 3).
Tabla 3. Diferencias en los resultados del implante percutáneo de válvula aórtica según las características de los centros (2014-2015)
| Hospitales tipo 3 | Hospitales tipo 4 | p | |||
|---|---|---|---|---|---|
| No UCIC | UCIC | No UCIC | UCIC | ||
| Infarto agudo de miocardio | 1,2 | 0,0 | 0,7 | 0,9 | 0,878 |
| Inserción de marcapasos permanente | 17,6 | 16,0 | 13,2 | 15,0 | 0,536 |
| Ictus posintervención | 1,2 | 0,0 | 1,0 | 0,6 | 0,624 |
| Complicaciones por prótesis de válvula cardiaca | 3,53 | 0,00 | 1,85 | 4,32 | 0,002 |
| Shock posintervención | 0,00 | 0,00 | 0,58 | 1,79 | 0,017 |
| Insuficiencia renal posintervención | 1,2 | 0,0 | 2,5 | 2,4 | 0,743 |
| Hemorragia o hematoma que complica un procedimiento | 16,5 | 32,0 | 10,5 | 13,7 | 0,003 |
| Punción o laceración accidental durante un procedimiento | 3,5 | 0,0 | 3,2 | 4,0 | 0,600 |
| Infección posoperatoria | 1,2 | 0,0 | 0,6 | 1,7 | 0,145 |
| Sepsis | 0,0 | 0,0 | 0,8 | 0,8 | 0,819 |
| Cirugía vascular durante el ingreso | 2,4 | 4,0 | 5,0 | 5,7 | 0,542 |
| REAR | 1,10 ± 0,87 | 0,97 ± 0,47 | 0,98± 0,77 | 1,00 ± 0,85 | 0,581 |
| RAMER | 4,59 ± 0,87 | 4,09 ± 0,06 | 4,05 ± 1,08 | 4,03 ± 0,88 | < 0,001 |
|
RAMER: razón ajustada de mortalidad estandarizada por riesgo; REAR: razón estandarizada de estancia ajustada por riesgo; UCIC: unidad de cuidados intensivos cardiológicos. Los datos expresan n (%) o media ± desviación estándar. |
|||||
Los hospitales de tipo 4 con UCIC tuvieron un mayor porcentaje de shock posoperatorio (1,8 frente a 0,6%; p = 0,017), igual incidencia de sepsis (0,8 frente a 0,8%; p < 0,819) y menor RAMER (4,03 ± 0,88 frente a 4,05 ± 1,08; p < 0,001) que los que carecían de este recurso.
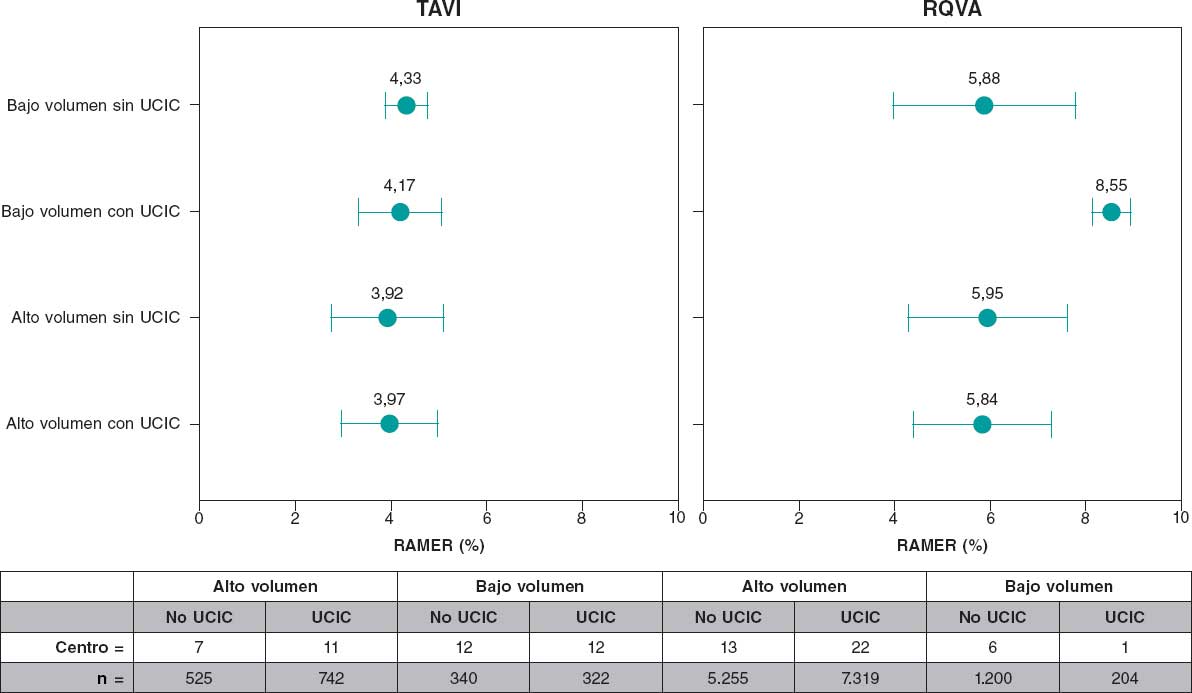
En cuanto al volumen de intervenciones de los hospitales, la mediana de TAVI por año era de 11 [2-36] para los centros de bajo volumen y de 33 [9-67] para los de alto volumen. La RAMER era menor en los hospitales de alto volumen (3,95 ± 1,08 frente a 4,26 ± 0,72; p < 0,001) (tabla 4 y figura 1). La estancia media ajustada no mostró diferencias entre los hospitales con y sin UCIC (1,00 ± 0,85 frente a 0,98 ± 0,77; p = 0,581). En relación con las complicaciones crudas, en general, el procedimiento TAVI no mostró diferencias estadísticamente significativas entre hospitales de alto y bajo volumen (tabla 4).
Tabla 4. Diferencias en los resultados del implante percutáneo de válvula aórtica según el volumen de actividad de los centros (2014-2015)
| Bajo volumen | Alto volumen | p | |
|---|---|---|---|
| Infarto agudo de miocardio | 0,63 | 0,95 | 0,311 |
| Inserción de marcapasos permanente | 14,21 | 14,36 | 0,489 |
| Ictus posintervención | 0,91 | 0,71 | 0,402 |
| Complicaciones por prótesis de válvula cardiaca | 2,92 | 4,86 | 0,366 |
| Shock posintervención | 1,46 | 1,33 | 0,172 |
| Insuficiencia renal posintervención | 2,54 | 2,29 | 0,412 |
| Hemorragia o hematoma que complica un procedimiento | 13,60 | 12,15 | 0,188 |
| Punción o laceración accidental durante un procedimiento | 2,72 | 4,18 | 0,054 |
| Infección posoperatoria | 1,30 | 1,10 | 0,424 |
| Sepsis | 1,17 | 0,55 | 0,105 |
| Cirugía vascular durante el ingreso | 4,15 | 5,92 | 0,049 |
| REAR | 0,992 ± 0,655 | 1,008 ± 0,787 | 0,237 |
| RAMER | 4,26 ± 0,72 | 3,95 ± 1,08 | < 0,001 |
|
RAMER: razón ajustada de mortalidad estandarizada por riesgo; REAR: razón estandarizada de estancia ajustada por riesgo. Los datos expresan n (%) o media ± desviación estándar. |
|||
Figura 1. Comparación de la mortalidad intrahospitalaria ajustada en porcentaje para el implante percutáneo de válvula aórtica (TAVI) y el reemplazo quirúrgico de válvula aórtica (RQVA). Considérese que, en cuanto a RQVA, en hospitales de bajo volumen con UCIC solo se incluye un centro. RAMER: razón ajustada de mortalidad estandarizada por riesgo; REAR: razón estandarizada de estancia ajustada por riesgo; UCIC: unidad de cuidados intensivos cardiológicos.
Características del centro tratante y resultados del RQVA
La presencia de UCIC se mostró como un factor protector para la mortalidad intrahospitalaria en estos pacientes (OR = 0,79; IC95%, 0,67-0,93; p = 0,005). Sin embargo, el contraste de la RAMER entre centros con y sin UCIC no mostró diferencias estadísticamente significativas (5,91 ± 1,49 con UCIC frente a 5,94 ± 1,72 sin UCIC; p = 0,335) (figura 1), y tampoco para la REAR. Los hospitales de tipo 4 con UCIC tuvieron un mayor porcentaje de shock posoperatorio (2,2 frente a 1,3%; p = 0,024) y una menor incidencia de sepsis (1,1 frente a 2,3%; p < 0,001) (tabla 5).
Tabla 5. Diferencias en los resultados del reemplazo quirúrgico de válvula aórtica según las características de los centros (2014-2015)
| Hospitales tipo 4 | p | ||
|---|---|---|---|
| No UCIC | UCIC | ||
| Infarto agudo de miocardio | 1,4 | 1,4 | 0,67 |
| Inserción de marcapasos permanente | 4,0 | 4,5 | 0,138 |
| Ictus posintervención | 1,1 | 1,3 | 0,305 |
| Complicaciones por prótesis de válvula cardiaca | 2,5 | 1,1 | 0,729 |
| Shock posintervención | 1,3 | 2,2 | 0,024 |
| Insuficiencia renal posintervención | 6,9 | 6,1 | 0,038 |
| Hemorragia o hematoma que complica un procedimiento | 6,2 | 6,3 | 0,767 |
| Punción o laceración accidental durante un procedimiento | 1,0 | 0,8 | 0,095 |
| Infección posoperatoria | 1,8 | 2,2 | 0,132 |
| Sepsis | 2,3 | 1,1 | < 0,001 |
| Cirugía vascular durante el ingreso | 2,7 | 3,1 | 0,166 |
| REAR | 1,00 ± 0,68 | 0,99 ± 0,67 | 0,770 |
| RAMER | 5,91 ± 1,49 | 5,94 ± 1,72 | 0,335 |
|
RAMER: razón ajustada de mortalidad estandarizada por riesgo; REAR: razón estandarizada de estancia ajustada por riesgo; UCIC: unidad de cuidados intensivos cardiológicos. Los datos expresan n (%) o media ± desviación estándar. |
|||
La RAMER en relación con el volumen de procedimientos fue menor en los hospitales de alto volumen (5,89 ± 1,54 frente a 6,27 ± 2,02; p < 0,001) (tabla 6), sin diferencias estadísticamente significativas respecto a la REAR (0,99 ± 0,73 frente a 1,06 ± 0,75; p = 0,463). No se encontraron diferencias estadísticamente significativas entre hospitales de alto y bajo volumen en cuanto al porcentaje de complicaciones crudas (tabla 6).
Tabla 6. Diferencias en los resultados del reemplazo quirúrgico de válvula aórtica según el volumen de actividad de los centros (2014-2015)
| Bajo volumen | Alto volumen | p | |
|---|---|---|---|
| Infarto agudo de miocardio | 1,81 | 1,37 | 0,066 |
| Inserción de marcapasos permanente | 3,75 | 4,32 | 0,117 |
| Ictus posintervención | 0,93 | 1,22 | 0,177 |
| Complicaciones por prótesis de válvula cardiaca | 1,54 | 1,14 | 0,072 |
| Shock posintervención | 2,26 | 2,44 | 0,320 |
| Insuficiencia renal posintervención | 6,63 | 6,67 | 0,462 |
| Hemorragia o hematoma que complica un procedimiento | 5,95 | 6,35 | 0,279 |
| Punción o laceración accidental durante un procedimiento | 0,82 | 0,88 | 0,445 |
| Infección posoperatoria | 1,57 | 2,04 | 0,112 |
| Sepsis | 1,46 | 1,69 | 0,269 |
| Cirugía vascular durante el ingreso | 2,22 | 2,93 | 0,055 |
| REAR | 1,06 ± 0,75 | 0,99 ± 0,73 | 0,463 |
| RAMER | 6,27 ± 2,02 | 5,89 ± 1,54 | < 0,001 |
|
RAMER: razón ajustada de mortalidad estandarizada por riesgo; REAR: razón estandarizada de estancia ajustada por riesgo. Los datos expresan n (%) o media ± desviación estándar. |
|||
Asociación entre los resultados de TAVI y RQVA
En los hospitales de tipo 4 no se halló correlación lineal estadísticamente significativa entre las RAMER de la TAVI y de la RQVA (r = 0,21; p = 0,14). Asimismo, la variable alto volumen en RQVA tenía un efecto protector, pero no estadísticamente significativo, cuando era introducida en el modelo de ajuste de riesgo de la mortalidad intrahospitalaria de TAVI (OR = 0,73; IC95%, 0,33-1,62). Los 17 centros (1.134 episodios identificados) que compartían la característica de alto volumen de TAVI y de RQVA tenían una RAMER para TAVI significativamente menor que los centros que compartían la característica de bajo volumen para TAVI y RQVA (4 ± 1,1 frente a 4,5 ± 0,7; p < 0,001). Un solo centro (80 episodios) con alto volumen de TAVI y bajo de RQVA era el que menor RAMER para TAVI mostraba (2,8 ± 0,3; p < 0,001 respecto a alto volumen para TAVI y RQVA).
DISCUSIÓN
Los hallazgos de este estudio, con datos de la vida real en nuestro país, muestran una asociación consistente entre las características estructurales de los centros tratantes y los resultados en el reemplazamiento valvular aórtico, tanto quirúrgico como transcatéter (figura 1). Los hospitales con mayor volumen, con servicio de cirugía cardiaca y dotados de UCIC muestran una menor mortalidad ajustada a riesgo en ambos procedimientos.
En relación con la asociación entre el volumen y los resultados, nuestro estudio muestra, para TAVI, resultados concordantes con los descritos en la literatura10-14, con tasas de mortalidad similares a las observadas en otros países en el periodo analizado (2014-2015) y superiores a las publicadas para 2015-201714. Las diferencias en mortalidad ajustada entre centros de alto y bajo volumen en España son inferiores a las descritas, lo que puede explicarse porque, en realidad, en esos años en España se están comparando centros con bajo volumen frente a los de muy bajo volumen. Así, 52 de los 53 centros que realizaron TAVI en los años 2014 y 2015 en España se situaban en el rango de los dos cuartiles inferiores (5-54 procedimientos al año), por volumen de procedimientos, del trabajo de Vemulapalli et al.14, y solo 7 de esos centros se situaban por encima del rango del tercil inferior del trabajo de Kaier et al.15. Estos datos deben ponerse en el contexto de la curva de aprendizaje de esta técnica en nuestro país29.
La asociación entre mayor volumen y menor RAMER también se encontró para el RQVA. En este caso también se están comparando centros de bajo volumen, pues únicamente 12 y 10 de los 42 centros, en 2014 y 2015 respectivamente, superaban las 200 intervenciones de RQVA, y más del 70% de los centros se encontraban en los dos cuartiles inferiores de volumen de RQVA del trabajo de Hirji et al.30.
En este estudio, los centros de alto volumen de ambos procedimientos mostraban una menor mortalidad ajustada para TAVI que los centros de bajo volumen para ambos procedimientos, lo que coincide con los hallazgos de Mao et al.31. No obstante, el único centro identificado como de alto volumen para TAVI y bajo para RQVA mostraba excelentes resultados en TAVI; al tratarse de un solo centro con un número de casos limitado (un 4% del total de TAVI), este hallazgo, que sugiere una mayor relevancia de la experiencia específica que de la global en el reemplazo valvular aórtico, deberá ser analizado en el futuro. Sin embargo, esto es razonable, pues apunta a que la experiencia se acumula por procesos o equipos dedicados concretos, más que por los centros en su globalidad.
El hallazgo más novedoso de este estudio, al no haber encontrado referencias en la literatura, es la asociación entre la presencia de UCIC y la menor mortalidad para ambas técnicas. Esta asociación es más robusta y de mayor significado clínico en el TAVI que en el RQVA, lo que parece lógico, puesto que los pacientes sometidos a RQVA generalmente son remitidos a unidades de cuidados intensivos generales.
En el Sistema Nacional de Salud se ha descrito la asociación entre la disponibilidad de UCIC y los mejores resultados para el shock cardiogénico en el IAM20, pero hasta ahora no se ha referido esta asociación para procedimientos quirúrgicos. En la literatura se ha señalado una relación virtuosa entre el volumen de RQVA y los resultados en el TAVI, lo que probablemente esté relacionado con una mayor experiencia del equipo29,31. La presencia de UCIC puede ser una variable que recoja tanto una mayor experiencia y más participación de los cardiólogos en el manejo de pacientes con condiciones cardiacas críticas, como la global del centro y de las unidades de cardiología y cirugía cardiaca, contribuyendo en ambos casos a un mejor manejo del paciente sometido a procedimientos intervencionistas (TAVI y RQVA) a lo largo de su proceso asistencial.
Por tanto, los resultados descritos podrían tener importancia para planificar tanto la asistencia y el reparto de recursos como la docencia y la formación en los procedimientos mencionados.
Limitaciones
El presente trabajo es un análisis retrospectivo de datos administrativos. No obstante, la validez del diseño, aun con sus inherentes limitaciones, se ha contrastado con registros clínicos26,32. Dicha fiabilidad permite la comparación de los resultados de múltiples hospitales33 y se ha utilizado específicamente en el análisis de resultados en el TAVI11-13,29,30. Sin embargo, es necesario mencionar que los datos del CMBD deben considerarse con precaución porque no están auditados. Por último, se trata de un estudio que recoge la experiencia inicial del procedimiento TAVI, probablemente todavía dentro de la curva de aprendizaje de esta técnica en los centros analizados, por lo que los hallazgos deberán ser contrastados con series más recientes y amplias.
CONCLUSIONES
Se observa una asociación entre las características estructurales de los centros tratantes y los resultados en el reemplazo valvular aórtico, tanto quirúrgico como endovascular, con una gran heterogeneidad entre centros. Los hospitales con mayor volumen, con servicio de cirugía cardiaca y dotados de UCIC presentan una menor mortalidad ajustada a riesgo en ambos procedimientos.
FINANCIACIÓN
Este estudio se ha financiado mediante una subvención no condicionada de la Fundación Interhospitalaria de Investigación Cardiovascular.
CONTRIBUCIÓN DE LOS AUTORES
I. J. Núñez-Gil: conceptualización, elaboración del manuscrito y análisis; J. Elola y M. García-Márquez: conceptualización, recogida y análisis de datos, elaboración y revisión crítica del manuscrito; J.L. Bernal y C. Fernández: recogida y análisis de datos y revisión crítica del manuscrito; A. Íñiguez, L. Nombela Franco, P. Jiménez-Quevedo, J. Escaned, C. Macaya: elaboración y revisión crítica del manuscrito, y A. Fernández-Ortiz: conceptualización, análisis de datos, elaboración y revisión crítica del manuscrito.
CONFLICTO DE INTERESES
Ninguno en relación con el presente manuscrito.
AGRADECIMIENTOS
Al Instituto de Información Sanitaria del Sistema Nacional de Salud del Ministerio de Sanidad, Consumo y Bienestar Social, por la cesión parcial de la base de datos del CMBD.
¿QUÉ SE SABE DEL TEMA?
- La estenosis aórtica grave sintomática es una frecuente causa de morbilidad y mortalidad en nuestro país, y su tratamiento recomendado es el reemplazo valvular.
- En numerosos procedimientos médicos y quirúrgicos, el volumen de intervenciones del centro ha demostrado tener una influencia importante en los resultados.
- Esta relación entre volumen y resultados se ha descrito concretamente para el TAVI, y en España para el IAM, el shock cardiogénico y la cirugía de revascularización coronaria, entre otros.
¿QUÉ APORTA DE NUEVO?
- El presente artículo analiza datos del mundo real en nuestro país en más de 17.000 pacientes que recibieron una prótesis valvular aórtica mediante RQVA o TAVI.
- Los hallazgos muestran una importante heterogeneidad y una asociación consistente entre las características estructurales de los centros tratantes y los resultados en el reemplazo de válvula aórtica, tanto RQVA como TAVI.
- Los centros con mayor volumen de actividad, con servicio de cirugía cardiaca y dotados de UCIC regentada por cardiólogos presentan una menor mortalidad ajustada a riesgo en ambos procedimientos.
BIBLIOGRAFÍA
1. Alkhouli M, Alqahtani F, Ziada KM, Aljohani S, Holmes DR, Mathew V. Contemporary trends in the management of aortic stenosis in the USA. Eur Heart J. 2020;41:921-928.
2. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
3. Luft HS, Hunt SS. Evaluating individual hospital quality through outcome statistics. JAMA. 1986;255:2780-2784.
4. Thiemann DR, Coresh J, Oetgen WJ, Powe NR. The association between hospital volume and survival after acute myocardial infarction in elderly patients. N Engl J Med. 1999;340:1640-1648.
5. Birkmeyer JD, Siewers AE, Finlayson EV, et al. Hospital volume and surgical mortality in the United States. N Engl J Med. 2002;346:1128-1137.
6. Gandjour A, Bannenberg A, Lauterbach KW. Threshold volumes associated with higher survival in health care: a systematic review. Med Care. 2003;41:1129-1141.
7. Ross JS, Normand ST, Wang Y, et al. Hospital Volume and 30-Day Mortality for Three Common Medical Conditions. N Engl J Med. 2010;362:1110-1118.
8. Luft HS, Bunker JP, Enthoven AC. Should operations be regionalized? The empirical relation between surgical volume and mortality. N Engl J Med. 1979;301:1364-1369.
9. Canto JG, Every NR, Magid DJ, et al. The volume of primary angioplasty procedures and survival after acute myocardial infarction. N Engl J Med. 2000;342:1573-1580.
10. Vakili BA, Kaplan R, Brown DL. Volume-Outcome Relation for Physicians and Hospitals Performing Angioplasty for Acute Myocardial Infarction in New York State. Circulation. 2001;104:2171-2176.
11. Srinivas VS, Hailpern SM, Koss E, Monrad ES, Alderman MH. Effect of Physician Volume on the Relationship Between Hospital Volume and Mortality During Primary Angioplasty. J Am Coll Cardiol. 2009;53:574-579.
12. Kim LK, Minutello RM, Feldman DN, et al. Association between transcatheter aortic valve implantation volume and outcomes in the United States. Am J Cardiol. 2015;116:1910-1915.
13. Badheka AO, Patel NJ, Panaich SS, et al. Effect of hospital volume on outcomes of transcatheter aortic valve implantation. Am J Cardiol. 2015;116:587-594.
14. Vemulapalli S, Carroll JD, Mack MJ, et al. Procedural Volume and Outcomes for Transcatheter Aortic-Valve Replacement. N Engl J Med. 2019;380:2541-2550.
15. Kaier K, Oettinger V, Reinecke H, et al. Volume–outcome relationship in transcatheter aortic valve implantations in Germany 2008–2014: a secondary data analysis of electronic health records. BMJ Open. 2018;8:e020204.
16. Goicolea Ruigómez FJ, Elola J, Durante-López A, Fernández-Pérez C, Bernal JL, Macaya C. Cirugía de revascularización aortocoronaria en España. Influencia del volumen de procedimientos en los resultados. Rev Esp Cardiol. 2020;73:488-494.
17. Bertomeu V, Cequier A, Bernal JL, et al. Mortalidad intrahospitalaria por infarto agudo de miocardio. Relevancia del tipo de hospital y la atención dispensada. Estudio RECALCAR. Rev Esp Cardiol. 2013;66:935-942.
18. Worner F, San Román A, Sánchez PL, Viana A, González-Juanatey JR. Atención a los pacientes con enfermedades cardiacas agudas y críticas. Posición de la Sociedad Española de Cardiología. Rev Esp Cardiol. 2015;69:239-242.
19. Rodriguez-Padial L, Elola FJ, Fernández-Pérez C, et al. Patterns of inpatient care for acute myocardial infarction and 30-day, 3-month and 1-year cardiac readmission rates in Spain. Int J Cardiol. 2017;230:14-20.
20. Sánchez-Salado JC, Burgos V, Ariza-Solé A, et al. Trends in cardiogenic shock management and prognostic impact of type of treating center. Rev Esp Cardiol. 2020;73:546-553.
21. Íñiguez Romo A, Bertomeu Martínez V, Rodríguez Padial L, et al. The RECALCAR project. Healthcare in the cardiology units of the Spanish National Health System, 2011 to 2014. Rev Esp Cardiol. 2017;70:567-575.
22. Worner F, San Román A, Sánchez PL, Viana Tejedor A, González-Juanatey JR. The healthcare of patients with acute and critical heart disease. Position of the Spanish Society of Cardiology. Rev Esp Cardiol. 2016;69:239-242.
23. Procedure-Specific Measure Updates and Specifications Report Hospital-Level 30-Day Risk-Standardized Mortality Measure Isolated Coronary Artery Bypass Graft (CABG) Surgery – Version 4.0. Yale New Haven Health Services Corporation/Center for Outcomes Research & Evaluation (YNHHSC/CORE). Centers for Medicare & Medicaid Services (CMS). 2017.
24. Society of Thoracic Surgeons'. Online STS Adult Cardiac Surgery Risk Calculator. Disponible en: http://riskcalc.sts.org/stswebriskcalc/#/. Consultado 20 Dic 2019.
25. Pope GC, Ellis RP, Ash AS, et al. Principal inpatient diagnostic cost group model for Medicare risk adjustment. Health Care Financ Rev. 2000;21:93-118.
26. Sharon-Lise T, Normand SLT, Glickman ME, Gatsonis CA. Statistical methods for profiling providers of medical care: issues and applications. J Am Stat Assoc. 1997;92:803-814.
27. Goldstein H, Spiegelhalter DJ. League tables and their limitations: statistical aspects of institutional performance. J Royal Stat Soc. 1996;159:385-443.
28. Shahian DM, Normand SL, Torchiana DF, et al. Cardiac surgery report cards: comprehensive review and statistical critique. Ann Thorac Surg. 2001;72:2155-2168.
29. Lunardi M, Pesarini G, Zivelonghi C, et al. Clinical outcomes of transcatheter aortic valve implantation: from learning curve to proficiency. Open Heart. 2016;3:e000420.
30. Hirji SA, McCarthy E, Kim D, et al. Relationship Between Hospital Surgical Aortic Valve Replacement Volume and Transcatheter Aortic Valve Replacement Outcomes. JACC Cardiovasc Interv. 2020;13:335-343.
31. Mao J, Redberg RF, Carroll JD, et al. Association Between Hospital Surgical Aortic Valve Replacement Volume and Transcatheter Aortic Valve Replacement Outcomes. JAMA Cardiol. 2018;3:1070-1078.
32. Bernal JL, Barrabés JA, Íñiguez A, et al. Clinical and administrative data on the research of acute coronary syndrome in Spain: minimum basic data set validity. Rev Esp Cardiol. 2018;72:56-62.
33. Krumholz HM, Wang Y, Mattera JA, et al. An administrative claims model suitable for profiling hospital performance based on 30 day mortality rates among patients with an acute myocardial infarction. Circulation. 2006;113:1683-1692.
RESUMEN
Introducción y objetivos: Existe un creciente interés en el desarrollo de dispositivos para el tratamiento de la insuficiencia mitral (IM) de forma mínimamente invasiva. Para este propósito, disponer de un modelo experimental que reproduzca las condiciones de la enfermedad sería de gran utilidad. Nuestro objetivo fue validar un modelo experimental de IM en cerdos.
Métodos: Para esta fase de creación del modelo se han utilizado 3 cerdos de raza large white, de 2 meses de edad y un peso de 25 ± 3 kg. Se provocó un infarto en el territorio de la arteria circunfleja que afectó la perfusión del músculo papilar posteromedial, y posteriormente se sometió al animal a una sobrecarga de volumen mediante creación de un shunt arteriovenoso, con la conexión de la aorta y la pulmonar mediante un tubo de dacrón. Se realizó análisis mediante ecocardiografía y resonancia magnética antes de la intervención y a las 8 semanas, y posteriormente el animal fue eutanasiado para realizar el estudio anatomopatológico.
Resultados: De los 3 cerdos, 1 falleció durante la intervención por fibrilación ventricular y los otros 2 sobrevivieron al procedimiento y fueron eutanasiados como estaba previsto a las 8 semanas. En ambos se produjo un infarto transmural, uno lateral y otro posteroinferior, con IM moderada secundaria. Las dimensiones y los volúmenes ventriculares aumentaron, y la contractilidad global se mantuvo a pesar de las alteraciones segmentarias.
Conclusiones: El modelo experimental de IM crónica basado en el daño isquémico del músculo papilar posteromedial asociado a una sobrecarga de volumen es factible, seguro y reproducible, y puede ser de gran utilidad para comprobar la seguridad y la eficacia de los futuros dispositivos para el tratamiento de esta afección.
Palabras clave: Insuficiencia mitral. Modelo experimental. Modelo porcino.
ABSTRACT
Introduction and objectives: There is great interest in the development of devices for the percutaneous management of mitral regurgitation (MR). For this reason, having an experimental model that reproduces the conditions of the disease is of great importance. Our objective was to validate an experimental model of MR in a porcine model.
Methods: For the model creation phase 3, 2-month-old 25 ± 3 kg large white pigs were used. An acute myocardial infarction was caused in the circumflex artery territory that hampered the perfusion of the posteromedial papillary muscle. Then, volume overload was induced in the animal by creating an arteriovenous shunt and connecting the aorta and the pulmonary artery using a Dacron tube. Echocardiography and magnetic resonance imaging were performed before the intervention and on week 8. Afterwards, the animal was euthanized to conduct the pathological study.
Results: One out of the 3 pigs died during the intervention due to ventricular fibrillation. The remaining 2 pigs survived the procedure and were euthanized as scheduled on week 8. In both cases a transmural infarction occurred, 1 at lateral level and the other one at posteroinferior level with moderate secondary mitral regurgitation. Ventricular dimensions and volumes increased and the overall contractility was maintained despite segmental alterations.
Conclusions: The experimental model of chronic MR based on the ischemic damage of the posteromedial papillary muscle associated with volume overload is feasible, safe and reproducible. Also, it can be very useful to test the safety and efficacy of future devices for the management of this condition.
Keywords: Mitral regurgitation. Experimental model. Porcine model.
Abreviaturas
IM: insuficiencia mitral.
INTRODUCCIÓN
La cirugía valvular mitral es el tratamiento estándar de los pacientes con insuficiencia mitral (IM) grave que cumplen los criterios y las indicaciones propuestos en las guías de práctica clínica1. Sin embargo, casi un 50% de los pacientes remitidos a cirugía no son operados2,3, debido fundamentalmente a la presencia de comorbilidad, disfunción del ventrículo izquierdo o la edad4. En estos casos, el tratamiento mediante técnicas transcatéter se ha convertido en una alternativa válida.
Debido a la gran complejidad de la válvula mitral, existen numerosos dispositivos en investigación para poder reducir el grado de insuficiencia de forma transcatéter5,6. De todos estos dispositivos, muy pocos han alcanzado aplicación en el tratamiento de pacientes, y de ellos, solo el MitraClip, que está inspirado en la técnica de Alfieri, ha demostrado una amplia utilidad clínica7-9.
Por ello, es de gran relevancia disponer de un modelo animal de IM para poder comprobar la seguridad, la eficacia y la respuesta tisular de estos nuevos dispositivos en un escenario lo más similar posible a las futuras situaciones clínicas. Nuestro objetivo fue valorar la factibilidad de la creación de un modelo experimental de IM que reproduzca las condiciones reales con grados aceptables de seguridad y eficacia.
MÉTODOS
Modelo animal
Se han descrito en la literatura diversos modelos experimentales para producir una IM, que van desde la provocación de un daño isquémico mediante la oclusión selectiva de la circunfleja acompañado de la rotura de una cuerda mitral10, la producción de isquemia combinada de la circunfleja y la coronaria derecha11, o la producción de isquemia selectiva de las arterias marginales que irrigan el músculo papilar12. Un grupo español estudió la influencia del infarto auricular en la IM isquémica y el remodelado auricular y ventricular mediante la oclusión de la circunfleja antes o después del origen de la rama auricular13. Los modelos basados únicamente en la producción de daño isquémico produjeron IM de grado moderado, y solo en el modelo de Cui et al.10, que asociaba una rotura de cuerdas con la consiguiente sobrecarga volumétrica, se producía una regurgitación grave. Nuestro grupo ha diseñado un nuevo modelo de producción de IM mediante la asociación de un daño isquémico y la creación de un shunt aortopulmonar como mecanismo de sobrecarga volumétrica.
En este estudio experimental se han utilizado para la creación del modelo 3 cerdos domésticos, raza large White, de 2 meses de edad y 25 ± 3 kg de peso. Todos los procedimientos se realizaron de acuerdo con la regulación legal nacional (Real Decreto 53/2013, de 1 de febrero, sobre estándares básicos para la protección de animales de experimentación) y la Directiva Europea 2010/63/UE.
Los estudios ecocardiográficos se efectuaron con un equipo Vivid I GE, con sonda cardiaca sectorial 3S (1,5-4 MHz), realizando cortes paraesternales largos, paraesternal en el eje corto y apicales de 4 cámaras.
El estudio por resonancia se llevó a cabo con un equipo Signa HDx 3.0 T GE mediante secuencias multifarias balanceadas FIESTA en los planos cardiacos específicos (de 2, 3 y 4 cámaras, y en el eje corto) para evaluación de la anatomía y la funcionalidad cardiaca. Todas las imágenes se procesaron con el software ReportCard 4.0.
Concepción del modelo experimental
Procedimiento anestésico para la realización de la intervención destinada a producir IM y estudio mediante resonancia magnética
El día de la intervención quirúrgica se administró una premedicación anestésica consistente en una combinación de midazolam (0,35 mg/kg, Midazolam Normon, Normon), ketamina (5 mg/kg, Imalgene 1000, Merial) y metadona (0,1 mg/kg, Semfortan, Dechra) aplicada por vía intramuscular. Una vez comprobada la correcta sedación, se procedió a una preoxigenación con mascarilla con oxígeno al 100%. A continuación, se realizó la venoclisis en la vena auricular marginal con un catéter endovenoso de 20 GA, y se administró fluidoterapia de mantenimiento con Ringer lactato a un ritmo de infusión de 10 ml/kg por hora. La inducción anestésica se realizó con propofol (2-4 mg/kg, Propovet, Esteve), tras lo cual se hizo una intubación traqueal convencional. El mantenimiento anestésico se mantuvo con sevoflurano (Sevorane, Abbot) a 1-1,5 CAM. Como agente analgésico intraoperatorio se usó un bolo intravenoso lento de 5 µg/kg de fentanilo (Fentanest, Janssen), seguido de infusión continua a dosis de 6 µg/kg por hora durante todo el procedimiento, aplicando dosis de rescate en caso necesario.
Previamente a la toracotomía se administró como bloqueante neuromuscular atracurio (Tracrium, Glaxo SmithKline) a dosis de 0,25 mg/kg por vía intravenosa, dosis que fue repetida a los 30 minutos en caso necesario.
Como medida adicional de analgesia, antes de la toracotomía se realizó un bloqueo intercostal con bupivacaína al 0,5% (Buvacaína, Braun), a dosis de 2 mg/kg, en 5 puntos: en el espacio intercostal del abordaje quirúrgico, dos espacios craneales y dos caudales a este.
El tratamiento anticoagulante administrado fue heparina sódica a dosis de 200 UI/kg por vía intravenosa, y como terapia antiarrítmica se empleó una infusión de amiodarona (Trangorex, Sanofi-Aventis) a dosis de 5 mg/kg por hora.
Se aplicó ventilación controlada por volumen durante el procedimiento. Los parámetros ventilatorios utilizados fueron: fracción inspirada de oxígeno de 0,4, volumen corriente de 10 ml/kg, controlando la presión máxima inspiratoria y ajustando la frecuencia respiratoria en función del volumen por minuto y la presión parcial de dióxido de carbono, relación entre tiempo inspiratorio y espiratorio 1:2-1:3 (en función de la oxigenación arterial y de las presiones arteriales), tiempo de pausa inspiratoria del 10% y presión positiva al final de la espiración de 4, pasando a 8 de forma gradual tras la toracotomía. Se realizaron maniobras de reclutamiento alveolar cada 20 minutos para evitar el colapso alveolar y las atelectasias.
Se monitorizaron las constantes vitales cada 10 minutos y se realizaron gasometrías arteriales con medición de parámetros durante el procedimiento.
En el posoperatorio inmediato se administraron 1,6 mg/kg de furosemida (Seguril, Aventis) y 4 mg/kg de carprofeno (Rimadyl, Pfizer) por vía intravenosa. Como medida analgésica posoperatoria se usó fentanilo transdérmico (Durogesic, Janssen) a dosis de 50 µg/h las primeras 72 horas, seguido de buprenorfina (Buprex, Life) a dosis de 0,01 mg/kg por vía subcutánea cada 8 horas durante 3 días. Asimismo, se administraron carprofeno (Rimadyl) a dosis de 4 mg/kg cada 24 horas por vía oral como terapia antiinflamatoria durante 5 días y amoxicilina-ácido clavulánico (Synulox, Pfizer) a dosis de 20 mg/kg cada 12 horas por vía oral como terapia antibiótica durante 9 días.
El protocolo para la realización de la resonancia magnética consistió en la administración, el día del procedimiento, de premedicación anestésica: una combinación de midazolam (0,35 mg/kg, Midazolam Normon) y ketamina (5 mg/kg, Imalgene 1000) por vía intramuscular. Una vez comprobada la correcta sedación de los animales, fueron trasladados a la zona de preparación y se procedió a una preoxigenación con mascarilla con oxígeno al 100%. A continuación, se realizó la venoclisis en la vena auricular marginal con un catéter endovenoso de 20 GA. Para la inducción anestésica se administró propofol (2-4 mg/kg, Propovet), tras lo cual se realizó la intubación traqueal convencional. El mantenimiento anestésico se llevó a cabo con sevoflurano (Sevorane) a 1-1,5 CAM.
La ventilación mecánica se hizo con los mismos parámetros que durante el procedimiento, con monitorización periódica de las constantes vitales y gasometrías arteriales.
Producción del infarto en el territorio de la arteria circunfleja
Tras la anestesia del animal se procedió a la apertura del tórax y la disección del pericardio para acceder a la arteria coronaria circunfleja y producir el infarto en esta mediante una ligadura quirúrgica. Previamente se comprobó mediante inyección de contraste y estudio ecocardiográfico qué ramas de esta irrigaban el músculo papilar posteromedial. Una vez identificadas, se procedió a la ligadura, intentando ocluir las arterias obtusas marginales 2 y 3 para no inducir una IM masiva.
Creación de un shunt arteriovenoso
Tras el infarto se procedió a la sobrecarga de volumen mediante la creación de un shunt arteriovenoso, que se llevó a cabo conectando una rama de la arteria pulmonar con la aorta usando un tubo de dacrón. Este procedimiento se realizó con clampaje y sin circulación extracorpórea.
Una vez realizados los procedimientos, se cerró el tórax y se trasladó el cerdo al animalario para su control y cuidado.
Seguimiento
La presencia de IM, así como el efecto en el remodelado cardiaco, se evaluaron mediante ecocardiografía y resonancia magnética a las 8 semanas del procedimiento y mediante ventriculografía en el momento de la eutanasia.
Se clasificó el grado de IM por ecografía utilizando métodos semicuantitativos (estimación de área de color, vena contracta). En estos estudios ecográficos y en los de resonancia magnética se midieron los volúmenes de las cámaras cardiacas (diámetros y volúmenes de los ventrículos izquierdo y derecho, diámetros y volúmenes de la aurícula izquierda) y su función.
Estudio anatomopatológico
A las 8 semanas se realizó la eutanasia de los animales, siguiendo las directrices del RD 53/2013 sobre protección animal.
Se llevó a cabo una necropsia completa, ordenada y sistemática de cada uno de los animales, con el fin de identificar y diagnosticar posibles patologías asociadas al procedimiento, y se obtuvieron muestras que se fijaron en formol tamponado al 10% para su estudio histopatológico. En el estudio macroscópico del corazón se recogió el peso y se examinaron las cavidades, las paredes, los músculos papilares, las cuerdas tendinosas, el anillo y los velos valvulares, y se documentaron mediante fotografías las posibles anomalías observadas en estas estructuras. Después se recogieron los velos desde su punto de inserción hasta su borde libre, incluyendo las cuerdas tendinosas, y fueron fijadas en formol tamponado al 10% e incluidas en parafina para su estudio histopatológico. Se tiñeron secciones seriadas de 3 µm de grosor con la técnica habitual de hematoxilina y eosina; con elastina de Van Gieson para evaluar tanto fibras elásticas como colágenas; con tricrómico de Masson para la diferenciación de fibras musculares y colágenas; y con PAS-azul alcián para la detección de mucopolisacáridos. Los cambios histopatológicos identificados fueron evaluados de manera semicuantitativa estableciendo grados de daño.
Una vez obtenidos los velos, con el objetivo de caracterizar el infarto se realizaron 4 cortes transversales, desde el vértice del corazón hasta la base, que se pesaron y tiñeron mediante la tinción histoquímica trifeniltetrazolio, que permite distinguir el área viable (color rojo) de la región necrosada (color blanco). Para ello, los niveles establecidos se sumergieron en una solución al 1% de cloruro de trifeniltetrazolio (Sigma-Aldrich) en tampón fosfato salino a pH 7,4, durante 5-10 minutos a 37 °C, y a continuación se introdujeron en formol tamponado al 10%. Las secciones fueron fotografiadas y las áreas se midieron con el sistema ImageJ. De cada nivel se recogieron muestras del área de infarto, límite y área no infartada, que fueron incluidas en parafina y teñidas con hematoxilina y eosina, y con tricrómico de Masson, con el fin de caracterizar el daño isquémico.
RESULTADOS
El primer animal falleció durante el procedimiento, debido a una fibrilación ventricular sin respuesta; los otros dos completaron el seguimiento planteado de 8 semanas sin complicaciones.
Estudio ecocardiográfico
Animal 1
Los datos del estudio ecocardiográfico basal y a las 8 semanas en el eje paraesternal largo y en cortes apicales de 4 cámaras se recogen en la tabla 1. En el estudio basal, los grosores ventriculares a nivel anteroseptal fueron de 10,6 mm y a nivel posteroinferior fueron de 9 mm. La válvula mitral era morfológicamente normal, con velos finos de movimiento normal, sin que se apreciara regurgitación por Doppler color. A las 8 semanas se observaron alteraciones segmentarias de la contractilidad de tipo hipocinesia grave en los 3 segmentos de la cara lateral, con hipercontractilidad del resto de los segmentos, una válvula mitral con velo posterior engrosado y con disminución de la motilidad, y regurgitación mitral moderada en forma de chorro de regurgitación excéntrico dirigido posteriormente.
Tabla 1. Datos del estudio ecocardiográfico basal y a las 8 semanas del animal 1
| DTDVI (mm) | DTSVI (mm) | FA (%) | FE (%) | Área color (cm2) | Vena contracta (mm) | |
|---|---|---|---|---|---|---|
| Basal | 46 | 30 | 34 | 62 | 0 | 0 |
| 8 semanas | 49 | 32 | 34 | 60 | 4 | 4 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FA: fracción de acortamiento; FE: fracción de eyección. |
||||||
Animal 2
Los datos del estudio ecocardiográfico basal y a las 8 semanas se muestran en la tabla 2. En el estudio basal, los grosores ventriculares a nivel anteroseptal fueron de 9 mm y a nivel posteroinferior fueron de 6 mm. La válvula mitral era morfológicamente normal, con velos finos de movimiento normal, sin que se apreciara regurgitación por Doppler color. A las 8 semanas se apreciaban alteraciones de la contractilidad en los segmentos basal y medio en la cara posterior, válvula mitral con engrosamiento de ambos velos y regurgitación mitral moderada en forma de chorro regurgitante central.
Tabla 2. Datos del estudio ecocardiográfico basal y a las 8 semanas del animal 2
| DTDVI (mm) | DTSVI (mm) | FA (%) | FE (%) | Área color (cm2) | Vena contracta (mm) | |
|---|---|---|---|---|---|---|
| Basal | 44 | 28 | 36 | 65 | 0 | 0 |
| 8 semanas | 47 | 30 | 36 | 63 | 6 | 5 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FA: fracción de acortamiento; FE: fracción de eyección. |
||||||
Resonancia magnética
El estudio basal mostró unos ventrículos de dimensiones, grosores y contractilidad global y segmentaria normales para nuestro laboratorio en poblaciones similares.
El estudio a las 8 semanas reveló alteraciones segmentarias de la contractilidad y adelgazamiento de la pared lateral y transformación grasa posterior en el cerdo 1, y a nivel posteroinferior en el cerdo 2 (figura 1). Los volúmenes ventriculares crecieron un 10 y un 7%, respectivamente.
Figura 1. Resonancia magnética del animal 2. Eje corto del ventrículo izquierdo. Se aprecia transformación grasa a nivel posterior.
Los valores recogidos mediante este estudio se muestran en la tabla 3 y la tabla 4.
Tabla 3. Datos del estudio por resonancia basal y a las 8 semanas del animal 1
| DTDVI (mm) | DTSVI (mm) | VTDVI (ml) | VTSVI (ml) | FE (%) | Aurículaizquierda (cm2) | |
|---|---|---|---|---|---|---|
| Basal | 46 | 31 | 68 | 29 | 57 | 12 |
| 8 semanas | 49 | 32 | 75 | 30 | 60 | 14 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FE: fracción de eyección; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo. |
||||||
Tabla 4. Datos del estudio por resonancia basal y a las 8 semanas del animal 2
| DTDVI (mm) | DTSVI (mm) | VTDVI (ml) | VTSVI (ml) | FE (%) | Aurículaizquierda (cm2) | |
|---|---|---|---|---|---|---|
| Basal | 42 | 29 | 58 | 29 | 50 | 10 |
| 8 semanas | 44 | 31 | 62 | 30 | 52 | 11 |
|
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FE: fracción de eyección; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo. |
||||||
Estudio anatomopatológico
Animal 1
En el examen macroscópico se observó un área de infarto en la cara lateral que se extendía desde el nivel apical al basal. El empleo de trifeniltetrazolio determinó que se trataba de un infarto transparietal (figura 2), cuyo tamaño aparece recogido en la tabla 1 del material adicional, junto al peso de cada nivel.
Figura 2. Animal 1. Presencia de áreas de infarto transparietal desde el nivel basal (A) hasta el apical (D). Tinción de trifeniltetrazolio.
La válvula mitral presentaba un velo posterior engrosado, mientras que el anterior no estaba afectado. Microscópicamente, en el velo posterior se apreció un engrosamiento focal, con incremento del depósito de mucopolisacáridos y vascularización de la parte proximal, con reducción distal del número de vasos. Las áreas de infarto se caracterizaban histológicamente por la presencia de tejido conjuntivo maduro, entre el que se disponían islotes de fibras musculares cardiacas y células inflamatorias.
Animal 2
La evaluación macroscópica puso de manifiesto la presencia de un área de infarto transparietal en la cara posterior que afectaba a los segmentos medios y basales (figura 3), así como al músculo papilar (figura 4). La extensión de esta lesión en los diferentes niveles se muestra en la tabla 2 del material adicional.
Figura 3. Animal 2. Presencia de áreas de infarto transparietal que se extienden desde el nivel medio (B) hasta el basal (D). Tinción de trifeniltetrazolio.
Figura 4. Lesión del músculo papilar. Parte inferior del nivel C. Tinción de trifeniltetrazolio.
En el examen macroscópico, la válvula mitral presentaba velos engrosados, con hemorragias en su superficie atrial (figura 1A del material adicional). Histológicamente, además de las hemorragias citadas, ambos velos mostraban engrosamiento por depósito de mucopolisacáridos, sobre todo en la capa media (figura 1B,C del material adicional). También se observaron vasos de pequeño calibre junto con una leve respuesta inflamatoria (figura 2 del material adicional). Las áreas de infarto se caracterizaban por la presencia de tejido conjuntivo maduro entre el que se disponían islotes de fibras musculares cardiacas con características similares a las descritas en el animal 1.
DISCUSIÓN
Nuestro grupo ha desarrollado un modelo experimental porcino seguro y factible para producir IM isquémica tras provocar un infarto, asociada a sobrecarga de volumen mediante shunt aortopulmonar.
En la actualidad existen diversas publicaciones sobre modelos experimentales, en cerdo y oveja fundamentalmente, destinados a la producción y el mantenimiento de IM. Todos ellos tienen ventajas e inconvenientes, y remedan diversas etiologías de IM, desde la miocardiopatía dilatada hasta la rotura de cuerdas, pasando por la IM isquémica.
En el modelo de IM isquémica, Llaneras et al.14 consiguieron producir IM en ovejas mediante la ligadura de las arterias obtusas marginales. Los autores demostraron que para la aparición de este evento es preciso que concurran dos condiciones: una, que se infarte el músculo papilar, y otra, que el ventrículo se dilate. Ninguna de las condiciones por separado lo produciría. En sus resultados, la ligadura de las marginales 2 y 3 daba lugar a una IM que se desarrollaba paulatinamente, mientras que la ligadura de las marginales 2, 3 y además la posterolateral llevaría a una IM masiva, con alta letalidad.
Este modelo ha sido modificado posteriormente mediante la producción de IM por rotura de una cuerda tendinosa y la asociación de un evento isquémico en el territorio de la circunfleja por medio de la implantación de un aneroide10. Esto producía una lesión isquémica con disfunción del músculo papilar a la vez que una sobrecarga de volumen. Sin embargo, la rotura no controlada de cuerdas tendinosas puede conllevar una alta mortalidad en los animales al producirse una IM masiva, que suele ser mal tolerada. En este estudio no se detallan los eventos adversos de los animales ni si alguno falleció durante el procedimiento.
En vista de los pros y los contras de los modelos descritos, nuestro objetivo fue crear un modelo sostenible de IM isquémica, que a la luz de la literatura parece ser reproducible. Para ello, teniendo en cuenta lo descrito en estudios previos, el modelo de daño isquémico del músculo papilar posteromedial asociado a una sobrecarga de volumen parece el más seguro y efectivo. Dado que la sobrecarga de volumen mediante la rotura de una cuerda o la producción de un gran infarto puede llevar a una IM masiva y un deterioro grave del animal, nuestra intención fue crear un shunt arteriovenoso como forma segura de inducir la sobrecarga de volumen, pues trabajos previos han demostrado que la creación de un shunt sistémico pulmonar produce un remodelado biventricular15.
En nuestro estudio produjimos un infarto agudo de miocardio de pequeño tamaño, probablemente por la oclusión aislada de las arterias coronarias obtusas marginales. Otros autores ocluyeron las marginales junto con la posterolaterales, lo cual produjo infartos agudos de miocardio de mayor tamaño, pero con el precio de un significativo aumento de la mortalidad, motivo por el cual en nuestro estudio se optó por ocluir solo las marginales.
Puede que el pequeño tamaño del infarto agudo de miocardio haya sido la causa de que la IM fuera solo de grado moderado, con un remodelado ventricular discreto (incremento de un 10 y un 7% en los cerdos 1 y 2) a pesar de las alteraciones segmentarias de la contractilidad, aunque no se puede descartar que un shunt arteriovenoso de insuficiente magnitud pueda haber contribuido a este hecho.
Por último, es destacable que en este modelo se produce una etiología mixta de la regurgitación mitral: los análisis anatomopatológicos revelaron anomalías morfológicas en los velos mitrales, por lo que la regurgitación no sería, en sentido estricto, únicamente funcional. Esto abre nuevas hipótesis acerca de la repercusión de una sobrecarga hemodinámica sobre los velos mitrales que puede ir más allá de la dilatación del anillo o la restricción isquémica de su movimiento.
Limitaciones
Las limitaciones de nuestro estudio se derivan fundamentalmente de su pequeño tamaño muestral, lo que dificulta extraer conclusiones definitivas. Sin embargo, consideramos muy útil comunicar un nuevo modelo experimental para producir IM isquémica mediante ligadura coronaria y sobrecarga volumétrica por shunt aortopulmonar, que deberá ser confirmado en estudios posteriores.
Se desconoce el impacto en el remodelado ventricular de la creación del shunt aortopulmonar. Dados los resultados de este trabajo, en futuras fases de estudio de este modelo se plantea analizar la magnitud del shunt y su influencia sobre el remodelado ventricular.
Los infartos creados mediante la ligadura quirúrgica de la circunfleja fueron pequeños. Es probable que la implantación de un coil u otro dispositivo de oclusión en la circunfleja proximal hubiera conseguido infartos de mayor tamaño. En cualquier caso, en el diseño del estudio se planteó el abordaje quirúrgico, ya que era necesaria una toracotomía para la realización del shunt arteriovenoso.
Otra posible limitación puede ser el corto seguimiento de los animales (8 semanas), lo que podría explicar que el proceso de remodelado tras el infarto agudo de miocardio no se hubiera terminado de completar, motivo por el que los volúmenes ventriculares no alcanzaron mayores dimensiones.
CONCLUSIONES
El modelo experimental de IM crónica basado en el daño isquémico del músculo papilar posteromedial asociado a una sobrecarga de volumen es factible, seguro y reproducible en nuestra experiencia inicial. Podría ser de utilidad para comprobar la seguridad y la eficacia de los futuros dispositivos para el tratamiento de esta afección.
FINANCIACIÓN
Este trabajo ha sido financiado parcialmente por una ayuda concedida por la Gerencia Regional de Salud de Castilla y León (GRS1396_A_16).
CONFLICTO DE INTERESES
R. Estévez-Loureiro es proctor de MitraClip y ha recibido una beca de investigación de Abbott Vascular. A. Pérez de Prado ha participado y recibido honorarios en asesorías Boston Scientific e iVascular SL, y en charlas para Abbott, Braun Surgical, Terumo Medical Corporation y Philips Volcano. Los demás autores no reportan conflictos de intereses relacionados con este artículo.
¿QUÉ SE SABE DEL TEMA?
- La IM es la segunda valvulopatía mas frecuente. La cirugía valvular mitral es el tratamiento estándar, pero más del 50% de los pacientes no son operados por su comorbilidad.
- Existen numerosos dispositivos en investigación para poder reducir el grado de insuficiencia de forma transcatéter y diversas publicaciones sobre modelos experimentales, destinados a la producción y el mantenimiento de una IM para probar estos dispositivos. Todos ellos presentan ventajas e inconvenientes, y remedan diversas etiologías de la IM, desde miocardiopatía dilatada, pasando por IM isquémica, hasta la rotura de cuerdas.
- Tras los modelos publicados, parece que para que se produzca un modelo de IM sostenible son necesarias dos condiciones: lesión isquémica con afectación del músculo papilar y dilatación ventricular.
¿QUÉ APORTA DE NUEVO?
- Se describe un nuevo modelo experimental para causar IM isquémica mediante la producción combinada de daño isquémico por oclusión coronaria de las ramas que irrigan el músculo papilar y sobrecarga volumétrica del ventrículo izquierdo con shunt aortopulmonar por implantación de un tubo de dacrón entre la aorta y una rama pulmonar.
- Cabe destacar que ninguno de los animales que sobrevivió al acto quirúrgico murió en el seguimiento, lo que puede constituir un modelo factible y seguro de IM isquémica.
BIBLIOGRAFÍA
1. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
2. Mirabel M, Iung B, Baron G, et al. What are the characteristics of patients with severe, symptomatic, mitral regurgitation who are denied surgery?Eur Heart J. 2007;28:1358-1365.
3. Borger MA, Alam A, Murphy PM, Doenst T, David TE. Chronic ischemic mitral regurgitation:repair, replace or rethink?Ann Thorac Surg. 2006;81:1153-1161.
4. Jamieson WR, Edwards FH, Schwartz M, Bero JW, Clark RE, Grover FL. Risk stratification for cardiac valve replacement. National Cardiac Surgery. Ann Thorac Surg. 1999;67:943-951.
5. Herrmann HC, Maisano F. Transcatheter therapy of mitral regurgitation. Circulation. 2014;130:1712-1722.
6. Maisano F, Alfieri O, Banai S, et al. The future of transcatheter mitral valve interventions:competitive or complementary role of repair vs. replacement?Eur Heart J. 2015;36:1651-1659.
7. Mauri L, Foster E, Glower DD, et al. 4-year results of a randomized controlled trial of percutaneous repair versus surgery for mitral regurgitation. J Am Coll Cardiol. 2013;62:317-328.
8. Nickenig G, Estevez-Loureiro R, Franzen O, et al. Percutaneous Mitral Valve Edge-to-Edge Repair:In-Hospital Results and 1-Year Follow-Up of 628 Patients of the 2011-2012 Pilot European Sentinel Registry. J Am Coll Cardiol. 2014;64:875-84.
9. Maisano F, Franzen O, Baldus S, et al. Percutaneous mitral valve interventions in the real world:early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. J Am Coll Cardiol. 2013;62:1052-1061.
10. Cui YC, Li K, Tian Y, et al. A pig model of ischemic mitral regurgitation induced by mitral chordae tendinae rupture and implantation of an ameroid constrictor. PloS One. 2014;9:e111689.
11. Minakawa M, Robb JD, Morital M, et al. A model of ischemic mitral regurgitation in pigs with three-dimensional echocardiographic assessment. J Heart Valve Dis. 2014;23:713-720.
12. Hamza O, Kiss A, Kramer AM, Tillmann KE, Podesser BK. Characterization of a novel percutaneous closed chest swine model of ischemic mitral regurgitation guided by contrast echocardiography. Eurointervention. 2019. pii:EIJ-D-19-00095.
13. Aguero J, Galan-Arriola C, Fernandez-Jimenez R, et al. Atrial Infarction and Ischemic Mitral Regurgitation Contribute to post-MI Remodeling of the Left Atrium. J Am Coll Cardiol. 2017;70:2878-2889.
14. Llaneras MR, Nance ML, Streicher JT, et al. Large animal model of ischemic mitral regurgitation. Ann Thorac Surg. 1994;57:432-439
15. Pereda D, García-Lunar I, Sierra F, et al. Magnetic Resonance Characterization of Cardiac Adaptation and Myocardial Fibrosis in Pulmonary Hypertension Secondary to Systemic-To-Pulmonary Shunt. Circ Cardiovasc Imaging. 2016;9:e004566.
RESUMEN
Introducción y objetivos: Una proporción significativa de pacientes sometidos a implante percutáneo de válvula aórtica (TAVI) presenta indicación de anticoagulación oral por fibrilación auricular. En estos pacientes, con frecuencia el riesgo hemorrágico es alto. El objetivo del estudio fue comparar los resultados clínicos en pacientes tratados con dosis baja de apixabán o con acenocumarol, un antagonista de la vitamina K (AVK).
Métodos: Registro observacional multicéntrico que incluyó pacientes sometidos a TAVI tratados con dosis baja de apixabán (2,5 mg/12 h) o AVK, en ambos casos sin tratamiento antiplaquetario asociado. Se llevó a cabo un emparejamiento por puntuación de propensión para seleccionar dos cohortes comparables. Se recabó la información de los 12 meses posteriores al procedimiento. Se consideraron objetivos coprimarios de eficacia (muerte, infarto de miocardio e ictus) y de seguridad (hemorragias BARC ≥ 2).
Resultados: Se incluyeron 236 pacientes y se obtuvieron 2 grupos de 64 pacientes comparables en cuanto a características basales. Solo 19 (30%) cumplieron estrictamente los criterios de ajuste a la baja de la dosis de apixabán. A los 12 meses, la incidencia de muerte, infarto de miocardio e ictus fue comparable (12,5% con AVK frente a 9,3% con apixabán; p = 0,5), pero la incidencia de hemorragia BARC ≥ 2 fue significativamente mayor en el grupo de AVK (7,8 frente a 0%; p = 0,02). La mayoría de los eventos trombóticos en el grupo de apixabán se observaron en pacientes con reducción de dosis no ajustada a criterios.
Conclusiones: En este registro de pacientes con TAVI y fibrilación auricular, el uso de la dosis baja de apixabán en comparación con el uso de AVK, sin antiagregantes concomitantes, se asoció a una menor incidencia de hemorragias mayores con una incidencia similar de eventos tromboembólicos.
Palabras clave: TAVI. Anticoagulación. Apixabán. Antagonistas vitamina K.
Abstract
Introduction and objectives: A significant amount of patients undergoing transcatheter aortic valve implantation (TAVI) have an indication for oral anticoagulation due to atrial fibrillation. In these patients the bleeding risk is often high. The purpose of this study was to compare the clinical outcomes of patients treated with low doses of apixaban or the vitamin K antagonist (VKA) acenocumarol in this setting.
Methods: Multicenter observational registry including patients treated after TAVI with low doses of apixaban (2.5 mg/12 hours) or VKA both without associated antiplatelet therapy. Propensity score matching was conducted to select 2 comparable cohorts. Data were gathered for 12 months following the procedure. Coprimary endpoints of efficacy (death, myocardial infarction, and stroke) and safety (bleeding BARC ≥ 2) were considered.
Results: A total of 236 patients were included. They were divided into 2 comparable groups of 64 patients each. Only 19 patients (30%) strictly met the dose adjustment criteria for apixaban. The rate of death, myocardial infarction, and stroke was similar at the 12-month follow-up (12.5% with VKA vs 9.3% with apixaban, P = .5), but the rate of bleeding BARC ≥ 2 was significantly higher in the VKA group (7.8% vs 0%; P = .02). Most of the events seen in the apixaban group occurred in patients with incorrect dose titration.
Conclusions: In this registry of patients treated with TAVI and atrial fibrillation the use of low-dose apixaban compared to VKA—both without antiplatelet agents—was associated to a lower rate of actionable bleeding and a similar rate of thrombotic events.
Keywords: TAVI. Anticoagulation. Apixaban. Vitamin K antagonist.
Abreviaturas ACOD: anticoagulantes orales de acción directa. AVK: antagonista de la vitamina K. BARC: Bleeding Academic Research Consortium. MACE: eventos cardiovasculares adversos mayores. FA: fibrilación auricular. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El crecimiento exponencial del número de procedimientos de implante percutáneo de válvula aórtica (TAVI) en los últimos años es consecuencia de la extensa y sólida evidencia científica que ha ampliado sus indicaciones1-3.
La fibrilación auricular (FA) es un hallazgo frecuente en estos pacientes4. Su presencia previa al implante, así como su nueva aparición durante el seguimiento, se asocian a una mayor mortalidad y a una más alta incidencia de ictus5, pero también a más hemorragias debidas en gran medida a la necesidad de anticoagulación6,7. El riesgo de hemorragia es en particular elevado en los pacientes sometidos a TAVI dado su perfil de edad generalmente avanzada.
Los anticoagulantes orales de acción directa (ACOD) han mostrado un mejor perfil de seguridad y eficacia que los antagonistas de la vitamina K (AVK) en el contexto de la FA no valvular. Sin embargo, existen pocos estudios que analicen su papel en pacientes con FA valvular y en la actualidad solo las guías de valvulopatías de la European Society of Cardiology de 2017 los recomiendan como clase IIa C, pero a partir del tercer mes del implante de una bioprótesis quirúrgica8. No obstante, hasta la fecha el dabigatrán es el único ACOD que ha demostrado ser no inferior a los AVK en pacientes con bioprótesis quirúrgicas9.
Respecto a los pacientes con FA sometidos a TAVI, existe muy poca evidencia para los ACOD. En uno de los escasos estudios publicados, el uso de apixabán se asoció a una significativa menor incidencia de eventos adversos a los 30 días que el uso de AVK10. No obstante, existían diferencias significativas entre grupos, no se realizó emparejamiento estadístico alguno y se incluyeron pacientes con antiagregación asociada.
La población tratada actualmente con TAVI se caracteriza por tener una edad avanzada (con frecuencia sobre los 80 años), grados variables de insuficiencia renal crónica y en ocasiones peso corporal bajo. Estas condiciones podrían justificar una relativamente alta prevalencia de uso de la dosis reducida de apixabán (2,5 mg/12 h).
En el presente estudio nos planteamos evaluar el uso de apixabán a dosis baja en pacientes con TAVI y comparar su evolución clínica a largo plazo con la de pacientes tratados con AVK. Para ello se diseñó un registro multicéntrico que incluye pacientes con indicación de anticoagulación oral (sin antiagregación asociada) tras TAVI a base de AVK o de apixabán a dosis de 2,5 mg/12 h, entre los que se efectuó un emparejamiento por índice de propensión de tratamiento.
MÉTODOS
Población del estudio
Se diseñó un registro observacional multicéntrico de carácter retrospectivo, a partir de la revisión de los registros de TAVI individuales de 4 centros hospitalarios del ámbito nacional.
La población a estudio estuvo formada por todos los pacientes consecutivos sometidos a TAVI desde 2008 con diagnóstico de FA al alta del procedimiento y con indicación de anticoagulación oral crónica aislada, ya fuera con AVK o con apixabán a dosis de 2,5 mg/12 h, y que contaran con al menos 1 año de seguimiento. Se excluyeron, por tanto, los pacientes fallecidos durante el ingreso, sin contemplar ningún criterio adicional de exclusión.
La elección de la dosis de apixabán estuvo siempre sujeta a criterio del médico responsable del paciente. En relación a este aspecto, la Agencia Europea de Medicamentos recomienda la dosis reducida de apixabán en pacientes con FA no valvular y filtrado glomerular de 15-29 ml/min y en aquellos con al menos 2 de las siguientes características: edad ≥ 80 años, peso corporal ≤ 60 kg o creatinina sérica ≥ 1,5 mg/dl (133 µmol/l)11.
Objetivos del estudio y definiciones de eventos
En cada caso registrado se recogieron todas las variables clínicas, datos demográficos y factores de riesgo cardiovascular. Además, en todos los pacientes se tuvieron en cuenta los antecedentes previos al TAVI, como presencia de enfermedad cardiovascular o cirugías cardiacas anteriores, enfermedad pulmonar o renal crónica, cirrosis hepática o neoplasias. También se incluyeron las variables asociadas con su estado cardiovascular, como función ventricular, estenosis aórtica y enfermedad coronaria. Los riesgos quirúrgicos se evaluaron mediante las escalas de riesgo EuroSCORE log, EuroSCORE II y Society of Thoracic Surgery (STS) score. Dada la presencia de FA al alta (ya conocida o de novo), se calcularon los riesgos anuales de eventos tromboembólicos usando la escala CHA2DS2-VASc y el riesgo hemorrágico con el HAS-BLED en todos los pacientes.
Se recogieron datos relacionados con el procedimiento, así como las complicaciones derivadas de este definidas por los criterios actualizados del Valve Academic Research Consortium-2 (VARC-2)12.
Se analizó la incidencia de eventos cardiovasculares adversos mayores (MACE) en todos los pacientes a 1 año de seguimiento tras el procedimiento de implante de TAVI en cada centro. Se consideraron MACE la muerte por cualquier causa, el ictus (isquémico o hemorrágico) y el infarto agudo de miocardio, todos ellos definidos también por los criterios VARC-211. Además, se analizó la incidencia de hemorragia, categorizada según la clasificación Bleeding Academic Research Consortium (BARC)12 y considerada relevante si BARC ≥ 2. Se consideró un objetivo combinado neto de eficacia-seguridad que incluía todos los MACE y la hemorragia BARC ≥ 2.
Se consideraron 2 objetivos coprimarios: uno de eficacia (compuesto por los MACE) y otro de seguridad (las hemorragias BARC ≥ 2). Los objetivos secundarios fueron un objetivo combinado neto de eficacia-seguridad, muerte total, muerte de causa cardiaca, infarto de miocardio, ictus e ictus hemorrágico.
La adjudicación de eventos quedó a criterio de los investigadores de cada centro, provistas las definiciones previamente indicadas. La base de datos no incluyó ninguno que permitiera la identificación de los pacientes, garantizando la total anonimidad. Se contó con la aprobación del comité de ética para investigación del centro coordinador.
Análisis estadístico
Las variables continuas se expresaron mediante media y desviación estándar o mediana y rango intercuartílico, según el tipo de distribución. Las categóricas se expresaron como porcentajes. Mediante la prueba de Kolmogorov-Smirnov se determinó si la distribución de las variables continuas era normal, en cuyo caso se realizó la comparación de ambos grupos mediante la prueba t de Student para datos independientes, y si seguía una distribución no normal se utilizó la prueba de Wilcoxon. Para las comparaciones de variables cualitativas o categóricas se utilizó la prueba de χ2 o la prueba exacta de Fisher si era preciso. Se hizo un análisis de riesgos proporcionales de Cox en la muestra total antes del emparejamiento para identificar variables predictoras del evento combinado neto. Se incluyeron las variables que mostraban una p < 0,1 en el análisis univariado.
Dadas las limitaciones y los sesgos en la interpretación de las posibles asociaciones en la comparación de variables no ajustadas al tratarse de un estudio observacional, se realizó un ajuste por índice de propensión utilizando el modelo de regresión logística. Se estableció el tipo de anticoagulación al alta (apixabán 2,5 mg frente a AVK) como variable dependiente y se incluyeron en el análisis como variables independientes las características basales que se detallan en la tabla 1. Puesto que el número de pacientes fue claramente menor en el grupo de apixabán, el emparejamiento por índice de propensión de tratamiento tuvo como objetivo emparejar cada paciente del grupo de apixabán con un paciente del grupo de AVK. Este procedimiento incluyó 2 etapas: 1) Las puntuaciones de propensión se estimaron mediante regresión logística, en la que se utilizó el tratamiento con apixabán como variable de resultado y todas las covariables analizadas como predictores; y 2) los pacientes fueron emparejados 1:1 usando una simple coincidencia del caso «vecino» más cercano que se basa en un algoritmo de correspondencia que clasifica las observaciones en el grupo de apixabán por su puntuación de propensión estimada. Luego se combina cada unidad secuencialmente con una unidad del grupo AVK que tenga la puntuación de propensión más cercana. Todas las diferencias de medias estandarizadas después del emparejamiento fueron inferiores al 10%. La calibración se valoró usando la prueba de Hosmer-Lemeshow y la precisión se evaluó usando el área bajo la curva ROC (Receiver Operating Characteristic). Se utilizó el programa PS Matching junto con SPSS versión 22.0 (IBM, Estados Unidos). El programa PS Matching realiza todos los análisis en R a través del SPSS R-Plugin. Se analizó la supervivencia libre de eventos mediante el método de Kaplan-Meier, utilizando el log-rank test para la comparación de ambos grupos. Todos los análisis fueron bilaterales y se consideraron valores estadísticamente significativos aquellos con p < 0,05. Los análisis estadísticos se realizaron con el programa estadístico SPSS 22.0.
Tabla 1. Características basales antes y después del ajuste por índice de propensión
| Cohorte global | Cohorte emparejada | |||||
|---|---|---|---|---|---|---|
| Apixabán (n = 64) | AVK (n = 172) | p | Apixabán (n = 64) | AVK (n = 64) | p | |
| Sexo masculino | 41 (64) | 60 (35) | < 0,001 | 41 (64) | 38 (59) | 0,6 |
| Edad (años) | 82 ± 6 | 83 ± 6 | 0,3 | 82 ± 6 | 81 ± 7,5 | 0,7 |
| Peso (kg) | 72 ± 12 | 71 ± 17 | 0,6 | 72 ± 12 | 74 ± 14 | 0,5 |
| Talla (cm) | 161 ± 10 | 158 ± 14 | 0,1 | 161 ± 10 | 160 ± 9 | 0,32 |
| HTA | 55 (86) | 140 (81) | 0,4 | 55 (86) | 48 (75) | 0,11 |
| Diabetes mellitus | 27 (42) | 51 (30) | 0,07 | 27 (42) | 19 (30) | 0,14 |
| Filtrado glomerular basal (ml/min) | 58 ± 20 | 61 ± 23 | 0,3 | 58 ± 20 | 60 ± 25 | 0,6 |
| SCA previo | 4 (6) | 10 (6) | 0,9 | 4 (6) | 4 (6) | 1 |
| ACTP previa | 9 (14) | 10 (6) | 0,04 | 9 (14) | 8 (13) | 0,8 |
| PAoC previo | 3 (5) | 12 (7) | 0,52 | 3 (5) | 4 (6) | 0,7 |
| RVAo previo | 7 (11) | 6 (4) | 0,03 | 7 (11) | 4 (6) | 0,3 |
| Ictus previo | 3 (5) | 26 (15) | 0,03 | 3 (5) | 3 (5) | 1 |
| EPOC | 19 (30) | 39 (23) | 0,27 | 19 (30) | 15 (23) | 0,4 |
| Cirrosis | 0 | 4 (2) | 0,6 | 0 | 1 (1,6) | 1 |
| Neoplasia | 11 (17) | 16 (9) | 0,09 | 11 (17) | 6 (9) | 0,2 |
| Enfermedad vascular periférica | 7 (11) | 4 (5) | 0,15 | 7 (11) | 2 (6) | 0,4 |
| NYHA III-IV | 30 (51) | 111 (65) | 0,06 | 30 (51) | 37 (58) | 0,4 |
| FEVI basal (%) | 53 ± 12 | 56 ± 13 | 0,1 | 53 ± 12 | 56 ± 12 | 0,3 |
| EuroSCORE log | 13,3 ± 9 | 18,5 ± 13 | 0,002 | 13,3 ± 9 | 14 ± 8 | 0,7 |
| EuroSCORE II | 4,2 ± 5 | 6,4 ± 6 | 0,013 | 4,2 ± 5 | 4,7 ± 4 | 0,55 |
| STS mortalidad | 6 [2-10] | 7 [5-15] | 0,4 | 6 [2-10] | 11 [3-11] | 0,5 |
| CHA2DS2-VASc | 4,5 ± 1,1 | 4,6 ± 1,4 | 0,55 | 4,5 ± 1,1 | 4 ± 1,3 | 0,07 |
| HAS-BLED | 2,8 ± 1 | 2,74 ± 1 | 0,8 | 2,8 ± 1 | 2,5 ± 1,1 | 0,3 |
|
ACTP: angioplastia coronaria transluminal percutánea; AVK: antagonistas de la vitamina K; HTA: hipertensión arterial; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association; PAoC: pontaje aortocoronario previo; RVAo: recambio valvular aórtico; SCA: síndrome coronario agudo; STS: Surgeon Thoracic Score. Los datos se muestran como n (%), media ± (desviación estándar) o mediana [rango intercuartílico]. |
||||||
RESULTADOS
De un total de 1.791 pacientes se obtuvo una cohorte final de 236 que cumplían criterios de inclusión, de los cuales 64 (27%) fueron tratados con dosis reducida de apixabán al alta tras el TAVI y 172 (73%) fueron tratados con AVK. Mediante emparejamiento por índice de propensión de tratamiento se obtuvieron 2 grupos de 64 pacientes cada uno. El diagrama de flujo de los pacientes se muestra en la figura 1. La distribución de casos con apixabán por centros fue del 60, el 20, el 14 y el 3%.
Figura 1. Diagrama de flujo del estudio. AVK: antagonistas de la vitamina K; FA: fibrilación auricular; TAVI: implante percutáneo de válvula aórtica.
En cuanto a la adecuación de la dosificación a la baja de apixabán respecto al grado de cumplimiento de las características recomendadas por la Agencia Europea de Medicamentos11, se observó que solo 19 (30%) pacientes cumplían estrictamente los requisitos (figura 2). Un 68% de los pacientes ≥ 80 años presentaban un grado de enfermedad renal crónica IIIA (filtrado glomerular de 30-59 ml/min), habiéndose considerado ese factor como suficiente para indicar la dosis de 2,5 mg.
Figura 2. Agrupación de los pacientes tratados con apixabán a dosis reducida según las variables contempladas para la reducción de dosis. Se muestra el número de pacientes que cumplía cada una de las condiciones, así como las posibles combinaciones de estas. La Agencia Europea de Medicamentos recomienda la dosis reducida de apixabán en pacientes con fibrilación auricular no valvular y filtrado glomerular (FG) de 15-29 ml/min, y en aquellos con al menos 2 de las siguientes características: edad ≥ 80 años, peso corporal ≤ 60 kg o creatinina sérica ≥ 1,5 mg/dl (133 µmol/l)11.
En la tabla 1 se muestran las características basales de la cohorte global y las de la cohorte ajustada por índice de propensión. En la cohorte global se observó que el grupo de apixabán incluía más varones, más pacientes con antecedentes de intervención coronaria y valvular, y menos con historia de ictus. Los valores de los índices EuroSCORE eran más bajos que en el grupo de AVK, pero los índices de riesgo hemorrágico eran similares. No se observaron diferencias significativas entre los grupos emparejados.
Las características de los procedimientos y las complicaciones observadas en los grupos ya emparejados se muestran en la tabla 2. No se hallaron diferencias significativas para ninguno de los aspectos analizados. Es interesante señalar que los pacientes del grupo de apixabán tuvieron cifras más altas de hemoglobina al alta. En este grupo, además, 10 pacientes habían llegado al TAVI bajo tratamiento con anticoagulación y terapia antiagregante (suspendida tras el TAVI), frente a solo 1 paciente en el grupo con AVK. En cuanto a la cronología de la FA, todos los pacientes del grupo de AVK ya tenían FA antes del TAVI, mientras que en el grupo de apixabán 5 pacientes la desarrollaron tras el procedimiento de TAVI.
Tabla 2. Características del procedimiento, complicaciones y características al alta de la cohorte emparejada
| Apixabán (n = 64) | AVK (n = 64) | p | |
|---|---|---|---|
| Prótesis aórtica expandible con balón | 51 (80) | 50 (78) | 0,8 |
| Acceso femoral | 64 (100) | 62 (97) | 0,5 |
| Éxito del implante | 64 (100) | 64 (100) | 1 |
| Transfusiones | 7 (11) | 5 (8) | 0,5 |
| Oclusión coronaria | 0 | 0 | |
| Embolización de la prótesis | 0 | 0 | |
| Rotura anillo | 0 | 0 | |
| Ictus periprocedimiento | 1 (1,6) | 1 (1,6) | 1 |
| Complicación vascular | 7 (11) | 10 (16) | 0,4 |
| Hemorragia BARC ≥ 2 | 4 (6,3) | 4 (6,3) | 1 |
| SCA periprocedimiento | 0 | 0 | |
| Necesidad de marcapasos | 8 (13) | 10 (16) | 0,6 |
| Fibrilación auricular de novo | 5 (8) | 0 | 0,06 |
| Hemoglobina (g/dl) al alta | 12 ± 1,6 | 11 ± 1,4 | 0,05 |
| Plaquetas al alta (109/l) | 133 ± 92 | 160 ± 60 | 0,2 |
| Filtrado glomerular (ml/min) al alta | 68 [53-82] | 66 [40-82] | 0,5 |
|
AVK: antagonistas de la vitamina K; BARC: Bleeding Academic Research Consortium; SCA: síndrome coronario agudo. Los datos se muestran como n (%), media ± desviación estándar o mediana [rango intercuartílico]. |
|||
No se perdieron pacientes en el seguimiento clínico. En la tabla 3 se recogen los eventos cardiovasculares observados desde el alta y hasta 1 año de seguimiento, sin ponerse de manifiesto diferencias significativas entre ambos grupos para los MACE. En el grupo tratado con AVK se produjeron 4 (6%) muertes, de las cuales 2 tuvieron causa cardiaca (insuficiencia cardiaca y muerte súbita) y otras 2 fueron secundarias a hemorragias mayores (ictus hemorrágico y shock hipovolémico tras una caída con fractura de cadera). Los 3 pacientes fallecidos en el grupo de apixabán lo fueron por patología pulmonar. Es interesante observar los eventos dentro del grupo de apixabán según el uso de dosis reducida ajustada o no a criterios, ya que los MACE se concentraron en el grupo con dosis no ajustada.
Tabla 3. Eventos cardiovasculares adversos mayores y hemorragias a 12 meses
| Apixabán | AVK (n = 64) | p* | ||||
|---|---|---|---|---|---|---|
| DR (n = 64) | DRA (n = 19) | DRNA (n = 45) | ||||
| MACE | 6 (9,3) | 1 (5,3) | 5 (11) | 8 (12,5) | 0,5 | |
| Muerte | 3 (4,7) | 0 | 3 (4,7) | 4 (6,2) | 0,7 | |
| Muerte de causa cardiaca | 0 | 0 | 0 | 2 (3,1) | 0,3 | |
| Infarto de miocardio | 1 (1,6) | 0 | 1 (2,2) | 1 (1,6) | 1 | |
| Ictus | 2 (3,1) | 1 (5,3) | 1 (2,2) | 3 (4,7) | 0,9 | |
| Ictus hemorrágico | 0 | 0 | 0 | 2 (3,1) | 0,5 | |
| Hemorragias BARC ≥ 2 | 0 | 0 | 0 | 5 (7,8) | 0,02 | |
| Objetivo seguridad-eficacia** | 4 (6,2) | 0 | 4 (8,8) | 8 (12,5) | 0,23 | |
|
AVK: antagonistas de la vitamina K; DR: dosis reducida; DRA: dosis reducida ajustada; DRNA: dosis reducida no ajustada; MACE: eventos cardiovasculares adversos mayores. Los datos se muestran como n (%). * Valores de p para la comparación de apixabán DR frente a AVK. ** Combinado de muerte, infarto de miocardio, ictus y hemorragias BARC ≥ 2. |
||||||
Solo se comunicaron hemorragias relevantes (BARC ≥ 2) en el grupo de AVK, con una diferencia significativa respecto al grupo de apixabán. Estos eventos ocurrieron en los meses 1, 3, 5, 6 y 11 tras el TAVI. De esas hemorragias mayores, 3 se debieron a causas digestivas, una fue por una hemorragia subaracnoidea y otra fue un hematoma espontáneo en los rectos anteriores del abdomen. Todos estos pacientes requirieron ingreso, 1 intervención quirúrgica y 4 recibieron transfusiones hemáticas. En el grupo de apixabán, la tasa de hemorragias BARC ≥ 2 observada (0%) fue inferior a la esperada por el índice HAS-BLED (3,4%), mientras que en el grupo de AVK fue a la inversa: la tasa observada (7,8%) fue superior a la esperada (2,8%).
Las curvas de supervivencia acumulada libre de MACE al año no mostraron diferencias significativas entre ambos grupos, tal como puede verse en la figura 3. En la figura 4 se muestran las curvas de supervivencia libre de hemorragias BARC ≥ 2, con diferencias significativas favorables al grupo de apixabán. Las curvas de supervivencia libre de muerte, infarto, ictus y hemorragias BARC ≥ 2 no mostraron diferencias significativas, pero sí una tendencia favorable al apixabán (figura 5). El análisis multivariado de Cox realizado sobre la muestra total, previamente al emparejamiento de casos, identificó el uso de apixabán como predictor independiente para el objetivo combinado neto de eficacia y seguridad (hazard ratio = 0,56; intervalo de confianza del 95%, 0,23-0,98; p = 0,04).
Figura 3. Curvas de Kaplan-Meier de supervivencia libre de eventos cardiovasculares adversos mayores (MACE) a 1 año. AVK: antagonista de la vitamina K.
Figura 4. Curvas de Kaplan-Meier de supervivencia libre de hemorragias BARC ≥ 2. AVK: antagonista de la vitamina K.
Figura 5. Curvas de Kaplan-Meier de supervivencia libre de muerte, infarto, ictus y hemorragias BARC ≥ 2.
DISCUSIÓN
Los hallazgos principales de este estudio son: a) el uso de apixabán es todavía minoritario respecto al de AVK en la población con TAVI y FA; b) el uso de apixabán en dosis baja es muy frecuente en este contexto, pero en muchas ocasiones no se ajusta de manera estricta a las instrucciones de uso contempladas y es habitual la infradosificación; c) el tratamiento con apixabán en dosis reducida, en comparación con el de AVK, se asoció a incidencias muy similares de eventos trombótico-isquémicos y a un significativo menor riesgo de hemorragia mayor.
Estos hallazgos, con las reservas derivadas de las limitaciones del estudio, estarían en consonancia con los resultados del subanálisis del estudio ARISTOTLE13 en pacientes con bioprótesis, que muestran la seguridad y la eficacia del apixabán en pacientes valvulares, aunque entre estos últimos solo el 31% superaban los 75 años de edad. Un subestudio del ensayo ENGAGE AF-TIMI 4814 con 191 pacientes con implantación previa de una bioprótesis quirúrgica o transcatéter y FA mostró una reducción significativa de las hemorragias mayores con dosis bajas (30 mg) de edoxabán en comparación con warfarina. Las dosis bajas y altas (60 mg) de edoxabán se asociaron con una reducción en el compuesto de accidente cerebrovascular, embolia sistémica, hemorragia grave o muerte.
La población sometida a TAVI abarca un colectivo de edad muy avanzada y con múltiple comorbilidad, muy poco representado en los estudios clínicos de otros contextos como el de la FA no valvular. La presencia de FA previa o desarrollada de novo tras el TAVI no es infrecuente en esta población y suma un riesgo tanto embólico como hemorrágico superior al de otras poblaciones, lo que supone un reto importante al decidir el mejor tratamiento antitrombótico.
Existen aún pocos estudios que hayan comparado los ACOD con los AVK en el contexto de TAVI, y son registros. En el antes citado de Seeger et al.10 se compararon 141 pacientes tratados con apixabán (la mayoría con dosis 5 mg) y 131 con AVK, y se encontró un mejor perfil de seguridad y una similar eficacia con apixabán. No obstante, en este registro, además de no evaluar la dosis reducida de apixabán, no se hizo emparejamiento estadístico y se incluyeron casos con tratamiento antiplaquetario concomitante. En nuestro estudio creímos muy conveniente excluir a los pacientes con terapia antiagregante asociada y efectuar un emparejamiento por índice de propensión de tratamiento, ya que ambos aspectos reducen de forma notable la carga de sesgos inherente a todo análisis comparativo derivado de registros. Por otra parte, el estudio de la dosis reducida resultaba muy pertinente dado su frecuente uso en esta población.
En otro estudio se comparó la evolución clínica de 154 pacientes tratados con varios ACOD y 172 tratados con AVK, siempre sin antiplaquetarios15, pero de nuevo sin emparejamiento estadístico y observando significativas diferencias entre grupos. Los autores encontraron unos perfiles de eficacia y seguridad muy similares, aunque el grupo de ACOD mostraba un perfil basal de riesgo hemorrágico y trombótico más adverso.
Finalmente, en los registros RESOLVE (The Assessment of Transcatheter and Surgical Aortic Bioprosthetic Valve Thrombosis and Its Treatment With Anticoagulation) y SAVORY (Subclinical Aortic Valve Bioprosthesis Thrombosis Assessed With Four- Dimensional Computed Tomography) no se encontraron diferencias significativas en cuanto a reducción del movimiento de los velos de la prótesis entre los ACOD y la warfarina (3 frente a 4%, respectivamente; p = 0,72), aunque ambos parecían mejores que la no anticoagulación16.
Merece discusión la alta prevalencia de infradosificación del apixabán en esta población. Creemos que esta puede venir condicionada por la percepción de un muy alto riesgo hemorrágico en estos pacientes, muchos de ellos octogenarios y con alta prevalencia de enfermedad renal crónica así como de otras enfermedades, y un variable grado de fragilidad, que si bien no es un criterio establecido para modular el tipo y la dosis de anticoagulación, sí puede influir en la decisión.
El hecho de haber encontrado en este registro diferencias favorables al apixabán con dosis de 2,5 mg respecto a los AVK podría hacer pensar que la infradosificación no penaliza tanto como en el contexto general de los pacientes con FA no valvular13, y es más, se asocia a un mejor perfil de seguridad sin detrimento de la eficacia. Sin embargo, no puede recomendarse de forma abierta el uso de la dosis reducida y creemos en el rigor del ajuste de dosis. Aunque el tamaño de los subgrupos según ajuste de dosis correcto o no era pequeño y no permite extraer resultados concluyentes, dentro del grupo de apixabán se observaron más eventos trombóticos-isquémicos en el grupo de ajuste incorrecto. Ahora bien, es preciso tener en cuenta que la dosificación debe ser dinámica, ya que las condiciones de ajuste de dosis varían a lo largo del seguimiento, y así se optimiza en todo momento el tratamiento de estos pacientes.
Dicho lo anterior, las indicaciones de tratamiento con estos fármacos están sufriendo modificaciones a raíz de los datos recientes de la vida real. Hasta hace 1 año, el apixabán estaba contraindicado en pacientes con deterioro renal grave, en los que el tratamiento con AVK seguía siendo de elección. Los estudios más recientes demuestran el claro beneficio en términos de hemorragias con la dosis de apixabán de 2,5 mg, y en términos de eventos tromboembólicos y mortalidad con la de 5 mg, en pacientes con enfermedad renal grave y diálisis17.
Lo complejo del tema queda ilustrado por los resultados del ensayo GALILEO18 (Global Study Comparing a rivAroxaban-based Antithrombotic Strategy to an antipLatelet-based Strategy After Transcatheter aortIc vaLve rEplacement to Optimize Clinical Outcomes). Este estudio ha evidenciado que, en pacientes sin indicación de anticoagulación oral después de TAVI, una estrategia de tratamiento que incluye rivaroxabán a dosis de 10 mg al día más un antiagregante en los primeros 90 días se asoció con un mayor riesgo de muerte o de complicaciones tromboembólicas y un mayor riesgo de hemorragia que una estrategia basada en terapia antiplaquetaria dual por 90 días y luego simple.
Los estudios aleatorizados actualmente en marcha aportarán evidencias más sólidas sobre las mejores estrategias antitrombóticas en los pacientes tras TAVI con y sin FA19.
Limitaciones
La principal limitación del estudio es el no ser aleatorizado. Como todo registro observacional, está sujeto a factores confusores más o menos evidentes. Aunque el uso del emparejamiento por índice de propensión de tratamiento derivó en 2 grupos de características basales muy similares, la probabilidad de sesgos no queda eliminada.
El tamaño muestral es la segunda limitación más importante. El volumen de pacientes con TAVI y a su vez con indicación de anticoagulación oral aislada no es alto en un centro aislado de nuestro medio, y más aún si se quiere incluir los tratados específicamente con apixabán a dosis reducida. Por ello, se diseñó un estudio multicéntrico con centros de alto volumen (en comparación con la media del país), pero aun así el tamaño de muestra no pudo ser mayor. Esto hace que el estudio esté infrapotenciado y tenga que considerarse exploratorio y generador de hipótesis. Esta limitación resulta todavía más evidente para la comparación de los subgrupos según el tipo de ajuste de dosis. No obstante, en espera de ensayos debidamente potenciados, los resultados de registros de este tipo contribuyen a aportar algo de conocimiento.
La adjudicación de eventos no se efectuó de manera centralizada, aunque se ajustaron a las definiciones estandarizadas previamente establecidas11.
CONCLUSIONES
El uso de dosis baja de apixabán (2,5 mg/12 h) en pacientes sometidos a TAVI no se adecuó con frecuencia de forma estricta a las recomendaciones oficiales. En este registro, el uso de apixabán a dosis reducida, en comparación con el uso de acenocumarol, se asoció con cifras muy similares de eventos trombóticos-isquémicos, pero con un significativo menor riesgo de hemorragia mayor. Este estudio sugiere que, en los pacientes tratados con TAVI que tienen FA, el empleo de apixabán a dosis reducida (en caso de estar apropiadamente indicada) resultaría más seguro e igual de eficaz que el de acenocumarol.
CONFLICTO DE INTERESES
J.M. de la Torre Hernández ha recibido ayuda a la investigación no condicionada y panel de asesoría (Bristol-Myers Squibb). Asimismo, es Editor Jefe de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito.
¿Qué se sabe del tema?
- La realización de TAVI está experimentando un notable crecimiento. La prevalencia de FA entre los pacientes con TAVI es alta. Los ACOD han mostrado un mejor perfil de seguridad y eficacia que los AVK en el contexto de la FA no valvular, pero existen pocos estudios que analicen su papel en pacientes con TAVI y FA, y en concreto ninguno que evalué el de la dosis reducida de apixabán.
¿Qué aporta de nuevo?
- Este registro multicéntrico muestra que el uso de apixabán es todavía minoritario respecto al de AVK en la población con TAVI y FA. Entre los pacientes tratados con apixabán, el empleo de dosis baja es muy frecuente, pero en muchas ocasiones no se ajusta de manera estricta a las instrucciones de uso contempladas. En este estudio, el tratamiento con apixabán a dosis reducida, en comparación con el de AVK, se asoció a incidencias muy similares de eventos trombóticos-isquémicos y a un significativo menor riesgo de hemorragia relevante.
BIBLIOGRAFÍA
1. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
2. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374:1609-1620.
3. Waksman R, Rogers T, Torguson R, et al. Transcatheter Aortic Valve Replacement in Low-Risk Patients With Symptomatic Severe Aortic Stenosis. J Am Coll Cardiol. 2018;72:2095-2105.
4. Koniari I, Tsigkas G, Kounis N, et al. Incidence, pathophysiology, predictive factors and prognostic implications of new onset atrial fibrillation following transcatheter aortic valve implantation. J Geriatr Cardiol. 2018;15:50-54.
5. Biviano AB, Nazif T, Dizon J, et al. Atrial Fibrillation Is Associated With Increased Mortality in Patients Undergoing Transcatheter Aortic Valve Replacement:Insights From the Placement of Aortic Transcatheter Valve (PARTNER) Trial. Circ Cardiovasc Interv. 2016 ;9:e002766.
6. Kapadia S, Agarwal S, Miller DC, et al. Insights Into Timing, Risk Factors, and Outcomes of Stroke and Transient Ischemic Attack After Transcatheter Aortic Valve Replacement in the PARTNER Trial (Placement of Aortic Transcatheter Valves). Circ Cardiovasc Interv. 2016;9. pii:e002981.
7. Tarantini G, Mojoli M, Urena M, Vahanian A. Atrial fibrillation in patients undergoing transcatheter aortic valve implantation:epidemiology, timing, predictors, and outcome. Eur Heart J. 2017;38:1285-1293.
8. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
9. Durães AR, de Souza Roriz P, de Almeida Nunes B, et al. Dabigatran Versus Warfarin After Bioprosthesis Valve Replacement for the Management of Atrial Fibrillation Postoperatively:DAWA Pilot Study. Drugs R D. 2016;16:149-154.
10. Seeger J, Gonska B, Rodewald C, et al. Apixaban in Patients With Atrial Fibrillation After Transfemoral Aortic Valve Replacement. JACC Cardiovasc Interv. 2017;10:66-74.
11. Agencia Europea de Medicamentos. Anexo I. Ficha técnica o resumen de las características del producto. Disponible en:https://www.ema.europa.eu/en/documents/product-information/eliquis-epar-product-information_es.pdf. Consultado 12 Mar 2020.
12. Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation:the Valve Academic Research Consortium-2 consensus document. J Thorac Cardiovasc Surg. 2013;145:6-23.
13. Guimarães PO, Pokorney SD, Lopes RD, et al. Efficacy and safety of apixaban vs warfarin in patients with atrial fibrillation and prior bioprosthetic valve replacement or valve repair:Insights from the ARISTOTLE trial. Clin Cardiol. 2019;42:568-571.
14. Carnicelli AP, De Caterina R, Halperin JL, et al. ENGAGE AF-TIMI 48. Edoxaban for the Prevention of Thromboembolism in Patients With Atrial Fibrillation and Bioprosthetic Valves. Circulation. 2017;135:1273-1275.
15. Geis NA, Kiriakou C, Chorianopoulos E, Uhlmann L, Katus HA, Bekeredjian R. NOAC monotherapy in patients with concomitant indications for oral anticoagulation undergoing transcatheter aortic valve implantation. Clin Res Cardiol. 2018;107:799-806.
16. Chakravarty T, Søndergaard L, Friedman J, et al. RESOLVE and SAVORY Investigators. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves:an observational study. Lancet. 2017;389:2383-2392.
17. Siontis KC, Zhang X, Eckard A, et al. Outcomes Associated With Apixaban Use in Patients With End-Stage Kidney Disease and Atrial Fibrillation in the United States. Circulation. 2018;138:1519-1529.
18. Dangas GD, Tijssen JGP, Wöhrle J, et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382:120-129.
19. Guedeney P, Mehran R, Collet JP, Claessen BE, Ten Berg J, Dangas GD. Antithrombotic Therapy After Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2019;12:e007411.
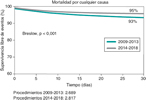
RESUMEN
Introducción y objetivos: El objetivo primario de este estudio fue presentar la mortalidad total intrahospitalaria del registro español de implante percutáneo de válvula aórtica (TAVI) desde su inicio hasta el año 2018, y como objetivos secundarios otros eventos clínicos intrahospitalarios, la mortalidad total a los 30 días y la evaluación de cuál ha sido la evolución temporal de este registro.
Métodos: Fueron analizados todos los pacientes consecutivos incluidos en el registro español de TAVI. En este análisis temporal se dividió la población en pacientes tratados antes de 2014 (cohorte A: 2009-2013) y pacientes tratados entre los años 2014 y 2018 (cohorte B).
Resultados: Desde agosto de 2007 hasta junio de 2018 se incluyeron 7.180 pacientes. La edad media fue de 81,2 ± 6,5 años y el 53% eran mujeres. El EuroSCORE logístico fue del 12% (8-20). Se utilizó un acceso transfemoral en el 89%. La mortalidad total intrahospitalaria fue del 4,7% y a los 30 días fue del 5,7%. En el análisis temporal durante la fase hospitalaria, las tasas de infarto, accidente cerebrovascular, necesidad de marcapasos, taponamiento, obstrucción coronaria y complicaciones vasculares fueron similares en ambos grupos. Sin embargo, en la cohorte B se observó una reducción de la necesidad de conversión a cirugía y de mala posición de la válvula, y además la tasa de éxito del implante fue mayor (93 frente a 96%; p < 0,001). La mortalidad por cualquier causa ajustada tanto intrahospitalaria como a los 30 días, fue significativamente menor en la cohorte B (odds ratio [OR] = 0,65; intervalo de confianza del 95% [IC95%], 0,48-0,86; p = 0,003; y OR = 0,71; IC95%, 0,54-0,92; p = 0,002, respectivamente).
Conclusiones: En el análisis temporal del registro español de TAVI se observan un cambio en el perfil clínico de los pacientes y una mejora en la evolución clínica tanto intrahospitalaria como a los 30 días en los pacientes tratados en los últimos años.
Palabras clave: Tratamiento transcatéter de la válvula aórtica. Registros. Estenosis aórtica grave.
ABSTRACT
Introduction and objectives: This study primary endpoint was to present the in-hospital all-cause mortality of the Spanish TAVI registry from its inception until 2018. Secondary endpoints included other in-hospital clinical events, 30-day all-cause mortality, and an assessment of the time trend of this registry.
Methods: All consecutive patients included in the Spanish TAVI registry were analyzed. In this time-based analysis, the population was been divided into patients treated before 2014 (cohort A: 2009-2013) and patients treated between 2014 and 2018 (cohort B).
Results: From August 2007 to June 2018, 7180 patients were included. The mean age was 81.2 ± 6.5 years and 53% were women. The logistic EuroSCORE was 12% (8-20). Transfemoral access was used in 89%. In-hospital and 30-day all-cause mortality was 4.7% and 5.7%, respectively. On the time-based analyses during the hospital stay, the rate of myocardial infarction, stroke, need for pacemakers, tamponade, coronary obstruction, and vascular complications was similar between both groups. However, cohort B showed less need for conversion to surgery and malapposition of the valve. Also, the implant success rate increased from 93% to 96% (P < .001). In-hospital and 30-day all-cause mortality was significantly lower in cohort B, ([OR, 0.65; IC95%, 0.48-0.86; P = .003] and [OR, 0.71; IC95%, 0.54-0.92; P = .002], respectively).
Conclusions: The time trend analysis of the Spanish TAVI registry showed a change in the patients’ clinical profile and an improvement in the in-hospital clinical outcomes and 30-day all-cause mortality in patients treated more recently.
Keywords: Transcatheter treatment of the aortic valve. Records. Severe aortic stenosis.
Abreviaturas TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI) constituye actualmente la mejor opción terapéutica en la mayoría de los pacientes ancianos con estenosis aórtica grave degenerativa1,4. La evidencia que respalda esta indicación proviene de rigurosos ensayos clínicos aleatorizados realizados tanto con prótesis balón-expandible5-7 como con prótesis autoexpandibles8-10. En este sentido, recientemente esta técnica se ha consolidado tras la publicación de los resultados iniciales de nuevos estudios realizados en pacientes con bajo riesgo11,12.
Con el paso de los años, la técnica de implantación y el tipo de pacientes se han ido modificando13,14. Estos factores, junto con la aparición de nuevas generaciones de válvulas que incluyen mejoras técnicas, han facilitado la disminución de los eventos cardiacos y cerebrales mayores tanto intrahospitalarios como en el seguimiento a largo plazo15,16. En el registro francés de TAVI (n = 16.969 pacientes) se ha observado una reducción del riesgo quirúrgico de los pacientes intervenidos, una mayor simplificación de la técnica por vía transfemoral y un descenso de la mortalidad a corto plazo en los últimos años (2013-2015) en comparación con el primer periodo estudiado (2010-2012). Sin embargo, en el análisis temporal del registro inglés (n = 3.980) no se encontraron estas diferencias.
El objetivo primario de este estudio fue presentar la mortalidad por cualquier causa intrahospitalaria del registro español de TAVI desde su inicio hasta el año 2018. Como objetivos secundarios se incluyeron otros eventos clínicos intrahospitalarios, la mortalidad total a los 30 días y el análisis de la evolución temporal en 2 periodos de tiempo bien definidos: desde agosto de 2007 hasta diciembre de 2013 (cohorte A) y desde enero de 2014 hasta junio de 2018 (cohorte B), evaluando las diferencias en las características clínicas basales y en la aparición de eventos clínicos entre ambos grupos.
MÉTODOS
El registro español de TAVI está promovido por la junta directiva de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología. Desde el año 2010, todos los centros que realizan TAVI en España son invitados cada año a participar en el registro e introducir los datos de todos los pacientes con estenosis aórtica grave tratados con TAVI. Los datos provienen de los servicios de cardiología y de cirugía cardiaca, y se introducen en una base de datos dedicada online que se revisa de manera periódica. A pesar de que no existe una auditoría formal, sistemáticamente se realiza una revisión de los datos introducidos en el registro para buscar inconsistencias o ausencia de datos; la revisión la lleva a cabo una persona experta en bases de datos, que contacta con los centros para solventar las incidencias encontradas. En el registro han participado 46 centros de España (anexo 1 del material adicional), y aunque comenzó en el año 2010, se han introducido 232 pacientes de forma retrospectiva tratados entre los años 2007 y 2009, que han sido incluidos en el análisis.
En este estudio se han analizado todos los pacientes consecutivos incluidos en el registro español de TAVI. En el análisis temporal se dividió la población en pacientes tratados antes de 2014 (cohorte A: 2009-2013) y pacientes tratados entre 2014 y 2018 (cohorte B), dado que 2014 es el año en que se comenzaron a implantar las nuevas generaciones de las 2 válvulas más utilizadas en nuestro país: la Edwards y la CoreValve.
Variables del estudio
Los eventos se definieron según las recomendaciones del Valve Academic Research Consortium17 en la cohorte A y según las recomendaciones del Valve Academic Research Consortium II18 en la cohorte B. Se definió alto riesgo quirúrgico como un valor del EuroSCORE logístico > 20% y un valor del Society of Thoracic Surgeons’ risk model > 8%.
Análisis estadístico
Una vez comprobada la distribución normal (test de normalidad de Kolmogorov-Smirnov), los datos cuantitativos se presentaron en forma de media ± desviación estándar o mediana y rango intercuartílico, según procediera, y los cualitativos como valor absoluto y porcentaje. Para evaluar los predictores de mortalidad hospitalaria se utilizó un modelo de regresión logística multivariable. Se incluyeron en los análisis las variables con un valor de probabilidad < 0,1 en el análisis univariable o clínicamente relevantes. Para evaluar los predictores de mortalidad a los 30 días se realizó un modelo de regresión de Cox con pasos hacia atrás. La curva de supervivencia se obtuvo mediante el método de Kaplan-Meier. Se consideró estadísticamente significativo un valor de p bilateral < 0,05. El análisis estadístico se realizó con el paquete estadístico SPSS 19.
RESULTADOS
Resultados totales
Características basales y del procedimiento
Desde agosto de 2007 hasta junio de 2018 se incluyeron consecutivamente en el registro español de TAVI 7.180 pacientes. La edad media fue de 81,2 ± 6,5 años y el 53% eran mujeres. El EuroSCORE logístico fue del 12% (8-20). Se utilizó un acceso transfemoral en el 89% de los casos, de los cuales el 78% fueron por punción percutánea y el resto por disección quirúrgica. El tipo de prótesis más frecuente fue el sistema autoexpandible tipo CoreValve (49%), seguida muy de cerca por la familia de prótesis balón-expandible Edwards (46%). El tamaño de la prótesis más frecuente fue el número 26. El éxito del dispositivo fue del 94% (tabla 1 y tabla 2).
Tabla 1. Características clínicas y ecocardiográficas basales de los pacientes incluidos en el estudio
| Características basales | Todos los pacientes (n = 7.180) | Cohorte A (años 2009-2013) (n = 3.075) | Cohorte B (años 2014-2018) (n = 4.105) | p |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad | 81,2 ± 6,5 7.171 | 81,0 ± 6,4 3.075 | 81,2 ± 6,7 4.096 | 0,19 |
| Mujeres | 3.796 / 7.166 (53,0) | 1.636 / 3.075 (53,2) | 2.160 / 4.091 (52,8) | 0,79 |
| Peso, kg | 72,6 ± 14 7.087 | 70,9 ± 13 3.069 | 72,1 ± 14 4.018 | < 0,001 |
| Altura, cm | 160 ± 9 6.714 | 159 ± 9 2.879 | 160 ± 9 3.835 | < 0,001 |
| Índice de masa corporal | 28,01 ± 4,9 6.838 | 27,99 ± 4,9 2.879 | 28,16 ± 4,9 3.959 | 0,143 |
| Hipertensión | 5.728 / 7.081 (80,9) | 2.437 / 3.073 (79,3) | 3.291 / 4.008 (82,1) | 0,003 |
| Dislipemia | 3.903 / 6.698 (58,3) | 1.586 / 2.875 (55,1) | 2.317 / 3.823 (60,6) | < 0,001 |
| Diabetes mellitus | 2.447 / 6.752 (36,2) | 998 / 2.875 (34,7) | 1.449 / 3.877 (37,4) | 0,02 |
| Antecedentes | ||||
| ACV previo | 764 / 6.797 (11,3) | 342 / 2.879 (11,9) | 422 / 3.918 (10,7) | 0,15 |
| Enfermedad vascular periférica | 1.009 / 6.903 (14,6) | 484 / 3.071 (15,7) | 525 / 3.832 (13,7) | 0,02 |
| Enfermedad coronaria | 2.090 / 7.105 (29,4) | 1.231 / 3.075 (40,0) | 1.576 / 4.030 (39,1) | 0,43 |
| IAM previo | 919 / 6.565 (13,9) | 396 / 2.878 (13,7) | 523 / 3.687 (14,2) | 0,62 |
| ICP previa | 1.476 / 6.879 (21,4) | 651 / 3.065 (21,2) | 825 / 3.814 (21,6) | 0,70 |
| Cirugía de revascularización previa | 645 / 6.689 (9,6) | 336 / 3.059 (10,9) | 309 / 3.630 (8,5) | 0,001 |
| Recambio valvular aórtico previo | 210 / 4.245 (4,9) | 44 / 931 (4,7) | 166 / 3.314 (5,0) | 0,73 |
| Recambio valvular mitral previo | 81 / 4.245 (1,1) | 6 / 931 (0,6) | 75 / 3.314 (2,3) | 0,001 |
| Fibrilación auricular | 1.905 / 7.037 (27,1) | 855 / 3.067 (27,9) | 1.050 / 3.970 (26,4) | 0,18 |
| Marcapasos | 520 / 7.037 (7,3) | 216 / 3.067 (7,0) | 304 / 3.970 (7,6) | 0,33 |
| Aclaramiento renal (ml/min/1,73 m2) | 55 ± 25 6.638 | 50 ± 47 2.874 | 58 ± 27 3.764 | < 0,001 |
| Disnea clase III-IV | 4.726 / 6.810 (69,4) | 2.136 / 2.877 (74,2) | 2.590 / 3.933 (66,8) | < 0,001 |
| Angina clase III-IV | 567 / 7.062 (8,0) | 303 / 3.073 (9,8) | 264 / 3.989 (7) | < 0,001 |
| EuroSCORE logístico | 12 (8-20) 6.738 | 14 (9-22) 3.027 | 11 (7-18) 3.711 | < 0,001 |
| Escala STS | 5 (3-9) 3.190 | 7 (4-18) 1.024 | 5 (3-7) 2.166 | < 0,001 |
| Alto riesgo quirúrgico | 2.010 (28,0%) | 1.139 (37%) | 871 (22%) | < 0,001 |
| Contraindicación quirúrgica | 1.854 / 7.180 (25,8) | 971 / 3.075 (31,6) | 883 / 4.105 (21,5) | < 0,001 |
| Datos ecocardiográficos preprocedimiento | ||||
| FEVI (%) | 56,9 ± 13 6.927 | 56,9 ± 14 3.056 | 56,8 ± 13 3.871 | 0,66 |
| Gradiente transvalvular aórtico medio, mmHg | 48 ± 15 6.599 | 49 ± 15 3.026 | 47 ± 15 3.573 | < 0,001 |
| Gradiente transvalvular aórtico máximo, mmHg | 79 ± 23 6.606 | 81 ± 23 3.033 | 77 ± 23 3.573 | < 0,001 |
| Área valvular indexada, cm2 | 0,65 ± 0,2 4.267 | 0,62 ± 0,2 1.679 | 0,68 ± 0,2 2.588 | < 0,001 |
| Presión de la arteria pulmonar, mmHg | 47 ± 18 3.046 | 48 ± 16 1.188 | 47 ± 20 1.858 | 0,17 |
| Diámetro del anillo aórtico, mm | 23,2 ± 3 3.935 | 22,9 ± 2 1.224 | 23,2 ± 3 2.711 | 0,001 |
| Insuficiencia mitral grado III-IV | 410 / 5.857 (7,0) | 159 / 2.368 (6,7) | 251 / 3.489 (7,2) | 0,48 |
| Insuficiencia aórtica grado III-IV | 121 / 3.172 (3,8) | 56 / 691 (8,1) | 65 / 2.481 (2,6) | < 0,001 |
|
ACV: accidente cerebrovascular; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; STS: Society of Thoracic Surgeons’ risk model. |
||||
Tabla 2. Características del procedimiento
| Todos los pacientes (n = 7.180) | Cohorte A (años 2009-2013) (n = 3.075) | Cohorte B (años 2014-2018) (n = 4.105) | p | |
|---|---|---|---|---|
| Acceso | < 0,001 | |||
| Transaórtico | 56 / 7.180 (0,8) | 28 / 3.075 (0,9) | 28 / 4.105 (0,7) | |
| Axilar subclavio | 144 / 7.180 (2,0) | 58 / 3.075 (1,8) | 86 / 4.105 (2,0) | |
| Transapical | 568 / 7.180 (7,9) | 431 / 3.075 (14,0) | 137 / 4.105 (3,3) | |
| Transfemoral | 6.412 / 7.180 (89,3) | 2.558 / 3.075 (83,2) | 3.804 / 4.105 (92,6) | |
| Tipo de acceso | 0,57 | |||
| Disección | 1.378 / 6.225 (22,1) | 526 / 2.417 (21,7) | 852 / 3.808 (22,4) | |
| Punción | 4.847 / 6.225 (77,8) | 1.891 / 2.417 (78,2) | 2.956 / 3.808 (77,6) | |
| Tipo de prótesis | < 0,0001 | |||
| Engager | 5 / 7.180 (0,1) | 0 / 3.075 (0) | 5 / 4.105 (0,1) | |
| Direct Flow | 8 / 7.180 (0,1) | 3 / 3.075 (0,1) | 5 / 4.105 (0,1) | |
| Allegra | 5 / 7.180 (0,1) | 0 / 3.075 (0,1) | 16 / 4.105 (0,4) | |
| Lotus | 60 / 7.180 (0,8) | 1 / 3.075 (0,03) | 59 / 4.105 (1,4) | |
| Symetis | 105 / 7.180 (1,5) | 0 / 3.075 (0) | 105 / 4.105 (2,6) | |
| Portico | 172 / 7.180 (2,4) | 0 / 3.075 (0) | 172 / 4.105 (4,1) | |
| Edwards | 3.309 / 7.180 (46,1) | 1.468 / 3.075 (47,7) | 1.841 / 4.105 (44,8) | |
| CoreValve | 3.516 / 7.180 (48,9) | 1.603 / 3.075 (52,1) | 1.913 / 4.105 (46,6) | |
| Tamaño de la prótesis | < 0,001 | |||
| 23 | 1.746 / 6.712 (26,0) | 742 / 2.865 (25,9) | 1.004 / 3.847 (26,1) | |
| 26 | 2.742 / 6.712 (40,9) | 1.402 / 2.865 (48,9) | 1.340 / 3.847 (34,8) | |
| 29 | 1.791 / 6.712 (26,7) | 681 / 2.865 (23,8) | 1.110 / 3.847 (28,8) | |
| > 29 | 247 / 6.712 (3,6) | 37 / 2.865 (1,2) | 210 / 3.847 (5,4) | |
| Otros tamaños | 186 / 6.712 (2,7) | 3 / 865 (0,04) | 183 / 3.847 (4,7) | |
| Predilatación | 2.072 / 3.748 (55,3) | 707 / 809 (87,4) | 1.365 / 2.939 (46,4) | < 0,0001 |
| Posdilatación | 1.457 / 6.767 (21,5) | 561 / 3.071 (18,3) | 897 / 3.696 (24,3) | < 0,0001 |
| Sala | < 0,0001 | |||
| Quirófano | 288 / 7.180 (4,0) | 223 / 3.075 (7,2) | 65 / 4.105 (1,5) | |
| Sala de hemodinámica | 6.575 / 7.180 (91,6) | 2.759 / 3.075 (89,7) | 3.816 / 4.105 (92,5) | |
| Híbrida | 317 / 7.180 (4,4) | 93 / 3.075 (3,0) | 224 / 4.105 (5,4) | |
| Duración, minutos (media ± desviación estándar) | 105 ± 45 | 106 ± 47 | 105 ± 43 | 0,48 |
| Mediana | 95 (72-121) 5.514 | 95 (72-122) 2.834 | 95 (72-120) 2.680 | 0,94 |
| Duración ingreso, días (media ± desviación estándar) | 8,3 ± 8 | 8,6 ± 8 | 8,0 ± 7 | 0,002 |
| Mediana | 6 (5-9) 6.459 | 6 (5-9) 2.751 | 6 (4-8) 3.708 | 0,15 |
| Éxito del implante | 6.778 / 7.153 (94,8) | 2.848 / 3.062 (93,0) | 3.930 / 4.091 (96,1) | < 0,001 |
Complicaciones intrahospitalarias y en el seguimiento
Durante la hospitalización, la tasa de infarto agudo de miocardio fue del 0,9%, la de accidente cerebrovascular fue del 1,9%, la de complicaciones vasculares fue del 10,7% y la de hemorragia fue del 7,6%. La necesidad de implante de marcapasos fue del 14%. La mortalidad total intrahospitalaria fue del 4,7% y a los 30 días del 5,7% (tabla 3).
Tabla 3. Eventos hospitalarios
| Todos | Cohorte A (años 2009-2013) (n = 3.075) | Cohorte B (años 2014-2018) (n = 4.105) | p | OR no ajustada | OR ajustada | p | |
|---|---|---|---|---|---|---|---|
| Conversión cirugía | 58 / 7.076 (0,8) | 34 / 3.005 (1,1) | 24 / 4.062 (0,6) | 0,013 | 0,52 (0,31-0,88) | 0,49 (0,24-0,98) | 0,04 |
| Taponamiento | 57 / 6.899 (0,8) | 19 / 2.900 (0,7) | 38 / 3.999 (1,0) | 0,18 | 1,45 (0,83-2,56) | 2,17 (1,08-3,85) | 0,03 |
| Obstrucción coronaria | 23 / 6.889 (0,3) | 12 / 2.897 (0,4) | 11 / 3.992 (0,3) | 0,33 | 0,66 (0,29-1,52) | 0,69 (0,28-1,69) | 0,42 |
| Malaposición | 153 / 6.884 (2,2) | 92 / 2.897 (3,2) | 61 / 3.987 (1,5) | < 0,001 | 0,47 (0,34-0,66) | 0,46 (0,32-0,66) | 0,001 |
| Migración | 119 / 6.884 (1,7) | 76 / 2.897 (2,5) | 43 / 3.987 (1) | ||||
| Embolización | 12 / 6.884 (0,2) | 2 / 2.897 (0,1) | 10 / 3.987 (0,2) | ||||
| Desconocido | 22 / 6.884 (0,3) | 14 / 2.897 (0,2) | 8 / 3.987 (0,1) | ||||
| IAM | 64 / 7.055 (0,9) | 28 / 3.053 (0,9) | 36 / 4.001 (0,9) | 0,94 | 0,98 (0,60-1,61) | 0,97 (0,53-1,79) | 0,93 |
| Complicaciones vasculares | 769 / 7.055 (10,7) | 268 / 3.053 (8,8) | 501 / 4.001 (12,5) | < 0,001 | 1,49 (1,27-1,72) | 1,18 (0,98-1,41) | 0,09 |
| Hemorragias | 544 / 7.054 (7,6) | 169 / 3.053 (5,5) | 375 / 4.001 (9,4) | < 0,001 | 1,75 (1,47-2,13) | 1,79 (1,43-2,22) | < 0,001 |
| Complicaciones renales | 377 / 7.054 (5,3) | 140 / 3.053 (4,6) | 237 / 4.001 (5,9) | 0,01 | 1,32 (1,05-1,61) | 1,32 (1,03-1,69) | 0,028 |
| ACV | 133 / 7.055 (1,9) | 55 / 3.053 (1,8) | 78 / 4.001 (1,9) | 0,65 | 1,09 (0,76-1,54) | 0,84 (0,55-1,28) | 0,43 |
| Marcapasos | 1.016 / 7.092 (14,3) | 416 / 3.053 (13,6) | 600 / 4.001 (15,0) | 0,14 | 1,11 (0,96-1,27) | 0,99 (0,84-1,16) | 0,91 |
| Mortalidad hospitalaria | 340 / 7.054 (4,7) | 200 / 3.053 (6,6) | 140 / 4.001 (3,5) | < 0,001 | 0,52 (0,41-0,65) | 0,65 (0,48-0,86) | 0,003 |
|
ACV: accidente cerebrovascular; IAM: infarto agudo de miocardio; OR: odds ratio. |
|||||||
Resultados del análisis temporal
Características basales y del procedimiento
No se observaron diferencias entre los grupos en cuanto a la edad media y el sexo de los pacientes. Sin embargo, la cohorte B presentó con más frecuencia factores de riesgo cardiovascular y cirugía previa de la válvula mitral, pero menos enfermedad vascular periférica. A pesar de que la incidencia de enfermedad coronaria fue similar en ambos grupos, el antecedente de revascularización coronaria quirúrgica fue menos frecuente en la cohorte B. Las cifras de aclaramiento de creatinina fueron mayores en la cohorte B. Con respecto a la situación clínica, la presencia de síntomas graves (clase funcional III-IV), tanto para disnea (New York Heart Association) como para angina (clasificación canadiense), fue significativamente menor en la cohorte B. El riesgo quirúrgico según el EuroSCORE logístico y el Society of Thoracic Surgeons’ risk model fue significativamente menor en la cohorte B. En la cohorte B también hubo menos pacientes inoperables o con alto riesgo quirúrgico. En este grupo, la gravedad de la estenosis fue menor (mayor área valvular indexada, menor gradiente medio transvalvular) y el diámetro del anillo fue mayor. Con respecto al tipo de acceso, a partir del año 2014 aumentó de manera muy significativa el acceso transfemoral, que pasó de un 83 a un 94%, debido fundamentalmente a una reducción del acceso transapical del 14 al 3%. El tipo de válvula fue casi exclusivamente Edwards SAPIEN XT y CoreValve en la cohorte A, mientras que en la cohorte B se introdujeron las nuevas generaciones de estas válvulas (Edwards SAPIEN 3 y Evolut R), así como otro tipo de válvulas autoexpandibles como Portico (4,1%), ACURATE neo (2,6%) y la válvula Lotus (1,4%). El tamaño de válvula más frecuente fue de 26 mm en ambos grupos. La tasa de predilatación disminuyó en la cohorte B, pero aumentó la tasa de posdilatación. El éxito del implante se incrementó significativamente en el último periodo y pasó de un 93% (cohorte A) a un 96% (cohorte B). También se modificó de manera significativa el espacio de trabajo donde se efectuó el TAVI; aunque la sala de hemodinámica fue el más habitual en ambas cohortes, en la B se observó una reducción de los implantes en el quirófano y un incremento en las salas híbridas.
Eventos intrahospitalarios y a los 30 días de seguimiento
La duración del ingreso se redujo de manera significativa en la cohorte B. En la fase hospitalaria, las tasas de infarto agudo de miocardio, accidente cerebrovascular, necesidad de marcapasos y obstrucción coronaria fueron similares en ambos grupos. Sin embargo, la incidencia de conversión a cirugía (figura 1) y de mala posición de la válvula se redujo significativamente en los pacientes tratados a partir del año 2014. No hubo diferencias entre los grupos en cuanto a complicaciones vasculares, pero las tasas de hemorragias totales y de complicaciones renales fueron más altas en la cohorte B. La mortalidad ajustada por cualquier causa hospitalaria fue notablemente menor en la cohorte B, con una reducción del 47% (odds ratio [OR] = 0,65; intervalo de confianza del 95% [IC95%], 0,48-0,86; p = 0,003).
Figura 1. Tasa de conversión a cirugía urgente a lo largo de los años.
En el seguimiento clínico a los 30 días, la mortalidad se redujo un 32% en la cohorte B (6,9 frente a 4,7%) (OR = 0,71; IC95%, 0,54-0,92; p = 0,002) (figura 2 y figura 3). Los predictores de mortalidad a los 30 días se detallan en la tabla 4.
Figura 2. Tasa de supervivencia al año de seguimiento en los pacientes incluidos en el registro español de TAVI tratados en los años 2009-2013 y 2014-2018.
Figura 3. Tasa de supervivencia al año de seguimiento en los pacientes solo con alto riesgo quirúrgico tratados en 2009-2013 y 2014-2018.
Tabla 4. Predictores independientes de mortalidad a los 30 días de seguimiento
| Variables predictoras de muerte a 30 días | OR univariable (IC95%) | p | OR multivariable ajustada (IC95%) previa al procedimiento | p | OR multivariable ajustada (IC95%) previa y posterior al procedimiento | p |
|---|---|---|---|---|---|---|
| Preprocedimiento | ||||||
| Años 2014-2018 | 0,52 (0,41-0,65) | < 0,001 | 0,59 (0,46-0,76) | < 0,001 | 0,71 (0,54-0,92) | 0,01 |
| Índice de masa corporal | 0,97 (0,95-0,99) | 0,007 | ||||
| Dislipemia | 0,93 (0,74-0,93) | 0,54 | 0,94 (0,74-1,21) | 0,64 | 0,89 (0,69-1,14) | 0,35 |
| Aclaramiento de creatinina | 0,99 (0,98-0,99) | < 0,001 | * | * | ||
| Enfermedad vascular periférica | 1,49 (1,13-1,97) | 0,005 | * | * | ||
| Gradiente aórtico medio, mmHg | 1,003 (0,99-1,01) | 0,47 | 1,002 (0,99-1,01) | 0,57 | 1,003 (0,99-1,01) | 0,54 |
| Insuficiencia mitral III-IV | 1,98 (1,34-2,92) | 0,001 | * | * | ||
| Insuficiencia aórtica III-IV | 2,06 (1,01-4,19) | 0,05 | * | * | ||
| Angina III-IV | 1,08 (0,73-1,61) | 0,69 | 1,16 (0,76-1,78) | 0,50 | 1,16 (0,74-1,81) | 0,52 |
| Disnea III-IV | 1,48 (1,13-1,96) | 0,005 | * | * | ||
| Riesgo quirúrgico | 1,38 (1,09-1,74) | 0,007 | 1,33 (1,03-1,71) | 0,029 | 1,26 (0,96-1,64) | 0,09 |
| Posprocedimiento | ||||||
| Tipo acceso transfemoral | 0,50 (0,38-0,66) | < 0,001 | 0,49 (0,36-0,67) | < 0,001 | ||
| Éxito del implante | 0,10 (0,08-0,13) | < 0,001 | 0,11 (0,09-0,15) | < 0,001 | ||
|
IC95%: intervalo de confianza del 95%; OR: odds ratio. Estas variables no se han introducido en el modelo porque se utilizan para calcular el riesgo quirúrgico. |
||||||
DISCUSIÓN
Los principales hallazgos de este estudio fueron: a) existe una evolución temporal en el tipo de pacientes tratados con TAVI en España a lo largo de los años; b) se demuestra que ha habido modificaciones, con un aumento del acceso transfemoral, un aumento de la posdilatación, una disminución de la tasa de mala posición, una disminución de la necesidad de conversión a cirugía y, lo que es más importante, un incremento significativo de la tasa de éxito del implante a partir del año 2014; y c) se observa una reducción significativa de la mortalidad por cualquier causa, tanto intrahospitalaria como a los 30 días, en los pacientes tratados a partir del año 2014.
Diferencias en las características basales
En el presente estudio se observó un cambio temporal en el perfil de riesgo de los pacientes tratados con TAVI en España. El porcentaje de pacientes con alto riesgo en el primer periodo fue del 37%, frente al 22% a partir de 2014. Estos hallazgos concuerdan con los descritos en el análisis temporal del registro francés15, en el que se redujo el EuroSCORE logístico de un 21,7 ± 14,2% a un 17,9 ± 12,3. En este sentido, los hechos que explican estos hallazgos son la aparición de estudios aleatorizados que usan el TAVI en pacientes de menor riesgo2,7. Entre los años 2015 y 2016 se dispuso de los resultados de los estudios NOTION (The Nordic Aortic Valve Intervention) y PARTNER II (Placement of Aortic Transcatheter Valves), realizados en pacientes de riesgo bajo e intermedio, respectivamente. En el estudio NOTION no se encontraron diferencias significativas entre los pacientes tratados con TAVI o con recambio valvular aórtico quirúrgico en términos del objetivo combinado de muerte, accidente cerebrovascular o infarto agudo de miocardio al año y a los 5 años. En el estudio PARTNER II7 se aleatorizaron 2.032 pacientes con riesgo intermedio para ser tratados con TAVI o con cirugía, y no hubo diferencias significativas en el objetivo primario de muerte por cualquier causa o accidente cerebrovascular discapacitante a los 2 años de seguimiento. Sin embargo, al estudiar solo la cohorte tratada mediante acceso transfemoral, el TAVI tuvo unas tasas notablemente menores de muerte y de accidente cerebrovascular discapacitante.
Diferencias en el procedimiento
En el presente estudio se describen cambios temporales que parecen tener un impacto en el aumento de la tasa de éxito del implante, lo cual es un factor íntimamente relacionado con la mortalidad. La diferencia encontrada sería un descenso de la mala posición. Además, se describe un incremento del acceso transfemoral. Todos estos cambios se explican por la mayor experiencia con la técnica de implantación, cuya tendencia es a la simplificación, y por las mejoras en el diseño de las prótesis. A lo largo de 2014 se comenzaron a implantar las nuevas generaciones de válvulas (Edwards SAPIEN 3 y Evolut R), que aportan mejoras técnicas como la reducción del tamaño del sistema liberador y propician un mayor uso por vía transfemoral en la cohorte B. La incorporación de la falda externa se asoció a una menor tasa de fuga periprotésica, con un mayor éxito del dispositivo y una menor necesidad de sobredimensionamiento de la prótesis, lo que disminuye potencialmente la incidencia de rotura del anillo y la necesidad de conversión a cirugía (procedimiento con una alta mortalidad). Además, en el caso de la prótesis Evolut R la incorporación de una plataforma totalmente recapturable puede haber tenido un papel en la disminución de la incidencia de mala posición y, también, en el aumento de la tasa de éxito del implante que se observa a partir de 2014.
Reducción de la mortalidad
En el año 2013 se publicaron los datos de 1.416 pacientes incluidos en los años 2010 y 2011 en el registro español de TAVI19. En este análisis se reportó una tasa de éxito del implante del 94% y una mortalidad hospitalaria del 8%. En el presente estudio, la tasa de mortalidad total fue del 4,7%. Un aspecto reseñable de este análisis temporal del registro español es que se demuestra una clara disminución de la mortalidad en el segundo periodo estudiado (cohorte B), que es independiente de las características basales de los pacientes. Estos resultados están en consonancia con el análisis temporal del registro francés, en el que se demostró una reducción de la mortalidad hospitalaria y a los 30 días de los pacientes incluidos en el periodo 2013-201515. Por el contrario, en el análisis temporal del registro inglés16, que abarcó los años 2007 a 2012, no hubo diferencias en las características basales ni el riesgo quirúrgico de los pacientes incluidos en esos años, pero aumentó el porcentaje de pacientes con disfunción ventricular. En este registro solo se observó un descenso en la mortalidad en los 2 primeros años de seguimiento en los pacientes tratados en 2012 y un descenso en los días de hospitalización. Los autores achacan estos resultados a la adquisición con el tiempo de mayor experiencia para seleccionar mejor a los pacientes que se benefician más del TAVI, hecho que también puede haber afectado a los resultados del presente estudio.
En este registro, al igual que en el francés, se encontró un aumento de la tasa de taponamiento en el último periodo estudiado. Sin embargo, la tasa de conversión a cirugía fue menor, lo que sugiere que la consolidación del procedimiento y el diagnóstico precoz de las complicaciones pueden haber influenciado los resultados.
Un aspecto destacable es el incremento de las hemorragias totales y de la disfunción renal observado en la cohorte B. Estos resultados deben considerarse con precaución, pues falta información sobre la gravedad y la causa de estos eventos. No obstante, dada la disminución de la mortalidad en este periodo, se puede inferir que no deben aumentar de manera importante las hemorragias mayores, aunque esto sería una especulación, ya que no se dispone de más información.
Limitaciones
La principal limitación de este estudio radica en que se trata de un registro cuyos datos no han sido sometidos a auditoría externa, y además es un registro voluntario en el que no participan todos los centros que realizan TAVI en España. Alguna variable está recogida en el 50% de los pacientes, lo cual es excepcional, ya que la gran mayoría de las variables constan en más del 90% de los casos. En el caso de las complicaciones vasculares (hemorragia e insuficiencia renal) no se dispone del grado o de las causas, y en consecuencia los datos deben tomarse con precaución. Por otro lado, el cambio en la adjudicación de eventos derivado de la distinta definición utilizada en el primer y en el segundo periodo (Valve Academic Research Consortium y Valve Academic Research Consortium II, respectivamente) podría variar en algún paciente, aunque se considera que sería excepcional.
CONCLUSIONES
En el presente estudio se demuestra un mejor perfil de riesgo de los pacientes tratados en los últimos años, junto con una mejora fundamentalmente en el éxito del implante, lo que ha conllevado una disminución de la mortalidad por cualquier causa tanto hospitalaria como a los 30 días de seguimiento.
AGRADECIMIENTOS
Los autores desean agradecer a la Dra. María José Pérez-Vizcayno su ayuda en la revisión de los datos y en el análisis estadístico. Los autores están muy agradecidos a todas las personas involucradas y todos los centros participantes en el registro nacional español de TAVI.
FINANCIACIÓN
La Sección de Hemodinámica y Cardiología Intervencionista financia el mantenimiento y la explotación de la base de datos.
CONFLICTO DE INTERESES
R. Trillo-Nouche es proctor de válvulas de TAVI para Medtronic y Boston Scientific. M. Pan ha participado y recibido honorarios en charlas para Abbott, Terumo Medical Corporation y Philips Volcano. R. Moreno es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. R. Moreno ha participado y recibido honorarios por charlas, asesoría y asistencia a congresos por parte de Edwards Lifesciences, y es proctor de válvulas Lotus y ACURATE neo, ambas de Boston Scientific. R. Moreno también ha participado en charlas, asesoría y asistencia a congresos para Boston Scientific, y es proctor de la válvula Allegra de New Vascular Therapy. I. Amat-Santos es proctor de Boston Scientific. R. Romaguera ha participado y recibido honorarios de Medtronic y Palex Medical. A. Pérez de Prado ha participado y recibido honorarios por asesorías a Boston Scientifice iVascular, y por charlas para Abbott, B Braun Surgical, Terumo Medical Corporation y Philips Volcano. L. Nombela-Franco es proctor para Abbott y ha participado y recibido honorarios por charlas de Edwards Lifesciences. F. Alfonso es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. J. M. de la Torre Hernández es editor jefe de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. El resto de los autores no tienen conflictos de intereses.
¿QUÉ SE SABE DEL TEMA?
- En registros nacionales, como el francés, ya se ha observado un cambio temporal en el perfil clínico y en la evolución clínica de los pacientes tratados con TAVI. Sin embargo, estos hallazgos no se han producido en el análisis temporal del registro inglés.
¿QUÉ APORTA DE NUEVO?
- El principal aporte de este estudio es la publicación de los datos totales del registro de nuestro país y que en la literatura queden reflejados los resultados, además de mostrar la existencia de un cambio temporal en el perfil de los pacientes y en los resultados clínicos, que refleja el aumento de la experiencia con la técnica de implantación y las mejoras en el diseño de las prótesis.
BIBLIOGRAFÍA
1. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
2. Thyregod HG, Steinbrüchel DA, I hlemann N, et al. Transcatheter Versus Surgical Aortic Valve Replacement in Patients With Severe Aortic Valve Stenosis:1-Year Results From the All-Comers NOTION Randomized Clinical Trial. J Am Coll Cardiol. 2015;65:2184-2194.
3. Makkar RR, Fontana GP, Jilaihawi H, et al. Transcatheter aortic-valve replacement for inoperable severe aortic stenosis. N Engl J Med. 2012;366:1696-1704.
4. Thourani VH, Kodali S, Makkar RR, et al. Transcatheter aortic valve replacement versus surgical valve replacement in intermediate-risk patients:a propensity score analysis. Lancet. 2016;387:2218-2225.
5. Kodali SK, Williams MR, Smith CR, et al. Two-year outcomes after transcatheter or surgical aortic-valve replacement. N Engl J Med. 2012;366:1686-1695.
6. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
7. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
8. Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
9. Popma JJ, Adams DH, Reardon MJ, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63:1972-1981.
10. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic- Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
11. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
12. Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
13. Islas F, Almería C, García-Fernández E, et al. Usefulness of echocardiographic criteria for transcatheter aortic valve implantation without balloon predilation:a single-center experience. J Am Soc Echocardiogr. 2015;28:423-429.
14. García E, Almería C, UnzuéL, Jiménez-Quevedo P, Cuadrado A, Macaya C. Transfemoral implantation of Edwards Sapien XT aortic valve without previous valvuloplasty:role of 2D/3D transesophageal echocardiography. Catheter Cardiovasc Interv. 2014;84:868-876.
15. Auffret V, Lefevre T, Van Belle E, et al. Temporal Trends in Transcatheter Aortic Valve Replacement in France:FRANCE 2 to FRANCE TAVI. J Am Coll Cardiol. 2017;70:42-55.
16. Ludman PF, Moat N, de Belder MA, et al. Transcatheter aortic valve implantation in the United Kingdom:temporal trends, predictors of outcome, and 6-year follow-up:a report from the UK Transcatheter Aortic Valve Implantation (TAVI) Registry, 2007 to 2012. Circulation. 2015;131:1181-1190.
17. Leon MB, Piazza N, Nikolsky E, et al. Standardized endpoint definitions for transcatheter aortic valve implantation clinical trials:a consensus report from the Valve Academic Research Consortium. Eur Heart J. 2011;32:205-217.
18. Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation:the Valve Academic Research Consortium-2 consensus document. Eur Heart J. 2012;33:2403-2418.
19. SabatéM, Cánovas S, García E, et al. In-hospital and mid-term predictors of mortality after transcatheter aortic valve implantation:data from the TAVI National Registry 2010-2011. Rev Esp Cardiol. 2013;66:949-958.