RESUMEN
Introducción y objetivos: La trombosis del stent (TS) es una complicación infrecuente del intervencionismo coronario, pero potencialmente letal. Su fisiopatología es multifactorial y en algunos casos no está bien esclarecida. La tomografía de coherencia óptica (OCT) ofrece una alta resolución espacial y permite identificar causas mecánicas subyacentes relacionadas con la TS que escapan a la angiografía convencional.
Métodos: Registro prospectivo unicéntrico que incluyó consecutivamente pacientes con diagnóstico de TS definitiva a los que se realizó OCT en el momento agudo. Se evaluó la presencia de anomalías mecánicas subyacentes y se estableció si podían considerarse la causa más probable de la TS. Se evaluaron el pronóstico intrahospitalario y la evolución clínica durante el seguimiento.
Resultados: Se incluyeron 105 pacientes. Se identificaron anomalías mecánicas por OCT en el 87% de los casos, y finalmente se establecieron como causa más probable de la TS en el 77,1%. Los hallazgos difirieron de manera significativa en función de la temporalidad de las TS: en las agudas, lo más frecuente fue no encontrar ninguna anomalía mecánica (41,8%); en las subagudas, predominó la infraexpansión del stent (47,8%); en las tardías, la mala aposición (30,8%), y en las muy tardías, la neoateroesclerosis (52%). En cambio, no se encontraron diferencias en los hallazgos de OCT en función del tipo de stent trombosado. En todos los casos se realizó un tratamiento dirigido a corregir la anomalía detectada, con implante de nuevo stent en el 52% de los pacientes. No se detectaron complicaciones relacionadas con la técnica de OCT.
Conclusiones: La OCT es una herramienta segura y útil en el estudio de la TS. Permite identificar mecanismos causales específicos en función de la temporalidad y optimizar el tratamiento de los pacientes que sufren esta rara, pero grave, complicación.
Palabras clave: Tomografía de coherencia óptica. Trombosis del stent. Imagen intracoronaria.
Abstract
Introduction and objectives: Stent thrombosis (ST) is a rare but potentially fatal complication of percutaneous coronary interventions. With its high spatial resolution, optical coherence tomography (OCT) allows identification of underlying mechanical causes of stent thrombosis that may be overlooked by conventional angiography.
Methods: We conducted a prospective, single-center registry that consecutively included patients with a definitive diagnosis of ST who underwent OCT at the acute presentation. The presence of underlying mechanical abnormalities was assessed, and their likelihood as the primary cause of ST was determined. In-hospital and follow-up prognosis was evaluated.
Results: A total of 105 patients were included in the final analysis. Mechanical abnormalities were identified by the OCT in 87% of cases and deemed the most probable cause of ST in 77.1%. Findings varied significantly by timing of stent thrombosis: in acute cases, no mechanical abnormality was most common (41.8%); in subacute cases, stent underexpansion predominated (47.8%); in late cases, malapposition was most frequent (30.8%); and in very late cases, neoatherosclerosis was the leading cause (52%). However, no significant differences were found in relation to the type of stent involved. In all cases, treatment was tailored to correct the detected abnormality, with a new stent being implanted in 52% of patients. There were no OCT-related complications.
Conclusions: OCT is a safe and valuable tool in the assessment of ST as it allows the identification of distinct causative mechanisms according to timing of ST and helps optimize the management of patients experiencing this rare but serious complication.
Keywords: Optical coherence tomography. Stent thrombosis. Intracoronary imaging.
Abreviaturas
OCT: tomografía de coherencia óptica. TS: trombosis del stent.
INTRODUCCIÓN
La evolución tecnológica del intervencionismo coronario, impulsada especialmente por los stents farmacoactivos de última generación, ha transformado el tratamiento de la cardiopatía isquémica, reduciendo eficazmente la reestenosis y mejorando el pronóstico clínico de los pacientes1. No obstante, la trombosis del stent (TS) persiste como una complicación infrecuente, pero devastadora, con una mortalidad asociada que puede alcanzar el 40%2. Sus mecanismos fisiopatológicos son complejos y multifactoriales, incluyendo factores relacionados con el paciente, la técnica del implante, el tipo de stent utilizado y la propia evolución de la enfermedad3.
Tradicionalmente, la angiografía coronaria ha sido la herramienta de elección para la evaluación de posibles complicaciones tras el implante de un stent. Sin embargo, su incapacidad para visualizar adecuadamente la interacción del stent y la pared vascular limita su utilidad diagnóstica. En este contexto, la tomografía de coherencia óptica (OCT), gracias a su excelente resolución espacial, permite identificar in vivo alteraciones mecánicas subyacentes potencialmente responsables o coadyuvantes de la TS.
El presente estudio tiene como objetivo principal evaluar el papel de la OCT en la caracterización de los mecanismos implicados en la TS, analizando su viabilidad, seguridad, implicaciones terapéuticas y potencial para optimizar la estrategia de revascularización en este complejo escenario clínico. Los hallazgos preliminares del estudio fueron publicados anteriormente4, y ahora presentamos los resultados definitivos.
MÉTODOS
Población de estudio
Se realizó un registro prospectivo unicéntrico en el que se incluyeron consecutivamente pacientes con diagnóstico de TS definitiva, según los criterios del Academic Research Consortium, desde octubre de 2013 hasta diciembre de 2022, en el Hospital Universitario de La Princesa, Madrid. Durante ese periodo se implantaron stents en 6.881 pacientes. Se excluyeron los pacientes con inestabilidad hemodinámica grave y lesiones inaccesibles con el catéter de OCT.
Se realizó un protocolo sistemático que incluía la realización de OCT antes y después del tratamiento. Si al cruzar la lesión con la guía no se recuperaba flujo anterógrado, se recomendaba realizar tromboaspiración, y si persistía un flujo TIMI de 0-1 se recomendaba utilizar un balón < 2 mm inflado a baja presión para evitar la distorsión de la lesión subyacente. El tratamiento final de la TS fue decidido libremente por el operador.
Las TS se clasificaron en función del tiempo desde el implante: aguda (< 24 horas), subaguda (24 horas a 30 días), tardía (30 días a 1 año) o muy tardía (> 1 año). Los stents se categorizaron en convencional, farmacoactivo de primera generación, farmacoactivo de nueva generación o bioabsorbible.
Se realizó un seguimiento clínico prospectivo evaluando la mortalidad intrahospitalaria y, tras el alta, un evento combinado de mortalidad de causa cardiovascular, nuevo infarto, nueva TS o nueva revascularización del vaso culpable.
El protocolo del estudio fue aprobado por el Comité Ético del Hospital Universitario de La Princesa y todos los pacientes otorgaron el consentimiento informado.
Adquisición y análisis de imágenes de OCT
Se emplearon los sistemas de OCT disponibles en cada momento (Dragonfly, St. Jude Medical, y OPTIS AptiVue, Abbott), y las imágenes se adquirieron con técnica no oclusiva y un volumen de contraste de 15 ml a 5 ml/s en el árbol izquierdo y de 12 ml a 4 ml/s en la coronaria derecha para el purgado. Se estudiaron el segmento correspondiente al stent y los 10 mm adyacentes a sus bordes. Se descartaron aquellos estudios de mala calidad por purgado insuficiente o por artefactos. Se realizó un análisis morfométrico corte a corte que incluía el área luminal mínima, el área del stent mínima y máxima, las áreas y los diámetros de referencia, el índice de expansión del stent (área del stent mínima / área de referencia media × 100), la carga trombótica (en longitud y área) y la mala aposición (distancia axial desde la superficie del strut hasta el borde de la luz mayor que el grosor del strut [significativa cuando > 200 µm])5. Se consideraron como struts no cubiertos aquellos que estaban en contacto directo con la luz del vaso. La neoateroesclerosis se definió como cambios en la neoíntima que incluyesen tejido lipídico, fibrolipídico o cálcico, y se estudió la presencia de rotura de placa. Se evaluó si existía disección de los bordes (separación de tejido vascular que penetra hasta la media, se extiende 2 mm y > 60°)6 o enfermedad del borde del stent (placa lipídica rota adyacente al borde, por cobertura incompleta o por progresión de la enfermedad)7,8. El análisis lo realizaron 2 analistas expertos en OCT sin conocer las características clínicas de los pacientes, según un protocolo estandarizado.
Objetivo principal: anomalías mecánicas y hallazgo dominante
Se analizó la presencia de anomalías mecánicas y se estableció un hallazgo dominante en cada caso. Si coexistían varias, se consideró como hallazgo dominante aquella anomalía que predominase en la zona con mayor cantidad de trombo9. Se especificaron como anomalías mecánicas potencialmente culpables la disección del borde, la infraexpansión, la mala aposición grave, la progresión de enfermedad del borde, la neoateroesclerosis y la ausencia de recubrimiento de los struts (para TS tardías y muy tardías); también se registró la ausencia de anomalías mecánicas. Posteriormente, se determinó si el hallazgo dominante podía considerarse la causa principal de la TS. Esto se hizo excluyendo otras posibles causas de TS (fallos en la medicación antiagregante o situaciones clínicas protrombóticas). Se estudiaron los factores predictores de la presencia de neoateroesclerosis y de la rotura de placa en TS muy tardías.
Análisis estadístico
Para el análisis estadístico se utilizó el software R. Las variables continuas se expresaron como media y desviación estándar o como mediana (P25-P75), y se compararon con las pruebas t de Student o Wilcoxon. Para más de 2 grupos, se usaron las pruebas ANOVA o Kruskal-Wallis. Las variables categóricas se compararon con las pruebas χ2 o exacta de Fisher. Se aplicaron modelos de regresión logística para predictores de mortalidad intrahospitalaria y modelos de Cox para eventos tras el alta. El análisis de supervivencia se presentó con curvas de Kaplan-Meier y comparación log-rank. El nivel de significación establecido fue p < 0,05.
RESULTADOS
Características clínicas y angiográficas
Se registraron 142 pacientes con diagnóstico de TS definitiva, de los cuales 105 fueron incluidos en el análisis final (figura 1). Se contabilizaron 17 pacientes con TS aguda (16%), 23 con TS subaguda (22%), 13 con TS tardía (12%) y 52 con TS muy tardía (50%). Las características basales de los pacientes en función del tiempo de presentación de la TS (agudas/subagudas frente a tardías/muy tardías) se recogen en la tabla 1. La presentación más habitual fue el infarto de miocardio con elevación del segmento ST (81,9%), y la arteria afectada con más frecuencia fue la descendente anterior (42%). La mayor parte de los dispositivos trombosados eran stents farmacoactivos de nueva generación (53,3%), seguidos de stents convencionales (28,6%), farmacoactivos de primera generación (13,3%) y bioabsorbibles (4,8%), con una proporción significativamente mayor de stents convencionales en el grupo de TS tardía/muy tardía, y de farmacoactivos de nueva generación y bioabsorbibles en el grupo de TS aguda/subaguda. En cuanto al tratamiento de la TS, el uso de stents farmacoactivos y balón liberador de fármaco fue significativamente más frecuente en las TS tardías/muy tardías, y el tratamiento con anti-IIb/IIIa y optimización con balón fue más frecuente en las TS agudas/subagudas.
Tabla 1. Características basales de la población de estudio, angiográficas y del procedimiento
| Variables | Global n = 105 (%) | TS aguda/ subaguda n = 40 (%) | TS tardía/ muy tardía n = 65 (%) | p |
|---|---|---|---|---|
| Edad, años | 65,8 ± 11,8 | 49 | 82 | – |
| Varones | 89 (84,8) | 30 (76,9) | 59 (89,4) | 0,150 |
| Factores de riesgo | ||||
| Tabaquismo | 47 (44,8) | 16 (41) | 31 (47) | 0,697 |
| Hipertensión arterial | 68 (64,8) | 25 (64,1) | 43 (65,1) | 1 |
| Dislipemia | 69 (65,7) | 19 (48,7) | 50 (75,7) | 0,009 |
| Diabetes mellitus | 28 (26,7) | 10 (25,6) | 18 (27,8) | 1 |
| Tratamiento previo | < 0,001 | |||
| Doble antiagregación | 45 (40,9) | 32 (80) | 13 (20) | – |
| Antiagregación única | 53 (50,5) | 7 (18) | 46 (69,7) | – |
| Ninguno | 5 (3,8) | 0 | 5 (7,6) | – |
| Presentación | < 0,001 | |||
| IAMCEST | 83 (81,9) | 34 (85) | 49 (75,3) | – |
| Killip-Kimball IV | 14 (13,3) | 5 (12,8) | 9 (13,6) | – |
| Stents analizados | 105 | 40 | 65 | < 0,001 |
| Convencionales | 30 (28,6) | 6 (15,4) | 24 (36,4) | – |
| SFA 1.ª generación | 14 (13,3) | 1 (2,6) | 13 (19,7) | – |
| SFA nueva generación | 56 (53,3) | 29 (72,5) | 27 (41,5) | – |
| Bioabsorbibles | 5 (4,8) | 4 (10,3) | 1 (1,5) | – |
| Tipo de tratamiento | < 0,001 | |||
| Conservador | 6 (5,7) | 2 (5,3) | 2 (3,1) | – |
| Balón convencional (SD/ND) | 24 (22,9) | 13 (34,2) | 11 (16,9) | – |
| Balón liberador de fármaco | 4 (3,8) | 0 | 4 (6,1) | – |
| SFA | 52 (49,5) | 12 (30) | 40 (61,5) | – |
| Stent bioabsorbible | 3 (2,9) | 0 | 3 (4,6) | – |
| Balón ND + anti-IIB-IIIa | 12 (11,4) | 10 (26,3) | 2 (3,1) | – |
|
IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ND: no distensible; SD: semidistensible; SFA: stent farmacoactivo; TS: trombosis del stent. |
||||
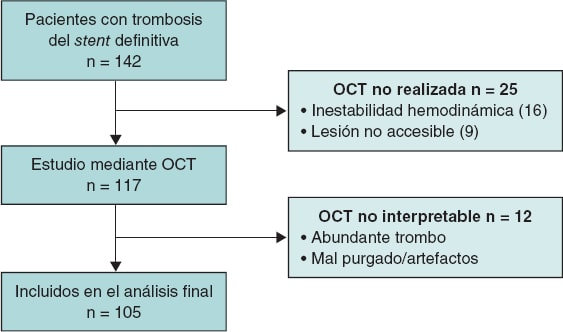
Figura 1. Diagrama de flujo de la inclusión de pacientes en el estudio. OCT: tomografía de coherencia óptica.
Análisis por OCT
No se registraron complicaciones derivadas de la técnica de OCT. Los datos morfométricos y de la interacción del stent con la pared del vaso obtenidos se resumen en la tabla 2. Se estudiaron en total 24.834 cortes, de los cuales 1.453 (5,8%) no se analizaron por abundante cantidad de trombo residual.
Tabla 2. Análisis morfométrico e interacción del stent con la pared del vaso en función del tipo de trombosis
| Variables | TS aguda (n = 17) | TS subaguda (n = 23) | TS tardía (n = 13) | TS muy tardía (n = 52) | p |
|---|---|---|---|---|---|
| Trombo | |||||
| Fr con trombo por stent, % | 68,8 ± 24 | 61,7 ± 21 | 37,1 ± 27,9 | 42,6 ± 24,3 | < 0,001 |
| Área máxima trombo, mm2 | 4,38 ± 1,72 | 3,12 ± 1,82 | 2,5 ± 1,6 | 2 ± 1,4 | < 0,001 |
| Longitud máxima, mm | 22,9 ± 30 | 15,35 ± 19 | 8,4 ± 5,8 | 7,9 ± 4,7 | < 0,001 |
| Mala aposición | |||||
| Fr con mala aposición por stent, % | 13,3 ± 14 | 9,3 ± 9 | 11,4 ± 11,5 | 2,3 ± 5,9 | < 0,001 |
| Área máxima, mm2 | 0,48 ± 0,54 | 0,61 ± 0,7 | 1,29 ± 1,5 | 0,42 ± 1,21 | < 0,001 |
| Longitud máxima struts, mm | 3,11 ± 3,99 | 1,92 ± 2,12 | 2,26 ± 2,3 | 0,6 ± 1,31 | < 0,001 |
| Stents con algún Fr con mala aposición, % | 13 (76,5) | 17 (73,9) | 10 (76,9) | 10 (19,2) | < 0,001 |
| Recubrimiento | |||||
| Fr no recubiertos por stent, % | 88,2 ± 27,5 | 77,9 ± 30,6 | 21,3 ± 28,5 | 3,37 ± 11,42 | < 0,001 |
| Longitud máxima struts no recubiertos, mm | 19,3 ± 11,6 | 16,1 ± 8,5 | 5,1 ± 8,6 | 1,6 ± 5,3 | < 0,001 |
| Stents con algún Fr no cubierto (%) | 17 (100) | 22 (95,6) | 10 (76,9) | 15 (28,8) | < 0,001 |
| Neoateroesclerosis | |||||
| Fr con neoateroesclerosis por stent, n | 0 | 0 | 3,1 ± 2,9 | 41,1 ± 47,8 | < 0,001 |
| Stents con algún Fr con neoateroesclerosis, n | 0 | 0 | 3 (23) | (78) | < 0,001 |
| Expansión | |||||
| Área referencia media, mm2 | 7,74 ± 2,15 | 5,76 ± 2,41 | 7,46 ± 2,29 | 6,19 ± 2,09 | 0,012 |
| Área mínima stent | 6,98 ± 2,06 | 4,35 ± 1,53 | 6,09 + 2,03 | 5,6 ± 1,89 | < 0,001 |
| Índice expansión, % | 91,78 ± 21 | 86,9 ± 42,6 | 84 + 19,9 | 95,21 ± 32,4 | 0,48 |
| Índice expansión < 80% | 6 (35,3) | 12 (52,1) | 5 (38,5) | 17 (33,3) | 0,1 |
|
Fr: frames; TS: trombosis del stent. |
|||||
No se encontraron diferencias en las tasas de infraexpansión según el tipo de trombosis, y únicamente se registró un área del stent mínima < 4,5 mm2 en las TS subagudas. El número de struts no recubiertos disminuyó de manera significativa a lo largo del tiempo (aunque el 30% de los stents presentaban algún strut no recubierto después de 1 año), al igual que la carga trombótica y la mala aposición (figura 2). Se estudiaron estos hallazgos en función del tipo de stent (tabla 3) y se encontró que el número de stents con struts no recubiertos o mal apuestos fue mayor en los stent farmacoactivos que en los convencionales.
Tabla 3. Análisis morfométrico en función del tipo de stent
| Variables | Convencional (n = 30) | SFA 1.ª generación (n = 14) | SFA nueva generación (n = 56) | Bioabsorbible (n = 5) | p |
|---|---|---|---|---|---|
| N.º Fr no recubiertos por stent | 29,4 ± 64 | 27,8 ± 87 | 130,6 ± 128,6 | 121,8 ± 89,4 | < 0,001 |
| Stents con algún strut no recubierto (%) | 10 (33) | 6 (42) | 42 (75) | 5 (100) | < 0,001 |
| N.º Fr con trombo por stent | 82,3 ± 44 | 100,9 ± 51 | 134,4 ± 83,2 | 73,4 ± 59,7 | 0,022 |
| Stents con algún strut con mala aposición (%) | 6 (20) | 5 (35,7) | 36 (64,3) | 3 (60) | < 0,001 |
| Stents con expansión < 80% | 20,7% | 50% | 44,6% | 40% | 0,104 |
| Stents con neoateroesclerosis (%) | 17 (56,7) | 7 (50) | 16 (28,6) | 0 | 0,013 |
|
Fr: frames; SFA: stent farmacoactivo. |
|||||
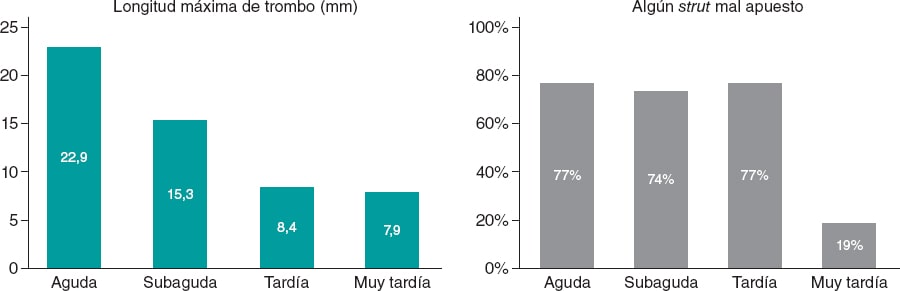
Figura 2. Hallazgos morfométricos a lo largo del tiempo.
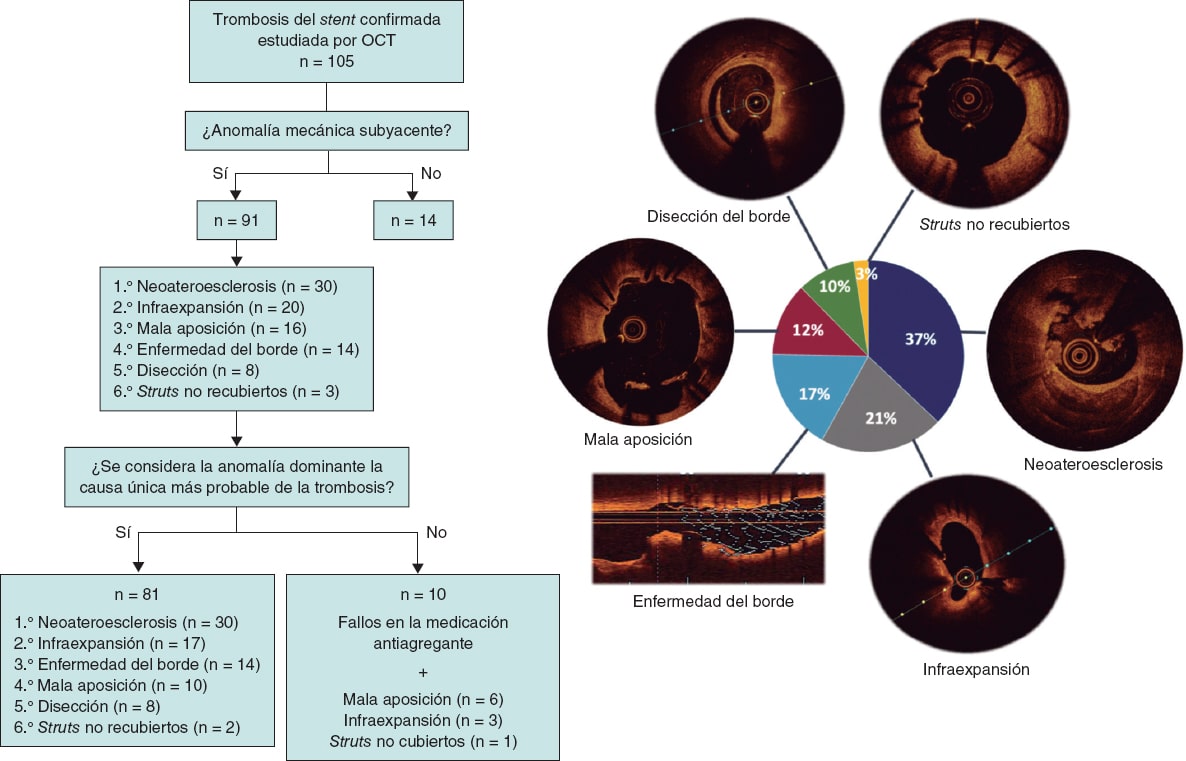
Figura 3. Figura central. Adjudicación del hallazgo dominante y causa más probable de la trombosis del stent. OCT: tomografía de coherencia óptica.
Objetivo primario
Se halló alguna anomalía mecánica subyacente en 91 de los 105 pacientes analizados (86,7%). De ellos, 10 tuvieron además algún fallo en el cumplimiento de la medicación antiagregante los días previos a la TS, por lo que finalmente se consideró que la anomalía mecánica encontrada fue la causa única más probable de la TS en 81 pacientes (77,1%). La distribución global de los hallazgos dominantes se muestra en la figura 3, y los hallazgos representativos de algunos de los casos de TS se recogen en la figura 4.
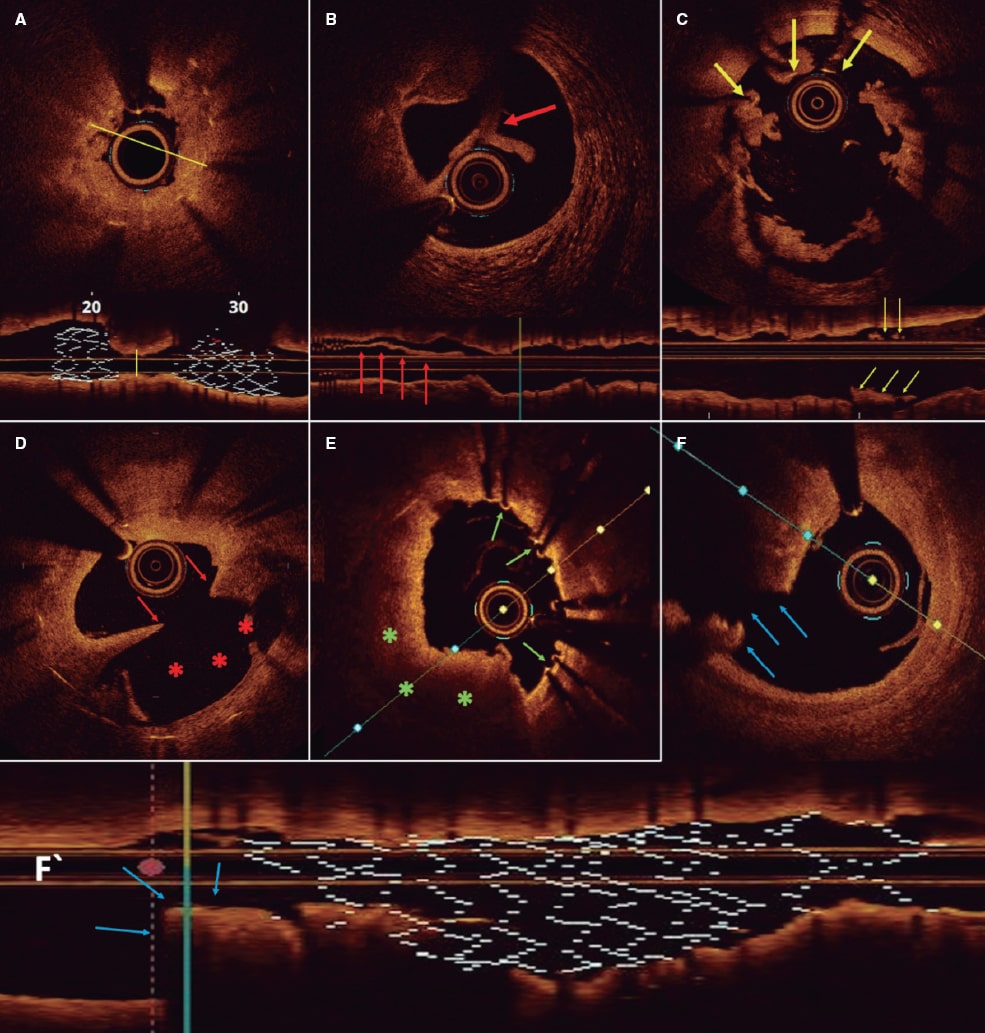
Figura 4. Imágenes representativas de los hallazgos dominantes por tomografía de coherencia óptica. A: corte longitudinal y seccional de un stent con infraexpansión marcada (la línea indica el diámetro mínimo). B: disección del borde del stent. La flecha indica el borde de tejido separado del resto de la pared. C: mala aposición. Las flechas señalan struts, asociados a trombo, que no están en contacto con la pared del vaso. D: neoateroesclerosis con placa rota. Las flechas indican la solución de continuidad de la íntima, y los asteriscos la cavidad en la placa vaciada de su contenido. E: struts no recubiertos (flechas). F y F‘: cortes seccional y longitudinal de stent con enfermedad del borde distal con placa rota (flechas).
El hallazgo dominante varió significativamente (p < 0,001) en función del tiempo de la TS (tabla 4). En las TS agudas, lo más frecuente fue no detectar ninguna anomalía mecánica (41,2%) y el hallazgo dominante fue la disección del borde del stent (23,5%); en las subagudas, la infraexpansión (47,8%); en las tardías, la mala aposición; y en las muy tardías, la neoateroesclerosis (52%). Sin embargo, no se encontraron diferencias significativas (p = 0,07) en función del tipo de stent: en los convencionales y en los farmacoactivos de primera generación, lo más frecuente fue encontrar neoateroesclerosis (46,7% y 35,7%, respectivamente), y en los farmacoactivos de nueva generación lo más habitual fue la infraexpansión (26,8%). En las TS muy tardías, la neoateroesclerosis fue el hallazgo más frecuente tanto en los stents convencionales como en los farmacoactivos (56,7 frente a 50%; p = 0,45), y tanto en las TS que ocurrían en los primeros 5 años tras el implante del stent como en las que aparecían después. Se registraron 5 trombosis de dispositivos bioabsorbibles, cuyos hallazgos específicos han sido detallados previamente10.
Tabla 4. Hallazgos dominantes en función del tiempo de presentación de la trombosis y del tipo de stent
| Hallazgo dominante | TS aguda (n = 17) | TS subaguda (n = 23) | TS tardía (n = 13) | TS muy tardía (n = 52) |
|---|---|---|---|---|
| Disección del borde | 4 (23,5) | 4 (17,4) | 0 | 0 |
| Infraexpansión | 2 (11,8) | 11 (47,8) | 1 (7,7) | 6 (11,5) |
| Mala aposición | 3 (17,6) | 3 (13) | 4 (30,8) | 6 (11,5) |
| Neoateroesclerosis | 0 | 0 | 3 (23,1) | 27 (52) |
| No hallazgo | 7 (41,8) | 3 (13) | 1 (7,7) | 3 (5,7) |
| Enfermedad del borde | 1 (5,9) | 2 (8,7) | 2 (15,4) | 9 (17,3) |
| Struts no recubiertos | 0 | 0 | 2 (15,4) | 1 (2) |
| Hallazgo dominante | Convencional (n = 30) | SFA 1.ª generación (n = 14) | SFA nueva generación (n = 56) | Bioabsorbible (n = 5) |
| Disección del borde | 2 (6,7) | 0 | 5 (8,9) | 1 (20) |
| Infraexpansión | 2 (6,7) | 2 (14,2) | 15 (26,8) | 1 (20) |
| Mala aposición | 5 (16,7) | 3 (21,4) | 8 (14,3) | 0 |
| Neoateroesclerosis | 14 (46,7) | 5 (35,7) | 11 (19,6) | 0 |
| No hallazgo | 1 (3,3) | 2 (14,3) | 9 (16,1) | 2 (40) |
| Enfermedad del borde | 6 (20) | 1 (7,1) | 6 (10,7) | 1 (20) |
| Struts no recubiertos | 0 | 1 (7,1) | 2 (3,6) | 0 |
|
SFA: stent farmacoactivo; TS: trombosis del stent. |
||||
Neoateroesclerosis y rotura de placa
Se detectó neoateroesclerosis en 40 pacientes, independientemente de que se considerase el hallazgo dominante. No hubo diferencias en las características de los pacientes con y sin neoateroesclerosis, aunque aquellos con neoateroesclerosis tenían mayor área mínima del stent, menor área luminal mínima y menor cantidad de struts no cubiertos y mal apuestos (tabla 1 del material adicional). El área luminal mínima fue el único factor asociado a un mayor riesgo de desarrollo de neoateroesclerosis (odds ratio [OR] = 0,39; intervalo de confianza del 95% [IC95%], 0,16-0,75; p = 0,013).
Se observó rotura de placa en 16 de los pacientes con neoateroesclerosis. No hubo diferencias en sus características basales ni en la composición de la neoateroesclerosis entre los pacientes con y sin rotura de placa (tabla 2 del material adicional). A pesar del escaso tamaño muestral, se encontró que el área luminal mínima fue un factor protector frente a la rotura de placa (OR = 0,22; IC95%, 0,04-0,7; p = 0,035). La presencia de neovasos o de calcio en el interior del stent no se asoció con la rotura de placa, y tampoco se encontró asociación con el tipo de stent.
Seguimiento clínico
La mortalidad intrahospitalaria de toda la cohorte fue del 9,2%, sin diferencias entre los pacientes con y sin realización de OCT (8,5 frente a 11%; p = 0,7). Los principales predictores de mortalidad fueron la presencia de insuficiencia renal crónica (OR = 9,56; IC95%, 2,28-41,14; p = 0,002) y la situación Killip-Kimbal III/IV (OR = 14,8; IC95%, 3,38-79,6; p = 0,001).
En cuanto al evento combinado, se registraron 28 casos durante el seguimiento (mediana de 2.143 días [15-2.906]). La probabilidad de supervivencia libre de evento a 1 y 5 años fue del 83,3% y el 73,1%, respectivamente. Durante el seguimiento se registraron 13 fallecimientos. La probabilidad calculada de supervivencia al año fue del 96% y a los 5 años fue del 86,7% (figura 1 del material adicional).
DISCUSIÓN
La TS continúa siendo una complicación grave y con elevada mortalidad11. Comprender su fisiopatología es fundamental para mejorar su prevención, diagnóstico y tratamiento12. En este contexto, el uso de la OCT aporta información crucial en tiempo real, permitiendo un diagnóstico mucho más preciso y un tratamiento personalizado.
Este estudio constituye la serie nacional más extensa de TS estudiadas mediante OCT. Los principales hallazgos son: 1) el uso de OCT en el momento agudo de la TS es factible y seguro en centros con experiencia; 2) la OCT es capaz de identificar anomalías mecánicas en el 86,7% de los casos de TS; 3) el hallazgo dominante varía según el tiempo de la TS (en las agudas, lo más frecuente es no encontrar anomalías mecánicas, mientras que en las subagudas predomina la infraexpansión, en las tardías la mala aposición, y en las muy tardías la neoateroesclerosis); 4) la OCT permite guiar el tratamiento en función del hallazgo dominante y puede reducir el implante de nuevos stents; y 5) la mortalidad intrahospitalaria es baja (9,2%), siendo la situación Killip-Kimbal IV y la insuficiencia renal sus principales predictores.
Se consiguió un estudio de OCT de adecuada calidad en el 74% de los pacientes, tasa muy superior a la de los principales registros europeos9,13. Aunque la presencia de trombo puede limitar la visibilidad, con tromboaspiración o uso de extensores de catéter es posible mejorar la calidad de la imagen. A diferencia de otros estudios en los que se realizó la OCT en un procedimiento diferido al diagnóstico de TS, en nuestro estudio se hizo durante el evento agudo, lo que constituye una fortaleza metodológica significativa.
La OCT demostró una notable capacidad para detectar anomalías mecánicas (86,7%). En este contexto, la información que aporta la angiografía resulta insuficiente. En el estudio PESTO13, la angiografía identificó la causa de la TS en el 12% de los casos, mientras que por OCT se identificó en más del 90%. El estudio CLI-OPCI14 concluyó, por primera vez, que la OCT aporta información sobre el resultado inmediato del stent que no es perceptible por angiografía, motivando la realización de intervenciones adicionales hasta en un tercio de los pacientes.
Aunque algunos hallazgos coinciden con los del estudio PRESTIGE9, nuestro análisis aporta matices relevantes. En particular, en las TS agudas, la mayoría de los casos no presentaban anomalías mecánicas evidentes (a diferencia de nuestros resultados preliminares, en los que predominaba la mala aposición), lo que refuerza el papel predominante del tratamiento antitrombótico y del estado protrombótico como factores clave, hecho respaldado también por la mayor cantidad de trombo encontrada en las TS precoces con respecto a las tardías. Este hallazgo, mucho menos destacado en estudios previos, subraya la utilidad de la OCT no solo para identificar causas mecánicas, sino también para descartar intervenciones innecesarias, y resalta la importancia del tratamiento farmacológico. Por otra parte, nuestro estudio no incluyó la no cobertura del strut como causa de TS agudas/subagudas, asumiendo que ningún stent está recubierto de neoíntima en los primeros 30 días.
La asociación entre mala aposición aguda y TS es controvertida15-17. Una posible explicación es que, aunque la mala aposición es casi omnipresente tras el implante de un stent18,19, su asociación con trombosis es difícil de establecer debido a la baja probabilidad de que esta ocurra posteriormente.
La infraexpansión sí está establecida como uno de los predictores más importantes de TS. En el estudio CLI-OPCI20 se determinó un área luminal mínima > 4,5 mm2 para discriminar eventos durante el seguimiento. Este punto de corte no es alcanzable en vasos pequeños y no aplica en lesiones de tronco izquierdo. Por ello, quizás sería más adecuado utilizar la expansión relativa6,21, aunque aún no ha demostrado ser superior a la expansión absoluta para la predicción de eventos.
En las TS tardías, el hallazgo más frecuente fue la mala aposición. La mayoría de los casos de struts con mala aposición aguda no grave se resuelven durante el seguimiento, aunque hasta un 30% pueden persistir18. En un estudio22 se encontraron tasas mucho menores de mala aposición (8%) que en los grandes registros previos9,13, probablemente porque el implante índice se había realizado guiado por imagen, lo que además permite aseverar que se trataba de mala aposición adquirida en el 75% de los casos.
Se detectó neoateroesclerosis en la mayor parte de las TS tardías y muy tardías, independientemente del tipo de stent, a diferencia de otros estudios en los que predominaban en los stents farmacoactivos. Esto puede deberse a que el tiempo entre el implante del stent y la trombosis fue mayor en los stents convencionales, lo que concuerda con que el predictor más importante para el desarrollo de neoateroesclerosis es la duración del seguimiento23. El uso de OCT evitó el tratamiento innecesario con nuevos stents en el 48% de los pacientes, una tasa mayor que en otras series de TS sin tratamiento guiado por imagen24 e incluso mayor que la del registro PRESTIGE9.
Limitaciones
Este trabajo presenta varias limitaciones: 1) la ausencia de grupo control impide evaluar predictivamente ciertos hallazgos como la mala aposición, y tampoco se puede confirmar de manera definitiva la superioridad del uso de OCT en estas intervenciones con respecto a una estrategia sin la ayuda de imagen intracoronaria; 2) no se utilizó un laboratorio centralizado para el análisis de OCT, lo que puede limitar la reproducibilidad externa; 3) existe un sesgo de selección al haber excluido a los pacientes más graves y con anatomías complejas, lo que explicaría los resultados clínicos favorables y podría alterar la prevalencia de algunos mecanismos; 4) la TS es un proceso multifactorial, por lo que no se puede concluir que el hallazgo dominante sea la causa definitiva; 5) la presencia de trombo dificulta el análisis de las estructuras subyacentes; 6) el implante índice del stent no se realizó guiado por imagen, por lo que no es posible saber si la mala aposición es aguda o adquirida; y 7) en muchos pacientes no se realizaron estudios seriados de OCT durante la intervención, por lo que no se ha podido analizar el grado de corrección de la anomalía detectada.
CONCLUSIONES
La OCT es una herramienta segura, factible y de gran utilidad para el tratamiento de la TS. Permite identificar la causa más probable del evento en la mayoría de los casos, que cambia en función del tiempo de presentación de la trombosis, y realizar un tratamiento personalizado corrigiendo la causa subyacente.
FINANCIACIÓN
Los autores declaran que no han recibido financiación específica para la realización de este trabajo.
CONSIDERACIONES ÉTICAS
Este estudio ha sido aprobado por el comité de ética del Hospital de La Princesa. Todos los procedimientos realizados estuvieron de acuerdo con los principios éticos de la Declaración de Helsinki. Este estudio ha seguido las directrices SAGER. Se obtuvieron por escrito, y están archivados, los consentimientos informados necesarios para la publicación.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado ninguna herramienta de inteligencia artificial en la elaboración del texto.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido de manera equitativa en la concepción, el diseño y el análisis del estudio, y en la redacción y la revisión del artículo. Todos aprueban la versión final y se hacen responsables de su contenido.
CONFLICTO DE INTERESES
F. Alfonso es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del artículo. El resto de los autores no tienen conflictos de intereses en relación con este trabajo.
¿QUÉ SE SABE DEL TEMA?
- La TS es una complicación infrecuente, pero de gran relevancia, caracterizada por una elevada mortalidad, una notable tasa de recurrencias y una fisiopatología compleja y multifactorial. Comprender en profundidad los mecanismos fisiopatológicos subyacentes es fundamental para seleccionar estrategias preventivas y terapéuticas adecuadas.
¿QUÉ APORTA DE NUEVO?
- El estudio representa la serie nacional más amplia de casos consecutivos de TS evaluados mediante OCT, y evidencia la capacidad de esta técnica para detectar alteraciones mecánicas subyacentes potencialmente involucradas en la patogénesis de esta grave complicación.
- Las anomalías mecánicas observadas en la TS varían de manera significativa en función del tiempo de presentación.
- Mejorar la técnica de implante del stent podría reducir la incidencia de TS, ya que sería posible corregir algunas causas como la mala aposición y la infraexpansión.
- El uso de OCT durante el tratamiento de la TS permite guiar y optimizar los resultados del procedimiento.
BIBLIOGRAFÍA
1. Kastrati A, Mehilli J, Pache J, et al. Analysis of 14 Trials Comparing Sirolimus-Eluting Stents with Bare-Metal Stents. N Engl J Med. 2007;356:1030-1039.
2. Alfonso F. The “Vulnerable“Stent. Why So Dreadful?J Am Coll Cardiol. 2008;51:2403-2406.
3. Park KW, Hwang SJ, Kwon DA, et al. Characteristics and predictors of drug-eluting stent thrombosis:Results from the multicenter Korea stent thrombosis (KoST) registry. Circ J. 2011;75:1626-1632.
4. Cuesta J, Rivero F, Bastante T, et al. Optical Coherence Tomography Findings in Patients With Stent Thrombosis. Rev Esp Cardiol. 2017;70:1050-1058.
5. Prati F, Kodama T, Romagnoli E, et al. Suboptimal stent deployment is associated with subacute stent thrombosis:Optical coherence tomography insights from a multicenter matched study. From the CLI Foundation investigators:The CLI-THRO study. Am Heart J. 2015;169:249-256.
6. Räber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1:Guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39:3281-3300.
7. Alfonso F, Fernandez-Viña F, Medina M, Hernandez R. Neoatherosclerosis:The Missing Link Between Very Late Stent Thrombosis and Very Late In-Stent Restenosis. J Am Coll Cardiol. 2013;61:155.
8. Joner M, Koppara T, Byrne RA, et al. Neoatherosclerosis in Patients With Coronary Stent Thrombosis:Findings From Optical Coherence Tomography Imaging (A Report of the PRESTIGE Consortium). JACC Cardiovasc Interv. 2018;11:1340-1350.
9. Adriaenssens T, Joner M, Godschalk TC, et al. Optical Coherence Tomography Findings in Patients With Coronary Stent Thrombosis:A Report of the PRESTIGE Consortium (Prevention of Late Stent Thrombosis by an Interdisciplinary Global European Effort). Circulation. 2017;136:1007-1021.
10. Cuesta J, García-Guimaraes M, Basante T, Rivero F, Antuña P, Alfonso F. Bioresorbable Vascular Scaffold Thrombosis:Clinical and Optical Coherence Tomography Findings. Rev Esp Cardiol. 2019;72:90-91.
11. la Torre-Hernández JM, Alfonso F, Hernández F, et al. Drug-Eluting Stent Thrombosis. J Am Coll Cardiol. 2008;51:986-990.
12. Alfonso F, Dutary J, Paulo M, et al. Combined use of optical coherence tomography and intravascular ultrasound imaging in patients undergoing coronary interventions for stent thrombosis. Heart. 2012;98:1213-1220.
13. Souteyrand G, Amabile N, Mangin L, et al. Mechanisms of stent thrombosis analysed by optical coherence tomography:insights from the national PESTO French registry. Eur Heart J. 2016;37:1208-1216.
14. Prati F, Di Vito L, Biondi-Zoccai G, et al. Angiography alone versus angiography plus optical coherence tomography to guide decision-making during percutaneous coronary intervention:the Centro per la Lotta contro l'Infarto-Optimisation of Percutaneous Coronary Intervention (CLI-OPCI) study. EuroIntervention. 2012;8:823-829.
15. Ng JCK, Lian SS, Zhong L, Collet C, Foin N, Ang HY. Stent malapposition generates stent thrombosis:Insights from a thrombosis model. Int J Cardiol. 2022;353:43-45.
16. Prati F, Romagnoli E, La Manna A, et al. Long-term consequences of optical coherence tomography findings during percutaneous coronary intervention:the Centro Per La Lotta Contro L'infarto –Optimization Of Percutaneous Coronary Intervention (CLI-OPCI) LATE study. EuroIntervention. 2018;14:443-451.
17. Romagnoli E, Gatto L, La Manna A, et al. Role of residual acute stent malapposition in percutaneous coronary interventions. Catheter Cardiovasc Interv. 2017;90:566-575.
18. Shimamura K, Kubo T, Akasaka T, et al. Outcomes of everolimus-eluting stent incomplete stent apposition:a serial optical coherence tomography analysis. Eur Heart J Cardiovasc Imaging. 2015;16:23-28.
19. Ali ZA, Maehara A, Généreux P, et al. Optical coherence tomography compared with intravascular ultrasound and with angiography to guide coronary stent implantation (ILUMIEN III:OPTIMIZE PCI):a randomised controlled trial. Lancet. 2016;388:2618-2628.
20. Prati F, Romagnoli E, Burzotta F, et al. Clinical Impact of OCT Findings During PCI:The CLI-OPCI II Study. JACC Cardiovasc Imaging. 2015;8:1297-1305.
21. Ali ZA, Landmesser U, Maehara A, et al. Optical Coherence Tomography–Guided versus Angiography-Guided PCI. N Engl J Med. 2023;389:1466-1476.
22. Mori H, Sekimoto T, Arai T, et al. Mechanisms of Very Late Stent Thrombosis in Japanese Patients as Assessed by Optical Coherence Tomography. Can J Cardiol. 2024;40:696-704.
23. Otsuka F, Byrne RA, Yahagi K, et al. Neoatherosclerosis:Overview of histopathologic findings and implications for intravascular imaging assessment. Eur Heart J. 2015;36:2147-2159.
24. Armstrong EJ, Feldman DN, Wang TY, et al. Clinical Presentation, Management, and Outcomes of Angiographically Documented Early, Late, and Very Late Stent Thrombosis. JACC Cardiovasc Interv. 2012;5:131-140.

