RESUMEN
El acceso vascular es una parte esencial de cualquier procedimiento intervencionista coronario o estructural. En procedimientos coronarios, el acceso femoral tradicional prácticamente ha sido sustituido por el radial desde hace 15-20 años. No obstante, el acceso femoral, tanto arterial como venoso, sigue siendo la principal vía de abordaje para el intervencionismo estructural. El acceso femoral ha ido evolucionando con el paso del tiempo de una punción mediante referencias anatómicas a una punción mucho más precisa guiada por ecografía. La llegada de técnicas como el recambio valvular aórtico percutáneo ha condicionado el uso de introductores arteriales de gran tamaño y, por tanto, la necesidad de sistemas de control de la hemostasia, principalmente los sistemas percutáneos de cierre vascular. Este artículo revisa diversos conceptos anatómicos, técnicas de punción, evaluación diagnóstica y estrategias de cierre de las principales vías de acceso arterial y venoso utilizadas en el diagnóstico y el tratamiento de diferentes patologías estructurales.
Palabras clave: TAVI. Vascular. Accesos. Estructural.
ABSTRACT
Vascular access is an essential part of all interventional procedures whether coronary or structural. Over the last 15 to 20 years, in coronary interventions, traditional femoral access has been mostly replaced by the radial approach. Nonetheless, the femoral approach through both artery and vein is still the main approach for structural heart procedures. Over the last few years, femoral access has evolved from a puncture guided by anatomical references to more accurate ultrasound-guided approaches. The relatively recent introduction of interventions such as transcatheter aortic valve replacement has conditioned the use of large introducers and ultimately the need for specific hemostatic systems, above all, percutaneous closure devices. This manuscript reviews different anatomical concepts, puncture techniques, diagnostic assessments, and closure strategies of the main arterial and venous approaches for the diagnosis and treatment of different structural heart procedures.
Keywords: TAVI. Vascular. Accesses. Structural.
Abreviaturas AFC: arteria femoral común. DAP: ductus arterioso persistente. TAVI: implante percutáneo de válvula aórtica.
ACCESOS ARTERIALES
Técnica de punción arterial
El acceso vascular es una parte esencial de cualquier procedimiento intervencionista coronario o estructural. Para procedimientos coronarios, el acceso femoral tradicional prácticamente ha sido sustituido por el radial desde hace 15-20 años. No obstante, el acceso femoral sigue siendo el principal para intervencionismo estructural. También se utilizan en menor medida otros accesos, como el braquial, el cubital, el axilar y el carotídeo. El conocimiento de la anatomía y de la técnica de punción es fundamental. Esto es especialmente relevante en accesos distintos del radial/cubital, en los que la tasa de complicaciones es mayor, sobre todo si se emplean catéteres y dispositivos de gran tamaño.
Acceso femoral arterial
La arteria femoral común (AFC) es el lugar ideal de punción, por su mayor tamaño y por estar sobre la cabeza femoral, lo que favorece su palpación y un plano de compresión. La AFC está en la vaina femoral lateral, mientras que la vena femoral común está en la vaina medial y el nervio femoral por fuera de la vaina, lateral a la arteria. Distalmente, se divide en las arterias femorales superficial y profunda. Una punción alta, por encima del ligamento inguinal, dificulta la compresión arterial y favorece la posibilidad de sangrado retroperitoneal. Una punción baja, en la arteria femoral superficial o profunda, aumenta las posibilidades de seudoaneurisma, hematoma o isquemia, así como de fístula arteriovenosa, porque a ese nivel la vena con frecuencia está superpuesta a la arteria y se puede atravesar inadvertidamente.
Hay 3 forma básicas de canalizar la AFC:
1) Basada en referencias cutáneas
Era la forma más utilizada en el pasado. Típicamente se palpa en busca del latido arterial 2-3 cm por debajo del pliegue cutáneo inguinal. Se administra anestesia local y luego se utiliza una aguja con la técnica modificada de Seldinger, puncionando únicamente la pared anterior para evitar el sangrado en la zona posterior de la arteria. Una vez obtenido flujo pulsátil, se introduce una guía hasta la aorta abdominal bajo visualización fluoroscópica. De manera alternativa puede usarse un equipo de micropunción para practicar un orificio más pequeño, casi un 60% menor, con la potencial reducción de complicaciones. Se utilizan una guía de 0,018 pulgadas y un introductor de 4 Fr, mediante el cual se puede introducir ya la guía de 0,035 pulgadas. La punción basada en referencias cutáneas no es óptima si se busca una gran precisión.
2) Basada en referencias radiográficas
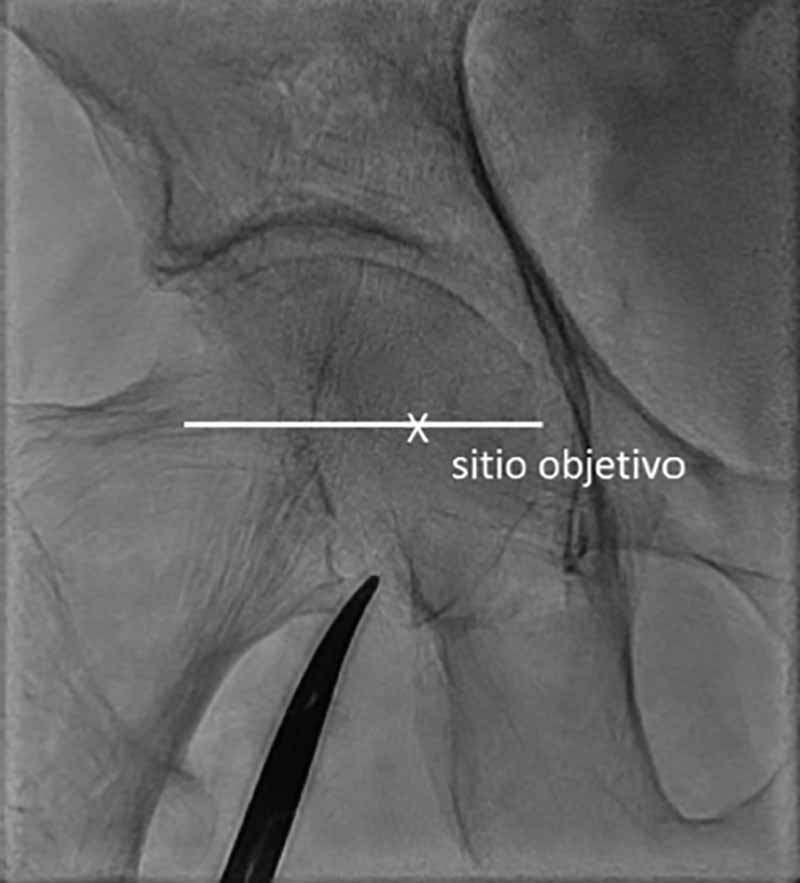
La cabeza femoral se visualiza por fluoroscopia y se coloca un marcador radiopaco en su borde inferior como referencia de altura. Si se punciona con la aguja inclinada 30-45°, este es el sitio donde introducir la aguja para intentar pinchar la arteria en la mitad de la cabeza femoral (figura 1). Si se punciona algo más vertical, se debe entrar en la piel un poco más cranealmente. El ligamento inguinal suele estar a unos 15 mm por encima de la mitad de la cabeza femoral y la bifurcación arterial femoral se encuentra en la mayoría de los pacientes distal a la parte inferior de la cabeza femoral, de ahí que la mitad de la cabeza femoral sea la zona objetivo. Cuando se necesitan introductores de gran calibre, como en el implante percutáneo de válvula aórtica (TAVI), se lleva a cabo una variación de esta técnica y se inyecta contraste mediante un catéter avanzado por otro acceso arterial hasta la AFC para localizarla con certeza.
Figura 1. Referencias radiológicas de la punción sobre la arteria femoral.
3) Guiada por ultrasonidos
La mayoría de los intervencionistas formados en los últimos 15 años han tenido una limitada experiencia con la vía femoral por el auge del acceso radial. Así, sería razonable que el aprendizaje de la vía femoral se basara en el uso de ultrasonidos. Se utiliza una sonda lineal vascular de 8-12 MHz introducida en una bolsa estéril. El eco bidimensional permite visualizar directamente la AFC, su bifurcación y la cabeza femoral. Se debe evaluar la AFC en el eje largo desde su bifurcación hasta que entra posteriormente en la pelvis, midiendo su calibre y valorando la presencia de placas de ateroma. Se debe evaluar también la arteria en el eje corto o transversal, que da una imagen típica de «cabeza de Mickey» en la bifurcación arterial con la vena medial y la femoral superficial sobre la profunda, y toda la sección de corte de la AFC para evaluar cuál es su sección más sana, desplazando el transductor cranealmente (vídeo 1 del material adicional). La vena se diferencia de la arteria porque es mucho más fácilmente compresible y por la dirección y la velocidad del flujo con Doppler color. La evaluación con ultrasonidos permite seleccionar la zona de la arteria con menos calcio en la pared anterior. La infiltración con un anestésico local en ese punto y la punción se realizan bajo control ecográfico, que muestra la entrada de la aguja en la parte central de la arteria para facilitar el buen funcionamiento de los sistemas de cierre. Tras introducir la guía de 0,035 pulgadas, se comprueba con ultrasonidos que el sitio de punción es el adecuado, ya que la guía es muy ecogénica y fácilmente visible. Este abordaje no requiere el uso de contraste ni de rayos X durante la punción. En el estudio FAUST1, un ensayo prospectivo y multicéntrico que asignó aleatoriamente a 1.004 pacientes para TAVI por acceso femoral guiado por fluoroscopia o por ecografía, la punción ecoguiada se asoció a una mayor tasa de éxito en el primer intento (83 frente a 46%; p < 0,01), una reducción del número de intentos (1,3 frente a 3,0; p < 0,01), una reducción del riesgo de venopunción (2,4 frente a 15,8; p < 0,01), una disminución del tiempo medio de acceso (136 frente a 148 segundos; p < 0,01) y una menor frecuencia de complicaciones derivadas del acceso (1,4 frente a 3,6%; p = 0,04).
Las complicaciones básicas de la punción arterial en procedimientos estructurales (TAVI) se resumen en la tabla 1. La edad avanzada, el sexo femenino, el bajo peso o la obesidad, la enfermedad vascular periférica, la insuficiencia renal, la diátesis hemorrágica, la anticoagulación basal y un mayor tamaño del introductor se asocian al desarrollo de complicaciones2. En el pasado, los porcentajes de complicaciones vasculares eran elevados, pero en los últimos años se han reducido de manera muy importante2.
Tabla 1. Principales complicaciones del acceso arterial femoral
| Incidencia (%) | |
|---|---|
| Hematoma | 2,2-12,5 |
| Hemorragia retroperitoneal | 1-2,2 |
| Rotura ileofemoral | 0,7-7,1 |
| Seudoaneurisma | 2-6 |
| Disección arterial | 2-7,4 |
| Infección local | 1,6-6,3 |
DISPOSITIVOS DE CIERRE ARTERIAL
Los dispositivos de cierre arterial se introdujeron a comienzos de la década de 1990. Para accesos arteriales con introductores > 8 Fr hay disponibles dispositivos de cierre basados en sutura o implantes bioabsorbibles. En la tabla 2 se describen los 3 dispositivos de cierre vascular de gran calibre de mayor uso en la actualidad.
Tabla 2. Principales dispositivos de cierre vascular percutáneo
| Compañía | Nombre | Tipo | Indicación FDA | Características |
|---|---|---|---|---|
| Abbot | Perclose Proglide | Sutura | Accesos AFC (5-21 Fr), vena (5-24 Fr) | Monofilamento de polipropileno con nudo premontado
Mínimo material intravascular residual Mantiene guía de acceso Sin restricción de reacceso Precierre con 2 dispositivos si > 8 Fr |
| Abbot | Prostar XL | Sutura | Accesos AFC (8,5-24 Fr) | Dos hilos de sutura de poliéster trenzado
Cuatro agujas de nitinol Mínimo material intravascular residual Mantiene la guía de acceso Precierre si > 10 Fr |
| Teleflex | Manta | Implante bioabsorbible | Acceso AFC dispositivos 10-20 Fr | No necesidad de precierre
Ancla intravascular residual |
|
AFC: arteria femoral común; FDA: Food and Drug Administration. |
||||
Proglide
Perclose/Proglide (Abbott Vascular, Estados Unidos) es el dispositivo de sutura más utilizado en la actualidad, por ser más sencillo que el Prostar XL. Se introduce sobre una guía de 0,035 pulgadas en la arteria hasta que se observa flujo pulsátil de sangre por el puerto lateral. Una palanca libera un pie dentro de la luz, que se tracciona sobre la pared anterior de la arteria mientras se liberan las agujas y se forma el nudo. El cierre de la arteria se logra al apretar el nudo. Para introductores > 8 Fr hace falta un precierre antes de poner el introductor, siguiendo los pasos comentados, pero sin apretar el nudo, maniobra que se realiza al finalizar el procedimiento. Para el uso del dispositivo de sutura se hace previamente una adecuada tunelización del tejido celular subcutáneo para garantizar la bajada del nudo corredizo de sutura. En general, para procedimientos de TAVI, el precierre se hace con 2 dispositivos liberados en diferentes orientaciones (habitualmente perpendiculares) que se aprietan al retirar al final el dispositivo utilizado, obteniendo una sutura en X sobre la superficie arterial.
Manta
El dispositivo Manta (Teleflex, Estados Unidos) está disponible en 2 tamaños, 14 y 18 Fr, para arteriotomías de 10-14 Fr y 15-20 Fr, respectivamente. Tras pinchar la arteria, se debe medir su profundidad con una vaina específica. A pesar de que su rendimiento es mayor en arterias no calcificadas, algunos operadores lo prefieren en arterias calcificadas porque es en estas donde los sistemas de cierre con sutura funcionan peor. Sobre un introductor específico se introduce el dispositivo de cierre por completo, hasta oír un clic. Después se retira el conjunto hasta la profundidad previamente medida y se libera el ancla intraarterial mediante una palanca. Se tracciona el dispositivo hasta observar un color verde-amarillo en un indicador de tensión y, manteniendo la tensión, se avanza un cilindro azul que baja un cierre radiopaco y fija el material de colágeno sobre la superficie arterial. Comprobada la hemostasia, se retira la guía (en general de 0,035 pulgadas de alto soporte) y se corta la sutura. El ancla es reabsorbible y el cierre metálico es útil para pinchar > 2,5 cm por encima o por debajo si es necesario volver a acceder a la arteria.
PARTICULARIDADES DEL ACCESO ARTERIAL EN EL TAVI
El TAVI ha revolucionado el tratamiento de la estenosis aórtica grave, convirtiéndose en el procedimiento de elección para una gran proporción de pacientes. En el TAVI, la elección de la vía de acceso marca los resultados, por lo cual es de vital importancia una adecuada planificación de esta.
Los diferentes estudios han mostrado resultados desfavorables para los accesos transtorácicos comparados con los transfemorales, por lo que siempre que sea posible se deben priorizar estos últimos3. Además, las sucesivas mejoras de la tecnología y el aumento de la experiencia de los operadores han logrado reducir las complicaciones vasculares mayores desde > 10% en las series iniciales hasta < 3% en los últimos años4.
Acceso transfemoral
Planificación
En la mayoría de los casos, el acceso transfemoral puede realizarse completamente percutáneo y con sedación superficial. Para garantizar su éxito, es obligatoria una planificación meticulosa mediante angiografía por tomografía computarizada (angio-TC) e, idealmente, reconstrucción volumétrica y análisis mediante software específicos. Mediante dicho análisis se debe valorar sobre todo el diámetro mínimo del vaso desde la bifurcación femoral hasta el origen de la ilíaca común. Se considera un mínimo de 5,5 mm para las prótesis de 14 Fr y de 6-6,5 mm para las de 18 Fr, aunque los operadores expertos pueden practicar accesos con diámetros menores si la arteria no presenta calcificación en los 360° de su pared. También se deben evaluar las tortuosidades, la presencia de placas calcificadas y la calidad de los lechos distales. Asimismo, se valorará toda la aorta descendente, considerando el acceso transfemoral como un todo desde la femoral hasta el anillo aórtico. En caso de duda concreta sobre el lugar de punción, la ecografía in situ suele ser de gran ayuda porque permite valorar con gran precisión el tamaño del vaso y la calidad de la pared arterial. Así pues, puede darse el caso de un vaso gravemente enfermo en el cual se identifique mediante ecografía la presencia de una zona preservada para la punción y el posterior cierre percutáneo.
Aspectos técnicos
La zona de punción se extiende desde 1 cm por encima de la bifurcación femoral hasta el origen de la arteria epigástrica. Distalmente, es deseable separarse de la bifurcación para evitar dañar el ostium de la arteria femoral profunda durante la punción o el cierre, así como para tener suficiente distancia en caso de que se requiera implantar un stent recubierto de rescate. Proximalmente, el límite de punción lo marca la arteria epigástrica que, al dirigirse hacia el músculo recto anterior, garantiza que nos encontramos fuera del abdomen.
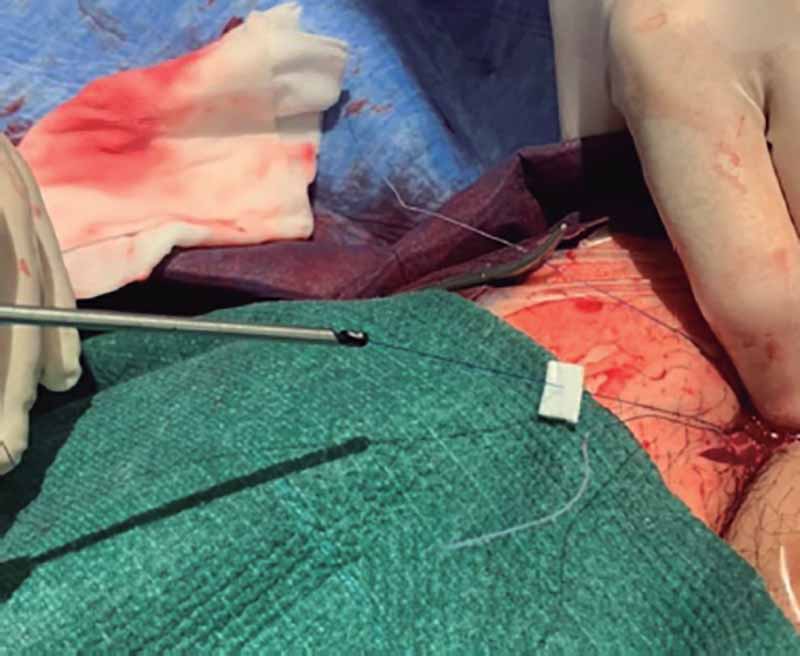
La punción ecoguiada reduce el número de complicaciones1. Debe hacerse un barrido para elegir el segmento de arteria femoral común con menor grado de calcificación y menos placa, en especial en la pared anterior. La presencia de calcificación extensa anterior y la existencia de placas excéntricas inmediatamente proximales a la zona de punción pueden ser limitaciones importantes de los dispositivos de cierre con sutura; en estos casos, se puede considerar el abordaje quirúrgico (figura 2). Otras alternativas, como la micropunción o la colocación de un pigtail en la zona de punción mediante acceso femoral contralateral, son menos habituales. En algunos centros colocan una guía de seguridad anterógradamente desde la arteria radial o desde un acceso femoral contralateral para poder llevar a cabo una oclusión de emergencia mediante balón o implantar un stent cubierto si falla el cierre; en estos casos, deben sopesarse el potencial beneficio de la guía de seguridad y el riesgo de complicación vascular asociado a un acceso femoral secundario.
Figura 2. Bajada de parches de teflón a través de la sutura del dispositivo Proglide.
Si se obtiene un acceso femoral con éxito pero existe estenosis a un nivel más proximal (ilíaca externa o común), se puede considerar realizar dilataciones sucesivas mediante vainas de tamaños crecientes o dilataciones con balón. En algunos casos, la litotricia intravascular puede ser de utilidad. Si hay tortuosidades importantes, se puede utilizar un guía de muy alto soporte (Lunderquist, Cook Medical, Estados Unidos).
Las 3 modalidades de cierre más comunes son: a) 2 dispositivos de cierre mediante sutura (Proglide) girados (uno a las 11 y otro a la 1 horarias); b) 1 dispositivo de sutura y 1 dispositivo de colágeno (AngioSeal, Terumo, Japón); y c) 1 dispositivo de cierre con colágeno (Manta). El uso de dispositivos de cierre con sutura tiene mayor curva de aprendizaje, pero parece asociarse a un menor número de complicaciones graves y de cirugía abierta de rescate. En ocasiones se requieren más de 2 dispositivos para un cierre completo5. Si se produce un fallo del sistema de cierre, en caso de ser con sutura todavía, mantener la guía en la arteria permite la colocación de nuevos dispositivos (1 o varios Proglide con diferente rotación, o un nuevo dispositivo por colágeno). Si el dispositivo inicial fallido era de colágeno y no se ha dejado una guía en paralelo de rescate, no dispondremos de guía, por lo que las soluciones más rápidas serán implantar un stent-graft (stent recubierto de una membrana que evita el sangrado) o avisar a cirugía para un cierre quirúrgico de rescate. Por el contrario, en caso de cierre no fallido pero con sangrado residual, se puede añadir la mitad de la dosis de protamina y realizar una compresión prolongada. También es muy efectivo bajar pequeños parches de teflón a través de la sutura del Proglide (figura 2). La protamina a dosis completa puede llevar a la trombosis del sistema arterial, por lo que se recomienda usar la mitad de la dosis que se ha administrado de heparina sódica. Al finalizar el procedimiento, algunos operadores realizan una angiografía de control desde un acceso arterial secundario, aunque si no hay sangrado externo también se puede comprobar la ausencia de complicaciones y la presencia de flujo distal mediante ecografía. En cuanto al acceso secundario para angiografía durante el posicionamiento de la válvula, en algunos centros optan por el acceso femoral contralateral, aunque se debe priorizar el radial siempre que sea posible, ya que se asocia a menor riesgo de sangrado y de complicaciones vasculares6.
Acceso transaxilar
El acceso axilar/subclavio no debe utilizarse como acceso prioritario en pacientes con buen acceso transfemoral. Aunque algunos estudios han mostrado buenos resultados, el registro español encuentra una mayor tasa de complicaciones en comparación con el acceso transfemoral7. Por ello, se considera como acceso alternativo cuando el transfemoral no es de buena calidad.
En general, se prefiere el acceso izquierdo por no tener un origen común con la arteria carótida y presentar un acceso más parecido al femoral, debido a la curvatura mayor de la aorta y la perpendicularidad al plano anular. En cambio, el acceso derecho raramente se selecciona y se reserva para pacientes con injerto de mamaria izquierda permeable o estenosis graves de subclavia izquierda; se debe desaconsejar siempre que el plano anular se encuentre horizontalizado (> 30-45°), ya que entra en general por la curvatura menor de la aorta y desalineado con el plano valvular.
Como en el acceso transfemoral, la planificación mediante angio-TC es fundamental, valorando la presencia de calcificaciones, estenosis y calibre mínimo, en particular en el origen de la subclavia al ser la zona más proclive a presentar ateroesclerosis. Vale la pena señalar también la diferente histología de la arteria subclavia, que presenta una media con más fibras elásticas y una adventicia más fina, comparada con la femoral, que tiene una media con células musculares lisas y una adventicia más gruesa y fibrosa8. Estas características hacen de la subclavia una arteria más frágil y susceptible a roturas o disecciones. El acceso generalmente es mediante técnica quirúrgica, aunque se han descrito series con acceso percutáneo9. Es importante no avanzar demasiado el introductor, dejando al menos 5 cm hasta el plano valvular para el correcto despliegue de la prótesis. En algunos casos se puede suturar un tubo de dacrón a la arteria proximalmente y al introductor distalmente. Con la técnica percutánea se debe crear un asa radial-femoral con anterioridad al acceso, que permita posicionar un balón de oclusión en caso de sangrado o durante el intercambio de dispositivos.
Acceso transcarotídeo
En algunos centros con experiencia, el acceso transcarotídeo se considera como acceso alternativo de elección en pacientes sin acceso transfemoral. Mientras que el riesgo de ictus es similar al del acceso transfemoral, el principal riesgo es el daño de nervios periféricos, como el facial o el laríngeo recurrente (ramo del nervio vago), que se han descrito hasta en un 2,2% de los casos10,11.
La técnica generalmente es quirúrgica y se suele usar el lado izquierdo, practicando una pequeña incisión de 5 cm a lo largo del borde anterior del músculo esternocleidomastoideo, tras lo cual se debe retraer el músculo para exposición y punción directa de la arteria. Se puede comprobar mediante camplaje proximal la presencia de circulación colateral, y suele mantenerse la monitorización cerebral continua durante el procedimiento. Al igual que en el acceso subclavio, se debe procurar no avanzar demasiado el introductor para dejar espacio suficiente para el correcto despliegue de la válvula.
Acceso transcava
El abordaje transcava es el último desarrollado para el acceso vascular alternativo en el intervencionismo percutáneo. Su objetivo es evitar la morbilidad de los abordajes transtorácicos, a la vez que presenta las ventajas de un acceso transfemoral venoso (práctica ausencia de complicaciones a nivel femoral y posibilidad de sedación consciente). Sin embargo, el abordaje requiere la capacidad de realizar una punción desde la vena cava hacia la aorta abdominal a través del retroperitoneo y posteriormente avanzar el introductor y el sistema de liberación en el TAVI. Este paso precisa una planificación preoperatoria minuciosa con angio-TC. El acceso transcava es posible porque la presión hidrostática intersticial en el espacio retroperitoneal supera la presión venosa, por lo que la sangre que sale de la aorta abdominal durante el procedimiento vuelve a la circulación venosa en lugar de acumularse en el retroperitoneo. Por otro lado, la zona de entrada en la aorta abdominal deberá estar libre de calcificación, tanto para el correcto avance del material como para el cierre efectivo de esta comunicación cavo-aórtica al final del procedimiento mediante un dispositivo oclusor tipo Amplatzer (generalmente VSD Occluder, Abbott Vascular).
Los principales datos sobre el acceso transcava proceden de un registro prospectivo multicéntrico que incluyó 100 pacientes12. Este registro halló una tasa de éxito del procedimiento del 99%, pero una tasa de hemorragias potencialmente mortales del 7% y de complicaciones vasculares del 13%. Por ello, actualmente su uso suele ser marginal.
Acceso quirúrgico aórtico directo
El acceso quirúrgico aórtico directo requiere anestesia general y se desarrolló como alternativa al acceso transapical, intentando superar las complicaciones y el daño miocárdico derivados del acceso apical. Requiere una esternotomía superior parcial que se extiende hasta el segundo o el tercer espacio intercostal derecho. En la actualidad está en desuso.
Particularidades del acceso arterial en otros procedimientos estructurales
Fugas paravalvulares
El cierre de fugas (leaks) paravalvulares es probablemente uno de los procedimientos más complejos y con mayor heterogeneidad entre operadores. Las fugas paravalvulares se dividen principalmente en aórticas y mitrales.
Fugas paravalvulares aórticas
El acceso es principalmente retrógrado (aorta-ventrículo) y por tanto es imprescindible una punción arterial. En la mayoría de los casos se implanta un dispositivo Amplatzer Vascular Plug 3 (Abbott Vascular). Estos dispositivos requieren una vaina de liberación de entre 6 y 7 Fr. En las fugas más pequeñas se puede implantar un Amplatzer Vascular Plug 4, que puede avanzar por un catéter diagnóstico de 4 Fr. Estos procedimientos se pueden acometer por vía radial13, aunque la mayoría de los operadores prefieren la arteria femoral, evitando el riesgo de espasmo en caso de necesitar una manipulación de catéter importante. En general, el uso de una guía de alto soporte en el ventrículo izquierdo es suficiente para proporcionar soporte para avanzar los catéteres de liberación. En este sentido, se recomiendan guías de alto soporte, como las utilizadas en el TAVI, para evitar perforaciones del ventrículo izquierdo. En caso contrario, puede ser necesario realizar un asa arteriovenosa e incluso un asa arterioarterial (especialmente útil en fugas sobre TAVI autoexpandibles)14. En ambas situaciones será necesario un acceso adicional venoso o arterial específicamente. Por último, cabe destacar que, a pesar del tamaño limitado de los introductores, se recomienda el uso de sistemas de cierre vascular, al ser en su mayoría pacientes con válvulas mecánicas y que por tanto requieren un reinicio precoz de la anticoagulación.
Fugas paravalvulares mitrales
La mayoría de los operadores utilizan el acceso anterógrado (aurícula izquierda-ventrículo) a través de una vena femoral y acceso transeptal. Para esta técnica es imprescindible tener un buen soporte de imagen con ecocardiografía transesofágica tridimensional y usar un catéter con capacidad de flexión para orientarlo sobre el origen de la fuga. En la mayoría de los casos, la colocación de una guía de alto soporte en el ventrículo izquierdo evita la necesidad de un asa arteriovenosa (que requeriría un acceso arterial). Por tanto, muchas veces un acceso venoso único puede ser suficiente. Los dispositivos utilizados son generalmente los mismos que en las fugas aórticas y los catéteres necesarios tienen el mismo tamaño. Es importante destacar que, en ocasiones, las fugas mitrales requieren el implante de múltiples dispositivos. En caso de querer realizar un implante simultáneo de 2 o más dispositivos, puede ser necesario realizar tantos accesos venosos como dispositivos se vayan a implantar. Alternativamente, las fugas paravalvulares mitrales se pueden cruzar de manera retrógrada (ventrículo-aurícula izquierda). Esta técnica requiere la manipulación de catéteres dentro del ventrículo izquierdo y, por tanto, comporta un alto riesgo de arritmias. Puede ser una alternativa en caso de dificultades para el cruce anterógrado y en general es más fácil en fugas posteriores que en anteriores (ya que la guía siempre tiene tendencia a ir a través de la aorta). Esta técnica requiere, obviamente, una punción arterial y la realización de un asa arteriovenosa a nivel de la aurícula izquierda.
Coartación de aorta
El tratamiento percutáneo de elección para la coartación de aorta es el implante de stents. Para ello es necesario un acceso arterial de gran tamaño (10-14 Fr), que habitualmente es femoral. El calibre del introductor femoral depende de la elección de los balones y de los stents que se utilicen. Los stents pueden ser con o sin recubrimiento. Los stents recubiertos se usan sobre todo para las coartaciones complejas, como las que tienen obstrucción completa o estenosis crítica con riesgo de rotura, las que se asocian a aneurismas, seudoaneurismas, ductus o enfermedad de la pared (válvula bicúspide, Turner); en pacientes de edad avanzada se puede considerar el uso de stents recubiertos que puedan cubrir una disección o rotura. El inconveniente de usar stents recubiertos, aparte del riesgo de oclusión de las ramas próximas, es que necesitan una vaina 3 Fr mayor que lo necesario para el balón. En general, la vaina debe ser 2-3 Fr mayor que el mínimo requerido por el balón para dar espacio suficiente al stent y permitir su libre desplazamiento por el interior.
Para el acceso arterial femoral hay que tener en cuenta que los pacientes con coartación de aorta a menudo tienen una vasculatura arterial de diámetro menor del normal en los miembros inferiores. Además, un acceso adicional arterial radial es útil para la visualización y la angiografía durante el procedimiento, y para cruzar coartaciones críticas u oclusiones completas. En raros casos, el acceso carotídeo puede ser necesario para llegar a la aorta descendente (neonatos, estenosis críticas)15.
En cuanto al cierre, dado que la vaina suele ser de 12-14 Fr, se recomienda el cierre vascular con los dispositivos específicos antes mencionados o bien por compresión manual diferida una vez revertida la heparinización16.
Cierre de ductus arterioso
Para el cierre de ductus habitualmente se canalizan la arteria y la vena femorales. Es recomendable realizar un cateterismo izquierdo y derecho para registrar las presiones pulmonares y sistémicas, por lo que resulta razonable realizar el acceso venoso con un introductor de 7 Fr. Los dispositivos oclusores de ductus de mayor tamaño son también compatibles con 7 Fr y habitualmente se implantan por el lado venoso, por lo que puede plantearse un acceso arterial inicial de 5 Fr, que por comodidad suele hacerse por vía femoral (pensando en la posible necesidad de realizar un asa arteriovenosa), aunque puede hacerse por vía radial con una potencial reducción de las complicaciones vasculares. Cuando el acceso venoso femoral no es posible (oclusión bilateral femoral o de cava inferior) y se prefiere un acceso inferior a la aurícula derecha (como en el caso del cierre percutáneo del ductus o de defectos del tabique interauricular), se ha descrito el uso de otras rutas, como la transhepática17.
Respecto al calibre de los accesos vasculares, hay que tener en cuenta la técnica elegida y el tipo y el tamaño del dispositivo. Existen 2 posibilidades para el tratamiento percutáneo del ductus arterioso persistente: coils o dispositivos oclusores. Si el ductus es de pequeño tamaño (< 4 mm) se pueden usar 1 o varios coils de liberación controlada compatibles con catéteres de pequeño tamaño (4 Fr) e incluso con microcatéteres. Para ductus de mayor tamaño se suelen usar dispositivos oclusores. Todos ellos son de nitinol y autoexpandibles, que suelen ser compatibles con vainas de 5-7 Fr, dependiendo de su tamaño.
La canalización del ductus se hace por vía anterógrada (desde la arteria pulmonar) o retrógrada (desde la aorta), en cuyo caso requiere un asa arteriovenosa. En ambas vías se suele introducir la vaina del dispositivo por el lado venoso anterógrado desde donde se implanta. En cuanto al cierre, al ser accesos de no gran calibre, y habitualmente el mayor por acceso venoso, suele hacerse mediante compresión manual.
ACCESO VENOSO
Técnica de punción venosa ecoguiada
El acceso venoso transfemoral es el más utilizado para la realización de procedimientos de intervencionismo estructural percutáneo no TAVI. A través de la vena femoral se accede a las cámaras cardiacas derechas, y mediante una punción transeptal a las cámaras cardiacas izquierdas.
Tradicionalmente, la punción venosa se llevaba a cabo guiada por referencias anatómicas. Los operadores experimentados obtienen una razonable tasa de éxito con este método. Sin embargo, existe una posibilidad de complicaciones nada despreciable, como punción arterial inadvertida, fistula venoarterial, neumotórax (en el acceso venoso yugular interno), lesión nerviosa o múltiples intentos fallidos de canulación. El riesgo y las consecuencias de estas complicaciones dependen del tipo de pacientes tratados. Los factores de riesgo, como la obesidad, la caquexia, la radioterapia previa o las cicatrices quirúrgicas previas, entre otros, pueden influir en el éxito de la canulación y en la aparición de complicaciones18.
La técnica más segura para la canulación venosa es la ecoguiada. Para identificar la vena que se va a puncionar y establecer su relación con la arteria acompañante se puede hacer presión con la sonda de ultrasonidos, de manera que típicamente la vena se colapsará y no así la arteria (ver secciones anteriores).
Existen 2 técnicas para llevar a cabo la punción venosa ecoguiada: la transversal (fuera de plano) y la longitudinal (en plano)19. Ambas tienen ventajas y desventajas. La técnica transversal permite ver en el mismo plano las estructuras adyacentes que deben evitarse durante la punción. Sin embargo, con esta técnica es más difícil visualizar la punta de la aguja de punción; para ello se debe de ajustar el ángulo de la sonda con el fin de hacer coincidir el plano de la aguja y el plano de la sonda. La técnica longitudinal permite seguir la trayectoria de la aguja desde su entrada en la piel hasta el contacto con la vena diana. Como contrapartida, las estructuras adyacentes, y sobre todo la arteria acompañante, no se visualizan en el mismo plano. Se puede mejorar la visualización de la vena diana mediante una maniobra de Valsalva.
Dispositivos de cierre percutáneo de acceso venoso
Históricamente, la hemostasia de la punción venosa se ha realizado mediante compresión manual prolongada combinada con la aplicación de un vendaje compresivo. Con el uso de introductores de mayor tamaño para la realización de procedimientos de intervencionismo estructural, sobre todo en el acceso venoso femoral, se buscan métodos más efectivos y seguros para conseguir la hemostasia.
Punto de sutura subcutáneo «en 8»
Esta técnica consiste en pasar una sutura subcutánea proximal y transversal a la entrada del introductor venoso, y luego cruzar al lado contrario y hacer una sutura subcutánea distal a la entrada de la vaina. Esta sutura frunce la piel y el tejido celular subcutáneo, ejerciendo presión sobre la vena femoral. La técnica se complementa con un ligero vendaje compresivo. Se ha descrito una técnica modificada realizando la sutura subcutánea longitudinal al trayecto de la vena en vez de transversal, buscando minimizar la posibilidad de una punción inadvertida de la vena20.
Dispositivos de cierre vasculares
En el acceso venoso femoral con vainas de hasta 8 Fr se ha utilizado Angioseal con buenos resultados21. El uso del dispositivo de sutura percutánea Proglide ha demostrado ser efectivo y seguro en el acceso venoso femoral con vainas de hasta 24 Fr22. La técnica de implante es la misma que en la arteria (ver secciones anteriores). Dependiendo del resultado del cierre, se puede combinar con una sutura subcutánea «en 8» si la hemostasia inicial no es completa. Generalmente, se completa con un vendaje compresivo ligero.
Particularidades del intervencionismo mitral
La intervención percutánea sobre la válvula mitral más frecuente es la reparación «borde a borde» con los dispositivos MitraClip (Abbott Vascular, Estados Unidos) o Pascal (Edwards Lifesciences, Estados Unidos), si bien existen dispositivos de anuloplastia directa que intentan replicar una reparación similar a la efectuada quirúrgicamente. También se están desarrollando opciones de recambio valvular mitral transcatéter, algunas ya por completo percutáneas, con buenos resultados.
En el intervencionismo percutáneo sobre la válvula mitral, el acceso vascular más utilizado es la vena femoral, por su calibre, su accesibilidad y su facilidad de cierre al finalizar el procedimiento. La elección de la vena femoral izquierda o derecha depende de las circunstancias clínicas del enfermo (que tenga los 2 accesos disponibles, patología vascular intervenida previa en alguno de los 2 accesos, etc.) y de la preferencia del operador, por su comodidad al hacer el implante. Por esto, el acceso más usado es la vena femoral derecha, más cómoda para el operador y con algo menos de radiación.
Se ha descrito la posibilidad de efectuar el implante por vía yugular derecha, aunque solo se han publicado casos anecdóticos, por dificultades de acceso femoral, como la presencia de un filtro de vena cava inferior ocluido o de angulaciones muy marcadas del eje iliofemoral venoso23. El implante es técnicamente más dificultoso y requiere tener en cuenta múltiples consideraciones, si bien la punción es casi igual que la habitual.
La punción venosa ecoguiada limita sus posibles complicaciones y debería generalizarse. En la mayoría de los casos se implantan dispositivos de precierre antes de comenzar el procedimiento. Tras insertar una guía de alto soporte, que se lleva hasta la vena cava superior (o inferior, si el acceso es yugular), se efectúa una disección del acceso con fórceps, predilataciones del acceso con dilatadores de diferentes calibres y se avanza el catéter guía hasta la aurícula derecha. Su avance suele ser menos dificultoso que en el acceso arterial, con menos resistencia. El calibre del catéter guía del dispositivo MitraClip es de 24 Fr, con el dispositivo Pascal es de 22 Fr y para el implante de prótesis (mitrales o aórticas en posición mitral) difiere dependiendo del tipo de dispositivo que se vaya a implantar.
Particularidades del intervencionismo tricuspídeo
El intervencionismo sobre la válvula tricúspide ha evolucionado mucho en la última década, actuando bien sobre la coaptación de los velos, con anuloplastia con sutura o con anillo, y últimamente con recambio valvular percutáneo ortotópico o heterotópico24.
El acceso más utilizado es el venoso, a través de la vena femoral, de la yugular o de ambas. Dependiendo del tipo de procedimiento, es preciso canalizar otro acceso venoso más o un acceso arterial, preferiblemente radial, dado su menor índice de complicaciones vasculares.
El dispositivo que actualmente más se utiliza para el tratamiento de la insuficiencia tricuspídea es el TriClip (Abbott Vascular), desde que recibió la marca CE en el año 2020. Con el desarrollo del dispositivo TriClip, que tiene una rueda específica para alejarse del septo interauricular, el acceso venoso derecho o izquierdo no influye en el implante, y por ello la inmensa mayoría de los operadores utilizan la vena femoral derecha como vía de acceso25.
Respecto al implante de prótesis ortotópicas o heterotópicas, el acceso de elección es igualmente el femoral derecho, con calibres distintos dependiendo del dispositivo a utilizar (entre 14 y 30 Fr).
Particularidades del intervencionismo pulmonar
El intervencionismo sobre válvula o arteria pulmonar siempre requiere un acceso venoso muy variable en su diámetro, dependiendo de la técnica que se lleve a cabo. El acceso por la vena femoral es el más habitual y, por tanto, incrementar el tamaño de los introductores no supone un problema tan grave como en los accesos arteriales.
El implante percutáneo de válvulas pulmonares requiere el uso de introductores de 16-22 Fr, dependiendo del modelo. En muchos casos es necesario usar guías de alto soporte para rectificar las curvaturas en el trayecto en las cavidades derechas.
El tratamiento agudo de la enfermedad tromboembólica pulmonar requiere la introducción de sistemas de extracción de trombos. Dado que el principal condicionante del sistema utilizado es el tamaño del trombo, y que la arteria pulmonar puede albergar trombos de gran tamaño, algunos sistemas necesitan un acceso de gran calibre; por ejemplo, el Penumbra (Penumbra Inc, Estados Unidos) puede avanzar por un 8 Fr, el Nautilus (iVascular, España) por un 10 Fr y el Flowtriever (Inari Medical Inc, Estados Unidos) requiere 16-24 Fr.
En otros casos de trombectomía más distal o angioplastia pulmonar en enfermedad tromboembólica crónica se requieren introductores mucho más pequeños (6-7 Fr). Utilizar sistemas telescópicos (catéteres dentro de catéteres) puede ser muy útil en algunos casos de difícil acceso y puede requerir introductores más grandes.
Particularidades del cierre de la orejuela izquierda
Para el cierre percutáneo de la orejuela izquierda normalmente se practica un acceso venoso femoral. Algunos operadores realizan un acceso arterial adicional para monitorizar la presión arterial de manera invasiva. Este acceso arterial debe hacerse por vía radial para reducir las complicaciones hemorrágicas. En algunos casos, la guía es con ecografía intracardiaca, para la que se necesita un acceso femoral venoso complementario.
Un aspecto clave para la elección del calibre del introductor venoso por el que se va a implantar el dispositivo es el tipo y el tamaño del introductor. Los dispositivos más utilizados en nuestro medio son Amplatzer/Amulet (Abbott Vascular), Watchmann (Boston Scientific, Estados Unidos) y Lambre (Lifetech, China)26. El tamaño de los introductores varía desde 8-10 Fr (Lambre) hasta 12-14 Fr (Amulet y Watchman Flx).
En cuanto al cierre vascular, la mayoría de los operadores siguen usando compresión manual o sutura «en 8» para el acceso venoso, aunque también se pueden utilizar los sistemas de cierre vascular antes descritos.
Particularidades del acceso venoso en otros procedimientos estructurales
Hay otros procedimientos estructurales que requieren un acceso venoso, principalmente por la vena femoral. Entre los más prevalentes destacan el cierre del foramen oval permeable y el cierre de comunicaciones interauriculares. En algunos casos, estos procedimientos pueden ser guiados por ecografía intracardiaca, por lo que requieren un acceso femoral venoso adicional. Existen multitud de dispositivos de diferentes compañías que permiten el cierre de estas patologías, aunque los más habituales son los dispositivos Amplatzer PFO occluder, Amplatzer ASD occluder y Gore, sobre todo Gore Cardioform (WL Gore & Associates, Estados Unidos). En el caso de los dispositivos Amplatzer, para su implante se requieren introductores de entre 8 y 12 Fr. Por su parte, el sistema Gore requiere introductores de 11 Fr cortos, ya que vienen premontados sobre una vaina de liberación. En general, la incidencia de complicaciones vasculares es baja al tratarse principalmente de pacientes jóvenes y requerir un único acceso venoso femoral. En caso de oclusión de cava inferior, se han descrito implantes a través de la vena yugular27.
FINANCIACIÓN
Este artículo no ha recibido financiación.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido en la redacción y la revisión crítica del artículo.
CONFLICTO DE INTERESES
X. Freixa es proctor de Abbott Medical. R. Romaguera es editor asociado de REC: Interventional Cardiology, por lo que se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito; además, es proctor de Boston Scientific y ha recibido honorarios por charlas de Medtronic. R. Trillo es proctor de Medtronic y Boston Scientific. A. Jurado-Román ha recibido honorarios por charlas de Boston Scientific.
MATERIAL ADICIONAL
Vídeo 1. Freixa X. DOI: 10.24875/RECIC.M22000327
BIBLIOGRAFÍA
1. Seto AH, Abu-Fadel MS, Sparling JM, et al. Real-time ultrasound guidance facilitates femoral arterial access and reduces vascular complications: FAUST (Femoral Arterial Access With Ultrasound Trial). JACC Cardiovasc Interv. 2010;3:751-758.
2. Toggweiler S, Leipsic J, Binder RK, et al. Management of vascular access in transcatheter aortic valve replacement: part 2: Vascular complications. JACC Cardiovasc Interv. 2013;6:767-776.
3. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
4. Forrest JK, Deeb GM, Yakubov SJ, et al. 2-Year Outcomes After Transcatheter Versus Surgical Aortic Valve Replacement in Low-Risk Patients. J Am Coll Cardiol. 2022;79:882-896.
5. van Wiechen MP, Tchetche D, Ooms JF, et al. Suture- or Plug-Based Large-Bore Arteriotomy Closure: A Pilot Randomized Controlled Trial. JACC Cardiovasc Interv. 2021;14:149-157.
6. Junquera L, Urena M, Latib A, et al. Comparison of Transfemoral Versus Transradial Secondary Access in Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2020;13:e008609.
7. Jimenez-Quevedo P, Nombela-Franco L, Munoz-Garcia E, et al. Early clinical outcomes after transaxillary versus transfemoral TAVI. Data from the Spanish TAVI registry. Rev Esp Cardiol. 2021;75:479-487.
8. Schafer U, Ho Y, Frerker C, et al. Direct percutaneous access technique for transaxillary transcatheter aortic valve implantation: “the Hamburg Sankt Georg approach”. JACC Cardiovasc Interv. 2012;5:477-486.
9. Amat-Santos IJ, Santos-Martinez S, Conradi L, et al. Transaxillary transcatheter ACURATE neo aortic valve implantation - The TRANSAX multicenter study. Catheter Cardiovasc Interv. 2021;98:E291-E298.
10. Hameed I, Oakley CT, Hameed NUF, et al. Alternate accesses for transcatheter aortic valve replacement: A network meta-analysis. J Card Surg. 2021;36:4308-4319.
11. Panagides V, Kalavrouziotis D, Dumont E, et al. Cranial nerve injury during transcarotid transcatheter aortic valve replacement. Int J Cardiol. 2022;353:46-48.
12. Greenbaum AB, Babaliaros VC, Chen MY, et al. Transcaval Access and Closure for Transcatheter Aortic Valve Replacement: A Prospective Investigation. J Am Coll Cardiol. 2017;69:511-521.
13. Giacchi G, Freixa X, Hernández-Enríquez M, et al. Minimally Invasive Transradial Percutaneous Closure of Aortic Paravalvular Leaks: Following the Steps of Percutaneous Coronary Intervention. Can J Cardiol. 2016;32:1575.e17-e19.
14. Estévez-Loureiro R, Benito-González T, Gualis J, et al. Percutaneous paravalvular leak closure after CoreValve transcatheter aortic valve implantation using an arterio-arterial loop. J Thorac Dis. 2017;9:E103-E108.
15. Singh HS, Benson LN, Osten M, Horlick E. Cardiac Catheterization in Adult Congenital Heart Disease. En: Gatzoulis MA, Webb Piers GD, Daubeney EF, eds. Management of Adult Congenital Heart Disease. 3rd ed. Philadelphia: Elsevier; 2018.
16. Salinas P, Sánchez-Recalde A, Galeote G, et al. Intervencionismo percutáneo sobre coartación aórtica en el paciente adulto. En: Martín-Moreiras J, Cruz-González I, eds. Manual de Hemodinámica e Intervencionismo Cardiaco. Madrid: Marbán; 2014.
17. Ebeid MR. Transhepatic vascular access for diagnostic and interventional procedures: Techniques, outcome and complications. Catheter Cardiovasc Interv. 2007;69:594-606.
18. National Institute for Health and Care Excellence. Guidance on the use of ultrasound locating devices for placing central venous catheters. NICE; 2002. Disponible en: https://www.nice.org.uk/guidance/ta49/resources/guidance-on-the-use-of-ultrasound-locating-devices-for-placing-central-venous-catheters-pdf-2294585518021. Consultado 1 Jun 2022.
19. Privitera D, Mazzone A, Pierotti F, et al. Ultrasound-guided peripheral intravenous catheters insertion in patient with difficult vascular access: Short axis/out-of-plane versus long axis/in-plane, a randomized controlled trial. J Vasc Access. 2021;23(4):589-597.
20. Wyss CA, Anliker O, Gämperli O, et al. Closure of Large Percutaneous Femoral Venous Access Using a Modified “Figure-of-Eight” Suture. Innovations (Phila). 2018;13:147-151.
21. Coto HA. Closure of the femoral vein puncture site after transcatheter procedures using Angio-Seal. Catheter Cardiovasc Interv. 2002;55:16-19.
22. Geis NA, Pleger ST, Chorianopoulos E, et al. Feasibility and clinical benefit of a suture-mediated closure device for femoral vein access after percutaneous edge-to-edge mitral valve repair. EuroIntervention. 2015;10:1346-1353.
23. Yap J, Chen S, Smith TWR, et al. Transjugular mitral valve repair with the MitraClip: A step-by-step guide. Catheter Cardiovasc Interv. 2020;96:699-705.
24. Asmarats L, Puri R, Latib A, Navia JL, Rodés-Cabau J. Transcatheter Tricuspid Valve Interventions: Landscape, Challenges, and Future Directions. J Am Coll Cardiol. 2018;71:2935-2956.
25. Moñivas V, Li P, Sanchis R, et al. Tratamiento percutáneo de la insuficiencia tricuspídea. Procedimiento detallado guiado por imagen con MitraClip. REC Interv Cardiol. 2020;2:118-128.
26. Romaguera R, Ojeda S, Cruz-González I, Moreno R. Spanish Cardiac Catheterization and Coronary Intervention Registry. 30th Official Report of the Interventional Cardiology Association of the Spanish Society of Cardiology (1990-2020) in the year of the COVID-19 pandemic. Rev Esp Cardiol. 2021;74:1095-1105.
27. Qintar M, Villablanca P, Lee J, et al. Patent foramen ovale closure with vena cava thrombus: You need an arm and a neck! Clin Case Rep. 2021;9:e03884.