RESUMEN
En la última década, el reemplazo valvular aórtico transcatéter (TAVR, por sus siglas en inglés) se ha convertido en el tratamiento preferente para los pacientes con estenosis aórtica grave y con alto o incluso moderado riesgo quirúrgico. En consecuencia, esta nueva tecnología ha sido evaluada en sujetos de bajo riesgo quirúrgico. En el estudio PARTNER 3 se aleatorizó a 1.000 pacientes (puntuación media de la Society of Thoracic Surgeons, 1,9%; edad media, 73 años) para ser sometidos a TAVR con una válvula balón expandible o a reemplazo quirúrgico de válvula aórtica, y se halló que la TAVR fue superior en términos del objetivo final compuesto de muerte, ictus y reingreso a 1 año. En el ensayo Evolut Low Risk, en el que 1.468 pacientes fueron aleatorizados a TAVR con una prótesis autoexpandible o cirugía, la TAVR no fue inferior a esta última en términos del criterio de valoración principal compuesto de muerte o accidente cerebrovascular discapacitante a los 24 meses. Si bien el seguimiento a 1-2 años disponible no responde a la pregunta sobre la durabilidad de las válvulas transcatéter, estos resultados cambiarán nuestra práctica clínica diaria.
Palabras clave: Reemplazo de válvula aórtica transcatéter. Riesgo quirúrgico bajo. Ensayo aleatorizado.
ABSTRACT
Over the last decade, transcatheter aortic valve replacement (TAVR) has become the preferred treatment for patients with severe aortic stenosis at increased risk for surgery. Consequently, this new technology has been recently tested in low-risk subjects. The PARTNER 3 trial randomized 1000 patients (mean Society of Thoracic Surgeons score, 1.9%; mean age, 73 years) to undergo TAVR with a balloon-expandable valve or surgical aortic valve replacement showing that TAVR was superior in terms of the composite endpoint of death, stroke and re-hospitalization at 1 year. In the Evolut Low Risk trial that randomized 1468 patients with the use of a self-expandable prosthesis, TAVR was non-inferior to surgery for the primary composite endpoint of death or disabling stroke at 24 months. While the available 1-year follow up does not answer the question of transcatheter valves durability, these results will definitely change our everyday clinical practice.
Keywords: Transcatheter aortic valve replacement. Low surgical risk. Randomized trial.
Abbreviations: EAo: estenosis aórtica; FPV: fuga paravalvular; SAVR: reemplazo quirúrgico de válvula aórtica; TAVI: implante percutáneo de válvula aórtica.
La angioplastia coronaria percutánea tardó aproximadamente 30 años, desde la primera experiencia capitaneada por Andreas Gruentzig en 1977, en alcanzar la indicación clase I en las guías de práctica clínica sobre el manejo de la revascularización miocárdica del tronco coronario izquierdo/enfermedad arterial coronaria de 3 vasos y en reemplazar a la cirugía de revascularización coronaria en el manejo de la mayoría de pacientes con enfermedad arterial coronaria. Algo parecido ha ocurrido con el implante percutáneo de válvula aórtica (TAVI), realizado por primera vez hace 17 años en un paciente de riesgo prohibitivo con estenosis valvular aórtica (EAo) grave, hasta la llegada del ensayo aleatorizado contemporáneo de TAVI comparado con recambio valvular aórtico quirúrgico (SAVR) en una población de bajo riesgo quirúrgico. Ha sido un camino jalonado por importantes avances técnicos en prótesis válvulares cardiacas percutáneas, por la creciente experiencia de los intervencionistas y por ensayos aleatorizados rigurosamente diseñados. De hecho, el TAVI demostró por primera vez ser superior al tratamiento médico en pacientes considerados inoperables1,2, y confirmó no ser inferior al SAVR en pacientes de riesgo alto3,4 e intermedio5,6. De hecho, cuando se realiza por vía transfemoral, el TAVI demostró ser superior al SAVR7. Así que el momento parecía propicio para poner a prueba esta disruptiva tecnología en pacientes de bajo riesgo, que suponen el 80% de los pacientes que hasta la fecha se someten a intervenciones SAVR8,9.
El ensayo PARTNER 310 es un estudio aleatorizado y multicéntrico que comparó las intervenciones de TAVI y SAVR para el tratamiento de la EAo sintomática grave en pacientes de bajo riesgo quirúrgico (puntuaciones < 4% en la escala de la Society of Thoracic Surgeons [STS]. Este ensayo aleatorizó a 1.000 pacientes de bajo riesgo (puntuación media en la escala STS del 1,9%) de 71 centros (el 98% de los pacientes se inscribieron en los Estados Unidos) a someterse a TAVI transfemoral con la prótesis válvular expandible por balón SAPIEN 3 (Edwards Lifesciences, Irvine, California, Estados Unidos), o a SAVR. El objetivo primario fue un compuesto de mortalidad por cualquier causa, accidente cerebrovascular y rehospitalización por insuficiencia cardiaca al año. El ensayo se diseñó para poner a prueba tanto la no inferioridad (con un margen preespecificado de 6 puntos porcentuales) como la superioridad del TAVI en la población tratada. Se observó un descenso del 46% en el índice del objetivo primario compuesto al cabo de 1 año para TAVI frente a SAVR que cumplió los criterios tanto de no inferioridad (8,5 frente al 15,1%; diferencia absoluta: -6,6%; intervalo de confianza del 95% [IC95%], de -10,8 a -2,5; p < 0,001) como de superioridad (hazard ratio [HR]: 0,54; IC95%, 0,37-0,79; p = 0,001). Aún después de excluir las rehospitalizaciones por insuficiencia cardiaca, el componente más débil del objetivo compuesto, el TAVI obtuvo mejores resultados que la cirugía (mortalidad o accidente cerebrovascular del 1,8 frente al 4,9%; efecto del tratamiento: 0,36; IC95%, 0,17-0,79). También se valoraron jerárquicamente varios objetivos secundarios preespecificados que arrojaron índices mucho más bajos de accidente cerebrovascular (0,6 frente al 2,4%; p = 0,02), mortalidad o accidente cerebrovasculare (1,0 frente al 3,3%; p = 0,01), hemorragia mayor o con peligro para la vida (3,6 frente al 24,5%; p < 0,001) y fibrilación auricular de nueva aparición (5,0 frente al 39,5%; p < 0,001) en el grupo TAVI. No se observaron diferencias significativas en las fugas paravalvulares (FPV) moderadas o graves (0,8 frente al 0%), en la necesidad de implantar marcapasos permanentes (6,5 frente al 4,0%) ni en las complicaciones vasculares mayores (2,2 frente al 1,5%) entre ambas poblaciones.
Otro estudio aleatorizado realizado en pacientes de bajo riesgo con EAo, el ensayo Evolut Low Risk11, confirmó la no inferioridad del TAVI con una protesis valvular autoexpandible (Evoult R and Pro, Evolut Medtronic Inc., Minneapolis, Minnesota, Estados Unidos) comparado con la cirugía en el objetivo primario compuesto de mortalidad por cualquier causa o accidente cerebrovascular discapacitante a los 24 meses11. La tasa de incidencia estimada a los 24 meses del objetivo primario fue del 5,3% en el grupo TAVI frente al 6,7% en el grupo quirúrgico (diferencia: –1,4 puntos porcentuales; intervalo creíble bayesiano al 95% para la diferencia: de –4,9 a 2,1; probabilidad posterior de no inferioridad > 0,999). En este estudio, el TAVI no resultó superior a SAVR, aunque arrojó índices numéricamente más bajos para los resultados clínicos más importantes (los resultados principales de ambos estudios se muestran en la tabla 1). En resumen, los pacientes sometidos a TAVI arrojaron tasas de incidencia más bajas de accidentes cerebrovasculares discapacitantes, complicaciones hemorrágicas, daño renal agudo y fibrilación auricular y una tasa de incidencia más alta de FPV moderadas/graves e implante de marcapasos. Aunque una comparativa entre los dos ensayos resulta difícil habida cuenta de las diferencias en el diseño estadístico y objetivos de ambos (algo que supera el objetivo de este manuscrito), sí es importante resaltar que ambos estudios apuntaron en la misma dirección sugiriendo un efecto de clase de TAVI en esta población de bajo riesgo.
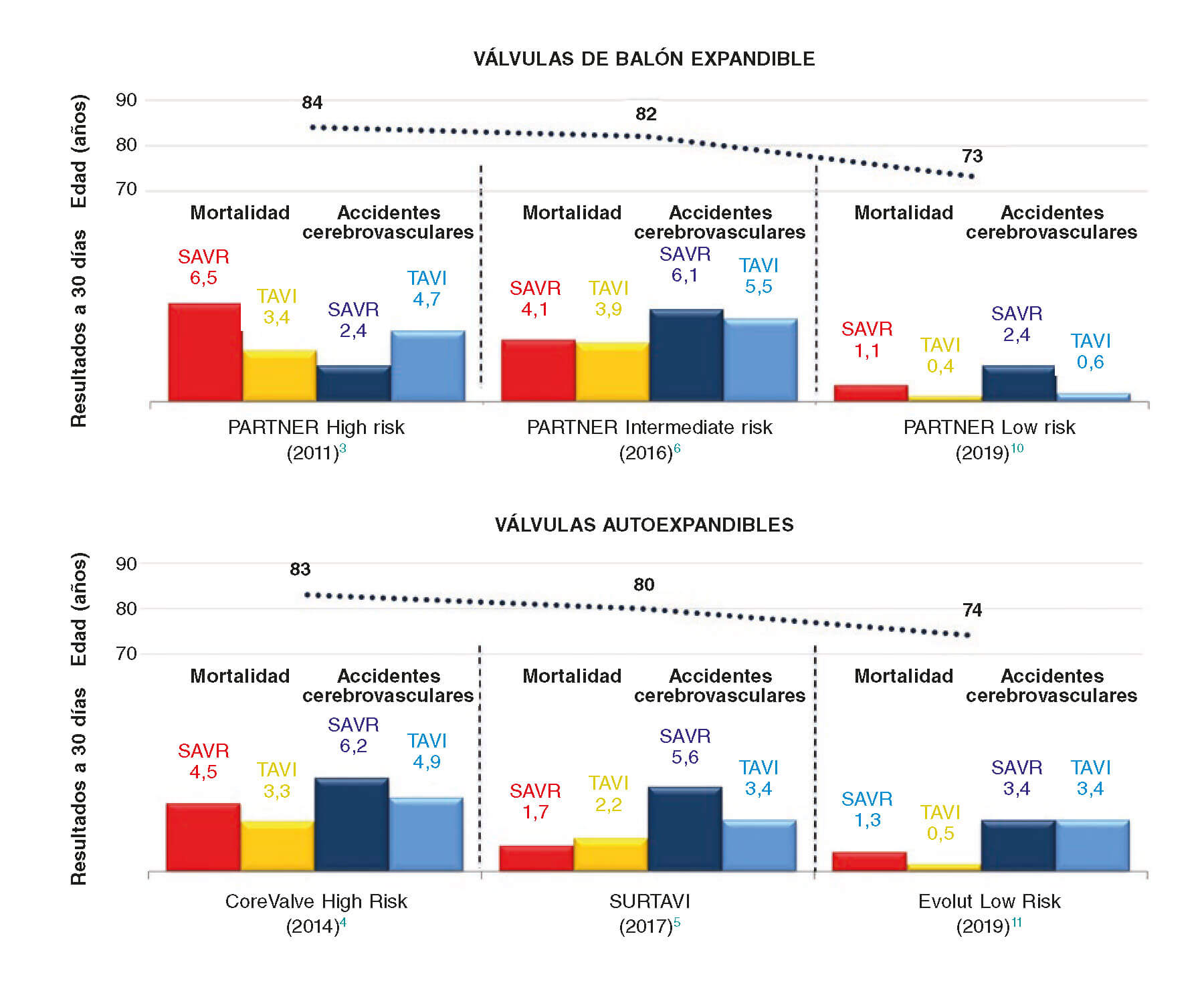
Estos estudios son un hito de la cardiología intervencionista y, por ende, de la medicina moderna por dos razones. En primer lugar, porque son el último escalón en la escala de riesgo quirúrgico para TAVI, demostrando de una vez por todas que el abordaje transcatéter de la EAo grave ofrece resultados similares (si no superiores) a los de SAVR con independencia del riesgo quirúrgico. En segundo lugar, y más importante si cabe, porque se trata de los dos primeros ensayos aleatorizados que ponen a prueba el abordaje transcatéter de la EAo en una población más joven con mayor esperanza de vida. La media de edad de la población del estudio fue de 73-74 años, con apenas el 10% de los participantes del estudio con una edad < 65 años en el ensayo PARTNER 3. Antes de la llegada de estos estudios, la media de edad de los pacientes tratados con TAVI estaba por encima de los 80 años (figura 1)8. Centrándonos en el PARTNER 3, en esta población de pacientes más jóvenes y sanos, el grupo de control quirúrgico tuvo muy buenos resultados, arrojando índices de mortalidad a los 30 días de apenas el 1,1% y tasas de accidentes cerebrovasculares discapacitantes a los 30 días del 0,4% (un 2% de accidentes cerebrovasculares no discapacitantes). En cualquier caso, el grupo TAVI arrojó índices de mortalidad a los 30 días todavía más bajos (0,4%) sin tasas de accidentes cerebrovasculares discapacitantes (un 0,6% de accidentes cerebrovasculares no discapacitantes). A este respecto, el índice extremadamente bajo de accidentes cerebrovasculares observado en el grupo TAVI cuestiona la necesidad de un uso rutinario de dispositivos de protección frente a embolias cerebrales. La mortalidad por cualquier causa al cabo de 1 año también fue extremadamente baja en ambos grupos comparado con anteriores ensayos PARTNER. Si analizamos los datos con detenimiento, está claro que casi todas las pocas muertes que se produjeron tuvieron alguna causa cardiaca (observándose una tasa de mortalidad cardiaca del 0,8% en el grupo TAVI frente a un 2% en el grupo SAVR). Este hallazgo es nuevo si lo comparamos con anteriores estudios TAVI en los que la mortalidad cardiaca suponía menos del 60% de las muertes al cabo de 1 año, lo cual, con toda probabilidad, se debe a la menor edad y baja prevalencia de comorbilidades de la población del PARTNER 3.
Figura 1. Mortalidad a 30 días y tasas de accidentes cerebrovasculares en dos importantes ensayos sobre implante transcatéter de prótesis valvular aórtica (TAVI) frente a recambio valvular aórtico quirúrgico (SAVR) en todo el espectro de riesgo quirúrgico. Cabe destacar que la media de edad de la población del estudio se redujo significativamente en los ensayos clínicos PARTNER 3 (PARTNER Low Risk) y Evolut Low Risk.
Otro hallazgo sorprendente de este estudio fue que anteriores problemas del TAVI tales como las complicaciones vasculares, la necesidad de implante de marcapasos y los índices de FPV moderadas/graves fueron tan bajos como los de SAVR. Esto probablemente se deba a los importantísimos avances técnicos de las prótesis valvulares para TAVI de última generación12 (con la llegada de las faldas externas de sellado y un menor calibre de la vaina introductora), a las metódicas valoraciones preoperatorias realizadas mediante tomografía computarizada (reduciéndose, por tanto, el dimensionamiento de la prótesis) y a la mayor experiencia de los intervencionistas (con resultado de implantes más precisos). Este descenso de las complicaciones perioperatorias, sumado a la adopción de abordajes mínimamente invasivos (solo un tercio de las intervenciones TAVI se realizaron bajo anestesia general, y la mayoría ni siquiera precisó de ingreso en la unidad de cuidados intensivos) resultó en hospitalizaciones más cortas para los pacientes TAVI (3,0 frente a 7,0 días) y en índices más altos de altas hospitalarias y autocuidado (el 95,8 frente al 73,1%) comparado con SAVR. Así pues, tanto el estado funcional como la calidad de vida a los 30 días fueron mejores entre pacientes TAVI.
En lo que respecta a los hallazgos ecocardiográficos, aunque la FPV moderada/grave fue similar en los 2 grupos, TAVI arrojó índices mucho más altos de FPV leve que la cirugía (del 28,7% frente al 2,9%). Habría que señalar que se desconoce el impacto que tienen las FPV leves en los resultados a largo plazo de pacientes más jóvenes. Además, los pacientes TAVI presentaban áreas valvulares aórticas medias más bajas y gradientes transvalvulares más altos a los 30 días que los pacientes SAVR (1,7 frente a 1,8 cm2 y 12,8 frente a 11,2 mmHg, respectivamente). Este hallazgo no descrito en ninguno de los anteriores ensayos PARTNER probablemente se deba al mayor uso de bioprótesis más grandes en el grupo quirúrgico (el 80% de las prótesis medían ≥ 23 mm). No obstante, todavía está por ver si la mayor área valvular del grupo quirúrgico se traducirá en beneficios hemodinámicos o clínicos en un seguimiento a más largo plazo. Cabe destacar que, en el ensayo Evolut Low Risk, a los 12 meses los pacientes sometidos a TAVI con una prótesis valvular supraanular autoexpandible presentaron gradientes valvulares aórticos más bajos (8,6 frente a 11,2 mmHg) y áreas efectivas del orificio más grandes (2,3 frente a 2,0 cm2) que los pacientes del grupo quirúrgico.
Tabla 1. Resumen de las características basales y resultados de pacientes con estenosis valvular aórtica inscritos en los ensayos aleatorizados PARTNER 3 y Evolut Low Risk
| PARTNER 3 | Evolut Low Risk | |||||
|---|---|---|---|---|---|---|
| TAVI (n = 496) | SAVR (n = 454) | Efecto del tratamiento [IC95%] | TAVI (n = 725) | SAVR (n = 678) | Diferencia [IC95%] | |
| Características basales | ||||||
| Edad (años) | 73,3±5,8 | 73,6±6,1 | – | 74,1±5,8 | 74,1±5,8 | – |
| Puntuación en la escala STS (%) | 1,9±0,7 | 1,9±0,6 | – | 1,9±0,7 | 1,9±0,7 | – |
| Sexo varón (%) | 67,5 | 71,1 | – | 64,0 | 66,2 | – |
| FEVI media (%) | 65,7±9,0 | 66,2±8,6 | – | 61,7±7,9 | 61,9±7,7 | – |
| Clase III-IV según NYHA (%) | 31,2 | 23,8 | – | 25,1 | 28,4 | – |
| Objetivo primario | ||||||
| Mortalidad por cualquier causa, accidente cerebrovascular o rehospitalizaciones por insuficiencia cardiaca al cabo de 1 año (%) | 8,5 | 15,1 | 0,54 [0,37-0,79] | – | – | – |
| Mortalidad por cualquier causa o accidente cerebrovascular discapacitante al cabo de 2 años (%) | – | – | – | 5,3 | 6,7 | –1,4 [–4,9- 2,1] |
| Resultados a 30 días | ||||||
| Mortalidad por cualquier causa (%) | 0,4 | 1,1 | 0,37 [0,07-1,88] | 0,5 | 1,3 | –0,8 [–1,9- 0,2] |
| Mortalidad cardiaca (%) | 0,4 | 0,9 | 0,46 [0,08-2,49] | 0,5 | 1,3 | –0,8 [–1,9- 0,2] |
| Accidente cerebrovascular discapacitante (%) | 0 | 0,4 | ND | 0,5 | 1,7 | –1,2 [–2,4- -0,2] |
| Hemorragia mayor o con peligro para la vida (%) | 1,2 | 11,9 | 0,09 [0,04-0,22] | 2,4 | 7,5 | –5,1 [–7,5- -2,9] |
| Complicaciones vascular mayores (%) | 2,2 | 1,5 | 1,44 [0,56-3,73] | 3,8 | 3,2 | 0,6 [–1,4- 2,5] |
| Daño renal agudo en fase II-III (%) | 0,4 | 1,8 | ND | 0,9 | 2,8 | –1,8 [–3,4- –0,5] |
| Fibrilación auricular de nueva aparición (%) | 5,0 | 39,5 | 0,10 [0,06-0,16] | 7,7 | 35,4 | –27,7 [–31,8- –23,6] |
| Implante de un nuevo marcapasos (%) | 6,5 | 4,0 | 1,66 [0,93-2,96] | 17,4 | 6,1 | 11,3 [8,0-14,7] |
| Fuga paravalvular moderada/grave (%) | 0,8 | 0 | ND | 3,4 | 0,4 | – |
| Área valvular aórtica media (cm2) | 1,7±0,02 | 1,8±0,02 | –0,1 [–0,1- 0] | 2,2±0,06 | 2,0±0,06 | – |
| Gradiente valvular aórtico medio (mmHg) | 12,8 | 11,2 | 1,5 [0,9-2,0] | 3,4 | 0,4 | – |
| Resultados a 1 año | ||||||
| Mortalidad por cualquier causa (%) | 1,0 | 2,5 | 0,41 [0,14-1,17] | 2,4 | 3,0 | –0,6 (–2,6-1,3) |
| Mortalidad cardiaca (%) | 0,8 | 2,0 | 0,40 [0,12-1,30] | 1,7 | 2,6 | –0,9 (−2,7- 0,7) |
| Accidente cerebrovascular discapacitante (%) | 0,2 | 0,9 | 0,22 [0,03-2,00] | 0,8 | 2,4 | –1,6 (–3,1- –0,3) |
| Rehospitalizaciones por insuficiencia cardiaca (%) | 7,3 | 11,0 | 0,65 [0,42-1,00] | 3,2 | 6,5 | –3,4 (–5,9- –1,0) |
|
FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; NYHA: New York Heart Association; SAVR: recambio valvular aórtico quirúrgico; STS: Society of Thoracic Surgeons; TAVI: implante transcatéter de prótesis valvular aórtica. |
||||||
La principal limitación de estos estudios es que el seguimiento a corto plazo no responde a la incógnita de la durabilidad de la prótesis valvular del TAVI, algo de importancia capital cuando tratamos sujetos más jóvenes de bajo riesgo. Sorprende que los datos disponibles a largo plazo (seguimiento de hasta 8 años)13,14 no parecen revelar signo alguno de deterioro valvular precoz. Aunque esto sigue siendo motivo de preocupación para muchos médicos, hemos de decir que muchas de las bioprótesis quirúrgicas que se utilizan hoy en día en todo el mundo tienen incluso menos datos a largo plazo que los disponibles para las percutaneas. Para abordar esta cuestión, el protocolo del estudio incluye una evaluación anual de hasta 10 años, al menos, después del primer procedimiento, que, finalmente, arrojará luz sobre el rendimiento hemodinámico a largo plazo (en lo que a la disfunción de la válvula bioprotésica y las tasas de fracaso se refiere) de las válvulas cardiacas percutáneas y quirúrgicas. Por si esto fuera poco, un subanálisis mediante angiografía por tomografía computarizada del ensayo PARTNER 3 analizará la disfunción válvula-velos y la trombosis valvular asintomática. Sobre esta cuestión, al cabo de 1 año, cinco pacientes del grupo TAVI y un único paciente del grupo quirúrgico presentaban evidencias indicativas de trombosis valvular.
Cabe destacar que los hallazgos de estos estudios no deben extrapolarse a todos los pacientes con EAo de bajo riesgo quirúrgico. Por ejemplo, los pacientes con válvula aórtica bicúspide, representativos de una porción importante de sujetos más jóvenes con EAo, fueron excluidos del análisis principalmente por problemas relacionados con la presencia de un anillo elíptico o calcificaciones asimétricas de los velos que, posiblemente, acarrearon la expansión excéntrica de la prótesis e índices más altos de FPV y riesgo de rotura anular)15,16. En un reciente análisis de emparejamiento por puntuación de la propensión del registro STS/TVT, el procedimiento TAVI en válvula bicúspide frente a tricúspide se asoció a un mayor riesgo de lesión aórtica y de conversión a cirugía a corazón abierto (si bien la tasa global fue < 1,0%), aunque la supervivencia a los 30 días y 1 año fue parecida. Llegados a este punto, es necesario realizar un ensayo aleatorizado y dedicado de pacientes con EAo bicúspide. Estos estudios también excluyeron a pacientes con vías transfemorales no aptas, EAo con gradiente y flujo bajos, enfermedad arterial coronaria grave (puntuación en la escala SYNTAX > 32) y ausencia de síntomas17. Por último, los pacientes reclutados fueron intervenidos por operadores experimentados en centros que habitualmente gestionan volúmenes altos de casos. En este sentido, los bajos índices de eventos descritos podrían no ser reproducibles en centros más pequeños con médicos menos experimentados.
Los estudios PARTNER 3 y Evolut Low Risk tendrán profundas implicaciones para la práctica clínica y, con toda probabilidad, generarán una indicación clase I de TAVI, también, en sujetos de bajo riesgo en las guías de práctica clínica internacionales de próxima publicación. Las opciones de tratamiento en pacientes con EAo asintomática grave ya no deberían basarse, solo, en el riesgo quirúrgico sino en consideraciones clínicas y anatómicas y en la propia preferencia de los pacientes. A menos que haya una característica anatómica clara que decante la balanza a favor del procedimiento SAVR (como, por ejemplo, una válvula aórtica bicúspide, una puntuación alta en la escala SYNTAX o un abordaje transfemoral inviable), a partir de ahora cada paciente que vaya a someterse a una intervención SAVR con una válvula bioprotésica, deberá ser informado de la posibilidad de optar por el procedimiento TAVI. Quizá dentro de no mucho tiempo, el implante transcatéter de prótesis valvular aórtica se convierta en el tratamiento preferido para la mayoría de pacientes con EAo y provoque el largamente esperado cambio de paradigma: en lugar de preguntarnos si un paciente es candidato a un procedimiento TAVI, tendremos que justificar que es candidato a la cirugía. Habrá que esperar a los datos de durabilidad a largo plazo, pero parece que la intervención SAVR va camino de convertirse en una especie en peligro de extinción.
CONFLICTO DE INTERESES
G. Tarantini ha recibido remuneración económica por su labor como conferenciante de Edwards Lifesciences, Medtronic, Boston Scientifics, Abbott. L. Nai Fovino no declaró conflicto de interés alguno en relación con este artículo.
BIBLIOGRAFÍA
1. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
2. Popma JJ, Adams DH, Reardon MJ, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63:1972-1981.
3. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
4. Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
5. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
6. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
7. Thourani VH, Kodali S, Makkar RR, et al. Transcatheter aortic valve replacement versus surgical valve replacement in intermediate-risk patients:a propensity score analysis. Lancet. 2016;387:2218-2225.
8. Tarantini G, Nai Fovino L, Gersh BJ. Transcatheter aortic valve implantation in lower-risk patients:what is the perspective?Eur Heart J. 2018;39:658-666.
9. Tarantini G, Lefèvre T, Terkelsen CJ, et al. One-Year Outcomes of a European Transcatheter Aortic Valve Implantation Cohort According to Surgical Risk. Circ Cardiovasc Interv. 2019;12:e006724.
10. Mack MJ, Leon MB, Thourani VH, et al.;PARTNER 3 Investigators. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
11. Popma JJ, Deeb GM, Yakubov SJ, et al.;Evolut Low Risk Trial Investigators. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
12. Nai Fovino L, Badawy MRA, Fraccaro C, et al. Transfemoral aortic valve implantation with new-generation devices:the repositionable Lotus versus the balloon-expandable Edwards Sapien 3 valve. J Cardiovasc Med (Hagerstown). 2018;19:655-663.
13. Barbanti M, Costa G, Zappulla P, et al. Incidence of Long-Term Structural Valve Dysfunction and Bioprosthetic Valve Failure After Transcatheter Aortic Valve Replacement. J Am Heart Assoc. 2018;7:e008440.
14. Tarantini G, Purita PAM, D'Onofrio A, et al. Long-term outcomes and prosthesis performance after transcatheter aortic valve replacement:results of self-expandable and balloon-expandable transcatheter heart valves. Ann Cardiothorac Surg. 2017;6:473-483.
15. Tarantini G, Basso C, Fovino LN, Fraccaro C, Thiene G, Rizzo S. Left ventricular outflow tract rupture during transcatheter aortic valve implantation:anatomic evidence of the vulnerable area. Cardiovasc Pathol. 2017;29:7-10.
16. Tarantini G, Fabris T, Cardaioli F, Nai Fovino L. Coronary access after transcatheter aortic valve replacement in bicuspid aortic valve:lights and shades. JACC Cardiovasc Interv. 2019. http://doi.org/10.1016/j.jcin.2019.03.031.
17. Tarantini G, Nai Fovino L, Tellaroli P, Fabris T, Iliceto S. Asymptomatic Severe Aortic Stenosis and Noncardiac Surgery. Am J Cardiol. 2016;117:486-488.