La enfermedad coronaria (EC) es una de las principales causas de muerte en todo el mundo. Y en el futuro, su incidencia se va a ver espoleada por la cada vez mayor prevalencia de la obesidad, la diabetes y el síndrome metabólico.
La patogénesis de la ateroesclerosis, principal causa de la EC, ha sido objeto de gran interés1. En una breve revisión parece evidente que la dislipemia tiene un papel primordial que empieza por la incorporación de lipoproteínas séricas de baja densidad a la túnica íntima endotelial seguido de la atracción de macrófagos al interior de la pared arterial a través de las quimiocinas y las moléculas de adhesión endotelial. Finalmente, gotículas de colesterol pasan al citosol del macrófago, oxidándose y formando las llamadas «células espumosas». En un intercambio recíproco, los mediadores inflamatorios liberados por las células espumosas desencadenan daños endoteliales, fibrosis e hiperplasia intimal. Es entonces cuando la estenosis coronaria hace acto de presencia, una patología que es la base de la EC con la inflamación como elemento primordial.
Es probable que la inflamación tenga un papel en la EC estable e inestable. Aunque muchos pacientes presentan ateromas pequeños, sufren trombosis coronarias agudas tales como el síndrome coronario agudo. Estudios patológicos han demostrado que las células T, los macrófagos y los mastocitos se congregan en sitios de ruptura de la placa donde sobreexpresan las metaloproteinasas de matriz, degradan el colágeno y debilitan la cápsula fibrosa que soporta las placas. Además, una vez que el endotelio ha quedado expuesto a la placa tras una ruptura, estas células inflamatorias facilitan la trombosis y la formación de un tapón plaquetario. Los rastros de estos daños en los pacientes son unos niveles altos de interleucina 6 y proteína C reactiva en sangre1.
TRATAMIENTOS ANTI-INFLAMATORIOS DE LA EC
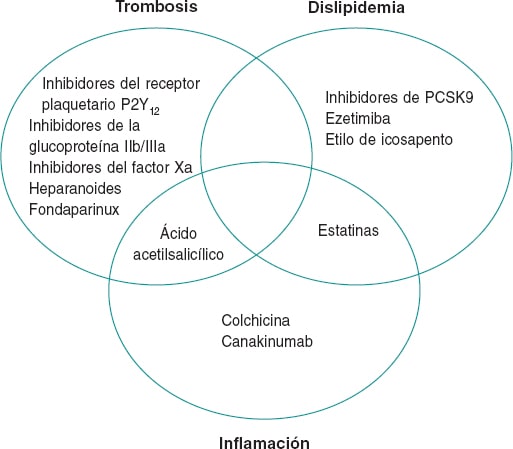
El papel principal de la inflamación en la EC ha llevado a descripciones de la ateroesclerosis como «la inflamación crónica de las arterias», un hecho ya confirmado por la ciencia desde la década de 19802. Aún así, décadas después, todavía no hay ningún tratamiento de la EC que actúe sobre las vías inflamatorias (figura 1). Muchos de los actuales tratamientos antiinflamatorios lo han intentado sin conseguirlo. Por ejemplo, los corticoides tienen un amplio abanico de propiedades antiinflamatorias, pero su promoción de la dislipidemia y la hipertensión termina por provocar aterogénesis. Los fármacos antiinflamatorios no esteroideos distintos del ácido acetilsalicílico inhiben la prostaciclina, que mejora el tono vascular y la agregación plaquetaria en las coronarias. El interés generado por el metotrexato procede de estudios observacionales que han confirmado sus propiedades cardioprotectoras en pacientes con artritis reumatoide. No obstante, un ensayo clínico aleatorizado que analizó su efecto en pacientes con ateroesclerosis reveló que no reduce los marcadores inflamatorios séricos ni evita el infarto de miocardio3.
Figura 1. Fundamentos terapéuticos en el manejo de la enfermedad coronaria. La figura muestra agentes con beneficios probados sobre la mortalidad en el tratamiento de la enfermedad coronaria. Aunque la trombosis, la dislipemia y la inflamación son claves en la patogénesis de la enfermedad coronaria, la falta de agentes anti-inflamatorios efectivos es evidente.
El canakinumab, un inhibidor de la interleucina-1b, fue el primer agente en prevenir, eficazmente, la ocurrencia de eventos cardiovasculares en pacientes que habían sufrido recientemente un infarto de miocardio. En el estudio CANTOS, la administración de canakinumab 150 mg 1 vez al día redujo los índices de infarto de miocardio no mortal, accidente cerebrovascular y mortalidad (hazard ratio [HR] = 0,85; intervalo de confianza del 95% [IC95%], 0,74-0,98) a costa de un índice más alto de sepsis mortal e infección (0,31 frente a 0,18 por cada 100 personas-años; p = 0,02). Este ensayo fue un importante avance científico que reveló que la hipótesis inflamatoria es una alternativa terapéutica en el manejo de la EC. En cualquier caso, los costes del tratamiento y el moderado efecto observado han limitado su uso4.
Al igual que ocurre con el metotrexato, el interés por la colchicina proviene de datos observacionales. En pacientes que sufren brotes de gota, el uso de colchicina se ha asociado a menos eventos cardiovasculares comparado con no usar este fármaco5. Estas observaciones dieron lugar al estudio aleatorizado no ciego de la colchicina LoDoCo (Dosis baja de colchicina para la prevención secundaria de la enfermedad cardiovascular) que confirmó un descenso de los eventos cardiovasculares en pacientes con EC estable6. Aunque con algunas limitaciones metodológicas, el estudio sirvió como nicho para nuevos y más sólidos datos clínicos sobre la colchicina.
La colchicina es un inhibidor de microtúbulos que podría ayudar a evitar la migración leucocitaria a sitios de formación y ruptura de la placa. También inhibe la formación del inflamasoma NLRP3, una estructura que se ha descubierto, recientemente, está implicada en la muerte celular mediada por las citoquinas. Estos complejos proteínicos proinflamatorios se activan mediante cristales de colesterol en los macrófagos y secretan interleucina (IL)-1b, la diana citoquínica del canakinumab. La colchicina también ha demostrado ser capaz de reducir la proteína C reactiva, la IL-1 y la IL-67.
Un estudio de seguimiento más extenso del ensayo LoDoCo, el LoDoCo2, inscribió a 5.522 pacientes con EC crónica y les aleatorizó para recibir colchicina o placebo durante una mediana de seguimiento de 28,6 meses tras un tras periodo de preinclusión abierto para garantizar la tolerabilidad a la colchicina. Esta se asoció a un descenso del 31% (HR = 0,69; IC95%, 0,57-0,83; p < 0,001) de la mortalidad cardiovascular, el infarto, el accidente cerebrovascular isquémico y la revascularización. En cambio, los pacientes que recibieron colchicina mostraron una incidencia más alta, aunque baja, de mortalidad no cardiovascular (HR = 1,51; IC95%, 0,99-2,31; p = 0,06)8. Otros eventos adversos e intolerancias fueron raros.
LA COLCHICINA EN EL SCA
Otros dos estudios han analizado el papel que juega la colchicina en el contexto de un infarto de miocardio reciente: el estudio COLCOT (Perfil de eficacia y seguridad de dosis bajas de colchicina tras infarto de miocardio) y el COPS (colchicina en pacientes con síndrome coronario agudo). El primero y más extenso de los dos, el estudio COLCOT, aleatorizó a 4.745 pacientes que habían sufrido un infarto de miocardio dentro de los 30 días siguientes a la administración de colchicina o placebo durante una mediana de seguimiento de 22,6 meses. Aquellos pacientes que recibieron colchicina experimentaron un descenso del 23% (HR = 0,77; IC95, 0,61-0,97; p = 0,02) en el objetivo compuesto de muerte cardiovascular, parada cardiorrespiratoria, accidente cerebrovascular isquémico, infarto y angina con necesidad de revascularización urgente. Aunque se trató de un resultado positivo, se debió principalmente a la presencia de menos revascularizaciones en el grupo que recibió colchicina. Además, los pacientes aleatorizados a recibir colchicina tuvieron más neumonías (0.9 frente al 0.4%; p = 0,03) que los que recibieron placebo9. La administración temprana de colchicina se asoció a mayores beneficios (al cabo de 3 días) en el estudio COLCOT (HR = 0,52; IC95%, 0,32-0,84 para un inicio a los 3 días frente a HR = 0,98; IC95%, 0,53-1,75 para inicios entre 4 y 7 días)10.
El estudio COPS inscribió a 795 pacientes que fueron aleatorizados para recibir colchicina o placebo durante 12 meses. Al cabo de 1 año, no se observó ninguna diferencia estadística en el objetivo compuesto de muerte cardiovascular, infarto, accidente cerebrovascular isquémico y parada cardiorrespiratorioa con la colchicina comparado con el placebo (HR = 0,65; IC95%, 0,38-1,09; p = 0,10), probablemente por la menor incidencia de eventos debido a un periodo corto de seguimiento y a una muestra de pequeño tamaño. Además, fallecieron 8 pacientes del grupo que recibió colchicina y 1 del que recibió placebo, un efecto que resultó significativo a nivel estadístico y que se debió a la mortalidad no cardiovascular (p = 0,047)11. Aunque este estudio inscribió a relativamente pocos pacientes, reprodujo una señal tendente a la mortalidad ya anunciada por el más extenso estudio LoDoCo2.
Se está llevando a cabo el mayor estudio jamás realizado hasta la fecha sobre la administración de colchicina tras infarto de miocardio, el estudio CLEAR SYNGERY (Colchicina y espironolactona en el IAM; NCT03048825). Este estudio aleatorizará a 7.000 pacientes y ayudará a esclarecer si la colchicina aumenta la mortalidad no cardiovascular. Los hallazgos de los estudios COPS y LoDoCo2 podrían terminar siendo espurios, algo similar a lo ocurrido con los primeros estudios sobre estatinas, que terminaron siendo desmentidos. Por otro lado, la colchicina podría tener un impacto importante, que se habría pasado por alto, al reducir las defensas del huésped.
Quizá nos encontremos ante el primer tratamiento antiinflamatorio barato y ampliamente disponible (la colchicina) para el tratamiento de la EC. No obstante, el problema de la mortalidad no cardiovascular debe resolverse previo a una adopción generalizada de este fármaco.
FINANCIACIÓN
Los autores no recibieron ninguna financiación durante la realización de este estudio.
CONFLICTO DE INTERESES
S.S. Jolly declar financiación de Boston Scientific y de los Institutos Canadienses de Investigación en Salud. W. Hijazi no declara ningún conflicto de intereses.
BIBLIOGRAFÍA
1. Bouabdallaoui N, Tardif JC, Waters DD, et al. Time-to-treatment initiation of colchicine and cardiovascular outcomes after myocardial infarction in the Colchicine Cardiovascular Outcomes Trial (COLCOT). Eur Heart J. 2020;41:4092-4099.
2. Butt AK, Cave B, Maturana M, Towers WF, Khouzam RN. The Role of Colchicine in Coronary Artery Disease. Curr Probl Cardiol. 2021;46:100690.
3. Hansson GK. Inflammation, Atherosclerosis, and Coronary Artery Disease. N Engl J Med. 2005;352:1685-1695.
4. Nabel EG, Braunwald E., 2012. A Tale of Coronary Artery Disease and Myocardial Infarction. N Engl J Med. 2012;366:54-63.
5. Nidorf SM, Eikelboom JW, Budgeon CA, Thompson PL. Low-Dose Colchicine for Secondary Prevention of Cardiovascular Disease. J Am Coll Cardiol. 2013;61:404-410.
6. Nidorf SM, Fiolet ATL, Mosterd A, et al.;LoDoCo2 Trial Investigators. Colchicine in Patients with Chronic Coronary Disease. N Engl J Med. 2020;383:1838-1847.
7. Ridker PM, Everett BM, Pradhan A, et al.;CIRT Investigators. Low-Dose Methotrexate for the Prevention of Atherosclerotic Events. N Engl J Med. 2019;380:752-762.
8. Ridker PM, Everett BM, Thuren T, et al.;CANTOS Trial Group Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377:1119-1131.
9. Solomon D, Liu CC, Kuo IH, Zak A, Kim SC. Effects of colchicine on risk of cardiovascular events and mortality among patients with gout:a cohort study using electronic medical records linked with Medicare claims. Ann Rheum Dis. 2016;75:1674-1679.
10. Tardif JC, Kouz S, Waters DD, et al. 2019. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med. 2019;381:2497-2505.
11. Tong DC, Quinn S, Nasis A, et al. 2020. Colchicine in Patients With Acute Coronary Syndrome. Circulation. 2020;142:1890-1900.