RESUMEN
Introducción y objetivos: La importancia de la inflamación en la patogénesis de la enfermedad coronaria, así como tras la angioplastia percutánea, es un fenómeno reconocido. Sin embargo, el efecto de la colchicina para atenuar la inflamación tras la intervención coronaria percutánea se desconoce. Este metanálisis investigó la eficacia de la colchicina en pacientes que se sometieron a intervención coronaria percutánea con el objetivo de prevención secundaria
Métodos: Se revisaron las bases de datos Web of Science, PubMed, OVID MEDLINE, Embase, Cochrane Central Register of Controlled Trials y ClinicalTrials.gov, y se analizaron los datos de los estudios que investigaban la eficacia de la colchicina en pacientes que se sometieron a angioplastia coronaria percutánea, usando un modelo de efectos aleatorios.
Resultados: En 13 estudios, que incluyeron un total de 7.414 pacientes, no se observó ninguna diferencia entre los tratados con colchicina y los no tratados con colchicina en cuanto a mortalidad por cualquier causa (OR = 1,1; IC95%, 0,72-1,56; I2 = 0%), mortalidad por causa cardiovascular (OR = 0,98; IC95%, 0,42-2,28; I2 = 14,2%), infarto de miocardio (OR = 0,84; IC95%, 0,65-1,08; I2 = 1,4%) y revascularización coronaria (OR = 0,64; IC95%, 0,28-1,42; I2 = 49,3%). Sin embargo, los pacientes tratados con colchicina mostraron un menor riesgo de accidente vascular cerebral (OR = 0,33; IC95%, 0,15-0,72; I2 = 0%).
Conclusiones: Agregar colchicina a la terapia medica estándar en pacientes sometidos a angioplastia coronaria percutánea no modificó la mortalidad por cualquier causa, la mortalidad por causa cardiovascular ni la revascularización coronaria, pero si mostró una tendencia a un menor riesgo de infarto de miocardio y un menor riesgo significativo de accidente vascular cerebral.
Palabras clave: Enfermedad coronaria. Angioplastia percutánea. Inflamación. Colchicina.
ABSTRACT
Introduction and objectives: The role of inflammation in the pathogenesis of coronary artery disease, and that resulting from percutaneous coronary intervention (PCI) is increasingly recognized, yet the effect of colchicine in attenuating peri-PCI inflammation remains unknown. This meta-analysis investigated the efficacy of colchicine in patients undergoing PCI for secondary prevention of coronary artery disease.
Methods: The Web of Science, PubMed, Ovid MEDLINE, Embase, Cochrane Central Register of Controlled Trials and ClinicalTrials.gov databases were searched. Data on studies assessing the efficacy profile of colchicine in patients undergoing PCI were pooled using a random-effects model.
Results: In 13 studies of 7414 patients, no differences were observed between patients treated with colchicine compared to those without for all-cause mortality (OR, 1.1; 95%CI, 0.72-1.56; I2 = 0%), cardiovascular mortality (OR, 0.98; 95%CI, 0.42-2.28; I2 = 14.2%), myocardial infarction (OR, 0.84; 95%CI, 0.65-1.08; I2 = 1.4%) or coronary revascularization (OR, 0.64; 95%CI, 0.28-1.42; I2 = 49.3%). However, patients treated with colchicine had a lower risk of stroke (OR, 0.33; 95%CI, 0.15-0.72; I2 = 0%).
Conclusions: Adding colchicine to standard medical therapy in patients undergoing PCI did not decrease all-cause mortality, cardiovascular mortality or urgent revascularization. However, it showed a trend towards a lower risk of myocardial infarction and a significantly lower risk of stroke.
Keywords: Coronary artery disease. Percutaneous coronary intervention. Inflammation. Colchicine.
Abreviaturas
ECA: estudio controlado aleatorio. IAMSEST: infarto agudo de miocardio sin elevación del segmento ST. ICP: intervención coronaria percutánea. IM: infarto de miocardio. SCA: síndrome coronario agudo.
INTRODUCCIÓN
A pesar de que cada vez hay más tratamientos preventivos primarios y secundarios, los eventos coronarios siguen siendo la principal causa de morbimortalidad en todo el mundo1,2. Los cambios en el estilo de vida (perder peso, seguir una dieta baja en sal, la deshabituación tabáquica), el tratamiento médico (regímenes antihipertensivos, reductores de los niveles lipídicos, de glucosa y antitrombóticos) y la revascularización coronaria mediante intervención coronaria percutánea (ICP) y cirugía de revascularización coronaria (CABG) son el abordaje multifacético de esta enfermedad. No obstante, a pesar de los avances hechos en este abordaje multimodal, la morbimortalidad cardiovascular sigue siendo alta.
Más recientemente, el papel central que juega la inflamación en la patogénesis de la enfermedad coronaria secundaria a la formación de placa aterosclerótica por síndrome coronario agudo (SCA) y la propia ICP han sido objeto de un interés cada vez mayor. La colchicina, un agente anti-inflamatorio indicado en patologías inflamatorias múltiples tales como la pericarditis, la gota y la fiebre mediterránea familiar ha ido ganando enteros como potencial atenuador de la inflamación aterosclerótica. Este fármaco inhibe la polimerización de la tubulina y, finalmente, reduce la activación de ciertas células del sistema inmune y la respuesta inflamatoria3,4. Evidencias recientes sugieren, además, que la colchicina es beneficiosa en el tratamiento de eventos cardiovasculares en pacientes con signos clínicos de enfermedad coronaria5. No obstante, el impacto que tiene entre los pacientes durante el periodo peri-ICP sigue siendo un tema controvertido.
Ensayos recientes han empezado a explorar los efectos de la colchicina en el contexto de la ICP, aunque con resultados contradictorios. En el estudio Colchicine-PCI de pacientes con síndrome coronario agudo sin elevación del segmento ST, la administración de colchicina inmediatamente antes y después de la ICP se tradujo en niveles más bajos de interleucina 6 y proteína C reactiva de alta sensibilidad (PCRas) a las 24 horas, pero no en un menor número de lesiones miocárdicas asociadas a la ICP6. El estudio COPE-ICP realizado después de este confirmó que administrada entre 6 y 24 horas antes de la ICP, la colchicina, de hecho, sí redujo las lesiones miocárdicas asociadas a la ICP en una población de pacientes con angina estable e infarto agudo de miocardio sin elevación del segmento ST (IAMSEST)7. En cualquier caso, el estudio COVERT-MI publicado más recientemente8 no halló ninguna diferencia en el tamaño del infarto ni en remodelado del ventrículo izquierdo en las imágenes obtenidas mediante resonancia magnética cardiaca en pacientes a tratamiento con colchicina frente a pacientes no tratados con este agente.
Estos estudios individuales podrían, no obstante, no ofrecer un análisis dotado de la potencia estadística necesaria, sobre todo, en eventos de bajo riesgo como los accidentes cerebrovasculares o en cuestiones como el impacto que tiene la colchicina, en materia de prevención secundaria, en los pacientes durante el periodo peri-ICP, lo cual sugeriría la necesidad de realizar una valoración sistemática y un metanálisis tanto de la calidad de la evidencia obtenida como de los efectos del tratamiento en los eventos cardiovasculares adversos mayores.
MÉTODOS
Protocolo
El proceso de búsqueda de este metanálisis se basó en la guía de publicación de la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) y está registrado como PROSPERO (CRD42021247704). Se trata de un metanálisis que no requirió aprobación específica del comité ético al utilizar resultados publicados en anteriores estudios. Toda la información relevante está contenida en los estudios incluidos. El autor de correspondencia tuvo acceso ilimitado a todos los datos, así como la responsabilidad final sobre la decisión de enviar, o no, el manuscrito para su publicación. Los datos que avalan los hallazgos de este estudio están disponibles gracias al autor de correspondencia bajo petición motivada.
Estrategia de búsqueda
Se realizó una búsqueda integral en la literatura médica existente de todos los estudios publicados (retrospectivos, observacionales y controlados aleatorizados) disponibles en Web of Science, Embase, PubMed, Ovid MEDLINE, Cochrane Central Register of Controlled Trials (CENTRAL) y ClinicalTrials.gov (empezando el 23 de agosto de 2021, sin restricciones lingüísticas. Este metanálisis no incluyó casos clínicos, cartas al editor, revisiones ni capítulos de libros. Las palabras clave empleadas en la búsqueda fueron ‘colchicina,’ ‘enfermedad coronaria,’ ‘coronariopatía,’ ‘angina,’ ‘infarto de miocardio,’ ‘infarto agudo de miocardio,’ ‘isquemia miocárdica,’ ‘síndrome coronario agudo,’ ‘cardiopatía isquémica,’ ‘intervención coronaria percutánea,’ ‘angioplastia transluminal percutánea,’ ‘revascularización coronaria percutánea’ y ‘revascularización miocárdica’ incluidos sus subtítulos, términos MeSH y todos los sinónimos. También se hizo un cribado de la bibliografía de cada uno de los estudios seleccionados (la estrategia de búsqueda detallada se puede consultar en el material adicional). EL proceso de búsqueda se participó según la guía de publicación de la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA).
Criterios de selección
Los estudios fueron aptos si incluían cualquiera de los siguientes criterios a) comparaban la eficacia del tratamiento con colchicina a cualquier dosis y con cualquier duración al tratamiento médico estándar con o sin placebo; b) incluían poblaciones de pacientes tratados de ICP con independencia de la indicación y c) participaban, como mínimo, 1 de los siguientes resultados cardiovasculares: mortalidad cardiovascular, mortalidad por cualquier causa, infarto de miocardio (IM), accidente cerebrovascular o revascularización coronaria urgente. La selección de los estudios corrió a cargo de 2 revisores independientes (C.E. Soria Jiménez y J. Chang), primero, cribando títulos y resúmenes y luego revisando textos completos y sus referencias bibliográficas correspondientes. En caso de desacuerdo sobre la elegibilidad de los estudios, un tercer revisor (H.M. García-García) valoraba la discrepancia y las decisiones terminaban alcanzándose por consenso.
Recopilación de datos y objetivos de los estudios
Dos revisores independientes (C.E. Soria Jiménez y F. Hayat) dispusieron y organizaron los datos sobre las características de los estudios, de los pacientes y los índices de episodios de los objetivos en una base de datos estructurada y, luego, procedieron a compararla. Todas las discrepancias provocaron la re-evaluación de los datos primarios y la valoración de un tercer revisor (H.M. García García). Todos los desacuerdos existentes se resolvieron por consenso.
Objetivos
El objetivo primario preespecificado fue la mortalidad por cualquier causa. Los objetivos clínicos secundarios fueron la mortalidad cardiovascular, el IM, el accidente cerebrovascular y cualquier revascularización. Cada objetivo se valoró según las definiciones dadas en los protocolos originales de los estudios (resumido en la tabla 1 del material adicional).
Riesgo de sesgo
El riesgo de sesgo de cada estudio se valoró empleando las herramientas Riesgo de Sesgo de Cochrane (RoB 2.0) para ensayos controlados aleatorizados (ECA) y Riesgo de Sesgo en Estudios no aleatorizados del Manual Cochrane de revisiones sistemáticas de intervenciones (ROBINS-I) para estudios observacionales. Dos investigadores (C.E. Soria Jiménez y J. Sanz Sánchez) valoraron independientemente 5 dominios de sesgo en los ECA: (1) proceso de aleatorización, (2) desviaciones de las intervenciones pretendidas, (3) datos de resultados faltantes, (4) medición de los resultados y (5) selección de los resultados participados. Estos mismos investigadores valoraron, también, 7 dominios de sesgo en los estudios observacionales: (1) factores de confusión, (2) selección de los participantes, (3) clasificación de las intervenciones, (4) desviaciones de las intervenciones pretendidas (5) datos de resultados faltantes, (6) medición de los resultados y (7) selección de los resultados participados (tabla 2 y 3 del material adicional).
Análisis estadístico
Tanto los odds ratios (OR) como los intervalos de confianza del 95% (IC95%) se valoraron empleando el modelo de efectos aleatorios de DerSimonian-Laird empleándose el método Mantel-Haenszel para calcular la heterogeneidad. La presencia de heterogeneidad entre los distintos estudios se valoró empleando el estadístico Q de Cochran referido a la distribución de la X2 (Valores p ≤ 0,10 se consideraron significativos a nivel estadístico) más el estadístico I2 para valorar las inconsistencias. Los valores iguales a 0% fueron indicativos de ausencia de heterogeneidad y los valores ≤ 25, ≤ 50 y > 50% de heterogeneidad baja, moderada y alta, respectivamente. La presencia de sesgo de publicación se investigó empleando la prueba de Harbord y estimación visual con diagramas de bosque. Se realizó un análisis de sensibilidad dejando 1 fuera para todos los resultados retirando, iterativamente, 1 estudio cada vez para confirmar que nuestros hallazgos no estaban vinculados a 1 único estudio. Para dar cuenta de las diferentes duraciones del seguimiento de los distintos estudios, se realizó otro análisis de sensibilidad empleando 1 modelo de regresión de Poisson con efectos aleatorios de las intervenciones para calcular las medias mediante ponderación por la inversa de la varianza de las razones de tasas de incidencia estratificadas específicas de cada estudio. Los resultados se expresaron como razones de tasas de incidencia que son coeficientes exponenciales del modelo de regresión.
Se realizó un análisis de metarregresión empleando el método empírico bayesiano para calcular la varianza interestudio tau2 y valorar el efecto de la dosis de colchicina, la duración del seguimiento, el porcentaje de pacientes con SCA y el porcentaje de pacientes con diabetes mellitus sobre los efectos del tratamiento en el objetivo primario.
Los valores de p bilateral < 0,05 se consideraron estadísticamente significativos. Los análisis estadísticos se realizaron empleando el software Stata, versión 13.1 (StataCorp LP, College Station, Estados Unidos).
RESULTADOS
Resultados de la búsqueda
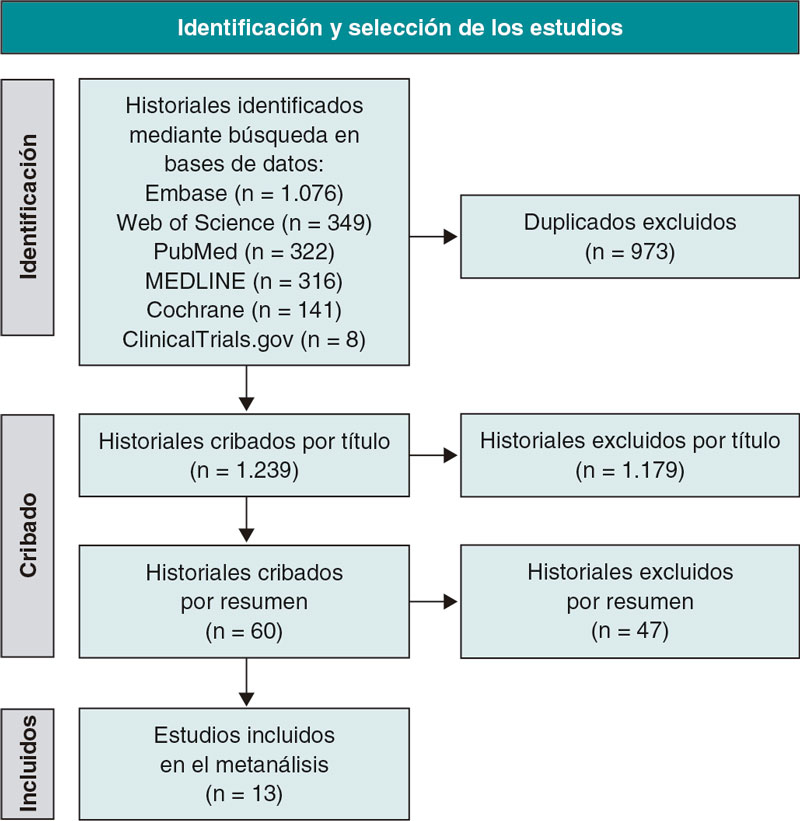
La figura 1 muestra tanto la búsqueda del estudio PRISMA como el proceso de selección. De 1.239 publicaciones se identificaron un total de 12 ECA5-16 y 1 estudio observacional17 que son las que se incluyeron, finalmente en este análisis. Nos pusimos en contacto con el autor para correspondencia del estudio COOL15 para que facilitase datos de una serie de pacientes tratados de ICP; 58 de un total de 80 pacientes evaluados (72,5%) fueron tratados de ICP. Al final, el estudio sí cumplió nuestros criterios de inclusión y fue incorporado a nuestro análisis. Las principales características de los estudios incluidos se muestran en la tabla 1. Los datos sobre los resultados, la mortalidad, los IM, los accidentes cerebrovasculares y las revascularizaciones urgentes se participaron en 12, 9, 5 y 6 estudios, respectivamente. Se incluyó a un total de 3.741 y 3.673 pacientes tratados con y sin colchicina, respectivamente (para un total de 7.414 pacientes). El tiempo transcurrido desde la ICP hasta el inicio de la colchicina fue inmediatamente antes de la ICP hasta 13,5 días después se muestra en la tabla 1.
Figura 1. Diagrama de flujo de la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) de los resultados de las búsquedas en las diferentes bases de datos y selección de los estudios.
Tabla 1. Características de los estudios seleccionados
| Estudio/Autor | Año | Diseño de los estudios | Multicéntrico | Pacientes (n) | Población | Dosis y duración de la colchicina | Tiempo transcurrido desde la ICP hasta el inicio de la colchicina | Seguimiento |
|---|---|---|---|---|---|---|---|---|
| COVERT-MI8 | 2021 | ECA | Sí | 192 | Adultos con un IAMCEST índice derivados para recibir una ICP primaria o de rescate | Dosis de carga (2 mg) por vía oral seguida de 1 dosis oral diaria de 0,5 mg 2 veces/día durante 5 días | Dosis de carga inmediatamente antes de la ICP, si no es posible, inmediatamente después | 3 meses |
| COPE-PCI7 | 2021 | ECA | No | 75 | Adultos con angina estable o IAMSEST tratados de angiografía e ICP | 1 mg seguido de 0,5 mg 1 hora después y entre 6 y 24 horas pre-ICP | Entre 6 y 24 horas antes de la coronariografía | 1 día |
| Colchicine-PCI6 | 2020 | ECA | No | 400 | Adultos con sospecha de cardiopatía isquémica o SCA derivados para recibir una angiografía con posible ICP | 1,2 mg entre 1 y 2 horas pre-angiografía, 0,6 mg 1 hora después o inmediatamente después de la intervención en caso de angiografía urgente | Entre 1 y 2 horas antes de la coronariografía | 1 mes |
| COPS9 | 2020 | ECA | Sí | 795 | Adultos con SCA y evidencias de EC tratados de angiografía con ICP o tratamiento médico | 0,5 mg 2 veces/día durante 1 mes, luego 0,5 mg día durante 11 meses | Inmediatamente después de la ICP y la aleatorización | 13,2 meses |
| LoDoCo-MI10 | 2019 | ECA | No | 237 | Adultos víctimas de IM tipo 1 durante los últimos 7 días | 0,5 mg día durante 30 días | 1,5 días después del IM índice | 1 mes |
| Talasaz11 | 2019 | ECA | No | 196 | Adultos que debutaron con IAMCEST tratados de ICP | ND | ND | 1 mes |
| COLCOT I5 | 2019 | ECA | Sí | 4745 | Adultos víctimas de IM los últimos 30 días con algún tipo de revascularización coronaria completada | 0,5 mg 1 vez/día durante, como mínimo, 2 años | 13,5 días | 42 meses |
| Vaidya17 | 2018 | Observacional | No | 80 | Adultos que debutaron con SCA < 1 mes antes tratados de coronariografía invasiva y revascularizados según indicación | 0,5 mg 1 vez/día durante 1 año | ND (< 1 mes desde el SCA según criterios de inclusión) | 12,6 meses |
| COLIN12 | 2017 | ECA (De etiqueta abierta) | No | 44 | Adultos ingresados por IAMCEST con oclusión de 1 de las principales coronarias tratados de ICP | 1 mg 1 vez/día durante 1 mes | El primer día del IAM | 1 mes |
| Deftereos 201513 | 2015 | ECA (Piloto) | Sí | 151 | Adultos ingresados por IAMCEST de ≤ 12 horas de evolución desde que el paciente cursa dolor tratados de ICP | Dosis de carga de 2 mg, 0.5 mg 2 veces/día durante 5 días | Inmediatamente después de haber realizado la coronariografía diagnóstica | 5 días |
| Deftereos 201314 | 2013 | ECA | No | 222 | Adultos con diabetes con edades comprendidas entre los 40 y 80 años tratados de ICP con stents metálicos | 0,5 mg 2 veces/día durante 6 meses | Dentro de las primeras 24 horas desde la realización de la ICP índice | 6 meses |
| COOL15 | 2012 | ECA | No | 80 | Adultos con SCA o accidente cerebrovascular isquémico agudo | 1 mg 1 vez/día durante 30 días | Inmediatamente después de la aleatorización | 1 mes |
| O’Keefe16 | 1992 | ECA | No | 197 | Adultos tratados de angioplastia electiva (en 1 única coronaria o multivaso, lesiones de nueva aparición o reestenóticas) para angina silente, estable o inestable; CABG | 0,6 mg 2 veces/día durante 6 meses | En algún momento entre 12 antes y 24 horas después de la angioplastia con balón | 6 meses |
|
CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; ECA: ensayo controlado aleatorizado; IAMCEST: infarto agudo de miocardio sin elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; IM: infarto de miocardio; ND: no disponible; SCA: síndrome coronario agudo. |
||||||||
Características basales
Las principales características basales de los pacientes incluidos se muestran en la tabla 2. La mayoría de los pacientes incluidos eran varones con una media de edad de 60 años, con SCA y revascularizados con stents farmacoactivos.
Tabla 2. Características basales de los pacientes de cada estudio
| Estudio/Autor | Media de edad | Varones (%) | SCA (%) | SFA (%) | HTN (%) | DM2 (%) | HLD (%) | IM previo (%) | ICP previa (%) | CABG previa (%) | Tratados de ICP (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| COVERT-MI8 | 60 | 80,3 | 100 | 95,7 | 30,8 | 13,1 | 33,1 | 0 | 0 | 0 | 93 |
| COPE-PCI7 | 64,7 | 71,5 | 58,7 | 97,0 | 54,5 | 22,9 | 63,5 | 17,5 | 16,0 | ND | 100 |
| Colchicine-PCI6 | 66,3 | 93,5 | 49,5 | ND | 91,7 | 57,8 | 88,8 | 25,8 | 37,6 | ND | 100 |
| COPS9 | 59,9 | 79,5 | 100,0 | ND | 50,5 | 19,0 | 46,0 | 15,0 | 13,0 | 4,5 | 88 |
| LoDoCo-MI10 | 61,0 | 77,0 | 100,0 | ND | 47,5 | 22,0 | ND | 15,0 | 11,5 | ND | 90 |
| Talasaz11 | ND | ND | 100,0 | ND | ND | ND | ND | ND | ND | ND | 100 |
| COLCOT I5 | 60,6 | 80,9 | 100,0 | ND | 51,1 | 20,2 | ND | 16,2 | 16,9 | 3,2 | 93 |
| Vaidya17 | 57,4 | 77,5 | 100,0 | ND | 53,8 | 31,3 | 85,0 | 51,3 | 63,8 | ND | 77,5 |
| COLIN12 | 59,9 | 79,4 | 100,0 | ND | 43,4 | 13,7 | 36,5 | ND | 4,6 | 2,4 | 100 |
| Deftereos 201513 | 58,0 | 69,0 | 100,0 | ND | 39,5 | 21,5 | 52,0 | 0,0 | ND | ND | 100 |
| Deftereos 201314 | 63,6 | 65,5 | 31,0 | 0 | 48,5 | 100,0 | ND | ND | ND | ND | 100 |
| COOL15 | 57,2 | 88,8 | 91,3 | ND | 42,5 | 16,3 | 47,5 | 17,5 | 0 | ND | 73 |
| O’Keefe16 | 60,5 | 86,0 | 39,5 | 0 | ND | 12,0 | ND | ND | ND | 25,5 | 100 |
|
CABG: cirugía de revascularización coronaria; DM2, diabetes mellitus tipo 2; HLD: hiperlipemia; HTN: hipertensión; ICP: intervención coronaria percutánea; IM: infarto de miocardio; ND: no disponible; SCA: síndrome coronario agudo; SFA: stent farmacoactivo. |
|||||||||||
Sesgo de publicación y asimetría
Las distribuciones de los diagramas de bosque de los resultados preespecificados indican la ausencia de sesgo de publicación en todos los resultados (figuras 1-5 del material adicional).
Estudio de valoración del riesgo de sesgo
La tabla 2 y la tabla 3 del material adicional resumen los resultados de la valoración del riesgo de sesgo. Once estudios fueron clasificados de riesgo de sesgo bajo, 1 de cierto riesgo sesgo y otro de riesgo de sesgo alto.
Resultados
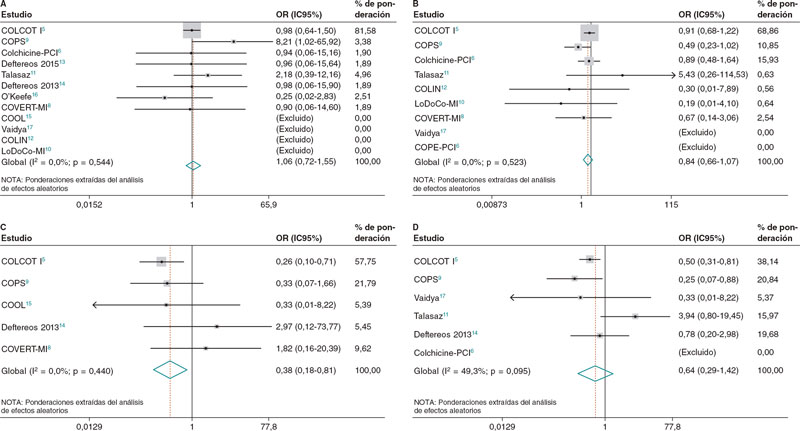
No se observaron diferencias entre los pacientes tratados con y sin colchicina y aquellos tratados con placebo en lo referente a la mortalidad por cualquier causa (OR = 1,06; IC95%, 0,72-1,55; I2 = 0%), mortalidad cardiovascular (OR = 0,98; IC95%, 0,42-2,28; I2 = 14,2%) o revascularización coronaria (OR = 0,64; IC95%, 0,29-1,42; I2 = 49,3%), No obstante, los pacientes tratados con colchicina sí presentaban un menor riesgo de accidente cerebrovascular (OR = 0,38; IC95%, 0,18-0,81; I2 = 0%) y una tendencia hacia un menor riesgo de IM (OR = 0,84; IC95%, 0,66-1,07; I2 = 0%) (figura 2).
Figura 2. Diagramas de bosque para los principales resultados de muerte (A), infarto de miocardio (B), accidente cerebrovascular (C) y revascularización (D). IC95%: intervalo de confianza del 95%; OR: odds ratio.
Análisis de sensibilidad
En el análisis de sensibilidad dejando un estudio fuera cada vez, los resultados coincidieron con los del análisis primario (tablas 4-8 del material adicional). Asimismo, en 1 análisis de sensibilidad sobre el uso de las razones de tasas de incidencia para tener en cuenta las diferentes duraciones del seguimiento los hallazgos no se vieron alterados (tabla 9 del material adicional).
Cuando se calcularon las ratios de riesgo con los modelos de efectos aleatorios, los hallazgos siguieron siendo consistentes con el análisis principal para todos los objetivos (tabla 10 del material adicional). Los análisis de meta-regresión con efectos aleatorios confirmaron que la dosis de colchicina (p = 0,33), la duración del seguimiento (p = 0,88), el porcentaje de pacientes con SCA (p = 0,37) o el porcentaje de pacientes con diabetes mellitus (p = 0,96) no influyeron significativamente en el efecto del tratamiento en lo que al objetivo primario se refiere (tabla 11 del material adicional).
DISCUSIÓN
Este metanálisis incluyó a 7.414 pacientes de 12 ECA y 1 estudio observacional. Vino a confirmar que la incorporación de colchicina al tratamiento médico estándar en pacientes tratados de ICP aportó ciertos beneficios clínicos sobre los eventos cardiovasculares. Ante todo, confirmó que, comparado con la ausencia de este fármaco o placebo, el uso de colchicina redujo el riesgo de accidentes cerebrovasculares mostrando una tendencia descendente hacia un menor riesgo de IM sin observarse ninguna heterogeneidad. No se observaron diferencias en la mortalidad por cualquier causa, mortalidad cardiovascular ni en la revascularización coronaria. Cabe destacar que la dosis de colchicina, la duración del seguimiento, el porcentaje de pacientes con SCA o la diabetes mellitus no influyeron en el efecto del tratamiento (ver la lista de comprobación de la declaración PRISMA en la tabla 12 del material adicional).
Nuestros resultados de mortalidad por cualquier causa y mortalidad cardiovascular coinciden con los de 1 metanálisis previo de 5 ECA realizado por Fu et al.18 que tampoco halló un descenso significativo de la mortalidad, IM, eventos adversos graves o reestenosis. Una posible explicación de la ausencia de beneficio sobre la mortalidad descrita en ambos ensayos podría ser que, aunque el índice de mortalidad fue, por lo general, bajo y las diferencias observadas no significativas a nivel estadístico en muchos de estos estudios, la duración del seguimiento fue, por lo general, corta (≤ 30 días) en la mayoría de los estudios, razón por la cual, quizás se observaran índices de eventos más altos con datos de seguimiento a más largo plazo. Se debe mencionar que el metanálisis realizado por Fu et al.18 incluyó 1 ECA de pacientes tratados de CABG, no ICP. Es posible que los perfiles inflamatorios de esta cohorte de pacientes varíen con respecto a los de pacientes tratados de ICP (por ejemplo, enfermedad coronaria multivaso, una recuperación posoperatoria más larga y un mayor riesgo de complicaciones posoperatorias). De hecho, esta población mixta podría haber llevado al descenso observado en la incidencia global de IM, eventos adversos graves y reestenosis. Asimismo, un metanálisis previo realizado por Fiolet et al.19 demostró que la incorporación de colchicina al tratamiento médico estándar en pacientes con síndrome coronario agudo y crónico redujo significativamente el riesgo del objetivo primario (un compuesto de IM, accidente cerebrovascular y mortalidad cardiovascular) y objetivo individual de IM, accidente cerebrovascular y revascularización coronaria no observándose ninguna diferencia en la mortalidad por cualquier causa ni en la mortalidad cardiovascular. Nuestros resultados que demuestran un menor riesgo de accidentes cerebrovasculares y una tendencia descendente hacia un menor riesgo de IM coinciden con este metanálisis. Una diferencia clave entre los distintos metanálisis realizados es la población de pacientes. Fiolet et al.19 incluyeron los estudios LoDoCo20 y LoDoCo221 cuyos criterios de inclusión fueron pacientes con enfermedad coronaria crónica y estabilidad clínica de más de 6 meses de evolución. Esto supuso que > 50% de los pacientes analizados estuviese fuera del periodo peri-ICP y, probablemente, tuviese un perfil inflamatorio distinto cuando se administró la colchicina. Ambos estudios tuvieron seguimientos más largos (36 y 29 meses, respectivamente), así que hubo tiempo para capturar resultados distintos como IM y revascularizaciones urgentes entre los distintos grupos de tratamiento. En cambio, nuestro metanálisis solo se centró en pacientes dentro del citado periodo peri-ICP tal y como hicieron Fu et al.18 y amplió el número total de estudios analizados a 12 ECA y 1 estudio observacional. Hasta donde nosotros sabemos, nuestro estudio es el metanálisis más extenso realizado hasta la fecha que ha valorado los efectos de la colchicina en los resultados clínicos de pacientes en el periodo peri-ICP.
Alkouli et al.22 confirmaron un aumento de la incidencia ajustada del accidente cerebrovascular isquémico en pacientes tratados de ICP por infarto agudo de miocardio con elevación del segmento ST (IAMCEST) (del 0,6 al 0,96%), IAMSEST (del 0,5 al 0,6%) y angina inestable o cardiopatía isquémica estable (AI/CIE, del 0,3 al 0,72%). La mortalidad intrahospitalaria también fue más alta (23,5 frente al 11,0%, 9,5 frente al 2,8% y 11,5 frente al 2,4% para las cohortes IAMCEST, IAMSEST y AI/CIE, respectivamente). Por su parte, los accidentes cerebrovasculares post-ICP se asociaron a estancias hospitalarias el doble de largas, las altas no domiciliarias aumentaron más del triple y el gasto creció por encima del 60%. Teniendo en cuenta la alta complejidad de los pacientes tratados y las técnicas ICP empleadas durante la pasada década, es obvio que se necesitan estrategias y tratamientos preventivos eficaces y aquí es, precisamente, donde tienen cabida otros fármacos anti-inflamatorios como la colchicina, para mitigar la morbimortalidad de pacientes con accidentes cerebrovasculares post-ICP. En la fase aguda del IM, los inflamasomas activados provocan una intensa respuesta inflamatoria23. También sobrevienen daños endoteliales tras una ICP con la correspondiente desestabilización de la placa aterosclerótica y el consiguiente tromboembolismo que provoca eventos cardiovasculares24. La colchicina podría jugar un papel en la prevención del accidente cerebrovascular estabilizando las placas ateroscleróticas de pacientes tratados de ICP, si bien este efecto podría no ser lo bastante sólido como para subsanar el daño endotelial directo sobrevenido cuando se realizó la ICP.
La colchicina es un fármaco muy conocido con propiedades anti-inflamatorias bien establecidas. Su mecanismo de acción todavía se desconoce, pero actúa, en parte, inhibiendo el inflamasoma NLRP3 (una proteína que contiene 1 dominio de unión a nucleótido y oligomerización, 1 dominio repetido rico en leucina y 1 dominio rico en pirina) que, en última instancia, infraexpresa la interleucina 1B y la interleucina 6, 2 conocidos mediadores inflamatorios23-27. También provoca disrupción de los microtúbulos y una menor activación y extravasación de neutrófilos. Como los niveles altos de biomarcadores inflamatorios son un predictor independiente de eventos cardiovasculares adversos mayores28-31, nuestros resultados vienen a confirmar que la incorporación de colchicina al tratamiento médico que se administra en la actualidad es una importante adición que contribuye a atenuar, más si cabe, la inflamación que sobreviene durante la prevención secundaria de la enfermedad cardiovascular en pacientes tratados de ICP.
Algunas limitaciones de nuestro estudio son el uso de datos globales a nivel de los estudios y no de los pacientes. Aunque esto limita los análisis de subgrupo, las conclusiones globales seguirían siendo las mismas. También hubo pocos pacientes en cada uno de los estudios analizados que no fueran tratados de ICP, lo cual limitaría los efectos globales sobre una población ICP. No obstante, en todos los estudios, la inmensa mayoría de los pacientes sí recibieron esta intervención. Asimismo, el estudio LoDoCo221 inscribió a pacientes tratados de ICP, pero al final, fue excluido de nuestro análisis porque los pacientes precisaban un periodo de estabilidad clínica de 6 meses tras la ICP antes de iniciar el tratamiento con colchicina. Este intervalo de 6 meses desde la realización de la ICP hasta la administración de colchicina se alejaba de nuestro periodo de interés (el periodo peri-ICP). El estudio realizado por O’keefe16 se realizó en la era de la angioplastia con balón, razón por la cual, en este contexto, el tratamiento con colchicina podría no ser comparable a pacientes tratados de ICP en la era de las estatinas, modernos stents y agentes antiagregantes plaquetarios. Por otro lado, aunque la mayoría de pacientes de nuestro estudio fueron tratados de ICP por presentar SCA, se excluyeron otras presentaciones clínicas de los pacientes tales como cardiopatía isquémica, angina inestable e incluso IM agudo. Teniendo en cuenta el diferente estado clínico en el momento de la presentación en lo que la ICP se refiere, es probable que el perfil inflamatorio de estas poblaciones distintas de pacientes también cambiase dando como resultado desenlaces clínicos distintos. En cualquier caso, los diferentes criterios de inclusión y exclusión, definiciones de los resultados y dosis y duración del tratamiento con colchicina no introdujeron heterogeneidad en nuestros resultados.
CONCLUSIONES
En pacientes tratados de ICP, la incorporación de colchicina al tratamiento médico óptimo se tradujo en un significativo descenso de la incidencia de accidentes cerebrovasculares, así como en una tendencia descendente hacia un menor riesgo de IM. No obstante, esto no se tradujo en índices más bajos de mortalidad por cualquier causa, mortalidad cardiovascular ni revascularización urgente.
FINANCIACIÓN
Este estudio no recibió ninguna subvención del sector público, privado, así como tampoco de ninguna organización sin ánimo de lucro.
CONTRIBUCIÓN DE LOS AUTORES
M.B. Levine participó en la recogida de datos y en la investigación. F. Hayat y J. Chang participaron en la recogida de datos, investigación y redacción, edición y revisión del primer borrador del manuscrito. C.E. Soria Jiménez, J. Sanz Sánchez y H. García-García tuvieron la idea del proyecto y participaron en la recogida de datos, análisis formal e investigación de los mismos, metodología, gestión del proyecto, recursos, validación, visualización, redacción, edición y revisión de todos los borradores del manuscrito y versión final del mismo.
CONFLICTO DE INTERESES
H.M. García-García declara haber recibido una beca institucional de Biotronik, Boston Scientific, Medtronic, Abbott, Neovasc, Shockwave, Phillips y Corflow. Los demás autores no declaran ningún conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- La inflamación juega un papel fundamental en la patogénesis de la enfermedad coronaria y está implicada, asimismo, en las intervenciones coronarias percutáneas. La colchicina es un potente fármaco anti-inflamatorio. Se desconoce, no obstante, el efecto que ejerce sobre la atenuación de la inflamación peri-ICP.
¿QUÉ APORTA DE NUEVO?
- En este metanálisis de 12 ECA y 1 estudio observacional, la incorporación de colchicina a pacientes tratados de ICP se tradujo en una incidencia más baja de accidentes cerebrovasculares. Otros eventos cardiovasculares adversos mayores no arrojaron ninguna diferencia significativa a este respecto.
BIBLIOGRAFÍA
1. Fox KA, Poole-Wilson P, Clayton TC, et al. 5-year outcome of an interventional strategy in non-ST-elevation acute coronary syndrome: the British Heart Foundation RITA 3 randomised trial. Lancet. 2005;366:914-920.
2. Boden WE, O’Rourke RA, Teo KK, et al. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med. 2007;356:1503-1516.
3. Deftereos S, Giannopoulos G, Papoutsidakis N, et al. Colchicine and the heart: pushing the envelope. J Am Coll Cardiol. 2013;62:1817-1825.
4. Nidorf SM, Eikelboom JW, Thompson PL. Colchicine for secondary prevention of cardiovascular disease. Curr Atheroscler Rep. 2014;16:391.
5. Tardif JC, Kouz S, Waters DD, et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med. 2019;381:2497-2505.
6. Shah B, Pillinger M, Zhong H, et al. Effects of Acute Colchicine Administration Prior to Percutaneous Coronary Intervention: COLCHICINE-PCI Randomized Trial. Circ Cardiovasc Interv. 2020;13:e008717.
7. Cole J, Htun N, Lew R, Freilich M, Quinn S, Layland J. Colchicine to Prevent Periprocedural Myocardial Injury in Percutaneous Coronary Intervention: The COPE-PCI Pilot Trial. Circ Cardiovasc Interv. 2021;14:e009992.
8. Mewton N, Roubille F, Bresson D, et al. Effect of Colchicine on Myocardial Injury in Acute Myocardial Infarction. Circulation. 2021;144:859-869.
9. Tong DC, Quinn S, Nasis A, et al. Colchicine in Patients With Acute Coronary Syndrome: The Australian COPS Randomized Clinical Trial. Circulation. 2020;142:1890-1900.
10. Hennessy T, Soh L, Bowman M, et al. The Low Dose Colchicine after Myocardial Infarction (LoDoCo-MI) study: A pilot randomized placebo controlled trial of colchicine following acute myocardial infarction. Am Heart J. 2019;215:62-69.
11. Talasaz AH, Jenab Y, Hosseini SH. P461. Colchicine before percutaneous coronary intervention in acute myocardial infarction. Eur Heart J. 2019(40):Suppl 1;ehz745.0994.
12. Akodad M, Lattuca B, Nagot N, et al. COLIN trial: Value of colchicine in the treatment of patients with acute myocardial infarction and inflammatory response. Arch Cardiovasc Dis. 2017;110:395-402.
13. Deftereos S, Giannopoulos G, Angelidis C, et al. Anti-Inflammatory Treatment With Colchicine in Acute Myocardial Infarction: A Pilot Study. Circulation. 2015;132:1395-1403.
14. Deftereos S, Giannopoulos G, Raisakis K, et al. Colchicine treatment for the prevention of bare-metal stent restenosis in diabetic patients. J Am Coll Cardiol. 2013;61:1679-1685.
15. Raju NC, Yi Q, Nidorf M, Fagel ND, Hiralal R, Eikelboom JW. Effect of colchicine compared with placebo on high sensitivity C-reactive protein in patients with acute coronary syndrome or acute stroke: a pilot randomized controlled trial. J Thromb Thrombolysis. 2012;33:88-94.
16. O’Keefe JH Jr, McCallister BD, Bateman TM, Kuhnlein DL, Ligon RW, Hartzler GO. Ineffectiveness of colchicine for the prevention of restenosis after coronary angioplasty. J Am Coll Cardiol. 1992;19:1597-1600.
17. Vaidya K, Arnott C, Martínez GJ, et al. Colchicine Therapy and Plaque Stabilization in Patients With Acute Coronary Syndrome: A CT Coronary Angiography Study. JACC Cardiovasc Imaging. 2018;11:305-316.
18. Fu C, Wang B. Colchicine administration for percutaneous coronary intervention: A meta-analysis of randomized controlled trials. Am J Emerg Med. 2021;46:121-125.
19. Fiolet A, Opstal T, Mosterd A, et al. Efficacy and Safety of Low-Dose Colchicine in Patients with Coronary Disease: A Systematic Review and Meta-Analysis of Randomized Trials. Eur Heart J. 2021;00:1-11.
20. Nidorf SM, Eikelboom JW, Budgeon CA, Thompson PL. Low-dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol. 2013;61:404-410.
21. Nidorf SM, Fiolet ATL, Mosterd A, et al. Colchicine in Patients with Chronic Coronary Disease. N Engl J Med. 2020;383(19):1838-1847.
22. Alkhouli M, Alqahtani F, Tarabishy A, Sandhu G, Rihal CS. Incidence, Predictors, and Outcomes of Acute Ischemic Stroke Following Percutaneous Coronary Intervention. JACC Cardiovasc Interv. 2019;12:1497-1506.
23. Chen B, Frangogiannis NG. Immune cells in repair of the infarcted myocardium. Microcirculation. 2017;e12305.
24. de Winter RJ, Heyde GS, Koch KT, et al. The prognostic value of pre-procedural plasma C-reactive protein in patients undergoing elective coronary angioplasty. Eur Heart J. 2002;23:960-966.
25. Rajamäki K, Lappalainen J, Oörni K, et al. Cholesterol crystals activate the NLRP3 inflammasome in human macrophages: a novel link between cholesterol metabolism and inflammation. PLoS One. 2010;5:e11765.
26. Paschke S, Weidner AF, Paust T, Marti O, Beil M, Ben-Chetrit E. Technical advance: Inhibition of neutrophil chemotaxis by colchicine is modulated through viscoelastic properties of subcellular compartments. J Leukoc Biol. 2013;94:1091-1096.
27. Martinon F, Pétrilli V, Mayor A, Tardivel A, Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature. 2006;440:237-241.
28. Buffon A, Liuzzo G, Biasucci LM, et al. Preprocedural serum levels of C-reactive protein predict early complications and late restenosis after coronary angioplasty. J Am Coll Cardiol. 1999;34:1512-1521.
29. Kwaijtaal M, van Diest R, Bär FW, et al. Inflammatory markers predict late cardiac events in patients who are exhausted after percutaneous coronary intervention. Atherosclerosis. 2005;182:341-348.
30. Patti G, Di Sciascio G, D’Ambrosio A, Dicuonzo G, Abbate A, Dobrina A. Prognostic value of interleukin-1 receptor antagonist in patients undergoing percutaneous coronary intervention. Am J Cardiol. 2002;89:372-376.
31. Walter DH, Fichtlscherer S, Sellwig M, Auch-Schwelk W, Schächinger V, Zeiher AM. Preprocedural C-reactive protein levels and cardiovascular events after coronary stent implantation. J Am Coll Cardiol. 2001;37:839-846.