Sr. Editor:
El tratamiento de la enfermedad coronaria (EC) con calcificación importante constituye un desafío técnico en aquellos pacientes que precisan modificación de la placa de ateroma como parte de una intervención percutánea. En este sentido, los cardiólogos intervencionistas deben estar familiarizados con la amplia gama de técnicas de modificación de placa existentes y que se utilizan para preparar los vasos a fin de facilitar un despliegue y expansión óptimos del stent coronario1. En presencia de enfermedad calcificada proximal en vasos tortuosos, la aterectomía orbital puede emplearse como alternativa a la rotacional por su mayor estabilidad con ablación inversa, mayor facilidad de uso y la versatilidad que proporciona el uso de una fresa de un único tamaño que puede utilizarse en distintos perfiles vasculares. La técnica tiene, además, un perfil de seguridad similar al de la aterectomía rotacional2. En este artículo, se detalla un caso de EC fuertemente calcificada en los segmentos proximales de 3 vasos. Nuestro caso muestra cómo la aterectomía orbital se utilizó para preparar los 3 vasos epicárdicos con una fresa de un único tamaño dentro de un único procedimiento guiado por corregistro de ecografía intravascular (IVUS) y fisiología..
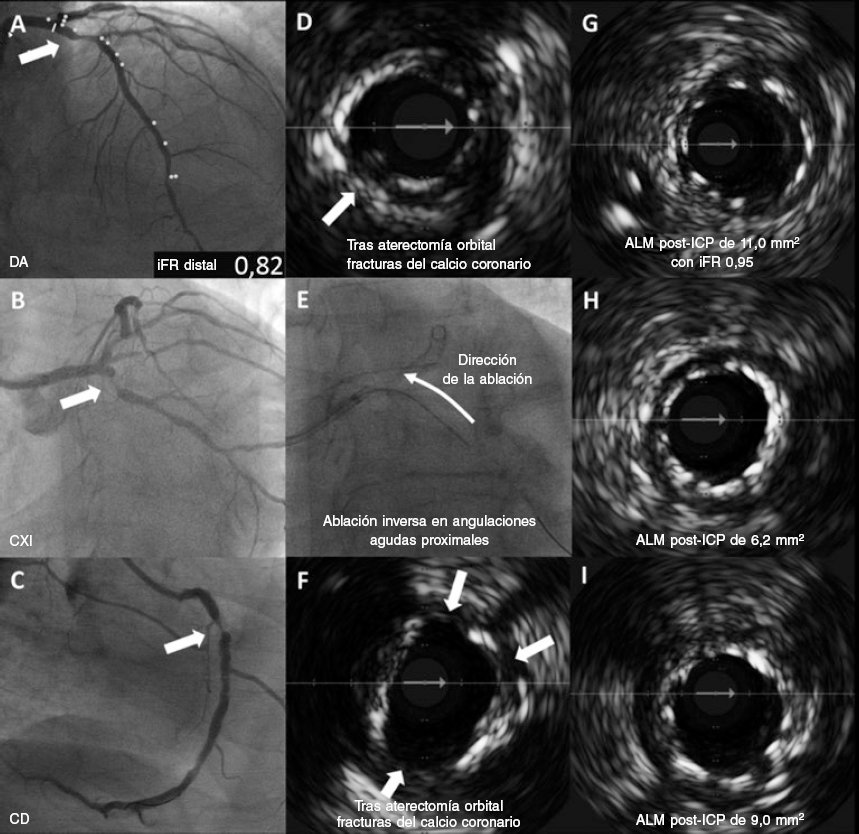
Nuestro paciente esun varón de 73 años con opresión torácica de esfuerzo que presentaba además hipertensión, diabetes mellitus tipo II, enfermedad pulmonar obstructiva crónica grave (volumen espiratorio forzado en el primer segundo [FEV1] del 29%) y fibrilación auricular. El examen clínico no reveló anomalías y las pruebas de hematología y bioquímica fueron normales salvo por un fragmento N-terminal del péptido natriurético tipo B de 1.365 pg/ml (valores de referencia normales: < 125 pg/ml) y niveles de troponina I de 351 ng/l (valores de referencia normales: 3-58 ng/l). El electrocardiograma confirmó la presencia de fibrilación auricular. La ecocardiografía transtorácica confirmó la presencia de función sistólica del ventrículo izquierdo deteriorada con una fracción de eyección del 43% acompañada de hipocinesia inferior. Tras dar su consentimiento informado, al paciente se le practicó una coronariografía invasiva que reveló la presencia de EC fuertemente calcificada en los 3 vasos proximales con ateroma difuso (descendente anterior [DA] figura 1A; circunfleja izquierda [CXI] figura 1B; coronaria derecha [CD] figura 1C; los segmentos enfermos están resaltados con flechas). La distribución de la enfermedad era anatómicamente compleja (puntuación en la escala SYNTAX de 30) y, teniendo en cuenta el estado clínico del paciente, la puntuación obtenida en la escala SYNTAX II predijo un índice de mortalidad a 4 años asociado a la intervención coronaria percutánea (ICP) o a la cirugía de revascularización coronaria del 8,3 y 17,7%, respectivamente. Finalmente, el paciente fue tratado de una ICP según recomendación del equipo multidisciplinario.
Figura 1. Angiografía basal con aterectomía orbital guiada por IVUS muestra los mecanismos de modificación de la placa de calcio con despliegue del stent y aposición de struts. A: lesión en DA proximal con un iFR de 0,82. B: lesión en CXI proximal. C: lesión en CD proximal. D: fracturas de calcio (asteriscos) tras aterectomía orbital guiada por IVUS. E: s aterectomía orbital inversa. F: fracturas de calcio (asteriscos) tras aterectomía orbital guiada por IVUS. G: aposición del stent en DA con ALM post-ICP de 11,0 mm2 e iFR de 0,95. H: aposición del stent en CXI con ALM de 6,2 mm2. I: aposición del stent en CD con ALM de 9,0 mm2. ALM: área luminal mínima; CD: coronaria derecha; CXI: circunfleja izquierda; DA: descendente anterior; ICP: intervención coronaria percutánea; iFR: índice diastólico instantáneo sin ondas; IVUS: ecografía intravascular.
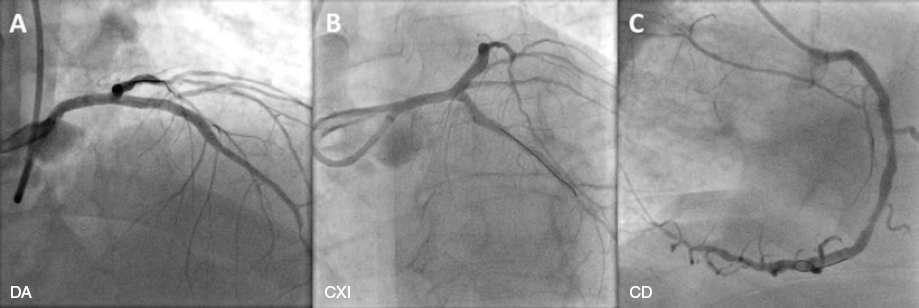
El procedimiento se realizá a través de la arteria radial derecha- El índice diastólico instantáneo sin ondas (iFR) de la lesión angiográficamente menos grave de la DA fue positivo (0,82). Se empleó la IVUS con corregistro para caracterizar mejor el grado de enfermedad calcificada en la DA y CD. No obstante, la estenosis de la CXI no se pudo cruzar con el catéter IVUS sin modificar antes la placa de calcio, razón por la cual no se tomaron imágenes intracoronarias de dicho vaso previas a la intervención. Dada la presencia de calcificación grave (> 270º) en las zonas de anclaje de los vasos diana en DA y CD, se realizó directamente una aterectomía orbital de manera en las 3 arterias con una fresa de 1,25 mm (Diamondback 360, CSI, Estados Unidos). Esta redujo eficazmente los depósitos de calcio fracturándolos. (DA, figura 1D; CD, figura 1F; las fracturas del calcio se muestran con flechas) Tras un tratamiento adicional con balones no distensibles, se desplegaron sendos stents liberadores de sirolimus tanto en la DA como en la CXI (3,5 x 35 mm y 3,0 x 15 mm, respectively; Osiro, Biotronik, Alemania) y un stent liberador de everolimus en la CD (3,5 x 33 mm; XIENCE, Abbott, Estados Unidos). La IVUS post-ICP de los 3 vasos confirmó la aposición completa de los struts, buenas áreas mínimas de los stent y la cobertura de las lesiones. Además, la fisiología post-ICP de la DA confirmó los buenos resultados funcionales con un iFR de 0,95 (DA, figura 1G; CXI, figura 1H; CD, figura 1I). Los resultados angiográficos finales de los 3 vasos diana se muestran en la figura 2 (DA, figura 2A; CXI, figura 2B; CD, figura 2C). El resumen de los dispositivos utilizados en la intervención se muestra en la tabla 1.
Figura 2. Muestra los resultados angiográficos finales en DA (A), CXI (B) y CD (C). CD: coronaria derecha; CXI: circunfleja izquierda; DA: descendente anterior.
Tabla 1. Dispositivos empleados para la realización de ICP
| Vaso | Dispositivo |
|---|---|
| DA | Catéter guía EBU de 7 FR y 3,5 mm |
| Guía coronaria ViperWire (Cardiovascular Systems Inc., Estados Unidos) | |
| Guía coronaria Sion Blue (ASAHI Intecc Inc., Japón) | |
| Guía de presión para la evaluación fisiológica de lesiones coronarias OmniWire (Philips, Países Bajos) | |
| Microcatéter FineCross (Terumo Corporation, Japón) | |
| Sistema de aterectomía orbital coronaria Diamondback 360 con fresa de 1,25 mm (Cardiovascular Systems Inc., Estados Unidos of America) | |
| Catéter IVUS Eagle Eye (Philips, Países Bajos) | |
| Balón Trek de 2,5 x 15 mm (Abbott, Estados Unidos) | |
| Balón ND Xperience de 3,5 x 10 mm (iVascular, España) | |
| Stent farmacoactivo Osiro de 3,5 x 35 mm (Biotronik, Alemania) | |
| CXI | Guía coronaria ViperWir (Cardiovascular Systems Inc., Estados Unidos) |
| Guía coronaria Sion Blue (ASAHI Intecc Inc., Japón) | |
| Sistema de aterectomía orbital coronaria Diamondback 360 con fresa de 1,25 mm (Cardiovascular Systems Inc., Estados Unidos) | |
| Catéter IVUS Eagle Eye (Philips, Países Bajos) | |
| Balón Trek de 2,5 x 15 mm (Abbott, Estados Unidos) | |
| Balón ND Xperience de 3,0 x 15 mm (iVascular, España) | |
| Stent farmacoactivo Osiro de 3,0 x 15 mm (Biotronik, Alemania) | |
| CD | Guía coronaria ViperWire (Cardiovascular Systems Inc., Estados Unidos) |
| Guía coronaria Sion Blue (ASAHI Intecc Inc., Japón) | |
| Sistema de aterectomía orbital coronaria Diamondback 360 con fresa de 1,25 mm (Cardiovascular Systems Inc., Estados Unidos) | |
| Catéter IVUS Eagle Eye (Philips, Países Bajos) | |
| Balón Trek de 3,0 x 12 mm (Abbott, Estados Unidos) | |
| Balón ND Xperience de 3,5 x 10 mm (iVascular, España) | |
| Stent farmacoactivo XIENCE Skypoint de 3,5 x 33 mm (Abbott, Estados Unidos) | |
|
CD: coronaria derecha; CXI: circunfleja izquierda; DA: descendente anterior; EBU: alto soporte; ICP: intervención coronaria percutánea; IVUS: ecografía intravascular; ND: no distensible. |
|
Este caso constituye un ejemplo de modificación de la placa de ateroma coronaria en un paciente con EC calcificada, dentro de un procedimiento guiado por imágen y fisiología intracoronarias, preparación de la placa calcificada con aterectomía orbital y evaluaciones post-ICP. Estas tecnologías son clave para garantizar resultados duraderos de la ICP y, a nivel general, añaden valor pronóstico3. La aterectomía a 3 vasos estuvo justificada por el grado de calcificación. Además, se consideró cuidadosamente el uso de la aterectomía orbital (en lugar de la rotacional) por sus características únicas, sobre todo, por la ablación inversa (figura 1E) y el diámetro variable de debulking, lo cual posibilita tratar vasos de diferentes diámetros con una fresa de un único tamaño4,5. En casos seleccionados, estas características de la aterectomía orbital pueden resultar especialmente útiles en vasos ostiales y/o angulados, sobre todo, en la CXI como en el caso en cuestión en el que la tortuosidad puede llegar a entorpecer la adecuada modificación de la placa en lesiones fuertemente calcificadas, verse limitada por el sesgo de la fresa o permitir, solo, la ablación anterógrada, afectando al soporte del catéter guía y, por ende, al éxito de toda la intervención.
En resumen, nuestro caso muestra la viabilidad de realizar una aterectomía orbital a 3 vasos asistida por corregistro en lesiones coronaria proximales muy calcificadas.
Se obtuvo el consentimiento informado y por escrito del paciente a efectos de publicación.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
A. Shabbir y D. Chipayo redactaron el artículo y prepararon las imágenes. A. Jerónimo realizó una revisión crítica del contenido intelectual del artículo al que contribuyeron sustancialmente. A. Travieso también realizó una revisión crítica del contenido intelectual de este al que contribuyó sustancialmente. N. Gonzalo y J. Escaned conceptualizaron el manuscrito y realizaron una revisión crítica del mismo. Todos los coautores dieron su aprobación a la versión que finalmente se publicaría y asumen, plenamente, toda responsabilidad sobre este artículo.
CONFLICTO DE INTERESES
A. Shabbir declaró haber recibido honorarios como conferenciante y emolumentos de Philips. A. Travieso aseguró haber recibido una beca de investigación sin restricciones de Philips. J. Escaned cuenta con el apoyo del proyecto de Intensificación de la Actividad Investigadora INT22/00088 del Instituto de Salud Carlos III con sede en Madrid (España). También declaró ser ponente y formar parte del comité asesor de Philips. A. Jerónimo, D. Chipayo y N. Gonzalo no declararon ningún conflicto de intereses.
BIBLIOGRAFÍA
1. Riley RF, Henry TD, Mahmud E, et al. SCAI position statement on optimal percutaneous coronary interventional therapy for complex coronary artery disease. Catheter Cardiovasc Interv. 2020;96:346-362.
2. Khan AA, Murtaza G, Khalid MF, et al. Outcomes of rotational atherectomy versus orbital atherectomy for the treatment of heavily calcified coronary stenosis:A systematic review and meta-analysis. Catheter Cardiovasc Interv. 2021;98:884-892.
3. Escaned J, Collet C, Ryan N, et al. Clinical outcomes of state-of-the-art percutaneous coronary revascularization in patients with de novo three vessel disease:1-year results of the SYNTAX II study. Eur Heart J. 2017;38:3124-3134.
4. Chambers JW, Feldman RL, Himmelstein SI, et al. Pivotal trial to evaluate the safety and efficacy of the orbital atherectomy system in treating de novo, severely calcified coronary lesions (ORBIT II). JACC Cardiovasc Interv. 2014;7:510-518.
5. Lee M, Genereux P, Shlofmitz R, et al. Orbital atherectomy for treating de novo, severely calcified coronary lesions:3-year results of the pivotal ORBIT II trial. Cardiovasc Revasc Med. 2017;18:261-264.