RESUMEN
Introducción y objetivos: La derivación bidireccional de Glenn (DBG) es un paso esencial en la reparación cardiaca fisiológica del ventrículo único. La DBG aumenta el flujo sanguíneo pulmonar, permite el crecimiento de las arterias pulmonares y mejora la saturación arterial de oxígeno. También permite la descarga del volumen ventricular, mejorando así la supervivencia. El objetivo del estudio fue registrar a todos los pacientes tras DBG que desarrollaron canales colaterales, los métodos de abordaje y su impacto.
Métodos: Se incluyeron 56 pacientes que habían sido tratados con DBG, con una mediana de edad de 2,08 (1-3) años. Se colocó un stent pulmonar periférico tras la DBG a 2 pacientes. De todos ellos, 10 (17,86%) presentaban hiperviscosidad sintomática y se les realizó una flebotomía. La DBG falló en 2 pacientes. Cuarenta y un pacientes (73,2%) tenían colaterales y 37 (66,1%) colaterales aortopulmonares.
Resultados: Los pacientes con colaterales presentaban valores de hematocrito significativamente mayores (50,00 ± 8,76), desde el punto de vista estadístico, en comparación con los pacientes sin colaterales venosas (p = 0,031). Los pacientes con colaterales presentaban una presión arterial pulmonar media significativamente mayor (15 [12-18] mmHg), desde el punto de vista estadístico (p = 0,025). Se llevó a cabo el cierre percutáneo (CP) de las colaterales en 7 pacientes. Uno de ellos tuvo un cierre satisfactorio de las colaterales venovenosas a las venas epicárdicas y abdominales 3 años antes. Cuatro pacientes se sometieron a CP de colaterales venovenosas a venas pulmonares izquierdas y derechas. Se realizó un cierre de una colateral aortopulmonar a 1 paciente. En 1 paciente se falló en un intento de cierre de colaterales venosas que se complicó con un accidente vascular cerebral. Un paciente presentó extravasación localizada al separar el cable. Se produjo un aumento estadísticamente muy significativo de la saturación de oxígeno tras el CP de las colaterales venovenosas (69,83 ± 10,91 frente a 82,83 ± 9,87; p = 0,008).
Conclusiones: El CP de las colaterales es técnicamente exigente, pero es un tratamiento eficaz tras la DBG para mejorar la saturación y la calidad de vida del paciente. Es crucial conocer las posibles complicaciones y su tratamiento eficaz.
Palabras clave: Venovenoso. Colaterales aortopulmonares. Vena pulmonar. Embolización con coils. Embolización del dispositivo. Cierre percutáneo.
ABSTRACT
Introduction and objectives: The bidirectional Glenn shunt (BDG) is an essential step in the repair of a physiologically single-ventricle heart. BDG increases pulmonary blood flow, allows growth of the pulmonary arteries, and improves SaO2. The procedure also allows unloading of ventricular volume, thereby improving survival. Our aim was to register all patients who developed collaterals following BDG, document the management methods used, and assess their impact.
Methods: We included 56 patients who underwent BDG procedures at a median age of 2.08 (1-3) years. After BDG, peripheral pulmonary stenting was used in 2 patients. Symptomatic hyperviscosity was present in 10 patients (17.86%), who underwent venesection. BDG was unsuccessful in 2 patients. Venovenous collaterals were observed in 41 patients (73.2%), and aortopulmonary collaterals in 37 (66.1%).
Results: Hematocrit levels were significantly higher in patients with venovenous collaterals (50.00 ± 8.76) than in those without (P = .031). Mean pulmonary artery pressure was also significantly higher in patients with venovenous collaterals (15 [12-18] mmHg; P = .025). One patient had undergone successful closure of venovenous collaterals to epicardial veins and abdominal veins 3 years previously. Seven patients underwent transcatheter closure (TCC) of collaterals. Of these, 4 patients underwent TCC of venovenous collaterals to left and right pulmonary veins; 1 patient underwent closure of an aortopulmonary collateral; 1 patient underwent a failed attempt at venovenous collateral closure that was complicated by an ischemic stroke; and 1 patient had localized extravasation upon separation of the cable. A highly statistically significant increase in SaO2 was observed after TCC of venovenous collaterals (69.83 ± 10.91 vs 82.83 ± 9.87; P = .008).
Conclusions: TCC of collaterals is a technically demanding but effective management strategy following BDG to improve patients’ SaO2 and quality of life. Awareness of possible complications and their effective management is crucial.
Keywords: Venovenous. Aortopulmonary collaterals. Pulmonary vein. Coil embolization. Device embolization. Transcatheter closure.
Abreviaturas
CAP: colaterales aortopulmonares. CP: cierre percutáneo. DBG: derivación bidireccional de Glenn. DBT: derivación de Blalock-Taussig modificada.
INTRODUCCIÓN
La incidencia de la cardiopatía congénita (CC) es de 6 y 13 casos por cada 1.000 nacimientos vivos1. En la actualidad, en países desarrollados, se emplea el diagnóstico prenatal para la detección de CC antes del nacimiento. En países en vías de desarrollo, solo se diagnostican a unos pocos niños con CC y aun son menos los que se benefician del tratamiento quirúrgico, lo cual ha creado un patrón de presentación tardía acompañado de una alta tasa de complicaciones2.
El término «ventrículo único» se suele emplear para describir toda CC con 1 ventrículo funcional, incluida la doble entrada al ventrículo izquierdo, el ventrículo único, el ventrículo común y la conexión aurículoventricular (AV) univentricular. También son susceptibles de incorporarse a este grupo otras lesiones tales como el síndrome de corazón izquierdo hipoplásico (SCIH), la atresia tricuspídea, la comunicación interventricular desequilibrada, la atresia mitral con raíz aórtica normal y los síndromes de heterotaxia con un ventrículo funcional³.
La derivación bidireccional de Glenn (DBG) y la intervención de hemi-Fontan son técnicas quirúrgicas que se utilizan para crear una anastomosis cavopulmonar superior (ACPS) en pacientes con ventrículo único anatómico o funcional. Con independencia de si se trata del derecho o el izquierdo, el ventrículo único debe suministrar sangre tanto a la circulación sistémica de alta resistencia como a la circulación pulmonar de baja resistencia hasta que se realice la corrección quirúrgica. La intervención DBG o de hemi-Fontan ayudan a eliminar la carga de volumen sobre el ventrículo único y facilitan la correspondiente cirugía de Fontan4.
Los canales colaterales venosos sistémicos de pacientes con corazones univentriculares tras ACPS o intervención de hemi-Fontan pueden provocar una desaturación sistémica significativa. Tras la ACPS, la diferencia de presión que existe entre la vena cava superior (VCS) y la vena cava inferior desencadena el desarrollo de conexiones venosas entre ambos sistemas para descomprimir la presión elevada del sistema de la VCS. Las colaterales venovenosas pueden surgir en cualquier momento tras la ACPS5.
El estudio de las colaterales venosas debe realizarse rutinariamente en todos los pacientes cateterizados pre-Glenn y pre-Fontan. Las colaterales venovenosas con drenaje infracardiaco quedarán separadas de la circulación sistémica tras terminar la operación de Fontan. No es preciso embolizar estas colaterales salvo que el paciente presente una vena cava inferior interrumpida con exclusión de las venas hepáticas de la circulación de Fontan, tal y como sucede en la operación de Kawashima. En cambio, las colaterales venovenosas que drenan en las venas pulmonares o en la aurícula seguirán provocando cianosis por los shunts de derecha a izquierda, por lo cual deben ser embolizadas6.
Spicer et al.7 informaron de una incidencia del 84% de colaterales aortopulmonares (CAP) en niños cateterizados pre-Fontan. Las CAP que se desarrollan en el corazón univentricular suelen tener una comunicación extensa y comprometer redes de vasos más pequeños entre colaterales más grandes. En tales situaciones, el cierre total de las CAP no resulta viable. Además, la embolización extensa de todas las CAP alarga el procedimiento de cateterismo total y aumenta las posibles complicaciones sin ningún beneficio clínico adicional. Bradley et al.8 recomiendan la embolización selectiva de CAP entre moderadas y grandes en pacientes tratados de cirugías reparadoras del corazón univentricular. El flujo sanguíneo pulmonar suministrado por las CAP también puede ser importante en pacientes cianóticos. En estos pacientes, el cierre de las CAP puede llegar a reducir la saturación sistémica a niveles peligrosamente bajos.
Nuestro objetivo fue registrar a todos aquellos pacientes derivados a nuestro centro tras ser tratados de una DBG entre marzo de 2022 y febrero de 2023. Realizamos un estudio completo tanto de su hemodinámica como de los canales colaterales, incluidas las colaterales venovenosas hacia venas sistémicas o pulmonares y CAP. También exploramos diferentes métodos de tratamiento y valoramos el impacto de dichos tratamientos en pacientes con fisiología univentricular.
MÉTODOS
El estudio incluyó a 56 pacientes tratados de DBG. Se excluyó a los pacientes enfermos críticos. Se recopiló la historia médica completa de todos los pacientes, incluidos los datos demográficos (edad actual, sexo, peso, altura, superficie corporal), los antecedentes perinatales, de desarrollo, de venesección, de hospitalización y los datos quirúrgicos (la edad en el momento de la intervención, la fecha de esta, así como cualquier otra intervención quirúrgica previa a la DBG, como el cerclaje previo de la arteria pulmonar o la derivación de Blalock-Taussig modificada [DBT]). La historia médica también incluyó información sobre estudios hemodinámicos invasivos previos, intervenciones percutáneas previas (como el implante de stent en la arteria pulmonar o el cierre de colaterales venovenosas) y el tratamiento médico actual. El examen clínico consistió en medir la presión arterial, el pulso, la frecuencia respiratoria y los niveles basales de SaO2. También se realizó un estudio cardiaco local, se observaron las colaterales superficiales subcutáneas torácicas y se analizaron las cicatrices torácicas. Se auscultaron los sonidos y soplos cardiacos y los pulmones. Se realizó un electrocardiograma de 12 derivaciones para valorar la frecuencia y el ritmo cardiacos, el eje, la presencia de trastornos de la conducción y arritmias. Se realizó una radiografía torácica para valorar la sombra cardiaca, la vasculatura pulmonar y la presencia de stents, dispositivos de embolización y suturas procedentes de esternotomías previas.
Se realizó una ecocardiografía transtorácica completa para determinar la ubicación del corazón, las vísceras, el ápex cardiaco, las conexiones AV y ventrículoarteriales, la relación y anomalías de los grandes vasos, la descripción de la conexión AV como entrada doble, la atresia de una de las entradas o una válvula AV común, la descripción de la conexión ventrículoarterial y la determinación de la morfología y función sistólica del ventrículo dominante (derecho, izquierdo o indeterminado).
Se incluyeron los datos disponibles de la tomografía computarizada multidetector para confirmar la anatomía, determinar el drenaje venoso sistémico y pulmonar, valorar el árbol pulmonar periférico, el tamaño y permeabilidad de la DBG y establecer la presencia de colaterales venovenosas y CAP. Se hicieron las pruebas de laboratorio rutinarias previas al cateterismo cardiaco, como un hemograma completo, la relación internacional normalizada y pruebas de la función renal y virología.
El cateterismo cardiaco invasivo incluyó un estudio hemodinámico completo de los pacientes antes de la finalización de la operación de Fontan y de los pacientes desaturados. La intervención se realizó bajo aporte de oxígeno al 100%. Las vías de acceso habituales fueron la arteria femoral derecha y las venas subclavias derecha o izquierda. La inyección de la DBG se hizo en el plano posteroanterior (PA) a fin de valorar la permeabilidad de la DBG y el tamaño del árbol pulmonar. Se inyectó la vena innominada en el plano PA para valorar la presencia de colaterales venovenosas y la aorta descendente, también en el mismo plano, para determinar la presencia de CAP. También se registraron las presiones y saturaciones de varias cámaras cardiacas.
Las intervenciones percutáneas se realizaron previa indicación incluido el implante de stent pulmonar periférico o cierre de colaterales venovenosas o CAP. Los colaterales venovenosas solo se cerraron en pacientes desaturados considerados no aptos para finalizar la operación de Fontan (por una función ventricular comprometida, insuficiencia grave de la válvula AV o valores medios de presión de la arteria pulmonar [PAP] > 14 mmHg) tras excluir a todos aquellos pacientes con hipertensión pulmonar o síndrome de la VCS. Las principales CAP se cerraron en pacientes con evidencia de sobrecarga del volumen ventricular como presión telediastólica ventricular alta), provocando presión de retroceso en venas y arterias pulmonares.
Análisis estadístico
Los datos cualitativos se expresan como frecuencias y porcentajes y los cuantitativos como media ± desviación estándar. Se utilizaron la prueba t de Student, el análisis de varianza de un factor y la prueba de la t de Student para muestras independientes. También se emplearon la regresión lineal y el análisis de correlación de Pearson para determinar la correlación existente entre las variables de interés. Los datos se analizaron con software comercial disponible (SPSS versión 19.0) y los valores de p < 0,05 se consideraron significativos a nivel estadístico. Todos los datos y materiales del estudio están disponibles previa solicitud.
RESULTADOS
Nuestro registro incluyó a 56 pacientes tratados de DBG derivados a nuestro centro entre marzo de 2022 y febrero de 2023. La mediana de edad fue de 9,67 años (7,42-12,17), 31 varones (55,4%) y 25 mujeres (44,6).
Se trató a 30 (53,6%) pacientes solo de 1 DBG y a 26 pacientes (46,4%) de otras intervenciones previo a la DBG: 1 cerclaje de la arteria pulmonar en 15 pacientes (26,8%), 1 DBT en 10 (17,9%) y ambas intervenciones en 1 paciente (1,7%). De los 10 pacientes tratados de DBT, 7 (70%) presentaban 1 DBT derecha y 3 (30%) 1 DBT izquierda. Se trató a 3 (5,4%) pacientes de septectomía quirúrgica con DBG y se implantó un marcapasos permanente en 1 paciente (1,8%) mediante esternotomía de repetición.
En 5 pacientes (8,9%) se llevaron a cabo intervenciones percutáneas: 1 septostomía auricular con balón de Rashkind tras el nacimiento y previo a este en 2 pacientes (3,6%); implante de stents en la arteria pulmonar periférica tras la DBG en 2 pacientes (3,6%) y cierre de colaterales venovenosas en 1 paciente (1,8%).
La media de edad durante la DBG fue de 2,08 años (1-3) (mínimo-máximo, 0,42-17 años). Un total de 47 pacientes (83,9%) recibieron un DBG derecho, 8 pacientes (14,3%) recibieron DBG bilateral y solo 1 paciente (1,8%) 1 DBG izquierdo.
Todos los pacientes tenían pulsaciones periféricas intactas y 54 (96,4%) presentaban acropaquia. Solo 1 paciente (1,8%) presentaba síndrome de la VCS (figura 1 del material adicional) y otro (1,8%) colaterales venosas superficiales en tórax y abdomen asociadas a cianosis profunda secundaria a la DBG (figura 2 del material adicional). Los 2 pacientes recibieron tratamiento quirúrgico para revertir la DBG. Los valores medios de SaO2 fueron 78,27 ± 8,47% (55-99%). Los índices de hemoglobina de los pacientes estudiados se ilustran en la tabla 1 del material adicional.
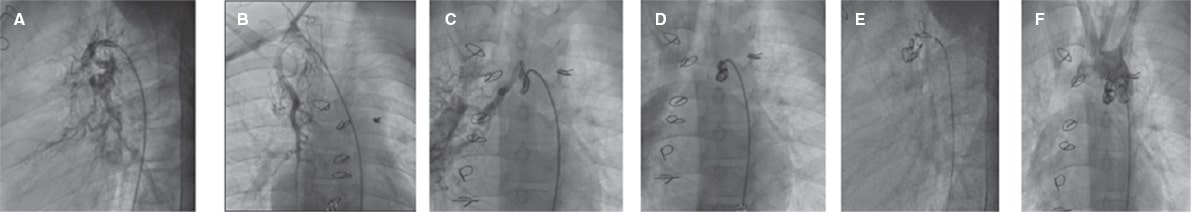
Figura 1. Aortografía en planos craneales lateral y oblicuo anterior derecho muestra 2 arterias colaterales aortopulmonares mayores, una proveniente de la arteria mamaria interna derecha y la otra de la región posterior del arco aórtico con llenado de las 2 arterias pulmonares. A, B: cierre percutáneo exitoso de las colaterales aortopulmonares. C, D, E: cierre de las colaterales aortopulmonares mediante el uso de 3 coils. F: inyección final tras el cierre de las colaterales aortopulmonares con coils.
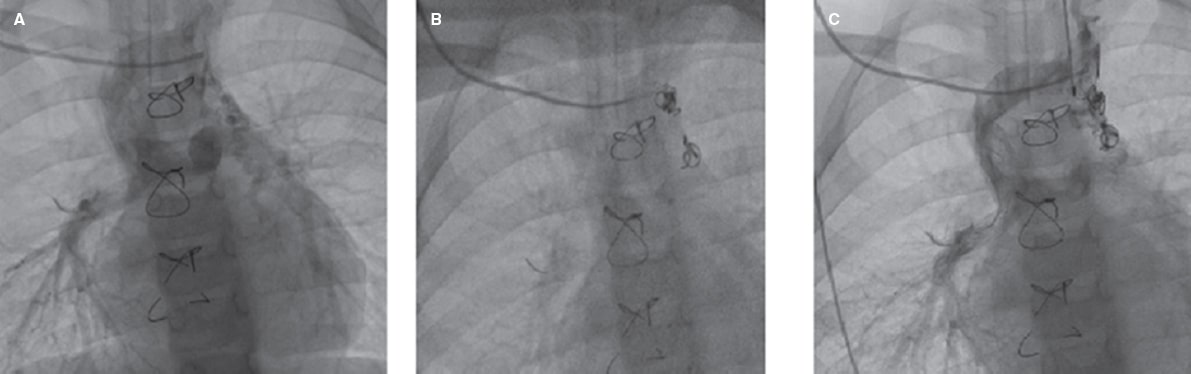
Figura 2. Cierre percutáneo exitoso de colaterales venovenosas. A: colaterales venovenosas drenando en las venas pulmonares superiores derecha e izquierda. B: cierre de la región proximal de las colaterales con coils. C, D: resultado tras el cierre percutáneo de las colaterales venovenosas con coils con flujo residual lento hacia las colaterales.
Tabla 1. Anatomía básica mediante ecocardiografía transtorácica
| Anatomía básica | N | Porcentaje |
|---|---|---|
| D-TGA | 10 | 17,9% |
| DSVD | 16 | 28,6% |
| Atresia tricuspídea | 9 | 16,1% |
| Tetralogía de Fallot | 4 | 7,1% |
| CAVC no balanceado | 3 | 5,4% |
| Atresia pulmonar y tricuspídea | 3 | 5,4% |
| DEVI | 6 | 9,8% |
| Ventrículo único anatómico | 1 | 1,8% |
| DEVD, DSVD, DSVI, vasos grandes mal apuestos | 2 | 3,6% |
| CAVC balanceado (Tipo A de Rastelli) | 1 | 1,8% |
|
CAVC: canal aurículoventricular común; D-TGA: dextrotrasposición de las grandes arterias; DEVD: doble entrada al ventrículo derecho; DEVI: doble entrada al ventrículo izquierdo; DSVD: doble salida del ventrículo derecho; DSVI: doble salida del ventrículo izquierdo. |
||
Dos de los pacientes (3,6%) eran anémicos con niveles de hemoglobina por debajo del rango normal para su edad y sexo (una niña de 27 meses con niveles de hemoglobina de 8 g/dl y un niño de 13 años con niveles de hemoglobina de 11,8 g/dl). Treinta y ocho pacientes (67,9%) presentaban policitemia con niveles de hemoglobina entre 14,5 y 21,1 g/dl y una media de 16,92 ± 1,75 g/dl. Además, 31 pacientes (55,4%) presentaban valores altos de hemoglobina entre 44,8 y 71 con una media de 54,37 ± 6,43. Se flebotomizó a 10 pacientes (17.9%) con anterioridad al cateterismo cardiaco; 4 de ellos (7,14%) fueron flebotomizados por primera vez mientras que los otros 6 (10,7%) ya se les había flebotomizado por presentar síntomas de hiperviscosidad tales como fatiga, cefalea, disnea y trastornos visuales. Los datos ecocardiográficos se incluyen en la tabla 1 y tabla 2.
Tabla 2. Datos ecocardiográficos
| Variables | N |
|---|---|
| Morfología del ventrículo dominante | |
| Ventrículo izquierdo | 26 (46,4%) |
| Ventrículo derecho | 27 (48,2%) |
| Ventrículo único indeterminado | 1 (1,8%) |
| Función sistólica ventricular | |
| Mantenida | 48 (85,7%) |
| Alterada | 8 (14,3%) |
| Ubicación de Glenn | |
| Derecha | 48 (85,7%) |
| Izquierda | 1 (1,8%) |
| Bilateral | 7 (12,5%) |
En 30 pacientes se realizaron tomografías computarizadas multidetector; 2 de ellos (6,7%) presentaban una DBG dilatada aneurismáticamente (figura 3 del material adicional).
Figura 3. Cierre percutáneo exitoso de una colateral venovenosa. A: derivación de Glenn y colateral venovenosa hacia la vena pulmonar superior izquierda. B: cierre percutáneo de la colateral venovenosa con 2 coils. C: inyección final tras el cierre de la colateral venovenosa con un flujo muy reducido hacia la vena pulmonar superior izquierda.
Posteriormente se trató con éxito mediante implante de stent per- cutáneo a 3 pacientes con estenosis significativas de la arteria pulmonar izquierda.
Todos los pacientes fueron cateterizados incluida la valoración invasiva de las presiones y la SaO2 de varias cámaras cardiacas. Los resultados de esta valoración se muestran en la tabla 2 del material adicional. Se llevó a cabo una valoración exhaustiva de las colaterales venovenosas, de las CAP y de todos los datos recopilados (tabla 3).
Tabla 3. Valoración angiográfica de colaterales
| Cateterismo | N = 56 | |
|---|---|---|
| Colaterales aortopulmonares | ||
| Presencia | Sí | 37/56 (66,1%) |
| Número | Uno | 9/37 (24,3%) |
| Múltiples | 28/37 (75,7%) | |
| Tamaño | Pequeño | 28/37 (75,7%) |
| Moderado/grande | 9/37 (24,3%) | |
| Origen | Aorta descendente | 23/37 (62,2%) |
| Aorta | 11/37 (29,7%) | |
| Arteria subclavia izquierda | 0/37 (0,0%) | |
| AMID y arco aórtico | 1/37 (2,7%) | |
| AMII | 1/37 (2,7%) | |
| Aorta y arteria subclavia izquierda | 1/37 (2,7%) | |
| Drenaje | Izquierdo | 19/37 (51,4%) |
| Derecho | 7/37 (18,9%) | |
| Ambos | 11/37 (29,7%) | |
| Colaterales venovenosas | ||
| Presencia | Sí | 41/56 (73,2%) |
| Número | Uno | 7/41 (17%) |
| Pocas (2-3) | 3/41 (7,3%) | |
| Múltiples | 31/41 (75,6%) | |
| Tamaño* | Pequeño | 11/41 (26,8%) |
| Moderado/grande | 31/41 (75,6%) | |
| Origen** | Vena innominada izquierda | 35/41 (85,4%) |
| Vena innominada derecha | 1/41 (2,4%) | |
| Vena subclavia | 1/41 (2,4%) | |
| Ácigos y hemiácigos | 1/41 (2,4%) | |
| VCS | 1/41 (2,4%) | |
| No definido | 2/41 (4,8%) | |
| Drenaje*** | Pericárdico | 3/41 (7,3%) |
| Epicárdico | 14/41 (34%) | |
| VCI | 9/41 (22%) | |
| Seno coronario | 7/41 (17%) | |
| Vena abdominal | 2/41 (4,8%) | |
| Ácigos | 3/41 (7,3%) | |
| Pulmonar izquierda | 5/41 (12,2%) | |
|
AMID: arteria mamaria interna derecha; AMII: arteria mamaria interna izquierda; VCI: vena cava inferior; VCS: vena cava superior. * Un paciente presentaba colaterales venovenosas tanto de tamaño pequeño como de tamaño grande. ** Dos pacientes presentaban origen no definido de colaterales venovenosas. *** Dos pacientes presentaban diferentes puntos de drenaje de colaterales venovenosas. |
||
De los 56 pacientes cateterizados, 52 (92,9%) presentaban colaterales, incluidas venovenosas y CAP. Solo 4 pacientes (7,1%) carecían de colaterales. De entre todos los pacientes, 19 (36,5%) recibieron tratamiento médico y seguimiento habitual, se derivó a 20 (38,5%) para valoración quirúrgica para completar la operación de Fontan y se trató a 7 (13,5%) del CP de las colaterales (tabla 4 y figura 1, figura 2 y figura 3). Por problemas económicos, se programó a 2 pacientes (3,8%) para recibir el CP de las colaterales en una sesión posterior. Además, se intentaron cerrar sin éxito las colaterales venovenosas en 2 pacientes (3,8%), se derivó a 2 pacientes (3,8%) para revisión de la derivación de Glenn por un procedimiento fallido y a otros 2 (3,8%) para revisión de la derivación de Glenn y reparación biventricular.
Tabla 4. Detalles del cierre percutáneo de colaterales en 6 pacientes
| Tipo de colaterales | Trayectoria de las colaterales | Coil/dispositivo | Acceso y trayectoria | Complicaciones | Efecto en la SaO2 |
|---|---|---|---|---|---|
| Colaterales VV | Tamaño medio (4 mm) de la vena innominada hacia una de las venas pulmonares izquierdas | Dispositivo AGA ADO II 4 x 6 | Vena subclavia derecha - vena innominada - colaterales VV | Extravasación localizada | La SaO2 pasó del 55% antes de la intervención al 75% a la finalización de esta |
| Colaterales VV | 2 colaterales grandes surgiendo de la vena innominada hacia la vena pulmonar superior izquierda | 2 dispositivos AGA ADO I (8/6 y 6/4) | Vena yugular interna izquierda - vena innominada - colaterales VV Vena subclavia derecha - vena innominada - colaterales VV | Primer intento fallido debido a la alta tortuosidad Segundo intento exitoso | La SaO2 pasó del 83% antes de la intervención al 93% a la finalización de esta |
| Colaterales VV | Colaterales grandes y tortuosas de la vena innominada hacia la vena pulmonar superior izquierda | 2 coils electrolargables Cook (5/3 y 5/5) | Vena subclavia derecha - vena innominada - colaterales VV Vena yugular interna izquierda - Vena innominada – colaterales VV | Sin complicaciones | La SaO2 pasó del 80% antes de la intervención al 92% a la finalización de esta |
| CAPM | 2 CAMP, una procedente de la AMID y otra grande procedente de la parte posterior del arco aórtico con llenado de las 2 arterias pulmonares | 3 coils electrolargables Cook (6,5/5, 5/5 y 5/3) | Arteria femoral derecha - aorta - CAP | Sin complicaciones | La SaO2 pasó del 83% antes de la intervención al 80% a la finalización de esta |
| Colaterales VV | De la vena innominada izquierda hacia la vena pulmonar superior derecha | Coil electrolargable Cook (6,5/5) | Vena subclavia derecha - vena innominada - colaterales VV Vena yugular interna izquierda – vena innominada - colaterales VV hacia las venas pulmonares izquierda y superior derecha | Sin complicaciones | La SaO2 pasó del 69% antes de la intervención al 90% a la finalización de esta |
| Colaterales VV | Colateral VV grande desde la vena innominada hacia las venas sistémicas paravertebrales | Coil electrolargable Cook (5 x 5) | Vena subclavia derecha - vena innominada – colaterales VV Vena yugular interna izquierda – Vena innominada Colaterales VV | Sin complicaciones | La SaO2 pasó del 60% antes de la intervención al 76% a la finalización de esta |
|
ADO: Amplatzer Duct Occluder; AMID: arteria mamaria interna derecha; CAP: colateral aortopulmonar; CAPM: colaterales aortopulmonares mayores; SaO2: saturación de oxígeno; VV: venovenoso. |
|||||
Durante el CP de las colaterales, 3 pacientes desarrollaron complicaciones. El primero, por la embolización de un coil en la vena innominada durante el intento de cerrar las colaterales venovenosas, no obstante, el coil se retiró con éxito con un lazo.
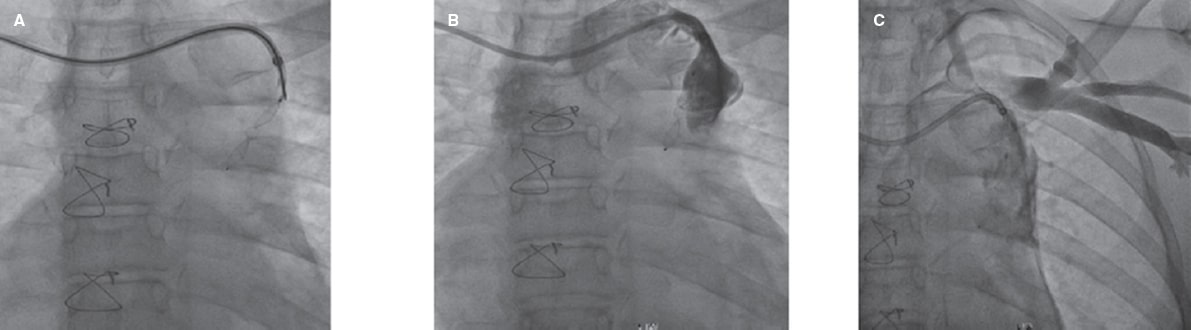
El segundo paciente era una mujer de 18 años tratada del CP electivo de una colateral venovenosa con un dispositivo Amplatzer Duct Occluder II (Abbott, Estados Unidos). Tras liberar el dispositivo en la colateral y taponar su porción proximal, hubo problemas cuando se procedió a separar el cable del dispositivo. No obstante, tras manipulaciones e inyección selectiva en el origen de la colateral, se confirmó la extravasación localizada en el sitio proximal. Se retiró el catéter a la vena innominada y se reinsertó unos minutos, lo cual reveló una menor extravasación y el sellado con éxito de la perforación. La radiografía torácica de control no mostró más complicaciones (figura 4).
Figura 4. Angiografía de colateral venovenosa en plano posteroanterior. A: Amplatzer Duct Occluder II bien colocado en la colateral venovenosa. B: extravasación en el origen proximal de la colateral tras separación del cable. C: inyección tras varios minutos que muestra el sellado de la extravasación.
El tercer paciente era un niño de 13 años que recibió una inyección en la vena ácigos que reveló la presencia de 2 grandes colaterales venovenosas derecha e izquierda hacia las venas pulmonares. Se intentó sin éxito cerrar dichas colaterales. Como la intervención fue larga, el paciente terminó desarrollando una debilidad aguda en el lado izquierdo tras el cateterismo. Tanto la resonancia magnética cerebral como la angiografía confirmaron la presencia de un infarto hemorrágico agudo en las regiones gangliónicas basales derechas y periventriculares y la oclusión de la arteria cerebral media derecha desde el segmento distal M1, indicativo de un evento embólico. Después, el paciente recibió una trombectomía mecánica y desarrolló debilidad residual mínima en el lado izquierdo y disartria.
Los valores de SaO2 aumentó significativamente tras el CP de las colaterales venovenosas (69,83 ± 10,91 frente a 82,83 ± 9,87), con valores p = 0,008 (tabla 5).
Tabla 5. Comparativa entre la SaO2 al principio y después del tratamiento en pacientes tratados del cierre percutáneo de las colaterales venovenosas
| SaO2 (%) | Al principio | Después del tratamiento | Diferencia | Valor del test | p | Sig |
|---|---|---|---|---|---|---|
| Media ± DE | ||||||
| Media ± DE | 69,83 ± 10,91 | 82,83 ± 9,87 | 13,00 ± 3,09 | 4,210* | 0,008 | HS |
| Rango | 55-83 | 71-93 | ||||
|
DE: desviación estándar; SaO2: saturación de oxígeno. p > 0,05: no significativo; p < 0,05: significativo; p < 0,01: altamente significativo. * Prueba t de muestras emparejadas. |
||||||
Aunque los valores basales de SO2 fueron más bajos en pacientes con colaterales venovenosas, esta diferencia no fue estadísticamente significativa. Los niveles de hematocrito y la PAP media fueron mucho mayores en pacientes con colaterales venovenosas que en aquellos sin ellas (p = 0,031 y p = 0,025, respectivamente; tabla 3 del material adicional). La presión telediastólica (PTD) se correlacionó positivamente con la PAP media con un valor de p de 0,001 (figura 4 del material adicional).
La edad a la realización de la DBG se correlacionó positivamente con los niveles de hemoglobina (HCT) y de hemoglobina (p = 0,001 y p = 0,002, respectivamente) y se observó que los pacientes tratados de DBG a edades más avanzadas presentaron niveles más altos de hemoglobina y HCT.
El tiempo trascurrido desde la DBG se correlacionó negativamente con los valores basales de SO2 (p = 0,023) y se observó que cuanto más tiempo había trascurrido desde la derivación de Glenn, menores eran los valores basales de SO2 del paciente. Además, se observó una correlación positiva altamente significativa entre el tiempo transcurrido desde la derivación de Glenn y los niveles de HCT (p = 0,002), indicativo que cuanto más tiempo había trascurrido desde la derivación de Glenn, mayores eran los niveles de HCT del paciente.
DISCUSIÓN
La media de edad a la que se trató de DBG a nuestros pacientes fue de 2,08 años [RIQ = 1-3]. Existen otros 3 registros recientes realizados en países en vías de desarrollo similares al nuestro: el de Azhar et al.9 en Arabia Saudita, el de Meyer et al.10 en Sudáfrica y el de Tariq et al.11 en Pakistán. Las medianas de edad de los pacientes de estos registros fueron 10 meses, 2,5 años y 1,9 años, respectivamente. En registros más antiguos, como los publicados por Talwar et al.12 en India, Al-Dairy et al.13 en Irán y Sen et al.14, también en India, las medianas de edad de los pacientes fueron 3, 5 y 7,5 años, respectivamente, indicativo de una menor edad cuando se realizó la DBG en los registros recientes9-14. A diferencia de los registros de países en vías de desarrollo, la literatura occidental alude a una mediana de edad durante la realización de la DBG inferior al año, tal y como refieren Kogon et al.15 en Atlanta (Estados Unidos), LaPar et al.16 en Virginia (Estados Unidos), Reddy et al.17 en California (Estados Unidos) y Shuler et al.18 en Cincinnati (Estados Unidos).
Lo ideal es que los niños reciban la DBG entre los 6 y 12 meses de edad, seguido de la finalización de la operación de Fontan 1 año después19. La edad relativamente mayor de los niños tratados de DBG en países en vías desarrollo podría deberse a una presentación y diagnóstico tardíos, a la falta de centros de atención primaria, sobre todo en zonas rurales, a una falta de derivaciones en el momento oportuno y a la reticencia de las familias de que se trate a sus hijos mediante corrección quirúrgica escalonada por cuestiones económicas20.
En lo referente a las intervenciones post-DBG, 2 pacientes (3,6%) recibieron stents en la arteria pulmonar periférica antes de acudir a nuestro centro y 3 en la arteria pulmonar izquierda (5,4%). A diferencia de nuestro estudio, solo en 1 paciente del estudio de Yamada et al.21 se implantó el stent en la arteria pulmonar derecha. La discrepancia observada en las tasas de intervención entre los 2 estudios podría deberse a la mayor edad de nuestros pacientes, así como a los esfuerzos por reducir sus comorbilidades para mejorar la capacidad funcional y calidad de vida, sobre todo teniendo en cuenta que la mayoría no eran aptos para finalizar la operación de Fontan.
La anatomía básica más común incluyó la trasposición de las grandes arterias, la doble salida del ventrículo derecho y la atresia tricuspídea, un hallazgo que coincide con los de Naik et al.22 y Sen et al.1. En cambio, Atz et al.23 estudiaron a un total de 382 pacientes en Estados Unidos y confirmaron que la anatomía básica más común era el SCIH (25,6%), seguido de la atresia tricuspídea (18%) y la doble entrada al ventrículo izquierdo (13%). La ausencia de SCIH en los registros realizados en países en vías de desarrollo podría atribuirse a su mal pronóstico y a una baja tasa de supervivencia. Un total de 41(73,2%) de los 56 pacientes de nuestro estudio presentaban colaterales venovenosas. McElhinney et al.24 estudiaron a 54 pacientes y solo 18 (33,3%) presentaban colaterales venovenosas. El porcentaje más alto de nuestro estudio podría deberse al mayor tiempo trascurrido desde la cirugía hasta el cateterismo, ya que el tiempo medio trascurrido entre cirugía y cateterismo fue de 1,3 años en el estudio de McElhinney et al.24 y 7,5 años en el nuestro.
En nuestro estudio, 37 pacientes (66,1%) tenían CAP, una cifra similar a la descrita por Triedman et al.25 que diagnosticaron CAP en el 65% de los pacientes.
En nuestro estudio, se trató a 6 pacientes del CP de colaterales venovenosas: 5 durante este registro y 1 en 2019. Se observó un aumento estadísticamente significativo de la SaO2 (%) tras la intervención (69,83 ± 10,91 frente a 82,83 ± 9,87; p = 0,008). McElhinney et al.24 también confirmaron el éxito de la embolización de los coils en 10 canales colaterales de 6 pacientes, lo cual aumentó los niveles de SaO2 que pasaron del 9 al 20% (una subida media del 16%).
Lu et al.26 aludieron a un estudio de cohorte realizado entre 9 pacientes de entre 5 y 15 años (mediana de 9 años) con cianosis progresiva tras la DBG. Se logró con éxito el CP del sistema venoso ácigos y hemiácigos usando coils en 4 pacientes, oclusores del conducto arterioso permeable en 3, oclusores de la comunicación interauricular en 2 y un oclusor del conducto arterioso permeable con coils en 1 paciente. Los valores de SaO2 de la arteria femoral pasaron del 81 al 88%.
En nuestro registro, de los 6 pacientes tratados del CP de colaterales venovenosas, solo 2 presentaban colaterales venovenosas a venas sistémicas (1 a venas epicárdicas y abdominales y el otro a venas paravertebrales) y los otros 4, colaterales venovenosas a venas pulmonares.
También observamos que 7 de los 8 pacientes con una conexión VCS bilateral preexistente desarrollaron colaterales venovenosas. Además, 10 de los 11 pacientes tenían una distribución inapropiada de la AP/distorsión de la AP y 6 de los 8 pacientes con función sistólica ventricular deteriorada desarrollaron colaterales venovenosas. No obstante, estos hallazgos no fueron significativos a nivel estadístico. Según Magee et al.27, el desarrollo de colaterales venovenosas se asoció a una conexión anómala de la vena cava superior, a la distorsión de la arteria pulmonar, a una mayor presión media de la VCS, a una mayor presión media PA, a una menor presión media en la aurícula derecha y a un aumento del gradiente medio entre la VCS y la aurícula derecha. Solo este último factor se asoció de manera independiente al desarrollo de colaterales.
McElhinney et al.24 confirmaron que, en los pacientes que desarrollaron canales colaterales venosos, el gradiente medio de presión traspulmonar fue mayor al inicio de la DBG (p = 0,005), una correlación que ya no fue significativa en el seguimiento, principalmente por la descompresión del sistema de la VCS a través de los canales colaterales venosos. En nuestros pacientes, no se observó ninguna correlación entre el gradiente de presión traspulmonar (VCS-aurícula izquierda) y la presencia de colaterales venovenosas en el seguimiento.
En nuestro centro se evita el cierre de colaterales venovenosas en pacientes con niveles altos de PAP (hipertensión pulmonar) al tratarse de una contraindicación; aunque las colaterales venovenosas descomprimen un sistema venoso congestionado, en aquellos pacientes con niveles normales o medios de PAP entre 14 y 20 mmHg (que, aunque no presentan hipertensión pulmonar no son buenos candidatos para finalizar la operación de Fontan) acompañado de desaturación, sí procedimos a cerrar las colaterales venovenosas.
El presente estudio confirmó que 37 de los 56 pacientes (66,1%) tenían CAP. Se trató con éxito a 1 paciente del CP de colaterales aortopulmonares. Los pacientes con estas colaterales tratados mediante derivación de Glenn eran más jóvenes y mayor el tiempo trascurrido desde la intervención, un hallazgo que coincide con el de Grosse-Wortmann et al.28, que midieron el flujo sanguíneo de las CAP de forma no invasiva en pacientes con DBG y Fontan empleando IRM. Estos autores descubrieron que una relación Qp/Qs más alta se asoció con menor edad en el momento de crear una ACPS y concluyeron que los pacientes tratados de ACPS a una edad menor tenían más probabilidades de desarrollar CAP.
Hallamos una correlación positiva altamente significativa entre la PTD y los valores medios de PAP (p = 0,001). Coincidiendo con nuestros hallazgos, Schwartz et al.29 informaron que, en el cateterismo pre-Fontan, los valores medios altos de PAP se asociaron a una PTD alta en un único ventrículo. Estos autores sugirieron que esta relación subraya lo importante que es la PTD en individuos con cardiopatía univentricular. También afirmaron que la PTD tiene un papel esencial a la hora medir las presiones arterial pulmonar y venosa central, cuyos niveles altos se asocian a una mayor morbilidad.
CONCLUSIONES
El CP de colaterales es una estrategia de tratamiento post-DBG que, aunque técnicamente exigente, es eficaz a la hora de mejorar tanto la SaO2 como la calidad de vida. Resulta esencial conocer las posibles complicaciones y abordarlas de forma efectiva.
FINANCIACIÓN
Ninguna.
CONSIDERACIONES ÉTICAS
El presente estudio fue aprobado por el comité de ética en investigación de la Facultad de Medicina de la Universidad de Ain Shams (FMASU MS 507/2022). Se obtuvo consentimiento verbal y escrito (para la participación en el estudio, las pruebas y la publicación —incluidas las fotografías—) de los participantes mayores de 18 años o del tutor del paciente en caso de ser menor de 18 años tras explicarles el objetivo del estudio. Las imágenes de pacientes se han anonimizado en la medida de lo posible para preservar su intimidad manteniendo visibles solo los rasgos que ilustran lo descrito en el texto. Nuestra investigación se llevó a cabo de conformidad con las recomendaciones internacionalmente aceptadas para investigaciones clínicas (Declaración de Helsinki de la Asociación Médica Mundial). Se han tenido en cuenta los posibles sesgos de sexo y género en la preparación de este artículo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó ninguna herramienta de inteligencia artificial en la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORES
Y.A. Ali recopiló datos, revisó el análisis estadístico y redactó el manuscrito. N. El-Sayed Nour El Deen recopiló datos y realizó el análisis estadístico. G.S. Elshahed supervisó la recopilación de datos, revisó los resultados y editó el manuscrito.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- El cierre de colaterales venosas hacia las venas pulmonares mejora los valores de SaO2.
¿QUÉ APORTA DE NUEVO?
- El CP de colaterales post-DBG es todo un desafío a nivel técnico.
- Es esencial conocer las posibles complicaciones y abordarlas y tratarlas de manera efectiva.
BIBLIOGRAFÍA
1. Liu S, Joseph KS, Lisonkova S, et al. Association between maternal chronic conditions and congenital heart defects:a population-based cohort study. Circulation. 2013;128:583-589.
2. Mocumbi AO, Lameira E, Yaksh A, et al. Challenges on the management of congenital heart disease in developing countries. Int J Cardiol. 2011;148:285-288.
3. Rao PS. Single ventricle A comprehensive review. Children. 2021;8:441.
4. Salik I, Mehta B, Ambati S. Bidirectional Glenn procedure or hemi-Fontan [Internet], Treasure Island (FL):StatPearls Publishing;2022. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK563299/. Consultado 17 Jun 2024.
5. Dilawar M, Gottliebson WM, Bradley SM, et al. Rapid development of a large systemic-to-pulmonary vein fistula after bidirectional Glenn shunt and successful closure with an Amplatzer duct occluder. Circulation. 2001;104:E41-E42.
6. Tomita H, Ishikawa Y, Hasegawa S, et al. Use of a 0.052“Gianturco Coil to embolize a persistent right superior vena cava following extracardiac total cavopulmonary connection. Catheter Cardiovasc Interv. 2001;52:481-483.
7. Spicer RL, Uzark KC, Moore JW, et al. Aortopulmonary collateral vessels and prolonged pleural effusions after modified Fontan procedures. Am Heart J. 1996;131:1164-1168.
8. Bradley SC, McCall MM, Sistino JJ, et al. Aortopulmonary collateral flow in the Fontan patient:Does it matter?Ann Thorac Surg. 2001;72:408-815.
9. Azhar A, Eid R, Elakaby A. et al. Outcomes of bidirectional Glenn surgery done without prior cardiac catheterization. Egypt Heart J. 2022;74:57.
10. Meyer HM, Marange-Chikuni D, Zühlke L, et al. Outcomes After Bidirectional Glenn Shunt in a Tertiary-Care Pediatric Hospital in South Africa. J Cardiothorac Vasc Anesth. 2022;36:1573-1581.
11. Tariq M, Zahid I, Hashmi S, et al. The Glenn procedure:Clinical outcomes in patients with congenital heart disease in Pakistan. Ann Card Anaesth. 2021;24:30-35.
12. Talwar S, Sandup T, Gupta S, et al. Factors determining early outcomes after the bidirectional superior cavopulmonary anastomosis. Indian J Thorac Cardiovasc Surg. 2018;34:457-467.
13. Al-Dairy A, Dehaki MG, Omrani G, et al. The Outcomes of Superior Cavopulmonary Connection Operation:a Single Center Experience. Braz J Cardiovasc Surg. 2017;32:503-507.
14. Sen S, Bandyopadhyay B, Eriksson P, et al. Functional capacity following univentricular repair--midterm outcome. Congenit Heart Dis. 2012;7:423-432.
15. Kogon BE, Plattner C, Leong T, et al. The bidirectional Glenn operation:a risk factor analysis for morbidity and mortality. J Thorac Cardiovasc Surg. 2008;136:1237-1242.
16. LaPar DJ, Mery CM, Peeler BB, et al. Short and long-term outcomes for bidirectional Glenn procedure performed with and without cardiopulmonary bypass. Ann Thorac Surg. 2012;94:164-171.
17. Reddy VM, McElhinney DB, Moore P, et al. Outcomes after bidirectional cavopulmonary shunt in infants less than 6 months old. J Am Coll Cardiol. 1997;29:1365-1370.
18. Shuler JM, Statile C, Heydarian H, et al. Surgical Timing and Outcomes of Unilateral Versus Bilateral Superior Cavopulmonary Anastomosis:An Analysis of Pediatric Heart Network Public Databases. Pediatr Cardiol. 2021;42:662-667.
19. Silvilairat S, Cabalka AK, Cetta F, et al. Protein-losing enteropathy after the Fontan operation:Associations and predictors of clinical outcome. Congenit Heart Dis. 2008;3:262-268.
20. Tewfik M, El-Sayed M, Roushdy A, et al. The Glenn Shunt Revisited, A Single Center Registry in Ain Shams University Cardiology Department. Congenit Heart Dis. 2022;17:71-85.
21. Yamada K, Roques X, Elia N, et al. The short- and mid-term results of bidirectional cavopulmonary shunt with additional source of pulmonary blood flow as definitive palliation for the functional single ventricular heart. Eur J Cardiothorac Surg. 2000;18:683-689.
22. Naik RB, Srivastava CP, Arsiwala S, et al. Early outcomes after the on pump bidirectional Glenn procedure:A single center experience. J Card Surg. 2021;36:3207-14.
23. Atz AM, Travison TG, McCrindle BW, et al. Cardiac performance and quality of life in patients who have undergone the Fontan procedure with and without prior superior cavopulmonary connection. Cardiol Young. 2013;23:335-343.
24. McElhinney DB, Reddy VM, Hanley FL, et al. Systemic venous collateral channels causing desaturation after bidirectional cavopulmonary anastomosis:Evaluation and management. J Am Coll Cardiol. 1997;30:817-824.
25. Triedman JK, Bridges ND, Mayer JE, et al. Prevalence and risk factors for aortopulmonary collateral vessels after Fontan and bidirectional Glenn procedures. J Am Coll Cardiol. 1993;22:207-15.
26. Lu M, Wu W, Zhang G, et al. Transcatheter occlusion of azygos/hemiazygos vein in patients with systemic venous collateral development after the bidirectional Glenn procedure. Cardiology. 2014;128:293-300.
27. Magee AG, McCrindle BW, Mawson J, et al. Systemic venous collateral development after the bidirectional cavopulmonary anastomosis:prevalence and predictors. J Am Coll Cardiol. 1998;32:502 508.
28. Grosse-Wortmann L, Al-Otay A, Yoo SJ. Aortopulmonary collaterals after bidirectional cavopulmonary connection or Fontan completion:quantification with MRI. Circ Cardiovasc Imaging. 2009;2:219-25.
29. Schwartz MC, Brock MA, Nykanen D. et al. Risk factors for an elevated ventricular end-diastolic pressure prior to the Fontan operation. Pediatr Cardiol. 2018;39:315-323.