RESUMEN
El ictus después de un implante percutáneo de válvula aórtica es una de las complicaciones más devastadoras. Su etiología es multifactorial y en torno a la mitad de los casos ocurren durante el procedimiento o en el periodo inmediatamente posterior. El uso de dispositivos de protección embólica durante la intervención para prevenir que los émbolos alcancen los vasos cerebrales es una estrategia preventiva muy prometedora para reducir esta complicación. Sin embargo, la evidencia sólida que apoye su uso sistemático todavía es escasa. El estudio REFLECT II es un estudio aleatorizado que evalúa la seguridad y la eficacia de un dispositivo de protección embólica en pacientes que reciben un implante percutáneo de válvula aórtica.
Palabras clave: TAVI. Ictus. Sistemas de protección embólica. Prevención.
Abstract
The occurrence of strokes after transcatheter aortic valve replacement is one of the most devastating complications. It has a multifactorial etiology and nearly half of the events occurr during or immediately after the procedure. The use of periprocedural embolic protection devices to stop the emboli from reaching the cerebral vessels is a promising preventive strategy to reduce this complication. However, we still lack solid evidence supporting its systematic use. The REFLECT II clinical trial is a new randomized clinical trial that assessed the safety and efficacy profile of an embolic protection device in patients undergoing transcatheter aortic valve replacement.
Keywords: TAVI. Stroke. Embolic protection device. Prevention.
Abreviaturas:
ACV: accidente cerebrovascular. DPCE: dispositivo de protección cerebral embólica. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El accidente cerebrovascular (ACV) tras el implante percutáneo de válvula aórtica (TAVI) es una de las complicaciones más temidas y devastadoras, si no la más transcendente, por el impacto en la calidad de vida y en la mortalidad de los pacientes. Si bien no es muy frecuente (~3%), su incidencia no ha disminuido de forma paralela a la de otras complicaciones con el desarrollo de la técnica y los nuevos dispositivos, a pesar de los esfuerzos y de las medidas preventivas adoptadas1. Varios estudios utilizando resonancia magnética y Doppler cerebral han demostrado que la gran mayoría de los ACV tras un TAVI tienen un origen embólico desde la propia válvula aórtica2, y al menos la mitad están en estrecha relación temporal con el procedimiento3. Por ello, los dispositivos de protección cerebral embólica (DPCE) han surgido como una estrategia preventiva, a modo de barrera mecánica para proteger el territorio vascular cerebral durante la intervención. Recientemente se han presentado los resultados del estudio REFLECT II (NCT 02536196), un estudio aleatorizado para evaluar la seguridad y la eficacia del DPCE TriGUARD 3 (Keystone Heart Ltd, Caesarea, Israel) en la reducción de eventos clínicos y lesiones cerebrales durante el TAVI4.
ESTUDIO REFLECT II
Se trata de un estudio aleatorizado 2:1 (dispositivo frente a control) con un tamaño muestral estimado de 225 pacientes, aunque por su finalización prematura incluyó 179 pacientes (121 en el grupo del dispositivo y 58 en el grupo control). El objetivo primario de seguridad fue un evento clínico combinado que incluyó muerte, ictus, hemorragia amenazante para la vida, fallo renal agudo en estadio 2 o 3, complicación vascular mayor o reintervención valvular a los 30 días. El objetivo de eficacia por análisis jerárquico incluyó mortalidad o ictus a 30 días, deterioro en la prueba neurológica NIHSS (National Institute of Health Stroke Scale), ausencia de lesiones cerebrales y volumen total en resonancia los 2 a 5 días posteriores al procedimiento. Para el objetivo primario de seguridad se añadieron los datos de 41 pacientes tratados con el dispositivo de la fase inicial de reclutamiento «roll-in» (162 frente a 58), y para el análisis de eficacia se utilizaron además 63 pacientes del grupo control del estudio previo con este dispositivo DEFLECT III (NCT02070731)5 (121 frente a 121 pacientes control). El análisis preespecificado de eficacia por protocolo se estableció en los pacientes que exclusivamente tuviesen una cobertura completa de los 3 troncos cerebrales, que al final se consiguió en 62 (59,3%) pacientes. Las características basales estuvieron bien equilibradas entre ambos grupos, salvo un mayor porcentaje de pacientes con antecedente de ictus en el grupo del dispositivo. Aunque no hubo diferencias estadísticamente significativas en el objetivo primario de seguridad, el porcentaje de eventos fue mayor en el grupo del dispositivo (15,9 frente a 7,0%; p = 0,11), principalmente debido a una mayor incidencia de hemorragia amenazante para la vida (5,7 frente a 0%; p = 0,12) y de complicación vascular mayor (7,0 frente a 0%; p = 0,04) relacionada con el TAVI y no con el DPCE. El objetivo de eficacia también fue similar en los 2 grupos en todos los eventos analizados: mortalidad o ictus a 30 días (9,8 frente a 6,7% en el grupo control; p = 0,475), empeoramiento de la puntuación NIHSS (14,1 frente a 7,6%; p = 0,176), lesiones cerebrales (85,0 frente a 84,9%; p = 1,000) y volumen de las lesiones cerebrales (215,4 frente a 188,1 mm3; p = 0,405) (tabla 1). El volumen total de las lesiones cerebrales fue menor en el análisis por protocolo preespecificado de los pacientes con protección cerebral completa (145,7 frente a 188,1 mm3), pero sin alcanzar la significación estadística.
Tabla 1. Estudios aleatorizados realizados con sistemas de protección cerebral embólica
| Estudio | Año | Dispositivo | N.º total de pacientes/total con DPCE | Objetivo primario | Resultados principales |
|---|---|---|---|---|---|
| EMBOL-X, Wendt et al.6 | 2015 | EMBOL-X (Edwards Lifesciences, Estados Unidos | 30/14 | Lesiones cerebrales nuevas Volumen de lesiones |
|
| DEFLECT III, Lansky et al.5 | 2015 | TriGuard (Keystone Heart Ltd, Israel) | 85/46 | Seguridad y eficacia Objetivo de seguridad: muerte, ictus, hemorragia amenazante para la vida, fallo renal (estadio 2-3), complicación vascular mayor |
|
| MISTRAL-C,Van Mieghem et al.7 | 2016 | SENTINEL (Boston Scientific, Estados Unidos) | 65/32 | Nuevas lesiones cerebrales |
|
| CLEAN-TAVI, Haussig et al.8 | 2016 | SENTINEL (Boston Scientific, Estados Unidos) | 100/50 | Número y volumen de lesiones cerebrales |
|
| SENTINEL, Kapadia et al.9 | 2017 | SENTINEL (Boston Scientific, Estados Unidos) | 363/244 | Seguridad y eficacia clínica (MACCE) del DPCE durante el TAVI |
|
| REFLECT II, Moses4 | 2020 | TriGUARD 3(Keystone Heart Ltd, Israel) | 179/121 | Objetivo de seguridad (evento combinado) a 30 días Objetivo de eficacia (muerte o ictus, deterioro de prueba neurológica, ausencia de lesiones cerebrales y volumen) a 30 días |
|
|
DPCE: dispositivo de protección cerebral embólica; MACCE: eventos adversos cardiovasculares mayores; NIHSS: National Institute of Health Stroke Scale; TAVI: implante percutáneo de válvula aórtica. |
|||||
REFLEXIONES SOBRE EL ENSAYO REFLECT II
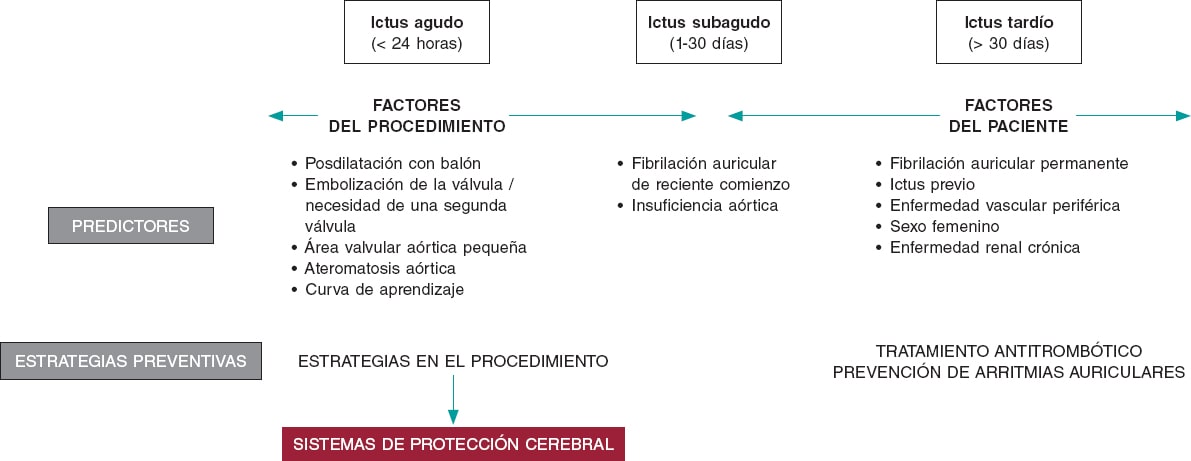
El ACV tras un TAVI es un problema complejo y con una etiología multifactorial. Factores propios del paciente, como arritmias auriculares o enfermedad vascular cerebral previa, factores relacionados con el procedimiento, como embolias o inestabilidad hemodinámica, y la terapia antitrombótica posterior, tienen un impacto en diferentes momentos durante y tras el TAVI (figura 1). Los DPCE podrían ayudar a reducir los ACV relacionados con el propio procedimiento. Se han realizado 6 ensayos clínicos aleatorizados (incluyendo los estudios DEFLECT III y REFLECT II) con DPCE en pacientes tratados con TAVI (tabla 1)4-9. La incorporación de este nuevo estudio vuelve a señalar las limitaciones de los estudios aleatorizados previos con DPCE, con un número pequeño de pacientes incluidos y eventos poco frecuentes, y por lo tanto sin potencia suficiente para evaluar diferencias en los resultados clínicos. La gran mayoría de los objetivos primarios incluyeron eventos subrogados a hallazgos en pruebas de imagen (en general incidencia y volumen de nuevas lesiones cerebrales en la resonancia)10.
Figura 1. Factores de riesgo de accidentes cerebrovasculares tras un TAVI y posibles estrategias de prevención.
El REFLECT II es un estudio complejo en cuanto a diseño y análisis, con diferentes grupos poblacionales para los objetivos de seguridad y eficacia, junto con múltiples factores interconectados que pueden enmascarar un posible efecto beneficioso del dispositivo. Como en los estudios previos, la tasa de éxito del implante fue muy alta (> 90%) y sin complicaciones graves asociadas. Se debe tener en cuenta que se trata de una estrategia preventiva, por lo que la seguridad debe ser primordial y el número de complicaciones asociadas a su uso debería ser próximo a cero. En términos de eficacia, hay que considerar que el porcentaje de pacientes con cobertura cerebral completa fue bajo (~ 60%), a pesar de que el dispositivo está diseñado para cubrir los 3 troncos supraaórticos. Queda por elucidar si el análisis previo de la tomografía computarizada a nivel del arco y los troncos supraaórticos puede contribuir a seleccionar los mejores candidatos para este dispositivo. En otros estudios, el porcentaje de pacientes con material capturado dentro de los filtros del dispositivo SENTINEL (Boston Scientific, Corp., Estados Unidos) ha sido sistemáticamente alto (> 90%). Otra limitación de este estudio es que se desconocen la cantidad y la naturaleza del material embolizado, dado el propio diseño del dispositivo que actúa como barrera deflectora impidiendo la entrada del material embólico en los troncos supraaórticos. Por último, el resultado neutro del análisis de los 4 objetivos de eficacia apoya más un uso selectivo de los DPCE en pacientes considerados de alto riesgo de eventos embólicos; por ejemplo, con calcificación muy grave de la válvula aórtica o bicúspide, procedimientos valve-in-valve o ictus previo. Es cierto que varios estudios observacionales con comparaciones de cohortes históricas11 y registros con ajuste de propensión de riesgo12 han demostrado una tasa menor de ACV isquémico intrahospitalario (o en las primeras 72 horas) de forma global, pero se trata de estudios con posibles sesgos y limitaciones. Por lo tanto, son necesarios estudios aleatorizados con potencia suficiente que permitan detectar diferencias clínicas para establecer una indicación definitiva de esta medida preventiva. Dos estudios aleatorizados en marcha (PROTECTED TAVR [NCT04149535] y BHF PROTECT-TAVI [ISRCTN16665769]), con un tamaño muestral importante y evaluación sistemática por un especialista en neurología, permitirán aclarar estas dudas. La implicación de un neurólogo en la evaluación de los pacientes es un aspecto trascendental en el diseño de estos estudios, que ayudará a detectar eventos clínicos «silentes» para los no especialistas que pueden conllevar un deterioro neurológico posterior con implicaciones clínicas en el seguimiento a medio y largo plazo, principalmente en pacientes jóvenes y con mayor esperanza de vida.
No hay duda de la importancia y del impacto de los ACV tras un TAVI, y el objetivo final debe ser reducir su incidencia. El propio procedimiento origina que el material embólico migre hacia el territorio cerebral en una gran mayoría de los pacientes. La evidencia actual de los DPCE procedente de los ensayos clínicos aleatorizados se centra en la reducción del volumen de las lesiones cerebrales silentes como un marcador subrogado de enfermedad cerebral. El beneficio clínico de estos dispositivos se basa solo en estudios observacionales, por lo que su uso universal frente al selectivo para la reducción de eventos clínicos está todavía por determinar. Futuros estudios aleatorizados, con un tamaño muestral mayor, con una metodología adecuada y con potencia estadística suficiente para detectar diferencias en eventos clínicos, marcarán el devenir de los DPCE en la prevención de ACV tras un TAVI.
FINANCIACIÓN
No existen fuentes de financiación para este artículo.
CONFLICTO DE INTERESES
L. Nombela-Franco es proctor de Abbott Vascular y ha recibido honorarios por consultoría de Abbott Vascular y Boston Scientific. G. Tirado-Conte no tiene conflictos que declarar.
BIBLIOGRAFÍA
1. Huded CP, Tuzcu EM, Krishnaswamy A, et al. Association Between Transcatheter Aortic Valve Replacement and Early Postprocedural Stroke. JAMA. 2019;321:2306-2315.
2. Armijo G, Nombela-Franco L, Tirado-Conte G. Cerebrovascular events after transcatheter aortic valve implantation. Front Cardiovasc Med. 2018;5:104.
3. Nombela-Franco L, Webb JG, de Jaegere PP, et al. Timing, predictive factors, and prognostic value of cerebrovascular events in a large cohort of patients undergoing transcatheter aortic valve implantation. Circulation. 2012;126:3041-3053.
4. Moses JW. A randomized evaluation of the TriGUARD3 cerebral embolic protection device to reduce the impact of cerebral embolic lesions after transcatheter aortic valve implantation:the REFLECT II trial. En:Transcatheter Cardiovascular Therapeutics 2020 (TCT 2020). October 15, 2020. Disponible en: https://academic.oup.com/eurheartj/article/42/27/2670/6277114. Consultado 4 Nov 2020.
5. Lansky AJ, Schofer J, Tchetche D, et al. A prospective randomized evaluation of the TriGuard™HDH embolic DEFLECTion device during transcatheter aortic valve implantation:results from the DEFLECT III trial. Eur Heart J. 2015;36:2070-2078.
6. Wendt D, Kleinbongard P, Knipp S, et al. Intraaortic protection from embolization in patients undergoing transaortic transcatheter aortic valve implantation. Ann Thorac Surg. 2015;100:686-691.
7. Van Mieghem NM, van Gils L, Ahmad H, et al. Filter-based cerebral embolic protection with transcatheter aortic valve implantation:the randomised MISTRAL-C trial. EuroIntervention. 2016;12:499-507.
8. Haussig S, Mangner N, Dwyer MG, et al. Effect of a cerebral protection device on brain lesions following transcatheter aortic valve implantation in patients with severe aortic stenosis:the CLEAN-TAVI randomized clinical trial. JAMA. 2016;316:592-601.
9. Kapadia SR, Kodali S, Makkar R, et al. Protection against cerebral embolism during transcatheter aortic valve replacement. J Am Coll Cardiol. 2017;69:367-377.
10. Bagur R, Solo K, Alghofaili S, et al. Cerebral embolic protection devices during transcatheter aortic valve implantation:systematic review and meta-analysis. Stroke. 2017;48:1306-1315.
11. Seeger J, Gonska B, Otto M, et al. Cerebral embolic protection during transfemoral aortic valve replacement significantly reduces death and stroke compared with unprotected procedures. J Am Coll Cardiol Intv. 2017;10:2297-2303.
12. Megaly M, Sorajja P, Cavalcante JL, et al. Ischemic Stroke With Cerebral Protection System During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2020;13:2149-2155.