RESUMEN
Introducción y objetivos: La biopsia endomiocárdica (BEM) es una técnica diagnóstica fundamental en el diagnóstico de distintas miocardiopatías, pero no está exenta de posibles complicaciones. Se presentan los resultados en términos de rentabilidad diagnóstica y seguridad de la serie de BEM realizadas en corazón no trasplantado en nuestro hospital, así como las consecuencias de la implementación de un protocolo de actuación y seguridad en BEM desarrollado en nuestro centro.
Métodos: Se revisaron de forma retrospectiva todas las BEM en corazón no trasplantado realizadas desde septiembre de 2004 hasta julio de 2018. Se comparó la rentabilidad diagnóstica y seguridad en dos etapas: antes y después de la puesta en marcha del protocolo.
Resultados: Se incluyeron 204 BEM realizadas en 190 pacientes. La indicación más frecuente fue el estudio de disfunción ventricular o sospecha de miocarditis (51,5%), seguida de estudio de miocardiopatía restrictiva o infiltrativa (44,6%). Se realizaron 172 BEM en cavidades derechas (84,3%) y 30 en cavidades izquierdas (14,7%); solo en 2 de los procedimientos se tomaron muestras de ambos ventrículos. La BEM permitió el diagnóstico definitivo en el 52% de los casos. Tras la implementación del protocolo se observó una mejoría en la rentabilidad diagnóstica (42,5 frente a 58,1%; p = 0,030) y una disminución en la tasa de complicaciones mayores (del 7,5% al 3,2%; p = 0,167), con una reducción estadísticamente significativa en la tasa de perforaciones cardiacas (6,3 frente a 0,8%; p = 0,025).
Conclusiones: La BEM es una técnica con un gran potencial diagnóstico en pacientes con sospecha de miocardiopatía. Aunque puede presentar complicaciones potencialmente graves, la puesta en marcha de un protocolo de actuación y seguridad se asocia a una reducción en la tasa de complicaciones y a una mejoría en la rentabilidad diagnóstica.
Palabras clave: Biopsia endomiocárdica. BEM. Miocardiopatías. Miocarditis. Amiloidosis. Mapa electroanatómico.
ABSTRACT
Introduction and objectives: Endomyocardial biopsy (EMB) is an established diagnostic tool in myocardial disease. However, this technique may carry major complications. We present the diagnostic and safety results of our experience in EMB in the non-transplant setting. We also present the results after the implementation of a technical and safety protocol developed at our center.
Methods: We retrospectively analyzed the data of all EMBs conducted in non-transplant patients from September 2004 through July 2018. We compared the diagnostic yield and rate of major complications of EMB in two different periods: before and after implementing the protocol.
Results: We included 204 EMBs performed in 190 patients. The most frequent indications were the evaluation of ventricular dysfunction or suspected myocarditis (51.5%) and the evaluation of restrictive cardiomyopathy or suspected infiltrative disease (44.6%). One hundred and seventy-two EMBs were performed in the right cardiac chambers (84.3%) and 30 EMBs in the left cardiac chambers (14.7%). The samples were taken from both ventricles on 2 cases only. Definite diagnosis was reached in 52% of the cases. After the implementation of the protocol, the diagnostic yield significantly improved (42.5% vs 58.1%; P = .030) and the rate of major complications decreased (from 7.5% to 3.2%; P = .167), with a statistically significant lower rate of cardiac perforation (6.3% vs 0.8%; P = .025).
Conclusions: The EMB is a diagnostic tool with a great potential in patients with suspected cardiomyopathy. Our experience shows that a technical and safety protocol can help decrease the rate of complications and improve the diagnostic yield of EMB.
Keywords: Endomyocardial biopsy. EMB. Cardiomyopathy. Myocarditis. Amyloidosis. Electroanatomical map.
Abreviaturas: BEM: biopsia endomiocárdica.
INTRODUCCIÓN
La biopsia endomiocárdica (BEM) constituye una herramienta diagnóstica clave en la monitorización del rechazo en sujetos con trasplante cardiaco1 y también en el diagnóstico de distintas miocardiopatías2-4. Desde los inicios de esta técnica, a mediados del siglo pasado5,6, se han producido importantes avances que han permitido mejorar su rentabilidad diagnóstica y minimizar el riesgo de complicaciones para el paciente. No obstante, las complicaciones mayores relacionadas con la BEM, aunque infrecuentes, pueden ser graves7.
Nuestro objetivo fue presentar los resultados en términos de rentabilidad diagnóstica y seguridad de la serie de BEM en corazón no trasplantado realizadas en nuestro hospital, un centro de referencia nacional en el diagnóstico y el tratamiento de miocardiopatías que cuenta con una amplia experiencia en trasplante cardiaco y, en consecuencia, también en la monitorización del rechazo mediante BEM en injertos cardiacos. Se pretende asimismo describir las consecuencias de la implementación de un protocolo de actuación y seguridad en la tasa de complicaciones y la rentabilidad diagnóstica de esta técnica.
MÉTODOS
Se incluyeron de forma retrospectiva todos los procedimientos de BEM en corazón no trasplantado realizados desde septiembre de 2004 hasta julio de 2018. Se analizaron datos demográficos y fisiológicos, parámetros ecocardiográficos relevantes (fracción de eyección del ventrículo izquierdo y grosor máximo del septo interventricular) y tiempos relacionados con el procedimiento.
Se tuvieron en cuenta las principales indicaciones para la realización de BEM en corazón no trasplantado, de acuerdo con las recomendaciones publicadas por la American Heart Association/European Society of Cardiology en 20072,3. Con la intención de facilitar el análisis de los datos, la indicación del procedimiento se codificó en 4 categorías: 1) estudio de disfunción ventricular no explicada o sospecha de miocarditis; 2) sospecha de enfermedad infiltrativa o miocardiopatía restrictiva; 3) estudio de arritmias ventriculares; y 4) tumor cardiaco. Se supervisaron todos los estudios histopatológicos de todas las muestras en todos los casos (antes y después del protocolo), por un mismo anatomopatólogo con una dilatada experiencia en el estudio de BEM. Las muestras no se volvieron a revisar de manera retrospectiva para este estudio, sino que se mantuvo el diagnóstico inicial en las 2 etapas.
Se determinó también la tasa de complicaciones mayores, considerando como tales las reflejadas en estudios previamente publicados: muerte, perforación con taponamiento cardiaco, arritmias ventriculares sostenidas con inestabilidad hemodinámica, bloqueo auriculoventricular completo con necesidad de marcapasos, accidente cerebrovascular, infarto agudo de miocardio y aparición de insuficiencia valvular grave8-10. Se compararon las características principales de los procedimientos antes y después de la implementación de un protocolo de actuación y seguridad, incluyendo la tasa de complicaciones mayores y la rentabilidad diagnóstica de la BEM en ambos periodos.
Protocolo de actuación y seguridad
En febrero de 2013 se puso en marcha en nuestro centro un protocolo de actuación y seguridad con el objetivo de mejorar la seguridad de la BEM y diagnosticar de forma precoz las complicaciones en caso de que se produzcan. Los puntos clave de este protocolo son:
-
•Designación de grupo de coordinación del programa BEM en corazón nativo, integrado por cardiólogos hemodinamistas, especialistas en miocardiopatías e insuficiencia cardiaca avanzada, y patólogos.
-
•Planificación del procedimiento junto con el cardiólogo prescriptor de la prueba, teniendo en cuenta la indicación y las características del paciente para poder determinar la localización de la BEM y la vía de acceso. La localización de la BEM (ventrículo derecho, ventrículo izquierdo o ambos) se determina fundamentalmente por el patrón de realce del gadolinio en la resonancia magnética cardiaca. En casos muy seleccionados con captación muy parcheada o con BEM previa negativa, se opta por una BEM guiada por mapa electroanatómico.
-
•Entrega de consentimiento informado por parte del cardiólogo prescriptor y explicación al paciente de los potenciales beneficios y riesgos derivados del procedimiento.
-
•Manejo de fármacos antiagregantes y anticoagulantes periprocedimiento por parte del cardiólogo prescriptor.
-
–Antiagregación: la mayoría de las BEM pueden realizarse sin interrumpir la antiagregación con ácido acetilsalicílico. En caso de precisar la suspensión, se realiza 7 días antes. Para los pacientes en tratamiento con clopidogrel y ticagrelor, la suspensión se realiza 5 días antes, y para los que toman prasugrel, 7 días antes.
-
–Anticoagulación: se tiene en cuenta el riesgo tromboembólico de cada paciente. En los pacientes en tratamiento con dicumarínicos se realiza terapia puente solo en aquellos con alto riesgo tromboembólico, la suspensión del fármaco se realiza 5 días antes del procedimiento y se inicia heparina de bajo peso molecular 3 días antes del procedimiento. En los pacientes con anticoagulantes de acción directa se suspende el fármaco 24-72 horas antes, en función del aclaramiento renal, y no es necesaria terapia puente.
-
–El momento de reintroducción de la antiagregación o la anticoagulación se determina teniendo siempre en cuenta el riesgo hemorrágico y tromboembólico de cada paciente.
-
-
•Realización, o en su defecto supervisión, del procedimiento en todos los casos por parte del cardiólogo operador con mayor experiencia en la realización de BEM en corazón nativo.
-
•Realización de ecocardiografía transtorácica antes del procedimiento para confirmar la ausencia de derrame pericárdico, definir la anatomía cardiaca (tamaño del septo interventricular y de las cavidades, localización de músculos papilares, etc.) y determinar la presencia y el grado de posibles insuficiencias valvulares.
-
•Preparación del equipo de pericardiocentesis antes de comenzar.
-
•Monitorización de las constantes vitales y electrocardiograma durante todo el procedimiento.
-
•Obtención de al menos 3 muestras de buena calidad en cada una de las localizaciones previamente planificadas, con confirmación de la posición del biotomo mediante escopia e inyección de contraste antes de cada una de las tomas.
-
•Traslado de las muestras en formol tamponado al 4% o en medio específico, según las indicaciones del patólogo.
-
•Realización de ecocardiografía transtorácica inmediatamente después de la toma de la última biopsia o en caso de sospecha de complicación durante el procedimiento, y monitorización de la presencia o de un aumento de derrame pericárdico u otras complicaciones mecánicas, como la insuficiencia valvular. En ocasiones (p. ej., sospecha de miocardiopatía inflamatoria o infiltrativa con afectación segmentaria de acuerdo con las pruebas de imagen previas), resulta útil la realización de un ecocardiograma durante el procedimiento para ser más precisos en la localización del segmento específico que se quiere biopsiar.
-
•Observación hemodinámica y electrocardiograma durante al menos 6-8 horas en el hospital de día de hemodinámica, o en caso de pacientes ya ingresados, en la unidad de cuidados cardiológicos, con especial atención a la aparición de posibles complicaciones del acceso vascular.
-
•En caso de aparición de derrame pericárdico tras una BEM junto con datos clínicos o ecocardiográficos de taponamiento cardiaco, se intenta realizar pericardiocentesis evacuadora en la misma sala de hemodinámica. En la mayoría de los casos se deja un catéter de drenaje que se retira cuando su débito es prácticamente nulo y se ha resuelto el derrame pericárdico. En caso de aumento progresivo del derrame o inestabilidad hemodinámica a pesar de la pericardiocentesis se indica cirugía urgente para evacuación del derrame pericárdico y reparación de la perforación cardiaca.
Descripción del procedimiento
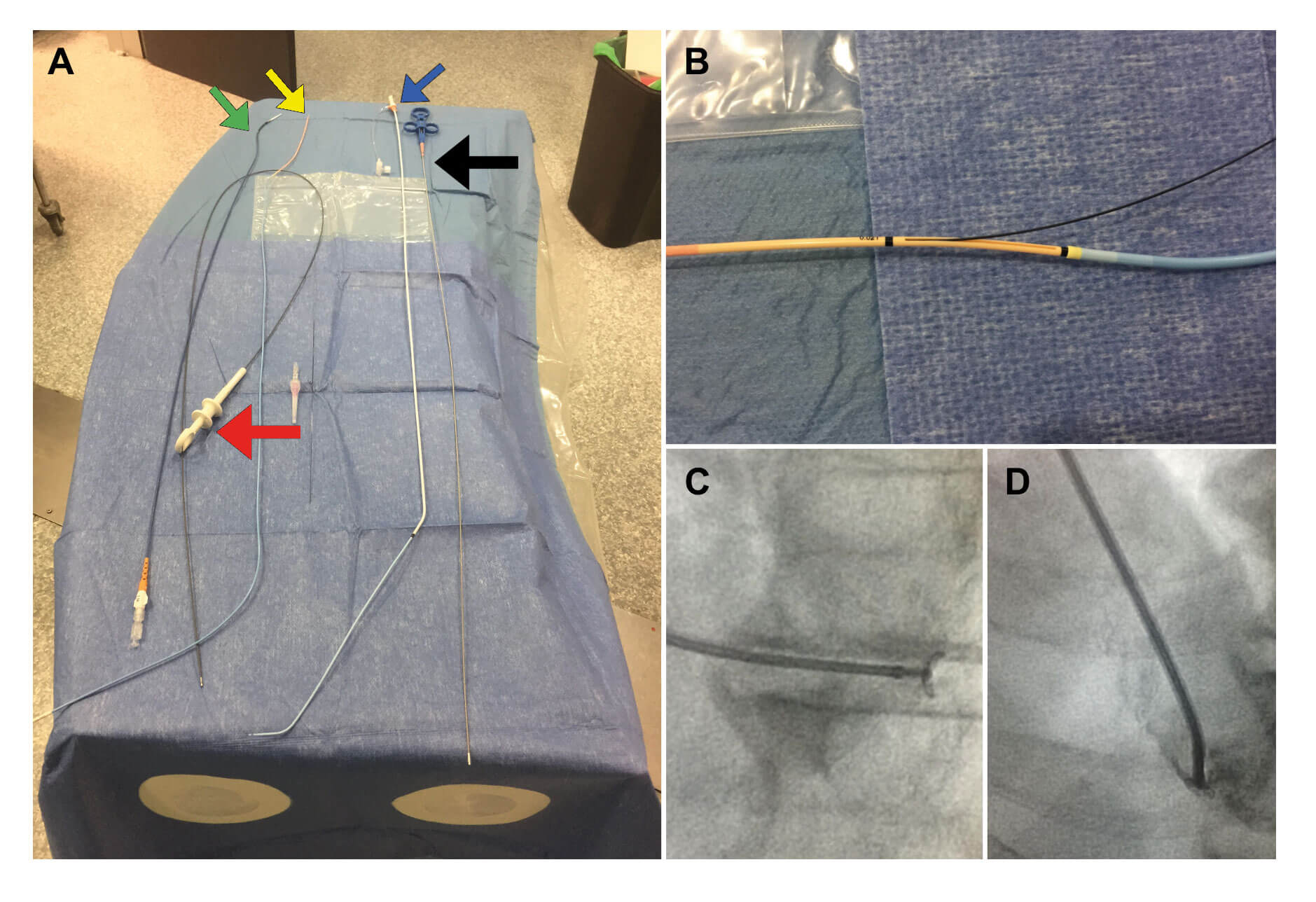
La descripción del procedimiento puede consultarse en el material adicional y en la figura 1.
Figura 1. A: material utilizado para la realización de BEM en nuestro centro. En la parte derecha se encuentran el biotomo (flecha negra) y la vaina y el catéter multipropósito 7 Fr (flecha azul) empleados en la BEM derecha. En la parte izquierda se encuentran la pinza Endojaw (flecha roja) y 2 de los sistemas sheathless para acceso radial en la BEM izquierda: catéter guía JR4 7,5 Fr de 100 cm (flecha verde) y sistema Railway 7 Fr (flecha amarilla). B: se muestra este último sistema montado en un catéter multipropósito a nivel del puerto de intercambio. C: pinza de BEM abierta y dirigida hacia la pared posterolateral del ventrículo izquierdo para la toma de muestra (oblicua anterior izquierda 30° y craneal 15°). D: giro horario en la misma proyección para dirigir el catéter guía hacia el septo con inyección de contraste para comprobar su posición.
Análisis estadístico
Las variables cualitativas se expresan como porcentajes y las variables continuas se expresan como medias ± desviación estándar como medida de dispersión. Se utilizaron la prueba de 2 para comparar variables cualitativas y la prueba de la t de Student para comparar medias en muestras independientes.
Se utilizó el paquete de datos SPSS 21 (SPSS, Inc.; Chicago, Illinois, Estados Unidos) para llevar a cabo todo el análisis estadístico. Se consideró significativo un valor de p < 0,05.
RESULTADOS
Desde septiembre de 2004 hasta julio de 2018 se realizaron 204 BEM en corazón nativo en 190 pacientes (12 con 2 BEM y 1 con 3 BEM). Todas las BEM, tras la implementación del protocolo, se realizaron directamente o bajo la estrecha supervisión de un mismo operador experimentado. Se realizaron 172 BEM en cavidades derechas (84,3%) y 30 en cavidades izquierdas (14,7%), mientras que solo en 2 procedimientos se tomaron muestras de ambos ventrículos. En el caso de las BEM derechas, el acceso vascular más utilizado fue la vena femoral (88,4%), seguido de la vena cefálica o la basílica (9,9%) y de la vena yugular interna derecha (1,7%). De las BEM izquierdas, algo más de la mitad se realizaron empleando la arteria radial (56,7%) y en el resto (43,3%) la arteria femoral. Uno de los casos de BEM biventricular precisó punción venosa femoral y abordaje transeptal, mientras que en el otro se realizó punción arterial y venosa femoral independiente. En el 47,5% de los casos, la BEM se hizo de forma aislada, y en los demás se realizó junto con otro procedimiento (cateterismo derecho, coronariografía e incluso implante de balón de contrapulsación intraaórtico en un paciente). Cabe destacar que tres de los procedimientos se llevaron a cabo guiados por mapa electroanatómico.
Características del procedimiento y rentabilidad diagnóstica
En la tabla 1 se muestran las características principales de los procedimientos comparando las 2 etapas: antes y después de la implementación del protocolo de actuación y seguridad. Se alcanzó un diagnóstico anatomopatológico definitivo en el 52,0% de los casos de manera global. Es importante destacar que, a pesar de que las indicaciones no fueron significativamente distintas en las 2 etapas, la rentabilidad diagnóstica mejoró de manera estadísticamente significativa tras la puesta en marcha del protocolo (42,5 frente a 58,1%; p = 0,030), sobre todo a expensas de una mayor rentabilidad diagnóstica en los casos de disfunción ventricular o sospecha de miocarditis (28,2 frente a 53,0%; p = 0,013). Se produjo también un aumento significativo del número de muestras obtenidas y del número de BEM izquierdas. Se observó una reducción significativa en los tiempos del procedimiento sin diferencias en los tiempos de escopia, si bien es cierto que esta diferencia pudo deberse a que la BEM aislada (sin otro procedimiento asociado) fue menos frecuente antes que después del protocolo (33,8% frente a 56,5%; p = 0,004).
Tabla 1. Características basales y de los procedimientos de BEM, globales y comparativas antes y después del protocolo de actuación y seguridad
| Total (n = 204) | Antes del protocol (n = 80) | Después del protocolo (n = 124) | p | |
|---|---|---|---|---|
| Características principales | ||||
| Edad (años) | 52,1 ± 17,1 | 50,4 ± 16,5 | 53,2 ± 17,4 | 0,252 |
| Varones (%) | 60,3 | 55,0 | 63,7 | 0,214 |
| FEVI (%) | 44,2 ± 17,2 | 48,1 ± 18,9 | 42,5 ± 16,2 | 0,060 |
| SIV (mm) | 12,8 ± 4,5 | 12,7 ± 4,5 | 12,8 ± 4,5 | 0,927 |
| ASC (m2) | 1,83 ± 0,21 | 1,81 ± 0,23 | 1,84 ± 0,20 | 0,632 |
| Número de muestras válidas | 3,6 ± 1,4 | 3,0 ± 1,2 | 4,0 ± 1,4 | < 0,001 |
| Duración del procedimiento (min) | 43,3 ± 19,9 | 47,8 ± 22,5 | 41,1 ± 18,2 | 0,038 |
| Tiempo de escopia (min) | 12,1 ± 7,1 | 12,6 ± 6,3 | 11,9 ± 7,6 | 0,516 |
| Indicaciones | 0,698 | |||
| Estudio disfunción ventricular no explicada o miocarditis | 105 (51,5%) | 39 (48,8%) | 66 (53,2%) | |
| MCR o sospecha de infiltrativa | 91 (44,6%) | 36 (45,0%) | 55 (44,4%) | |
| Arritmias ventriculares | 5 (2,5%) | 3 (3,7%) | 2 (1,6%) | |
| Tumores | 3 (1,4%) | 2 (2,5%) | 1 (0,8%) | |
| Localización BEM | 0,003 | |||
| Solo ventrículo derecho | 172 (84,3%) | 76 (95,0%) | 96 (77,4%) | |
| Solo ventrículo izquierdo | 30 (14,7%) | 4 (5,0%) | 26 (21,0%) | |
| Biventricular | 2 (1,0%) | 0 | 2 (1,6%) | |
| Rentabilidad diagnóstica (%) | 52,0 | 42,5 | 58,1 | 0,030 |
|
ASC: área de superficie corporal; BEM: biopsia endomiocárdica; FEVI: fracción de eyección del ventrículo izquierdo; MCR: miocardiopatía restrictiva; SIV: septo interventricular. |
||||
Si bien no llegó a alcanzar la significación estadística (p = 0,083), la rentabilidad diagnóstica fue distinta para cada una de las indicaciones, siendo mayor en los casos de sospecha de miocardiopatía restrictiva o infiltrativa y en tumores cardiacos. En la tabla 2 se detalla el diagnóstico de anatomía patológica en cada una de las indicaciones.
Tabla 2. Rentabilidad diagnóstica en cada una de las indicaciones de la BEM
| Indicación BEM | Rentabilidad diagnóstica | Diagnóstico anatomopatológico final |
|---|---|---|
| Estudio disfunción ventricular no explicada o sospecha de miocarditis (n = 105) | Total: 43,8% Antes protocolo: 28,2% Después protocolo: 53,0% (p = 0,013) |
Miocarditis: 37 (35,2%) MCH: 4 (3,8%) Amiloidosis: 2 (1,9%) Toxicidad por cobalto: 2 (1,9%) Miocardiopatía mitocondrial: 1 (1,0%) Sin diagnóstico: 61 (58,1%) |
| Sospecha de MCR o infiltración (n = 91) | Total: 61,5% Antes protocolo: 58,3% Después protocolo: 63,6% (p = 0,611) |
Amiloidosis: 44 (48,4%) MCH: 7 (7,7%) FEM: 2 (2,2%) Sarcoidosis: 1 (1,1%) Miocarditis: 1 (1,1%) Fabry: 1 (1,1%) Sin diagnóstico: 35 (38,5%) |
| Arritmias ventriculares (n = 5) | Total: 40,0% | MCH: 1 (20,0%) Miocarditis: 1 (20,0%) Sin diagnóstico: 3 (60,0%) |
| Tumores cardiacos (n = 3) | Total: 66,7% | Angiosarcoma: 2 (66,7%) Sin diagnóstico: 1 (33,3%) |
|
BEM: biopsia endomiocárdica; FEM: fibrosis endomiocárdica; MCH: miocardiopatía hipertrófica. Se muestran la rentabilidad diagnóstica total de la serie y la comparación entre las 2 etapas (antes y después del protocolo de actuación y seguridad) en las 2 indicaciones principales. Se detalla también, expresado en número absoluto y porcentaje entre paréntesis, el diagnóstico anatomopatológico final en cada indicación. |
||
La rentabilidad diagnóstica de la BEM izquierda y la BEM biventricular fue similar a la de la BEM solo derecha (56,3 frente a 51,2%; p = 0,384). Cabe mencionar que la indicación más frecuente en el caso de la BEM izquierda fue el estudio de disfunción ventricular o la sospecha de miocarditis (70% de los casos). En cambio, esta indicación era menos frecuente en las BEM derechas (48,9% de los casos).
Todas las BEM guiadas por mapa electroanatómico se realizaron después de la puesta en marcha del protocolo. Se logró un diagnóstico anatomopatológico definitivo en 2 de las 3 BEM (un caso de miocarditis y un caso de miocardiopatía por enterovirus), y además se pudo iniciar tratamiento específico en ambos casos.
Seguridad y complicaciones mayores
En nuestra serie ocurrieron 10 complicaciones mayores, lo que representa una tasa global del 4,9%. Ningún paciente falleció. Todas las complicaciones se produjeron durante la toma de BEM en cavidades derechas, con excepción de los dos casos de accidente isquémico transitorio, que tuvieron lugar durante una BEM izquierda. En la tabla 3 se resumen todas las complicaciones mayores y su evolución.
Tabla 3. Resumen de las complicaciones mayores en orden cronológico de aparición
| Paciente | Fecha procedimiento | Edad (años) | Sexo | Indicación para BEM | Localización | Diagnóstico final | Complicación | Tratamiento |
|---|---|---|---|---|---|---|---|---|
| 1 | Junio 2017 | 66 | Mujer | Estudio de disfunción ventricular o sospecha de miocarditis | VD | Sin diagnóstico | Perforación con taponamiento cardiaco | Pericardiocentesis |
| 2 | Noviembre 2016 | 40 | Varón | Estudio de disfunción ventricular o sospecha de miocarditis | VI | Miocarditis linfocitaria | AIT | No precisó |
| 3 | Junio 2016 | 35 | Varón | Sospecha de MCR o infiltrativa | Biventricular (VD) | Sarcoidosis | TVMS durante BEM derecha con inestabilidad hemodinámica | Cardioversión eléctrica |
| 4 | Mayo 2015 | 71 | Varón | Sospecha de MCR o infiltrativa | VD | Amiloidosis | Arritmia ventricular que degenera en asistolia | Estimulación con marcapasos transcutáneo y atropina intravenosa |
| 5 | Enero 2013 | 49 | Mujer | Estudio de disfunción ventricular o sospecha de miocarditis | VD | Sin diagnóstico | Perforación con taponamiento cardiaco | Pericardiocentesis |
| 6 | Octubre 2012 | 55 | Mujer | Estudio de disfunción ventricular o sospecha de miocarditis | VD | Sin diagnóstico | Perforación con taponamiento cardiaco | Cirugía |
| 7 | Octubre 2011 | 82 | Varón | Sospecha de MCR o infiltrativa | VD | Amiloidosis | Derrame pericárdico grave sin signos de compromiso hemodinámico | Cirugía diferida (por persistencia de derrame pericárdico en el seguimiento) |
| 8 | Julio 2011 | 67 | Varón | Sospecha de MCR o infiltrativa | VI | Amiloidosis | AIT | No precisó |
| 9 | Junio 2008 | 51 | Varón | Estudio de disfunción ventricular o sospecha de miocarditis | VD | Sin diagnóstico | Perforación con taponamiento cardiaco | Pericardiocentesis |
| 10 | Mayo 2007 | 37 | Varón | Estudio de disfunción ventricular o sospecha de miocarditis | VD | Miocarditis linfocitaria | Perforación con taponamiento cardiaco y parada cardiorrespiratoria | Cirugía |
|
AIT: accidente isquémico transitorio; BEM: biopsia endomiocárdica; MCR: miocardiopatía restrictiva; TVMS: taquicardia ventricular monomorfa sostenida; VD: ventrículo derecho; VI: ventrículo izquierdo. |
||||||||
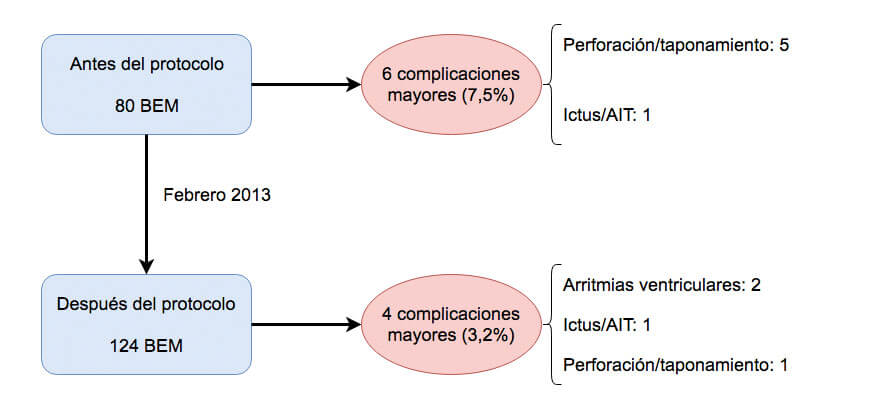
En la figura 2 se muestran las principales complicaciones mayores ocurridas en nuestra serie, antes y después del protocolo de seguridad y actuación. Es importante destacar que, tras la puesta en marcha del protocolo de actuación y seguridad, las complicaciones mayores se redujeron más de la mitad (del 7,5 al 3,2%), aunque esta diferencia no resultó estadísticamente significativa (p = 0,167). La reducción se debió principalmente a una disminución de los casos de perforación cardiaca, con solo un caso desde la puesta en marcha del protocolo (6,3 antes frente a 0,8% después del protocolo; p = 0,025).
Figura 2. Complicaciones mayores asociadas a la BEM antes y después de la puesta en marcha del protocolo. AIT: accidente isquémico transitorio; BEM: biopsia endomiocárdica.
DISCUSIÓN
A pesar de haberse producido en los últimos años importantes avances en el diagnóstico no invasivo del rechazo agudo en pacientes receptores de trasplante cardiaco11,12, y también en el diagnóstico no invasivo de distintas miocardiopatías13-16, la BEM sigue siendo el método de referencia para lograr un diagnóstico definitivo en la mayoría de estas situaciones. Los hallazgos de la BEM pueden tener, además, implicaciones pronósticas relevantes. No obstante, la rentabilidad de esta técnica no es absoluta y varía en las distintas series publicadas (tabla 4)8,9,17-24. En nuestra serie fue posible obtener un resultado anatomopatológico definitivo en algo más de la mitad de los casos. Es interesante observar cómo la rentabilidad diagnóstica en nuestra serie mejoró de forma significativa tras la puesta en marcha del protocolo, a expensas fundamentalmente de una mejoría de la rentabilidad en los casos de disfunción ventricular o de sospecha de miocarditis. Los avances en las técnicas de inmunohistoquímica y de detección genómica, la planificación de todos los casos eligiendo el abordaje más apropiado para cada paciente (según el tipo de miocardiopatía de sospecha), la experiencia acumulada y la obtención de un mayor número de muestras en cada procedimiento son algunos de los motivos que justificarían este cambio.
Tabla 4. Rentabilidad diagnóstica y complicaciones mayores en las principales series de BEM en corazón no trasplantado publicadas hasta la fecha
| Autor (año) | Número de BEM | Localización/acceso vascular | Número medio de muestras/BEM | Rentabilidad diagnóstica | Complicaciones mayores |
|---|---|---|---|---|---|
| Deckers et al.17(1992) | 546 | VD/yugular (96,2%); femoral (1,3%); subclavia (0,5%). |
6 ± 2 | No indicada | 0,5% perforaciones 0,4% mortalidad |
| Felker et al.18(1999)a | 1.278 | VD/yugular | No publicado | 16% | 0,9% |
| Bennet et al.19(2013) | 851 | VD/no indicado | 5,6 | 25,5% | 0,9% |
| Hiramitsu et al.20(1998)b | 19.964 | VD (84,3%); VI (56,7%); AD (6,0%) | 2,6 en VD 2,8 en VI 2,2 AD |
No indicada | 0,7% perforaciones 0,05% mortalidad |
| Holzmann et al.8(2008)c | 3.048 | VD/femoral | 8,2 ± 0,8 (retrospectiva); 10,1 ± 0,6 (prospectiva) |
No indicada | 0,12% en serie retrospectiva 0% en serie prospectiva |
| Yilmaz et al.9(2010) | 755 | VD (17,1%); VI (35,1%); BiV (47,3%)/femoral | 5,6 ± 1,5 en VD; 5,8 ± 1,5 en VI; 8,4 ± 3,5 en BiV |
BiV 79,3 frente a UniV 67,3% | 1,1% (BiV 0,56% frente a UniV 1,51%) |
| Fiorelli et al.21(2012) | 1.783 | VD/yugular + 5 casos VI | No indicado | No indicada | 0,8% 0,2% mortalidad |
| Jang et al.22(2013) | 228 | VD/femoral | 5,6 ± 2,3 | No indicada | 1,3% |
| Chimenti et al.23(2013) | 4.221 | VD (15,9%); VI (27,3%); BiV (56,8%)/femoral | 4,2 ± 1,6 en VD; 4,5 ± 1,2 en VI; 8,7 ± 1,6 en BiV |
VI 96,3 frente a VD 71,4% en BEM BiV | 0,39% (VI 0,33% frente a VD 0,5%) |
| Isogai et al.24(2015)d | 9.167 | No indicado | No indicado | No indicada | 0,9% |
|
AD: aurícula derecha; BEM: biopsia endomiocárdica; BiV: biventricular; UniV: univentricular; VD: ventrículo derecho; VI: ventrículo izquierdo. |
|||||
Las series publicadas por centros con alto volumen de BEM indican tasas de complicaciones mayores inferiores al 1% (tabla 4). En nuestra serie, la tasa de complicaciones es más alta. El hecho de que la indicación más frecuente en nuestro centro fuese el estudio de disfunción ventricular puede justificarlo, ya que este un grupo de pacientes tienen mayor riesgo de complicaciones25. Es importante recalcar que la puesta en marcha del protocolo, sumado al papel que desempeña la curva de aprendizaje en esta técnica23,24, han permitido reducir la ocurrencia de complicaciones mayores en nuestro centro más de la mitad, con una tasa de perforaciones por debajo del 1%. Creemos que nuestros resultados reflejan una situación más real de la BEM en nuestro medio. Por tanto, consideramos que este tipo de procedimiento no debe banalizarse y tiene que ser realizado en centros con experiencia suficiente, bajo las pautas de un protocolo claro de actuación y seguridad.
La toma de muestras de ambos ventrículos ha demostrado, en algunas series, mejorar la rentabilidad diagnóstica de la prueba sin aumentar la tasa de complicaciones9,23. Nuestra experiencia en este abordaje es aún limitada, pero sí hemos evidenciado una mayor aceptación de la BEM izquierda después del protocolo. En España, este abordaje se ha empleado poco hasta el momento en el diagnóstico de miocardiopatías. La diferencia en los criterios diagnósticos utilizados en otras series de BEM de ventrículo izquierdo y biventricular hace difícil la comparación con nuestros resultados. Queremos destacar que, en nuestra experiencia, la BEM izquierda es una técnica segura (con una única complicación desde la puesta en marcha del protocolo) y con una rentabilidad diagnóstica equiparable a la de la BEM derecha. Esta afirmación tiene más valor todavía si tenemos en cuenta que la indicación mayoritaria para las BEM izquierdas fue la sospecha de miocarditis, situación en que la BEM ha tenido clásicamente una rentabilidad diagnóstica limitada26. Consideramos, por tanto, que se trata de un abordaje útil y que puede proporcionar información muy valiosa en estos casos.
En los últimos años, la utilización del abordaje radial para la obtención de una BEM izquierda ha sustituido de manera gradual al acceso femoral en nuestra serie. Existe evidencia en la literatura acerca de su factibilidad y seguridad27-31, con un interés creciente en su aplicación en la práctica clínica gracias al perfeccionamiento de la técnica, con una reducción del perfil de los catéteres y de los biotomos, y el desarrollo de los catéteres sheathless específicos para este acceso. El riesgo de complicaciones relacionadas es potencialmente menor, y la técnica permite, al igual que ocurre con el intervencionismo coronario realizado por vía radial32, reducir la duración de la estancia hospitalaria y poder dar el alta a los pacientes tras unas horas de vigilancia.
La realización de la BEM guiada por mapa electroanatómico constituye una estrategia prometedora para mejorar la rentabilidad diagnóstica de la prueba. Desde que Corrado et al.33 describieron por primera vez la correlación entre las zonas de bajo voltaje y reemplazo fibroadiposo en los pacientes con displasia arritmogénica del ventrículo derecho se han publicado varios estudios que dan valor y constatan la seguridad de este abordaje combinado en el diagnóstico de distintas miocardiopatías34. Nuestra experiencia en estos casos es aún limitada, pero consideramos que constituye una técnica de enorme potencial para el diagnóstico de miocardiopatías de distribución parcheada, como la miocarditis o la sarcoidosis cardiaca. Además, tiene la ventaja de permitir una optimización en la toma de muestras, reduciendo su número y dirigiendo el biotomo hacia zonas de transición en lugar de a zonas de mayor necrosis, donde el riesgo de perforación es mayor.
Limitaciones
Nuestro estudio presenta varias limitaciones. En primer lugar, se trata de un estudio retrospectivo, con todos los sesgos que eso implica al obtener datos de interés. En segundo lugar, recoge la experiencia de un único centro, por lo que sus resultados son difícilmente generalizables. Por otro lado, al tratarse de un centro de referencia en miocardiopatías en clase funcional avanzada y amiloidosis, existe la posibilidad de que estos pacientes estén sobrerrepresentados en nuestra serie.
CONCLUSIONES
En nuestra experiencia, la BEM es una técnica con un atractivo potencial diagnóstico en los pacientes con sospecha de miocardiopatía. No obstante, es importante recordar que es un procedimiento que puede asociar complicaciones potencialmente graves. Este estudio demuestra que la puesta en marcha de un protocolo de actuación y seguridad permite minimizar la aparición de complicaciones y además puede mejorar la rentabilidad diagnóstica de la BEM.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- La BEM es una herramienta clave en el diagnóstico de distintas miocardiopatías.
- A pesar de su enorme potencial diagnóstico, se trata de un procedimiento que puede asociar complicaciones graves.
- Las grandes series de BEM publicadas indican tasas de complicaciones en general bajas (< 1%) y datos de rentabilidad diagnóstica variables.
¿QUÉ APORTA DE NUEVO?
- Se presentan los resultados de seguridad y rentabilidad diagnóstica de la serie de BEM en corazón no trasplantado realizadas en nuestro centro, en una gran variedad de contextos clínicos. Se trata de la serie española más amplia publicada hasta la fecha.
- Se describen las características de la técnica de BEM, así como los detalles del protocolo de actuación y seguridad para realización de BEM aprobado en nuestro centro.
- Se demuestra, por primera vez, que la implementación de un protocolo de actuación y seguridad se asocia con una reducción en la tasa de complicaciones mayores y una mejoría en la rentabilidad diagnóstica de la BEM.
BIBLIOGRAFÍA
1. Costanzo MR, Dipchand A, Starling R, et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2010;29:914-956.
2. Cooper LT, Baughman KL, Feldman AM, et al. The role of endomyocardial biopsy in the management of cardiovascular disease:a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol. 20076;50:1914-1931.
3. Caforio ALP, Pankuweit S, Arbustini E, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis:a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34:2636-2648.
4. Caforio ALP, Adler Y, Agostini C, et al. Diagnosis and management of myocardial involvement in systemic immune-mediated diseases:a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Disease. Eur Heart J. 2017;38:2649-2662.
5. Kent G, Sutton DC, Sutton GC. Needle biopsy of the human ventricular myocardium. Q Bull Northwest Univ Evanst Ill Med Sch. 1956;30:213-214.
6. Sakakibara S, Konno S. Endomyocardial biopsy. Jpn Heart J. 1962;3:537-543.
7. Francis R, Lewis C. Myocardial biopsy:techniques and indications. Heart. 2018;104:950-958.
8. Holzmann M, Nicko A, Kühl U, et al. Complication rate of right ventricular endomyocardial biopsy via the femoral approach:a retrospective and prospective study analyzing 3048 diagnostic procedures over an 11-year period. Circulation. 2008;118:1722-1728.
9. Yilmaz A, Kindermann I, Kindermann M, et al. Comparative evaluation of left and right ventricular endomyocardial biopsy:differences in complication rate and diagnostic performance. Circulation. 2010;122:900-909.
10. Sławek S, Araszkiewicz A, Gaczkowska A, et al. Endomyocardial biopsy via the femoral access —still safe and valuable diagnostic tool. BMC Cardiovasc Disord. 2016;16:222.
11. Miller CA, Fildes JE, Ray SG, et al. Non-invasive approaches for the diagnosis of acute cardiac allograft rejection. Heart Br Card Soc. 2013;99:445-453.
12. Mingo-Santos S, Moñivas-Palomero V, Garcia-Lunar I, et al. Usefulness of Two-Dimensional Strain Parameters to Diagnose Acute Rejection after Heart Transplantation. J Am Soc Echocardiogr. 2015;28:1149-1156.
13. Yoshida A, Ishibashi-Ueda H, Yamada N, et al. Direct comparison of the diagnostic capability of cardiac magnetic resonance and endomyocardial biopsy in patients with heart failure. Eur J Heart Fail. 2013;15:166-175.
14. Zhao L, Fang Q. Recent advances in the noninvasive strategies of cardiac amyloidosis. Heart Fail Rev. 2016;21:703-721.
15. Bami K, Haddad T, Dick A, Dennie C, Dwivedi G. Noninvasive imaging in acute myocarditis. Curr Opin Cardiol. 2016;31: 217.
16. Spieker M, Katsianos E, Gastl M, et al. T2 mapping cardiovascular magnetic resonance identifies the presence of myocardial inflammation in patients with dilated cardiomyopathy as compared to endomyocardial biopsy. Eur Heart J Cardiovasc Imaging. 2018;19:574-582.
17. Deckers JW, Hare JM, Baughman KL. Complications of transvenous right ventricular endomyocardial biopsy in adult patients with cardiomyopathy:a seven-year survey of 546 consecutive diagnostic procedures in a tertiary referral center. J Am Coll Cardiol. 1992;19:43-47.
18. Felker GM, Hu W, Hare JM, Hruban RH, Baughman KL, Kasper EK. The spectrum of dilated cardiomyopathy. The Johns Hopkins experience with 1,278 patients. Medicine (Baltimore). 1999;78:270-283.
19. Bennett MK, Gilotra NA, Harrington C, et al. Evaluation of the role of endomyocardial biopsy in 851 patients with unexplained heart failure from 2000-2009. Circ Heart Fail. 2013;6:676-684.
20. Hiramitsu S, Hiroe M, Uemura A, Kimura K, Hishida H, Morimoto S. National survey of the use of endomyocardial biopsy in Japan. Jpn Circ J. 1998;62:909-912.
21. Fiorelli AI, Benvenuti L, Aielo V, et al. Comparative analysis of the complications of 5347 endomyocardial biopsies applied to patients after heart transplantation and with cardiomyopathies:a single-center study. Transplant Proc. 2012;44:2473-2478.
22. Jang SY, Cho Y, Song JH, et al. Complication Rate of Transfemoral Endomyocardial Biopsy with Fluoroscopic and Two-dimensional Echocardiographic Guidance:A 10-Year Experience of 228 Consecutive Procedures. J Korean Med Sci. 2013;28:1323-1328.
23. Chimenti C, Frustaci A. Contribution and risks of left ventricular endomyocardial biopsy in patients with cardiomyopathies:a retrospective study over a 28-year period. Circulation. 2013;128:1531-1541.
24. Isogai T, Yasunaga H, Matsui H, et al. Hospital volume and cardiac complications of endomyocardial biopsy:a retrospective cohort study of 9508 adult patients using a nationwide inpatient database in Japan. Clin Cardiol. 2015;38:164-170.
25. Elbadawi A, Elgendy IY, Ha LD, et al. National Trends and Outcomes of Endomyocardial Biopsy for Patients With Myocarditis:From the National Inpatient Sample Database. J Card Fail. 2018;24:337-341.
26. Kindermann I, Kindermann M, Kandolf R, et al. Predictors of outcome in patients with suspected myocarditis. Circulation. 2008;118:639-648.
27. Schulz E, Jabs A, Gori T, et al. Feasibility and safety of left ventricular endomyocardial biopsy via transradial access:Technique and initial experience. Catheter Cardiovasc Interv Off J Soc Card Angiogr Interv. 2015;86:761-765.
28. Bagur R, Bertrand OF, Béliveau P, et al. Feasibility of using a sheathless guiding catheter for left ventricular endomyocardial biopsy performed by transradial approach. J Invasive Cardiol. 2014;26:E161-163.
29. Schäufele TG, Spittler R, Karagianni A, et al. Transradial left ventricular endomyocardial biopsy:assessment of safety and efficacy. Clin Res Cardiol Off J Ger Card Soc. 2015;104:773-781.
30. Bagur R, Gilchrist IC. Transradial approach to take a little piece of heart. Catheter Cardiovasc Interv Off J Soc Card Angiogr Interv. 2015;86:766-767.
31. Choudhury T, Schäufele TG, Lavi S, et al. Transradial Approach for Left Ventricular Endomyocardial Biopsy. Can J Cardiol. 2018;34:1283-1288.
32. Córdoba-Soriano JG, Jiménez-Mazuecos J, Rivera Juárez A, et al. Safety and Feasibility of Outpatient Percutaneous Coronary Intervention in Selec-ted Patients:A Spanish Multicenter Registry. Rev Esp Cardiol. 2017;70:535-542.
33. Corrado D, Basso C, Leoni L, et al. Three-dimensional electroanato-mic voltage mapping increases accuracy of diagnosing arrhythmoge-nic right ventricular cardiomyopathy/dysplasia. Circulation. 2005;111:3042-3050.
34. Vaidya VR, Abudan AA, Vasudevan K, et al. The efficacy and safety of electroanatomic mapping-guided endomyocardial biopsy:a systematic review. J Interv Card Electrophysiol. 2018;53:63-71.