Sr. Editor:
Presentamos el caso de un varón joven con una gran comunicación interventricular (CIV) postinfarto que se reparó quirúrgicamente de forma diferida tras 10 días de soporte con circulación con oxigenador extracorpóreo de membrana venoarterial (ECMO-VA). El paciente tenía una CIV residual grande que condicionaba una situación de congestión refractaria por hiperaflujo pulmonar, la cual fue tratada de forma exitosa con cierre percutáneo. El paciente dio su consentimiento para la publicación del caso respetando su anonimato.
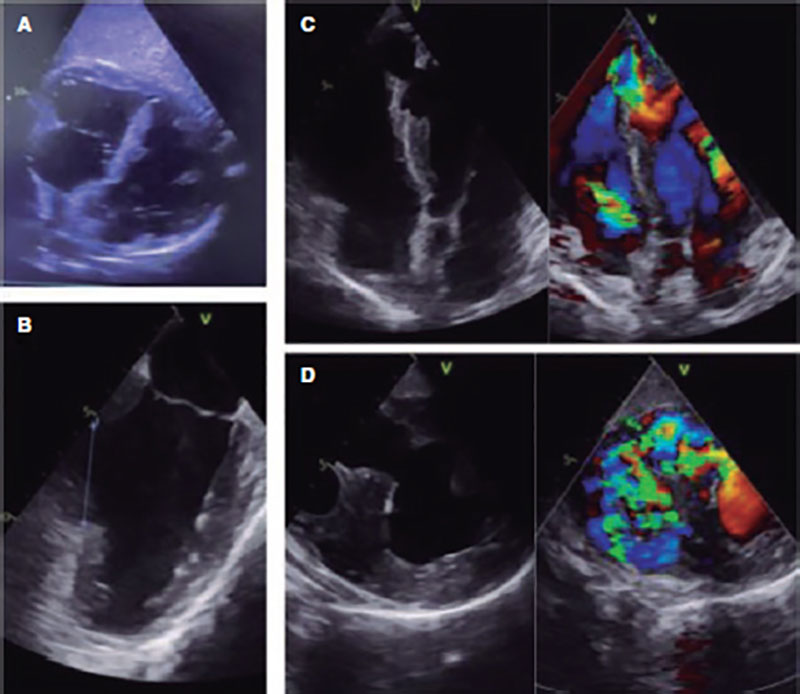
Se trata de un varón de 46 años sin antecedentes, que había sufrido un infarto inferior Killip-I. El cateterismo evidenció enfermedad multivaso, con lesión responsable en la coronaria derecha proximal TIMI-0 (Thrombolysis in Myocardial Infarction) revascularizada con un stent farmacoactivo. Ingresó en la unidad coronaria y evolucionó a shock cardiogénico. Se realizaron estudios ecocardiográficos transtorácicos y transesofágicos, que mostraron disfunción biventricular grave y una CIV amplia (50 mm), inferoseptal basal de trayecto anfractuoso y no restrictiva (Qp/Qs 3) (figura 1).
Figura 1. Gran comunicación interventricular inferoseptal basal hasta los segmentos apicales vista en ecocardiografía transtorácica (A), con diámetro máximo de 50 mm por ecocardiografía transesofágica (B). En los ejes largos (C) y cortos (D) en ecocardiografía transesofágica se observa un shunt izquierda-derecha no restrictivo.
Se procedió a la intubación y canulación de ECMO-VA y balón de contrapulsación. El paciente requirió aminas, con rápida estabilización. Se planteó trasplante cardiaco directo, por el alto riesgo de fracaso quirúrgico, pero finalmente se decidió la reparación diferida.
El paciente se mantuvo estable y sin insuficiencia cardiaca, pero al noveno día presentó hemólisis por trombosis del filtro ECMO, con fallo renal agudo y edema pulmonar, por lo que requirió hemodiafiltración venovenosa continua. Se realizó cirugía urgente con doble bypass aortocoronario y cierre de la CIV con parche de pericardio. En el posoperatorio presentó shock profundo por disfunción ventricular grave (fracción de eyección del ventrículo izquierdo < 10%). Posteriormente tuvo mejoría progresiva, con decanulación y extubación al quinto y séptimo día tras la operación, respectivamente.
Presentó congestión pulmonar y requirió hemodiafiltración venovenosa y luego un diurético intravenoso. En el control con ecocardiografía transtorácica y transesofágica se observó una nueva CIV residual no restrictiva. Tras un balance negativo, un cateterismo mostró presión aórtica 90/60 mmHg, presión arterial pulmonar 26/16/8 mmHg, presión de enclavamiento pulmonar 7 mmHg, presión en aurícula derecha 4 mmHg y Qp/Qs 1,7.
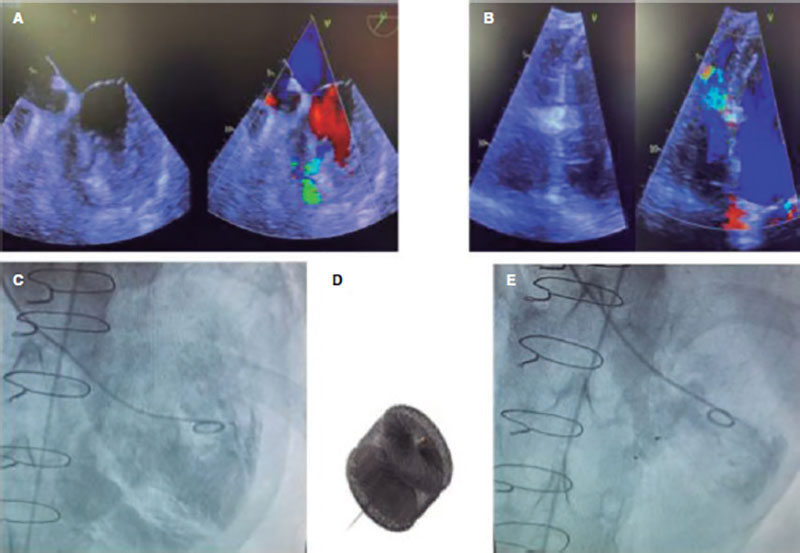
Ante una CIV residual con congestión por hiperaflujo, se indicó su cierre. Por el alto riesgo quirúrgico (miopatía, fallo renal, disfunción ventricular), se optó por un abordaje percutáneo. Por vía venosa femoral se cerró con dispositivo Amplatzer AVPII 12 mm (Abbott, Estados Unidos), con disminución franca del shunt angiográfico y con un shunt residual intradispositivo restrictivo (figura 2).
Figura 2. Comunicación interventricular residual posquirúrgica no restrictiva (A) y pequeña comunicación interventricular residual tras el cierre con Amplatzer (B), por ecocardiografía transtorácica. La angiografía muestra un shunt significativo izquierda-derecha (C) que disminuye significativamente tras el cierre percutáneo (E) con un dispositivo Amplatzer-AVPII (D).
Tras el cierre se pudieron retirar la hemodiafiltración venovenosa y el diurético. Se inició el bloqueo neurohormonal y se dio el alta al paciente euvolémico y en buena clase funcional.
La CIV postinfarto es una complicación mecánica poco frecuente, cuya incidencia ha disminuido (1-3% a 0,1-0,3%) en la era de la revascularización percutánea. Aparece habitualmente a los 3-5 días del infarto, aunque puede hacerlo en las primeras 24 h o de forma tardía. En el infarto agudo de miocardio anterior, la CIV suele ser apical, de trayecto simple, mientras que en el infarto agudo de miocardio inferior suele ser basal, amplia, de trayecto anfractuoso y no restrictiva, con peor pronóstico por presentar mayor shunt y afectación ventricular derecha. El tratamiento definitivo es la reparación quirúrgica, que tiene una alta tasa de mortalidad (hasta el 40%). El momento óptimo de la cirugía es controvertido: las guías de práctica clínica recomiendan cirugía urgente, aunque en centros experimentados se realiza diferida, cuando la aparición del tejido cicatricial permite una buena sutura1. En las series publicadas, la mortalidad es mayor en cirugía precoz, comparada con cirugía diferida más allá de la primera semana, pero puede haber un sesgo de selección, ya que los pacientes más graves son los intervenidos precozmente. Durante la espera, el uso de dispositivos de soporte mecánico puede evitar el deterioro hemodinámico2, aunque cuanto más largo sea el tiempo de espera más aumenta el riesgo de complicaciones asociadas a la asistencia. Respecto a qué dispositivo escoger, la evidencia se basa en pequeños estudios observacionales. El balón de contrapulsación podría ser una opción, pero es insuficiente si hay shock establecido. El Impella (Abiomed, Estados Unidos) permite una buena descarga del ventrículo izquierdo, con el inconveniente de la posibilidad de invertir el shunt y generar desaturación arterial. La ECMO-VA se ha utilizado con éxito y consigue revertir la situación de shock como puente hasta la cirugía o, en algún caso de CIV muy amplia, hasta el trasplante3. También se ha utilizado en este escenario el corazón artificial total, pero la experiencia es limitada. En modelos experimentales ningún dispositivo ha normalizado la situación hemodinámica ni ha igualado el cociente Qp/Qs, pero parece que la combinación de ECMO-VA e Impella/balón de contrapulsación intraaórtico es la opción que más ventajas ofrece4. Una situación particular es la presencia de edema pulmonar secundario al hiperaflujo pulmonar por shunt izquierda-derecha. Parece que optimizar la descarga del ventrículo izquierdo podría mejorar esta situación al disminuir el Qp/Qs, aunque el manejo es controvertido. En cuanto al cierre percutáneo, cada vez hay más experiencia y se ha utilizado como tratamiento definitivo en CIV pequeñas y como puente hasta la cirugía en CIV más grandes, aunque con riesgo de fracaso y embolización. También se ha reportado su uso en CIV residuales tras cirugía cardiaca5.
Como conclusión, el tratamiento de la CIV postinfarto es controvertido. La cirugía es el tratamiento de elección y parece que diferirla aumenta el éxito, pero no se ha establecido el tiempo de espera óptimo. El uso de soporte mecánico puede evitar el deterioro hemodinámico, siendo la ECMO-VA una opción atractiva. El cierre percutáneo puede ser una alternativa en escenarios concretos. Por último, la evidencia es escasa y basada en estudios observacionales, por lo que quedan muchas dudas que resolver.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido durante el proceso asistencial del paciente, así como con la redacción y revisión del caso.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Ronco D, Matteucci M, Kowalewski M, et al. Surgical Treatment of Postinfarction Ventricular Septal Rupture. JAMA Netw Open. 2021;4:e2128309.
2. Hussain S, Pillarella J, Pauwaa S, et al. Management of Post Infarction Ventricular Septal Rupture in Contemporary Era. J Card Fail. 2020;26(10 Suppl):S106.
3. Rob D, Špunda R, Lindner J, et al. A rationale for early extracorporeal membrane oxygenation in patients with postinfarction ventricular septal rupture complicated by cardiogenic shock. Eur J Heart Fail. 2017;19:97-103.
4. Pahuja M, Schrage B, Westermann D, Basir MB, Reshad Garan A, Burkhoff D. Hemodynamic effects of mechanical circulatory support devices in ventricular septal defect. Circ Heart Fail. 2019;12:e005981.
5. Faccini A, Butera G. Techniques, Timing, and Prognosis of Transcatheter Post Myocardial Infarction Ventricular Septal Defect Repair. Curr Cardiol Rep. 2019;21:59.