RESUMEN
Introducción y objetivos: El implante percutáneo de válvula aórtica (TAVI) se realiza tradicionalmente con el apoyo de cirugía cardiaca mínimamente invasiva (CCMI) en el mismo centro. Sin embargo, los avances en los procedimientos han permitido realizar TAVI de forma segura sin cirugía cardiaca inmediata. Este estudio describe la experiencia de nuestro centro en el TAVI sin CCMI.
Métodos: Análisis retrospectivo de los primeros 300 pacientes a quienes se realizó TAVI sin CCMI entre 2020 y 2024. El objetivo principal fue la mortalidad a los 30 días. Los objetivos secundarios fueron la mortalidad intraprocedimiento y la mortalidad hospitalaria, el accidente cerebrovascular, la cirugía cardiaca de urgencia (CCU), las complicaciones vasculares, la hemorragia grave y el implante de marcapasos. Los resultados se compararon con el registro nacional portugués de TAVI.
Resultados: La edad media de la cohorte fue de 82 ± 5 años y el 54% eran mujeres. La mediana de la puntuación de riesgo STS fue de 3,8 [IQR: 2,3-6,6], con el 17% de pacientes de alto riesgo (STS > 8). La mayoría de las intervenciones fueron electivas (83%). Se utilizó el acceso transfemoral en el 99% de los casos y se implantaron válvulas autoexpandibles en el 95% de ellos. La tasa de mortalidad a los 30 días fue del 3,7 % (n = 11). Se produjeron accidentes cerebrovasculares en el 2,7% (n = 8). La tasa de supervivencia al procedimiento fue del 99% (n = 298). No se precisó CCU en ningún paciente y no hubo casos de obstrucción coronaria, necesidad de TAVI en TAVI como medida de rescate ni embolización valvular. Dos pacientes presentaron taponamiento pericárdico (0,7%). Se produjeron hemorragias graves y complicaciones vasculares en el 8% de los pacientes, y se implantó marcapasos en el 20%. Al año, la tasa de mortalidad fue del 12%, el 4% por causas cardiovasculares. El 91% de los supervivientes presentaron una mejora de los síntomas. No hubo diferencias significativas en los resultados en comparación con los del registro nacional de TAVI.
Conclusiones: El TAVI se realizó de forma segura y eficaz sin CCMI, incluso en casos urgentes y complejos. La no necesidad de CCU y los resultados comparables a los referentes nacionales respaldan la viabilidad del TAVI en centros seleccionados sin cirugía cardiaca. Ampliar el acceso al TAVI en este contexto puede reducir los tiempos de espera y mejorar la atención de la estenosis aórtica grave, al tiempo que se mantiene una alta calidad del procedimiento.
Palabras clave: Implante percutáneo de válvula aórtica. TAVI. Estenosis aórtica grave. Cirugía cardiaca mínimamente invasiva.
ABSTRACT
Introduction and objectives: Transcatheter aortic valve implantation (TAVI) is traditionally performed with on-site cardiac surgery (CS) backup. However, procedural advances enabled TAVI to be performed safely without immediate CS backup. This study describes our single-center experience with TAVI performed in a center without on-site CS backup.
Methods: We conducted a retrospective analysis of the first 300 patients undergoing TAVI without on-site CS backup between 2020 and 2024. The primary endpoint was 30-day mortality. Secondary endpoints included procedural and in-hospital mortality, stroke, emergency cardiac surgery (ECS), vascular complications, major hemorrhage, and pacemaker implantation. Outcomes were compared with those from the Portuguese national TAVI registry.
Results: The cohort mean age was 82±5 years (54% women). The median STS risk score was 3.8 [IQR, 2.3–6.6], with 17% high-risk patients (STS > 8). Most procedures were elective (83%). Transfemoral access was used in 99% of cases, and self-expandable valves were implanted in 95%. The 30-day mortality rate was 3.7% (n = 11), while stroke occurred in 2.7% (n = 8). The procedural survival rate was 99% (n = 298). No cases of ECS occurred (n = 0), coronary obstruction, TAVI-in-TAVI deployment as a bailout, or valve embolization were reported. Pericardial tamponade occurred in 0.7% of cases (n = 2). Major hemorrhage and vascular complications occurred in 8%, and pacemaker implantation in 20%. The 1-year mortality rate was 12%, with 4% attributed to cardiovascular causes; among survivors, and 91% reported symptomatic improvement. There were no significant differences in outcomes vs the results from the TAVI national registry.
Conclusions: TAVI was safely and effectively performed without on-site CS, including emergency and complex cases. The non-ECS rate and outcomes comparable to national benchmarks support the feasibility of TAVI in selected non-CS centers. In this context, expanding TAVI access may reduce waiting times and improve the management of severe aortic stenosis while maintaining high procedural quality.
Keywords: Transcatheter aortic valve implantation. TAVI. Severe aortic stenosis. Cardiac surgery backup.
Abreviaturas
CC: cirugía cardiaca. CCU: cirugía cardiaca de urgencia. EA: estenosis aórtica. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
La estenosis aórtica (EA) es la valvulopatía primaria más frecuente que requiere intervención1. Se espera que su prevalencia, en torno al 3-5% en individuos mayores de 75 años2,3, aumente como consecuencia de la mayor esperanza de vida, mayor sensibilización al respecto y mejor precisión diagnóstica4. La tasa de mortalidad de la EA grave sintomática no tratada se sitúa en el 10-20% durante el primer año (el 45% a los 4 años)2,5.
El implante percutáneo de válvula aórtica (TAVI) es una alternativa bien establecida y menos invasiva al reemplazo quirúrgico de la válvula aórtica en pacientes con EA grave sintomática1,6. Inicialmente reservada para pacientes de alto riesgo, las indicaciones del TAVI se han ido ampliado tanto a pacientes de riesgo intermedio como a pacientes de menor riesgo de edad avanzada1,6. Las mejoras en la tecnología de las válvulas, las técnicas empleadas en esta intervención y la experiencia de los operadores han contribuido a reducir las complicaciones y mejorado la seguridad global3. La mayor prevalencia de la EA y la ampliación de las indicaciones del TAVI subrayan la necesidad de incrementar la capacidad procedimental para satisfacer la demanda clínica actual y futura y garantizar un acceso oportuno al tratamiento7.
Las guías de práctica clínica actuales recomiendan realizar el TAVI única y exclusivamente en centros dotados de cirugía cardiaca (CC) in situ1,6, porque el soporte quirúrgico proporciona una red de seguridad en caso de complicaciones que requieran cirugía cardiaca urgente (CCU).8 No obstante, la tasa de CCU ha ido disminuyendo de forma notable hasta el 0,5-1% de los TAVI que se realizan9; además, los resultados de estas intervenciones siguen siendo desfavorables9, con una tasa de supervivencia del 54% en el evento índice y solo del 22% al cabo de 1 año10, lo cual plantea dudas sobre los beneficios reales del soporte quirúrgico obligatorio.
La disponibilidad del TAVI sigue siendo variable y se observan disparidades regionales derivadas de la concentración de centros con CC4,11. Como resultado, el acceso es limitado en regiones sin centros terciarios de referencia, lo cual provoca largas listas de espera y un peor pronóstico3. La mortalidad en lista de espera para el TAVI se sitúa en el 18%, lo cual pone de relieve lo importante que es realizar la intervención en el momento oportuno12. Ampliar el TAVI a centros sin CC in situ mejoraría el acceso a esta intervención, aumentaría el número de TAVI, reduciría las desigualdades en la atención sanitaria y aliviaría la carga de los centros quirúrgicos, permitiéndoles centrarse en intervenciones de mayor riesgo3,13. El número limitado de centros acreditados limita el volumen nacional de intervenciones que se realizan, lo cual, a su vez, impide al sistema sanitario satisfacer las crecientes necesidades del TAVI de la población4,14.
El objetivo del presente estudio es describir la experiencia con el TAVI de un centro sin CC in situ y comparar los resultados con el estándar nacional de centros que sí cuentan con apoyo quirúrgico.
MÉTODOS
Población del estudio
Se realizó un estudio de cohorte retrospectivo y unicéntrico que incluyó a los primeros 300 pacientes consecutivos tratados mediante TAVI en nuestro centro, el Hospital Espírito Santo de Évora (Portugal), entre 2020 y 2024. El estudio se llevó a cabo en un hospital sin servicio de CC in situ. Se identificó a los pacientes a través del registro institucional de intervencionismo en cardiopatía estructural. El estudio fue aprobado por el comité de ética del centro, se obtuvo el consentimiento informado de todos los participantes y se llevó a cabo de conformidad con los principios establecidos en la Declaración de Helsinki.
Recogida de datos
Se obtuvieron datos clínicos, ecocardiográficos, analíticos y sobre las intervenciones realizadas a partir de las historias clínicas electrónicas de los pacientes, incluidas las técnicas de imagen empleadas, documentación intervencionista y los informes de alta. Las características basales incluyeron parámetros demográficos, clínicos y ecocardiográficos e información sobre la intervención como, por ejemplo, la vía de acceso y el tipo de válvula implantada.
Objetivos
El objetivo primario fue la mortalidad por cualquier causa a 30 días. Los objetivos secundarios fueron la necesidad de CCU, la mortalidad intrahospitalaria, el accidente cerebrovascular, la mortalidad por cualquier causa al año, la muerte cardiaca al año, las complicaciones vasculares, las hemorragias mayores y el implante de marcapasos definitivos. Los resultados clínicos se definieron de conformidad con los criterios establecidos por el Valve Academic Research Consortium-3 (VARC-3)15. La CCU se definió como toda aquella conversión quirúrgica cardiaca no programada a cirugía abierta necesaria para tratar una complicación potencialmente mortal durante o inmediatamente después del TAVI y realizada antes de que el paciente abandonara la sala de hemodinámica.
También se compararon los resultados clínicos con los datos más recientes del registro nacional portugués de TAVI16, que incluye única y exclusivamente centros con CC in situ, para establecer un punto de referencia para el perfil de seguridad y eficacia de la intervención.
Seguimiento
El seguimiento se realizó mediante visitas clínicas a los 3 y 12 meses, complementadas con llamadas telefónicas y revisión de las historias clínicas electrónicas cuando no fue posible realizar visitas presenciales. La mejoría sintomática se evaluó en base a los cambios experimentados en la clase funcional (CF) de la New York Heart Association (NYHA).
Análisis estadístico
Las variables categóricas se expresaron como frecuencias y porcentajes y se compararon mediante la prueba de la X2 o la prueba exacta de Fisher, según correspondiera. Las variables continuas se evaluaron para comprobar su normalidad mediante la prueba de Shapiro–Wilk. Los datos con distribución normal se expresaron como media ± desviación estándar (DE) y se compararon mediante la prueba t de Student. Las variables sin una distribución normal se expresaron como mediana [rango intercuartílico (RIQ)] y se compararon mediante la prueba U de Mann–Whitney. La significación estadística se estableció para un valor de p bilateral < 0,05. Todos los análisis estadísticos se realizaron con el software Stata versión 18.0 (StataCorp, Estados Unidos).
RESULTADOS
Características basales
Se incluyeron los primeros 300 pacientes consecutivos tratados mediante TAVI entre 2020 y 2024.
La media de edad de la cohorte fue de 82 ± 5 años (rango: 62-101) y el 54% (n = 161) eran mujeres. La mediana del riesgo según la puntuación obtenida en la Society of Thoracic Surgeons (STS) fue del 3,8% [RIQ: 2,3–6,6], con un 17% (n = 51) clasificado como de alto riesgo (STS > 8). El 21% (n = 64) ya había sido hospitalizado con anterioridad por EA sintomática. Siete pacientes (2%) que ya habían sido tratados mediante reemplazo quirúrgico valvular aórtico fueron intervenidos mediante TAVI en TAVI. Se observó EA grave de bajo flujo y bajo gradiente en el 10% (n = 31) y válvula aórtica bicúspide en el 6% (n = 18). Las características basales de los pacientes incluidos se resumen en la tabla 1 y tabla 2. El registro nacional portugués de TAVI incluyó a un total de 2.346 pacientes. Comparado con nuestra cohorte, este registro tenía más pacientes con CF > II según la NYHA (68 frente al 51%; p < 0,01) y EPOC (22 frente al 12%; p < 0,01) y nuestro centro, una mayor prevalencia de enfermedad renal crónica (50 frente al 38%; p < 0,01). Las características basales del registro nacional y su comparativa con nuestra cohorte se muestran en la tabla 3.
Tabla 1. Características basales y comorbilidades
| Características basales | Valores |
|---|---|
| Edad, años | 82 ± 5 [62-101] |
| Sexo femenino, % (n) | 54 (161) |
| Puntuación STS, % | 3,75; RIQ [2,29-6,55] |
| Riesgo bajo (STS < 4), % (n) | 52 (156) |
| Riesgo intermedio (STS 4-8), % (n) | 31 (93) |
| Riesgo alto (STS > 8), % (n) | 17 (51) |
| EuroSCORE, % | 2,23; RIQ [2,29-6,55] |
| Anterior ingreso por EA, % (n) | 21 (64) |
| Hipertensión, % (n) | 86 (258) |
| Diabetes mellitus, % (n) | 35 (104) |
| Dislipemia, % (n) | 71 (214) |
| TFGe < 60 ml/min/1,73 m² | 50 (50) |
| FA/Aleteo, % (n) | 22 (65) |
| Marcapasos, % (n) | 15 (46) |
| EC, % (n) | 21 (63) |
| Ecocardiograma transtorácico | |
| Gradiente transaórtico medio, mmHg | 48 ± 14 |
| Velocidad pico transaórtica, m/s | 4,3 ± 0,7 |
| AVA (cm²) | 0,74 ± 0,2 |
| FEVI, % | 57 ± 12 |
| FEVI < 40%, % (n) | 12 (36) |
| EA BF/BG, % (n) | 10 (31) |
| PSAP, mmHg | 38 ± 14 |
| Insuficiencia aórtica significativa, % (n)* | 24 (71) |
| Insuficiencia mitral significativa, % (n)* | 27 (83) |
| Angio-TC | |
| Perímetro del anillo aórtico, mm | 74 ± 9 |
| Área del anillo aórtico, cm² | 4,3 ± 0,9 |
| Diámetro del anillo aórtico derivado del perímetro, mm | 23,3 ± 3,3 |
| Puntuación de calcio valvular aórtico, UA | 2.912 ± 1.572 |
| Diámetro mínimo de la arteria femoral, mm | 7,1 ± 1,3 |
| Válvula aórtica bicúspide, % (n) | 6 (18) |
|
Los datos expresan n (n), media ± desviación estándar (DE) o mediana [RIQ]. Características basales, prevalencia y comorbilidades, incluidos los hallazgos del ecocardiograma transtorácico y de la angiotomografía computarizada (Angio-TC) en la población total. Angio-TC: angiotomografía computarizada; AVA: área valvular aórtica; BF/BG: bajo flujo y bajo gradiente; EA: estenosis aórtica; EC: enfermedad coronaria; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; PSAP: presión sistólica de la arteria pulmonar; STS: Society of Thoracic Surgeons; TFGe: tasa de filtrado glomerular estimada. * Valvulopatía significativa definida como aquella de grado > 2. |
|
Tabla 2. Comparativa de las características basales entre nuestra cohorte y el registro nacional portugués de TAVI
| Características basales | Nuestro centro (n = 300) | Registro nacional (n = 2.346) | Valor de p |
|---|---|---|---|
| Edad, años | 82 ± 5 | 81 ± 7 | 0,6 |
| Sexo femenino, % | 54 | 53 | 0,8 |
| Puntuación obtenida en la escala de riesgo STS, % [RIQ] | 3,8 [2,3-6,6] | 4,7 [3,0-7,1] | 0,7 |
| Puntuación obtenida en la escala de riesgo EuroSCORE II, % | 2,3 [1,6-4,0] | 4,3 [2,5-7,1] | 0,3 |
| Clase funcional NYHA > II, % | 51 | 68 | < 0,01 |
| DM, % | 35 | 33 | 0,5 |
| EPOC, % | 12 | 22 | < 0,01 |
| TFG < 60 ml/min/1,73 m², % | 50 | 38 | < 0,01 |
| FA, % | 22 | 25 | 0,3 |
| ICP, % | 14 | 23 | < 0,01 |
| Accidente cerebrovascular, % | 8 | 12 | 0,06 |
| ETT | |||
| Gradiente medio, mmHg | 48 ± 14 | 49 ± 16 | 0,8 |
| AVA (cm²) | 0,72 ± 0,20 | 0,64 ± 0,20 | 0,7 |
| FEVI < 50%, % | 21 | 28 | 0,08 |
|
Comparativa de las características basales entre nuestra cohorte y el registro nacional portugués de TAVI16. FA: fibrilación auricular; AVA: área valvular aórtica; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; ETT: ecocardiograma transtorácico; FEVI: fracción de eyección del ventrículo izquierdo; TFG: tasa de filtrado glomerular; ICP: intervención coronaria percutánea; NYHA: New York Heart Association; RIQ: rango intercuartílico; STS: Society of Thoracic Surgeons. |
|||
Tabla 3. Contexto clínico y características de la intervención
| Contexto clínico | Valores |
|---|---|
| Intervención electiva, % (n) | 83 (248) |
| Ingreso con anterioridad a la intervención, % (n) | 17 (52) |
| Días hasta el TAVI (en caso de ingreso), días | 12 ± 8 |
| Shock cardiogénico, % (n) | 5 (15) |
| Ventilación mecánica invasiva, % (n) | 1,7 (5) |
| Ventilación mecánica no invasiva, % (n) | 2,7 (8) |
| Enfermedad coronaria significativa, % (n) | 11 (33) |
| ICP previa al TAVI, % (n) | 7 (21) |
| Creatinina sérica (mg/dl) | 1,05 [0,86-1,41] |
| Hemoglobina (g/dl) | 12,2 ± 1,9 |
| NT-proBNP (pg/ml) | 1865 [292-4250] |
| Tiempo de evaluación, días | 15 [3-54] |
| Tiempo de espera, días | 59 [22-122] |
| Procedencia del paciente | |
| Nuestra propia área hospitalaria, % (n) | 62 (185) |
| Dentro de nuestra área de influencia, % (n) | 17 (53) |
| Fuera de nuestra área de influencia, % (n) | 21 (63) |
| Características de la intervención | |
| Abordaje femoral, % (n) | 99 (299) |
| Abordaje secundario | |
| Radial, % (n) | 10 (29) |
| Femoral, % (n) | 90 (271) |
| Predilatación, % (n) | 58 (175) |
| Tipo de válvula | |
| Válvulas autoexpandibles, % (n) | 95 (286) |
| Evolut, % (n) | 91 (260/286) |
| Acurate, % (n) | 2 (6/286) |
| Navitor, % (n) | 7 (20/286) |
| Válvulas balón-expandibles, % (n) | 5 (14) |
| Myval, % (n) | 100 (14/14) |
| Tamaño de válvula (mm) | 27,5 ± 3,0 |
| Posdilatación, % (n) | 38 (113) |
| Tiempo de fluoroscopia (min) | 26 [21-33] |
| Volumen de contraste (ml) | 216 [173-263] |
|
Características clínicas del contexto poblacional y características de la intervención. Los datos expresan porcentaje y número (n), salvo que se indique lo contrario. CD: coronaria derecha; CXI: circunfleja izquierda; DA: descendente anterior; ICP: intervención coronaria percutánea; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); TAVI: implante percutáneo de válvula aórtica. |
|
Características de la intervención
La mayoría de las intervenciones fueron electivas (83%; n = 249) y el 17% (n = 51) se realizaron de forma urgente tras un ingreso hospitalario no programado por EA grave sintomática. El shock cardiogénico se documentó en el 5% (n = 15) y el soporte ventilatorio en el 4% (n = 12) (tabla 3). El abordaje transfemoral se utilizó en el 99% de los casos (n = 298); las 2 intervenciones restantes se realizaron por vía transcarótida y empleando un injerto aortofemoral, ambos con exposición quirúrgica por el equipo de cirugía vascular. Se emplearon prótesis autoexpandibles en el 95% de los casos (n = 286), principalmente de la familia Evolut (Medtronic, Estados Unidos) en el 91% (n = 259), seguidas de válvulas Navitor (Abbott, Estados Unidos) en el 7% (n = 20) y Acurate (Boston Scientific, Estados Unidos) en el 2% (n = 6). Se empleó la prótesis balón-expandible Myval (Meril, India) en el 5% (n = 14) (tabla 4).
Tabla 4. Resultados de la intervención y el seguimiento
| Resultados clínicos derivados de la intervención | Valores |
|---|---|
| Mortalidad intraoperatoria, % (n) | 0,7 (2) |
| Mortalidad intrahospitalaria, % (n) | 2 (6) |
| Accidente cerebrovascular, % (n) | 2,7 (8) |
| Cirugía cardiaca urgente, % (n) | 0 (0) |
| Hemorragia mayor, % (n) | 8 (25) |
| Complicación vascular, % (n) | 8 (24) |
| Lesión renal aguda, % (n) | 6 (18) |
| Taponamiento cardiaco, % (n) | 0,7 (2) |
| Estancia en la UCI, días | 2 [2-3] |
| Estancia hospitalaria total, días | 3 [2-6] |
| En pacientes electivos, días | 3 [2-5] |
| Resultados obtenidos durante el seguimiento | |
| Al cabo de 1 mes | |
| Mortalidad a 30 días, % (n) | 3,7 (11) |
| Implante de marcapasos definitivo, % (n) | 20 (61) |
| Al cabo de 1 año | |
| Mortalidad a 1 año, % (n) | 12,4 (27/217) |
| Mortalidad cardiovascular, % (n) | 4 (8/203) |
| Reingreso hospitalario, % (n) | 17 (51/300) |
| Mejoría sintomática, % (n) | 91 (246/269) |
|
Resultados de la intervención y el seguimiento según los criterios VARC-3.15 Los datos con %, (n) expresan porcentajes y número de casos. Las variables con (días) expresan número de días y RIQ. La hemorragia mayor se define como hemorragia VARC-3 tipo 2-3: hemorragia franca que precisa intervención médica, hospitalización o transfusión de ≥ 1 unidad de sangre. La cirugía cardiaca urgente se define como toda aquella cirugía cardiaca no programada necesaria para tratar una complicación potencialmente mortal durante o inmediatamente después de la intervención, realizada antes de que el paciente abandone la sala de hemodinámica. Las complicaciones vasculares se definen como lesiones arteriales o venosas, disección, estenosis, isquemia, trombosis, seudoaneurisma, hematoma, embolización distal o fracaso del dispositivo de cierre asociado al abordaje quirúrgico y que requieren intervención o producen secuelas clínicas. La lesión renal aguda se define según los criterios KDIGO como un incremento de los niveles de creatinina sérica ≥ 0,3 mg/dl en 48 h o ≥ 1,5 veces el valor basal en 7 días. |
|
Resultados de la intervención y al cabo de 1 mes
El objetivo primario, la tasa de mortalidad a 30 días, fue del 3,7% (n = 11) y la tasa de mortalidad intrahospitalaria del 2% (n = 6). La supervivencia al final de la intervención se alcanzó en el 99% de los pacientes (n = 298). Ningún paciente precisó CCU. Dos pacientes (0,7%) fueron tratados mediante pericardiocentesis percutánea por taponamiento cardiaco: uno debido a una perforación autocontenida del ventrículo izquierdo provocada por la guía, que no requirió CCU, y otro por causas indeterminadas, que persistieron y finalmente precisó cirugía cardiaca exploratoria diferida, con resultado de muerte posoperatoria. No se registraron casos de rotura del anillo valvular aórtico, obstrucción coronaria, TAVI en TAVI, ni embolización valvular. El accidente cerebrovascular ocurrió en el 2,7% de los casos (n = 8), el 1,6% de los cuales (n = 5) fueron incapacitantes. Las tasas de hemorragias mayores y complicaciones vasculares fueron del 8%, respectivamente. Se hizo necesario implantar un marcapasos definitivo en el 20% de los casos (n = 61) (tabla 4). La tabla S1 muestra una descripción detalla de las causas de muerte tanto precoces como asociadas a la intervención.
Resultados durante el seguimiento
La tasa de mortalidad por cualquier causa al año fue del 12% (n = 36) y la de muerte cardiaca, del 4% (n = 12). La tabla S1 muestra una descripción detallada de las causas de muerte. El reingreso hospitalario se produjo en el 17% (n = 51), incluidos 32 eventos cardiovasculares y 19 no cardiovasculares. La tabla S1 muestra una descripción detallada de las causas de reingreso. El 91% de los pacientes supervivientes con datos disponibles refirió mejoría sintomática, evaluada según la CF de la NYHA (tabla 4).
Comparativa con el registro nacional de TAVI
Comparado con los resultados del registro nacional portugués de TAVI disponibles16 (tabla 5), nuestro centro tuvo una tasa de mortalidad a 30 días más baja, aunque no significativa (del 3,7 frente al 4,8%; OR = 0,8; IC95%, 0,44–1,47; p = 0,5) y tasas similares de mortalidad a 1 año (del 12 frente al 11%; OR = 1,0; IC95%, 0,76–1,47; p = 0,8) (figura 1). La tasa de CCU fue equivalente en los 2 grupos (0 frente al 0,4%; p = 0,5), al igual que las complicaciones vasculares (8 frente al 6,8%; p = 0,4) y la ocurrencia de hemorragias mayores (8,3 frente al 13,3%; p = 0,2). En nuestro centro, la incidencia de accidente cerebrovascular (2,7 frente al 4,6%; p = 0,1) y lesión renal aguda (6 frente al 4,2%; p = 0,5) fue numéricamente más baja. Las tasas de implante de marcapasos también fueron similares (20 frente al 19%; p = 0,7) (figura 2). Sin embargo, los reingresos hospitalarios al año fueron más habituales en nuestra cohorte (17 frente al 9,6%; p = 0,03).
Tabla 5. Comparativa de los resultados entre nuestro centro y el registro nacional de TAVI
| Variable de resultado | Nuestro centro (n = 300) | Registro nacional (n = 2.346) | Odds ratio IC95% | Valor de p |
|---|---|---|---|---|
| Mortalidad a 30 días, % (n) | 3,7 (11) | 4,8 (110/2.297) | 0,8 [0,4-1,4] | 0,79 |
| Mortalidad a 1 año, % (n) | 12 (36) | 11 (194/1.706) | 1,1 [0,6-1,5] | 0,86 |
| Taponamiento cardiaco, % (n) | 0,7 (2) | 1,0 (8/775) | 0,6 [0,2-2,0] | 0,73 |
| Obstrucción coronaria, % (n) | 0 (0) | 1,8 (14/772) | NE | 0,09 |
| Cirugía cardiaca urgente, % (n) | 0 (0) | 0,4 (4/954) | 0,8 [0,2-6,8] | 0,35 |
| TAVI en TAVI, % (n) | 0 (0) | 1,1 (8/725) | NE | 0,09 |
| Complicación vascular, % (n) | 8 (24) | 7 (120/1.766) | 1,2 [0,9-1,6] | 0,43 |
| Hemorragia mayor, % (n) | 8 (25) | 13 (273/2.054) | 0,6 [0,4-0,9] | 0,02 |
| Accidente cerebrovascular, % (n) | 2,7 (8) | 4,6 (88/1.893) | 0,6 [0,3-1,2] | 0,14 |
| LRA, % (n) | 6 (18) | 4,2 (79/1.892) | 1,5 [0,9-2,1] | 0,46 |
| Implante de marcapasos, % (n) | 20 (60) | 19 (374/1.964) | 1,1 [0,9-1,3] | 0,69 |
| Reingreso hospitalario, % (n) | 17 (51) | 10 (98/1.017) | 1,9 [1,3-2,8] | 0,03 |
|
Comparativa de los resultados de la intervención y clínicos entre nuestra cohorte y el registro nacional de TAVI16. Los datos se expresan en porcentajes. La lesión renal aguda (LRA) se definió según los criterios KDIGO como un aumento de la creatinina sérica ≥ 0,3 mg/dl en 48 horas o ≥ 1,5 veces el valor basal en 7 días. IC95%: intervalo de confianza del 95%; LRA: lesión renal aguda; NE: no estimable; TAVI: implante percutáneo de válvula aórtica. |
||||
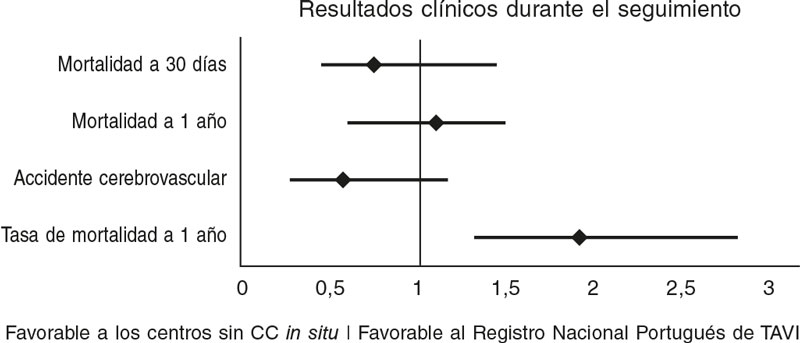
Figura 1. Diagrama de bosque que compara las odds ratios (OR) de los objetivos primarios entre nuestro centro sin soporte de cirugía cardiaca (CC) in situ con el registro nacional portugués de TAVI16 (centros con CC in situ).
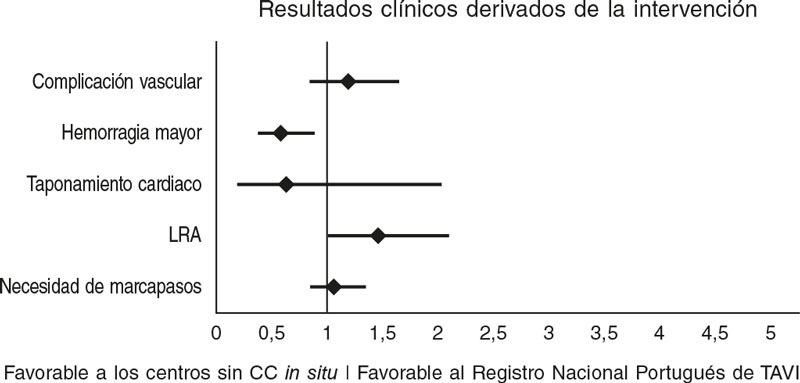
Figura 2. Diagrama de bosque de los resultados clínicos de la intervención que compara nuestro centro sin CC in situ con el registro nacional portugués de TAVI16 (centros con CC in situ).
DISCUSIÓN
El presente estudio unicéntrico representa la primera experiencia nacional del TAVI en un centro sin soporte de CC in situ. Nuestros resultados sugieren que este modelo es viable y seguro, con resultados parecidos a los comunicados en series nacionales e internacionales, incluidos centros con soporte quirúrgico. Nuestros resultados fueron similares, en lo referente a los objetivos principales, a los del registro nacional portugués de TAVI,16 que solo incluye centros con soporte quirúrgico in situ. Aunque ningún paciente de nuestra serie precisó CCU, 1 paciente sí precisó intervención quirúrgica diferida por un derrame pericárdico persistente, que, en cualquier caso, resultó una intervención fallida. Esta observación coincide con otros informes que indican que los resultados de la conversión quirúrgica urgente tras el TAVI son desfavorables, incluso en centros con soporte quirúrgico8,10.
El perfil de seguridad y eficacia del TAVI ha mejorado de forma sustancial gracias a una planificación minuciosa de las intervenciones, la participación de un equipo multidisciplinar (con la incorporación de cirugía cardiaca) y la cada vez mayor experiencia de los hemodinamistas apoyada en los avances tecnológicos. Como resultado, la necesidad de contar con soporte quirúrgico inmediato ha ido perdido relevancia. Aunque las complicaciones que requieren cirugía siguen siendo raras, se asocian a una alta morbimortalidad, incluso tras el tratamiento quirúrgico. En este contexto, nuestros resultados avalan la viabilidad y no inferioridad de realizar TAVI sin CC in situ, lo cual refuerza su aplicabilidad a diferentes contextos clínicos, incluidos pacientes más jóvenes y aquellos con enfermedad multivalvular o coronaria.
Nuestro programa refleja la realidad contemporánea del TAVI, con una población heterogénea y de alto riesgo, incluida una proporción significativa de casos urgentes e inestables, tales como pacientes hospitalizados y en shock cardiogénico. También tratamos a pacientes con características anatómicas y clínicas complejas, como TAVI en TAVI, válvulas aórticas bicúspides, una FEVI reducida e hipertensión pulmonar. Este perfil de pacientes no seleccionados refleja el verdadero abanico de casos que los programas estructurados del TAVI deben abordar en la actualidad, más allá de intervenciones electivas transfemorales para la EA nativa.
Se debe mencionar que la mediana de tiempo de espera para la intervención fue breve (59 días [RIQ: 22–122]) y que el 20% de los pacientes procedía de fuera del área de referencia directa de nuestro hospital. Esto sugiere que nuestro centro se ha convertido en un referente regional para el TAVI a pesar de no contar con CC in situ, lo cual refleja tanto la accesibilidad del programa como la confianza depositada en la experiencia de nuestro equipo multidisciplinar. Se debe mencionar que muchos de estos pacientes fueron derivados porque los centros TAVI habituales no podían satisfacer la demanda asistencial de manera oportuna, lo cual subraya nuestro papel dando cobertura a necesidades clínicas no atendidas en la región.
Nuestros hallazgos coinciden con los resultados de países donde el TAVI se realiza sin CC in situ, como España11, Alemania17 y Austria18. En España, el registro multicéntrico comunicó una tasa de conversión a cirugía abierta del 0,3% en centros sin CC in situ11. El registro alemán AQUA, con más de 17.000 pacientes, no halló diferencias significativas en los resultados clínicos entre los centros con y sin CC, con una tasa de mortalidad a 30 días del 3,8% en hospitales con CC visitante frente al 4,2% en aquellos con soporte quirúrgico permanente y tasas de cirugía urgente del 0,3 y 0,7%, respectivamente17. Asimismo, un estudio austríaco mostró resultados favorables en centros sin cirugía in situ, sin diferencias significativas en las tasas de mortalidad intrahospitalaria ni conversión quirúrgica18. Nuestros resultados coinciden con estas observaciones, con una tasa de mortalidad a 30 días del 3,7% y 0 casos de CCU, lo cual demuestra resultados clínicos equivalentes y no inferiores a los de centros con soporte quirúrgico in situ.
Se debe mencionar que nuestro estudio refleja una era más contemporánea, con intervenciones realizadas en pacientes de menor riesgo, mediante dispositivos de última generación, por operadores más experimentados y con una planificación preoperatoria más precisa mediante imágenes por TC avanzada. Además, a diferencia de estudios anteriores en los que estaban presentes cirujanos visitantes, en nuestro centro todas las intervenciones se realizaron sin soporte quirúrgico in situ, lo cual demuestra la factibilidad de un modelo completamente independiente.
Este estudio proporciona evidencia contemporánea del mundo real de que el TAVI puede realizarse de forma segura y eficaz en pacientes seleccionados en centros sin CC in situ, lo cual favorece un mayor acceso a esta intervención sin comprometer los estándares de calidad.
Nuestros resultados tienen importantes implicaciones en materia organizativa y regulatoria.
En el actual contexto de una cada vez mayor demanda del TAVI y recursos limitados en los centros quirúrgicos de alto volumen, descentralizar la atención hacia centros sin CC in situ podría mejorar el acceso sin comprometer los resultados clínicos. Nuestros datos avalan la ampliación de programas TAVI bajo condiciones estrictamente controladas tales como protocolos estandarizados, equipos intervencionistas bien entrenados, redes de derivación sólidas y acceso a cirugía cardiaca dentro de un circuito regional estructurado. Las agencias reguladoras podrían considerar revisar los requisitos actuales para la cirugía in situ y fomentar un modelo en el que la experiencia clínica guíe una implementación segura del intervencionismo en cardiopatía estructural al tiempo que se garantice un acceso oportuno a centros quirúrgicos designados para contar con un soporte protocolizado en caso de que se requiera una intervención quirúrgica diferida.
Estos hallazgos ponen de manifiesto no solo el perfil de seguridad sino también la viabilidad de llevar los programas TAVI a centros seleccionados sin soporte quirúrgico in situ. Con una adecuada selección de pacientes, hemodinamistas experimentados y protocolos homogéneos, se pueden obtener resultados clínicos excelentes incluso sin soporte quirúrgico inmediato. Nuestra experiencia avala un modelo asistencial estructural más inclusivo que ofrezca tratamiento oportuno y eficaz a un mayor número de pacientes, sin comprometer la seguridad ni la eficacia.
Limitaciones
Aunque estos resultados son alentadores, se deben tener en cuenta varias limitaciones. En primer lugar, se trata de un estudio unicéntrico y retrospectivo y aunque se llevó a cabo una recogida integral de datos, no puede descartarse la presencia de factores de confusión no medidos.
En segundo lugar, no se dispone de seguimiento a largo plazo más allá de 1 año, lo cual limita las conclusiones sobre la durabilidad de la válvula y las complicaciones tardías. En tercer lugar, el hecho de que un equipo multidisciplinario altamente experimentado fuera el que llevó a cabo tanto la selección de pacientes como la planificación de la intervención, podría limitar la extrapolación de los resultados a otros centros sin soporte quirúrgico.
CONCLUSIONES
Nuestro estudio demuestra que el TAVI puede realizarse de forma segura y eficaz en centros sin CC in situ, incluso en una población heterogénea de pacientes no seleccionados. Los resultados clínicos fueron ampliamente comparables y avalan la no inferioridad de este abordaje frente a los centros con CC in situ. El riesgo de CCU fue muy bajo y su beneficio incremental limitado, sigue habiendo pocos centros con CC y, además, están sobrecargados. Estos hallazgos sugieren que, con una planificación metódica de los casos junto a la cada vez mayor experiencia quirúrgica, la ampliación de los programas TAVI a centros seleccionados sin CC in situ es una estrategia segura y viable para satisfacer la demanda creciente y mejorar el acceso al tratamiento de la EA grave. Se requieren ensayos clínicos aleatorizados que confirmen estos resultados y guíen una implementación a mayor escala.
DISPONIBILIDAD DE LOS DATOS
Las bases de datos generadas o analizadas durante el presente estudio están disponibles a través del autor de correspondencia previa solicitud razonada.
FINANCIACIÓN
Ninguna.
CONSIDERACIONES ÉTICAS
El presente estudio fue aprobado por el comité de ética del Hospital Espírito Santo de Évora (ULSAC). Todas las intervenciones se realizaron de conformidad con los principios éticos del comité de investigación del centro, así como con los principios establecidos en la Declaración de Helsinki. Se obtuvo el consentimiento informado de todos los participantes incluidos en el estudio. Se han tenido en cuenta las guías SAGER en todas las fases del estudio. Las consideraciones de sexo y género se abordaron adecuadamente y cualquier posible diferencia en este sentido se analizó y comunicó cuando fue pertinente.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se emplearon herramientas de inteligencia artificial en la preparación de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORES
A. Rocha de Almeida: conceptualización, metodología, depuración de datos, análisis formal, investigación, redacción del borrador original y revisión y edición de la versión final.
R. Fernandes, Â. Bento, D. Neves, D. Brás y G. Mendes: redacción del borrador original y revisión y edición de la versión final. R. Rocha, M. Paralta Figueiredo y R. Viana: depuración de datos, revisión y edición del manuscrito final. R. Louro y Á. Laranjeira Santos: revisión y edición de la versión final. L. Patrício: conceptualización, supervisión, revisión y edición de la versión final y validación. Todos los autores leyeron y dieron su aprobación a la versión definitiva del manuscrito.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- Los programas TAVI están recomendados en centros con CC in situ porque algunas complicaciones podrían requerir cirugía urgente.
- No obstante, la tasa de CCU tras el TAVI es consistentemente baja y los beneficios clínicos añadidos que ofrece el soporte quirúrgico inmediato son limitados en la práctica actual.
¿QUÉ APORTA DE NUEVO?
- Se trata del primer estudio a nivel nacional que evalua los resultados clinicos del TAVI en un centro sin CC in situ.
- La mortalidad a 30 dias de 300 pacientes consecutivos fue parecida a la de cohortes nacionales e internacionales y la necesidad de CCU fue del 0% (n = 0).
- Estos hallazgos avalan la seguridad y viabilidad de realizar TAVI en centros seleccionados sin cirugia cardiaca in situ.
BIBLIOGRAFÍA
1. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
2. Généreux P, Sharma RP, Cubeddu RJ, et al. The Mortality Burden of Untreated Aortic Stenosis. J Am Coll Cardiol. 2023;82:2101-2109.
3. Compagnone M, Dall’Ara G, Grotti S, et al. Transcatheter Aortic Valve Replacement Without On-Site Cardiac Surgery. JACC Cardiovasc Interv. 2023;16:3026-3030.
4. Ali N, Faour A, Rawlins J, et al. ‘Valve for Life’: tackling the deficit in transcatheter treatment of heart valve disease in the UK. Open Heart. 2021;8:e001547.
5. Coisne A, Montaigne D, Aghezzaf S, et al. Association of Mortality With Aortic Stenosis Severity in Outpatients. JAMA Cardiol. 2021;6:1424.
6. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e72-e227.
7. Elbaz-Greener G, Masih S, Fang J, et al. Temporal Trends and Clinical Consequences of Wait Times for Transcatheter Aortic Valve Replacement. Circulation. 2018;138:483-493.
8. Aarts HM, van Nieuwkerk AC, Hemelrijk KI, et al. Surgical Bailout in Patients Undergoing Transfemoral Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2025;18:89-99.
9. Carroll JD, Mack MJ, Vemulapalli S, et al. STS-ACC TVT Registry of Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2020;76:2492-2516.
10. Eggebrecht H, Vaquerizo B, Moris C, et al. Incidence and outcomes of emergent cardiac surgery during transfemoral transcatheter aortic valve implantation (TAVI): insights from the European Registry on Emergent Cardiac Surgery during TAVI (EuRECS-TAVI). Eur Heart J. 2018;39:676-684.
11. Roa Garrido J, Jimenez Mazuecos J, Sigismondi A, et al. Transfemoral TAVR at Hospitals Without On-Site Cardiac Surgery Department in Spain. JACC Cardiovasc Interv. 2019;12:896-898.
12. Rocha de Almeida A, Carias de Sousa M, Magro C, et al. CO 92. Telemonitoring Aortic Valvular Intervention Waiting Lista Patients Prognostic Value. Rev Port Cardiol. 2023;42:S3-S85.
13. Kobo O, Saada M, Roguin A. Can Transcatheter Aortic Valve Implantation (TAVI) Be Performed at Institutions Without On-Site Cardiac Surgery Departments? Cardiovasc Revasc Med. 2022;41:159-165.
14. Iannopollo G, Cocco M, Leone A, et al. Tran-scatheter aortic-valve implantation with or without on-site cardiac surgery: The TRACS trial. Am Heart J. 2025;280:7-17.
15. Généreux P, Piazza N, Alu MC, et al. Valve Academic Research Consortium 3: Updated Endpoint Definitions for Aortic Valve Clinical Research. J Am Coll Cardiol. 2021;77:2717-2746.
16. Guerreiro C, Ferreira PC, Teles RC, et al. Short and long-term clinical impact of transcatheter aortic valve implantation in Portugal according to different access routes: Data from the Portuguese National Registry of TAVI. Rev Port Cardiol. 2020;39:705-717.
17. Eggebrecht H, Bestehorn M, Haude M, et al. Outcomes of transfemoral transcatheter aortic valve implantation at hospitals with and without on-site cardiac surgery department: insights from the prospective German aortic valve replacement quality assurance registry (AQUA) in 17 919 patients. Eur Heart J. 2016;37:2240-2248.
18. Florian E, David Z, K FM, et al. Impact of On-Site Cardiac Surgery on Clinical Outcomes After Transfemoral Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2018;11:2160-2167.

