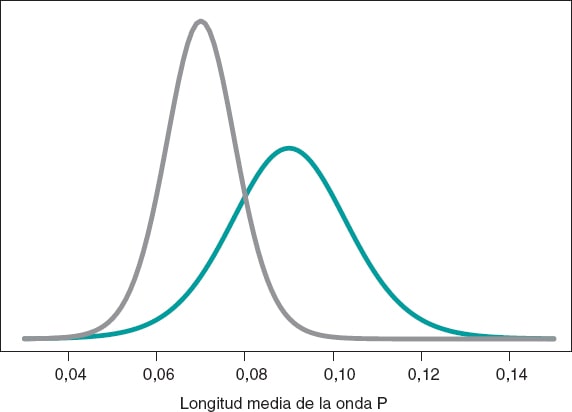
Artículo
Artículo especial
Rec Interv Cardiol. 2019;2:108-119
Requisitos y sostenibilidad de los programas de ICP primaria en España en el IAMCEST. Documento de consenso de SEC, AEEC y SEMES
Requirements and sustainability of primary PCI programs in Spain for the management of patients with STEMI. SEC, AEEC, and SEMES consensus document
a Área de Enfermedades del Corazón, Hospital Universitario de Bellvitge, IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona, España
b Servicio de Cardiología, Hospital Universitario de León, León, España
c Servicio de Cardiología, Hospital Clínico Universitario de Santiago, Santiago de Compostela, A Coruña, España
d Servicio de Cardiología, Hospital Universitario de Salamanca, Salamanca, España
e Servicio de Cardiología, Hospital Germans Trias i Pujol, Badalona, Barcelona, España
f Servicio de Cardiología, Hospital Galdakao-Usansolo, Galdakao, Vizcaya, España
g Servicio de Cardiología, Hospital Universitario La Paz, IDIPAZ, Madrid, España
h Servicio de Cardiología, Hospital Clínico Universitario de Valladolid, Valladolid, España
i Servicio de Cardiología, Hospital Álvaro Cunqueiro, Vigo, Pontevedra, España
j Servicio de Cardiología, Hospital de la Santa Creu i Sant Pau, Barcelona, España
k Servicio de Cardiología, Hospital Universitario Virgen de la Victoria, Málaga, España
l SUMMA 112, Madrid, Universidad Alfonso X el Sabio, Villanueva de la Cañada, Madrid, España
m Servicio de Cardiología, Hospital do Salnés, Vilagarcía de Arousa, Pontevedra, España
n Urgencias Sanitarias de Galicia 061, Santiago de Compostela, A Coruña, España
o Servicio de Cardiología, Hospital Universitario 12 de Octubre, Madrid, España
p Servicio de Cardiología, Hospital Universitario Reina Sofía, Córdoba, España
RESUMEN
El tratamiento de los pacientes con insuficiencia mitral aguda supone un reto terapéutico. Estos pacientes tienen una morbimortalidad muy elevada, que requiere un abordaje multidisciplinario. El presente documento recoge el posicionamiento de tres asociaciones implicadas en el tratamiento de estos pacientes: la Asociación de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares, la Asociación de Cardiología Intervencionista y la Asociación de Imagen Cardiaca. Incluye aspectos relacionados con la selección y los cuidados del paciente, los aspectos técnicos del tratamiento de borde a borde desde el punto de vista intervencionista y de la imagen cardiaca, y los resultados de este proceso. No se han incluido los resultados de la cirugía de reparación o sustitución mitral, que es la primera opción terapéutica a considerar en estos pacientes, por exceder los objetivos del documento.
Palabras clave: Insuficiencia mitral. Infarto agudo de miocardio. Fracción de eyección del ventrículo izquierdo. Rotura del músculo papilar. Tratamiento de reparación percutánea de borde a borde.
ABSTRACT
The approach to patients with acute mitral regurgitation poses a therapeutic challenge. These patients have a very high morbidity and mortality rate, thus requiring a multidisciplinary approach. This document presents the position of 3 associations involved in the management of these patients: the Ischemic Heart Disease and Acute Cardiovascular Care Association, the Interventional Cardiology Association, and the Cardiac Imaging Association. The document discusses aspects related to patient selection and care, technical features of the edge-to-edge procedure from both the interventional and imaging unit perspectives, and the outcomes of this process. The results of mitral repair and/or replacement surgery, which is the first-line treatment option to consider in these patients, have not been included as they exceed the scope of the aims of the document.
Keywords: Mitral regurgitation. Acute myocardial infarction. Left ventricular ejection fraction. Papillary muscle rupture. Transcatheter edge-to-edge mitral valve repair.
Abreviaturas IM: insuficiencia mitral. RMP: rotura del músculo papilar. TEER: tratamiento de reparación percutánea de borde a borde. VI: ventrículo izquierdo.
SELECCIÓN DEL PACIENTE, MOMENTO ÓPTIMO Y CUIDADOS EN LA UNIDAD DE CUIDADOS AGUDOS CARDIOLÓGICOS
En la insuficiencia mitral (IM) aguda grave, el incremento brusco en el volumen telediastólico del ventrículo izquierdo (VI) conduce a un aumento rápido de la presión telediastólica del VI y de la aurícula izquierda, que resulta en última instancia en una marcada congestión pulmonar y el desarrollo de edema agudo de pulmón1. Paralelamente, el gran volumen de regurgitación conduce a una reducción del flujo anterógrado y del gasto cardiaco. En los pacientes con IM previa y ventrículo normal, la tolerancia hemodinámica será mejor, mientras que la situación se agrava en los pacientes con isquemia asociada y disfunción ventricular1,2.
La etiología de la IM aguda se puede agrupar en dos categorías (tabla 1): isquémica, bien por isquemia aguda del músculo papilar e incluso rotura de este en el contexto del infarto agudo de miocardio, o por remodelado ventricular y aumento de la tracción de los velos y tethering; y no isquémica, como la rotura de cuerdas en la enfermedad valvular mixomatosa o asociada a procedimientos de cardiología intervencionista. Otras causas son la endocarditis, los traumatismos o la IM dinámica por movimiento sistólico anterior mitral en un paciente con miocardiopatía hipertrófica o de estrés2,3.
Tabla 1. Etiología, fisiopatología y presentación clínica de la insuficiencia mitral aguda
| Etiología | Fisiopatología | Presentación clínica | Tratamiento |
|---|---|---|---|
| Isquemia del músculo papilar Rotura del músculo papilar por infarto Rotura de cuerdas Movimiento sistólico anterior (miocardiopatía hipertrófica obstructiva, síndrome de tako-tsubo) Miocardiopatía dilatada-insuficiencia mitral secundaria Endocarditis Traumatismo Complicación periprocedimiento |
Aumento de presión telediastólica del ventrículo izquierdo Aumento de presión de la aurícula izquierda Aumento de presión capilar pulmonar Bajo gasto por disminución del flujo anterógrado |
Insuficiencia cardiaca aguda/edema agudo de pulmón Edema agudo de pulmón flash Shock cardiogénico |
Diuréticos Inotrópicos (dobutamina, milrinona) Vasodilatadores (nitroprusiato)/vasopresores Revascularización Soporte circulatorio mecánico (balón de contrapulsación intraaórtico, oxigenador extracorpóreo de membrana, Impella) Reparación de borde a borde Cirugía |
Los pacientes con IM aguda estarán típicamente sintomáticos. La presentación clínica varía dependiendo del mecanismo, la rapidez de la instauración, la presencia de IM previa y la función ventricular. El edema agudo de pulmón flash puede ocurrir en pacientes con IM dinámica y función ventricular normal, en relación con el aumento de la poscarga. En estos casos, la presión arterial pue- de ser normal o estar elevada1-4. El shock cardiogénico es la forma de presentación más extrema de la IM aguda grave. Habitualmente ocurre en pacientes con disfunción sistólica del VI, pero puede desarrollarse incluso en aquellos con función ventricular conservada, en quienes la IM se instaura de forma muy brusca por rotura de músculo papilar (RMP). En los estadios intermedios, los pacientes pueden presentar edema agudo de pulmón con presión arterial mantenida sin llegar a la situación de shock3,5.
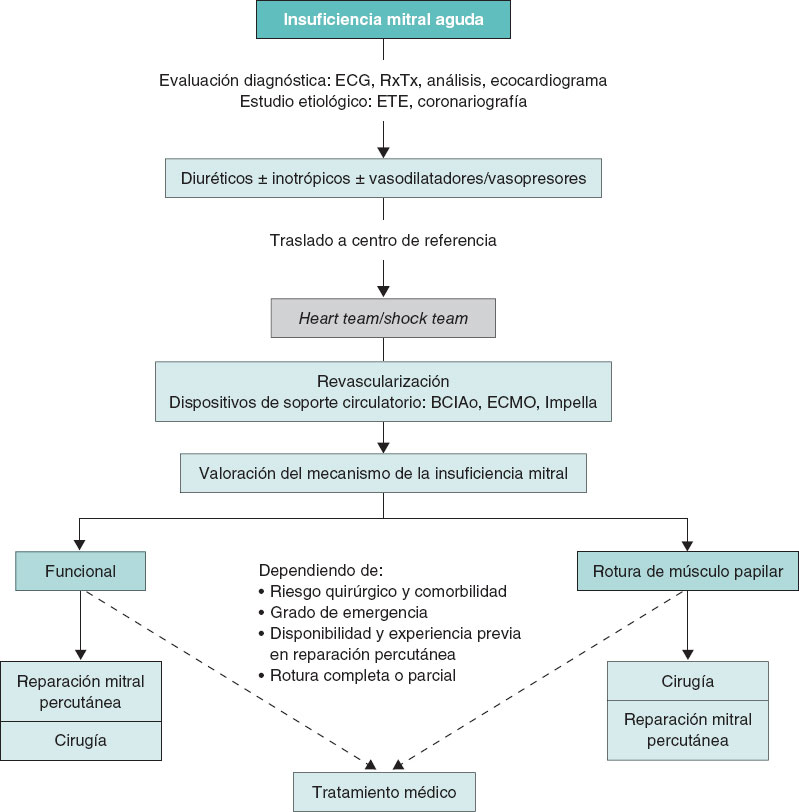
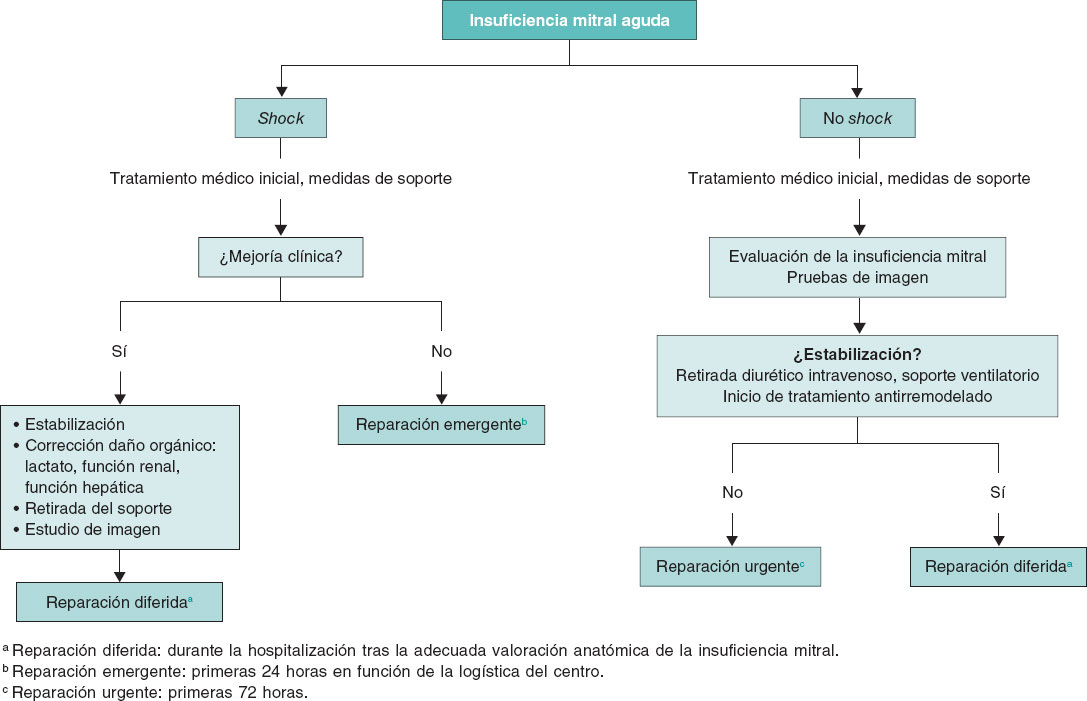
El primer objetivo del tratamiento debe ser la estabilización clínica y hemodinámica del paciente (figura 1). Estos pacientes deberían trasladarse lo antes posible a un centro de referencia con unidad de cuidados agudos/intensivos cardiológicos especializados y disponibilidad de unidad de hemodinámica y cirugía cardiaca. Los diuréticos de asa por vía intravenosa a altas dosis son la base del tratamiento médico, preferiblemente en infusión continua. Los fármacos inotrópicos se recomiendan en pacientes con disfunción sistólica del VI. En aquellos con presión arterial normal o elevada se aconseja el empleo de vasodilatadores por vía intravenosa, fundamentalmente nitroprusiato o nitroglicerina, ya que disminuyen la poscarga del VI y con ello el grado de regurgitación mitral6-8. El empleo de vasopresores se restringe a aquellos pacientes en situación de shock cardiogénico con hipotensión e hipoperfusión mantenida a pesar del empleo de inotrópicos. Estos fármacos aumentan la poscarga y pueden contribuir a aumentar el grado de IM, por lo que deben emplearse a la mínima dosis posible que permita mantener una adecuada presión de perfusión a los tejidos1,7,8.
Figura 1. Algoritmo de tratamiento para la insuficiencia mitral aguda. BCIAo: balón de contrapulsación intraaórtico; ECG: electrocardiograma; ECMO: oxigenador extracorpóreo de membrana; ETE: ecocardiografía transesofágica; RxTx: radiografía del tórax.
La ventilación mecánica no invasiva puede ser de utilidad en pacientes con edema agudo de pulmón flash, que a menudo se asocia a hipertensión. La ventilación con presión positiva mejora la relación ventilación-perfusión, disminuye el edema alveolar, reduce el espacio muerto y mejora la redistribución de flujo pulmonar. Sin embargo, los pacientes en situación de shock cardiogénico asociado a IM aguda grave precisan intubación orotraqueal precoz y ventilación mecánica con el objetivo de lograr una adecuada estabilización, disminuir la descarga adrenérgica y asegurar una correcta oxigenación8.
La monitorización de los parámetros electrocardiográficos, hemodinámicos y gasométricos debe ser precisa y continua. Para ello se aconseja la canalización de una línea arterial para monitorización arterial invasiva, un acceso venoso central en pacientes en shock, la medición de la presión venosa central, la cuantificación continua de la diuresis y la realización de controles gasométricos con una periodicidad variable dependiendo de la situación clínica del paciente. En caso de escasa respuesta diurética se recomienda el tra- tamiento de sustitución renal continuo de forma precoz con el ob- jetivo de reducir lo antes posible la congestión pulmonar9,10.
En caso de refractariedad al tratamiento farmacológico inicial y de persistencia del deterioro clínico y hemodinámico durante las primeras 12-24 horas, se valorará el inicio de soporte mecánico circulatorio11. En tal situación es aconsejable la evaluación del caso por el shock team del centro y tomar una decisión conjunta sobre la secuencia más adecuada de tratamiento y la elección del dispositivo. Esta elección se basará en 4 aspectos fundamentales: a) aquellos relacionados con el paciente y su comorbilidad; b) la etiología y el mecanismo de la IM, y la función ventricular; c) la situación hemodinámica y el grado de profundidad del shock; y d) la experiencia del centro. El abordaje detallado del soporte circulatorio está fuera del objetivo del presente documento. Brevemente, el balón de contrapulsación intraaórtico puede resultar de utilidad en pacientes con IM secundaria a infarto de miocardio en situación de pre-shock (estadio B de la clasificación de la SCAI [Society for Cardiovascular Angiography and Interventions], cuando el paciente se encuentra hipotenso o taquicárdico, pero mantiene una adecuada perfusión tisular) o en estadios iniciales del shock (estadio C de la SCAI, cuando necesita fármacos inotrópicos, vasopresores o soporte mecánico para mantener la perfusión sistémica)12,13. En este mismo escenario, en fases más avanzadas del shock (estadio D de la SCAI, cuando no responde a las medidas instauradas en el estadio anterior), y más aún si existe RMP, el dispositivo de elección será el oxigenador extracorpóreo de membrana venoarterial periférico con o sin descarga asociada del VI mediante balón de contrapulsación intraaórtico o Impella (Abiomed, Estados Unidos), con especial precaución en caso de RMP13,14. En los pacientes con IM isquémica en el contexto de un infarto de miocardio por isquemia del músculo papilar o miocardiopatía dilatada isquémica, o disfunción ventricular izquierda con función conservada del ventrículo derecho, el dispositivo Impella puede resultar de gran utilidad, ya que permite la descarga directa del VI y con ello la reducción de las presiones telediastólicas del VI y la regurgitación mitral, al tiempo que mejora el gasto cardiaco11 (figuras1 y 2 del material adicional). Un aspecto esencial a considerar es el inicio precoz del soporte mecánico circulatorio en los pacientes con indicación, con el objetivo de anticipar y prevenir la aparición de fallo multiorgánico establecido.
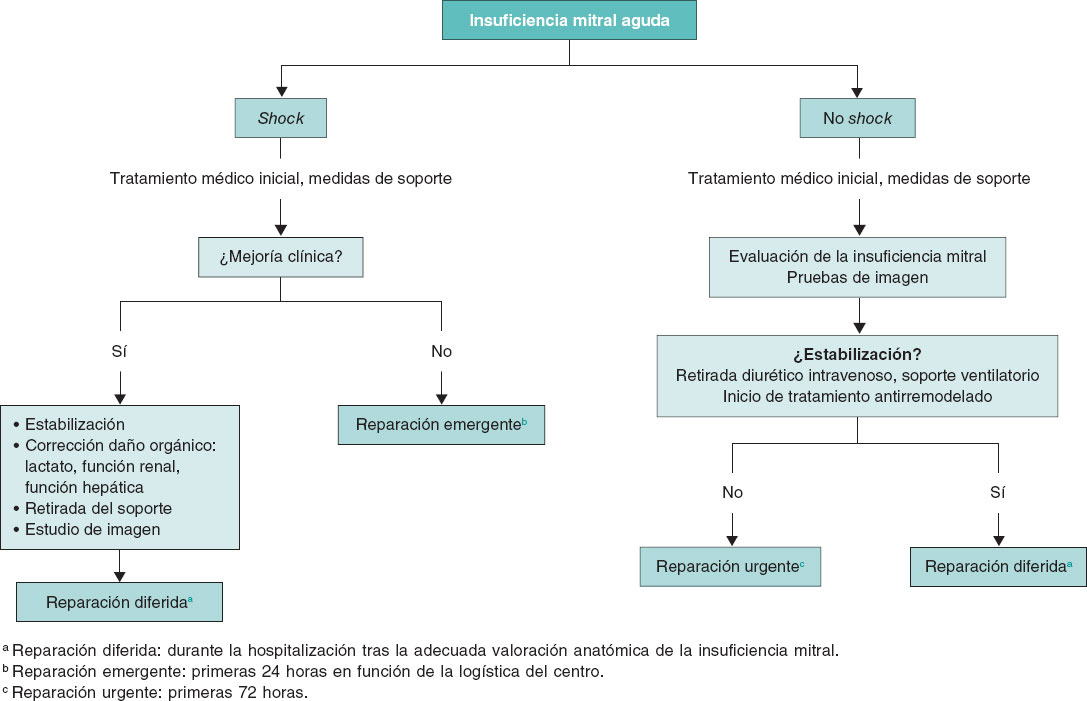
Figura 2. Momento óptimo para el tratamiento de reparación mitral.
La revascularización coronaria es muy recomendable cuando la IM está relacionada con isquemia aguda15. En este sentido, y en relación con la revascularización percutánea en el contexto del infarto agudo de miocardio, la gravedad de la IM puede cambiar desde la fase más próxima a la angioplastia hasta la fase más crónica. En cualquier caso, la persistencia de IM significativa condiciona el pronóstico a corto y medio plazo de los pacientes16. El tratamiento definitivo pasa por una sustitución o una reparación mitral.
En la actualidad, el momento óptimo para realizar la intervención percutánea sobre la válvula mitral es motivo de controversia. Será variable en función de la etiología, la función ventricular, el estado clínico del paciente y la comorbilidad. Siempre que la situación clínica y hemodinámica lo permita, es preferible el implante diferido. Sin embargo, esta situación no siempre es posible y en algunas ocasiones es preciso el tratamiento agudo de la IM mediante una reparación de borde a borde para lograr la estabilización del paciente. Así, en pacientes con edema agudo de pulmón flash, con VI normal, en los que la IM suele asociarse a hipertensión, que responden adecuadamente al tratamiento médico con oxigenoterapia/ventilación mecánica no invasiva y diuréticos, así como en aquellos pacientes inestables, en los que la respuesta al tratamiento sea adecuada, la reparación se realizará de forma diferida, una vez resuelta la insuficiencia cardiaca aguda, en situación de euvolemia, con la dosis de diurético ajustada. En algunos pacientes con insuficiencia cardiaca por IM en los que no se logra la retirada del tratamiento diurético por vía intravenosa, deberá considerarse la reparación urgente, dentro de las primeras 72 horas. Por último, en el espectro más grave de pacientes, aquellos con IM en situación de shock cardiogénico, con respuesta insuficiente al tratamiento y persistencia de shock refractario, se debe evaluar la viabilidad de la reparación emergente (dentro de las siguientes 24 horas) de la válvula mitral o considerar alternativas como el trasplante cardiaco. (figura 2). En este grupo de pacientes más inestables, el tratamiento de reparación percutánea puede cambiar el espectro de gravedad, aun con reducciones parciales de la gravedad de la IM, facilitando la transición a un escenario más estable que permita plantear un tratamiento definitivo3.
PAPEL DE LAS TÉCNICAS DE IMAGEN EN LA VALORACIÓN DE LA INSUFICIENCIA MITRAL AGUDA
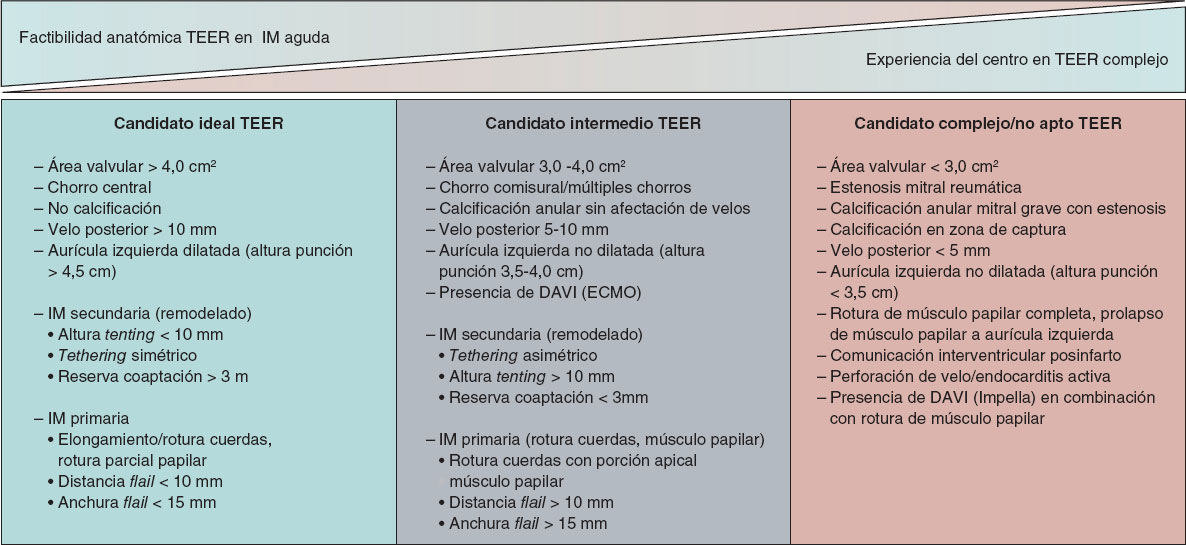
Se requiere un alto índice de sospecha para identificar a los pacientes con IM significativa de instauración aguda. La ecocardiografía transtorácica se puede realizar en la cabecera del paciente, incluso en la sala de emergencias, y debería ser la técnica de primera línea en la evaluación de la disnea aguda. La ecocardiografía es la prueba de imagen de primera elección para identificar el mecanismo causante de la IM y descartar otras etiologías para un nuevo soplo sistólico en este contexto clínico. A menudo se requiere la ecocardiografía transesofágica para establecer el diagnóstico, la gravedad de la IM y la estrategia de tratamiento, definiendo además a aquellos candidatos más o menos idóneos para el tratamiento de reparación percutánea de borde a borde (TEER) (figura 3).
Figura 3. Evaluación de la idoneidad para el tratamiento de reparación mitral de borde a borde. DAVI: dispositivo de asistencia ventricular izquierda; ECMO: oxigenador extracorpóreo de membrana; IM: insuficiencia mitral; TEER: tratamiento de reparación percutánea de borde a borde.
La exploración ecocardiográfica debe incluir una cuidadosa evaluación del VI (fracción de eyección, dimensiones y alteraciones del movimiento de la pared), la anatomía de la válvula mitral (anillo, velos, cuerdas tendinosas y músculos papilares) y la identificación de la etiología, el mecanismo y el grado de la IM. Se debe realizar un enfoque integrador para la cuantificación de la IM, que incluya parámetros cualitativos, semicuantitativos y cuantitativos de acuerdo con las guías vigentes17,18. El flujo de Doppler color suele ser marcadamente excéntrico, lo que puede subestimar la gravedad de la IM. La medición del ancho de la vena contracta y la densidad de la señal Doppler de onda continua son las técnicas más simples para determinar rápidamente si hay una IM significativa. La curva de velocidad del volumen de regurgitación en el Doppler de onda continua a menudo muestra la forma triangular característica debido a una rápida disminución en la velocidad sistólica tardía, que refleja el aumento abrupto en la presión auricular izquierda, coherente con una «onda v». La IM isquémica es mayor en la sístole precoz y tardía cuando predominan las fuerzas opuestas de tracción (contracción sistólica del VI). Cuanto más grave sea la IM, más holosistólica será la duración de la IM. Sin embargo, es importante recordar que algunos parámetros de Doppler para evaluar la gravedad de la IM se ajustan mejor a la IM crónica que a la aguda. La combinación de hipotensión y alta presión en la aurícula izquierda resulta en un bajo gradiente de conducción y, por lo tanto, una velocidad del chorro de IM más baja a través de la válvula mitral. En consecuencia, la imagen Doppler color a menudo no mostrará una gran turbulencia en el flujo, y así la IM puede subestimarse o no apreciarse en absoluto. Algunas imágenes anatómicas relevantes (flail del velo, RMP, VI hiperdinámico en el contexto de edema pulmonar o shock cardiogénico) deberían ser suficientes para corroborar el diagnóstico, incluso si el Doppler color no muestra un gran chorro de IM.
La ecocardiografía también identifica con frecuencia la causa de la IM aguda. Una etiología habitual en los pacientes ancianos es la rotura de cuerdas asociada a degeneración fibroelástica. La IM isquémica debida a la tracción de la valva también será evidente con alteraciones en el movimiento de la pared en la región de la arteria coronaria culpable y la consecuente tracción de los velos. La IM isquémica aguda puede ocurrir con isquemia miocárdica activa o reversible, y puede desaparecer después de que se resuelva la isquemia, por lo que se recomienda una nueva evaluación después de la revascularización19.
La IM aguda por remodelado del VI es una consecuencia de la distorsión en la relación espacial normal del aparato valvular mitral y el VI. Con el remodelado adverso del VI (dilatación y cambio de forma), uno o ambos velos mitrales se desplazan en sentido apical y radial lejos del centro del ventrículo, debido al desplazamiento hacia fuera de los músculos papilares secundario al remodelado. Este patrón se observa mejor en las vistas apicales de 3 y 4 cámaras20. Las valvas son esencialmente normales en el escenario agudo, pero se ha descrito un proceso de remodelado de la valva con aumento de los grosores durante el seguimiento21. El anillo mitral puede estar dilatado, siendo más frecuente en la IM no aguda. Aunque tanto el remodelado regional como el global pueden llevar a IM, el sitio específico de remodelado es muy relevante. Los infartos miocárdicos inferolaterales tienen más probabilidades de estar asociados con una IM significativa que los infartos miocárdicos anteriores19. Las diferencias entre el remodelado regional y el global típicamente resultan en patrones de tracción diferentes. Los pacientes con tracción simétrica presentan chorros centrales, mientras que aquellos con tracción asimétrica se caracterizan por chorros excéntricos.
La forma más grave de la IM aguda es la RMP. Las características ecocardiográficas bidimensionales comunes incluyen una valva mitral suelta con cuerdas cortadas o una cabeza de músculo papilar que se mueve libremente dentro del corazón izquierdo. Debido a la diferencia en la anatomía vascular coronaria, la RMP posteromedial ocurre con más frecuencia que la anterolateral. El prolapso de la valva de reciente aparición durante la fase aguda del infarto de miocardio puede ser un signo de una RMP inminente que requiere atención cuidadosa. La función del VI a menudo es hiperdinámica debido a una disminución repentina de la poscarga, y las alteraciones regionales del movimiento de la pared pueden ser sutiles o no reconocidas. La evaluación del Doppler color suele mostrar una IM excéntrica, lo que puede llevar a una subestimación del grado de la IM.
INTERVENCIONISMO PERCUTÁNEO EN LA INSUFICIENCIA MITRAL AGUDA
Hasta la fecha, el abordaje quirúrgico de la IM aguda sigue siendo la primera línea de tratamiento, a pesar de que los pacientes incluidos en las series quirúrgicas están muy seleccionados y sus resultados no pueden generalizarse, además de que se trata de una evidencia observacional. En este sentido, en el SHOCK Trial Registry solo se ofreció cirugía valvular mitral al 38% de los pacientes con IM aguda posinfarto complicada con shock cardiogénico22, con una mortalidad en estos casos del 40%. Asimismo, en un estudio en el que se evaluaba la presencia de RMP en una gran cohorte de pacientes con IM, se halló que solo el 57,5% recibieron tratamiento quirúrgico23; decisión influida por la edad, la comorbilidad y la estabilidad clínica. Este grupo de pacientes tuvieron una mortalidad del 36%. Incluso en aquellos tratados con cirugía, los resultados fueron subóptimos teniendo en cuenta la mortalidad precoz, la tasa de transfusiones, la insuficiencia renal y la ventilación mecánica prolongada24.
Por lo tanto, el desarrollo de enfoques menos invasivos para abordar la IM en este contexto, en el que los pacientes suelen presentar un alto riesgo quirúrgico, es primordial para ampliar el potencial número de pacientes que se beneficiarían de una corrección de la IM.
Las técnicas percutáneas para el tratamiento de la IM han experimentado un gran desarrollo en los últimos años. De todos los dispositivos disponibles, el TEER con el sistema MitraClip (Abbott Vascular, Estados Unidos) es el más utilizado y acumula la mayor experiencia clínica. El TEER con MitraClip ha demostrado ser una técnica segura y eficaz para reducir la IM en pacientes con alto riesgo quirúrgico, y para mejorar los síntomas, la calidad de vida y el pronóstico en pacientes con IM funcional y degenerativa25-28. El dispositivo PASCAL (Edwards Lifesciences, Estados Unidos), en el ensayo aleatorizado CLASP IID29, también ha demostrado un rendimiento seguro y eficaz en comparación con MitraClip en pacien- tes con IM degenerativa. Del mismo modo, los datos procedentes de registros tampoco muestran diferencias significativas con el MitraClip en la regurgitación mitral secundaria30.
Sin embargo, mientras que la mayoría de los TEER se realizan en pacientes que se encuentran en una situación clínica estable con clase funcional avanzada e IM crónica, los pacientes con IM aguda están menos representados en la literatura. La IM aguda supone una gran necesidad no cubierta en la que el uso de intervenciones percutáneas ha crecido de manera significativa en los últimos años.
Cada vez hay más pruebas de la eficacia y la seguridad del TEER en pacientes que desarrollan una IM aguda grave sintomática de «tipo funcional». El grupo EREMMI (European Registry of MitraClip in Acute Mitral Regurgitation following an Acute Myocardial Infarction) ha publicado la mayor serie sobre el tema. El primer artículo apareció en 2020 y mostraba la experiencia europea con MitraClip en este contexto31. Se incluyeron 44 pacientes con una edad media de 70 años y alto riesgo quirúrgico (mediana de EuroSCORE II 15,1%,) entre 2016 y 2018. Es importante destacar que la media- na de tiempo entre el diagnóstico de infarto agudo de miocardio y el tratamiento intervencionista con el MitraClip fue de 18 días, y entre el desarrollo de IM y el tratamiento fue de 12,5 días, lo que refleja el fracaso en la estabilización con tratamiento médico aislado. Los pacientes estaban muy sintomáticos, con un 63,6% en clase IV de la New York Heart Association (NYHA) en el momento del procedimiento. En esta serie, el éxito técnico fue del 86,6%. Durante el seguimiento, la mortalidad a los 30 días fue del 9,1%, cifra más que aceptable teniendo en cuenta que la IM isquémica aguda es la enfermedad con mayor mortalidad en todas las cirugías de IM aguda32. A los 6 meses se observaron una IM ≤ 2+ en el 72,5% y una clase I-II de la NYHA en el 75,9% de los pacientes supervivientes.
Posteriormente, los investigadores evaluaron el papel del TEER en el escenario del shock cardiogénico en una cohorte de 93 pacientes33. El éxito técnico fue elevado y la mortalidad a los 30 días, aunque mayor en el grupo de shock cardiogénico, no mostró una diferencia estadísticamente significativa entre los grupos (10% en pacientes con shock y 2,3% en pacientes sin shock; p = 0,212). Por otro lado, la tasa de mortalidad en los pacientes que no estaban en situación de shock fue extremadamente baja, incluso para una población de tan alto riesgo, lo que refleja los efectos hemodinámicos positivos de una corrección percutánea de la IM. Por lo tanto, si la experiencia del equipo de TEER es amplia, el shock cardiogénico no debería excluir este enfoque terapéutico. Estos resultados, junto con la nueva información sobre el papel del TEER en pacientes en shock34-36, deberían situar a este tratamiento como una estrategia a considerar teniendo en cuenta su seguridad y eficacia.
Comparando los pacientes con fracción de eyección del VI mayor o menor del 35%, los autores no encontraron diferencias significativas en la mortalidad intrahospitalaria ni al año (11 frente a 7%, p = 0,51, y 19 frente a 12%, p = 0,49), ni tampoco en la tasa de rehospitalización a 3 meses. Por lo tanto, el efecto positivo del tratamiento percutáneo se mantiene en los pacientes con fracción de eyección más baja37.
Por último, el trabajo más completo del grupo comparó 3 estrategias de tratamiento de la IM precozmente tras un infarto: conservadora, quirúrgica y TEER38. Esta serie incluyó 471 pacientes, de los que 266 se trataron de forma conservadora y 205 se sometieron a intervenciones; de estas, 106 fueron quirúrgicas y 99 fueron TEER. En consonancia con la literatura previa, los pacientes tratados médicamente presentaron los peores resultados, con una mortalidad 2 veces mayor que los que recibieron una intervención. Sin embargo, más interesante es la comparación de ambas estrategias intervencionistas. Los resultados revelaron que los pacientes con corrección quirúrgica presentaban peores resultados que los que recibieron MitraClip, con una mortalidad más de 2 veces superior a 1 año. Esta diferencia se debió a la mortalidad durante la hospitalización (16 frente a 6%; p = 0,03). Dicho hallazgo fue independiente del perfil de puntuación de riesgo quirúrgico de los pacientes.
En cuanto al tratamiento percutáneo en el escenario de la RMP, se ha presentado la mayor serie tratada con TEER39. El estudio incluyó 23 pacientes, con una edad media de 68 años, el 56% varones, rechazados para cirugía debido a su alto riesgo quirúrgico. Casi el 90% se encontraban en situación de shock cardiogénico y 17 estaban con soporte mecánico circulatorio (11 con balón de contrapulsación intraaórtico, 2 con Impella y 4 con oxigenador extracorpóreo de membrana venoarterial). El éxito inmediato de la intervención se obtuvo en el 87% de los pacientes y se acompañó de una rápida mejoría hemodinámica. La mortalidad hospitalaria fue del 30%, todavía elevada, pero aceptable si se tiene en cuenta que los pacientes no eran candidatos a cirugía y que la única alternativa posible era el tratamiento médico, con un pronóstico infausto. Cabe señalar que 5 pacientes que pudieron ser dados de alta recibieron una sustitución quirúrgica de la válvula mitral con éxito durante el seguimiento, lo que pone de relieve el importante papel de la transición a una situación clínica más estable para poder realizar una intervención quirúrgica diferida.
En este escenario, las guías y las recomendaciones40-42 recogen el tratamiento percutáneo solo en pacientes seleccionados de alto riesgo no aptos para cirugía. Sin embargo, considerando la dificultad de la toma de decisiones, las limitaciones para ofrecer la cirugía a una población más amplia y la complejidad de tratar a los pacientes con shock cardiogénico, la mayoría de los casos deberían evaluarse por el shock team y considerar las diferentes opciones terapéuticas, entre ellas el tratamiento percutáneo (figura 1).
Existen varias posibles ventajas de un enfoque percutáneo en el tratamiento de la IM aguda. Estos pacientes suelen presentar un deterioro clínico significativo, principalmente atribuible al desarrollo de la regurgitación mitral dirigida a una aurícula izquierda pequeña y no distensible. Esto se traduce en presiones pulmonares muy elevadas y un volumen de eyección efectivo bajo, que son los factores fisiológicos principales que conducen a la enfermedad. El TEER induce una mejoría hemodinámica casi inmediata al aliviar la cantidad de regurgitación mitral, lo que a su vez disminuye las presiones en las cámaras izquierdas y en la arteria pulmonar, y aumenta el gasto cardiaco, llevando a una recuperación más rápida con la menor agresión tisular posible43. Además, el TEER no excluye una cirugía cardiaca programada en caso de que el dispositivo falle o recurra la IM. De hecho, el papel del TEER como puente hacia una cirugía de menor riesgo es atractivo. En los casos en que la evolución no sea buena, tampoco se cierra la puerta a un posible trasplante cardiaco.
En cuanto a las limitaciones, hay varias que deben señalarse. Los resultados con TEER en esta condición son prometedores, pero la evidencia se limita a análisis observacionales retrospectivos de una población pequeña. No se puede excluir la presencia de un sesgo de selección en los pacientes tratados con TEER, en el sentido de que solo aquellos que respondieron al tratamiento médico y al soporte cardiaco fueron los que recibieron TEER. Asimismo, el seguimiento clínico y ecocardiográfico a largo plazo es limitado. Y por otra parte, casi todos los estudios incluyen pacientes de antes de 2020, cuando aún no se disponía de las nuevas generaciones de dispositivos con posibilidad de captura independiente o más grandes y anchos, que pueden mejorar los resultados del TEER.
Idealmente, el desarrollo de registros prospectivos y un ensayo aleatorizado debidamente diseñado y ejecutado deberían proporcionar información más robusta sobre la indicación de este tratamiento en la IM aguda.
Actualmente existen 2 ensayos en fases muy iniciales que puede que arrojen claridad en este escenario. El ensayo internacional multicéntrico EMCAMI (Early Transcatheter Mitral Valve Repair After Myocardial Infarction; ClinicalTrials.gov: NCT06282042) se ha diseñado para evaluar de manera prospectiva el papel del tratamiento precoz con el tratamiento de aproximación de velos con MitraClip frente al tratamiento convencional conservador en la IM aguda próxima (menos de 90 días) a un infarto agudo de miocardio, en términos de mortalidad y reingresos por insuficiencia cardiaca. En el ensayo MINOS (Transcatheter Mitral Valve Repair for Inotrope Dependent Cardiogenic Shock; ClinicalTrials.gov: NCT05298124) se evaluarán las mismas estrategias de tratamiento en pacientes con shock cardiogénico e IM aguda.
Consideraciones técnicas y organizativas
La reparación valvular percutánea de borde a borde en la IM aguda supone un desafío desde el punto de vista técnico y organizativo, con varios aspectos destacables.
La aurícula izquierda suele ser pequeña y no distensible. Por lo tanto, la punción transeptal y la posición para lograr suficiente altura sobre la válvula pueden ser complejas y requieren experiencia. Asimismo, es posible que se necesite una punción fuera de la fosa oval. Podrían ser recomendables los sistemas que permiten la punción con radiofrecuencia para un punto de entrada preciso44.
La complejidad de la anatomía valvular, especialmente en casos de IM primaria, en los que se puede encontrar espacios, o gaps grandes y anchos, y los chorros comisurales, no son infrecuentes. En estas situaciones se recomienda aprovechar las nuevas características de MitraClip G4 o PASCAL Ace45,46, que permiten la captura independiente y la optimización de los velos para mejorar los resultados. Con estas nuevas generaciones, la gran mayoría de los casos son técnicamente realizables. Si se trata de regurgitación mitral primaria por RMP, por lo general, después de la colocación de múltiples dispositivos, se estabiliza el músculo papilar y se controla el movimiento adicional, evitando así desgarros adicionales de tejido. Sin embargo, se debe prestar especial atención para no interferir con el dispositivo en el músculo y evitar daños adicionales o incluso la rotura completa en aquellos con una rotura parcial.
El deterioro clínico de algunos pacientes puede ser muy rápido, lo que plantea la cuestión de si los equipos especializados en válvula mitral deben estar preparados para realizar el TEER en situaciones de emergencia, o incluso si deberían trasladarse a centros que no la ofrezcan y cuyos pacientes sean demasiado inestables para ser transferidos. En este sentido, se considera que los equipos deben poder implementar el tratamiento en las siguientes 24 horas de deterioro clínico para la IM primaria y los pacientes en shock, y lo antes posible para el resto de los casos. Este tipo de tratamientos deberían considerarse dentro del marco del «código shock», todavía por desarrollar en la mayoría de las comunidades autónomas, y organizarlas según los recursos disponibles.
CONCLUSIONES
Los pacientes con IM aguda requieren un abordaje multidisciplinario tanto en su evaluación diagnóstica como en la toma de decisiones sobre la estrategia de tratamiento. El TEER constituye una alternativa de tratamiento eficaz para la IM aguda, ya sea como tratamiento definitivo o como transición a un escenario más estable para otros tratamientos, con una alta tasa de éxito del procedimiento y una mejoría del pronóstico de los pacientes en centros con experiencia en la técnica. La adecuada selección de los pacientes, la cuidadosa evaluación anatómica y la elección del momento óptimo para el implante son esenciales para el éxito del TEER.
FINANCIACIÓN
Este trabajo no ha recibido financiación.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido a la redacción del texto y a su revisión crítica, y han aprobado la versión final del artículo.
CONFLICTO DE INTERESES
No existe ningún conflicto de intereses.
MATERIAL ADICIONAL
BIBLIOGRAFÍA
1. Bernard S, Deferm S, Bertrand PB. Acute valvular emergencies. Eur Heart J Acute Cardiovasc Care. 2022;11:653-665.
2. Boudoulas KD, Triposkiadis F, Koenig S, et al. Acute mitral regurgitation with and without acute heart failure. Heart Fail Rev. 2023;28:1201-1209.
3. Shuvy M, Maisano F, Strauss BH. Transcatheter Mitral Edge-to-Edge Repair for Treatment of Acute Mitral Regurgitation. Can J Cardiol. 2023;39:1382-1389.
4. Stout KK, Verrier ED. Acute valvular regurgitation. Circulation. 2009;119:3232-3241.
5. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease:a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143:e72-227.
6. Harmon L, Boccalandro F. Cardiogenic shock secondary to severe acute ischemic mitral regurgitation managed with an Impella 2.5 percutaneous left ventricular assist device. Catheter Cardiovasc Interv. 2012;79:1129-1134.
7. Akodad M, Schurtz G, Adda J, Leclercq F, Roubille F. Management of valvulopathies with acute severe heart failure and cardiogenic shock. Arch Cardiovasc Dis. 2019;112:773-780.
8. van Diepen S, Katz JN, Albert NM, et al.;American Heart Association Council on Clinical Cardiology;Council on Cardiovascular and Stroke Nursing;Council on Quality of Care and Outcomes Research;and Mission:Lifeline. Contemporary management of cardiogenic shock:a scientific statement from the American Heart Association. Circulation. 2017;136:e232-e268.
9. Chioncel O, Parissis J, Mebazaa A, et al. Epidemiology, pathophysiology and contemporary management of cardiogenic shock - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2020;22:1315-1341.
10. Saxena A, Garan AR, Kapur NK, et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 2020;141:1184-1197.
11. Vandenbriele C, Balthazar T, Wilson J, et al. Left Impella®-device as bridge from cardiogenic shock with acute, severe mitral regurgitation to MitraClip®-procedure:a new option for critically ill patients. Eur Heart J Acute Cardiovasc Care. 2021;10:415-421.
12. Kettner J, Sramko M, Holek M, Pirk J, Kautzner J. Utility of intra-aortic balloon pump support for ventricular septal rupture and acute mitral regurgitation complicating acute myocardial infarction. Am J Cardiol. 2013;112:1709-1713.
13. Baran DA, Grines CL, Bailey S, et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock:This document was endorsed by the American College of Cardiology (ACC), the American Heart Association (AHA), the Society of Critical Care Medicine (SCCM), and the Society of Thoracic Surgeons (STS) in April 2019. Catheter Cardiovasc Interv. 2019;94:29-37.
14. Martínez-Sellés M, Hernández-Pérez FJ, Uribarri A, et al. Cardiogenic shock code 2023. Expert document for a multidisciplinary organization that allows quality care. Rev Esp Cardiol. 2023;76:261-269.
15. Castleberry AW, Williams JB, Daneshmand MA, et al. Surgical revascularization is associated with maximal survival in patients with ischemic mitral regurgitation:a 20-year experience. Circulation. 2014;129:2547-2556.
16. Nishino S, Watanabe N, Kimura T, et al. The Course of Ischemic Mitral Regurgitation in Acute Myocardial Infarction After Primary Percutaneous Coronary Intervention:From Emergency Room to Long-Term Follow-Up. Circ Cardiovasc Imaging. 2016;9:e004841.
17. Lancellotti P, Pibarot P, Chambers J, et al. Multi-modality imaging assessment of native valvular regurgitation:an EACVI and ESC council of valvular heart disease position paper. Eur Heart J Cardiovasc Imaging. 2022;23:E171-232.
18. Zoghbi WA, Adams D, Bonow RO, et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation. J Am Soc Echocardiogr. 2017;30:303-371.
19. Watanabe N. Acute mitral regurgitation. Heart. 2019;105:671-677.
20. Kimura T, Roger VL, Watanabe N, et al. The unique mechanism of functional mitral regurgitation in acute myocardial infarction:a prospective dynamic 4D quantitative echocardiographic study. Eur Heart J Cardiovasc Imaging. 2019;20:396-406.
21. Nishino S, Watanabe N, Gi T, Kuriyama N, Shibata Y, Asada Y. Longitudinal Evaluation of Mitral Valve Leaflet Remodeling After Acute Myocardial Infarction:Serial Quantitation of Valve Geometry Using Real-Time 3-Dimensional Echocardiography. Circ Cardiovasc Imaging. 2020;13:E011396.
22. Thompson CR, Buller CE, Sleeper LA, et al. Cardiogenic shock due to acute severe mitral regurgitation complicating acute myocardial infarction:A report from the SHOCK Trial Registry. J Am Coll Cardiol. 2000;36(3 Suppl. A):1104-1109.
23. Bhardwaj B, Sidhu G, Balla S, et al. Outcomes and Hospital Utilization in Patients With Papillary Muscle Rupture Associated With Acute Myocardial Infarction. Am J Cardiol. 2020:125:1020-1025.
24. Kilic A, Sultan I, Chu D, Wang Y, Gleason TG. Mitral Valve Surgery for Papillary Muscle Rupture:Outcomes in 1342 Patients From The Society of Thoracic Surgeons Database. Ann Thorac Surg. 2020;110:1975-1981.
25. Nickenig G, Estevez-Loureiro R, Franzen O, et al. Percutaneous mitral valve edge-to-edge Repair:In-hospital results and 1-year follow-up of 628 patients of the 2011-2012 pilot European Sentinel Registry. J Am Coll Cardiol. 2014;64:875-884.
26. Mack MJ, Lindenfeld JA, Abraham WT, et al. 3-Year Outcomes of Transcatheter Mitral Valve Repair in Patients With Heart Failure. J Am Coll Cardiol. 2021;77:1029-1040.
27. Mauri L, Foster E, Glower DD, et al. 4-year results of a randomized controlled trial of percutaneous repair versus surgery for mitral regurgitation. J Am Coll Cardiol. 2013;62:317-328.
28. Stone GW, Abraham WT, Lindenfeld J, et al. Five-Year Follow-up after Transcatheter Repair of Secondary Mitral Regurgitation. N Engl J Med. 2023;388:2037-2048.
29. Lim DS, Smith RL, Gillam LD, et al. Randomized Comparison of Transcatheter Edge-to-Edge Repair for Degenerative Mitral Regurgitation in Prohibitive Surgical Risk Patients. JACC Cardiovasc Interv. 2022;15:2523-2536.
30. Haschemi J, Haurand JM, Bönner F, Kelm M, Westenfeld R, Horn P. PASCAL vs MitraClip for Mitral Valve Transcatheter Edge-to-Edge Repair:A Single-Center Real-World Experience. JACC Cardiovasc Interv. 2022;15:1002-1004.
31. Estévez-Loureiro R, Adamo M, Arzamendi D, et al. Transcatheter mitral valve repair in patients with acute myocardial infarction:Insights from the European Registry of MitraClip in Acute Mitral Regurgitation following an acute myocardial infarction (EREMMI). EuroIntervention. 2020;15:1248-1250.
32. Lorusso R, Gelsomino S, De Cicco G, Beghi C, et al. Mitral valve surgery in emergency for severe acute regurgitation:analysis of postoperative results from a multicentre study. Eur J Cardiothorac Surg. 2008;33:573-582.
33. Estévez-Loureiro R, Shuvy M, Taramasso M, et al. Use of MitraClip for mitral valve repair in patients with acute mitral regurgitation following acute myocardial infarction:Effect of cardiogenic shock on outcomes (IREMMI Registry). Catheter Cardiovasc Interv. 2021;97:1259-1267.
34. Tang GHL, Estevez-Loureiro R, Yu Y, Prillinger JB, Zaid S, Psotka MA. Survival following edge-to-edge transcatheter mitral valve repair in patients with cardiogenic shock:A nationwide analysis. J Am Heart Assoc. 2021;10:e019882.
35. Simard T, Vemulapalli S, Jung RG, et al. Transcatheter Edge-to-Edge Mitral Valve Repair in Patients With Severe Mitral Regurgitation and Cardiogenic Shock. J Am Coll Cardiol. 2022;80:2072-2084.
36. Martínez Gómez E, Mclernie A, Tirado-Conte G, et al. Percutaneous valve repair with Mitraclip device in hemodynamically unstable patients:A systematic review. Catheter Cardiovasc Interv. 2021;98:E627-625
37. Haberman D, Estévez-Loureiro R, Benito-González T, et al. Safety and Feasibility of MitraClip Implantation in Patients with Acute Mitral Regurgitation after Recent Myocardial Infarction and Severe Left Ventricle Dysfunction. J Clin Med. 2021;10:1819.
38. Haberman D, Estévez-Loureiro R, Benito-González T, et al. Conservative, surgical, and percutaneous treatment for mitral regurgitation shortly after acute myocardial infarction. Eur Heart J. 2022;43:641-650.
39. So C, Kang G, Lee J, et al. Transcatheter Edge-to-Edge Repair for Acute Mitral Regurgitation With Cardiogenic Shock Secondary to Mechanical Complication. Cardiovasc Revasc Med. 2022;45:44-50.
40. Damluji AA, Van Diepen S, Katz JN, et al. Mechanical Complications of Acute Myocardial Infarction:A Scientific Statement From the American Heart Association. Circulation. 2021;144:E16-35.
41. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur J Cardiothorac Surg. 2021;60:727-800.
42. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease:Executive Summary:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021;77:450-500.
43. Siegel RJ, Biner S, Rafique AM, et al. The acute hemodynamic effects of MitraClip therapy. J Am Coll Cardiol. 2011;57:1658-1665.
44. Sharma SP, Nalamasu R, Gopinathannair R, Vasamreddy C, Lakkireddy D. Transseptal Puncture:Devices, Techniques, and Considerations for Specific Interventions. Curr Cardiol Rep. 2019;21:52.
45. Hausleiter J, Lim DS, Gillam LD, et al. Transcatheter Edge-to-Edge Repair in Patients With Anatomically Complex Degenerative Mitral Regurgitation. J Am Coll Cardiol. 2023;81:431-442.
46. Chakravarty T, Makar M, Patel D, et al. Transcatheter Edge-to-Edge Mitral Valve Repair With the MitraClip G4 System. JACC Cardiovasc Interv. 2020;13:2402-2414.
* Autor para correspondencia.
Correo electrónico: ana_viana_tejedor@hotmail.com (A. Viana-Tejedor).
@Ana_Viana_T; @belcid7; @RodrigoEstevez1; @DrFerreraD; @PabloJ; @manuelbarreirop
RESUMEN
La tomografía computarizada es una técnica no invasiva, de gran resolución espacial, con excelente definición del calcio y del espacio intravascular al emplear medios de contraste, que brinda la posibilidad de realizar tanto mediciones como simulaciones virtuales de intervencionismo coronario y estructural. Se ha establecido como la técnica de referencia en la selección de pacientes y la planificación de procedimientos de intervencionismo transcatéter coronario y estructural en diferentes escenarios (implante percutáneo de válvula aórtica, cierre percutáneo de orejuela izquierda, reemplazo de válvula mitral transcatéter y reemplazo de válvula tricúspide transcatéter). El presente trabajo revisa el papel de la tomografía computarizada en el intervencionismo cardiaco coronario y estructural.
Palabras clave: Tomografía computarizada. Intervencionismo estructural. TAVI. LAAO. TMVR.
ABSTRACT
Computed tomography is a noninvasive imaging technique with high spatial resolution, providing excellent definition of calcium and intravascular space through the use of contrast media. This imaging modality allows both highly accurate measurements and virtual simulations for preprocedural planning in coronary and structural heart disease interventions. Computed tomography is currently the gold standard technique for patient selection and preprocedural planning in numerous scenarios, such as transcatheter aortic valve implantation, left atrial appendage occlusion, transcatheter mitral valve repair, and transcatheter tricuspid valve repair. This article reviews the role of computed tomography in transcatheter coronary and structural heart disease interventions.
Keywords: Computed tomography. Structural heart disease interventions. TAVR. LAAO. TMVR.
Abreviaturas ECG: electrocardiograma. LAAO: cierre percutáneo de la orejuela izquierda. TAVI: implante percutáneo de válvula aórtica. TC: tomografía computarizada. TMVR: reemplazo valvular mitral transcatéter. TSVI: tracto de salida del ventrículo izquierdo.
INTRODUCCIÓN
El intervencionismo coronario y estructural cardiaco ha tenido como técnicas de imagen tradicionales la fluoroscopia y la ecocardiografía transesofágica, en especial para la monitorización durante los procedimientos. La selección de los pacientes por imagen generalmente se fundamentaba también en la ecocardiografía, pero el avance tecnológico y de conocimiento en los últimos años ha permitido introducir nuevas técnicas, en particular la tomografía computarizada (TC) y en menor medida la resonancia magnética, en el ámbito del intervencionismo.
En la actualidad, la TC es la técnica de elección previa al intervencionismo estructural cardiaco en una amplia variedad de procedimientos, así como la técnica de cribado de enfermedad coronaria e incluso para la planificación del intervencionismo coronario.
En la presente revisión se repasan los usos y las indicaciones de la TC cardiaca en el ámbito del intervencionismo cardiaco transcatéter coronario y estructural.
ASPECTOS GENERALES DE LA TOMOGRAFÍA COMPUTARIZADA CARDIACA
La TC es una herramienta idónea para la valoración de los pacientes antes de un procedimiento de cardiología intervencionista. Es una técnica de imagen no invasiva, con excelente definición del calcio y del espacio intravascular con el uso de medios de contraste, que presenta una resolución espacial submilimétrica isotrópica y una aceptable resolución temporal.
La TC, igual que la coronariografía invasiva, utiliza una fuente de rayos X para generar la imagen. Los equipos actuales van montados sobre un anillo (gantry) en el que se dispone el tubo de rayos X opuesto a una corona de detectores. El haz de radiación emitido se atenúa y absorbe de acuerdo con las densidades de los tejidos del paciente. La energía captada por los detectores es reconstruida para obtener una imagen médica.
Al realizar una imagen tomográfica de las estructuras cardiacas y de las arterias coronarias hay que tener en cuenta que se trata de estructuras de reducido calibre y en constante movimiento, de forma independiente entre sí, en los tres ejes del espacio. Por ello, se requiere que el equipo tenga una serie de capacidades técnicas que permitan obtener estudios concluyentes. La tabla 1 recoge la definición de algunos parámetros técnicos fundamentales en la imagen de TC.
Tabla 1. Principales conceptos básicos de tomografía computarizada
| Concepto | Definición |
|---|---|
| Resolución espacial | Capacidad de visualizar dos puntos independientes que se encuentran muy cerca. Depende del tamaño de los detectores; en los equipos modernos es < 1 mm |
| Isotropismo | Imagen compuesta por vóxeles con un tamaño similar en los tres planos del espacio. Permite reformatear la imagen minimizando la pérdida de resolución |
| Resolución temporal | El menor tiempo que precisa el equipo para adquirir la imagen. Depende de la velocidad de rotación del gantry y del método de adquisición |
La adquisición de una TC cardiaca debe realizarse siempre con sincronización electrocardiográfica (ECG-gatted). Esta sincronización ECG permite compensar los movimientos cardiacos, y la realización del estudio en apnea permite compensar los movimientos respiratorios. Se pueden realizar adquisiciones durante todo el ciclo cardiaco o durante una fase del ciclo seleccionada previamente. La adquisición de todo el ciclo cardiaco (llamada «retrospectiva» en los tomógrafos con una cobertura en Z menor de 16 cm) presenta la ventaja de poder reconstruir todas sus fases y hacer una valoración funcional (volúmenes, fracción de eyección, movimiento de los velos valvulares) y reconstrucciones en 4D; sin embargo, requiere una mayor dosis de radiación. Esto puede corregirse en parte con una adquisición retrospectiva con modulación de dosis, en la que se predefine una o varias fases para realizar la adquisición de máxima calidad y el resto del ciclo cardiaco se adquiere con menos calidad, y por lo tanto con una menor dosis de radiación1.
La mejora tecnológica y el aumento de la disponibilidad de escáneres de TC con software para adquisición cardiaca ha permitido incluir esta técnica como estándar en diversos procedimientos de intervencionismo estructural. Se considera que lo mínimo requerido es un equipo de TC de 64 cortes con capacidad para sincronizar con el ECG, pero los equipos más modernos permiten mejor calidad de imagen, menor radiación y uso de contraste. Los equipos de última generación siguen distintas líneas de desarrollo: a) equipos de amplia cobertura (aumenta la distancia explorada en cada latido incrementando el número de detectores, y existen equipos con más de 300 detectores y cobertura cardiaca en un solo latido); b) doble fuente con pitch alto (utilizan dos fuentes de radiación desalineadas 90° con una alta velocidad de la mesa para mejorar la resolución temporal de manera muy significativa); c) equipos espectrales (mediante detectores de distinta sensibilidad o diferentes niveles de energía del emisor se obtienen imágenes en diferentes espectros energéticos que permiten cierto grado de caracterización tisular); y d) conteo de fotones (se eliminan los detectores fotoluminiscentes intermedios, permitiendo aumentar la resolución espacial a 0,2 mm).
Además del equipo de TC son necesarios una bomba inyectora al menos bifásica que permita un alto flujo (4-7 ml/s), un medio de contraste con una concentración de yodo en torno a 350 mg/ml (idealmente isoosmolar) y un sistema digital de procesamiento y almacenamiento de imagen en formato DICOM (Digital Imaging and Communication in Medicine).
La preparación de los pacientes para realizar una TC cardiaca es de crucial importancia para obtener estudios diagnósticos de calidad. Tras descartar contraindicaciones para la realización de la prueba, se debe obtener su consentimiento informado. Se canalizará un acceso venoso periférico, generalmente antecubital derecho (18-20 G). El paciente suele colocarse en decúbito supino con los brazos por encima de la cabeza. Se aplican los electrodos del ECG asegurando una excelente calidad del trazado. Se debe explicar y ensayar con el paciente la apnea necesaria durante la exploración, así como comprobar la calidad del ECG durante la apnea.
En función de la indicación del estudio, si la frecuencia del paciente es alta o el ritmo es irregular puede ser necesario utilizar medicación previa a la exploración, siendo la más frecuente bloqueadores beta intravenosos. En aquellos estudios en los que sea preciso evaluar el lumen coronario, en general se administrará también nitroglicerina sublingual. En cuanto a la realización de una TC cardiaca previa a un intervencionismo estructural, hay que recordar que una estenosis aórtica o mitral grave sintomática es una contraindicación para el uso de nitroglicerina, y los bloqueadores beta deben administrarse con precaución, bajo supervisión de personal cualificado y garantizando la disponibilidad de medios para llevar a cabo una resucitación cardiopulmonar avanzada si fuera necesaria.
APLICACIÓN AL INTERVENCIONISMO CORONARIO
La angiografía coronaria por TC permite hacer una valoración anatómica detallada del árbol coronario, su origen y trayecto, detectar la presencia de lesiones ateroescleróticas, cuantificar los segmentos afectados y determinar la gravedad de la estenosis y la carga ateroesclerótica. Es la técnica estándar para la valoración del paciente sintomático y se puede plantear en algunos pacientes asintomáticos de alto riesgo seleccionados. Tiene una sensibilidad del 97% y una especificidad del 78% tomando como referencia la coronariografía invasiva en una población con una probabilidad pretest del 56%. En comparación con otras técnicas invasivas presenta la mayor sensibilidad, si bien tienen más especificidad técnicas funcionales tales como la resonancia magnética de estrés (80%), la ecocardiografía de estrés (82%) y la tomografía por emisión de positrones (85%)2. A pesar de tener una menor especificidad, la estrategia anatómica basada en la TC se ha comprobado que no es inferior en términos de pronóstico respecto a la estrategia funcional basada en test de isquemia (estudio PROMISE)3.
El alto valor predictivo negativo de la TC la ha posicionado, según las guías de práctica clínica, como técnica de primera línea en los pacientes sintomáticos de riesgo bajo-intermedio para descartar la presencia de enfermedad coronaria obstructiva4. La tabla 2 recoge las principales indicaciones de la TC coronaria en diferentes escenarios clínicos.
Tabla 2. Indicaciones actuales de la tomografía computarizada de arterias coronarias y de la medición del calcio arterial coronario según las guías de práctica clínica de la Sociedad Europea de Cardiología
| Síntomas agudos | Grado de recomendación | Nivel de evidencia | Año | Ref. |
|---|---|---|---|---|
| Pacientes con sospecha de síndrome coronario agudo, troponinas normales o en rango incierto, electrocardiograma normal y no recurrencia de dolor; puede ser considerado como parte de la evaluación diagnóstica inicial | IIA | A | 2023 | 5 |
| Uso sistemático en pacientes con sospecha de síndrome coronario agudo | III | B | 2023 | 5 |
| Síntomas estables | Grado de recomendación | Nivel de evidencia | Año | Ref. |
| Paciente sintomático con sospecha de enfermedad coronaria que no puede ser descartada clínicamente | I | B | 2019 | 4 |
| Estratificación del riesgo en pacientes con sospecha o nuevo diagnóstico de enfermedad coronaria | I | B | 2019 | 4 |
| Pacientes con sospecha de angina vasoespástica para estudiar enfermedad coronaria subyacente | I | C | 2019 | 4 |
| Despistaje de enfermedad coronaria en pacientes hemodinámicamente estables con vegetaciones aórticas que requieren cirugía cardiaca | I | B | 2023 | 6 |
| Pacientes con probabilidad baja-intermedia de enfermedad coronaria y un test previo de estrés no invasivo equívoco | IIA | C | 2021 | 7 |
| Alternativa a coronariografía invasiva previamente a cirugía cardiaca valvular en pacientes con probabilidad baja de enfermedad coronaria | IIA | C | 2021 | 8 |
| Pacientes con sospecha de cardiomiopatía para el despistaje de enfermedad arterial coronaria o anomalías coronarias que puedan causar la miocardiopatía | IIA | C | 2023 | 9 |
| Pacientes previamente a cirugía no cardiaca no urgente, de riesgo intermedio-alto: a) baja-intermedia probabilidad de enfermedad coronaria y sospecha de síndrome coronario crónico o síndrome coronario agudo sin movilización enzimática; b) paciente no elegible para pruebas funcionales no invasivas | IIA | C | 2022 | 10 |
| No se recomienda la tomografía computarizada coronaria para el seguimiento sistemático de pacientes con enfermedad coronaria establecida | III | C | 2019 | 4 |
| Asintomáticos | Grado de recomendación | Nivel de evidencia | Año | Ref. |
| Puntuación de calcio como modificador del riesgo en pacientes asintomáticos de moderado riesgo cardiovascular | IIB | B | 2019 | 4 |
| Individuos seleccionados sin historia de enfermedad coronaria, alto riesgo cardiovascular (SCORE > 10%, fuerte historia familiar, hipercolesterolemia familiar) y deseo de iniciar un programa de ejercicio intenso | IIB | B | 2021 | 11 |
| Alto riesgo cardiovascular (diabetes mellitus, historia familiar o test previo que sugieren enfermedad coronaria) | IIB | C | 2019 | 4 |
| Adultos (> 40 años) asintomáticos con diabetes mellitus | IIB | B | 2019 | 4 |
| Adultos asintomáticos no diabéticos de bajo riesgo | III | C | 2019 | 4 |
Los avances tecnológicos y la inclusión de nuevas técnicas, como la perfusión de estrés con TC y el análisis de la reserva fraccional de flujo con TC (FFRCT, fractional flow reserve computed tomography), han permitido aumentar la especificidad hasta el 85-87%12, con un mayor valor predictivo positivo de la técnica y permitiendo evaluar de manera precisa a pacientes de riesgo intermedio-alto.
Se han publicado importantes trabajos en relación con el pronóstico de los pacientes estudiados mediante TC. El estudio SCOT-HEART13 demostró una reducción de las muertes por causa cardiovascular y de los infartos de miocardio no fatales a los 5 años de seguimiento con una estrategia guiada por TC con ajuste de tratamiento según los resultados, frente a una estrategia de manejo convencional. Por otra parte, el estudio DISCHARGE14 demostró un similar riesgo de eventos cardiovasculares mayores en el seguimiento en pacientes con probabilidad intermedia y dolor torácico estable aleatorizados a TC frente a coronariografía invasiva, y una menor tasa de complicaciones en el grupo con la técnica no invasiva. Estos estudios avalan a la TC como herramienta de primera línea para descartar la presencia de enfermedad coronaria, establecer el tratamiento de prevención en los pacientes con enfermedad coronaria no obstructiva, estratificar a los pacientes con enfermedad coronaria obstructiva y ser una alternativa a la coronariografía invasiva en un amplia variedad de pacientes.
En los pacientes con antecedente de enfermedad coronaria, la TC coronaria se puede emplear para valorar los puentes de derivación aortocoronaria, para comprobar la permeabilidad de stents coronarios en determinados casos (segmentos proximales y stents > 3,0 mm) y para el estudio de oclusiones coronarias totales crónicas previo a la revascularización coronaria percutánea. En el estudio BYPASS-CTCA15, en el que se aleatorizó a los pacientes con revascularización coronaria quirúrgica previa para realizarles una valoración anatómica basada en TC y coronariografía invasiva, o una coronariografía invasiva aislada, se objetivó una reducción de la duración del procedimiento y de la nefropatía por contraste en los pacientes con valoración no invasiva de la derivación aortocoronaria.
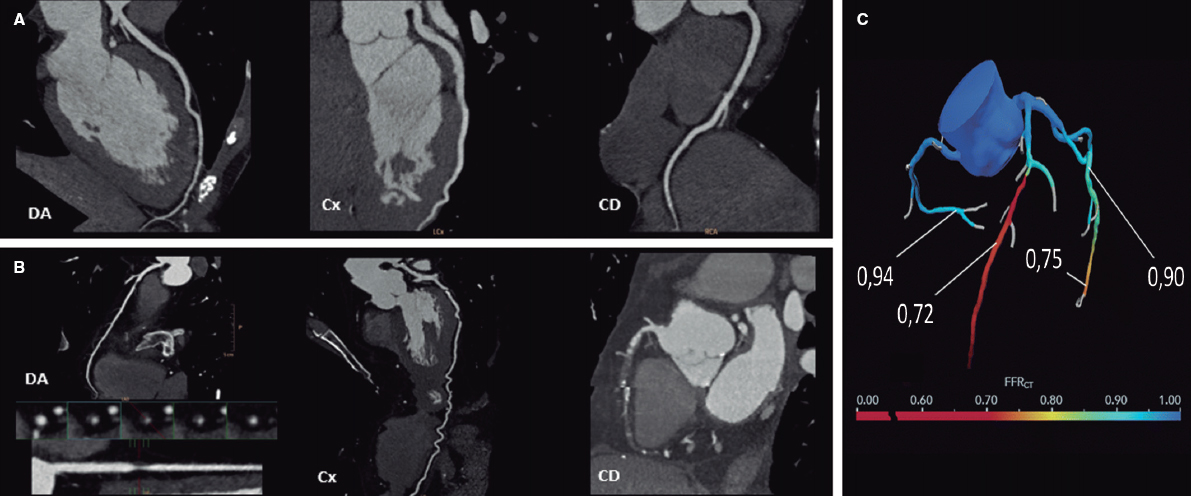
La TC coronaria debe ser procesada de acuerdo con las recomendaciones de la Society of Cardiovascular Computed Tomography16. Existen diferentes formatos de representación de imágenes (axial, reformateo multiplanar, proyección de máxima intensidad, reformateo multiplanar curvado o reconstrucción volumétrica), siendo su uso complementario. La lectura de un estudio de TC coronaria comienza por la valoración de su calidad, la identificación de potenciales artefactos y la visualización del origen, el trayecto y la dominancia coronaria. A continuación, los principios generales para la lectura son: a) revisión sistemática de cada segmento coronario desde múltiples planos y en sección transversal; b) estar alerta a posibles artefactos; c) evaluación de la morfología y la composición de las lesiones; y d) graduación de la gravedad de las lesiones utilizando una imagen de alta resolución en vistas longitudinales y transversales al lumen del vaso. Las arterias coronarias se segmentan, siguiendo la distribución modificada de la American Heart Association, en 18 segmentos coronarios. Las lesiones identificadas se enumerarán haciendo referencia al segmento, la naturaleza de la lesión (no calcificada, parcialmente calcificada o calcificada) y el grado de estenosis que genera (figura 1): normal (ausencia de lesión o estenosis), mínima (reducción del lumen < 25%), leve (25-49%), moderada (50-69%), grave (70-99%) u oclusión (> 99%).
Figura 1. La tomografía computarizada permite evaluar las arterias coronarias con el objetivo de excluir la presencia de enfermedad coronaria (A, arterias coronarias normales), o bien determinar la gravedad y la localización de la enfermedad coronaria obstructiva (B, lesión grave en la arteria descendente anterior [DA] proximal y oclusión crónica total en la arteria coronaria derecha [CD] media y distal). Mediante simulación computacional se puede evaluar la funcionalidad de las lesiones (C, reserva fraccional de flujo con TC [FFRCT], lesión grave en la DA media y en la arteria circunfleja [Cx] distal).
El análisis detallado de la TC permite establecer un plan de intervencionismo percutáneo, seleccionar el material a utilizar y potencialmente reducir el tiempo y la complejidad del procedimiento. Esto puede ser especialmente útil en la optimización del ángulo de fluoroscopia basado en el análisis de la TC en lesiones coronarias complejas o bifurcadas, así como en la realización de un sondaje coronario complejo en pacientes portadores de prótesis valvular aórtica percutánea17.
La complejidad global de la enfermedad coronaria se puede representar mediante índices como la puntuación de calcio o el número de segmentos con algún grado de enfermedad coronaria, pero también se dispone de varias escalas específicas. De estas, las más difundidas son CAD-RADSTM (Coronary Artery Disease Reporting and Data System)18 y su actualización CAD-RADSTM 2.019, en la que se añaden parámetros de perfusión y complejidad de placa. Existen otras más específicas, como la escala CT-SYNTAX20 con información anatómica de la TC y los datos clínicos de la escala SYNTAX, y las escalas Functional CT-SYNTAX21 y Functional FFRCT22, que añaden la información funcional del FFRCT. Estas escalas permiten refinar la decisión entre una estrategia de revascularización quirúrgica o percutánea, con buenos resultados iniciales23. Su validación pronóstica en diferentes escenarios, así como su implementación en la práctica asistencial, pueden suponer un cambio de paradigma en la realización de estudios diagnósticos invasivos en pacientes estables.
En los pacientes con oclusión coronaria total crónica, el análisis de la TC previo al procedimiento permite estimar la probabilidad de éxito de revascularización coronaria percutánea; para ello se han elaborado varias escalas pronósticas, como J-CTO24, CT-RECTOR25 y KCCT26 (tabla 3). Los parámetros analizados incluyen la extensión de la calcificación, la tortuosidad vascular, la morfología del «muñón» de la oclusión, la presencia de múltiples oclusiones y la longitud de las lesiones.
Tabla 3. Escalas de predicción para el éxito y la dificultad de revascularización de oclusiones totales crónicas por tomografía computarizada
| Puntuación | Variables (puntuación) | Clasificación |
|---|---|---|
| J-CTO | Extremidad cónica (0) frente a desafilada (1) | Fácil (0) Intermedio (1) Difícil (2) Muy difícil (≥ 3) |
| Ninguna calcificación (0) frente a alguna (1) | ||
| Angulación de la oclusión ≤ 45° (0) frente a > 45° (1) | ||
| Longitud de la oclusión < 20 mm (0) frente a ≥ 20 mm (1) | ||
| Sin intentos de revascularización previos fallidos (0) frente a con intentos previos (1) | ||
| CT-RECTOR | < 2 oclusiones (0) frente a ≥ 2 interrupciones completas (1) | Fácil (0) Intermedio (1) Difícil (2) Muy difícil (≥ 3) |
| Extremidad cónica (0) frente a desafilada (1) | ||
| < 50% de calcificación del perímetro del vaso en el eje corto (0) frente a ≥ 50% de calcificación en algún punto de la oclusión (1) | ||
| Angulación de la oclusión ≤ 45° (0) frente a > 45° (1) | ||
| Sin intentos de revascularización previos fallidos (0) frente a con intentos previos (1) | ||
| Tiempo de duración de la oclusión coronaria total crónica < 12 meses (0) frente a ≥ 12 meses (1) | ||
| KCCT | Extremidad cónica (0) frente a desafilada (1) | Fácil (0) Intermedio (1) Difícil (2) Muy difícil (3) Extremamente difícil (≥ 4) |
| Sin ramas colaterales adyacentes (0) frente a con ramas colaterales adyacentes (1) | ||
| Longitud de la oclusión < 15 mm (0) frente a ≥ 15 mm (1) | ||
| Angulación de la oclusión ≤ 45° (0) frente a > 45° (1) | ||
| Calcificación del vaso en el eje corto < 180° de perímetro o < 50% del área (0) frente a ≥ 180° de perímetro y ≥ 50% del área (1) frente a calcificación central completa de 360° de perímetro y 100% del área (2) | ||
| Sin intentos de revascularización previos fallidos (0) frente a con intentos previos (1) | ||
| Tiempo de duración de la oclusión coronaria total crónica < 12 meses (0) frente a ≥ 12 meses (1) |
APLICACIÓN AL INTERVENCIONISMO ESTRUCTURAL CARDIACO
Implante percutáneo de válvula aórtica
Una vez diagnosticada la estenosis aórtica grave por ecocardiografía, la TC constituye la prueba de elección para realizar una valoración integral del paciente candidato a implante percutáneo de válvula aórtica (TAVI)27. Con la TC se puede, en un único estudio, valorar los accesos vasculares, confirmar el grado de estenosis aórtica y la morfología valvular, medir el anillo aórtico, evaluar el riesgo de oclusión coronaria y determinar los ángulos óptimos de fluoroscopia, entre otros aspectos. Además, en un alto porcentaje de los casos permite realizar un cribado de enfermedad coronaria obstructiva proximal y una valoración de hallazgos extracardiacos28.
El estudio de planificación de un TAVI incluye: a) adquisición sin contraste para cuantificar el calcio valvular aórtico (opcional); b) adquisición con sincronización ECG en fase sistólica, al menos en la región del complejo valvular aórtico; y c) dependiendo de la velocidad y de la cobertura del equipo utilizado, una o varias adquisiciones para los accesos iliofemorales, sin ser imprescindible la sincronización ECG en esta región. El estudio requiere la inyección de medio de contraste (50-90 ml, con flujo a 3-5 ml/s, sujeto a variaciones según el equipo utilizado y la superficie corporal del paciente)28.
Los principales aspectos que deben detallarse en el informe de TC para realizar un TAVI se listan en la tabla 4.
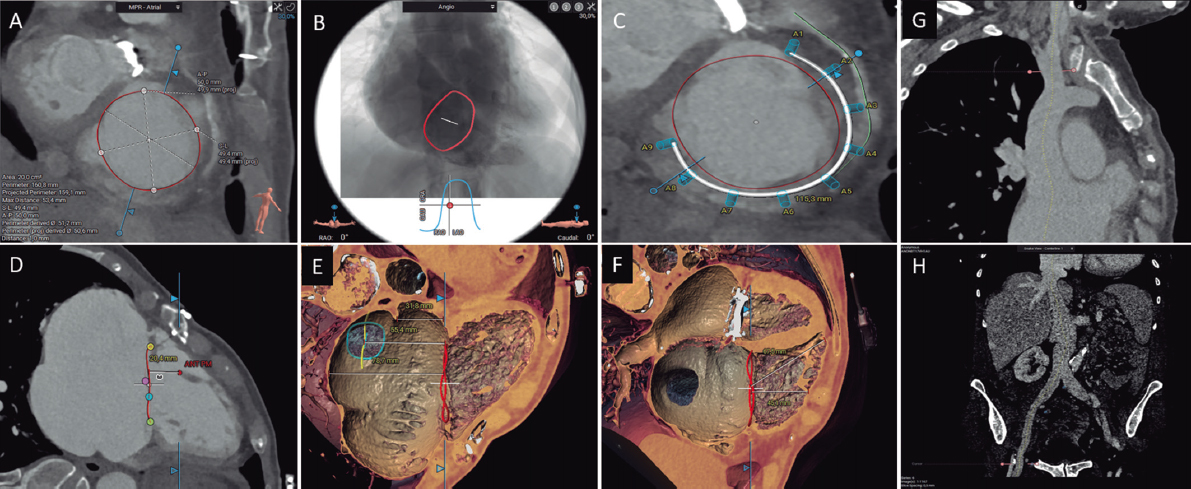
Tabla 4. Principales aspectos a describir en el informe de la tomografía computarizada previa a un implante percutáneo de válvula aórtica o un cierre percutáneo de la orejuela auricular izquierda
| Implante percutáneo de válvula aórtica | |
|---|---|
| Anillo aórtico | Medición en fase sistólica |
| Área y perímetro | |
| Diámetros mayor y menor | |
| Proyección de fluoroscopia óptima | |
| Calcio y válvula | Presencia, morfología y extensión del calcio |
| Morfología valvular | |
| Aorta y accesos | Altura del origen de las arterias coronarias |
| Diámetro luminal mínimo de cada segmento vascular | |
| Descripción de calcificaciones y patología vascular | |
| Otros | Anatomía coronaria |
| Hallazgos extracardiacos | |
| Cierre percutáneo de orejuela auricular izquierda | |
| Trombo | Despistaje de defecto repleción arterial/venoso |
| Morfología y zona de despliegue | Describir la morfología y la presencia de lóbulos proximales |
| Medir la zona de despliegue, diámetro mayor | |
| Medir la profundidad y la longitud de la orejuela | |
| Proyección de fluoroscopia óptima | |
| Otros | Anatomía del septo interauricular |
| Anatomía de las venas pulmonares | |
| Describir si hay derrame pericárdico | |
En la actualidad existen dos diseños generales de prótesis valvulares aórticas transcatéter: expandibles con balón y autoexpandibles. Los TAVI expandibles con balón utilizan la fuerza radial acompañada del inflado del balón para acomodar su diseño circular a la forma oval del anillo aórtico. En cambio, los autoexpandibles se expanden por sí mismos, gracias a la memoria del nitinol, hasta acomodarse sobre el anillo. Además de diferencias técnicas y de diseño, hay que tener en cuenta que los algoritmos de selección del tamaño del dispositivo no son intercambiables entre ellos. Las prótesis expandibles con balón se basan en el área del anillo aórtico, y las autoexpandibles en el perímetro.
La figura 2 resume toda la evaluación necesaria antes de realizar un TAVI.
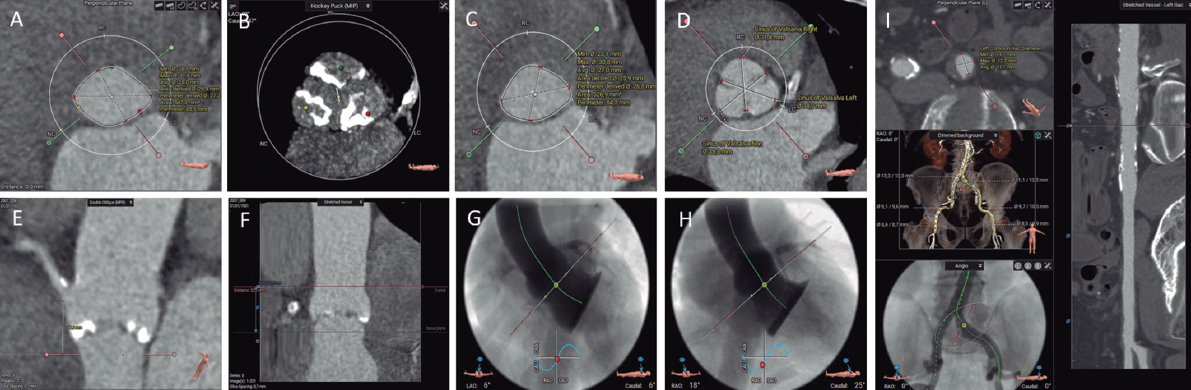
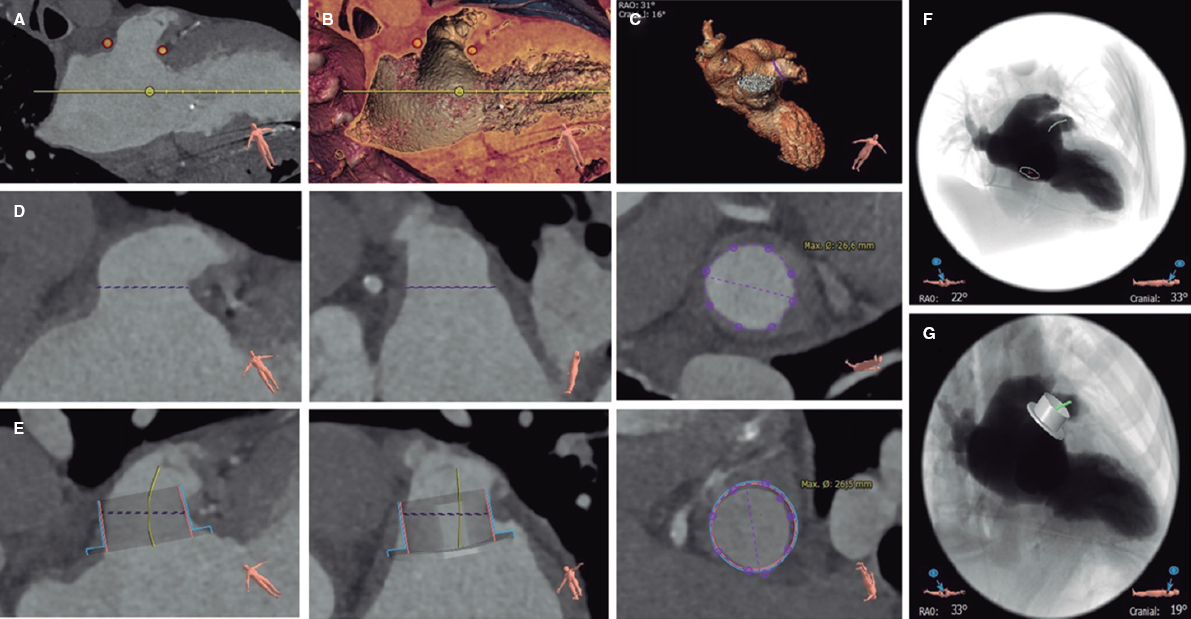
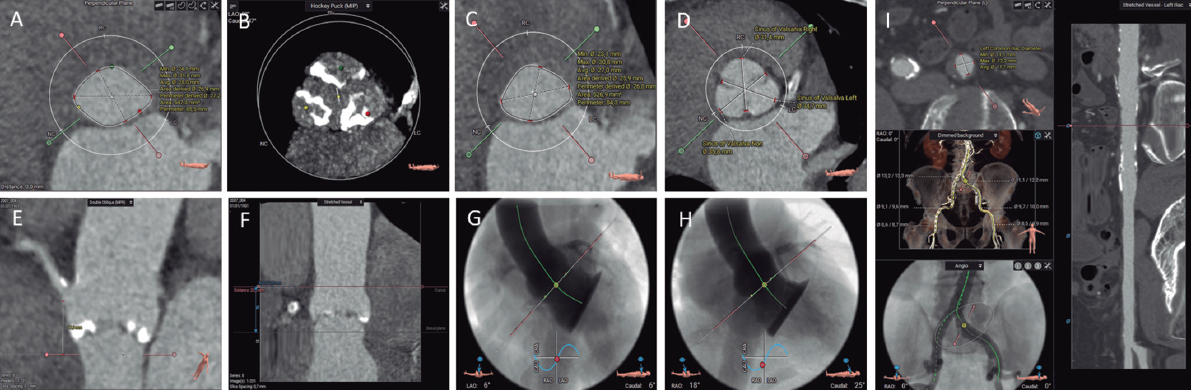
Figura 2. Evaluación previa al implante percutáneo de válvula aórtica con tomografía computarizada y software de análisis 3mensio CT: anillo aórtico (A), calcio valvular aórtico (B), tracto de salida del ventrículo izquierdo (C), diámetros de los senos de Valsalva (D), altura del origen de la coronaria derecha (E), altura de la unión sinotubular (F), proyección coplanar 3 cusp (G), proyección cusp-overlap (H) y accesos transfemorales (I).
Es preciso comprender y analizar la anatomía del complejo valvular aórtico, compuesto por el tracto de salida del ventrículo izquierdo (TSVI), los senos de Valsalva, los triángulos fibrosos entre los velos aórticos y los velos aórticos en sí mismos. Una medida fundamental es la valoración adecuada del plano del anillo aórtico, que se define como el plano virtual alineado con el punto de inserción más bajo de cada cúspide aórtica o nadires. Se determinan los diámetros mayor y menor, el área y el perímetro del anillo aórtico. De acuerdo con estas medidas, se seleccionará el tamaño del TAVI. El anillo aórtico modifica su tamaño y forma durante el ciclo cardiaco, siendo la mesosístole (30-35% R-R), en la mayoría de las ocasiones, el mejor momento para realizar la medición (mayor tamaño y menor elipticidad)29. Existen software específicamente diseñados para automatizar estas medidas y simular el implante, que facilitan el flujo de trabajo y reducen la variabilidad inter- e intraobservador.
La zona de despliegue de la prótesis (landing zone) comprende las cúspides aórticas, el anillo aórtico y el TSVI. La presencia de calcificación grave en el TSVI y en la válvula aórtica aumenta el riesgo de regurgitación periprotésica ulterior, mientras que la presencia de calcificaciones nodulares de gran tamaño puede conllevar un mayor riesgo de rotura del anillo aórtico, en especial con las prótesis expandibles con balón30. Se deben describir la localización y la extensión del calcio en la válvula aórtica y en los primeros 5-7 mm del TSVI, al ser esta la zona de sellado de la mayoría de los TAVI disponibles. La morfología y el grado de calcificación de la válvula aórtica deben ser sistemáticamente informados, prestando especial atención a la presencia de calcio con efecto masa (bulky) o que fusione parcialmente las comisuras aórticas28.
Hay que evaluar la altura perpendicular desde el plano del anillo aórtico hasta el origen de las arterias coronarias. Si bien no se han establecido unos valores de corte absolutos, una altura de origen de las arterias coronarias < 12 mm y unos senos de Valsalva < 30 mm conllevan un mayor riesgo de oclusión coronaria asociada al TAVI31.
En el informe deben constar también las proyecciones óptimas por TC para el despliegue de la prótesis. Su identificación reduce la dosis de radiación, el contraste y la duración del procedimiento29. Se reportarán la angulación para obtener una proyección coplanar (3 cusp), con alineamiento de las cúspides, y la angulación para obtener una proyección de solapamiento (cusp overlap), con las cúspides izquierda y derechas solapadas. Este plano despliega el TSVI y permite realizar un mejor control de la profundidad del implante durante la liberación de la prótesis, en especialmente con las autoexpandibles32.
En cuanto a los accesos vasculares, la TC permite su valoración en un único estudio, con excelente resolución y delimitación de la presencia y la extensión de las calcificaciones. Las complicaciones vasculares incrementan la morbimortalidad del procedimiento de TAVI. Los factores asociados con la aparición de complicaciones vasculares son la relación entre el diámetro mínimo vascular y el diámetro externo del introductor empleado, la presencia de calcificaciones moderadas o graves, y la tortuosidad vascular33. Se deben reflejar en el informe los diámetros luminales mínimos, la extensión, la distribución y la gravedad de la calcificación, y la presencia o no de patología vascular en todos los segmentos vasculares entre la válvula aórtica y las arterias femorales comunes izquierda y derecha a la altura de la cabeza del fémur28. En caso de que los accesos femorales no sean válidos, se valorarán accesos alternativos, siendo los más habituales el axilar/subclavio, el carotídeo, el transcava y el transapical.
Requiere especial atención la válvula aórtica bicúspide, dado que asocia una menor tasa de éxito del procedimiento y mayores tasas de regurgitación periprotésica, pero con similares resultados clínicos34. Se deben determinar el tipo de válvula bicúspide (fusión de senos, dos senos o forme fruste)35, la presencia de rafe, la distribución del calcio, el tamaño y la excentricidad del anillo, así como el origen y la altura del origen de las arterias coronarias. La medición del anillo aórtico puede resultar especialmente compleja en válvulas bicúspides de dos senos, precisando una metodología específica28. Se define el anillo aórtico como el plano virtual alineado con el punto de inserción más bajo de la cúspide más anterior/lateral. Se fija dicho punto como punto de partida con rotación antihoraria hasta el punto de inserción más bajo de la cúspide posterior/medial. La perpendicular a estos dos puntos centrada en el punto en que se alcanza la menor área transversal es el lugar indicado para trazar la medida (una angulación excesiva o insuficiente puede conducir a una sobre- o infraestimación del tamaño del anillo). Se determinan los diámetros mayor y menor, y el área y el perímetro del anillo aórtico. En relación con la selección del tamaño de la prótesis basándose en el tamaño del anillo aórtico, se han desarrollado algoritmos que también tienen en cuenta la longitud del rafe, el volumen de la calcificación y su distribución (CASPER, calcium algorithm sizing for bicuspid evaluation with raphe)36. Por otro lado, se ha propuesto un método (LIRA, level of implantation at the raphe) mediante la delineación del perímetro del orificio de apertura de la válvula bicúspide37, si bien no está claro que resulte superior a las mediciones convencionales38.
Una variante del TAVI es el implante valve-in-valve, en el cual se coloca una prótesis percutánea sobre una bioprótesis previa disfuncionante. La TC tiene un papel crucial para la selección del tamaño de la prótesis, en especial cuando se desconoce el modelo o el tamaño de la prótesis implantada, pero también para estratificar el riesgo de oclusión coronaria. Entre los parámetros principales para determinar el riesgo de obstrucción coronaria se encuentran el nivel que alcanzan los velos protésicos respecto del origen de las coronarias y de la unión sinotubular, el plano de riesgo sobre la unión sinotubular, la distancia del TAVI virtual a la unión sinotubular < 2 mm, la distancia del TAVI virtual al origen de las arterias coronarias < 4 mm, una prótesis previa supraanular o supracoronaria, una prótesis quirúrgica con velos implantados por fuera del anillo (tipo Mitroflow o Trifecta), un implante previo en posición alta y la presencia de una desviación comisural moderada o grave39,40.
Una vez realizado el TAVI, la TC permite valorar la posición y la geometría de la prótesis, así como el grosor y la movilidad de los velos protésicos. Tras el procedimiento de TAVI puede realizarse una TC en caso de disfunción o degeneración protésica identificada por ecocardiografía, sospecha de trombosis, endocarditis infecciosa o regurgitación periprotésica que requiera valoración anatómica. Se ha descrito el fenómeno de engrosamiento con hipoatenuación y reducción de la movilidad en los velos protésicos, que está asociado a trombosis subclínica y que se resuelve con un régimen de anticoagulación. Este hallazgo se ha asociado a una mayor tendencia (no significativa) a eventos embólicos, por lo que no existe un consenso ni indicación establecida de realizar TC de forma sistemática después del TAVI. Su aparición es más frecuente en valve-in-valve, prótesis expandibles con balón y prótesis de mayor tamaño o con expansión excéntrica por válvulas bicúspides, por ejemplo41.
Por último, comentar la posibilidad de utilizar la TC para resolver dudas diagnósticas en relación con la gravedad de la estenosis aórtica. Puede resultar particularmente útil la valoración del calcio valvular aórtico en pacientes con estenosis aórtica de bajo flujo y bajo gradiente con fracción de eyección preservada, siendo sugestivos de estenosis aórtica grave degenerativa unos valores ≥ 2.000 unidades Agatston en varones y ≥ 1.200 en mujeres, y por el contrario sugestivos de ausencia de estenosis grave degenerativa unos valores < 1.600 en varones y < 800 en mujeres8.
Cierre percutáneo de la orejuela izquierda
El cierre percutáneo de la orejuela izquierda (LAAO [left atrial appendage occlusion]) es una alternativa a la anticoagulación oral en pacientes en fibrilación auricular en quienes esta se encuentre contraindicada. La técnica tradicionalmente utilizada en la selección de pacientes es la ecocardiografía transesofágica (ETE), para descartar la presencia de trombo en la orejuela y poder realizar las mediciones para la selección del dispositivo. De forma consistente, se ha demostrado que las mediciones tridimensionales (ETE-3D, TC) tienen más precisión para seleccionar el tamaño del dispositivo que la ETE-2D. Por lo tanto, la TC es una técnica alternativa en la selección de pacientes, ya que permite ver si hay trombo y evaluar la anatomía y el tamaño de la orejuela, así como del septo interauricular42.
La TC para valoración del LAAO debe llevarse a cabo con sincronización ECG, idealmente en fase telesistólica (de mayor expansión de la orejuela izquierda), y se debe realizar una segunda adquisición en fase venosa, 60-90 segundos tras la administración del contraste, para evaluar la presencia o no de trombo en la orejuela izquierda43. Los principales aspectos que hay que detallar en un informe de TC para LAAO se listan en la tabla 4. Si la calidad lo permite, es recomendable realizar una valoración de la anatomía coronaria.
Tabla 5. Predictores de obstrucción del tracto de salida del ventrículo izquierdo en el implante percutáneo de válvula mitral
| Predictores de obstrucción | Límite de riesgo de obstrucción |
|---|---|
| Área del neo-TSVI | < 1,9 cm2 |
| Área de falda del neo-TSVI | < 1,5 cm2 |
| Dimensiones del velo mitral anterior | > 25 mm |
| Septo interventricular saliente | Grosor > 15 mm |
| Distancia del anillo mitral al septo interventricular | < 17,8 mm |
| Ángulo aortomitral agudo | < 110° |
| Ventrículo izquierdo pequeño | Diámetro telediastólico < 48 mm |
| Hipertrofia del ventrículo izquierdo | Masa miocárdica indexada > 105 g/m2 |
|
TSVI: tracto de salida del ventrículo izquierdo. |
|
La morfología de la orejuela izquierda es muy variable y compleja. Se han comercializado diferentes dispositivos para LAAO, de los cuales los más empleados son los dispositivos de lóbulo y de disco. La medición de la zona de despliegue se realiza mediante reformateo multiplanar partiendo de los planos de dos cámaras y coronal. En el caso de los dispositivos de lóbulo, la zona de despliegue se sitúa desde la arteria circunfleja a un punto situado a 10-20 mm por dentro del ligamento de Marshall. La profundidad viene determinada desde la zona de despliegue hasta el extremo más distal de la orejuela. Por su parte, con los dispositivos de disco, la zona de despliegue se sitúa a 10-12 mm por dentro del ostium de la orejuela, cubriendo en su extremo inferior el trayecto de la arteria circunfleja. La profundidad en este tipo de dispositivos se define desde el ostium hasta la pared opuesta de la orejuela43. Es importante valorar también la anatomía de las estructuras adyacentes, en especial del ligamento de Marshall para valorar la factibilidad de cubrirlo por completo con un dispositivo de disco y evitar la formación de trombos en el seguimiento44, así como las características anatómicas de la arteria pulmonar en relación con la orejuela izquierda45.
Existen software específicamente diseñados para automatizar estas medidas y simular el implante (figura 3). La utilización de un software de simulación del procedimiento mediante computación permite mejorar la selección de los dispositivos y el resultado del procedimiento46.
Figura 3. Planificación del cierre percutáneo de la orejuela izquierda con tomografía computarizada y software de análisis 3mensio CT: identificación del ostium de la orejuela izquierda (A y B), morfología de la orejuela izquierda (C), medida de la zona de despliegue (D, planos longitudinales y transversal), simulación del dispositivo oclusor (E, planos longitudinales y transversal), simulación de la proyección de fluoroscopia y posición de la punción transeptal (F), y simulación del dispositivo oclusor en la fluoroscopia (G).
Tras el LAAO se recomienda realizar una prueba de imagen a los 45-60 días del implante, para comprobar la estabilidad y el posicionamiento del dispositivo, en búsqueda de fugas residuales y para descartar la presencia de un trombo relacionado con el dispositivo. La ETE y la TC son las técnicas más habitualmente empleadas. La TC permite una mejor visualización de la posición y del despliegue del dispositivo, tiene igual capacidad de detección de trombos y presenta una mayor sensibilidad en la detección de paso residual de contraste. Este último puede ser debido a una malposición del dispositivo, a la presencia de una fuga peridispositivo o a la permeabilidad del tejido de recubrimiento47. La relevancia clínica de las fugas residuales, así como la importancia de su tamaño, no están del todo aclaradas48.
Reemplazo valvular mitral transcatéter
Dentro del intervencionismo valvular mitral transcatéter existen opciones de reparación y reemplazo. Las técnicas de reparación borde-a-borde están clínicamente consolidadas; en ellas, la selección de pacientes y la monitorización del procedimiento se realiza con ETE. En cambio, para las diferentes técnicas de reemplazo valvular la TC es una herramienta imprescindible. La TC debe adquirirse con sincronización ECG cubriendo y reconstruyendo todo el ciclo cardiaco tras la administración de medio de contraste con una adecuada opacificación de al menos las cavidades izquierdas, e idealmente también las derechas para mejorar la visualización de la anatomía y sus relaciones. Se han publicado recomendaciones detalladas para su adquisición y optimización49. La TC permite evaluar el tamaño y la forma del anillo mitral, seleccionar el tipo y el tamaño de la prótesis a implantar, simular virtualmente el implante y evaluar el neo-TSVI resultante del implante virtual, seleccionar los ángulos óptimos de fluoroscopia y planificar los accesos vasculares (transeptal o transapical)49 (figura 4). Las mediciones específicas para cada dispositivo están determinadas por el fabricante.
Figura 4. Diferentes pasos de la planificación del reemplazo valvular mitral transcatéter con tomografía computarizada y software de análisis 3mensio CT en dos pacientes con valve-in-MAC (A-C) y con válvula nativa (D-F): delimitación y medición del anillo mitral (A y D), evaluación de la distancia de la prótesis virtual al septo interventricular (D y E) y medición del neotracto de salida del ventrículo izquierdo (C y F).
Se ha descrito el reemplazo valvular mitral transcatéter (TMVR, transcatheter mitral valve replacement) sobre válvula nativa, sobre anuloplastia quirúrgica previa (valve-in-ring), sobre prótesis valvular biológica disfuncionante previa (valve-in-valve) y sobre anillo mitral nativo gravemente calcificado (valve-in-MAC)50. La TC resulta en especial útil para la selección del tamaño de la prótesis, así como para la valoración del riesgo embólico en procedimientos de valve-in-MAC mediante la valoración del espesor del calcio anular mitral, su extensión en el perímetro posterior o en los trígonos mitrales, y el daño de los velos mitrales51.
La principal complicación que debemos evitar durante la planificación del TMVR es la aparición de obstrucción del TSVI tras el TMVR. El neo-TSVI es la distancia/área existente entre el borde inferior del implante virtual y el septo interventricular. Los principales factores predictores de obstrucción en el neo-TSVI se detallan en la tabla 552. El área del neo-TSVI debe evaluarse en meso-telesístole (40-50% R-R; menor área del ciclo cardiaco), y el nivel de riesgo de obstrucción será mayor cuanto menor sea el área de neo-TSVI: < 170 mm2 muy alto riesgo, 170-190 mm2 alto riesgo, 190-220 mm2 riesgo aceptable y > 220 mm2 bajo riesgo. En casos seleccionados con alto riesgo de obstrucción se pueden aplicar técnicas de laceración del velo anterior mitral (LAMPOON) o ablación del septo interventricular (ablación septal con alcohol) para aumentar el área de neo-TSVI53.
Reemplazo valvular tricúspide transcatéter
Entre los procedimientos transcatéter sobre la válvula tricúspide se han descrito principalmente la reparación borde-a-borde, la anuloplastia y el reemplazo valvular ortotópico y heterotópico (prótesis valvulares en las venas cavas).
La adquisición es similar a la de la TC previa al TMVR (sincronización ECG cubriendo y reconstruyendo todo el ciclo cardiaco tras la administración de medio de contraste), pero optimizando el contraste de las cavidades cardiacas derechas, usando para ello protocolos de inyección trifásica (mezcla de contraste y solución salina a distintas concentraciones). Se han publicado recomendaciones detalladas para su adquisición y optimización49. El estudio mediante TC permite evaluar la geometría y el tamaño del anillo tricúspide a lo largo del ciclo cardiaco, la morfología y la movilidad de los velos tricuspídeos, la posición y la relación de la arteria coronaria derecha respecto al anillo tricúspide, el volumen y la fracción de eyección del ventrículo derecho, el ángulo óptimo de fluoroscopia y los accesos vasculares54 (figura 5).
Figura 5. Evaluación de la válvula tricúspide mediante tomografía computarizada y software de análisis 3mensio CT: medición del anillo tricúspide (A), simulación de la proyección de fluoroscopia (B), simulación de los anclajes de anuloplastia percutánea respecto a la arteria coronaria derecha (C), distancia del anillo tricúspide al músculo papilar anterior (D), distancia del anillo tricúspide al techo del seno coronario, la vena cava inferior y el techo de la aurícula derecha (E), distancia del anillo tricúspide a la pared libre y al ápex del ventrículo derecho (F), reconstrucción multiplanar curvada de la vena cava superior (G) y la vena cava inferior, y accesos femorales (H).
La TC también puede complementar la valoración de la posición y la relación de los electrodos de estimulación con los velos tricuspídeos en casos seleccionados de reparación borde-a-borde. Sin embargo, su utilidad principal radica en la selección de pacientes y la planificación de procedimientos de anuloplastia y reemplazo valvular, en los que es una técnica imprescindible. En relación con la anuloplastia, permite seleccionar el tamaño del dispositivo, descartar mediante simulación la interacción de los sistemas de anclaje y el trayecto de la arteria coronaria derecha, y evaluar el tenting de los velos tricuspídeos para valorar una posible regurgitación residual tras el procedimiento54. En el reemplazo heterotópico permite dimensionar las venas cavas superior e inferior a diferentes niveles, evaluar la anatomía y la localización de las venas suprahepáticas, y establecer el tamaño de la aurícula derecha; aspectos que determinarán el tipo y el tamaño del dispositivo a implantar55. Por último, en el reemplazo ortotópico los criterios de selección dependen en gran medida del dispositivo elegido; no obstante, en general, es necesario evaluar el tamaño del anillo, la distancia al músculo papilar anterior o a la pared libre del ventrículo derecho, la posición de confluencia de las venas cavas y los ángulos entre estas y el anillo tricúspide, así como la vía de acceso56.
Otros procedimientos
Cierre de fugas periprotésicas
La TC ha mostrado un buen rendimiento diagnóstico en la detección de fugas periprotésicas aórticas y mitrales, permitiendo definir el número, la localización, la forma y el tamaño de los defectos57. Es especialmente útil en la valoración de complicaciones de endocarditis infecciosa58, así como para la planificación y el soporte del cierre de fugas periprotésicas en posición aórtica59. Por otro lado, la simulación basada en la TC previa al procedimiento de reemplazo valvular aórtico o mitral permite predecir la aparición de fugas periprotésicas60.
Cardiopatías congénitas
La resonancia magnética es la técnica de elección en el diagnóstico, la evaluación y el seguimiento de las cardiopatías congénitas. Esto se debe a su capacidad para obtener cualquier geometría de exploración y realizar una valoración anatómica y funcional, una caracterización tisular y un análisis de flujos, así como a la ausencia de radiación en una población generalmente joven. La TC se reserva para pacientes y casos seleccionados.
La selección de los pacientes, del dispositivo y del tamaño de este previamente al intervencionismo en cardiopatías congénitas puede realizarse con TC o con resonancia magnética. La TC tiene mayor resolución espacial y permite delimitar con más precisión las áreas de calcificación y el adecuado dimensionado de la prótesis. Es imprescindible realizar una resonancia magnética o una TC antes de la intervención en el reemplazo valvular pulmonar transcatéter y en el tratamiento percutáneo de la coartación de aorta. Puede resultar también útil en casos de conducto arterial permeable y de fístulas complejas. Presenta un menor valor añadido en el cierre de defectos septales, tales como comunicación interauricular o interventricular61. Sin embargo, en la comunicación interventricular posinfarto de miocardio la TC puede resultar muy útil para dimensionar el defecto y valorar la morfología, la extensión y los bordes, ya que suelen ser defectos anfractuosos y complejos difíciles de evaluar correctamente por ecocardiografía62.
Fusión de imagen de TC y fluoroscopia durante el intervencionismo
La información anatómica y la planificación realizada antes del procedimiento pueden integrarse en la monitorización de este. Para ello, utilizando un software y una estación de trabajo específicas, se realiza una segmentación de las estructuras cardiacas de manera semiautomática y se corregistra con la anatomía del paciente en la mesa de intervención desde dos proyecciones de fluoroscopia. Tras el corregistro se puede integrar toda la información de la TC en el procedimiento, permitiendo, entre otras opciones, ampliar el rango de visión, mejorar la compresión de las relaciones anatómicas, posicionar marcadores o trayectorias, y planificar angulaciones de fluoroscopia óptimas63, si bien son imágenes estáticas que no tienen sincronización ECG ni respiratoria (figura 6).
Figura 6. Ejemplos de fusión de imágenes de tomografía computarizada y fluoroscopia en diferentes procedimientos empleando Heart Navigator (Philips): reemplazo valvular aórtico percutáneo (A), cierre de orejuela izquierda (B), reemplazo valvular mitral percutáneo valve-in-MAC (C), implante valvular en la vena cava superior (D) e inferior (E), y cierre de fuga periprotésica mitral (F).
La fusión de TC y fluoroscopia ha demostrado reducir la duración del procedimiento, el uso de contraste y la radiación en el TAVI y el LAAO, así como disminuir la necesidad de cambio de tamaño de dispositivo intraprocedimiento en el LAAO. Se han descrito su uso y utilidad en multitud de procedimientos, y ha mostrado ser más útil en las intervenciones más complejas (TMVR, reemplazo valvular tricúspide transcatéter, TAVI transcava, cierre de fugas periprotésicas, etc.)64.
CONCLUSIONES
La TC es una técnica no invasiva, de elevada resolución espacial, con excelente definición del calcio y del espacio intravascular con el empleo de medios de contraste, que brinda la posibilidad de realizar tanto mediciones como simulaciones virtuales de intervencionismo coronario y estructural. Se ha establecido como la técnica de referencia en la selección de pacientes y la planificación de procedimientos de intervencionismo transcatéter coronario y estructural en diferentes escenarios (TAVI, LAAO, TMVR y reemplazo valvular tricúspide transcatéter).
FINANCIACIÓN
El presente trabajo no ha recibido ninguna financiación.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado inteligencia artificial para la elaboración del presente trabajo.
CONTRIBUCIÓN DE LOS AUTORES
El borrador del manuscrito fue elaborado por M. Barreiro-Pérez e I. Cruz-González, y revisado en profundidad y aprobado por todos los autores. Las correcciones y la respuesta a los revisores, y los cambios editoriales, los realizaron Berenice Caneiro Queija y M. Barreiro-Pérez.
CONFLICTO DE INTERESES
M. Barreiro-Pérez ha recibido pagos por presentaciones o actividades educativas de Abbott Vascular, Edwards Lifesciences, Venus MedTech, Lifetech y Cardiovalve. I. Cruz-González ha recibido pagos por presentaciones o actividades educativas de Abbott Vascular y Boston Scientific. R. Estévez Loureiro ha recibido pagos por presentaciones o actividades educativas de Abbott Vascular, Boston Scientific, Edwards Lifesciences y Venus MedTech.
BIBLIOGRAFÍA
1. Abbara S, Blanke P, Maroules CD, et al. SCCT guidelines for the performance and acquisition of coronary computed tomographic angiography:A report of the society of Cardiovascular Computed Tomography Guidelines Committee:Endorsed by the North American Society for Cardiovascular Imaging (NASCI). J Cardiovasc Comput Tomogr. 2016;10:435-449.
2. Knuuti J, Ballo H, Juarez-Orozco LE, et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina:a meta-analysis focused on post-test disease probability. Eur Heart J. 2018;39:3322-3330.
3. Douglas PS, Hoffmann U, Patel MR, et al. Outcomes of anatomical versus functional testing for coronary artery disease. N Engl J Med. 2015;372:1291-1300.
4. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
5. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44:3720-3826.
6. Delgado V, Ajmone Marsan N, De Waha S, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023;44:3948-4042.
7. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42:3599-3726.
8. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561-632.
9. Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J. 2023;44:3503-3626.
10. Halvorsen S, Mehilli J, Cassese S, et al. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J. 2022;43:3826-3924.
11. Pelliccia A, Sharma S, Gati S, et al. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J. 2021;42:17-96.
12. Pontone G, Baggiano A, Andreini D, et al. Stress Computed Tomography Perfusion Versus Fractional Flow Reserve CT Derived in Suspected Coronary Artery Disease:The PERFECTION Study. JACC Cardiovasc Imaging. 2019;12(8 Pt 1):1487-1497.
13. Newby DE, Adamson PD, Berry C, et al. Coronary CT Angiography and 5-Year Risk of Myocardial Infarction. N Engl J Med. 2018;379:924-933.
14. Maurovich-Horvat P, Bosserdt M, Kofoed KF, et al. CT or Invasive Coronary Angiography in Stable Chest Pain. N Engl J Med. 2022;386:1591-1602.
15. Jones DA, Beirne AM, Kelham M, et al. Computed Tomography Cardiac Angiography Before Invasive Coronary Angiography in Patients With Previous Bypass Surgery:The BYPASS-CTCA Trial. Circulation. 2023;148:1371-1380.
16. Leipsic J, Abbara S, Achenbach S, et al. SCCT guidelines for the interpretation and reporting of coronary CT angiography:A report of the Society of Cardiovascular Computed Tomography Guidelines Committee. J Cardiovasc Comput Tomogr. 2014;8:342-358.
17. Andreini D, Collet C, Leipsic J, et al. Pre-procedural planning of coronary revascularization by cardiac computed tomography:An expert consensus document of the Society of Cardiovascular Computed Tomography. J Cardiovasc Comput Tomogr. 2022;16:558-572.
18. Cury RC, Abbara S, Achenbach S, et al. CAD-RADSTM Coronary Artery Disease –Reporting and Data System. An expert consensus document of the Society of Cardiovascular Computed Tomography (SCCT), the American College of Radiology (ACR) and the North American Society for Cardiovascular Imaging (NASCI). Endorsed by the American College of Cardiology. J Cardiovasc Comput Tomogr. 2016;10:269-281.
19. Cury RC, Leipsic J, Abbara S, et al. CAD-RADSTM 2.0 –2022 Coronary Artery Disease-Reporting and Data System:An Expert Consensus Document of the Society of Cardiovascular Computed Tomography (SCCT), the American College of Cardiology (ACC), the American College of Radiology (ACR), and the North America Society of Cardiovascular Imaging (NASCI). J Cardiovasc Comput Tomogr. 2022;16:536-557.
20. Papadopoulou SL, Girasis C, Dharampal A, et al. CT-SYNTAX score:a feasibility and reproducibility study. JACC Cardiovasc Imaging. 2013;6:413-415.
21. Collet C, Miyazaki Y, Ryan N, et al. Fractional Flow Reserve Derived From Computed Tomographic Angiography in Patients With Multivessel CAD. J Am Coll Cardiol. 2018;71:2756-2769.
22. Gabara L, Hinton J, Kira M, et al. Derivation and validation of a novel functional FFRCT score incorporating the burden of coronary stenosis severity and flow impairment to predict clinical events. J Cardiovasc Comput Tomogr. 2024;18:33-42.
23. Kageyama S, Serruys PW, Kotoku N, et al. Coronary computed tomography angiography-based SYNTAX score for comprehensive assessment of advanced coronary artery disease. J Cardiovasc Comput Tomogr. 2024;18:120-136.
24. Morino Y, Abe M, Morimoto T, et al. Predicting successful guidewire crossing through chronic total occlusion of native coronary lesions within 30 minutes:the J-CTO (Multicenter CTO Registry in Japan) score as a difficulty grading and time assessment tool. JACC Cardiovasc Interv. 2011;4:213-221.
25. Opolski MP, Achenbach S, Schuhbäck A, et al. Coronary computed tomographic prediction rule for time-efficient guidewire crossing through chronic total occlusion:insights from the CT-RECTOR multicenter registry (Computed Tomography Registry of Chronic Total Occlusion Revascularization). JACC Cardiovasc Interv. 2015;8:257-267.
26. Yu CW, Lee HJ, Suh J, et al. Coronary Computed Tomography Angiography Predicts Guidewire Crossing and Success of Percutaneous Intervention for Chronic Total Occlusion:Korean Multicenter CTO CT Registry Score as a Tool for Assessing Difficulty in Chronic Total Occlusion Percutaneous Coronary Intervention. Circ Cardiovasc Imaging. 2017;10:e005800.
27. Otto CM, Kumbhani DJ, Alexander KP, et al. 2017 ACC Expert Consensus Decision Pathway for Transcatheter Aortic Valve Replacement in the Management of Adults With Aortic Stenosis:A Report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2017;69:1313-1346.
28. Blanke P, Weir-McCall JR, Achenbach S, et al. Computed Tomography Imaging in the Context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR):An Expert Consensus Document of the Society of Cardiovascular Computed Tomography. JACC Cardiovasc Imaging. 2019;12:1-24.
29. Francone M, Budde RPJ, Bremerich J, et al. CT and MR imaging prior to transcatheter aortic valve implantation:standardisation of scanning protocols, measurements and reporting —a consensus document by the European Society of Cardiovascular Radiology (ESCR). Eur Radiol. 2020;30:2627-2650.
30. Hahn RT, Kodali S, Tuzcu EM, et al. Echocardiographic imaging of procedural complications during balloon-expandable transcatheter aortic valve replacement. JACC Cardiovasc Imaging. 2015;8:288-318.
31. Ribeiro HB, Webb JG, Makkar RR, et al. Predictive factors, management, and clinical outcomes of coronary obstruction following transcatheter aortic valve implantation:insights from a large multicenter registry. J Am Coll Cardiol. 2013;62:1552-1562.
32. Kim WK, Toggweiler S, Renker M, et al. Comparison of 3-Cusp Coplanar and 2-Cusp Overlap Views for the Implantation of a Self-Expanding Transcatheter Heart Valve. JACC Cardiovasc Interv. 2023;16:1422-1424.
33. Toggweiler S, Gurvitch R, Leipsic J, et al. Percutaneous aortic valve replacement:vascular outcomes with a fully percutaneous procedure. J Am Coll Cardiol. 2012;59:113-118.
34. Jilaihawi H, Chen M, Webb J, et al. A Bicuspid Aortic Valve Imaging Classification for the TAVR Era. JACC Cardiovasc Imaging. 2016;9:1145-1158.
35. Michelena HI, Della Corte A, Evangelista A, et al. International consensus statement on nomenclature and classification of the congenital bicuspid aortic valve and its aortopathy, for clinical, surgical, interventional and research purposes. Eur J Cardiothorac Surg. 2021;60:448-476.
36. Petronio AS, Angelillis M, De Backer O, et al. Bicuspid aortic valve sizing for transcatheter aortic valve implantation:Development and validation of an algorithm based on multi-slice computed tomography. J Cardiovasc Comput Tomogr. 2020;14:452-461.
37. Iannopollo G, Romano V, Buzzatti N, et al. Supra-annular sizing of transcatheter aortic valve prostheses in raphe-type bicuspid aortic valve disease:the LIRA method. Int J Cardiol. 2020;317:144-151.
38. Weir-McCall JR, Attinger-Toller A, Blanke P, et al. Annular versus supra-annular sizing for transcatheter aortic valve replacement in bicuspid aortic valve disease. J Cardiovasc Comput Tomogr. 2020;14:407-413.
39. Tang GHL, Komatsu I, Tzemach L, et al. Risk of coronary obstruction and the need to perform BASILICA:the VIVID classification. EuroIntervention. 2020;16:E757-E759.
40. Tarantini G, Sathananthan J, Fabris T, et al. Transcatheter Aortic Valve Replacement in Failed Transcatheter Bioprosthetic Valves. JACC Cardiovasc Interv. 2022;15:1777-1793.
41. Jilaihawi H, Asch FM, Manasse E, et al. Systematic CT Methodology for the Evaluation of Subclinical Leaflet Thrombosis. JACC Cardiovasc Imaging. 2017;10:461-470.
42. Eng MH, Wang DD, Greenbaum AB, et al. Prospective, randomized comparison of 3-dimensional computed tomography guidance versus TEE data for left atrial appendage occlusion (PRO3DLAAO). Catheter Cardiovasc Interv. 2018;92:401-407.
43. Korsholm K, Berti S, Iriart X, et al. Expert Recommendations on Cardiac Computed Tomography for Planning Transcatheter Left Atrial Appendage Occlusion. JACC Cardiovasc Interv. 2020;13:277-292.
44. Cepas-Guillén P, Flores-Umanzor E, Leduc N, et al. Impact of Device Implant Depth After Left Atrial Appendage Occlusion. JACC Cardiovasc Interv. 2023;16:2139-2149.
45. Halkin A, Cohen C, Rosso R, et al. Left atrial appendage and pulmonary artery anatomic relationship by cardiac-gated computed tomography:Implications for late pulmonary artery perforation by left atrial appendage closure devices. Heart Rhythm. 2016;13:2064-2069.
46. De Backer O, Iriart X, Kefer J, et al. Impact of Computational Modeling on Transcatheter Left Atrial Appendage Closure Efficiency and Outcomes. JACC Cardiovasc Interv. 2023;16:655-666.
47. Agudelo V, Millán X, Li CH, et al. Prevalence, mechanisms and impact of residual patency and device-related thrombosis following left atrial appendage occlusion:a computed tomography analysis. EuroIntervention. 2021;17:E944-E952.
48. Saw J, Fahmy P, DeJong P, et al. Cardiac CT angiography for device surveillance after endovascular left atrial appendage closure. Eur Heart J Cardiovasc Imaging. 2015;16:1198-1206.
49. Pulerwitz TC, Khalique OK, Leb J, et al. Optimizing Cardiac CT Protocols for Comprehensive Acquisition Prior to Percutaneous MV and TV Repair/Replacement. JACC Cardiovasc Imaging. 2020;13:836-850.
50. Babaliaros VC, Lederman RJ, Gleason PT, et al. The Art of SAPIEN 3 Transcatheter Mitral Valve Replacement in Valve-in-Ring and Valve-in-Mitral-Annular-Calcification Procedures. JACC Cardiovasc Interv. 2021;14:2195-2214.
51. Guerrero M, Wang DD, Pursnani A, et al. A Cardiac Computed Tomography-Based Score to Categorize Mitral Annular Calcification Severity and Predict Valve Embolization. JACC Cardiovasc Imaging. 2020;13:1945-1957.
52. Yoon SH, Bleiziffer S, Latib A, et al. Predictors of Left Ventricular Outflow Tract Obstruction After Transcatheter Mitral Valve Replacement. JACC Cardiovasc Interv. 2019;12:182-193.
53. Barreiro-Perez M, Caneiro-Queija B, Puga L, et al. Imaging in Transcatheter Mitral Valve Replacement:State-of-Art Review. J Clin Med. 2021;10:5973.
54. Hell MM, Emrich T, Kreidel F, et al. Computed tomography imaging needs for novel transcatheter tricuspid valve repair and replacement therapies. Eur Heart J Cardiovasc Imaging. 2021;22:601-610.
55. Lopes BBC, Hashimoto G, Bapat VN, Sorajja P, Scherer MD, Cavalcante JL. Cardiac Computed Tomography and Magnetic Resonance Imaging of the Tricuspid Valve:Preprocedural Planning and Postprocedural Follow-up. Interv Cardiol Clin. 2022;11:27-40.
56. Barreiro-Pérez M, González-Ferreiro R, Caneiro-Queija B, et al. Transcatheter Tricuspid Valve Replacement:Illustrative Case Reports and Review of State-of-Art. J Clin Med. 2023;12:1371.
57. Koo HJ, Lee JY, Kim GH, et al. Paravalvular leakage in patients with prosthetic heart valves:cardiac computed tomography findings and clinical features. Eur Heart J Cardiovasc Imaging. 2018;19:1419-1427.
58. Entrikin DW, Gupta P, Kon ND, Carr JJ. Imaging of infective endocarditis with cardiac CT angiography. J Cardiovasc Comput Tomogr. 2012;6:399-405.
59. Lesser JR, Han BK, Newell M, Schwartz RS, Pedersen W, Sorajja P. Use of cardiac CT angiography to assist in the diagnosis and treatment of aortic prosthetic paravalvular leak:a practical guide. J Cardiovasc Comput Tomogr. 2015;9:159-164.
60. Morris MF, Pena A, Kalya A, et al. Predicting paravalvular leak after transcatheter mitral valve replacement using commercially available software modeling. J Cardiovasc Comput Tomogr. 2020;14:495-499.
61. Siripornpitak S, Goo HW. CT and MRI for Repaired Complex Adult Congenital Heart Diseases. Korean J Radiol. 2021;22:308-323.
62. Arzamendi D, Li CH, Serra A. Cardiac Computed Tomography-guided Closure of Ventricular Septal Defect Secondary to Myocardial Infarction. Rev Esp Cardiol. 2015;68:626.
63. Hussain MA, Nabi F. Complex Structural Interventions:The Role of Computed Tomography, Fluoroscopy, and Fusion Imaging. Methodist Debakey Cardiovasc J. 2017;13:98-105.
64. Barreiro-Perez M, Cruz-Gonzalez I, Moreno-Samos JC, Barahona MF, Sanchez PL. Cardiovascular Structural Interventions —Echo/Computed Tomography-Fluoroscopy Fusion Imaging Atlas. Circ J. 2018;82:2206-2207.
* Autor para correspondencia.
Correo electrónico: manuelbarreiroperez@gmail.com (M. Barreiro-Pérez).
@manuelbarreirop; @icruzgonzalez; @RodrigoEstvez1; @CHPedroLi; @che_parada; @lvaroRodriperez; @b_caneiro
RESUMEN
Un número importante de aquellos pacientes en quienes se realiza coronariografía por angina o isquemia presentan en pruebas no invasivas arterias coronarias sin lesiones o con estenosis no significativas. Muchos de estos pacientes tienen isquemia miocárdica de causa no obstructiva (INOCA/ANOCA), una condición con importancia pronóstica que afecta de manera considerable la calidad de vida. La ausencia de un diagnóstico que haga posible un tratamiento médico efectivo acarrea la repetición de pruebas diagnósticas y un mayor uso de recursos sociosanitarios. Es necesaria una estrategia diagnóstica adecuada para poder realizar un tratamiento personalizado, que mejore los síntomas y la calidad de vida. En este documento de la SEC-Asociación de Cardiología Clínica, SEC-Asociación de Cardiología Intervencionista, SEC-Asociación de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares, y SEC-Asociación de Imagen Cardiaca, se establecen unos algoritmos sencillos y prácticos con el objetivo de facilitar el diagnóstico precoz y el tratamiento más adecuado de los pacientes con ANOCA.
Palabras clave: ANOCA. INOCA. Disfunción microvascular. Angina vasoespástica.
ABSTRACT
A substantial number of patients undergoing coronary angiography for angina or ischemia in noninvasive tests have coronary arteries without lesions or with nonsignificant stenosis. Many of these patients have nonobstructive myocardial ischemia (INOCA/ANOCA), which is an entity with prognostic importance that significantly affects patients’ quality of life. The absence of a proper diagnosis leads to inappropriate medical treatment, repeat diagnostic tests, and greater use of social and health resources. An adequate diagnostic strategy is required for individualized treatment that improves symptoms and quality of life. In this document from the SEC-Clinical Cardiology Association, SEC-Interventional Cardiology Association, SEC-Ischemic Heart Disease and Acute Cardiac Care Association, and SEC-Cardiovascular Imaging Association of the Spanish Society of Cardiology, we provide simple and practical algorithms, with the aim of facilitating the early diagnosis and most appropriate treatment for patients with ANOCA.
Keywords: ANOCA. INOCA. Microvascular dysfunction. Vasospastic angina.
Abreviaturas ANOCA: angina con arterias coronarias sin lesiones obstructivas (angina with no obstructive coronary arteries). IMR: índice de resistencias de la microcirculación. INOCA: isquemia con arterias coronarias sin lesiones obstructivas (ischemia with no obstructive coronary artery disease). PET: tomografía por emisión de positrones (positron emission tomography). RFC: reserva de flujo coronario. SEC: Sociedad Española de Cardiología.
INTRODUCCIÓN
La angina de pecho afecta a más de 100 millones de personas en todo el mundo1-5. Se estima que en España, de acuerdo con el estudio OFRECE, la prevalencia de angina es del 2,6%, lo que implica que hay más de 270.000 personas con esta afección4. De los pacientes estables remitidos a coronariografía, ya sea por angina o por test positivo de detección de isquemia, un número significativo no tienen enfermedad obstructiva de las arterias coronarias1. Muchos de estos pacientes presentan angina (ANOCA, angina with no obstructive coronary arteries) o isquemia (INOCA, ischemia with non-obstructive coronary artery disease) de causa no obstructiva. Estas representan dos aspectos de la misma enfermedad, por lo que las recomendaciones del documento son extensibles a ambas.
Es más frecuente en las mujeres (50-70%) que en los varones (30-50%), si bien la prevalencia real se desconoce1-5. En estos pacientes, la angina o la isquemia se produce por una disfunción vascular coronaria, causada por trastornos vasomotores del vaso epicárdico o de las arteriolas, o por disfunción coronaria microvascular6-8.
Cabe destacar que, en la actualidad, se encuentra masivamente infradiagnosticada y, por ende, con miles de pacientes que sufren sus consecuencias sin un tratamiento que podría ser efectivo. Las causas de esta falta de diagnóstico y de tratamiento son varias. En primer lugar está la inercia asociada al paradigma que ha dominado durante décadas la aproximación diagnóstica de los pacientes con angina, centrado en identificar estenosis coronarias y no trastornos vasomotores o microcirculatorios coronarios. Además, de manera bastante generalizada, se ha considerado al paciente con angina sin estenosis coronarias como un paciente de bajo riesgo y con una escasa respuesta al tratamiento antianginoso convencional9. En segundo lugar, y en parte relacionado con lo anterior, está el hecho de que muchas técnicas no invasivas se basan en la identificación de isquemia regional característica de las estenosis coronarias (déficits de contractilidad o captación de un isótopo durante el esfuerzo o estrés), por lo que presentan unas bajas sensibilidad y especificidad para detectar la isquemia de origen no obstructivo. En tercer lugar, la mayor parte de los cardiólogos no han tenido acceso a técnicas invasivas que proporcionan evidencia objetiva de disfunción vascular en sus pacientes. Dichas técnicas intracoronarias se han considerado una parcela del cardiólogo intervencionista que, en la mayoría de los casos, no desempeña un papel clave en el tratamiento y el seguimiento del paciente con INOCA. Estas barreras impiden que la valiosa información proporcionada por las técnicas invasivas no sea utilizada en el abordaje clínico de estos pacientes. Finalmente, los pacientes con ANOCA/INOCA a menudo presentan patologías y afecciones extracardiológicas que requieren un enfoque multidisciplinario y dificultan el seguimiento por cardiólogos especialistas.
En el año 2019, las guías de la Sociedad Europea de Cardiología para el diagnóstico y el tratamiento del paciente con síndrome coronario crónico supusieron un importante avance en el reconocimiento de la angina de origen microvascular y del valor de las técnicas diagnósticas específicas. Así, en la aproximación diagnóstica de los pacientes con sospecha de angina coronaria microvascular, las guías señalan que se debe considerar la medición de la reserva de flujo coronario (RFC) y de la resistencia microcirculatoria mediante una guía de presión en pacientes con síntomas persistentes, pero con coronarias angiográficamente normales o con estenosis moderadas y reserva fraccional de flujo normal (recomendación IIaB). Incluso el resto de las recomendaciones, como la administración intracoronaria de acetilcolina durante la coronariografía o el empleo de Doppler transtorácico de la descendente anterior, la resonancia magnética cardiaca (cardio-RM) o la tomografía por emisión de positrones (PET) para la evaluación no invasiva de la RFC, tienen un nivel de recomendación menor (IIbB). En los pacientes con sospecha de angina vasoespástica, las guías señalan que se debe considerar la realización de pruebas de provocación intracoronarias para la identificación del espasmo coronario (recomendación IIaB)10.
Sin embargo, en los últimos años se han realizado numerosos estudios dirigidos al paciente con ANOCA que evalúan la eficacia de nuevas pruebas diagnósticas invasivas para su diagnóstico específico, y también ensayos aleatorizados que valoran la mejora sintomática cuando se realiza un tratamiento personalizado. Estos estudios apuntan de forma consistente a que el abordaje personalizado y multidisciplinario de estos pacientes ayuda a la mejora de los síntomas, reduce las visitas médicas, disminuye el número de tratamientos administrados y reduce el coste económico generado por este síndrome11-13.
OBJETIVOS DEL DOCUMENTO
Promovido por la Asociación de Cardiología Clínica, la Asociación de Cardiología Intervencionista, la Asociación de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares y la Asociación de Imagen Cardiaca de la Sociedad Española de Cardiología (SEC), pretende:
- Revisar las distintas causas del síndrome ANOCA y los métodos actuales para realizar su diagnóstico y su tratamiento personalizado.
- Proponer un algoritmo de diagnóstico y de tratamiento para el abordaje de estos pacientes acorde con las guías de práctica clínica para el síndrome coronario crónico de la Sociedad Europea de Cardiología y con las evidencias más recientes.
- Estimular a los distintos agentes gestores de salud a crear circuitos multidisciplinarios para el diagnóstico, el tratamiento y el seguimiento dirigido de estos pacientes.
La elaboración de este documento se ha basado en la interpretación de las últimas evidencias científicas, pero con un enfoque eminentemente práctico, para que las recomendaciones puedan aplicarse de una manera efectiva en nuestro medio. Cada asociación de la SEC aportó las evidencias científicas y su visión del área correspondiente, para luego, mediante consenso, elaborar un único documento con recomendaciones prácticas. La elección de los miembros para elaborar el documento la realizaron los presidentes de las asociaciones implicadas, escogiéndolos en función de su experiencia clínica y sus conocimientos sobre la materia.
IMPORTANCIA DE LA ANOCA EN LA PRÁCTICA CLÍNICA
Si bien desde hace décadas se admite que los pacientes con angina sin lesiones coronarias podrían corresponder a una condición nosológica propia (inicialmente denominada síndrome X), en la práctica clínica se les ha prestado poca atención debido sobre todo a la extendida noción de que tienen un buen pronóstico14. No obstante, numerosos estudios en los que el diagnóstico se realizó, a diferencia del síndrome X, basándose en evidencia objetiva de disfunción vascular coronaria, mostraron de forma consistente que la isquemia de origen no obstructivo tiene una importante repercusión pronóstica. El riesgo de eventos coronarios adversos en estos pacientes viene determinado en gran medida por factores como la carga de placa, la demostración de isquemia miocárdica, la disfunción microvascular y la presencia de vasoespasmo o de disfunción endotelial coronaria. Así, en un estudio realizado en 917 mujeres con signos o síntomas de isquemia miocárdica, la variable combinada de infarto de miocardio o muerte de causa cardiovascular ocurrió en el 6,5% de las mujeres sin enfermedad arterial coronaria, en el 12,8% de las que tenían ateromatosis no obstructiva y en el 25,9% de aquellas con enfermedad arterial coronaria obstructiva, tras 10 años de seguimiento (figura 1)15. En un metanálisis de 54 estudios, con 35.039 pacientes, se confirmó el aumento del riesgo de infarto de miocardio no mortal y de muerte, con una incidencia, tras 5 años de seguimiento, de 0,98/100 personas-año en los pacientes con ANOCA, siendo mayor el riesgo en los sujetos con isquemia probada (frente a aquellos sin isquemia), así como en los pacientes con enfermedad arterial coronaria no obstructiva (frente a aquellos con coronarias normales)16.
Figura 1. Riesgo de infarto de miocardio o de muerte de causa cardiovascular tras 10 años de seguimiento en una cohorte de mujeres15. EAC: enfermedad arterial coronaria; ANOCA/INOCA: angina/isquemia con arterias coronarias no obstructivas.
En la misma línea, aun en presencia de unas arterias coronarias angiográficamente normales, la disfunción microvascular determinada por una RFC disminuida ha demostrado ser un potente determinante del riesgo de muerte y de infarto en estos pacientes17. Asimismo, en estos sujetos también se han descrito un aumento de otras complicaciones cardiovasculares, incluyendo ictus e insuficiencia cardiaca18, y una mayor prevalencia de enfermedad cerebral de pequeño vaso19. En conclusión, los pacientes con disfunción microvascular coronaria, identificada por una RFC alterada, tienen un mayor riesgo de eventos cardiovasculares mayores20.
La prueba de acetilcolina coronaria también permite estratificar el riesgo coronario. La respuesta anormal a la acetilcolina intracoronaria es indicativa de trastornos vasomotores causados por disfunción endotelial o por hiperreactividad de las células musculares lisas. Además de causar angina vasoespástica, los trastornos vasomotores coronarios condicionan un mayor riesgo de eventos cardiovasculares a largo plazo en los pacientes con angina, en especial cuando se asocian a aumentos de la microcirculación coronaria13,21. Incluso respuestas vasoconstrictoras moderadas a la acetilcolina pueden predecir un peor pronóstico en este contexto20.
Además, los pacientes con ANOCA suelen tener síntomas persistentes, en parte debido a que no se alcanza un diagnóstico precoz adecuado y, por lo tanto, se retrasa el tratamiento, lo que se asocia con un aumento innecesario de pruebas diagnósticas dirigidas a descartar una enfermedad arterial coronaria obstructiva, visitas a urgencias, ingresos hospitalarios, ansiedad, empeoramiento de la calidad de vida, bajas laborales y costes sanitarios directos e indirectos16,22,23.
Realizar un diagnóstico de INOCA es importante para formular tratamientos efectivos para el control de la sintomatología anginosa. El estudio CorMicA (Coronary Microvascular Angina) incluyó 151 pacientes con ANOCA en los que se realizaron cateterismo y estudio funcional invasivo (determinación del RFC, del índice de resistencia microcirculatoria y de la reserva fraccional de flujo) seguido de test de vasorreactividad con acetilcolina11. Los pacientes se aleatorizaron para revelar el endotipo concreto y guiar el tratamiento en concordancia con los resultados (grupo intervención) frente al tratamiento estándar que se aplicaría sin conocer los resultados de la prueba (grupo control). El tratamiento dirigido se adaptó de acuerdo con los endotipos documentados en el estudio invasivo (angina vasoespástica: cese del tabaco, antagonistas de los canales de calcio, nitratos de larga duración y cambios en el estilo de vida; angina microvascular: bloqueadores beta, cambios en el estilo de vida, considerar inhibidores de la enzima convertidora de angiotensina y estatinas; dolor torácico no cardiaco: suspender el tratamiento antianginoso) y se asoció de manera significativa con una mejoría de la angina a los 6 meses (medida con el Seattle Angina Questionnaire), de la calidad de vida, de la percepción de enfermedad y de la satisfacción con el tratamiento, si bien no hubo diferencias en el riesgo de eventos adversos cardiacos mayores. En el grupo de intervención se prescribieron más fármacos antianginosos (87,8 frente a 48,7%; p < 0,001). Aunque los resultados son muy interesantes, no hay que olvidar que se trata de un único estudio y con un número limitado de pacientes.
ENDOTIPOS DEL PACIENTE CON ANOCA
Las causas específicas de ANOCA aún no están por completo descritas y probablemente sean multifactoriales en la inmensa mayoría de los pacientes. En la figura 2 se resumen las causas específicas descubiertas hasta el momento y los mecanismos fisiopatológicos involucrados en su génesis. Cabe destacar que las técnicas de diagnóstico específico muchas veces no permiten diferenciar entre los distintos mecanismos fisiopatológicos, y además en muchos pacientes estos mecanismos se superponen. Actualmente se describen 4 mecanismos fisiopatológicos causantes de ANOCA:
Figura 2. Posibles resultados del estudio funcional invasivo en un paciente con ANOCA. Causas específicas descubiertas hasta el momento con los mecanismos fisiopatológicos involucrados en su génesis. Ach: acetilcolina; ANOCA: angina con arterias coronarias sin lesiones obstructivas; IMR: índice de resistencias de la microcirculación; RFC: reserva de flujo coronario. (Figura de elaboración propia basada en Meeder et al.1, Jansen et al.3, Kunadian et al.7, Kunadian et al.34 y Hokimoto et al.35.)
- Disfunción microvascular por una alteración estructural de la microcirculación. En pacientes con miocardiopatía hipertensiva se ha encontrado una escasa densidad de microvasos en comparación con pacientes sin miocardiopatía24. También se ha descrito un remodelado de la microcirculación coronaria consistente en hipertrofia e induración de la capa media arteriolar en pacientes con hipertensión y la suma de otros factores de riesgo cardiovascular, infiltración vascular por amiloide en la amiloidosis cardiaca y reducción del calibre luminal por compresión extrínseca en casos de hipertrofia del ventrículo o de aumento de la presión intraventricular izquierda3,7,25. Estos cambios provocan una disminución en la conductancia microcirculatoria que se manifiesta con un aumento de las resistencias microvasculares (índice de resistencias de la microcirculación [IMR, index of microcirculatory resistance] ≥ 25). Los valores elevados de IMR se relacionan con mayor edad y con hipertrofia del ventrículo izquierdo, sin una clara diferencia entre sexos26,27.
- Enfermedad funcional microvascular. Especialmente aquellas mujeres con escasos factores de riesgo y sin cardiopatía estructural objetivable presentan un flujo coronario en reposo aumentado que se traduce en una RFC baja28. A pesar de que el flujo coronario está habitualmente preservado en hiperemia máxima, muchos de estos pacientes presentan una baja capacidad de esfuerzo. En estos casos se plantea un desbalance en la disponibilidad de oxígeno (por un aumento de la demanda) con participación del endotelio como mecanismo principal de su génesis (por un incremento de la síntesis de óxido nítrico)29. Además, en estos pacientes se ha asociado un mayor número de alteraciones isquémicas en otros órganos, como el riñón, la retina y el sistema nervioso central, por lo que es probable que se trate de una afectación sistémica30.
- Disfunción microvascular por espasmo de la microcirculación. La disfunción microvascular por vasoespasmo es más frecuente en las mujeres que presentan factores de riesgo cardiovascular, y posiblemente la disfunción endotelial desempeñe un papel fundamental. Esta ocurre con más frecuencia en las arteriolas grandes y medianas, y se traduce en una vasoconstricción paradójica en respuesta al aumento de la demanda de oxígeno por el miocardio, lo cual se pone de manifiesto tras la administración intracoronaria de acetilcolina3,7,19,31.
- Espasmo epicárdico. Habitualmente el espasmo epicárdico no se relaciona con los factores de riesgo tradicionales, a excepción del tabaquismo. Se cree que existen 2 grandes mecanismos causantes de espasmo epicárdico: la disfunción endotelial y la hiperreactividad de las células musculares lisas. Estos mecanismos responden a los estímulos del sistema nervioso autónomo de forma contraria si son estímulos procedentes del sistema simpático (como ejercicio o una prueba de estimulación por frío) y de forma aumentada si son estímulos parasimpáticos (por ejemplo, con espasmos nocturnos)19,32.
CARACTERÍSTICAS CLÍNICAS DEL PACIENTE CON ANOCA
El primer paso para identificar al paciente con ANOCA es la sospecha diagnóstica. Los pacientes con angina microvascular suelen referir dolor torácico de tipo anginoso, en general con el esfuerzo, aunque a veces puede ser en reposo, más frecuente en las mujeres, y con respuesta limitada a los nitratos de acción corta. En ocasiones, en lugar de angina los sujetos pueden presentar un equivalente anginoso en forma de disnea de esfuerzo o sintomatología más atípica con predominio de náuseas, vómitos, mareo o fatiga. En el espasmo microvascular, que es más frecuente en el sexo femenino, se puede presentar angina inestable, con respuesta variable a los nitratos1,3.
En relación a la angina causada por trastornos coronarios vasomotores, es importante señalar que el espectro y las manifestaciones de estos son mucho más variados que el patrón de angina de Prinzmetal, que constituye un caso muy concreto de trastorno vasomotor causado por el espasmo oclusivo de un vaso epicárdico, pero que no es representativo de sustratos mucho más frecuentes, como el espasmo difuso no oclusivo y el espasmo arteriolar o microvascular. Por ejemplo, en los trastornos vasomotores causados por disregulación endotelial, la sintomatología dominante es la angina de esfuerzo, mientras que en cuadros vasomotores desencadenados por hiperreactividad de las células musculares lisas de los vasos coronarios (como es el caso de la angina de Prinzmetal) la angina suele presentarse como angina de reposo o inestable, sobre todo nocturna, aunque también puede asociarse a dolor torácico de esfuerzo, y puede iniciarse en respuesta a un estímulo concreto como el estrés, el frío o el aumento de factores humorales vasoconstrictores. También se puede asociar a otras patologías, como migraña o fenómeno de Raynaud. Es conocida la relación de algunos fármacos anticancerosos, como el 5-fluorouracilo y la capecitabina, entre otros, con la angina vasoespástica33. Asimismo, la primera manifestación clínica del vasoespasmo epicárdico puede ser un infarto de miocardio sin presencia de obstrucciones coronarias (MINOCA, Myocardial Infarction with No Obstructive Coronary Arteries)19. El hábito tabáquico se asocia con frecuencia a esta afección, a diferencia de otros factores de riesgo clásicos, como la hipertensión arterial, la diabetes mellitus y la dislipemia19,32.
ABORDAJE DIAGNÓSTICO NO INVASIVO DEL PACIENTE CON ANOCA
El abordaje diagnóstico del paciente con ANOCA se enmarca dentro del proceso diagnóstico del síndrome coronario crónico recomendado por las guías de práctica clínica, y en primer lugar es no invasivo10. No obstante, es importante destacar que se han analizado las evidencias científicas disponibles, que en ciertos aspectos son escasas, por lo que algunas de las afirmaciones se basan no solo en estudios clínicos sino también en el consenso de los autores del documento.
Tras la sospecha diagnóstica de angina, el paciente debe ser enviado a cardiología para realizar una evaluación básica de los síntomas, electrocardiograma, ecocardiograma, analítica general y respuesta clínica a un primer tratamiento antianginoso. Se recomienda una estrategia no invasiva en la mayoría de los pacientes con síntomas no limitantes y que presentan un valor pretest de riesgo de enfermedad obstructiva coronaria bajo o intermedio. Esta estrategia consiste en la realización de pruebas de imagen no invasivas, incluyendo estudios funcionales, que se basan en subrogados del flujo miocárdico y de la reserva de flujo coronaria o estudios anatómicos, principalmente tomografía computarizada coronaria3. La elección de las diferentes pruebas diagnósticas dependerá de la capacidad de realización de ejercicio por parte del paciente, la disponibilidad y la experiencia de cada centro, entre otros factores (figura 3)1,3,7,34,35.
Figura 3. Abordaje diagnóstico del paciente con sospecha de ANOCA o INOCA. Ach: acetilcolina; ANOCA: angina con arterias coronarias sin lesiones obstructivas; CI: consentimiento informado; DMV: disfunción microvascular; FRCV: factores de riesgo cardiovascular; IMR: índice de resistencias de la microcirculación; INOCA: isquemia con arterias coronarias sin lesiones obstructivas; IRPM: índice de reserva de perfusión miocárdica; RFC: reserva de flujo coronario; RM: resonancia magnética; TC: tomografía computarizada; VD: vasodilatador. (Figura de elaboración propia basada en Meeder et al.1, Perera et al.2, Jansen et al.3, Kunadian et al.7, Ang y Berry31, Kunadian et al.34 y Hokimoto et al.35.)
Cabe destacar que, en gran parte de los pacientes con ANOCA, las pruebas de imagen no invasivas para detección de isquemia tienen una baja sensibilidad para diagnosticar la mayoría de endotipos, en especial los asociados a trastornos coronarios vasomotores. En un registro de pacientes estudiados con pruebas de detección de isquemia no invasivas y con pruebas invasivas funcionales (consideradas como el método de referencia para su diagnóstico), solo un 50% de aquellos con una RFC baja presentaban alteración en las pruebas de imagen no invasivas36. De hecho, ningún estudio no invasivo de estrés puede detectar con fiabilidad el espasmo de la microvasculatura y la disfunción endotelial coronaria, y un test de estrés negativo no excluye disfunción coronaria vasomotora, en especial en pacientes sintomáticos7. Las causas de la baja sensibilidad de estas técnicas son diversas, pero cabe destacar que se basan en objetivar diferencias regionales entre segmentos miocárdicos (captación no uniforme de trazadores en la tomografía por emisión de fotón único, diferencias en la movilidad de un segmento miocárdico en la ecocardiografía de estrés). Dadas las características de la angina microvascular, en la que la isquemia puede ser generalizada, es difícil encontrar defectos regionales en las pruebas no invasivas. Además, los pacientes con vasoespasmo suelen presentar negatividad en las pruebas de esfuerzo basadas en la comparación entre reposo e hiperemia. Por lo tanto, es importante destacar que la sospecha de ANOCA debe estar presente siempre en pacientes con dolor torácico sugestivo y con tomografía computarizada coronaria normal o sin enfermedad coronaria obstructiva (< 50% de reducción del diámetro), y en pacientes con resultado negativo en pruebas de imagen no invasivas para la detección de isquemia. En la actualidad, ninguna técnica permite la visualización anatómica directa de la microcirculación coronaria in vivo en humanos, por lo que su evaluación recae en la medición de parámetros que reflejan el estado funcional, como el flujo de sangre miocárdico y la reserva del flujo miocárdico7.
Sin embargo, ciertos endotipos de ANOCA que presentan una RFC baja y una alta sospecha de angina microvascular pueden diagnosticarse de forma no invasiva, mediante varias técnicas de imagen, como PET, ecocardiograma transtorácico Doppler, ecocardiograma transtorácico con contraste y cardio-RM. La RFC se define como el incremento de flujo entre el estado de reposo y el de hiperemia máxima. Valores inferiores a una RFC entre 2 y 2,5 se consideran patológicos1.
La PET permite determinar el flujo sanguíneo miocárdico tanto en reposo como en hiperemia en términos absolutos, lo que permite calcular la RFC. Aunque esta es la técnica no invasiva considerada de referencia, y se correlaciona bien con el estudio invasivo (una RFC < 2 se asocia con un peor pronóstico independientemente de la gravedad de la enfermedad coronaria)37, su disponibilidad se encuentra muy limitada en nuestro medio3,38 debido a su alto coste y a la necesidad de utilizar radiotrazadores específicos que necesitan un ciclotrón cerca y que emiten radiación, como por ejemplo el agua marcada con oxígeno-15, el amoníaco marcado con nitrógeno-13 o el rubidio-82 análogo del potasio.
El ecocardiograma transtorácico Doppler permite determinar la velocidad de flujo sanguíneo basal y en hiperemia (tras la adminis- tración de adenosina) mediante la onda del Doppler pulsado. Una RFC < 2,5 se considera diagnóstica de disfunción microvascular. Sin embargo, requiere personal altamente entrenado y solo puede medirse en la arteria descendente anterior3,39. Por otra parte, el estudio mediante ecocardiograma transtorácico con contraste con uso de microburbujas permite estimar el flujo de perfusión miocárdica en función del grado de opacificación de este, y se ha demostrado una buena correlación con la PET, si bien puede existir una gran variabilidad interobservador y requiere mayor validación en estudios40.
Finalmente, con la cardio-RM se puede determinar la perfusión miocárdica mediante la utilización de agentes estresores y de contraste (gadolinio), con el fin de calcular el índice de reserva de perfusión miocárdica, que es un parámetro subrogado de la RFC. La disponibilidad de esta técnica es mayor que la de la PET y existe menor variabilidad interobservador que en los estudios con ecocardiograma, lo que la convierte en la prueba más adecuada para valorar la disfunción microvascular en nuestro medio; sin embargo, necesita ser validada en el resto de los endotipos de la ANOCA3,41. El estado de hiperemia o vasodilatación coronaria se puede conseguir mediante la perfusión con bomba de adenosina o la administración de un bolo único de regadenosón, y se compara de forma cuantitativa la perfusión en estrés frente al reposo. La capacidad diagnóstica de la cardio-RM de estrés en la disfunción microvascular se demostró hace ya dos décadas42; un índice de reserva de per- fusión miocárdica < 1,84 ha demostrado una sensibilidad del 73% y una especificidad del 74% para predecir alteraciones en el estudio invasivo de fisiología coronaria, con un área bajo la curva ROC (receiver operating characteristic) de 0,7841. Una valoración cuantitativa de los estudios de perfusión de estrés demostró una correlación aún mayor con el estudio invasivo en una serie de 65 pacientes (50 con angina estable, el 46% de ellos sin lesiones coronarias, y 15 voluntarios sanos) para discriminar entre enfermedad multivaso y disfunción microvascular, con un área bajo la curva de 0,94 (p < 0,001) para el valor de flujo miocárdico global en estrés < 1,82 ml/g/min43. En este estudio, el flujo miocárdico en estrés se correlacionó mejor con las medidas invasivas que la reserva de flujo miocárdico. Por otra parte, también se ha demostrado su capacidad pronóstica: en una serie de 218 pacientes con angina y coronarias sin lesiones epicárdicas44, un índice de reserva de perfusión miocárdica ≤ 1,47 se asoció con 3 veces más riesgo de eventos cardiovasculares mayores respecto a aquellos pacientes con un valor > 1,47 (hazard ratio = 3,14; intervalo de confianza del 95%, 1,58-6,25; p = 0,001). En otra serie de 395 pacientes, la reserva de perfusión miocárdica aumentó el valor pronóstico frente al modelo basal (edad, sexo y realce tardío) del objetivo primario, definido como muerte de causa cardiovascular, infarto no fatal, parada recuperada y revascularización tardía, tras 460 días de seguimiento. En este estudio, además, se confirmó que la valoración de la isquemia mediante perfusión cuantitativa (definida como más de un 10% de miocardio isquémico) fue mejor que la valoración cualitativa (definida como un defecto de perfusión en 2 o más segmentos)45. Rahman et al.46 también demostraron que las técnicas de cardio-RM de alta resolución que utilizan perfusión por completo cuantitativa tenían una buena precisión y eran mejores que la evaluación visual para detectar la disfunción microvascular.
Desafortunadamente, algunas de las pruebas que ayudarían en el diagnóstico funcional no invasivo de los pacientes con ANOCA/INOCA no están disponibles para uso clínico habitual en muchos centros de nuestro país, lo que limita la aproximación diagnóstica de estos pacientes.
La tabla 1 muestra los criterios diagnósticos de ANOCA, y en la figura 3 el algoritmo diagnóstico completo propuesto para los pacientes con ANOCA, especificando la estrategia inicial y cuándo planificar el estudio invasivo, así como las posibles terapias en función del endotipo específico.
Tabla 1. Criterios diagnósticos de ANOCA
| Endotipo | Fisiopatología | Criterios | Comentarios |
|---|---|---|---|
| Angina microvascular | Disfunción microvascular coronaria | Síntomas de isquemia miocárdica | • Angina de esfuerzo o reposo • Equivalente anginoso (disnea de esfuerzo) |
| Evidencia de isquemia miocárdica | • Prueba de detección de isquemia positiva | ||
| Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50% • Observado mediante TC de coronarias o coronariografía |
||
| Función microvascular coronaria alterada | • Test de adenosina: RFC ≤ 2,0 (2,5 según el método), IRM ≥ 25, RHM ≥ 1,9 • Espasmo microvascular (espontáneo o test de acetilcolina): angina, alteraciones ECG, sin espasmo epicárdico (reducción de la luz < 90%) |
||
| Angina vasoespástica | Espasmo epicárdico | Síntomas | • Angina, más en reposo, sobre todo nocturna • Tolerancia al esfuerzo disminuida, sobre todo por la mañana • Respuesta a nitratos y antagonistas del calcio |
| Cambios ECG | • Cambios (elevación/descenso) del segmento ST ≥ 1 mV • Nuevas ondas U negativas |
||
| Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50% • Observado mediante TC de coronarias o coronariografía |
||
| Espasmo coronario | • Vasoconstricción > 90% con angina y cambios ECG espontáneos o tras test de provocación (acetilcolina) | ||
| Función microvascular coronaria conservada | • Test de adenosina: RFC > 2,0 (2,5 según el método), IRM < 25, RHM < 1,9 | ||
| Mixto | Angina microvascular y espasmo epicárdico | Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50% • Observado mediante TC de coronarias o coronariografía |
| Angina microvascular | • Disfunción microvascular • Test de adenosina: RFC ≤ 2,0 (2,5 según el método), IRM ≥ 25, RHM ≥ 1,9 |
||
| Espasmo coronario | • Angina + cambios ECG + vasoconstricción epicárdica (> 90%) | ||
| Dolor torácico no cardiaco | Ninguna | Ausencia de enfermedad arterial coronaria obstructiva | • RFF > 0,80 o estenosis < 50%, • Observado mediante TC de coronarias o coronariografía |
| Test funcionales normales | • Test de adenosina: RFC > 2,0 (2,5 según el método), IRM < 25, RHM < 1,9 • Test de acetilcolina negativo |
||
|
ANOCA: angina con arterias coronarias sin lesiones obstructivas; ECG: electrocardiograma; IRM: índice de resistencia microvascular; RFC: reserva de flujo coronario; RFF: reserva fraccional de flujo; RHM: resistencia a la velocidad hiperémica miocárdica; TC: tomografía computarizada. Tabla basada en los datos de Meeder et al.1, Perera et al.2, Jansen et al.3, Kunadian et al.7, Mejia-Renteria et al.19, Ong et al.25, Ang y Berry31, Kunadian et al.34 y Hokimoto et al.35. |
|||
ABORDAJE DIAGNÓSTICO INVASIVO DEL PACIENTE CON ANOCA
Con respecto a la valoración invasiva del paciente con sospecha de ANOCA, si bien se trata de procedimientos muy seguros, no están exentos de riesgo, por lo que es preciso que el personal posea una formación específica en la realización y la interpretación de las distintas pruebas, así como establecer los circuitos adecuados. Actualmente se recomienda un estudio funcional doble con una prueba de provocación de vasoespasmo con infusión intracoronaria de acetilcolina y una prueba de función microvascular median- te guía de presión-termistor en reposo y en hiperemia máxima farmacológica7,11,34,35.
Se recomienda realizar la prueba de provocación de vasoespasmo con acetilcolina intracoronaria. Debido a que la ficha técnica de la acetilcolina no contempla su uso intracoronario, antes de realizar la prueba es preciso contactar con el servicio de farmacia del centro para autorizarlo. En la mayoría de los casos, el paciente deberá consentir por escrito el uso del fármaco fuera de ficha técnica47. Esta prueba ha demostrado tener unas altas sensibilidad y especificidad (en torno al 90 y el 100%, respectivamente, dependiendo de las características de los pacientes) para el diagnóstico de angina vasoespástica (tanto micro- como macrovascular), con un número muy reducido de complicaciones47,48. Para su realización es importante evitar el uso de fármacos vasodilatadores de larga duración antes de la prueba. Se recomienda un mínimo de 18 horas sin agentes vasodilatadores orales o tópicos para evitar falsos negativos. A pesar de que el uso de bloqueadores beta puede incrementar la vasoconstricción tras la infusión de acetilcolina, no se recomienda interrumpirlos antes de la prueba si se considera necesario. Hay que valorar que en los procedimientos realizados por vía radial deberá evitarse el uso de antagonistas del calcio47. Básicamente, la prueba consiste en la infusión de dosis crecientes de acetilcolina y valorar de manera simultánea la reproducción de los síntomas que aqueja el paciente, los cambios en el electrocardiograma (en 12 derivaciones) y la presencia de un espasmo de las arterias epicárdicas > 90% del diámetro basal. En el año 2021, la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología publicó un documento técnico para su realización e interpretación47.
La valoración de la función microvascular puede realizarse con guía intracoronaria Doppler o con guía de presión-termistor. No obstante, a día de hoy, las únicas guías disponibles son las de presión-termistor (Pressurewire X, Abbott, Estados Unidos) que utilizan el método de termodilución. La termodilución coronaria permite obtener valores de flujo coronario en reposo y en hiperemia máxima tras la infusión de cualquier agente vasodilatador de la microcirculación (habitualmente adenosina o un derivado). Estos valores se obtienen con la infusión de 3 ml de solución salina fisiológica por el catéter guía y calculando el tiempo de tránsito de esta entre el segmento proximal de la arteria y el segmento distal, donde se emplaza el termistor distal de la guía tanto en reposo como en hiperemia máxima. Obteniendo los datos de flujo en reposo y en hiperemia máxima se calcula la RFC, que en condiciones normales debe ser > 2,5. Unos valores de RFC ≤ 2,5 se consideran diagnósticos de disfunción microvascular. Debido a que durante la realización de la prueba en hiperemia máxima se obtiene de manera simultánea la presión de perfusión de la microcirculación (presión que se mide en el segmento distal de la arteria donde se emplaza la guía), se puede calcular la resistencia mínima de la microcirculación (el IMR). En los estudios con pacientes sanos se ha establecido un punto de corte de 25. Los valores de IMR ≥ 25 también son considerados como disfunción microvascular7,34,35.
Cabe destacar también otro método prometedor en el campo del diagnóstico invasivo del paciente con ANOCA. Utilizando la misma guía de presión y un microcatéter dedicado (RayFlow, Hexacath, Francia), se pueden obtener el valor de flujo absoluto coronario (en ml/min) y las resistencias absolutas de la microcirculación (en unidades Wood)49. Al tratarse de valores absolutos, estos dependen en parte del territorio de perfusión de la arteria y del segmento estudiado. Actualmente se encuentra en investigación una aproximación indexada utilizando este método50.
ABORDAJE TERAPÉUTICO DEL PACIENTE CON ANOCA
Enfoque general
En el paciente con ANOCA el tratamiento debería enfocarse en el alivio de los síntomas y en mejorar el perfil de riesgo, la calidad de vida y el pronóstico. En este sentido, el diagnóstico precoz, la identificación de los mecanismos fisiopatológicos implicados y el inicio temprano del tratamiento ajustado al endotipo de INOCA son clave para lograr el éxito terapéutico1,3,7,25,31,34,35,51-54. Sin embargo, los estudios realizados con tratamiento médico específico para esta patología son de pequeño tamaño, con metodología heterogénea y resultados variables, por lo que es difícil establecer unas recomendaciones robustas en el abordaje terapéutico de estos pacientes.
Cambios en el estilo de vida y control de los factores de riesgo cardiovascular
En primer lugar, dado el impacto que tienen los factores de riesgo cardiovascular en el desarrollo de la disfunción microvascular coronaria y el espasmo epicárdico, es fundamental un control adecuado de ellos, tanto con cambios en el estilo de vida (reducción de peso, ejercicio físico, cese del hábito tabáquico, reducción del estrés) como con tratamientos farmacológicos adecuados10. Para disminuir el riesgo de vasoespasmo coronario es importante evitar factores desencadenantes, como el hábito tabáquico y el consumo de ciertas drogas (cocaína y anfetaminas)10.
Las estatinas no solo son beneficiosas por su efecto sobre el perfil lipídico, sino que también se ha observado que tienen un efecto positivo sobre la función endotelial y en la prevención del desarrollo de espasmos coronarios55,56. Los inhibidores del sistema renina-angiotensina son beneficiosos al disminuir la presión arterial y mejorar la función endotelial. De hecho, se han descrito efectos positivos con estos fármacos tanto en la disfunción microvascular coronaria como en el vasoespasmo epicárdico55-57. El papel del ácido acetilsalicílico en los pacientes sin enfermedad cardiovascular conocida es controvertido55,56. De hecho, en el documento de las sociedades japonesas no se recomienda en ausencia de estenosis angiográficas en los pacientes con vasoespasmo (indicación IIIB)35.
Tratamiento antianginoso
Es fundamental para disminuir los síntomas de los pacientes. En los que tienen un endotipo estructural de INOCA (disfunción microvascular) se recomienda preferentemente el empleo de fármacos que disminuyan el consumo de oxígeno miocárdico, como los bloqueadores beta o los antagonistas de los canales del calcio (también se podría plantear la ivabradina en ciertos casos), valorando asimismo el empleo de otros como la ranolazina, la trimetazidina y el nicorandil. En los pacientes con un endotipo vasomotor de INOCA (tanto si se trata de espasmo epicárdico como microvascular) se recomienda el uso de antagonistas de los canales del calcio, nitratos o nicorandil, o ambos (tabla 2)1,3,7,25,31,34,35,51-54.
Tabla 2. Abordaje terapéutico del paciente con ANOCA o INOCA
| Tratamiento general | |||
|---|---|---|---|
| Cambios en el estilo de vida | • Dieta mediterránea • Ejercicio físico • Control del peso • Reducción del estrés |
||
| Control de los factores de riesgo cardiovascular | • Hipertensión arterial • Dislipemia • Diabetes • Cese del hábito tabáquico |
||
| Ácido acetilsalicílico | • Si antecedentes de ECV • Si no antecedentes de ECV, su uso es controvertido |
||
| IECA o ARA II | • Reducción de la presión arterial • Mejoría de la función endotelial: posible beneficio en la disfunción microvascular coronaria y el vasoespasmo coronario |
||
| Estatinas | • Reducción del colesterol total y LDL • Mejoría de la función endotelial • Posible beneficio en la angina vasoespástica |
||
| Fármacos antianginosos | Angina microvascular | Bloqueadores beta | • Disminución del consumo de oxígeno miocárdico* |
| Antagonistas del calcio | • Disminución del consumo de oxígeno miocárdico • Relajación del músculo liso vascular |
||
| Ranolazina | • Mejoría de la reserva de perfusión microvascular | ||
| Trimetazidina | • Aumento de la tolerancia celular a la isquemia | ||
| Angina vasoespástica | Antagonistas del calcio | • Disminución del consumo de oxígeno miocárdico • Disminución del espasmo coronario, vía relajación del músculo liso vascular |
|
| Nitratos | • Disminución del consumo de oxígeno miocárdico • Disminución del espasmo coronario, vía relajación del músculo liso vascular |
||
| Nicorandil | • Efecto vasodilatador coronario | ||
| Angina microvascular + angina vasoespástica | Antagonistas del calcio, nitratos, ranolazina, trimetazidina, nicorandil | ||
|
* Valorar el uso de nebivolol por sus propiedades antioxidantes a través del óxido nítrico. ANOCA: angina con arterias coronarias sin lesiones obstructivas; ARA II: antagonistas de los receptores de la angiotensina II; ECV: enfermedad cardiovascular; IECA: inhibidores de la enzima convertidora de la angiotensina; INOCA: angina con arterias coronarias sin lesiones obstructivas; LDL: lipoproteínas de baja densidad. Tabla basada en los datos de Meeder et al.1, Jansen et al.3, Kunadian et al.7, Kobayashi et al.26, Ang y Berry31, Kunadian et al.34, Hokimoto et al.35, Beltrame et al.51, Mehta et al.52, Seitz et al.53 y Abouelnour et al.54. |
|||
Existen algunas evidencias con el nebivolol respecto a otros bloqueadores beta, debido a su potencial efecto vasodilatador por su acción sobre la producción de óxido nítrico58. También se ha sugerido un efecto beneficioso del carvedilol al mejorar la dilatación dependiente del endotelio59. Un estudio aleatorizado con 81 pacientes demostró un beneficio del tratamiento con ranolazina en el control de los síntomas en aquellos pacientes con una RFC < 2,560. El tratamiento con diltiazem no mostró beneficio en la reducción de los síntomas, la calidad de vida ni la función microvascular coronaria en el estudio aleatorizado EDIT-CMD con 73 pacientes con ANOCA tras 6 semanas de tratamiento, si bien sí se documentó una reducción en la inducción de vasoespasmo epicárdico12. Finalmente, existen prometedores posibles beneficios con fármacos que actúan sobre nuevas dianas terapéuticas, como el cilostazol, un inhibidor de la fosfodiesterasa 3 que actúa sobre el vasoespasmo coronario61, o el zibotentán, un antagonista selectivo de la endotelina A con beneficios sobre la microcirculación y la disfunción endotelial62, o el fasudilo, un inhibidor de la enzima rho-cinasa que ha demostrado disminuir el IMR en pacientes con test de provocación de vasoespasmo positivo e IMR elevado13.
Tratamiento para la angina resistente
En aquellos pacientes que continúan con angina se ha planteado el uso de fármacos como los antidepresivos tricíclicos a dosis bajas (modulan la captación de noradrenalina y los efectos anticolinérgicos, lo cual puede inducir la analgesia) o los neuroestimuladores que bloquean la transmisión del dolor a nivel de la médula espinal, e incluso la realización de intervencionismo coronario en caso de angina vasoespástica refractaria al tratamiento médico51.
Seguimiento de los pacientes
El seguimiento de estos pacientes se debería realizar de manera coordinada entre atención primaria y cardiología, y una vez controlados los síntomas se debería hacer de manera preferente en atención primaria, remitiendo a cardiología en caso de descompensación. Por otra parte, dadas las particularidades de la ANOCA, es fundamental explicar al paciente en qué consiste su enfermedad y las implicaciones que tiene, y es necesario un abordaje multidisciplinario puesto que en ocasiones se requiere la implicación de otros profesionales sanitarios, como psicólogos, internistas, clínica del dolor, etc.
Líneas futuras de investigación
Finalmente, existen ensayos clínicos en marcha que están explorando si el tratamiento intensivo de la aterosclerosis coronaria con estatinas de alta intensidad, inhibidores del sistema renina-angiotensina-aldosterona y dosis bajas de ácido acetilsalicílico mejora la angina y la isquemia. El ensayo WARRIOR (NCT03417388) está evaluando si dicho tratamiento se traduce en mejores resultados, mientras que el MINOCA-BAT (NCT03686696) investiga si una intervención con bloqueadores beta e inhibidores del sistema renina-angiotensina-aldosterona reduce los eventos clínicos cardiovasculares mayores.
CONCLUSIONES
Los pacientes con sospecha de ANOCA muestran una amplia diversidad, pero hoy en día pueden tener un diagnóstico y un tratamiento personalizado eficaz. Es importante que los cardiólogos clínicos conozcan las distintas patologías que puede presentar un paciente con ANOCA y las herramientas diagnósticas y terapéuticas disponibles. La realización de pruebas de diagnóstico invasivo es una nueva opción que requiere entrenamiento específico para su correcta realización e interpretación, al igual que la cardio-RM con adenosina o regadenosón para el cálculo de la perfusión miocárdica. En resumen, hay que realizar acciones concretas en todos los centros asistenciales para crear circuitos diagnósticos y terapéuticos específicos para el abordaje de estos pacientes.
FINANCIACIÓN
El presente trabajo no contó con financiación.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido en la concepción, la búsqueda bibliográfica, el desarrollo, la redacción, la lectura y la aprobación final del manuscrito. C. Escobar fue el coordinador del consenso.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado la inteligencia artificial para la realización del presente documento.
CONFLICTO DE INTERESES
J. Escaned, receptor del Proyecto para Intensificación de la Actividad Investigadora INT22/00088 del Instituto de Salud Carlos III, declara haber recibido honorarios como ponente en actividades educativas para Abbott y Philips. C. Escobar, J.M. Gámez y V. Barrios han recibido honorarios por ponencias de Menarini. El resto de los autores no tienen conflictos de intereses.
BIBLIOGRAFÍA
1. Meeder JG, Hartzema-Meijer MJ, Jansen TPJ, Konst RE, Damman P, Elias-Smale SE. Outpatient Management of Patients With Angina With No Obstructive Coronary Arteries:How to Come to a Proper Diagnosis and Therapy. Front Cardiovasc Med. 2021;8:716319.
2. Perera D, Berry C, Hoole SP, et al. Invasive coronary physiology in patients with angina and non-obstructive coronary artery disease:a consensus document from the coronary microvascular dysfunction workstream of the British Heart Foundation/National Institute for Health Research Partnership. Heart. 2022;109:88-95.
3. Jansen TPJ, Konst RE, Elias-Smale SE, et al. Assessing Microvascular Dysfunction in Angina With Unobstructed Coronary Arteries:JACC Review Topic of the Week. J Am Coll Cardiol. 2021;78:1471-1479.
4. Alonso JJ, Muñiz J, Gómez-Doblas JC, et al. Prevalencia de angina estable en España. Resultados del estudio OFRECE. Rev Esp Cardiol. 2015;68:691-699.
5. Douglas PS, Hoffmann U, Patel MR, et al. Outcomes of anatomical versus functional testing for coronary artery disease. N Engl J Med. 2015;372:1291-1300.
6. Rahman H, Ryan M, Lumley M, et al. Coronary microvascular dysfunction is associated with myocardial ischemia and abnormal coronary perfusion during exercise. Circulation. 2019;140:1805-1816.
7. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI expert consensus document on ischaemia with non-obstructive coronary arteries in collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology and Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. Eur Heart J. 2020;41:3504-3520.
8. Taqueti VR. Coronary microvascular dysfunction in vasospastic angina:provocative role for the microcirculation in macrovessel disease prognosis. J Am Coll Cardiol. 2019;74:2361-2364.
9. Luu JM, Wei J, Shufelt CL, et al. Clinical Practice Variations in the Management of Ischemia With No Obstructive Coronary Artery Disease. J Am Heart Assoc. 2022;11:e022573.
10. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
11. Ford TJ, Stanley B, Good R, et al. Stratified medical therapy using invasive coronary function testing in angina:the CorMicA trial. J Am Coll Cardiol. 2018;72(23 Pt A):2841-2855.
12. Jansen TPJ, Konst RE, de Vos A, et al. Efficacy of Diltiazem to Improve Coronary Vasomotor Dysfunction in ANOCA:The EDIT-CMD Randomized Clinical Trial. JACC Cardiovasc Imaging. 2022;15:1473-1484.
13. Suda A, Takahashi J, Hao K, et al. Coronary Functional Abnormalities in Patients With Angina and Nonobstructive Coronary Artery Disease. J Am Coll Cardiol. 2019;74:2350-2360.
14. Kaski JC, Collins P, Nihoyannopoulos P, Maseri A, Poole-Wilson PA, Rosano GM. Cardiac syndrome X:clinical characteristics and left ven-tricular function:long-term follow-up study. J Am Coll Cardiol. 1995;25:807-814.
15. Sharaf B, Wood T, Shaw L, et al. Adverse outcomes among women presenting with signs and symptoms of ischemia and no obstructive coronary artery disease:findings from the national heart, lung, and blood institute-sponsored women's ischemia syndrome evaluation (WISE) angiographic core laboratory. Am Heart J. 2013;166:134-141.
16. Radico F, Zimarino M, Fulgenzi F, et al. Determinants of long-term clinical outcomes in patients with angina but without obstructive coronary artery disease:a systematic review and meta-analysis. Eur Heart J. 2018;39:2135-2146.
17. Pepine CJ, Anderson RD, Sharaf BL, et al. Coronary microvascular reactivity to adenosine predicts adverse outcome in women evaluated for suspected ischemia:results from the National Heart, Lung and Blood Institute WISE (Women's Ischemia Syndrome Evaluation) study. J Am Coll Cardiol. 2010;55:2825-2832.
18. Patel S, Fung M, Liang Z, Butalia S, Anderson TJ. Temporal Trends of the Prevalence of Angina With No Obstructive Coronary Artery Disease (ANOCA). Can J Cardiol. 2023;39:63-70.
19. Mejia-Renteria H, Travieso A, Matías-Guiu JA, et al. Coronary microvascular dysfunction is associated with impaired cognitive function:the Cerebral-Coronary Connection study (C3 study). Eur Heart J. 2023;44:113-125.
20. Boerhout CKM, de Waard GA, Lee JM, et al. Prognostic value of structural and functional coronary microvascular dysfunction in patients with non-obstructive coronary artery disease;from the multicentre international ILIAS registry. EuroIntervention. 2022;18:719-728.
21. Grigorian-Shamagian L, Oteo JF, Gutiérrez-Barrios A, et al. Endothelial dysfunction in patients with angina and non-obstructed coronary arteries is associated with an increased risk of mayor cardiovascular events. Results of the Spanish ENDOCOR registry. Int J Cardiol. 2023;370:18-25.
22. Jespersen L, Abildstrøm SZ, Hvelplund A, Prescott E. Persistent angina:highly prevalent and associated with long-term anxiety, depression, low physical functioning, and quality of life in stable angina pectoris. Clin Res Cardiol. 2013;102:571-581.
23. Schumann CL, Mathew RC, Dean JL, et al. Functional and Economic Impact of INOCA and Influence of Coronary Microvascular Dysfunction. JACC Cardiovasc Imaging. 2021;14:1369-1379.
24. Nadruz W. Myocardial remodeling in hypertension. J Hum Hypertens. 2015;29:1-6.
25. Ong P, Camici PG, Beltrame JF, et al.;Coronary Vasomotion Disorders International Study Group (COVADIS). International standardization of diagnostic criteria for microvascular angina. Int J Cardiol. 2018;250:16-20.
26. Kobayashi Y, Fearon WF, Honda Y, et al. Effect of Sex Differences on Invasive Measures of Coronary Microvascular Dysfunction in Patients With Angina in the Absence of Obstructive Coronary Artery Disease. JACC Cardiovasc Interv. 2015;8:1433-1441.
27. Chung JH, Lee KE, Lee JM, et al. Effect of Sex Difference of Coronary Microvascular Dysfunction on Long-Term Outcomes in Deferred Lesions. JACC Cardiovasc Interv. 2020;13:1669-1679.
28. Nardone M, McCarthy M, Ardern CI, et al. Concurrently Low Coronary Flow Reserve and Low Index of Microvascular Resistance Are Associated With Elevated Resting Coronary Flow in Patients With Chest Pain and Nonobstructive Coronary Arteries. Circ Cardiovasc Interv. 2022;15:e011323.
29. Rahman H, Demir OM, Khan F, et al. Physiological Stratification of Patients With Angina Due to Coronary Microvascular Dysfunction. J Am Coll Cardiol. 2020;75:2538-2549.
30. Beltrame JF, Crea F, Kaski JC, et al. International standardization of diagnostic criteria for vasospastic angina. Eur Heart J. 2017;38:2565-2568.
31. Ang DTY, Berry C. What an Interventionalist Needs to Know About INOCA. Interv Cardiol. 2021;16:e32.
32. Lanza GA, Careri G, Crea F. Mechanisms of coronary artery spasm. Circulation. 2011;124:1774-1782.
33. Matsumoto T, Saito Y, Saito K, et al. Relation Between Cancer and Vasospastic Angina. Adv Ther. 2021;38:4344-4353.
34. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology &Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. EuroIntervention. 2021;16:1049-1069.
35. Hokimoto S, Kaikita K, Yasuda S, et al. JCS/CVIT/JCC 2023 Guideline Focused Update on Diagnosis and Treatment of Vasospastic Angina (Coronary Spastic Angina) and Coronary Microvascular Dysfunction. Circ J. 2023;87:879-936.
36. Lee SH, Shin D, Lee JM, et al. Clinical Relevance of Ischemia with Nonobstructive Coronary Arteries According to Coronary Microvascular Dysfunction. J Am Heart Assoc. 2022;11:e025171.
37. Ziadi MC, Dekemp RA, Williams KA, et al. Impaired myocardial flow reserve on rubidium-82 positron emission tomography imaging predicts adverse outcomes in patients assessed for myocardial ischemia. J Am Coll Cardiol. 2011;58;740-748.
38. Driessen RS, Raijmakers PG, Stuijfzand WJ, Knaapen P. Myocardial perfusion imaging with PET. Int J Cardiovasc Imaging. 2017;33:1021-1031.
39. Michelsen MM, Mygind ND, Pena A, et al. Transthoracic Doppler echocardiography compared with positron emission tomography for assessment of coronary microvascular dysfunction:the iPOWER study. Int J Cardiol. 2017;228:435-443.
40. Vogel R, Indermühle A, Reinhardt J, et al. The quantification of absolute myocardial perfusion in humans by contrast echocardiography:algorithm and validation. J Am Coll Cardiol. 2005;45:754-762.
41. Thomson LE, Wei J, Agarwal M, et al. Cardiac magnetic resonance myocardial perfusion reserve index is reduced in women with coronary microvascular dysfunction. A National Heart, Lung, and Blood Institute–sponsored study from the Women's Ischemia Syndrome Evaluation. Circ Cardiovasc Imaging. 2015;8:e002481.
42. Panting JR, Gatehouse PD, Yang GZ, et al. Abnormal subendocardial perfusion in cardiac syndrome X detected by cardiovascular magnetic resonance imaging. N Engl J Med. 2002;346:1948-1953.
43. Kotecha T, Martinez-Naharro A, Boldrini M, et al. Automated Pixel-Wise Quantitative Myocardial Perfusion Mapping by CMR to Detect Obstructive Coronary Artery Disease and Coronary Microvascular Dysfunction:Validation Against Invasive Coronary Physiology. JACC Cardiovasc Imaging. 2019;12:1958-1969.
44. Zhou W, Lee JCY, Leung ST, et al. Long-Term Prognosis of Patients With Coronary Microvascular Disease Using Stress Perfusion Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2021;14:602-611.
45. Sammut EC, Villa ADM, Di Giovine G, et al. Prognostic Value of Quantitative Stress Perfusion Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2018;11:686-694.
46. Rahman H, Scannell CM, Demir OM, et al. High-Resolution Cardiac Magnetic Resonance Imaging Techniques for the Identification of Coronary Microvascular Dysfunction. JACC Cardiovasc Imaging. 2021;14:978-986.
47. Gutiérrez E, Gómez-Lara J, Escaned J, et al. Assessment of the endothelial function and spasm provocation test performed by intracoronary infusion of acetylcholine. Technical report from the ACI-SEC. REC Interv Cardiol. 2021;3:286-296.
48. Montone RA, Rinaldi R, Del Buono MG, et al. Safety and prognostic relevance of acetylcholine testing in patients with stable myocardial ischaemia or myocardial infarction and non-obstructive coronary arteries. EuroIntervention. 2022;18:e666-e676.
49. Rivero F, Gutiérrez-Barrios A, Gomez-Lara J, et al. Coronary microvascular dysfunction assessed by continuous intracoronary thermodilution:A comparative study with index of microvascular resistance. Int J Cardiol. 2021;333:1-7.
50. de Vos A, Jansen TPJ, van't Veer M, et al. Microvascular Resistance Reserve to Assess Microvascular Dysfunction in ANOCA Patients. JACC Cardiovasc Interv. 2023;16:470-481.
51. Beltrame JF, Tavella R, Jones D, Zeitz C. Management of ischaemia with non-obstructive coronary arteries (INOCA). BMJ. 2021;375:e060602.
52. Mehta PK, Huang J, Levit RD, Malas W, Waheed N, Bairey Merz CN. Ischemia and no obstructive coronary arteries (INOCA):A narrative review. Atherosclerosis. 2022;363:8-21.
53. Seitz A, Martínez Pereyra V, Sechtem U, Ong P. Update on coronary artery spasm 2022 –A narrative review. Int J Cardiol. 2022;359:1-6.
54. Abouelnour A, Gori T. Vasomotor Dysfunction in Patients with Ischemia and Non-Obstructive Coronary Artery Disease:Current Diagnostic and Therapeutic Strategies. Biomedicines. 2021;9:1774.
55. Ong P, Athanasiadis A, Sechtem U. Treatment of Angina Pectoris Associated with Coronary Microvascular Dysfunction. Cardiovasc Drugs Ther. 2016;30:351-356.
56. Picard F, Sayah N, Spagnoli V, Adjedj J, Varenne O. Vasospastic angina:A literature review of current evidence. Arch Cardiovasc Dis. 2019;112:44-55.
57. Choi BG, Jeon SY, Rha SW, et al. Impact of Renin-Angiotensin System Inhibitors on Long-Term Clinical Outcomes of Patients With Coronary Artery Spasm. J Am Heart Assoc. 2016;5:e003217.
58. Erdamar H, Sen N, Tavil Y, et al. The effect of nebivolol treatment on oxidative stress and antioxidant status in patients with cardiac syndrome-X. Coron Artery Dis. 2009;20:238-244.
59. Matsuda Y, Akita H, Terashima M, et al. Carvedilol improves endothelium-dependent dilatation in patients with coronary artery disease. Am Heart J. 2000;140:753-759.
60. Rambarat CA, Elgendy IY, Handberg EM, et al. Late sodium channel blockade improves angina and myocardial perfusion in patients with severe coronary microvascular dysfunction:Women's Ischemia Syndrome Evaluation-Coronary Vascular Dysfunction ancillary study. Int J Cardiol. 2019;276:8-13.
61. Shin ES, Lee JH, Yoo SY, et al. A randomised, multicentre, double blind, placebo controlled trial to evaluate the efficacy and safety of cilostazol in patients with vasospastic angina. Heart. 2014;100:1531-1536.
62. Morrow AJ, Ford TJ, Mangion K, et al. Rationale and design of the Medical Research Council's Precision Medicine with Zibotentan in Microvascular Angina (PRIZE) trial. Am Heart J. 2020;229:70-80.
* Autor para correspondencia.
Correo electrónico: escobar_cervantes_carlos@hotmail.com (C. Escobar).
@JEscaned; @AntoniCarolRuiz; @S_Raposeiras; @jmgamez3; @rfreixap; @Ana_Viana_T; @clinica_sec; @AgudosSEC
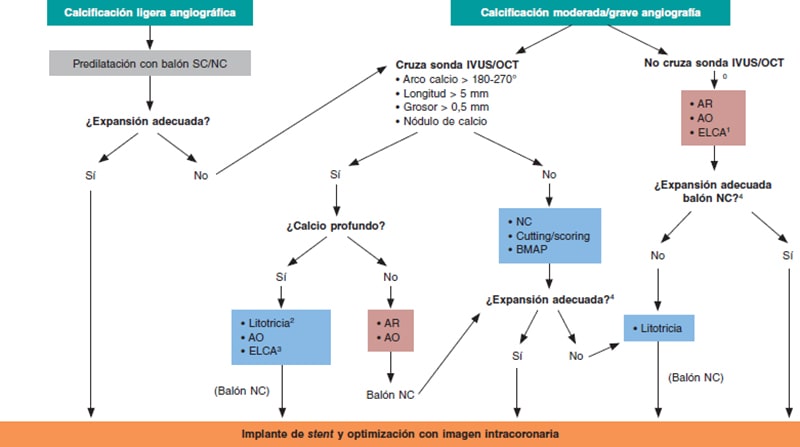
RESUMEN
La calcificación coronaria es probablemente el mayor determinante de un mal resultado de la angioplastia y se asocia a mayores tasas de eventos adversos. En la actualidad existen distintas técnicas de modificación de la placa basadas en balones o en dispositivos específicos. El conocimiento de sus características y su uso adecuado son aspectos clave para el tratamiento óptimo de las lesiones calcificadas. Este artículo de posicionamiento, promovido desde la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología (ACI-SEC), describe las técnicas de modificación de la placa existentes en la actualidad y propone un algoritmo para el tratamiento de la lesión calcificada.
Palabras clave: Lesiones coronarias calcificadas. Técnicas de modificación de la placa. Imagen intracoronaria.
Abstract
Coronary artery calcification is probably the main determinant of the poor outcome of percutaneous coronary interventions and is associated with higher rates of adverse events. There are currently different balloon or specific device-based plaque modification techniques available. Knowing their characteristics and proper use is key for the optimal treatment of calcified lesions. This position paper—promoted by the Interventional Cardiology Association of the Spanish Society of Cardiology (ACI-SEC)—describes existing plaque modification techniques currently available and proposes an algorithm for the management of calcified lesions.
Keywords: Calcified coronary lesions. Plaque modification techniques. Intracoronary imaging modalities.
Abreviaturas
AO: aterectomía orbitacional. AR: aterectomía rotacional. BC: balón de corte. BS: balón de scoring. ELCA: angioplastia coronaria con láser excimer. LIC: litotricia intracoronaria.IMPLICACIONES DE LA CALCIFICACIÓN EN EL INTERVENCIONISMO CORONARIO PERCUTÁNEO
La calcificación vascular es un proceso íntimamente ligado a la ateroesclerosis. Se puede producir en la capa media (fundamentalmente en arterias periféricas) o en la capa íntima (arterias coronarias). En el contexto de la ateroesclerosis coronaria aparece en fases intermedias o avanzadas de la evolución de la placa por conversión de células musculares lisas a fenotipos osteoblásticos e infiltración de la placa de ateroma por macrófagos que eliminan las células musculares lisas apoptóticas y que contienen vesículas calcificadas1. La calcificación de las placas de ateroma puede tomar diversas formas, que probablemente corresponden a diferentes estadios de la misma enfermedad: microcalcificaciones (< 15 μ), calcificaciones puntiformes (< 90° de arco de circunferencia), hojas o láminas de calcio (> 90° de arco o > 3 mm de longitud) y nódulos de calcio1.
Los principales factores de riesgo asociados a la calcificación coronaria son la edad, la raza caucásica, la diabetes mellitus y la enfermedad renal crónica1.
La prevalencia de la calcificación coronaria es variable según la población estudiada y el método diagnóstico2. La definición angiográfica clásica de calcificación moderada se refiere a radioopacidades observadas durante el movimiento cardiaco, y la de calcificación grave a radioopacidades observadas sin necesidad de movimiento cardiaco, habitualmente a ambos lados de la luz arterial. La prevalencia de calcificación moderada o grave oscila entre el 18 y el 60%3,4.
La calcificación dificulta el intervencionismo coronario percutáneo (ICP) por varios motivos: a) la resistencia al avance de los dispositivos, en especial cuando se encuentra en combinación con tortuosidad (en último extremo, lesiones «no cruzables»); b) la reducida distensibilidad de la placa, que requerirá mayor presión en los balones de dilatación o dispositivos de modificación de la placa (lesiones «no dilatables»), y c) la dificultad para el avance del stent y para su expansión5. Otros problemas serían la malaposición y el daño del polímero que pueden conducir a una liberación no homogénea del fármaco antiproliferativo. Todo ello hace que la calcificación sea uno de los mayores determinantes de la puntuación SYNTAX6 y que se asocie con un peor resultado del ICP y con mayores tasas de eventos adversos en el seguimiento, incluyendo mortalidad en pacientes con lesiones gravemente calcificadas7. Adicionalmente, incrementa la tasa de complicaciones del procedimiento, relacionadas tanto con la propia calcificación como con las herramientas necesarias para su tratamiento: disección coronaria, pérdida de ramas laterales, atrapamiento del material de ICP, distorsión del stent o incluso pérdida de este, y la temida perforación coronaria que es especialmente grave dada la dificultad para avanzar el material de sellado8.
Para evitar estos problemas y sus implicaciones pronósticas se han desarrollado numerosos dispositivos de modificación de la placa, cuyo uso apropiado es esencial para realizar un ICP seguro y eficaz en lesiones calcificadas.
Este artículo de posicionamiento, promovido por la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología (ACI-SEC), que ha contado con distintos profesionales expertos en este ámbito, describe las técnicas de modificación de la placa disponibles en nuestro medio y propone un algoritmo de manejo de la lesión calcificada.
TÉCNICAS DE IMAGEN INTRACORONARIA PARA LA EVALUACIÓN DE LESIONES CALCIFICADAS
Las técnicas de imagen intracoronaria desempeñan un papel fundamental en la evaluación de las lesiones calcificadas. El uso de tomografía de coherencia óptica (OCT) o ecografía intravascular (IVUS) puede ser muy útil para mejorar la detección y la evaluación del calcio, para la selección de la técnica de modificación de la placa y para optimizar el resultado, en especial en relación con la expansión del stent.
Detección y evaluación de la calcificación
La angiografía es una técnica con una sensibilidad limitada para la detección de calcio. Tanto el IVUS como la OCT tienen mayores sensibilidad y especificidad, y permiten, a diferencia de la angiografía, evaluar las características y la extensión de la calcificación, que son aspectos fundamentales para determinar las opciones de tratamiento2,9. La tabla 1 muestra las diferencias de las 2 técnicas en cuanto a la detección del calcio. La diferencia fundamental entre ambas técnicas de imagen es que, dado que el calcio produce sombra posterior en el IVUS, no es posible evaluar de manera adecuada su grosor. Como marcador alternativo, la presencia de reverberaciones en el IVUS se ha asociado con la presencia de calcio más fino (< 0,5 mm). En la OCT, el calcio parietal no produce sombra posterior y, por tanto, se puede evaluar su grosor con precisión. El calcio nodular, sin embargo, produce sombra tanto en el IVUS como en la OCT (figura 1).
Tabla 1. Técnicas de imagen intracoronaria para la caracterización de lesiones calcificadas
| Técnica de imagen | Sensibilidad | Especificidad | Patrón calcio | Arco calcio | Longitud calcio | Grosor calcio | Desventajas |
|---|---|---|---|---|---|---|---|
| OCT | ++++ | ++++ | Calcio parietal: estructura de baja reflectividad con bordes bien delimitados sin sombra posterior (figura 1A) Nódulo de calcio: estructura protruyente en la luz con sombra posterior (figura 1C) |
Permite cuantificarlo | Permite cuantificarlo | Se puede medir | Requiere eliminar la sangre de la luz del vaso para obtener imágenes. Esto podría incrementar el volumen de contraste en comparación con el IVUS No permite una adecuada visualización de lesiones ostiales |
| IVUS | +++++ | ++++ | Calcio parietal: estructura hiperecogénica con sombra posterior (figura 1B) Nódulo de calcio: estructura protruyente en la luz con sombra posterior (figura 1D) |
Permite cuantificarlo | Permite cuantificarlo | No se puede medir debido a la sombra posterior Las reverberaciones son un marcador de calcio fino (< 0,5 mm) |
La sombra posterior dificulta la evaluación del grosor del calcio En el IVUS de 20 MHz. la limitada resolución y el artefacto de campo cercano pueden dificultar la definición de la profundidad del calcio respecto al lumen en lesiones graves |
|
IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica. |
|||||||
Figura 1. Evaluación del calcio con ecocardiografía intravascular (IVUS) y tomografía de coherencia óptica (OCT). A: calcio parietal en OCT, estructura de baja reflectividad con bordes bien delimitados (asterisco). B: calcio parietal en IVUS, estructura hiperecogénica con sombra posterior. C: nódulo de calcio en OCT, estructura protruyente en la luz con sombra posterior. D: nódulo de calcio en IVUS, estructura que protruye en la luz con sombra posterior.
Con ambas técnicas se han desarrollado escalas de puntuación (tabla 2) que incorporan las características de la calcificación que se han asociado a infraexpansión del stent. La primera escala desarrollada con OCT incluye 3 parámetros: arco del calcio > 180° (2 puntos), longitud del calcio > 5 mm (1 punto) y grosor del calcio > 0,5 mm (1 punto). Aquellas lesiones con una puntuación > 2 tienen riesgo de infraexpansión del stent si no se realiza una adecuada preparación de la placa5. Con IVUS se ha desarrollado una escala similar que utiliza 4 criterios: arco del calcio > 270° con más de 5 mm de longitud (1 punto), arco del calcio > 360° (1 punto), presencia de nódulo calcificado (1 punto) y vaso adyacente < 3,5 mm (1 punto). Una puntuación ≥ 2 indica la necesidad de realizar una técnica de modificación de la placa previa a la implantación del stent10.
Tabla 2. Escalas de puntuación del calcio coronario basadas en tomografía de coherencia óptica y ecografía intravascular
| OCT | IVUS | |||
|---|---|---|---|---|
| Puntos | Puntos | |||
| Máximo arco de calcio | ≤ 180° | 0 | ≤ 270° | 0 |
| > 180° (> 50%* circunferencia) |
2 | 270° y > 5 mm longitud | 1 | |
| 360° | 1 | |||
| Máximo grosor de calcio | ≤ 0,5 mm | 0 | ||
| > 0,5* mm | 1 | |||
| Longitud de calcio | ≤ 5 mm | 0 | ||
| > 5* mm | 1 | |||
| Tipo de calcio | No nodular | 0 | ||
| Nódulo | 1 | |||
| Diámetro del vaso | ≥ 3,5 mm | 0 | ||
| < 3,5 mm | 1 | |||
|
IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica. |
||||
Selección de las técnicas de modificación de la placa basada en la imagen intracoronaria
Las características del calcio evaluado por imagen intracoronaria pueden ayudar a seleccionar la técnica de modificación de la placa más adecuada. Este aspecto se desarrolla en profundidad en el último apartado del documento, pero en general aquellas lesiones en las que el calcio no tenga criterios de riesgo de infraexpansión se podrán tratar utilizando balones de alta presión o balones modificados (scoring o cutting), y cuando sí existan esos criterios será necesario aplicar técnicas de modificación de la placa más avanzadas. Además de estos criterios, también habrá que tener en cuenta la profundidad del calcio, dado que algunas técnicas actúan fundamentalmente en la porción superficial y no profunda de la placa.
Optimización de la implantación del stent basada en la imagen intracoronaria
Tanto el IVUS como la OCT permiten determinar si se ha obtenido una adecuada expansión del stent. Este aspecto es en especial relevante en las lesiones calcificadas, que son las que más se asocian a infraexpansión, y esta es el parámetro más fuertemente relacionado con el fracaso del stent11. La correcta aposición y la ausencia de disección o hematoma significativo en los bordes, así como una adecuada cobertura de la lesión, son los otros parámetros de optimización por la imagen que deben evaluarse tras la implantación de un stent12.
TÉCNICAS INDEPENDIENTES DE BALÓN
Aterectomía rotacional
La aterectomía rotacional (AR) es una técnica que utiliza una oliva metálica recubierta de cristales de diamante en su tercio distal que rota a alta velocidad y realiza un corte diferencial al avanzar por el vaso (figura 2A), pulverizando el tejido calcificado a la vez que preserva el tejido elástico adyacente13.
Figura 2. Dispositivos de modificación de la placa. A: dispositivo de aterectomía rotacional. B: dispositivo de aterectomía orbitacional. C: dispositivo de láser coronario con los dos modelos de consola existentes. D: dispositivo de litotricia intravascular. (Modificada con permiso de Cubero-Gallego et al.13)
Surgió hace más de 30 años en un intento de facilitar el tratamiento de las lesiones coronarias mediante la reducción de la carga de placa. El entusiasmo inicial comportó un gran uso de la AR en diversos contextos, no sustentado por estudios científicos. Esto se tradujo en resultados subóptimos14 que derivaron en una reducción de su empleo para casos muy seleccionados. Durante todos estos años, la AR ha evolucionado con mejoras tecnológicas, de la técnica en sí y en la selección de los pacientes.
Actualmente está disponible el sistema ROTAPRO (Boston Scientific, Estados Unidos), que facilita la técnica al haber sustituido el pedal de la versión inicial por un botón ubicado en la parte superior del avanzador de la oliva. Hay otro botón en el lateral del avanzador que permite cambiar al modo dynaglide (rotación a bajas revoluciones, recomendable para introducir y extraer la oliva). La consola es más pequeña y con pantalla digital. Existen olivas de entre 1,25 y 2,5 mm compatibles con catéteres de 6-8 Fr en función de su tamaño. La oliva se avanza sobre una guía específica de 0,009 pulgadas (0,014 en la parte radioopaca), de la que existen 2 versiones (RotaWire Floppy y RotaWire Extra-Support) que se utilizan dependiendo de las características de la placa y del soporte necesario13.
La principal indicación son las lesiones gravemente calcificadas no cruzables o no dilatables con balón. Probablemente, el escenario óptimo es una lesión calcificada concéntrica con un área luminal mínima menor que la oliva. Las lesiones excéntricas y anguladas son menos favorables, ya que conllevan un incremento del riesgo de complicaciones13,15. Se puede realizar como estrategia primaria o de rescate tras un «fallo de balón»; la estrategia primaria se ha asociado con una reducción de la duración del procedimiento, de la radiación y del contraste, y posiblemente con un ahorro de material15.
También ha evolucionado el objetivo de la AR, pasando del antiguo concepto de retirar cuanta más placa mejor (debulking) al más moderno de modificar la placa y «facilitar» el ICP. Esto ha hecho evolucionar las recomendaciones técnicas para realizar la AR. Las recomendaciones actuales se describen en la tabla 3.
Tabla 3. Recomendaciones para el empleo seguro de la aterectomía rotacional
| Acceso arterial | Depende del tamaño máximo de oliva que se vaya a emplear. En la actualidad, el más empleado es el radial porque permite el uso de olivas de hasta 1,75 mm (si el catéter es de 6 Fr) o 2,15 mm (si el catéter es de 7 Fr) |
| Catéter guía | Se aconsejan los de curva simple de alto soporte |
| Guía | El posicionamiento de la guía de manera directa suele ser factible, aunque se puede utilizar una guía convencional y realizar el intercambio mediante microcatéter o balón coaxial En función de las características de la lesión, puede optarse por RotaWire Floppy o Extrasupport |
| Tamaño de la oliva | Es recomendable el empleo de olivas pequeñas para mantener una proporción oliva/arteria ≤ 0,5. La oliva más empleada es la de 1,5 mm. En algunos casos es aconsejable el incremento progresivo del tamaño de la oliva |
| Velocidad de rotablación | Selección de velocidades de rotablación < 180.000 rpm, idealmente entre 135.000 y 150.000 rpm. Reservar las altas velocidades para casos en los que la oliva no es capaz de cruzar pese a una técnica óptima. Prestar especial atención a evitar caídas > 5.000 rpm durante la rotablación |
| Tiempo de ablación | Una menor duración de los periodos de ablación (idealmente ≤ 15 s) reduce el riesgo de complicaciones (bloqueo auriculoventricular, enlentecimiento del flujo) |
| Movimientos de ablación | Movimientos graduales, continuos, de avance y retroceso (pecking) |
| Solución de lavado | Debe usarse solución salina heparinizada con vasodilatadores/espasmolíticos (verapamilo, nitratos) |
| Marcapasos | El uso de olivas de menor diámetro y de velocidades más bajas, y el posicionamiento de la oliva con el modo dinaglyde, han reducido sustancialmente el número de bloqueos auriculoventriculares transitorios durante la rotablación En casos seleccionados, sobre todo en la coronaria derecha o la circunfleja dominante, podría valorarse el empleo preventivo de atropina intravenosa o el implante de un marcapasos transitorio |
La complicación más frecuente es el fenómeno de slow/no-flow, aunque su incidencia ha disminuido hasta un 2,6%17. Se produce por embolización de residuos en la microcirculación y existe más riesgo en lesiones largas en las que se realizan pasadas múltiples y prolongadas con olivas grandes, sin pausas adecuadas entre ellas, y cuando existe mal vaso distal. En caso de tratar la coronaria derecha o las circunflejas dominantes, puede asociarse a trastornos de conducción transitorios. Más infrecuentes son las complicaciones graves como el atrapamiento de la oliva, la perforación y la disección coronaria13. La gravedad de la lesión, las angulaciones marcadas y el uso de olivas muy pequeñas son factores predisponentes para el atrapamiento de la oliva. La tortuosidad, así como la falta de coaxialidad del catéter guía en el tratamiento de lesiones ostiales, pueden favorecer la ocurrencia de disecciones y perforaciones coronarias.
Aunque la AR ha demostrado facilitar el ICP con una mayor tasa de éxito que la angioplastia con balón, no se ha comprobado un claro beneficio clínico18-21.
Para analizar sus resultados hay que destacar que la AR se ha usado en pacientes de mayor riesgo clínico y con lesiones más complejas22. Otro aspecto que debe considerarse es el gran porcentaje de casos en los que está técnica se ha empleado como rescate (12-50%)20,21,23, por lo que es de suponer que sin AR no se habrían podido realizar o tendrían peores resultados. Aunque hay estudios en marcha para determinar las ventajas de la AR electiva o de rescate, la correcta evaluación del paciente y de la lesión coronaria debería inclinarnos a aumentar su uso electivo, o más precoz, con un potencial impacto beneficioso en los resultados24.
En conclusión, la AR realizada conforme a las recomendaciones actuales es segura y eficaz. Debería contarse con ella entre las diversas herramientas disponibles en nuestros laboratorios de cardiología intervencionista y asegurar la formación de todo el personal para su correcto uso.
Aterectomía orbitacional
El dispositivo Diamonback-360 (OAS) (Cardiovascular Systems, Estados Unidos) consiste en una corona orbital bidireccional diamantada que utiliza una combinación de fuerza centrífuga (creando órbitas elípticas) y rozamiento de la superficie para modificar la placa calcificada y aumentar la distensibilidad (figura 2B). Además, con el impacto pulsátil de la corona al incrementar la velocidad, puede crear microfracturas que modifican el calcio profundo (figura 2B y figura 3). Debido a esto, una sola corona de 1,25 mm puede tratar vasos desde 2,5 hasta 4 mm.
Figura 3. Características del catéter de aterectomía orbitacional y sus efectos. (Modificada con permiso de Cardiovascular Systems25.)
En comparación con el resto de las técnicas de modificación de la placa, la aterectomía orbitacional (AO) es la que más tarde se ha introducido en nuestro país y aún es escasa la experiencia con ella.
Su principal indicación es el tratamiento de lesiones calcificadas no dilatables26.
El procedimiento de preparación es muy similar al de la AR, pero es necesaria una guía específica, la Viper-Wire (0,012 pulgadas (0,014 la parte radiopaca). La corona se avanza con el sistema Glide-Assist (rotación a bajas revoluciones) hasta posicionarse cerca de la lesión. Otra característica diferencial del dispositivo es la posibilidad de realizar la ablación de manera anterógrada y retrógrada. A diferencia de la AR, la velocidad de avance del dispositivo debe ser muy lenta (1-3 mm/s) para asegurar un buen resultado del procedimiento y disminuir las complicaciones17,26. El mecanismo de acción de la AO consiste en una rotación elíptica de la corona, que consigue un aumento progresivo del diámetro orbital a medida que se aumenta la velocidad de rotación de 80.000 a 120.000 rpm. Se recomiendan ciclos ≤ 30 s (existe una señal sonora de aviso para terminar el ciclo) con pausas de 20-30 s entre ellos, que pueden duplicarse si ha habido mala tolerancia hemodinámica26. Es necesaria la infusión continua de una solución lubricante para ayudar a minimizar las lesiones térmicas durante la AO; además, se administran aproximadamente 18 ml/min de líquido para ayudar a refrigerar el dispositivo y a eliminar los residuos, disminuyendo así la isquemia y la embolización distal13,26,27.
Las complicaciones son similares a las descritas para la AR. No obstante, la aplicación retrógrada disminuye la probabilidad de atrapamiento de la corona y puede reducir el riesgo de disección o perforación en lesiones anguladas u ostiales. La incidencia de perforación es del 0,7-2%28,29. Los residuos que se producen con la AO teóricamente son de menor tamaño que los producidos con la AR, y esto, unido a que la corona no impide el flujo coronario durante la aterectomía, reduce el riesgo de fenómeno de slow/no-reflow, así como la lesión térmica endotelial27. Sin embargo, no son raros los trastornos de la conducción transitorios cuando se trata la coronaria derecha o la circunfleja dominante.
La evidencia actual se basa en los estudios ORBIT I30 y ORBIT II28, en los que la AO obtuvo buenos resultados en cuanto a éxito del procedimiento (94 y 89%, respectivamente), con tasas de eventos cardiovasculares adversos mayores (MACE) del 23,5% y de revascularización de la lesión diana del 7,8% a los 3 años31. Posteriormente se realizó el estudio COAST29, en el que se utilizó el nuevo sistema MicroCrown. En él se incluyeron 100 pacientes, con una tasa de éxito del procedimiento del 85% y una tasa de MACE del 22,2% al año de seguimiento. Estamos en espera de los resultados del estudio ECLIPSE, que aleatorizará 2.000 pacientes con calcificación grave para ser tratados con AO o con predilatación con balón antes del implante de un stent farmacoactivo.
En resumen, la AO es una técnica de modificación del calcio complementaria al resto con potenciales ventajas técnicas, como tener un solo tamaño de corona compatible con 6 Fr para tratar todas las lesiones y la posibilidad de aplicación en retroceso. Aunque faltan datos de estudios comparativos, su elección dependerá del perfil del paciente y de la lesión que se vaya a tratar, siendo la imagen intracoronaria un aspecto esencial.
Láser Excimer
La angioplastia coronaria con láser Excimer (ELCA) se basa en un láser de cloruro de xenón que genera pulsos cortos de luz ultravioleta de 308 nm que penetran solo 50 µm, y esto lo hace más seguro en comparación con los antiguos láseres infrarrojos de onda continua. Modifica la placa mediante un triple mecanismo: fotoquímico (rotura de enlaces moleculares), fototérmico (vaporización tisular) y fotocinético (expansión y colapso de la burbuja de la punta del catéter durante su avance). Los fragmentos liberados son < 10 μm, lo cual minimiza la afectación microvascular al ser absorbidos por el sistema reticuloendotelial.
El sistema actual es el CVX-300 Laser System (Philips), aunque ya existe uno de nueva generación, el LAS-100 Laser System (Philips), que lo sustituirá próximamente (figura 2C). Existen diferentes tamaños de catéteres (0,9, 1,4, 1,7 y 2,0 mm) (tabla 4), cuya selección depende del tipo de lesión y del tamaño del vaso (ratio catéter/diámetro del vaso: 0,5-0,6), siendo el más usado el de 0,9 mm por su menor perfil y porque alcanza mayor fluencia (80 mJ/mm2), tasa de repetición de pulso (80 Hz) y duración de la aplicación (10 s con 5 s de reposo), aumentando las probabilidades de éxito en placas fibrocalcificadas32,33.
Tabla 4. Características de los catéteres de angioplastia coronaria con láser Excimer
| 0,9 mm-X 80 | 1,4 mm | 1,7 mm | 2 mm | |
|---|---|---|---|---|
| Catéter guía compatible | 6 Fr | 6/7 Fr | 7 Fr | 8 Fr |
| Diámetro mínimo del vaso (mm) | 2 | 2,2 | 2,5 | 3 |
| Energía (mJ/mm2) | 30-80 | 30-60 | 30-60 | 30-60 |
| Frecuencia (Hz) | 25-80 | 25-40 | 25-40 | 25-40 |
| Tiempo de aplicación/pausa (s) | 10/5 | 5/10 | 5/10 | 5/10 |
Antes de su uso es necesario primero calibrar la consola y luego el catéter. En ambos momentos, todos los profesionales y el paciente deben usar gafas protectoras para evitar daños oculares. Posteriormente, se introduce a través de cualquier guía coronaria de 0,014 pulgadas hasta alcanzar la lesión; existe un sistema monorraíl que facilita su avance. La energía se libera a través del extremo distal del catéter mientras se avanza muy lentamente (0,5 mm/s) para modificar la placa; también se puede aplicar en retirada. Es importante optimizar el soporte para asegurar el avance del catéter. No existe un límite de pulsos y tiene mayor efecto cuantos más se usen, aunque también comporta un mayor riesgo de complicaciones. Algunos autores sugieren un máximo de 12 aplicaciones33. Es conveniente valorar el estado del vaso tras cada aplicación. En cuanto a la selección de los parámetros, tradicionalmente se iniciaba a 45 mJ/mm2 y 25 Hz, pero cada vez más operadores optan por unas mayores energía y frecuencia iniciales, sobre todo para tratar lesiones resistentes o calcificadas33.
Antes y durante las aplicaciones se recomienda lavar el vaso de sangre y contraste con una infusión de solución salina fisiológica (1-3 ml/s). En lesiones resistentes, con calcificación grave o stents infraexpandidos, puede requerirse una mayor energía. Esta puede alcanzarse no lavando la sangre con solución salina fisiológica o incluso administrando contraste durante las aplicaciones («técnica de explosión»). Esta técnica alcanza la máxima potencia, pero incrementa el riesgo de complicaciones. Algunos autores33 la recomiendan como primera opción en lesiones no trombóticas, aunque parece prudente reservarla para lesiones resistentes a ELCA con infusión salina.
Las indicaciones de la ELCA se han clasificado tradicionalmente en dos grupos: lesiones «trombóticas» (no abordadas en este documento) y lesiones «calcificadas» (no trombóticas, como reestenosis en el interior del stent, oclusiones crónicas, lesiones calcificadas, etc.). Estas últimas pueden dividirse en lesiones no cruzables y no dilatables, en las que a continuación se describe la utilidad de la ELCA.
Lesiones no cruzables
La principal ventaja del láser es su compatibilidad con cualquier guía coronaria. Así, las lesiones no cruzables con balón/microcatéter constituyen su principal indicación17. En un registro multicéntrico de lesiones no cruzables, el éxito del procedimiento fue del 87,3%, con un 0,8% de disecciones con afectación del flujo y ninguna perforación34. La calcificación grave se ha asociado a mayor probabilidad de fallo de la técnica34, ya que parece que la ablación la realiza fundamentalmente en los tejidos que hay entre el calcio35. Sin embargo, la utilización de ELCA con contraste podría incrementar el éxito en estas lesiones33.
Lesiones no dilatables
Aunque el éxito de la ELCA en lesiones no dilatables es alto36, habitualmente no es el tratamiento de primera línea. Dentro de estas lesiones, un escenario interesante son las lesiones en el interior del stent (reestenosis o infraexpansión). En la infraexpansión aguda, la ELCA podría ser el tratamiento de elección. Permite modificar el tejido resistente detrás del stent sin alterar su arquitectura. Su utilización con contraste podría ser más segura por el efecto «protector» del stent. Se han publicado casos aislados y series pequeñas con tasas de éxito superiores al 95% y pocas complicaciones37.
Es una técnica segura cuando se realiza según las recomendaciones. La disección coronaria es la complicación más frecuente (5%), aunque es poco habitual que sea limitante de flujo (1%). La frecuencia de perforación coronaria es < 1%38, y la embolización distal y las arritmias ventriculares son excepcionales39.
En conclusión, la ELCA es una técnica especialmente útil en lesiones no cruzables debido a su compatibilidad con cualquier guía de angioplastia. También ha demostrado su eficacia en lesiones no dilatables, incluidas las lesiones en el interior del stent. Sin embargo, aún falta información sobre su eficacia en lesiones calcificadas.
TÉCNICAS DEPENDIENTES DE BALÓN
Balones de corte y de scoring
Los balones de corte (BC) son dispositivos de modificación de la placa que aparecieron como una alternativa a los antiguos balones de angioplastia coronaria40. Su objetivo es lograr una rotura controlada de la placa (con incisiones en el tejido fibrocálcico) (figura 4), facilitando la expansión de los balones, minimizando el daño de la íntima y disminuyendo la reestenosis18,41.
Figura 4. Técnica Rotacutting. Efecto de la aterectomía rotacional (AR) y del balón de corte (Rotacutting) posterior con mayor modificación de la placa y área luminal mínima.
Existen dos tipos: el BC y el balón de scoring (BS). Se ha descrito su uso en diferentes escenarios, como reestenosis en el interior del stent, lesiones aortoostiales, bifurcaciones y vaso pequeño asociado a uso de balón farmacoactivo42.
Las principales limitaciones de los BC son sus peores navegabilidad y perfil de cruce en comparación con los balones convencionales, aunque en los últimos años han mejorado estos aspectos. Los BS tienen una mejor navegabilidad que los antiguos BC.
La complicación más temida es la rotura coronaria, pero no se ha demostrado un incremento significativo con su uso.
La principal diferencia entre los dispositivos disponibles radica en sus diferentes elementos externos de aterotomía, que se describen a continuación (figura 5).
Figura 5. Características de balones modificados. A: balón de corte (Boston Scientific, Estados Unidos). B: WOLVERINE (Boston Scientific, Estados Unidos). C: AngioSculpt (Spectranetics, Estados Unidos). D: Scoreflex (OrbusNeich, Hong Kong ). E: Grip (Acrostak, Suiza). F: NSE-Alpha (B. Braun, Alemania). G: Naviscore (iVascular, España).
Cutting Balloon Flextome
El Cutting Balloon Flextome (Boston Scientific, Estados Unidos) consiste en un balón NC (no distensible) con 3 microcuchillas montadas longitudinalmente sobre la superficie. No ha demostrado superioridad sobre los balones convencionales en lesiones A/B, por lo que su uso se limita solo a lesiones complejas17 y calcificadas43.
WOLVERINE
El Wolverine (Boston Scientific, Estados Unidos) es la evolución del anterior, con mejor perfil de cruce, mayor flexibilidad y punta más visible.
AngioSculpt
El AngioSculpt (Spectranetics, Estados Unidos) consiste en un balón semidistensible con bajo perfil de cruce, rodeado de forma helicoidal por 3 filamentos de nitinol que aseguran el anclaje del balón, con menor riesgo de disección o perforación17. Es un dispositivo más flexible y tiene una mejor navegabilidad que el antiguo BC44, con buenos resultados en comparación con la dilatación con balón semidistensible45.
Scoreflex
El Scoreflex (OrbusNeich, Hong Kong) es un BS compuesto por un balón NC con un sistema de doble alambre de nitinol que facilita la modificación controlada de la placa a baja presión. Tiene un bajo perfil y posee una combinación de revestimiento hidrófilo e hidrófobo que minimiza la fricción durante el cruce de la lesión.
Grip
El Grip (Acrostak, Suiza) es un balón de alta presión con 4 hileras de 3 o 4 protuberancias cada una. Permite dilatar hasta 22 atm. Tiene una punta cónica en dos versiones: Grip, con punta corta de 2 mm, y Grip TT, con punta larga de 4 mm para una mayor navegabilidad en anatomías tortuosas. Tiene un recubrimiento hidrolubricado en la punta y en el catéter (no en el balón), lo que facilita su anclaje en la lesión a la vez que su navegabilidad hasta esta.
NSE Alpha
El NSE Alpha (B. Braun, Alemania) es un BS con 3 elementos de scoring de nailon y una sección triangular de corte unidos solo en ambos extremos del balón y dispuestos en 120°. Destacan su flexibilidad y navegabilidad, con buenos resultados en lesiones de novo y en reestenosis en el interior del stent18.
NaviscoreTM
El NaviscoreTM (iVascular, España) es un BS con un diseño que combina los beneficios del BS y del BC. Consiste en un balón de alta presión con filamentos de nitinol de unas 125 µm de grosor. Los filamentos tienen una orientación axial que permite una mayor capacidad de cruce y más flexibilidad, además de una modificación de la placa en angulación de 90° con menos riesgo de perforación. El recubrimiento hidrófilo del catéter permite mejorar su navegabilidad.
En conclusión, los BC y los BS son dispositivos de modificación de la placa útiles en lesiones no dilatables cuando la calcificación no es muy grave. Su principal ventaja es su facilidad de uso, al ser una técnica con balón compatible con guías de angioplastia convencionales.
Balones de muy alta presión
El balón NC de muy alta presión (BMAP) OPN (SIS medical, Suiza) es un balón de doble capa que permite una expansión homogénea, a muy alta presión, sin aumentar su diámetro. Está disponible con diámetros de 2 a 4 mm y presión de rotura de 35 atm, aunque testado en fábrica hasta 45 atm (tabla 5)46.
Tabla 5. Distensibilidad del balón de muy alta presión OPN NC
| Presión (atm) | OPN NC 2,0 (mm) | OPN NC 2,5 (mm) | OPN NC 3,0 (mm) | OPN NC 3,5 (mm) | OPN NC 4,0 (mm) |
|---|---|---|---|---|---|
| 10 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 |
| 20 | 2,1 | 2,6 | 3,14 | 3,67 | 4,19 |
| 30 | 2,18 | 2,7 | 3,29 | 3,85 | 4,37 |
| 35 | 2,2 | 2,77 | 3,36 | 3,91 | 4,41 |
|
NC: no distensible. |
|||||
El BMAP lleva usándose más de 10 años y ha demostrado ser seguro y eficaz hasta 40 atm en lesiones gravemente calcificadas tras el fallo de otros dispositivos y en la infraexpansión del stent, con tasas de éxito del 75-100% sin evidencia de disección, perforación ni rotura del balón en pequeñas series de casos47. Comparado con el balón NC convencional en lesiones no dilatables, ha demostrado obtener un diámetro luminal mínimo y una ganancia aguda mayores, con menor estenosis residual48.
En el mayor registro hasta la fecha se incluyeron 326 pacientes con lesiones no dilatables en los que se usó el BMAP tras el fallo de un balón NC. Los pacientes se dividieron en dos grupos: los que respondieron con presiones de 30-40 atm y los que respondieron con presiones > 40 atm. El éxito del procedimiento se alcanzó en el 96,6% de los pacientes. El 53% respondieron a presiones de 30-40 atm, mientras que el 47% restante lo hicieron a presiones > 40 atm. A 180 de los pacientes se le realizó imagen intracoronaria, y de estos, 106 presentaron calcificación > 270°. En este subgrupo de pacientes, la presión requerida para una óptima expansión fue > 40 atm en el 78,3% de los casos. Tres pacientes (0,9%) presentaron roturas coronarias, que fueron resueltas con inflados prolongados o implante de stents cubiertos. En los 3 casos, la rotura ocurrió en la predilatación y se asoció a la rotura del balón, con presiones de 30-40 atm, lo cual sugiere que la perforación no parece estar relacionada con la presión de inflado sino con las características de la placa o con la estimación del tamaño del vaso, que en los 3 casos fue por angiografía49.
En el año 2021 se publicó el estudio ISAR-CAL50, en el que se aleatorizaron 70 pacientes con lesiones coronarias gravemente calcificadas y predilatación fallida con balón NC para ser tratados con BS o con BMAP. El objetivo principal fue comparar la expansión del stent por OCT. No hubo diferencias en el porcentaje de expansión del stent, pero sí en objetivos secundarios angiográficos como la mejoría del diámetro luminal mínimo y la estenosis residual, a favor del BMAP50.
Por último, las oclusiones crónicas son el máximo exponente de lesiones calcificadas y complejas. En el estudio PLACCTON, el uso de BMAP, tanto de forma aislada como combinado con otras técnicas de modificación de la placa, resultó seguro y eficaz en casos seleccionados de oclusiones crónicas51.
En conclusión, el BMAP es una alternativa segura y eficaz en lesiones calcificadas no dilatables. Faltan estudios aleatorizados que nos permitan definir mejor la estrategia para el uso de dicho dispositivo y del resto de las técnicas de modificación de la placa.
Litotricia intracoronaria
El sistema de litotricia intracoronaria (LIC) está formado por un catéter balón específico (Shockwave Medical, Estados Unidos) que se conecta a un generador portátil recargable (figura 2D). El generador produce pulsos de energía que se transmiten a unos emisores situados en el interior del balón. Los pulsos se emiten a una frecuencia de 1 por segundo, hasta un máximo de 10 pulsos por aplicación. Cada catéter balón puede administrar un máximo de 80 pulsos. El catéter consiste en un balón semidistensible de recambio rápido con un perfil de cruce de 0,042 pulgadas que es compatible con cualquier guía de 0,014 pulgadas y con catéteres guía de 6 Fr.
Su principal indicación son las lesiones calcificadas no dilatables.
Se recomienda una relación 1:1 entre el diámetro del vaso y el del balón. Una vez posicionado en la lesión, el balón se hincha a 4 atm para asegurar un buen contacto entre la superficie del balón y la pared vascular, que facilite la transmisión de la energía. El balón tiene en su interior 2 emisores que reciben una descarga eléctrica proveniente del generador, con lo que se vaporiza el líquido que hay en su interior y se generan ondas sónicas que provocan un efecto local. Cada pulso libera el equivalente a 50 atm.
Estas ondas atraviesan el tejido blando causando microfracturas selectivas del calcio a nivel de las capas íntima y media. Tras la emisión de pulsos y la correspondiente modificación del calcio, el balón se infla hasta 6 atm para maximizar la ganancia luminal. El catéter balón está disponible con una longitud única de 12 mm y con diámetros de 2,5, 3,0, 3,5 y 4,0 mm52.
La mayor evidencia disponible proviene del estudio Disrupt-CAD III, un registro prospectivo que evaluó la eficacia y la seguridad de la LIC en 431 pacientes con lesiones calcificadas. La incidencia de MACE (muerte, infarto o revascularización de la lesión diana) a 30 días fue del 7,8% y la efectividad (éxito del procedimiento con estenosis en el interior del stent < 50%) fue del 92,4%. En este estudio no se incluyeron pacientes con infarto agudo de miocardio ni con lesiones complejas53. Recientemente se han publicado los resultados del seguimiento a 12 meses, en el que se objetivó una incidencia de MACE del 13,8%, con una tasa de trombosis del stent del 1,1%54.
La base del tratamiento con balón de LIC es una fractura controlada del calcio coronario. En un subestudio con OCT del Disrupt-CAD II tras la LIC se observaron fracturas en el calcio en el 79% de las lesiones55, frente a un 67% de las lesiones en el estudio Disrupt-CAD III53.
A pesar de que el uso del balón de LIC se ha extendido en todo el mundo, todavía hay poca información sobre la seguridad y la eficacia de su uso en contextos complejos (síndrome coronario agudo, oclusiones crónicas, bifurcaciones o lesiones aortoostiales), y muchas veces esta se limita a casos aislados o series cortas52. Las principales limitaciones del sistema son una capacidad de cruce reducida en estenosis graves calcificadas o tortuosas y su dificultad de uso en lesiones difusas o multivaso (por el número limitado de pulsos por catéter y el diferente calibre de los vasos a tratar).
Un estudio ha valorado el uso del dispositivo en stents infraexpandidos por calcificación coronaria grave, y ha objetivado un éxito angiográfico de hasta el 73%, inferior al 95% observado en lesiones nativas56, probablemente porque sea aún más difícil expandir una lesión calcificada cuando el stent ya está implantado. Por ello, con independencia de la técnica usada, es recomendable no implantar el stent hasta haber preparado adecuadamente la lesión. Además, la aplicación de litotricia en este contexto, en especial sobre stents recién implantados, podría producir daños estructurales en el polímero57. Otro registro multicéntrico ha mostrado un éxito del dispositivo del 92,3% en este tipo de lesiones58. Faltan datos a medio y largo plazo sobre la seguridad de esta técnica en dicho escenario.
Se ha descrito el uso combinado de balón de LIC con otros dispositivos modificadores de la placa, como AR59, AO60 o ELCA61, y parece una estrategia muy atractiva en casos en los que no se consiga llegar con el balón de LIC hasta la lesión diana.
En conclusión, la LIC ha tenido un crecimiento exponencial en el tratamiento de las lesiones calcificadas no dilatables, por su seguridad, eficacia y corta curva de aprendizaje. Sin embargo, falta información sobre su uso en escenarios complejos y sus resultados en comparación con otras técnicas de modificación de la placa.
TÉCNICAS COMBINADAS
No hay mucha evidencia sobre la combinación de dispositivos o de técnicas de modificación de la placa en lesiones gravemente calcificadas.
La realización de AR seguida de BC (RotaCutting) (figura 4) o de litotricia (RotaTripsy) (figura 6) se ha descrito como técnica complementaria, segura y eficaz62-64. En ambos casos, el concepto es similar. La AR afecta principalmente al calcio superficial, pero no al más profundo, y en ocasiones es insuficiente para preparar adecuadamente la placa. Por otro lado, el BC o la litotricia podrían complementar la acción de la AR en la modificación de la placa. Sin embargo, si la lesión calcificada determina una estenosis muy grave, puede ser difícil alcanzar con estos balones la lesión diana. En su uso combinado, la AR modifica el calcio superficial creando un túnel que permite avanzar el BC o el balón de litotricia, que una vez posicionado completa la modificación de la placa. Como diferencias entre ambas técnicas, hay que tener en cuenta que el BC puede ayudar a la fractura del calcio si no existe una calcificación muy grave. La técnica RotaTripsy59,63 puede ser más eficaz para lesiones gravemente calcificadas con calcio grueso, pero tiene un mayor coste. Con un concepto similar, se ha descrito la combinación de AO con litotricia, con buenos resultados60.
Figura 6. Técnica Rotatripsy. A: estenosis grave muy calcificada en la arteria descendente anterior. Ecografía intravascular (IVUS) que muestra calcificación de 360°. B: aterectomía rotacional (AR) (oliva de 1,5 mm). C: infraexpansión de balón no distensible de 3 mm tras la AR. D: litotricia intracoronaria con balón de 3 mm con adecuada expansión a 6 atm tras 50 pulsos. E-G: IVUS y tomografía de coherencia óptica que muestran el efecto combinado de la AR y la litotricia con múltiples zonas de «limado/disección» intimal provocados por la AR (asteriscos) y fracturas intimales y profundas producidas por la litotricia. H: resultado final tras el implante de un stent.
La AR también se ha combinado con ELCA (técnica RASER)65. El láser puede ser la única opción en lesiones verdaderamente no cruzables para facilitar el avance de un microcatéter y así realizar el intercambio por la RotaWire y completar el ICP. Esto podría aplicarse de forma similar combinando el láser con la AO.
Se ha descrito la combinación de ELCA y litotricia (técnica ELCATripsy) para casos en los que la AR o la AO no son recomendables, como lesiones cercanas o a nivel de stents recientemente implantados. En estos casos, el láser podría crear un túnel que facilite el avance del balón de litotricia sin riesgo de dañar el stent recién implantado61.
ALGORITMO PARA EL TRATAMIENTO ÓPTIMO DE LAS LESIONES CORONARIAS CALCIFICADAS
Para la elección de la estrategia de modificación de la placa hay que conocer las particularidades de las distintas técnicas, así como sus indicaciones y sus riesgos (tabla 6). Además, hay que tener en cuenta el perfil clínico del paciente, las características de la lesión, los medios disponibles y las capacidades del operador. En algunos casos complejos, puede ser razonable no realizar el ICP ad hoc para planificarlo adecuadamente e incluso realizar la angioplastia entre dos operadores expertos.
Tabla 6. Comparación de las distintas técnicas de modificación de la placa
| Técnicas que no utilizan balón | Técnicas que utilizan balóna | ||||||
|---|---|---|---|---|---|---|---|
| AR | AO | ELCA | BC | BS | BMAP | LIC | |
| Características técnicas | |||||||
| Descripción de la tecnología | Oliva con punta diamantada que rota a alta velocidad | Corona diamantada con rotación elíptica | Energía ultravioleta con efectos fotoquímico, fototérmico y fotocinético | Balón NC con microcuchillas longitudinales | Balón SC con elementos de scoring en la superficie | Balón NC de doble capa que permite muy alta presión | Balón SC que emite energía mecánica pulsátil |
| Mecanismo de acción | Corte diferencial/abrasión anterógrada Efecto adicional derivado de la vibración de la corona (+) |
Lijado diferencial/abrasión anterógrada y retrógrada Efecto adicional derivado de la vibración dela corona (+++) |
Fotoablación/vaporización | Corte superficial de la placa | Corte superficial de la placa | Inflado a 35-40 atm | Litotricia/fragmentación del calcio |
| Tamaños de dispositivos | Oliva de 1,25-2,5 mm | Corona de 1,25 mm | Catéteres de 0,9-2 mm | 2-4 mm | 1,47-4 mm | 1,5-4 mm | 2,5-4 mm |
| Catéter guía compatible* | 6 Fr; 1,25 y 1,5 mm 7 Fr; 1,75 mm 8 Fr; 2,0 y 2,15 mm 9 Fr; 2,25 y 2,38 mm 10 Fr; 2,50 mm |
6 Fr | 6 Fr; 0,9 y 1,4 mm 7 Fr; 1,7 mm 8 Fr; 2,0 mm |
6 Fr | 6 Fr (algunos con 5 Fr) | 6 Fr | 6 Fr |
| Tipo de guía compatible | RotaWire 0,009 pulgadas (0,014 la parte radiopaca) | ViperWire 0,012 pulgadas (0,014 la parte radiopaca) | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas |
| Tipo de consola/sistema | Pequeña sin pedal (RotaPro) | Pequeña sin pedal | Grande con pedal | – | – | – | Pequeña sin pedal |
| Indicaciones y efectos | |||||||
| Indicación principal | Modificación de la placa (lesiones calcificadas no dilatables o solo cruzables por microcatéter) | Modificación de la placa (lesiones calcificadas no dilatables o solo cruzables por microcatéter) | Modificación de la placa (lesiones no cruzables, lesiones no dilatables en el interior del stent) | RIS | RIS | Optimización de la expansión del stent | Modificación de la placa calcificada |
| Efecto sobre calcio intimal o profundo | Intimal | Intimal y profundo | Intimal y profundo | Intimal | Intimal | Intimal | Intimal y profundo |
| RIS | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Infraexpansión de stent | Solo crónica | Solo crónica | Aguda o crónica | – | – | Aguda o crónica | Solo recomendable en crónica |
| Ventajas | Útil en lesiones no cruzables con balón Mayor disponibilidad que AO/ELCA |
Posibilidad de aplicación retrógrada (útil en lesiones anguladas/ostiales) Una sola corona para todos los casos compatible con 6 Fr |
No necesidad de guía específica Catéter de 0,9 (el más frecuente) compatible con 6 Fr Elección en lesiones no cruzables con balón y microcatéter Permite guía en ramas laterales |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales Menor coste |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales Menor coste |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales Menor coste. |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales |
| Desventajas | Curva de aprendizaje larga Necesidad de guía específica Necesidad de catéter guía de gran Fr para olivas grandes |
Curva de aprendizaje larga Necesidad de guía específica Peor capacidad de cruce en lesiones no cruzables con balón Se requiere un lubricante específico que está contraindicado en pacientes alérgicos al huevo y la soja |
Curva de aprendizaje intermedia Consola voluminosa y necesidad de calentamiento y calibrado |
Limitada capacidad de cruce No útil en calcificación muy grave |
No útil en calcificación muy grave | Limitada capacidad de cruce | Limitada capacidad de cruce Límite de pulsos por catéter |
| Complicaciones | |||||||
| Perforación/disección mayor | Moderado | Moderado | Moderado | Bajo/moderado | Bajo/moderado | Bajo/moderado | Bajo |
| Slow/no-flow | Moderado | Moderado | Bajo | Bajo | Bajo | Bajo | Bajo |
| Bloqueo auriculoventricular | Moderado en CD/CX dominantes | Moderado en CD/CX dominantes | Bajo | Bajo | Bajo | Bajo | Bajo |
| Atrapamiento | Moderado (mayor con oliva de 1,25 mm y en lesiones graves y anguladas) | Bajo | Bajo | Bajo | Bajo | Bajo (no infrecuente atrapamiento sobre la guía; valorar una segunda guía paralela) | Bajo |
| Recomendaciones técnicas | Velocidad 135.000-180.000 Relación dispositivo/vaso ≤ 0,6 Movimientos de pecking Ciclos cortos con pausas entre ellos Evitar lesiones anguladas |
Velocidad 80.000-120.000 Movimiento continuo lento de avance y retroceso (útil en anguladas y ostiales) Ciclos cortos con pausas más largas entre ellos si deterioro hemodinámico Evitar anterógrado en lesiones anguladas |
Relación dispositivo/vaso ≤ 0,6 Movimiento continuo lento de avance (también aplicable en retroceso) Aplicación durante inyección de solución salina Aplicación sin lavar con solución salina o con inyección de contraste en casos seleccionados Evitar lesiones anguladas |
Balón 1:1 dimensionamiento del vaso Inflado y desinflado lento y gradual Rotar el balón seguido de inflados repetidos puede aumentar el número de incisiones |
Balón 1:1: dimensionamiento del vaso Inflado y desinflado lento y gradual |
Balón 1:1: dimensionamiento del vaso Inflado y desinflado lento y gradual |
Balón 1:1: dimensionamiento del vaso Purgado óptimo de aire del balón Secuencia de inflado a 4 atm, aplicación de 10 pulsos e inflado a 6 atm Desinflado gradual tras pitido en consola Al menos 20 pulsos en cada lesión |
|
AO: aterectomía orbitacional; AR: aterectomía rotacional; BC: balón de corte; BMAP: balón de muy alta presión; BS: balón de scoring; CD: arteria coronaria derecha; CX: arteria circunfleja; ELCA: angioplastia coronaria con láser Excimer; LIC: litotricia intracoronaria; NC: no distensible; RIS: reestenosis en el interior del stent; SC: semidistensible. |
|||||||
La evidencia actual proveniente de estudios comparativos o de ensayos clínicos que permita elegir entre las distintas técnicas de modificación de la placa es muy limitada66,67 (tabla 7). Por este motivo, aunque se han propuesto distintos algoritmos sobre el tipo de calcio y la técnica de modificación de la placa a elegir67, no existen indicaciones claras en las guías de práctica clínica. Hay estudios en marcha que podrán aportar más información en el futuro.
Tabla 7. Principales estudios sobre técnicas de modificación de la placa
| Estudio (año) | Diseño y tamaño muestral | Tipo de lesión | Resultados principales |
|---|---|---|---|
| Aterectomía rotacional | |||
| ROTAXUS20,24 (2013) | ECA de 240 p (120 AR, 120 TE) | Calcificación moderada-grave | – Éxito de la estrategia: AR 92,5% y TE 83,3%; p = 0,03 – Ganancia luminal aguda: AR 1,56 mm y TE 1,44; p < 0,01 – No diferencias significativas en disección, perforaciones y flujo lento/ausencia de flujo – Pérdida luminal en el stent a 9 meses: AR 0,44 mm y TE 0,31 mm; p = 0,04 – MACE a 9 meses: AR 24,2% y TE 28,3%; p = 0,46. – MACE a 2 años: AR 29,4% y TE: 34,3%; p = 0,47 |
| PREPARE CALC21 (2018) | ECA: 200 p AR vs. BM (de corte o de scoring) |
Calcificación grave | – Éxito de la estrategia: AR 98% y BM 81%; p = 0,0001 – No diferencias significativas en disección, perforaciones y flujo lento/ausencia de flujo – Pérdida luminal a 9 meses: AR 0,22 mm y BM 0,16 mm; p = 0,21 – RLD a 9 meses: AR 2% y BM 7%; p = 0,17 – No diferencias significativas a 9 meses en mortalidad ni trombosis de stent |
| Aterectomía orbitacional | |||
| ORBIT I30 (2013) | EPNA de 50 p | Calcificación (leve a grave) | – Éxito del procedimiento (estenosis residual < 20% tras stent): 94% – Tasa de MACE a 6 meses: 8% – Disección: 12% – Perforación: 2% |
| ORBIT II28,31 (2014) | EPNA de 443 p | Calcificación grave | – Éxito del procedimiento (estenosis < 50% tras implante de stent sin MACE intrahospitalarios): 98,6% – Disección grave: 2,3% – Perforación: 0,9% – Flujo lento/ausencia de flujo: 0,2% – MACE a 30 días y 3 años: 10,4% y 23,5%, respectivamente |
| COAST29 (2020) | EPNA de 100 p | Calcificación grave | – Éxito del procedimiento (estenosis < 50% tras implante del stent sin MACE intrahospitalarios): 85% – Disección: 2% – Perforación: 2% – Flujo lento/ausencia de flujo: 2% – MACE a 30 días y 1 año: 15% y 22,2%, respectivamente |
| ELCA | |||
| Fernandez et al.36 (2013) | Observacional 58 p | – Fallo de balón (lesiones no cruzables o no dilatables) tratados con ELCA ± AR – Calcificación > moderada 82,1% |
– Éxito del procedimiento (estenosis < 20% tras stent sin disección limitante de flujo ni perforación tipo II o III): 91% – Éxito de ELCA aislado en 76,1%, ELCA tras fallo de AR 6,8% y ELCA + AR 8,6% – Solo 1 caso de éxito de AR cuando falló ELCA – Cuatro complicaciones relacionadas con el procedimiento (flujo lento transitorio, oclusión de rama lateral y 2 perforaciones). |
| ELLEMENT37 (2014) | Observacional 28 p | – Infraexpansión de stent tratada con ELCA de alta energía con contraste tras fallo de balón NC – Calcificación 89,3% |
– Éxito de láser (incremento ≥ 1 mm2 de AMS con IVUS o ≥ 20% DLM por angiografía coronaria cuantitativa tras la predilatación con balón NC que falló antes de ELCA): 96,4% – Infarto periprocedimiento: 7,1%, – Flujo lento transitorio: 3,6% |
| LEONARDO68 (2015) | Observacional 100 p | – Fallo de balón en lesiones complejas – Calcificación 57% |
– Éxito del procedimiento (estenosis < 50% tras implante de stent): 91,7% – Ninguna perforación, disección, oclusión de rama lateral significativa, espasmo ni ausencia de flujo |
| LAVA69 (2018) | Observacional 130 lesiones | – Lesiones no cruzables con balón: 43,8% – Lesiones no dilatables con balón: 40,8% – Calcificación moderada o grave: 62% – RIS: 37% |
– Éxito del procedimiento: 88,8% (93,8% en no dilatables y 83,7% en no cruzables) – Perforación: 1,78% – Infarto periprocedimiento: 0,86% |
| Ojeda et al.34 (2020) | Observacional 126 lesiones | – Lesiones no cruzables con balón – Calcificación ≥ moderada: 62,7% – Oclusión crónica: 46% |
– Éxito técnico (estenosis residual < 30% y TIMI 3): 90,5% – Éxito del procedimiento (éxito técnico sin eventos adversos intrahospitalarios): 87,3% – Calcificación grave asociada a fallo de ELCA |
| Balones modificados (balones de corte o de scoring) y BMAP | |||
| ISAR-CALC50 | ECA de 74 p (BMAP vs. BS) | Lesiones calcificadas graves no dilatables con balón | – Expansión del stent por OCT similar con BMAP y BS (0,72 ± 0,12 frente a 0,68 ± 0,13; p = 0,22) – BMAP mayor incremento de DLM (2,83 ± 0,34 mm frente a 2,65 ± 0,36 mm; p = 0,03) y menor estenosis (11,6 ± 4,8% frente a 14,4 ± 5,6%; p = 0,02) – No diferencias en cuanto a éxito del procedimiento |
| Litotricia intracoronaria | |||
| DISRUPT CAD III53,54 | EPNA 431 p | Calcificación grave | – Éxito del procedimiento (estenosis residual < 50% sin MACE intrahospitalarios): 92,4% – Infarto periprocedimiento: 6,8% – Disección grave: 0,3% – Perforación: 0,3% – Flujo lento o ausencia de flujo: 0% – RLD a 30 días: 1,3% – Trombosis de stent: 0,8% – MACE a 1 año: 13,8% |
|
AMS: área mínima del stent; AR: aterectomía rotacional; BM: balón modificado; BMAP: balón de muy alta presión; NC: no distensible; BS: balón de scoring; DLM: diámetro luminal mínimo; ECA: ensayo controlado aleatorizado; ELCA: angioplastia coronaria con láser Excimer; EPNA: estudio prospectivo no aleatorizado; IVUS: ecografía intravascular; MACE: eventos cardiovasculares adversos mayores; OCT: tomografía de coherencia óptica; p: pacientes; RIS: reestenosis en el interior del stent; RLD: revascularización de la lesión diana; TE: tratamiento estándar; TIMI: Thrombolysis In Myocardial Infarction. |
|||
En caso de que exista una calcificación angiográfica ligera y la expansión de balones sea adecuada, puede no ser necesaria una mayor preparación de la placa previamente al implante del stent. Sin embargo, cuando la calcificación angiográfica es moderada o grave, las técnicas de imagen intracoronaria son recomendables por su gran utilidad para planificar la intervención y optimizar los resultados (figura 7).
Figura 7. Figura central. Algoritmo de modificación de la placa calcificada. AO: aterectomía orbitacional; AR: aterectomía rotacional; BMAP: balón de muy alta presión; ELCA: angioplastia coronaria con láser Excimer; NC: no distensible; SC: semidistensible.
0: se puede intentar la predilatación con balones de bajo perfil, que en ocasiones permite la valoración inicial con imagen intravascular.
1: de elección si no cruza un microcatéter.
2: si no cruza un balón de litotricia, puede predilatarse con balón o combinar otras técnicas (Rotatripsy, Elcatripsy, Orbital-tripsy).
3: actualmente preferible a la litotricia en caso de infraexpansión aguda del stent.
4: además de la expansión angiográfica final del balón NC, la imagen intracoronaria es útil para comprobar el efecto de las técnicas realizadas en la modificación de la placa.
En general, es útil aplicar la «regla del 5»: aquellas lesiones en las que el calcio ocupa < 50% de la circunferencia (180°), no se extiende longitudinalmente > 5 mm y no tiene > 0,5 mm de grosor, se podrán tratar de manera adecuada utilizando balones de alta presión o balones modificados (BC o BS).
Cuando no se cumplan estos criterios o se visualicen nódulos de calcio, será necesario aplicar técnicas de modificación de la placa más avanzadas. Para la selección de cada técnica, además de la extensión circunferencial, longitudinal y el grosor, tiene también importancia la profundidad del calcio, dado que algunas técnicas, como la AR, actúan fundamentalmente en la porción superficial y no profunda de la placa.
Las lesiones con una calcificación significativa tan estenótica que no permita el cruce de la sonda de IVUS o de OCT, probablemente precisen AR/AO o láser (que podría ser de elección en caso de que la lesión no sea cruzable ni siquiera por un microcatéter que permita el intercambio por las guías específicas de AR/AO). Otra alternativa es intentar una predilatación con balones de bajo perfil, que en ocasiones permite la valoración inicial con imagen intravascular que guíe la toma de decisiones, como ya se ha mencionado.
La expansión del balón tras la realización de estas técnicas nos orientará sobre la adecuada preparación de la placa. Además, la imagen intracoronaria es muy útil para confirmar una adecuada modificación del calcio que permita la expansión del stent. Los efectos de las distintas técnicas, como la presencia de fracturas (con balón o litotricia), el limado superficial del calcio (con AR) o ambos efectos (con AO)70, pueden ser visibles con imagen intracoronaria (figura 6). Tras el uso de ELCA se han descrito fracturas superficiales y profundas, si bien sus efectos pueden no ser visibles con OCT y, al igual que con la LIC, esto no implica que la placa no haya sido modificada.
En función del tipo de lesión y de los efectos producidos por estas técnicas, puede ser necesaria la combinación de más de una de ellas para asegurar el implante óptimo del stent y unos resultados clínicos favorables.
CONCLUSIONES
La calcificación coronaria es probablemente el mayor determinante de un mal resultado del ICP y de revascularización percutánea incompleta, y se asocia a mayores tasas de eventos adversos. Las técnicas de imagen intracoronaria desempeñan un papel fundamental en la comprensión de las lesiones calcificadas, para seleccionar la técnica de modificación de la placa y optimizar el resultado del ICP. El conocimiento de las distintas técnicas de modificación de la placa es esencial para el tratamiento óptimo de las lesiones calcificadas. En espera de estudios comparativos entre ellas, es razonable seleccionar la técnica en función del tipo de lesión, y en ocasiones es necesario combinarlas para asegurar el implante óptimo del stent y unos resultados clínicos favorables.
FINANCIACIÓN
No ha habido financiación.
CONTRIBUCIÓN DE LOS AUTORES
Redacción del documento: A. Jurado-Román, A. Gómez-Menchero, N. Gonzalo, J. Martín-Moreiras, R. Ocaranza, Soledad Ojeda, J. Palazuelos, O. Rodríguez-Leor, P. Salinas, B. Vaquerizo, X. Freixa y A.B. Cid-Álvarez. Diseño, coordinación, revisión de la versión final y envío del documento: A. Jurado-Román.
CONFLICTO DE INTERESES
S. Ojeda es editora asociada de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. A. Jurado-Román, X. Freixa y A.B. Cid-Álvarez forman parte de la junta directiva de la ACI-SEC.
BIBLIOGRAFÍA
1. Mori H, Torii S, Kutyna M, Sakamoto A, Finn AV, Virmani R. Coronary Artery Calcification and its Progression: What Does it Really Mean? JACC Cardiovasc Imaging. 2018;11:127-142.
2. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
3. Copeland-Halperin RS, Baber U, Aquino M, et al. Prevalence, correlates, and impact of coronary calcification on adverse events following PCI with newer-generation DES: Findings from a large multiethnic registry. Catheter Cardiovasc Interv. 2018;91:859-866.
4. Sharma SK, Bolduan RW, Patel MR, et al. Impact of calcification on percutaneous coronary intervention: MACE-Trial 1-year results. Catheter Cardiovasc Interv. 2019;94:187-194.
5. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
6. Serruys PW, Morice MC, Kappetein AP, et al. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease. N Engl J Med. 2009;360:961-972.
7. Kawashima H, Serruys PW, Hara H, et al. 10-Year All-Cause Mortality Following Percutaneous or Surgical Revascularization in Patients With Heavy Calcification. JACC Cardiovasc Interv. 2022;15:193-204.
8. Hendry C, Fraser D, Eichhofer J, et al. Coronary perforation in the drug-eluting stent era: incidence, risk factors, management and outcome: the UK experience. EuroIntervention. 2012;8:79-86.
9. Mintz GS, Popma JJ, Pichard AD, et al. Patterns of calcification in coronary artery disease. A statistical analysis of intravascular ultrasound and coronary angiography in 1155 lesions. Circulation. 1995;91:1959-1965.
10. Zhang M, Matsumura M, Usui E, et al. Intravascular Ultrasound-Derived Calcium Score to Predict Stent Expansion in Severely Calcified Lesions. Circ Cardiovasc Interv. 2021; e010296.
11. Stefanini GG, Alfonso F, Barbato E, et al. Management of Myocardial Revascularization Failure: An Expert Consensus Document of the EAPCI. EuroIntervention. 2020;16:e875-e890.
12. Räber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. EuroIntervention. 2018;14:656-677.
13. Cubero-Gallego H, Tizón-Marcos H, Vaquerizo B. Opciones actuales para el tratamiento de las lesiones calcificadas. REC Interv Cardiol. 2020;2:129-139.
14. Hellig F, Pandie S, Barbato E, Colombo A, Heyndrickx JR. Rotational atherectomy. En: PCR - EAPCI Textbook 2015, Part III. Europa Digital & Publishing; 2015.
15. Sharma SK, Tomey MI, Teirstein PS, et al. North American Expert Review of Rotational Atherectomy. Circ Cardiovasc Interv. 2019;12:e007448.
16. Barbato E, Carrié D, Dardas P, et al. European expert consensus on rotational atherectomy. EuroIntervention. 2015;11:30-36.
17. De Maria GL, Scarsini R, Banning AP. Management of Calcific Coronary Artery Lesions: Is it Time to Change Our Interventional Therapeutic Approach? JACC Cardiovasc Interv. 2019;12:1465-1478.
18. Bittl JA, Chew DP, Topol EJ, Kong DF, Califf RM. Meta-analysis of randomized trials of percutaneous transluminal coronary angioplasty versus atherectomy, cutting balloon atherotomy, or laser angioplasty. J Am Coll Cardiol. 2004;43:936-942.
19. Safian RD, Feldman T, Muller DW, et al. Coronary angioplasty and Rotablator atherectomy trial (CARAT): immediate and late results of a prospective multicenter randomized trial. Catheter Cardiovasc Interv. 2001;53:213-220.
20. Abdel-Wahab M, Richardt G, Joachim Büttner H, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6:10-19.
21. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. Circ Cardiovasc Interv. 2018;11:e007415.
22. Iannaccone M, Piazza F, Boccuzzi GG, et al. ROTational AThErectomy in acute coronary syndrome: early and midterm outcomes from a multicentre registry. EuroIntervention. 2016;12:1457-1464.
23. Kawamoto H, Latib A, Ruparelia N, et al. In-hospital and midterm clinical outcomes of rotational atherectomy followed by stent implantation: the ROTATE multicentre registry. EuroIntervention. 2016;12:1448-1456.
24. de Waha S, Allali A, Büttner HJ, et al. Rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: Two-year clinical outcome of the randomized ROTAXUS trial. Catheter Cardiovasc Interv. 2016;87:691-700.
25. Cardiovascular System (CSI). Diamondback 360 Coronary Orbital Atherectomy System. Disponible en: https://csi360.com/diamondback-coronary-orbital-atherectomy-system/. Consultado 27 sep 2022.
26. Shlofmitz E, Shlofmitz R, Lee MS. Orbital Atherectomy: A Comprehensive Review. Interv Cardiol Clin. 2019;8:161-171.
27. Yamamoto MH, Maehara A, Karimi Galougahi K, et al. Mechanisms of Orbital Versus Rotational Atherectomy Plaque Modification in Severely Calcified Lesions Assessed by Optical Coherence Tomography. JACC Cardiovasc Interv. 2017;10:2584-2586.
28. Chambers JW, Feldman RL, Himmelstein SI, et al. Pivotal trial to evaluate the safety and efficacy of the orbital atherectomy system in treating de novo, severely calcified coronary lesions (ORBIT II). JACC Cardiovasc Interv. 2014;7:510-518.
29. Redfors B, Sharma SK, Saito S, et al. Novel Micro Crown Orbital Atherectomy for Severe Lesion Calcification: Coronary Orbital Atherectomy System Study (COAST). Circ Cardiovasc Interv. 2020;13:e008993.
30. Parikh K, Chandra P, Choksi N, Khanna P, Chambers J. Safety and feasibility of orbital atherectomy for the treatment of calcified coronary lesions: the ORBIT I trial. Catheter Cardiovasc Interv. 2013;81:1134-1139.
31. Lee M, Généreux P, Shlofmitz R, et al. Orbital atherectomy for treating de novo, severely calcified coronary lesions: 3-year results of the pivotal ORBIT II trial. Cardiovasc Revasc Med. 2017;18:261-264.
32. Tsutsui RS, Sammour Y, Kalra A, et al. Excimer Laser Atherectomy in Percutaneous Coronary Intervention: A Contemporary Review. Cardiovasc Revasc Med. 2021;25:75-85.
33. Golino L, Caiazzo G, Calabrò P, et al. Excimer laser technology in percutaneous coronary interventions: Cardiovascular laser society’s position paper. Int J Cardiol. 2022;350:19-26.
34. Ojeda S, Azzalini L, Suárez de Lezo J, et al. Excimer laser coronary atherectomy for uncrossable coronary lesions. A multicenter registry. Catheter Cardiovasc Interv. 2021;98:1241-1249.
35. Mintz GS, Kovach JA, Javier SP, et al. Mechanisms of lumen enlargement after excimer laser coronary angioplasty. An intravascular ultrasound study. Circulation. 1995;92:3408-3414.
36. Fernandez JP, Hobson AR, McKenzie D, et al. Beyond the balloon: excimer coronary laser atherectomy used alone or in combination with rotational atherectomy in the treatment of chronic total occlusions, non-crossable and non-expansible coronary lesions. EuroIntervention. 2013;9:243-250.
37. Latib A, Takagi K, Chizzola G, et al. Excimer Laser LEsion modification to expand non-dilatable stents: the ELLEMENT registry. Cardiovasc Revasc Med. 2014;15:8-12.
38. Sintek M, Coverstone E, Bach R, et al. Excimer Laser Coronary Angioplasty in Coronary Lesions: Use and Safety From the NCDR/CATH PCI Registry. Circ Cardiovasc Interv. 2021;14(7):e010061.
39. Protty MB, Hussain HI, Gallagher S, et al. Excimer laser coronary atherectomy during complex PCI: An analysis of 1,471 laser cases from the British Cardiovascular Intervention Society database. Catheter Cardiovasc Interv. 2021;97:E653-E660.
40. Unterberg C, Buchwald AB, Barath P, Schmidt T, Kreuzer H, Wiegand V. Cutting balloon coronary angioplasty -- initial clinical experience. Clin Cardiol. 1993;16:660-664.
41. Barath P, Fishbein MC, Vari S, Forrester JS. Cutting balloon: a novel approach to percutaneous angioplasty. Am J Cardiol. 1991;68:1249-1252.
42. Bonaventura K, Schwefer M, Yusof AKM, et al. Systematic Scoring Balloon Lesion Preparation for Drug-Coated Balloon Angioplasty in Clinical Routine: Results of the PASSWORD Observational Study. Adv Ther. 2020;37:2210-2223.
43. Okura H, Hayase M, Shimodozono S, et al. Mechanisms of acute lumen gain following cutting balloon angioplasty in calcified and noncalcified lesions: an intravascular ultrasound study. Catheter Cardiovasc Interv. 2002;57:429-436.
44. Barbato E, Shlofmitz E, Milkas A, Shlofmitz R, Azzalini L, Colombo A. State of the art: evolving concepts in the treatment of heavily calcified and undilatable coronary stenoses - from debulking to plaque modification, a 40-year-long journey. EuroIntervention. 2017;13:696-705.
45. de Ribamar Costa JJ, Mintz GS, Carlier SG, et al. Nonrandomized comparison of coronary stenting under intravascular ultrasound guidance of direct stenting without predilation versus conventional predilation with a semi-compliant balloon versus predilation with a new scoring balloon. Am J Cardiol. 2007;100:812-817.
46. Felekos I, Karamasis GV, Pavlidis AN. When everything else fails: High-pressure balloon for undilatable lesions. Cardiovasc Revasc Med. 2018;19:306-313.
47. Díaz JF, Gómez-Menchero A, Cardenal R, Sánchez-González C, Sanghvi A. Extremely high-pressure dilation with a new noncompliant balloon. Tex Heart Inst J. 2012;39:635-638.
48. Secco GG, Ghione M, Mattesini A, et al. Very high-pressure dilatation for undilatable coronary lesions: indications and results with a new dedicated balloon. EuroIntervention. 2016;12:359-365.
49. Secco GG, Buettner A, Parisi R, et al. Clinical Experience with Very High-Pressure Dilatation for Resistant Coronary Lesions. Cardiovasc Revasc Med. 2019;20:1083-1087.
50. Rheude T, Rai H, Richardt G, et al. Super high-pressure balloon versus scoring balloon to prepare severely calcified coronary lesions: the ISAR-CALC randomised trial. EuroIntervention. 2021;17:481-488.
51. Delgado-Arana JR, Rumoroso JR, Regueiro A, et al. Plaque modification in calcified chronic total occlusions: the PLACCTON study. Rev Esp Cardiol. 2022;75:213-222.
52. Vilalta del Olmo V, Rodríguez-Leor O, Redondo A, et al. Intracoronary lithotripsy in a high-risk real-world population. First experience in severely calcified, complex coronary lesions. REC Interv Cardiol. 2020;2:76-81.
53. Hill JM, Kereiakes DJ, Shlofmitz RA, et al. Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Artery Disease. J Am Coll Cardiol. 2020;76:2635-2646.
54. Kereiakes DJ, Hill JM, Shlofmitz RA, et al. Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Lesions: 1-Year Results From the Disrupt CAD III Study. J Soc Cardiovasc Angiogr Interv. 2022. https://doi.org/10.1016/j.jscai.2021.100001.
55. Ali ZA, Nef H, Escaned J, et al. Safety and Effectiveness of Coronary Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Stenoses: The Disrupt CAD II Study. Circ Cardiovasc Interv. 2019;12:e008434.
56. Pham V, Bonnet M, Varenne O, et al. In-stent use of Intravascular Coronary Lithotripsy for restenosis and stent underexpansion, a multicenter experience. Can J Cardiol. 2022;10:1474-1475.
57. Achim A, Alampi C, Krivoshei L, Leibundgut G. In vitro effect of intravascular lithotripsy on the polymer of a drug-eluting stent. EuroIntervention. 2022;18:e333-e334.
58. Tovar Forero MN, Sardella G, Salvi N, et al. Coronary lithotripsy for the treatment of underexpanded stents; the international & multicentre CRUNCH registry. EuroIntervention. 2022;18:574-581.
59. Gonzálvez-García A, Jiménez-Valero S, Galeote G, Moreno R, López de Sá E, Jurado-Román A. “RotaTripsy”: Combination of Rotational Atherectomy and Intravascular Lithotripsy in Heavily Calcified Coronary Lesions: A Case Series. Cardiovasc Revasc Med. 2022;35:179-184.
60. Yarusi BB, Jagadeesan VS, Hussain S, et al. Combined Coronary Orbital Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified Coronary Stenoses: The First Case Series. J Invasive Cardiol. 2022;34:E210-E217.
61. Jurado-Román A, García A, Moreno R. ELCA-Tripsy: Combination of Laser and Lithotripsy for Severely Calcified Lesions. J Invasive Cardiol. 2021;33:E754-E755.
62. Amemiya K, Yamamoto MH, Maehara A, et al. Effect of cutting balloon after rotational atherectomy in severely calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019;94:936-944.
63. Jurado-Román A, Gonzálvez A, Galeote G, Jiménez-Valero S, Moreno R. RotaTripsy: Combination of Rotational Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified Lesions. JACC Cardiovasc Interv. 2019;12:e127-e129.
64. Chen G, Zrenner B, Pyxaras SA. Combined Rotational Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified in-Stent Neoatherosclerosis: A Mini-Review. Cardiovasc Revasc Med. 2019;20:819-821.
65. Protty MB, Gallagher S, Farooq V, et al. Combined use of rotational and excimer lASER coronary atherectomy (RASER) during complex coronary angioplasty - An analysis of cases (2006-2016) from the British Cardiovascular Intervention Society database. Catheter Cardiovasc Interv. 2021;97:E911-E918.
66. McInerney A, Escaned J, Gonzalo N. Calcified coronary artery disease: pathophysiology, intracoronary imaging assessment, and plaque modification techniques. REC Interv Cardiol. 2022;4:216-227.
67. Bulluck H, McEntegart M. Contemporary tools and devices for coronary calcium modification. JRSM Cardiovasc Dis. 2022. https://doi.org/10.1177/20480040221089760.
68. Ambrosini V, Sorropago G, Laurenzano E, et al. Early outcome of high energy Laser (Excimer) facilitated coronary angioplasty ON hARD and complex calcified and balloOn-resistant coronary lesions: LEONARDO Study. Cardiovasc Revasc Med. 2015;16:141-146.
69. Karacsonyi J, Armstrong EJ, Truong HTD, et al. Contemporary Use of Laser During Percutaneous Coronary Interventions: Insights from the Laser Veterans Affairs (LAVA) Multicenter Registry. J Invasive Cardiol. 2018;30:195-201.
70. Yamamoto MH, Maehara A, Kim SS, et al. Effect of orbital atherectomy in calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019;93:1211-1218.
* Autor para correspondencia. Correo electrónico: alfonsojuradoroman@gmail.com (A. Jurado-Román); mjimeneznavarro@gmail.com (M. Jiménez Navarro).
RESUMEN
La estadística bayesiana valora de forma probabilística cualquier fuente de incertidumbre asociada a un estudio estadístico y utiliza el teorema de Bayes para actualizar, de manera secuencial, la información generada en las diferentes fases del estudio. Las características de la inferencia bayesiana la hacen especialmente útil para el tratamiento de datos cardiológicos procedentes de estudios experimentales u observacionales que contienen diferentes fuentes de variabilidad y complejidad. En este trabajo se presentan los conceptos básicos de la estadística bayesiana relativos a la estimación de parámetros y cantidades derivadas, predicción de nuevos datos y contrastes de hipótesis; estos últimos en el contexto de la selección de modelos o teorías.
Palabras clave: Distribución a posteriori. Distribución previa. Distribución predictiva. Probabilidad bayesiana. Teorema de Bayes.
ABSTRACT
Bayesian statistics assesses probabilistically all sources of uncertainty involved in a statistical study and uses Bayes’ theorem to sequentially update the information generated in the different phases of the study. The characteristics of Bayesian inference make it particularly useful for the treatment of cardiological data from experimental or observational studies including different sources of variability, and complexity. This paper presents the basic concepts of Bayesian statistics associated with the estimation of parameters and derived quantities, new data prediction, and hypothesis testing. The latter in the context of model or theory selection.
Keywords: Posterior distribution. Prior distribution. Predictive distribution. Bayesian probability. Bayes’ theorem.
Introducción: matemáticas, probabilidad y estadística
Según el conocido científico Stephen Hawking, el objetivo de la ciencia es «nothing less than a complete description of the universe we live in»1. Las científicas y los científicos perseguimos dicho objetivo construyendo teorías y valorando sus predicciones. Es la esencia del método científico.
La estadística es una disciplina científica que diseña experimentos y aprende de los datos. Formaliza el proceso de aprendizaje a través de observaciones y sirve de guía para la utilización del conocimiento acumulado en la toma de decisiones. Conceptos como azar, incertidumbre y suerte son casi tan antiguos como la propia humanidad, y reducir la incertidumbre ha sido siempre un deseo común de la mayoría de las civilizaciones. La probabilidad es el lenguaje matemático que cuantifica la incertidumbre y elemento fundamental del aprendizaje estadístico, que representa en términos probabilísticos tanto las poblaciones objeto de estudio como las muestras aleatorias procedentes de dichas poblaciones.
No existe una única metodología estadística. Las más conocidas y utilizadas son, con mucha diferencia, la estadística frecuentista y la estadística bayesiana. Ambas tienen objetivos comunes y utilizan la probabilidad como lenguaje del aprendizaje estadístico, aunque su diferente concepción de la probabilidad es el elemento que marca la gran diferencia entre ellas. Con la concepción frecuentista solo es lícito asignar probabilidades a fenómenos aleatorios que pueden definirse a través de experimentos que pueden repetirse muchas veces y siempre en condiciones idénticas e independientes.
La concepción bayesiana de la probabilidad es más amplia porque permite asignar probabilidades a cualquier elemento con incertidumbre, independientemente de su naturaleza. La probabilidad bayesiana se aplica a cualquier suceso aleatorio, tanto el que puede repetirse en las condiciones exigidas por la probabilidad frecuentista como aquel que no las cumple (probabilidad de que Arnau, persona de 60 años que vive solo en casa, se recupere de un ataque al corazón). Las diferencias entre ambas metodologías aún se amplían más porque la probabilidad bayesiana asigna probabilidades a parámetros (como la prevalencia de personas entre 45 y 65 años que han sufrido un ataque al corazón), a hipótesis estadísticas (la eficacia de un nuevo tratamiento para enfermos diabéticos con insuficiencia cardiaca es mayor que la de un tratamiento convencional), a modelos probabilísticos o, incluso, a datos faltantes generados por pérdidas de seguimiento no aleatorias (ignorar en un estudio de supervivencia sobre un proceso terminal la información de los enfermos con pérdida de seguimiento introduciría información sesgada en el estudio).
El segundo elemento diferenciador entre ambas metodologías estadísticas es la utilización del teorema de Bayes. Para la bayesiana es una herramienta fundamental para actualizar de forma secuencial la información relevante de un estudio. De esa forma, después de una primera fase de análisis, el conocimiento generado servirá como inicio de un nuevo proceso de aprendizaje que incorpore nueva información sobre el problema.
Las concepciones probabilísticas frecuentista y bayesiana comparten el mismo sistema axiomático y las mismas propiedades probabilísticas. Este nicho común las hace compartir un lenguaje matemático común.
Es difícil explicar el mapa de conceptos básicos bayesianos y sus relaciones sin entrar en muchos tecnicismos, y mucho más a través de estudios reales del mundo de la investigación cardiovascular. Por este motivo, en este artículo trabajaremos con ejemplos muy sencillos, que entendemos como potentes en términos conceptuales, pero simples y desprovistos de complejidades técnicas.
Este trabajo consta de siete secciones. La primera, esta introducción, presenta el marco de conocimiento general en el que se inserta la estadística bayesiana con relación a las matemáticas, la probabilidad y la estadística. La segunda muestra unas breves pinceladas históricas de la metodología bayesiana. Dedicamos la siguiente sección al teorema de Bayes en su versión más inocente para sucesos aleatorios. Seguidamente se abordan los conceptos y el protocolo básico de la estadística bayesiana: distribución previa, función de verosimilitud, distribución a posteriori y distribución predictiva para predecir resultados experimentales. También se explican brevemente los problemas computacionales inherentes a la aplicación práctica de los métodos bayesianos y se muestra su potencialidad para generar inferencias sobre cantidades derivadas relevantes. Los contrastes de hipótesis, especialmente el valor de p, se abordan más adelante, así como la propuesta bayesiana para contrastar hipótesis. El trabajo concluye con un pequeño comentario sobre la utilización de distribuciones previas.
CON BAYES, PRICE Y LAPLACE EMPEZÓ TODO
Conocer un poco de la historia bayesiana es importante porque permite situarla en una escala temporal y social que ilumina y potencia su aprendizaje. Esbozamos unas pequeñas pinceladas de algunos acontecimientos relevantes de esta historia. McGrayne2 cuenta de forma sencilla y rigurosa la historia completa.
Las primeras noticias del teorema de Bayes proceden de la Gran Bretaña de mitad del siglo xviii, con el reverendo Thomas Bayes intentando demostrar la existencia de Dios a través de las matemáticas. Nunca se atrevió a publicar sus resultados. A su muerte, legó todos sus ahorros a su amigo Richard Price para que, si lo consideraba oportuno, los gastara publicando sus trabajos. Price los publicó, pero pasaron prácticamente desapercibidos.
Seguimos en el siglo xviii, ahora en Francia con Pierre-Simon Laplace, uno de los matemáticos más brillantes de la historia. Descubrió, independientemente de Bayes y de Price, el teorema de Bayes en el formato que conocemos actualmente y desarrolló la concepción bayesiana de la probabilidad. Tras su muerte, sus trabajos fueron casi olvidados e incluso vilipendiados porque ya no estaban en sintonía con la idea imperante de objetividad que en aquellos días impregnaba el mundo de la ciencia.
Volvemos a Gran Bretaña. Bletchley Park era una mansión del siglo xix en el norte de Londres que se convirtió durante la Segunda Guerra Mundial (1939-1945) en el centro de los trabajos de descifrado de los mensajes secretos del ejército alemán. Alan Turing y su equipo, en el que destacamos al estadístico bayesiano Jack Good, tuvieron un papel clave en la historia de la estadística bayesiana: el teorema de Bayes fue una gran ayuda para descifrar el código de las máquinas Enigma que los alemanes utilizaban para cifrar y descifrar mensajes. Finalizada la guerra, el gobierno británico clasificó como secreto de estado toda información relacionada con Turing, las matemáticas, la estadística y las descodificaciones. El teorema de Bayes siguió siendo una buena herramienta para pocos científicos y un anatema (o peor) para la mayoría de ellos. Como anécdota especialmente reveladora, McGrayne2 cuenta que cuando Good presentó ante los miembros de la Royal Statistical Society británica los detalles del método que Turing y su equipo habían utilizado en el descifrado de los códigos nazis, las primeras palabras del siguiente orador fueron: «Tras estas estupideces […]».
En la segunda mitad del siglo xx, el futuro de la estadística bayesiana pintaba muy negro: pocos apoyos en el mundo académico anglosajón, casi desconocida en el resto de la comunidad científica y muchas dificultades de tipo computacional para aplicar la estadística bayesiana en estudios reales con datos. Pero no sucedió aquello que parecía que debía ocurrir. Seguimos en plena Segunda Guerra Mundial, ahora en el Laboratorio Nacional de Los Álamos del Estado de Nuevo México, en Estados Unidos. Este centro fue creado secretamente durante la Segunda Guerra Mundial para investigar la construcción de armas nucleares bajo el paraguas del Proyecto Manhattan, liderado por los Estados Unidos y con participación de Gran Bretaña y Canadá. Este entorno es el origen de los métodos de simulación Montecarlo, descubiertos en 1946 por el matemático polaco Stanislaw Ulam mientras jugaba un solitario. También aquí, Metropolis et al.3 publican el primer algoritmo de simulación Montecarlo basado en cadenas de Markov (MCMC) en el marco de sus investigaciones sobre la bomba H.
Durante muchos años no hay conexiones directas entre la estadística bayesiana y los métodos MCMC, aunque existen trabajos (especialmente en reconocimiento de imágenes) que ligarán ambos elementos4. Propiciados por los avances tecnológicos, en particular en materia computacional, Alan Gelfand y Adrian Smith, un norteamericano y un inglés, recogen los trabajos previos en métodos MCMC y los vinculan directamente con la estadística bayesiana5. Es el principio de la gran revolución bayesiana: comienza en el terreno de las aplicaciones para, poco a poco, impregnar también el mundo académico. La inferencia bayesiana es ahora reconocida, aceptada y valorada por la comunidad científica como una metodología estadística útil para el desarrollo científico y social.
TEOREMA DE BAYES
El formato más conocido del teorema de Bayes se presenta para sucesos aleatorios. Si A y B son sucesos aleatorios, entonces
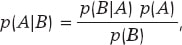
siendo p(A) la probabilidad del suceso A, p(A|B) la probabilidad asociada A pero condicionada por la información de que B ha ocurrido, y análogamente p(B)> 0 y p(B|A). Es importante distinguir entre las probabilidades p(A) y p(A|B). Ambas cuantifican la ocurrencia de A, pero p(A) lo hace de forma absoluta y p(B|A) de forma relativa y condicionada por la información recogida en B. Por ejemplo, nadie dudaría en pensar que la probabilidad de que una persona sufra una angina de pecho es mayor si se sabe que esa persona es hipertensa que si no se tiene esa información: p (Angina pecho | Hipertensión) > p (Angina pecho).
Ejemplo I: infecciones y test
La prevalencia de una determinada infección en cierta población es de 0,004. Se dispone de un test para detectar su presencia con una sensibilidad del 94% y una especificidad del 97%. Queremos valorar la probabilidad de que una persona de dicha población esté realmente infectada si se sabe que se ha hecho el test con resultado positivo para la infección.
Denotamos con V y Vc el suceso que describe si una persona tiene o no la infección, respectivamente. Por tanto, p(V) = 0,004 y p(Vc) = 0,996. Representamos por (+) y (–) un resultado positivo y negativo de la prueba para la infección, respectivamente. En términos probabilísticos, si una persona está infectada tendrá un resultado positivo con probabilidad 0,94 y un resultado negativo con probabilidad 0,06 p(+|V) = 0,94 y p(–|V) = 0,06 (falso negativo). Si no está infectada, la prueba resultará negativa con una probabilidad 0,97 y positiva con una probabilidad 0,03 p(–|Vc) = 0,97 y p(+|Vc) = 0,03 (falso positivo).
Según el teorema de Bayes, la probabilidad de que una persona esté infectada cuando ha tenido un resultado positivo para el test es
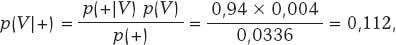
siendo p(+) = p(+|V) p(V) + p(+|Vc) p(Vc) = 0,0336 como consecuencia de la aplicación del teorema de la probabilidad total (figura 1).
Figura 1. Probabilidad a posteriori de infección con un resultado positivo del test p(V|+) (gráfica superior) y con un resultado negativo p(V|–) (gráfica superior) en relación con la probabilidad a priori, p(V), de infección.
En principio, parece desconcertante que un test tan fiable y con un resultado positivo para la infección genere una probabilidad a posteriori pequeña, 0,112, a favor de la infección. Pero si nos fijamos en que la probabilidad inicial de tener la infección es p(V) = 0,004 y que después del resultado positivo del test es p(V|+) = 0,112, vemos que ha pasado de 4 a 112 por mil, se ha multiplicado por 28, y nos parece más relevante la influencia del resultado del test en dicha probabilidad a posteriori. En cualquier caso, necesitaríamos por lo menos una segunda prueba para aumentar la evidencia a favor o en contra de la infección.
La figura 2 muestra dos gráficas. La curva superior es la probabilidad a posteriori de la infección cuando el test ha dado positivo, p(V|+). La curva inferior corresponde también a la probabilidad de infección, pero con un resultado negativo del test, p(V|–). En ambos casos, dichas probabilidades a posteriori están representadas en términos de la probabilidad a priori, p(V), de tener la infección. Cuando p(V) está cerca de 0, como en este ejemplo, la probabilidad p(V|+) aumenta mucho, aunque en términos absolutos continúa siendo muy baja. Por el contrario, cuando p(V) está cerca de 1, la probabilidad p(V|–) continuará siendo alta a pesar de la evidencia en contra de un resultado negativo muy fiable. El elemento fundamental para entender esta situación es que la probabilidad a posteriori, p(V|+) = 0,112, combina una probabilidad muy pequeña de tener la infección con una probabilidad muy alta de un test positivo cuando se tiene la infección.
Figura 2. Número aproximado de personas infectadas, no infectadas, verdaderos positivos, verdaderos negativos, falsos positivos y falsos negativos en una población de 100.000 habitantes con una prevalencia inicial para la infección de 0,004 y un test con sensibilidad del 94% y especificidad del 97%.
Seguimos valorando los resultados obtenidos. La prevalencia de la infección, p(V) = 0,004, indica que en una población de 100.000 personas podríamos esperar alrededor de 400 infectadas y unas 99.600 no infectadas (figura 2). Si se realizara el test a toda la población esperaríamos que, aproximadamente, 376 de las 400 personas infectadas fueran positivas para el test (verdaderos positivos) y 24 no (falsos negativos). En el grupo de las personas sanas, el test resultaría negativo en alrededor de 96.612 personas (verdaderos negativos), pero positivo en aproximadamente 2.988 (falsos positivos). Si nos fijáramos en el número de personas con un test positivo, tendríamos 376 verdaderos positivos y 2.988 falsos positivos. Por tanto, la mayoría (en torno al 89%) de las personas con un test positivo no estarían realmente infectadas.
Una segunda repetición del test con un resultado también positivo aportaría mayor evidencia a favor de la infección. Su probabilidad debería actualizarse, incluyendo como nueva información el resultado positivo de la segunda prueba. Si representamos ahora por (+1) y (+2) un resultado positivo para la primera y la segunda pruebas, la probabilidad relevante sería p(V|+1,+2). La utilización secuencial del teorema de Bayes permite calcular dicha probabilidad considerando p(V|+1) = 0,112 como probabilidad a priori. El resultado obtenido, p(V|+1,+2) = 0,798, muestra una gran evidencia a favor de la infección después de dos resultados positivos de la prueba.
ESTIMACIÓN DE PARÁMETROS
Los estudios bayesianos básicos tienen como protagonistas a los modelos probabilísticos gobernados por parámetros desconocidos, que constituyen el foco de atención de la maquinaria inferencial bayesiana. Recordemos que un parámetro es una característica de una población estadística objeto de estudio. Ejemplos de parámetros son el porcentaje de efectividad de un fármaco, la tasa de supervivencia a 5 años del sarcoma de tejidos blandos, el factor básico de reproducción R0 de una infección, etc. Estimamos parámetros utilizando información parcial de la población objeto de estudio procedente de muestras de datos obtenidas mediante procedimientos aleatorios que garantizan su representatividad y su condición de miniatura de la población.
El modelo probabilístico más conocido es la distribución normal, con una función de densidad simétrica en forma de campana y definida a través de dos parámetros: la media (µ) y la desviación típica (σ). La media es el centro de gravedad de la distribución y corresponde al pico de la campana. La desviación típica es una medida de dispersión que determina la anchura de la campana: en todas las distribuciones normales, el intervalo (µ − 3σ, µ + 3σ) incluye el 99,7% de los valores de la distribución. Por lo tanto, la probabilidad asociada al intervalo (−3, 3) en una distribución normal con media 0 y desviación típica 1 será la misma que la asociada al intervalo (−6, +6) de una distribución normal con media 0 y desviación típica 2 (figura 3).
Figura 3. Gráfica de una densidad normal de media 0 y desviación típica 1 (color verde) y de una densidad normal de media 0 y desviación típica 2 (co-lor gris).
La media y la desviación típica son parámetros desconocidos en la mayoría de los estudios basados en datos normales. En nuestro caso, para evitar complicaciones técnicas, supondremos que la desviación típica es conocida y, por lo tanto, el proceso estadístico solo tendrá ojos para la media µ. El teorema de Bayes se adapta ahora al territorio de las distribuciones de probabilidad con la atención puesta en la media poblacional µ como parámetro de interés, según:
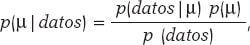
siendo p(μ) la distribución previa (o distribución a priori) de μ que cuantifica, en términos probabilísticos, la información inicial que se tiene sobre μ, y p(μ | datos) la distribución a posteriori de µ que contiene la información sobre µ que se tiene cuando a la información inicial se añade la de los datos. El término p(datos | μ) es la función de verosimilitud de μ, una medida que valora la compatibilidad de los datos con los posibles valores de μ. El elemento p(datos) es la distribución predictiva previa (también evidencia en contextos de aprendizaje automático [machine learning]) y valora la plausibilidad de los datos obtenidos.
Ejemplo II: corazón de niñas y niños con atrofia muscular
Falsaperla et al.6 presentan los resultados de un estudio observacional sobre el deterioro del sistema de conducción eléctrica del corazón que causa bradicardia o alteraciones en el electrocardiograma de niñas y niños con atrofia muscular espinal tipos 1 y 2 (AME1 y AME2, respectivamente). Nos hemos inspirado en este trabajo para construir un banco de datos simulado y, consecuentemente, los resultados de este ejemplo no proceden de Falsaperla et al.6 y no deberían compararse con los del trabajo original.
Simulamos datos de la longitud del intervalo PR, que se extiende desde el inicio de la despolarización auricular hasta el comienzo de la despolarización ventricular, de 14 niños con AME2. Asumimos un modelo normal con media desconocida y desviación típica conocida. Nuestro objetivo estadístico es estimar la media.
Seguimos el protocolo bayesiano. Necesitamos primero una distribución previa p(μ) que exprese nuestra información sobre dicho parámetro. Consideramos un escenario sin otra información sobre μ que no sea la de los datos y utilizamos la distribución de Jeffreys, que trata a todos los posibles valores de μ por igual7. La distribución a posteriori de μ, p(μ | datos), es una distribución normal con media 0,13 y desviación típica 0,03/√√14 segundos, que podemos ver representada gráficamente en la figura 4. Estimamos que μ es 0,13 segundos y valoramos directamente la precisión de dicha estimación a través de un intervalo de credibilidad que nos informa de que la probabilidad a posteriori de que μ tome valores entre 0,114 y 0,146 segundos es 0,95. Damos una probabilidad muy pequeña, 0,05, a que μ sea > 0,146 o < 0,114.
Figura 4. Distribución a posteriori de la longitud media del intervalo PR en niños afectados por atrofia muscular espinal tipo 2.
Un análisis frecuentista de estos datos nunca permitiría una eva luación probabilística directa sobre μ. Un intervalo de confianza frecuentista del 95% para μ proporcionaría los mismos resultados numéricos que el intervalo bayesiano, pero debería interpretarse de forma completamente diferente. La confianza frecuentista del 95% es sobre la capacidad del intervalo de incluir el verdadero valor de μ, y no sobre los posibles valores de μ. El intervalo construido, (0,114, 0,146), tiene una probabilidad de 0,95 de capturar el verdadero valor de μ, pero también una probabilidad de 0,05 de no hacerlo. Recordemos que la concepción frecuentista de la probabilidad impide asignar probabilidades a parámetros y no puede establecer valoraciones probabilísticas directas sobre μ.
PREDICCIÓN DE NUEVAS OBSERVACIONES
Predicción y estimación son conceptos estadísticos fundamentales. Estimamos parámetros, pero predecimos datos y resultados experimentales, siempre a través de distribuciones de probabilidad.
La distribución predictiva a posteriori para los resultados de un futuro experimento se construye combinando el modelo probabilístico, que relaciona los futuros datos y los parámetros, y la distribución a posteriori. Un aspecto importante del proceso predictivo respecto al de estimación es su mayor incertidumbre. De forma general, la precisión de las estimaciones mejora cuando aumenta el tamaño de la muestra, y en el caso hipotético de disponer de todos los datos, nuestra estimación sería exacta. Esta característica no la tiene el proceso de predicción. Aunque la precisión de las predicciones aumenta con el tamaño de la muestra, en el caso hipotético de acceder a toda la información poblacional nunca podrían establecerse predicciones sin error.
Ejemplo II: corazón de niñas y niños con atrofia muscular (continuación)
En la etapa de estimación, hemos estudiado la longitud media del intervalo PR en niñas y niños con AME2, aprendizaje basado en una muestra de 14 datos simulados. Contemplamos ahora una situación completamente diferente. Tenemos un niño con AME2 que no ha participado en el estudio y queremos predecir la longitud de su intervalo PR. El objetivo ahora no es estimar medias de la población con AME2, sino predecir el valor de la longitud del intervalo PR de un niño concreto.
La figura 5 muestra la distribución predictiva a posteriori de la longitud del intervalo PR de un nuevo niño con AME2. Esta predicción está basada en la información de los 14 niños de la muestra, pero hace referencia a un nuevo niño afectado por AME2. El valor predicho de la longitud del intervalo PR de este nuevo niño es 0,13 segundos. La precisión de la predicción se cuantifica a través de intervalos de predicción. En este caso, con probabilidad 0,95, el valor predicho se encontrará entre 0,069 y 0,191 segundos.
Figura 5. Distribución predictiva a posteriori de la longitud del intervalo PR de un nuevo niño con atrofia muscular espinal tipo 2.
SIMULACIÓN Y COMPARACIÓN DE GRUPOS
El protocolo bayesiano con los tres elementos básicos, distribución previa, función de verosimilitud y distribución a posteriori, es común a casi todo tipo de escenarios, básicos con pocos parámetros y complejos con muchas fuentes de incertidumbre con estructuras jerárquicas complicadas. Se trata de un protocolo sencillo y robusto que es conceptualmente potente y atractivo.
Las dificultades aparecen cuando queremos implementar este protocolo en estudios reales con cierta complejidad. En pocos casos puede obtenerse una expresión analítica para la distribución a posteriori de los parámetros, y resulta imposible para aquellas distribuciones a posteriori asociadas a cantidades de interés derivadas. En la mayoría de los estudios, las matemáticas se complican mucho y es imposible obtener las distribuciones a posteriori. En estos casos, los métodos MCMC son los salvadores del análisis bayesiano. Son capaces de simular muestras aproximadas de la distribución a posteriori relevante y generar, a partir de ellas, las inferencias o predicciones que el estudio requiera.
En el siguiente ejemplo ilustraremos la situación más básica que hemos comentado: a partir de una distribución (analítica) a posteriori diana simularemos distribuciones a posteriori de cantidades de interés relevantes no analíticas.
Ejemplo III: infarto agudo de miocardio y stents
Este ejemplo está inspirado en Iglesias et al.8. Se trata de un estudio con 1.300 pacientes con infarto agudo de miocardio sometidos a una intervención coronaria por vía percutánea. Cada paciente fue asignado aleatoriamente a un tratamiento con stents liberadores de sirolimus con polímero degradable (grupo S) o a un tratamiento con stents liberadores de everolimus con polímero durable (grupo E).
Comparamos ambos tratamientos en relación con la proporción de muertes a los 12 meses del tratamiento. De los 649 pacientes del grupo S, 35 renunciaron al tratamiento o se perdieron durante el primer año de seguimiento, y 24 murieron. En el grupo E, inicialmente con 651 pacientes, 25 se perdieron o renunciaron al tratamiento, y 22 murieron. La presencia de datos faltantes por pérdida de seguimiento es un tema importante que debe tratarse con cuidado. En este caso los obviaremos porque nuestro objetivo es ilustrar los procedimientos bayesianos con el menor tecnicismo posible.
Empezamos analizando el riesgo de muerte θs y θE en los grupos S y E, respectivamente, al cabo de 1 año de tratamiento. Como en ambos grupos cada persona puede morir o no durante el año de tratamiento, el modelo probabilístico en cada grupo es una distribución binomial que describirá el número de muertes registradas. El riesgo de muerte en cada grupo es una proporción, con valores entre 0 y 1. Seleccionamos como distribución previa para cada proporción una distribución β porque es un modelo probabilístico adecuado para proporciones y no presenta dificultades de cálculo. La distribución β (que representamos como Be(α, β)) tiene dos parámetros, α > 0 y β > 0, que determinan la forma de la distribución, así como su media y su varianza. Se trata de una distribución flexible, que puede ser simétrica o asimétrica, positiva o negativa (figura 6).
Figura 6. Gráfica de densidades β: Be(0,5, 0,5) en color verde, Be(2, 2) en color gris, Be(3, 22) en color granate, Be(12, 2) en color azul y Be(12, 12) en co-lor calabaza.
La distribución β a priori que mejor describe la ausencia de información es Be(0,5, 0,5). Su justificación solo obedece a criterios teóricos. La distribución a posteriori del riesgo de muerte en cada grupo será también una β cuyos parámetros actualizados se obtienen sumando el número de muertes y el número de personas vivas del estudio a los dos valores 0,5 y 0,5 de la distribución β a priori:
p(θs) = Be(0,5, 0,5); p(θs | datos) = Be(24,5, 590,5),
p(θE) = Be(0,5, 0,5); p(θE | datos) = Be(22,5, 604,5).
La estimación del riesgo de muerte en pacientes del grupo S y del grupo E es la media de su distribución a posteriori: 0,040 y 0,036, respectivamente. Además, con una probabilidad 0,95 el riesgo de muerte en el grupo S se encuentra entre 0,026 y 0,057, y en el grupo E entre 0,023 y 0,052. Estos resultados indican que la proporción de muertes en ambos grupos es pequeña, aunque ligeramente superior en el grupo S. El intervalo de credibilidad del 95%, tanto de θs como de θE, es muy informativo (figura 7).
Figura 7. Distribución a posteriori de la proporción de muertes en pacientes del grupo S (color verde) y del grupo E (color gris).
Asumimos como objetivo la comparación del riesgo de muerte a 1 año en ambos grupos. Aunque la herramienta en la que primero podríamos pensar es los contrates de hipótesis (que introduciremos más adelante), la literatura epidemiológica y estadística sobre el tema es abundante y es habitual comparar dos grupos a través del riesgo relativo (RR) o del riesgo absoluto (RA)9. El RR de muerte al cabo de 1 año en pacientes con stents de tipo S frente a pacientes con stents de tipo E es RR = θs/θE, un cociente entre dos proporciones. Valores de RR < 1 indican que la proporción de muertes en el grupo S es menor que en el grupo E, y valores > 1 evidencian lo contrario. Puesto que el RR se define a través de θs y θE, la información de ambas proporciones, expresada mediante su distribución a posteriori, puede propagarse a RR como una distribución de probabilidad a posteriori, p(RR | datos) (figura 8). Esta distribución no es analítica, pero puede aproximarse a través de una simulación Montecarlo a partir de las dos distribuciones a posteriori, p(θs | datos) y p(θE | datos). De forma aproximada, la media a posteriori de RR es 1,160, su desviación típica es 0,346 y la probabilidad a posteriori de que RR sea > 1 es 0,641. Un análisis frecuentista análogo sería más complicado matemáticamente y no proporcionaría una valoración probabilística directa de RR.
Figura 8. Distribución a posteriori del riesgo relativo de muerte al cabo de 1 año en pacientes con stents de tipo S frente a pacientes con stents de tipo E. El área de la región sombreada es la probabilidad, 0,641, de que la proporción de muertes en el grupo S sea mayor que en el grupo E.
Si comparamos ambos grupos según el RA de muerte al cabo de 1 año, nuestro objetivo sería RA = θs−θE. Se trata de una diferencia entre dos proporciones que podrá tomar valores entre −1 y 1. Valores negativos indicarán que la proporción de muertes en el grupo E es mayor que la del grupo S, y valores positivos indicarán lo contrario. La figura 9 muestra la distribución a posteriori de RA.
Figura 9. Distribución a posteriori del riesgo absoluto de muerte al cabo de 1 año en pacientes con stents de tipo S frente a pacientes con stents de tipo E. El área de la región sombreada es la probabilidad, 0,641, de que la proporción de muertes en el grupo S sea mayor que en el grupo E.
La media a posteriori de RA es 0,004, la desviación típica es 0,011 y con una probabilidad de 0,641 RA será > 0.
CONTRASTAR HIPÓTESIS: VALORES de p FRECUENTISTAS
Los contrastes de hipótesis son el tema que más discrepancias genera entre la comunidad científica bayesiana y frecuentista, porque es donde se evidencian más claramente las consecuencias de su diferente concepción de la probabilidad. Contrastar hipótesis es contrastar teorías. La mayoría de las nuevas teorías aparecen en el escenario científico de forma poco ruidosa y van acumulando, poco a poco, evidencia a su favor hasta que consiguen desbancar a las vigentes hasta ese momento.
El concepto más utilizado y conocido en la estadística frecuentista es el valor de p, así como su cifra de 0,05, que aparece en algunos estudios como un número mágico con el que se rechazan o aceptan hipótesis o teorías científicas. El valor de p es una herramienta propia de la inferencia frecuentista inexistente en la bayesiana para contrastar dos hipótesis: la hipótesis nula H0 (que suele representar la teoría científica vigente) y la hipótesis alternativa H1 (una nueva teoría). Los valores de p siempre están asociados a los datos, porque sin datos no hay valores de p. En estas condiciones, el significado del valor de p es la probabilidad de que un cierto resumen teórico de los datos sea igual al observado o más incompatible con la hipótesis nula en el supuesto de que dicha hipótesis sea cierta. Dicha compatibilidad viene marcada habitualmente por el umbral p = 0,05. Valores de p ≥ 0,05 mantienen la confianza en la hipótesis nula y valores de p < 0,05 favorecen la alternativa.
El uso excesivo, y a veces no adecuado, de los valores de p en estudios científicos es un tema de discusión en el mundo estadístico. Empezó en ambientes estadísticos reducidos y fue creciendo a medida que aumentaba el uso del valor de p más como un elemento «mágico» que como una herramienta científica. En 2014, la American Statistical Association, una de las sociedades estadísticas más importantes del mundo, abordó el tema y desarrolló un documento al respecto que se ha convertido en referente10. Algunas de las conclusiones sobre los valores de p relevantes para el tratamiento de datos biomédicos son:
-
1. Son una medida probabilística de la compatibilidad de los datos con la hipótesis nula. Cuanto más pequeño es un valor de p, más incompatibilidad muestran los datos con ella.
-
2. No valoran la probabilidad de que una hipótesis sea cierta ni tampoco de que no lo sea.
-
3. Las conclusiones de un estudio no deberían basarse únicamente en si un valor de p supera o no un determinado umbral. La utilización del término «estadísticamente significativo» (p < 0,05) para establecer conclusiones distorsiona cualquier procedimiento científico.
-
4. No proporcionan una medida del tamaño de un efecto ni de la importancia de un resultado. Cualquier efecto pequeño puede producir valores de p pequeños cuando el tamaño muestral o la precisión de las medidas es grande, y cualquier efecto grande puede producir valores de p grandes con muestras pequeñas u observaciones poco precisas.
Los valores de p han sido injustamente tratados porque se les han atribuido unas propiedades tan fantásticas e irreales que al final se han vuelto en su contra. Su discusión ha sacudido positivamente el debate científico y ha impulsado la crítica en disciplinas científicas que usan los datos para generar conocimiento. El enorme interés que despiertan en la actualidad los temas de reproducibilidad científica le debe mucho a ese debate11-15.
ACUMULAR EVIDENCIA PARA VALORAR PROBABILÍSTICAMENTE NUEVAS TEORÍAS
El concepto bayesiano de la probabilidad es el elemento clave para contrastar hipótesis y teorías, porque permite asignar probabilidades directas a hipótesis y teorías, tanto previas, p(teoría es cierta), como a posteriori, p(teoría es cierta|datos )16.
La estadística frecuentista basa su tratamiento de los contrastes de hipótesis en probabilidades del tipo p(datos|teoría es cierta), mientras que la estadística bayesiana lo basa en probabilidades de la forma p(teoría es cierta|datos). La probabilidad frecuentista p(datos|teoría es cierta) asume como cierta la teoría que se quiere contrastar y bajo esa suposición valora la concordancia de los datos con dicha hipótesis. La probabilidad bayesiana p(teoría es cierta|datos) valora probabilísticamente la certeza de la teoría objeto de análisis en relación con los datos obtenidos.
La herramienta fundamental de la estadística bayesiana para elegir entre las hipótesis
H0: la teoría 1 es cierta
H1: la teoría 2 es cierta
basándose en un conjunto de datos es el factor Bayes17, el cociente entre la probabilidad asociada a los datos según ambas teorías. Puede expresarse también como el cociente entre las odds a posteriori (p(la teoría 1 es cierta | datos ) / p(la teoría 2 es cierta | datos )) a favor de la certeza de la teoría 1 en relación a la de la teoría 2 y las correspondientes odds a priori (p(la teoría 1 es cierta) / p(la teoría 2 es cierta). De esta forma:
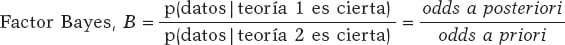
El factor Bayes (B) representa la evidencia a favor de la certeza de la teoría 1 (en relación a la de la teoría 2) proporcionada por los datos: transforma probabilidades a priori en probabilidades a posteriori. Al factor Bayes en escala logarítmica, log (B), se le conoce también como «peso de la evidencia», término que fue acuñado por Turing en Bletchley Park durante la Segunda Guerra Mundial. Valores pequeños del factor Bayes dan poco soporte a H0 frente a H1, y valores grandes proporcionan una fuerte cobertura a H0.
Ejemplo I: infecciones y test (continuación)
Retomemos los datos del ejemplo I: Vallivana necesita tener un diagnóstico sobre la infección con dos resultados positivos del test. Este problema puede plantearse como un contraste entre dos hipótesis:
H0: Vallibana tiene la infección
H1: Vallibana no tiene la infección
Asumimos que Vallibana no tiene ninguna característica especial que la haga tener una probabilidad de infección diferente que el resto de la población. Consecuentemente, sabemos que p(Vallibana tiene la infección) = 0,004 y p(Vallibana no tiene la infección) = 0,996. Las odds a priori para Vallibana a favor de la infección en relación con la no infección son:
Vallibana se hace el test y sale positivo (+1). Decide repetírselo y vuelve a dar positivo (+2.). Las odds a posteriori para Vallibana a favor de la infección en relación con la no infección son:

El factor Bayes a favor de que Vallibana tenga la infección, o sea, el cociente entre las odds a posteriori y a priori, es 987,75. Este valor proporciona una fuerte evidencia a favor de que Vallibana esté realmente infectada (+).
Ejemplo II: corazón de niñas y niños con atrofia muscular espinal (continuación)
Volvemos al estudio de Falsaperla et al.6 del ejemplo II con el objetivo de comparar la longitud media del PR en niñas y niños con AME1 y AME2, que denotaremos μ1 y μ2, respectivamente, a través del contraste de hipótesis:
H0: μ2 ≤ μ1
H1: μ2 > μ1
en el que la hipótesis nula, H0, afirma que la longitud media del PR en niñas y niños con AME2 es menor o igual que en los niños con AME1. La hipótesis alternativa H1 afirma lo contrario. Continuamos trabajando con datos normales simulados en ambos grupos: n1 = 14 observaciones en el grupo AME1 con media y desviación típica muestral de 0,10 y 0,02 segundos, respectivamente, y n2 = 14 observaciones del grupo AME2 con media y desviación típica muestral de 0,13 y 0,03 segundos, respectivamente.
Construimos un proceso inferencial para la media de cada grupo por separado. En ambos casos, consideramos una distribución previa neutra que conceda todo el protagonismo a los datos. La figura 10 muestra la distribución a posteriori de la media de cada grupo. Ambas distribuciones están bastante separadas, por lo que las probabilidades a posteriori asociadas a cada hipótesis son bastante diferentes: 0,002 para H0 y 0,998 para H1.
Figura 10. Distribución a posteriori de la longitud media del intervalo PR en niñas y niños afectados por atrofia muscular espinal tipo 1 (color verde) y tipo 2 (color gris).
p(H0|datos) = p(μ2 ≤ μ1|datos) = 0,002
p(H1|datos) = p(μ2 > μ1|datos) = 0,998
Aproximadamente es 500 veces más probable que H1 sea cierta que no lo sea. Ante tal cantidad de evidencia, la decisión más sensata es elegir H1. El tratamiento frecuentista de este contraste se basa en el valor de p. En nuestro caso, obtendríamos un valor de p = 0,002, que implicaría rechazar la hipótesis nula en favor de la alternativa. Ambas metodologías proponen la misma decisión y proporcionan los mismos resultados numéricos: probabilidades de 0,002; sin embargo, ambas probabilidades son conceptualmente distintas. La probabilidad bayesiana valora la hipótesis nula en relación con los datos observados, mientras que la probabilidad frecuentista valora los datos observados en el supuesto de que la hipótesis nula sea cierta.
Seguimos inspirándonos en Falsaperla et al.6 y recordamos que nuestros ejemplos no están basados en los trabajos originales y que solo tienen objetivos ilustrativos de los procedimientos bayesianos. Trabajamos ahora con la longitud de la onda P del electrocardiograma. Queremos comparar la longitud media de dicha onda en niños con AME1 y con AME2. Simulamos 14 observaciones de la longitud de la onda P en el grupo de niños con AME1 y en el de niños con AME2. La media y la desviación típica muestral son 0,09 y 0,05 segundos en el grupo AME1, respectivamente, y 0,07 y 0,03 segundos en el grupo AME2. Comparamos las medias de ambos grupos a través del contraste de hipótesis:
H0: media onda P en AME1 = media onda P en AME2
H1: media onda P en AME1 > media onda P en AME2
según un proceso inferencial bayesiano similar al del ejemplo anterior. La figura 11 muestra la distribución a posteriori de la longitud media de la onda P en ambos grupos. Puede observarse que los datos del grupo de niñas y niños con AME2 son menores que los del grupo con AME1. La probabilidad a posteriori asociada a cada hipótesis es:
Figura 11. Distribución a posteriori de la longitud media de la onda P en niñas y niños afectados por atrofia muscular espinal tipo 1 (color verde) y tipo 2 (color gris).
p(H0 | datos) = p(media onda P en AME1 ≤ media onda P
en AME2 | datos)
p(H1 |datos) = p(media onda P en AME1 > media onda P
en AME2 | datos)
Estos resultados proporcionan una notable evidencia a favor de la hipótesis alternativa, que es casi 8 veces más probable que H0. Desde el punto de vista frecuentista, el valor de p asociado a los datos sería 0,107 (> 0,05), por lo que concluiríamos afirmando que los datos no proporcionan evidencia para rechazar H0. La decisión bayesiana podría ser perfectamente la misma, pero el análisis bayesiano proporciona la valoración directa de la certeza de ambas hipótesis. Los resultados del análisis bayesiano podrían aprovecharse como información previa en un futuro estudio con más datos. De esta forma, las distribuciones a posteriori obtenidas (figura 11) serían las distribuciones previas en ese nuevo estudio. El teorema de Bayes permite generar conocimiento de forma secuencial para buscar evidencia a favor o en contra de las hipótesis.
ALGUNAS DUDAS QUE PLANTEA LA CARDIOLOGÍA SOBRE LA APLICACIÓN DE LA METODOLOGÍA EN ESTUDIOS CLÍNICOS
Uno de los temas más controvertidos en la metodología bayesiana es la selección de distribuciones previas. Un análisis bayesiano permite siempre la posibilidad de no utilizar ninguna información sobre la cantidad de interés que no sea la proporcionada por los datos. En este caso, se trabaja con distribuciones previas que desempeñan un papel neutro en el proceso de aprendizaje, que únicamente sirven como punto de partida para el inicio del protocolo inferencial bayesiano.
Las distribuciones previas informativas contienen información adicional a la proporcionada por los datos, como por ejemplo conocimiento experto18-20 o resultados de estudios anteriores21,22. Se trata de una característica bayesiana muy valiosa en estudios en los que se dispone de pocos datos, como por ejemplo enfermedades raras y medicamentos huérfanos. Es importante co-mentar que los procesos inferenciales basados en previas informaciones deberían incluir un análisis de sensibilidad de los resultados obtenidos con respecto a la(s) distribución(ones) previa(s) utilizada(s). Asimismo, es cada vez más frecuente considerar comunidades de distribuciones previas, con distribuciones pre vias diversas, más o menos escépticas o entusiastas con el efecto que se desea probar, porque proporcionan un marco científico de referencia.
En los ensayos clínicos, la utilización de distribuciones previas informativas permite, en muchas ocasiones, reducir los tamaños muestrales frecuentistas basados en valores preasignados de la potencia del test y en estimaciones previas de los parámetros22. Un ejemplo de dicha situación es el estudio BIOSTEMI8. La muestra de 1.300 pacientes fue estimada por métodos bayesianos a través de una distribución previa robusta en forma de mixtura que incorpora en igual proporción información histórica de 407 pacientes procedentes del ensayo BIOSCIENCE23 y una distribución prácticamente no informativa. La flexibilidad del aprendizaje secuencial bayesiano es un elemento clave en los llamados diseños bayesianos adaptativos24, que permiten incorporar información adicional en diferentes fases del ensayo sin que peligren la consistencia y la fiabilidad de sus resultados.
FINANCIACIÓN
Este trabajo ha sido subvencionado parcialmente por Biotronik Spain S.A. y por el proyecto PID2019-106341GB-I00 del Ministerio de Ciencia e Innovación del Gobierno de España.
CONTRIBUCIÓN DE LOS AUTORES
C. Armero es la responsable de la estructura, el contenido y la escritura del trabajo. P. Rodríguez y J.M. de la Torre Hernández han participado en la revisión del trabajo de forma activa.
CONFLICTO DE INTERESES
C. Armero, P. Rodríguez y J.M. de la Torre Hernández declaran no tener ningún conflicto de intereses con respecto al contendido, la autoría y la publicación de este trabajo. J.M. de la Torre Hernández es editor jefe de REC: Interventional Cardiology. Se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito.
BIBLIOGRAFÍA
1. Hawking S. A Brief History of Time:The Origin and Fate of the Universe. New York:Bantam;1988.
2. McGrayne SB. La teoría que nunca murió:De cómo la regla de Bayes permitiódescifrar el código Enigma, perseguir los submarinos rusos y emerger triunfante de dos siglos de controversia. Barcelona:Crítica;2012.
3. Metropolis N, Rosenbluth A, Rosenbluth M, Teller A, Teller E. Equations of state calculations by fast computing machines. J Chem Phys. 1953;21:1087-1092.
4. Robert CP, Casella G. A Short History of Markov Chain Monte Carlo:Subjective Recollections from Incomplete Data. Stat Sci. 2011;26:102-115.
5. Gelfand AE, Smith AFM. Sampling-based approaches to calculating marginal densities. J Am Stat Assoc. 1990;85:398-409.
6. Falsaperla R, Vitaliti G, Collotta AD, et al. Electrocardiographic Evaluation in Patients With Spinal Muscular Atrophy:A Case-Control Study. J Child Neurol. 2018;33:487-492.
7. Robert CP, Chopin N, Rousseau J. Harold Jeffreys's Theory of Probability Revisited. Stat Sci. 2009;24:141-172.
8. Iglesias JF, Muller O, Heg D, et al. Biodegradable polymer sirolimus-eluting stents versus durable polymer everolimus-eluting stents in patients with ST-segment elevation myocardial infarction (BIOSTEMI):a single-blind, prospective, randomised superiority trial. Lancet. 2019;394:1243-1253.
9. Christensen R, Johnson W, Branscum A, Hanson TE. Bayesian Ideas and Data Analysis:An Introduction for Scientists and Statisticians. Boca Raton:CRC Press;2011.
10. Wasserstein RL, Lazar NA. The ASA Statement on p-Values:Context, Process, and Purpose. Am Stat. 2016;70:129-133.
11. Goodman SN. Toward Evidence-Based Medical Statistics. 1:The P Value Fallacy. Ann Intern Med. 1999;130:995-1004.
12. Greenland S, Senn SJ, Rothman KJ, et al. Statistical tests, P values, confidence intervals, and power:a guide to misinterpretations. Eur J Epidemiol. 2016;31:337-350.
13. Halsey LG, Curran-Everett D, Vowler SL, Drummond GB. The fickle P value generates irreproducible results. Nat Methods. 2015;12:179-185.
14. Ioannidis JPA. Why Most Published Research Findings Are False. PLoS Med. 2005;2:e124.
15. Ioannidis JPA. The Proposal to Lower P Value Thresholds to .005. J Am Med Assoc. 2018;319:1429-1430.
16. Kruschke JK. Doing Bayesian data analysis:A Tutorial with R, JAGS, and Stan. 2nd ed. Amsterdam:Academic Press/Elsevier;2015.
17. Kass RE, Raftery AE. Bayes Factors. J Am Stat Assoc. 1995;90:773-795.
18. Hampson LV, Whitehead J, Eleftheriou D, et al. Elicitation of Expert Prior Opinion:Application to the MYPAN Trial in Childhood Polyarteritis Nodosa. PLoS One. 2015;10:e0120981.
19. Mason AJ, Gomes M, Grieve R, Ulug P, Powell JT, Carpenter J. Development of a practical approach to expert elicitation for randomised controlled trials with missing health outcomes:Application to the IMPROVE trial. Clin Trials. 2017;14:357-367.
20. Jansen JO, Wang H, Holcomb JB, et al. Elicitation of prior probability distributions for a proposed Bayesian randomized clinical trial of whole blood for trauma resuscitation. Transfusion. 2020;60:498-506.
21. Grant RL. The uptake of Bayesian methods in biomedical meta-analyses:A scoping review (2005–2016). J Evidence-Based Med. 2019;12:69-75.
22. Spiegelhalter DJ, Abrams KR, Myles JP. Bayesian Approaches to Clinical Trials and Health-Care Evaluation. Chichester:Wiley;2004.
23. Pilgrim T, Heg D, Roffi M, et al. Ultrathin strut biodegradable polymer sirolimus-eluting stent versus durable polymer everolimus-eluting stent for percutaneous coronary revascularisation (BIOSCIENCE):a randomised, single-blind, non- inferiority trial. Lancet. 2014;384:2111-2122.
24. Schmidli H, Gsteiger S, Roychoudhury A, O'Hagan A, Spiegelhalter D, Neuenschwander B. Robust meta-analytic-predictive priors in clinical trials with historical control information. Biometrics. 2014;70:1023-1032.
* Autor para correspondencia:
Correo electrónico: Carmen.armero@uv.es (C. Armero).
- Denervación renal en el tratamiento de la hipertensión arterial. Posicionamiento conjunto de la SEH-LELHA y la ACI-SEC
- Valoración de la función endotelial y provocación de vasoespasmo coronario mediante infusión intracoronaria de acetilcolina. Documento técnico de la ACI-SEC
- Actualización de las recomendaciones sobre requisitos y equipamiento en cardiología intervencionista
- Atención de la cardiopatía isquémica en salas de cateterismo durante la contingencia sanitaria por pandemia de COVID-19. Recomendaciones de la Sociedad de Cardiología Intervencionista de México (SOCIME)