RESUMEN
El cierre percutáneo de la orejuela izquierda ha ido emergiendo como un procedimiento cada vez más prometedor para pacientes con fibrilación auricular no valvular y riesgo hemorrágico muy alto o prohibitivo. Se trata de una técnica segura, con un porcentaje de complicaciones bajo; sin embargo, algunas de ellas, como la embolización del dispositivo, pueden ser graves, y la toma de decisiones y la estrategia más adecuada pueden ser difíciles debido a la escasa evidencia disponible. La presente revisión proporciona un resumen de los aspectos más importantes sobre la embolización de dispositivos de cierre de la orejuela izquierda, tanto en su prevalencia como en su abordaje y las opciones de tratamiento.
Palabras clave: Cierre de orejuela. Embolización. Dispositivos.
ABSTRACT
Percutaneous left atrial appendage closure has emerged as a promising procedure for patients with non-valvular atrial fibrillation with a very high or prohibitive bleeding risk. It is a safe technique, with a low rate of complications; however, complications, such as device embolization can be potentially serious, and decision-making as well as selecting the most appropriate strategy may be challenging due to the limited evidence available in this context. This review provides an overview of the most critical aspects of left atrial appendage closure device embolization focusing on its prevalence, management strategies, and treatment options.
Keywords: Left atrial appendage closure. Embolization. Devices.
Abreviaturas
AI: aurícula izquierda. ETE: ecocardiograma transesofágico. VI: ventrículo izquierdo.
INTRODUCCIÓN
La fibrilación auricular se ha convertido en la arritmia más frecuente de nuestros tiempos. Se estima que su prevalencia en la población española es de un 4,4% en las personas mayores de 40 años, lo que en números absolutos se traduce en más de 1 millón de españoles con este trastorno del ritmo1. Desde hace años existe una sólida evidencia sobre su relación con el aumento de la incidencia de ictus y de la mortalidad de causa cardiovascular en ambos sexos2,3, por lo que la anticoagulación a dosis terapéuticas es un pilar fundamental del tratamiento de estos pacientes. Sin embargo, en aquellos con riesgo hemorrágico elevado o prohibitivo, el cierre percutáneo de la orejuela izquierda ha emergido como una alternativa razonable y no inferior al tratamiento anticoagulante en lo que respecta a eventos cardioembólicos, muerte de causa cardiovascular y sangrado clínicamente relevante4.
Aunque la tasa de complicaciones intraprocedimiento y posimplante se mantiene baja, al aumentar el número de procedimientos realizados en todo el mundo la tasa de embolización del dispositivo se sitúa actualmente en torno al 0-1.5% de todos los procedimientos realizados5.
La presente revisión resume la evidencia disponible acerca de la embolización de dispositivos de cierre percutáneo de la orejuela izquierda, mediante una descripción de los tipos de dispositivos disponibles, los potenciales predictores de embolización y el tratamiento recomendado para cada caso.
TIPOS DE DISPOSITIVOS
A continuación, se describen brevemente los 3 tipos de dispositivos que se encuentran disponibles en nuestro medio.
Familia WATCHMAN
Los WATCHMAN (Boston Scientific, Estados Unidos) son una familia de dispositivos de un único lóbulo de cierre que se implanta a unos 10 mm del ostium de la orejuela izquierda, por lo que este no queda cubierto.
En 2020, Boston Scientific sacó al mercado la nueva generación, WATCHMAN FLX, que en un metanálisis de 54.727 pacientes demostró ser superior en términos de mortalidad de causa cardiovascular, sangrados mayores, derrame pericárdico y embolización del dispositivo respecto a su predecesor, WATCHMAN 2.5. Esto se debe en parte a su menor superficie metálica, lo que reduce el riesgo de trombosis, y al mayor número de ganchos (18 frente a 10), lo que permite una mejor adaptación al ostium con menor incidencia de fugas6,7. Está disponible en 5 tamaños diferentes, que abarcan ostium desde 14 hasta 31,5 mm.
La Food and Drug Administration aprobó en 2024 el dispositivo WATCHMAN FLX pro, que incorpora como novedad una membrana de tejido recubierta de un fluoropolímero diseñada para aumentar la resistencia a los trombos y facilitar la endotelización, lo cual podría traducirse en regímenes antitrombóticos más cortos tras el procedimiento. Ha mostrado resultados prometedores en casos clínicos publicados8 y está en marcha un estudio unicéntrico, el WATCHMAN FLX PRO CT (NCT05567172), cuyo objetivo es determinar la morfología y la cobertura tisular de la superficie del dispositivo a los 90 días del implante. No dispone aún del marcado CE (Conformidad Europea) para su comercialización en Europa.
Familia Amplatzer
En 2013 obtuvo el marcado CE la segunda generación de esta familia: el Amplatzer Amulet (Abbott, Estados Unidos) (figura 1A). Consta de un lóbulo de cierre, que se suele implantar a 10-15 mm del ostium, y de un disco que permite cubrirlo por completo. Ambas partes están conectadas por una cintura central. Sus dimensiones se basan y miden en función de la zona de aterrizaje (landing zone) que presente la orejuela, que es el sitio donde descansa el lóbulo del dispositivo. Está disponible en varios tamaños, desde 16 hasta 34 mm, que cubren una superficie de zona de aterrizaje de la orejuela que abarca de 11 a 31 mm9.
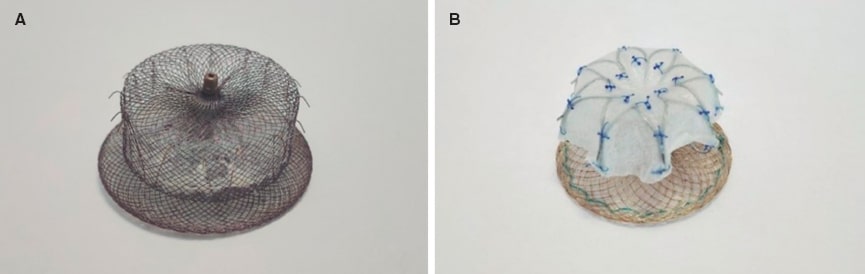
Figura 1. A: dispositivo Amplatzer. B: dispositivo LAmbre.
El estudio Amulet IDE10, que comparó el Amplatzer Amulet con el dispositivo WATCHMAN de primera generación, concluyó que la tasa de oclusión de la orejuela izquierda fue mayor con el dispositivo de doble sellado. Asimismo, se demostró la no inferioridad del primero con respecto a la seguridad y la efectividad en la reducción de ictus para pacientes con fibrilación auricular no valvular, pero se observó una incidencia más alta, casi el doble, de eventos adversos, como derrame pericárdico y embolización del dispositivo, si bien es cierto que la experiencia era mayor en aquel momento con los dispositivos WATCHMAN, lo cual pudo influir en que aparecieran más complicaciones con el dispositivo Amplatzer10. Los resultados de no inferioridad se mantuvieron en el análisis a 5 años, con un porcentaje significativamente mayor de pacientes sin anticoagulación prescrita en el grupo de Amplatzer (94 frente a 91%; p = 0,009) y una tasa muy baja de ictus al año en ambos grupos (1,6% por año), con una incidencia mayor de ictus mortal en el grupo de WATCHMAN (1,9 frente a 1,2%; p = 0,03)11.
En un estudio que comparó las 2 generaciones de dispositivos Abbott se concluyó que la segunda presentaba una menor incidencia de fugas residuales peridispositivo, pero no hubo diferencias significativas en cuanto a la tasa de complicaciones mayores ni la mortalidad, y la tasa de éxito en el implante fue similar12.
LAmbre
LAmbre es un dispositivo de doble mecanismo de sellado (lóbulo y disco) de la marca comercial Lifetech Scientific Corporation (China) (figura 1B). Abarca una gama de 15 tamaños diferentes (16-36 mm) y está fabricado con una malla de nitinol y una membrana de poliéster. Su diseño presenta 8 ganchos distales y 8 ganchos con forma de U, que confieren una mayor estabilización debido a un mejor anclaje en las trabéculas de la orejuela. Obtuvo el marcado CE en 2016.
En un estudio prospectivo multicéntrico realizado en China con 103 pacientes, el dispositivo LAmbre tuvo una tasa de éxito del implante del 98,05%. La incidencia de derrame pericárdico posprocedimiento en los primeros 7 días fue del 4,95%, y ninguno requirió tratamien- to activo. Un paciente presentó ictus a los 2 meses del procedimiento, en contexto de reducción de dosis de anticoagulante. No se observó trombosis del dispositivo en ningún paciente, si bien es cierto que el tiempo medio de seguimiento fue de solo 12,2 meses13.
Este dispositivo tiene la peculiaridad de que es posible fabricarlo a medida en caso de orejuelas anatómicamente complejas o con dimensiones fuera del rango normal.
INCIDENCIA DE EMBOLIZACIÓN
La embolización del dispositivo de cierre de la orejuela, ya sea a una cavidad cardiaca, a un vaso grande o a un vaso periférico, es una complicación infrecuente, pero potencialmente mortal, con incidencias de mortalidad que llegan hasta el 10,2% en los registros publicados. La experiencia de los cardiólogos intervencionistas o electrofisiólogos que realizan el implante de los dispositivos, así como el número de procedimientos por año en cada hospital, se han relacionado de manera significativa con diferencias en la incidencia de embolización (0,6 y 1,5% en centros de alto y bajo volumen, respectivamente)5.
En cuanto al tipo de dispositivo utilizado y la incidencia de embolización, la relación no está del todo clara. El dispositivo WATCHMAN FLX presenta una incidencia menor que su predecesor WATCHMAN 2.5, (odds ratio = 0,35; intervalo de confianza del 95%, 0,18-0,70; p < 0,02), como ya se demostró en un metanálisis con 54.727 pacientes publicado en 20236, y llega a ser del 0% en el estudio PINNACLE FLX7.
En cuanto al dispositivo Amulet, el estudio Amulet IDE, que comparó este implante con el WATCHMAN, mostró una incidencia de embolización del 0,6 y el 0,2%, respectivamente, pero los autores argumentan estos resultados en parte por la menor experiencia de los operadores en ese momento con el dispositivo Amulet10. En el estudio SWISS-APERO, de 2021, en el que se comparó con el dispositivo WATCHMAN FLX, ambos presentaron similar incidencia de embolización (0,9% en los dos grupos)14.
Por su parte, en una revisión sistemática de 403 pacientes publicada en 2020, con el dispositivo LAmbre no hubo ningún caso de embolización15, y en otro ensayo alemán de 2024 con 118 pacientes la incidencia fue del 1,7%, pero el procedimiento se realizaba sin contraste, lo cual supone un sesgo importante al interpretar este incremento en la incidencia de complicaciones16. En las diversas experiencias españolas, la tasa ha sido de prácticamente el 0%17,18, y en la experiencia inicial brasileña fue del 2%, si bien el tamaño muestral era pequeño (1 caso de 51 pacientes incluidos)19.
Por lo tanto, basándose en estos datos se puede afirmar que la incidencia de embolización de los distintos dispositivos se sitúa en torno al 1%, sin diferencias significativas entre ellos.
Es importante señalar que, entre los factores que influyen en la embolización, se encuentran no solo las características del dispositivo, sino también las características anatómicas y morfológicas de la orejuela. Se ha reportado que las orejuelas tipo cactus, que son aquellas con un lóbulo central dominante del que parten muchos y pequeños lóbulos secundarios, se asocian a mayor riesgo de embolización. Asimismo, las orejuelas poco profundas y con cuellos anchos también se han relacionado con mayor riesgo de embolización del dispositivo20,21.
Se ha descrito que el ritmo cardiaco del paciente podría influir en un mayor riesgo de embolización del dispositivo, aunque no está del todo claro su papel. Parece lógico, y así se ha postulado en algunos casos publicados22, que una orejuela contráctil, es decir, la que se encuentra en ritmo sinusal, tenga un mayor riesgo de migración o embolización del dispositivo por la mayor fuerza de contracción comparada con aquella en fibrilación auricular. A su vez, la conversión del ritmo, sea de sinusal a fibrilación auricular o viceversa, también se ha postulado como un posible mecanismo que favorece la embolización.
En un análisis retrospectivo de embolizaciones de dispositivos tipo WATCHMAN a partir de datos del registro NCDR LAAO23, se concluyó que los pacientes que se encuentran en ritmo sinusal en el momento del implante parecen tener mayor riesgo de embolización tardía del dispositivo (primeros 45 días tras el alta), posiblemente porque la contracción activa de la orejuela en ritmo sinusal puede llevar a una subestimación del tamaño del ostium. Ante una caída posterior en fibrilación auricular (estado en el cual la orejuela suele estar más dilatada), el dispositivo puede quedar infraajustado, lo que favorecería su migración23.
En cuanto al momento de aparición, en la revisión realizada por Eppinger et al.5 se evidenció que la embolización del dispositivo fue más frecuente en el periodo agudo (primeras 24 h desde el implante) excepto en las arterias periféricas, en las que fue más prevalente en el periodo tardío (> 45 días).
En la tabla 1, la figura 2 y la figura 3 se presenta un resumen de las características de los dispositivos y sus tasas de embolización.
Tabla 1. Características y tasa de embolización de los dispositivos con marcado CE
| Dispositivo | Año CE | Características específicas | Tasas de embolización |
|---|---|---|---|
| WATCHMAN FLX, Boston Scientific | 2019 | Diseño en forma de paraguas
Menor superficie metálica que su predecesor 18 ganchos de fijación |
PINNACLE FLX7, 2021: 0 %
SWISS-APERO14, 2021: 0,9% SEAL-FLX24, 2022: 0% Della Rocca et al.25, 2022: 0% SURPASS FLX26, 2024: 0,04% |
| Amplatzer Amulet, Abbott | 2013 | Disco proximal y lóbulo distal
Disco proximal independiente del lóbulo, sin tornillo 10 pares de ganchos en el disco distal Longitud de la cintura hasta 20 mm (mayor adaptabilidad) Diámetro del disco 40% más grande que el lóbulo |
Kleinecke et al.12, 2020: 0,9%
AMULET IDE10, 2021: 0,6% SWISS-APERO14, 2021: 0,9% SEAL-FLX24, 2022: 0,7% Della Rocca25, 2022: 0,1% |
| LAmbre, Lifetech | 2016 | Paraguas ajustable más cubierta de poliéster 8 pares de ganchos radiales en forma de U
Amplia variedad de tamaños (hasta 40 mm) |
Cruz-González et al.18, 2018: 0%
Li et al.27, 2018: 0% Park et al.28, 2018: 0% Huang et al.29, 2019: 0% Ali et al.15, 2020: 0% Llagostera-Martín et al.17, 2021: 0% Wang et al.30, 2021: 0% Chamié et al.19, 2022: 2% Chen et al.31, 2022: 0% Vij et al.16, 2024: 1,7% (sin contraste) |
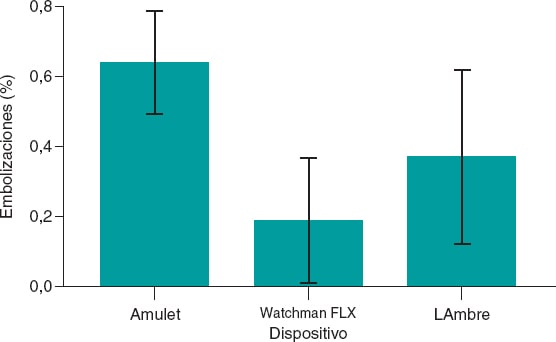
Figura 2. Gráfico de barras que muestra el porcentaje de embolizaciones de los dispositivos.
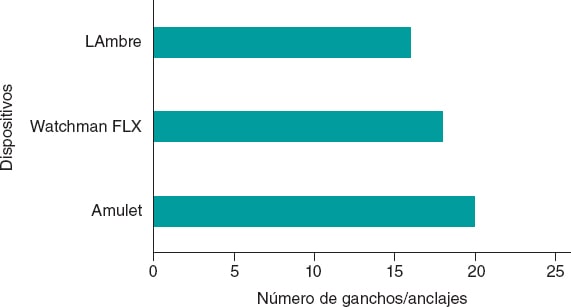
Figura 3. Dispositivos y número de ganchos y anclajes que presentan.
TÉCNICAS PARA REDUCIR EL RIESGO DE EMBOLIZACIÓN DEL DISPOSITIVO
Existen diversos factores relacionados con la anatomía de la aurícula y la orejuela izquierdas, el procedimiento per se y el dispositivo implantado que pueden favorecer un mayor riesgo de embolización. En mayo de 2023 se publicó un consenso de expertos de la Society for Cardiovascular Angiography & Interventions y la Heart Rhythm Society sobre el procedimiento de cierre de la orejuela izquierda y sus complicaciones32, en el que se abordan los aspectos más importantes (tabla 2). La elección correcta del tamaño del dispositivo es crucial, ya que tanto el sobre- como el infradimensionamiento favorecen la embolización. Además, los operadores deben estar entrenados y familiarizados con el procedimiento del implante (se recomienda haber realizado al menos 25 punciones transeptales y un mínimo de 10 cierres de orejuela como operador principal), así como con la recuperación del dispositivo embolizado (para lo cual se aconseja experiencia en el manejo de vainas de gran calibre y lazos de recuperación). En cuanto a las técnicas de imagen, pueden considerarse distintos momentos del procedimiento:
Tabla 2. Prevención de la embolización en las distintas fases del procedimiento
| Preprocedimiento | Intraprocedimiento | Posprocedimiento |
|---|---|---|
| Elección correcta del tamaño del dispositivo (evitar sobre- e infradimensionamiento) | Guía intraoperatoria mediante ETE 2D y 3D, y fluoroscopia | Verificación posoperatoria inmediata con ETT para detección temprana de embolizaciones |
| Entrenamiento adecuado del operador (mínimo 25 punciones transeptales y 10 cierres de orejuela) | Realización correcta del tug test (aunque su utilidad es debatida) | Evaluación prealta con ETT |
| Uso de técnicas de imagen preoperatorias: ETE 2D y 3D en múltiples ángulos o TC | Cumplimiento de criterios PASS (WATCHMAN) o CLOSE (Amplatzer) antes de liberar el dispositivo | Control de seguimiento a los 45-90 días con ETE o TC |
| La TC 3D es superior al ETE en la planificación del procedimiento | ||
| Evitar aurículas muy deplecionadas (< 12 mmHg) | ||
|
2D: bidimensional; 3D: tridimensional; ETE: ecocardiograma transesofágico; ETT: ecocardiograma transtorácico; TC: tomografía computarizada. |
||
- – En el preoperatorio se recomienda realizar un estudio dirigido mediante ecocardiograma transesofágico (ETE), obtener imá- genes bidimensionales en ángulos de 0°, 45°, 90° y 135°, y utilizar la técnica ETE tridimensional de manera sistemática, ya que proporciona una mejor precisión del tamaño. La tomografía computarizada cardiaca está cada vez más reconocida como una técnica superior al ETE para planificar el procedimiento, ya que ofrece mejor resolución espacial y permite identificar con más precisión el diámetro máximo de la zona de aterrizaje. Además, las reconstrucciones tridimensionales proporcionan una imagen volumétrica de la orejuela izquierda, mejoran la predicción del tamaño del dispositivo y, en algunos casos, mediante softwares especializados, permiten simular el implante y planificar rutas de acceso y punciones transeptales20.
- – En el intraoperatorio, el procedimiento debe guiarse por técnicas de imagen, utilizando la fluoroscopia y la ETE tanto bi- como tridimensional. Una nueva modalidad, la ecografía intracardiaca tridimensional, está evolucionando como una técnica de imagen complementaria para guiar el procedimiento, aunque actualmente presenta mayor coste y más complejidad que el ETE debido a la necesidad de colocar la sonda en la aurícula izquierda (AI). Un aspecto importante es la medición de la presión de la AI durante el procedimiento, ya que se ha demostrado que aurículas muy deplecionadas tienden a dar medidas erróneas. En general, para una correcta interpretación se recomienda que la presión auricular sea ≥ 12 mmHg. En caso de presión auricular baja, se pueden administrar líquidos intravenosos hasta alcanzar unos parámetros adecuados32.
- – En el posoperatorio inmediato es preciso comprobar la correcta colocación del dispositivo y descartar la presencia de derrame pericárdico u otras complicaciones.
- – Antes del alta resulta fundamental el ecocardiograma transtorácico, ya que la mayoría de las embolizaciones se producen en el posoperatorio inmediato, entendiendo como tal las primeras 24 horas posteriores al implante33,34.
- – Como control de seguimiento se recomienda realizar ETE o tomografía computarizada a los 45-90 días del implante.
Las casas comerciales de WATCHMAN y Amplatzer recomiendan una serie de pasos en el procedimiento intraoperatorio para asegurarse de que el dispositivo está implantado correctamente; deben cumplirse todos antes de liberar el dispositivo.
Para el WATCHMAN se utiliza el acrónimo PASS (posición, anclaje, tamaño [size] y sellado), y para el Amplatzer el acrónimo es CLOSE (circunfleja, lóbulo, orientación, separación y elíptico), tal como se detalla en la tabla 3.
Tabla 3. Criterios PASS y CLOSE para los dispositivos WATCHMAN y Amplatzer
| Criterios | PASS (WATCHMAN) | CLOSE (Amplatzer) |
|---|---|---|
| 1 | Posición: cobertura adecuada del ostium, inmediatamente distal o en el mismo ostium | Circunfleja: el lóbulo del dispositivo debe estar 1/3 a 2/3 distal de la arteria circunfleja |
| 2 | Anclaje: prueba de tracción suave sin cambio en la posición del dispositivo | Lóbulo: apariencia de neumático al comprimirlo |
| 3 | Tamaño (size): compresión del dispositivo del 8 al 20% de su tamaño original | Orientación: el lóbulo del dispositivo debe ser coaxial con la pared de la orejuela izquierda |
| 4 | Sellado: fuga residual < 5 mm; todos los lóbulos están cubiertos | Separación adecuada del lóbulo y el disco |
| 5 | Elíptico: el disco debe estar bajo tensión con una apariencia cóncava |
Un aspecto importante es la realización de la prueba del «tirón» (tug test) durante el procedimiento para evaluar la estabilidad del dispositivo implantado. Consiste en aplicar una fuerza de tracción controlada al dispositivo una vez que ha sido desplegado en la orejuela, con el objetivo de asegurar que esté firmemente anclado y no se desplace. Su uso está muy difundido en todo el mundo y hoy en día se realiza de manera habitual. Sin embargo, en 2020, un estudio indagó sobre su eficacia y determinó su utilidad mediante el implante de un dispositivo en la vaina principal de liberación que era capaz de medir la fuerza ejercida en Newtons35. El dispositivo elegido para el estudio fue el Amulet y se encontró que la fuerza ejercida por el operador en la liberación del dispositivo era mayor que en el propio tug test posterior, tanto para dispositivos mayores (2,96 ± 0,57 frente a 1,04 ± 0,24 N; p < 0,001) como menores de 25 mm (1,72 ± 0,43 frente a 1,01 ± 0,59 N; p = 0,049), por lo que se concluyó que el tug test era redundante. Cabe decir que en todos los implantes del estudio (un total de 23) se cumplieron los criterios CLOSE recomendados por la casa comercial.
CÓMO TRATAR LAS EMBOLIZACIONES
El abordaje y el tratamiento de las embolizaciones depende fundamentalmente de 3 factores: el tamaño del dispositivo embolizado, el sitio a donde ha migrado y el estado hemodinámico del paciente. En la revisión realizada por Eppinger et al.5, el sitio más frecuente de migración fue la aorta (37%), seguida del ventrículo izquierdo (VI) (33,3%), la AI (24,3%) y las arterias periféricas (4,6%). Además, los autores llegaron a la conclusión de que la embolización en el VI o en el aparato subvalvular mitral era la que presentaba mayor grado de complicaciones y más necesidad de cirugía (44,4%). En la revisión sistemática llevada a cabo por Aminian et al.34, el sitio predominante de embolización se repartió entre la aorta y el VI (30% cada uno), con una predilección del dispositivo WATCHMAN por la aorta (7 casos de 9) y del Amplatzer Cardiac Plug (Abbott, Estados Unidos; ya no comercializado en España) por el VI (6 casos de 9). En esta revisión, todos los dispositivos mayores de 25 mm se alojaron en la AI o en el VI. En el estudio LAAODE33, el sitio más frecuente de embolización siguió siendo la aorta (30%), seguido de la AI (24%) y del VI (20%).
Una vez producida la embolización, actualmente se dispone de 2 abordajes fundamentales:
– Abordaje percutáneo: puede ser por acceso transarterial o transeptal. Normalmente se suelen utilizar lazos únicos o múltiples, pero también se ha descrito el uso de pinzas de biopsia endomiocárdica36. La elección de uno u otro método depende fundamentalmente del tamaño, la localización y la anatomía del dispositivo. Alkhouli et al.36 publicaron una serie de recomendaciones: los lazos únicos son mejores para dispositivos grandes, la vaina debe ser 2-4 Fr más grande que el tamaño de la vaina requerido para implantar el dispositivo, y los dispositivos de nitinol (por ejemplo, Amplatzer) pueden doblarse y retraerse dentro de la vaina, mientras que los que no contienen nitinol (por ejemplo, WATCHMAN) suelen requerir una gran deformación para ser extraídos. En la tabla 4, la tabla 5 y la tabla 6 se muestra una lista de lazos, fórceps, biotomos y catéteres que pueden ser de utilidad para recapturar dispositivos de forma percutánea. Todo ello se ha extraído del catálogo European Device Guide37. La figura 4 muestra fotografías de dispositivos de lazo único y múltiple, a modo de ejemplo.
Tabla 4. Lazos que pueden ser de utilidad para recapturar un dispositivo embolizado
| Lazo | Fabricante | Introductor (Fr) | Longitud del lazo (cm) | Longitud del catéter (cm) | Diámetro útil del lazo (mm) | Características |
|---|---|---|---|---|---|---|
| GooseNeck MicroSnare | Medtronic | 2,3-3 | 175; 200 | 150 | 2; 4; 7 | Un solo lazo a 90° y coils de tungsteno dorado |
| GooseNeck Snare | Medtronic | 4; 6 | 120 | 102 | 5; 10; 15; 20; 25; 30; 35 | Similar a MicroSnare |
| EN Snare estándar | Merit Medical | 6; 7 | 120 | 100 | 6-10; 9-15; 12-20; 18-30; 27-45 | 3 lazos entrelazados |
| EN Snare Mini | Merit Medical | 3,2 | 175 | 150 | 2-4; 4-8 | Similar a EN Snare estándar |
| One Snare estándar | Merit Medical | 4; 6 | 120 | 100 | 5; 10; 15; 20; 25; 30; 35 | Lazo de captura con un solo ángulo de 90°, recubierto de tungsteno dorado |
| One Snare Micro | Merit Medical | 2,3-3 | 175; 200 | 150; 175 | 2; 4; 7 | Similar a One Snare estándar |
| Atrieve Snare | Argon Medical Devices, Inc. | 3,2; 6; 7 | 120; 175 | 100; 150 | 2-4; 4-8; 6-10; 9-15; 12-20; 18-30; 27-45 | 3 lazos superpuestos, no entrelazados |
| Bard Snare Kit | BD Interventional | 9; 11 | 120 | 63; 58 | 20 | Lazo de captura radiopaco de 90° |
| Sistema de recuperación vascular CloverSnare 4-Loop | Cook Medical | 6 | 90 | 85 | 32 | Lazo de nitinol de 4 asas con núcleo de tántalo |
| Multi-Snare | PFM Medical | 3; 4; 5; 6 | 125; 175 | 105; 150 | 2-3; 4-6; 5-8; 10-15; 15-20; 20-30; 30-40 | Sistema de recuperación de doble plano |
Tabla 5. Fórceps y biotomos que pueden ser de utilidad para recapturar dispositivos embolizados
| Fórceps/biotomo | Fabricante | Introductor (Fr) | Longitud (cm) | Características |
|---|---|---|---|---|
| Pinza de biopsia estándar | Cordis | 5,5; 7 | 50; 104 | Disponibles pinzas rectas y curvas |
| Pinza de biopsia endomiocárdica Procure | Abbott | 5,4-7 | 50; 105 | Disponibles pinzas rectas y curvas |
| Dispositivo de agarre Raptor* | US Endoscopy | 7 | 230 | Rotación de 360° |
| Sistema de recuperación Needle’s Eye | Cook Medical | 16 | 54; 94 | Alambre de acero inoxidable/nitinol, utilizado habitualmente para retirar electrodos cardiacos |
| Catéter Lasso ajustable | Biosense Webster | 7 | 115 | Catéter de mapeo usado en electrofisiología |
| Dispositivo de recuperación ŌNŌ | B. Braun Interventional Systems, Inc. | 7,5 | 100 | Cesta autoexpandible de nitinol de 35 mm |
| Pinza cardiológica de agarre con tres garras planas | H + H Maslanka | 5,4 | 120 | 3 garras retráctiles |
|
* El uso intravascular de este dispositivo se considera fuera de indicación. |
||||
Tabla 6. Catéteres y vainas de utilidad para recapturar dispositivos embolizados
| Catéter/vaina | Fabricante | Tamaño (Fr) | Longitud (cm) | Forma | Compatibilidad alambre guía (pulgadas) |
|---|---|---|---|---|---|
| Check-Flo extra grande | Cook Medical | 20-24 | 25; 40; 65 | Rígida | 0,038 |
| Vaina introductora Gore DrySeal Flex | Gore & Associates | 10; 12; 14; 15; 16; 18; 20; 22; 24; 26 | 33; 45; 65 | Flexible | 0,035 |
| Sistema de liberación Mitraclip | Abbott | 24 | 80 | Flexible | 0,035 |
| Keller-Timmermans | Cook Medical | 18-24 | 65; 85 | Disponible recta y curvada | 0,038 |
| Catéter guía bidireccional Destino con válvula hemostática | Oscor Inc. | 8,5; 10; 12 | 67; 71; 73; 75; 77 | Disponible recta y curvada | 0,038 |
– Abordaje quirúrgico: es un procedimiento más invasivo, alarga la estancia hospitalaria y tiene mayor mortalidad36. Habitualmente se lleva a cabo cuando existe una gran desestructuración del aparato valvular o es necesario reparar el ventrículo.

Figura 4. A: lazo tipo Amplatz de «cuello de ganso» como ejemplo de dispositivo de un único lazo. B: lazo tipo EN Snare en el que se observan sus 3 lazos entrelazados.
En el caso del tratamiento percutáneo, Fahmy et al.38, en su experiencia ex vivo, necesitaron vainas más grandes para recuperar dispositivos WATCHMAN que las usadas para recuperar dispositivos tipo Amplatzer Cardiac Plug, y es importante destacar que recomiendan un asa en «cuello de ganso» más grande (preferiblemente de 15-20 mm) para facilitar el enganche de las patas del WATCHMAN, así como una vaina más grande (idealmente de 18 Fr) para retraer el dispositivo con mayor facilidad. Otras opciones son enganchar el dispositivo por el centro o por los lados, pero se requiere una fuerza de tracción mucho mayor para recuperar el WATCHMAN dentro de la vaina. Es recomendable que 2 operadores participen en el intento de recuperación: uno para estabilizar la vaina mientras el otro tira con firmeza del dispositivo capturado hacia su interior38.
Como ya hemos visto, la embolización del dispositivo hacia el VI puede provocar inestabilidad hemodinámica y suele asociarse a una alta tasa de necesidad de recuperación quirúrgica. La recuperación percutánea en el VI es especialmente desafiante debido al riesgo no menospreciable de daño a las válvulas aórtica y mitral. Los alambres de estabilización, en especial si el dispositivo está desplegado, pueden engancharse en estructuras circundantes y causar lesiones tisulares. Abbadi et al.39 publicaron un caso de implante de dispositivo tipo Amulet que a las pocas horas embolizó al VI y quedó enredado en el aparato subvalvular mitral, lo que generó insuficiencia mitral grave. Para su recuperación, utilizaron un lazo tipo Amplatz de 35 mm montado sobre un catéter guía de 6 Fr e introducido a través de un sistema de catéter MitraClip (Abbott, Estados Unidos) de 24 Fr. El dispositivo se atrapó por la cintura central, se traccionó hasta la AI y posteriormente fue retirado dentro del catéter MitraClip. El paciente quedó estable y con insuficiencia mitral leve.
En la actualidad se investiga en materiales y sistemas específicos para facilitar la captura, la recolocación y la retirada de los dispositivos. Uno de ellos es O–NO– (B. Braun, Alemania), que consiste en una cesta autoexpandible de nitinol de 35 mm unida a un catéter de 12 Fr con una luz interna de 7,5 Fr. En una serie de 3 casos publicada en 2024 (2 con migración a la AI y 1 al tracto de salida del VI debajo de la válvula aórtica), el dispositivo O–NO– tuvo un éxito de recuperación del 100%, sin complicaciones40.
En la figura 5 y la figura 6 se muestran algunos ejemplos de embolización de dispositivos de cierre de la orejuela izquierda.
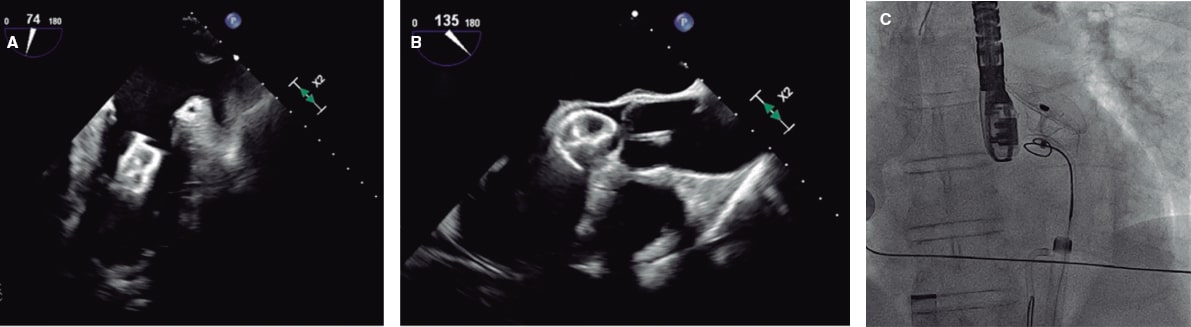
Figura 5. Ecocardiograma transesofágico (ETE) intraprocedimiento y fluoroscopia de cierre de la orejuela izquierda con un dispositivo Amulet de 25 mm. A: el dispositivo migró al ventrículo izquierdo (VI). B: se introdujo por un acceso femoral izquierdo un catéter guía JR4 de 8 Fr con un lazo de 20 mm que agarró el dispositivo por el tornillo del lóbulo distal y permitió traccionarlo a la aorta descendente. C: a continuación se canalizó la arteria femoral derecha con un introductor de 16 Fr, y con un catéter guía y un lazo de 30 mm se volvió a agarrar el dispositivo por el tornillo del lóbulo distal, que fue traccionado y finalmente extraído.
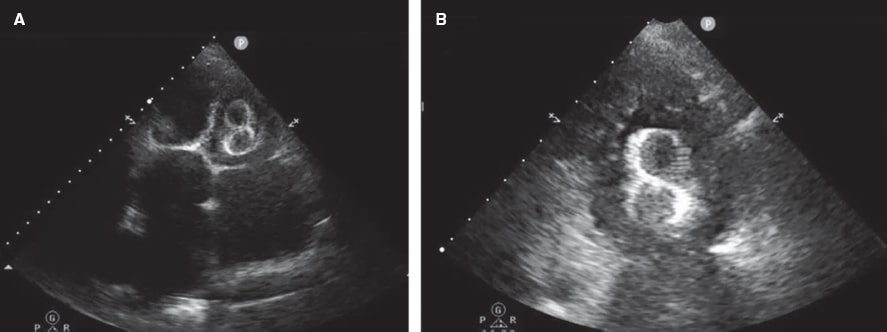
Figura 6. Ecocardiograma transtorácico (ETT) realizado 24 horas tras el implante de un dispositivo tipo LAmbre de 38 mm. A: se visualiza la migración al ventrículo izquierdo (VI), atrapado por el aparato subvalvular mitral. B: ampliación de la imagen.
ALGORITMOS DE TRATAMIENTO
Se han publicado diversos algoritmos cuyo objetivo es aportar algo de luz y guiar al operador en la toma de decisiones. En todos ellos se considera que, si el paciente se encuentra hemodinámicamente estable y no hay un daño vascular o valvular importante, la técnica percutánea es de elección como primer intento (76,4%, en contraposición al 21,7% de los pacientes que requirieron cirugía cardiaca abierta de entrada en la serie de Eppinger et al.5, de los cuales el 60% presentaban embolización al VI), siempre considerando que la embolización a una cámara cardiaca es de mayor riesgo que a un vaso grande o periférico36. Si el primer intento tiene éxito, es aceptable tanto intentar volver a recolocar el dispositivo en su sitio correcto como retirarlo del cuerpo del paciente y programar un nuevo implante.
En caso de que el primer intento percutáneo no tenga éxito, algo que suele ocurrir en aproximadamente una tercera parte de los pacientes, se puede volver a realizar otro intento percutáneo o directamente pasar a cirugía cardiaca abierta, teniendo en cuenta que el fallo de un primer intento ya incrementa la mortalidad de un 2,9% a un 21,4%5.
Si en el segundo intento tampoco se consigue capturar el dispositivo y el paciente no es candidato a cirugía, Alkhouli et al.36 plantean una serie de opciones, como pueden ser probar a desimpactar el dispositivo y recolocarlo en una zona anatómicamente menos comprometida, inflar un balón distal al mismo para traccionar y facilitar su movilización hacia una posición más segura, e incluso utilizar 2 lazos simultáneamente.
Por último, en los pacientes de riesgo quirúrgico prohibitivo, asintomáticos, y siempre y cuando el dispositivo se aloje en la aorta descendente, una opción es el tratamiento conservador con vigilancia periódica, aunque no está claro cada cuánto tiempo se debe hacer el seguimiento ni qué tratamiento antitrombótico o anticoagulante es el ideal.
En la figura 7 se propone un algoritmo de abordaje y tratamiento según la última evidencia disponible, en el que se sintetiza la información expuesta previamente.
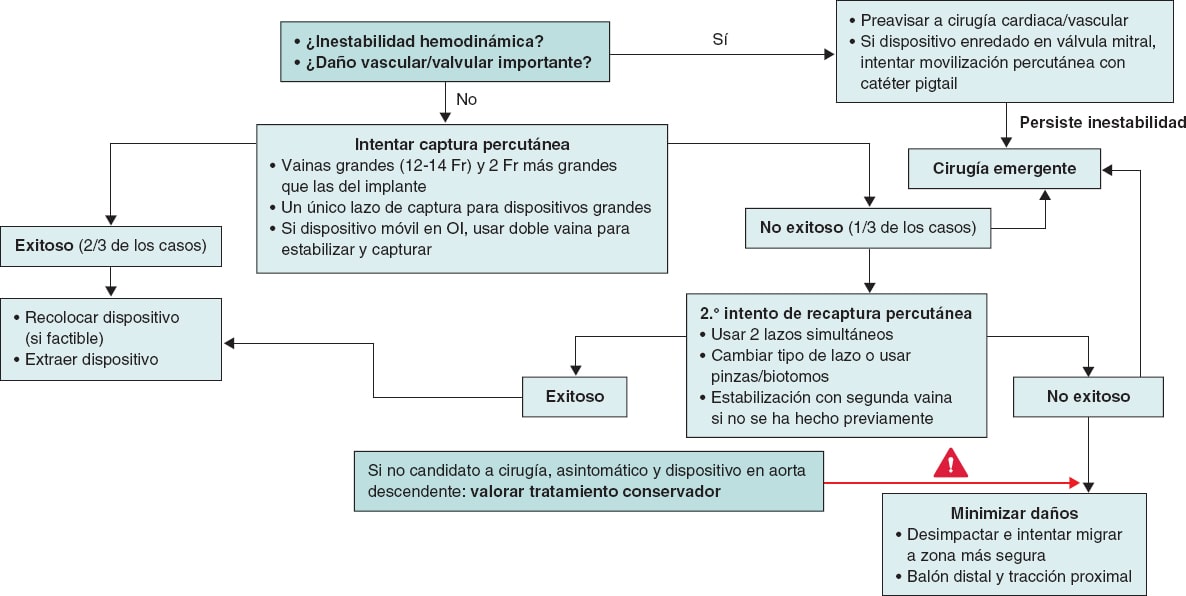
Figura 7. Propuesta de algoritmo de tratamiento para la embolización de un dispositivo de cierre de la orejuela izquierda (OI).
CONCLUSIONES
La embolización del dispositivo de cierre de la orejuela izquierda es una complicación infrecuente, pero potencialmente mortal, de un procedimiento que ha demostrado ser seguro y eficaz para la prevención de ictus en pacientes con fibrilación auricular no valvular y contraindicación para la anticoagulación. Aunque el diseño de los dispositivos ha evolucionado durante los últimos años, la correcta selección del paciente, la planificación preoperatoria detallada y una ejecución meticulosa del procedimiento siguen siendo pilares fundamentales para minimizar los riesgos. Esta revisión resalta la complejidad multifactorial y la gran cantidad de aspectos que intervienen en su aparición. Ante una embolización, la recuperación percutánea debe ser el enfoque inicial siempre que sea viable, y reservar la cirugía para casos seleccionados de desestructuración de la anatomía valvular, inestabilidad hemodinámica o tras un primer intento percutáneo fallido. El desarrollo de nuevas herramientas específicas para la recuperación y la estandarización de los algoritmos de tratamiento contribuirán a optimizar los resultados clínicos en estos escenarios. Futuras investigaciones deberán centrarse en identificar predictores anatómicos y técnicos más precisos, así como en validar estrategias preventivas que se puedan aplicar de manera universal.
FINANCIACIÓN
Este estudio no ha recibido ninguna subvención del sector público ni privado, así como tampoco de ninguna organización sin ánimo de lucro.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizó inteligencia artificial en la preparación de esta revisión.
CONTRIBUCIÓN DE LOS AUTORES
M.Á. Martín-Arena y G. Galeote-García realizaron la búsqueda bibliográfica, recopilaron la información y redactaron las versiones inicial y final del artículo. A. Lara-García, A. Jurado-Román, S. Jiménez-Valero, A. Gonzálvez-García, D. Tébar-Márquez, B. Rivero-Santana, J. Zubiaur, M. Basile, S. Valbuena-López, L. Fernández-Gassó, R.D. González-Gallarza y R. Moreno aportaron imágenes, figuras y datos, realizaron una revisión crítica del texto y contribuyeron a su redacción final. Todos los autores aprobaron la versión final del artículo.
CONFLICTO DE INTERESES
R. Moreno es editor asociado de REC: Interventional Cardiology, y se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito; también ha recibido honorarios como conferenciante y consultor de Abbott, Medtronic y Boston Scientific. A. Gonzálvez ha recibido honorarios como conferenciante de Abbott. G. Galeote ha recibido honorarios como conferenciante de Abbott, Boston Scientific y M.A. Jurado es proctor de Abbott y Boston Scientific, y ha recibido honorarios como conferenciante de Abbott y Boston Scientific. M. Basile ha recibido ayudas para asistencia a congresos por parte de Abbott.
BIBLIOGRAFÍA
1. Gómez-Doblas JJ, Muñiz J, Martin JJA, et al. Prevalence of Atrial Fibrillation in Spain. OFRECE Study Results. Rev Esp Cardiol. 2014;67:259-269.
2. Wolf PA, Abbott RD, Kannel WB. Atrial Fibrillation: A Major Contributor to Stroke in the Elderly: The Framingham Study. Arch Intern Med. 1987; 147:1561-1564.
3. Kannel WB, Wolf PA, Benjamin EJ, Levy D. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates 1. Am J Cardiol. 1998;82(7, Suppl 1):2N-9N.
4. Osmancik P, Herman D, Neuzil P, et al. 4-Year Outcomes After Left Atrial Appendage Closure Versus Nonwarfarin Oral Anticoagulation for Atrial Fibrillation. J Am Coll Cardiol. 2022;79:1-14.
5. Eppinger S, Piayda K, Rodes-Cabau J, et al. Embolization of percutaneous left atrial appendage closure devices: timing, management and associated clinical outcomes. Eur Heart J. 2023;44(Suppl 2):ehad655.2276.
6. Najim M, Reda Mostafa M, Eid MM, et al. Efficacy and safety of the new generation WATCHMAN FLX device compared to the WATCHMAN 2.5: a systematic review and meta-analysis. Am J Cardiovasc Dis. 2023;13:291-299.
7. Kar S, Doshi SK, Sadhu A, et al. Primary Outcome Evaluation of a Next-Generation Left Atrial Appendage Closure Device. Circulation. 2021;143:1754-1762.
8. Nielsen-Kudsk JE, Kramer A, Andersen A, Kim WY, Korsholm K. First-in-human left atrial appendage closure using the WATCHMAN FLX Pro device: a case report. Eur Heart J Case Rep. 2024;8:ytae135.
9. Bavishi C. Transcatheter Left Atrial Appendage Closure: Devices Available, Pitfalls, Advantages, and Future Directions. US Cardiol Rev. 2023;17:e05.
10. Lakkireddy D, Thaler D, Ellis CR, et al. Amplatzer Amulet Left Atrial Appendage Occluder Versus WATCHMAN Device for Stroke Prophylaxis (Amulet IDE): A Randomized, Controlled Trial. Circulation. 2021;144:1543-1552.
11. Lakkireddy D, Ellis CR, Thaler D, et al. 5-Year Results From the AMPLATZER Amulet Left Atrial Appendage Occluder Randomized Controlled Trial. J Am Coll Cardiol. 2025;85:1141-1153.
12. Kleinecke C, Cheikh-Ibrahim M, Schnupp S, et al. Long-term clinical outcomes of Amplatzer cardiac plug versus Amulet occluders for left atrial appendage closure. Catheter Cardiovasc Interv. 2020;96:E324-E331.
13. Bangash AB, Li Y, Huang W, et al. Left atrial appendage occlusion using the LAmbre device in atrial fibrillation patients with a history of ischemic stroke: 1-Year outcomes from a multicenter study in China. Pacing Clin Electrophysiol. 2023;46:1478-1483.
14. Galea R, De Marco F, Meneveau N, et al. Amulet or WATCHMAN Device for Percutaneous Left Atrial Appendage Closure: Primary Results of the SWISS-APERO Randomized Clinical Trial. Circulation. 2022;145:724-738.
15. Ali M, Rigopoulos AG, Mammadov M, et al. Systematic review on left atrial appendage closure with the LAmbre device in patients with non-valvular atrial fibrillation. BMC Cardiovasc Disord. 2020;20:78.
16. Vij V, Ruf TF, Thambo JB, et al. Contrast-free left atrial appendage occlusion in patients using the LAMBRETM device. Int J Cardiol. 2024;405: 131939.
17. Llagostera-Martín M, Cubero-Gallego H, Mas-Stachurska A, et al. Left Atrial Appendage Closure with a New Occluder Device: Efficacy, Safety and Mid-Term Performance. J Clin Med. 2021;10:1421.
18. Cruz-González I, Freixa X, Fernández-Díaz JA, Moreno-Samos JC, Martín-Yuste V, Goicolea J. Left Atrial Appendage Occlusion With the LAmbre Device: Initial Experience. Rev Esp Cardiol. 2018;71:755-756.
19. Chamié F, Guerios E, Silva DP, Fuks V, Torres R. Oclusão do Apêndice Atrial Esquerdo com a Prótese Lambre: Experiência Multicêntrica Inicial no Brasil. Arq Bras Cardiol. 2022;119:48-56.
20. Holmes DR, Korsholm K, Rodés-Cabau J, Saw J, Berti S, Alkhouli MA. Left atrial appendage occlusion. EuroIntervention. 2023;18:e1038-e1065.
21. Garg J, Kabra R, Gopinathannair R, et al. State of the Art in Left Atrial Appendage Occlusion. JACC Clin Electrophysiol. 2025;11:602-641.
22. Bhagat A, Gier C, Kim P, Diggs P, Gursoy E. Delayed embolization of next-generation left atrial appendage closure device in an asymptomatic patient. Hear Case Rep. 2023;9:598-601.
23. Friedman DJ, Freeman JV, Zimmerman S, et al. WATCHMAN device migration and embolization: A report from the NCDR LAAO Registry. J Cardiovasc Electrophysiol. 2023;34:1192-1195.
24. Korsholm K, Kramer A, Andersen A, et al. Left atrial appendage sealing performance of the Amplatzer Amulet and WATCHMAN FLX device. J Interv Card Electrophysiol. 2023;66:391-401.
25. Rocca DGD, Magnocavallo M, Gianni C, et al. Procedural and short-term follow-up outcomes of Amplatzer Amulet occluder versus WATCHMAN FLX device: A meta-analysis. Heart Rhythm. 2022;19:1017-1018.
26. Kapadia SR, Yeh RW, Price MJ, et al. Outcomes With the WATCHMAN FLX in Everyday Clinical Practice From the NCDR Left Atrial Appendage Occlusion Registry. Circ Cardiovasc Interv. 2024;17:e013750.
27. Li S, Zhang J, Zhang J, et al. GW29-e1803 LAmbre Occluder in Patients with Atrial Fibrillation: a Prospective single-center registry. J Am Coll Cardiol. 2018;72(16, Suppl):C150.
28. Park JW, Sievert H, Kleinecke C, et al. Left atrial appendage occlusion with lambre in atrial fibrillation: Initial European experience. Int J Cardiol. 2018;265:97-102.
29. Huang H, Liu Y, Xu Y, et al. Percutaneous Left Atrial Appendage Closure With the LAmbre Device for Stroke Prevention in Atrial Fibrillation: A Prospective, Multicenter Clinical Study. JACC Cardiovasc Interv. 2017;10:2188-2194.
30. Wang B, Wang Z, He B, et al. Percutaneous Left Atrial Appendage Closure Confirmed by Intra-Procedural Transesophageal Echocardiography under Local Anesthesia: Safety and Clinical Efficacy. Acta Cardiol Sin. 2021;37: 146-154.
31. Chen YH, Wang LG, Zhou XD, et al. Outcome and safety of intracardiac echocardiography guided left atrial appendage closure within zero-fluoroscopy atrial fibrillation ablation procedures. J Cardiovasc Electrophysiol. 2022; 33:667-676.
32. Saw J, Holmes DR, Cavalcante JL, et al. SCAI/HRS expert consensus statement on transcatheter left atrial appendage closure. Heart Rhythm. 2023;20:e1-e16.
33. Murtaza G, Turagam MK, Dar T, et al. Left Atrial Appendage Occlusion Device Embolization (The LAAODE Study): Understanding the Timing and Clinical Consequences from a Worldwide Experience. J Atr Fibrillation. 2021;13:2516.
34. Aminian A, Lalmand J, Tzikas A, Budts W, Benit E, Kefer J. Embolization of left atrial appendage closure devices: A systematic review of cases reported with the WATCHMAN device and the amplatzer cardiac plug. Catheter Cardiovasc Interv. 2015;86:128-135.
35. Salmon MK, Hammer KE, Nygaard JV, Korsholm K, Johansen P, Nielsen-Kudsk JE. Left atrial appendage occlusion with the Amulet device: to tug or not to tug? J Interv Card Electrophysiol. 2021;61:199-206.
36. Alkhouli M, Sievert H, Rihal CS. Device Embolization in Structural Heart Interventions: Incidence, Outcomes, and Retrieval Techniques. JACC Cardiovasc Interv. 2019;12:113-126.
37. European Device Guide. Cardiac Interventions Today. Disponible en: https://citoday.com/device-guide/european. Consultado 2 Jul 2025.
38. Fahmy P, Eng L, Saw J. Retrieval of embolized left atrial appendage devices. Catheter Cardiovasc Interv. 2018;91:E75-E80.
39. Abbadi AB, Akodad M, Horvilleur J, Neylon A. Retrieval of a left appendage device from the left ventricle using a large bore steerable catheter. Catheter Cardiovasc Interv. 2024;104:365-367.
40. Hermann D, Khan Z, Khan Z, Abreu J, Loyalka P, Qureshi AM. First-in-Human Percutaneous Removal of Left Atrial Appendage Occlusion Devices With a Novel Retrieval System. JACC Clin Electrophysiol. 2024;10:1004-1009.
* Autor para correspondencia.
Correo electrónico: (M.Á. Martín-Arena).
@martinarenaMA;
@hemodin90;
@Azlaragarcia;
@JuradoRomanAl;
@Dr_DanielTebar;
@BorjaRiversa;
@JonZubiaur;
@MattiaBasile97;
@cayevalbuena;
@LuciaFGasso;
@reginadalmau;
@RaulmorenoMD

