Sr. Editor:
La utilización de homoinjertos criopreservados como sustitutos de la raíz aórtica completa se introdujo hace más de tres décadas con ventajas considerables respecto a las prótesis biológicas, como la mayor durabilidad, el menor riesgo de endocarditis y el mejor perfil hemodinámico con mayor preservación de la función ventricular a largo plazo1. Sin embargo, la mayoría de estos injertos inician su degeneración a los 10 años de la intervención, y generalmente presentan una calcificación masiva de la pared del homoinjerto y disfunción valvular2.
La reintervención quirúrgica en este contexto conlleva un riesgo muy elevado, dada la necesidad de abordar una aorta con calcificación extensa que con frecuencia requiere una nueva sustitución completa de la raíz aórtica3,4, por lo que el implante percutáneo de válvula aórtica (TAVI, transcatheter aortic valve implantation) resulta en especial atractivo. Las válvulas de los homoinjertos habitualmente degeneran en forma de insuficiencia aórtica pura y la raíz aórtica suele presentar una calcificación muy extensa a nivel de los senos y de la unión sinotubular; paradójicamente, en ocasiones la calcificación del anillo es escasa3,4. Esto último puede suponer un reto para la estabilidad de las prótesis de balón expandible, de manera que hasta el momento existe escasa evidencia científica sobre su papel en este particular contexto anatómico.
Se describen los casos de 5 pacientes consecutivos (edad media: 68,4 ± 10,4 años) con homoinjerto de raíz aórtica degenerado en forma de insuficiencia aórtica aislada (vídeo 1 del material adicional) o doble lesión aórtica tratados mediante TAVI transfemoral con prótesis de balón expandible entre 2017 y 2021 en un centro hospitalario (tabla 1). En todos los casos se desestimó una nueva sustitución valvular quirúrgica por el alto riesgo de la intervención, debido a la calcificación masiva y circunferencial del homoinjerto. Los procedimientos se realizaron tras obtener el consentimiento informado de los pacientes, bajo sedación profunda (pacientes 2, 3 y 4) o anestesia general (pacientes 1 y 5, para mejorar la tolerancia al ecocardiograma transesofágico y conseguir una mayor precisión en la colocación de la prótesis), guiados por ecocardiografía transesofágica, disponiendo de una tomografía computarizada previa a la intervención para valorar la calcificación y los diámetros del injerto. Se procedió al implante directo con inflado lento y prolongado de la prótesis en todos los casos salvo en el paciente número 5, en quien se realizó un primer inflado incompleto seguido de una posdilatación completa (figura 1 y vídeo 2 del material adicional), debido a que presentaba una importante resistencia a la expansión durante el inflado inicial. En una paciente (paciente 2 de la tabla 1) se avanzó una guía para proteger la coronaria izquierda durante el implante de la prótesis (vídeo 3 del material adicional).
Tabla 1. Pacientes con homoinjerto aórtico degenerado tratados con TAVI transfemoral
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | |
|---|---|---|---|---|---|
| Características basales | |||||
| Edad, años | 84 | 70 | 63 | 69 | 56 |
| Sexo | Mujer | Mujer | Mujer | Varón | Varón |
| EuroSCORE II (%) | 23% | 7% | 4% | 10% | 5% |
| STS (%) | 17% | 5% | 3% | 7% | 3% |
| Indicación de homoinjerto | VAB -AAA | VAB- AAA | EI | EI | VAB-AAA |
| Edad del homoinjerto, años | 12 | 12 | 15 | 14 | 17 |
| Tipo de disfunción | IAo grave | IAo grave | Doble lesión | IAo grave | Doble lesión |
| Gradiente transprotésico (mmHg) | NA | NA | 80 | NA | 54 |
| Agatston de la válvula | 3824 | 1936 | 1873 | 1650 | 5555 |
| Agatston del homoinjerto | 9100 | 9037 | 10456 | 11456 | 17400 |
| Calcificación del homoinjerto | Grave | Grave | Grave | Grave | Grave |
| Diámetro derivado del anillo (mm) | 24,8 | 24,2 | 23,2 | 25,7 | 28,02 |
| Perímetro del anillo (mm) | 78 | 76 | 73 | 81 | 88 |
| Diámetro máximo (mm) | 24 | 24 | 22 | 25 | 26 |
| Procedimiento | |||||
| Anestesia | General | Sedación | Sedación | Sedación | General |
| Medida del anillo por ETE (mm) | 25 | 25 | 22 | 24 | 24 |
| Prótesis Edwards | SAPIEN XT 26 | SAPIEN 3 26 | SAPIEN 3 23 | SAPIEN 3 26 | SAPIEN 3 Ultra 26 |
| Acceso | Transfemoral | Transfemoral | Transfemoral | Transfemoral | Transfemoral |
| Insuficiencia periprotésica | 0 | 0 | 0 | 0 | 0 |
| Marcapasos | No | No | No | No | No |
| Tiempo de escopia (min) | 19 | 23 | 36 | 29 | 21 |
| Contraste (ml) | 60 | 100 | 80 | 60 | 60 |
| Complicaciones VARC-3 | No | No | No | No | No |
| Seguimiento | |||||
| Tiempo seguimiento (meses) | 41 | 35 | 14 | 10 | 1 |
| Muerte al año | Ninguno | Ninguno | Ninguno | Ninguno | NA |
| Insuficiencia cardiaca al año | Ninguno | Ninguno | Ninguno | Ninguno | NA |
| ACVA al año | Ninguno | Ninguno | Ninguno | Ninguno | NA |
| Marcapasos al año | Ninguno | Ninguno | Ninguno | Ninguno | NA |
| Gradiente transaórtico (mmHg) | 24 | 15 | 35 | 20 | NA |
| Insuficiencia aórtica | No | No | No | No | NA |
| Eventos durante el seguimiento | Ninguno | Ninguno | Ninguno | Ninguno | NA |
|
AAA: aneurisma de aorta ascendente; ACVA: accidente cerebrovascular agudo; ETE: ecocardiografía transesofágica; EI: endocarditis infecciosa; IAo: insuficiencia aórtica; NA: no aplica; VAB: válvula aórtica bicúspide; VARC-3: Valvular Academic Research Consortium-3. |
|||||
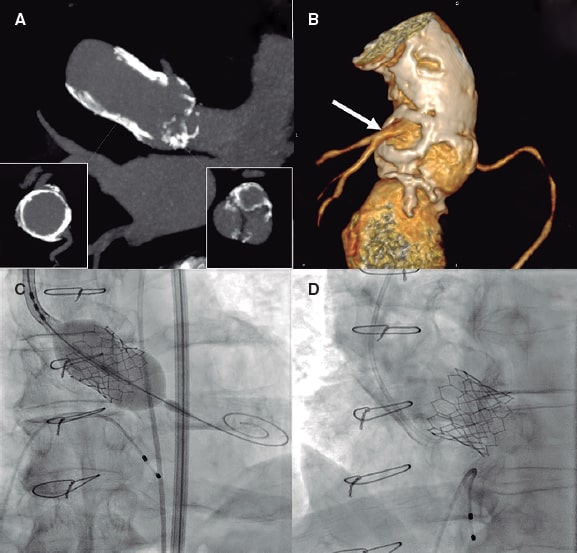
Figura 1. A: tomografía computarizada con reconstrucción multiplanar en la que se visualiza el homoinjerto calcificado (corte transversal en el cuadrante inferior izquierdo), con menor calcificación en la válvula aórtica (corte transversal en el cuadrante inferior derecho). B: tomografía computarizada con reconstrucción tridimensional de la raíz aórtica, con visión posterior, en la que se visualiza la calcificación grave del homoinjerto que preserva el neo-ostium del tronco izquierdo (flecha). C: implante de prótesis aórtica SAPIEN 3 Ultra de 26 mm (Edwards Lifesciences, Estados Unidos), con expansión parcial que se completa en un segundo inflado. D: imagen angiográfica final que muestra la grave calcificación del homoinjerto con la prótesis bien expandida.
El implante fue exitoso en todos los pacientes, sin que ninguno presentara insuficiencia aórtica periprotésica significativa ni bloqueo auriculoventricular tras el procedimiento. Solo se identificó una complicación, un pseudoaneurisma de la arteria femoral contralateral, que se trató con compresión ecoguiada (paciente 3 de la tabla 1). El tiempo medio de estancia hospitalaria fue de 5,2 días. Tras un seguimiento medio de 20,2 ± 15,2 meses, todos los pacientes estaban libres de eventos y todas las prótesis funcionaban con normalidad.
Hasta la fecha, la mayor parte de la experiencia publicada sobre homoinjertos aórticos degenerados tratados de manera percutánea se limita al uso de prótesis autoexpandibles5,6, posiblemente por su capacidad de ser recapturadas y reposicionadas, dado el temor de embolización de la prótesis ante la escasez de calcio en el anillo valvular. Sin embargo, la utilización de prótesis de balón expandible puede presentar ventajas adicionales: a) garantizar una adecuada expansión de la prótesis, b) conseguir una menor interferencia de material metálico en la pared del homoinjerto calcificado y c) mantener el acceso a las coronarias en el seguimiento de los pacientes, cuya media de edad suele ser inferior a la de los pacientes tratados con TAVI.
La degeneración de homoinjertos de raíz aórtica es un escenario complejo, con escasa evidencia científica disponible. Nuestra serie de homoinjertos tratados con prótesis de balón expandible muestra que esta es una opción viable y segura para este tipo de pacientes.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido en la elaboración, la redacción y la corrección de esta carta.
CONFLICTO DE INTERESES
No existen conflictos de intereses en relación con este trabajo.
MATERIAL ADICIONAL
Vídeo 1. Unzuéa L. DOI: 10.24875/RECIC.M21000251
Vídeo 2. Unzuéa L. DOI: 10.24875/RECIC.M21000251
Vídeo 3. Unzuéa L. DOI: 10.24875/RECIC.M21000251
BIBLIOGRAFÍA
1. González-Pinto A, Vázquez RJ, Sánchez A, et al. Homoinjerto de raíz aórtica para el tratamiento quirúrgico de las afecciones de la válvula aórtica con aorta ascendente dilatada. Rev Esp Cardiol. 2004;57:412-416.
2. Amabile N, Bical OM, Azmoun A, Ramadan R. Nottin R, Deleuze PH. Long-term results of freestyle stentless bioprosthesis in the aortic position:a single- center prospective cohort of 500 patients. J Thorac Cardiovasc Surg. 2014;148:1903-1911.
3. Sadowski J, Kapelak B, Bartus K, et al. Reoperation after fresh homograft replacement:23 years'experience with 655 patients. Eur J Cardiothorac Surg. 2003;23:996-1000.
4. Joudinaud TM, Baron F, Raffoul R, et al. Redo aortic root surgery for failure of an aortic homograft is a major technical challenge. Eur J Cardiothorac Surg. 2008;33:989-994.
5. López-Otero D, Teles R, Goméz-Hospital JA, Balestrini CS, Romaguera R, Saiibi-Solano JF. Implante percutáneo de válvula aórtica:seguridad y eficacia del tratamiento del homoinjerto aórtico disfuncionante. Rev Esp Cardiol. 2012;65:350-355.
6. Chan PH, Di Mario C, Davies SW, Kelleher A, Trimlett R, Moat N. Transcatheter aortic valve implantation in degenerate failing aortic homograft root replacements. J Am Coll Cardiol. 2011;58:1729-1730.