RESUMEN
Introducción y objetivos: Entre el 10 y el 25% de los pacientes hospitalizados por síndrome coronario agudo desarrollan insuficiencia renal aguda, lo que aumenta la morbimortalidad. Existen escalas para predecir la aparición de nefropatía inducida por contraste (NIC) tras la realización de una angiografía coronaria en pacientes con síndrome coronario agudo. El objetivo de este estudio fue evaluar la asociación entre el índice albúmina-creatinina (IAC) urinario y el desarrollo de NIC tras una angiografía coronaria en pacientes con síndrome coronario agudo.
Métodos: Se analizaron pacientes internados por síndrome coronario agudo a quienes se realizó angiografía coronaria durante el ingreso, con el cálculo del IAC en las primeras 24 horas. Se determinó el mejor valor de corte por curva ROC (Receiver Operating Characteristic) del IAC asociado a NIC. Se compararon las curvas ROC de la escala de Mehran sola y con el agregado de la variable de IAC.
Resultados: Se analizaron 148 pacientes. La mediana de la edad fue de 64 años (56-73), el 35% eran mujeres, el aclaramiento de creatinina fue de 86 ml/min (66-107) y el IAC de 5 mg/g (0-14). El 9,6% de los pacientes desarrollaron NIC tras la angiografía coronaria cuando su IAC fue ≥ 20 mg/g y el 1,6% cuando fue < 20 mg/g. El área bajo la curva ROC de la escala de Mehran para predecir el desarrollo de NIC tras la angiografía coronaria fue de 0,75 (intervalo de confianza del 95% [IC95%], 0,68-0,81); cuando se agregó la variable de IAC fue de 0,82 (IC95%, 0,76-0,87).
Conclusiones: El IAC basal se asoció con el desarrollo de NIC tras la angiografía coronaria. Al añadirlo a la escala de Mehran aumentó la capacidad discriminativa. El IAC podría ser una herramienta de simple uso, bajo costo y amplia disponibilidad para detectar pacientes en riesgo de desarrollar NIC y adoptar medidas preventivas apropiadas.
Palabras clave: Contraste intravenoso. Angiografía coronaria. Microalbuminuria. Nefropatía inducida por contraste. Índice albúmina-creatinina urinario.
ABSTRACT
Introduction and objectives: Between 10% and 25% of patients hospitalized due to an acute coronary syndrome develop acute kidney injury, a condition associated with higher morbidity and mortality rates. Scores have been developed to predict the occurrence of post-coronary angiography contrast-induced nephropathy (CIN) in patients with acute coronary syndrome. The objective of this study was to assess the association between microalbuminuria and post-coronary angiography CIN in patients with acute coronary syndrome.
Methods: Patients admitted with acute coronary syndrome in whom a coronary angiography was performed during their hospitalization and with urinary albumin-to-creatinine ratio (ACR) assessment within the first 24 hours were analyzed. The best ACR cutoff value for coronary angiography-induced CIN was determined using the C-statistic measure. The receiver operating characteristic (ROC) curves were built to compare between the predictive ability of the Mehran score alone and also in combination with the ACR.
Results: A total of 148 patients were analyzed. Median age was 64 years (56-73), 35% were women, mean creatinine clearance rate at admission was 86 mL/min (66-107) and the ACR was 5 mg/g (0-14). The analysis showed that 9.6% of the patients developed post-coronary angiography CIN with ACR levels ≥ 20 mg/g compared to 1.6% when these levels were < 20 mg/g. The area under the ROC curve of the Mehran score to predict the development of post-coronary angiography CIN was 0.75 (95%CI, 0.68-0.81) and when the ACR was added it went up to 0.82 (95%CI, 0.76-0.87).
Conclusions: The ACR levels at admission were associated with the development of post-coronary angiography CIN and bring added value to an already validated predictive score. Therefore, the ACR should be used as a simple and accessible tool to detect and prevent this severe complication in patients with acute coronary syndrome.
Keywords: Contrast media. Coronary angiography. Microalbuminuria. Contrast-induced nephropathy. Urine albumin-to-creatinine ratio.
Abreviaturas
RAC: ratio albúmina-creatinina. SCA: síndrome coronario agudo. DRA: daño renal agudo. NIC: nefropatía inducida por contraste.
INTRODUCCIÓN
El deterioro de la función renal tiene asociado un mal pronóstico en pacientes con síndrome coronario agudo (SCA) o estable. Una de las causas más comunes del daño renal agudo (DRA) en pacientes hospitalizados es la nefropatía inducida por la administración intravenosa de agentes de contraste1. Su incidencia está entre el 1% y el 6% y aumenta, considerablemente, en patologías de alto riesgo como en el marco del SCA. La frecuencia descrita de la nefropatía inducida por contraste (NIC) tras una coronariografía está entre el 12% al 46% en pacientes con SCA2,3.
Son muchas las causas que desencadenan una NIC en pacientes sin antecedentes de insuficiencia renal como, por ejemplo, la inestabilidad hemodinámica, la administración IV de agentes de contraste, los eventos tromboembólicos y las reacciones farmacológicas adversas, entre otros. También es importante tener en cuenta el tipo de contraste utilizado, su osmolaridad, el volumen administrado y la falta de medidas preventivas4-6.
Como la NIC tiene asociado un mal pronóstico en pacientes hospitalizados, se han diseñado escalas predictivas para identificar a los pacientes más vulnerables susceptibles de desarrollar esta complicación. La escala de Mehran es uno de los índices de uso más habitual para calcular las posibilidades de desarrollar NIC tras una coronariografía7.
Es bien sabido que la microalbuminuria es un predictor de la disfunción renal, sobre todo, en pacientes diabéticos e hipertensos8-14. También se ha observado que existe una relación entre los niveles altos de microalbuminuria y los malos resultados descritos en pacientes con SCA15-16. En la actualidad, la microalbuminuria se calcula a partir de la dosis de la ratio albúmina-creatinina (RAC) en una muestra de orina17.
El objetivo de este estudio es calcular la microalbuminuria usando la RAC como una variable predictiva de la NIC tras una coronariografía en pacientes con SCA.
MÉTODOS
Población
Se analizó a una serie de pacientes consecutivos con SCA hospitalizados en la unidad coronaria de un hospital comunitario. El estudio incluyó a pacientes a quienes se les realizó una coronariografía hospitalaria con agentes de contraste IV hiperosmolares tales como iopamidol, optiray o xenetix. El volumen de contraste IV para cada estudio angiográfico se calculó retrospectivamente. Se calculó que cada inyección de material de contraste en la coro- naria izquierda requirió una media de 10 a 8 cc para la coronaria derecha.
Se excluyó del estudio a los pacientes con antecedentes de insuficiencia renal, macroalbuminuria, tratamiento con diuréticos y angina secundaria.
La RAC en orina se calculó en todos los pacientes incluidos en el estudio mediante una inmunoturbidimetría a partir de muestras de orina recogidas durante las 24 horas siguientes a la hospitalización.
Definiciones
La nefropatía inducida por contraste (NIC) IV se definió como un aumento de los niveles de creatinina sérica ≥ 25% 48 horas después de la coronariografía o un aumento absoluto de ≥ 0,5 mg/dl comparado con los niveles obtenidos en el momento de la hospitalización.
La microalbuminuria se definió como una tasa anómala de excreción urinaria de albúmina de entre 30 y 200 mg/min o 30 a 229 mg/día.
El protocolo del estudio fue aprobado por la junta de revisión de conformidad del hospital de conformidad con la Declaración de Helsinki, las guías de buena práctica clínica y la normativa reguladora local. Se obtuvieron los consentimientos informados de todos los pacientes.
Consideraciones bioquímicas
Se centrifugó una muestra de orina recogida durante las primeras 24 horas siguientes al ingreso hospitalario (preferiblemente durante la mañana) a 3000 rpm y se conservó a -20º Celsius hasta realizar el análisis bioquímico. El principio de la prueba RAC es la inmunoturbidimetría. Este método se basa en la reacción de los anticuerpos de la albúmina humana al antígeno. Luego se miden los complejos tras la aglutinación. Se empleó el analizador COBAS 6000 (ROCHE, Suiza) para procesar la muestra. Los límites de detección analítica de la prueba fueron 3 y 400 mg/g. El coeficiente de variación de la prueba fue del 3,8%.
Análisis estadístico
Se utilizó la prueba de Kolmogorov-Smirnov para analizar la distribución de las variables continuas y sus medidas de curtosis y asimetría. Los datos se expresaron como media y desviación estándar o como mediana con rango intercuartílico (25-75%) y se compararon utilizando la prueba de la t de Student o la prueba U de Mann-Whitney-Wilcoxon para grupos independientes según su distribución paramétrica o no paramétrica, respectivamente.
Las variables discretas se expresaron como porcentajes y se compararon empleando la prueba de la X2. La razón de productos cruzados se expresó como odds ratio (OR) con su intervalo de confianza del 95% (IC95%). El estadístico C se empleó para detectar el mejor valor de corte de la RAC asociado al objetivo primario y comparar la capacidad discriminatoria de la escala de Mehran por sí sola y acompañada del RAC.
Se realizará un análisis de regresión multivariable para predecir la NIC que incluya la RAC y se ajuste a la escala de Mehran.
Se emplearon los paquetes de software estadístico IBM SPSS Statistics versión 19 y MedCalc versión 11.6.1 (Mariakerke, Bélgica) para realizar el análisis estadístico y calcular y comparar el estadístico C. Para comprobar el valor predictivo adicional de la RAC, se comparó el estadístico C utilizando solo la escala de Mehran y también la información obtenida de la RAC.
RESULTADOS
De un total de 397 pacientes diagnosticados de SCA, 148 (59,4%) recibieron una coronariografía durante su hospitalización y esta fue la población del estudio. La media de edad fue de 64 ± 12 años; el 35% eran mujeres, el 20% tenía diabetes, el 54% dislipemia, el 65% hipertensión y el 42% eran fumadores en la actualidad. Los niveles medios de glucosa en sangre en el momento de la hospitalización eran de 110 mg/dl (98-133 mg/dl), la mediana de aclaramiento de creatinina (calculada empleando la ecuación MDRD) fue de 86 ml/min (66-107) y la RAC, 5 mg/g (0-14) (tabla 1). La comparativa de pacientes entre estos grupos con o sin NIC reveló una incidencia más alta de sobrepeso y obesidad, bloqueo de rama izquierda, fibrilación auricular e IAM clase III-IV en la clasificación de Killip y Kimball (tabla 2).
Tabla 1. Características basales de los pacientes
| Número total de pacientes | N = 148 | ||
| Edad (años), mediana [25-75] | 64 [56-73] | ||
| Mujeres | 35 | ||
| Hipertensión | 65 | ||
| Diabetes mellitus | 20 | ||
| Dislipemia | 54 | ||
| Tabaquismo | 42 | ||
| IAM previo | 24,5 | ||
| IAMCEST | 20,9 | ||
| SCASEST | 79,1 | ||
| Niveles de glucosa en sangre en ayunas, mg/dl | 110 [98-133] | ||
| Niveles de creatinina sérica, mg/dl | 0,9 [0,8-1,0] | ||
| Tasa de aclaramiento de creatinina, ml/min | 86 [66-107] | ||
| Ratio albúmina-creatinina en orina, mg/gr | 5 [0-14] | ||
| CPK, UI/L | 121 [73-264] | ||
| CK-MB, UI/L | 16 [12-34] | ||
| Niveles de troponina T, ng/ml | 0,01 [0,01-0,27] | ||
| Deterioro de la FAVI de moderado a severo (FE < 40%) | 5,79 | ||
|
Salvo que se especifique lo contrario, los datos expresan n (%) o media y desviación estándar. CK-MB: banda miocárdica de la creatincinasa; CPK: creatinfosfocinasa; FAVI: fracción de acortamiento del ventrículo izquierdo; FE: fracción de eyección; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IQR: rango intercuartílico; SCASEST: síndrome coronario agudo sin elevación del segmento ST; UI: unidades internacionales. |
|||
Tabla 2. Comparativa de pacientes con y sin nefropatía inducida por contraste
| NIC - (136) | NIC + (12) | p | |
|---|---|---|---|
| Edad (años) | 63,7 [55-74] | 68 [61-76] | NS |
| Mujeres | 25,3 | 16,7 | NS |
| Hipertensión | 67,7 | 58,3 | NS |
| Diabetes | 20 | 33,3 | NS |
| Índice de masa corporal | 26 [24-29] | 29 [25-31] | 0,05 |
| Tasa de aclaramiento de creatinina, mg/dl | 85 [65-108] | 74 [50-98] | NS |
| Niveles de glucosa en sangre durante la hospitalización, mg/dl | 112 [100-142] | 143 [108-209] | NS |
| IAM previo | 26 | 16 | NS |
| ICP previa | 17 | 8,3 | NS |
| Accidente cerebrovascular o AIT previo | 3,6 | 8,3 | NS |
| SCASEST | 17,7 | 25 | NS |
| IAMCEST | 30,8 | 33,3 | NS |
| Bloqueo de rama izquierda | 3,6 | 16,7 | 0,02 |
| Fibrilación auricular | 0,9 | 8,3 | 0,02 |
| Clase Killip y Kimball III-IV | 4,1 | 22 | 0,001 |
|
Salvo que se especifique lo contrario, los datos expresan n (%) o media y desviación estándar del 25-75%. AAS: ácido acetilsalicílico; AIT: accidente isquémico transitorio; ARA II: antagonista del receptor de la angiotensina II; CK-MB: banda miocárdica de la creatincinasa; CPK: creatinfosfocinasa; FAVI: fracción de acortamiento del ventrículo izquierdo; FC: frecuencia cardiaca; FE: fracción de eyección; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; IQR: rango intercuartílico; NS: no significativo; PAS: presión arterial sistólica; SCASEST: síndrome coronario agudo sin elevación del segmento ST; UI: unidades internacionales. |
|||
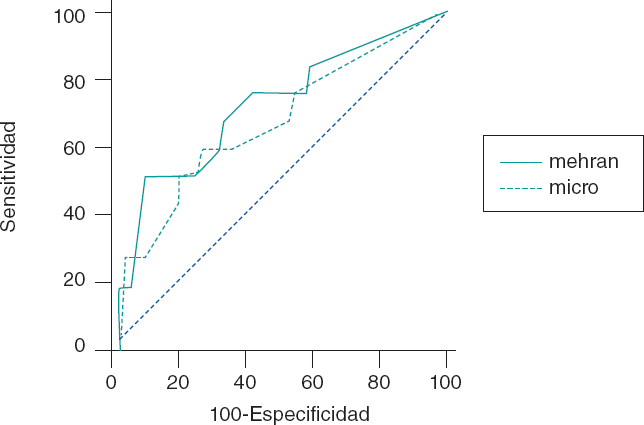
El estadístico C confirmó que el mejor valor de corte de la RAC asociado a la NIC fue de 20 mg/g. Doce pacientes desarrollaron NIC (8,1%) y la RAC del 22% de los pacientes fue > 20 mg/g. La prevalencia de una RAC > 20 mg/g en pacientes sin NIC fue del 2,9% y del 11.3% (p = 0,01) en pacientes con NIC. La nefropatía inducida por contraste fue mucho más alta con RAC ≥ 20 mg/g que con RAC < 20 mg/g (9,6 frente al 1,6%, respectivamente, p < 0,001). Cuando se incorporó la RAC a la escala de Mehran, su potencial predictivo aumentó hasta 0,82 (IC95%, 0,76-0,87) (figura 1).
Figura 1. Efecto de la ratio albúmina-creatinina cuando se incorporó a la escala de Mehran. Cuando se incorporó la ratio albúmina-creatinina ratio a la escala de Mehran, su potencial predictivo aumentó de 0,75 a 0,82 (IC95%, 0,76-0,87).
Empleando el modelo de análisis de regresión multivariable, una RAC > 20 mg/g resultó un predictor independiente de la NIC: OR = 3,2 (0,7-6,2); p = 0,01, ajustado por las variables de la escala de Mehran (edad, sexo femenino, índice de masa corporal, fibrilación auricular, clase Killip III-IV y tasa de aclaramiento de creatinina)
DISCUSIÓN
Nuestro estudio confirmó la relación que existe entre la RAC y el desarrollo de NIC en pacientes hospitalizados por SCA.
La lesión renal aguda en el marco del SCA predispone a más complicaciones tales como mortalidad hospitalaria y a largo plazo; así pues, predecirla es de una importancia capital. Un reciente estudio ha revelado que la incidencia del DRA está cercano al 17% en el marco del SCA con importantes aumentos de las complicaciones cardiovasculares. En este estudio, la RAC no se utilizó como marcador inicial del DRA. El desarrollo de NIC tampoco se analizó específicamente como una complicación posterior a la coronariografía18-22.
La microalbuminuria calculada a través de la RAC se obtiene de una muestra de orina y es un marcador establecido de la disfunción endotelial validado para predecir la ocurrencia de eventos cardiovasculares y mortalidad en diferentes escenarios clínicos. Un análisis previo de nuestro grupo reveló que unos niveles altos de la RAC se asocian a resultados mucho peores en pacientes con SCA sin elevación del segmento ST y a un índice más alto de resultados clínicos más importantes tales como mortalidad y/o infarto agudo de miocardio agudo no mortal en el seguimiento a largo plazo (del 12 frente al 2,2%, p =/< 0,0001)23. Otros autores han demostrado su utilidad para valorar el riesgo de desarrollar DRA, principalmente, en el marco del SCA o cuando el paciente está siendo intervenido mediante cirugía cardiaca24. Tziakas et al. confirmaron la importante correlación que existe entre unos niveles RAC más altos debidos a un IAM y el desarrollo de posterior a este evento (área bajo la curva ROC, 0,72; IC95%, 0,67-0,77). En cualquier caso, los autores, no hicieron ninguna mención sobre el impacto clínico de esta complicación en el curso clínico del paciente ni sobre su relación con el uso de contraste durante la coronariografía25.
Se debe prestar especial atención a pacientes con DRA tras la coronariografía en el marco del SCA. Diferentes estudios han revelado que la NIC influye negativamente en el pronóstico de pacientes hospitalizados y a largo plazo. En nuestra población, la tasa de mortalidad de pacientes con NIC fue mucho más alta que la de pacientes sin esta patología (del 33 frente al 1,8%).
El uso de la RAC en orina se ha estudiado en este contexto. Meng et al. descubrieron que los niveles altos de microalbuminuria (una RAC entre 30 y 300 mg/g) se asociaban significativamente con el desarrollo de lesión renal aguda tras la administración de contraste en pacientes intervenidos mediante cateterismo cardiaco (12.1 frente al 5.0%; p = 0,005). Aquí un punto clave que distingue este estudio del nuestro es que solo incluyó a pacientes con coronariografías programadas y fuera del marco del SCA26. Otro punto importante es que el valor de corte de la RAC para desarrollar NIC se fijó a partir de un análisis del área bajo la curva ROC y que su valor de 20 mg/g fue incluso menor que el umbral estándar convencional de 30 mg/g, un hallazgo que coincide con lo descrito en otros estudios clínicos27.
La incidencia de la NIC y su impacto en el resultado clínico de pacientes coronarios ha promovido el desarrollo de escalas predictivas de esta enfermedad. Uno de los índices más conocidos es la escala de Mehran que incorpora variables tales como edad > 75, hipertensión, clase funcional III/IV, insuficiencia cardiaca, diabetes mellitus, anemia, uso de balón de contrapulsación intraaórtico, volumen de contraste administrado y antecedentes de disfunción renal. Esta escala es capaz de identificar qué pacientes son más susceptibles de desarrollar NIC tras la coronariografía, (área bajo la curva ROC, 0,75). Cuando la RAC se incorporó a esta escala, se observó un mayor potencial discriminatorio para predecir NIC tras la coronariografía en el marco del SCA. Esto demostraría la utilidad práctica de incorporar este índice como una variable de la escala de Mehran.
La NIC, una de las causas más frecuentes de nefrotoxicidad aguda, es un evento multifactorial. Entre sus causas se debe mencionar el efecto nefrotóxico directo que provocan las sustancias de contraste durante las intervenciones endovasculares sobre el endotelio renal y el desarrollo de necrosis tubular aguda. Se estima que la nefrotoxicidad del contraste hiperosmolar potenciada por las alteraciones hemodinámicas provocadas por el SCA en curso puede llegar a alterar la resistencia vascular con los correspondientes cambios en la regulación de la liberación y equilibrio de sustancias vasoactivas como adenosina, endotelina y óxido nítrico. Este daño perpetúa el enlentecimiento de la perfusión renal, la hipoxemia de la médula espinal, la lesión isquémica y, en última instancia, la muerte celular. Además de reducir el aclaramiento de productos de estrés oxidativo, unos niveles más bajos de la tasa de filtrado glomerular aumentan la concentración de mediadores inflamatorios que desencadenan alteraciones estructurales a nivel del epitelio tubular renal tales como edema, vacuolización y muerte28,29.
Consideramos que estos hallazgos pueden ayudar a identificar a pacientes con alto riesgo de desarrollar NIC tras la coronariografía en el marco del SCA con el fin de promover medidas, conductas y estrategias preventivas que eviten esta complicación.
Limitaciones
En primer lugar, una de las limitaciones más importantes de nuestro estudio fue que se llevó a cabo en un único centro. No obstante, se debe mencionar que la población incluida fue representativa y cubrió todo el espectro de pacientes con SCA hospitalizados en nuestra unidad coronaria, lo que garantiza la validez interna y representatividad de nuestro estudio. En segundo lugar, el hecho de que se tratara de una muestra pequeña pudo haber condicionado la aparición de falsos negativos debido a su error alfa o a su menor potencial estadístico, lo cual pudo haber evitado que se realizara el análisis multivariable correspondiente. Por último, algunos datos como el volumen de contraste utilizado en cada estudio se calcularon retrospectivamente con los sesgos habituales de este tipo de análisis.
CONCLUSIONES
La ratio albúmina-creatinina, un predictor reconocido de la disfunción renal y endotelial, resultó también un marcador de la NIC en pacientes con SCA con un valor añadido cuando se incorporó a una escala clínica validada a nivel general. Estos resultados podrían ser el principio de un estudio generador de hipótesis pendiente de ser confirmado, prospectivamente, a nivel multicéntrico.
FINANCIACIÓN
Este trabajo no ha recibido financiación ni becas..
CONFLICTO DE INTERESES
Ninguno.
AGRADECIMIENTOS
Queremos agradecerle a toda la plantilla de la Unidad Coronaria del Hospital Alemán, y muy en especial al equipo de enfermería, su colaboración en la trascendental labor de recogida de muestras de orina para la realización de este estudio.
¿QUÉ SE SABE DEL TEMA?
- La NIC es una de las causas más frecuentes de DRA en pacientes hospitalizados. La microalbuminuria es un marcador establecido de la disfunción endotelial validado para predecir la ocurrencia de eventos cardiovasculares y mortalidad en diferentes escenarios clínicos. La RAC es útil para valorar el riesgo de desarrollar NIC, sobre todo, en el marco del SCA o cuando el paciente está siendo intervenido mediante cirugía cardiaca.
¿QUÉ APORTA DE NUEVO?
- Nuestro estudio demostró la relación que existe entre la RAC y el desarrollo de NIC tras la coronariografía en pacientes hospitalizados con SCA. El estadístico C confirmó que el mejor valor de corte de la RAC asociado a la NIC fue de 20 mg/g. La RAC ofreció un valor añadido cuando se incorporó a la escala de Mehran para valorar el riesgo de desarrollar NIC tras la coronariografía en el marco del SCA.
BIBLIOGRAFÍA
1. Hsiao PG, Hsieh CA, Yeh CF, et al. Early prediction of acute kidney injury in patients with acute myocardial injury. J Crit Care. 2012;27:525.e1-e7.
2. McCullough PA. Contrast-induced acute kidney injury. J Am Coll Cardiol. 2008;51:1419-1428.
3. Mehran R, Nikolski E. Contrast-induced nephropathy:Definition, epidemiology, and patients at risk. Kidney International. 2006;69:S11-S15.
4. Parikh CR, Coca SG, Wang Y et al. Long-term prognosis of acute kidney injury after acute myocardial infarction. Arch Intern Med. 2008;168:987-995.
5. Persson PB, Hansell P, Liss P. Pathophysiology of contrast medium-induced nephropathy, Kidney Int. 2005;68:14-22.
6. Tsai TT, Patel UD, Chag TI, et al. Contemporary incidence, predictors and outcomes of acute kidney injury in patients undergoing percutaneous coronary interventions:insights from the NCDR Cath-PCI Registry. JACC Cardiovasc Interv. 2014;7:1-9.
7. Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention. J Am Coll Cardiol. 2004;44:1393-1399.
8. Mogensen CE, Christensen CK. Predicting diabetic nephropathy in insulin-dependent patients. N Engl J Med. 1984;31:89-93.
9. Valmadrid CT, Klein R, Moss SE, Klein BE. The risk of cardiovascular disease morbidity associated with microalbuminuria and gross proteinuria in persons with older-onset diabetes mellitus. Arch Intern Med. 2000;160:1093-1100.
10. Dogra G, Rich L, Stanton K, Watts Parving H. Microalbuminuria in essential hypertension and diabetes. J Hypertens. 1996;14:S89-S94.
11. Deckert T, Feldt-Rasmussen B, Borch-Johnsen K, Jensen T, Kofoed-Enevoldsen A. Albuminuria reflects under-spread vascular damage:the steno hypothesis. Diabetologia. 1989;32:219-226.
12. Estacio RO, Dale RA, Schrier R, Krantz MJ. Relation of reduction in urinary albumin excretion to ten-year cardiovascular mortality in patients with type 2 diabetes and systemic hypertension. Am J Cardiol. 2012;109:1743-1748.
13. Stehouwer CD, Smulders YM. Microalbuminuria and risk for cardiovascular disease:Analysis of potential mechanisms. J Am Soc Nephrol. 2006;17:2106-2111.
14. Bennett PH, Haffner S, Kasiske BL, et al. Screening and management of microalbuminuria in patients with diabetes mellitus:recommendations to the Scientific Advisory Board of the National Kidney Foundations from an ad hoc committee of the Council on Diabetes Mellitus of the National Kidney Foundation. Am J Kidney Dis. 1995;25:107-12.
15. Berton G, Cordiano R, Palmieri F, Cucchini R, De Toni R, Palatini P. Microalbuminuria during acute myocardial infarction. A strong predictor for 1-year morbidity. Eur Heart J. 2001;22:1466-1475.
16. Nazer B, Ray KK, Murphy SA, Gibson M, Cannon CP. Urinary albumin concentration and long-term cardiovascular risk in acute coronary syndrome patients:A PROVE IT-TIMI 22 sub-study. J Thromb Thrombolysis. 2013;36:233-239.
17. Jensen JS, Clausen P, Borch-Johnsen K, Jensen G, Feldt-Rasmussen B. Detecting microalbuminuria by urinary albumin/keratinize concentration ratio. Nephrol Dial Transplant. 1997;12S2:6-9.
18. Marenzi G, Assanelli E, Campodonico J, et al. Contrast volume during primary percutaneous coronary intervention and subsequent contrast-induced nephropathy and mortality. Ann Intern Med. 2009;150:170-177.
19. Rihal CS, Textor SC, Grill DE, et al. Incidence and prognostic importance of Acute Renal Failure after percutaneous coronary intervention. Circulation. 2002;105:2259-2264.
20. Garcia S, Ko B, Adabag S. Contrast-induced nephropathy and risk of acute kidney injury and mortality after cardiac operations. Ann Thorac Surg. 2012;94:772-777.
21. Bouzas-Mosquera A, Vázquez-Rodríguez JM, Calviño-Santos R, et al. Contrast-Induced Nephropathy and Acute Renal Failure Following Emergent Cardiac Catheterization:Incidence, Risk Factors and Prognosis. Rev Esp Cardiol. 2007;60:1026-1034.
22. Ueda J, Nygren A, Hansell P, Ulfendahl HR. Effect of intravenous contrast media on proximal and distal tubular hydrostatic pressure in the rat kidney. Acta Radiologica. 1993;34:83-87.
23. Higa CC, Novo FA, Nogues I, Ciambrone MG, Donato MS, Gambarte MJ, Rizzo N, Catalano MP, Korolov E, Comignani PD. Single spot albumin to creatinine ratio:A simple marker of long-term prognosis in non-ST segment elevation acute coronary syndromes. Cardiology J. 2016;23:236-241.
24. Coca SG, Jammalamadaka D, Sint K, et al. Preoperative proteinuria predicts acute kidney injury in patients undergoing cardiac surgery. J Thorac Cardiovasc Surg. 2012;143:495-502.
25. Tziakas D, Chalikias G, Kareli D, et al. Spot urine albumin to creatinine ratio outperforms novel acute kidney injury biomarkers in patients with acute myocardial infarction. Int J Cardiol. 2015;197:48-55.
26. Meng H, Wu P, Zhao Y, et al. Microalbuminuria in patients with preserved renal function as a risk factor for contrast-Induced acute kidney injury following invasive coronary angiography. Eur J Radiol. 2016;85:1063-1067.
27. Heart Outcomes Prevention Evaluation Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus:Results of the HOPE study and MICRO HOPE sub-study. Lancet. 2000;355:253-259.
28. Maioli M, Toso A, Gallopin M, et al. Preprocedural score for risk of contrast-induced nephropathy in elective coronary angiography and intervention. J Cardiovasc Med (Hagerstown). 2010;11:444-449.
29. Goldenberg I, Matetzky S. Nephropathy induced by contrast media:pathogenesis, risk factors and preventive strategies. CMAJ. 2005;172:1461-1471.