RESUMEN
Introducción y objetivos: Estudios previos han asociado la gravedad de la calcificación de las lesiones coronarias evaluadas con angiografía coronaria invasiva (ACI) con un número limitado de medidas obtenidas con tomografía de coherencia óptica (OCT). El objetivo de este estudio es analizar la correlación de una amplia y exhaustiva serie de medidas de OCT con la gravedad de la calcificación estimada por ACI.
Métodos: Se estudiaron retrospectivamente 75 pacientes (75 lesiones) de un único centro a quienes se realizaron simultáneamente ACI y OCT. La OCT se llevó a cabo tras la administración de nitroglicerina intracoronaria antes del intervencionismo coronario. En la ACI, la calcificación coronaria se valoró utilizando un sistema de clasificación en tres grados. Con OCT se evaluaron el máximo ángulo, el área, el grosor máximo, la longitud y la profundidad del calcio.
Resultados: La ACI detectó menos lesiones calcificadas que la OCT (n = 69; 92%) y todos los casos detectados por ACI fueron identificados con OCT (n = 30; 100%). La OCT no encontró calcio en ninguna de las lesiones sin calcio en la ACI (n = 6; 100%). La sensibilidad de la ACI fue del 43,5%, (IC95%, 0,32-0,56) y la especificidad del 100% (IC95%, 0,52-1,0). A medida que se incrementaron el ángulo, el grosor y el área del calcio por OCT también aumentó la gravedad del calcio determinada por ACI en la mayoría de los casos.
Conclusiones: La ACI tiene una baja sensibilidad, pero una alta especificidad, para la detección de lesiones calcificadas en comparación con la OCT. Al incrementarse el ángulo, el grosor, el área y la longitud del calcio en la OCT aumenta el número de lesiones con calcificación grave en la ACI.
Palabras clave: Tomografia. Coherencia optica. Angiografia coronaria invasiva. Intervencion coronaria percutanea. Calcificacion.
ABSTRACT
Introduction and objectives: Former studies have associated the severity of calcified plaques (CP) on the invasive coronary angiography (ICA) with a limited number of optical coherence tomography (OCT) measurements. The objective of this study was to describe the correlation between an extended and comprehensive set of OCT measurements and the severity of calcifications as seen on the ICA.
Methods: We retrospectively studied 75 patients (75 lesions) who underwent ICA and, concurrently, OCT imaging at a single institution. The OCT was performed before the percutaneous coronary intervention and after the administration of intracoronary nitroglycerine. The coronary artery calcium was scored using a three-tier classification system on the ICA. Maximum calcium angle, area, maximum thickness, length of calcium, and calcium depth were assessed on the OCT.
Results: The ICA detected fewer CP lesions compared to the OCT (N = 69; 92%), all cases of positive ICA were detected by the OCT (N = 30; 100%). The OCT did not find any positive lesions in negative angiographic lesions (N = 6; 100%). The sensitivity of the ICA was 43.5% (95%CI, 0.32-0.56) and its specificity, 100% (95%CI, 0.52-1.0). In most cases, as calcium angle, thickness, and area increased on the OCT so did the calcium severity of the lesions on the angiography.
Conclusions: Compared to the OCT, the ICA has a low sensitivity and a high specificity in the detection of calcified plaques. As calcium angle, thickness, area, and length increased on the OCT so did the number of angio-defined lesions of severe CP.
Keywords: Tomography. Optical coherence tomography. Invasive coronary angiography. Percutaneous coronary intervention. Calcification.
Abreviaturas
PC: placa calcificada. OCT: tomografía de coherencia óptica. ACI: angiografía coronaria invasiva.
INTRODUCCIÓN
La enfermedad coronaria tiene una alta prevalencia en Estados Unidos y se asocia a una incidencia alta de mortalidad cardiovascular1. El tratamiento de la enfermedad coronaria en fase avanzada (por ejemplo, lesiones calcificadas) suele ser a través de intervenciones coronarias percutáneas, aunque usar solo la ICP en placas calcificadas (PC) se asocia a peores resultados de la intervención2-5. Esto se debe principalmente a la falta de información sobre el grado de extensión de la calcificación y sobre el mejor tratamiento de esta entidad previo al implante de un stent. Por tanto, es necesario usar técnicas de imágenes intravasculares para caracterizar los depósitos de calcio que se hallan en el interior del vaso y guiar al cardiólogo intervencionista6-9.
La tomografía de coherencia óptica (OCT) es una técnica de imágenes de cortes transversales de alta resolución con una resolución axial sin igual de entre ~ 20 micrones10. La OCT proporciona mediciones más precisas de la PC que otras técnicas de imágenes como la angiografía coronaria invasiva (ACI) y la ecografía intravascular (IVUS)11.
Anteriores estudios han vinculado la gravedad de la PC descrita en la ACI con un número limitado de mediciones en la OCT6,12-14. El objetivo de nuestro estudio fue ahondar en la descripción de la correlación existente entre un conjunto ampliado e integral de mediciones mediante OCT y la gravedad de la calcificación confirmada por la ACI.
MÉTODOS
Población del estudio
Se realizó un estudio retrospectivo de 75 pacientes sometidos a ACI y de quienes se obtuvieron paralelamente imágenes por OCT en el St. Francis Hospital de Roslyn, Nueva York (Estados Unidos) entre noviembre de 2018 y abril de 2019. La ACI identificó un total de 109 lesiones en estos pacientes. Se realizó un análisis por OCT y ACI en 75 de estas lesiones consideradas primarias y se excluyeron 34 lesiones (de las que no se tenían imágenes por OCT). Todas las lesiones primarias eran lesiones descritas en las imágenes por OCT y no en la lesión diana que recibió el stent durante la intervención. Se excluyeron placas calcificadas que no se pudieron evaluar por OCT. Todas las lesiones excluidas eran lesiones secundarias consideradas no primarias por la menor carga de calcificación que presentaban. Ninguna lesión precisó preparación ni ablación previa a la obtención de las imágenes por OCT. Ninguno de los puntos calcificados en la población en estudio fue lo bastante grueso como para evaluar el área debido a atenuación. Debido a su naturaleza retrospectiva, el estudio quedó exento del análisis del comité de revisión institucional. Se obtuvo el consentimiento informado de los pacientes para la ACI y la OCT.
Adquisición de imágenes mediante tomografía de coherencia óptica
La OCT se realizó antes de la intervención coronaria percutánea y después de la administración de nitroglicerina intracoronaria (100 a 200 µg) mediante el sistema de OCT de dominio de frecuencia ILUMIEN OPTIS (Abbott Vascular, Estados Unidos) y un catéter de 2,7 Fr para la obtención de imágenes de OCT (C7 Dragonfly, Dragonfly Duo o Dragonfly OPTIS; Abbott Vascular, Estados Unidos). El catéter de OCT se avanzó en sentido distal a la lesión. También se inyectó, manualmente, un agente de contraste a través del catéter guía con pullbacks automáticos de OCT a una velocidad de 20 mm/segundo para una distancia media de pullback de 75 ± 12,2 mm.
Definición y análisis de las imágenes
Las imágenes obtenidas mediante ACI y OCT se corregistraron la una respecto de la otra atendiendo a los puntos anatómicos de los pacientes. Posteriormente, se retiraron todos los identificadores de las imágenes corregistradas obtenidas mediante ACI y OCT. Las mediciones por ACI y OCT se valoraron independientemente por 2 evaluadores expertos en angiografías, cegados a la información sobre los pacientes, salvo datos sobre la ubicación anatómica de las lesiones según la ACI. La ubicación se analizó a través de 2 proyecciones distintas para asegurar una mayor precisión durante el estudio de los vasos. Los evaluadores clasificaron, entonces, el grado de calcificación según un sistema de clasificación triple: calcificación mínima o inexistente, cobertura de calcio ≤ 50% de la circunferencia del vaso (calcificación moderada) y cobertura de calcio de entre el 50 y el 100% de la circunferencia del vaso (calcificación grave) según la clasificación de Mintz et al.9. En caso de discrepancia entre los evaluadores, se invitó a un tercer evaluador a clasificar el grado de calcificación, también cegado a la información sobre los pacientes y a las valoraciones de los revisores.
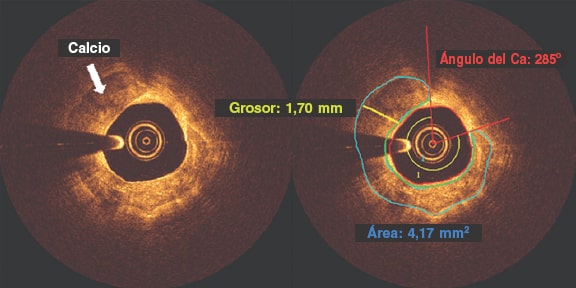
El análisis de los depósitos de calcio mediante OCT se hizo en el estudio de retirada previo a la intervención coronaria percutánea. En todos los análisis de la PC por OCT se usó la herramienta de validación QIVUS 3.1 (Medis Medical Imaging, Países Bajos) siguiendo un procedimiento operativo estandarizado en un laboratorio central (Red de Investigación Cardiovascular MedStar – MCRN, Washington, DC, EU). La PC se analizó en el área de máxima gravedad y se definió por áreas heterogéneas de baja atenuación de señal y bordes marcadamente delineados. Las imágenes se valoraron a nivel de la lesión: tanto el ángulo y grosor máximos de la placa de calcio, así como su longitud (número de fotogramas con depósitos de calcio). El ángulo de la calcificación se determinó usando el centro de la luz como vértice (figura 1, rayos rojos) en su trayectoria desde un borde claramente delineado del depósito de calcio hasta el otro. Se empleó un software de detección automática para identificar la capa fibrosa que cubría el área del calcio y las profundidades mínima y máxima de esta (figura 1, área de color verde). El área de calcio se trazó delineando los bordes de la placa de calcio heterogénea. El grosor del área de calcio (figura 1, línea amarilla) se analizó en la proyección con el mayor ángulo de todos (figura 1). La longitud de la calcificación se obtuvo del número total de proyecciones con calcio multiplicado por el intervalo de fotogramas.
Figura 1. Fotogramas de tomografía de coherencia óptica revelan la presencia de placa calcificada. El ángulo de la calcificación se determinó usando el centro de la luz como vértice (rayos rojos) en su trayectoria desde un borde claramente delineado del depósito de calcio hasta el otro. Se empleó un software de detección automática para identificar el casquete fibroso que cubría el área de la calcificación y las profundidades mínima y máxima de esta (área de color verde). El grosor de la calcificación (línea amarilla) se analizó en la proyección con el mayor ángulo de todos tras localizar el área de la calcificación definida por los bordes delineados de la placa de calcio heterogéneo. Ca: calcio.
Reproducibilidad intra e interobservadores
La variabilidad intraobservadores del análisis de las imágenes por ACI y OCT se analizó a partir de 24 imágenes seleccionadas aleatoriamente de las lesiones primarias sin calcio o leve calcificacion, moderadas y graves por 2 evaluadores independientes tanto en la ACI como en la OCT. Todas las mediciones por OCT incluyeron el ángulo, el grosor, la longitud y el área de la calcificación. Los mismos 2 evaluadores analizaron las mismas 24 imágenes obtenidas mediante ACI y OCT 4 semanas después de la evaluación inicial.
La variabilidad interobservadores del análisis de las imágenes por ACI y OCT se estudió analizando 50 imágenes seleccionadas aleatoriamente de las lesiones primarias sin calcio o leve calcification, moderadas y graves por los mismos 2 evaluadores independientes tanto en la ACI como en la OCT. Todas las mediciones por OCT incluyeron, también, el ángulo, el grosor, la longitud y el área de la calcificación. Después, se compararon los análisis de cada evaluador. La reproducibilidad se analizó con el coeficiente kappa de Cohen.
Método estadístico
La comparativa de todas las variables categóricas (expresadas como frecuencias y porcentajes) se hizo con la prueba de la χ2 o la prueba exacta de Fisher. La comparativa de los datos continuos se llevó a cabo mediante la prueba t de Student. Los datos continuos se expresaron como media ± desviación estándar para las variables normalmente distribuidas o como mediana (rango intercuartílico) para las no distribuidas normalmente. Tanto la sensibilidad como la especificidad de la ACI con respecto a la OCT se determinaron con tablas 2 × 2 estándar. Un análisis de regresión logística determinó la relación existente entre la gravedad confirmada en las mediciones de la angiografía y de la OCT. El análisis ROC (receiving operating characteristic) estableció los valores de corte óptimos usando el área bajo la curva y el índice Youden.
RESULTADOS
Análisis de la reproducibilidad intra e interobservadores
La concordancia intraobservador se situó en el 96% (23/24; k = 0,92), indicativo de una concordancia casi perfecta entre los diferentes análisis. Solo hubo 1 caso de discordancia entre calcificación moderada frente a inexistente o leve.
La concordancia interobservador entre los distintos analistas se situó en el 94% (47/50; k = 0,72), indicativo de una notable concordancia interobservadores. Hubo discordancia entre los diferentes analistas en 2 casos de calcificación moderada frente a inexistente o leve y en 1 caso de calcificación moderada frente a grave.
Población
Las características clínicas basales de nuestros pacientes se muestran en la tabla 1. Los pacientes eran predominantemente varones, con edades comprendidas entre los 56,3 y los 75,5 años. La mayoría de los pacientes presentaban signos de angina inestable. La mayoría de los pacientes presentaban comorbilidades, la hipertensión fue la más prevalente, seguida de cerca por la hiperlipemia. Más de la mitad de la población de pacientes eran fumadores. El vaso más estudiado en la OCT fue la arteria descendente anterior.
Tabla 1. Características demográficas de los pacientes y hallazgos angiográficos
| n = 75 | |
|---|---|
| Edad, años | 65,9 ±9,6 |
| Varón | 55 (73,3) |
| Altura, cm | 171,6 ±11,6 |
| Peso, kg | 92,4 ±20,3 |
| Niveles de creatinina, mg/dl | 1,12 ±0,95 |
| Diabetes | 28 (37,33) |
| Hipertensión | 59 (78,67) |
| Hiperlipemia | 57 (76) |
| Fumador | 40 (53,33) |
| Hemodiálisis | 2 (2,67) |
| Enfermedad arterial periférica | 4 (5,33) |
| Infarto de miocardio previo | 11 (14,67) |
| Cirugía de revascularización coronaria previa | 4 (5,33) |
| Presentación clínica | |
| Infarto de miocardio con elevación del segmento ST | 0 (0) |
| Infarto de miocardio sin elevación del segmento ST | 7 (9,33) |
| Angina inestable | 43 (57,33) |
| Isquemia silente | 4 (5,33) |
| Hallazgos angiográficos | |
| Intervención coronaria percutánea | 61 (81,33) |
| Vía de acceso femoral | 63 (84) |
| Tamaño del catéter, French | 6 |
| Vaso diana | |
| Tronco coronario izquierdo | 1 (1,33) |
| Descendente anterior/Ramas diagonales | 61 (81,33) |
| Circunfleja izquierda/Ramo intermedio/Obtusa marginal | 10 (13,33) |
| Circunfleja derecha/Descendente posterior | 7 (9,59) |
| Localización de la lesión | |
| Proximal | 40 (57,14) |
| Media | 26 (37,14) |
| Distal | 4 (5,71) |
| Parámetros del stent y de la lesión | |
| Longitud de la lesión, mm | 25,84 ±13,47 |
| Estenosis de la lesión | 74,74 ±15,27 |
| Diámetro del stent, mm | 3,11 ±0,53 |
| Longitud del stent, mm | 24,62 ±8,84 |
| Distancia del pullback, mm | 75 ±12,2 |
|
Los datos expresan n (%) o media ± desviación estándar. |
|
Gravedad angiográfica y parámetros de la tomografía de coherencia óptica
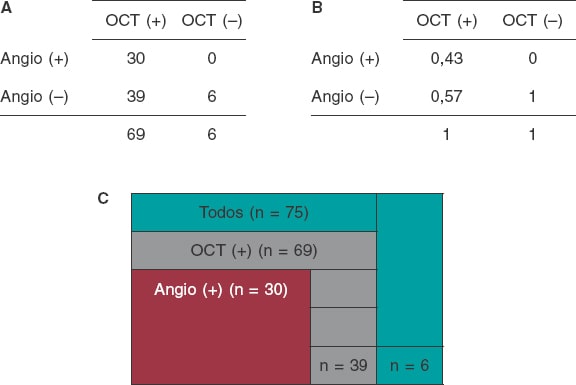
Se analizaron un total de 75 lesiones. La detección de lesiones de PC en la angiografía en relación con la OCT se muestra en la figura 2. La angiografía detectó menos lesiones de PC que la OCT que detectó lesiones positivas (n = 69; 92%). Todos los casos de angiografía positiva fueron detectados por la OCT (n = 30; 100%). La OCT no halló ninguna lesión calcificada en lesiones angiográficas negativas (n = 6; 100%). El 43% de las lesiones fueron positivas tanto en la OCT como en la ACI. La sensibilidad de la ACI fue: 43.5% (IC95%, 0,32-0,56) y su especificidad: 100% (IC95%, 0,52-1,0).
Figura 2. Lesiones de placa calcificada tal y como se muestran en una angiografía en relación con una OTC. A: valores positivos y negativos en la OCT en el eje x y valores positivos y negativos en la angiografía en el eje y. La tabla 4 × 4 muestra la correlación entre las mediciones obtenidas mediante OCT y las obtenidas mediante angiografía por número de lesiones primarias. B: valores positivos y negativos en la OCT en el eje x y valores negativos y positivos en la angiografía en el eje y. La tabla 4 × 4 muestra la correlación entre las mediciones obtenidas mediante OCT y las obtenidas mediante angiografía por porcentaje de lesiones primarias. C: número total de lesiones primarias (en color verde); la separación pintada en color verde representa las lesiones primarias no detectadas por la OCT ni por la angiografía. Todas las lesiones primarias positivas en la OCT están, aquí, representadas (en color gris); la separación pintada en color gris representa las lesiones primarias detectadas por la OCT, pero no por la angiografía. Todas las lesiones positivas en la angiografía están, aquí, representadas (en color rojo); todas estas lesiones se detectaron mediante OCT. Angio: angiografía; OCT: tomografía de coherencia óptica.
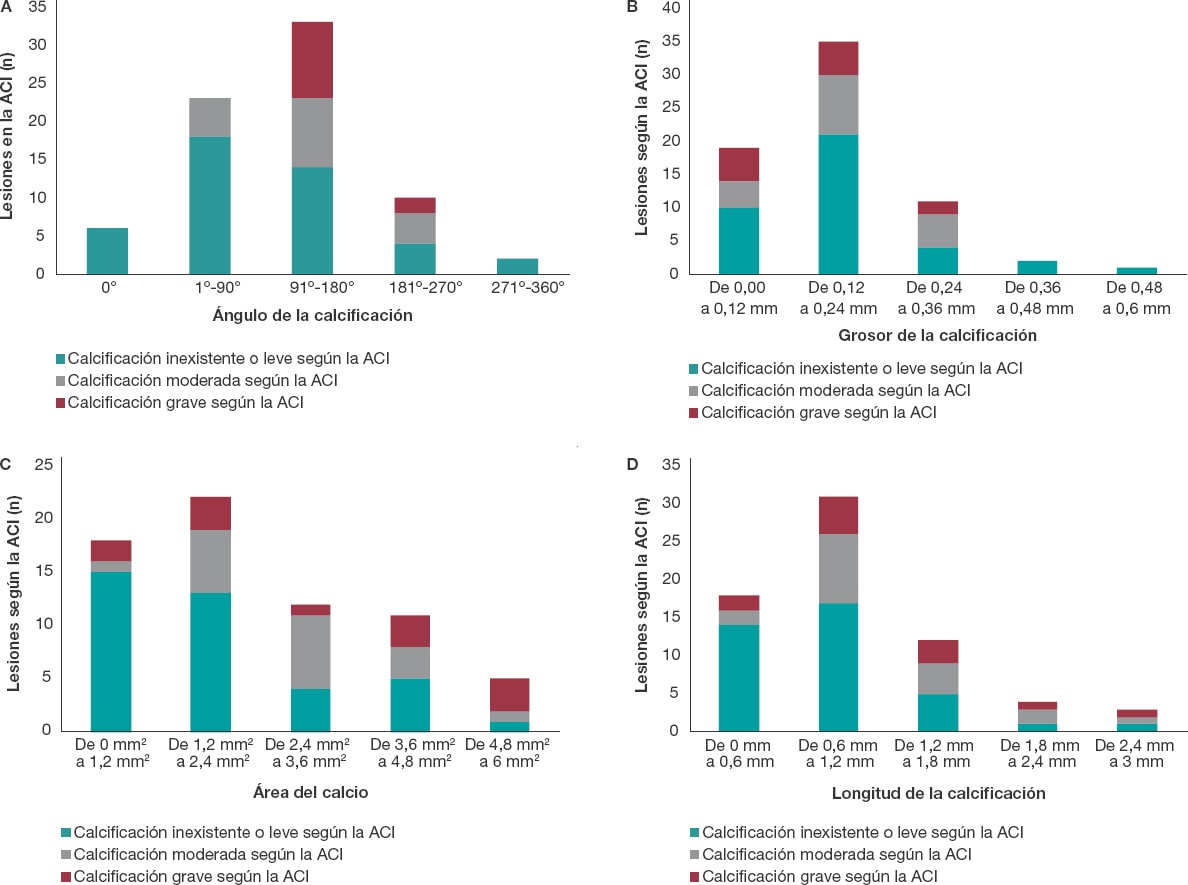
En la mayoría de los casos, a mayor ángulo (figura 3A), grosor (figura 3B), área (figura 3C) y longitud de la calcificación en las imágenes por OCT (figura 3D) mayor gravedad de las lesiones coronarias calcificadas según la angiografía. La relación entre la gravedad de las lesiones coronarias calcificadas, según la angiografía, y la longitud de las mismas, según la OCT, se muestra en la figura 3D. Según la OCT, la gravedad de las lesiones de PC coincidió con longitudes más largas también en la OCT.
Figura 3. A: lesiones angiográficas clasificadas en función de la gravedad dentro de las mediciones del ángulo de la calcificación obtenidas por la OCT. Todos los valores se expresaron en frecuencias. Los ángulos están en rangos de iguales proporciones según los grados observados. Las lesiones más graves observadas por la OCT se hallaron en rangos de 91 a 180° seguido de la medición del ángulo de la calcificación, también mediante OCT, en rangos de 181 a 270°; no se observaron lesiones de PC graves en las mediciones del ángulo de la calcificación, obtenidas mediante OCT, a 0º ni en rangos de 1 a 90º. B: lesiones angiográficas clasificadas en función de la gravedad dentro del grosor de la calcificación observado en la OCT. Todas las lesiones se expresaron en frecuencias. El grosor de la calcificación se expresó, en la OCT, en mm y se distribuyó en rangos que iban desde valores mínimos a máximos. El mayor grado de puntuación de calcio angiográfico, la PC grave, se observó en la OCT por igual en grosores de 0 a 0,12 mm y de 0,12 a 0,24 mm. C: lesiones angiográficas clasificadas en función de la gravedad dentro del área de la calcificación observada en la OCT. Todas las lesiones se expresaron en frecuencias. El área de la calcificación observada en la OCT se expresó en mm2 y se distribuyó en rangos de valores mínimos a máximos. El mayor grado de puntuación de calcio angiográfico, la PC grave, estaba en un rango de entre 4,8 y 6 mm2. D: lesiones angiográficas clasificadas en función de la gravedad dentro de la longitud de la calcificación observada en la OCT. Todas las lesiones se expresaron en frecuencias. La longitud de la calcificación observada en la OCT se expresó en mm y se distribuyó en rangos que iban desde valores mínimos a máximos. El mayor grado de puntuación de calcio angiográfico, la PC grave, se detectó de 0,6 a 1,2 mm. ACI: angiografía coronaria invasiva; OCT: tomografía de coherencia óptica; PC: placas calcificadas.
DISCUSIÓN
Los principales hallazgos de nuestro estudio fueron a) comparada con la OCT, la ACI tiene una sensibilidad baja y una especificidad alta para la detección de placas de calcio; b) a mayor ángulo, grosor, área y longitud de la calcificación en la OCT, lesiones coronarias calcificadas más graves según la angiografía.
La ACI proporciona imágenes bidimensionales a tiempo real con características in vivo del perfil de la luz15. En cambio, la técnica invasiva de diagnóstico mediante imágenes tridimensionales, OCT, ofrece la resolución más alta de todas para caracterizar variaciones en la composición de la placa11,16. La detección de lesiones angiográficas mediante ACI se emplea desde hace décadas. No obstante, hay estudios que aseguran que la ACI tiene poca capacidad para detectar placas calcificadas en la pared arterial6,11,17. Algunos estudios han comparado la caracterización y cuantificación de la placa mediante ACI a la angiotomografía computarizada y a la ecografía intravascular, pero pocos han analizado la caracterización de la placa mediante ACI y su cuantificación mediante OCT6. Nuestro estudio analizó la sensibilidad y especificidad de la ACI frente a la OCT. Se analizaron 75 lesiones y se obtuvo una sensibilidad y especificidad de la ACI del 43,5% y 100%, respectivamente, sensibilidad que fue menor que la mostrada en anteriores estudios (una sensibilidad del 50,9% y una especificidad del 95,1%)6. La sensibilidad de la ACI es baja porque solo ofrece una proyección bidimensional de las lesiones y su resolución es peor que la de la OCT18,19.
La OCT detectó todas las PC presentes en la ACI (n = 30), así como también lesiones no detectadas por la ACI (n = 39). En la angiografía, la presencia de PC es indicativa de que la calcificación tiene características de PC extensa en la OCT (por ejemplo, ángulo, grosor y área). Nuestro estudio concluyó que las calcificaciones graves detectadas por la ACI presentan ángulos más altos en la OCT, tal y como demostró el estudio de Wang et al.6. La implicación clínica es que cuando la ACI detecta una lesión calcificada, moderada o grave, el médico puede estar seguro de que dicha calcificación es real. La OCT sería el siguiente paso lógico para una mejor caracterización de la PC. Determinar la morfología de una lesión calcificada (por ejemplo, superficial, profunda o nodular) mediante una OCT nos permite seleccionar la mejor estrategia de preparación de la lesión. La OCT también detectó calcificaciones que la ACI pasó por alto, lo cual sugiere que, por sí sola, la ACI no es una técnica de imágenes fiable para la detección de PC. Por lo tanto, en presencia de lesiones sospechosas, la OCT debería ser el siguiente paso para hacer estudios integrales de estas lesiones.
Las mediciones obtenidas mediante OCT del grosor, longitud y área de una lesión calcificada son propias de esta tecnología puesto que la OCT es la única técnica de imágenes capaz de medir estos valores6. Los grosores > 0,5 mm se asocian a la infraexpansión del stent7,20. Esto no se exploró en nuestra población puesto que no todas las lesiones fueron objeto de una intervención coronaria percutánea. No obstante, sí se amplió el análisis mediante OCT para incluir la profundidad y el área de la calcificación en las imágenes por OCT. Se observó que cuanto mayor era el área de la calcificación en la OCT, más lesiones graves se detectaban en la ACI. Se observaron más lesiones graves de PC en rangos de entre 4,8 y 6 mm2. Las áreas de calcio > 5 mm2 podrían ser el cuarto «5» en la «regla del 5» de la OCT que identifica las características de la PC asociadas a una mala expansión del stent7.
Limitaciones del estudio
Este es un estudio observacional y retrospectivo con sus limitaciones correspondientes. El tamaño de la muestra fue relativamente pequeño.
CONCLUSIONES
La angiografía coronaria invasiva tiene una sensibilidad baja y una especificada alta para la detección de placas calcificadas comparada con la OCT. A mayor ángulo, grosor, área y longitud de la calcificación en la OCT, lesiones coronarias calcificadas más graves según la angiografía.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
C. McGuire: diseño del estudio, recopilación de datos, redacción y análisis del manuscrito; E. Schlofmitz: diseño del estudio, recopilación de datos y revisión crítica del manuscrito; G. D. Melaku, K. O. Kuku y Y. Kahsay: recopilación de datos y revisión crítica del manuscrito; R. Schlofmitz y A. Jeremias: redacción y revisión crítica del manuscrito; H. M. Garcia-Garcia: diseño del estudio, análisis y recopilación de datos, preparación y revisión crítica del manuscrito.
CONFLICTO DE INTERESES
H.M. Garcia-Garcia declararon haber recibido una subvención institucional de Biotronik, Boston Scientific, Medtronic, Abbott, Neovasc, Shockwave, Phillips y Corflow. Los autores restantes no han declarado ningún conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- Las intervenciones coronarias percutáneas dependen de la angiografía para obtener información y poder tomar decisiones clínicas sobre cómo preparar las lesiones; no obstante, el grado de calcificación no termina de apreciarse del todo bien en la angiografía.
- La relación entre la ACI y la OCT y la gravedad de la PC se analizó midiendo el grosor y el ángulo de la calcificación en la OCT.
- No se analizaron todas las mediciones de OCT ni su relación con la gravedad de la PC según la ACI.
¿QUÉ APORTA DE NUEVO?
- Comparada con la OCT, la ACI tiene una sensibilidad baja, pero una especificada alta para la detección de placas fuertemente calcificadas.
- A mayor área, longitud, grosor y ángulo de la calcificación en la OCT, más lesiones graves por PC según la angiografía, indicativo de que se pueden emplear todas las mediciones obtenidas mediante OCT para la detección de lesiones fuertemente calcificadas.
- La OCT es una alternativa viable a la angiografía en lo referente al estudio de la calcificación; amplía la caracterización del calcio y ofrece información detallada que arroja luz sobre el uso de tratamientos dedicados de «reducción del volumen de placa» durante la preparación de la lesión.
BIBLIOGRAFÍA
1. Miao Benjamin, Hernandez Adrian V., Alberts Mark J., Mangiafico Nicholas, Roman Yuani M., Coleman Craig I. Incidence and Predictors of Major Adverse Cardiovascular Events in patients With Established Atherosclerotic Disease or Multiple Risk Factors. J Am Heart Assoc. 2020;9:e014402.
2. Guedeney P, Claessen BE, Mehran R, et al. Coronary Calcification and Long-Term Outcomes According to Drug-Eluting Stent Generation. JACC Cardiovasc Interv. 2020;13:1417-1428.
3. Costa JR, Sousa A, Moreira AC, et al. Incidence and Predictors of Very Late (≥4 Years) Major Cardiac Adverse Events in the DESIRE (Drug-Eluting Stents in the Real World)-Late Registry. JACC Cardiovasc Interv. 2010;3:12-18.
4. Conway C, McGarry JP, Edelman ER, McHugh PE. Numerical Simulation of Stent Angioplasty with Predilation:An Investigation into Lesion Constitutive Representation and Calcification Influence. Ann Biomed Eng. 2017;45:2244-2252.
5. Waters DD, Azar RR. The Curse of Target Lesion Calcification. J Am Coll Cardiol. 2014;63:1855-1856.
6. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
7. Fujino A, Mintz G, Matsumura M, et al. TCT-28. A New Optical Coherence Tomography-Based Calcium Scoring System to Predict Stent Underexpansion. J Am Coll Cardiol. 2017;70 (18, Supplement):B12-B13.
8. Lee T, Mintz GS, Matsumura M, et al. Prevalence, Predictors, and Clinical Presentation of a Calcified Nodule as Assessed by Optical Coherence Tomography. JACC Cardiovasc Imaging. 2017;10:883-891.
9. Mintz GS, Popma JJ, Pichard AD, et al. Patterns of calcification in coronary artery disease. A statistical analysis of intravascular ultrasound and coronary angiography in 1155 lesions. Circulation. 1995;91:1959-1965.
10. Brezinski ME, Tearney GJ, Bouma BE, et al. Imaging of coronary artery microstructure (in vitro) with optical coherence tomography. Am J Cardiol. 1996;77:92-93.
11. Wang Ying, Osborne Michael T., Tung Brian, Li Ming, Li Yaming. Imaging Cardiovascular Calcification. J Am Heart Assoc. 2018;7:e008564.
12. Oosterveer TTM, van der Meer SM, Scherptong RWC, Jukema JW. Optical Coherence Tomography:Current Applications for the Assessment of Coronary Artery Disease and Guidance of Percutaneous Coronary Interventions. Cardiol Ther. 2020;9:307-321.
13. Gharaibeh Y, Prabhu DS, Kolluru C, et al. Coronary calcification segmentation in intravascular OCT images using deep learning:application to calcification scoring. J Med Imaging (Bellingham). 2019;6:045002.
14. Kume T, Akasaka T, Kawamoto T, et al. Assessment of Coronary Intima - Me-dia Thickness by Optical Coherence Tomography. Circ J. 2005;69:903-907.
15. Ryan Thomas J. The Coronary Angiogram and Its Seminal Contributions to Cardiovascular Medicine Over Five Decades. Circulation. 2002;106:752-756.
16. Kubo T, Imanishi T, Takarada S, et al. Assessment of culprit lesion morphology in acute myocardial infarction:ability of optical coherence tomography compared with intravascular ultrasound and coronary angioscopy. J Am Coll Cardiol. 2007;50:933-939.
17. Tuzcu EM, Berkalp B, De Franco AC, et al. The dilemma of diagnosing coronary calcification:Angiography versus intravascular ultrasound. J Am Coll Cardiol. 1996;27:832-838.
18. Lee CH, Hur S-H. Optimization of Percutaneous Coronary Intervention Using Optical Coherence Tomography. Korean Circ J. 2019;49:771-793.
19. Park S-J, Kang S-J, Ahn J-M, et al. Visual-functional mismatch between coronary angiography and fractional flow reserve. JACC Cardiovasc Interv. 2012;5:1029-1036.
20. Fujino A, Mintz GS, Lee T, et al. Predictors of Calcium Fracture Derived From Balloon Angioplasty and its Effect on Stent Expansion Assessed by Optical Coherence Tomography. JACC Cardiovasc Interv. 2018;11:1015-1017.